Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ МАРКЕРОВ НАЛИЧИЯ ОПУХОЛЕВЫХ Т-ЛИМФОБЛАСТОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области медицины и предназначено для идентификации маркеров наличия опухолевых Т-лимфобластов при детекции минимальной остаточной болезни (МОБ) у пациентов с острыми лейкозами, в первую очередь у детей. Основная область применения разработанной методики - детская онкология, решение проблемы лечения острых лейкозов у детей путем персонификации терапии и повышения эффективности лекарственной и/или трансплантационной терапии на основе высокочувствительной детекции полного пула клонов опухолевых лимфобластов в кровотоке пациента.
Уровень техники
Острые лимфобластные лейкозы характеризуются усиленной пролиферацией и накоплением в костном мозге клонов незрелых опухолевых лимфобластов. Совокупность опухолевых лимфобластов, сохранившихся в организме пациента после проведения интенсивной терапии, получила название минимальной остаточной болезни (МОБ). Поскольку даже незначительное количество сохранившихся опухолевых клеток обуславливает высокий риск рецидива острого лейкоза, ранняя диагностика и высокочувствительное определение уровня МОБ представляют одну из наиболее острых проблем современной онкологической гематологии.
Результаты исследований в области лечения острых лейкозов свидетельствуют о том, что сохранение МОБ после проведения интенсивной химиотерапии или трансплантации гемопоэтических стволовых клеток является наиболее достоверным предиктором рецидива заболевания. Контроль минимальной остаточной болезни - важнейший элемент современных программ лечения острых лейкозов. При проведении терапии лейкозов ключевые решения принимаются на основании оценки ответа на выполненные терапевтические элементы, и оценка эта базируется на технологиях чувствительной детекции минимальной остаточной болезни.
В ходе процесса созревания лимфоцитов происходит V(D)J-рекомбинация - многостадийный процесс внутрихромосомной перестройки иммуноглобулиновых локусов в дифференцирующихся лимфобластах, в результате которого формируются зрелые гены отдельных цепей Т- и В-клеточных рецепторов. При этом каждый отдельный клон Т-лимфоцитов, включая опухолевые Т-лимфобласты, характеризуется уникальной последовательностью V(D)J-перестройки, которая может быть использована для детекции этого клона в образцах от пациента.
Известны три комплементарные технологии для детекции МОБ при острых лимфобластных лейкозах: 1) проточная цитометрия с детекцией популяции лимфоцитов, выделяемой на основании аберрантного иммунофенотипа; 2) RT qPCR (количественная полимеразная цепная реакция в реальном времени, кПЦР-РВ) с детекцией химерного транскрипта; 3) RT qPCR с детекцией индивидуального генетического маркера, образованного в результате клональной реарранжировки гена В- или Т-клеточного рецептора, т.е. уникальной последовательности V(D)J-перестройки.
Метод проточной цитометрии реализован в различных модификациях (см. US 20040224371 A1, 11.11.2004; US 20060263833 A1, 23.11.2006; ЕР 2259065 А1, 08.12.2010; WO 2013187765 A3, 24.04.2014; CN 204142732 U, 04.02.2015), но характеризуется относительно невысокой чувствительностью даже при использовании 10- или 12-тицветных зондов: не более 104, то есть 1 опухолевая клетка на 10000 проанализированных (Fossat С и др. Methodological aspects of minimal residual disease assessment by flow cytometry in acute lymphoblastic leukemia: A french multicenter study. Cytometry В Clin Cytom. 2014 Nov 1. doi: 10.1002/cyto.b.21195; Appelbaum FR. Measurement of minimal residual disease before and after myeloablative hematopoietic cell transplantation for acute leukemia. Best Practice and Research Clinical Haematology. 2013 Sep; 26 (3): 279-284).
Количественная ПЦР-амплификация уникальных последовательностей V(D)J-перестроек генов Т-клеточных рецепторов более информативна (Flohr Т и др. International BFM Study Group (I-BFM-SG). Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia. 2008 Apr; 22 (4): 771-782). Предложены модификации метода, разработаны наборы реагентов для анализа отдельных локусов (см., например, CN 1814791 A, 09.08.2005; CN 103627810 A, 12.03.2013; CN 104328209 A, 04.02.2015). Результат во многом определяется обоснованным выбором амплифицируемых локусов генома и качеством дизайна олигонуклеотидных праймеров для постановки реакции (van der Velden VH и др. Minimal residual disease diagnostics in acute lymphoblastic leukaemia: impact of primer characteristics and size of junctional regions. British Journal of Haematology. 2014; 164 (3): 451-453). Технология усовершенствована применением глубокого массированного секвенирования продуктов амплификации (Faham М и др. Deep-sequencing approach for minimal residual disease detection in acute lymphoblastic leukemia. Blood. 2012 Dec 20; 120 (26): 5173-5180). С ее помощью удалось повысить чувствительность метода до 105, то есть 1 опухолевая клетка на 100000 проанализированных (теоретически - до 106) (Logan АС и др. Minimal residual disease quantification using consensus primers and high-throughput IGH sequencing predicts post-transplant relapse in chronic lymphocytic leukemia. Leukemia. 2013; 27 (8): 1659-1665; Ladetto M и др. Next-generation sequencing and real-time quantitative PCR for minimal residual disease detection in B-cell disorders. Leukemia. 2014; 28 (6): 1299-1307).
Международная заявка WO 2004033728 относится к изучению клональности с использованием ПЦР-амплификации для ранней диагностики лимфопролиферативных заболеваний. В документе предусмотрены наборы праймеров для амплификации, включающие прямой праймер или его вариант, способный амплифицировать перегруппировку, выбранную из группы, состоящей из VH-JH IGH перегруппировки, DH-JH IGH перегруппировки, VK-JK IGK перегруппировки, VK/интрон-Kde IGK перегруппировки, Vлямбда-Jлямбда IGL перегруппировки, Vss-Jss TCRB перегруппировки, Dss-Jss TCRB перегруппировки, Vгамма-Jгамма TCRG перегруппировки, Vдельта-Jдельта TCRD перегруппировки, Dдельта-Dдельта TCRD перегруппировки, Dдельта-Jдельта TCRD перегруппировки, Vдельта-Dдельта TCRD перегруппировки или транслокации, выбранной из t(11;14)(BCL1-IGH) и t(14;18)(BCL2-IGH). Праймеры могут быть использованы в ПЦР-исследованиях клональности для ранней диагностики лимфопролиферативных заболеваний и детекции минимальной остаточной болезни. Также предусмотрены наборы, содержащие праймеры.
Международная заявка WO 2013086450 описывает композиции и способы для стандартизации эффективности амплификации ДНК высокогетерогенных наборов олигонуклеотидных праймеров, которые могут быть использованы для амплификации гетерогенных наборов матриц ДНК, которые содержат перестроенную ДНК лимфоидных клеток, кодирующую Т-клеточные рецепторы или иммуноглобулины. Раскрытые способы, праймеры и контрольные матрицы полезны для коррекции нежелательного искажения при использовании наборов праймеров для амплификации, которое ведет к неточности при мультиплексном высокопроизводительном секвенировании продуктов амплификации и количественном определении уникальных последовательностей ТКР или иммуноглобулинов в образце. Отличительным признаком является применение композиции, содержащей множества матричных олигонуклеотидов структуры 5'-U1-В1-V-B2-R-B3-J-B4-U2-3', которые могут быть применены в качестве стандарта для калибровки при амплификации с использованием набора праймеров. Также раскрыты способы для установления и коррекции искажения эффективности работы праймеров при амплификации с использованием раскрытых контрольных матричных олигонуклеотидов.
Международная заявка WO 2004078020 относится способу количественной реакции ПЦР с обратной транскрипцией в реальном времени для детекции минимальной остаточной болезни у пациентов с лейкемией посредством амплификации транскрипта слитого гена, включающему выбор подходящего для амплификации образца от пациента надлежащего качества, определение оптимальных условий для выполнения реакции обратной транскрипции, определение оптимальных условий для количественной реакции ПЦР в реальном времени и установление стандартизованной процедуры для анализа данных. Способ согласно патенту отличается использованием ОТ-ПЦР в реальном времени как основы предложенной технологии.
Международная заявка WO 2008019872 относится способу диагностики острого лейкоза у детей, который позволяет отличить нормальные клетки и клетки острого лимфобластного лейкоза, где способ включает стадию определения уровня экспрессии специфических генов (маркеров) и определение повышения или снижения уровня их экспрессии. Способ определения уровня экспрессии специфических генов отличается использованием гибридизации на микрочипах. Недостаток микрочипов - опасность контаминации образцов и более низкая чувствительность в сравнении с ПЦР и тем более высокопроизводительным секвенированием.
Международная заявка WO 2006048264 предлагает несколько тысяч маркеров острого лимфобластного лейкоза (ОЛЛ), острого бифенотипического лейкоза (ОБЛ) и острого миелоидного лейкоза (ОМЛ) m0, включая также по 4 подтипа острого В-лимфобластного лейкоза и острого Т-лимфобластного лейкоза, - по 300 генетических маркеров для каждого вида целевых клеток. Маркеры представлены без последовательностей, научную ценность имеет способ их компоновки. Для реализации изобретения могут быть использованы общепринятые методы: анализ на микрочипе, гибридизационный анализ, полимеразная цепная реакция, иммунофенотипирование и др. Способ согласно патенту отличается сравнением профиля экспрессии генов в изучаемых клетках с профилем экспрессии генов в референсных стандартных раковых клетках с охарактеризованным генотипом.
Международная заявка WO 2011139371 «Отслеживание заболевания и здорового состояния организма с помощью профилирования клонотипов» относится к улучшенным способам диагностики и прогнозирования течения аутоиммунных заболеваний и рака, в особенности, лимфоидных опухолей, таких как лимфомы и лейкозы. В заявке предусмотрены способы применения секвенирования ДНК для идентификации персонализированных биомаркеров у пациентов с лимфоидными опухолями и другими заболеваниями. Идентифицированные биомаркеры могут быть использованы для постановки диагноза и отслеживания течения заболевания у пациента. В частности, изобретение относится к чувствительному методу мониторинга лимфом, которые претерпевают клональное изменение в ходе своего течения и лечения, без необходимости разработки альтернативных анализов для детекции новых мутированных клонов.
Способ согласно заявке WO 2011139371 может быть принят в качестве прототипа для описываемого способа определения маркеров наличия опухолевых Т-лимфобластов.
При этом способ согласно WO 2011139371 отличается от разработанного способа определения маркеров наличия опухолевых Т-лимфобластов использованием высокопроизводительного секвенирования пространственно разделенных индивидуальных молекул нуклеиновых кислот или секвенирования транскриптов из пространственно разделенных индивидуальных клеток. Данный способ секвенирования представляет значительные технические трудности и значительно увеличивает стоимость и сложность анализа. Разработанный способ определения маркеров наличия опухолевых Т-лимфобластов отличается амплификацией объединенного образца транскриптов из образца клеток от пациента и не требует амплификации и секвенирования пространственно разделенных индивидуальных молекул нуклеиновых кислот. Секвенирование согласно разработанному способу может производиться по методу Сэнгера и не является высокопроизводительным. Таким образом, способ по заявке WO 2011139371 отличается от разработанного способа определения маркеров наличия опухолевых Т-лимфобластов применением принципиально другого подхода к секвенированию нуклеиновых кислот.
При этом разработанный способ определения маркеров наличия опухолевых Т-лимфобластов характеризуется не меньшей чувствительностью и надежностью, которые достигаются при применении значительно более простых, надежных и экономически эффективных лабораторных процедур - мультиплексной полимеразной цепной реакции (ПЦР) и секвенирования по Сэнгеру. Раскрытие изобретения
Задачей изобретения является разработка способа определения маркеров опухолевых Т-лимфобластов. Маркерами опухолевых Т-лимфобластов в предложенном способе являются уникальные для каждого пациента последовательности V(D)J-перестроек генов Т-клеточных рецепторов опухолевых Т-лимфобластов. Отслеживание выявленных маркеров опухолевых Т-лимфобластов в образцах, полученных от пациентов, позволяет проводить мониторинг минимальной остаточной болезни при острых лейкозах.
Поставленная задача решается за счет способа, включающего:
а) получение от пациента с острым лейкозом образца, содержащего опухолевые Т-лимфобласты;
б) выделение геномной ДНК из полученного образца;
в) мультиплексную полимеразную цепную реакцию с использованием с использованием выделенной геномной ДНК в качестве матрицы и олигонуклеотидных праймеров для локуса TCR;
г) электрофорез для определения высокопредставленных продуктов амплификации и
д) последующее секвенирование высокопредставленных продуктов амплификации для определения последовательностей преобладающих V(D)J-престроек генов TCR,
где установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
В предпочтительном варианте, способ определения маркеров наличия опухолевых Т-лимфобластов включает:
а) получение от пациента с острым лейкозом образца, содержащего опухолевые Т-лимфобласты;
б) выделение геномной ДНК из полученного образца;
в) мультиплексную полимеразную цепную реакцию с использованием с использованием выделенной геномной ДНК в качестве матрицы и олигонуклеотидных праймеров для локусов TRB;
г) электрофорез для определения высокопредставленных продуктов амплификации и
д) последующее секвенирование высокопредставленных продуктов амплификации для определения последовательностей преобладающих V(D)J-перестроек генов TCR,
где установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
В более предпочтительном варианте, способ определения маркеров наличия опухолевых Т-лимфобластов включает:
а) получение от пациента с острым лейкозом образца, содержащего опухолевые Т-лимфобласты;
б) выделение геномной ДНК из полученного образца;
в) мультиплексную полимеразную цепную реакцию с использованием с использованием выделенной геномной ДНК в качестве матрицы и олигонуклеотидных праймеров для локусов TRB;
г) электрофорез для определения высокопредставленных продуктов амплификации и
д) последующее секвенирование высокопредставленных продуктов амплификации по Сэнгеру для определения последовательностей преобладающих V(D)J-перестроек генов TCR,
где установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
В более предпочтительном варианте, способ определения маркеров наличия опухолевых Т-лимфобластов включает:
а) выделение фракции РВМС из образца пунктата костного мозга пациента с острым лейкозом;
б) выделение геномной ДНК из полученной фракции;
в) мультиплексную полимеразную цепную реакцию с использованием выделенной геномной ДНК в качестве матрицы и олигонуклеотидных праймеров для локусов TRB;
г) электрофорез для определения высокопредставленных продуктов амплификации;
д) определение количества V(D)J-перестроек, связанных с опухолевыми клонами, по количеству высокопредставленных продуктов мультиплексных ПЦР;
е) элюцию высокопредставленных продуктов ПЦР из агарозного геля;
ж) секвенирование по Сэнгеру элюированных ПЦР-продуктов для определения последовательностей преобладающих V(D)J-перестроек генов TCR,
где установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
В еще более предпочтительном варианте, способ определения маркеров наличия опухолевых Т-лимфобластов включает:
а) выделение фракции РВМС из образца пунктата костного мозга пациента с острым лейкозом;
б) выделение геномной ДНК из полученной фракции;
в) мультиплексную полимеразную цепную реакцию с использованием выделенной геномной ДНК в качестве матрицы и олигонуклеотидных праймеров для локусов TRB;
г) электрофорез для определения высокопредставленных продуктов мультиплексной ПЦР, детектируемых как мажорные флюоресцирующие полосы при электрофорезе;
д) определение количества V(D)J-перестроек, связанных с опухолевыми клонами, по количеству высокопредставленных продуктов мультиплексной ПЦР;
е) элюцию высокопредставленных продуктов мультиплексной ПЦР из агарозного геля;
ж) секвенирование по Сэнгеру элюированных продуктов мультиплексной ПЦР для определения последовательностей V(D)J-перестроек генов TCR, содержащихся в элюированных высокопредставленных продуктах мультиплексной ПЦР,
где установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
В одном варианте, мультиплексную полимеразную цепную реакцию проводят с использованием прямых и обратных олигонуклеотидных ПЦР-праймеров для локусов TRB, которые представлены в SEQ ID NO1-10.
В одном варианте, последовательности преобладающих V(D)J-перестроек генов TCR являются последовательностями V(D)J-перестроек генов TCR опухолевых Т-лимфобластов.
В одном варианте, последовательности V(D)J-перестроек генов TCR опухолевых Т-лимфобластов являются маркерами наличия опухолевых Т-лимфобластов в образцах от пациента.
В одном варианте, маркеры наличия опухолевых Т-лимфобластов могут быть использованы для высокоточной детекции минимальной остаточной болезни при острых лейкозах.
В одном варианте, отслеживание выявленных маркеров опухолевых Т-лимфобластов в образцах, полученных от пациентов, позволяет проводить мониторинг минимальной остаточной болезни при острых лейкозах.
В одном варианте, способ определения маркеров наличия опухолевых Т-лимфобластов служит для высокоточной детекции минимальной остаточной болезни при острых лейкозах у детей.
В одном варианте, отслеживание выявленных маркеров опухолевых Т-лимфобластов в образцах, полученных от пациентов, позволяет проводить мониторинг минимальной остаточной болезни после проведения химиотерапии.
В одном варианте, отслеживание выявленных маркеров опухолевых Т-лимфобластов в образцах, полученных от пациентов с острым лейкозоментов, например, от пациентов-детей, например, после химиотерапии, проводят с помощью ПЦР, например, количественной ПЦР, такой как количественная ПЦР в реальном времени.
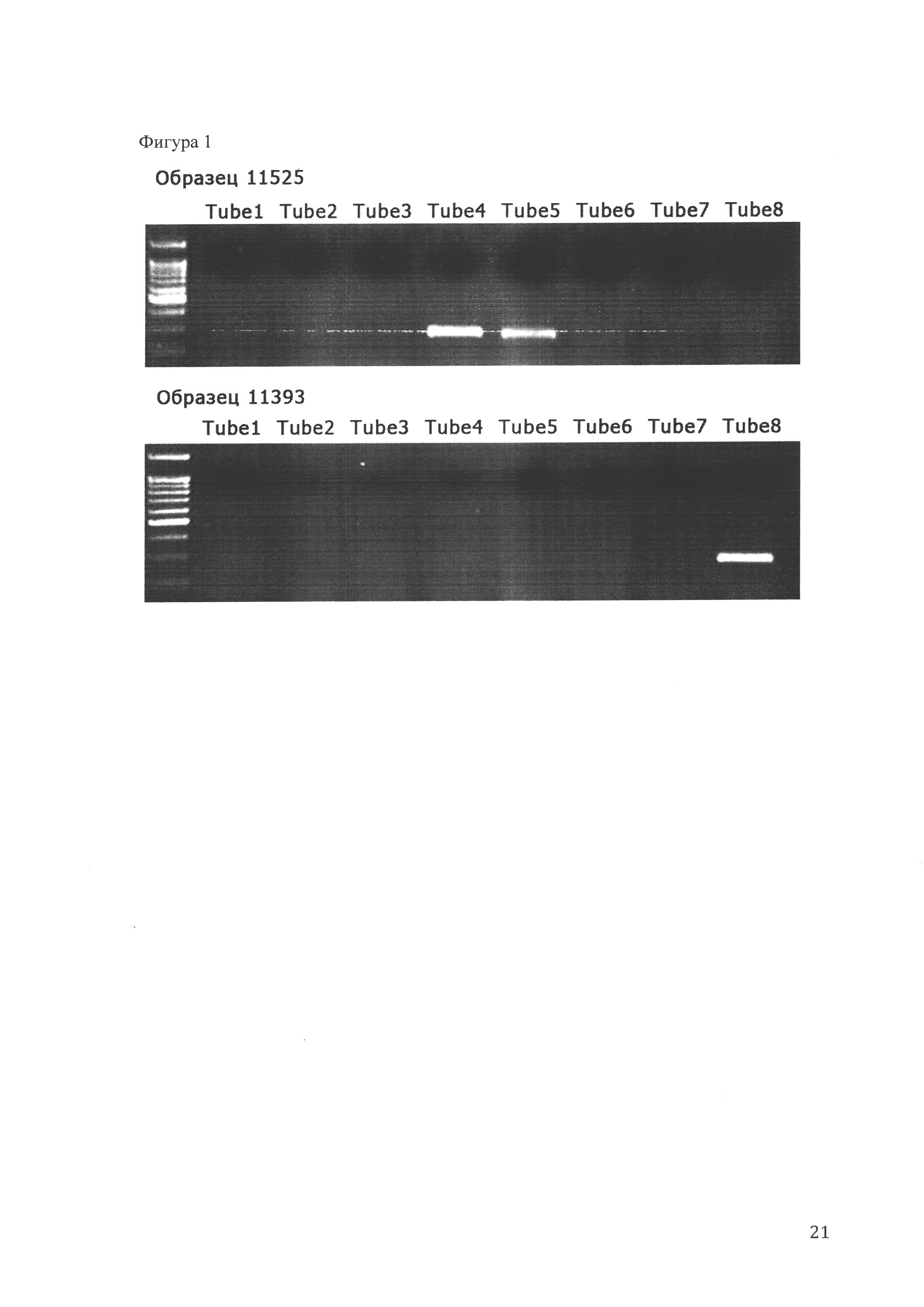
Фиг. 1 - результирующие электрофореграммы, демонстрирующие перестройки TRB локусов. (А) Результирующая электрофореграмма для пациента 11525 с В-ОЛЛ. В дорожке 1 маркер длин фрагментов ДНК. Дорожки 2-9 (Tube1-Tube8) соответствуют восьми различным мультиплексным реакциям ПЦР. (Б) Результирующая электрофореграмма для пациента 11393 с В-ОЛЛ.
Используемые в способе по изобретению праймеры приведены в SEQ ID NO1-10.
Описание предпочтительных вариантов осуществления
Способ определения маркеров наличия опухолевых Т-лимфобластов сочетает в себе использование мультиплексной ПЦР, идентификацию высокопредставленных продуктов мультиплексных ПЦР и последующее секвенирование высокопредставленных продуктов амплификации по Сэнгеру.
Способ определения маркеров наличия опухолевых Т-лимфобластов позволяет установить последовательности нуклеотидов высокопредставленных генов Т-клеточных рецепторов, являющиеся маркерами опухолевых Т-лимфобластов. Острые лимфобластные лейкозы характеризуются усиленной пролиферацией и накоплением в костном мозге клонов опухолевых лимфобластов, поэтому высокопредставленные гены Т-клеточных рецепторов в образце от пациента с ОЛЛ являются генами Т-клеточных рецепторов опухолевых лимфобластов. Установленные последовательности нуклеотидов высокопредставленных генов Т-клеточных рецепторов могут быть использованы для отслеживания наличия опухолевых Т-лимфобластов в образцах от пациентов.
Способ позволяет по результатам анализа продуктов мультиплексной ПЦР определить тип преобладающей V(D)J-перестройки генов бета-, гамма-, дельта- и опционально альфа-цепей TCR, а также провести полуколичественную оценку содержания таких перестроек в диагностическом образце индивидуальной геномной ДНК (идентифицировать высокопредставленные продукты), и по результатам прямого секвенирования полученных ПЦР-продуктов установить первичную структуру перестроенного гена TCR (т.е. последовательность нуклеотидов), однозначно характеризующую преобладающий клон опухолевых лимфобластов в диагностическом образце пациента с острым лейкозом.
Полученные данные о первичной структуре перестроенного гена TCR предназначены для детекции минимальной остаточной болезни после проведения химиотерапии.
Результатом применения способа является определение типа преобладающих V(D)J-перестроек генов Т-клеточных рецепторов, уровней их содержания в диагностическом образце индивидуальной геномной ДНК до проведения химиотерапии и установление первичной структуры перестроенного гена для детекции МОБ при острых лейкозах. Методика направлена на идентификацию характеристических перестроек локусов Т-клеточного рецептора в опухолевых клетках из диагностических образцов костного мозга и периферической крови пациентов с острыми лейкозами. Особенностью методики является получение фрагментов генов Т-клеточного рецептора, адаптированных к количественному мониторингу МОБ у пациентов после купирования острой фазы ОЛЛ (после химиотерапии). Результат достигается за счет использования упорядоченной системы олигонуклеотидных ПЦР-праймеров и секвенирования продукта амплификации, несущего информацию о первичной структуре перестроенного гена.
Структуры прямых и обратных праймеров, соответствующих фрагментам, соответственно, V и J сегментов локусов бета (TRB), представлены в SEQ ID NO1-10. Оптимизация набора праймеров заключалась в конструировании и тестировании аллель-, группо- и кластер-специфических праймеров, соответствующих всей совокупности исследуемых генов. Методика предусматривала модификацию для проведения количественной ПЦР в режиме «реального времени» и специализированную адаптацию получаемых библиотек ПЦР-продуктов к секвенированию.
Характеристические ПЦР-фрагменты, получаемые в результате применения разработанной методики, будут являться уникальными для каждого пациента молекулярно-генетическими маркерами опухолевых клонов Т-клеток.
Специфичность ПЦР-детекции V(D)J маркеров Т-клеток в разработанном способе определения маркеров наличия опухолевых Т-лимфобластов может достигать 99,8%. При этом аналитическая чувствительность метода детекции МОБ, основанного на определении молекулярно-генетических маркеров по разработанной методике, составляет не менее 1 опухолевой Т-клетки на 100000 нормальных Т-лимфоцитов.
По результатам тестирования различных комбинаций олигонуклеотидов были скомпонованы наиболее удачные сочетания смесевых праймеров, удовлетворяющие следующим требованиям:
- воспроизводимость результатов;
- отсутствие ложнопозитивных и ложнонегативных сигналов;
- отсутствие комплементарного ингибирования уровня праймирования в смеси;
- исчерпывающая информативность минимального набора комбинаций праймеров.
Техническим результатом предложенного изобретения является определение типа преобладающих V(D)J-перестроек генов Т клеточных рецепторов, уровней их содержания в диагностическом образце индивидуальной геномной ДНК и установление первичной структуры высокопредставленных генов. Полученные данные могут быть использованы для последующей детекции МОБ при острых лейкозах. Технический результат достигается за счет использования ранжированного набора олигонуклеотидных ПЦР-праймеров для локусов TRB (SEQ ID NO1-10). Выбранные сочетания смесевых праймеров характеризуются воспроизводимостью результатов на четырех вариантах модельной системы, ложно-позитивных и ложнонегативных сигналов, отсутствием комплементарного ингбирования уровня праймирования в смеси, исчерпывающей информативностью.
Примеры
Настоящее изобретение проиллюстрировано следующими примерами, не имеющими ограничительного характера.
Условия выполнения операций
Необходимо соблюдение следующих общепринятых в молекулярно-диагностических лабораториях условий постановки ПЦР и анализа результатов амплификации:
- проведение работ по постановки ПЦР в специализированных боксах для ПЦР-диагностики (например, LS-620, «Ламинарные Системы», Россия);
- использование исключительно фильтрованных наконечников для автоматических пипеток;
- регулярная стерилизация рабочих поверхностей и внутреннего пространства ПЦР-боксов и мелкого лабораторного оборудования;
- обязательное территориальное разделение помещений для работы с первичными клиническими образцами и помещений для серийной постановки и проведения ПЦР;
- сбор, хранение и утилизация биологического материала, использованного лабораторного пластика и неиспользованных остатков и отходов ПЦР в полном соответствии с существующими нормами и требованиями.
Оборудование, материалы и реагенты
В работе использовали следующее лабораторное оборудование:
- центрифуги Minispin Plus (Eppendorf, Германия), 5415R (Eppendorf, Германия), 5804R (Eppendorf, Германия);
- УФ-трансиллюминатор с возможностью фотографирования гелей ЕСХ-20М (Vilber Fourmat, Франция);
- флуориметр Qubit 2.0 (Invitrogen, США);
- вортекс Bio Vortex V1 (BioSan, Латвия);
- микроцентрифуга-вортекс Microspin FV-2400 (BioSan, Латвия);
- шейкер Bio Shaker 3D (BioSan, Латвия);
- термостатируемый ротационный шейкер Model 2000 (Robbins Scientific, США);
- весы Scout Pro (Ohaus, КНР);
- ПЦР-бокс («Ламинарные системы», Россия);
- термостат «Термит» («ДНК-технология», Россия);
- термостат Termo 48 (Biokom, Россия);
- охладитель проб SC2D (Biokom, Россия);
- электрофоретические камеры (Pharmacia, Швеция; Helicon, Россия);
- источники питания «Эльф-4» и «Эльф-8» («ДНК-технология», Россия);
- ПЦР-амплификаторы автоматические DNA-Engine (Bio-Rad, США) и OmniGene (Hybaid, Великобритания):
- автоматические микропипетки (Gilson, Франция; Eppendorf, Германия; HTL, Польша).
В работе использовали следующие расходные материалы:
- пластиковые наконечники с фильтрами и ПЦР-пробирки на 0,5 мл (Treff Lab, Швейцария; Porex Bio Products Group, США; SSI, США);
- пластиковые микроцентрифужные пробирки на 1,5 и 2,0 мл (Eppendorf, Германия);
- пленка Parafilm (American National Can, США);
- пластиковые центрифужные пробирки на 15 мл и 50 мл (Corning, США; Greiner, Австрия);
- колонки для очистки продуктов ПЦР QIAquick PCR purification system (Qiagen, Нидерланды);
- ДНК-маркеры длин 1 т.п.о. (1 kb DNA Ladder) и 100+1500 п.о. (100 bp DNA Ladder) (SibEnzyme, Россия), соосадитель Satellite Red («Евроген», Россия);
- набор для измерения концентрации ДНК в растворе Qubit dsDNA HS Assay Kit (Invitrogen, США);
- набор для выделения ДНК из геля (Qiagen, США), набор для выделения ДНК из реакционных смесей (Qiagen, США), набор для выделения ДНК из агарозного геля и реакционных смесей Cleanup Standart/Mini («Евроген», Россия);
- пробирки для сбора крови с ЭДТА Vacuette (Greiner, Австрия), SYBR Green I (Invitrogen, США).
Ферменты:
- термостабильная ДНК-полимераза Encyclo («Евроген», Россия);
- термостабильная ДНК-полимераза Tersus («Евроген», Россия);
- термостабильная ДНК-полимераза HS Taq («Евроген», Россия);
- протеиназа К (Promega, США);
- РНКаза A (Promega, США);
- эндонуклеаза рестрикции AluI (Fermenas, Литва);
- эндонуклеаза рестрикции RsaI (Fermenas, Литва);
- эндонуклеаза рестрикции НаеIII (NEB, США);
- ДНК-лигаза бактериофага Т4 (Promega, США).
Буферные и другие растворы:
- буфер PBS - 137 мМ NaCl, 2,7 мМ KCl, 1,47 мМ KН2РO4, 4,29 мМ Na2HPO4*7H2O, рН 7,3-7,5 (Amresco, США);
- лизирующий буфер: 60 мМ Трис, 100 мМ ЭДТА, 0.5% SDS;
- буфер ТЕ (10х): 0.1 М Трис-HCl (рН 8.0), 10 мМ ЭДТА;
- буфер ТВЕ (5×): 45 мМ Трис-HCl, 45 мМ Н3ВO3, 10 мМ ЭДТА (рН 8.3);
- буфер для нанесения образцов ДНК на агарозный гель: 0,1% бромфеноловыий синий, 0,1% ксиленцианол, 30% глицерин;
- буфер для гибридизации олигонуклеотидных адаптеров и подложек (5х): 50 мМ трис-НCl, 50 мМ хлорид магния;
- RNA Later (Qiagen, Нидерланды);
- связывающий буфер РВ для очистки ПЦР продукта (Qiagen, Нидерланды);
- промывочный буфер РЕ для очистки ПЦР продукта (Qiagen, Нидерланды);
- элюирующий буфер ЕВ для очистки ПЦР продукта (Qiagen, Нидерланды);
буферы для ДНК-полимераз HS Taq, Tersus и Encyclo («Евроген», Россия)
Ключевые технологические операции
Основные технологические операции, использованные в методике:
1. Выделение фракции РВМС
Диагностический образец пунктата костного мозга (до 1 мл) разводили 3 объемами 1x PBS буфера, аккуратно перемешивали, наслаивали полученную суспензию на 4 мл раствора фиколла, предварительно помещенного в центрифужную пробирку и центрифугировали при 400g в течение 32 минут при комнатной температуре. Интерфазу отбирали в отдельные пробирки. Содержащую РВМС интерфазу для промывки разбавляли 1xPBS до 15 мл, центрифугировали при 450g и 20°С 15 минут, супернатант удаляли. Осадок ресуспендировали в 15 мл PBS и снова центрифугировали при 450g и 20°С 15 минут, супернатант удаляли. Ресуспендировали в остатке жидкости и переносили в пробирку на 1,5 мл.
2. Выделение геномной ДНК
Клеточный осадок РВМС-фракций клинических образцов помещали в лизирующий буфер (60 мМ Трис, 100 мМ EDTA, 0.5% SDS), в который добавляли 0,4 мг РНКазы А и помещали на 1 час в термостатируемый ротационный шейкер на 37°С. Затем в раствор добавляли 1,5 мг протеиназы К и инкубировали в термостатируемом ротационном шейкере в течение ночи на 50°С.
Экстракцию ДНК из раствора осуществляли фенол-хлороформным методом. К лизату добавляли равный объем фенола (рН 8.0), аккуратно перемешивали в течение 30 минут и центрифугировали в течение 15 минут при 4 500 g. Водную фазу отбирали в чистую пробирку, добавляли к ней равный объем смеси фенол-хлороформ (1:1) и центрифугировали в течение 15 минут при 4 500 g. Водную фазу отбирали в чистую пробирку, добавляли к ней равный объем хлороформа и центрифугировали в течение 15 минут при 4 500 g. Водную фазу отбирали в заранее подготовленную пробирку с охлажденным этанолом 96% и центрифугировали в течение 15 минут при 4 500 g. Супернатант удаляли, а осадок промывали 6 мл охлажденного этанола 70% и центрифугировали в течение 10 минут при 4 500 g. После удаления супернатанта осадок промывали повторно 3 мл охлажденного этанола 70% и центрифугировали в течение 10 минут при 4 500 g. Супернатант удаляли, осадок высушивали при 50°С в течение 5 минут и растворяли в 200 мкл буфера ТЕ.
3. Проведение ПЦР
Проведение диагностических ПЦР предусмотрено в формате 96-луночного планшета и/или стрипованных серий пробирок. При постановке серийных мультиплексных ПЦР использовали общую для серии реакционную смесь, не содержащую ДНК анализируемой матрицы и праймеров. Каждая пробирка серии содержала предварительно подбираемую комбинацию смесевых прямых и обратных праймеров, приведенных в SEQ ID NO1-10, соответствующих определенным участкам - V, D и J-сегментам анализируемого локуса. Матрицу индивидуальной геномной ДНК добавляли независимо для каждой серии из расчета от 6 нг (min), соответствующих 1000 клеток анализируемого образца, до 60 нг (max), соответствующих 104 клеток, на каждую реакцию в зависимости от доступного клеточного содержания полученного для анализа клинического образца. В результате реакционная смесь каждой и серии реакций содержала:
|
Перед началом целевой амплификации проводили процедуру «hot start» для всей серии путем предварительного прогрева реакционных смесей в течение 120 с при 94°С в амплификаторах с нагреваемой крышкой. Профиль амплификации для приготовления библиотек фланкирующих последовательностей Alu:
|
После амплификации проводили финальное достраивание концов молекул ДНК при 72°С в течение 4 мин.
Количество циклов амплификации составляло 20 для тестовых серий по оптимизации условий проведения ПЦР и определению систем компановки праймеров и 25 - для анализа геномной ДНК индивидуальных клинических образцов. Анализ результатов ПЦР-тестирования проводили с помощью электрофореза в агарозном геле или - в случаях количественной ПЦР - в режиме «реального времени» определения кривых плавления ПЦР-продуктов.
4. Выделение ДНК из агарозного геля
Выделение ДНК из геля производили с использованием набора для экстракции ДНК из геля QIAquick (Qiagen, США). Вырезанный кусок геля помещали в пробирку на 1,5 мл, добавляли к 1 объему геля (из расчета 100 мг ≈ 100 мкл) 3 объема буфера QG и инкубировали 20 минут на качалке при комнатной температуре, после чего добавляли 1 объем изопропанола. Смесь переносили в спин-колонку и центрифугировали 1 минуту при 13000g, супернатант удаляли. Затем внесли в колонку 50 мкл QG, центрифугировали 1 минуту при 13000g, супернатант удаляли. Для промывки вносили в колонку 0,75 мл буфера РЕ, инкубировали при комнатной температуре 4 минуты и центрифугировали 1 минуту при 13000g, супернатант удаляли. Для удаления остатков РЕ центрифугировали пустую колонку 1 минуту при 13000g и переносили колонку в чистую собирательную пробирку. Элюцию ДНК с колонки производили дважды буфером ЕВ, вносили по 30 мкл в колонку, инкубировали 1 минуту и центрифугировали 1 минуту при 13000g.
5. Измерение количества ДНК
Определение концентрации ДНК в полученных образцах геномной ДНК из РВМСфракций или образцах элюатов суммарных ПЦР-фрагментов проводили в серийных разведениях образцов с помощью флюориметра Qubit 2.0 и набора для измерения концентрации ДНК в растворе Qubit dsDNA HS Assay Kit.
Последовательность выполнения технологических операций
1. Проводили выделение РВМС фракции из исследуемого образца пунктата костного мозга по стандартной процедуре.
2. Проводили выделение геномной ДНК из полученной РВМС-фракции по стандартной процедуре.
3. Проводили флуориментрическое определение количества и концентрации ДНК полученного образца на приборе Qubit 2.0, отбирали аликвоту и доводили концентрацию ДНК в анализируемом образце до значения 60 нг/мкл путем разведения в ТЕ буферном растворе.
4. В серию стрипованных пробирок на 0,2 мл последовательно добавляли по 1 мкл тестируемого образца геномной ДНК, по 2 мкл каждой из комбинаций смесевых олигонуклеотидных праймеров и по 17 мкл предварительно подготовленной реакционной смеси для ПЦР.
5. Проводили мультиплексную ПЦР в полной серии реакций согласно вышеприведенной прописи; после завершения амплификации из каждой пробирки отбирали аликвоту 5 мкл для полуколичественного анализа.
6. Проводили электрофорез в 1%-ом агарозном геле отобранных аликвот мультиплексных ПЦР в присутствии маркера длин фрагментов ДНК и образцов положительного контроля;
7. количество V(D)J-перестроек, связанных с опухолевыми клонами, определяли по количеству высокопредставленных продуктов мультиплексных ПЦР, детектируемых при помощи электрофореза.
8. по результатам денситометрии электрофореграмм определяли суммарную интенсивность всех ПЦР-продуктов и интенсивность высокопредставленных ПЦР-продуктов. Полученное соотношение интенсивностей соответствует содержанию выявленных V(D)J-перестроек генов TCR в анализируемом образце геномной ДНК.
9. Проводили элюцию высокопредставленных продуктов ПЦР из агарозного геля согласно вышеприведенной прописи и выполняли дополнительную очистку элюатов с использованием микроколонок QIAquick PCR purification system.
10. Проводили секвенирование по Сэнгеру элюированных ПЦР-продуктов с использованием ПЦР-праймеров на соответствующие J-сегменты генов TCR.
11. Установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов
Пример 1. Выявление маркеров наличия опухолевых Т-лимфобластов Проводили выделение мононуклеарных клеток периферической крови (РВМС-фракция) из диагностического образца пациента, а затем - выделение геномной ДНК из РВМС-фракции по методике, описанной выше.
ПЦР проводили в формате 96-луночного планшета и/или стрипованных серий пробирок по методике, описанной выше. Количество циклов амплификации составляло 20 для тестовых серий и 25 - для анализа геномной ДНК индивидуальных клинических образцов. Анализ результатов ПЦР-тестирования проводили с помощью электрофореза в агарозном геле.
По окончании реакции из каждой пробирки отбирали аликвоту 5 мкл для полуколичественного анализа. Проводили электрофорез отобранных аликвот в 1%-ом агарозном геле в присутствии маркера длин фрагментов ДНК и образцов положительного контроля. Количество V(D)J-перестроек, связанных с опухолевыми клонами, определяли по количеству высокопредставленных продуктов амплификации, детектируемых при помощи электрофореза. Отсутствие высокопредставленных продуктов указывало на отсутствие опухолевых Т-лимфобластов, и дальнейшие операции не проводили. По результатам денситометрии электрофореграмм определяли суммарную интенсивность всех ПЦР-продуктов и интенсивность высокопредставленных ПЦР-продуктов. Проводили элюцию высокопредставленных продуктов и выполняли дополнительную очистку элюатов с использованием микроколонок QIAquick PCR purification system или аналога (например, Cleanup Standard, Евроген). Проводили секвенирование по Сэнгеру элюированных ПЦР-продуктов с использованием ПЦР-праймеров на соответствующие J-сегменты генов TCR. Установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых Т-лимфобластов.
На Фиг. 1 представлены в качестве примера результирующие электрофореграммы, демонстрирующие перестройки генов TRB локуса: А - электрофореграмма пациента ОЛЛ с перестройками в обеих аллелях TRB локуса, Б - пациента с ОЛЛ с перестройкой в одном из аллелей. В клетках РВМС-фракций диагностических образцов как периферической крови, так и костного мозга больных острым лейкозом наблюдается ярко выраженное преобладание одного или нескольких, предположительно опухолевых клонов с немногими характеристическими перестройками.
Таким образом, на элекрофореграмме могут быть представлены один или несколько мажорных (высокопредставленных) ПЦР-продуктов (флюоресцирующих полос). Каждый из этих продуктов является результатом амплификации гена TRB, соответствующего гиперпредставленного клона Т-лимфобластов. Гиперпредставленность клона Т-лимфобластов говорит о его неконтролируемом размножении, что означает злокачественную трансформацию. Флуоресценция мажорных ПЦР-продуктов соответствует злокачественным клонам Т-лимфобластов, суммарная флуоресценция соответствует всей популяции Т-лимфобластов. Нуклеотидная последовательность гена или последовательности генов TCR, соответствующих злокачественным клонам Т-лимфобластов, являются маркерами наличия опухолевых Т-лимфобластов.