Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЕ ПЛАЗМИДНЫЕ ДНК, КОДИРУЮЩИЕ ГИБРИДНЫЕ ПОЛИПЕПТИДЫ СО СВОЙСТВАМИ КРАСНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА mCherry, ДЛЯ ПРОДУЦИРОВАНИЯ ГИБРИДНЫХ ФЛУОРЕСЦЕНТНЫХ БЕЛКОВ В Escherichia coli
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генетической инженерии. Может быть использовано для получения гибридных флуоресцентных белков в клетках Escherichia coli.
Флуоресцентные белки являются эффективным инструментом изучения локализации белков и динамики внутриклеточных процессов [Chudakov D., Lukyanov S., Lukyanov К. Fluorescent proteins as a toolkit for in vivo imaging. Trends Biotechnol. 2005. V.23. P.605-613; Giepmans В., Adams S., Ellisman M., Tsien R. The fluorescent toolbox for assessing protein location and function. Science. 2006. V.312. P.217-224]. Гибридные флуоресцентные белки могут быть использованы для молекулярной визуализации целевых белков с целью диагностики in vivo [Desplancq D., Rinaldi A.S., Stoessel A., Sibler A.P., Busso D., Oulad-Abdelghani M., Van Regenmortel M.H., Weiss E. Single-chain Fv fragment antibodies selected from an intrabody library as effective mono- or bivalent reagents for in vitro protein detection. J. Immunol. Methods. 2011. V.369. P.42-50], для исследования факторов, оказывающих влияние на взаимодействие белков, методом FRET [Huang J., Koide S. Rational conversion of affinity reagents into label-free sensors for peptide motifs by designed allostery. ACS Chem. Biol. 2010. V.5. P.273-277], для иммуноанализа с однокомпонентной системой детекции [Sakamoto S., Taura F., Pongkitwitoon В., Putalun W., Tsuchihashi R., Kinjo J., Tanaka H., Morimoto S. Development of sensitivity-improved fluorescence-linked immunosorbent assay using a fluorescent single-domain antibody against the bioactive naphthoquinone, plumbagin. Anal, and Bioanal. Chemistry. 2010. V.356. P.2955-2963].
Известна рекомбинантная плазмидная ДНК, обеспечивающая продукцию гибридного флуоресцентного белка EGFP-scFv в клетках Е.coli [Casey J.L., Coley A.M., Tilley L.M., Foley M.Green fluorescent antibodies: novel in vitro tools. Protein Eng. 2000. V.13. P.445-452]. Ген зеленого флуоресцентного белка EGFP клонируют перед геном одноцепочечного антитела анти-HepBsAg в векторе pGC. Индукцию проводят в клетках штамма Sure путем добавления 1 мМ ИПТГ, затем культивирование продолжают в течение 4 ч при 25°C. Выход рекомбинантного белка, обеспечиваемый за счет использования данной конструкции, составляет 0,2 мг/л культуры. Недостатком данной конструкции является большое количество индуктора, необходимое для экспрессии, и низкий выход гибридного флуоресцентного белка.
Известна рекомбинантная плазмидная ДНК, детерминирующая продукцию гибридного флуоресцентного белка REDantibody в клетках Е.coli [Markiv A., Anani В., Durvasula R., Kang A. Module based antibody engineering: A novel synthetic REDantibody. J. of Immunol. Meth. 2011. V.364. P.40-49]. Гены VH и VL-фрагментов антител объединяют в единой рамке считывания с геном красного флуоресцентного белка mRFP при помощи клонирования под контролем промотора Т71ас в составе векторной плазмиды pET26b. Наличие кодирующей последовательности сигнального пептида pelB обеспечивает секрецию продуктов экспрессии в периплазматическое пространство бактерий. Индукцию проводят в клетках штамма BL21(DE3) путем добавления 0.3 мМ ИПТГ, затем культивирование продолжают в течение 20 ч при 20°C. Выход рекомбинантных белков, обеспечиваемый за счет использования данной конструкции, составляет 1-9 мг/л культуры. Недостатком данной конструкции является невысокий выход гибридных флуоресцентных белков.
Известна наиболее близкая к заявленным рекомбинантная плазмидная ДНК, обеспечивающая продукцию гибридного флуоресцентного белка zif268-mCherry в клетках Е. coli [Ree J., Kim S. Kit including target sequence-binding protein and method of detecting target nucleic acid by using the kit. US Patent 2012/0064510 A1]. Ген ДНК-связывающего белка с доменом типа «цинковый палец» (zif) клонируют перед геном красного флуоресцентного белка mCherry, разделяя их при помощи последовательности, кодирующей глицин-сериновый линкер. Экспрессия гибридного гена регулируется промотором Т71ас в составе векторной плазмиды pET21b. Индукцию проводят в клетках штамма BL21(DE3) путем добавления 0.5 мМ ИПТГ, после чего продолжают культивирование при 25°C в течение 16 ч. Недостатком описанной конструкции является расположение кодирующей последовательности mCherry на 3'-конце гена гибридного белка, что ставит эффективность экспрессии гибридного белка в зависимость от нуклеотидной последовательности 5'-концевого партнера.
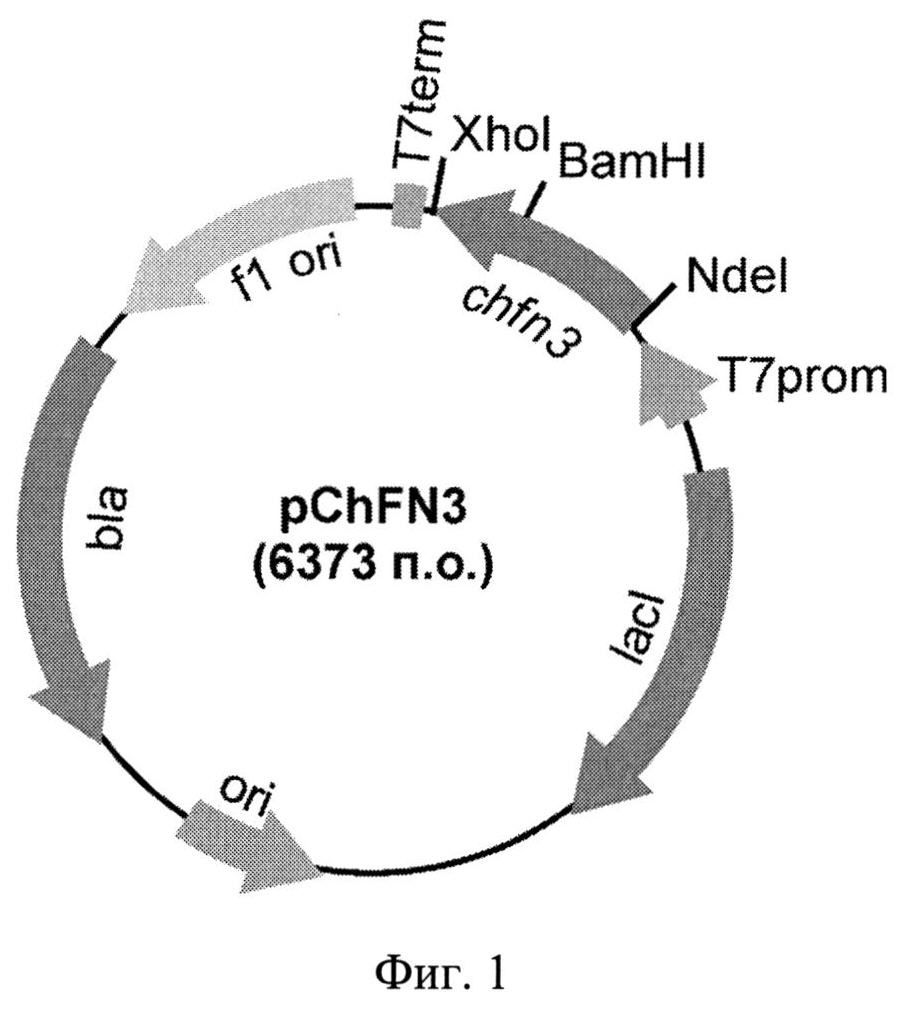
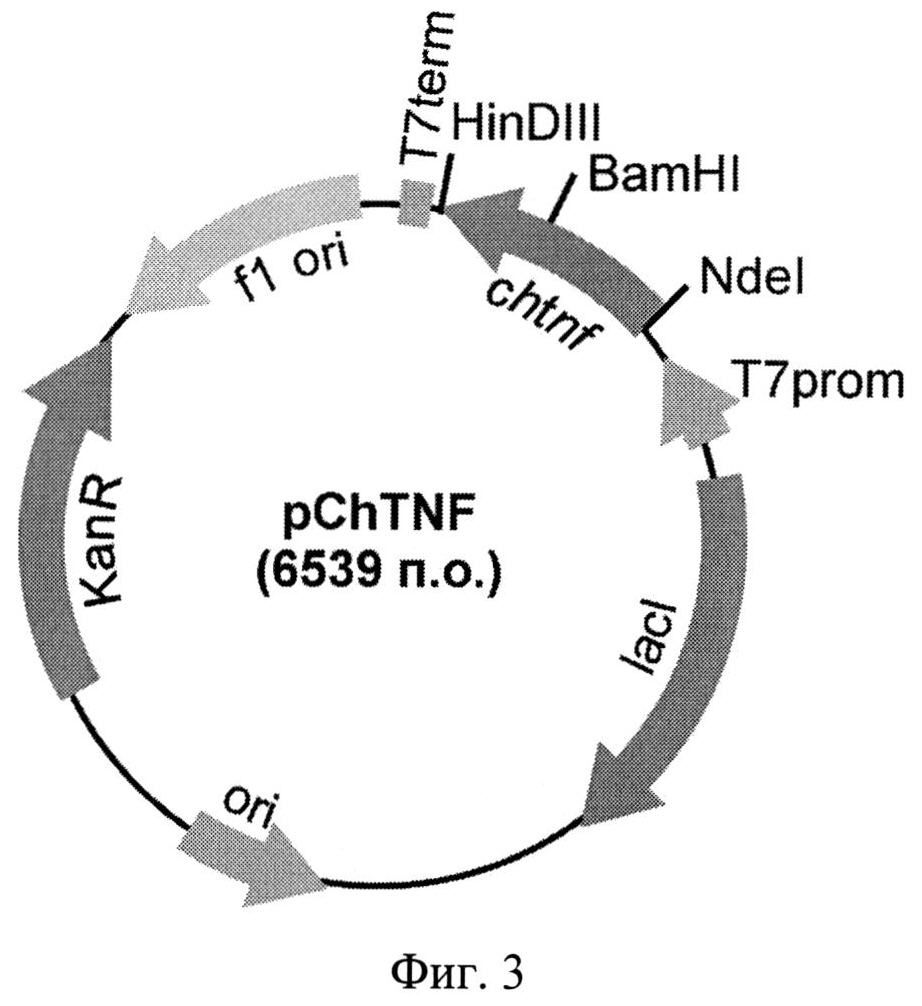
Технической задачей изобретения является получение рекомбинантных плазмидных ДНК, обеспечивающих эффективную продукцию гибридных флуоресцентных белков в клетках Е.coli. Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pChFN3, кодирующей гибридный полипептид ChFN3 со свойствами красного флуоресцентного белка mCherry и 10 домена фибронектина человека III типа (10FN3), с мол. массой 4,2 Md (6,373 т.п.о.), состоящей из NdeI/XhoI - фрагмента ДНК плазмиды рЕТ32а(+) длиной 5,366 т.п.о., включающего промотор Т71ас, терминатор транскрипции бактериофага Т7, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pChFN3 клеток к ампициллину, участок ori инициации репликации; и NdeI/XhoI - фрагмента ДНК размером 1,007 т.п.о., содержащего ген chfn3, кодирующий аминокислотную последовательность гибридного полипептида ChFN3 со свойствами красного флуоресцентного белка mCherry и 10FN3; содержащей уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: NdeI - 367, BamHI - 1068, XhoI - 1374, а также рекомбинантной плазмидной ДНК pChTNF, кодирующей гибридный полипептид ChTNF со свойствами красного флуоресцентного белка mCherry и фактора некроза опухолей человека (TNF), с мол. массой 4,24 Md (6,539 т.п.о.), состоящей из NdeI/XhoI - фрагмента ДНК плазмиды рЕТ28а длиной 5,289 т.п.о., включающего промотор бактериофага Т7, терминатор транскрипции бактериофага Т71ас, ген KanR, определяющий устойчивость трансформированных плазмидой pChTNF клеток к канамицину, участок ori инициации репликации; и NdeI/HinDIII - фрагмента ДНК размером 1,250 т.п.о., содержащего ген chtnf, кодирующий аминокислотную последовательность гибридного полипептида ChTNF со свойствами красного флуоресцентного белка mCherry и TNF, содержащей уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: NdeI - 238, BamHI - 939, HinDIII - 1442.
Рекомбинантные плазмидные ДНК pChFN3 и pChTNF кодируют индуцибельный синтез гибридных полипептидов ChFN3/ChTNF со свойствами красного флуоресцентного белка mCherry и 10FN3/TNF соответственно. Красный флуоресцентный белок mCherry, полученный на основе белка DsRed из Discosoma, характеризуется высокой скоростью созревания и фотостабильностью, сохраняет свои свойства в составе N- и С-концевых гибридов [ShanerN.C, Campbell R.E., Steinbach Р.А., Giepmans B.N., Palmer A.E., Tsien R.Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp.red fluorescent protein. Nat. Biotechnol. 2004. V.22. P.1567-72]. В отличие от зеленого флуоресцентного белка GFP, склонного к образованию агрегатов в процессе бактериальной экспрессии [Chang Н., Kaiser С., Hartl F., Barral J. De novo folding of GFP fusion proteins: high efficiency in eukaryotes but not in bacteria. J. Mol. Biol. 2005. V.353. P.397-409], mCherry представляет собой мономерный белок, не образующий агрегатов.
Известно, что эффективность экспрессии генов в бактериальных клетках во многом определяется эффективностью инициации трансляции, которая в свою очередь зависит от первичной и соответствующей вторичной структуры 5'-концевой области мРНК, содержащей последовательность Шайна-Дальгарно и инициирующий кодон [de Smiy М., van Duin J. Control of prokaryotic translational initiation by mRNA secondary structure. Prog. Nucl. Acid Res. Mol. Biol. 1990. V.38. P.1-35]. Особенностью предложенных плазмидных конструкций является расположение гена красного флуоресцентного белка mCherry на 5'-конце гибридного гена, а также модификация его 5'-концевой последовательности, способствующая более эффективной инициации трансляции мРНК. Предложенная модификация не оказывает влияния на флуоресцентные свойства белка, при этом способствует высокому уровню экспрессии гена mCherry и гена гибридного белка в целом, независимо от того, какая последовательность клонирована в 3'-концевом положении.
Для получения штаммов-продуцентов гибридных полипептидов ChFN3 и ChTNF компетентные клетки Е.coli штамма BL21(DE3) трансформируют рекомбинантной плазмидой pChFN3 и pChTNF соответственно. В результате трансформации штамма Е. coli BL21(DE3) полученными плазмидными ДНК и индукции ИТПГ достигается уровень экспрессии этих полипептидов не ниже 15% суммарного клеточного белка. Высокий индуцибельный уровень синтеза обеспечивается тем, что плазмиды pChFN3 и pChTNF содержат промотор Т71ас и усилитель трансляции гена 10 бактериофага Т7, а также модификацией 5'-концевой последовательности гена красного флуоресцентного белка mCherry.
Использование модифицированной кодирующей последовательности гибридных полипептидов ChFN3 и ChTNF (SEQ ID NO 1, SEQ ID NO 7), под контролем сильного регулируемого промотора Т71ас, в сочетании с наличием в плазмиде гена репрессора LacI и гена РНК-полимеразы бактериофага Т7 в хромосоме хозяйского штамма обеспечивает индуцибельный синтез целевых белков (SEQ ID NO 2, SEQ ID NO 8) с надежной регуляцией и высоким выходом, достигаемым при малых концентрациях индуктора. На 3'-конце гена chfn3 и на 5'-конце гена chtnf расположена последовательность, кодирующая шесть остатков гистидина, для облегчения очистки гибридных белков при помощи металлоаффинной хроматографии.
Предлагаемые конструкции могут быть использованы для получения рекомбинантных плазмидных ДНК, содержащих кодирующие последовательности других гибридных белков. Путем обработки плазмидных ДНК pChFN3 или pChTNF рестриктазами BamHI и XhoI или BamHI и HinDIII соответственно получают векторы для клонирования, которые объединяют в реакции лигирования с целевыми кодирующими последовательностями, полученными в результате ПЦР и/или обработки теми же рестриктазами содержащих их плазмидных или геномных ДНК. Выбор одного из предложенных векторов определяется предпочтительным расположением гексагистидиновой последовательности на N- или С-конце гибридного белка (в случае плазмидных ДНК pChTNF и pChFN3 соответственно).
Технический результат заявленного изобретения заключается в том, что полученные плазмидные конструкции pChTNF и pChFN3 обеспечивают эффективную продукцию гибридных полипептидов ChFN3 и ChTNF со свойствами красного флуоресцентного белка mCherry в штамме Е.coli BL21(DE3) в количестве не менее 15% от суммарного клеточного белка при концентрации индуктора 0,2 мМ. В отличие от прототипа использование данных конструкций обеспечивает высокий выход целевого белка (не менее 100 мг/л) при добавлении в 2,5 раз меньшего количества индуктора (ИПТГ). Совокупность перечисленных свойств обусловливает высокую технологичность процесса получения гибридных флуоресцентных белков.
Изобретение иллюстрируют графические материалы.
Фиг.1. Физическая карта рекомбинантной плазмиды pChFN3. Указаны уникальные сайты эндонуклеаз рестрикции. Т7 promotor - промотор Т71ас, Т7 terminator - терминатор транскрипции бактериофага Т7, lad - ген lac-репрессора, Ap - ген устойчивости к ампициллину, ori - участок инициации репликации плазмиды, chfn3 - рекомбинантный ген, кодирующий аминокислотную последовательность гибридного полипептида ChFN3.
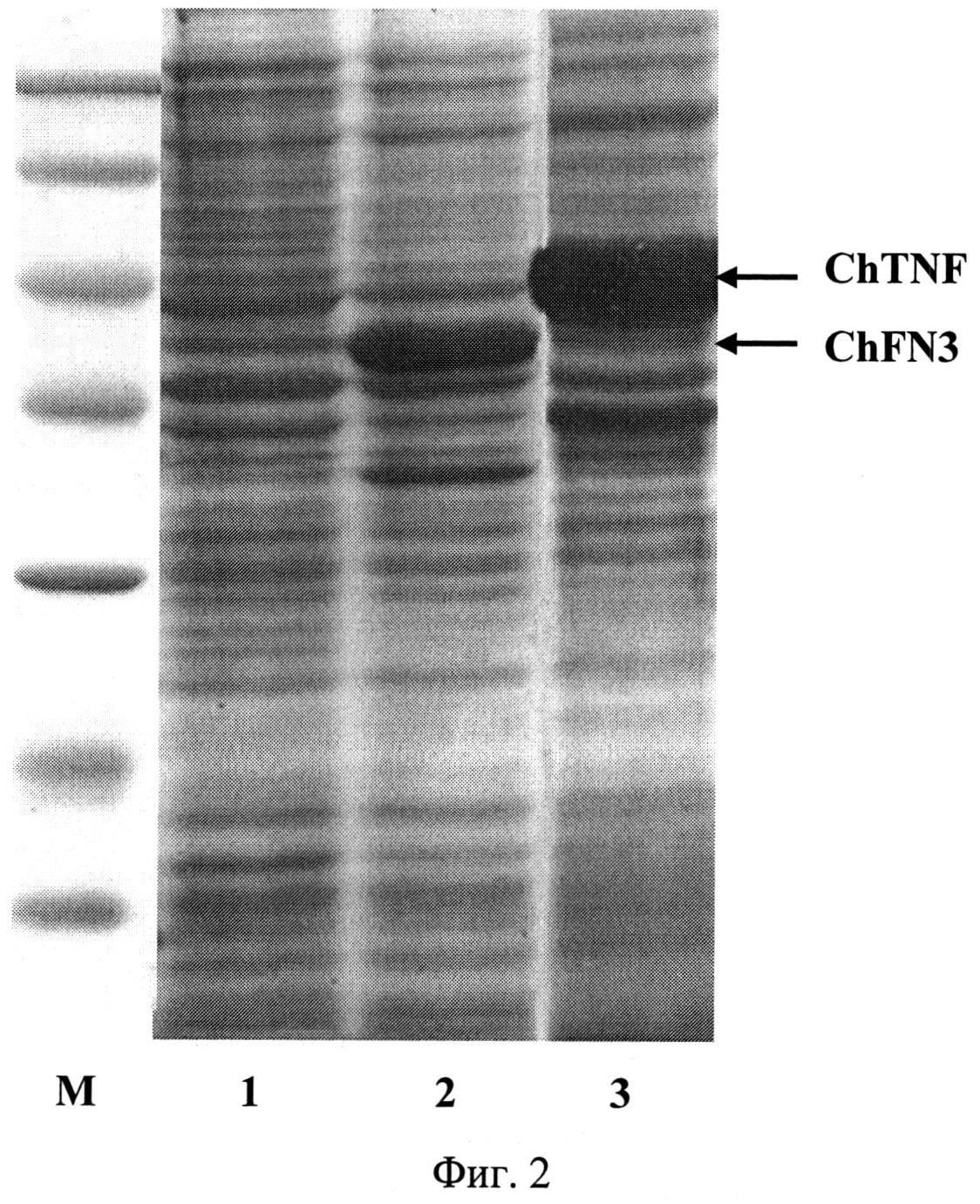
Фиг.2. Электрофореграмма лизатов клеток штаммов-продуцентов Е.coli BL21(DE3)/pChFN3 (дорожка 1 - до индукции, дорожка 2 - после индукции) и BL21(DE3)/pChTNF (дорожка 3) после индукции в 13%-ном полиакриламидном геле (M - белковые маркеры молекулярной массы); стрелками указаны гибридные полипептиды ChFN3 и ChTNF.
Фиг.3. Физическая карта рекомбинантной плазмиды pChTNF. Указаны уникальные сайты эндонуклеаз рестрикции. Т7 promotor - промотор Т71ас, Т7 terminator - терминатор транскрипции бактериофага Т7, lad - ген lac-репрессора, KanR - ген устойчивости к канамицину, ori - участок инициации репликации плазмиды, chtnf-рекомбинантный ген, кодирующий аминокислотную последовательность гибридного полипептида ChTNF.
Изобретение иллюстрируют следующие примеры.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pChFN3.
Для амплификации гена mCherry проводят полимеразную цепную реакцию (ПЦР) с использованием плазмидной ДНК pmCherry-Cl (Clontech, США) в качестве матрицы. Реакционная смесь для ПЦР объемом 50 мкл содержит 50 pmol праймера NdeCh (SEQ ID NO 3), 50 pmol праймера CheBam (SEQ ID NO 4), 2 мМ каждого из четырех dNTP, 2 нг ДНК-матрицы, 5 мкл 10х буфера для Pfu ДНК-полимеразы (Fermentas, Литва) и 2.5 е.а. Pfu ДНК-полимеразы (Fermentas). ПЦР проводят в следующем режиме: денатурация - 1 мин, 94°C; отжиг - 40 с, 52°C; достройка - 40 с, 72°C; количество циклов - 25. 2 мкг ПЦР-продукта обрабатывают рестриктазами NdeI и BamHI (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,701 т.п.о. выделяют из 1% агарозного геля с помощью набора MinElute Gel Extraction Kit (Qiagen, Германия).
Для амплификации гена 10FN3 проводят ПЦР в аналогичных условиях с использованием праймеров BamFN (SEQ ID NO 5) и FN_Xho (SEQ ID NO 6) и плазмидной ДНК pETFN3 [Л.Е.Петровская, Л.Н.Шингарова, Е.А.Крюкова, Е.Ф.Болдырева, С.А.Якимов, С.В.Гурьянова, В.Н.Новоселецкий, Д.А.Долгих, М.П.Кирпичников. Конструирование TNF-связывающих белков на основе домена фибронектина методом пересадки гипервариабельных участков антитела F10. Биохимия. 2012. Т.77. С.79-89] в качестве матрицы. 2 мкг ПЦР-продукта обрабатывают рестриктазами BamHI и XhoI (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,306 т.п.о. выделяют из 1,5% агарозного геля с помощью набора MinElute Gel Extraction Kit (Qiagen).
По 1 мкг полученных фрагментов и 0.2 мкг плазмидного вектора рЕТ32а(+), линеаризированного обработкой рестриктазами NdeI и XhoI, длиной 5366 п.о. лигируют в течение 3 ч при 13°C в 10 мкл раствора, содержащего 40 мМ трис-HCl (pH 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 5 е.а. Т4 ДНК-лигазы (Fermentas). 5 мкл лигазной смеси используют для трансформации компетентных клеток Е.coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 100 мкг/мл ампициллина.
Из выросших клонов выделяют плазмидную ДНК и обрабатывают рестриктазами NdeI и XhoI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1% агарозном геле. Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности. В результате получают целевую плазмидную ДНК pChFN3 (Фиг.1).
Пример 2.
Получение штамма-продуцента гибридного полипептида ChFN3.
Рекомбинантной плазмидной ДНК pChFN3 трансформируют компетентные клетки Е.coli BL21(DE3) (Novagen) и после выращивания рекомбинантньгх клонов на LB-arape с ампициллином (100 мкг/мл) при 37°C получают штамм-продуцент гибридного полипептида ChFN3.
Пример 3.
Определение продуктивности штамма-продуцента гибридного полипептида ChFN3.
Для определения продуктивности клетки E.coli BL21 (DE3)/pChFN3 выращивают при 37°C в 5 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, в течение 16 ч на качалке при 250 об/мин. Полученную ночную культуру в объеме 100 мкл переносят в 5 мл жидкой среды LB (разбавление до оптической плотности 0.15-0.20 при длине волны 560 нм), содержащей 100 мкг/мл ампициллина, и выращивают до оптической плотности 0,8 (длина волны 560 нм) при 37°С и перемешивании 250 об/мин. Добавляют ИПТГ до конечной концентрации 0,2 мМ, после чего клетки выращивают в течение 4 ч при 27°С и перемешивании 250 об/мин. Отбирают пробу культуры в количестве 1 оптическая единица (длина волны 560 нм) и центрифугируют 5 мин при скорости 7000 об/мин. Осажденные клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, pH 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 10 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. По окончании электрофореза гель прокрашивают при помощи кумасси R-250. После отмывки красителя гель сканируют и проводят математическую обработку результатов с помощью программы Scion Image (Scion Corp., США). По данным сканирования содержание гибридного полипептида ChFN3 составляет 15% от общего клеточного белка. На фиг.2 представлена электрофореграмма лизатов клеток штамма-продуцента Е.coli BL21(DE3)/pChFN3 в 13%-ном полиакриламидном геле до (дорожка 1) и после индукции ИПТГ (дорожки 2) (M - белковые маркеры молекулярной массы; стрелкой указан полипептид ChFN3).
Пример 4.
Выделение и очистка гибридного полипептида ChFN3.
Проводят индукцию биосинтеза гибридного полипептида ChFN3 в клетках штамма-продуцента Е.coli BL21(DE3)/pChFN3 ИПТГ (конечная концентрация 0,2 мМ) в течение 4 ч. Клетки центрифугируют 15 мин при 7000 об/мин.
1 г влажной биомассы индуцированных клеток ресуспендируют в 10 мл буфера (50 мМ Трис-HCl pH 8,0; 200 мМ NaCl; 1 мМ PMSF) после чего разрушают клетки обработкой в ультразвуковом дезинтеграторе Branson Sonifier 450, не допуская нагрева выше 10°C. Полученную суспензию центрифугируют 15 мин при 17000 об/мин. Выделение и очистку искомого полипепептида из супернатанта проводят с помощью Ni-аффинной хроматографии на колонке Ni-Sepharose FastFlow (GE Healthcare) объемом 2 мл в градиенте концентрации имидазола (0,1-0,5 М) в буфере (20 мМ Трис-HCl pH 8,0; 200 мМ NaCl). Объединенные фракции, содержащие очищенный белок и имеющие по данным белкового электрофореза чистоту более 90%, диализуют против буфера (20 мМ Трис-HCl pH 8,0; 50 мМ NaCl) и стерилизуют при помощи фильтрования. Средний выход очищенного таким образом гибридного полипептида ChFN3 составляет 120 мг из 1 л культуры.
Пример 5.
Конструирование рекомбинантной плазмидной ДНК pChTNF.
Для амплификации гена TNF проводят полимеразную цепную реакцию (ПЦР) с использованием плазмидной ДНК pTNF331 [Л.Н.Шингарова, Л.Н.Сагайдак, Р.Л.Турецкая, С.А.Недоспасов, Д.С.Есипов, В.Г.Коробко. Мутанты фактора некроза опухолей альфа человека: получение и некоторые свойства. Биоорган, химия. 1996. Т.22. С.243-251] в качестве матрицы. Реакционная смесь для ПЦР объемом 50 мкл содержит 50 pmol праймера Bam_TNF (SEQ ID NO 9), 50 pmol праймера TNFHIND (SEQ ID NO 10), 2 мМ каждого из четырех dNTP, 2 нг ДНК-матрицы, 5 мкл 10х буфера для Pfu ДНК-полимеразы (Fermentas, Литва) и 2.5 е.a. Pfu ДНК-полимеразы (Fermentas). ПЦР проводят в следующем режиме: денатурация - 1 мин, 94C; отжиг - 40 с, 54°C; достройка - 45 с, 72°C; количество циклов - 25. 2 мкг ПЦР-продукта обрабатывают рестриктазами BamHI и HindIII (Fermentas) в условиях, рекомендованных производителем ферментов, фрагмент длиной 0,503 т.п.о. выделяют из 1% агарозного геля с помощью набора MinElute Gel Extraction Kit (Qiagen, Германия).
Фрагмент ДНК, содержащий ген mCherry, получают обработкой плазмидной ДНК pChFN3 рестриктазами NdeI и BamHI (Fermentas), фрагмент длиной 0,701 т.п.о. выделяют из 1% агарозного геля с помощью набора MinElute Gel Extraction Kit (Qiagen, Германия).
По 1 мкг полученных фрагментов и 0.2 мкг плазмидного вектора рЕТ28а(+), линеаризированного обработкой рестриктазами NdeI и HinDIII, длиной 5289 п.о. лигируют в течение 3 ч при 13°C в 10 мкл раствора, содержащего 40 мМ трис-HCl (pH 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 5 е.а. Т4 ДНК-лигазы (Fermentas). 5 мкл лигазной смеси используют для трансформации компетентных клеток Е.coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 25 мкг/мл канамицина.
Из выросших клонов выделяют плазмидную ДНК и обрабатывают рестриктазами NdeI и HinDIII с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1% агарозном геле. Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности. В результате получают целевую плазмидную ДНК pChTNF (Фиг.3).
Пример 6.
Получение штамма-продуцента гибридного полипептида ChTNF.
Рекомбинантной плазмидной ДНК pChTNF трансформируют компетентные клетки Е.coli BL21(DE3) (Novagen) и после выращивания рекомбинантных клонов на LB-arape с канамицином (25 мкг/мл) при 37°C получают штамм-продуцент гибридного полипептида ChTNF.
Пример 7.
Определение продуктивности штамма-продуцента гибридного полипептида ChTNF.
Для определения продуктивности клетки E.coli BL21(DE3)/pChTNF выращивают при 37°C в 5 мл жидкой среды LB, содержащей 25 мкг/мл канамицина, в течение 16 ч на качалке при 250 об/мин. Полученную ночную культуру в объеме 100 мкл переносят в 5 мл жидкой среды LB (разбавление до оптической плотности 0.15-0.20 при длине волны 560 нм), содержащей 25 мкг/мл канамицина, и выращивают до оптической плотности 0,8 (длина волны 560 нм) при 37°C и перемешивании 250 об/мин. Добавляют ИПТГ до конечной концентрации 0,2 мМ, после чего клетки выращивают в течение 4 ч при 27°C и перемешивании 250 об/мин. Отбирают пробу культуры в количестве 1 оптическая единица (длина волны 560 нм) и центрифугируют 5 мин при скорости 7000 об/мин. Осажденные клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 10 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. По окончании электрофореза гель прокрашивают при помощи кумасси R-250. После отмывки красителя гель сканируют и проводят математическую обработку результатов с помощью программы Scion Image (Scion Corp., США). По данным сканирования? содержание гибридного полипептида ChTNF составляет 20% от общего клеточного белка. На Фиг.2 представлена электрофореграмма лизатов клеток штамма-продуцента Е. coli BL21(DE3)/pChTNF в 13%-ном полиакриламидном геле после индукции ИПТГ (дорожка 3) (M - белковые маркеры молекулярной массы; стрелкой указан полипептид ChTNF).
Пример 8.
Выделение и очистка гибридного полипептида ChTNF.
Проводят индукцию биосинтеза гибридного полипептида ChTNF в клетках штамма-продуцента Е.coli BL21(DE3)/pChTNF ИПТГ (конечная концентрация 0,2 мМ) в течение 4 ч. Клетки центрифугируют 15 мин при 7000 об/мин.
1 г влажной биомассы индуцированных клеток ресуспендируют в 10 мл буфера (50 мМ Трис-HCl pH 8,0; 200 мМ NaCl; 1 мМ PMSF) после чего разрушают клетки обработкой в ультразвуковом дезинтеграторе Branson Sonifier 450, не допуская нагрева выше 10°C. Полученную суспензию центрифугируют 15 мин при 17000 об/мин. Выделение и очистку рекомбинантного полипепептида из супернатанта проводят с помощью Ni-аффинной хроматографии на колонке Ni-Sepharose FastFlow (GE Healthcare) объемом 2 мл в градиенте концентрации имидазола (0,1-0,5 M) в буфере (20 мМ Трис-НСl pH 8,0; 200 мМ NaCl). Объединенные фракции, содержащие очищенный белок и имеющие по данным белкового электрофореза чистоту более 90%, диализуют против буфера (20 мМ Трис-HCl pH 8,0; 50 мМ NaCl) и стерилизуют при помощи фильтрования. Средний выход очищенного таким образом гибридного полипептида ChTNF составляет 150 мг из 1 л культуры.
Перечень последовательностей, представленных в описании изобретения
SEQ ID NO 1.


Нуклеотидная последовательность гена гибридного полипептида ChFN3 в плазмиде pChFN3. Жирным шрифтом выделен инициирующий кодон.
SEQ ID NO 2.

Аминокислотная последовательность гибридного полипептида ChFN3, кодируемого рекомбинантной плазмидой pChFN3.

Нуклеотидная последовательность праймера, использованного для амплификации гена mCherry.

Нуклеотидная последовательность праймера, использованного для амплификации гена mCherry.
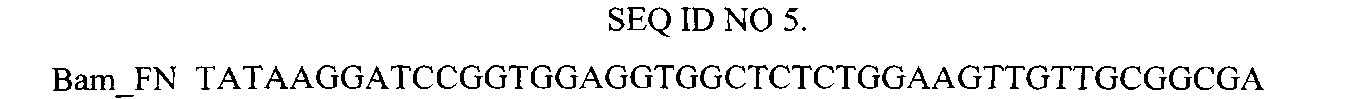
Нуклеотидная последовательность праймера, использованного для амплификации гена 10FN3.

Нуклеотидная последовательность праймера, использованного для амплификации гена I0FN3.
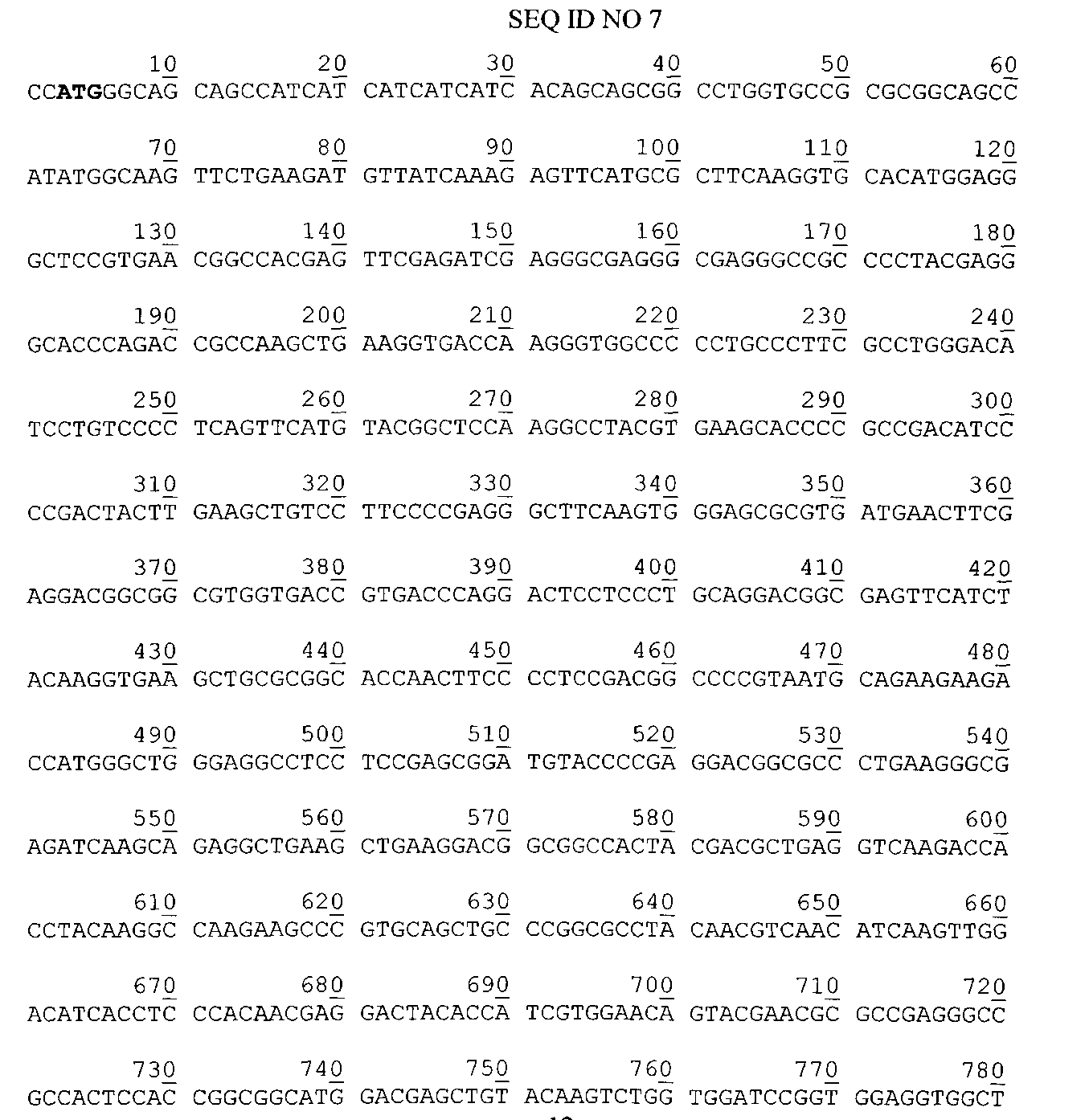

Нуклеотидная последовательность гена гибридного полипептида ChTNF в плазмиде pChTNF. Жирным шрифтом выделен инициирующий кодон.

Аминокислотная последовательность гибридного полипептида ChTNF, кодируемого рекомбинантной плазмидой pChTNF.
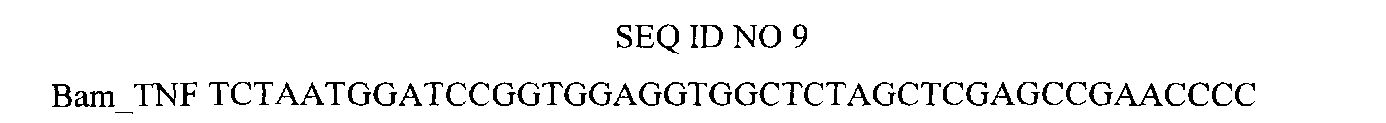
Нуклеотидная последовательность праймера, использованного для амплификации гена TNF.
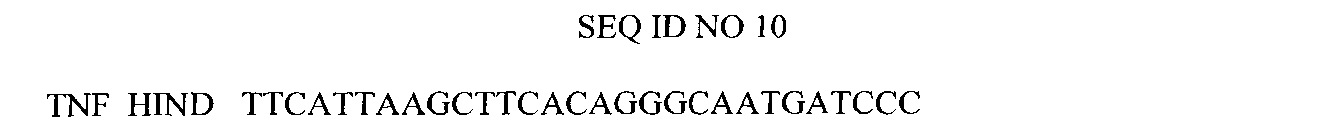
Нуклеотидная последовательность праймера, использованного для амплификации гена TNF.