Результат интеллектуальной деятельности: АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к ряду аналогов соединений 4Н-пиразоло[1,5-a]бензимидазола в качестве ингибиторов PARP. Более конкретно, настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям в качестве ингибиторов PARP.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
PARP представляет собой семейство ферментов, которые катализируют введение остатка ADP-рибозы в различные целевые белки. К настоящему времени было определено и охарактеризовано до 18 изоформ. Несмотря на большое количество ферментов в семействе, PARP-1 отвечает за более 90% ADP-рибозилирования в клетках.
Долгое время PARP-1 ассоциировалась с репарацией ДНК и поддержанием функционирования генома. После повреждения ДНК PARP-1 мгновенно активируется путем связывания с разрывами ДНК. После структурных изменений она начинает использовать NAD+ для синтеза поли(АБР)рибозы в качестве сигнала для других ферментов репарации (таких как ДНК лигаза III, ДНК полимераза бета). Данный процесс связывания и активации PARP-1 (известный как эксцизионная репарация оснований) обеспечивает усиление процесса репарации, который направлен на однонитевые разрывы ДНК (SSB). Инициирование SSB обычно происходит посредством окислительных повреждений, которые вызваны собственными метаболическими процессами клетки, а также экзогенными химиотерапевтическими средствами и облучением. Хорошо известно, что многие типы противораковых терапевтических средств, таких как средства алкилирования ДНК, лекарственные средства на основе платины, ингибиторы топоизомеразы и лучевая терапия, сопутствуют повреждениям ДНК. Применение данных терапевтических средств омрачено возникновением устойчивости к лекарственным средствам, в частности в пути репарации ДНК, управляемом PARP-1. Недавние исследования подтвердили, что селективные ингибиторы PARP-1 значительно усиливают противоопухолевые эффективности TMZ и цисплатина.
BRCA1 и BRCA2 играют существенную роль в гомологической рекомбинации (HR). Разрывы ДНК, возникающие в ходе репликации ДНК, могут быть репарированы только посредством HR. В 2005 г. Bryant и Farmer (Nature, 2005, 913 и 917) независимо обнаружили, что клеточные линии, дефицитные по ВАСА1 и ВАСА2, были очень чувствительными к ингибиторам PARP-1, что приводило к гибели клеток. Гены рака молочной железы BRCA1/2 долгое время характеризовали как гены-супрессоры опухолевого роста, которые играют неотъемлемую роль в репарации двунитевых разрывов ДНК. Носители мутации BRCA1/2 при раке яичника и раке предстательной железы также подвержены повышенному риску. Следовательно, ингибиторы PARP-1 также могут быть применены в качестве отдельной терапии для таких типов опухолей, которые уже лишены определенных типов механизма репарации ДНК.
PARP-1 была активно преследуемой целью в онкологии на протяжении 30 лет и Ferraris полностью резюмировал прогресс в данной области (J. Med. Chem. 2010, 4561). Ряд соединений независимо проходят клинические испытания в качестве единственного средства или синергически действующего лекарственного средства, как, например, велипариб (АВТ-888), нирапариб (MK-4827), BMN-673, СЕР-977, BGP-15, Е-7016, МР-124 и IND-1022. В последнее время определенные гетероциклические соединения также были раскрыты как пригодные для лечения различных видов рака в некоторых патентных документах, например, в WO 2014009872 (A1), WO 2014019468 (A1), WO 2014023390 (А2), WO 2013182580, WO 2013164061 (A1), ЕР2656843 (А1).
Кроме того, ингибирование PARP-1 представляло собой активно преследуемую цель поиска новых лекарственных средств для широких спектров терапевтических областей, охватывающих инсульт, ишемию сердца, воспаление и диабет (Pharmacol. Rev. 2002, 54, 375.).
Несмотря на то, что все время предпринимались усилия для разработки ингибиторов PARP-1 для лечения рака и других заболеваний, удовлетворительное лечение все еще не было достигнуто. Таким образом, существует потребность в разработке новых ингибиторов PARP-1.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение соединений, представленных формулой (I), или их фармацевтически приемлемых солей,
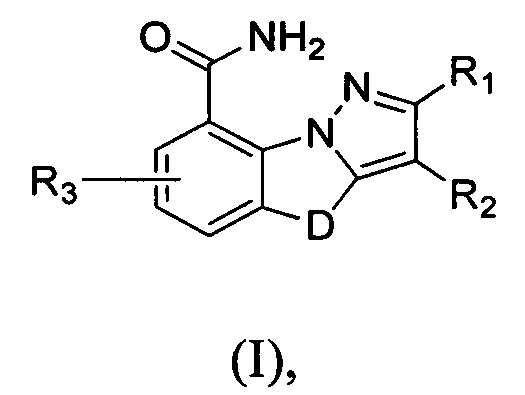
где
D выбран из группы, включающей -C(Rd1)(Rd2)-, -C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -O-, -S-, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O)- или -S(=O)2-;
R1-3, Rd1 и Rd2 отдельно и независимо выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH и NH2, или выбраны из группы, включающей необязательно замещенные R01 С1-10алкил, С1-10гетероалкил, С3-10ииклогидрокарбил, С3-10гетероциклогидрокарбил, С1-10алкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом, и С1-10гетероалкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом.
R01 выбран из группы, включающей F, Cl, Br, I, CN, ОН, SH, NH2 и R02;
R02 выбран из группы, включающей С1-10алкил, С1-10алкиламино, N,N-ди(С1-10алкил)амино, С1-10алкилоксил, С1-10алкилацил, С1-10алкилоксилкарбонил, С1-10алкилсульфонил, С1-10алкилсульфинил, С3-10циклоалкил, С3-10циклоалкиламино, С3-10гетероциклоалкиламино, С3-10циклоалкилоксил, С3-10циклоалкилацил, С3-10диклоалкилоксилкарбонил, С3-10циклоалкилсульфонил и С3-10циклоалкилсульфинил;
гетероатом или гетероатомная группа отдельно и независимо выбраны из группы, включающей -C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -O-, -S-, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O)- и -S(=O)2-;
Rd3-d7 отдельно и независимо выбраны из группы, включающей Н и R03;
R03 выбран из группы, включающей С1-10алкил, С1-10алкилацил, С1-10алкилоксилкарбонил, С1-10алкилсульфонил, С1-10алкилсульфинил, С3-10циклоалкил, С3-10циклоалкилацил, С3-10циклоалкилоксилкарбонил, С3-10циклоалкилсульфонил и С3-10диклоалкилсульфинил;
R02 и R03 необязательно замещены R001;
R001 выбран из группы, включающей F, Cl, Br, I, CN, ОН, N(CH3)2, NH(CH3), NH2, CF3, (NH2)CH2, (HO)CH2, CH3, CH3O, HC(=O), CH3OC(=O), CH3S(=O)2 и CH3S(=O); и
количество R01, R001 гетероатомов или гетероатомных групп отдельно и независимо выбрано из 0, 1, 2 или 3.
В одном варианте осуществления настоящего изобретения D выбран из -NH-, -N(CH3)-, -C(F)2-, -C(H)(F)- и -С(Н)(ОН)-.
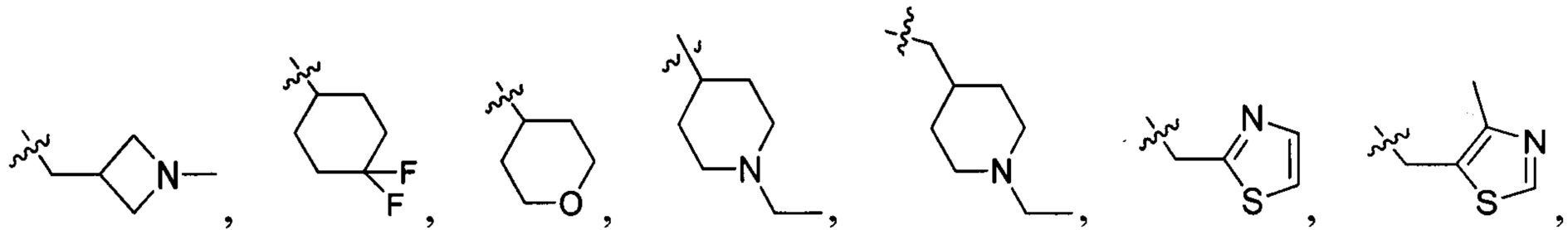
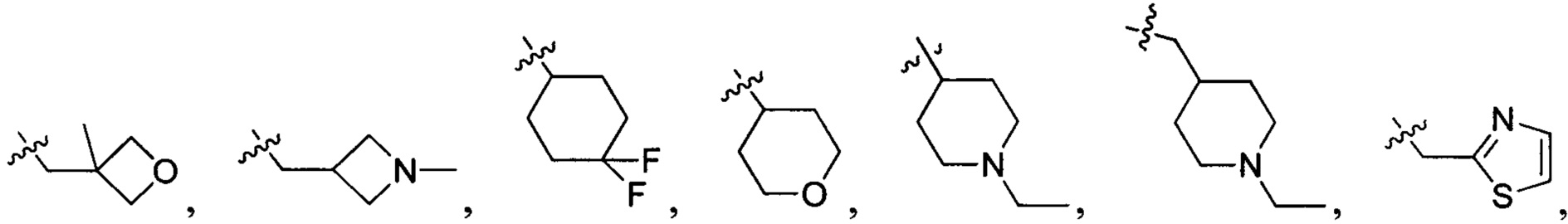
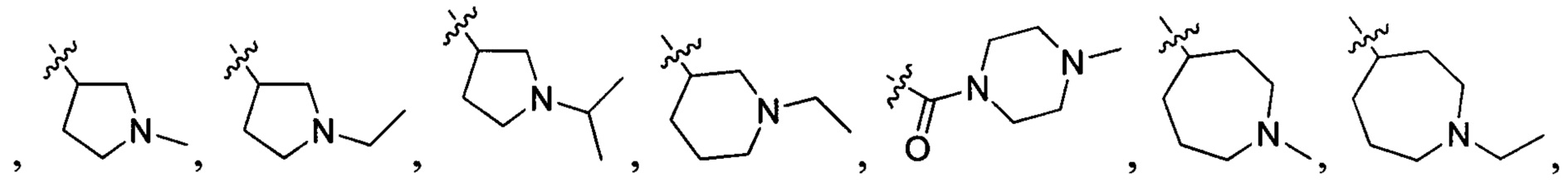
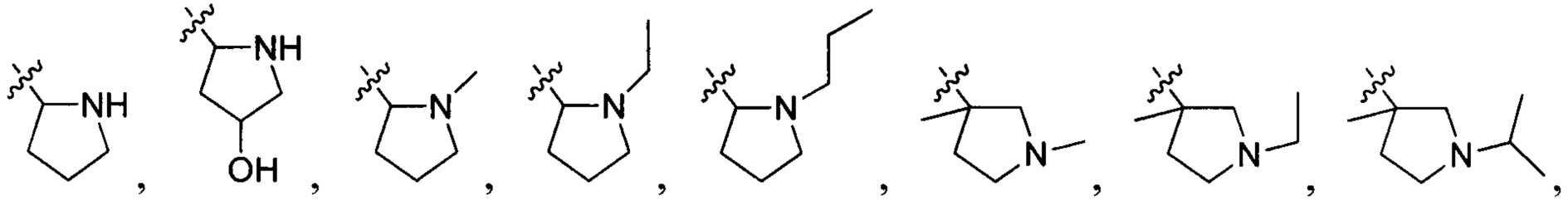
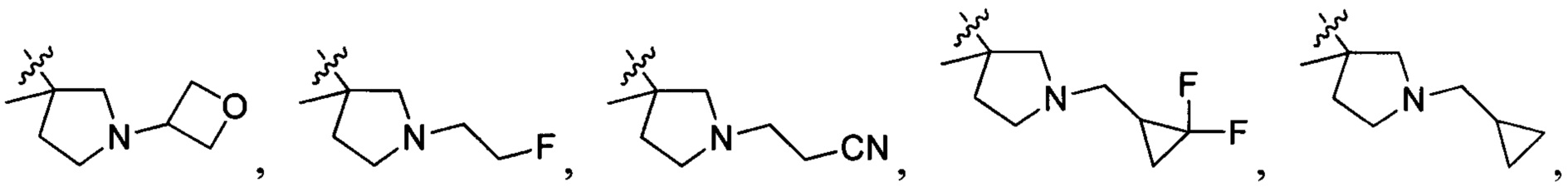
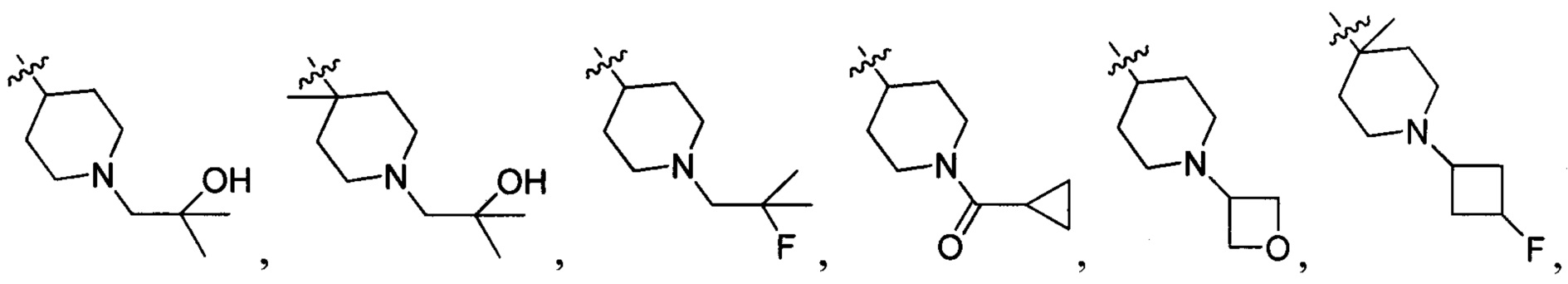
В одном варианте осуществления настоящего изобретения R1-3 отдельно и независимо выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, С1-6алкил, С1-6алкилоксил, бензилоксил, -CH2N(R21)(R22), 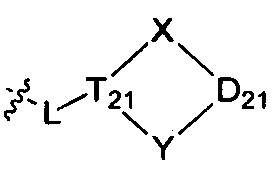 ,
,  и
и 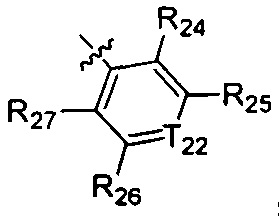 , при этом
, при этом
L и D21 отдельно и независимо выбраны из группы, включающей -C(Rd1)(Rd2)-, -C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -O-, -S-, -C(=O)-, -C(=O)O-, -C(=S)-, -S(=O)- или -S(=O)2-;
L также может представлять собой одинарную связь исключительно с целью связывания;
T21-22 отдельно и независимо выбраны из группы, включающей C(Rt) и N;
X выбран из (СН2)n, необязательно замещенного R01, а n выбран из 0, 1, 2 или 3, и предпочтительно из 0, 1 или 2;
Y выбран из (СН2)m, необязательно замещенного R01, a m выбран из 0, 1, 2 или 3, и предпочтительно из 1, 2 или 3;
R21-23 и Rd3-d7 отдельно и независимо выбраны из группы, включающей Н и R03;
R24-27, Rd1, Rd2 и Rt отдельно и независимо выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, и NH2, или выбраны из группы, включающей необязательно замещенные R01 С1-10алкил, С1-10гетероалкил, С3-10циклогидрокарбил, С3-10гетероциклогидрокарбил, С1-10алкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом, и С1-10гетероалкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом;
R01 выбран из группы, включающей F, Cl, Br, I, CN, ОН, SH, NH2 и R02;
R02 выбран из группы, включающей С1-10алкил, С1-10алкиламино, N,N-ди(C1-10алкил)амино, С1-10алкилоксил, С1-10алкилацил, С1-10алкилоксилкарбонил, C1-10алкилсульфонил, С1-10алкилсульфинил, С3-10циклоалкил, С3-10циклоалкиламино, С3-10гетероциклоалкиламино, С3-10циклоалкилоксил, С3-10циклоалкилацил, С3-10циклоалкилоксилкарбонил, С3-10циклоалкилсульфонил и С3-10циклоалкилсульфинил; гетероатом или гетероатомная группа отдельно и независимо выбраны из группы, включающей -C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -О-, -S-, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O)- и/или -S(=O)2-;
Rd3-d7 отдельно и независимо выбраны из группы, включающей Н и R03;
R03 выбран из группы, включающей С1-10алкил, С1-10алкилацил, С1-10алкилоксилкарбонил, С1-10алкилсульфонил, С1-10алкилсульфинил, С3-10циклоалкил, C3-10циклоалкилацил, С3-10циклоалкилоксилкарбонил, С3-10циклоалкилсульфонил и С3-10циклоалкилсульфинил;
R02 и R03 необязательно замещены R001
R001 выбран из группы, включающей F, Cl, Br, I, CN, ОН, N(CH3)2, NH(CH3), NH2, CF3, (NH2)CH2, (HO)CH2, CH3, CH3O, HC(=O), CH3OC(=O), CH3S(=O)2 и CH3S(=O); и
количество R01, R001, гетероатома или гетероатомной группы отдельно и независимо выбрано из 0, 1, 2 или 3.
В одном варианте осуществления настоящего изобретения R1 и R3 отдельно и независимо выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, С1-3алкил, C1-3алкилоксил, бензилоксил и 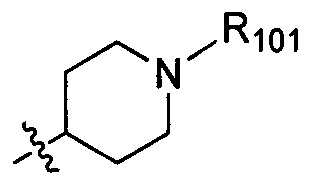 , в котором R101 выбран из группы, включающей Н, метил, этил, н-пропил или изопропил.
, в котором R101 выбран из группы, включающей Н, метил, этил, н-пропил или изопропил.
В одном варианте осуществления настоящего изобретения R1 выбран из группы, включающей Н, метил, метилоксил, бензилоксил, 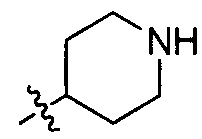 и
и 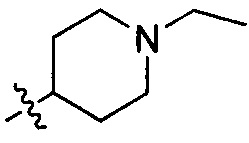 .
.
В одном варианте осуществления настоящего изобретения R3 выбран из группы, включающей Н, F, Cl, Br, CN и метил.
В одном варианте осуществления настоящего изобретения R2 выбран из -CH2N(R201)(R202), в котором R201 и R202 отдельно и независимо выбраны из группы, включающей Н, С1-3алкил, С1-3алкилацил, С3-6циклоалкилацил или С3-6циклоалкил.
В одном варианте осуществления настоящего изобретения R201 и R202 отдельно и независимо выбраны из группы, включающей Н или циклопропилацил.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей  и
и 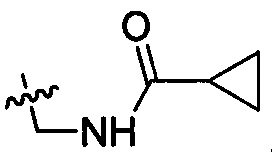 .
.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 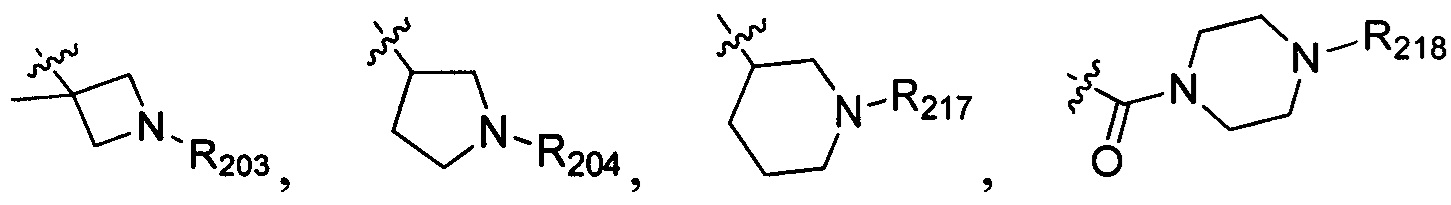 и
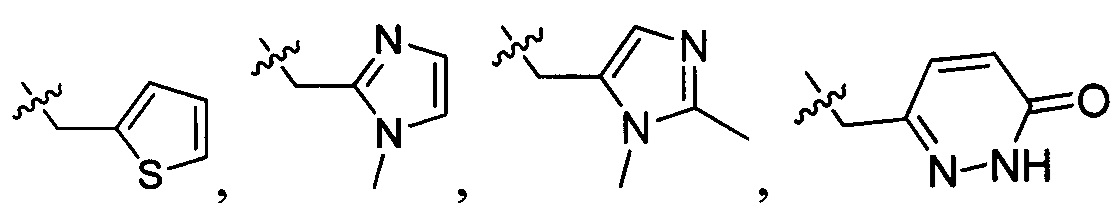
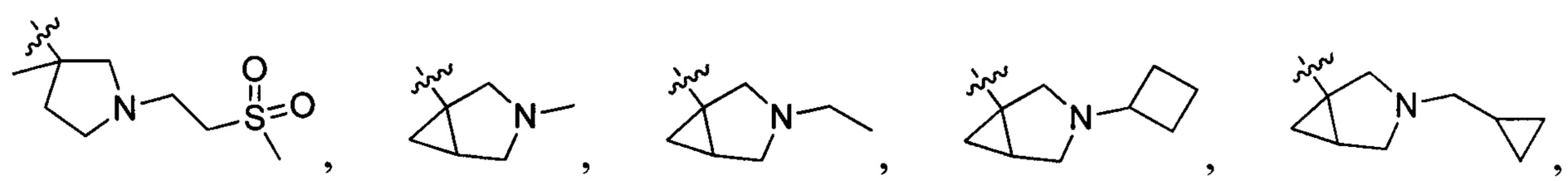
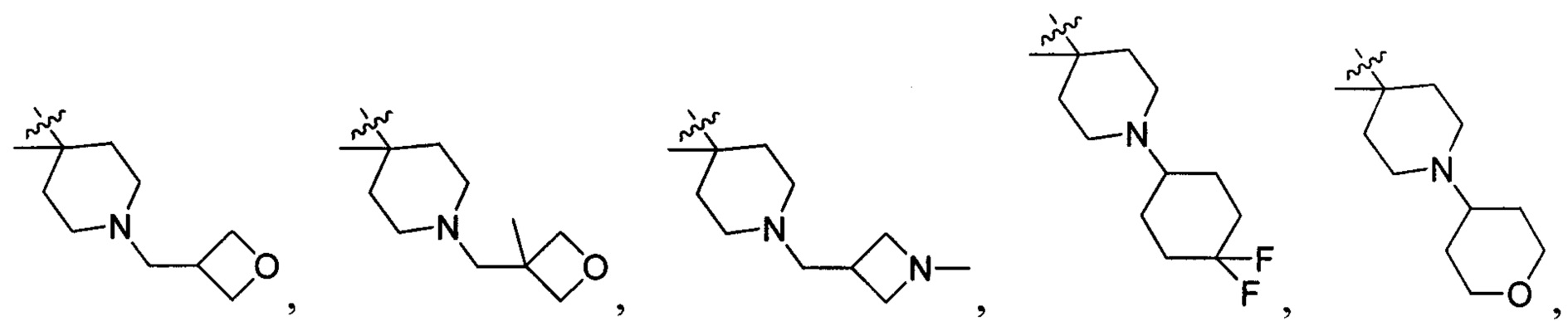
и 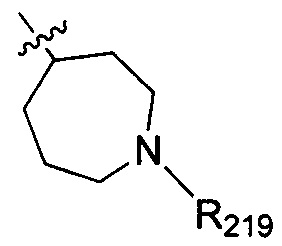 , в которых R203, R204, R217 и R218 отдельно и независимо выбраны из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил или циклопропилметилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил или метилоксил, а количество заместителей составляет 0, 1, 2 или 3.
, в которых R203, R204, R217 и R218 отдельно и независимо выбраны из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил или циклопропилметилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил или метилоксил, а количество заместителей составляет 0, 1, 2 или 3.
В одном варианте осуществления настоящего изобретения R203 выбран из группы, включающей метил, этил, н-пропил, изопропил, -СН2С(СН3)(СН3)(ОН) и циклопропилалкилен.
В одном варианте осуществления настоящего изобретения R204 выбран из группы, включающей метил, этил, н-пропил и изопропил.
В одном варианте осуществления настоящего изобретения R217-219 отдельно и независимо выбраны из группы, включающей метил и этил.
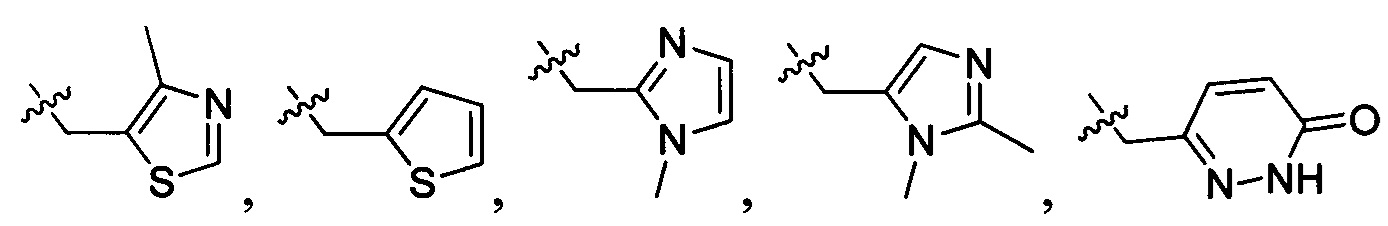
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 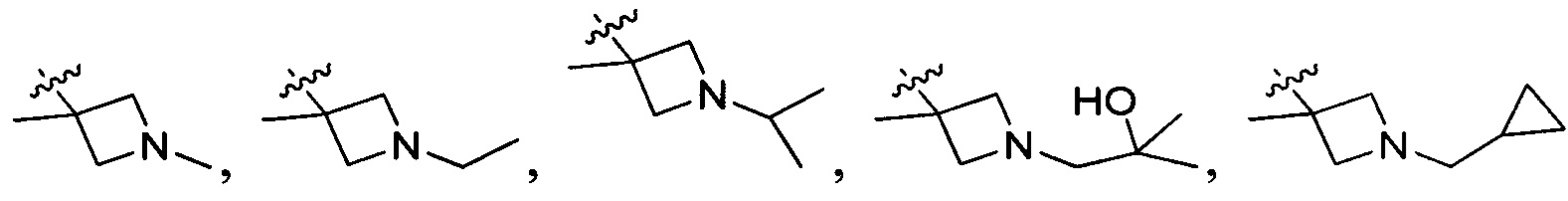
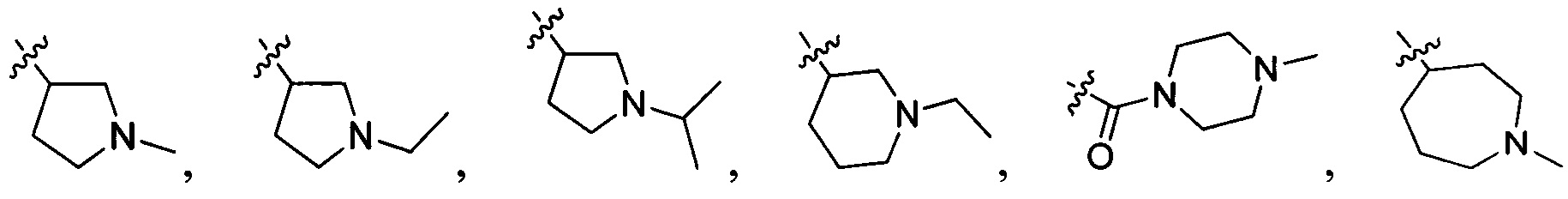 и
и 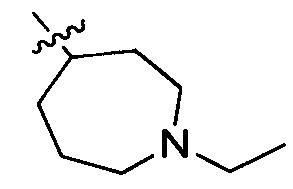 .
.
В одном варианте осуществления настоящего изобретения R2 выбран из 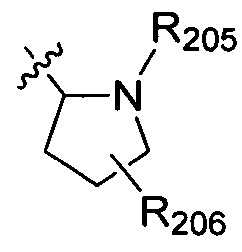 , в котором R205 и R206 отдельно и независимо выбраны из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил или циклопропилметилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил или метилоксил, а количество заместителей составляет 0, 1, 2 или 3.
, в котором R205 и R206 отдельно и независимо выбраны из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил или циклопропилметилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил или метилоксил, а количество заместителей составляет 0, 1, 2 или 3.
В одном варианте осуществления настоящего изобретения R205 и R206 отдельно, независимо и предпочтительно выбраны из группы, включающей Н, метил, этил, н-пропил и изопропил, и R206 также предпочтительно выбран из группы, включающей F, Cl, Br, I, CN, ОН и NH2.
В одном варианте осуществления настоящего изобретения R2 выбран из 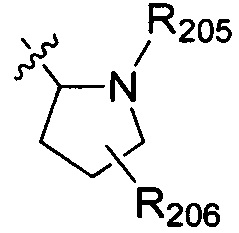 .
.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 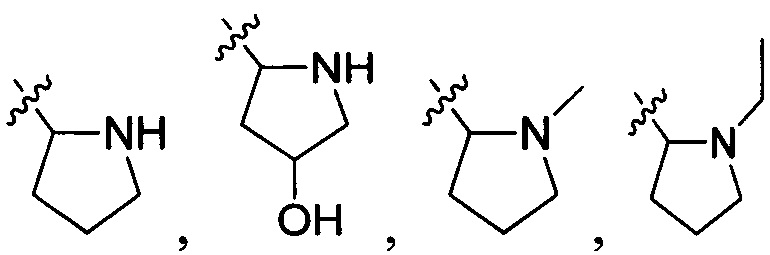 и
и 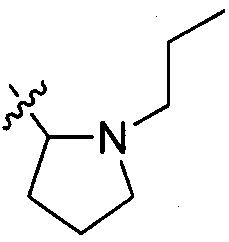 .
.
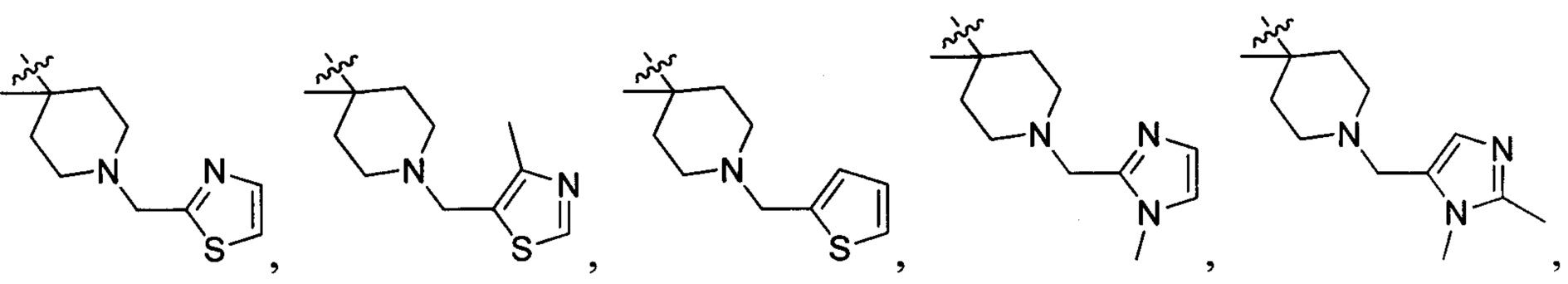
В одном варианте осуществления настоящего изобретения R2 выбран из 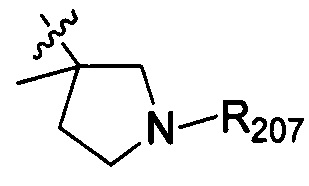 , в котором R207 выбран из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил, циклопропилметилен, циклобутил, циклобутилметилен, оксациклобутил или оксациклобутилалкилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил, CF3, метилоксил и метилсульфонил, а количество заместителей составляет 0, 1, 2 или 3.
, в котором R207 выбран из группы, включающей Н, замещенный или незамещенный С1-3алкил, циклопропил, циклопропилметилен, циклобутил, циклобутилметилен, оксациклобутил или оксациклобутилалкилен, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил, CF3, метилоксил и метилсульфонил, а количество заместителей составляет 0, 1, 2 или 3.
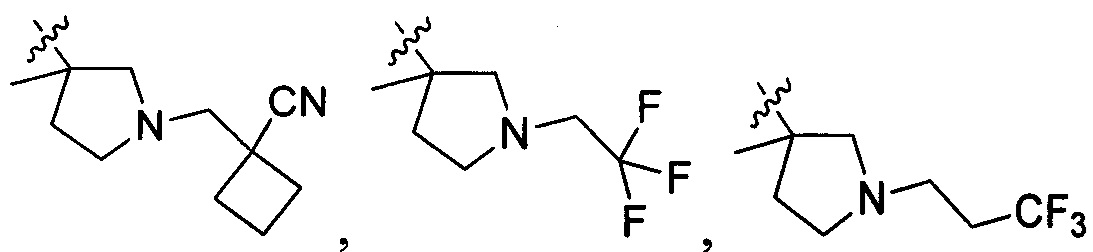
В одном варианте осуществления настоящего изобретения R207 выбран из группы, включающей Н, метил, этил, н-пропил, изопропил, -CH2CF3, -CH2CH2CF3, -CH2CH2F, -CH2CH2S(=O)2CH3, -CH2CH2CN,  ,
,  и
и 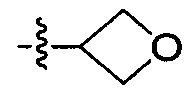 .
.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 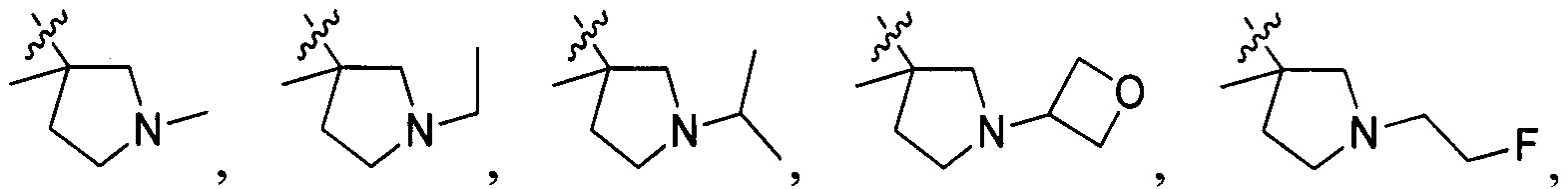
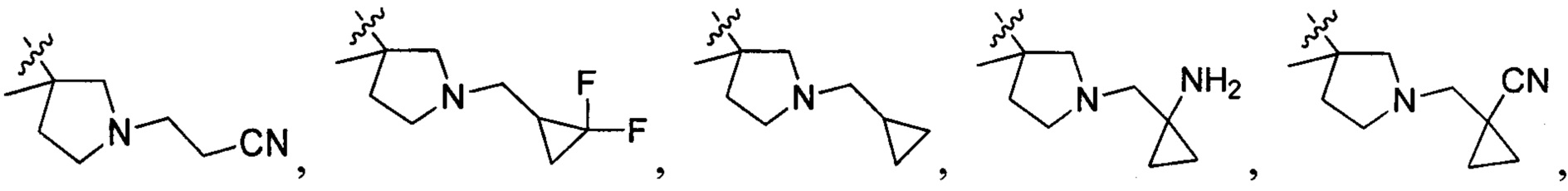
 и
и  .
.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 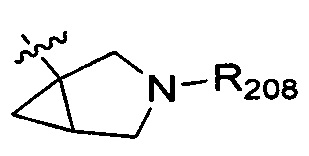 или
или 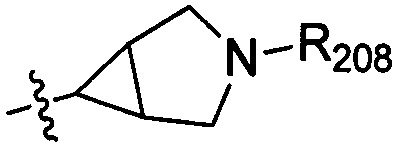 , в которых R208 выбран из группы, включающей Н, замещенный или незамещенный С1-4алкил, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил, CF3, метилоксил и метилсульфонил, а количество заместителей составляет 0, 1, 2 или 3.
, в которых R208 выбран из группы, включающей Н, замещенный или незамещенный С1-4алкил, где заместитель выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил, CF3, метилоксил и метилсульфонил, а количество заместителей составляет 0, 1, 2 или 3.
В одном варианте осуществления настоящего изобретения R208 выбран из группы, включающей Н, метил, этил, н-пропил, изопропил, циклопропилметилен и циклобутил.
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 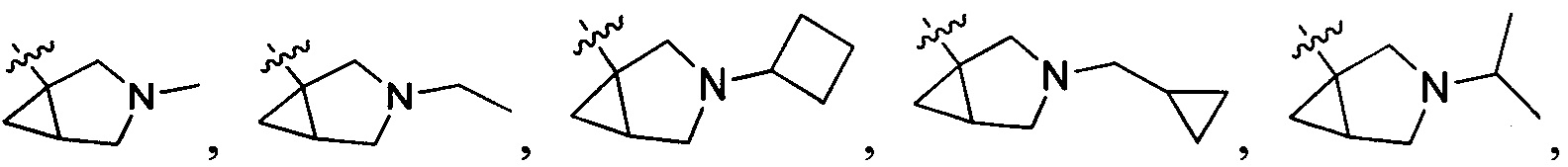
 и
и 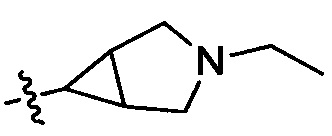 .
.
В одном варианте осуществления настоящего изобретения R2 выбран из 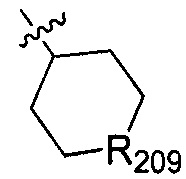 , в котором R209 выбран из группы, включающей -C(Rd1)(Rd2)-, C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -O-, -S-, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O)- или -S(=O)2-, где Rd1-d7 представляют собой таковые, определенные в п. 1.
, в котором R209 выбран из группы, включающей -C(Rd1)(Rd2)-, C(=O)N(Rd3)-, -N(Rd4)-, -C(=NRd5)-, -S(=O)2N(Rd6)-, -S(=O)N(Rd7)-, -O-, -S-, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O)- или -S(=O)2-, где Rd1-d7 представляют собой таковые, определенные в п. 1.
В одном варианте осуществления настоящего изобретения R209 выбран из группы, включающей О и S(=O)2.
В одном варианте осуществления настоящего изобретения R2 выбран из 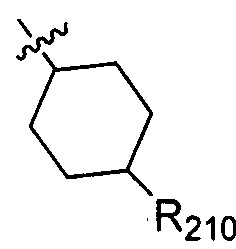 , в котором R210 выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, N,N-ди(С1-3алкил)амино и С1-3алкиламино.
, в котором R210 выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, N,N-ди(С1-3алкил)амино и С1-3алкиламино.
В одном варианте осуществления настоящего изобретения R210 выбран из группы, включающей диметиламино, метиламино, Н, F, Cl, Br, I, CN, ОН и NH2.
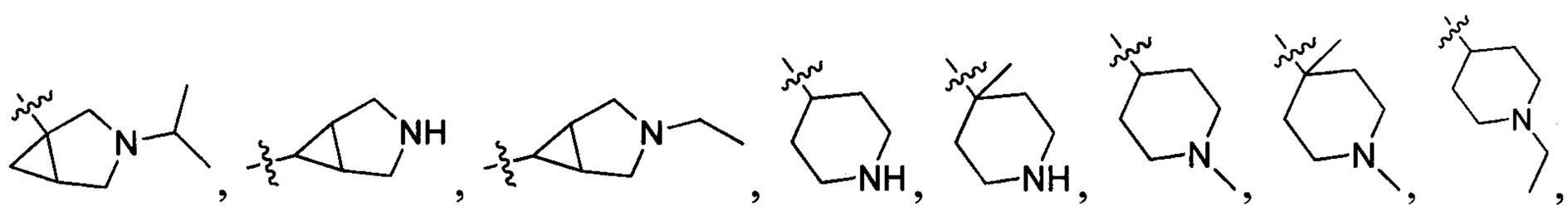
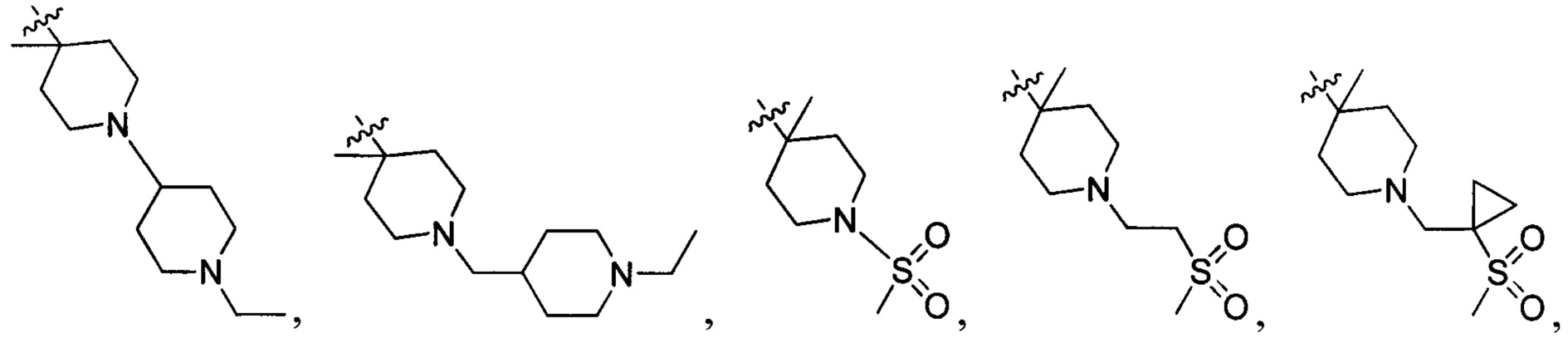
В одном варианте осуществления настоящего изобретения R2 выбран из 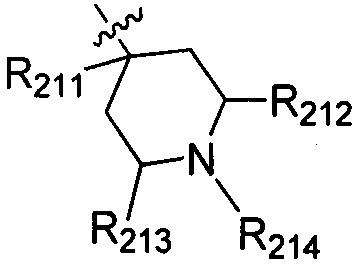 , в котором R211-214 выбраны из группы, включающей Н или замещенный или незамещенный С1-4алкилоксилкарбонил, С1-4алкил, 3-6-членный циклоалкил, 3-6-членный циклоалкилметилен или ненасыщенный 5-6-членный гетероциклогидрокарбил, где заместитель включает R215, и R211-213 также выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН и NH2, при этом циклоалкил или ненасыщенный гетероциклогидрокарбил содержит О, S или NR216 в количестве 0, 1 или 2, где
, в котором R211-214 выбраны из группы, включающей Н или замещенный или незамещенный С1-4алкилоксилкарбонил, С1-4алкил, 3-6-членный циклоалкил, 3-6-членный циклоалкилметилен или ненасыщенный 5-6-членный гетероциклогидрокарбил, где заместитель включает R215, и R211-213 также выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН и NH2, при этом циклоалкил или ненасыщенный гетероциклогидрокарбил содержит О, S или NR216 в количестве 0, 1 или 2, где
R216 выбран из группы, включающей Н и С1-4алкил, замещенный R215,
R215 выбран из группы, включающей F, Cl, Br, I, CN, ОН, NH2, метил, этил, метилоксил, этилоксил, формил, ацетил, метилсульфонил, этилсульфонил, метилоксилкарбонил, этилоксилкарбонил, диметиламино, диэтиламино, диметиламинокарбонил, диэтиламинокарбонил, оксо,
количество R215 составляет 1, 1, 2 или 3,
необязательно R212 и R213 можно соединять вместе с образованием линкера, выбранного из группы, включающей -СН2-, -СН2СН2- или -СН2СН2СН2-;
В одном варианте осуществления настоящего изобретения
R211 выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН, NH2, метил, этил, гидроксилметил и метилоксилкарбонил,
R212 выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН, NH2 и метил,
R213 выбран из группы, включающей Н, F, Cl, Br, I, CN, ОН и NH2,
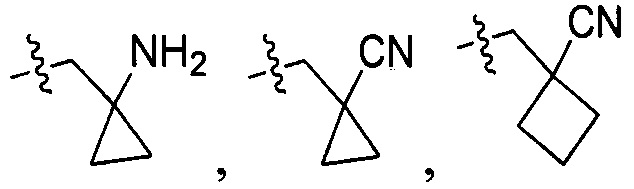
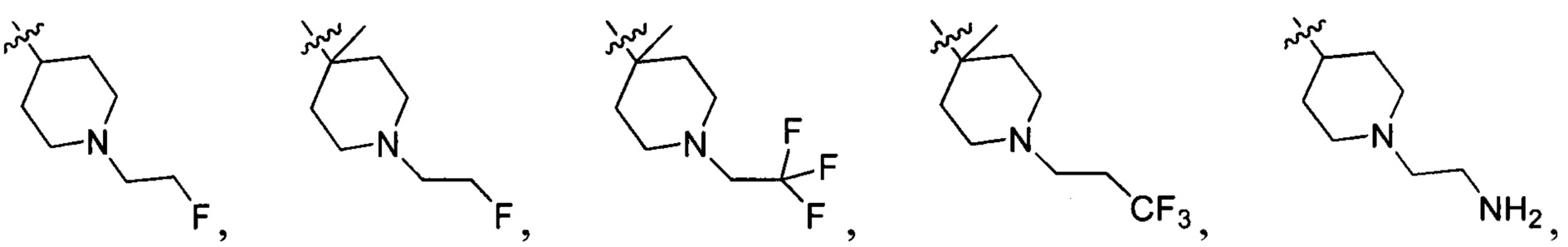
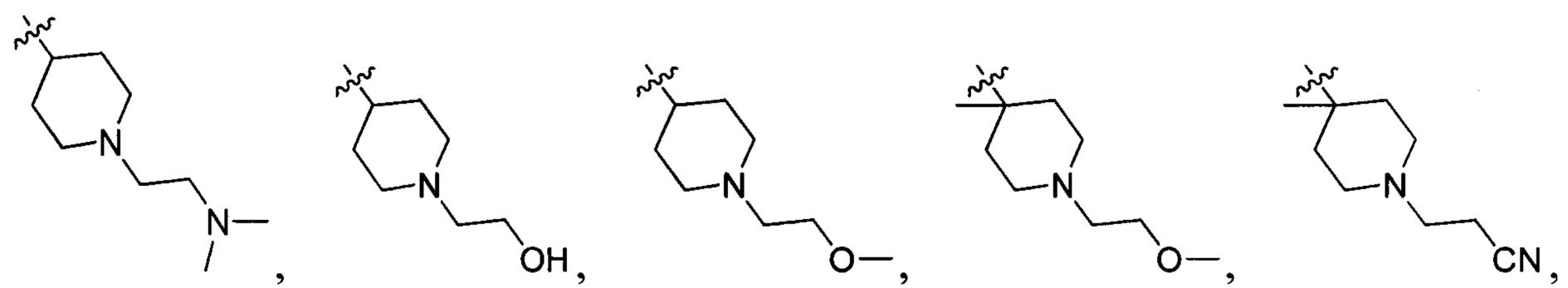
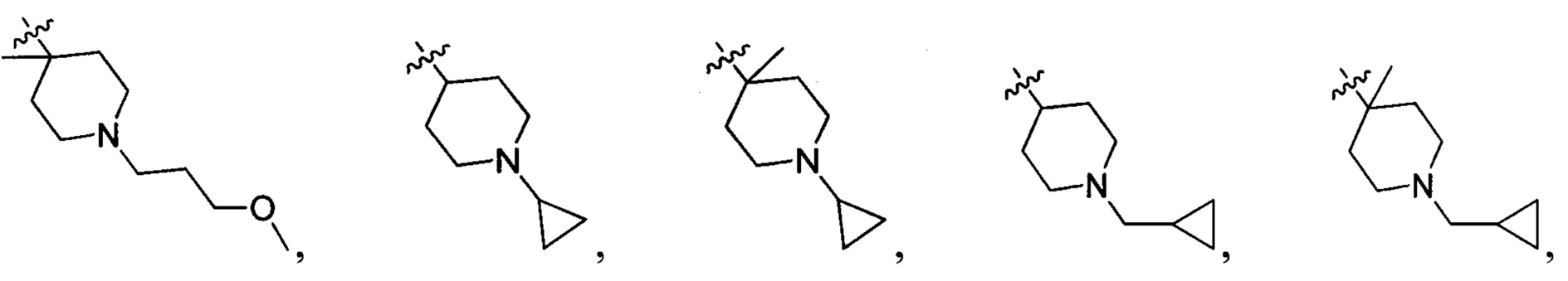
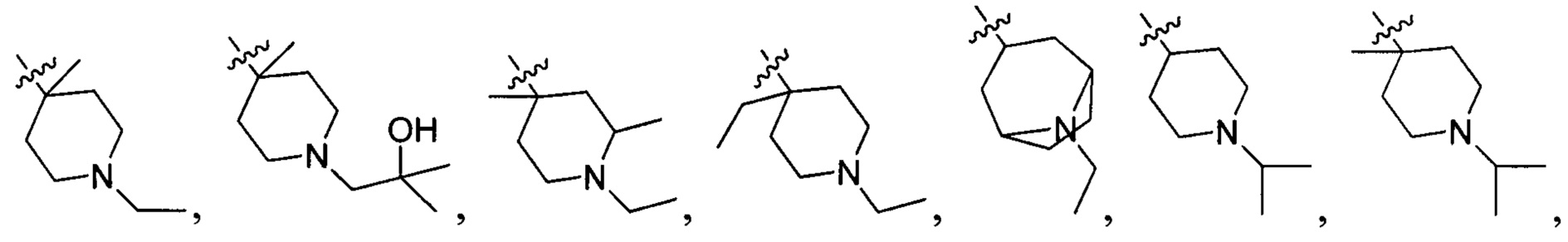
R214 выбран из группы, включающей Н, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-Бутил, -СН2С(ОН)(СН3)2, -CH2C(F)(CH3)2, -CH2CH2F, -CH2CF3, -CH2CH2CF3, -CH2CH2NH2, -CH2CH2OH, -CH2CH2CN, -CH2CH2OCH3, -CH2CH2CH2OCH3, -CH2CH2N(CH3)2, -S(=O)2CH3, -CH2CH2S(=O)2CH3, 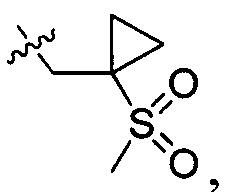 циклопропил, циклопропилметилен,
циклопропил, циклопропилметилен, 
 и
и  ;
;
В одном варианте осуществления настоящего изобретения R2 выбран из группы, включающей 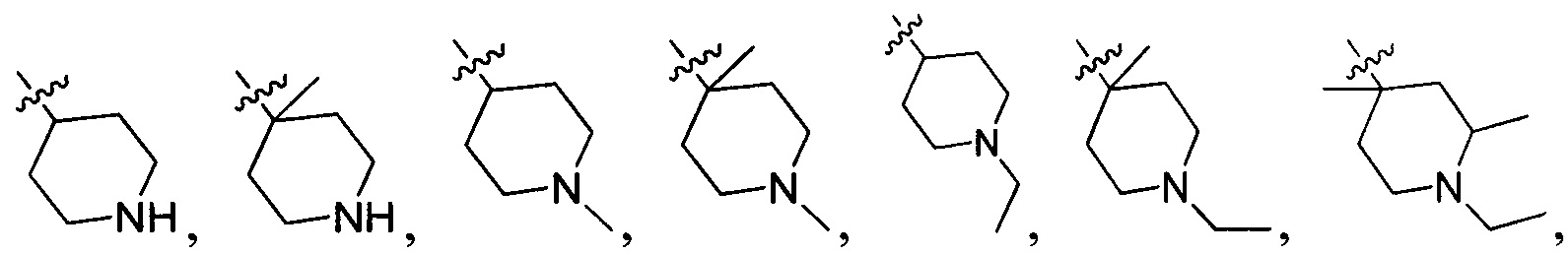
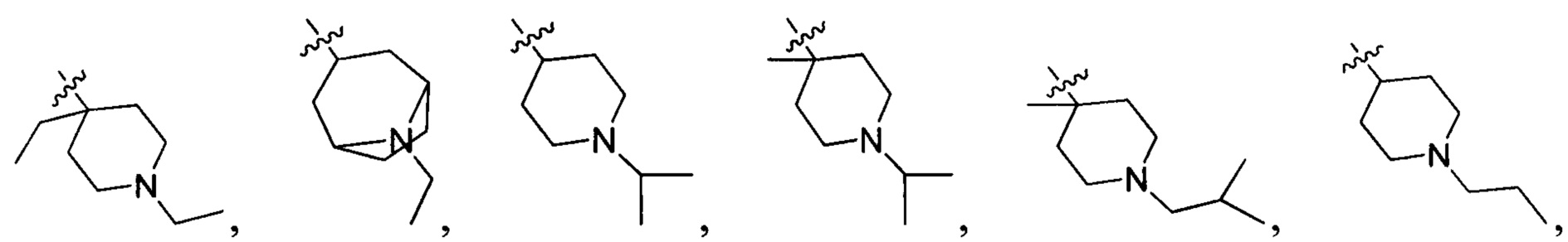
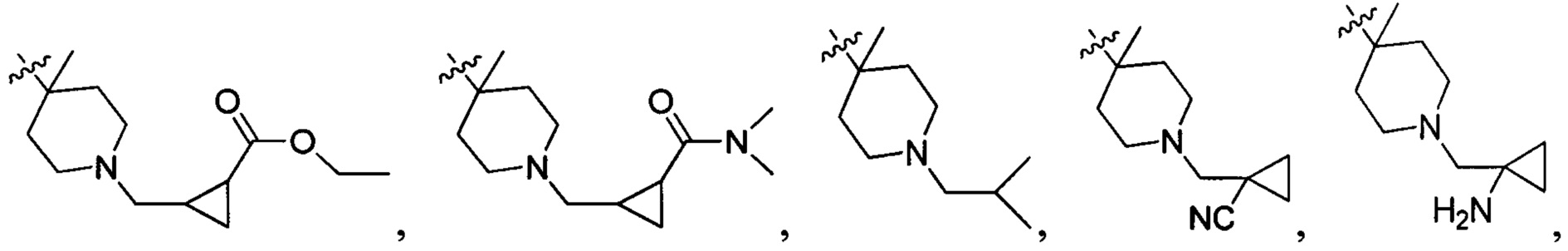
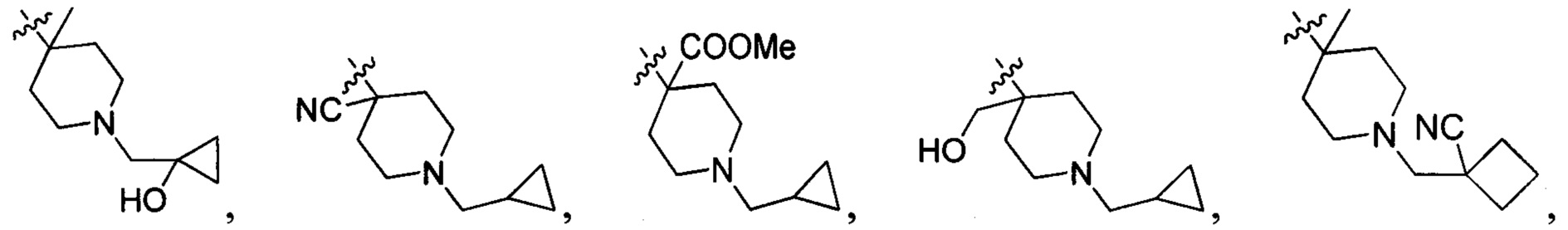
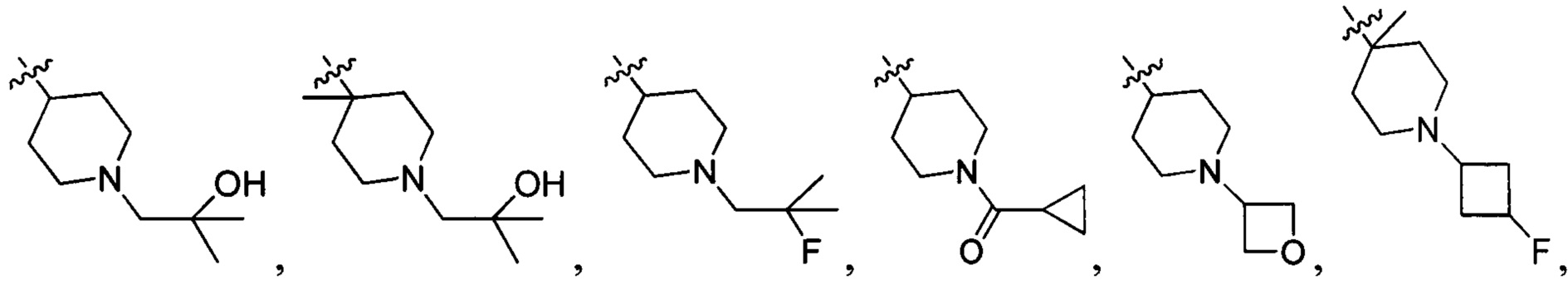
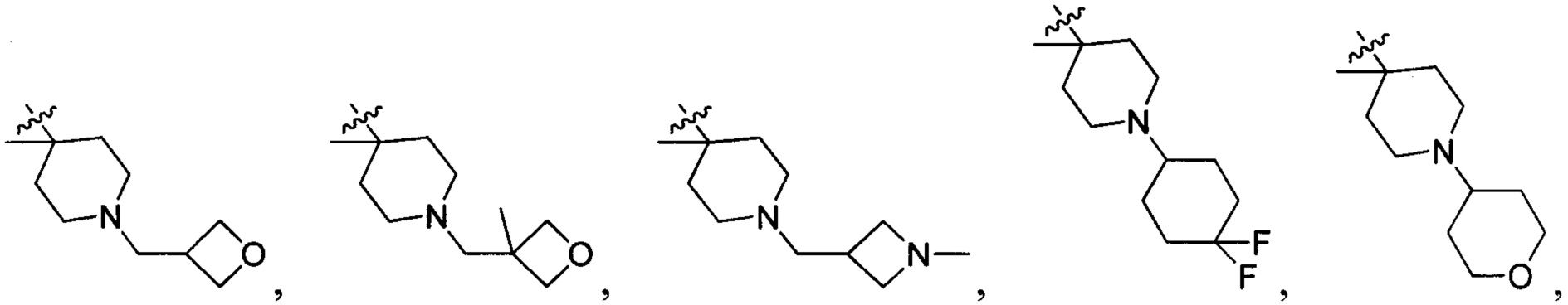
 и
и 
В одном варианте осуществления настоящего изобретения R2 выбран из 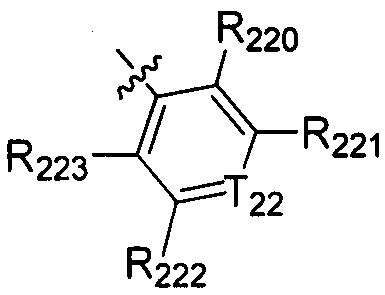 , в котором Т22 выбран из группы, включающей N или C(R224), а R220-224 отдельно и независимо выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, С1-3алкиламино-С1-3алкил и
, в котором Т22 выбран из группы, включающей N или C(R224), а R220-224 отдельно и независимо выбраны из группы, включающей Н, F, Cl, Br, I, CN, ОН, SH, NH2, С1-3алкиламино-С1-3алкил и  .
.
В одном варианте осуществления настоящего изобретения С1-3алкиламино-С1-3алкил выбран из метиламинометилена.
В одном варианте осуществления настоящего изобретения
R2 выбран из группы, включающей 
 и
и 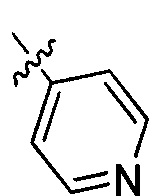 .
.
В одном варианте осуществления настоящего изобретения соединения или их фармацевтически приемлемые соли выбраны из
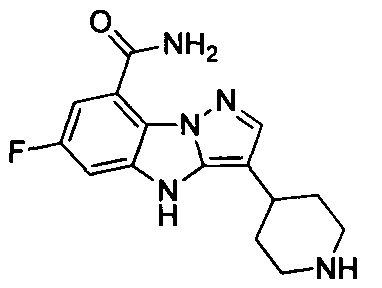
1) 6-фтор-3-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
2) 3-(1-этилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
3) 6-фтор-3-(1-(2-фторэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
4) 3-(1-циклопропилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
5) 3-(1-(циклопропилметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
6) 6-фтор-3-(1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
7) 6-фтор-3-(1-(2-фтор-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
8) 3-(1-(циклопропилкарбонил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
9) 6-фтор-3-(1-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
10) 6-фтор-3-(1-изопропилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
11) 6-фтор-3-(1-(оксетан-3-ил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
12) 6-фтор-3-(1-пропилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
13) 3-(1-(2-аминоэтил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
14) 3-(1-(2-(диметиламино)этил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
15) 6-фтор-3-(1-(2-метоксиэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
16) 6-фтор-3-(1-(2-гидроксиэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
17) 3-(1-этилпиперидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
18) 3-(1-этилазепан-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
19) 6-фтор-3-(1-метилазепан-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
20) 6-фтор-3-(1-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
21) 3-(1-этилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
22) 6-фтор-3-(1-изопропилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
23) 6-фтор-3-(пирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
24) 6-фтор-3-(1-пропилпирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида; 6-фтор-3-(1-метилпирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
25) 3-(1-этилпирролидин-2-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
26) 3-(1-этилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
27) 6-фтор-3-(3-метил-3-азабицикло[3.1.0]гексан-1-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
28) 3-(3-этил-3-азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
29) 3-(3-циклобутил-3-азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
30) 3-(3-(циклопропилметил)-3-азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
31) 6-фтор-3-(3-изопропил-3-азабицикло[3.1.0]гексан-1-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
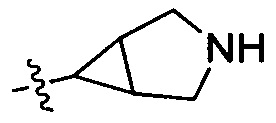
32) 3-(3-азабицикло[3.1.0]гексан-6-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
33) 3-(3-этил-3-азабицикло[3.1.0]гексан-6-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
34) 3-(8-этил-8-азабицикло[3.2.1]октан-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
35) 6-фтор-3-(4-гидроксипирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
36) 3-циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
37) 3-циано-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
38) 3-(аминометил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
39) 3-(циклопропанкарбоксамидометилен)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
40) 6-фтор-3-(4-фторфенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
41) 6-фтор-3-(2-фтор-4-((метиламино)метилен)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
42) 6-фтор-3-(4-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
43) 6-фтор-3-(2-фтор-5-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
44) 6-фтор-3-(пиридин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
45) 6-фтор-3-(4-(пиперидин-3-ил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
46) 6-фтор-3-(тетрагидро-2Н-пиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
47) 3-(4-(диметиламино)циклогексил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
48) 6-фтор-3-(4-метилпиперазин-1-карбонил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
49) 3-(1-(циклопропилметил)пиперидин-4-ил)-4,4,6-трифтор-4Н-пиразоло[1,5-a]индол-8-карбоксамида;
50) 3-(1-этилпиперидин-4-ил)-6-фтор-4-гидрокси-4Н-пиразоло[1,5-a]индол-8-карбоксамида;
51) 3-(1-этилпиперидин-4-ил)-6-фтор-4-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
52) 6-фтор-3-(4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
53) 3-(1-этил-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
54) 3-(1-циклопропил-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
55) 6-фтор-3-(1-(2-гидрокси-2-метилпропил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
56) 3-(1-(циклопропилметилен)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
57) 3-(1-(4,4-дифторциклогексил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
58) 6-фтор-3-(4-метил-1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
59) 6-фтор-3-(1-(2-фторэтил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
60) 6-фтор-3-(4-метил-1-(2,2,2-трифторэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
61) 6-фтор-3-(4-метил-1-(3,3,3-трифторпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
62) 3-(1-((1-цианоциклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
63) 3-(1-((1-цианоциклобутил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
64) 6-фтор-3-(4-метил-1-(2-(метилсульфонил)этил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
65) 6-фтор-3-(4-метил-1-((тетрагидро-2Н-пиран-4-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
66) 3-(1-((1-аминоциклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
67) 6-фтор-3-(4-метил-1-(оксетан-3-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
68) 6-фтор-3-(1-(2-метоксиэтил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
69) 6-фтор-3-(1-((1-гидроксициклопропил)метил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
70) 6-фтор-3-(4-метил-1-((3-метилоксетан-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
71) 6-фтор-3-(1-(3-метоксипропил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
72) 6-фтор-3-(4-метил-1-((1-(метилсульфонил)циклопропил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
73) 6-фтор-3-(4-метил-1-(тиазол-2-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
74) 6-фтор-3-(4-метил-1-(метилсульфонил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
75) 6-фтор-3-(1-(3-фторциклобутил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
76) 6-фтор-3-(4-метил-1-(тиофен-2-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
77) 3-(1-((1-этилпиперидин-4-ил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
78) 6-фтор-3-(4-метил-1-((1-метилазетидин-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
79) этил-2-((4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-ил)метил)циклопропанкарбоксилата;
80) 3-(1-((2-(диметилкарбамоил)циклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
81) 6-фтор-3-(1-изобутил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
82) 6-фтор-3-(4-метил-1-((4-метилтиазол-5-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
83) 6-фтор-3-(4-метил-1-((1-метил-1Н-имидазол-2-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
84) 3-(1-((1,2-диметил-1Н-имидазол-5-ил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
85) 3-(1'-этил-4-метил-[1,4'-бипиперидин]-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
86) 6-фтор-3-(4-метил-1-((6-оксо-1,6-дигидропиридазин-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
87) 3-(1-(2-цианоэтил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
88) 6-хлор-3-(1-этил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
89) 3-(1-этил-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
90) 3-(1,3-Диметилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
91) 6-фтор-3-(1-изопропил-3-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
92) 3-(1-(циклопропилметил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
93) 6-фтор-3-(3-метил-1-(оксетан-3-ил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
94) 6-фтор-3-(1-(2-фторэтил)-3-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
95) 3-(1-((2,2-дифторциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
96) 6-фтор-3-(3-метил-1-(2,2,2-трифторэтил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
97) 6-фтор-3-(3-метил-1-(2-(метилсульфонил)этил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
98) 6-фтор-3-(3-метил-1-(3,3,3-трифторпропил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
99) 3-(1-((1-аминоциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
100) 3-(1-((1-цианоциклобутил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
101) 3-(1-((1-цианоциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
102) 3-(1-(2-цианоэтил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
103) 3-(1-(циклопропилметил)-3-метилазетидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
104) 6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
105) 6-фтор-3-(4-метил-1,1-диоксидо-2Н-тиопиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
106) 3-(1,4-диэтилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
107) 3-(4-циано-1-(циклопропилметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
108) 3-(1-(циклопропилметил)-4-(гидроксиметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
109) метил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-1-(циклопропилметил)пиперидин-4-карбоксилата;
110) 3-(1-(циклопропилметил)-4-метилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
111) 3-(1-этил-4-метилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
112) 6-фтор-3-(1-изобутил-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
113) 6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
114) 3-(1,4-диметилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
115) 6-фтор-3-(1-(2-гидрокси-2-метилпропил)-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
116) 3-(1-этил-2,4-диметилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
117) 3-(1-этил-3-метилпирролидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
118) 6-фтор-3-(1-изопропил-3-метилпирролидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
119) 3-(1-(циклопропилметил)-3-метилпирролидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
120) 3-(1,3-диметилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
121) 3-(1-этил-3-метилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
122) 6-фтор-3-(1-изопропил-3-метилазетидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
123) 3-(1-(циклопропилметил)-3-метилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
124) 6-фтор-3-(1-(2-гидрокси-2-метилпропил)-3-метилазетидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
125) 6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
126) 2-(бензилокси)-6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
127) 6-фтор-2-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида;
128) 2-(1-этилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамида.
ОПРЕДЕЛЕНИЯ
С1-10 выбран из группы, включающей С1, С2, С3, С4, С5, С6, С7, C8, С9 и С10; С3-10 выбран из группы, включающей С3, С4, С5, С6, С7, С8, С9 и С10.
С1-10алкил, С1-10гетероалкил, С3-10циклогидрокарбил, С3-10гетероциклогидрокарбил, С1-10алкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом, или С1-10гетероалкил, замещенный С3-10циклогидрокарбилом или С3-10гетероциклогидрокарбилом, включают без ограничения
С1-10алкил, С1-10алкиламино, N,N-ди(С1-10алкил)амино, С1-10алкилоксил, С1-10алкилацил, С1-10алкилоксилкарбонил, С1-10алкилсульфонил, С1-10алкилсульфинил, С3-10циклоалкил, C3-10циклоалкиламино, С3-10гетероциклоалкиламино, C3-10циклоалкилоксил, C3-10циклоалкилацил, С3-10циклоалкилоксилкарбонил, С3-10циклоалкилсульфонил и С3-10циклоалкилсульфинил;
метил, этил, н-пропил, изопропил, -СН2С(СН3)(СН3)(ОН), циклопропил, циклобутил, пропилметилен, циклопропилацил, бензилоксил, трифторметил, аминометил, гидроксилметил, метилоксил, формил, метилоксилкарбонил, метилсульфонил, метилсульфинил, этилоксил, ацетил, этилсульфонил, этилоксилкарбонил, диметиламино, диэтиламино, диметиламинокарбонил и диэтиламинокарбонил;
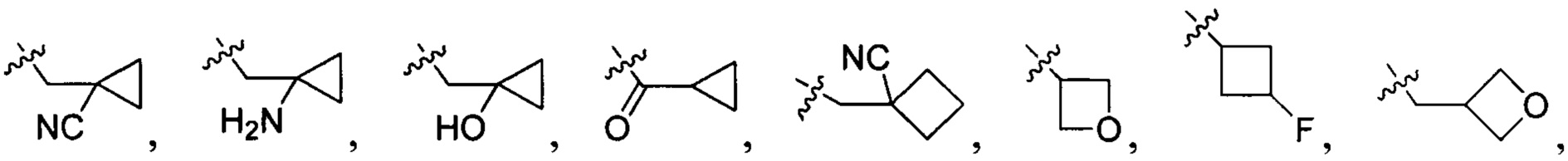
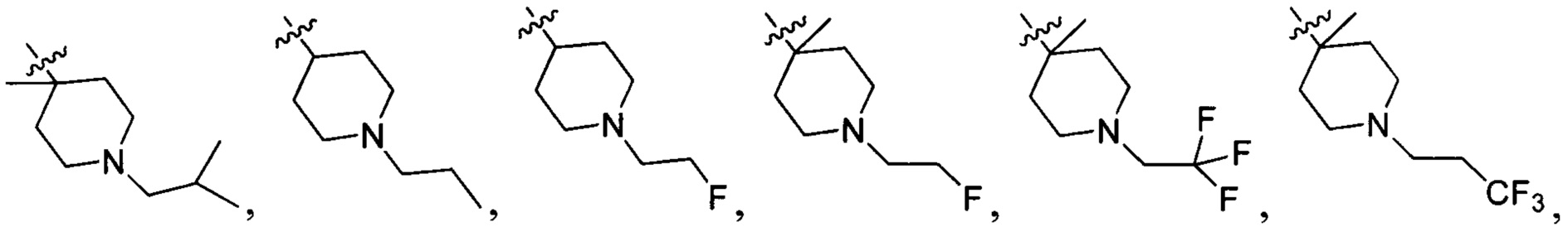
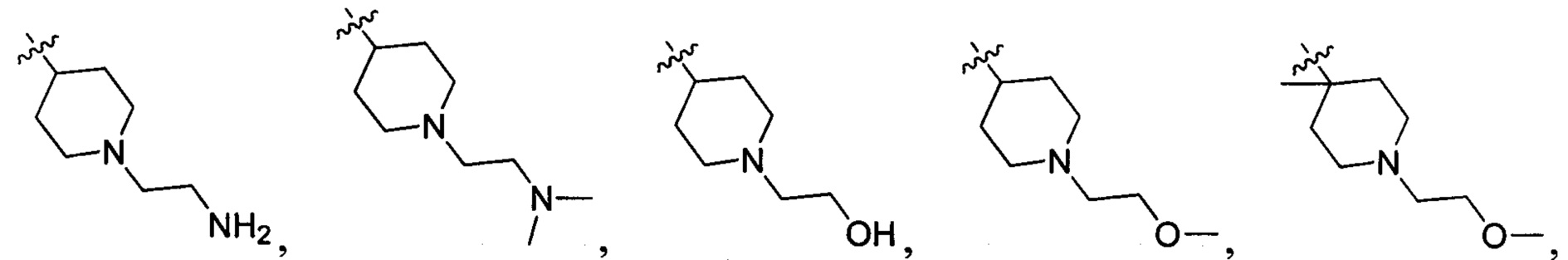
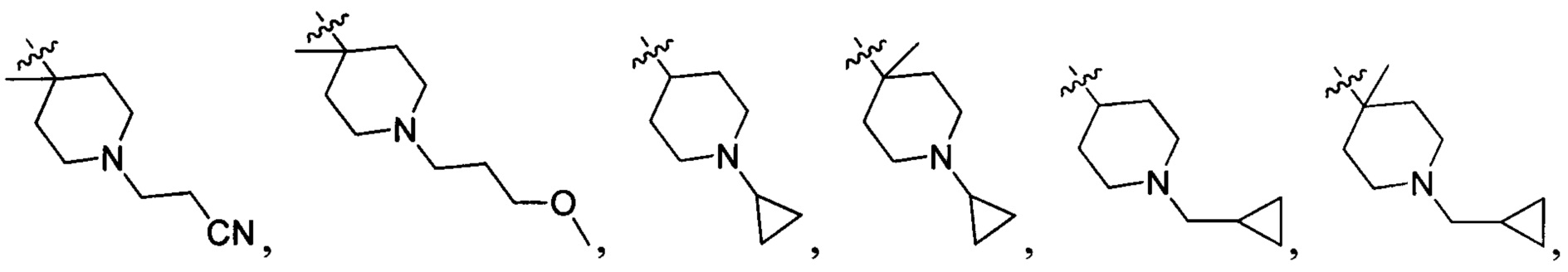
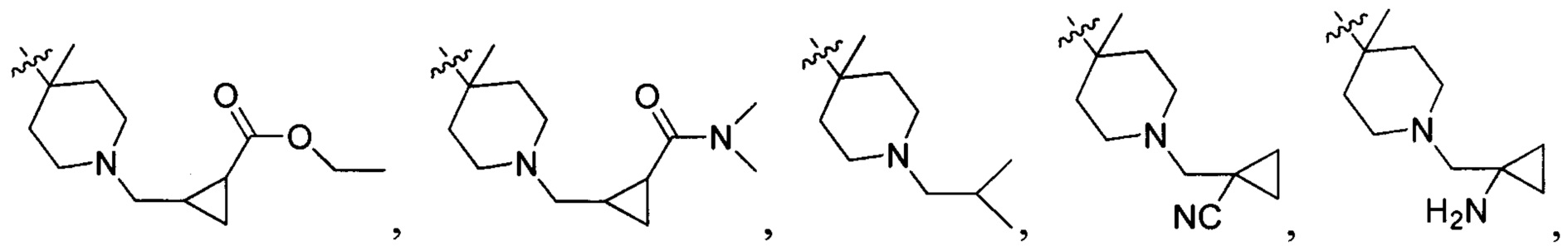
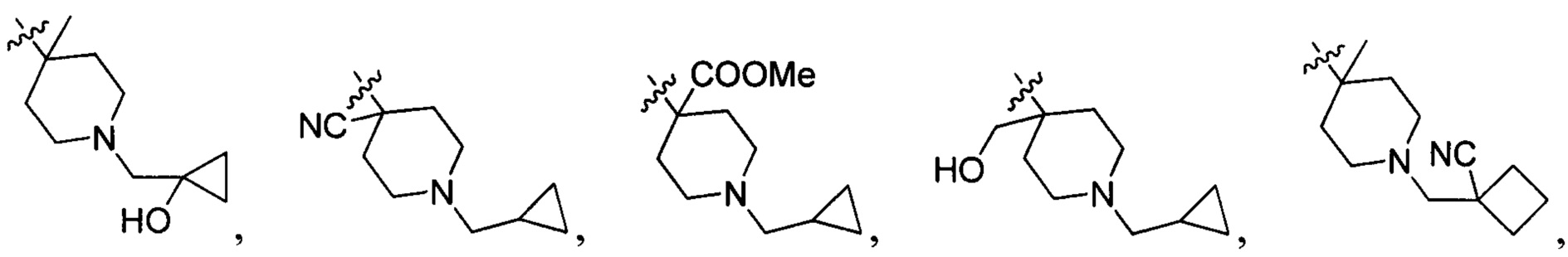
N(CH3)2, NH(CH3), -CH2CF3, -CH2CH2CF3, -CH2CH2F, -CH2CH2S(=O)2CH3, CH2CH2CN, 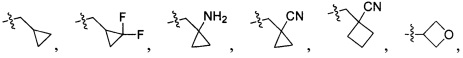 - CH2CH(OH)(CH3)2, -CH2CH(F)(CH3)2, -CH2CH2F, -CH2CF3, -CH2CH2CF3, -CH2CH2NH2, -CH2CH2OH, -CH2CH2OCH3, -CH2CH2CH2OCH3, -CH2CH2N(CH3)2, -S(=O)2CH3, CH2CH2S(=O)2CH3,
- CH2CH(OH)(CH3)2, -CH2CH(F)(CH3)2, -CH2CH2F, -CH2CF3, -CH2CH2CF3, -CH2CH2NH2, -CH2CH2OH, -CH2CH2OCH3, -CH2CH2CH2OCH3, -CH2CH2N(CH3)2, -S(=O)2CH3, CH2CH2S(=O)2CH3, 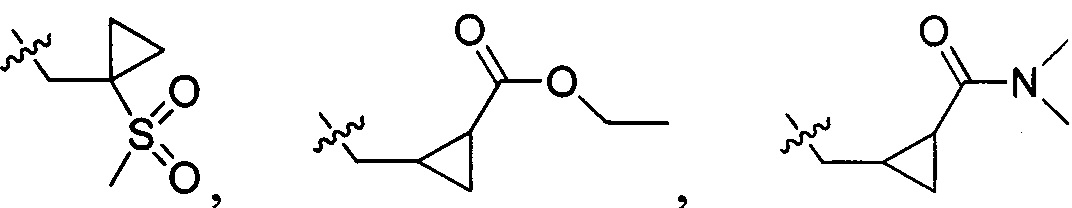 ,
, 
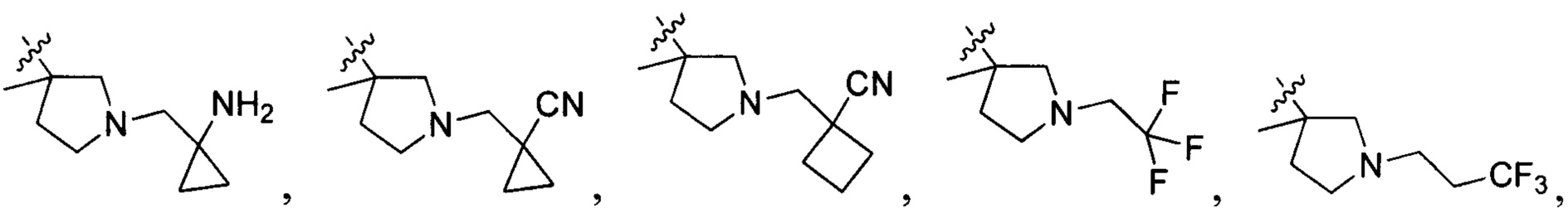
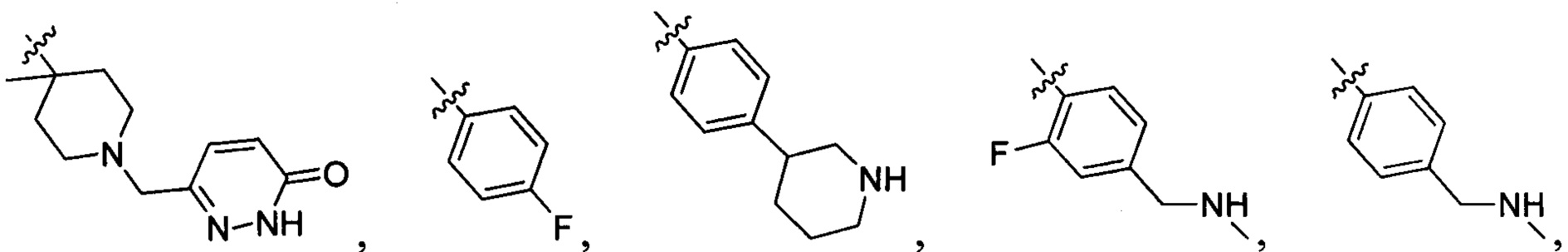
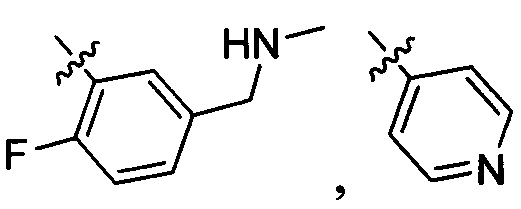 и
и
фенил, тиазолил, бифенил, нафтил, циклопентил, фурил, 3-пиррол инил, пирролидинил, 1,3-оксоланил, пиразолил, 2-пиразолинил, пиразолидинил, имидазолил, оксазолил, тиазолил, 1,2,3-оксадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,3,4-тиадиазолил, 4Н-пиранил, пиридил, пиперидинил, 1,4-диоксанил, морфолинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, 1,3,5-тритианил, 1,3,5-триазинил, бензофуранил, бензотиенил, индолил, бензимидазолил, бензотиазолил, пуринил, хинолинил, изохинолинил, циннолинил или хиноксалинил.
Термин ʺфармацевтически приемлемыйʺ используют в данном документе для обозначения таких соединений, материалов, композиций и/или лекарственных форм, которые, в рамках здравого медицинского суждения, подходят для применения по отношению к тканям людей и животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений в соответствии с обоснованным отношением польза/риск.
Термин ʺфармацевтически приемлемая сольʺ предназначен для включения соли соединения по настоящему изобретению, которую получают с помощью относительно нетоксичных кислоты или основания и соединения по настоящему изобретению, имеющего конкретные заместители. Если соединение по настоящему изобретению содержит относительно кислотную функциональную группу, то соль присоединения основания может быть получена посредством обеспечения контакта нейтральной формы таких соединений с достаточным количеством необходимого основания либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения основания включают соли натрия, калия, кальция, аммония, органического амина или магния или подобные соли. Если соединение по настоящему изобретению содержит относительно основную функциональную группу, то соль присоединения кислоты может быть получена посредством обеспечения контакта нейтральной формы таких соединений с достаточным количеством необходимой кислоты либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли неорганических кислот, в том числе хлористоводородной, бромистоводородной, азотной, угольной, углеводородной, фосфорной, гидрофосфорной, дигидрофосфорной, серной, сероводородной, йодистоводородной или фосфористой кислот и т.п.; а также соли органических кислот, в том числе уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, пробковой, фумаровой, молочной, миндальной, фталевой, бензолсульфоновой, п-толилсульфоновой, лимонной, винной, метансульфоновой кислоты или т.п.; а также соли аминокислот (таких как аргинат и т.п.) и соли органических кислот, таких как глюкуроновая кислота и т.п. (см. Berge et al., ʺPharmaceutical Saltsʺ, Journal of Pharmaceutical Science 66: 1-19 (1977)). Определенные конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, которые обеспечивают превращение соединений либо в соли присоединения основания, либо соли присоединения кислот.
Нейтральную форму данного соединения предпочтительно регенерируют посредством обеспечения контакта соли с основанием или кислотой с последующим выделением исходного соединения обычным способом. Исходная форма соединения отличается от различных форм его солей определенными физическими свойствами, такими как растворимость в полярных растворителях.
В контексте данного документа ʺфармацевтически приемлемые солиʺ относятся к производным соединений по настоящему изобретению, где исходное соединение модифицируют путем получения соли с кислотой или основанием. Примеры фармацевтически приемлемых солей включают без ограничения соли минеральной или органической кислоты с основными группами, такие как амины; щелочные или органические соли с кислотными группами, такие как карбоновые кислоты; и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Такие обычные нетоксичные соли включают без ограничения соли, полученные из неорганических и органических кислот, выбранных из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутамовой, гликолевой, бромистоводородной, хлористоводородной, йодистоводородной, гидроксильных кислот, гидроксинафтоевой, изетионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, надуксусной, янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной и толуолсульфоновой кислот.
Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основный или кислотный фрагмент, посредством обычных химических способов. Как правило, такие соли могут быть получены путем обеспечения реакции свободных форм кислоты или основания данных соединений со стехиометрическим количеством соответствующих основания или кислоты в воде, или в органическом растворителе, или в их смеси; как правило, неводная среда, такая как эфир, этилацетат, этанол, изопропанол, или ацетонитрил, или т.п. являются предпочтительными.
Помимо форм солей, в настоящем изобретении представлены соединения, которые находятся в форме пролекарства. Пролекарства соединений, описанные в данном документе, легко подвергаются химическим изменениям в физиологических условиях с обеспечением соединений по настоящему изобретению. Кроме того, пролекарства могут быть превращены в соединения по настоящему изобретению посредством химических или биохимических способов в окружающей среде in vivo.
Определенные соединения по настоящему изобретению могут существовать в несольватированных формах или сольватированных формах, в том числе в гидратированных формах. В общем, сольватированные формы подобны несольватированным формам и все они включены в объем настоящего изобретения. Определенные соединения по настоящему изобретению могут существовать в поликристаллической или аморфной формах.
Определенные соединения по настоящему изобретению могут содержать асимметричные атомы углерода (оптические центры) или двойные связи; при этом все рацематы, диастереомеры, геометрические изомеры и отдельные изомеры включены в объем настоящего изобретения.
Графические представления рацемических, амбискалемических и скалемических или энантиомерно чистых соединений, применяемые в данном документе, взяты из Maehr, J. Chem. Ed. 1985, 62: 114-120. Сплошные и прерывистые клинья применяют для обозначения абсолютной конфигурации стереоцентра, если не указано иное. Если соединения, описанные в данном документе, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иное, подразумевается, что соединения включают как Е, так и Z геометрические изомеры. Подобным образом, все таутомерные формы включены в объем настоящего изобретения.
Соединения по настоящему изобретению могут существовать в конкретной геометрической или стереоизомерной формах. Настоящее изобретение подразумевает все такие соединения, в том числе цис- и транс-изомеры, (-)- и (+)-энантиомеры, (R)- и (S)-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и другие их смеси, такие как энантиомерно или диастереомерно обогащенные смеси, и все данные смеси, которые включены в объем настоящего изобретения. Дополнительные асимметричные атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Все такие изомеры, а также их смеси, предназначены для включения в настоящее изобретение.
Оптически активные (R)- и (S)-изомеры и D- и L-изомеры могут быть получены посредством хиральных синтонов, или хиральных реагентов, или других обычных методик. Если необходим конкретный энантиомер соединения по настоящему изобретению, то он может быть получен посредством асимметричного синтеза или посредством получения производных с хиральным вспомогательным средством, где полученную в результате диастереомерную смесь разделяют, и вспомогательная группа отщепляется с получением чистых необходимых энантиомеров. В качестве альтернативы, если молекула содержит основную функциональную группу (такую как амино-группа) или кислотную функциональную группу (такую как карбоксильная группа), то диастереомерные соли могут быть образованы с соответствующей оптически активной кислотой или основанием, с последующим расщеплением диастереомеров посредством фракционной кристаллизации или хроматографических способов, известных в данной области, и последующего восстановления чистых энантиомеров. Кроме того, разделение энантиомеров и диастереомеров зачастую осуществляют посредством хроматографии с использованием хиральных, стационарных фаз, необязательно в комбинации с химическим получением производных (например, образованием карбаматов из аминов).
Соединения по настоящему изобретению также могут содержать несвойственные соотношения атомных изотопов на одном или более атомах, которые составляют такие соединения. Например, соединения могут быть меченными радиоактивными изотопами, такими как, например, тритий (3Н), йод-125 (125I) или углерод-14 (14С). Все изотопные вариации соединений по настоящему изобретению, несмотря на их радиоактивность, предназначены для включения в объем настоящего изобретения.
Термин ʺфармацевтически приемлемый носитель или наполнительʺ относится к любому составу или несущей среде, которые способны доставлять эффективное количество активного средства по настоящему изобретению без токсичных побочных эффектов относительно хозяина или пациента. Иллюстративные носители включают воду, масла, как растительные, так и минеральные, кремовые основы, лосьонные основы, мазевые основы и т.п. Данные основы включают суспендирующие средства, загустители, усилители проникновения и т.п. Их состав хорошо известен специалистам в области косметических средств и фармацевтических средств для наружного применения. Дополнительную информацию касательно носителей можно найти в Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott, Williams & Wilkins (2005), содержание которой включено в данный документ посредством ссылки.
Термин ʺвспомогательные средстваʺ обычно означает носители, разбавители и/или наполнители, необходимые для составления эффективных фармацевтических композиций.
Термины ʺэффективное количествоʺ или ʺтерапевтически эффективное количествоʺ в отношении лекарственного средства или фармакологически активного средства относятся к нетоксичному, но достаточному количеству лекарственного средства или фармакологически активного средства для обеспечения необходимого эффекта. В пероральных лекарственных формах по настоящему раскрытию ʺэффективное количествоʺ активного средства композиции относится к количеству активного средства, необходимому для обеспечения необходимого эффекта при применении в комбинации с другим активным средством композиции. Количество, которое является ʺэффективнымʺ, будет варьировать между субъектами в зависимости от возраста и общего состояния реципиента, а также конкретного активного средства, при этом соответствующее эффективное количество в отдельном случае может быть определено специалистом средней квалификации в данной области с помощью рутинного эксперимента.
Термины ʺактивный ингредиентʺ, ʺтерапевтическое средствоʺ, ʺактивное веществоʺ или ʺактивное средствоʺ означают химический объект, который может быть эффективным для лечения целевого нарушения, заболевания или состояния.
Термин ʺзамещенныйʺ означает, что любой один или более атомов водорода при указанном атоме замещен заместителем, в том числе дейтерием и вариантом водорода, при условии, что валентность указанного атома является нормальной и что замещенное соединение является стабильным. Если заместитель представляет собой кетонную группу (т.е. =O), то это означает, что 2 атома водорода являются замещенными. Кето-заместители не присутствуют при ароматических фрагментах. Термин ʺнеобязательно замещенныйʺ означает, что указанный атом может быть замещенным или не замещенным и, если не указано иное, виды и количество заместителей могут быть произвольными, при условии, что они могут быть получены в химии.
Если переменная (например, R) встречается более одного раза в составляющей или структуре соединения, то ее определение в каждом случае является независимым. Таким образом, например, если группа замещена 0-2 R, то указанная группа необязательно может быть замещена не более чем двумя группами R, при этом R в каждом случае имеет независимые варианты. Кроме того, комбинации заместителей и/или переменных являются допустимыми, только если такие комбинации обеспечивают стабильные соединения.
Если показано, что связь с заместителем пересекает связь, соединяющую два атома в кольце, то такой заместитель может быть связан с любым атомом в кольце. Если заместитель приведен без указания того, посредством какого атома такой заместитель связан с соединением общей формулы, в том числе с неуказанными соединениями, то такой заместитель может быть связан посредством любого атома в данном соединении. Комбинации заместителей и/или переменных являются допустимыми, только если такие комбинации обеспечивают стабильные соединения.
Заместители алкильных и гетероалкильных радикалов (в том числе тех групп, которые часто называют алкиленовыми, алкенильными, гетероалкиленовыми, гетероалкенильными, алкинильными, циклоалкильными, гетероциклоалкильными, циклоалкенильными и гетероциклоалкенильными) обычно называют ʺзаместителями алкильной группыʺ и один или более из них могут быть выбраны из следующих групп: -R', -OR', =O,=NR', =N-OR', -NR'Rʺ, -SR', -галоген, -SiR'RʺR''', OC(O)R', -C(O)R', -CO2R', -CONR'Rʺ, -OC(O)NR'Rʺ, -NRʺC(O)R', NR'C(O)NRʺRʺ', -NRʺC(O)2R', -NRʺ'ʺ-C(NR'RʺRʺ')=NRʺʺ, NRʺʺC(NR'Rʺ)=NR'ʺ, -S(O)R', -S(O)2R', -S(O)2NR'Rʺ, NRʺSO2R', -CN, -NO2, -N3, -CH(Ph)2 и фтор(С1-С4)алкил, при этом количество заместителей варьирует от ноля до (2m'+1), где m' представляет собой общее количество атомов углерода в таком радикале. Каждый из R', Rʺ, Rʺ', Rʺʺ и Rʺʺ' предпочтительно независимо представляет собой водород, замещенные или незамещенные гетероалкильные, замещенные или незамещенные арильные (например, арил, замещенный 1-3 галогенами), замещенные или незамещенные алкильные, алкокси или тиоалкокси-группы или арил алкильные группы. Если соединение по настоящему изобретению включает, например, более одной группы R, то каждая из групп R независимо выбрана также, как и каждая из групп R', Rʺ, Rʺ', Rʺʺ и Rʺ'ʺ, если присутствует более одной из этих групп. Если R' и Rʺ прикреплены к тому же атому азота, то они могут быть объединены с атомом азота с образованием 5-, 6-или 7-членного кольца. Например, подразумевается, что -NR'Rʺ включает без ограничения 1-пирролидинил и 4-морфолинил. Исходя из приведенного выше обсуждения заместителей, специалисту в данной области будет понятно, что термин ʺалкилʺ предназначен для включения групп, состоящих из атомов углерода, связанных с группами, отличными от групп водорода, такими как галогеналкил (например, -CF3 и -CH2CF3) и ацил (например, -С(O)СН3, -C(O)CF3, -С(O)СН2ОСН3 и т.п.).
Подобно заместителям, описанным для алкильного радикала, заместители арильных и гетероарильных групп в общем называют ʺзаместителями арильной группыʺ. Заместители выбраны, например, из следующих: -R', -OR', -NR'Rʺ, -SR', -галоген, -SiR'RʺRʺ', OC(O)R', -C(O)R', -CO2R', -CONR'Rʺ, -OC(O)NR'Rʺ, -NRʺC(O)R', NR'C(O)NRʺRʺ', -NRʺC(O)2R', -NRʺʺ'-C(NR'RʺRʺ')=NRʺʺ, NRʺʺC(NR'Rʺ)=NRʺ', -S(O)R', -S(O)2R', -S(O)2NR'Rʺ, NRʺSO2R', -CN, -NO2, -N3, -CH(Ph)2, фтор(С1-С4)алкокси и фтор(С1-С4)алкил и т.д., при этом количество заместителей варьирует от ноля до общего количества открытых валентностей в ароматическом кольце; где каждый из R', Rʺ, R'ʺ, Rʺʺ и R'ʺʺ предпочтительно независимо выбран из водорода, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. Если соединение по настоящему изобретению включает, например, более одной группы R, то каждая из групп R независимо выбрана также, как и каждая из групп R', Rʺ, R'ʺ, Rʺʺ и Rʺʺ' если присутствует более одной из этих групп.
Два заместителя при смежных атомах арильного или гетероарильного кольца необязательно могут быть замещены заместителем формулы -T-C(O)-(CRR')q-U-, где Т и U независимо выбраны из -NR-, -О-, -CRR'- или одинарной связи, a q равняется целому числу от 0 до 3. В качестве альтернативы, два заместителя при смежных атомах арильного или гетероарильного кольца необязательно могут быть замещены заместителем формулы -А(СН2)rB-, где А и В независимо выбраны из -CRR'-, -О-, -NR-, -S-, -S(O)-, S(O)2-, -S(O)2NR'- или одинарной связи, а r равняется целому числу от 1 до 4. Одна из одинарных связей образованного таким образом нового кольца необязательно может быть замещена двойной связью. В качестве альтернативы, два заместителя при смежных атомах арильного или гетероарильного кольца необязательно могут быть замещены заместителем формулы -А(СН2)rB-, где s и d отдельно и независимо выбраны из целых чисел от 0 до 3, а X представляет собой -О-, -NR'-, -S-, -S(O)-, -S(O)2- или -S(O)2NR'-. Заместители R, R', Rʺ и R'ʺ отдельно, предпочтительно и независимо выбраны из водорода и замещенного или незамещенного (С1-С6)алкила.
Термин ʺгидрокарбилʺ или его гипонимы (такие как алкил, алкенил, алкинил и фенил и т.д.) сам по себе или в качестве части другого заместителя означают, если не указано иное, прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинацию, которые могут быть полностью насыщенными, моно- или полиненасыщенными, и могут быть моно-, ди- или многозамещенными, и могут включать ди- или многовалентные радикалы, имеющие указанное количество атомов углерода (например, C1-С10, что означает от одного до десяти атомов углерода). ʺГидрокарбилʺ включает без ограничения алифатический гидрокарбил и ароматический гидрокарбил, при этом алифатический гидрокарбил включает линейные и циклические гидрокарбилы, в частности, включая без ограничения алкил, алкенил и алкинил, а ароматический гидрокарбил включает без ограничения 6-12-членный ароматический гидрокарбил, например, бензол, нафталин и т.д. В некоторых вариантах осуществления термин ʺалкилʺ означает радикал с прямой или разветвленной цепью или их комбинации, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать ди- и многовалентные радикалы. Примеры насыщенных углеводородных радикалов включают без ограничения метил, этил, н-пропил, изопропил, н-бутил, трет-Бутил, изобутил, втор-бутил, изобутил, циклогексил, (циклогексил)метил, циклопропилметил, гомологи и изомеры радикалов, такие как н-пентил, н-гексил, н-гептил, н-октил и т.п. Ненасыщенная алкильная группа представляет собой группу, имеющую одну или более двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают без ограничения винил, 2-пропенил, бутенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1-й 3-пропинил, 3-бутинил и высшие гомологи и изомеры.
Термин ʺгетерогидрокарбилʺ или его гипонимы (такие как гетероалкил, гетероалкенил, гетероалкинил, гетероарил и т.д.) сами по себе или в комбинации с другим термином означают, если не указано иное, стабильную прямую или разветвленную цепь, или циклический углеводородный радикал, или их комбинации, включающие указанное количество атомов углерода и по меньшей мере один гетероатом. В некоторых вариантах осуществления термин ʺгетероалкилʺ сам по себе или в комбинации с другим термином означает стабильный углеводородный радикал с прямой или разветвленной цепью или его комбинации, включающие указанное количество атомов углерода и по меньшей мере один гетероатом. В типичном варианте осуществления гетероатомы выбраны из группы, включающей В, О, N и S, где атомы азота и серы необязательно могут быть окислены и гетероатом азота необязательно может быть кватернизирован. Гетероатом(ы) В, О, N и S могут располагаться в любом внутреннем положении гетерогидрокарбильной груйпы (за исключением положения, в котором гидрокарбильная группа прикреплена к остатку молекулы). Примеры включают без ограничения -СН2-СН2-O-СН3, -СН2-СН2-NH-СН3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -СН2-СН2, -S(O)-CH3, -СН2-CH2-S(O)2-CH3, -СН=СН-O-СН3, -CH2-CH=N-OCH3 и -CH=CH-N(CH3)-CH3. Не более двух гетероатомов могут следовать друг за другом, как, например, -СН2-NH-OCH3.
Термины ʺалкоксиʺ, ʺалкиламиноʺ и ʺалкилтиоʺ (или тиоалкокси) применяются в их обычном значении и относятся к таким алкильным группам, которые прикреплены к остатку молекулы посредством атома кислорода, амино-группы или атома серы соответственно.
Термины ʺциклогидрокарбилʺ, ʺгетероциклогидрокарбилʺ или ʺциклогидрокарбилгетероилʺ или их гипонимы (такие как арил, гетероарил, арилгетероил, циклоалкил, гетероциклоалкил, циклоалкилгетероил, циклоалкенил, гетероциклоалкенил, циклоалкенилгетероил, циклоалкинил, гетероциклоалкинил и циклоалкинилгетероил и т.д.) сами по себе или в комбинации с другими терминами обозначают, если не указано иное, циклические варианты ʺгидрокарбилаʺ, ʺгетерогидрокарбилаʺ или ʺгидрокарбилгетероилаʺ соответственно. Кроме того, Для гетерогидрокарбила или гетероциклогидрокарбила (такого как гетероалкил и гетероциклоалкил), гетероатом может занимать положение, в котором гетероцикл прикреплен к остатку молекулы. Примеры циклоалкила включают без ограничения циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Неограничивающие примеры гетероциклических фрагментов включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофураниндол-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил и 2-пиперазинил.
Термин ʺгалогенʺ или ʺгалогенидʺ сами по себе или в качестве части другого заместителя означает, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, термин ʺгалогеналкилʺ предназначен для включения моногалогеналкила и полигалогеналкила. Например,' термин ʺгалоген(С1-С4)алкилʺ предназначен для включения, но без ограничения, трифторметила, 2,2,2-трифторэтила, 4-хлорбутила, 3-бромпропила и т.п.
Термин ʺарилʺ означает, если не указано иное, полиненасыщенный ароматический заместитель, который может быть моно-, ди- или полизамещенным и может состоять из одного кольца или нескольких колец (предпочтительно из 1-3 колец), которые слиты вместе или ковалентно связаны. Термин ʺгетероарилʺ относится к арильной группе (или кольцам), которые содержат от одного до четырех гетероатомов. В иллюстративном варианте осуществления гетероатом выбран из В, N, О и S, где атомы азота и серы необязательно окислены, и атом(ы) азота необязательно кватернизированы. Гетероарильная группа может быть прикреплена к остатку молекулы посредством гетероатома. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители любой описанной выше арильной и гетероарильной кольцевых систем выбраны из приемлемых заместителей, описанных ниже.
Для краткости, термин ʺарилʺ, при использовании в комбинации с другими терминами (например, арилокси, арилтио, арилалкил), включает как арильные, так и гетероарильные кольца, как определено выше. Таким образом, термин ʺарилалкилʺ предназначен для включения таких радикалов, в которых арильная группа присоединена к алкильной группе (например, бензильной, фенэтильной, пиридилметильной и т.п.), в том числе к таким алкильным группам, в которых атом углерода (например, метиленовая группа) был замещен, например, атомом кислорода, например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.
ʺКольцо или циклоʺ означает замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Так называемое кольцо включает слитые кольцевые фрагменты. Количество атомов в кольце обычно определяют как количество членов кольца. Например, ʺ5-7-членное кольцоʺ означает, что в кольцевом соединении присутствует от 5 до 7 атомов. Если не указано иное, кольцо необязательно включает от одного до трех гетероатомов. Таким образом, термин ʺ5-7-членное кольцоʺ включает, например, фенил, пиридинил и пиперидинил. Термин ʺ5-7-членное гетероциклоалкильное кольцоʺ, с другой стороны, включает пиридинил и пиперидинил, но не фенил. Термин ʺкольцоʺ дополнительно включает кольцевую систему, содержащую по меньшей мере одно кольцо, где каждое ʺкольцоʺ независимо определено выше.
Применяемый в данном документе термин ʺгетероатомʺ включает атомы, отличные от углерода (С) и водорода (Н), в том числе, например, атомы кислорода (О), азота (N), серы (S), кремния (Si), германия (Ge), алюминия (Al), бора (В) и т.д.
Термин ʺуходящая группаʺ означает функциональную группу или атом, которые могут быть смещены другими функциональной группой или атомом в реакции замещения (такой как реакция нуклеофильного замещения). Например, иллюстративные уходящие группы включают группы трифлата, хлора, брома и йода; группы сульфонового сложного эфира, такие как мезилат, тозилат, брозилат, нозилат и т.п.; и ацилокси-группы, такие как ацетокси, трифторацетокси и т.п.
Термин ʺзащитная группаʺ включает без ограничения ʺамино-защитную группуʺ, ʺгидрокси-защитную группуʺ или ʺтиол-защитную группуʺ. Термин ʺамино-защитная группаʺ означает защитную группу, подходящую для предотвращения побочных реакций при аминном азоте. Иллюстративные амино-защитные группы включают без ограничения формил; ацильные группы, например, алканоильные группы, такие как ацетил, трихлорацетил или трифторацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Воc); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-фторенилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Вn), тритил (Тr) и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS); и т.п. Термин ʺгидрокси-защитная группаʺ означает защитную группу, подходящую для предотвращения побочных реакций на гидрокси-группе. Иллюстративные гидрокси-защитные группы включают без ограничения алкильные группы, такие как метил, этил и трет-бутил; ацильные группы, например, алканоильные группы, такие как ацетил; арилметильные группы, такие как бензил (Bn), п-метоксибензил (РМВ), 9-фторенилметил (Fm) и дифенилметил (бензгидрил, DPM); силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS); и т.п.
Примеры галогеналкила включают без ограничения трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. ʺАлкоксиʺ обозначает алкильную группу, определенную выше, с указанным количеством атомов углерода, прикрепленных посредством кислородного мостика. С1-6алкокси предназначен для включения С1, С2, С3, С4, С5 и С6алкокси-групп. Примеры алкокси включают без ограничения метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентокси и втор-пентокси. ʺЦиклоалкилʺ предназначен для включения насыщенных кольцевых групп, таких как циклопропил, циклобутил или циклопентил. 3-7-Циклоалкил предназначен для включения С3, С4, С5, С6 и С7циклоалкильных групп. ʺАлкенилʺ предназначен для включения углеводородных цепей либо прямой, либо разветвленной конфигурации и с одной или более ненасыщенными углерод-углеродными связями, которые могут находиться в любой стабильной точке вдоль цепи, как, например, этенил и пропенил. Термин ʺгалогенʺ или ʺгалогенидʺ относится к фтору, хлору, брому и йоду.
Термин ʺгетероциклʺ или ʺгетероциклоʺ предназначен для обозначения стабильного моноциклического, или бициклического, или бициклического гетероциклического кольца, которое может быть насыщенным, частично ненасыщенным или ненасыщенным (ароматическим) и включать атомы углерода и 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из группы, включающей N, О и S, причем любое из определенных выше гетероциклических колец может быть слитым с бензольным кольцом с образованием бициклической группы. Гетероатомы азот и сера необязательно могут быть окисленными (т.е. NO и S (О) р). Атом азота может быть замещенным или не замещенным (т.е., N или NR, где R представляет собой Н или другие заместители, уже определенные в данном документе). Гетероциклическое кольцо может быть прикреплено к его боковой группе при любом гетероатоме или атоме углерода, что обеспечивает стабильную структуру. Гетероциклические кольца, описанные в данном документе, могут быть замещены при атоме углерода или при атоме азота, если полученное в результате соединение является стабильным. Атом азота в гетероцикле необязательно может быть кватернизированным. В предпочтительном варианте осуществления если общее количество атомов S и О в гетероцикле превышает 1, то эти гетероатомы не являются смежными друг с другом. В другом предпочтительном варианте осуществления общее количество атомов S и О в гетероцикле не превышает 1. Применяемый в данном документе термин ʺароматическая гетероциклическая группаʺ или ʺгетероарилʺ предназначен для обозначения стабильного 5-, 6- или 7-членного моноциклического или бициклического или 7-, 8-, 9- или 10-членного бициклического гетероциклического ароматического кольца, которое включает атомы углерода и 1, 2, 3 или 4 гетероатомов, независимо выбранных из группы, включающей N, О и S. Атом азота может быть замещенным или не замещенным (т.е. N или NR, где R представляет собой Н или другие заместители, уже определенные в данном документе). Гетероатомы азот и сера необязательно могут быть окисленными (т.е. NO и S (О) р). Следует отметить, что общее количество атомов S и О в ароматическом гетероцикле не превышает 1. Кольца с внутренними мостиками также включены в определение гетероцикла. Кольцо с внутренним мостиком возникает, если один или более атомов (т.е. С, О, N или S) соединяют два не являющихся смежными атома углерода или азота. Предпочтительные кольца с внутренними мостиками включают без ограничения один атом углерода, два атома углерода, один атом азота, два атома азота и группу углерод-азот. Следует отметить, что мостик всегда превращает моноциклическое кольцо в трициклическое кольцо. В кольце с внутренним мостиком заместители в кольце также могут присутствовать на мостике.
Примеры гетероциклов включают без ограничения акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4аН-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2Н,6Н-1, 5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1Н-индазолил, индоленил, индолинил, индолизинил, индолил, 3Н-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил,, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6Н-1,2,5-тиадиазенил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил. Также включены слитые кольца и спиро-соединения.
Соединения по настоящему изобретению могут быть получены несколькими способами синтеза, известными специалисту в данной области, в том числе конкретными вариантами осуществления, описанными ниже, вариантами осуществления, образованными путем их объединения с другими способами химического синтеза, известными в данной области, и эквивалентами, хорошо известными специалистам в данной области. Предпочтительные варианты осуществления включают без ограничения примеры настоящего изобретения.
Все растворители, применяемые в данном документе, являются коммерчески доступными и применяются без дополнительной очистки. Реакции обычно проводят в безводных растворителях в инертной атмосфере азота. Данные протонного ЯМР записаны на спектрометре Bruker Avance III 400 (400 МГц) и химические сдвиги выражены в виде δ (ppm) со сдвигом в сторону более слабого поля от тетраметилсилана. Масс-спектры определяли с помощью инструмента Agilent серии 1200 Plus 6110 (& 1956А). LC/MS или Shimadzu MS включает DAD:SPD-M20A (LC) и детектор Shimadzu Micromass 2020. Масс-спектрометр оснащен источником ионов для электрораспыления (ESI), функционирующим в положительном или отрицательном режиме.
В данном документе применяют следующие сокращения: водн. означает водный; HATU означает O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; EDC означает N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид, m-CPBA означает 3-хлорпероксибензойную кислоту; экв. означает эквивалент; CDI означает карбонил диимидазол; DCM означает дихлорметан; РЕ означает петролейный эфир; DIAD означает диизопропил азодикарбоксилат; DMF означает N,N-диметилформамид; DMSO означает диметилсульфоксид; EtOAc означает этилацетат; EtOH означает этанол; МеОН означает метанол; CBz означает бензилоксикарбонил, амино-защитная группа; ВОС означает трет-бутилкарбонил, амино-защитная группа; НОАс означает уксусную кислоту; NaCNBH3 означает натрия цианоборгидрид; к.т.означает комнатную температуру; O/N означает в течение ночи; THF означает тетрагидрофуран; Boc2O означает ди-трет-бутил дикарбонат; TFA означает трифторуксусную кислоту; DIPEA означает диизопропилэтиламин; SOCl2 означает оксид-дихлорид серы; CS2 означает дисульфид углерода; TsOH означает 4-метилбензолсульфоновую кислоту; NFSI означает N-фтор-N-(фенилсульфонил)бензолсульфонамид; NCS означает N-хлорсукцинимид; н-Bu4NF означает тетрабутиламмония фторид; i-PrOH означает 2-пропанол и т.пл. означает температуру плавления.
Соединения называли либо вручную, либо с помощью ChemDraw®, либо с использованием каталожных названий поставщиков, если они являлись коммерчески доступными.
Анализы HPLC проводили с помощью системы Shimadzu LC20AB с автоматическим пробозаборником Shimadzu SIL-20A и детектором Shimadzu DAD:SPD-M20A. Применяемой колонкой была Xtimate С18, 3 мкм, 2,1×300 мм. Способ 0-60 АВ_6 мин включал: нанесение линейного градиента, начало элюирования при 100% А (А: 0,0675% TFA в воде) и окончание элюирования при 60% В (В: 0,0625% TFA в MeCN) в общей сложности в течение 4,2 мин и затем элюирование при 60% В в течение 1,0 мин Затем колонку повторно уравновешивали в течение 0,8 мин до 100:0 с общим временем прогона 6 мин Способ 10-80АВ_6 мин включал: нанесение линейного градиента, начало элюирования при 90% А (А: 0,0675% TFA в воде) и окончание элюирования при 80% В (В: 0,0625% TFA в MeCN) в общей сложности в течение 4,2 мин и затем элюирование при 80% В в течение 1,0 мин. Затем колонку повторно уравновешивали в течение 0,8 мин до 90:10 с общим временем прогона 6 мин. Температура колонки составляла 50°С со скоростью потока 0,8 мл/мин. Детектор с диодной матрицей сканировал от 200 до 400 нм.
Тонкослойную хроматографию (TLC) проводили на силикагеле GF254 от Sanpont-group и для визуализации пятен обычно применяли УФ. В некоторых случаях также применяли дополнительные способы визуализации. В данных случаях разрабатывали пластинку для TLC с йодом (получали путем добавления примерно 1 г I2 к 10 г силикагеля и тщательного перемешивания), ванилином (получали путем растворения приблизительно 1 г ванилина в 100 мл 10% H2SO4), нингидрином (доступна коммерчески от Aldrich) или Magic Stain (получали путем тщательного смешивания (NH4)6Mo7O24⋅4H2O, 5 г (NH4)2Ce(IV)(NO3)6, 450 мл H2O и 50 мл концентрированной H2SO4) для визуализации соединения. Флэш-хроматографию проводили с использованием 40-63 мкм (230-400 меш) силикагеля от Silicycle, следуя методикам, аналогичным раскрытым в Still, W.С; Kahn, М.; and Mitra, М. Journal of Organic Chemistry, 1978, 43, 2923-2925. Типичные растворители, применяемые для флэш-хроматографии или тонкослойной хроматографии, представляли собой смеси, такие как дихлорметан/метанол, этилацетат/метанол и гексаны/этилацетат.
Препаративную хроматографию проводили с помощью системы Gilson-281 Prep LC 322 с применением детектора Gilson UV/VIS-156. Применяемой колонкой была Agella Venusil ASB Prep С18, 5 мкм, 150×21,2 мм или Phenomenex Gemini С18, 5 мкм, 150×30 мм или Boston Symmetrix С18, 5 мкм, 150 x30 мм или Phenomenex Synergi С18, 4 мкм, 150×30 мм. Узкие градиенты с ацетонитрилом/водой, где вода содержала 0,05% HCl или 0,25% НСООН или 0,5% NH3⋅H2O, использовали для элюирования соединений со скоростью потока примерно 25 мл/мин и общим временем прогона 8-15 мин
Анализы SFC проводили с помощью системы Agilent 1260 Infinity SFC с автоматическим пробозаборником Agilent 1260 и детектором Agilent DAD: 1260.
Применяемой колонкой была Chiralcel OD-H 250×4,6 мм I.D., 5 мкм или Chiralpak AS-H 250×4,6 мм I.D., 5 мкм или Chiralpak AD-H 250×4,6 мм I.D., 5 мкм. Способ OD-H_5_40_2,35 мл включал следующее: применяемая колонка: Chiralcel OD-H 250×4,6 мм I.D., 5 мкм, подвижная фаза: 40% этанол (0,05% DEA) в CO2, скорость потока: 2,35 мл/мин, длина волны: 220 нм. Способ AS-Н_3_40_2,35 мл включал следующее: применяемая колонка: Chiralpak AS-H 250×4,6 мм I.D., 5 мкм, подвижная фаза: 40% метанол (0,05% DEA) в CO2, скорость потока: 2,35 мл/мин, длина волны: 220 нм. Способ ОD-Н_3_40_2,35 мл включал следующее: применяемая колонка: Chiralcel OD-H 250×4,6 мм I.D., 5 мкм, подвижная фаза: 40% метанол (0,05% DEA) в CO2, скорость потока: 2,35 мл/мин, длина волны: 220 нм. Способ АD-Н_2_50_2,35 мл включал следующее: применяемая колонка: Chiralpak AD-H 250×4,6 мм I.D., 5 мм, подвижная фаза: 50% метанол (0,1% МЕА) в CO2, скорость потока: 2,35 мл/мин, длина волны: 220 нм.
Анализ посредством препаративной SFC проводили с помощью системы Waters Thar 80 Pre-SFC с применением УФ-детектора Gilson. Применяемой колонкой была Chiralcel OD-H 250×4,6 мм I.D., 5 м или Chiralpak AD-H 250×4,6 мм I.D., 5 м. Узкие градиенты с этанолом или метанолом в CO2, где этанол или метанол содержали 0,05% NH3⋅H2O или 0,05% DEA или 0,1% МЕА, использовали для элюирования соединения со скоростью потока от 40 до 80 мл/мин и общим временем прогона 20-30 мин
Ингибиторы PARP-1, представленные в данном документе, можно применять для лечения широкого спектра заболеваний, включая рак, инсульт, ишемию сердца, воспаление и диабет. Ингибиторы PARP-1 можно применять в качестве самостоятельного средства или в комбинации с другими химиотерапевтическими средствами для усиления эффекта данных стандартных химиотерапевтических средств.
Виды рака, которые можно лечить с помощью ингибиторов PARP-1, включают без ограничения рак молочной железы, рак яичника, рак поджелудочной железы, рак предстательной железы, рак толстого кишечника, лейкоз и т.д.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для более подробного описания настоящего изобретения представлены следующие примеры. Однако объем настоящего изобретения не ограничен ими.
Схема А
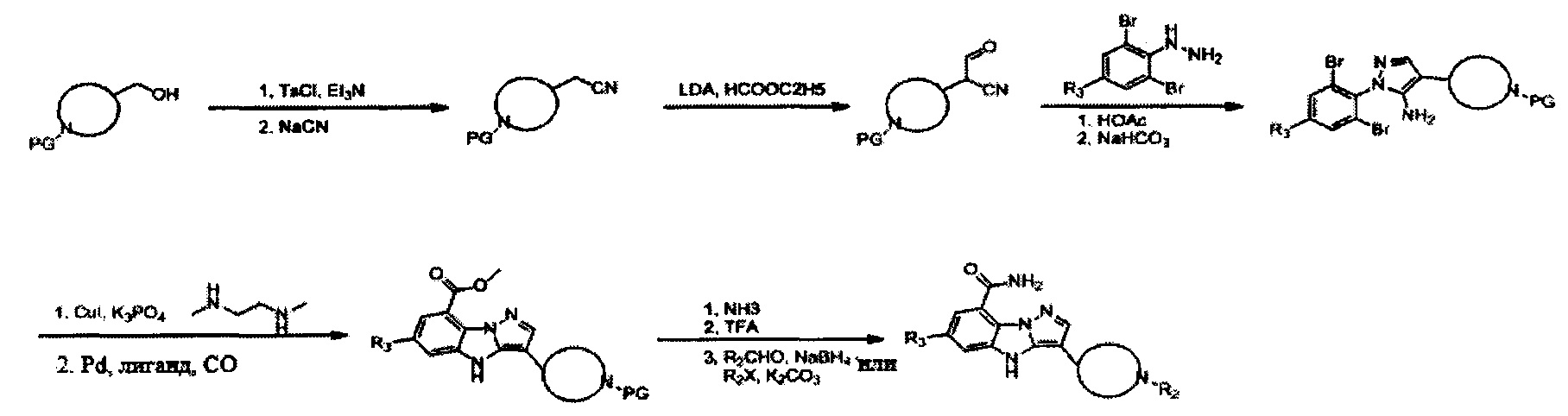
Пример 1
6-Фтор-3-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
Пример 1А
трет-Бутил-4-((тозилокси)метил)пиперидин-1-карбоксилат
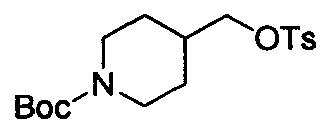
К раствору трет-бутил-4-(гидроксиметил)-пиперидин-1-карбоксилата (10 г, 46,5 ммоль), Et3N (5,64 г, 55,8 ммоль) и DMAP (1,13 г, 9,3 ммоль) в DCM (100 мл) частями добавляли TosCl (9,73 г, 51,2 ммоль) при 0°С в атмосфере N2. После перемешивания при 17°С в течение 2 ч добавляли воду (100 мл) для его гашения. Водный слой экстрагировали с помощью DCM (100 мл ×2). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством колоночной хроматографии с получением титульного соединения (17 г, 99% выход) в виде белого твердого вещества. LCMS (ESI) масса/заряд: 370 (М+1).
Пример 1В
трет-Бутил-4-(цианометил)пиперидин-1-карбоксилат
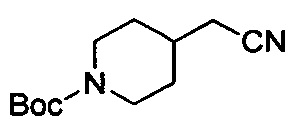
Для смеси примера 1А (19 г, 55,7 ммоль), цианида натрия (8,19 г, 167 ммоль) в диметилсульфоксиде (100 мл) обеспечивали реакцию при 100°С в течение 16 ч. После охлаждения до комнатной температуры смесь разводили водой (200 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×3). Объединенные органические слои промывали водой (50 мл) и солевым раствором (50 мл), затем высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (11 г), которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 225 (М+1).
Пример 1С
трет-Бутил-4-(1-циано-2-оксоэтил)пиперидин-1-карбоксилат
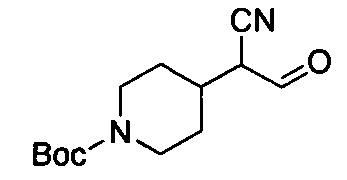
К смеси примера 1В (11 г, 49 ммоль), трет-ВuОК (32,9 г, 294 ммоль) в DMF (80 мл) по каплям добавляли раствор этилформиата (21,7 г, 294 ммоль) в DMF (50 мл) при -10°С в атмосфере N2. После завершения покапельного добавления смесь перемешивали при 17°С в течение 16 ч, а затем нейтрализовали с помощью 1H. HCl. Водный слой экстрагировали с помощью EtOAc (100 мл ×4). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (11 г, 89%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 253 (М+1).
Пример 1D
(2,6-Дибром-4-фторфенил)гидразин
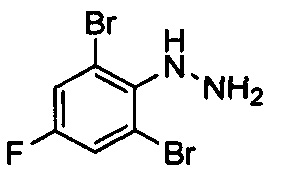
К раствору 2,6-дибром-4-фторанилина (5 г, 18,6 ммоль) в 35 мл 20% водн. НCl (35 мл) по каплям добавляли раствор NaNO2 (1,41 г, 20,45 ммоль) в воде (40 мл) при -5°С со скоростью покапельного добавления, достаточной для поддержания внутренней температуры ниже 5°С. Через 0,5 ч вышеуказанный раствор по каплям добавляли в раствор SnCl2 (10,49 г, 46 ммоль) в концентрированном растворе HCl (40 мл) при -15°С. После завершения покапельного добавления для смеси обеспечивали нагревание до 35°С и перемешивали в течение 12 ч. Смесь охлаждали до 0°С и доводили до рН=9 концентрированным водным раствором аммиака. Водный слой экстрагировали с помощью EtOAc (150 мл ×3). Органические слои промывали водой (100 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством колоночной хроматографии с получением титульного соединения (4 г, выход: 76%). 1Н ЯМР (400 МГц, CDCl3-d): δ ppm 3,91 (br.s., 1H), 5,37 (br.s. 1H), 7,31 (d, J=7,37 Гц, 2H).
Пример 1E
трет-Бутил-4-(1-циано-2-(2-(2,6-дибром-4-фторфенил)гидразоно)этил)пиперидин-1-карбоксилат
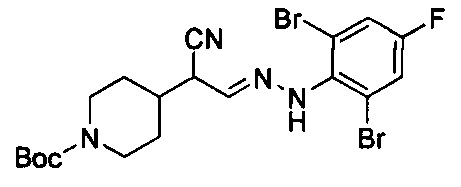
Смесь примера 1С (3,5 г, 13,87 ммоль) и примера 1D (3,94 г, 13,87 ммоль) в EtOH (30 мл) перемешивали при 80°С в течение 0,5 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде белого твердого вещества (3,8 г, 53%). LCMS (ESI) масса/заряд: 519 (М+1).
Пример 1F
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-ил)пиперидин-1-карбоксилат
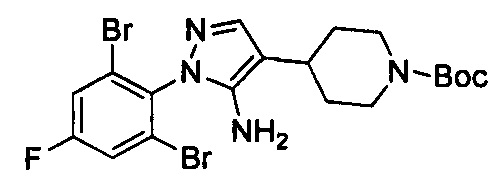
Смесь примера 1Е (3,8 г, 7,33 ммоль) и Et3N (1,48 г, 14,67 ммоль) в EtOH (30 мл) перемешивали при 80°С в течение 16 ч. Смесь выпаривали под вакуумом с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки. (3,8 г, 100%).
Пример 1G
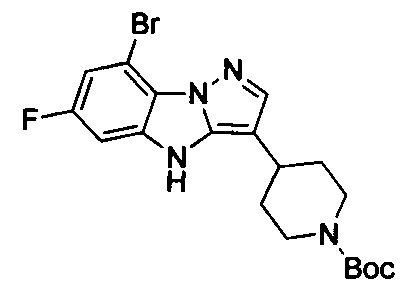
трет-Бутил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пиперидин-1-карбоксилат
Смесь примера 1F (2,4 г, 4,63 ммоль), N1,N2-диметилэтан-1,2-диамина (40,83 мг, 0,463 ммоль), CuI (88 мг, 0,463 ммоль) и K3PO4 (983 мг, 4,63 ммоль) в DMF (30 мл) перемешивали при 60°С в течение 1 ч при микроволновом излучение в атмосфере N2. Смесь охлаждали до комнатной температуры, а затем фильтровали через подушку целита, и фильтрат выпаривали под вакуумом с получением остатка, который очищали посредством колоночной хроматографии с получением титульного соединения в виде белого твердого вещества (0,4 г, 15%).
LCMS (ESI) масса/заряд: 437, 439 (M, M+2).
Пример 1H
Метил-3-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксилат
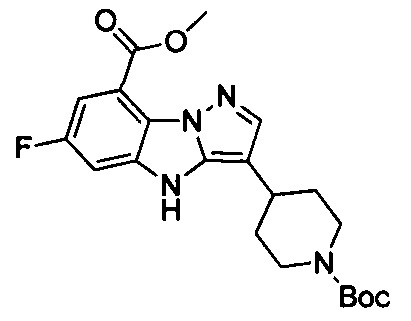
Смесь примера 1G (200 мг, 0,457 ммоль), Pd(OAc)2 (10,27 мг, 0,0457 ммоль), Pd(dppf)Cl2 (33,46 мг, 0,0457 ммоль), ксантфоса (53 мг, 0,0914 ммоль), DPPP (38 мг, 0,0914 ммоль), PPh3 (24 мг, 0,0914 ммоль) и Et3N (232 мг, 2,29 ммоль) в DMF (40 мл) и МеОН (20 мл) перемешивали при 120°С в течение 12 ч в атмосфере СО (3 МПа). Смесь охлаждали до комнатной температуры, а затем фильтровали через подушку целита. Фильтрат выпаривали с получением остатка, который очищали посредством колоночной хроматографии с получением титульного соединения в виде белого твердого вещества (100 мг, 52%). LCMS (ESI) масса/заряд: 417 (М+1).
Пример 1I
трет-Бутил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пиперидин-1-карбоксилат
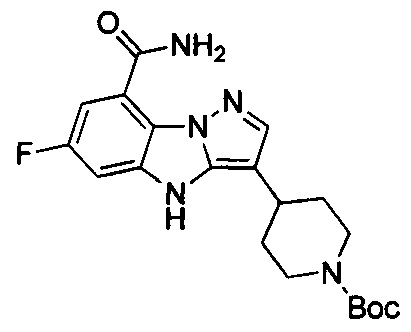
Для смеси примера 1H (100 мг, 0,24 ммоль) и NH3-MeOH (30 мл) в DMF (100 мл) обеспечивали реакцию при 120°С в течение 16 ч в закрытой пробирке. Смесь охлаждали, а затем удаляли раствор под вакуумом, и остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде белого твердого вещества (70 мг, 73%). LCMS (ESI) масса/заряд: 402 (М+1).
Пример 1J
6-Фтор-3-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
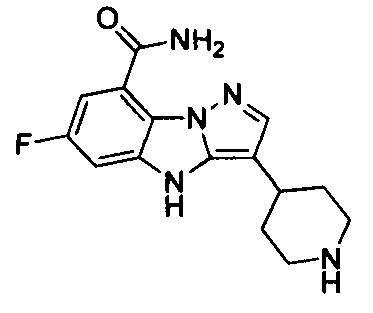
Смешанный раствор примера 1I (70 мг, 0,174 ммоль) в DCM (3 мл) и TFA (1 мл) перемешивали при 15°С в течение 1 ч, и удаляли раствор под вакуумом. Остаток очищали посредством препаративной HPLC с получением титульного соединения (25 мг, 49%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,93-1,96 (m, 2Н), 2,37-2,36 (d, 2Н), 3,09-3,22 (m, 3Н), 3,31-,53 (t, 2Н), 7,37-7,39 (m, 1H), 7,68-7,74 (m, 2Н). LCMS (ESI) масса/заряд: 302 (М+1).
Пример 2
3-(1-Этилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
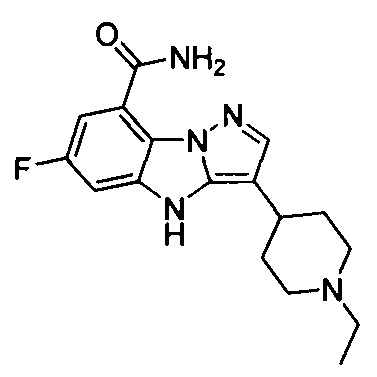
Смесь примера 1J (750 мг, 2,49 ммоль) и ацетальдегида (1,1 г, 24,9 ммоль) в МеОН (15 мл) перемешивали при 50°С в течение 0,5 ч. После этого к ней добавляли NaCNBH3 (3,13 г, 49,8 ммоль). Полученную в результате смесь перемешивали при 50°С в течение 16 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде белого твердого вещества (563,1 г, 69%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,31-1,34 (t, 3Н), 1,94-1,97 (m, 2Н), 2,27-2,31 (d, 2Н), 2,82 (t, 2Н), 2,97-3,02 (m, 3Н), 3,47-3,48 (d, 2Н), 7,34-7,37 (m, 1H), 7,67-7,72 (m, 2Н). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 3
6-Фтор-3-(1-(2-фторэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
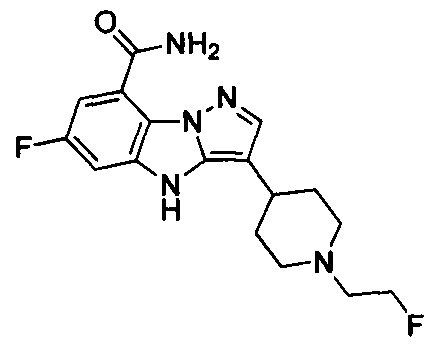
Смесь примера 1J (112 мг, 0,372 ммоль), 1-бром-2-метоксиэтана (71 мг, 0,558 ммоль) и карбоната калия (154 мг, 1,116 ммоль) в ацетонитриле (20 мл) перемешивали при 40°С в течение 16 часов. Смесь охлаждали и фильтровали, и фильтрат выпаривали под вакуумом с получением остатка, который очищали посредством препаративной HPLC с получением титульного соединения (4,6 мг, 3,6%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,94-2,15 (m, 2Н), 2,17-2,37 (m, 2Н), 2,86-3,07 (m, 3Н), 3,27-3,32 (m, 1H), 3,35-3,39 (m, 1H), 3,46-3,61 (m, 2Н), 4,71-4,80 (m, 1H), 4,89 (br.s., 1H), 7,28-7,41 (m, 1H), 7,60-7,76 (m, 2Н), 8,24-8,69 (m, 1H). LCMS (ESI) масса/заряд: 348 (М+1).
Пример 4
3-(1-циклопропилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
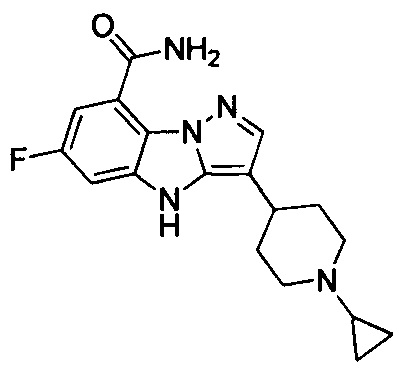
Смесь (1-этоксициклопропокси)триметилсилана (115 мг, 0,663 ммоль), примера 1J (40 мг, 0,133 ммоль), НОАс (79 мг, 1,33 ммоль) и NaCNBH3 (83 мг, 1,33 ммоль) в МеОН (10 мл) перемешивали при 66°С в течение 7 ч. Смесь охлаждали, а затем удаляли раствор под вакуумом, и остаток очищали посредством препаративной HPLC с получением титульного соединения (19,6 мг, 43%). 1Н ЯМР (400 МГц, метанол-d4) ppm 0,70-0,79 (m, 4Н), 1,84-1,92 (m, 2Н), 2,18-2,28 (t, 3Н), 2,85-2,94 (m, 3Н), 3,42-3,45 (d, 2Н), 7,33-7,35 (m, 1H), 7,65-7,68 (m, 2Н), 8,395 (s, 1H). LCMS (ESI) масса/заряд: 342 (М+1).
Пример 5
3-(1-(Циклопропилметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
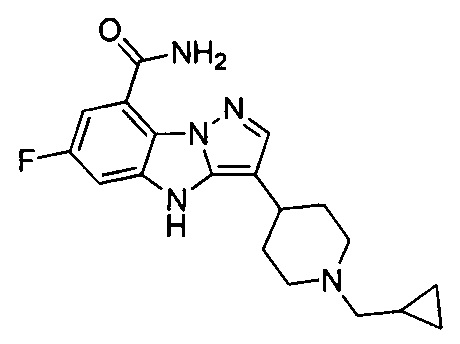
Смесь примера 1J (12 мг, 0,04 ммоль), циклопропанкарбальдегида (5,58 мг, 0,08 ммоль) и NaCNBH3 (50 мг, 0,8 ммоль) в МеОН (2 мл) перемешивали при 10°С в течение 16 ч. После этого к ней добавляли тетраизопропоксититан (17 мг, 0,06 ммоль) и непрерывно перемешивали в течение 1 часа. После удаления раствора под вакуумом остаток очищали посредством препаративной HPLC с получением титульного соединения (5,2 мг, 37%). 1Н ЯМР (400 МГц, метанол-d4) ppm 0,40-0,44 (m, 2Н), 0,75-0,79 (m, 1Н), 1,12-1,13 (m, 1H), 2,04 (s, 2H), 2,32-2,36 (d, 2H), 2,9-3,12 (m, 5 H), 3,68 (s, 2H), 7,36-7,39 (m, 1H), 7,68-7,73 (m, 2H), 8,50 (s, 1H). LCMS (ESI) масса/заряд: 356 (M+1).
Пример 6
6-Фтор-3-(1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
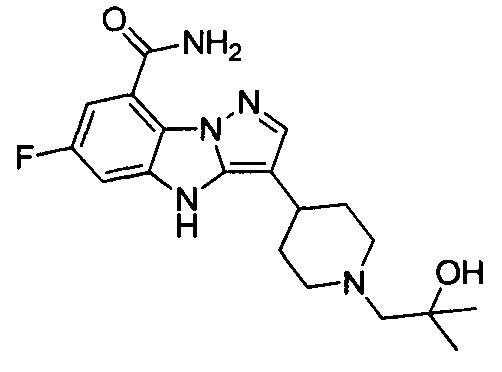
Пример 6А
трет-Бутил-4-(4-бензил-8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пиперидин-1-карбоксилат
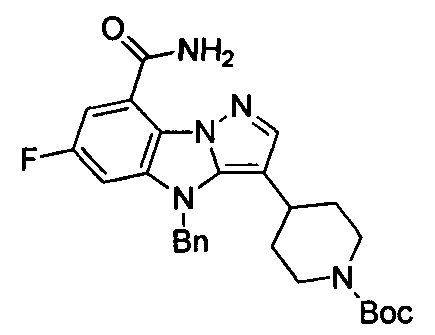
Смесь примера 1I (100 мг, 0,25 ммоль), (бромметил)бензола (127 мг, 0,748 ммоль) и карбоната калия (103 мг, 0,748 ммоль) в ацетонитриле (4 мл) перемешивали при 60°С в течение 4 часов. Смесь охлаждали и фильтровали, и фильтрат выпаривали под вакуумом с получением остатка, который очищали посредством хроматографии на силикагеле с получением титульного соединения (112,6 мг, 91,8%). LCMS (ESI) масса/заряд: 492 (М+1).
Пример 6В
4-Бензил-6-фтор-3-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
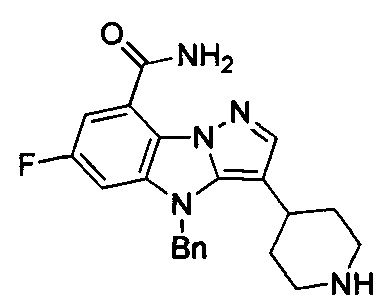
Смесь раствора примера 6А (112,6 мг, 0,229 ммоль) в DCM (9 мл) TFA (3 мл) перемешивали при 12°С в течение 2 часов. После удаления раствора под вакуумом получали титульное соединение (115 мг, 100%) в виде желтого твердого вещества, которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 392 (М+1).
Пример 6С
4-Бензил-6-фтор-3-(1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
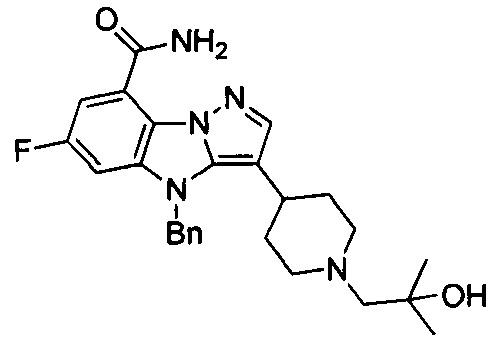
Смесь примера 6В (115 мг, 0,229 ммоль), 2,2-диметилоксирана (50 мг, 0,690 ммоль) и Et3N (116 мг, 1,15 ммоль) в этаноле (5 мл) нагревали при 120°С при микроволновом излучении в течение 1 часа. Смесь охлаждали и раствор удаляли под вакуумом, а затем остаток очищали посредством хроматографии на силикагеле с получением титульного соединения. LCMS (ESI) масса/заряд: 464 (М+1).
Пример 6D
6-Фтор-3-(1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
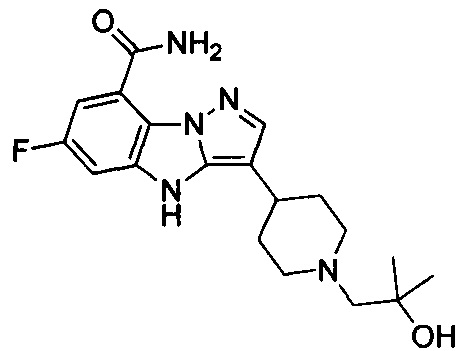
Смесь примера 6С (32 мг, 0,069 ммоль) и Pd/C (25 мг) в метаноле (30 мл) гидрогенизировали при 50°С в течение 4 часов в атмосфере Н2 (1 атм). Смесь охлаждали и фильтровали, и фильтрат выпаривали под вакуумом. После этого остаток очищали посредством препаративной HPLC с получением титульного соединения (8,2 мг, 32,2%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38 (s, 6Н), 2,10-2,30 (m, 4Н), 3,12 (s, 5Н), 3,57-3,73 (m, 2Н), 7,29-7,39 (m, 1H), 7,61-7,69 (m, 1H), 7,69-7,75 (m, 1H), 8,54 (br.s., 1H). LCMS (ESI) масса/заряд: 374 (М+1).
Пример 7
6-Фтор-3-(1-(2-фтор-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
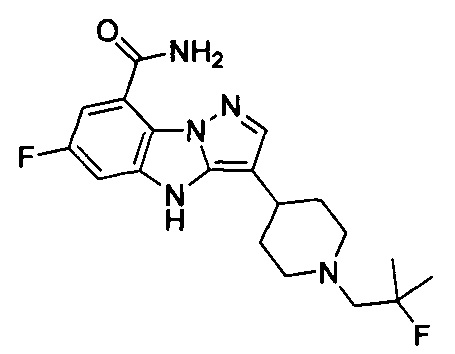
Пример 7А
4-Бензил-6-фтор-3-(1-(2-фтор-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
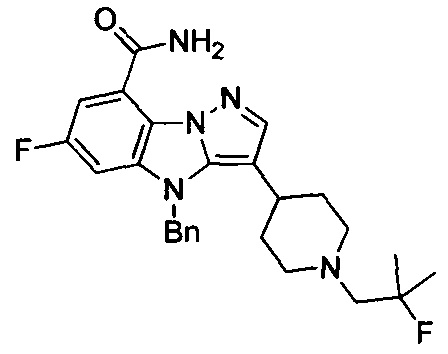
К смеси примера 6С (32 мг, 0,069 ммоль) в DCM (10 мл) по каплям добавляли раствор DAST (33 мг, 0,207 ммоль) в DCM (2 мл) при 0°С в атмосфере N2. После завершения покапельного добавления смесь перемешивали при 17°С в течение 16 ч, а затем гасили насыщенным раствором бикарбоната натрия (10 мл). Водный слой экстрагировали с помощью EtOAc (10 мл ×2). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством хроматографии на силикагеле с получением титульного соединения (27 мг, 84,4%). LCMS (ESI) масса/заряд: 466 (М+1).
Пример 7В
6-Фтор-3-(1-(2-фтор-2-метилпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
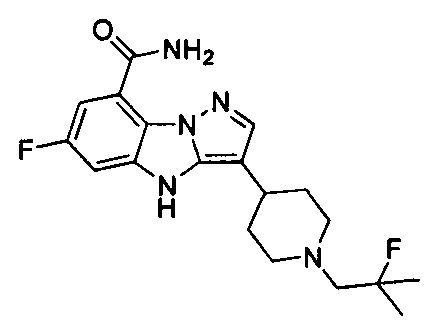
Смесь примера 7А (27 мг, 0,058 ммоль) и Pd/C (30 мг) в метаноле (20 мл) гидрогенизировали при 45°С в течение 16 часов в атмосфере Н2 (1 атм). Смесь охлаждали и фильтровали, и фильтрат выпаривали. Остаток очищали посредством препаративной HPLC с получением титульного соединения (2,1 мг, 10%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,42 (s, 3Н), 1,48 (s, 3Н), 1,90-2,03 (m, 2Н), 2,04-2,16 (m, 2Н), 2,51-2,67 (m, 2Н), 2,72-2,90 (m, 3Н), 3,23-3,31 (m, 2Н), 7,32-7,41 (m, 1H), 7,63-7,75 (m, 2Н), 8,27-8,59 (m, 1H). LCMS (ESI) масса/заряд: 376 (М+1)
Пример 8
3-(1-(Циклопропилкарбонил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
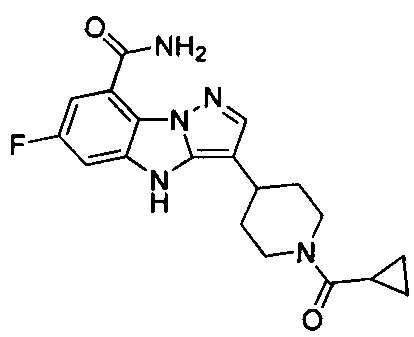
Смесь примера 1J (52 мг, 0,125 ммоль), циклопропанкарбоновой кислоты (13 мг, 0,150 ммоль), Et3N (50,5 мг, 0,5 ммоль) и HATU (47,5 мг, 0,125 ммоль) в ацетонитриле (5 мл) перемешивали при 50°С в течение 3 часов. После охлаждения смеси и удаления раствора под вакуумом остаток очищали посредством препаративной HPLC с получением титульного соединения (12,7 мг, 27,3%). LCMS: 370 [М+1]. 1Н ЯМР (400 МГц, DMSO-d6) ppm 0,72 (d, J=7,53 Гц, 4Н), 1,42-1,69 (m, 2Н), 1,88-2,07 (m, 3Н), 2,65-2,77 (m, 1H), 2,86-2,98 (m, 1H), 3,14-3,29 (m, 1H), 4,26-4,50 (m, 2Н), 7,43-7,50 (m, 1H), 7,51-7,59 (m, 1H), 7,76 (s, 1H). LCMS (ESI) масса/заряд: 370 (М+1).
Пример 9
6-Фтор-3-(1-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
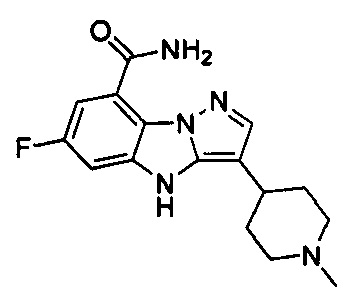
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,98-2,01 (d, 2Н), 2,29-2,31 (d, 2Н), 2,83 (s, 1H), 3,01-3,04 (d, 2Н), 3,48 (d, 2Н), 7,36-7,39 (m, 1H), 7,68-7,73 (m, 2Н), 8,49 (s, 1H), LCMS (ESI) масса/заряд: 316 (М+1).
Пример 10
6-Фтор-3-(1-изопропилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
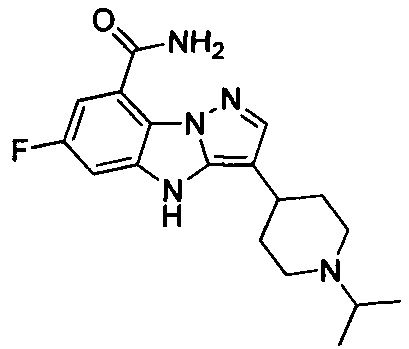
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38-1,40 (d, 6Н), 2,02-2,05 (d, 2Н), 2,36-2,40 (d, 2Н), 3,06 (m, 1H), 3,19-3,22 (t, 2Н), 3,51-3,55 (m, 3Н), 7,35-7,38 (m, 1H), 7,66-7,72 (m, 2Н), 8,51 (s, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 11
6-Фтор-3-(1-(оксетан-3-ил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
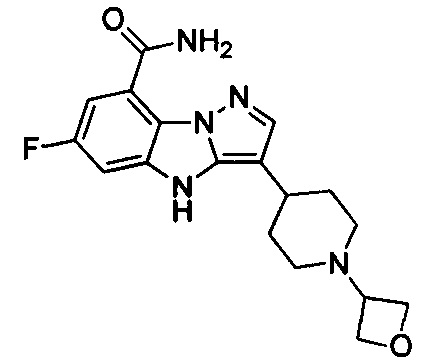
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, DMSO-d6) ppm 1,66-1,79 (m, 2Н), 1,82-1,99 (m, 4Н), 2,58-2,69 (m, 1H), 2,70-2,81 (m, 2Н), 3,36-3,45 (m, 1H), 4,45 (s, 2Н), 4,51-4,58 (m, 2Н), 7,36-7,44 (m, 1H), 7,45-7,53 (m, 1H), 7,65-7,75 (m, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 12
6-Фтор-3-(1-пропилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
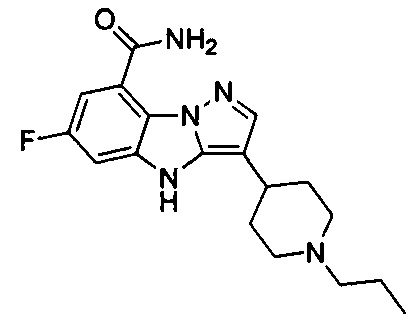
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) ppm 1,02-1,06 (t, 3Н), 1,76-1,82 (m, 2Н), 2,00-2,03 (d, 2Н), 2,31-2,34 (d, 2Н), 3,01-3,05 (m, 5 Н), 3,57-3,58 (d, 2Н), 7,36-7,39 (m, 1H), 7,68-7,73 (m, 2Н), 8,5l(s, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 13
3-(1-(2-Аминоэтил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
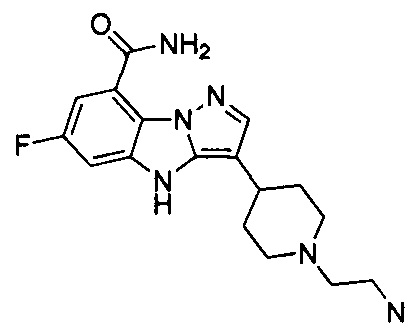
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,80-1,98 (m, 2Н), 2,06-2,17 (m, 2Н), 2,30-2,46 (m, 2Н), 2,68-2,85 (m, 3Н), 3,05-3,19 (m, 4Н), 7,30-7,38 (m, 1H), 7,69 (br.s., 2Н), 8,28-8,67 (m, 1H). LCMS (ESI) масса/заряд: 345 (М+1).
Пример 14
3-(1-(2-(Диметиламино)этил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
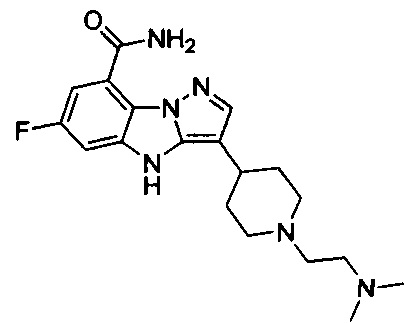
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,83-1,98 (m, 2Н), 2,05-2,18 (m, 2Н), 2,36-2,48 (m, 2Н), 2,68 (s, 6Н), 2,80 (t, J=6,46 Гц, 3Н), 2,97-3,07 (m, 2Н), 3,11-3,25 (m, 2Н), 7,25-7,40 (m, 1H), 7,57-7,75 (m, 2Н). LCMS (ESI) масса/заряд: 373 (М+1).
Пример 15
6-Фтор-3-(1-(2-метоксиэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
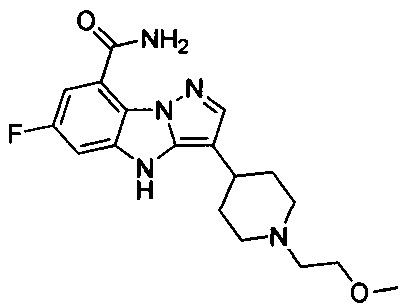
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 2,00-2,18 (m, 2Н), 2,22-2,38 (m, 2Н), 2,94-3,08 (m, 1H), 3,08-3,22 (m, 2Н), 3,33-3,38 (m, 2Н), 3,44 (s, 3Н), 3,56-3,70 (m, 2Н), 3,71-3,82 (m, 2Н), 7,19-7,38 (m, 1H), 7,53-7,64 (m, 1H), 7,68 (s, 1H), 8,42-8,66 (m, 1H). LCMS (ESI) масса/заряд: 360 (М+1).
Пример 16
6-Фтор-3-(1-(2-гидроксиэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
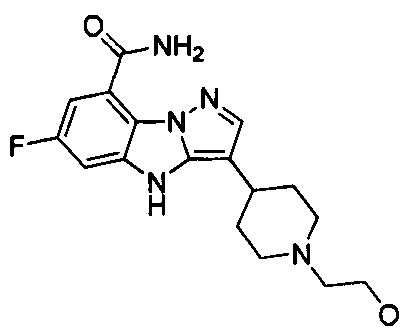
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 2,04-2,20 (m, 2Н), 2,25-2,37 (m, 2Н), 2,98-3,10 (m, 1H), 3,12-3,24 (m, 2Н), 3,25-3,31 (m, 2Н), 3,62-3,75 (m, 2Н), 3,89-3,99 (m, 2Н), 7,25-7,38 (m, 1H), 7,57-7,66 (m, 1H), 7,69 (s, 1H), 8,50-8,62 (m, 1H). LCMS (ESI) масса/заряд: 346 (М+1).
Пример 17
3-(1-Этилпиперидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
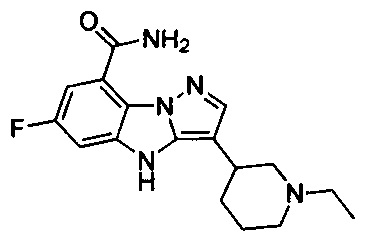
Данный пример получали, как описано в примерах 1 и 2, заменяя трет-бутил-3-(гидроксиметил)пиперидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1H-ЯМР (MeOD, 400 МГц) δ: 1,38 (t, 3Н), 1,85-2,00 (m, 2Н), 2,13-2,26 (m, 2Н), 2,94-3,03 (m, 2Н), 3,21-3,24 (m, 3Н), 3,59-3,73 (m, 2Н), 7,37-7,39 (dd, 1H), 7,66-7,69 (dd, 1H), 7,76 (s, 1H), 8,52 (bs, 1 H). LCMS (ESI) масса/заряд: 331 (М+1).
Пример 18
3-(1-Этилазепан-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
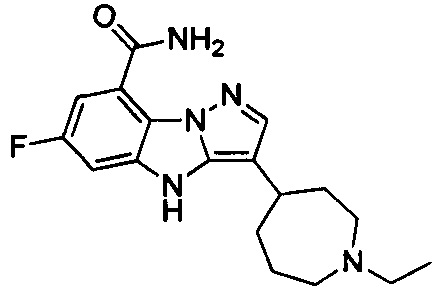
Пример 18А
1-трет-Бутил-4-этил-5-оксоазепан-1,4-дикарбоксилат
К раствору трет-бутил-4-оксопиперидин-1-карбоксилата (50 г, 251 ммоль) и BF3-Et2O (49,86 г, 351 ммоль) в THF (500 мл) по каплям добавляли этил-2-диазо (40,09 г, 351 ммоль) при -40°С в атмосфере N2. После завершения покапельного добавления смесь перемешивали при -40°С в течение 2 ч, а затем нагревали до 15°С и перемешивали в течение 16 ч. После завершения реакции смесь гасили водным раствором K2CO3 (500 мл). Водный слой экстрагировали с помощью EtOAc (500 мл ×2). Объединенные органические слои промывали водой и солевым раствором, после чего высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения (45 г, выход: 63%). LCMS (ESI) масса/заряд: 286 (М+1).
Пример 18В
1-трет-Бутил 4-этил-5-гидроксиазепан-1,4-дикарбоксилат
К раствору примера 18А (45 г, 157,7 ммоль) в МеОН (420 мл) частями добавляли NaBH4 (7,16 г, 189 ммоль) при 0°С. После перемешивания при 0°С в течение 1 ч полученную в результате смесь гасили водой (400 мл), и водную фазу экстрагировали с помощью EtOAc (400 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения (22,3 г, выход: 49%). LCMS (ESI) масса/заряд: 288 (М+1).
Пример 18С
1-трет-Бутил-4-этил-2,3,6,7-тетрагидро-1Н-азепин-1,4-дикарбоксилат
К раствору примера 18В (21 г, 73 ммоль), DBU (22 г, 146 ммоль) в толуоле (200 мл) по каплям добавляли MsCl (14,56 г, 128 ммоль). После завершения покапельного добавления смесь перемешивали при 110°С в течение 2 ч и охлаждали до комнатной температуры, а затем добавляли воду (200 мл) для ее гашения. Водный слой экстрагировали с помощью EtOAc (200 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения (13 г, выход: 66%). LCMS (ESI) масса/заряд: 270 (М+1).
Пример 18D
1-трет-Бутил-4-метил-азепан-1,4-дикарбоксилат
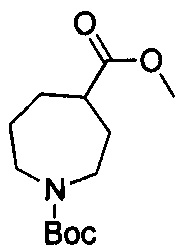
Смесь примера 18С (13 г, 48,27 ммоль) и Pd/C (1 г) в МеОН (130 мл) гидрогенизировали при 15°С в течение 16 ч в атмосфере Н2 (1 атм). Смесь фильтровали, и фильтрат выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки (10,7 г, выход: 82%). LCMS (ESI) масса/заряд: 258 (М+1).
Пример 18E
трет-Бутил-4-(гидроксиметил)азепан-1-карбоксилат
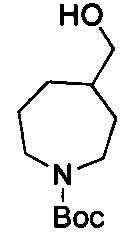
К раствору примера 18D (10,7 г, 39 ммоль) в THF (200 мл) частями добавляли LiAlH4 (1,48 г, 39 ммоль) при 0°С. После перемешивания при 0°С в течение 30 мин полученную в результате смесь гасили водой (10 мл), 15% водн. NaOH (10 мл), водой (30 мл). Смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения (7 г, выход: 77%). LCMS (ESI) масса/заряд: 230 (М+1).
Пример 18F
3-(1-Этилазепан-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
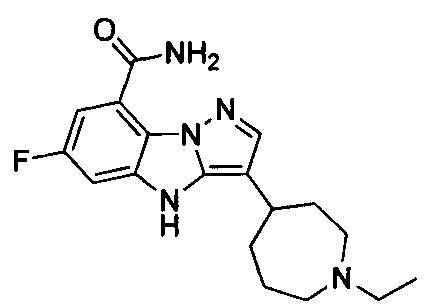
Данный пример получали, как описано в примерах 1 и 2, заменяя трет-бутил-4-(гидроксиметил)азепан-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,38-1,42 (t, 3Н), 1,93-1,96 (m, 2Н), 1,99-2,12 (m, 2Н), 2,32-2,34 (m, 2Н), 3,15-3,30 (m, 1H), 3,32-3,33 (m, 2Н), 3,33-3,53 (m, 4Н), 7,38-7,40 (dd, 1H), 7,69-7,73 (dd, 1H), 7,74 (s, 1H), 8,50 (bs, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 19
6-Фтор-3-(1-метилазепан-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
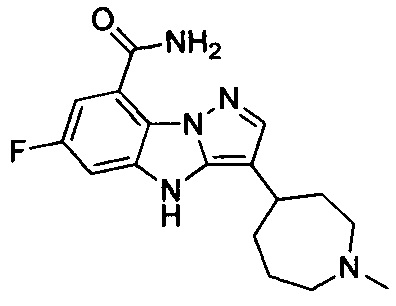
Данный пример получали согласно способу, описанному в примере 18. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,95-2,10 (m, 3Н), 2,26-2,35 (m, 3Н), 2,96 (s, 1H), 3,14-3,17 (m, 1H), 3,36-3,49 (m, 4Н), 7,38-7,40 (dd, 1H), 7,69-7,72 (dd, 1H), 7,74 (s, 1H), 8,47 (bs, 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 20
6-Фтор-3-(1-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
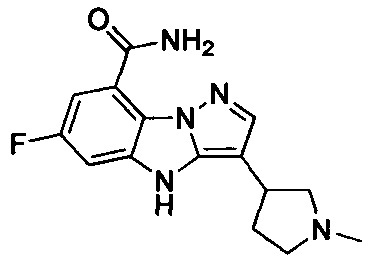
Данный пример получали, как описано в примерах 1 и 2, заменяя трет-бутил-3-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (MeOD, 400 МГц) δ: 2,29-2,35 (m, 1H), 2,59-2,62 (m, 1H), 2,99 (s, 3Н), 3,32-3,36 (m, 1H), 3,53-3,55 (m, 2Н), 3,76-3,81 (m, 2Н), 7,40-7,42 (dd, 1H), 7,70-7,73 (dd, 1H), 7,80 (s, 1H), 8,50 (bs, 1H). LCMS (ESI) масса/заряд: 302 (М+1).
Пример 21
3-(1-Этилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
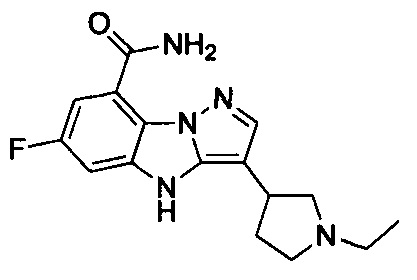
Данный пример получали, как описано в примере 20, заменяя трет-бутил-3-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (MeOD, 400 МГц) δ: 2,29-2,35 (m, 1H), 2,59-2,62 (m, 1H), 2,99 (s, 3Н), 3,32-3,36 (m, 1H), 3,53-3,55 (m, 2Н), 3,76-3,81 (m, 2Н), 7,40-7,42 (dd, 1H), 7,70-7,73 (dd, 1H), 7,80 (s, 1H), 8,50 (bs, 1H). LCMS (ESI) масса/заряд: 316 (М+1).
Пример 22
6-Фтор-3-(1-изопропилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
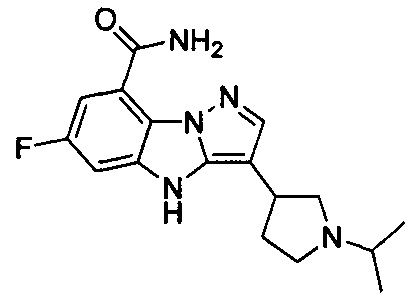
Данный пример получали, как описано в примере 20, заменяя трет-бутил-3-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,42-1,44 (d, 6Н), 2,25-2,31 (m, 1Н), 2,57-2,60 (m, 1H), 3,32-3,33 (m, 1H), 3,44-3,55 (m, 3Н), 3,68-3,71 (m, 1H), 7,41-7,43 (dd, 1H), 7,71-7,74 (dd, 1H), 7,82 (s, 1H), 8,55 (bs, 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 23
6-Фтор-3-(пирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
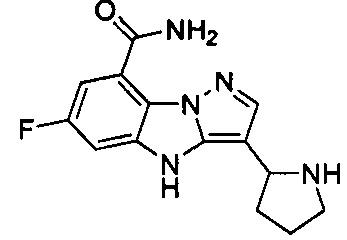
Данный пример получали, как описано в примере 1, заменяя трет-бутил-2-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 2,17-2,31 (m, 1H), 2,33-2,51 (m, 2Н), 2,52-2,67 (m, 1H), 3,48 (t, J=7,28 Гц, 2Н), 7,40 (dd, J=8,03, 2,26 Гц, 1H), 7,65 (dd, J=10,79, 2,26 Гц, 1H), 7,94 (s, 1H), 8,55 (br.s., 1H). LCMS (ESI) масса/заряд: 288 (М+1).
Пример 24
6-Фтор-3-(1-пропилпирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
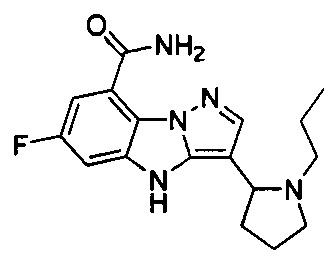
Данный пример получали, как описано в примере 2, заменяя трет-бутил-2-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,93 (t, J=7,34 Гц, 3Н), 1,54-1,79 (m, 2Н), 2,23 (d, J=5,02 Гц, 2Н), 2,37-2,53 (m, 2Н), 2,76 (br.s., 1H), 3,05 (br.s., 2Н), 3,65 (br.s., 1H), 4,31 (br.s., 1H), 7,44 (dd, J=8,09, 2,32 Гц, 1H), 7,73 (dd, J=10,92, 2,38 Гц, 1H), 7,94 (s, 1H), 8,54 (br.s., 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 25
6-Фтор-3-(1-метилпирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
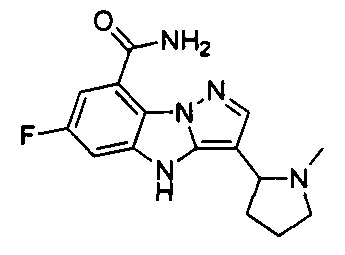
Данный пример получали, как описано в примере 2, заменяя трет-бутил-2-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 2,25-2,41 (m, 2Н), 2,47-2,67 (m, 2Н), 2,82 (s, 3Н), 3,23-3,30 (m, 1H), 3,66-3,79 (m, 1H), 4,50-4,58 (m, 1H), 7,43 (dd, J=8,16, 2,51 Гц, 1H), 7,64 (dd, J=10,73, 2,57 Гц, 1H), 7,95-8,02 (m, 1H), 8,52 (br.s., 1H). LCMS (ESI) масса/заряд: 302 (М+1).
Пример 26
3-(1-Этилпирролидин-2-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
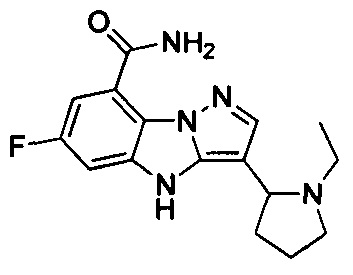
Данный пример получали, как описано в примере 2; заменяя трет-бутил-2-(гидроксиметил)пирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,30 (t, J=7,28 Гц, 3Н), 2,26-2,37 (m, 2Н), 2,46-2,61 (m, 2Н), 2,98-3,09 (m, 1H), 3,25 (d, J-10,29 Гц, 2Н), 3,68-3,80 (m, 1H), 4,55 (t, J=8,78 Гц, 1H), 7,42 (dd, J=8,16, 2,26 Гц, 1H), 7,64 (dd, J=10,73, 2,32 Гц, 1H), 7,97 (s, 1H), 8,54 (br.s., 1H). LCMS (ESI) масса/заряд: 316 (М+1).
Пример 27
3-(1-Этилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
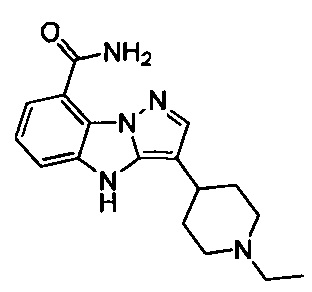
Данный пример получали, как описано в примере 1, заменяя (2,6-дибромфенил)гидразин на (2,6-дибром-4-фторфенил)гидразин. 1Н-ЯМР (400 МГц, метанол-d4) ppm 1,16-1,20 (t, 3Н), 1,84-1,87 (m, 2Н), 2,07-2,11 (d, 2Н), 2,16-2,19 (d, 2Н), 2,51-2,56 (q, 2Н), 2,70-2,75 (m, 1H), 3,11-3,13 (d, 2H), 7,40-7,44 (t, 1H), 7,61-7,63 (m, 1H), 7,70 (s, 1H), 7,99-8,02 (m, 1H). LCMS (ESI) масса/заряд: 312 (M+l).
Пример 28
6-Фтор-3-(3-метил-3-азабицикло[3.1.0]гексан-1-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
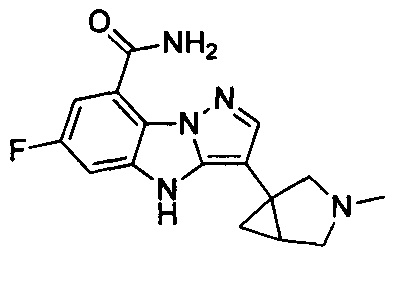
Пример 28А
Этил-1-бензил-2,5-дигидро-1Н-пиррол-3-карбоксилат
К раствору N-бензил-1-метокси-N-((триметилсилил)метил)метанамина (4,5 г, 61 ммоль) и этилпропиолата (5,0 г, 51 ммоль) в DCM (150 мл) по каплям добавляли Et3N (0,4 мл, 5,2 ммоль) при 0°С. После завершения покапельного добавления реакционную смесь перемешивали при 0°С в течение 1 ч, и нагревали до 20°С, и перемешивали в течение 24 ч, а затем гасили насыщенный NaHCO3 (100 мл). Водную фазу экстрагировали с помощью DCM (250 мл ×2). Объединенные органические слои промывали солевым раствором (150 мл ×2) и высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (10 г, выход: 80%) в виде желтого масла. LCMS (ESI) масса/заряд: 232 (М+1).
Пример 28В
Этил-3-бензил-3-азабицикло[3.1.0]гексан-1-карбоксилат
К смеси (CH3)3SOI (21,5 г, 97,7 ммоль) в DMSO (150 мл) частями добавляли 60% NaH (3,5 г, 87,5 ммоль) при 0°С - 5°С в атмосфере N2. После завершения добавления смесь перемешивали при 19°С в течение 2 ч, и после этого к ней частями добавляли раствор примера 28А (9 г, 38,9 ммоль) при 0°С-5°С. Смешанный реакционный раствор перемешивали при 19°С в течение 15 ч, а затем гасили насыщенным NaHCO3 (300 мл). Водную фазу экстрагировали с помощью DCM (500 мл ×2). Объединенные органические слои промывали солевым раствором (200 мл ×2) и высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (5,4 г, выход: 32%) в виде желтого масла. LCMS (ESI) масса/заряд: 246 (М+1).
Пример 28C
3-трет-Бутил-1-этил-3-азабицикло[3.1.0]гексан-1,3-дикарбоксилат
Смесь примера 28B (5,4 г, 22 ммоль), BOC2O (10 г, 46 ммоль) и 10% Pd/C (600 мг) в МеОН (100 мл) гидрогенизировали при 19°С в течение 15 ч в атмосфере Н2 (1 атм). Смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (5,3 г, выход: 94%) в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3) δ ppm 0,83 (t, J=4,96 Гц, 1H), 1,25 (t, J=7,15 Гц, 3H), 1,39-1,48 (m, 9 Н), 1,56 (dd, J=8,34, 4,58 Гц, 1H), 1,79 (s, 1H), 1,94-2,10 (m, 1H), 3,41 (dd, J=10,73, 3,45 Гц, 1H), 3,50-3,82 (m, 3Н), 4,07-4,19 (m, 2Н), 4,25 (d, J-7,15 Гц, 1H), 5,05 (s, 1H), 6,61 (t, J=l,88 Гц, 1H), 7,14 (s, 1H), 7,28-7,38 (m, 1H).
Пример 28D
трет-Бутил-1-(гидроксиметил)-3-азабицикло[3.1.0]гексан-3-карбоксилат
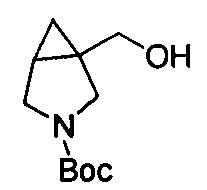
Смесь примера 28С (5,3 г, 20,7 ммоль) и 1H. LiOH (50 мл, 50 ммоль) в THF (25 мл) и МеОН (50 мл) перемешивали при 60°С в течение 2 часов. Смесь охлаждали до комнатной температуры и после этого экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой (50 мл ×2), солевым раствором (50 мл ×2), высушивали над Na2SO4 и выпаривали с получением остатка. Остаток растворяли в THF (100 мл) и к нему по каплям добавляли 10 М BH3-DMS (10 мл, 100 ммоль) при 0°С в атмосфере N2. После завершения покапельного добавления смесь перемешивали при 19°С в течение 15 ч, и после завершения реакции гасили МеОН (100 мл). Раствор выпаривали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (3,5 г, выход: 89%) в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3) δ ppm 0,51 (br.s., 1Н, 0,78 (dd, J=8,09, 5,08 Гц, 1H), 1,37-1,47 (m, 10Н), 3,42 (d, J=10,29 Гц, 2Н, 3,48-3,78 (m, 4Н).
Пример 28Е
трет-Бутил-1-(хлорметил)-3-азабицикло[3.1.0]гексан-3-карбоксилат
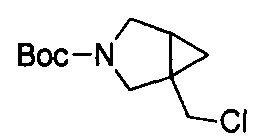
К смеси примера 28D (3,5 г, 16,43 ммоль), DMAP (200 мг, 1,6 ммоль) и Et3N (5 мл, 36,14 ммоль) в DCM (100 мл) частями добавляли TosCl (3,7 г, 19,47 ммоль) при 0°С. После перемешивания при 24°С в течение 15 ч смесь гасили водой (100 мл). Водный слой экстрагировали с помощью DCM (250 мл ×2).
Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (2,6 г, выход: 68%) в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3) δ ppm 0,68 (t, J=4,64 Гц, 1H), 0,90 (dd, J=8,16, 5,27 Гц, 1H), 1,39-1,55 (m, 10 Н), 3,36-3,46 (m, 2Н), 3,48-3,77 (m, 4Н).
Пример 28F
трет-Бутил-1-(цианометил)-3-азабицикло[3.1,0]гексан-3-карбоксилат
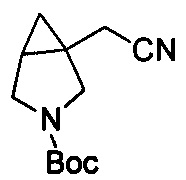
Смесь примера 28Е (2,6 г, 11 ммоль), NaCN (1,57 г, 32 ммоль) и KI (1,87 г, 11 ммоль) в DMSO (40 мл) перемешивали при 100-120°С в течение 2 ч. После охлаждения до комнатной температуры смесь разделяли между EtOAc (200 мл) и водным раствором Na2CO3 (120 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (2,4 г, выход: 96%) в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3) δ ppm 0,47-0,72 (m, 1H), 0,81-0,96 (m, 1H), 1,34-1,55 (m, 10Н), 2,53-2,80 (m, 2Н), 3,30 (d, J=10,54 Гц, 1H), 3,38-3,84 (m, 1H). LCMS (ESI) масса/заряд: 167(M-55).
Пример 28G
трет-Бутил-1-(1-циано-2-(диметиламино)винил)-3-азабицикло[3.1.0]гексан-3-карбоксилат
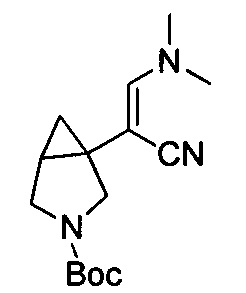
Смесь 1-трет-бутокси-N,N,N',N'-тетраметилметандиамина (3,8 г, 21,8 ммоль) и примера 28F (2,4 г, 10,8 ммоль) в DMF (20 мл) перемешивали при 70°С в течение приблизительно 10 ч. После охлаждения до комнатной температуры из полученной в результате смеси выпаривали растворитель под вакуумом с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 28Н
трет-Бутил-1-(1-циано-2-гидроксивинил)-3-азабицикло[3.1.0]гексан-3-карбоксилат
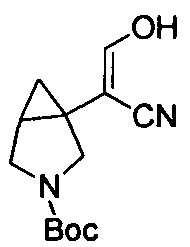
Раствор примера 28G (3,0 г, неочищенный, 10,8 ммоль) в смеси THF/HOAc/вода (1/1/1) (45 мл) перемешивали при 24°С в течение 5 ч После удаления раствора под вакуумом остаток разделяли между насыщенным NaHCO3 (100 мл) и EtOAc (100 мл). Водную фазу экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой (100 мл ×2), солевым раствором (100 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (1,4 г, выход: 52%) в виде желтого масла. LCMS (ESI) масса/заряд: 195 (М-55).
Пример 28I
3-(3-Азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
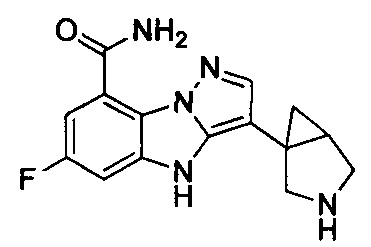
Данный пример получали, как описано в примерах 1E-1J.
Пример 28J
6-Фтор-3-(3-метил-3-азабицикло[3.1.0]гексан-1-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
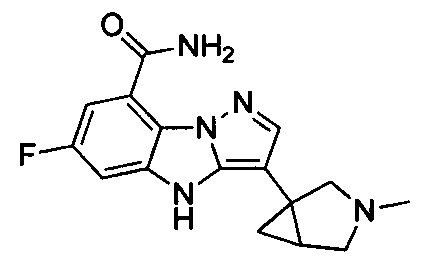
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,32 (d, J=6,40 Гц, 2Н), 2,05 (td, J=6,37, 3,95 Гц, 1H), 2,93 (s, 3Н), 3,47 (d, J=11,04 Гц, 1H), 3,59 (dd, J=11,11, 3,83 Гц, 1H), 3,67-3,76 (m, 1H), 3,85 (d, J=11,04 Гц, 1H), 7,32 (dd, J=8,16, 2,51 Гц, 1H), 7,58 (dd, J=10,79, 2,51 Гц, 1H), 7,77 (s, 1H), 8,52 (s, 1H). LCMS (ESI) масса/заряд: 314 (М+1).
Пример 29
3-(3-Этил-3-азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
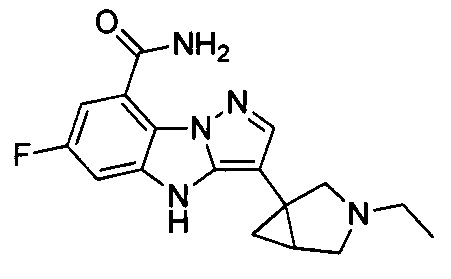
Данный пример получали согласно способу, описанному в примере 28. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,27-1,37 (m, 5Н), 1,95-2,11 (m, 1H), 3,22 (q, J=7,19 Гц, 2Н), 3,41 (d, J-10,92 Гц, 1H), 3,48-3,57 (m, 1H), 3,69 (s, 1H), 3,86 (d, J=10,92 Гц, 1H), 7,33 (dd, J=8,16, 2,51 Гц, 1H), 7,64 (dd, J=10,85, 2,57 Гц, 1H), 7,79 (s, 1H), 8,51 (s, 1H). LCMS (ESI) масса/заряд: 328 (М+1).
Пример 30
3-(3-Циклобутил-3-азабицикло[3.1.0]гексан-1-ил)-6-фтор-4Н- бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
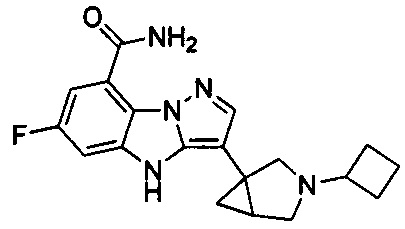
Данный пример получали согласно способу, описанному в примере 28. 1Н-ЯМР (400 МГц, DMSO-d6+D2O) 0,77 (dd, J=7,91, 4,14 Гц, 1H), 1,22 (t, J=4,14 Гц, 1H), 1,51-1,68 (m, 3Н), 1,77-1,96 (m, 4Н), 2,47 (br.s., 2Н), 2,88 (d, J=8,78 Гц, 1H), 2,98-3,13 (m, 2Н), 7,44 (dd, J=8,41, 2,51 Гц, 1H), 7,52 (dd, J=10,98, 2,57 Гц, 1H), 7,71 (s, 1H). LCMS (ESI) масса/заряд: 354 (М+1).
Пример 31
3-(3-(Циклопропилметил)-3-азабицикло[3.1,0]гексан-1-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
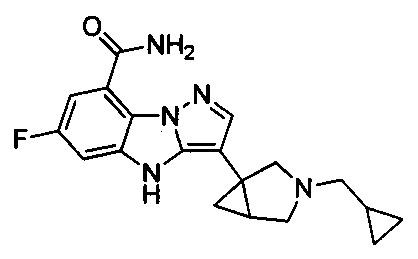
Данный пример получали согласно способу, описанному в примере 28. 1Н ЯМР (400 МГц, метанол-d4) δ ppm 0,32-0,35 (m, 2Н), 0,65-0,68 (m, 2Н), 1,06 (m, 1H), 1,16-1,19 (m, 1H), 1,39-1,42 (t, 1H), 1,92-1,94 (m, 1H), 2,84-2,85 (d, 2Н), 3,18-3,21 (m, 1H), 3,56-3,59 (d, 2Н), 3,73-3,75 (d, 2Н), 7,35-7,39 (dd, 1H), 7,68-7,71 (dd, 1H), 7,78 (s, 1H), 8,55 (s, 1H). LCMS (ESI) масса/заряд: 354 (М+1).
Пример 32
6-Фтор-3-(3-изопропил-3-азабицикло[3.1.0]гексан-1-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
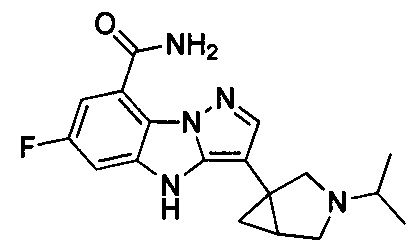
Данный пример получали согласно способу, описанному в примере 28. 1Н-ЯМР (400 МГц, метанол-d4) 1,25-1,43 (m, 8Н), 2,00-2,15 (m, 1H), 3,39 (s, 1H), 3,49 (d, J=11,04 Гц, 1H), 3,62 (d, J=3,89 Гц, 1H), 3,71 (s, 1H), 3,90 (d, J=10,92 Гц, 1H), 7,29-7,40 (m, 1H), 7,64 (dd, J=10,85, 2,57 Гц, 1H), 7,79 (s, 1H), 8,52 (br.s., 1H). LCMS (ESI) масса/заряд: 342 (М+1).
Пример 33
3-(3-Азабицикло[3.1.0]гексан-6-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
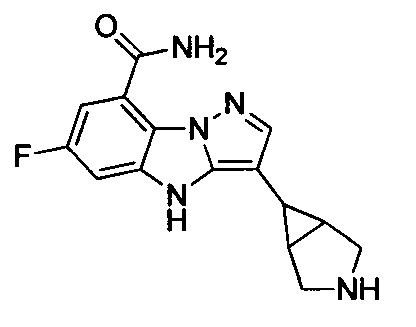
Пример 33А
Этил-5-бензил-4,6-диоксо-1,За,4,5,6,6а-гексагидропирроло[3,4-с]пиразол-3-карбоксилат
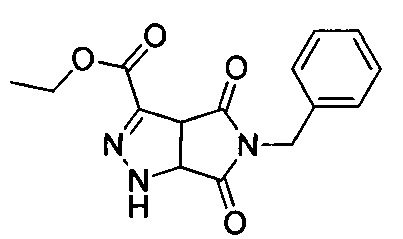
Смесь 1-бензил-1Н-пиррол-2,5-диона (5,0 г, 26,7 ммоль) и 2-пропионилдиазенкарбальдегида (2,9 мл, 28,0 ммоль) в толуоле (30 мл) перемешивали при 30°С в течение 5 ч. После удаления раствора под вакуумом остаток очищали посредством хроматографии на силикагеле с получением титульного соединения (7,67 г, выход 95,4%). LCMS (ESI) масса/заряд: 302 (М+1).
Пример 33В
Этил-3-бензил-2,4-диоксо-3-азабицикло[3.1.0]гексан-6-карбоксилат
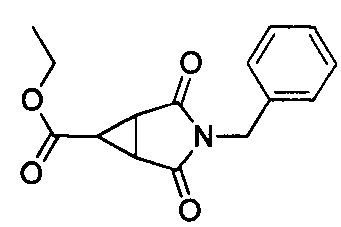
Пример 33А (7,67 г, 25,5 ммоль) нагревали до 190°С в течение 1 часа. Остаток очищали посредством хроматографии с получением титульного соединения (5,353 г, 76,9%) в виде белого твердого вещества. LCMS (ESI) масса/заряд: 274 (М+1).
Пример 33С
(3-Бензил-3-азабицикло[3.1.0]гексан-6-ил)метанол
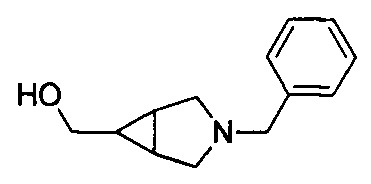
К суспензии LiAlH4 (3,055 г, 80,4 ммоль) в THF (50 мл) по каплям добавляли раствор примера 33В (5,353 г, 19,6 ммоль) в 30 мл THF при 0°С в атмосфере N2. После нагревания с обратным холодильником в течение 16 ч реакционную смесь гасили насыщенным водным раствором Na2SO4 (5 мл). Органический слой высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством хроматографии с получением титульного соединения (1,42 г, 35,8%). LCMS (ESI) масса/заряд: 204 (М+1).
Пример 33D
трет-Бутил-6-(гидроксиметил)-3-азабицикло[3.1.0]гексан-3-карбоксилат
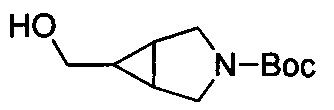
Смесь примера 33С (1,42 г, 7,0 ммоль), Boc2O (1,81 г, 8,4 ммоль) и 10% Pd/С (200 мг) в метаноле (80 мл) гидрогенизировали при 25°С в течение 16 ч в атмосфере Н2 (1 атм). Смесь фильтровали и фильтрат выпаривали с получением остатка, который очищали посредством хроматографии с получением титульного соединения 4 (1,14 г, 76%). LCMS (ESI) масса/заряд: 214 (М+1).
Пример 33Е
3-(3-Азабицикло[3.1.0]гексан-6-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
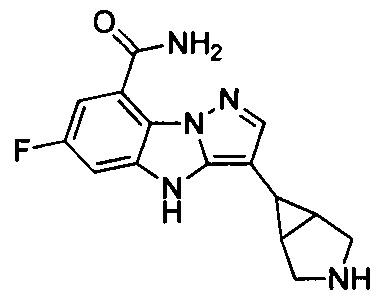
Данный пример получали, как описано в примерах 1E-1J. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,86-1,95 (m, 1H), 2,12-2,22 (m, 2Н), 3,49-3,65 (m, 4Н), 7,34-7,42 (m, 1H), 7,64-7,74 (m, 2Н), 8,42-8,61 (m, 1H). LCMS (ESI) масса/заряд: 300 (М+1).
Пример 34
3-(3-Этил-3-азабицикло[3.1.0]гексан-6-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
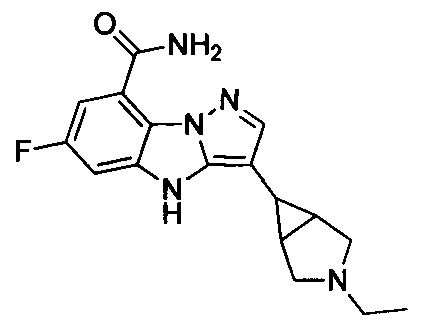
Данный пример получали согласно способу, описанному в примере 28. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,26 (s, 3Н), 1,95-2,02 (m, 2Н), 2,11-2,18 (m, 1H), 2,85-2,95 (m, 2Н), 2,96-3,08 (m, 2Н), 3,42-3,58 (m, 2Н), 7,30-7,38 (m, 1H), 7,60-7,65 (m, 1H), 7,65-7,70 (m, 1H). LCMS (ESI) масса/заряд: 328 (М+1).
Пример 35
3-(8-Этил-8-азабицикло[3.2.1]октан-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
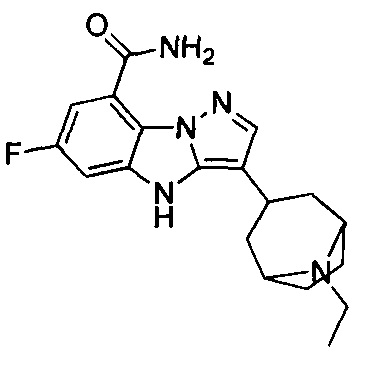
Пример 35А
трет-Бутил-3-циано-8-азабицикло[3.2.1]октан-8-карбоксилат
К смеси трет-бутил-3-оксо-8-азабицикло[3.2.1]октан-8-карбоксилата (10 г, 44,389 ммоль) в DME (300 мл) и EtOH (6,7 мл) частями добавляли трет-BuOK (20 г, 177,557 ммоль) и TOSMIC (17,33 г, 88,778 ммоль) при 0°С в атмосфере N2. После перемешивания при 60°С в течение 16 ч полученную в результате смесь гасили водой (100 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (6,08 г, выход: 57,96%) в виде белого твердого вещества. LCMS (ESI) масса/заряд: 327 (М+1).
Пример 35В
8-(трет-бутоксикарбонил)-8-азабицикло[3.2.1]октан-3-карбоновая кислота
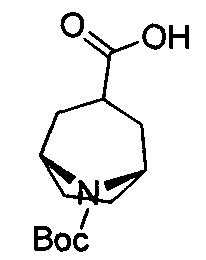
Раствор примера 35А (6,58 г, 27,845 ммоль) и KОН (9,36 г, 167,069 ммоль) в смеси EtOH/H2O (1:1, 200 мл) перемешивали при 80°С в течение 4 ч. Полученную в результате смесь разводили водой (100 мл) и водную фазу доводили до рН 3-4 с помощью 2 н. HCl, и после этого экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения в виде белого твердого вещества, которое применяли непосредственно на следующей стадии без дополнительной очистки (6,01 г, выход: 84,53%).
Пример 35С
трет-Бутил-3-(гидроксиметил)-8-азабицикло[3.2.11октан-8-карбоксилат
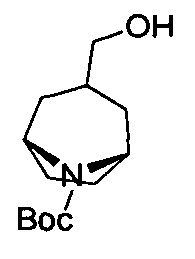
К раствору примера 35В (6 г, 23,529 ммоль) в THF (60 мл) добавляли BH3-DMS при 0°С в атмосфере N2. После перемешивания смеси при 25°С в течение 16 ч добавляли МеОН (100 мл) для ее гашения. Полученную в результате смесь выпаривали, и остаток очищали посредством колоночной хроматографии с получением титульного соединения (5,2 г, выход: 92,69%). LCMS (ESI) масса/заряд: 242 (М+1).
Пример 35D
3-(8-Этил-8-азабицикло[3.2.1]октан-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
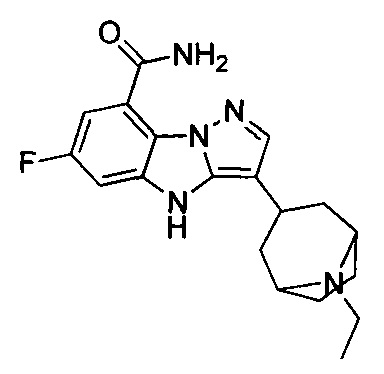
Данный пример получали, как описано в примерах 1E-1J и 2. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,42-1,45 (t, 3Н), 2,18-2,36 (m, 8 Н), 3,16-3,18 (m, 2Н), 3,36-3,42 (m, 1H), 4,13 (s, 2Н), 7,36-7,37 (dd, 1H), 7,61-7,66 (dd, 1H), 7,68 (s, 1H), 8,62 (bs, 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 36
6-Фтор-3-(4-гидроксипирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
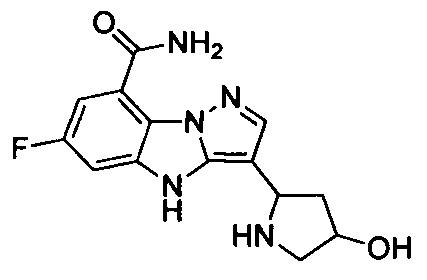
Пример 36А
1-(трет-Бутил) 2-метил-4-((трет-бутилдифенилсилил)окси)пирролидин-1,2-дикарбоксилат
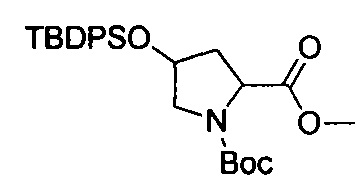
К смеси 1-трет-бутил-2-метил-4-гидроксипирролидин-1,2-дикарбоксилата (2 г, 8,13 ммоль), имидазола (1,1 г, 16,26 ммоль) в безводном DCM (50 мл) частями добавляли TBDPSC1 (2,68 г, 9,76 ммоль) при 0°С в атмосфере N2. После перемешивания при 15°С в течение 4 часов реакционную смесь промывали водой (10 мл ×2) и высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (3,9 г, выход: 99%) в виде бесцветного масла, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 36В
1-(трет-бутоксикарбонил)-4-((трет-бутилдифенилсилил)окси)пирролидин-2-карбоновая кислота
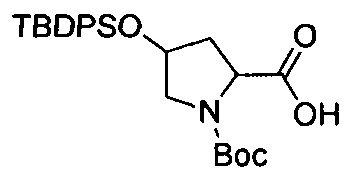
Смесь примера 36А (3,9 г, 8,1 ммоль) и LiOH (1 г, 24,2 ммоль) в смешанном растворе H2O (20 мл), МеОН (5 мл) и THF (20 мл) перемешивали при 15°С в течение 16 ч. Смесь разводили водой (50 мл) и доводили до рН 4-5 с помощью 1н. HCl, и водный слой экстрагировали с помощью EtOAc (50 мл ×3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (3,7 г, выход: 97%), которое применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 36С
трет-Бутил-4-((трет-утилдифенилсилил)окси)-2-(гидроксиметил)пирролидин-1-карбоксилат
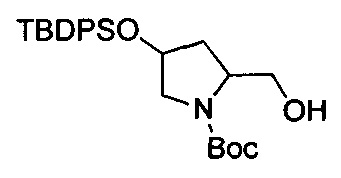
К смеси примера 36В (3,7 г, 7,89 ммоль), Et3N (2,2 г, 15,8 ммоль) в THF (100 мл) добавляли изопропилхлорформиат (1,2 г, 9,5 ммоль) при 0°С в атмосфере N2. После перемешивания при 15°С в течение 4 ч смесь охлаждали до 0°С и к ней добавляли NaBH4 (1,2 г, 31,56 ммоль). Реакционную смесь перемешивали при 15°С в течение 64 часов. После удаления раствора под вакуумом остаток разделяли между водой (50 мл) и DCM (50 мл). Водный слой экстрагировали с помощью DCM (50 мл ×2). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (3,5 г, выход: 100%). LCMS (ESI) масса/заряд: 456 (М+1).
Пример 36D
трет-Бутил-4-((трет-бутилдифенилсилил)окси)-2-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пирролидин-1-карбоксилат
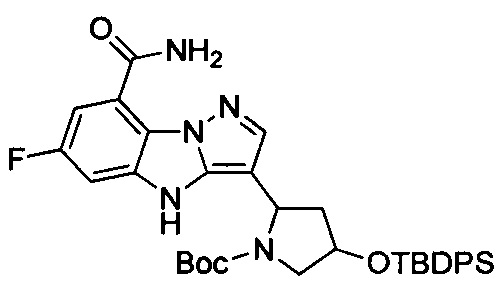
Данный пример получали, как описано в примерах 1E-1J. LCMS (ESI) масса/заряд: 642 (М+1).
Пример 36Е
6-Фтор-3-(4-гидроксипирролидин-2-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
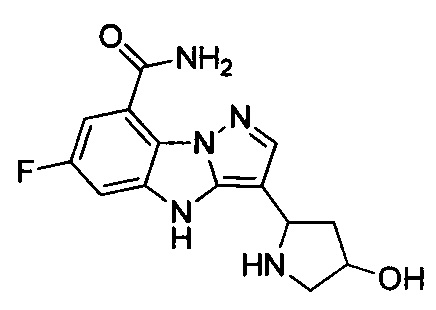
Смесь примера 36D (50 мг, 0,078 ммоль) в HBr/НОАс (0,5 мл) перемешивали при 15°С в течение 6 часов. Полученную в результате смесь выпаривали, и остаток очищали посредством препаративной HPLC с получением титульного соединения (10 мг, выход: 43%). 1Н ЯМР (400 МГц, DMSO-d6)=8,36 (br.s., 1H), 8,06-7,86 (m, 1H), 7,53 (d, J=9,9 Гц, 2Н), 4,91 (dd, J=6,l, 11,5 Гц, 1H), 4,56 (br.s., 1H), 3,45 (d, J=8,8 Гц, 1H), 3,06 (d, J=12,7 Гц, 1H), 2,48-2,41 (m, 1H), 2,21 (dd, J=5,8, 13,0 Гц, 1Н). LCMS (ESI) масса/заряд: 304 (М+1).
Пример 37
3-Циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
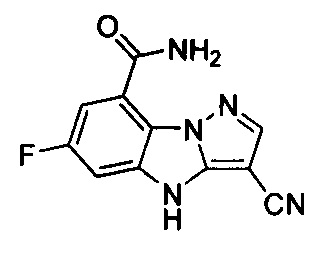
Пример 37А
5-Амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-карбонитрил
Смесь примера 1D (4 г, 14 ммоль) и 2-(этоксиметилен)малононитрила (2,24 г, 18,31 ммоль) в EtOH (30 мл) перемешивали при 80°С в течение 1,5 ч. Смесь выпаривали под вакуумом с получением титульного соединения (2,8 г, 56%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 37В
8-Бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбонитрил
Смесь примера 37А (2,8 г, 7,78 ммоль), N1,N2-диметилэтан-1,2-диамина (68 мг, 0,777 ммоль), CuI (148 мг, 0,777 ммоль) и K3PO4 (1,65 г, 7,78 ммоль) в DMF (30 мл) перемешивали при 60°С в течение 24 ч в атмосфере N2. Смесь охлаждали до комнатной температуры и фильтровали, и фильтрат выпаривали с получением остатка, который промывали с помощью МеОН и воды, а затем высушивали под вакуумом с получением титульного соединения (1,7 г, 78%), которое применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 37С
Метил-3-циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксилат
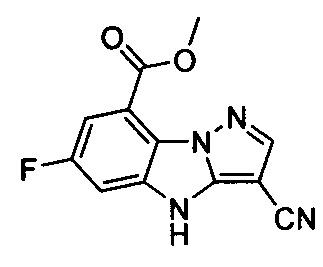
Раствор примера 37В (1 г, 3,58 ммоль), Pd(OAc)2 (161 мг, 0,72 ммоль), Pd(dppf)Cl2 (526 мг, 0,72 ммоль), ксантфоса (420 мг, 0,72 ммоль), DPPP (296 мг, 0,72 ммоль), PPh3 (188 мг, 0,72 ммоль) и Et3N (1,8 г, 18 ммоль) в DMF (30 мл) и МеОН (10 мл) перемешивали при 120°С в течение 12 ч в атмосфере СО (3 МПа). После охлаждения до комнатной температуры смесь фильтровали, и фильтрат выпаривали с получением остатка, который промывали с помощью DCM и высушивали. Полученное в результате титульное соединение (0,5 г, 54%) применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 37D
3-Циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
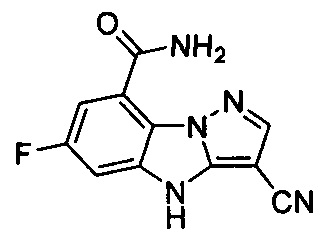
Смесь примера 37С (20 мг, 0,077 ммоль) и NH4OH (5 мл) в DMF (1 мл) и МеОН (1 мл) перемешивали при 120°С в течение 4 ч. После удаления раствора под вакуумом полученный в результате остаток очищали посредством препаративной HPLC с получением титульного соединения (2,99 мг, 16%). 1Н-ЯМР (400 МГц, MeOD-d4) δ ppm 7,52 (dd, J=7,91 Гц,1H), 7,80 (dd, J=10,67 Гц, 1H), 8,19 (s, 1H). LCMS (ESI) масса/заряд: 244 (М+1).
Пример 38
3-Циано-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
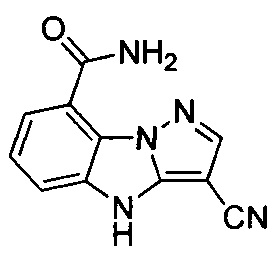
Данный пример получали, как описано в примере 37. 1Н ЯМР (400 МГц, D2O) δ ppm 7,54-7,58 (t, 1Н), 7,75-7,77 (d, 1H), 8,10-8,12 (d, 1H), 8,23 (S, 1H). LCMS (ESI) масса/заряд: 226 (M+1).
Пример 39
3-(Аминометил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
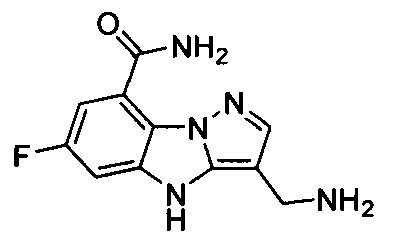
К смеси примера 37D (100 мг, 0,4 ммоль) в DCM (20 мл) и МеОН (50 мл) частями добавляли NiCl2-6H2O (200 мг, 0,8 ммоль) и NaBH4 (47 мг, 1,2 ммоль). После перемешивания при 0°С в течение 5 мин реакционную смесь выпаривали с получением остатка, который очищали посредством препаративной HPLC с получением титульного соединения (45 мг, 45%). 1Н ЯМР (400 МГц, D2O) ppm 4,2 (S, 2Н), 7,269-7,318 (t, 2Н), 7,796 (S, 1H), 8,399(S, 1H). LCMS (ESI) масса/заряд: 248 (М+1).
Пример 40
3-(Циклопропанкарбоксамидометил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
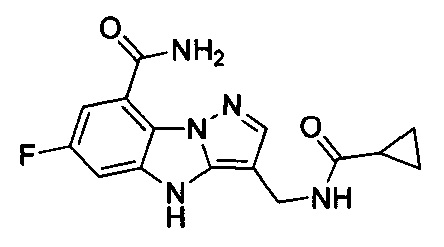
Смесь примера 39 (20 мг, 0,081 ммоль), циклопропанкарбоновой кислоты (8,36 мг, 0,098 ммоль), HOBt (13,12 мг, 0,0979 ммоль), EDCI (18,61 мг, 0,097 ммоль) и Et3N (25 мг, 0,242 ммоль) в DMF (5 мл) перемешивали при 30°С в течение 6 ч. После удаления раствора под вакуумом остаток очищали посредством препаративной HPLC с получением титульного соединения (11,9 мг, 48%). 1Н ЯМР (400 МГц, DMSO-d6) δ ppm 0,64-0,72 (m, 4Н), 1,52-1,57 (m, 1H), 4,25-2,50 (d, 2Н), 7,57-7,61 (m, 2Н), 7,82 (s, 1H), 8,13 (s, 1H), 8,44-8,46 (t, 1H), 10,46 (s, 1H), 11,93 (br, 1H). LCMS (ESI) масса/заряд: 316 (М+1).
Схема В
Пример 41
6-Фтор-3-(4-фторфенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
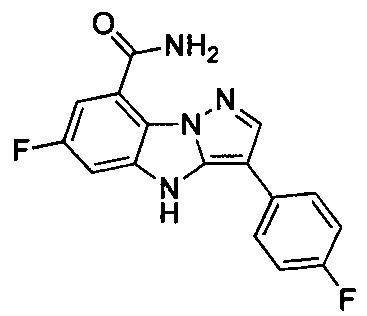
Пример 41А
Этил-5-амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-карбоксилат
Смесь примера 1D (5 г, 17,61 ммоль) и этил-2-циано-3-этоксиакрилата (2,98 г, 17,61 ммоль) в EtOH (100 мл) перемешивали при 78°С в течение 16 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (2,7 г, выход: 38%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 41В
Этил-8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбоксилат
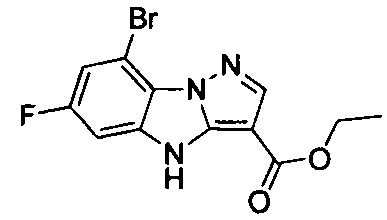
Смесь примера 41А (2,7 г, 6,63 ммоль), CuI (252 мг, 1,33 ммоль), N1,N2-диметилэтан-1,2-диамина (233,9 мг, 2,65 ммоль) и K3PO4 (4,22 г, 19,9 ммоль) в DMF (60 мл) перемешивали при 70°С в течение 16 часов в атмосфере N2. После охлаждения до комнатной температуры смесь фильтровали, и растворитель выпаривали под вакуумом. Полученный в результате остаток (2,16 г) можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 41С
8-Бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбоновая кислота
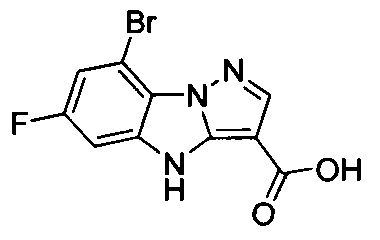
Смесь примера 41В (2,16 г, 6,62 ммоль) и NaOH (1,06 г, 26,49 ммоль) в МеОН (40 мл) и H2O (10 мл) перемешивали при 70°С в течение 16 ч. После выпаривания растворителя полученный в результате остаток можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 41D
8-Бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол
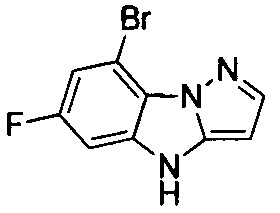
Раствор примера 41С (1,97 г, 6,61 ммоль) в смеси концентрированной HCl (20 мл) и Н2O (20 мл) перемешивали при 80°С в течение 16 ч. После нейтрализации с помощью концентрированного NH4OH полученную в результате смесь фильтровали. Осадок промывали с помощью МеОН и высушивали под вакуумом. Полученное твердое вещество (1,58 г) можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 41Е
8-Бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол
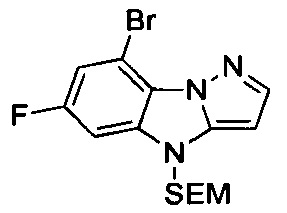
К раствору NaH (0,746 г, 18,66 ммоль) в THF (10 мл) добавляли раствор примера 41D (1,58 г, 6,22 ммоль) в THF (20 мл) при 0°С в атмосфере N2. Смесь перемешивали при 0°С в течение 0,5 ч, и после этого к ней добавляли SEMCl (1,56 г, 9,33 ммоль). Смесь перемешивали при 0°С в течение еще 1 ч, а затем гасили водой (20 мл). Водный слой экстрагировали с помощью DCM (20 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,43 г, выход: 17% за 4 стадии). LCMS (ESI) масса/заряд: 384, 386 (М, М+2).
Пример 41F
Метил-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксилат
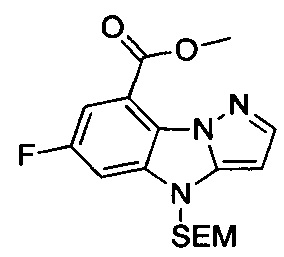
Смесь примера 41Е (0,43 г, 1,12 ммоль), Pd(OAc)2 (50 мг, 0,233 ммоль), Pd(dppf)Cl2 (164 мг, 0,233 ммоль), ксантфоса (194 мг, 0,335 ммоль), DPPP (138 мг, 0,335 ммоль), PPh3 (88 мг, 0,335 ммоль) и Et3N (566 мг, 5,59 ммоль) в DMF (10 мл) и МеОН (10 мл) перемешивали при 80°С в течение 24 ч в атмосфере СО (3 атм). После охлаждения до комнатной температуры смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,265 г, выход: 63%). LCMS (ESI) масса/заряд: 364 (М+1).
Пример 41G
Метил-3-бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксилат
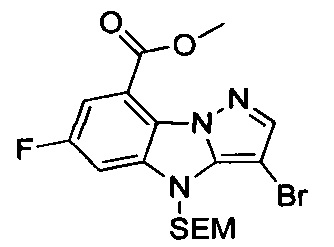
Смесь примера 41F (0,265 г, 729 ммоль) и NBS (117 мг, 656 ммоль) в DCM (20 мл) перемешивали при 10°С в течение 20 мин. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,24 г, выход: 75%). LCMS (ESI) масса/заряд: 442, 444 (М, М+2).
Пример 41Н
3-Бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоновая кислота
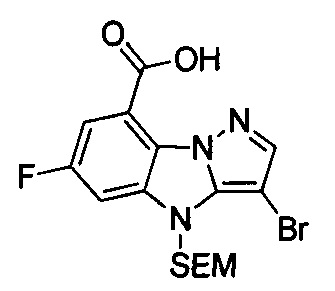
Смесь примера 41G (240 мг, 0,542 ммоль) и NaOH (108 мг, 2,71 ммоль) в МеОН (6 мл) и H2O (1,5 мл) перемешивали при 60°С в течение 0,5 ч. После охлаждения до комнатной температуры смесь доводили до рН 4 с помощью 1н. HCl, и водную фазу экстрагировали с помощью EtOAc (20 мл ×3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4 и выпаривали с получением титульного соединения (196 мг, выход: 84%), которое применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 41I
3-Бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
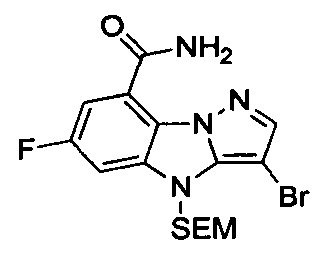
Смесь примера 41Н (0,196 г, 0,46 ммоль), HATU (0,226 мг, 0,595 ммоль), (NH4)2CO3 (0,439 г, 4,6 ммоль) и Et3N (0,138 г, 1,37 ммоль) в DMF (8 мл) перемешивали при 40°С в течение 16 ч в атмосфере N2. После удаления раствора под вакуумом остаток разводили водой (10 мл). Водный слой экстрагировали с помощью EtOAc (15 мл ×3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4 и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,125 г, выход: 64%). LCMS (ESI) масса/заряд: 427, 429 (М, М+2).
Пример 41J
6-Фтор-3-(4-фторфенил)-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
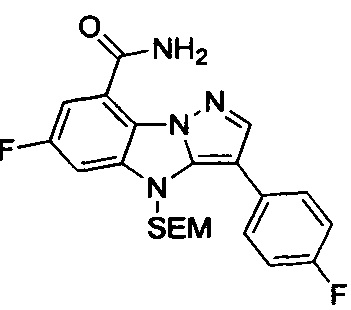
Смесь примера 41I (50 мг, 0,117 ммоль), Pd (dppf)Cl2 (17 мг, 0,023 ммоль), Na2CO3 (31 мг, 0,292 ммоль) и (4-фторфенил)бориновой кислоты (24 мг, 0,175 ммоль) в DMF (3 мл) и H2O (0,5 мл) перемешивали при 100°С в течение 16 ч в атмосфере N2. После удаления раствора под вакуумом остаток разводили водой (10 мл). Водный слой экстрагировали с помощью EtOAc (10 мл ×3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством препаративной TLC с получением титульного соединения (40 мг, выход: 77%). LCMS (ESI) масса/заряд: 443 (М+1).
Пример 41K
6-Фтор-3-(4-фторфенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
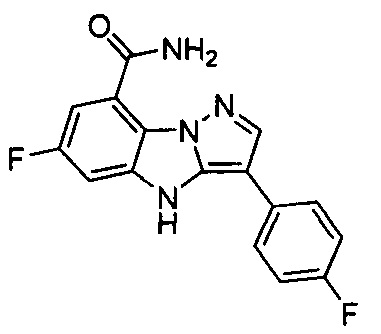
Смесь примера 41J (40 мг, 0,090 ммоль) в TFA (0,5 мл) и DCM (0,5 мл) перемешивали при 10°С в течение 5 ч. После удаления раствора под вакуумом к остатку добавляли МеОН (3 мл) и K2CO3 (0,037 г, 0,271 ммоль). Смесь перемешивали при 10°С в течение 2 ч. Смесь фильтровали и растворитель выпаривали под вакуумом. Остаток очищали посредством препаративной HPLC с получением титульного соединения (6,3 мг, выход: 24%). 1Н ЯМР (400 МГц, DMSO-d6) δ: 8,32 (s, 1H), 7,67-7,71 (m, 2Н), 7,59-7,61 (d, 1H), 7,55-7,57 (d, 1H), 7,22-7,27 (t, 2Н). LCMS (ESI) масса/заряд: 313 (М+1).
Пример 42
6-Фтор-3-(2-фтор-4-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
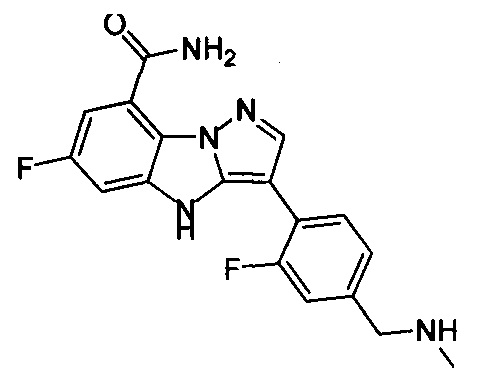
Пример 42А
1-(4-Бром-3-фторфенил)-N-метилметанамин
Смесь 4-бром-3-фторбензальдегида (2 г, 9,8 ммоль) и метанамина (30-40% в EtOH) (10 мл, 16,7 ммоль) в EtOH (10 мл) перемешивали при 75°С в течение 15 ч. Смесь охлаждали до комнатной температуры, а затем к ней добавляли NaBH4 (745 мг, 19,6 ммоль) одной порцией и перемешивали в течение еще 30 мин. После удаления раствора под вакуумом остаток разводили насыщенным NaHCO3 (20 мл). Водный слой экстрагировали с помощью EtOAc (50 мл ×3). Объединенные органические слои промывали водой (50 мл), солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (1,47 г, выход: 74%). LCMS (ESI) масса/заряд: 218, 220 (М, М+2).
Пример 42В
трет-Бутил-(4-бром-3-фторбензил)(метил)карбамат
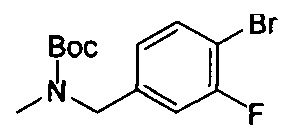
Смесь примера 42А (1,47 г, 6,77 ммоль), Boc2O (1,77 г, 8,12 ммоль) и Et3N (1,37 г, 13,54 ммоль) в DCM (15 мл) перемешивали при 18°С в течение 2 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (1,83 г, выход: 85%). LCMS (ESI) масса/заряд: 319 (М+1).
Пример 42С
трет-Бутил-(3-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)(метил)карбамат
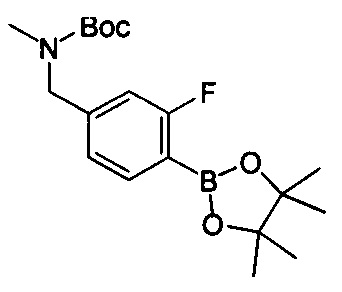
Смесь 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (1,76 г, 6,92 ммоль), примера 42В (1,83 г, 5,77 ммоль), KOAc (1,13 г, 11,54 ммоль) и Pd(dppf)Cl2 (422 мг, 0,577 ммоль) в DMSO (15 мл) перемешивали при 80°С в течение 15 ч в атмосфере N2. После охлаждения до комнатной температуры смесь фильтровали, и фильтрат разводили водой (20 мл). Водный слой экстрагировали с помощью EtOAc (50 мл ×2). Объединенные органические слои промывали водой (30 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (2 г, выход: 95%) в виде бесцветных масел.
Пример 42D
трет-Бутил-(4-(8-карбамоил-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-3-фторбензил)(метил)карбамат
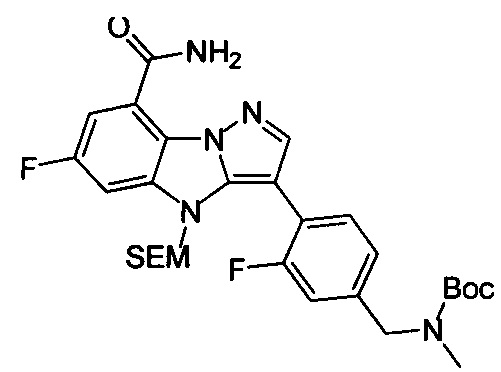
Смесь примера 41I (100 мг, 0,23 ммоль), примера 42С (85,7 мг, 0,23 ммоль), Na2CO3 (50 мг, 0,47 ммоль) и Pd(dppf)Cl2 (17,1 мг, 0,023 ммоль) в DMF (5 мл) и H2O (1 мл) перемешивали при 80°С в течение 15 ч в атмосфере N2. После охлаждения до комнатной температуры смесь фильтровали, и фильтрат разводили водой (20 мл). Водный слой экстрагировали с помощью EtOAc (50 мл ×2). Объединенные органические слои промывали водой (30 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством препаративной TLC с получением титульного соединения (110 мг, выход: 97%). LCMS (ESI) масса/заряд: 586 (М+1).
Пример 42Е
6-Фтор-3-(2-фтор-4-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
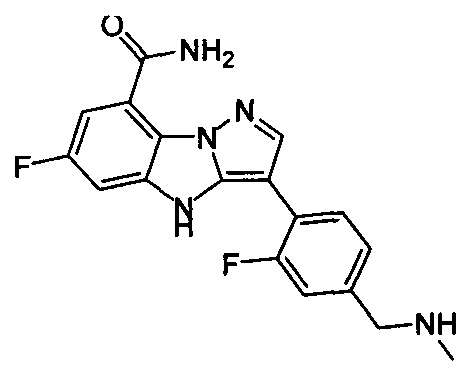
Смесь примера 42D (110 мг, 0,19 ммоль) в TFA (5 мл) и DCM (5 мл) перемешивали при 10°С в течение 15 ч. После удаления раствора под вакуумом к остатку добавляли МеОН (15 мл) и K2CO3 (53 мг, 0,38 ммоль). Смесь перемешивали при 18°С в течение 15 ч. Смесь фильтровали и фильтрат выпаривали. Остаток разделяли между водой (10 мл) и EtOAc (10 мл). Водный слой экстрагировали с помощью EtOAc/THF=3/l (20 мл ×2). Объединенные органические слои промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством препаративной HPLC с получением титульного соединения (22,45 мг, выход: 34%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, метанол-d4) ppm 2,79 (s, 3Н), 4,24 (s, 2Н), 4,48-5,29 (m, 27 Н), 7,37-7,43 (m, 2Н), 7,52 (d, J=7,78 Гц, 1H), 7,72 (d, J=9,79 Гц, 1H), 7,78 (t, J=7,78 Гц, 1H), 8,23 (s, 1H), 8,49 (br.s., 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 43
6-Фтор-3-(4-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
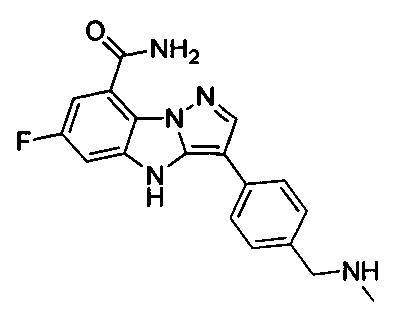
Данный пример получали согласно способу, описанному в примере 42. 1Н-ЯМР (400 МГц, метанол-d4+D2O) 2,77 (s, 3Н), 4,21 (s, 2Н), 7,46-7,62 (m, 3Н), 7,75 (d, J=8,16 Гц, 3Н), 8,26 (s, 1H), 8,53 (br.s., 1H). LCMS (ESI) масса/заряд: 338 (М+1).
Пример 44
6-Фтор-3-(2-фтор-5-((метиламино)метил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
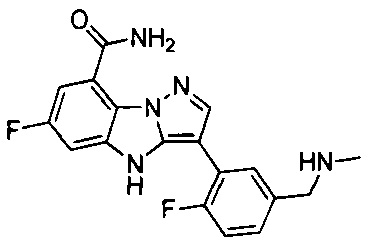
Данный пример получали согласно способу, описанному в примере 42. 1Н-ЯМР (400 МГц, DMSO-d6+D2O) 2,59 (br.s., 3Н), 4,13 (br.s., 2Н), 7,15-7,41 (m, 2Н), 7,47-7,68 (m, 2Н), 7,95-8,09 (m, 1H), 8,16-8,27 (m, 1H), 8,36 (br.s., 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 45
6-Фтор-3-(пиридин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
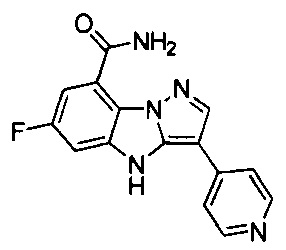
Данный пример получали согласно способу, описанному в примере 42. 1Н-ЯМР (MeOD, 400 МГц) δ: 7,55-7,63 (m, 2Н), 7,73-7,79 (m, 1H), 8,11-8,14 (m, 1H), 8,15-8,19 (m, 1H), 8,48-8,54 (m, 2Н), 8,55-8,59 (m, 1H), 10,28-10,36 (m, 1H). LCMS (ESI) масса/заряд: 296 (М+1).
Пример 46
6-Фтор-3-(4-(пиперидин-3-ил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
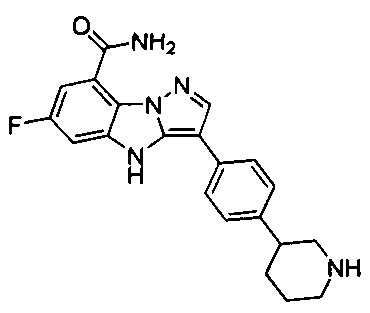
Пример 46А
трет-Бутил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперидин-1-карбоксилат
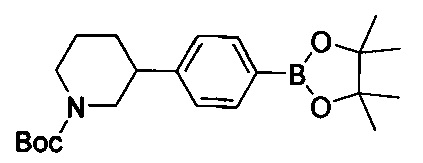
Смесь трет-Бутил-3-(4-аминофенил)пиперидин-1-карбоксилата (0,1 г, 0,362 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (0,101 г, 0,398 ммоль), ВРО (1,75 г, 0,00724 ммоль) и трет-BuONO (0,056 г, 0,542 ммоль) в ацетонитриле (3 мл) перемешивали при 10°С в течение 16 ч в атмосфере N2. Растворитель выпаривали под вакуумом и остаток очищали посредством препаративной TLC с получением титульного соединения (0,095 г, выход: 68%).
Пример 46В
6-Фтор-3-(4-(пиперидин-3-ил)фенил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
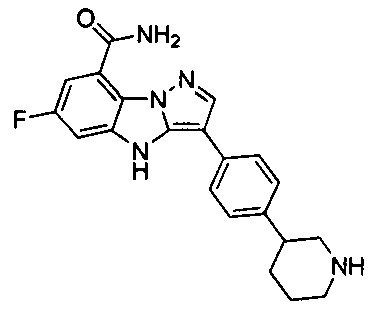
Данный пример получали согласно способу, описанному в примере 42. 1Н ЯМР (300 МГц, метанол-d4) ppm 1,189 (m, 2Н), 2,10-2,01 (m, 2Н), 3,03-3,14 (m, 3Н), 3,45-3,49 (m, 2H), 7,37-7,40 (d, 2H), 7,44-7,47 (dd, 1H), 7,66-7,68 (d, 2H), 7,74-7,79 (dd, 1H), 8,22 (s, 1H), 8,53 (s, 1H). LCMS (ESI) масса/заряд: 378 (М+1).
Пример 47
6-Фтор-3-(тетрагидро-2Н-пиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
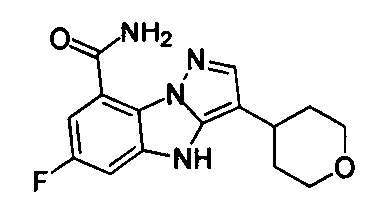
Пример 47А
3.6-Дигидро-2Н-пиран-4-илтрифторметансульфонат
К раствору дигидро-2Н-пиран-4(3Н)-она (1,8 г, 18,0 моль) в THF (20 мл) добавляли LiHMDS (1 М, 21,6 мл, 21,6 ммоль) при -78°С в атмосфере N2. После перемешивания в течение 1 ч при -78°С частями добавляли (CF3SO2)2NPh (6,4 г, 18,0 ммоль). Смесь перемешивали при 15°С в течение 16 ч и гасили водн. раствором NH4Cl (20 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде бесцветного масла (1,5 г, выход: 35,7%). LCMS (ESI) масса/заряд: 233 (М+1).
Пример 47В
2-(3,6-Дигидро-2Н-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
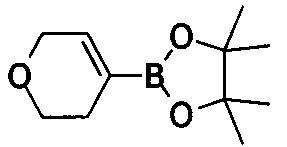
Данный пример получали согласно способу, описанному в примере 42С.
Пример 47С
6-Фтор-3-(тетрагидро-2Н-пиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
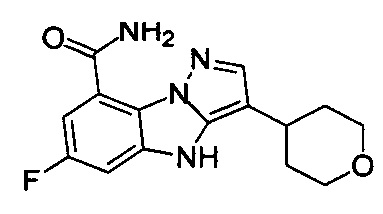
Данный пример получали согласно способу, описанному в примере 46В. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,82-2,03 (m, 4Н), 2,93-3,04 (m, 1H), 3,62 (td, J=11,70, 2,45 Гц, 2Н), 4,04-4,11 (m, 2Н), 7,32-7,39 (m, 1H), 7,66-7,75 (m, 2Н), 8,51-8,55 (m, 1H). LCMS (ESI) масса/заряд: 303 (М+1).
Пример 48
3-(4-(Диметиламино)циклогексил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
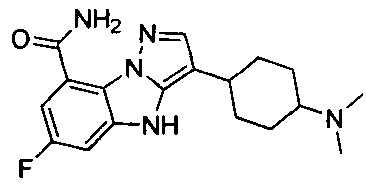
Пример 48А
4-((Трет-бутоксикарбонил)амино)циклогекс-1-ен-1-ил-трифторметансульфонат
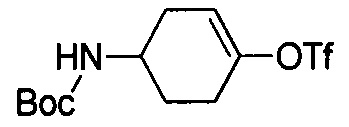
К раствору трет-Бутил-(4-оксоциклогексил)карбамата (1 г, 4,689 моль) в THF (20 мл) по каплям добавляли LiHMDS (1 М, 9,4 мл, 9,378 ммоль) при -78°С в атмосфере N2. После перемешивания при -78°С в течение 1 ч добавляли раствор (CF3SO2)2NPh (1,84 г, 5,158 ммоль) в THF (5 мл). Смесь перемешивали при 15°С в течение 16 ч, а затем гасили водн. раствором NH4Cl (20 мл). Водный слой экстрагировали с помощью EtOAc (20 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением титульного соединения в виде белого твердого вещества (1,16 г, выход: 71,60%). LCMS (ESI) масса/заряд: 347 (М+1).
Пример 48В
трет-Бутил-(4-(4.4,5.5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-3-ен-1-ил)карбамат
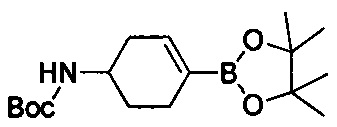
Данный пример получали согласно способу, описанному в примере 47В.
Пример 48С
3-(4-Диметиламино)циклогексил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
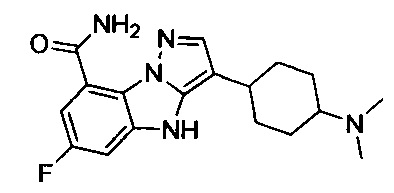
Данный пример получали согласно способам, описанным в примере 47С и примере 2. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,63-1,87 (m, 3Н), 1,91-2,10 (m, 2Н), 2,20-2,46 (m, 3Н), 2,81 (s, 4Н), 2,90 (s, 3Н), 3,19-3,30 (m, 1Н), 7,34-7,44 (m, 1H), 7,64-7,75 (m, 2Н), 7,78-7,85 (m, 1Н), 8,38-8,73 (m, 3Н). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 49
6-Фтор-3-(4-метилпиперазин-1-карбонил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
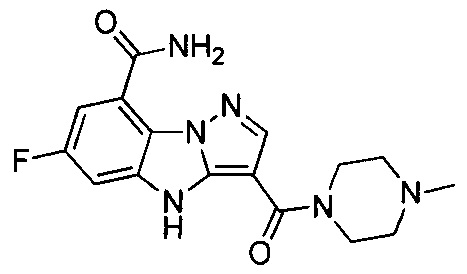
Пример 49А
Этил-8-бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбоксилат
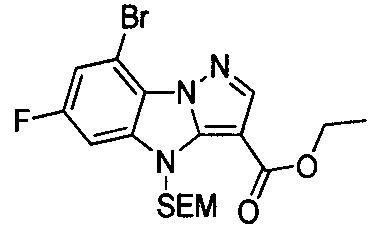
К раствору примера 41В (3,2 г, 9,812 моль) в THF (50 мл) частями добавляли NaH (785 мг, 19,625 ммоль) при 0°С в атмосфере N2. После перемешивания при 15°С в течение 0,5 ч и охлаждения до 0°С к нему по каплям добавляли SEMC1 (3,3 г, 19,625 ммоль). Смесь перемешивали при 15°С в течение еще 16 ч, а затем гасили насыщенным водн. раствором NH4Cl (30 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×3). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4 и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде желтого твердого вещества (2,16 г, выход: 48,21%). LCMS (ESI) масса/заряд: 456, 458 (М, М+2).
Пример 49В
8-Бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбоновая кислота
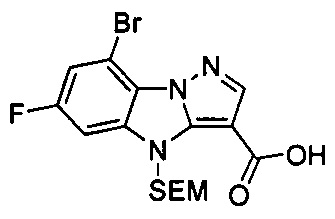
Смесь примера 49А (2,16 г, 4,726 ммоль) и NaOH (950 мг, 23,632 ммоль) в смешанном растворителе МеОН/H2O (2:1) (30 мл) перемешивали при 80°С в течение 16 ч Полученную в результате смесь доводили до рН 3-4 с помощью 1н. НСl. Водный слой экстрагировали с помощью EtOAc (30 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4 и выпаривали с получением титульного соединения (1,73 г, выход: 85,22%) которое можно было применять на следующей стадии без дополнительной очистки.
Пример 49С
трет-Бутил-4-(8-бром-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбонил)пиперазин-1-карбоксилат
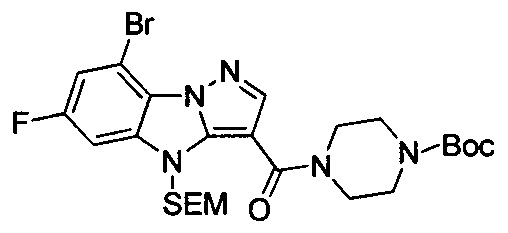
Смесь трет-бутил-пиперазин-1-карбоксилата (415 мг, 2,241 ммоль), примера 49В (800 мг, 1,868 ммоль), HATU (1,42 г, 3,735 ммоль) и Et3N (567 мг, 5,603 ммоль) в DMF (15 мл) перемешивали при 15°С в течение 16 ч в атмосфере N2. Смесь гасили с помощью Н2O (10 мл). Водный слой экстрагировали с помощью EtOAc (20 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4 и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (1 г, выход: 90%). LCMS (ESI) масса/заряд: 596, 598 (М, М+2).
Пример 49D
трет-Бутил-4-(8-циано-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбонил)пиперазин-1-карбоксилат
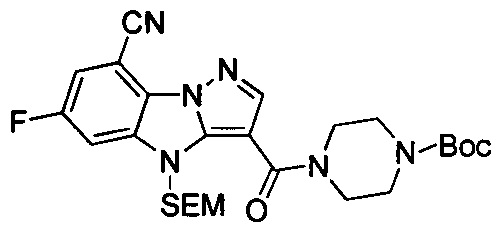
Смесь примера 49С (400 мг, 0,671 ммоль), Zn (87 мг, 1,341 ммоль), Zn(CN)2 (158 мг, 1,341 ммоль), DPPF (75 мг, 0,134 ммоль) и Pd2(DBA)3 (61 мг, 0,0671 ммоль) в DMF (10 мл) перемешивали при 120°С в атмосфере N2 в течение 10 часов. После охлаждения до комнатной температуры полученную в результате смесь разводили водой (20 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×3). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (350 мг, выход: 96,15%). LCMS (ESI) масса/заряд: 543 (М+1).
Пример 49Е
трет-Бутил-4-(8-карбамоил-6-фтор-4-((2-(триметилсилил)этокси)метил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-карбонил)пиперазин-1-карбоксилат
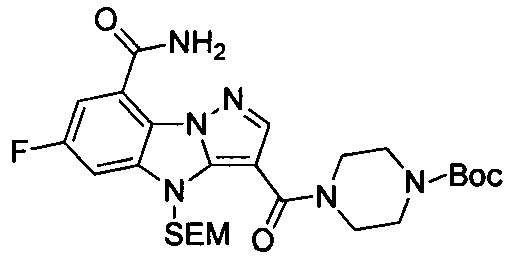
К смеси примера 49D (400 мг, 0,737 ммоль) и K2CO3 (510 мг, 3,685 ммоль) в DMSO (10 мл) добавляли Н2O2 (5 мл) при 0-5°С. После завершения покапельного добавления смесь перемешивали при 15°С в течение 1 ч и гасили водн. раствором Na2SO3 (20 мл). Водный слой экстрагировали с помощью EtOAc (30 мл×3). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4 и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (400 мг, выход: 96,85%). LCMS (ESI) масса/заряд: 561 (М+1).
Пример 49F
6-Фтор-3-(пиперазин-1-карбонил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
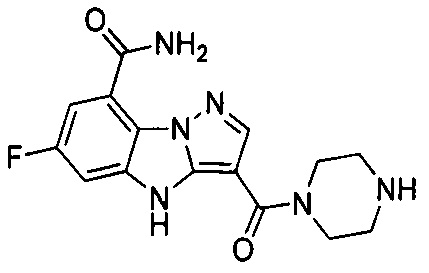
Смесь примера 49Е (100 мг, 0,178 ммоль) в TFA (1 мл) и DCM (1 мл) перемешивали при 15°С в течение 16 ч После удаления раствора под вакуумом к остатку добавляли K2CO3 (123 мг, 0,892 ммоль) и МеОН (2 мл). Смесь перемешивали при 15°С в течение 2 ч. Смесь фильтровали и фильтрат выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 49G
6-Фтор-3-(4-метилпиперазин-1-карбонил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
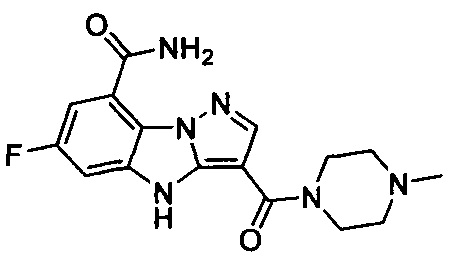
Смесь примера 49F (59 мг, 0,179 ммоль), формальдегида (40 мг, 0,358 ммоль) и Na(CN)BH3 (56 мг, 0,894 ммоль) в МеОН (2 мл) перемешивали при 15°С в течение 16 ч. После выпаривания растворителя под вакуумом остаток очищали посредством препаративной HPLC с получением титульного соединения (8,14 мг, выход: 13,23%) в виде белого твердого вещества. 1Н-ЯМР (MeOD, 400 МГц) δ: 2,68 (s, 3Н), 2,99 (d, J=4,64 Гц, 4Н), 4,00 (br.s., 4Н), 7,46-7,54 (m, 1H), 7,74-7,84 (m, 1H), 8,12-8,20 (m, 1H), 8,24-8,35 (m, 2Н). LCMS (ESI) масса/заряд: 345 (М+1).
Пример 50
3-(1-(Циклопропилметил)пиперидин-4-ил)-4,4,6-трифтор-4Н-пиразоло[1,5-α]индол-8-карбоксамид
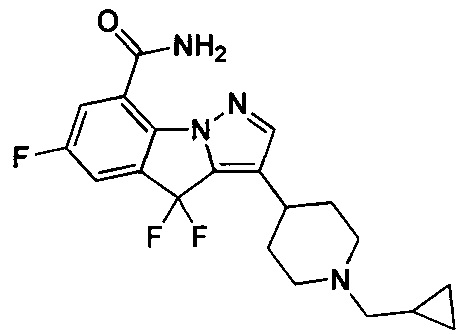
Пример 50А
Этил-(Е)-4-(диметиламино)-2-оксобут-3-еноат
Раствор этил-2-оксопропаноата (5,0 г, 43,1 ммоль) в DMF-DMA (5,0 г, 42,0 ммоль) перемешивали при 20°С в течение 16 ч. Полученную в результате смесь выпаривали с получением титульного соединения (7,0 г, неочищенное) в виде коричневого масла, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 50В
Этил-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-5-карбоксилат
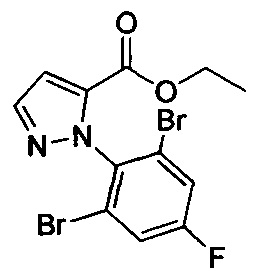
Смесь примера 1D (5,0 г, 17,6 ммоль), примера 50А (6,0 г, 35,2 ммоль) в EtOH (100 мл) и конц. HCl (2,4 мл) перемешивали при 80°С в течение 16 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (3,6 г, выход: 46,8%) в виде желтого твердого вещества.
Пример 50С
1-(2,6-Дибром-4-фторфенил)-1Н-пиразол-5-карбоновая кислота
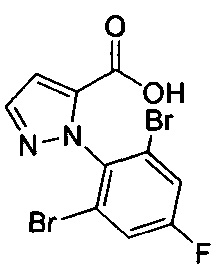
Смесь примера 50В (3,6 г, 9,18 ммоль) и NaOH (2,2 г, 55,1 ммоль) в МеОН (20 мл) и воде (2 мл) перемешивали при 20°С в течение 1 ч. После удаления раствора под вакуумом остаток разводили водой (50 мл) и доводили до рН 3 с помощью 2 н. НСl. Водный слой экстрагировали дихлорметаном (50 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (3,2 г, 97,0%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 50D
1-(2,6-Дибром-4-фторфенил)-N-метокси-N-метил-1Н-пиразол-5-карбоксамид
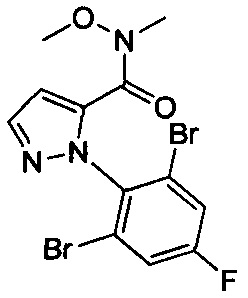
Смесь примера 50С (3,2 г, 8,82 ммоль), O,N-диметил-гидроксиламина (1,7 г, 17,6 ммоль), HATU (4,0 г, 10,6 ммоль) и Et3N (3,6 г, 35,3 ммоль) в сухом DMF (2 мл) перемешивали при 20°С в течение 16 ч в атмосфере N2. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (3,4 г, выход: 94,4%) в виде желтого твердого вещества.
Пример 50Е
8-Бром-6-фтор-4Н-пиразоло[1,5-a]индол-4-он
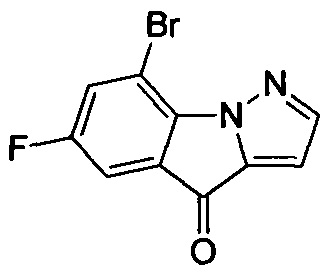
К смеси примера 50D (3,2 г, 7,90 ммоль) в сухом THF (5 мл) по каплям добавляли n-BuLi (2,8 мл, 7,11 ммоль) при -78°С в атмосфере N2. После перемешивания при -78°С в течение 0,5 ч смесь гасили насыщ. водн. раствором NH4Cl (30 мл).
Водный слой экстрагировали с помощью DCM (50 мл ×2). Объединенные органические слои выпаривали. Остаток промывали с помощью МеОН (30 мл) с получением титульного соединения (1,5 г, выход: 71,4%) в виде ярко-желтого твердого вещества. LCMS (ESI) масса/заряд: 267, 269 (М, М+2).
Пример 50F
Метил-6-фтор-4-оксо-4Н-пиразоло[1,5-a]индол-8-карбоксилат
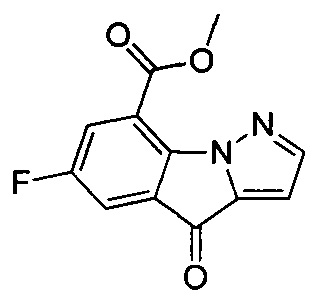
Смесь примера 50Е (1,3 г, 4,89 ммоль), Pd(dppf)Cl2 (0,71 г, 0,98 ммоль), Pd(OAc)2 (0,22 г, 0,98 ммоль), DPPP (0,81 г, 1,96 ммоль), PPh3 (0,51 г, 1,96 ммоль), ксантфоса (1,13 г, 1,96 ммоль) и Et3N (3 мл) в МеОН (20 мл) и DMF (60 мл) перемешивали при 80°С в течение 16 ч в атмосфере СО (3 атм). После охлаждения до 20°С смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,9 г, выход: 75,0%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 247 (М+1).
Пример 50G
Метил-6-фторспиро[пиразоло[1,5-a]индол-4,2'-[1,3]дитиолан]-8-карбоксилат
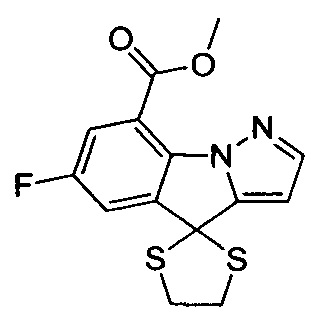
Смесь примера 50F (0,9 г, 3,66 ммоль), 2-этандитиол (0,69 г, 7,32 ммоль) и BF3-Et2O (1,0 г, 7,32 ммоль) в сухом DCM (30 мл) перемешивали при 50°С в течение 24 ч в атмосфере N2. После охлаждения до комнатной температуры смесь разводили DCM (30 мл). Объединенные органические слои промывали 10% NaOH (30 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали посредством колоночной хроматографии на силикагеле (РЕ: EtOAc=10:1) с получением титульного соединения (0,5 г, выход: 42,4%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 323 (М+1).
Пример 50Н
Метил-3-бром-6-фторспиро[пиразоло[1,5-a]индол-4,2'-[1,3]дитиолан]-8-карбоксилат
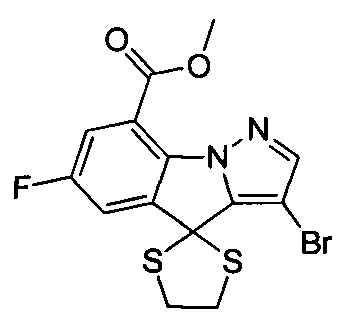
Смесь примера 50G (500 мг, 1,55 ммоль) и NBS (276 мг, 1,55 ммоль) в THF (20 мл) перемешивали при 40°С в течение 16 ч. После охлаждения до 20°С смесь выпаривали, и остаток очищали посредством колоночной хроматографии с получением титульного соединения (470 мг, выход: 75,7%) в виде светло-желтого твердого вещества. LCMS (ESI) масса/заряд: 401, 403 (М, М+2).
Пример 50I
Метил-3-бром-4,4,6-трифтор-4Н-пиразоло[1,5-a]индол-8-карбоксилат
Метил-3-бром-6-фтор-4-оксо-4Н-пиразоло[1,5-a]индол-8-карбоксилат
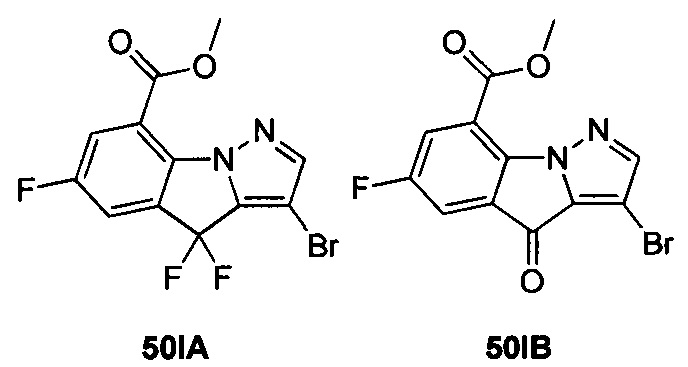
К раствору NIS (2,1 г, 9,38 ммоль) в DCM (20 мл) по каплям добавляли HF.Py (3,5 мл) при -78°С в атмосфере N2. После перемешивания при -78°С в течение 10 мин добавляли пример 50Н (470 мг, 1,17 ммоль). Полученную в результате смесь перемешивали при -78°С в течение 16 ч, а затем гасили насыщ. водн. раствором NaHCO3 (30 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×2). Объединенные органические слои промывали насыщ. водн. раствором Na2SO3 (30 мл), и растворитель выпаривали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением примера 50IA в виде желтого твердого вещества (250 мг, выход: 61,6%) и с получением примера 50IB (110 мг, выход: 27,2%) в виде белого твердого вещества.
Пример 50J
3-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-4,4,6-трифтор-4Н-пиразоло[1,5-a]индол-8-карбоновая кислота
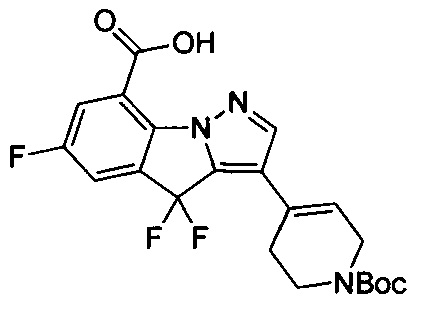
Смесь примера 50IA (200 мг, 0,499 ммоль), трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2Н)-карбоксилата (185 мг, 0,598 ммоль), Pd(dppf)Cl2 (37 мг, 0,050 ммоль) и K2CO3 (138 мг, 0,997 ммоль) в DMF (9 мл) и H2O (3 мл) перемешивали при 90°С в течение 16 ч в атмосфере N2. После охлаждения смеси до комнатной температуры и концентрирования под вакуумом остаток растворяли в воде (20 мл) и доводили до рН 3 с помощью 1н. HCl. Водный слой экстрагировали с помощью DCM (50 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (220 мг, неочищенное) без дополнительной очистки.
Пример 50K
трет-Бутил-4-(8-карбамоил-4,4,6-трифтор-4Н-пиразоло[1,5-a]индол-3-ил)-5,6-дигидропиридин-1(2H)-карбоксилат
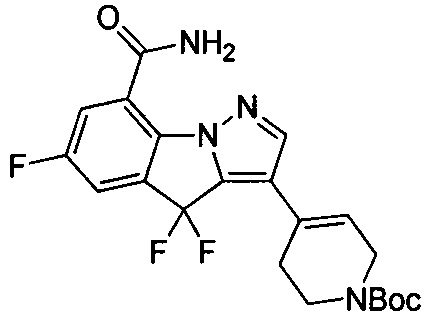
Смесь примера 50J (220 мг, 0,51 ммоль), (NH4)2CO3 (97 мг, 1,01 ммоль), Et3N (0,2 мл, 1,53 ммоль) и HATU (252 мг, 0,66 ммоль) в DMF (8 мл) перемешивали при 20°С в течение 16 ч. Реакционную смесь концентрировали под вакуумом и остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде желтого твердого вещества (70 мг, выход: 32,0%). LCMS (ESI) масса/заряд: 435 (М+1).
Пример 50L
трет-Бутил-4-(8-карбамоил-4,4.6-трифтор-4Н-пиразоло[1,5-a]индол-3-ил)пиперидин-1-карбоксилат
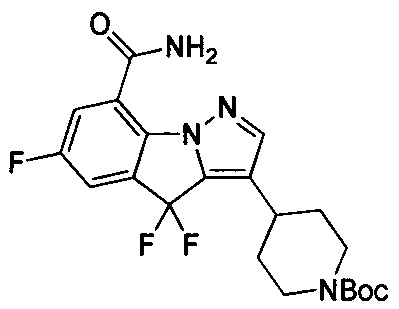
Смесь примера 50K (35 мг, 0,08 ммоль) и 10% Pd/C (20 мг) в сухом DCM (20 мл) и МеОН (10 мл) гидрогенизировали при 50°С в течение 16 ч в атмосфере Н2 (1 атм). Смесь фильтровали и фильтрат выпаривали с получением титульного соединения (30 мг, выход: 85,7%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 437 (М+1).
Пример 50М
4,4,6-Трифтор-3-(пиперидин-4-ил)-4Н-пиразоло[1,5-a]индол-8-карбоксамид
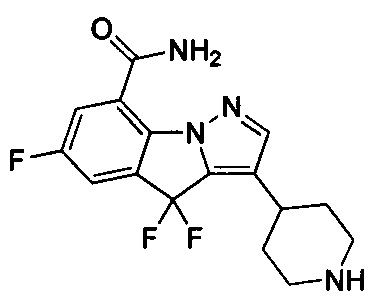
Смесь примера 50L (200 мг, 0,466 ммоль) в TFA (2 мл) и DCM (6 мл) перемешивали при 20°С в течение 2 ч. Полученную в результате смесь выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки (30 мг, неочищенное).
Пример 50N
3-(1-(Циклопропилметил)пиперидин-4-ил)-4,4,6-трифтор-4Н-пиразоло[1,5-α]индол-8-карбоксамид
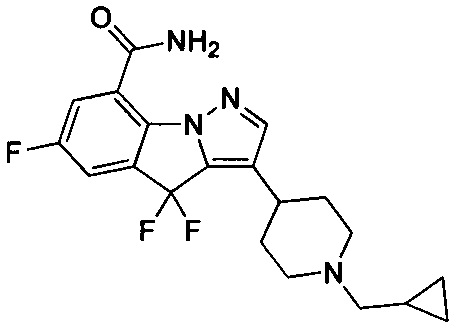
Смесь примера 50М (30 мг, 0,069 ммоль), циклопропанкарбальдегида (10 мг, 0,138 ммоль), Ti(O-ipr)4 (39 мг, 0,138 ммоль) и Na(CN)BH3 (13 мг, 0,207 ммоль) в МеОН (8 мл) перемешивали при 60°С в течение 16 ч в атмосфере N2. Полученную в результате смесь гасили водой (10 мл). Водный слой экстрагировали с помощью DCM (20 мл ×3). Объединенные органические слои выпаривали и остаток очищали посредством препаративной HPLC с получением титульного соединения в виде белого твердого вещества (5 мг, выход: 18,5%). 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,41 (d, J=4,89 Гц, 2Н), 0,72-0,81 (m, 2Н), 1,13 (br.s., 1H), 1,93-2,13 (m, 2Н), 2,31 (d, J=13,93 Гц, 2Н), 2,87-3,12 (m, 5 Н), 3,66 (d, J=U,17 Гц, 2Н), 7,78-7,82 (m, 1H), 7,85 (s, 1H), 7,97 (dd, J=9,91, 2,64 Гц, 1H), 8,07 (s, 1H). LCMS (ESI) масса/заряд: 391 (М+1).
Пример 51
3-(1-Этилпиперидин-4-ил)-6-фтор-4-гидрокси-4Н-пиразоло[1,5-a]индол-8-карбоксамид
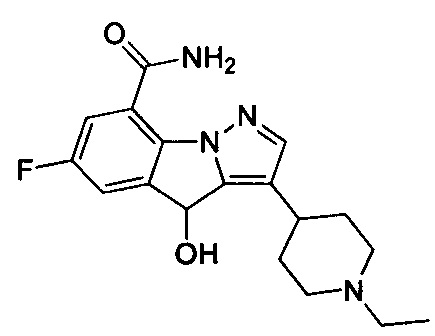
Пример 51А
трет-Бутил-4-(8-карбамоил-6-фтор-4-оксо-4Н-пиразоло[1,5-a]индол-3-ил)-3,6-дигидропиридин-1(2Н)-карбоксилат
Данный пример получали, как описано в примере 50K. LCMS (ESI) масса/заряд: 413 (М+1).
Пример 51В
трет-Бутил-4-(8-карбамоил-6-фтор-4-гидрокси-4Н-пиразоло[1,5-a]индол-3-ил)пиперидин-1-карбоксилат
Смесь примера 51А (50 мг, 0,121 ммоль) и 10% Pd/C (10 мг) в сухом МеОН (10 мл) гидрогенизировали при 50°С в течение 16 ч в атмосфере Н2 (1 атм). Смесь фильтровали и фильтрат выпаривали с получением титульного соединения (40 мг, выход: 80,0%), которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 417 (М+1).
Пример 51С
6-Фтор-4-гидрокси-3-(пиперидин-4-ил)-4Н-пиразоло[1,5-a]индол-8-карбоксамид
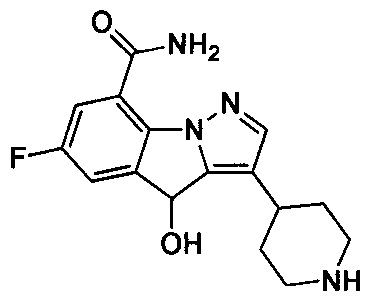
Данный пример получали, как описано в примере 50М.
Пример 51D
3-(1-Этилпиперидин-4-ил)-6-фтор-4-гидрокси-4Н-пиразоло[1,5-a]индол-8-карбоксамид
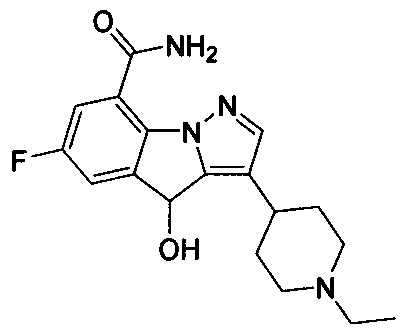
Смесь примера 51С (25 мг, 0,079 ммоль), 40% ацетальдегида (0,1 мл) и Na(CN)BH3 (20 мг, 0,316 ммоль) в МеОН (5 мл) перемешивали при 10°С в течение 16 ч. Полученную в результате смесь разводили водой (10 мл). Водный слой экстрагировали с помощью DCM (20 мл ×3). Объединенные органические слои выпаривали с получением остатка, который очищали посредством препаративной HPLC с получением титульного соединения (9,40 мг, выход: 34,8%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,11-1,18 (m, 3Н), 1,77-1,96 (m, 2Н), 2,01-2,16 (m, 2Н), 2,61 (br.s., 2Н), 2,81 (br.s., 3Н), 3,27 (br.s., 2Н), 5,72 (s, 1H), 7,59 (dd, J=7,22, 2,45 Гц, 1H), 7,70 (d, J=10,42 Гц, 1H), 7,76 (s, 1H), 7,99 (br.s., 1H), 8,32 (br.s., 1H), 10,09 (br.s., 1H). LCMS (ESI) масса/заряд: 345 (М+1).
Пример 52
3-(1-Этилпиперидин-4-ил)-6-фтор-4-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
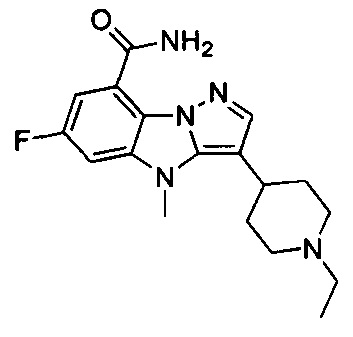
Пример 52А
трет-Бутил-4-(8-карбамоил-6-фтор-4-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пиперидин-1- карбоксилат
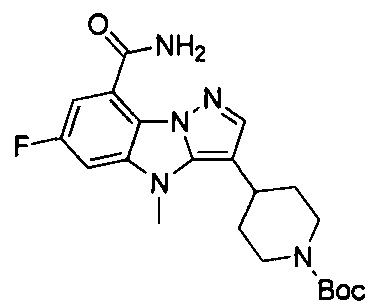
Смесь примера 1I (30 мг, 0,075 ммоль), K2CO3 (31 мг, 0,224 ммоль) и СН3I (32 мг, 0,224 ммоль) в DMF (3 мл) перемешивали при 10°С в течение 1 ч. Реакционную смесь гасили водой (10 мл). Водный слой экстрагировали с помощью EtOAc (10 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 52В
6-Фтор-4-метил-3-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
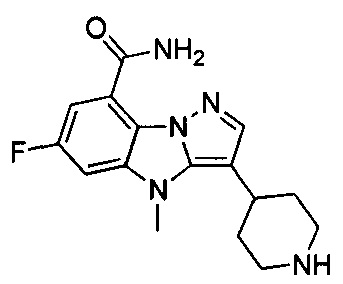
Смесь примера 52А (31 мг, 0,074 ммоль) в DCM (1 мл) и TFA (0,2 мл) перемешивали при 10°С в течение 2 ч. Смесь выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 52С
3-(1-Этилпиперидин-4-ил)-6-фтор-4-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
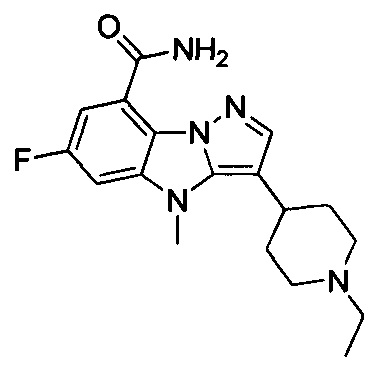
Данный пример получали согласно способу, описанному в примере 51D. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,23-1,26 (t, 3Н), 1,91-1,97 (m, 2Н), 2,11-2,14 (d, 2Н), 2,55 (t, 2Н), 2,78-2,80 (m, 2Н), 3,04-3,07 (m, 2Н), 3,32 (2Н), 3,87 (s,2Н), 7,48-8,50 (m, 1H), 7,64-7,67 (m, 1H), 7,73 (s, 1H), 8,54 (s, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Схема С
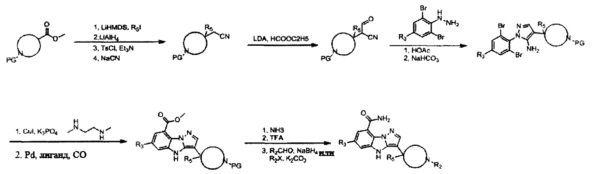
Пример 53
6-Фтор-3-(4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
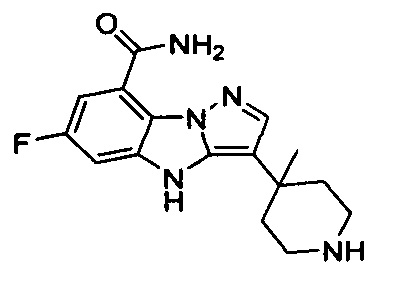
Пример 53А
1-(трет-Бутил)-4-метил-4-метилпиперидин-1,4-дикарбоксилат
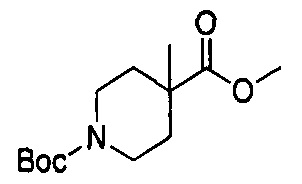
К раствору 1-трет-бутил-4-метил-пиперидин-1,4-дикарбоксилата (36,5 г, 0,15 моль) в безводном THF (400 мл) по каплям добавляли LiHMDS (1 М, 300 мл) при -78°С в атмосфере N2. После перемешивания при -78°С в течение 30 мин к нему по каплям добавляли раствор Mel (42,6 г, 0,3 моль) в THF (100 мл). Реакционную смесь перемешивали при -78°С в течение 2 часов, и нагревали до 15°С, и перемешивали в течение дополнительных 20 часов. После завершения реакции смесь гасили насыщ. водн. раствором NH4Cl (500 мл). Водный слой экстрагировали с помощью EtOAc (500 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (30 г, выход: 78%). LCMS (ESI) масса/заряд: 258 (М+1).
Пример 53В
трет-Бутил-4-(гидроксиметил)-4-метилпиперидин-1-карбоксилат
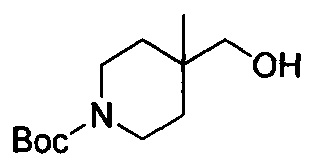
К раствору LiAlH4 (3,7 г, 97,5 ммоль) в безводном THF (40 мл) по каплям добавляли раствор примера 53А (10 г, 39 ммоль) в безводном THF (80 мл) при 0°С в атмосфере N2. После завершения покапельного добавления реакционную смесь перемешивали при 0°С в течение 2,5 часов, а затем гасили водой (4 мл), 15% водн. раствором NaOH (4 мл) и водой (12 мл). Полученную в результате смесь перемешивали при 0°С в течение дополнительных 20 минут. Смесь фильтровали и твердое вещество промывали с помощью EtOAc (50 мл×4). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (9 г, неочищенное), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 53С
трет-Бутил-4-(цианометил)-4-метилпиперидин-1-карбоксилат
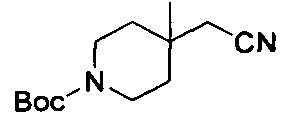
Данный пример получали согласно способу, описанному в примерах 1А-1В.
Пример 53D
6-Фтор-3-(4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
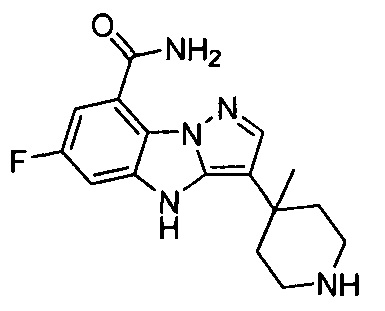
Данный пример получали, как описано в примерах 1E-1J. 1Н ЯМР (400 МГц, MeOD) δ: 8,51 (s, 1H), 7,81 (s, 1H), 7,69 (dd, J=2,4 Гц/т=10,2 Гц, 1H), 7,45 (dd, J=2,4 ГцЛ=8,0 Гц, 1H), 3,33-3,39 (m, 2Н), 3,12-3,32 (m, 2Н), 2,42-2,46 (m, 2Н), 2,03-2,08 (m, 2Н), 1,46 (s, 3Н). LCMS (ESI) масса/заряд: 316 (М+1).
Пример 54
3-(1-Этил-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
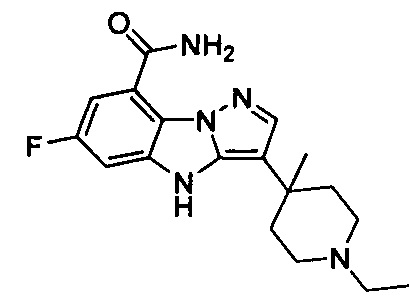
Данный пример получали, как описано в примере 52С (10 мг, выход: 38%). 1H ЯМР (400 МГц, DMSO) δ: 10,58 (s, 1H), 8,28 (s, 1H), 8,13 (s, 1H), 7,80 (s, 1H), 7,61 (dd, J=2,8 Гц / J=7,2 Гц, 1H), 7,49 (t, J=2,4 Гц, 1H),'2,75-2,78 (m, 2Н), 2,50-2,54 (m, 4Н), 2,18-2,20 (m, 2Н), 1,73-1,78 (m, 2Н), 1,30 (s, 3Н), 1,05 (t, J=7,2 Гц, 3Н). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 55
3-(1-Циклопропил-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
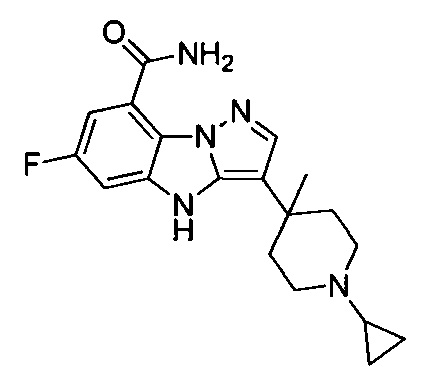
Данный пример получали, как описано в примере 4. 1Н-ЯМР (400 МГц, метанол-d4) 0,77 (d, J=5,40 Гц, 4Н), 1,41-1,45 (m, 3Н), 1,90-2,01 (m, 2Н), 2,28-2,44 (m, 3Н), 3,03 (br.s., 2Н), 3,27 (br.s., 2Н), 7,39 (dd, J=8,16, 2,51 Гц, 1H), 7,73 (dd, J=10,92, 2,38 Гц, 1H), 7,79 (s, 1H), 8,41 (br.s., 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 56
6-Фтор-3-(1-(2-гидрокси-2-метилпропил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
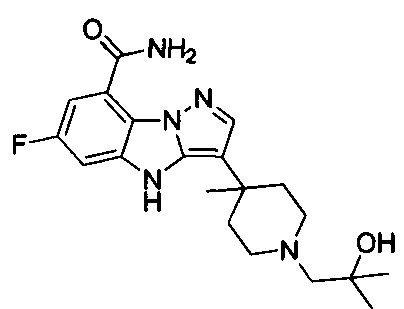
Данный пример получали согласно способу, описанному в примере 6. 1Н-ЯМР (400 МГц, DMSO-d4) δ ppm 1,13 (s, 6Н), 1,28 (s, 3Н), 1,86 (t, J=10,23 Гц, 2H), 2,20 (d, J=15,43 Гц, 2H), 2,62 (s, 2Н), 2,76 (br.s., 2Н), 3,04 (d, J=4,02 Гц, 2H), 7,48 (dd, J=8,34, 2,57 Гц, 1H), 7,56 (dd, J=10,92, 2,64 Гц, 1H), 7,79 (s, 1H), 8,31 (s, 1H). LCMS (ESI) масса/заряд: 388 (М+1).
Пример 57
3-(1-(Циклопропилметил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
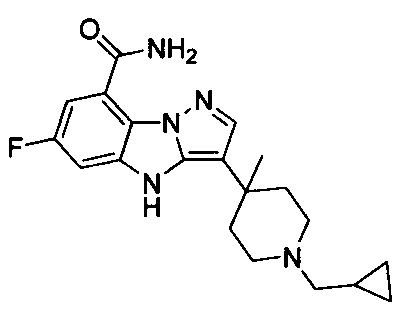
Данный пример получали согласно способу, описанному в примере 5. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,37 (d, J=3,89 Гц, 2Н), 0,73 (d, J=7,53 Гц, 2Н), 1,02-1,14 (m, 1H), 1,44 (br.s., 3Н), 2,08 (d, J-11,29 Гц, 2Н), 2,37-2,66 (m, 2Н), 2,94 (br.s., 3Н), 3,34-3,63 (m, 3Н), 7,38 (dd, J=8,09, 2,57 Гц, 1H), 7,71 (dd, J=10,92, 2,51 Гц, 1H), 7,79 (s, 1H), 7,77-7,81 (m, 1H), 8,51 (s, 1H). LCMS (ESI) масса/заряд: 370 (М+1).
Пример 58
3-(1-(4,4-Дифторциклогексил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
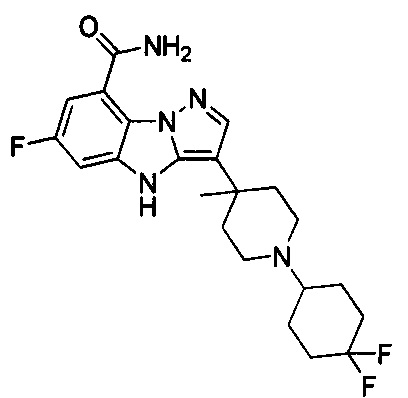
Данный пример получали согласно способу, описанному в примере 5. 1Н-ЯМР (400 МГц, DMSO-d4) δ ppm 1,22 (s, 3Н), 1,33-1,49 (m, 1H), 1,70 (br.s., 6Н), 1,92-2,12 (m, 1H), 2,31-2,38 (m, 1H), 2,59-2,64 (m, 1H), 7,40-7,62 (m, 2H), 7,74 (s, 1H). LCMS (ESI) масса/заряд: 434 (М+1).
Пример 59
6-Фтор-3-(4-метил-1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
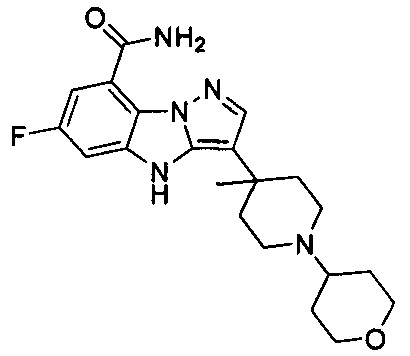
Данный пример получали согласно способу, описанному в примере 5. 1Н ЯМР (400 МГц, метанол-d4) 1,05 (t, J=7,22 Гц, 1H), 1,36 (s, 3Н), 1,50-1,60 (m, 1H), 1,82 (d, J=11,92 Гц, 3Н), 2,21-2,27 (m, 1H), 2,44-2,56 (m, 1H), 2,79 (br.s., 2Н), 3,35-3,42 (m, 1H), 3,90-4,05 (m, 1H), 7,32-7,38 (m, 1H), 7,71 (s, 1H). LCMS (ESI) масса/заряд: 400 (М+1).
Пример 60
6-Фтор-3-(1-(2-фторэтил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
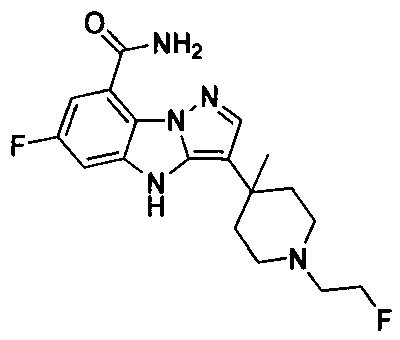
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,45 (s, 3Н), 2,01-2,05(m, 2Н), 2,24-2,47 (m, 2Н), 3,05 (m, 2Н), 3,24-3,25 (m, 1H), 3,26-3,27 (m, 1H), 3,33-3,34 (m, 1H), 4,70-4,72 (m, 1H), 4,82-4,93 (m, 1H), 7,37-7,39 (m, 1H), 7,68-7,79 (d, 1H), 7,81(s, 1H), 8,45 (br.s., 1H). LCMS (ESI) масса/заряд: 362 (M+1).
Пример 61
6-Фтор-3-(4-метил-1-(2,2,2-трифторэтил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
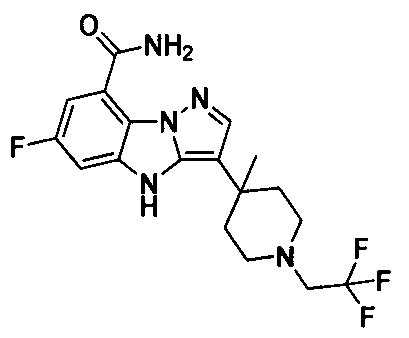
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,37 (s, 3Н), 1,79-1,91 (m, 2Н), 2,16-2,27 (m, 2Н), 2,58-2,69 (m, 2Н), 2,79-2,89 (m, 2Н), 2,98-3,10 (m, 2Н), 7,33-7,39 (m, 1H), 7,66-7,75 (m, 2Н). LCMS (ESI) масса/заряд: 398 (М+1).
Пример 62
6-Фтор-3-(4-метил-1-(3,3,3-трифторпропил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
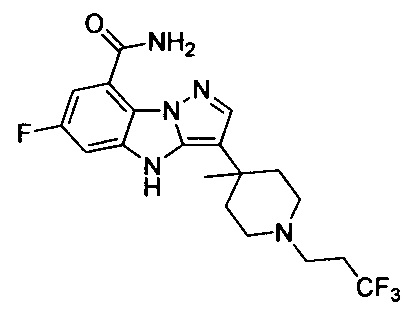
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,42 (s, 3Н), 1,92-2,05 (m, 2Н), 2,38 (d, J=14,93 Гц, 2Н), 2,54-2,71 (m, 2Н), 2,86 (d, J=9,79 Гц, 2Н), 2,93-3,07 (m, 2Н), 3,14 (d, J=11,17 Гц, 2Н), 7,37 (dd, J=8,16, 2,51 Гц, 1H), 7,70 (dd, J=10,92, 2,51 Гц, 1H), 7,76 (s, 1H), 8,37 (br.s., 1H). LCMS (ESI) масса/заряд: 412 (М+1).
Пример 63
3-(1-((1-Цианоциклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
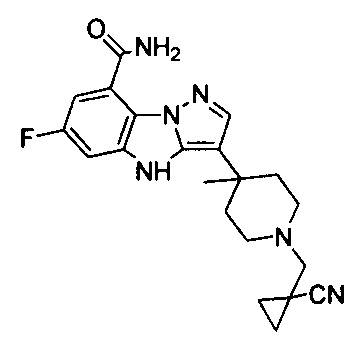
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4,) ppm 1,05 (d, J=2,26 Гц, 2Н), 1,32-1,38 (m, 2Н), 1,40 (s, 3Н), 1,89-2,05 (m, 2Н), 2,33 (d, J=15,69 Гц, 2Н), 2,69 (s, 4Н), 3,02 (br.s., 2Н), 7,38 (dd, J=8,09, 2,57 Гц, 1H), 7,68-7,83 (m, 2Н), 8,28 (br.s., 1H). LCMS (ESI) масса/заряд: 395 (М+1).
Пример 64
3-(1-((1-Цианоциклобутил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
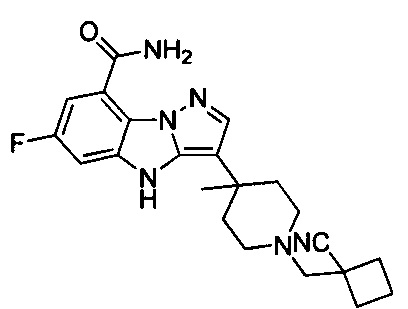
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,38 (s, 3Н), 1,85-1,94 (m, 2Н), 2,00-2,09 (m, 1H), 2,18-2,31 (m, 5 Н), 2,42-2,52 (m, 2Н), 2,63 (t, J=9,22 Гц, 2Н), 2,81 (s, 2Н), 2,88 (d, J=5,65 Гц, 2Н), 7,36 (dd, J=8,03, 2,26 Гц, 1H), 7,69 (d, J=2,26 Гц, 1H), 7,73 (s, 1H), 8,30 (br.s., 1H). LCMS (ESI) масса/заряд: 409 (М+1).
Пример 65
6-Фтор-3-(4-метил-1-(2-(метилсульфонил)этил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
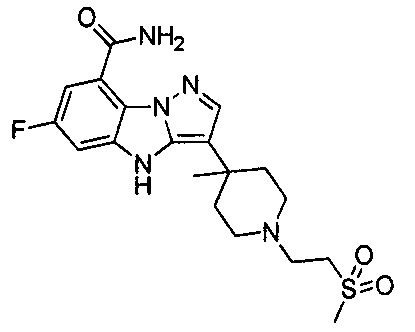
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,40 (s, 3Н), 1,87-1,98 (m, 2Н), 2,28-2,38 (m, 2Н), 2,63-2,80 (m, 2Н), 2,95-3,05 (m, 2Н), 3,07 (s, 3Н), 3,07-3,14 (m, 2Н), 3,38-3,47 (m, 2Н), 7,33-7,40 (m, 1H), 7,66-7,73 (m, 1H), 7,73-7,77 (m, 1H), 8,20-8,37 (m, 1H). LCMS (ESI) масса/заряд: 422 (М+1).
Пример 66
6-Фтор-3-(4-метил-1-((тетрагидро-2Н-пиран-4-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
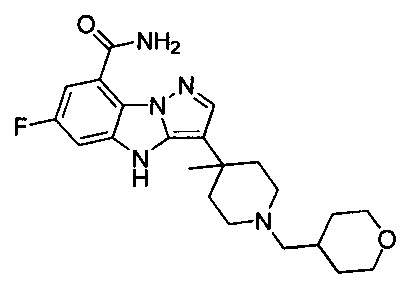
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,25-1,33 (m, 2Н), 1,37 (s, 3Н), 1,70 (d, J=13,30 Гц, 2Н), 1,80-1,89 (m, 3Н), 2,22 (br.s., 2Н), 2,23 (br.s., 2Н), 2,38 (br.s., 2Н), 2,67 (br.s., 2Н), 3,40-3,47 (m, 2Н), 3,94 (dd, J=11,67, 2,89 Гц, 2Н), 7,36 (dd, J=8,16, 2,51 Гц, 1H), 7,69 (d, J=2,51 Гц, 1H), 7,72 (br.s., 1H). LCMS (ESI) масса/заряд: 414 (М+1).
Пример 67
3-(1-((1-Аминоциклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
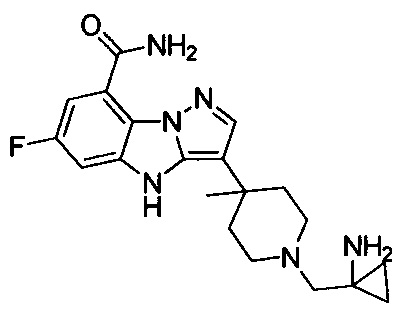
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 0,72-0,82 (m, 2Н), 0,93-1,00 (m, 2Н), 1,40 (s, 3Н), 1,91-2,03 (m, 2Н), 2,26-2,37 (m, 2Н), 2,66 (s, 4Н), 2,94-3,06 (m, 2Н), 7,33-7,41 (m, 1H), 7,67-7,73 (m, 1H), 7,73-7,77 (m, 1H), 8,22-8,48 (m, 2Н). LCMS (ESI) масса/заряд: 385 (М+1).
Пример 68
6-Фтор-3-(4-метил-1-(оксетан-3-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
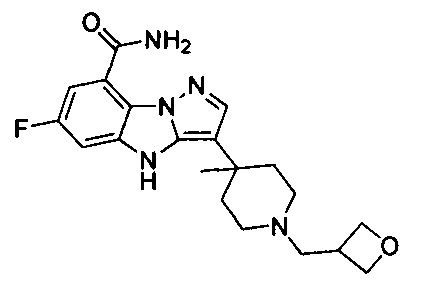
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, хлороформ-d) ppm 1,36 (s, 3Н), 1,78-1,88 (m, 2Н), 2,17-2,25 (m, 2Н), 2,36 (br.s., 2Н), 2,57-2,68 (m, 2Н), 2,72 (d, J=7,03 Гц, 2Н), 4,38-4,47 (m, 2Н), 4,60-4,63 (m, 1H), 4,80-4,82 (m, 2Н), 7,33-7,39 (m, 1H), 7,68-7,76 (m, 2Н). LCMS (ESI) масса/заряд: 386 (М+1).
Пример 69
6-Фтор-3-(1-(2-метоксиэтил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
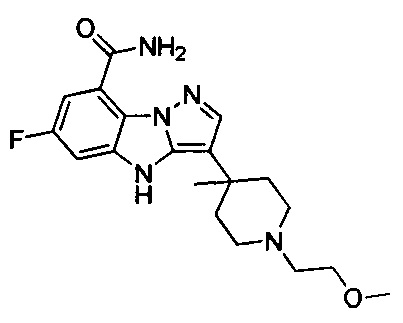
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,45 (s, 3Н), 2,07 (ddd, J=14,68, 10,85, 3,58 Гц, 2Н), 2,46 (d, J=14,81 Гц, 2Н), 3,12 (br.s., 2Н), 3,23 (t, J=4,83 Гц, 2Н), 3,41 (s, 5 Н), 3,66-3,73 (m, 2Н), 7,39 (dd, J=8,16, 2,51 Гц, 1H), 7,71 (dd, J=10,92, 2,51 Гц, 1H), 7,80 (s, 1H), 8,52 (s, 1H). LCMS (ESI) масса/заряд: 374 (М+1).
Пример 70
6-Фтор-3-(1-((1-гидроксициклопропил)метил)-4-метилпиперидин-4-ил)-4H-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
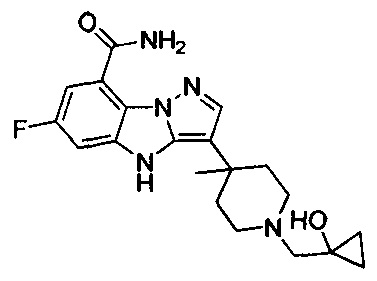
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 0,64-0,74 (m, 2Н), 0,84-0,93' (m, 2Н), 1,46 (s, 3Н), 2,04-2,18 (m, 2Н), 2,50 (d, J=15,18 Гц, 2Н), 3,16 (br.s., 4Н), 3,47-3,68 (m, 2Н), 7,36-7,43 (m, 1H), 7,68-7,75 (m, 1H), 7,79-7,84 (m, 1H), 8,48-8,65 (m, 1H). LCMS (ESI) масса/заряд: 386 (М+1).
Пример 71
6-Фтор-3-(4-метил-1-((3-метилоксетан-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
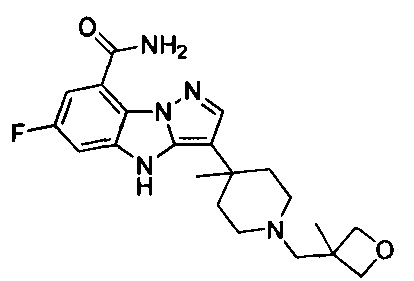
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38 (s, 3Н), 1,46 (s, 3Н), 1,81-1,93 (m, 2Н), 2,18-2,29 (m, 2Н), 2,33-2,54 (m, 2Н), 2,54-2,84 (m, 4Н), 4,31-4,35 (m, 2Н), 4,49-4,54 (m, 2Н), 7,34-7,39 (m, 1H), 7,68-7,75 (m, 2Н). LCMS (ESI) масса/заряд: 400 (М+1).
Пример 72
6-Фтор-3-(1-(3-метоксипропил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
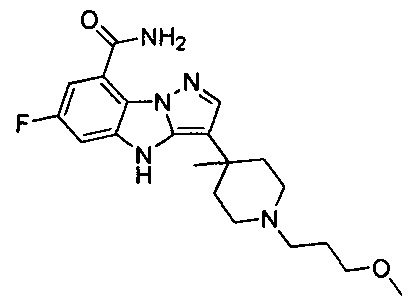
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,45 (s, 3Н), 1,94-2,01 (m, 2Н), 2,02-2,12 (m, 2Н), 2,47 (d, J=13,05 Гц, 2Н), 2,89-3,20 (m, 4Н), 3,34 (s, 3Н), 3,39 (br.s., 2Н), 3,45-3,52 (m, 2Н), 7,38 (dd, J=8,09, 2,57 Гц, 1H), 7,71 (dd, J=10,92, 2,51 Гц, 1H), 7,79 (s, 1H), 8,55 (s, 1H). LCMS (ESI) масса/заряд: 434 (М+1).
Пример 73
6-Фтор-3-(4-метил-1-((1-(метилсульфонил)циклопропил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
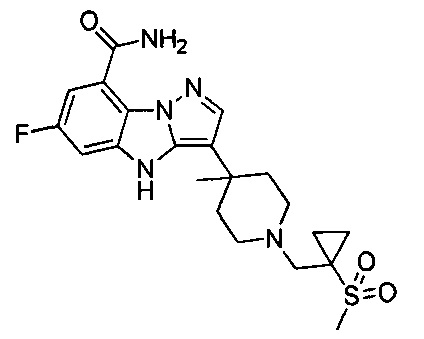
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 0,95-1,01 (ш, 2Н), 1,38 (s, 3Н), 1,41-1,49 (m, 2Н), 1,83-1,96 (m, 2Н), 2,27 (d, J=13,30 Гц, 2Н), 2,55 (br.s., 2Н), 2,86 (s, 2Н), 2,92 (br.s., 2Н), 3,24 (s, 3Н), 7,36 (dd, J=8,16, 2,51 Гц, 1H), 7,67-7,78 (m, 2Н). LCMS (ESI) масса/заряд: 448 (М+1).
Пример 74
6-Фтор-3-(4-метил-1-(тиазол-2-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
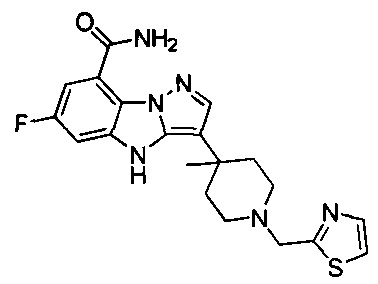
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,36-1,42 (m, 3Н), 1,86-1,97 (m, 2Н), 2,23-2,33 (m, 2Н), 2,63-2,73 (m, 2Н), 2,89-2,98 (m, 2Н), 4,02-4,07 (m, 2Н), 7,32-7,40 (m, 1H), 7,58-7,63 (m, 1H), 7,68-7,73 (m, 1H), 7,74 (s, 1H), 7,75-7,79 (m, 1H), 8,25-8,35 (m, 1H). LCMS (ESI) масса/заряд: 413 (М+1).
Пример 75
6-Фтор-3-(4-метил-1-(метилсульфонил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
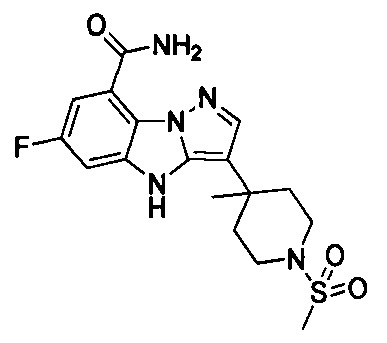
Данный пример получали согласно способу, описанному в примере 3. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,38-1,46 (m, 3Н), 1,88 (ddd, J=13,68, 9,66, 3,76 Гц, 2Н), 2,32 (d, J=15,06 Гц, 2Н), 2,78 (s, 3Н), 3,00-3,17 (m, 2Н), 3,46-3,53 (m, 2Н), 7,35-7,41 (m, 1H), 7,69-7,75 (m, 1H), 7,77-7,79 (m, 1Н), 8,46-8,53 (m, 1Н). LCMS (ESI) масса/заряд: 394 (М+1).
Пример 76
6-Фтор-3-(1-(3-фторциклобутил)-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
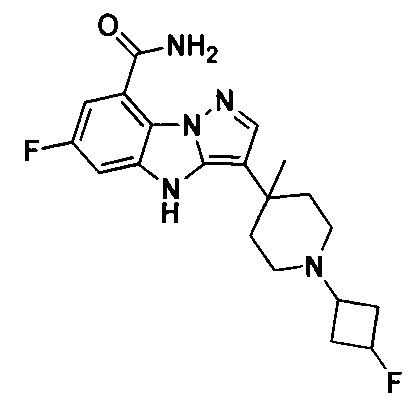
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,45 (s, 3Н), 1,96-2,18 (m, 2Н), 2,38-2,74 (m, 6Н), 2,94 (br.s., 4H), 3,74-3,93 (m, 1H), 5,12-5,32 (m, 1H), 7,41 (dd, J=8,16, 2,38 Гц, 1H), 7,67 (dd, J=10,79, 2,26 Гц, 1H), 7,79 (s, 1H), 8,52 (br.s., 1H). LCMS (ESI) масса/заряд: 388 (М+1).
Пример 77
6-Фтор-3-(4-метил-1-(тиофен-2-илметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
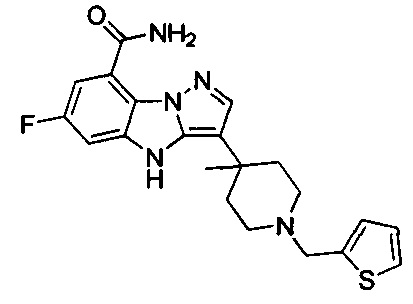
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) 1,34 (s, 3Н), 1,82 (ddd, J=13,36, 9,41, 3,45 Гц, 2Н), 2,13-2,27 (m, 1H), 2,32-2,53 (m, 1H), 2,69 (br.s., 2Н), 3,72 (s, 2Н), 6,87-7,01 (m, 2Н), 7,25-7,39 (m, 2Н), 7,62-7,75 (m, 2Н). LCMS (ESI) масса/заряд: 412 (М+1).
Пример 78
3-(1-((1-Этилпиперидин-4-ил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
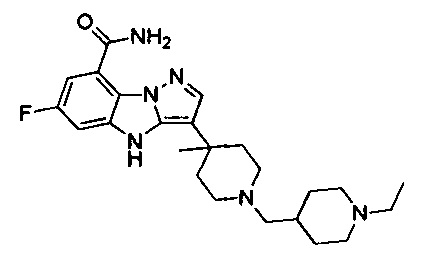
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,32-1,35 (t, 3Н), 1,42 (s, 3Н), 1,47-1,51 (d, 2Н), 1,99-2,08 (m, 5 Н), 2,35-2,38 (d, 2Н), 2,64-2,65 (d, 2Н), 2,89 (m, 2Н), 3,06 (t, 2Н), 3,11-3,15 (m, 4Н), 3,51-3,54 (d, 2Н), 7,37-7,39 (m, 1H), 7,70-7,74 (m, 1H), 7,77 (s, 1H), 8,446 (s, 2Н). LCMS (ESI) масса/заряд: 441 (М+1).
Пример 79
6-Фтор-3-(4-метил-1-((1-метилазетидин-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
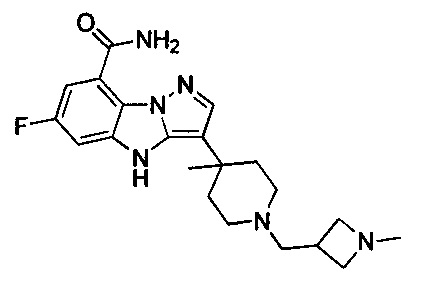
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,32 (s, 3Н), 1,89-1,95 (m, 2Н), 2,29-2,33 (d, 2Н), 2,60 (d, 2Н), 2,86-2,91, 2,64-2,65 (m, 7 Н), 3,18 (m, 1H), 3,84-3,88 (t, 2Н), 4,15-4,20 (t, 2Н), 7,36-7,39 (m, 1H), 7,70-7,73 (m, 1H), 7,77 (s, 1H), 8,41 (s, 2Н). LCMS (ESI) масса/заряд: 399 (М+1).
Пример 80
Этил-2-((4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-ил)метил)циклопропанкарбоксилат
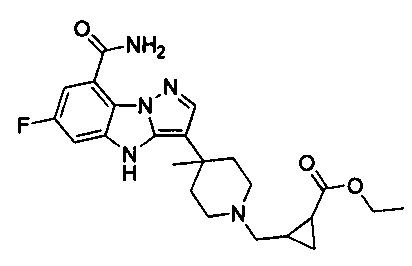
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) 0,86-1,34 (m, 6 Н), 1,35-1,49 (m, 2Н), 1,57-2,01 (m, 4Н), 2,09-2,28 (m, 2Н), 2,44-2,70 (m, 2Н), 2,99-3,27 (m, 2Н), 3,36-3,47 (m, 2Н), 3,53-3,75 (m, 2Н), 4,06-4,26 (m, 3Н), 7,50-7,65 (m, 1H), 7,74-7,85 (m, 1H), 8,05 (br.s., 1H). LCMS (ESI) масса/заряд: 442 (М+1).
Пример 81
Этил-3-(1-((2-(диметилкарбамоил)циклопропил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
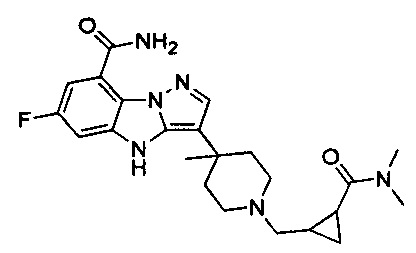
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) 0,97-1,29 (m, 2Н), 1,47 (s, 2Н), 1,65 (s, 1H), 2,08-2,30 (m, 3Н), 2,63 (d, J=15,3 Гц, 1Н), 2,85 (s, 1Н), 2,92-3,01(m, 3Н), 3,01-3,12 (m, 2Н), 3,12-3,27 (m, 2Н), 3,29 (s, 2Н), 3,34-3,47 (m, 2Н), 3,55-3,77 (m, 2Н), 7,56-7,70 (m, 1Н), 7,78-7,85 (m, 1Н), 8,12 (d, J=6,5 Гц, 1Н). LCMS (ESI) масса/заряд: 441 (М+1).
Пример 82
6-Фтор-3-(1-изобутил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
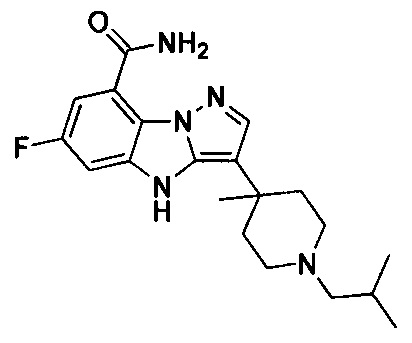
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,00-1,02 (d, 6Н), 1,43 (s, 3Н), 2,03-2,07 (m, 3Н), 2,10-2,11 (d, 2Н), 2,81-2,83 (d, 2Н), 3,03 (bs, 2Н), 3,31 (bs, 2Н), 7,35-7,38 (dd, 1Н), 7,67-7,71 (s, 1Н), 7,77 (s, 1Н), 8,53 (bs, 1Н). LCMS (ESI) масса/заряд: 372 (М+1).
Пример 83
6-Фтор-3-(4-метил-1-((4-метилтиазол-5-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
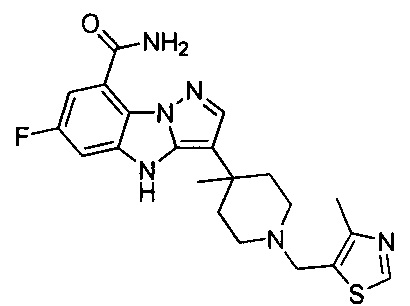
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) δ ppm 1,41 (s, 3Н), 1,89-2,01 (m, 2Н), 2,30-2,39 (m, 2Н), 2,43 (s, 3Н), 2,73-2,86 (m, 2Н), 2,97-3,15 (m, 2Н), 4,01-4,20 (m, 2Н), 7,30-7,47 (m, 1H), 7,65-7,86 (m, 2Н), 8,90-9,04 (m, 1H). LCMS (ESI) масса/заряд: 427 (М+1).
Пример 84
6-Фтор-3-(4-метил-1-((1-метил-1Н-имидазол-2-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
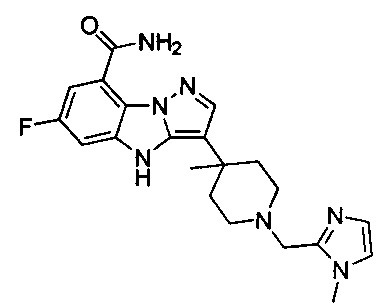
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4,) ppm 1,32-1,44 (m, 3Н), 1,78-1,96 (m, 2Н), 2,18-2,33 (m, 2Н), 2,46-2,62 (m, 2Н), 2,71-2,88 (m, 2Н), 3,73-3,77 (m, 2Н), 3,81 (s, 3Н), 7,01-7,11 (m, 1H), 7,18-7,23 (m, 1H), 7,33-7,40 (m, 1H), 7,73 (s, 2Н), 8,28-8,44 (m, 1H). LCMS (ESI) масса/заряд: 410 (М+1).
Пример 85
3-(1-((1,2-Диметил-1Н-имидазол-5-ил)метил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
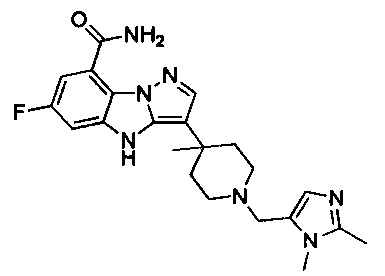
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38 (s, 3Н), 1,83-1,92 (m, 2Н), 2,27 (d, J=13,80 Гц, 2Н), 2,54 (s, 5 Н), 2,86 (d, J=10,92 Гц, 2Н), 3,70 (s, 2Н), 3,75 (s, 3Н), 7,17 (s, 1H), 7,36 (dd, J=8,16, 2,51 Гц, 1H), 7,66-7,80 (m, 2Н), 8,38 (br.s., 1H). LCMS (ESI) масса/заряд: 424 (М+1).
Пример 86
3-(1'-Этил-4-метил-[1,4'-бипиперидин]-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
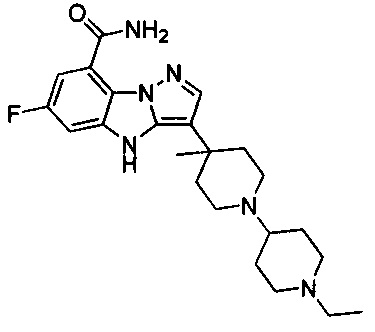
Данный пример получали согласно способу, описанному в примере 2. 1Н-ЯМР (400 МГц, метанол-d4) 1,09 (t, J=7,09 Гц, 3Н), 1,27 (s, 3Н), 1,50-1,70 (m, 2Н), 1,72-1,85 (m, 2Н), 1,92 (d, J=11,54 Гц, 2Н), 2,34 (br.s., 2Н), 2,75 (d, J=7,40 Гц, 7 Н), 2,86 (br.s., 2Н), 3,23 (d, J=10,42 Гц, 2Н), 7,49 (d, J=8,41 Гц, 1H), 7,58 (dd, J=10,85, 2,20 Гц, 1H), 7,79 (s, 1H), 8,28 (s, 2Н). LCMS (ESI) масса/заряд: 427 (М+1).
Пример 87
6-Фтор-3-(4-метил-1-((6-оксо-1,6-дигидропиридазин-3-ил)метил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
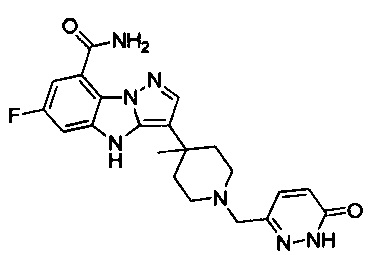
Данный пример получали согласно способу, описанному в примере 2. 1Н ЯМР (400 МГц, MeOD) δ: 8,35 (s, 1H), 7,70-7,74 (m, 2Н), 7,57-7,60 (d, 1H), 7,36-7,38 (t, 1H), 6,98-7,00 (d, 1H), 3,63 (s, 2Н), 2,86 (m, 2Н), 2,61.-2,63 (m, 2Н), 2,26-2,30 (d, 2Н), 1,87-1,94 (m, 2Н), 1,39 (s, 3Н). LCMS (ESI) масса/заряд: 424 (М+1).
Пример 88
3-(1-(2-Цианоэтил)-4-метилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
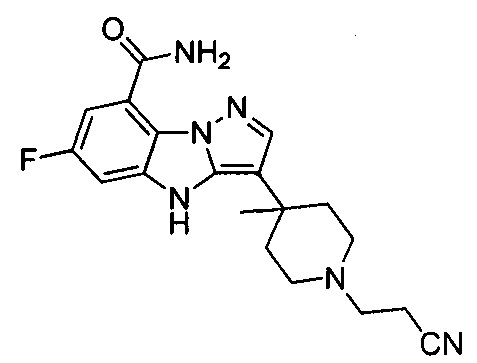
Смесь примера 53D (52 мг, 0,125 ммоль), акрилонитрила (66 мг, 1,25 ммоль) и карбоната калия (172 мг, 1,25 ммоль) в DMF (18 мл) перемешивали при 28°С в течение 1 часа. После завершения реакционную смесь гасили водой (10 мл). Водный слой экстрагировали с помощью EtOAc (20 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством препаративной HPLC с получением титульного соединения (31 мг, выход 66,0%). 1Н ЯМР (400 МГц, метанол-d4) ppm 1,39 (s, 3Н), 1,86-1,97 (m, 2Н), 2,25-2,36 (m, 2Н), 2,60-2,70 (m, 2Н), 2,74 (s, 2Н), 2,84-2,98 (m, 4Н), 7,33-7,41 (m, 1H), 7,68-7,73 (m, 1H), 7,74 (s, 1H), 8,21-8,32 (m, 1H). LCMS (ESI) масса/заряд: 369 (М+1).
Пример 89
6-Хлор-3-(1-этил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
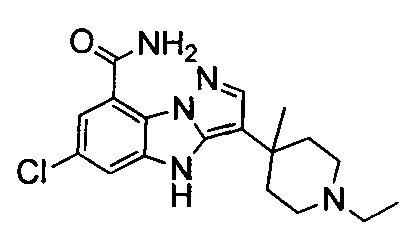
Данный пример получали, как описано в примере 53, заменяя (2,6-дибром-4-хлорфенил)гидразин на (2,6-дибром-4-фторфенил)гидразин. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,32-1,39 (t, 3Н), 1,46 (m, 1H), 2,52-2,55 (s, 3Н), 2,06-2,08 (m, 2Н), 2,47-2,48 (m, 2Н), 3,09-3,11 (m, 3Н), 3,34-3,41 (m, 3Н), 7,63 (s, 1H), 7,83 (s, 1H), 7,97-7,97 (d, 1H), 8,54 (bs, 1H). LCMS (ESI) масса/заряд: 360 (М+1).
Пример 90
3-(1-Этил-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
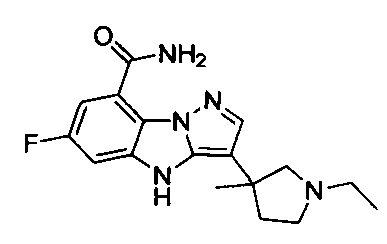
Данный пример получали, как описано в примере 53, заменяя трет-бутил-3-(гидроксиметил)-3-метилпирролидин-1-карбоксилат на трет-бутил-4-(гидроксиметил)-4-метилпиперидин-1-карбоксилат. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38 (s, 3Н), 1,64 (s, 3Н), 2,25-2,42 (m, 1H), 2,59-2,76 (m, 1H), 3,27-3,32 (m, 2Н), 3,39-3,53 (m, 1H), 3,54-3,71 (m, 2Н), 3,71-3,88 (m, 1H), 7,33-7,39 (m, 1H), 7,57-7,70 (m, 1H), 7,76-7,90 (m, 1H), 8,28-8,80 (m, 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 91
3-(1,3-диметилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
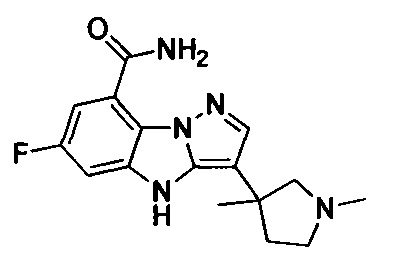
Данный пример получали согласно способу, описанному в примере 90. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 8,52 (br.s., 1H), 7,84 (s, 1H), 7,67 (dd, J=2,5, 10,9 Гц, 1H), 7,38 (dd, J=2,5, 8,0 Гц, 1H), 3,74 (d, J=11,3 Гц, 1H), 3,67-3,49 (m, 2Н), 3,40 (d, J=11,3 Гц, 1H), 2,96 (s, 3Н), 2,73-2,60 (m, 1H), 2,34 (td, J=7,8, 13,4 Гц, 1H), 1,64 (s, 3Н). LCMS (ESI) масса/заряд: 316 (М+1).
Пример 92
6-Фтор-3-(1-изопропил-3-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
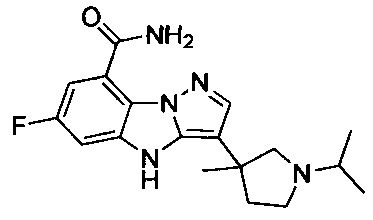
Данный пример получали согласно способу, описанному в примере 90. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,38-1,52 (m, 6Н), 1,71 (d, J=2,26 Гц, 3Н), 2,32-2,46 (m, 1H), 2,63-2,82 (m, 1H), 3,38-3,70 (m, 3Н), 3,76-4,11 (m, 2Н), 7,58-7,70 (m, 1H), 7,76-7,86 (m, 1H), 8,15-8,29 (m, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 93
3-(1-(Циклопропилметил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
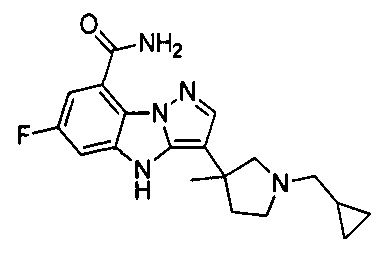
Данный пример получали согласно способу, описанному в примере 5. 1Н ЯМР (400 МГц, метанол-d4) ppm 0,41-0,52 (m, 2Н), 0,70-0,82 (m, 2Н), 1,10-1,26 (m, 1H), 1,66 (s, 3Н), 2,27-2,39 (m, 1H), 2,63-2,75 (m, 1H), 3,17 (d, J=7,15 Гц, 2Н), 3,44-3,58 (m, 1H), 3,59-3,78 (m, 2Н), 3,79-3,94 (m, 1H), 7,27-7,40 (m, 1H), 7,55-7,67 (m, 1H), 7,77-7,89 (m, 1H), 8,43-8,69 (m, 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 94
6-Фтор-3-(3-метил-1-(оксетан-3-ил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
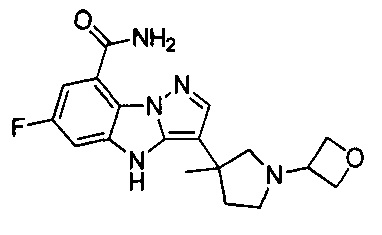
Данный пример получали согласно способу, описанному в примере 5. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,58 (s, 3Н), 2,01-2,10 (m, 1Н), 2,26-2,35 (m, 1H), 2,68-2,74 (m, 1H), 2,79-2,87 (m, 1H), 2,87-2,96 (m, 1H), 2,96-3,03 (m, 1H), 3,78-3,85 (m, 1H), 4,62-4,72 (m, 1H), 4,74-4,81 (m, 1H), 7,31-7,40 (m, 1H), 7,64-7,71 (m, 1H), 7,72-7,77 (m, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 95
6-Фтор-3-(1-(2-фторэтил)-3-метилпирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
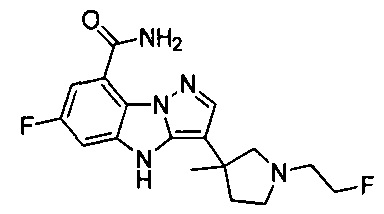
Данный пример получали согласно способу, описанному в примере 3. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,635 (s, 1Н), 2,243-2,263 (m, 1H), 2,522-2,554 (m, 1Н), 3,288-3,321 (d, 1H), 3,325 (s, 2Н), 3,329-3,337 (m, 1Н), 3,391-3,414 (m, 1Н), 3,632-3,659 (d, 1H), 4,730-4,860 (dt, 2Н), 7,291-7,317 (dd, 1Н), 7,586-7,619 (dd, 1H), 7,788 (s, 1Н), 8,445 (bs, 1Н), LCMS (ESI) масса/заряд: 348 (М+1).
Пример 96
3-(1-((2,2-Дифторциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4H-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
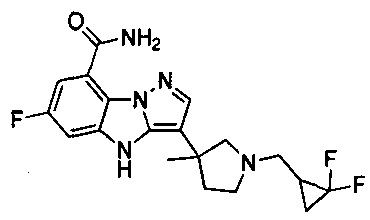
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,34-1,46 (m, 1H) 1,64 (s, 3Н) 1,67-1,79 (m, 1H) 2,03-2,11 (m, 1H) 2,20-2,31 (m, 1H) 2,52-2,63 (m, 1H) 3,13-3,24 (m, 1H) 3,24-3,31 (m, 2Н) 3,37-3,48 (m, 1H) 3,48-3,58 (m, 1H) 3,59-3,67 (m, 1H) 7,29-7,39 (m, 1H) 7,57-7,67 (m, 1H) 7,76-7,84 (m, 1H) 8,35-8,54 (m, 1H). LCMS (ESI) масса/заряд: 392 (М+1).
Пример 97
6-Фтор-3-(3-метил-1-(2,2,2-трифторэтил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
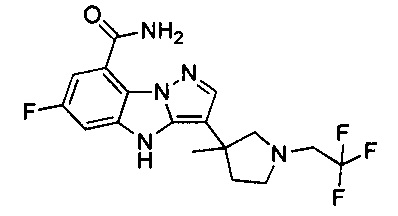
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,74 (s, 3Н), 2,39-2,54 (m, 1H), 2,74-2,88 (m, 1H), 3,69-3,82 (m, 1H), 3,82-3,95 (m, 2Н), 3,97-4,14 (m, 1H), 4,36-4,50 (m, 2Н), 7,55-7,64 (m, 1H), 7,73-7,83 (m, 1H), 8,12-8,20 (m, 1H). LCMS (ESI) масса/заряд: 384 (М+1).
Пример 98
6-Фтор-3-(3-метил-1-(2-(метилсульфонил)этил)пирролидин-3-ил)-4Н-бензо][4,5]имидазо[1,2-b]пиразол-8-карбоксамид
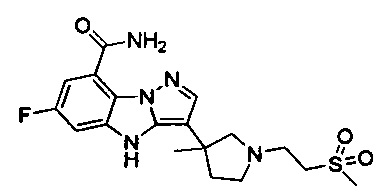
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 1,60 (s, 3Н), 2,05-2,15 (m, 1H), 2,18-2,28 (m, 1H), 2,63-2,69 (m, 1H), 2,69-2,78 (m, 1H), 3,01-3,10 (m, 1H), 3,11 (s, 3Н), 3,26-3,31 (m, 1H), 3,34-3,41 (m, 2Н), 3,41-3,50 (m, 1H), 3,50-3,60 (m, 1H), 7,35-7,45 (m, 1H), 7,63-7,70 (m, 1H), 7,72 (s, 1H), 8,22 (s, 1H). LCMS (ESI) масса/заряд: 408 (М+1).
Пример 99
6-Фтор-3-(3-метил-1-(3,3,3-трифторпропил)пирролидин-3-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
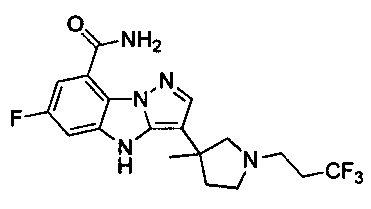
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4,) ppm 1,62 (s, 3Н), 2,16-2,25 (m, 1H), 2,43-2,53 (m, 1H), 2,58-2,72 (m, 1H), 3,08-3,14 (m, 1H), 3,16-3,29 (m, 1H), 3,34-3,39 (m, 1H), 3,41-3,47 (m, 1H), 7,32-7,41 (m, 1H), 7,63-7,71 (m, 1H), 7,74-7,83 (m, 1H), 8,24-8,34 (m, 1H). LCMS (ESI) масса/заряд: 398 (М+1).
Пример 100
3-(1-((1-Аминоциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
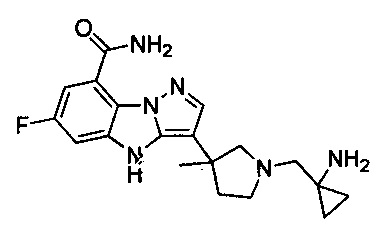
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) ppm 0,85 (s, 1H), 1,00 (s, 1H), 1,62 (s, 3Н), 2,07-2,17 (m, 1H), 2,34-2,44 (m, 1H), 2,85 (s, 1H), 2,94-3,01 (m, 1H), 3,04-3,12 (m, 1H), 3,20 (d, J=9,41 Гц, 1H), 7,33-7,39 (m, 1H), 7,64-7,70 (m, 1H), 7,75-7,80 (m, 1H), 7,83-7,85 (m, 1H), 8,02-8,05 (m, 1H), 8,34-8,47 (m, 1H). LCMS (ESI) масса/заряд: 371 (М+1).
Пример 101
3-(1-((1-Цианоциклобутил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
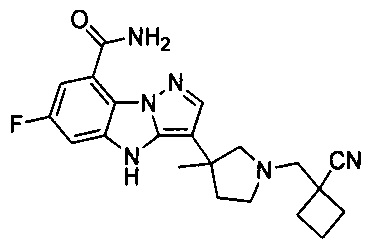
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, метанол-d4) 1,60 (s, 3Н), 2,00-2,11 (m, 2Н), 2,13-2,23 (m, 1H), 2,25-2,40 (m, 3Н), 2,45-2,58 (m, 2Н), 2,65-2,70 (m, 1H), 2,72-2,80 (m, 1H), 2,93 (s, 1H), 2,99-3,06 (m, 1H), 3,14-3,23 (m, 2Н), 7,38-7,44 (m, 1H), 7,69 (dd, J=10,85, 2,57 Гц, 1H), 7,74 (s, 1H), 8,33 (br.s., 1H). LCMS (ESI) масса/заряд: 395 (М+1).
Пример 102
3-(1-((1-Цианоциклопропил)метил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
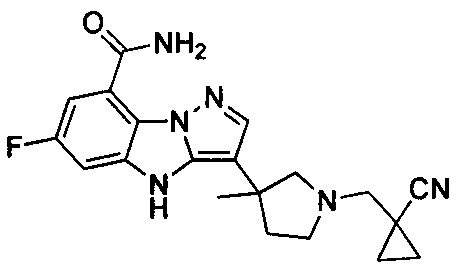
Данный пример получали согласно способу, описанному в примере 3. 1Н ЯМР (400 МГц, DMSO-d6) ppm 0,92 (d, J=2,26 Гц, 2H), 1,16-1,24 (m, 2Н), 1,48 (s, 3Н), 1,87-1,97 (m, 1H), 2,05 (s, 1H), 2,55 (d, J=7,53 Гц, 4H), 2,91 (s, 2Н), 7,43-7,50 (m, 1H), 7,51-7,61 (m, 1H), 7,79 (s, 1H). LCMS (ESI) масса/заряд: 381 (М+1).
Пример 103
3-(1-(2-Цианоэтил)-3-метилпирролидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
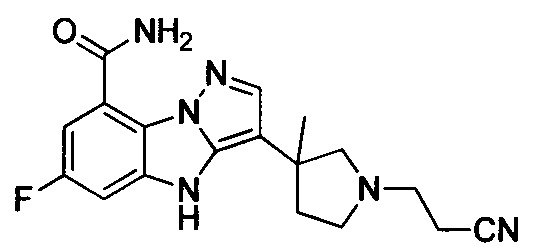
Данный пример получали согласно способу, описанному в примере 88. 1H ЯМР (400 МГц, метанол-d4) ppm 1,61 (s, 3Н), 2,06-2,16 (m, 1H), 2,23-2,33 (m, 1H), 2,80 (d, J=6,40 Гц, 1H), 2,83-2,91 (m, 1H), 2,93-3,02 (m, 1H), 3,03-3,12 (m, 1H), 3,27 (d, J=9,29 Гц, 2Н), 7,37-7,44 (m, 1H), 7,64-7,72 (m, 1H), 7,76 (s, 1H), 8,14-8,26 (m, 1H). LCMS (ESI) масса/заряд: 355 (М+1).
Пример 104
3-(1-(Циклопропилметил)-3-метилазетидин-3-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
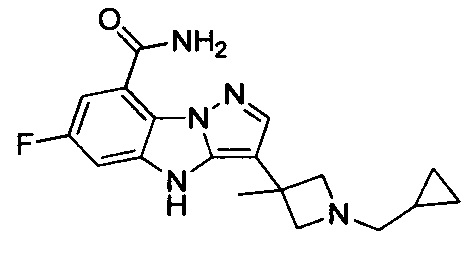
Данный пример получали согласно способу, описанному в примере 93. 1Н ЯМР (400 МГц, MeOD) δ: 8,51 (s, 1H), 7,96 (s, 1H), 7,70-7,73 (dd, 1H), 7,39-7,41 (dd, 1H), 4,39-4,32 (d, 2Н), 4,23-4,26 (d, 2Н), 3,15-3,17 (d, 2Н), 1,87 (s, 3Н), 1,06-1,08 (m, 1H), 0,69-0,74 (m, 2Н), 0,42-0,46 (m, 2Н). LCMS (ESI) масса/заряд: 342 (М+1).
Схема D
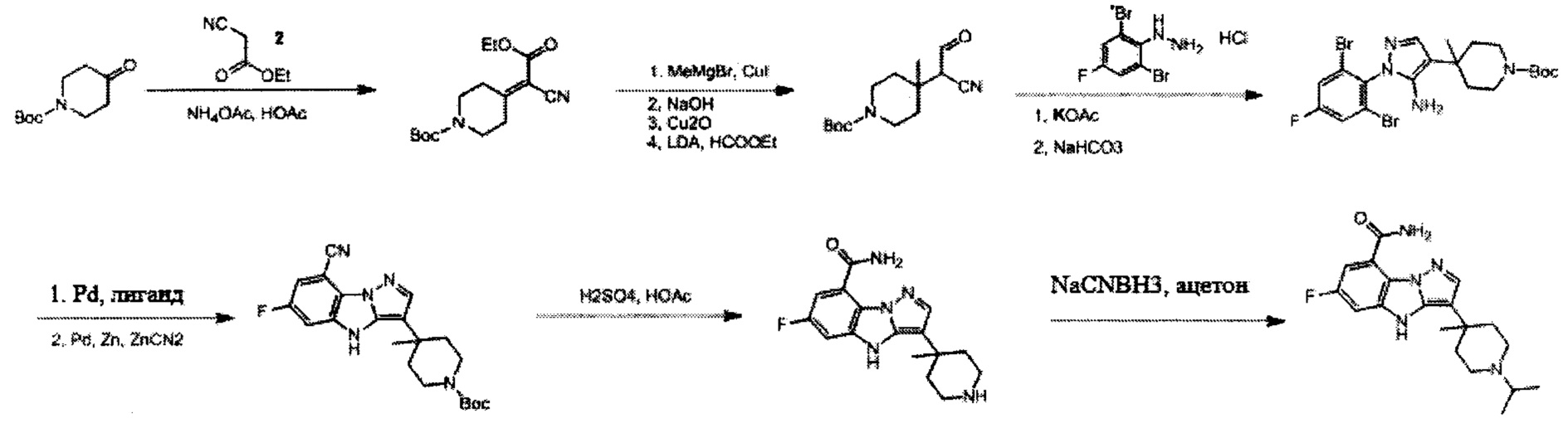
Пример 105
6-Фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
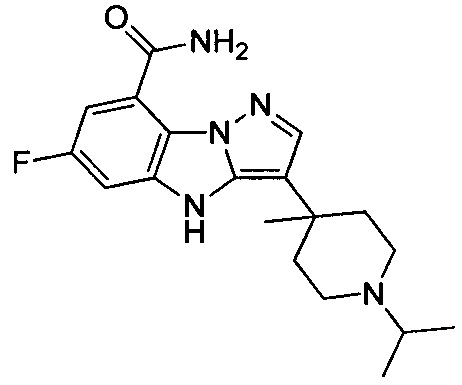
Пример 105А
трет-Бутил 4-(1-циано-2-этокси-2-оксоэтилиден)пиперидин-1-карбоксилат
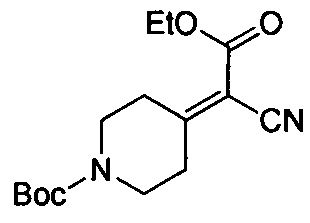
Смесь трет-бутил-4-оксопиперидин-1-карбоксилата (100 г, 0,5 моль), этил-2-цианоацетата (56,5 г, 0,5 моль), NH4OAc (19,2 г, 0,25 моль) и НОАс (15 г, 0,25 моль) в толуоле (1 л) перемешивали при 120°С в течение 5-6 ч для удаления воды посредством насадки Дина-Старка. После удаления растворителя под вакуумом остаток разделяли между EtOAc (500 мл) и водой (500 мл), водный слой экстрагировали с помощью EtOAc (500 мл ×3). Объединенные органические слои промывали солевым раствором (500 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством растирания с РЕ/EtOAc=10/1 (300 мл). Белое твердое вещество собирали посредством фильтрации с получением титульного соединения (90 г, 61% выход). 1Н ЯМР (400 МГц, хлороформ-d) δ ppm 1,38 (t, J=7,15 Гц, 3Н), 1,50 (s, 9Н), 2,79 (t, J=5,90 Гц, 2Н), 3,15 (t, J-5,83 Гц, 2Н), 3,56 (t, J=5,71 Гц, 2Н), 3,63 (t, J=5,83 Гц, 2Н), 4,31 (q, J=7,15 Гц, 2Н). LCMS (ESI) масса/заряд: 295 (М+1).
Пример 105В
трет-Бутил-4-(1-циано-2-этокси-2-оксоэтил)-4-метилпиперидин-1-карбоксилат
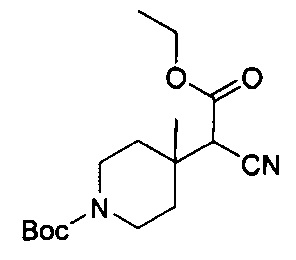
К смеси CuI (86,3 г, 0,454 моль) в сухом THF (1,7 л) по каплям добавляли 3 М метилмагния бромид (378 мл, 1,13 моль) при -60-70°С в атмосфере N2. После перемешивания при -10°С-0°С в течение 1 ч и охлаждения до -60-70°С добавляли раствор примера 105А (133,5 г, 0,454 моль) в THF (300 мл). Смесь перемешивали при 20°С в течение 15 ч, а затем охлаждали до 0°С и гасили насыщ. водн. раствором NH4Cl (1,2 л). После фильтрации через подушку целита, водный слой экстрагировали с помощью EtOAc (600 мл ×3). Объединенные органические слои промывали солевым раствором (500 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением неочищенного титульного соединения (142 г) в виде желтого масла, которое применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 105С
2-(1-(трет-Бутоксикарбонил)-4-метилпиперидин-4-ил)-2-цианоуксусная кислота
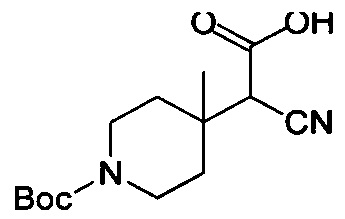
К раствору примера 105В (142 г, неочищенный, 0,458 моль) в смеси THF/MeOH=10:1 (1,2 л) по каплям добавляли раствор NaOH (73,3 г, 1,82 моль) в воде (320 мл) при 0°С. После завершения покапельного добавления смесь перемешивали при 20°С в течение 2 ч, а затем разводили посредством добавления воды (320 мл). Водный слой экстрагировали с помощью EtOAc (500 мл ×3). Объединенные органические слои промывали водой (200 мл ×2). Объединенный водный слой доводили до рН 3-4 с помощью 1н. HCl и экстрагировали с помощью DCM/MeOH=10:1 (300 мл ×6). Объединенный органический слой DCM/MeOH промывали солевым раствором (800 мл), а затем высушивали над Na2SO4, фильтровали и выпаривали с получением неочищенного титульного соединения (111,5 г) в виде желтого твердого вещества, которое применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 105D
трет-Бутил-4-(цианометил)-4-метилпиперидин-1-карбоксилат
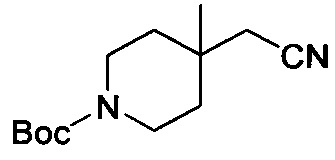
Смесь примера 105С (111,5 г, неочищенный, 0,395 моль) и Cu2O (11,4 г, 79,08 ммоль) в ацетонитриле (900 мл) перемешивали при 80°С в течение 2 ч.
После охлаждения до комнатной температуры смесь выпаривали, и остаток растворяли в EtOAc (1 л) и фильтровали через подушку целита для удаления нерастворимых веществ. Остаток на фильтре промывали с помощью EtOAc (250 мл ×2). К фильтрату добавляли THF (150 мл) для растворения осадков. Органический слой промывали водой, смесью вода/солевой раствор =1:1 (300 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством растирания с РЕ/EtOAc=10/1 (300 мл). Белое твердое вещество собирали посредством фильтрации с получением титульного соединения (98 г). LCMS (ESI) масса/заряд: 239 (М+1).
Пример 105Е
трет-Бутил-4-(1-циано-2-оксоэтил)-4-метилпиперидин-1-карбоксилат
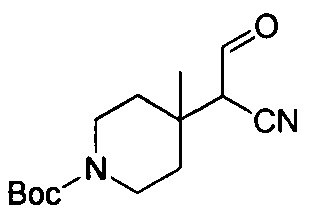
К смеси примера 105D (50 г, 0,21 моль) в THF (400 мл) по каплям добавляли 2 М LDA (160 мл, 0,32 моль) при - 60-70°С в атмосфере N2. После перемешивания при - 60-70°С в течение 1 ч по каплям добавляли этилформиат (32 г, 0,43 моль) до завершения, с последующим медленным нагреванием до 15°С и перемешиванием в течение еще 4 ч. Поле завершения реакционную смесь гасили водн. раствором NH4Cl (500 мл). Водный слой экстрагировали с помощью EtOAc (200 мл ×3). Объединенные органические слои промывали водой (200 мл), 1H. HCl (300 мл ×3), солевым раствором (200 мл), после этого высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который очищали путем растирания с РЕ/EtOAc=10/1 (200 мл). Белое твердое вещество собирали посредством фильтрации с получением титульного соединения (45 г, 80% выход). LCMS (ESI) масса/заряд: 267 (М+1).
Пример 105F
(2,6-Дибром-4-фторфенил)гидразина гидрохлорид
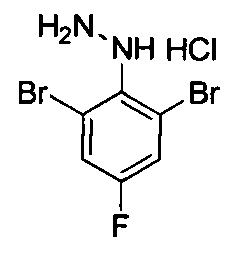
К смеси 2,6-дибром-4-фторанилина (50 г, 0,186 моль) в. конц. HCl (190 мл) по каплям добавляли раствор NaNO2 (14,1 г, 0,205 моль) в воде (70 мл) при -5-0°С. После перемешивания при -5-0°С в течение 40 мин вышеуказанную реакционную смесь по каплям добавляли в раствор SnCl2-2H2O (62,95 г, 0,279 моль) в конц. HCl (240 мл) при -5-0°С. Полученную в результате смесь медленно нагревали до 20°С и перемешивали в течение 12 ч. Твердое вещество собирали посредством фильтрации, промывали с помощью изо-РrOH (200 мл) и после этого высушивали под вакуумом с получением титульного соединения (47 г, 78% выход), которое можно было применять непосредственно на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, DMSO-d6) δ ppm 2,37-2,68 (m, 1H), 6,94-7,28 (m, 1H), 7,80 (d, J=8,03 Гц, 2H), 10,13 (br.s., 3Н).
Пример 105G
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-ил)-4-метилпиперидин-1-карбоксилат
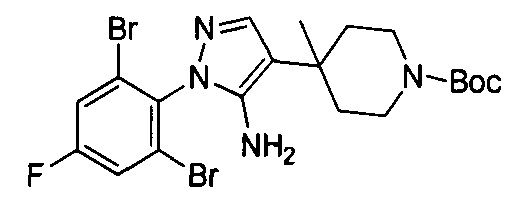
Смесь примера 105Е (50 г, 187,73 ммоль), KОАс (27,64 г, 281,73 ммоль) и примера 105F (72,17 г, 225,28 ммоль) в этаноле (500 мл) перемешивали при 60°С в течение 5 ч. После завершения реакции к смеси добавляли NaHCO3 (31,57 г, 375,78 ммоль) при перемешивании при 80°С в течение еще 15 ч. После охлаждения до комнатной температуры полученную в результате смесь выпаривали и остаток растворяли с помощью EtOAc (200 мл) и воды (200 мл). Водный слой экстрагировали с помощью EtOAc (200 мл ×3). Объединенные органические слои промывали солевым раствором (200 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством растирания с РЕ/EtOAc=10/1 (200 мл). Белое твердое вещество собирали посредством фильтрации с получением титульного соединения (75 г, 75% выход), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 105Н
трет-Бутил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
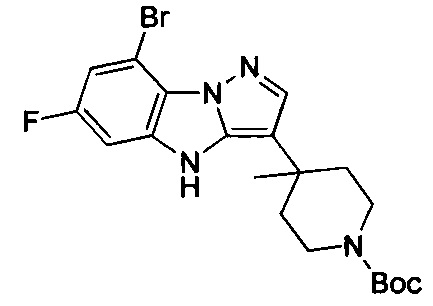
Смесь примера 105G (35 г, 65,78 ммоль), Pd2(dba)3 (6,02, 6,57 ммоль), ксантфоса (7,61 г, 13,16 ммоль) и Cs2CO3 (42,77 г, 131,58 ммоль) в DMF (300 мл) перемешивали при 130°С в течение 9 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и фильтрат выпаривали. Остаток растворяли в EtOAc (500 мл). Органический слой промывали водой (200 мл ×2), солевым раствором (200 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали с получением неочищенного титульного соединения в виде коричневого масла, которое можно было применять на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 451, 453 (М, М+2).
Пример 105I
трет-Бутил-4-(8-циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
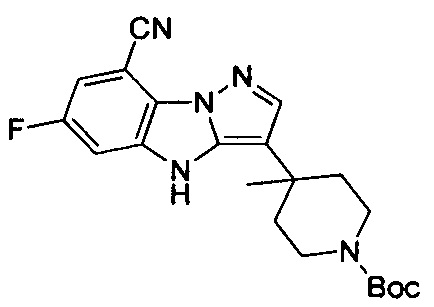
Смесь примера 105Н (29,7 г, неочищенный, 65,8 ммоль), Zn(CN)2 (15,4 г, 131,71 ммоль), Pd2(dba)3 (6,02 г, 6,58 ммоль), DPPF (7,30 г, 13,17 ммоль) и Zn (8,65 г, 131,71 ммоль) в DMF (300 мл) перемешивали при 120°С в течение 5 ч в атмосфере N2. После охлаждения до комнатной температуры смесь фильтровали и фильтрат выпаривали с получением остатка, который очищали посредством колоночной хроматографии с получением неочищенного титульного соединения (35 г, неочищенное) в виде желтой пены. LCMS (ESI) масса/заряд: 398 (М+1).
Пример 105J
трет-Бутил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
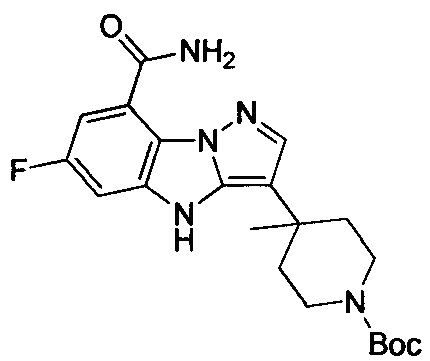
К раствору примера 105I (35 г, неочищенный, 88,17 ммоль) и 1H. NaOH (140 мл, 140 ммоль) в DMSO (100 мл) по каплям добавляли 30% H2O2 (40 мл) при 0°С. После завершения покапельного добавления реакционный раствор нагревали до 40-50°С и перемешивали в течение 2 часов, а после этого разводили водой (200 мл) и экстрагировали с помощью EtOAc/THF=3/1 (200 мл ×2). Объединенные органические слои промывали водой (150 мл ×2), солевым раствором (150 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (12,2 г, выход: 45%) в виде желтых твердых веществ. LCMS (ESI) масса/заряд: 416 (М+1).
Пример 105K
6-Фтор-3-(4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
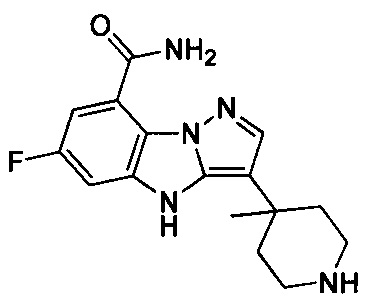
Раствор примера 105J (5 г, 12 ммоль) в смеси DCM/TFA (50 мл/10 мл) перемешивали при 20°С в течение 2 ч. Полученную в результате смесь выпаривали с получением титульного соединения в виде желтого масла, которое можно было применять на следующей стадии без дополнительной очистки.
Пример 105L
6-Фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
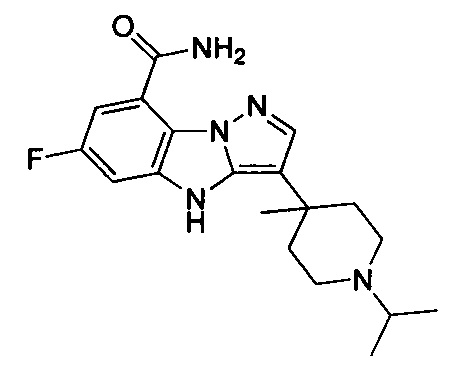
Раствор примера 105K (3,8 г, неочищенный, 12 ммоль), Na(CN)BH3 (2,8 г, 60 ммоль) в смеси ацетона (2,0 г, 34 ммоль) и метанола (50 мл) перемешивали при 25°С в течение 3 ч. После удаления раствора под вакуумом остаток растворяли в EtOAc/THF=5/1 (200 мл). Органические слои промывали водой (50 мл ×2), солевым раствором (50 мл), затем высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (4 г, выход: 90%). 1Н-ЯМР (400 МГц, DMSO-d6) δ ppm 1,11-1,61 (m, 9 Н), 1,89-2,29 (m, 2Н), 2,47 (br.s., 1H), 2,55 (br.s., 1H), 2,77 (d, J=12,05 Гц, 1H), 3,09-3,66 (m, 4Н), 7,53 (dd, J=8,28, 2,51 Гц, 1H), 7,63 (dt, J=10,92, 2,26 Гц, 1H), 7,79-7,99 (m, 1H), 8,17 (br.s., 1H), 10,23-10,75 (m, 2H), 12,49-12,93 (m, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 106
6-Фтор-3-(4-метил-1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
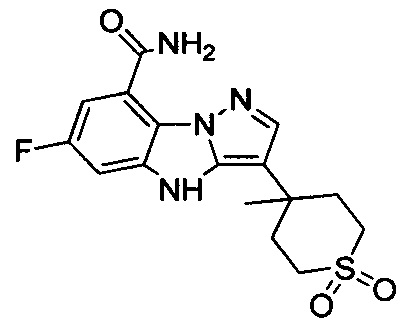
Пример 106А
8-Бром-6-фтор-3-(4-метилтетрагидро-2Н-тиопиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол
Данный пример получали, как описано в примерах 105А-105Н, заменяя дигидро-2Н-тиопиран-4(3Н)-он на трет-бутил-4-оксопиперидин-1-карбоксилат. LCMS (ESI) масса/заряд: 368, 370 (М, М+2).
Пример 106В
4-(8-Бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилтетрагидро-2Н-тиопиран-1,1-диоксид
Смесь примера 106А (0,1 г, 0,271 ммоль) и тСРВА (0,94 г, 0,542 ммоль) в DCM (15 мл) и THF (3 мл) перемешивали при 25°С в течение 3 ч. Смесь гасили насыщ. водн. раствором Na2SO3 (20 мл). Водный слой экстрагировали с помощью DCM (15 мл ×3). Объединенные органические слои промывали насыщ. водн. раствором NaHCO3 (20 мл), солевым раствором (15 мл), высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения, которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 106С
6-Фтор-3-(4-метил-1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
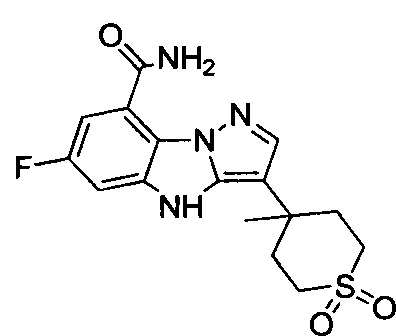
Данный пример получали, как описано в примерах 105I и 105J. 1Н ЯМР (400 МГц, MeOD) δ: 7,8798 (s, 1H), 7,56-7,59 (d, 1H), 7,46-7,48 (d, 1H), 3,11 (m, 2Н), 2,95-3,01 (m, 2Н), 2,52 (m, 2Н), 2,13-2,19 (m, 2Н), 1,35 (s, 3Н). LCMS (ESI) масса/заряд: 365 (М+1).
Пример 107
3-(1,4-Диэтилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
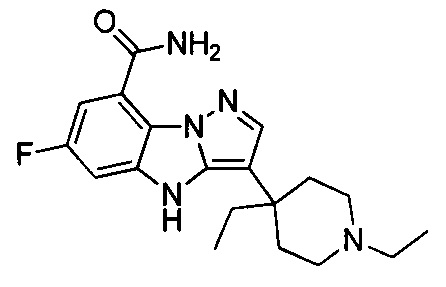
Пример 107А
трет-Бутил-4-(1-циано-2-этокси-2-оксоэтил)-4-этилпиперидин-1-карбоксилат 1,4-этилпиперидин-4-ил
К смеси примера 105А (1,0 г, 3,4 ммоль) в THF (20 мл) по каплям добавляли этилмагния бромид (2,83 мл, 8,49 ммоль) при -78°С в атмосфере N2. После перемешивания при -78°С в течение 1 ч, смесь нагревали до 32°С и перемешивали в течение 15 ч, а затем гасили насыщ. водн. раствором NH4Cl (100 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали солевым раствором (200 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,8 г, выход: 73%) в виде бесцветного масла. LCMS (ESI) масса/заряд: 325 (М+1).
Пример 107В
3-(1,4-Диэтилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
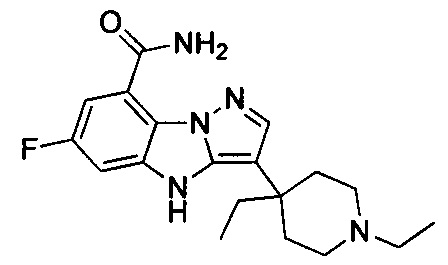
Данный пример получали, как описано в примере 105. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,80 (t, J=7,47 Гц, 3Н), 1,28 (t, J=7,34 Гц, 3Н), 1,72 (d, J=7,40 Гц, 1H), 1,89-2,14 (m, 1H), 2,41-2,61 (m, 1H), 3,06 (d, J=7,28 Гц, 3Н), 3,37-3,58 (m, 1H), 7,35 (dd, J=8,16, 2,51 Гц, 1H), 7,69 (dd, J=10,92, 2,64 Гц, 1H), 7,76 (s, 1H), 8,52 (s, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 108
3-(4-Циано-1-(циклопропилметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
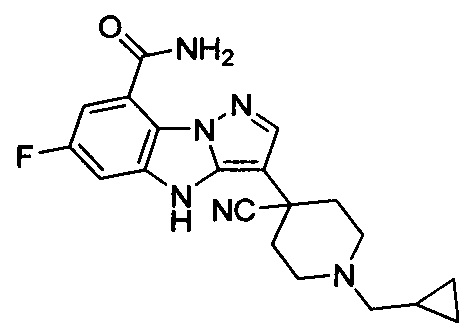
Пример 108А
трет-Бутил-4-циано-4-(цианометил)пиперидин-1-карбоксилат
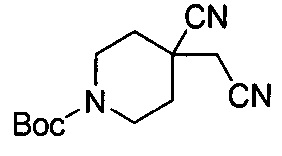
Раствор примера 105А (2,0 г, 6,8 ммоль) и KCN (1,71 г, 26,3 ммоль) в смеси этанола (20 мл)/воды (4 мл) перемешивали при 70-80°С в течение 15 ч. После удаления раствора под вакуумом остаток растворяли посредством добавления воды (100 мл). Водную фазу экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали солевым раствором (200 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (1,3 г, выход: 79%) в виде белого твердого вещества. LCMS (ESI) масса/заряд: 250 (М+1).
Пример 108В
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-ил)-4-цианопиперидин-1-карбоксилат
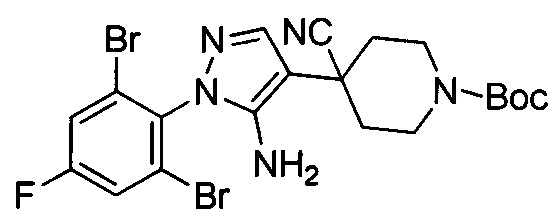
Данный пример получали, как описано в примерах 105E-105G.
Пример 108С
трет-Бутил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-цианопиперидин-1-карбоксилат
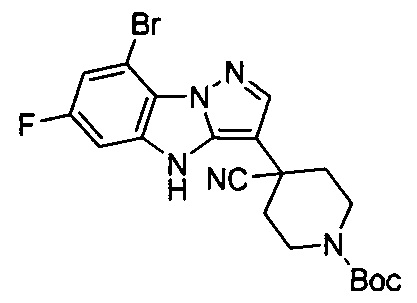
Смесь примера 108В (660 мг, 1,22 ммоль), CuI (70 мг, 0,37 ммоль), N1,N2-диметилэтан-1,2-диамина (65 мг, 0,74 ммоль) и K3PO4 (780 мг, 3,68 ммоль) в DMF (15 мл) перемешивали при 70°С в течение 10 часов в атмосфере N2. После охлаждения до комнатной температуры, полученную в результате смесь фильтровали через подушку целита. Фильтрат выпаривали и остаток очищали посредством колоночной хроматографии с получением титульного соединения (470 мг, выход: 78%) в виде белых твердых веществ. LCMS (ESI) масса/заряд: 462, 464 (М, М+2).
Пример 108D
3-(4-Цианопиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
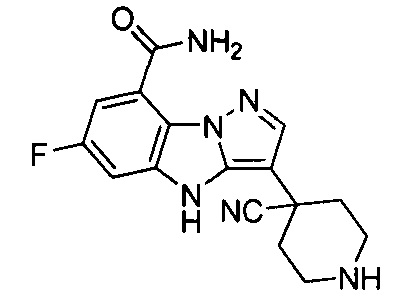
Данный пример получали, как описано в примерах 1G-1J. LCMS (ESI) масса/заряд: 327 (М+1).
Пример 108Е
3-(4-Циано-1-(циклопропилметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
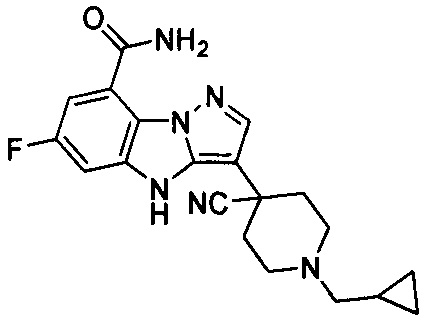
Данный пример получали согласно способу, описанному в примере 5. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,34 (d, J=5,90 Гц, 2Н), 0,67-0,75 (m, 2Н), 0,99-1,13 (m, 1H), 2,37 (br.s., 2Н), 2,58 (br.s., 2Н), 2,75 (d, J=6,90 Гц, 2Н), 2,89-3,07 (m, 2Н), 3,39-3,61 (m, 2Н), 7,44 (dd, J=8,09, 2,57 Гц, 1H), 7,75 (dd, J=10,85, 2,57 Гц, 1H), 7,90 (s, 1H), 8,34-8,47 (m, 1H). LCMS (ESI) масса/заряд: 381 (М+1).
Пример 109
3-(1-Циклопропилметил)-4-(гидроксиметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
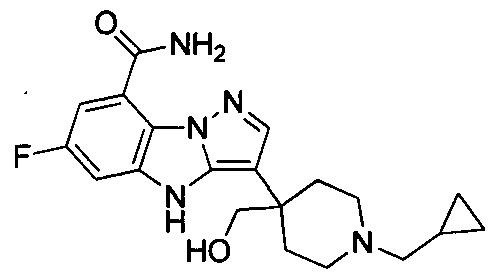
Пример 109А
4-(8-Бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-1-(трет-бутоксикарбонил)пиперидин-4-карбоновая кислота
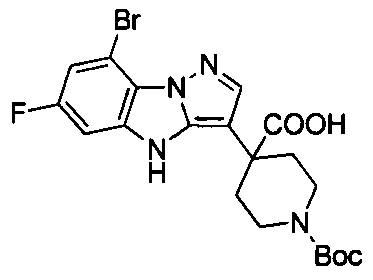
Смесь примера 108С (800 мг, 1,73 ммоль) и 40% водн. раствора NaOH (5 мл) в этаноле (25 мл) перемешивали при 80-90°С в течение 15 ч. После охлаждения до комнатной температуры смесь подкисляли до рН 3-4 с помощью 1н. HCl и экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой (50 мл ×2), солевым раствором (50 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (850 мг, чистота: 79%, выход: 98%) в виде желтого твердого вещества, которое применяли непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 481, 483 (М, М+2).
Пример 109В
трет-Бутил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-(гидроксиметил)пиперидин-1-карбоксилат
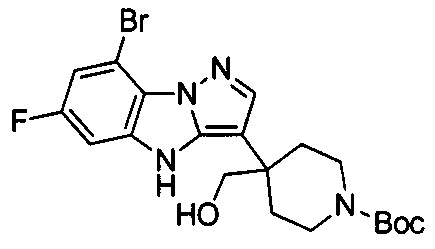
К смеси примера 109А (800 мг, 1,56 ммоль) в THF (15 мл) добавляли 10 М ВН3-DMS (1 мл, 10 ммоль) при 0°С в атмосфере N2. После завершения покапельного добавления смесь перемешивали при 0°С в течение 2 часов, а затем гасили с помощью МеОН (20 мл) и растворитель выпаривали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде белых твердых веществ. (508 мг, выход: 70%). LCMS (ESI) масса/заряд: 467, 469 (М, М+2).
Пример 109С
трет-Бутил-4-(8-циано-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-(гидроксиметил)пиперидин-1-карбоксилат
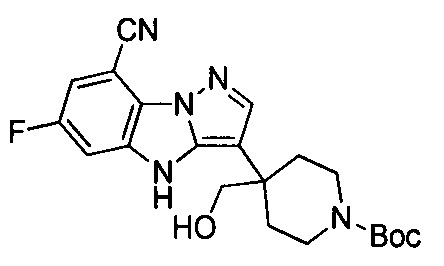
Смесь примера 109В (450 мг, 0,96 ммоль), Zn(CN)2 (225 мг, 1,92 ммоль), Pd2(dba)3 (176 мг, 0,19 ммоль), DPPF (215 мг, 0,38 ммоль) и Zn (125 мг, 1,92 ммоль) в DMF (5 мл) перемешивали при 120°С в течение 15 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и фильтрат концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде коричневых твердых веществ (387 мг, выход: 87%). LCMS (ESI) масса/заряд: 414 (М+1).
Пример 109D
трет-Бутил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-(гидроксиметил)пиперидин-1-карбоксилат
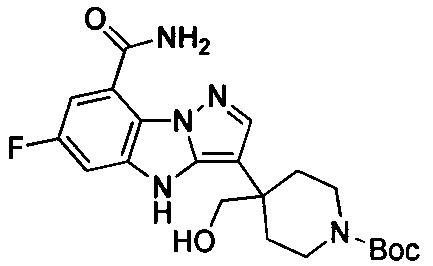
К смеси примера 109С (350 мг, 0,85 ммоль) и K2CO3 (600 мг, 4,34 ммоль) в DMSO (10 мл) по каплям добавляли 30% H2O2 (10 мл) при 0°С. После завершения покапельного добавления смесь перемешивали при 25°С в течение 10 ч, а затем разводили водой (50 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой (50 мл ×2), солевым раствором (50 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения в виде желтых твердых веществ (270 мг, выход: 68%). LCMS (ESI) масса/заряд: 432 (М+1).
Пример 109Е
6-Фтор-3-(4-(гидроксиметил)пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
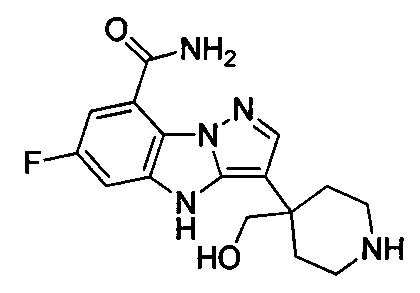
Смесь примера 109D (100 мг, 0,23 ммоль) в DCM (10 мл) и TFA (3 мл) перемешивали при 25°С в течение 3 ч. Полученную в результате смесь выпаривали с получением титульного соединения в виде желтого масла, которое можно было применять непосредственно на следующей стадии без дополнительной очистки. LCMS (ESI) масса/заряд: 332 (М+1).
Пример 109F
3-(1-(Циклопропилметил)-4-(гидроксиметил)пиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
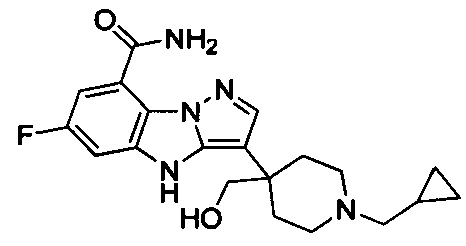
Данный пример получали согласно способу, описанному в примере 108Е. 1Н-ЯМР (400 МГц, DMSO-d6+D2O) δ ppm 0,06-0,35 (m, 2Н), 0,44-0,70 (m, 2Н), 0,81-1,14 (m, 1H), 1,57-2,01 (m, 1H), 2,05-2,47 (m, 1H), 2,57-2,98 (m, 1H), 3,08-3,28 (m, 1H), 3,32-3,52 (m, 1H), 7,38-7,69 (m, 2Н), 7,80 (s, 1H), 8,34 (s, 1H). LCMS (ESI) масса/заряд: 386 (М+1).
Пример 110
Метил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-1-(циклопропилметил)пиперидин-4-карбоксилат
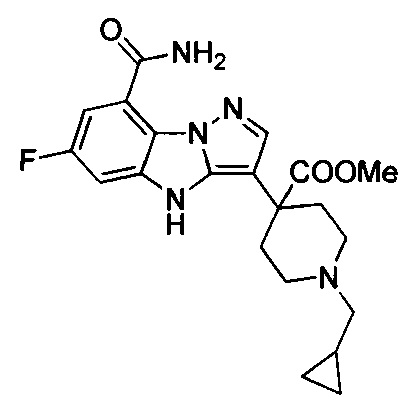
Пример 110А
1-(трет-Бутил)-4-метил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)пиперидин-1,4-дикарбоксилат
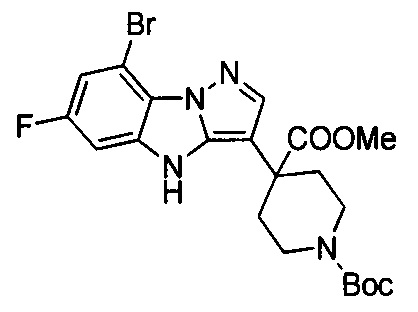
К раствору примера 109А (250 мг, 0,52 ммоль) в смеси MeOH/DCM=10/1 (1 мл) по каплям добавляли TMSCH2N2 (0,52 мл, 1,04 ммоль) при 0°С в атмосфере N2. После перемешивания при 0°С в течение 5 мин реакционный раствор гасили НОАс/H2O=1/10 (20 мл). Водный слой экстрагировали с помощью CH2Cl2 (50 мл ×2). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (200 мг, выход: 78%). LCMS (ESI) масса/заряд: 495, 497 (М, М+2).
Пример 10В
Метил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-1-(циклопропилметил)пиперидин-4-карбоксилат
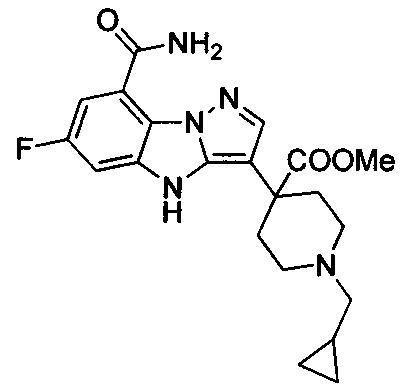
Данный пример получали согласно способу, описанному в примерах 109C-109F (11 мг, выход: 37%). LCMS (ESI) масса/заряд: 414 (М+1). 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,34 (d, J=5,90 Гц, 2Н), 0,67-0,75 (m, 2Н), 0,99-1,13 (m, 1H), 2,37 (br.s., 2Н), 2,58 (br.s., 2Н), 2,75 (d, J=6,90 Гц, 2Н), 2,89-3,07 (m, 2Н), 3,39-3,61 (m, 2Н), 7,44 (dd, J=8,09, 2,57 Гц, 1H), 7,75 (dd, J=10,85, 2,57 Гц, 1H), 7,90 (s, 1H), 8,34-8,47 (m, 1H). LCMS (ESI) масса/заряд: 414 (М+1).
Схема Е
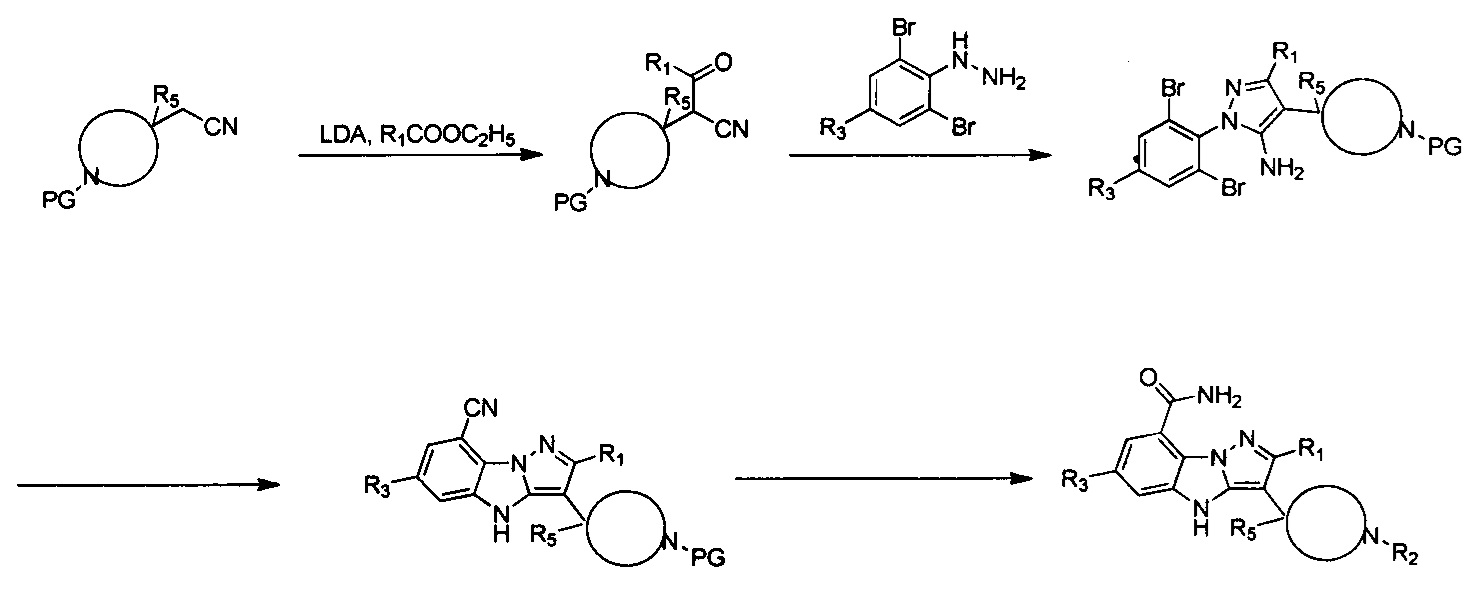
Пример 111
3-(1-(Циклопропилметил)-4-метилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
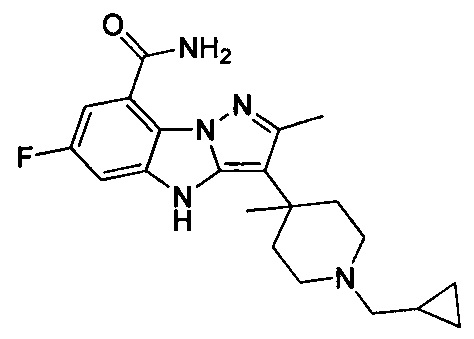
Пример 111А
трет-Бутил-4-(1-циано-2-оксопропил)-4-метилпиперидин-1-карбоксилат
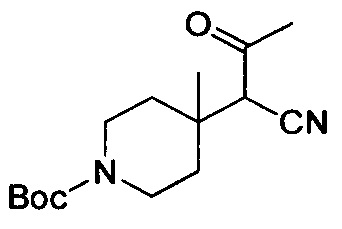
К раствору примера 53С (5,0 г, 21,0 ммоль) в сухом THF (60 мл) по каплям добавляли LDA (26 мл, 52,0 ммоль) при -78°С в атмосфере N2, с последующим покапельным добавлением Ac2O (5,4 г, 52,0 ммоль) после перемешивания при -78°С в течение 1 ч. Полученную в результате смесь медленно нагревали до комнатной температуры и перемешивали в течение 30 мин. Смесь гасили насыщ. водн. раствором NH4Cl (30 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×2). Объединенные органические слои выпаривали и остаток очищали посредством колоночной хроматографии с получением титульного соединения (4,5 г, выход: 76,5%) в виде желтого масла. LCMS (ESI) масса/заряд: 281 (М+1).
Пример 111В
трет-Бутил-4-(1-циано-2-(2-(2,6-дибром-4-фторфенил)гидразоно)пропил)-4-метилпиперидин-1-карбоксилат
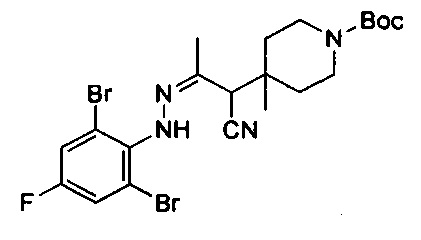
Смесь примера 111А (2,0 г, 7,14 ммоль), НОАс (0,2 мл) и примера 1D (2,4 г, 8,57 ммоль) в EtOH (30 мл) перемешивали при 70°С в течение 16 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (2,1 г, выход: 53,8%) в виде светло-желтого твердого вещества.
Пример 111С
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-3-метил-1H-пиразол-4-ил)-4-метилпиперидин-1-карбоксилат
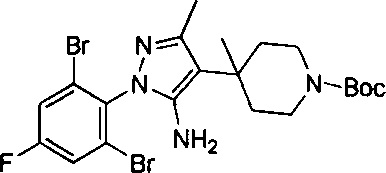
Смесь примера 111В (2,1 г, 3,84 ммоль) и K2CO3 (2,1 г, 15,4 ммоль) в EtOH (30 мл) нагревали до 80°С и перемешивали в течение 4 ч. После удаления раствора под вакуумом остаток очищали посредством колоночной хроматографии с получением титульного соединения (0,8 г, выход: 54,4%) в виде светло-красного твердого вещества.
Пример 111D
трет-Бутил-4-(8-бром-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
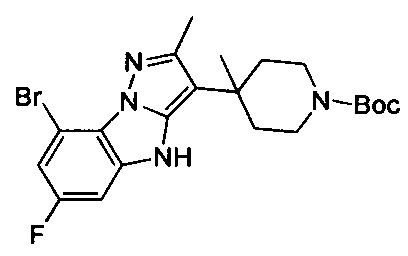
Смесь примера 111С (700 мг, 1,28 ммоль), CuI (73 мг, 0,38 ммоль), K3PO4 (814 мг, 3,84 ммоль) и N,N-диметил-1,2-этан-1,2-диамина (68 мг, 0,76 ммоль) в DMF (15 мл) перемешивали при 70°С в течение 5 ч в атмосфере N2. После охлаждения до комнатной температуры смесь фильтровали и фильтрат концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (400 мг, выход: 67,0%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 465, 467 (М, М+2).
Пример 111Е
трет-Бутил-4-(8-циано-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
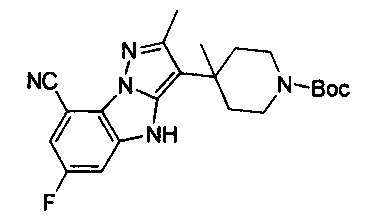
Смесь примера 111D (650 мг, 1,39 ммоль), Zn(CN)2 (326 мг, 2,78 ммоль), Pd2(dba)3 (254 мг, 0,28 ммоль), DPPF (309 мг, 0,56 ммоль) и Zn (181 мг, 2,78 ммоль) в DMF (8 мл) перемешивали при 120°С в течение 3 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (450 мг, выход: 78,5%) в виде желтых твердых веществ. LCMS (ESI) масса/заряд: 412 (М+1).
Пример 111F
трет-Бутил-4-(8-карбамоил-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
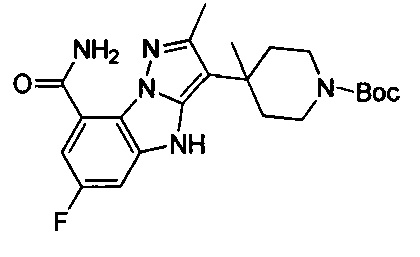
К смеси примера 111Е (450 мг, 1,09 ммоль) и K2CO3 (906 мг, 6,56 ммоль) в DMSO (10 мл) добавляли 30% Н2О2 (6 мл) при 0°С. После завершения покапельного добавления смесь перемешивали при 25°С в течение 16 ч, а затем разводили водой (50 мл). Водную фазу экстрагировали с помощью EtOAc (50 мл ×2). Объединенные органические слои промывали насыщ. водн. раствором Na2SO3 (50 мл ×2), солевым раствором (100 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (450 мг, выход: 95,7%) в виде белых твердых веществ. LCMS (ESI) масса/заряд: 430 (М+1).
Пример 111G
3-(1-Циклопропилметил)-4-метилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
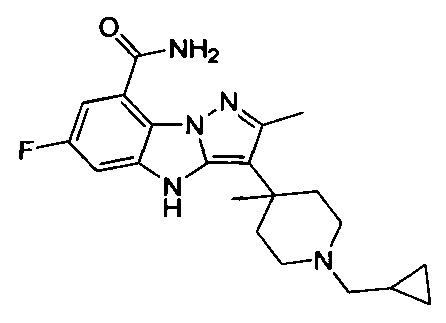
Данный пример получали, как описано в примерах 109Е и 109F. (50 мг, выход: 56,2%). 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,41 (d, J=4,52 Гц, 2Н), 0,64-0,83 (m, 2Н), 1,12 (br.s., 1H), 1,47 (br.s., 3Н), 2,09 (br.s., 2Н), 2,50 (s, 3Н), 2,54-2,71 (m, 2Н), 2,84-3,29 (m, 4Н), 3,52 (br.s., 2Н), 7,28 (d, J=8,03 Гц, 1H), 7,48-7,69 (m, 1H), 8,63 (br.s., 1H). LCMS (ESI) масса/заряд: 384 (М+1).
Пример 112
3-(1-Этил-4-метилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
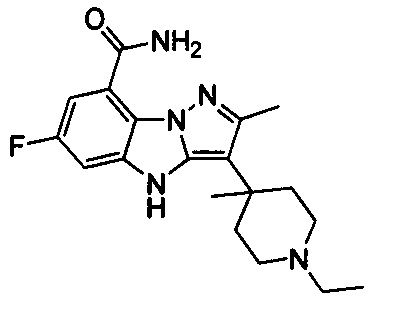
Данный пример получали согласно способу, описанному в примере 111. 1H-ЯМР (400 МГц, метанол-d4) δ ppm 1,20-1,61 (m, 6 Н), 2,09 (br.s., 2Н), 2,49 (s, 3Н), 2,52-2,77 (m, 2Н), 3,17 (br.s., 4Н), 3,49 (br.s., 2Н), 7,16-7,34 (m, 1H), 7,46-7,63 (m, 1H), 8,46 (s, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 113
6-Фтор-3-(1-изобутил-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
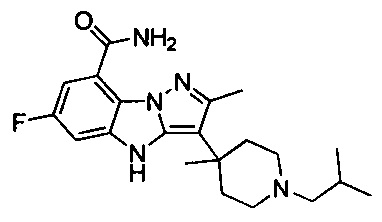
Данный пример получали согласно способу, описанному в примере 111. 1Н ЯМР (400 МГц, DMSO-d6) 0,84 (d, J=6,5 Гц, 7Н), 1,26 (s, 3Н), 1,76 (d, J=6,8 Гц, 3Н), 2,00 (d, J=7,3 Гц, 2Н), 2,13-2,29 (m, 3Н), 2,34 (s, 1H), 2,41 (s, 3Н), 2,68 (s, 1H), 7,36 (dd, J=2,5, 8,3 Гц, 1H), 7,55 (dd, J=2,5, 11,0 Гц, 1H), 8,04 (s, 1H), 8,29 (br.s. 1H), 10,63 (s, 1H). LCMS (ESI) масса/заряд: 386 (М+1).
Пример 114
6-Фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
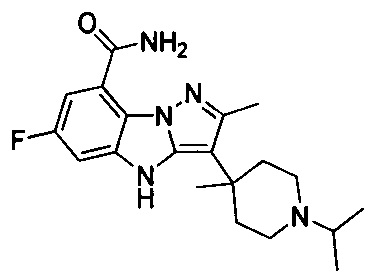
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (400 МГц, метанол-d4) d ppm 1,34 (d, J=5,52 Гц, 6H), 1,47 (br.s., 3Н), 2,11 (br.s., 2Н), 2,51 (s, 3Н), 2,53-2,72 (m, 2Н), 3,11 (br.s., 2Н), 3,44 (br.s., 3Н), 7,20-7,38 (m, 1H), 7,59 (dd, J=10,92, 2,64 Гц, 1H), 8,66 (br.s., 1H). LCMS (ESI) масса/заряд: 372 (М+1).
Пример 115
3-(1,4-Диметилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
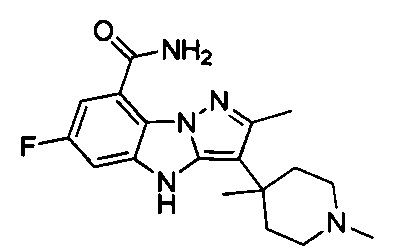
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,46 (s, 3Н), 2,05 (br.s., 2Н), 2,50 (s, 3Н), 2,56 (d, J=11,67 Гц, 2Н), 2,79 (s, 3Н), 3,09 (br.s., 2Н), 3,34-3,41 (m, 2Н), 7,31 (dd, J=8,09, 2,32 Гц, 1H), 7,63 (dd, J=10,98, 2,20 Гц, 1H), 8,55 (s, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 116
6-Фтор-3-(1-(2-гидрокси-2-метилпропил)-4-метилпиперидин-4-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
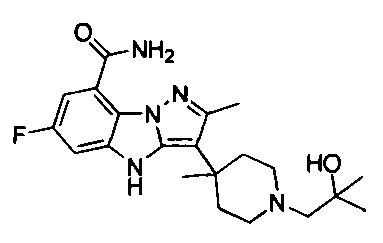
Данный пример получали согласно способу, описанному в примере 111. 1Н ЯМР (400 МГц, DMSO-d6) 1,02-1,14 (m, 6Н), 1,26 (s, 3Н), 1,69-1,81 (m, 2Н), 2,11-2,24 (m, 4Н), 2,32-2,44 (m, 6Н), 2,68 (br.s. 2Н), 7,37 (dd, J=2,5, 8,3 Гц, 1Н), 7,56 (dd, J=2,5, 11,0 Гц, 1H), 8,06 (s, 1H), 8,28 (s, 1H), 10,65 (s, 1H). LCMS (ESI) масса/заряд: 402 (M+1).
Пример 117
3-(1-Этил-2,4-диметилпиперидин-4-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
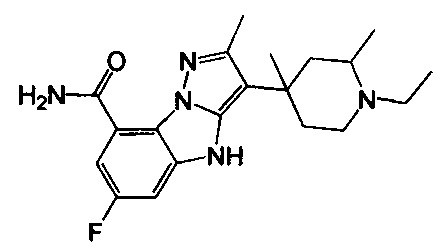
Данный пример получали согласно способу, описанному в примере 111. 1Н ЯМР (400 МГц, DMSO-d6) 1,07 (t, J=7,0 Гц, 3Н), 1,13 (d, J=6,0 Гц, 3Н), 1,41 (s, 3Н), 1,84-1,72 (m, 1Н), 1,97 (d, J=10,8 Гц, 2H), 2,05-2,16 (m, 1H), 2,44 (s, 3H), 2,54-2,70 (m, 2H), 2,77 (br.s. 1H), 2,90-3,03 (m, 2H), 7,41 (dd, J=2,4, 8,4 Гц, 1H), 7,55 (dd, J=2,5, 11,0 Гц, 1H), 8,05 (s, 1H), 8,33 (s, 1H), 10,63 (s, 1H). LCMS (ESI) масса/заряд: 372 (M+1).
Пример 118
3-(1-Этил-3-метилпирролидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
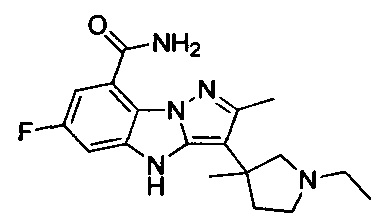
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,37-1,41 (t, 3Н), 1,58 (s, 3Н), 2,47-2,49 (m, 1Н), 2,51 (s, 3Н), 2,67-2,74 (m, 1Н), 3,29-3,30 (m, 2Н), 3,34-3,67 (m, 4Н), 7,33-7,35 (d, 1Н), 7,66-7,69 (d, 1H), 8,52 (bs, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 119
6-Фтор-3-(1-изопропил-3-метилпирролидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
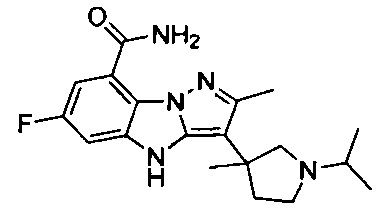
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,36-1,45 (m, 6Н), 1,52-1,59 (m, 3Н), 2,48 (s, 4Н), 2,61-2,73 (m, 1H), 3,45-3,53 (m, 1H), 3,55-3,82 (m, 4Н), 7,24-7,33 (m, 1Н), 7,56-7,68(m, 1Н), 8,40-8,55 (bs, 1H). LCMS (ESI) масса/заряд: 358 (М+1).
Пример 120
3-(1-(Циклопропилметил)-3-метилпирролидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
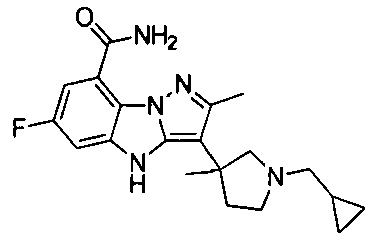
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (MeOD, 400 МГц) δ: 0,59 (d, 2Н), 0,96-1,06 (m, 1Н), 1,53 (s, 3Н), 2,12-2,22 (m, 1H), 2,48 (s, 5Н), 2,83-2,94 (m, 1H), 2,98-3,08 (m, 2Н), 3,11-3,20 (m, 1H), 7,33-7,36 (m, 1Н), 7,61-7,1Н74 (m, 1H). LCMS (ESI) масса/заряд: 370 (М+1).
Пример 121
3-(1,3-Диметилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
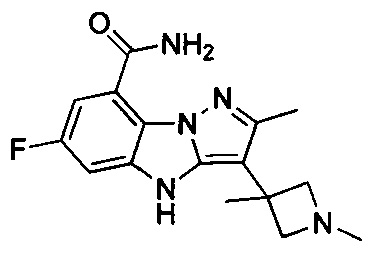
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,74 (s, 3Н), 2,37 (s, 3Н), 2,94 (s, 3Н), 4,27 (d, J=9,79 Гц, 2Н), 4,43 (d, J=9,29 Гц, 2Н), 7,29 (d, J=8,28 Гц, 1H), 7,62 (d, J=10,92 Гц, 1H), 8,51 (br.s., 1H). LCMS (ESI) масса/заряд: 316 (М+1).
Пример 122
3-(1-Этил-3-метилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
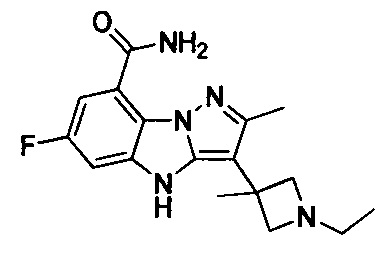
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,01-1,08 (ш, 3Н), 1,65-1,70 (m, 3Н), 2,34 (s, 3Н), 2,55-2,65 (m, 2Н), 3,47-3,53 (m, 2Н), 3,59-3,66 (m, 2Н), 7,28-7,36 (dd, 1H), 7,63-7,73 (dd, 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Пример 123
6-Фтор-3-(1-изопропил-3-метил азетидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
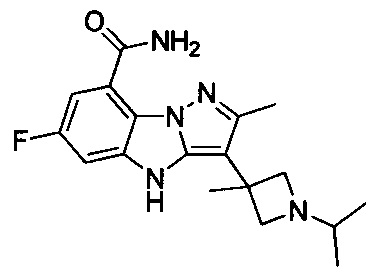
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (MeOD, 400 МГц) δ: 1,26 (d, J=6,53 Гц, 6Н), 1,75 (s, 3Н), 2,40 (s, 3Н), 3,38 (d, J=5,90 Гц, 1H), 4,20-4,28 (m, 2Н), 4,33-4,44 (m, 2Н), 7,27-7,43 (dd, 1Н), 7,62-7,76 (dd, 1H), 8,43-8,58 (bs, 1H). LCMS (ESI) масса/заряд: 344 (М+1).
Пример 124
3-(1-(Циклопропилметил)-3-метилазетидин-3-ил)-6-фтор-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
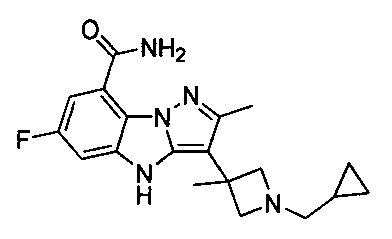
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 0,46 (d, J=4,02 Гц, 2Н), 0,66-0,82 (m, 2Н), 1,09 (d, J=6,02 Гц, 1H), 1,76 (s, 3Н), 2,37 (s, 3Н), 3,19 (br.s., 2Н), 4,19-4,40 (m, 2Н), 4,54 (d, J=9,16 Гц, 2Н), 7,24 (br.s., 1H), 7,57 (br.s., 1H), 8,53 (br.s., 1H). LCMS (ESI) масса/заряд: 356 (М+1).
Пример 125
6-Фтор-3-(1-(2-гидрокси-2-метилпропил)-3-метилазетидин-3-ил)-2-метил-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
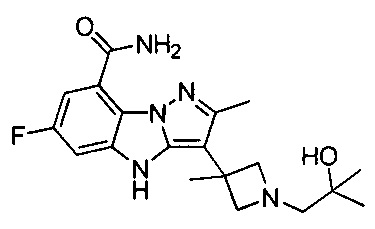
Данный пример получали согласно способу, описанному в примере 111. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,32 (s, 6Н), 1,75 (s, 3Н), 2,30-2,43 (m, 3Н), 3,24 (s, 2Н), 4,35 (d, J=9,91 Гц, 2Н), 4,52 (d, J=9,29 Гц, 2Н), 7,26 (d, J=8,03 Гц, 1H), 7,61 (d, J=11,04 Гц, 1H), 8,50 (br.s., 1H). LCMS (ESI) масса/заряд: 374 (М+1).
Пример 126
6-Фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
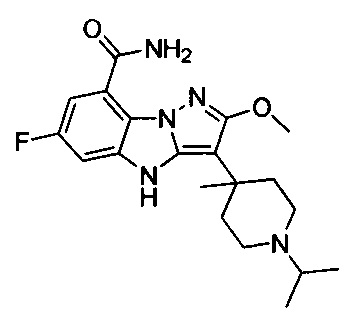
Пример 126А
трет-Бутил-4-(1-циано-2-(2-(2,6-дибром-4-фторфенил)гидразинил)-2-оксоэтил)-4-метилпиперидин-1-карбоксилат
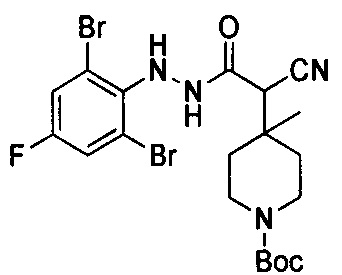
Смесь примера 105С (2,73 г, неочищенный, 9,67 ммоль), HATU (5,51 г, 0,26 ммоль), примера 1D (3,29 г, 11,60 ммоль) и Et3N (2,84 г, 29,01 ммоль) в DMF (20 мл) перемешивали при 25°С в течение 10 ч в атмосфере N2. После завершения реакционную смесь гасили водой (100 мл) и экстрагировали EtOAc (100 мл ×2). Объединенные органические слои промывали водой (50 мл ×2) и солевым раствором (50 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (4,50 г, выход: 85%) в виде желтых твердых веществ.
Пример 126В
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-3-гидрокси-1Н-пиразол-4-ил)-4-метилпиперидин-1-карбоксилат
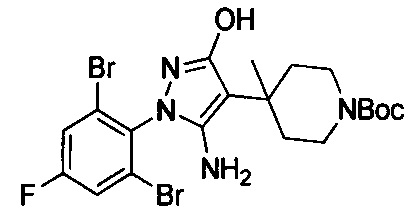
Смесь примера 126А (4,50 г, 8,21 ммоль) и K2CO3 (2,27 г, 16,42 ммоль) в этаноле (100 мл) перемешивали при 80°С в течение 15 ч. После удаления раствора под вакуумом остаток разводили водой (100 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои промывали водой (50 мл ×2) и солевым раствором (50 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (3,81 г, выход: 84%) в виде желтого твердого вещества.
Пример 126С
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-3-метокси-1Н-пиразол-4-ил)-4-метилпиперидин-1-карбоксилат
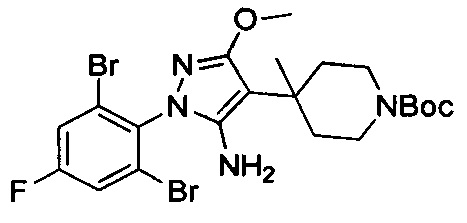
Смесь примера 126В (2,3 г, 3,65 ммоль), Mel (517,80 мг, 3,65 ммоль) и K2CO3 (1,51 г, 10,94 ммоль) в DMF (50 мл) перемешивали при 25°С в течение 15 ч. После удаления раствора под вакуумом остаток разводили водой (100 мл). Водный слой экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои прогдывали водой (50 мл ×2), солевым раствором (50 мл ×2), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (590 мг, выход: 28,76%) в виде желтого твердого вещества.
Пример 126D
трет-Бутил-4-(8-бром-6-фтор-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
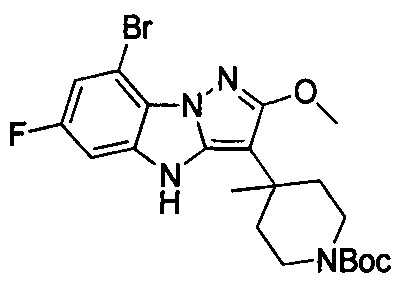
Смесь примера 126С (680 мг, 1,21 ммоль), CuI (69 мг, 0,36 ммоль), N1,N2-диметилэтан-1,2-диамин (64 мг, 0,73 ммоль) и K3PO4 (770 мг, 3,63 ммоль) в DMF (15 мл) перемешивали при 70°С в течение 10 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (455 мг, выход: 78%) в виде белых твердых веществ. LCMS (ESI) масса/заряд: 481, 483 (М, М+2).
Пример 126Е
трет-Бутил-4-(8-циано-6-фтор-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
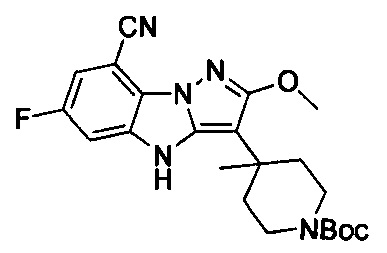
Смесь примера 126D (400 мг, 0,83 ммоль), Zn(CN)2 (108 мг, 1,69 ммоль), Pd2(dba)3 (152 мг, 0,16 ммоль), DPPF (185 мг, 0,33 ммоль) и Zn (108 мг, 1,66 ммоль) в DMF (8 мл) перемешивали при 120°С в течение 15 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (330 мг, выход: 81%) в виде желтых твердых веществ. LCMS (ESI) масса/заряд: 428 (М+1).
Пример 126F
трет-Бутил-4-(8-карбамоил-6-фтор-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-3-ил)-4-метилпиперидин-1-карбоксилат
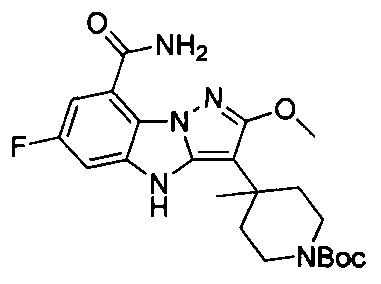
К смеси примера 126Е (200 мг, 0,47 ммоль) и K2CO3 (300 мг, 2,17 ммоль) в DMSO (5 мл) добавляли 30% Н2O2 (5 мл) при 0°С. После перемешивания при 25°С в течение 15 ч смесь разводили водой (50 мл). Водный слой экстрагировали с помощью EtOAc (50 мл ×3). Объединенные органические слои промывали водой (50 мл) и солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (195 мг, выход: 93%) в виде белых твердых веществ. LCMS (ESI) масса/заряд: 446 (М+1).
Пример 126G
6-Фтор-2-метокси-3-(4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
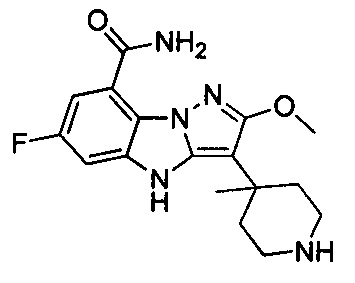
Раствор примера 126F (100 мг, 0,22 ммоль) в смеси DCM/TFA (10 мл/3 мл) перемешивали при 25°С в течение 3 ч. После удаления раствора под вакуумом получали титульное соединение, и его применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 126Н
6-Фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-2-метокси-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
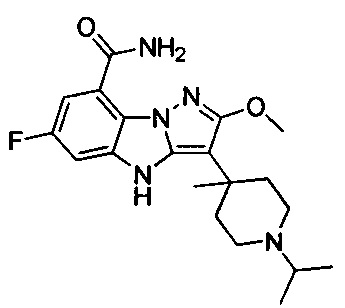
Смесь примера 126G (78 мг, неочищенный, 0,22 ммоль), ацетона (70 мг, 1,2 ммоль) и Na(CN)BH3 (140 мг, 2,22 ммоль) в смеси THF/MeOH (15 мл/5 мл) перемешивали при 24°С в течение 15 ч. Смесь разводили водой (20 мл). Водный слой экстрагировали с помощью EtOAc (30 мл ×2). Объединенные органические слои промывали водой (20 мл) и солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством препаративной HPLC с получением титульного соединения (35 мг, выход: 41%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,27-1,52 (m, 9 Н), 1,77-2,19 (m, 2Н), 2,69 (br.s., 2Н), 2,84-3,28 (m,.2Н), 3,39-3,55 (m, 3Н), 4,06 (s, 3Н), 7,31 (dd, J=8,03, 2,51 Гц, 1H), 7,66 (dd, J=10,98, 2,45 Гц, 1H), 8,55 (br.s., 1H). LCMS (ESI) масса/заряд: 388 (М+1).
Пример 127
2-(Бензилокси)-6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
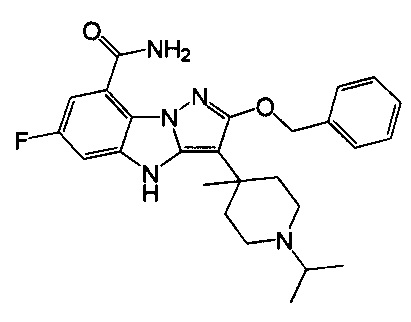
Пример 127А
Смесь примера 126В (3,0 г, 5,48 ммоль), Boc2O (10,0 г, 45,8 ммоль) и DMAP (670 мг, 5,48 ммоль) перемешивали при 80°С в течение 3 часов. После охлаждения до комнатной температуры смесь разводили водн. раствором NaHCO3 (30 мл). Водный слой экстрагировали с помощью DCM (100 мл ×3). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали с получением титульного соединения (4,5 г, неочищенное), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 127В
Смесь примера 127А (4,5 г, 5,31 ммоль) и K2CO3 (1,46 г, 10,62 ммоль) в МеОН (40 мл) перемешивали при 20°С в течение 4 ч. Смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством хроматографии с получением титульного соединения (3,1 г, выход: 80%) в виде желтого твердого вещества.
Пример 127С
Смесь примера 127В (2,5 г, 3,35 ммоль), K2CO3 (925 мг, 6,7 ммоль) и ВnВr (626 мг, 3,68 ммоль) в МеОН (30 мл) перемешивали при 60°С в течение 8 ч. Смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством хроматографии с получением титульного соединения (1,4 г, неочищенное) в виде белого твердого вещества.
Пример 127D
3-(Бензилокси)-1-(2,6-дибром-4-фторфенил)-4-(4-метилпиперидин-4-ил)-1Н-пиразол-5-амин
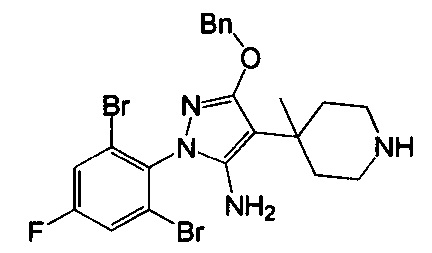
Раствор примера 127С (1,4 г, 1,63 ммоль) в 4М HCl/EtOAc (20 мл) перемешивали при 10°С в течение 3 часов. После удаления раствора под вакуумом получали титульное соединение (1,0 г, выход: 100%) в виде желтого твердого вещества, и его применяли непосредственно на следующей стадии без дополнительной очистки.
Пример 127Е
трет-Бутил-4-(5-амино-3-(бензилокси)-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-4-ил)-4-метилпиперидин-1-карбоксилат
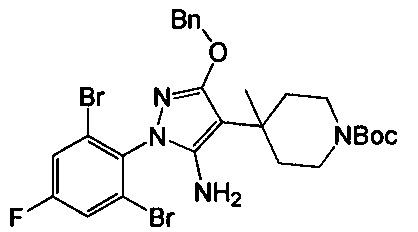
Смесь примера 127D (1,0 ц 1,78 ммоль), Et3N (362 мц 3,56 ммоль) и Boc2O (776 мг, 3,56 ммоль) в DCM (15 мл) перемешивали при 10°С в течение 4 часов. Смесь разводили с помощью H2O (20 мл). Водный слой экстрагировали с помощью DCM (15 мл ×2). Объединенные органические слои промывали водой, солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (1,0 г, неочищенное) в виде белого твердого вещества.
Пример 127F
2-(Бензилокси)-6-фтор-3-(1-изопропил-4-метилпиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
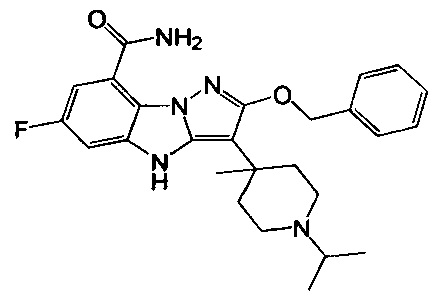
Данный пример получали, как описано в примерах 126D-126H. 1Н ЯМР (400 МГц, DMSO-d6) 0,95 (d, J=6,5 Гц, 6 Н), 1,24 (s, 3Н), 1,60-1,72 (m, 2Н), 2,34 (br.s. 4Н), 2,66-2,77 (m, 3Н), 5,32 (s, 2Н), 7,29-7,55 (m, 7 Н), 8,04 (s, 1H), 8,34 (br.s. 1H), 10,20 (s, 1H). LCMS (ESI) масса/заряд: 464 (М+1).
Схема F
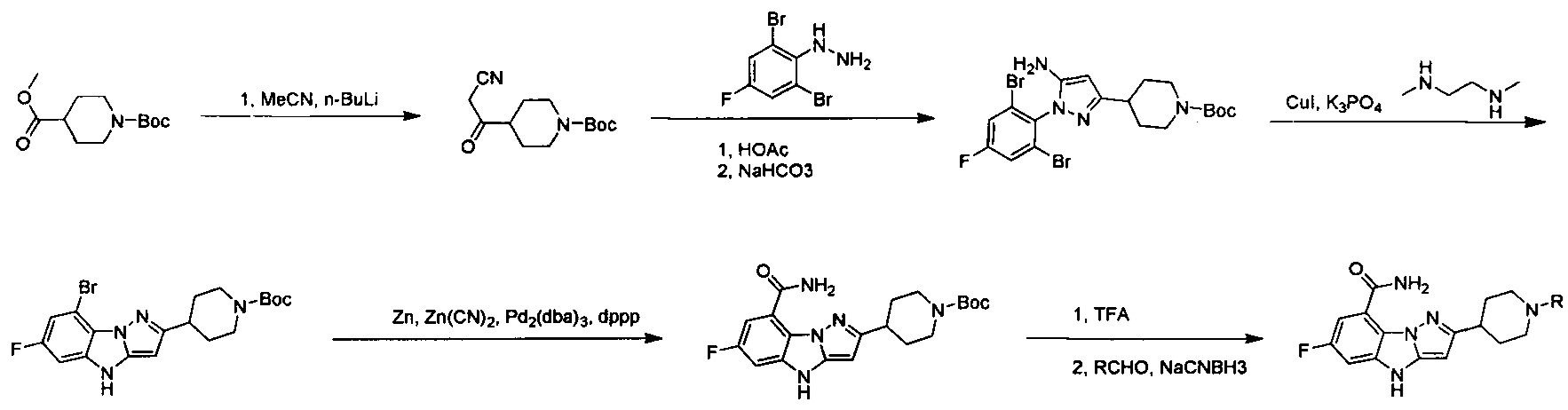
Пример 128
6-Фтор-2-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
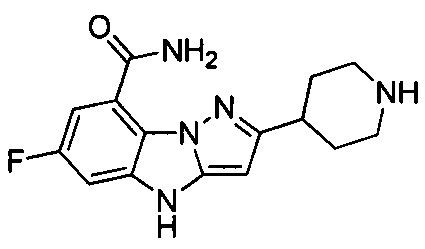
Пример 128А
трет-Бутил-4-(2-пианоацетил)пиперидин-1-карбоксилат
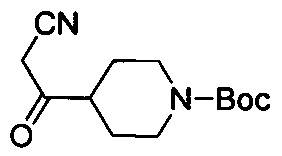
К раствору ацетонитрила (5,06 г, 123,4 ммоль) в сухом THF (200 мл) по каплям добавляли н-BuLi (39,5 мл, 98,6 ммоль) при -78°С в атмосфере азота. Смесь перемешивали при -78°С в течение 2 ч. После этого раствор 1-(трет-бутил)-4-метил-пиперидин-1,4-дикарбоксилата (20 г, 82,2 ммоль) в тетрагидрофуране (100 мл) по каплям добавляли в вышеуказанную смесь. После завершения покапельного добавления полученную в результате смесь нагревали до 15°С и перемешивали в течение 16 ч, а затем гасили насыщ. водн. раствором NH4Cl (100 мл). Водную фазу экстрагировали с помощью EtOAc (100 мл ×2). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (7,9 г, выход: 38,1%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 253 (М+1).
Пример 128В
трет-Бутил-4-(2-циано-1-(2-(2,6-дибром-4-фторфенил)гидразоно)этил)пиперидин-1-карбоксилат
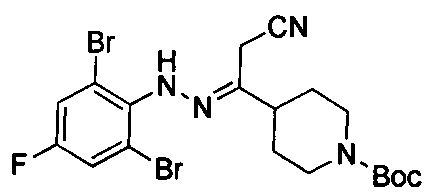
Смесь примера 128А (6,35 г, 25,16 ммоль) и примера 1D (10 г, 35,2 ммоль) в этаноле (80 мл) и НОАс (80 мл) перемешивали при 85°С в течение 16 ч. После охлаждения до комнатной температуры, смесь выпаривали с получением титульного соединения (15 г, неочищенное), которое можно было применять непосредственно на следующей стадии без дополнительной очистки.
Пример 128С
трет-Бутил-4-(5-амино-1-(2,6-дибром-4-фторфенил)-1Н-пиразол-3-ил)пиперидин-1-карбоксилат
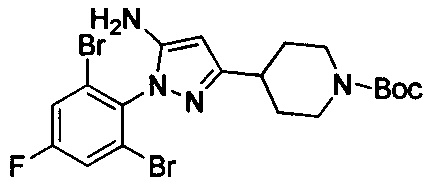
Смесь примера 128В (13 г, 25,1 ммоль) и Et3N (12,7 г, 125,5 ммоль) в этаноле (100 мл) нагревали до 80°С в течение приблизительно 16 ч. После охлаждения до комнатной температуры смесь выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (11 г, выход: 84,6%) в виде желтого твердого вещества.
Пример 128D
трет-Бутил-4-(8-бром-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-2-ил)пиперидин-1-карбоксилат
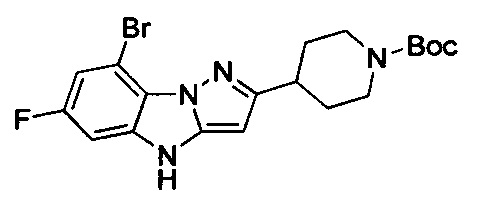
Смесь примера 128С (1,5 г, 2,9 ммоль), CuI (166 мг, 0,87 ммоль), K3PO4 (1,8 г, 8,7 ммоль) и N1,N2-диметилэтан-1,2-диамина (153 мг, 1,74 ммоль) в DMF (8 мл) перемешивали при 55°С в течение 18 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь разводили водой (20 мл). Водный слой экстрагировали с помощью EtOAc (20 мл ×2). Объединенные органические слои промывали водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии с получением титульного соединения (350 мг, выход: 27,6%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 437, 439 (М, М+2).
Пример 128Е
трет-Бутил-4-(8-карбамоил-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-2-ил)пиперидин-1-карбоксилат
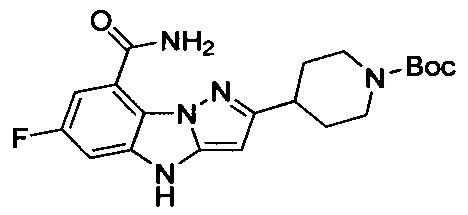
Смесь примера 128D (350 мг, 0,8 ммоль), Zn(CN)2 (188 мг, 1,6 ммоль), Pd2(dba)3 (110 мг, 0,12 ммоль), DPPF (133 мг, 0,24 ммоль) и порошкообразного Zn (104 мг, 1,6 ммоль) в DMF (4 мл) перемешивали при 120°С в течение 2 ч в атмосфере N2. После охлаждения до комнатной температуры полученную в результате смесь фильтровали и фильтрат выпаривали. Остаток очищали посредством препаративной TLC с получением титульного соединения (50 мг, выход: 16,2%) в виде желтого твердого вещества. LCMS (ESI) масса/заряд: 402 (М+1).
Пример 128F
6-Фтор-2-(пиперидин-4-ил)-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
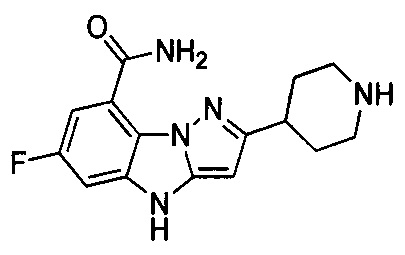
Смешанный раствор примера 128Е (50 мг, 0,125 ммоль) в TFA (1 мл) и DCM (6 мл) перемешивали при 20°С в течение 2 ч. Полученную в результате смесь выпаривали. Остаток очищали посредством препаративной HPLC с получением титульного соединения (23 мг, выход: 59,0%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,07-1,27 (m, 9Н), 2,51 (d, J=l,51 Гц, 2Н), 2,76-2,97 (m, 2Н), 3,34 (d, J=3,26 Гц, 2Н), 5,74 (br.s., 1H), 7,36-7,39 (m, 1H), 7,68-7,72 (m, 1H). LCMS (ESI) масса/заряд: 302 (М+1).
Пример 129
2-(1-Этилпиперидин-4-ил)-6-фтор-4Н-бензо[4,5]имидазо[1,2-b]пиразол-8-карбоксамид
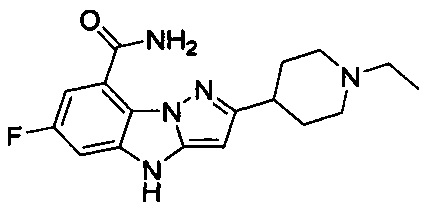
Смесь примера 128F (20 мг, 0,066 ммоль), 40% ацетальдегида (0,2 мл) и Na(CN)BH3 (17 мг, 0,264 ммоль) в МеОН (5 мл) перемешивали при 10°С в течение 16 ч. После завершения реакции полученную в результате смесь разводили водой (5 мл). Водный слой экстрагировали с помощью DCM (20 мл ×2). Объединенные органические слои выпаривали. Остаток очищали посредством препаративной HPLC с получением титульного соединения (17,36 мг, выход: 78,9%) в виде светло-желтого твердого вещества. 1Н-ЯМР (400 МГц, метанол-d4) δ ppm 1,38 (t, J=7,28 Гц, 3Н), 1,98-2,23 (m, 2Н), 2,28-2,49 (m, 2Н), 2,92-3,25 (m, 5 Н), 3,57 (d, т=11,54 Гц, 2Н), 5,83 (s, 1H), 7,29 (dd, J=8,28, 2,51 Гц, 1H), 7,61 (dd, J=10,92, 2,51 Гц, 1H), 8,60 (br.s., 1H). LCMS (ESI) масса/заряд: 330 (М+1).
Исследования in vitro
Клеточный анализ PAR-илирования
Клетки НСС1937 высеивали в 96-луночные планшеты в количестве 4×104 клеток/лунка и инкубировали при 37°С в инкубаторе в течение ночи. После обработки тестовым соединением в течение 30 мин клетки обрабатывали 1 мМ H2O2 в течение 10 мин Клетки дважды промывали 200 мкл предварительно охлажденного PBS и фиксировали с помощью 100 мкл предварительно охлажденной смеси метанол/ацетон (7:3) на льду в течение 30 мин. После высушивания на воздухе планшеты блокировали с использованием блокирующего раствора PBS-Tween (0,05%) с растворенными 5% обезжиренного сухого молока в течение 30 мин при комнатной температуре.
Клетки инкубировали с антителом 10Н к PAR (1:100) при комнатной температуре в течение 1 часа с последующим 3-разовым промыванием PBS-Tween20; а затем добавляли в блокирующий раствор, содержащий конъюгированное с флуоресцеина изотиоцианатом (FITC) вторичное противомышиное антитело козы и 1 мкг/мл DAPI для инкубирования без доступа света при комнатной температуре в течение 1 часа. После 3-разового промывания с помощью PBS-Tween20 планшеты анализировали с помощью флуоресцентного считывающего устройства для микропланшетов (Flexstation III, Molecular Devices).
Ферментный анализ PARP (следуя инструкциям набора для анализа НТ Universal Colorimetric PARP1 Assay).
Гистоновыми белками покрывали 96-луночный планшет и инкубировали в течение ночи при 4°С. После 3-разового промывания 200 мкл раствора PBST планшет блокировали блокирующим раствором и инкубировали в течение 30 мин при комнатной температуре, а затем 3 раза промывали раствором PBST. Соединение, подлежащее тестированию, обрабатывали и добавляли в планшет. После этого 20 мкл разбавленного раствора PARP1 (1HM) или 20 мкл PARP2 (3 нМ) добавляли в реакционную систему и инкубировали в течение 1 или 2 часов. 50 мкл смеси стрептавидин-HRP (1:50) добавляли в планшет и инкубировали в течение 30 мин при комнатной температуре. Затем планшет три раза промывали буфером PBST. 100 мкл (HRP) (хемилюминесцентный субстрат А и субстрат В (1:1)) добавляли в планшет и планшет сразу же считывали посредством устройства для считывания микропланшетов (Envision, PerkinElmer).
Анализ антипролиферации
Клетки MDA-MB-436 и MDA-MB-231 высеивали в 96-луночные планшеты с плотностью 500 и 2000 клеток на лунку соответственно и культивировали в течение ночи в среде RPMI1640, дополненной 10% (об./об.) FBS и 1% (об./об.) пенициллина-стрептомицина. После добавления соединения, подлежащего тестированию, клетки обрабатывали в течение 8 дней. Значения жизнеспособности клеток измеряли с использованием набора CCK8, а затем посредством конкретного способа: добавления 10 мкл реагента ССК8 в каждую лунку и инкубирования в течение 3 часов при 37°С в инкубаторе с 5% CO2. После встряхивания в течение 10 мин значения оптической плотности (OD) измеряли при 450 нм с помощью Flexstation III (Molecular Devices).
Для тестирования комбинации соединений (в комбинации с лекарственными средствами для повреждений ДНК) рассчитывали значение PF50 для измерения синергетического эффекта лекарственного средства. PF50=[IC50 тестируемого соединения]/[IC50 тестируемого соединения с фиксированной концентрацией лекарственного средства для повреждений ДНК]. В данном исследовании в качестве лекарственного средства для повреждений ДНК использовали темозоломид (TMZ).
Данные ферментативного ингибирования PARP-1 IC50 и клеточного PAR-илирования ЕС50 соединений по настоящему изобретению представлены в таблице I ниже. Соединения со значением IC50 от 1 нМ до 100 нМ обозначали как +++; соединения со значением IC50 от 101 нМ до 1000 нМ обозначали как ++ и соединения со значением IC50 выше 1000 нМ обозначали как +.
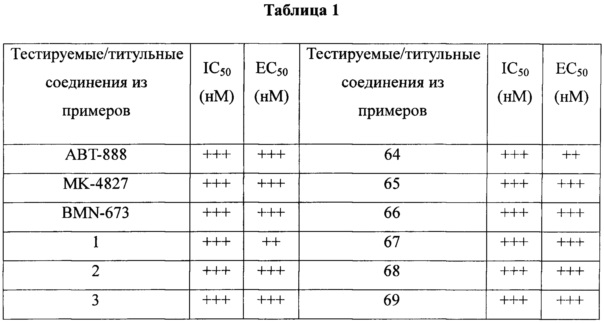
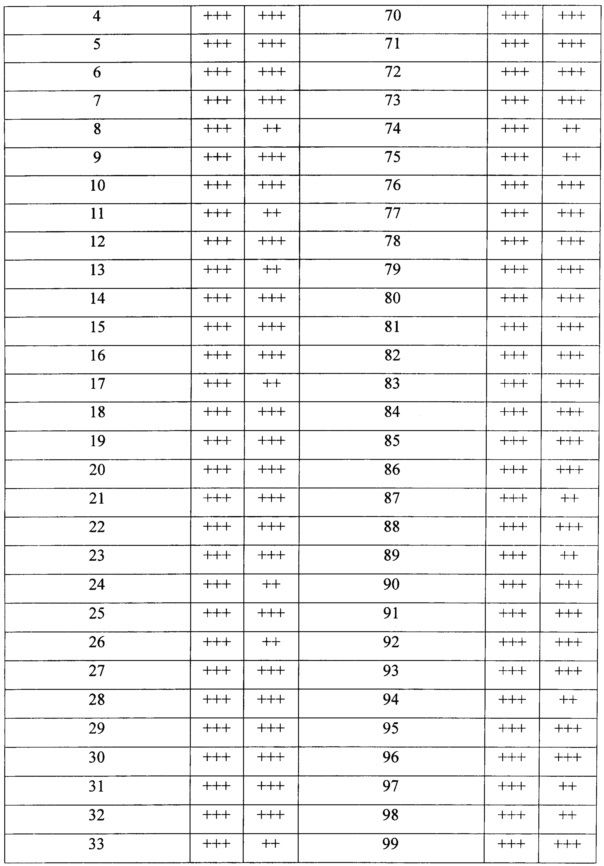
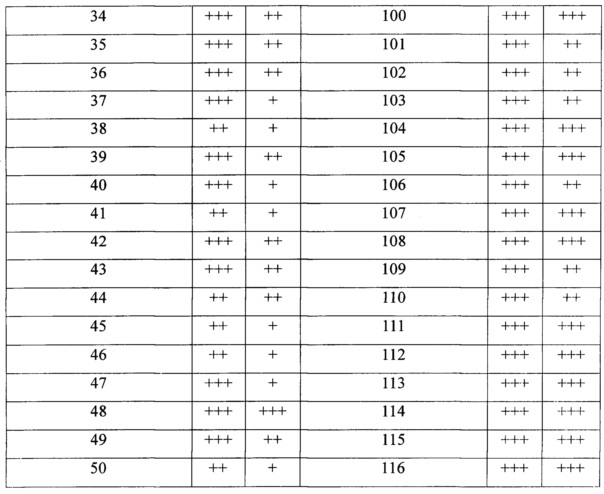
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/67f12dc1482135352adb480344211564.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/9266fb5fa274178421b10d3182a772f6.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/0da2fdc95f59d220bbb39411922f297e.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/01b113970896fa3975adc1b21b52be84.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/d5f7d8f1d493e312f0975119899bfee9.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/cafc40c07a6ee7bb747fbe09921719a8.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/d332ed05c71d530fe190d7508fc22776.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/a328079aa17ef841533deb3d98f3b9a3.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/209af2d1f0f21b7961ab51d4c1e70a32.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/4bc598461558854042e9567b9eff94ae.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/97872ad529b8ea23741371d8d0ea04fa.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/1a3ef170b3794dae18acc171a39cc366.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/5ad0a71a750a677eec5653b0209d7d25.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/ffb61baf2b02647166b20ff578a7fdd5.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/9c7e8885681f31d51f74a04b5983850a.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/0e7d42bce56d720670331a98b6271caa.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/2bd26bf982dc46593404f223015de42b.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/9b7e8b5f7a288a2d667b01ee623695c7.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/f69e4e781f87dff3ebfc39f2bf3975ae.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/3cfabfea305bd0f81515d53a18cba679.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/219f237c9e3ce8f158298227ccc57fb4.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/de466d242acc1aa080afb034ffdd5883.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/1347e3853a93d1ac0dcc7fe287d00263.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/c8a1b1547d9104fc4d80ab89dfeb30d0.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/6e37e8ebbfe9dd39df49dd3d668f7b39.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/8ddc040db80a4cb9ff85c2d3139cc099.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/13c66147a324f426e6f91e081a775ce7.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/4968900c306d670d7006da4256a26743.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/9150bbcd0abc8555bbb10924baf2ec4a.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/d6b52d3927aaaeb6e7b24c1e9d12dfed.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/86c627a2720ae35c68ae4bc501fc2cea.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/19ea294f09a99f1ff9b093c37beeffb5.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/e9a37c233b5ac8024b0926c283b4036f.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/123ffb09db956b54ff74a3f1501f40cb.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/faa465cd6bca397ee1c49ff59e06b26f.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/85d1b944c104cbba1a43861b4766f1ec.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/ba1f451ddcfc2ad917ded3479748280c.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/b3f7566045a7d705ff188d80d5931ced.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/7caa7f684acc9f1ea6bb74d7c935be22.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/9363c04e0e5f6c926892c6b3b895ab15.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/2fa47ef8f837b3ad3220bdba8e132a08.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/378e7527276526c0f0791dc9be4dbf8a.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/fc1ff398b1b3b4a3b54b6d2435ba0454.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/0391ddaa94b7698eb3490505c4595667.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/59a5e5d95068b4b79f6a85fcf204404e.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/622d359000ee9b04652a1961eb9fab44.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/b83a670201ede7b97a4961676abdd662.jpg)
![АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP](https://fips.edrid.ru/images/rid/e4/57/43/2336d8ed8ca71d721bf1735c9aed2ee9.jpg)

