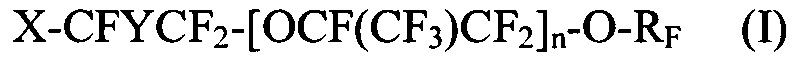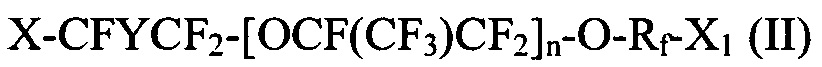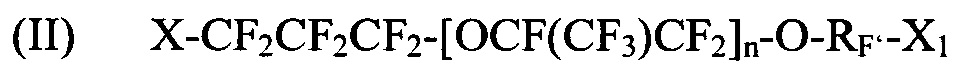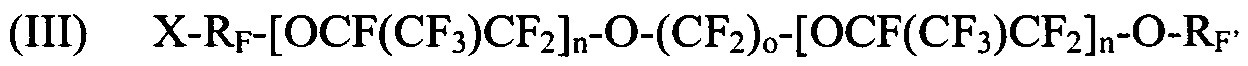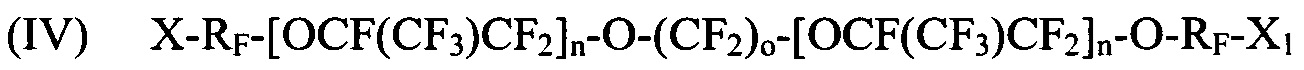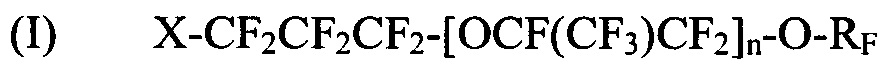Результат интеллектуальной деятельности: СПОСОБЫ ПОЛУЧЕНИЯ ГАЛОГЕНИРОВАННЫХ ФТОРИРОВАННЫХ ЭФИРСОДЕРЖАЩИХ СОЕДИНЕНИЙ
Вид РИД
Изобретение
[0001] Заявляются способы получения галогенированных фторированных эфирсодержащих соединений.
УРОВЕНЬ ТЕХНИКИ
[0002] Бром/йод-содержащие соединения являются ключевыми материалами для производства пероксидных отверждаемых эластомеров. Они используются как агенты передачи цепи и/или как функциональные мономеры. Например, дийодперфторбутан [I(CF2)4I] является одним из самых применяемых агентов передачи цепи и может использоваться в качестве исходного материала для функционального мономера (например, соединение йода, содержащее концевую двойную связь).
[0003] Бром/йод-содержащие фторангидриды являются также ценным исходным материалом для производства виниловых или аллиловых эфиров, которые можно использовать как функциональные мономеры при производстве эластомеров, а также длинноцепочечных разветвленных соединений для разнообразных прикладных задач.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Заявляется желательная альтернатива и/или новые соединения, которые можно использовать в качестве агентов передачи цепи и/или функциональных мономеров. Заявляются также новые способы получения соединений, которые можно использовать в качестве агентов передачи цепи и/или как функциональных мономеров; заявляемые способы менее затратные и/или предполагают использование готовых исходных материалов, таких, например, как фторсульфоновая кислота (FSO3H), тетрафторэтилен (TFE), гексафторпропилен оксид (HFPO), элементарные галогены и интергалоиды.
[0005] Заявляется способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, включающий:
(i) галогенирование дифторсульфурил пероксида с последующей реакцией с первым фторолефином для образования фторангидрида галогенированной фторорганической кислоты;
(ii) реагирование фторангидрида галогенированной фторорганической кислоты с первым соединением, выбранным как минимум из одного из перечисленных ниже:
(a) второй фторолефин в присутствии галоген-содержащего соединения для образования галогенированного фторированного эфирсодержащего соединения; и
(b) HFPO для образования соответствующего фторангидрида и преобразование соответствующего фторангидрида в галогенированное фторированное эфирсодержащее соединение.
[0006] Заявляется также способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, включающий:
(i) образование 2,2,3,3-тетрафтор-3-галогенпропаннитрила с использованием цианосодержащего соединения и TFE, где вариант образования выбирается из следующего:
a) добавка XCN к TFE, где X представляет собой I, Br или Cl; и
b) добавка MCN к TFE, где М представляет собой щелочной металл, который затем контактирует с галогеносодержащим соединением;
(ii) преобразование 2,2,3,3-тетрафтор-3-галогенпропаннитрила в 2,2,3,3-тетрафтор-3-галогенпропаноил фторид;
(iii) реагирование 2,2,3,3-тетрафтор-3-галогенпропаноил фторида с первым соединением, выбранным как минимум из одного из перечисленных ниже:
(a) фторолефин в присутствии галогена, содержащий соединение для образования галогенированного фторированного эфирсодержащего соединения, и
(b) HFPO для образования соответствующего фторангидрида и преобразование соответствующего фторангидрида в галогенированное фторированное эфирсодержащее соединение.
[0007] Заявляется также способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, заключающийся в следующем:
(i) реагирование дифторангидрида перфторорганической дикислоты с первым соединением, выбранным как минимум из одного из перечисленных ниже:
(a) первый фторолефин в присутствии галогена, содержащий соединение для образования галогенированного фторированного эфирсодержащего соединения; и
(b) HFPO для образования соответствующего дифторангидрида дикислоты и преобразование соответствующего дифторангидрида дикислоты в галогенированное фторированное эфирсодержащее соединение.
[0008] Приведенное выше краткое описание изобретения не предназначено для описания каждой реализации. Подробное описание одной или более реализаций заявляемого изобретения приведено ниже. Другие отличительные особенности, детали и преимущества будут очевидны из описания и пунктов формулы изобретения.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] В настоящей заявке любой термин может относиться к одному или нескольким объектам;
словесный оборот «и/или» используется для обозначения одной или обеих возможных ситуаций, например, выражение «А и/или В» подразумевает (А и В) и (А или В);
«фторолефин» представляет собой алифатическое соединение, содержащее как минимум одну концевую углерод-углеродную двойную связь (например, алкен или полиен). Фторолефин является фторированным, то есть как минимум одна из углеродно-водородных связей заменена углерод-фтор связью. Фторолефин может быть частично фторированным (где соединение содержит как минимум одну углерод-водородную связь и как минимум одну углерод-фтор связь) или полностью фторированным (где соединение содержит углерод-фтор связи и не содержит углерод-водородные связи). В качестве показательных фторолефинов выбирается как минимум один из тетрафторэтилена (TFE), гексафторпропилена (HFP), винилиден фторида (VDF), и хлортрифторэтилена (CTFE);
«галогенсодержащее соединение» выбирается из элементарных галогенов (I2, Br2 или Cl2) или интергалоидов; и
термин «интергалоид» относится к соединению, содержащему как минимум два или более разных галогенов, например, соответствующих формуле XYn, где n представляет собой нечетное целое число в диапазоне 1-7, а X и Y представляют собой галогены, где X менее электрически отрицательный галоген по сравнению, например, с IF и ICl.
[0010] В настоящей заявке подразумевается, что диапазон, указанный по начальному и конечному значению, включает в себя все промежуточные числа (например, диапазон от 1 до 10 включает в себя значения 1,4; 1,9; 2,33; 5,75; 9.98, и т.д.)
[0011] Также в настоящей заявке словесный оборот «как минимум один» подразумевает все числа, начиная с единицы и больше (например, как минимум 2, как минимум 4, как минимум 6, как минимум 8, как минимум 10, как минимум 25, как минимум 50, как минимум 100, и т.д.).
[0012] В настоящей заявке приводится описание способов получения галогенированного фторированного эфирсодержащего соединения с использованием фторолефина или HFPO (гексафторпропилен оксид).
[0013] Способ I
[0014] Синтез по Способу I начинается с дифторсульфурил пероксида. Дифторсульфурил пероксид (FO2SO-OSO2F) можно приготовить электрохимически, используя фторсульфоновую кислоту (FSO3H).
[0015] Дифторсульфурил пероксид галогенируется в результате реакции с галогенсодержащим соединением при температуре как минимум 10, 20, 23, 25, 30 или даже 35°С; и самое большее 40, 50, 60 или даже 80°С. Как правило, для образования продуктов реакции следует использовать молярный эквивалент дифторсульфурил пероксида относительно галогена в галогенсодержащем соединении. Затем вводится первый фторолефин для образования фторангидрида галогенированной фторорганической кислоты посредством соответствующего фторсульфата как промежуточного продукта. Эта реакция может происходить в исходных условиях или с активизацией с целью преобразования во фторангидрид посредством ввода подходящих источников фтора, таких, например, как щелочные фториды (MF), щелочноземельные фториды (MF2), или тетра-органиламмониевые фториды. В одной реализации реакция может производиться при температуре как минимум 10, 20, 23, 25, 30 или даже 35°С; и самое большее 40, 50, 60, 80 или даже 100°С. В ходе этой реакции промежуточно образующийся олефинсодержащий фторсульфат (например, I-CF2CF2-OSO2F) преобразуется в присутствии незначительного количества фторида в соответствующий фторангидрид галогенированной фторорганической кислоты. Количество используемого фторида находится в диапазоне от 0,03 до 10 молярных % фторид ионных молей -OSO2F. Как альтернативный вариант, промежуточно образующийся галогенированный олефинсодержащий фторсульфат может быть изолирован дистилляцией с последующей реакцией с небольшим количеством фторида (от 0,03 до 10 молярных%) - до образования соответствующего фторангидрида галогенированной фторорганической кислоты. Полученное соединение фторангидрида галогенированной фторорганической кислоты может быть изолировано и очищено известными способами.
[0016] Структура фторангидрида галогенированной фторорганической кислоты, соответствует, например XCF2C(O)F или XCF(CF3)C(O)F с X=I, Br или Cl.
[0017] Затем фторангидрид галогенированной фторорганической кислоты реагирует либо с вторым фторолефином, либо с HFPO.
[0018] Если фторангидрид галогенированной фторорганической кислоты реагирует со вторым фторолефином, это происходит в присутствии галогенсодержащего соединения для образования галогенированного фторированного эфирсодержащего соединения. Реакция производится предпочтительно при температуре в диапазоне от -40 до +60°С в зависимости от используемого катализатора. Реакция производится предпочтительно в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси. Молярная пропорция фторангидрида галогенированной фторорганической кислоты ко второму фторолефину находится в диапазоне от 1:0,5 до 1:5, предпочтительно в диапазоне от 1:1,1 до 1:1,2.
[0019] Если фторангидрид галогенированной фторорганической кислоты реагирует с HFPO, образуется соответствующий фторангидрид, который затем преобразуется в галогенированное фторированное эфирсодержащее соединение. Реакция фторангидрида галогенированной фторорганической кислоты с HFPO происходит при контакте соединений при температуре в диапазоне от -40 до +60°С в зависимости от используемого катализатора, в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, глим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, глим, диглим) или их смеси. Молярная пропорция фторангидрида галогенированной фторорганической кислоты к HFPO находится в диапазоне от 1:0,5 до 1:5, предпочтительно в диапазоне от 1:1,1 до 1:1,2.
[0020] Соответствующий фторангидрид может быть преобразован в галогенированное фторированное эфирсодержащее соединение посредством различных процессов.
[0021] В первой реализации соответствующий фторангидрид реагирует с третьим фторолефином в присутствии галогенсодержащего соединения для образования галогенированного фторированного эфирсодержащего соединения. Реакция производится при температуре от -40 до +60°С в зависимости от используемого катализатора, в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси.
[0022] Во второй реализации соответствующий фторангидрид пиролизуется в присутствии щелочного карбоната (например, Na2CO3, K2CO3) для образования винилового эфира. Пиролиз происходит при температуре от 120 до 300°С, предпочтительно в диапазоне от 150 до 180°С. Получаемый виниловый эфир может затем реагировать с интергалоидом для образования галогенированного фторированного эфирсодержащего соединения. Например, реакция получаемого винилового эфира происходит со смесью элементарного йод пентафторида при температуре в диапазоне от 30°С до 200°С, предпочтительно в диапазоне от 80 до 160°С. В качестве альтернативного варианта, реакция получаемого винилового эфира может производиться с ICl, HF и BF3 при температуре около 50°С как известно из предыдущего уровня техники (см, например, Журнал химии фтора. 2012, 133, 77-85).
[0023] В третьей реализации соответствующий фторангидрид реагирует с перфтораллил фторсульфатом (CF2=CF-CF2-OSO2F) для образования галогенированного фторированного эфирсодержащего соединения. Реакция производится предпочтительно при температуре в диапазоне от -40 до +60°С в зависимости от используемого фторсодержащего катализатора (например, щелочные фториды (MF), щелочноземельные фториды (MF2), или тетра-органиламмониевые фториды). Реакция производится предпочтительно в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси.
[0024] В четвертой реализации соответствующий фторангидрид реагирует с LiI для образования йодированного фторированного эфирсодержащего соединения при температуре в диапазоне от 100 до 250°С, предпочтительно в отсутствии любых растворителей.
[0025] Дополнительно в одной реализации соответствующий фторангидрид реагирует с HFPO для образования удлиненного фторангидрида, преобразуемого затем в галогенированное фторированное эфирсодержащее соединение способами, описанными выше.
[0026] В качестве альтернативного варианта, если желательно наличие молекулы, содержащей карбоновую кислоту, соответствующий фторангидрид может быть гидролизован при температуре в диапазоне от 0 до 100°С, предпочтительно 20-70°С, для образования соответствующей карбоновой кислоты.
[0027] Галогенированные фторированные эфирсодержащие соединения по Способу 1 соответствуют следующим формулам:
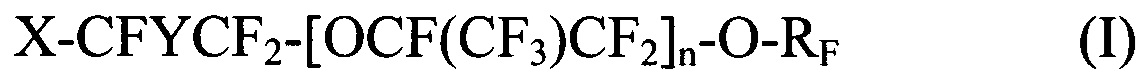
где X выбирается из Br, Cl и I; Y представляет собой F или CF3; n является целым числом в диапазоне 0-3 и RF представляет собой -CF=CF2 или -CF2CF=CF2; и
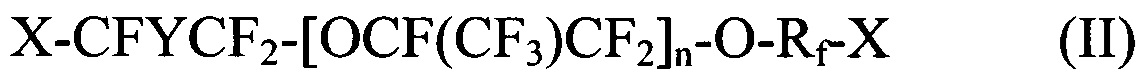
где X и X1 независимо выбираются из Br, Cl и I; Y представляет собой F или CF3; Rf выбираются из -CF2CF2-, -CF(CF3)CF2-, -CFClCF2-, или -CH2CF2-; и n является целым числом в диапазоне 0-3.
[0028] Галогенированные фторированные эфирсодержащие соединения по Способу 1 содержат: I-CF2-CF2-O-CF=CF2, I-CF2-CF2-O-CF2-CF=CF2, I-CF(CF3)-CF2-O-CF=CF2, I-CF(CF3)-CF2-O-CF2-CF=CF2, I-CF2-CF2-O-CF(CF3)-CF2-O-CF=CF2, I-CF2-CF2-O-CF(CF3)-CF2-O-CF2-CF=CF2, I-CF2-CF2-(O-(CF(CF3)-CF2)2-O-CF=CF2, I-CF2-CF2-(O-(CF(CF3)-CF2)2-O-CF2-CF=CF2, I-CF2-CF2-O-CF2-CF2-I, I-CF(CF3)-CF2-O-CF2-CF2-I, I-CF2-CF2-O-CF(CF3)-CF2-O-CF2-CF2-I, I-(CF(CF3)-CF2-O)2-CF2-CF2-I, Br-CF2-CF2-O-CF=CF2, Br-CF2-CF2-O-CF2-CF=CF2, Br-CF(CF3)-CF2-O-CF=CF2, Br-CF2-CF2-O-CF2-CF2-Br, I-CF2-CF2-O-CF2-CF2-Br, и Br-CF(CF3)-CF2-O-CF2-CF2-I.
[0029] Галогенированные фторированные эфирсодержащие соединения с формулой I могут быть получены, например, реакцией фторангидрида галогенированной фторорганической кислоты с HFPO для образования удлиненного фторангидрида галогенированной фторорганической кислоты с последующим пиролизом или реакцией фторангидрида галогенированной фторорганической кислоты с CF2=CF-CF2-OSO2F. Галогенированные фторированные эфирсодержащие соединения с формулой II могут быть получены, например, реакцией фторангидрида галогенированной фторорганической кислоты со фторолефином в присутствии галогенсодержащего соединения. Более того, молекулы с Формулой I могут быть преобразованы в формулу II фторидированием.
[0030] Способ II
[0031] Синтез по Способу II начинается с цианидсодержащего соединения, реагирующего с тетрафторэтиленом и галогеном для образования 2,2,3,3-тетрафтор-3-галогенпропаннитрила (другими словами, NCCF2CF2X где X представляет собой I, Cl или Br). Цианидсодержащее соединение представляет собой XCN или MCN, где X является I, Br или Cl и М представляет собой щелочной металл (например, Li, Na, K, и т.д.)
[0032] В одной реализации XCN контактирует с тетрафторэтиленом для образования 2,2,3,3-тетрафтор-3-галогенпропаннитрила. Эта реакция происходит в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси.
[0033] В другой реализации MCN сначала контактирует с тетрафторэтиленом в присутствии растворителя, затем этот продукт контактирует без предварительной изоляции с галогенсодержащим соединением для образования 2,2,3,3-тетрафтор-3-галогенпропаннитрила. Эта реакция «в одной колбе» может производиться при температуре как минимум 10, 20, 23, 25, 30 или даже 35°С; самое большее 70°С в нереактивных органических растворителях, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси. Эта реакция может быть активизирована в присутствии кислот Льюиса в качестве катализатора (например, BF3 или BF3 THF).
[0034] После образования 2,2,3,3-тетрафтор-3-галогенпропаннитрила, 2,2,3,3-тетрафтор-3-галогенпропаннитрил подвергается гидролизации для образования 2,2,3,3-тетрафтор-3-галогенпропановой кислоты. Гидролиз происходит при температуре в диапазоне от 0 до 100°С в присутствии воды и/или с раствором гидратогенного гидроксида натрия или калия с последующим добавлением кислоты.
[0035] Затем 2,2,3,3-тетрафтор-3-галогенпропановая кислота преобразуется в 2,2,3,3-тетрафтор-3-галогенпропаноил фторид, что производится либо непосредственным преобразованием, либо посредством промежуточного продукта 2,2,3,3-тетрафтор-3-галогенпропаноил хлорида.
[0036] Непосредственное преобразование 2,2,3,3-тетрафтор-3-галогенпропановой кислоты в 2,2,3,3-тетрафтор-3-галогенпропаноил фторид производится, например, с фторирующими агентами, такими, как трифторметилированные и дифторхлорметилированные бензолы (например, С6H5CF3, C6H5CF2Cl) в присутствии кислот Льюиса в качестве катализаторов (например, смесь TiO2 и TiCl4; BF3). В качестве фторирующих агентов для непосредственного преобразования также подходят диэтиламиносерный трифторид и 2-хлор-1,1,2-трифторэтил(диэтил)амин.
[0037] Промежуточный продукт 2,2,3,3-тетрафтор-3-галогенпропаноил хлорид может быть приготовлен из 2,2,3,3-тетрафтор-3-галогенпропановой кислоты например, с тионил хлоридом, бензоилхлоридом, или оксалил дихлоридом. На следующем шаге 2,2,3,3-тетрафтор-3-галогенпропаноил хлорид реагирует с источником фтора для образования 2,2,3,3-тетрафтор-3-галогенпропаноил фторида. Источником фтора может быть неорганическая соль фтора, такая, например, как фториды щелочного или щелочноземельного металла, или фторсодержащие органические соединения наподобие трифторметилированных и дифторхлорметилированных бензолов (например, C6H5CF3, C6H5CF2Cl) в присутствии кислоты Льюиса в качестве катализатора. В качестве фторирующих агентов для этой реакции подходят диэтиламиносерный трифторид и 2-хлор-1,1,2-трифторэтил(диэтил)амин.
[0038] 2,2,3,3-тетрафтор-3-галогенпропаноил фторид далее реагирует либо с фторолефином, либо с HFPO.
[0039] Если 2,2,3,3-тетрафтор-3-галогенпропаноил фторид реагирует с фторолефином, это происходит в присутствии галогенсодержащего соединения для образования галогенированного фторированного эфирсодержащего соединения. Реакция производится предпочтительно при температуре от -40 до +60°С в зависимости от используемого катализатора, в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, THF, пропионитрил, моноглим, диглим) или их смеси. Молярная пропорция фторангидрида галогенированной фторорганической кислоты к олефину находится в диапазоне от 1:0,5 до 1:5, предпочтительно в диапазоне от 1:1,1 до 1:1,2.
[0040] Если 2,2,3,3-тетрафтор-3-галогенпропаноил фторид реагирует с HFPO, образуется соответствующий фторангидрид, который затем преобразуется в галогенированное фторированное эфирсодержащее соединение. Реакция 2,2,3,3-тетрафтор-3-галогенпропаноил фторида с HFPO происходит предпочтительно при температуре в диапазоне от -40 до +60°С в зависимости от используемого катализатора, в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси. Молярная пропорция фторангидрида галогенированной фторорганической кислоты к HFPO находится в диапазоне от 1:0,5 до 1:5, предпочтительно в диапазоне от 1:1,1 до 1:1,2.
[0041] Соответствующий фторангидрид может быть преобразован в галогениованное фторированное эфирсодержащее соединение посредством различных процессов, описанных выше в Способе I. Например, соответствующий фторангидрид подвергается пиролизу в присутствии щелочного карбоната (например, Na2CO3, K2CO3) для образования винилового эфира. Пиролиз происходит при температуре от 120 до 300°С, предпочтительно в диапазоне от 150 до 180°С. Получаемый виниловый эфир может затем реагировать с интергалоидом для образования галогенированного фторированного эфирсодержащего соединения. Например, реакция получаемого винилового эфира происходит со смесью элементарного йода и йод пентафторида при температуре в диапазоне от 30°С до 200°С, предпочтительно в диапазоне от 80 до 160°С. В качестве альтернативного варианта реакция получаемого винилового эфира может производиться с ICl, HF и BF3 при температуре около 50°С.
[0042] Галогенированные фторированные эфирсодержащие соединения по Способу II имеют структуру:
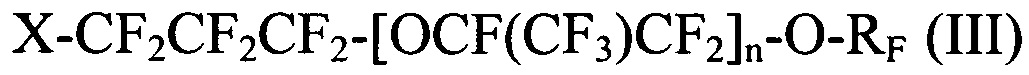
где X выбирается из I, Br и Cl; n является целым числом в диапазоне 0-3 и RF представляет собой -CF=CF2 или -CF2CF=CF2; и
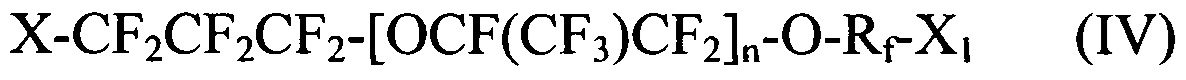
где X и X1 независимо выбираются из I, Br и Cl; Rf выбирается из -CF2CF2-, -CF(CF3)CF2-, -CFClF2-, или -CH2CF2-; и n является целым числом в диапазоне 0-3.
[0043] Показательные галогенированные фторированные эфирсодержащие соединения, получаемые Способом II, включают: I-CF2-CF2-CF2-O-CF=CF2, 1-CF2-CF2-CF2-O-CF2-CF=CF2, I-CF2-CF2-CF2-O-CF(CF3)-CF2-O-CF=CF2, I-CF2-CF2-CF2-O-CF(CF3)-CF2-O-CF2-CF=CF2, I-CF2-CF2-CF2-(O-(CF(CF3)-CF2)2-O-CF=CF2, I-CF2-CF2-CF2-O-(CF(CF3)-CF2-O)2-CF2-CF=CF2, I-CF2-CF2-CF2-O-CF2-CF2-I, I-CF2-CF2-CF2-O-CF(CF3)-CF2-O-CF2-CF2-I, Br-CF2-CF2-CF2-O-CF=CF2, Br-CF2-CF2-CF2-O-CF2-CF=CF2, Br-CF2-CF2-CF2-O-CF2-CF2-I, и I-CF2-CF2-CF2-O-CF2-CF2-Br.
[0044] Галогенированные фторированные эфирсодержащие соединения с Формулой III могут быть получены, например, в результате реакции фторангидрида галогенированной фторорганической кислоты с HFPO для образования удлиненного фторангидрида галогенированной фторорганической кислоты с последующим пиролизом или реакцией фторангидрида галогенированной фторорганической кислоты с CF2=CF-CF2-OSO2F. Галогенированные фторированные эфирсодержащие соединения с Формулой IV могут быть получены, например, в результате реакции фторангидрида галогенированной фторорганической кислоты с фторолефином в присутствии галогенсодержащего соединения. Более того, молекулы Формулы III могут быть преобразованы в Формулу IV фторидированием.
[0045] Способ III
[0046] Синтез по Способу III начинается с дифторангидрида перфторорганической дикислоты, который реагирует либо с фторолефином, либо с HFPO.
[0047] Дифторангидрид перфторорганической дикислоты представляет собой соединение со структурой F(O)C(CF2)nC(O)F, где n=0-4, 6 и 8.
[0048] Дифторангидрид перфторорганической дикислоты доступен на рынке или может быть синтезирован известными способами.
[0049] Например, FSO2O-(CF2CF2)n-OSO2F, где n является целым числом в диапазоне 1-5, может быть приготовлен электрохимически в количестве, определяемом коэффициентом n (в частности, n=1-5). Распределение FSO2O-(CF2CF2)n-OSO2F зависит в первую очередь от силы электрического тока (которая, в свою очередь, определяется удельной плотностью тока и площадью электродов; например, от 50 до 90 ампер), содержанием пероксида, пропорцией пероксида к TFE, температурой реакции (например, 35-60°С), и значением расхода TFE (например, от 90 до 300 г/ч), что зависит от размера ячейки. Полученная смесь перфторорганил бис(фторсульфатов) может быть дистиллирована, желаемая фракция собрана и использована в дальнейшем. Например, точка кипения наиболее крупных фракций FSO2O-(CF2CF2)n-OSO2F: при n=1 составляет от 101 до 103°С при атмосферном давлении; при n=2 от 136 до 137°С; при n=3 от 173 до 174°С; при n=4 равняется 90°С при давлении 14 мбар; при n=5: 115°С при давлении 14 мбар, причем при n>6 фракции отсутствуют, переходя в твердую фазу. Дифторангидриды перфторорганической дикислоты с четными номерами синтезируются реакцией FSO2O-(CF2CF2)n-OSO2F со фтор катализатором для образования соответствующего дифторангидрида дикислоты. Дифторангидриды перфторорганической дикислоты с нечетными номерами поставляются на рынок, например, компанией Exfluor Research Corporation, Round Rock, TX (например, F(O)C-(CF2)3-C(O)F) и SynQuest Laboratories, Inc., Alachua, FL (например, F(O)C-(CF2)-C(O)F).
[0050] Если дифторангидрид перфторорганической дикислоты вступает в реакцию с первым фторолефином, это производится в присутствии галогенсодержащего соединения для образования галогенированного фторированного эфирсодержащего соединения. Реакция производится при температуре в диапазоне от -40 до +60°С в зависимости от количества используемого фторсодержащего катализатора (например, щелочных фторидов (MF), щелочноземельных фторидов (MF2), или тетра-органиламмониевых фторидов), в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, тетрагидрофуран, пропионитрил, моноглим, диглим) или их смеси. Молярная пропорция дифторангидрида перфторорганической дикислоты к первому фторолефину находится в диапазоне от 1:1 до 1:10, предпочтительно в диапазоне от 1:2 до 1:5.
[0051] Если дифторангидрид перфторорганической дикислоты вступает в реакцию с HFPO, образуется соответствующий дифторангидрид дикислоты, который затем преобразуется в галогенированное фторированное эфирсодержащее соединение. Реакция дифторангидрида перфторорганической дикислоты с HFPO производится предпочтительно в диапазоне температур от -40 до +60°С в зависимости от используемого катализатора, в нереактивном органическом растворителе, например, с точкой кипения до 275°С (например, триглим и тетраглим), предпочтительно с точкой кипения до 170°С (например, CH3CN, THF, пропионитрил, моноглим, диглим) или их смеси. Молярная пропорция дифторангидрида галогенированной фторорганической дикислоты к HFPO находится в диапазоне от 1:1 до 1:10, предпочтительно в диапазоне от 1:2 до 1:5.
[0052] Соответствующий дифторангидрид дикислоты может быть преобразован в галогенированное фторированное эфирсодержащее соединение посредством различных процессов, описанных выше в Способе I, не забывая о том, что ввиду наличия двух фторангидридов в соответствующих соединениях дифторангидридов дикислоты, ранее изложенные стехиометрические показатели реакции следует удвоить для надежного преобразования обоих фторангидридов.
[0053] Например, соответствующий дифторангидрид дикислоты подвергается пиролизу в присутствии щелочного карбоната (например, Na2CO3, K2CO3) для образования дивинилового эфира. Пиролиз происходит при температуре от 120 до 300°С, предпочтительно от 150 до 180°С. Получаемый дивиниловый эфир может затем вступать в реакцию и интергалоидом для образования галогенированного фторированного эфирсодержащего соединения. Например, реакция получаемого дивинилового эфира происходит со смесью элементарного йода и йод пентафторида при температуре в диапазоне от 30°С до 200°С, предпочтительно в диапазоне от 80 до 160°С. В качестве альтернативного варианта реакция получаемого винилового эфира может производиться с IC1, HF и BF3 при температуре около 50°С.
[0054] Галогенированные фторированные эфирсодержащие соединения, получаемые Способом III, имеют структуру:
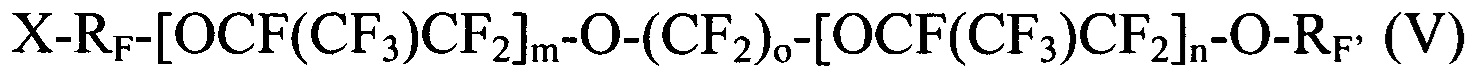
где X выбирается из I, Br и Cl; RF представляет собой -CF2CF2- или -CF2CF2CF2-; n является целым числом в диапазоне 0-3; m является целым числом в диапазоне 0-3; о является целым числом в диапазоне 2-6, 8 и 10; и RF' представляет собой -CF=CF2 или -CF2CF=CF2; и
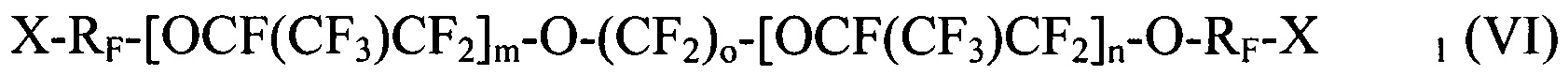
где X и X1 независимо выбираются из I, Br и Cl; RF независимо выбирается из -CF2-CF2-, -CF(CF3)CF2-, -CFClCF2-, или -CH2CF2-; n является целым числом в диапазоне 0 - 3; m является целым числом в диапазоне 0-3; о является целым числом в диапазоне 2-6, 8 и 10.
[0055] Показательные галогенированные фторированные эфирсодержащие соединения, получаемые Способом III, содержат: I-CF2-CF2-O-(CF2)2-O-CF=CF2, I-CF2-CF2-O-(CF2)3-O-CF=CF2, I-CF2-CF2-O-(CF2)4-O-CF=CF2, I-CF2-CF2-O-(CF2)2-O-CF2-CF=CF2, I-CF2-CF2-O-(CF2)3-O-CF2-CF=CF2, I-CF2-CF2-O-(CF2)2-O-CF(CF3)CF2-O-CF2=CF2, I-CF2-CF2-O-(CF2)2-O-CF(CF3)CF2-O-CF2-CF2=CF2, I-CF2-CF2-O-(CF2)2-O-CF2-CF2-I, I-CF2-CF2-O-(CF2)3-O-CF2-CF2-I, и I-CF2-CF2-O-(CF2)4-O-CF2-CF2-I, Br-CF2-CF2-O-(CF2)2-O-CF=CF2, Br-CF2-CF2-O-(CF2)3-O-CF=CF2, Br-CF2-CF2-O-(CF2)4-O-CF=CF2, Br-CF2-CF2-O-(CF2)2-O-CF2-CF=CF2, Br-CF2-CF2-O-(CF2)2-O-CF2-CF2-Br, Br-CF2-CF2-O-(CF2)3-O-CF2-CF2-Br, и Br-CF2-CF2-O-(CF2)4-O-CF2-CF2-Br, Br-CF2-CF2-O-(CF2)2-O-CF2-CF2-I, Br-CF2-CF2-O-(CF2)3-O-CF2-CF2-I, и I-CF2-CF2-O-(CF2)4-O-CF2-CF2-Br.
[0056] Галогенированные фторированные эфирсодержащие соединения с Формулой V могут быть получены, например, в результате реакции дифторангидрида галогенированной фторорганической дикислоты с HFPO для образования удлиненного дифторангидрида галогенированной фторорганической дикислоты с последующим пиролизом или реакцией дифторангидрида галогенированной фторорганической дикислоты с CF2=CF-CF2-OSO2F. Галогенированные фторированные эфирсодержащие соединения с Формулой VI могут быть получены, например, в результате реакции дифторангидрида галогенированной фторорганической дикислоты со фторолефином в присутствии галогенсодержащего соединения. Более того, молекулы Формулы V могут быть преобразованы в Формулу VI фторидированием.
[0057] В одной реализации заявляемые соединения (например, с Формулами II, IV и VI) могут использоваться в полимеризации фторполимера как агент передачи цепи. Обычно агенты передачи цепи добавляются к процессу полимеризации для регулирования молекулярного веса увеличивающейся цепи полимера. Дополнительно агенты передачи цепи могут быть преобразованы в функциональный мономер (например, добавлением этилена и последующим дегидрогалогенированием до соответствующего олефина) для последующего образования перекрестных связей. В одной реализации заявляемые соединения (например, с Формулами I, III и V) могут использоваться в полимеризации фторполимера в качестве функционального мономера. Как правило, функциональный мономер встраивается в полимер в процессе полимеризации и затем используется как участки для последующих перекрестных цепочек полимера.
[0058] Фторполимеры могут быть получены полимеризацией галогенированных фторированных эфирсодержащих соединений настоящей заявки в присутствии фторированных олефиновых мономеров и дополнительно, добавочных мономеров. Могут применяться известные технологии полимеризации, включая гидратогенную эмульсионную полимеризацию.
[0059] Заявляемые галогенированные фторированные эфирсодержащие соединения могут использоваться в полимеризации фторполимеров, таких, как: TFE/пропилен сополимер, ТРЕ/пропилен/VDF сополимер, VDF/HFP сополимер, TFE/VDF/HFP сополимер, TFE/PMVE сополимер, TFE/CF2=CFOC3F7 сополимер, TFE/CF2=CFOCF3/CF2=CFOC3F7 сополимер, TFE/этил винил эфир (EVE) сополимер, TFE/бутил винил эфир (BVE) сополимер, TFE/EVE/BVE сополимер, VDF/CF2=CF-OC3F7 сополимер, этилен/HFP сополимер, TFE/HFP сополимер, CTFE/VDF сополимер, TFE/VDF сополимер, TFE/VDF/PMVE/этилен сополимер, и TFE/VDF/ CF2=CFO(CF2)3OCF3 сополимер.
[0060] В одной реализации настоящей заявки заявляемый фторполимер может быть вулканизирован пероксидными вулканизирующими агентами, включая органические пероксиды. Во многих случаях предпочтительно использовать третичный бутил пероксид, в котором третичный атом углерода прикреплен к пероксильному кислороду.
[0061] Вулканизированные фторполимеры особенно полезны в качестве уплотнителей, прокладок и литых деталей в системах, подвергающихся воздействию повышенных температур и/или коррозионных материалов в таких отраслях, как автомобильная, химическая промышленность, производство полупроводников, аэрокосмическая и нефтяная отрасль, и т.п.
[0062] К показательным реализациям относятся:
[0063] Реализация 1. Способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, способ включает:
(i) галогенирование дифторсульфурил пероксида с последующей реакцией с первым фторолефином для образования фторангидрида галогенированной фторорганической кислоты;
(ii) реагирование фторангидрида галогенированной фторорганической кислоты с первым соединением, как минимум одним выбранным из:
(a) второго фторолефина в присутствии галоген-содержащего соединения для образования галогенированного фторированного эфирсодержащего соединения; и
(b) HFPO для образования соответствующего фторангидрида и преобразования соответствующего фторангидрида в галогенированное фторированное эфирсодержащее соединение.
[0064] Реализация 2. Способ по реализации 1, где преобразование соответствующего фторангидрида выбирается из:
(i) реагирования соответствующего фторангидрида с третьим фторолефином в присутствии галогенсодержащего соединения для образования галогенированного фторированного эфирсодержащего соединения;
(ii) пиролиза соответствующего фторангидрида для образования винилового эфира; затем реагирования винилового эфира с интергалоидом для образования галогенированного фторированного эфирсодержащего соединения;
(iii) реагирования соответствующего фторангидрида с CF2-CF-CF2-OSO2F для образования галогенированного фторированного эфирсодержащего соединения; или
(iv) реагирования соответствующего фторангидрида с LiI для образования галогенированного фторированного эфирсодержащего соединения.
[0065] Реализация 3. Способ по любой из предыдущих реализаций, где первый фторолефин выбирается как минимум один из: тетрафторэтилена, гексафторпропилена и хлортрифторэтилена.
[0066] Реализация 4. Способ по любой из предыдущих реализаций, где второй фторолефин выбирается как минимум один из: тетрафторэтилена, гексафторпропилена, винилиден фторида и хлортрифторэтилена.
[0067] Реализация 5. Способ по любой из реализаций 2-4, где третий фторолефин выбирается как минимум один из: тетрафторэтилена, гексафторпропилена, винилиден фторида и хлортрифторэтилена.
[0068] Реализация 6. Способ по любой из предыдущих реализаций, дополнительно включающий реагирование соответствующего фторангидрида с HFPO для образования удлиненного фторангидрида, преобразуемого затем в галогенированное фторированное эфирсодержащее соединение.
[0069] Реализация 7. Способ по любой из предыдущих реализаций, где структура галогенированного фторированного эфирсодержащего соединения выбирается как минимум одной из:
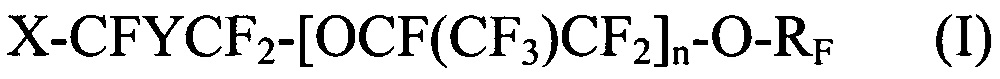
где X выбирается из Br, Cl и I; Y представляет собой F или CF3; n является целым числом в диапазоне 0-3 и RF представляет собой CF=CF2 или CF2CF=CF2; и
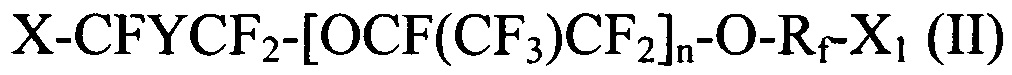
где X и X1 независимо выбираются из Br, Cl и I; Y представляет собой F или CF3; Rf выбираются из CF2CF2, CF(CF3)CF2, CFClCF2, или CH2CF2; и n является целым числом в диапазоне 1-3.
[0070] Реализация 8. Способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, способ включает:
(i) образование 2,2,3,3-тетрафтор-3-галогенпропаннитрила с использованием цианосодержащего соединения и TFE, где вариант образования выбирается из:
a) добавки XCN к TFE, где X представляет собой I, Br или Cl; и
b) добавки MCN к TFE, где М представляет собой щелочной металл, который затем контактирует с галогеносодержащим соединением;
(ii) преобразование 2,2,3,3-тетрафтор-3-галогенпропаннитрила в 2,2,3,3-тетрафтор-3-галогенпропаноил фторид;
(iii) реагирование 2,2,3,3-тетрафтор-3-галогенпропаноил фторида с первым соединением, как минимум одним, выбранным из
(a) фторолефина в присутствии галоген-содержащего соединения с образованием галогенированного фторированного эфирсодержащего соединения; и
(b) HFPO для образования соответствующего фторангидрида и преобразования соответствующего фторангидрида в галогенированное фторированное эфирсодержащее соединение.
[0071] Реализация 9. Способ по реализации 8, где вариант преобразования соответствующего фторангидрида выбирается из:
(а) реагирования соответствующего фторангидрида со вторым соединением, в качестве которого выбирается как минимум одно из перечисленных далее (i) третий фторолефин в присутствии галогенсодержащего соединения для образования соответствующего галогенированного эфирсодержащего соединения и (ii) HFPO для образования соответствующего фторангидрида;
(b) пиролиза соответствующего фторангидрида для образования винилового эфира; затем реагирования винилового эфира с интергалоидом для образования галогенированного фторированного эфирсодержащего соединения;
(c) реагирования соответствующего фторангидрида с CF2=CF-CF2-OSO2F для образования галогенированного фторированного эфирсодержащего соединения; или
(d) реагирования соответствующего фторангидрида с LiI для образования галогенированного фторированного эфирсодержащего соединения.
[0072] Реализация 10. Способ по реализации 8 или 9, где в качестве второго фторолефина выбирается как минимум один из следующих: тетрафторэтилен, гексафторпропилен, винилиден фторид и хлортрифторэтилен.
[0073] Реализация 11. Способ по любой из реализаций 8-10, где в качестве третьего фторолефина выбирается как минимум один из следующих: тетрафторэтилен, гексафторпропилен, винилиден фторид и хлортрифторэтилен.
[0074] Реализация 12. Способ по любой из реализаций 8-11, дополнительно включающий реагирование соответствующего фторангидрида с HFPO для образования удлиненного фторангидрида, преобразуемого затем в галогенированное фторированное эфирсодержащее соединение.
[0075] Реализация 13. Способ по любой из реализаций 8-12, где структура галогенированного фторированного эфирсодержащего соединения выбирается соответствующей как минимум одной из:
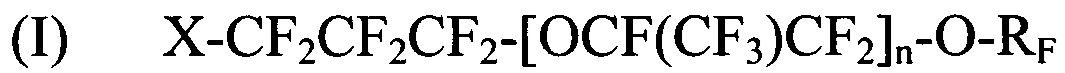
где X выбирается из I, Br и Cl; n является целым числом в диапазоне 0-3 и RF представляет собой CF=CF2 или CF2CF=CF2; и
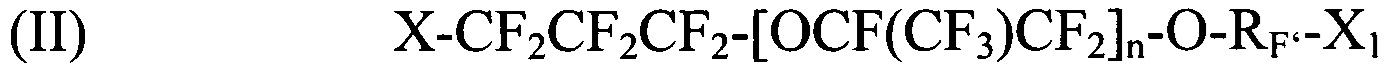
где X и X1 независимо выбираются из I, Br и Cl; RF'- выбирается из CF2CF2, CFClCF2, или CH2CF2; и n является целым числом в диапазоне 0-3.
[0076] Реализация 14. Способ получения галогенированного фторированного эфирсодержащего соединения из фторолефина, способ включает:
(i) реагирование дифторангидрида перфторорганической дикислоты с первым соединением, как минимум одним выбранным из:
(a) первого фторолефина в присутствии галогена, содержащего соединение для образования галогенированного фторированного эфирсодержащего соединения; и
(b) HFPO для образования соответствующего дифторангидрида дикислоты и преобразования соответствующего дифторангидрида дикислоты в галогенированное фторированное эфирсодержащее соединение.
[0077] Реализация 15. Способ по реализации 14, где этап преобразования выбирается из:
(i) реагирования соответствующего дифторангидрида дикислоты со вторым соединением, как минимум одним выбранным из:
(а) второго фторолефина в присутствии галоген-содержащего соединения с образованием галогенированного фторированного эфирсодержащего соединения; и
(b) реагирования соответствующего фторангидрида с HFPO для образования фторангидрида
(ii) пиролиза соответствующего фторангидрида для образования винилового эфира; затем реагирования винилового эфира с интергалоидом для образования галогенированного фторированного эфирсодержащего соединения;
(iii) реагирования соответствующего фторангидрида с CF2=CF-CF2-OSO2F для образования галогенированного фторированного эфирсодержащего соединения; или
(iv) реагирования соответствующего фторангидрида с LiI для образования галогенированного фторированного эфирсодержащего соединения.
[0078] Реализация 16. Способ по любой из реализаций 14-15, где первый фторолефин выбирается как минимум из одного из: тетрафторэтилена, гексафторпропилена, винилиденфторида и хлортрифторэтилена.
[0079] Реализация 17. Способ по любой из реализаций 14-16, где в качестве второго фторолефина выбирается как минимум один из следующих: тетрафторэтилен, гексафторпропилен, винилиден фторид и хлортрифторэтилен.
[0080] Реализация 18. Способ по любой из реализаций 14-17, где дифторангидриды перфторорганической дикислоты с четными номерами синтезируются введением первого перфторолефина в дифторсульфурил пероксид для образования перфторорганил бисфторсульфата и реагированием перфторорганил бисфторсульфата с катализатором для образования соответствующего дифторангидрида дикислоты.
[0081] Реализация 19. Способ по любой из реализаций 14-18, где катализатор выбирается из азотсодержащих оснований или фторидов металлов MF, где М представляет собой Li, Na, K или Cs.
[0082] Реализация 20. Способ по любой из реализаций 14-19, где структура галогенированного фторированного эфирсодержащего соединения выбирается соответствующей как минимум одной из:
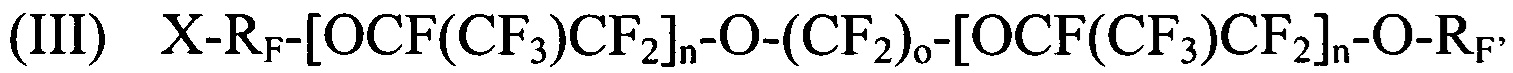
где X выбирается из I, Br и Cl; RF представляет собой CF2CF2 или CF2CF2CF2; n является целым числом в диапазоне 0-3; о является целым числом в диапазоне 2-6, 8 и 10; и RF' представляет собой CF=CF2 или CF2CF=CF2; и
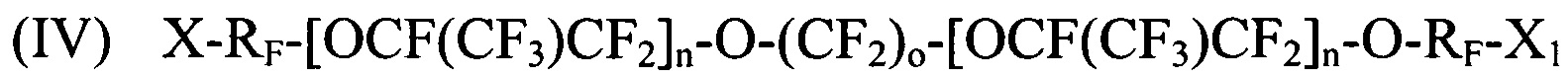
где X и Х1 независимо выбираются из I, Br и Cl; RF представляет собой независимо CF2-CF2, CF(CF3)CF2, CFClCF2, или CH2CF2; n является целым числом в диапазоне 0-3; о является целым числом в диапазоне 2-6, 8 и 10.
ПРИМЕРЫ
[0083] Преимущества и реализации настоящей заявки дополнительно иллюстрируются приведенными ниже примерами, но конкретные материалы и их количество, фигурирующие в этих примерах, равно как и другие условия и подробности, не следует трактовать в ограничительном смысле для заявляемого изобретения. Все процентные соотношения, пропорции и доли в примерах указываются по весу при отсутствии иных указаний.
[0084] Все материалы доступны на рынке, например, производства компанииий Sigma-Aldrich Chemical Company; Milwaukee, WI, или известны специалистам этой отрасли, если не оговорено иное.
[0085] Аббревиатуры, используемые в следующих примерах: А = амперы, b.р. = точка кипения, г = грамм, ч = час, кг = килограммы, мин = минуты, mol = моль, см = сантиметр, мбар = миллибар, мм = миллиметр, мл = миллилитр, л = литр, psi = давление в фунтах на квадратный дюйм, МПа = мегапаскаль и wt = вес.
[0086] Пример 1:
[0087] Синтез FSO2-O-O-SO2F
[0088] FSO3H подвергся электролизу в 10 л ячейке с двойными стенками и стеклянной футеровкой с помощью стальных катодов и стеклоуглеродных анодов (площадь электродов 720 см2). Электролит ячейки был приготовлен растворением NaCl (410 г; 7,0 mol) в FSO3H (13,1 кг; 8,5 л; 130,9 mol) и удалением предшествующей НСl сухим азотом при интенсивном перемешивании. Через ячейку пропускался ток 70 А при 56°С в течение 2 ч. Количество полученного пероксида (517 г; 2,6 mol) было вычислено (по закону Фарадея). Вычисленное значение согласовалось с результатами титрования при помощи KI (2 мл электролита было добавлено к раствору KI, охлажденному льдом, и количество получившегося йода было определено раствором тиосульфата).
[0089] Синтез ICF2CF2OSO2F
[0090] Эквимолярное количество йода (660 г; 2,6 mol) в диапазоне температур 20-65°С было добавлено к FSO2-O-O-SO2F, приготовленному выше. Затем в ячейку был медленно введен TFE при температуре <50°С. После подачи эквимолярного количества TFE (260 г; 2,6 mol) в течение 1 часа, нижний слой был отсепарирован и дистиллирован. ICF2CF2OSO2F был получен при 85% выходе (720 г; 2,2 mol; b.р. 100°С).
[0091] Синтез ICF2C(O)F
[0092] ICF2C(O)F был изготовлен из ICF2CF2OSO2F (350 г; 1,1 mol) в присутствии CsF (15 г; 0,1 mol) и нагревался до 90°С в течение 3 ч. ICF2C(O)F был собран при 91% выходе (224 г; 1,0 mol; b.р. от 39 до 41°С).
[0093] Синтез ICF2CF2OCF=CF2 и ICF2CF2OCF(CF3)CF2OCF=CF2:
[0094] CsF (3,1 г; 0,02 mol, был высушен при 110°С в вакууме перед использованием), диглим (150 мл) и ICF2COF (156,7 г; 0,70 mol) были помещены в стальной сосуд. Затем был добавлен HFPO (121 г; 0,73 mol) при -20°С. Реагирующая смесь перемешивалась при комнатной температуре в течение ночи. Нижний слой был отсепарирован и дистиллирован. Была получена смесь ICF2CF2OCF(CF3)C(O)F и ICF2CF2OCF(CF3)CF2OCF(CF3)C(O)F, которая затем нагревалась в присутствии К2СO3 (430 г; 3,1 mol) в диглиме (800 мл) при температуре от 150 до 180°С. Выход ICF2CF2OCF=CF2 (68 г; 0,21 mol; b.р. 102°С) и ICF2CF2OCF(CF3)CF2OCF=CF2 (172 г; 0,35 mol; b.р. 126°С) составил 30% и 50% соответственно (выход рассчитывался исходя из количества собранного материала относительно теоретического, подразумевающего 100% преобразование).
[0095] Пример 2: Синтез ICF2CF2OCF2CF2I
[0096] В стальной сосуд была помещена взвесь KF (32 г; 0,55 mol; высушенная в течение суток при 190°С в вакууме) в диглиме (200 мл) при комнатной температуре. Смесь была охлаждена до -20°С и сверху был добавлен ICF2C(O)F (112 г; 0,5 mol). Смесь была нагрета до комнатной температуры и перемешивалась в течение одного часа. Затем смесь была вновь охлаждена до -20°С и были последовательно добавлены I2 (140 г; 0,55 mol) и TFE под давлением 4,5 бар. Реакция сопровождалась падением давления. TFE добавлялся до тех пор, пока расход TFE не сделался пренебрежимо малым. Остаток TFE и другие летучие соединения были удалены, и смесь была промыта водными растворами Na2S2O3 и NaHCO3, высушена и дистиллирована. ICF2CF2OCF2CF2I был изолирован при 31% выходе (72 г; 0,15 mol; b.р. 136°С).
[0097] Пример 3:
[0098] Синтез ICF2CF2CN:
[0099] В стальной сосуд был помещен NaCN (25,1 г; 0,51 mol) и CH3CN (1189,4 г; 29,0 mol), затем был добавлен TFE (32 г; 0,32 mol) при 10°С. Смесь нагревалась до 20°С в течение 1 часа, затем была охлаждена до 10°С. После чего был добавлен раствор йода (25,6 г; 0,10 mol) в CH3CN (403 г; 9,8 mol). Смесь перемешивалась в течение ночи при 60°С. Затем смесь была охлаждена до 20°С. Был добавлен BF3⋅THF (7,8 г; 0,06 mol) и смесь вновь нагревалась в течение суток при 60°С. ICF2CF2CN был получен с 43% выходом (35,4 г; 0,14 mol; b.р. 60°С).
[00100] 19F NMR(CH3CN, RT; ppm): -55.0 I-CF2-; -109.4 -CF2-CN; GC-MS(m/e): 252.9 (ICF2CF2CN+), 176.9 (ICF2+), 127.0 (I+), 126.0 (NCCF2CF2+), 107.0 (CF2CFCN+), 100.0 (C2F4+), 76.0 (NCCF2+).
[00101] Пример 4:
[00102] Синтез FSO2O-(CF2CF2)x-OSO2F
[00103] TFE был введен в раствор FSO2-O-O-SO2F в FSO3H при интенсивном перемешивании в упомянутую ранее ячейку со стеклянной футеровкой.
[00104] Электролит был приготовлен растворением NaCl (360 г; 6,2 mol) в FSO3H (12,77 кг; 127,6 mol) и выдуванием образовавшейся НСl сухим азотом при интенсивном перемешивании.
[00105] Реакция с TFE производилась при температуре от 35 до 60°С, напряжении 15 В, токе 56 А и удельной плотности тока 78 мА/см. TFE вводился в ячейку с расходом 200 г/ч (2 mol/ч; итого: 1,51 кг; 15,1 mol). После реакции образовалась бифазная система. Нижняя фаза (продукт) была отделена (4,14 кг) и после интенсивной промывки водой была изолирована прозрачная желтоватая фаза (3,75 кг). Газовый хроматографический анализ показал распределение FSO2O-(CF2CF2)x-OSO2F: x =1:3,9, х=2:35,8, х=3:33,2, х=4:16,9, х=5: 1:6,3.
[00106] Синтез CF2=CFO(CF2)4OCF=CF2
[00107] Фракционированный FSO2O-(CF2CF2)x-OSO2F, где х=2 из предшествующих примеров был преобразован в F(O)C(CF2)2C(O)F с использованием CsF при 50°С.
[00108] В стальной сосуд были помещены CsF (13 г; 0,09 mol) и F(O)C(CF2)2C(O)F (213,4 г; 1,1 mol) в диглиме (166 мл) при 0°С. Стальной сосуд был охлажден до -18°С. Затем был добавлен HFPO (432 г; 2,6 mol), и смесь перемешивалась при окружающей температуре в течение 13 ч. Была получена бифазная смесь. Нижний слой был отсепарирован и дистиллирован. Полученный F(O)C(CF3)CFO(CF2)4OCF(CF3)C(O)F был затем нагрет в присутствии К2СО3(1,2 кг; 9 mol) в диглиме (2,5 л) при температуре от 150 до 180°С. Выход CF2=CFO(CF2)4OCF=CF2 составил 55% (240 г; 0,61 mol; b.р. 111°С при 950 мбар).
[00109] 19F NMR(CDCl3, RT; ppm): -86.6 (m, 4F), -116.0 (dd, 2F), -123.8 (ddt, 2F),
-126.9 (m, 4F), -137.2 (ddt, 2F)
[00110] Синтез ICF2CF2O(CF2)4OCF2CF2I В стальной сосуд были помещены CF2=CFO(CF2)4OCF=CF2 (169,5 г; 0,43 mol), I2 (88,7 г; 0,35 mol), и IF5 (155,3 г; 0,70 mol). Смесь нагревалась при 138°С в течение 16 часов. После остывания до комнатной температуры летучие побочные продукты были удалены промывкой азотом и остаток жидкости был осторожно вылит в ледяную воду. После интенсивной промывки ледяной водой и раствором бикарбоната натрия жидкость была высушена над MgSO4 и дистиллирована. Изолированный выход составил 56% (164,6 г; 0.24 mol; b.р. 70°С при 5,4 мбар).
[00111] Пример 5
[00112] Синтез ICF2CF2O(CF2)4OCF=CF2
[00113] В стальной сосуд были помещены CF2=CFO(CF2)4OCF=CF2 (161,6 г; 0,41 mol), I2 (40,6 г; 0,16 mol), и IF5 (71,0 г; 0,32 mol). Смесь нагревалась при 142°С в течение 16 часов. После остывания до комнатной температуры летучие побочные продукты были удалены промывкой азотом, и остаток жидкости был осторожно вылит в ледяную воду. После интенсивной промывки ледяной водой и раствором бикарбоната натрия жидкость была высушена над MgSO4 и дистиллирована. Изолированный выход составил 51% (113,4 г; 0,21 mol; b.р. 59°С при 5,4 мбар).
[00114] Предстоящие модификации и изменения заявляемого изобретения будут очевидны для специалистов без отхода от области и духа заявляемого изобретения. Заявляемое изобретение не должно ограничиваться реализациями, описание которых приводится исключительно для иллюстрации.