Результат интеллектуальной деятельности: ПОЛИПЕПТИДЫ
Вид РИД
Изобретение
Область изобретения
Изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2 (прамлинтида), к фармацевтическим композициям, содержащим эти полипептиды, и к применению этих полипептидов в качестве лекарственных средств.
Уровень техники
Большое и все увеличивающееся число людей страдает от сахарного диабета и ожирения. Сахарный диабет является нарушением обмена веществ, при котором способность утилизировать глюкозу частично или полностью утрачена.
Ряд режимов лечения нацелены на избыточный уровень глюкозы в крови, в то время как другие сосредоточены главным образом на снижении веса. Наиболее эффективным антидиабетическим агентом, используемым для снижения уровня глюкозы в крови, является инсулин и его аналог(и). Уже долгое время известно, что использование традиционного инсулина для лечения диабета связано с увеличением массы тела. Инсулин нужно вводить подкожно до нескольких раз в день.
Диабет 2 типа обычно лечат на ранних стадиях диетой и физическими упражнениями. Когда состояние прогрессирует, добавляются различные пероральные антидиабетические агенты. Инъекционные агенты, такие как аналоги GLP-1, также могут быть использованы на этой стадии. В целом, эти агенты являются наиболее эффективными у пациентов с функционирующими бета-клетками, способными высвобождать инсулин и амилин.
Человеческий амилин (SEQ ID №1) является полипептидом длиной в 37 аминокислот, который имеет физико-химические свойства, которые делают трудным его применение в качестве лекарственного препарата. В частности, он имеет тенденцию к фибриллогенезу, т.е. формированию фибрилл, in vitro и/или ex vivo и становится неэффективным из-за образования осадка. Кроме того, амилин трудно собрать в состав, так как он химически нестабилен и осаждается при физиологическом рН. Поэтому его собирают в состав в кислом растворе.
Человеческий амилин связывается с двумя различными рецепторными комплексами. Эти два комплекса содержат рецептор кальцитонина плюс белки, модифицирующие активность рецептора, RAMP1 или RAMP3. Из тесной связи между рецептором кальцитонина и рецептором амилина от агониста рецептора амилина можно ожидать некоторой перекрестной реактивности к рецептору кальцитонина. Например, прамлинтид имеет некоторую аффинность к рецептору кальцитонина, но она в 14 раз более высокая к рецептору амилина.
Рецептор кальцитонина обнаруживается во многих тканях всего организма и, по-видимому, участвует в регуляции метаболизма костной ткани. Кальцитонин лосося в настоящее время продается под торговым названием Miacalcic®. Продукт используется при гиперкальциемии, остеопорозе (в том числе постменопаузальном остеопороза и остеопорозе, связанном с приемом глюкокортикоидом), деформирующем остите (болезни Педжета) и вводится один раз в день путем инъекции или интраназально. Кальцитонин связывается со специфическими рецепторами в мембране скелета, почек и центральной нервной системы (ЦНС). Время полужизни кальцитонина лосося в плазме составляет примерно 45 минут.
Полипептиды с активностью к рецептору кальцитонина могут использоваться в лечении гиперкальциемии, остеопороза, болезни Педжета, ожирения или связанных с ожирением заболеваний, а также в профилактике связанных с ожирением заболеваний. Недостаток лечения используемыми в настоящее время препаратами кальцитонина заключается в том, что в связи с коротким периодом полужизни кальцитонина лосося в плазме препарат нужно вводить несколько раз в день и непосредственно перед едой.
Полипептиды с двойной активностью к рецептору кальцитонина и рецептору амилина могут быть предпочтительными.
Прамлинтид (SEQ ID №2) является лекарственным продуктом, который продается компанией Amylin Pharmaceuticals как Симлин® для лечения сахарного диабета как дополнение к инсулину. Прамлинтид является агонистом рецептора амилина. Он примерно в 14 раз менее активен на рецепторе кальцитонина.
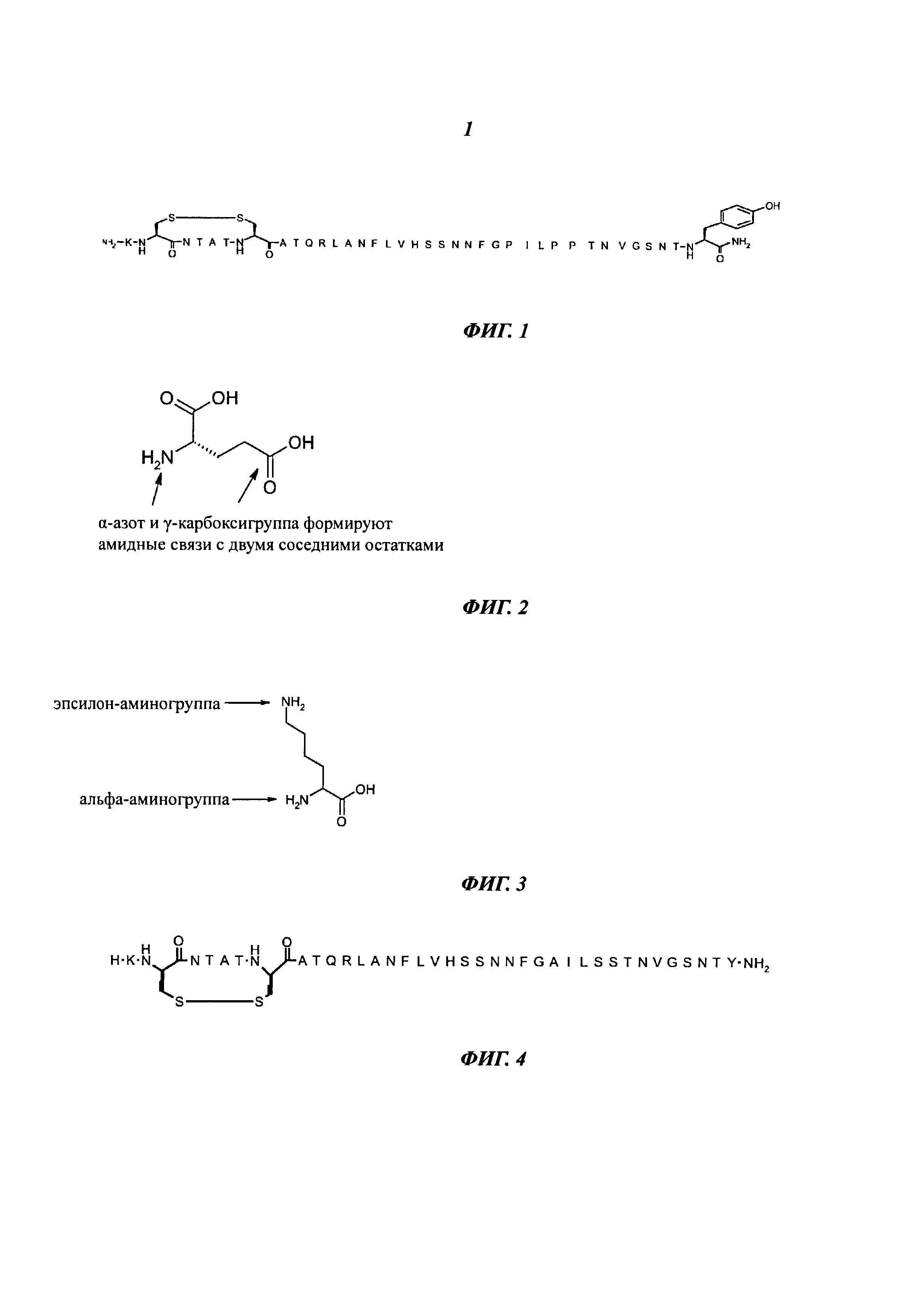
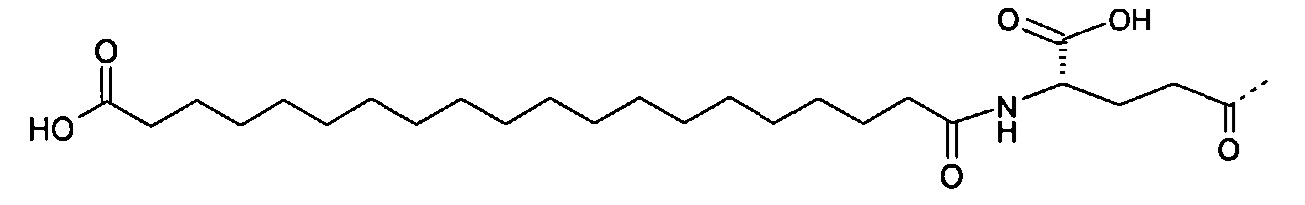
Химическая структура прамлинтида представлена ниже, а также на Фиг.1.
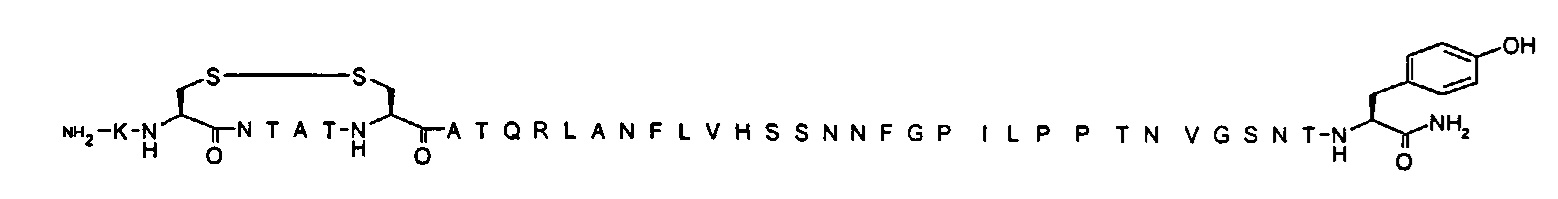
Прамлинтид химически нестабилен при нейтральном рН и поэтому представлен в кислом растворе. По сравнению с человеческим амилином аминокислоты в позициях 25, 28 и 29 в прамлинтиде замещены пролином. Эта модификация уменьшает склонность белка к образованию фибрилл. Прамлинтид имеет очень короткий период полужизни в плазме и, следовательно, должен вводиться два-три раза в день
WO2010046357 и WO2009034119 раскрывают полипептиды, содержащие амилиновые аналоги, имеющие альбуминсвязывающий остаток (называемые в данном документе амилиновыми производными). Даже при том, что эти полипептиды с альбуминсвязывающими группировками демонстрируют улучшенные фармакокинетические (PK) или фармакодинамические (PD) свойства по сравнению с прамлинтидом, они по-прежнему могут иметь плохую физическую стабильность в определенных условиях.
Сущность изобретения
Неожиданно было обнаружено, что полипептиды, содержащие аминокислоту, которая является аналогом SEQ ID №2 (прамлинтида), с аминокислотным остатком в позиции 37, который представляет собой пролин, может демонстрировать повышенную растворимость и/или физическую стабильность.
По меньшей мере в некоторых воплощениях полипептиды данного изобретения обладают повышенной растворимостью.
По меньшей мере в некоторых воплощениях полипептиды данного изобретения обладают повышенной физической стабильностью.
По меньшей мере в некоторых воплощениях полипептиды данного изобретения обладают повышенной растворимостью и физической стабильностью.
По меньшей мере в некоторых воплощениях полипептиды данного изобретения демонстрируют выгодный фармакокинетический профиль и/или выгодный фармакологический профиль. Примером выгодного фармакокинетического профиля является профиль длительного действия.
В одном широком аспекте данное изобретение относится к полипептиду, содержащему аминосилотную последовательность, которая является аналогом SEQ ID №2, содержащим остаток пролина в позиции 37, где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2. Возможно, в анализе активности человеческого рецептора амилина, описанном в данном документе, полипептид обладает EC50 примерно 1800 пМ или менее. Возможно, в анализе активности человеческого рецептора кальцитонина, описанном в данном документе, полипептид обладает ЕС50 примерно 1800 пМ или менее. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 4 примерно 100 мкМ или более. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 7 примерно 100 мкМ или более. Возможно, в анализе образования фибрилл (также называемом анализом фибрилляции), описанном в данном документе, полипептид обладает стабильностью примерно 25 часов или более. Возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному из его аминокислотных остатков. Данное изобретение также относится к фармацевтическим составам, содержащим его. Данное изобретение также относится к его фармакологическим применениям. Данное изобретение также относится к доставке (например, введению) его пациентам, нуждающимся в таком лечении.
В другом широком аспекте данное изобретение относится к полипептиду, содержащему аминосилотную последовательность, которая является аналогом SEQ ID №2, содержащим остаток пролина в позиции 37 и остаток глутаминовой кислоты в позиции 14, где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2. Возможно, в анализе активности рецептора амилина (описанном в данном документе) полипептид обладает EC50 примерно 1800 пМ или менее. Возможно, в анализе активности рецептора кальцитонина, описанном в данном документе, полипептид обладает EC50 примерно 1800 пМ или менее. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 4 примерно 100 мкМ или более. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 7 примерно 100 мкМ или более. Возможно, в анализе образования фибрилл (также называемом анализом фибрилляции), описанном в данном документе, полипептид обладает стабильностью примерно 25 часов или более. Возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному из его аминокислотных остатков. Данное изобретение также относится к фармацевтическим составам, содержащим его. Данное изобретение также относится к его фармацевтическим применениям. Данное изобретение также относится к доставке (например, введению) его пациентам, нуждающимся в таком лечении.
В другом широком аспекте данное изобретение относится к полипептиду, содержащему аминосилотную последовательность, которая является аналогом SEQ ID №2, содержащим остаток пролина в позиции 37, остаток гистидина или аргинина в позиции 17 и остаток глутаминовой кислоты в позиции 14, где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2. Возможно, в анализе активности рецептора амилина (описанном в данном документе) полипептид обладает EC50 примерно 1800 пМ или менее. Возможно, в анализе активности рецептора кальцитонина, описанном в данном документе, полипептид обладает ЕС50 примерно 1800 пМ или менее. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 4 примерно 100 мкМ или более. Возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 7 примерно 100 мкМ или более. Возможно, в анализе образования фибрилл (также называемом анализом фибрилляции), описанном в данном документе, полипептид обладает стабильностью примерно 25 часов или более. Возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному из его аминокислотных остатков. Данное изобретение также относится к фармацевтическим составам, содержащим его. Данное изобретение также относится к его фармацевтическим применениям. Данное изобретение также относится к доставке (например, введению) его пациентам, нуждающимся в таком лечении.
В другом широком аспекте данное изобретение относится к полипептиду, содержащему аминосилотную последовательность, которая является аналогом SEQ ID №2 формулы (I):

где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди Gly, His, Arg, Ser и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg, Lys и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Ala, Lys, Gln, Ser и Asn;
Xaa22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro, Arg и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp, Gln и Glu;
и где C-конец, возможно, может присутствовать в виде производного;
возможно, в анализе активности рецептора амилина, описанном в данном документе, полипептид обладает ЕС50 примерно 1800 пМ или менее;
возможно, в анализе активности рецептора кальцитонина, описанном в данном документе, полипептид обладает EC50 примерно 1800 пМ или менее.
возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 4 примерно 100 мкМ или более;
возможно, в анализе растворимости, описанном в данном документе, полипептид обладает растворимостью при рН 7 примерно 100 мкМ или более;
возможно, в анализе образования фибрилл (также называемом анализом фибрилляции), описанном в данном документе, полипептид обладает стабильностью примерно 25 часов или более; возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному из его аминокислотных остатков.
Данное изобретение также относится к фармацевтическим составам, содержащим его. Данное изобретение также относится к его фармацевтическим применениям. Данное изобретение также относится к доставке (например, введению) его пациентам, нуждающимся в таком лечении.
В другом аспекте изобретение также содержит фармацевтическую композицию, содержащую приведенный выше полипептид.
В другом аспекте изобретение также включает процесс изготовления фармацевтической композиции, содержащей приведенный выше полипептид.
В другом аспекте изобретение также включает приведенный выше полипептид для применения в качестве лекарственного средства.
Полипептиды данного изобретения являются выгодными, поскольку они обладают улучшенной растворимостью и/или физической стабильностью.
Подходящие анализы, используемые для определения активности на рецепторах амилина и кальцитонина, а также для определения растворимости и физической стабильности полипептидов, описаны в данном документе. Например, см. анализы (II), (IV) и (III), соответственно.
Фиг.1 представляет структуру.
Фиг.2 представляет структуру.
Фиг.3 представляет структуру.
Фиг.4 представляет структуру.
Определения
Термин «человеческий амилин», используемый в данном документе, относится к полипептиду человеческому амилину с последовательностью, изображенной в SEQ ID №1. Этот термин включает, но не ограничиваясь этим, человеческий полипептидный гормон из 37 аминокислот, известный как амилин, который в природе секретируется совместно с инсулином β-клетками поджелудочной железы. Человеческий амилин имеет следующую первичную аминокислотную последовательность:
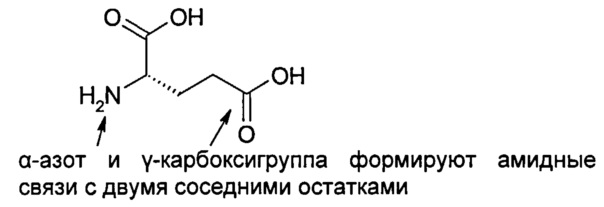
Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Ala-Ile-Leu-Ser-Ser-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr (SEQ ID №1)
Человеческий амилин имеет дисульфидный мостик между двумя остатками Cys и C-концевую амидную группу. Эта структура показана ниже, а также на Фиг.4.

В данном документе понятия «SEQ ID №1» и «человеческий амилин» могут быть использованы взаимозаменяемо.
Термин «прамлинтид», используемый в данном документе, относится к синтетическому полипептиду с последовательностью, изображенной на SEQ ID №2. Прамлинтид имеет следующую первичную аминокислотную последовательность:
Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Pro-Ile-Leu-Pro-Pro-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr (SEQ ID №2)
Прамлинтид имеет дисульфидный мостик между двумя остатками Cys и C-концевую амидную группу. Эта структура показана ниже, а также на Фиг.1.

В данном документе понятия «SEQ ID №2» и «прамлинтид» могут быть использованы взаимозаменяемо.
Термин «кальцитонин» означает кальцитонин лосося или кальцитонин человека.
Термин «кальцитонин лосося» или «sCT» означает природную белковую последовательность кальцитонина лосося, описанную в Niall et al (1969), Biochemistry vol 64, Фиг.2. Кальцитонин лосося является полипептидом, который состоит из 32 аминокислот. Он имеет дисульфидный мостик между первой и седьмой аминокислотами на амино-конце полипептидной цепи, который имеет существенное значение для его биологической активности, а также пролинамидную группу на карбокси-концевой аминокислоте.
Термин «кальцитонин человека» означает природную белковую последовательность кальцитонина человека, описанную в Niall et al (1969), Biochemistry vol 64, Фиг.2. Кальцитонин человека является полипептидом, который состоит из 32 аминокислот. Он имеет дисульфидный мостик между первой и седьмой аминокислотами на амино-конце полипептидной цепи, который имеет существенное значение для его биологической активности, а также пролинамидную группу на карбокси-концевой аминокислоте.
Термины «аналог амилина» или «амилиновый аналог» используются в данном документе по отношению к варианту SEQ ID №1.
Термины «аналог прамлинтида» или «прамлинтидный аналог» используются в данном документе по отношению к варианту SEQ ID №2.
Например, указанные варианты включают, но не ограничиваясь этим, одну или более чем одну замену, и/или одно или более чем одно удаление, и/или одно или более чем одно добавление любого из аминокислотных остатков любой природной или неприродной аминокислоты, синтетической аминокислоты или пептидомиметика, и/или прикрепление заместителя к любой природной или неприродной аминокислоте, синтетической аминокислоте или пептидомиметику в любой доступной позиции.
Вариант может иметь такое же количество аминокислотных остатков, как и прамлинтид (т.е. 37). Альтернативно, вариант может содержать меньше аминокислотных остатков, чем прамлинтид. Альтернативно, вариант может содержат больше аминокислотных остатков, чем прамлинтид. В некоторых воплощениях вариант имеет такое же число аминокислотных остатков, что и прамлинтид (т.е. 37). В некоторых воплощениях вариант включает замены любого из аминокислотных остатков на любую природную или неприродную аминокислоту, синтетическую аминокислоту или пептидомиметик, и/или присоединение заместителя к любой из природных или неприродных аминокислот, синтетических аминокислот или пептидомиметиков в любой доступной позиции.
Полипептид может содержать одну или более чем одну аминокислотную замену. Таким образом, для некоторых воплощений число аминокислотных замен в аналоге амилина может составлять по меньшей мере одну. Предпочтительно, число аминокислотных замен составляет от одной до пятнадцати, более предпочтительно от одной до двенадцати, более предпочтительно от одной до десяти, более предпочтительно от одной до пяти, более предпочтительно от одной до трех.
Число аминокислотных вставок, добавлений, делеций или замещений может составлять по меньшей мере 1, но может присутствовать до 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных вставок, добавлений, делеций или замен. Замена или добавление могут быть сделаны с любой природной или неприродной аминокислотой, синтетической аминокислотой, пептидомиметиком или другим химическим соединением. Добавление или удаление аминокислотных остатков может происходить на N-конце пептида и/или на С-конце пептида.
Используемый здесь термин «природная аминокислота» относится к аминокислоте (с обычным трехбуквенным кодом и однобуквенным кодом в скобках) выбранной из группы, включающей: глицин (Gly и G), пролин (Pro и Р), аланин (Ala и А), валин (Val и V), лейцин (Leu и L), изолейцин (Ile и I), метионин (Met и М), цистеин (Cys и С), фенилаланин (Phe и F), тирозин (Tyr и Y), триптофан (Trp и W), гистидин (His и Н), лизин (Lys и K), аргинин (Arg и R), глутамин (Gln и Q), аспарагин (Asn и N), глутаминовую кислоту (Glu и Е), аспарагиновую кислоту (Asp и D), серин (Ser и S) и треонин (Thr и Т). Если из-за опечаток имеются отклонения от общеиспользуемых кодов, то применяются общеиспользуемые коды. Аминокислоты, присутствующие в полипептидах данного изобретения, предпочтительно являются аминокислотами, которые могут быть закодированы нуклеиновой кислотой.
Если аналог содержит более 37 аминокислотных остатков или менее 37 аминокислотных остатков, специалист все равно может выровнять эту последовательность с последовательностью прамлинтида (SEQ ID NO 2) для определения числа замещений соответствующих аминокислотных остатков. Подходящей программой для выравнивания является "needle", которая представляет собой выравнивание по Нидлману-Вуншу. Алгоритм для этой программы выравнивания описан в Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48:443-453.
В нумерации последовательности SEQ ID №2 и в соответствии с установившейся практикой в данной области аминокислотному остатку на N-конце (Lys) присваивается №1, и последующие аминокислотные остатки нумеруются последовательно, заканчивая на C-конце тирозином, обозначенным №37. Поэтому, в целом, любая ссылка в данном документе на номер позиции аминокислотного остатка предусматривает его расположение в 37-аминокислотной последовательности; при этом указанная 37-аминокислотная последовательность является аналогом прамлинтида. Например, ссылка на аналог, модифицированный в позиции 14, может относиться к аналогу, в котором 14-й аминокислотный остаток из 37 аминокислот в аналоге был изменен.
Другими словами, нумерация аминокислотной последовательности аналога предусматривает позицию каждого аналога по отношению к 37-аминокислотной последовательности, где нумерация является последовательной и возрастает в направлении от N-конца к C-концу.
Аналоги могут быть описаны со ссылкой на номер аминокислотного остатка в прамлинтиде или человеческом амилине, который модифицирован, т.е. по его позиции и характеру изменения. Далее следуют неограничивающие примеры соответствующей номенклатуры аналогов.
Например:
[Pro37]-прамлинтид обозначает аналог SEQ ID №2 (прамлинтида), где изменением в прамлинтиде является замена Tyr в позиции 37 на Pro.
[Glu14,Arg17,Pro37]-прамлинтид обозначает аналог SEQ ID №2 (прамлинтида), в котором Asn в позиции 14 заменен на Glu, Val в позиции 17 заменен на Arg, а Tyr в позиции 37 заменен на Pro.
В еще одном примере des1 (или Des1) в отношении аналога прамлинтида относится к аналогу, в котором N-концевая аминокислота, лизин, удалена. Аналог прамлинтида, в котором N-концевая аминокислота удалена, также может быть обозначен как des1-прамлинтид.
[Pro25, Pro28, Pro29]-амилин человека обозначает аналог SEQ ID №1 (человеческого амилина), где модификациями в человеческом амилине были замены Ala в позиции 25 и Cys в позицииях 28 и 29 на Pro. Этот полипептид представляет собой прамлинтид. Соответственно, понятно, что прамлинтид является аналогом человеческого амилина. Таким образом, понятия «аналоги прамлинтида» и «аналоги амилина» могут быть использованы взаимозаменяемо.
Как видно из приведенных выше примеров, аминокислотные остатки могут быть идентифицированы по их полному названию, их одинбуквенному коду и/или трехбуквенному коду. Эти три способа полностью эквивалентны.
Выражения «соответствует», «эквивалентная позиция» или «соответствующая позиция», используемые в данном документе, могут использоваться для характеризации участка модификации в аналоге прамлинтида со ссылкой на SEQ ID №2. Эквивалентные или соответствующие позиции легко выводятся, например, простым написанием и визульным контролем; и/или может быть использована стандартная программа для выравнивания белков или полипептидов, например, "needle", которая представляет собой выравнивание Нидлмана-Вунша. Алгоритм описан в Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48: 443-453, и программа выравнивания Майерса и Миллера в "Optimal Alignments in Linear Space" CABIOS (computer applications in the biosciences) (1988) 4:11-17. Для выравнивания могут быть использованы матрица весов выравнивания по умолчанию BLOSUM62 и матрица идентичности по умолчанию, а штраф за первый остаток в делеции может быть установлен на -10, и штрафы за дополнительные остатки в делеции на -0,5.
Полипептид может содержать один или более чем один заместитель на одном или более чем одном аминокислотном остатке. Такие полипептиды также могут быть названы производными прамлинтида или производными амилина.
Термин «заместитель», используемый в данном документе, означает любую подходящую группировку, связанную, в частности ковалентно связанную, с аминокислотным остатком, в частности в любой доступной позиции на аминокислотном остатке. Как правило, подходящая группировка представляет собой химическую группировку.
В некоторых воплощениях заместитель содержит линкер.
В некоторых воплощениях полипептид имеет заместитель на одном аминокислотном остатке, где аминокислотный остаток является аминокислотным остатком на N-концевом остатке, либо аминокислотный остаток является лизином.
В некоторых воплощениях полипептид имеет на N-концевом аминокислотном остатке заместитель, связанный через α(альфа)-аминогруппу N-концевого аминокислотного остатка.
В некоторых воплощениях N-концевой аминокислотный остаток представляет собой лизин, и полипептид на N-концевом аминокислотном остатке имеет заместитель, связанный через ε (эпсилон)-аминогруппу аминокислотного остатка лизина.
В некоторых воплощениях полипептид удлинен за счет добавления остатка лизина на N-конце, и полипептид имеет заместитель на N-концевом аминокислотном остатке, связанный через ε-аминогруппу аминокислотного остатка лизина.
В некоторых воплощениях полипептид удлинен за счет добавления аминокислотного остатка на N-конце, и полипептид имеет на N-концевом аминокислотном остатке заместитель, связанный через α-аминогруппу N-концевого аминокислотного остатка.
Используемый в данном документе термин «гидрокарбил» (углеводородный остаток) относится к группе, содержащей по меньшей мере углерод и водород, которая, возможно, содержит один или более чем один подходящий заместитель. Примеры таких заместителей могут включать гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклическую группу. Помимо того, что заместители могут быть циклической группой, комбинация заместителей может формировать циклическую группу. Если гидрокарбил-группа содержит более чем один атом углерода, то эти атомы углерода не обязательно должны быть связаны друг с другом. Например, по меньшей мере два атома углерода могут быть связаны через подходящий атом или группу. Таким образом, гидрокарбил-группа может содержать гетероатомы. Подходящие гетероатомы будут очевидны специалистам в данной области и включают, например, серу, азот, кислород, фосфор и кремний. В одном воплощении гидрокарбил-группа выбрана из группы, состоящей из алкил-группы, алкенил-группы, алкинил-группы, арил-группы, гетероарил-группа или циклоалкил-группы, каждая из которых, возможно, может быть замещена. Примеры таких заместителей могут включать гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группу.
Используемый в данном документе термин «алкил» включает как насыщенную прямую цепь, так и разветвленные алкил-группы, которые могут быть замещенными (моно- или поли-) или незамещенными. Предпочтительно, алкил-группа представляет собой C1-20-алкильную группу, более предпочтительно C1-15, более предпочтительно C1-10-алкильную группу, более предпочтительно C1-8-алкильную группу, более предпочтительно C1-6-алкильную группу. Особенно предпочтительные алкильные группы включают, например, метил, этил, п-пропил, изо-пропил, п-бутил, сек-бутил, изо-бутил, трет-бутил, п-пентил, п-гексил, п-гептил и п-октил. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Используемый в данном документе термин «циклоалкил» относится к циклической алкильной группе, которая может быть замещенной (моно- или поли-) или незамещенной. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Используемый в данном документе термин «алкенил» относится к углеродной цепи, содержащей одну или более чем одну углерод-углеродную двойную связь, которая может быть разветвленной или неразветвленной, и замещенной (моно- или поли-) или незамещенной. Предпочтительно алкенил-группа представляет собой С2-20-алкенил-группу, более предпочтительно C2-15-алкенил-группу, более предпочтительно С2-10-алкенил-группу, более предпочтительно С2-8-алкенил-группу, или более предпочтительно С2-6-алкенил-группу. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Используемый в данном документе термин «алкинил» относится к углеродной цепи, содержащей одну или более чем одну углерод-углеродную тройную связь, которая может быть разветвленной или неразветвленной, и замещенной (моно- или поли-) или незамещенной. Предпочтительно алкинил-группа представляет собой С2-20-алкинил-группу, более предпочтительно С2-15-алкинил-группу, более предпочтительно С2-10-алкинил-группу, более предпочтительно С2-8-алкинил-группу, или более предпочтительно С2-6-алкинил-группу. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Используемый в данном документе термин «арил» относится к ароматической С6-10-группе, которая может быть замещенной (моно- или поли-) или незамещенной. Типичные примеры включают фенил и нафтил и т.д. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Используемый в данном документе термин «гетероарил» относится к арильной группы, определенной выше, которая содержит один или более чем один гетероатом. Подходящие гетероатомы будут очевидны специалистам в данной области и включают, например, серу, азот, кислород, фосфор и кремний. Подходящие заместители включают, например, гидрокси-, алкил-, гало-, алкокси-, галоалкил-, галоалкокси-, амино-, аминоалкил- или циклоалкил-группы.
Термин «линкер», используемый в данном документе, включает подходящие заместители, которые могут присоединяться к группировке, такой как химическая группировка, к полипептиду, такому как полипептидный остов. Таким образом, линкер и химическая группировка становятся заместителем вместе. Группировка, присоединенная к линкеру, может быть любой подходящей группировкой. Примеры включают альбуминсвязывающую группировку.
В одном воплощении альбуминсвязывающая группировка содержит от 6 до 40 атомов углерода, от 8 до 26 атомов углерода или от 14 до 22 атомов углерода, например, 16, 17, 18, 19, 20 атомов углерода.
В другом воплощении альбуминсвязывающая группировка является ацильной группой, выбранной из группы, содержащей СН3(СН2)rCO-, где r является целым числом от 4 до 38, предпочтительно целым числом от 4 до 24, более предпочтительно выбранной из группы, включающей СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- и СН3(СН2)22СО-.
В одном воплощении альбуминсвязывающая группировка содержит группу, которая может быть отрицательно заряженной при рН 7,4.
В одном воплощении альбуминсвязывающая группировка содержит карбоксильную группу, такую как HOOC(CH2)sCO-, где s является целым числом от 12 до 22. Предпочтительно s составляет 16 или 18.
В одном воплощении группировка, присоединенная к линкеру, является альбуминсвязывающей группировкой.
Например, линкер может содержать одну или две аминокислоты, которые на одном конце связаны с группировкой - такой как альбуминсвязывающая группировка - и на другом конце связаны с любой доступной позицией на полипептидном остове.
В некоторых воплощениях линкер обеспечивает мостик или связь между аминогруппой на полипептидном остове и ацильной группой на группировке - такой как альбуминсвязывающая группировка. Линкер может быть связан с N-концевым аминокислотным остатком или с остатком рядом с ним. Предпочтительно линкер связан с аминокислотой в позиции 1 прамлинтидного аналога.
Другим примером линкера является комбинация по меньшей мере одной аминокислоты и амина.
В одном воплощении предпочтительно амин является группой OEG, где формула OEG показана ниже:
В некоторых воплощениях предпочтительно линкер выбран из группы, состоящей из γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, Glu, Glu-Glu, Glu-γGlu, Glu-Arg, Glu-Glu-Arg, His, His-His, His-γGlu, His-His-γGlu, Gly, Gly-γGlu, Ser, Ser-γGlu, D-Arg-D-Arg, Arg, Arg-Arg, Arg-Arg-γGlu, Ser-Ser,-Gly-Ser-Ser, Ser-Ser,-Gly-Ser-Ser-γGlu, Ser-Ser-Gly-Ser-Ser-Gly и Ser-Ser-Gly-Ser-Ser-Gly-γGlu, γGlu-OEG, γGlu-2xOEG и OEG, предпочтительно линкер выбран среди γGlu, γGlu-γGlu, γGlu-OEG, γGlu-2xOEG и OEG, более предпочтительно линкер представляет собой γGlu-γGlu.
Линкер может усиливать и/или вносить вклад в связывающий эффект группировки (например, альбуминсвязывающей группировки), например, линкер, содержащий γGlu, может усиливать альбуминсвязывающий эффект полипептида.
Под терминами «γGlu», или «gGlu», или гаммаGlu, или гамма-L-Glu понимается аминокислота со следующей структурой (также показана на Фиг.2):
Под термином «γGlu-γGlu» понимается группировка со следующей структурой:
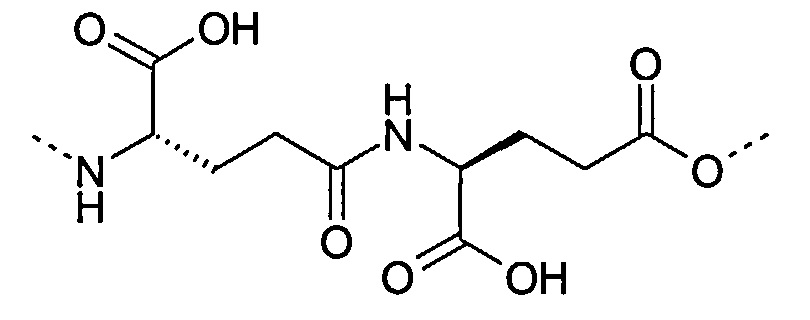
Под термином «γGlu-OEG» понимается группировка со следующей структурой:
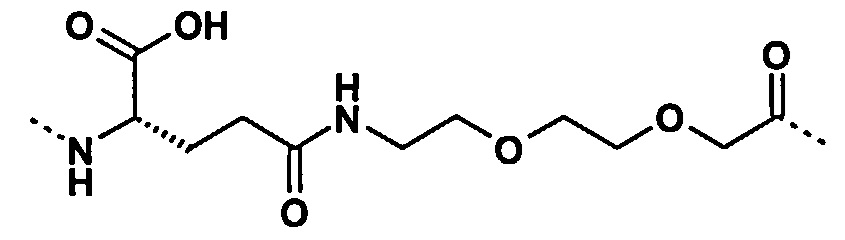
Под термином «γGlu-OEG-OEG» понимается группировка со следующей структурой:
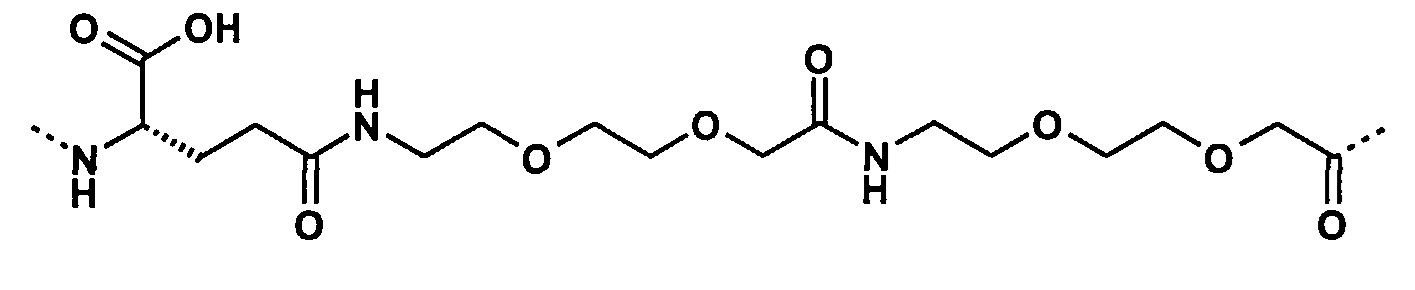
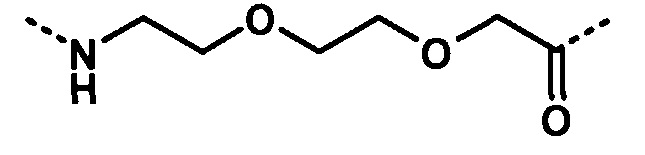
Термин «эпсилон-аминогруппа» или «ε-аминогруппа», используемый в данном докумете в отношении лизина, относится к аминогруппе в позиции 6, используя стандартную нумерацию IUPAC. Термин «альфа-аминогруппа» или «α-аминогруппа» относится к аминогруппе в позиции 2, используя стандартную нумерацию IUPAC. Мы ссылаемся на следующую структуру (также показана на Фиг.3).
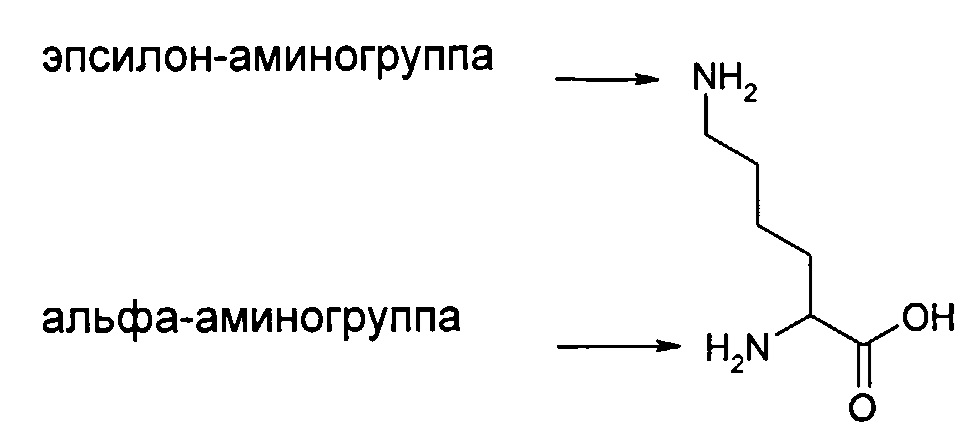
Термин «альбуминсвязывающая группировка», используемый в данном докумете, относится к любой химической группе, способной связываться с альбумином, т.е. обладающей аффинностью связывания с альбумином. В одном воплощении альбуминсвязывающая группировка является ацильной группой.
В некоторых воплощениях предпочтительно альбуминсвязывающая группировка является ацильной группой, выбранной среди:
(a) СН3(СН2)rCO-, где r является целым числом от 4 до 24;
(b) HOOC(CH2)sCO-, где s является целым числом от 14 до 20, например 16 или 18.
«Аффинность связывания с альбумином» может быть определена несколькими способами, известными в данной области. В одном способе соединение для измерения метится радиоактивным изотопом, например, 125I или 3H, и инкубируется с иммобилизованным альбумином (Kurtzhals et. al., Biochem. J., 312, 725-731 (1995)). Связывание соединения рассчитывается относительно стандарта. В другом способе радиоактивным изотопом метится родственное соединение, и его связывание с альбумином, иммобилизованным, например, на SPA-бусинах, конкурирует в серии разведении измеряемого соединения. Значение ЕС50 при конкуренции является мерой аффинности соединения. В третьем способе аффинность к рецептору или активность соединения измеряется при различных концентрациях альбумина, и сдвиг в относительной аффинности или активности соединения в зависимости от концентрации альбумина отражает его аффинность к альбумину.
Полипептиды данного изобретения проявляют хорошую активность. Термин «активность» используется для описания эффекта данного соединения в анализах, в которых было установлено сигмоидальное отношение между логарифмом концентрации и влиянием соединения. Кроме того, реакция должна варьировать в пределах от 0 до 100%. ЕС (эффективная концентрация)50 может быть использована для описания концентрации данного соединения, дающей 50% ответ в анализе, таком как функциональный анализ.
Полипептиды данного изобретения проявляют хорошую активность. Термин «активность» относится к способности снижать аппетит и/или повышать насыщаемомть. Активность может быть измерена по способности снижать аппетит как, например, описано в Анализе (I) в данном документе.
Полипептиды данного изобретения демонстрируют хорошую физическую стабильность. Термин «физическая стабильность» полипептида в соответствии с изобретением или его состава относится к тенденции полипептида не формировать биологически неактивные и/или нерастворимые агрегаты белка в результате воздействия термо-механической нагрузки и/или взаимодействия с дестабилизирующими границами раздела и поверхностями, такими как гидрофобные поверхности и границы раздела. Физическую стабильность водных составов полипептида можно оценить путем визуального осмотра, анализа образования фибрилл ThT (также называемого анализом фибрилляции), и/или измерения мутности, как описано в данном документе. Визуальный осмотр составов выполняется в резком сфокусированном свете на темном фоне. Мутность состава характеризуется ранжированной визуальной оценкой степени мутности, например, по шкале от 0 до 3 (состав, демонстрирующий отсутствие мутности, соответствует визуальной оценке 0, а состав, демонстрирующий визуальную мутность при дневном свете, соответствует визуальной оценке 3). Состав классифицируется как физически неустойчивый в связи с агрегацией белка, когда он демонстрирует визуальную мутность при дневном свете. Альтернативно, мутность состава может быть оценена путем простых способов измерения мутности, известных специалистам в данной области.
Полипептиды данного изобретения демонстрируют хорошую химическую стабильность. Термин «химическая стабильность» полипептида в соответствии с изобретением или его состава относится к отсутствию химических ковалентных изменений в структуре полипептида, что позволяет избежать формирования продуктов химической деградации, потенциально имеющих сниженную активность и/или повышенные иммуногенные свойства по сравнению с родительской (нативной) структурой полипептида. В зависимости от типа и характера родительского полипептида и окружающей среды, в которой содержится полипептид, могут формироваться различные продукты химической деградации. Вероятно, можно не полностью избежать ликвидации химической деградации, и специалистам в данной области хорошо известно часто наблюдаемое увеличение количества продуктов химической деградации во время хранения и применения полипептидных составов. Большинство полипептидов склонны к дезамидированию, процессу, в котором амидная группа боковой цепи в остатках глутамина или аспарагина гидролизуется с образованием свободной карбоновой кислоты. Другие пути деградации включают формирование высокомолекулярных продуктов трансформации, в которых две или более двух полипептидных молекул ковалентно связаны друг с другом за счет трансамидирования и/или дисульфидных взаимодействий, приводящих к образованию ковалентно связанных димерных, олигомерных и полимерных продуктов деградации (Stability of Protein Pharmaceuticals, Ahern. T.J. & Manning M.C., Plenum Press, New York 1992). Окисление (например, остатков метионина) может быть упомянуто в качестве другого варианта химической деградации. Химическую стабильность полипептидного состава можно оценить, измеряя количество продуктов химической деградации в различные временные точки после воздействия различных условий окружающей среды (образование продуктов деградации часто может ускоряться, например, при повышении температуры). Количество каждого отдельного продукта деградации часто определяют путем разделения продуктов деградации в зависимости от размера и/или заряда молекулы с использованием различных хроматографических методик (например, SEC-HPLC и/или RP-HPLC).
Термин «стабилизированный состав» относится к составу с повышенной физической стабильностью, повышенной химической стабильностью или повышенной физической и химической стабильностью по сравнению с водным раствором полипептида.
Описание изобретения
Общие аспекты
В одном аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный аналог обладает растворимостью примерно 100 мкМ или более при рН 4;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7,
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(с) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7,
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
(d) указанный полипептид обладает физической стабильностью примерно 25 часов или более в анализе образования фибрилл;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(с) указанный аналог обладает растворимостью примерно 100 мкМ или более при рН 4,
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2;
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4;
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
(e) указанный полипептид обладает физической стабильностью примерно 25 часов или более в анализе образования фибрилл;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
(b) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(c) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептиду, содержащему аминокислотную последовательность, которая является аналогом SEQ ID №2 формулы (I):

где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди Gly, His, Arg, Ser и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg, Lys и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Ala, Lys, Gln, Ser и Asn;
Хаа22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro, Arg и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp, Gln и Glu;
и где С-конец, возможно, присутствует в форме производного;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(b) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
(c) указанный аналог содержит остаток гистидина в позиции 35;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(b) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
(c) указанный аналог содержит остаток гистидина в позиции 35;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(b) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
(c) указанный аналог содержит остаток гистидина в позиции 35;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(e) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(b) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
(c) указанный аналог содержит остаток гистидина в позиции 35;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(d) указанный полипептид обладает физической стабильностью примерно 25 часов или более в анализе образования фибрилл;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
В другом аспекте данное изобретение относится к полипептидам, содержащим аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток глутаминовой кислоты в позиции 14;
(b) указанный аналог содержит остаток гистидина или аргинина в позиции 17;
(c) указанный аналог содержит остаток гистидина в позиции 35;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(d) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4;
(e) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
(f) указанный полипептид обладает физической стабильностью примерно 25 часов или более в анализе образования фибрилл;
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
Некоторые преимущества
Полипептиды данного изобретения могут демонстрировать улучшенную физическую стабильность.
Полипептиды данного изобретения могут демонстрировать улучшенную растворимость.
Полипептиды данного изобретения могут демонстрировать улучшенную физическую стабильность и растворимость.
Некоторые предпочтительные аспекты
Подходящие анализы для измерения связывания с человеческим рецептором амилина и активности, растворимости и физической стабильности представлены в данном документе (например, см. анализы (II), (IV) и (III), соответственно).
Предпочтительно Хаа14 представляет собой Glu.
Предпочтительно Xaa17 представляет собой His или Arg; более предпочтительно Arg.
Предпочтительно Хаа35 представляет собой Asn или Gln; более предпочтительно Asn.
Предпочтительно Хаа14 представляет собой Glu, a Xaa17 представляет собой Arg.
Предпочтительно Хаа14 представляет собой Glu, a Xaa17 представляет собой His.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 представляет собой Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu
Xaa17 представляет собой His или Arg;
Xaa18 представляет собой His;
Xaa21 представляет собой Asn;
Хаа22 представляет собой Asn;
Хаа26 представляет собой Ile;
Хаа31 представляет собой Asn;
Хаа35 представляет собой Asn.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 удален или независимо выбран среди His, Arg и Lys;
Хаа3 независимо выбран среди Gly, His и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ser и Asn;
Хаа22 представляет собой Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp, Gln и Glu.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 удален или независимо выбран среди Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди His и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln, Ser и Asn;
Хаа22 представляет собой Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 представляет собой Asn;
Хаа35 представляет собой Asn.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Thr и Asn;
Хаа26 представляет собой Ile;
Хаа31 представляет собой Asn;
Хаа35 независимо выбран среди Gln, Gly и Asn.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 удален;
Хаа3 независимо выбран среди Gly и Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Gln и Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди Asn, Gln и Glu.
В одном предпочтительном воплощении изобретения полипептид, содержащий аминокислотную последовательность, которая представляет собой аналог SEQ ID №2, имеет формулу (I), где:
Xaa1 представляет собой Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Lys, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ala, Lys, Gln и Ser;
Хаа22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди Gln, Glu и Asn.
В одном воплощении С-конец может быть в форме производного.
В одном воплощении С-конец полипептида может быть в виде аминокислоты или амида. В одном аспекте С-конец полипептида является амидом.
В одном воплощении С-конец присутствует в форме амида с формулой (II):
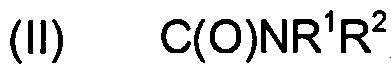 ,
,
где R1 и R2 независимо выбраны среди Н и алкила. Предпочтительно R1 и R2 оба являются Н.
В одном воплощении полипептиды данного изобретения могут иметь заместитель, присоединенный к любой из доступных позиций на одном или более чем одном аминокислотном остатке. Примеры заместителей включают химические группировки, непосредственно связанные с одним или более чем одним аминокислотным остатком, или химические группировки, связанные с одним или более чем одним аминокислотным остатком посредством линкера. Доступные точки прикрепления известны специалистам в данной области. Примеры доступных точек прикрепления включают N-конец полипептида, С-конец полипептида, эпсилон-аминогруппу остатка лизина, гидроксильную группу остатка серина, тирозина или треонина, амидную группу аспарагина или глутамина, карбоксильную группу остатка аспарагиновой кислоты или глутаминовой кислоты, тиольную группу остатка цмстеина. Предпочтительно, заместитель присоединен к N-концу полипептида или эпсилон-аминогруппе остатка лизина.
В другом воплощении заместитель присоединен к N-аминогруппе полипептида, где N-концевой аминокислотный остаток соответствует позиции 1 аналога SEQ ID №2.
В другом воплощении заместитель присоединен к эпсилон-аминогруппе остатка лизина в позиции 1 аналога SEQ ID №2.
В одном воплощении заместитель выбран среди углеводородной замещающей группы, гидроксильной группы и атома галогена. Примеры подходящих атомов галогена включают F, Cl, Br и I. Предпочтительно, заместитель представляет собой углеводородную замещающую группу.
В другом воплощении углеводородная замещающая группа представляет собой алкильную группу или группу формулы (III):
 ,
,
где L представляет собой линкер;
n=0 или 1;
Y представляет собой химическую группировку, такую как альбуминсвязывающая группировка.
В одном воплощении линкер содержит от 1 до 10 аминокислот. Линкер также может содержать амины.
Примеры подходящих аминов включают:
-С(О)-(СН2)l-O-[СН2СН2-O]m-(СН2)p-[NHC(О)-(СН2)l-O-[(СН2)n-O]m-(CH2)p]q-NH-,
где l, m, n и p независимо представляют собой 1-7, a q составляет 0-5.
Например, линкер может содержать амин, выбранный среди:
-С(O)-СН2-O-СН2-CH2-O-CH2-CH2-NH-; и
-С(O)-СН2-O-СН2-СН2-O-СН2-СН2-[NHC(O)-СН2-O-СН2-СН2-O-СН2-СН2-]1-NH-; и -С(O)-(СН2)2-O-[СН2СН2-O]7-(СН2)2-NH-.
В другом воплощении линкер представляет собой комбинацию аминокислотных остатков и указанных выше аминов, например:
γGlu-C(O)-CH2-O-CH2-CH2-O-CH2-CH2-[NHC(O)-CH2-O-CH2-CH2-O-СН2-CH2-]1-NH-; или
Arg-Arg-γGlu-C(O)-CH2-O-CH2-CH2-O-CH2-CH2-[NHC(O)-CH2-O-CH2-CH2-O-CH2-CH2-]1-NH-.
В некоторых воплощениях n=1, a L выбран из группы, состоящей из γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, Glu, Glu-Glu, Glu-γGlu, Glu-Arg, Glu-Glu-Arg, His, His-His, His-γGlu, His-His-γGlu, Gly, Gly-γGlu, Ser, Ser-γGlu, D-Arg-D-Arg, Arg, Arg-Arg, Arg-Arg-γGlu, Ser-Ser,-Gly-Ser-Ser, Ser-Ser,-Gly-Ser-Ser-γGlu, Ser-Ser-Gly-Ser-Ser-Gly и Ser-Ser-Gly-Ser-Ser-Gly-γGlu, γGlu-OEG, γGlu-OEG-OEG и OEG.
В некоторых воплощениях n=1, a L выбран среди γGlu, γGlu-γGlu, γGlu-OEG, γGlu-OEG-OEG и OEG, более предпочтительно линкер представляет собой γGlu-γGlu.
В другом воплощении n=0; соответственно между аминокислотными остатками полипептидного остова и химической группировкой Y нет линкера, т.е. Y присоединен к свободной позиции на полипептидном остове.
В одном воплощении Y является альбуминсвязывающей группировкой.
В одном воплощении альбуминсвязывающая группировка является ацильной группой.
Предпочтительно альбуминсвязывающая группировка представляет собой HOOC(CH2)sCO-, где s является целым числом от 12 до 22. Более предпочтительно s является целым числом от 14 до 20, например 14, 15, 16, 17, 18, 19 или 20. Более предпочтительно s составляет от 16 до 18. Более предпочтительно s составляет 18.
В одном воплощении полипептид изобретения содержит линкер γGlu, присоединенный к N-концу аналога амилина, и HOOC(CH2)18CO или НООС(СН2)16СО- в качестве альбуминсвязывающего остатка, где последовательность аналога амилина содержит Glu в позиции 14, His или Arg в позиции 17, His в позиции 35 или Pro в позиции 37 по сравнению с SEQ ID №2.
В другом воплощении замещающая группа и/или группа формулы (III) выбрана среди следующих групп, представленных в Табл. 1.
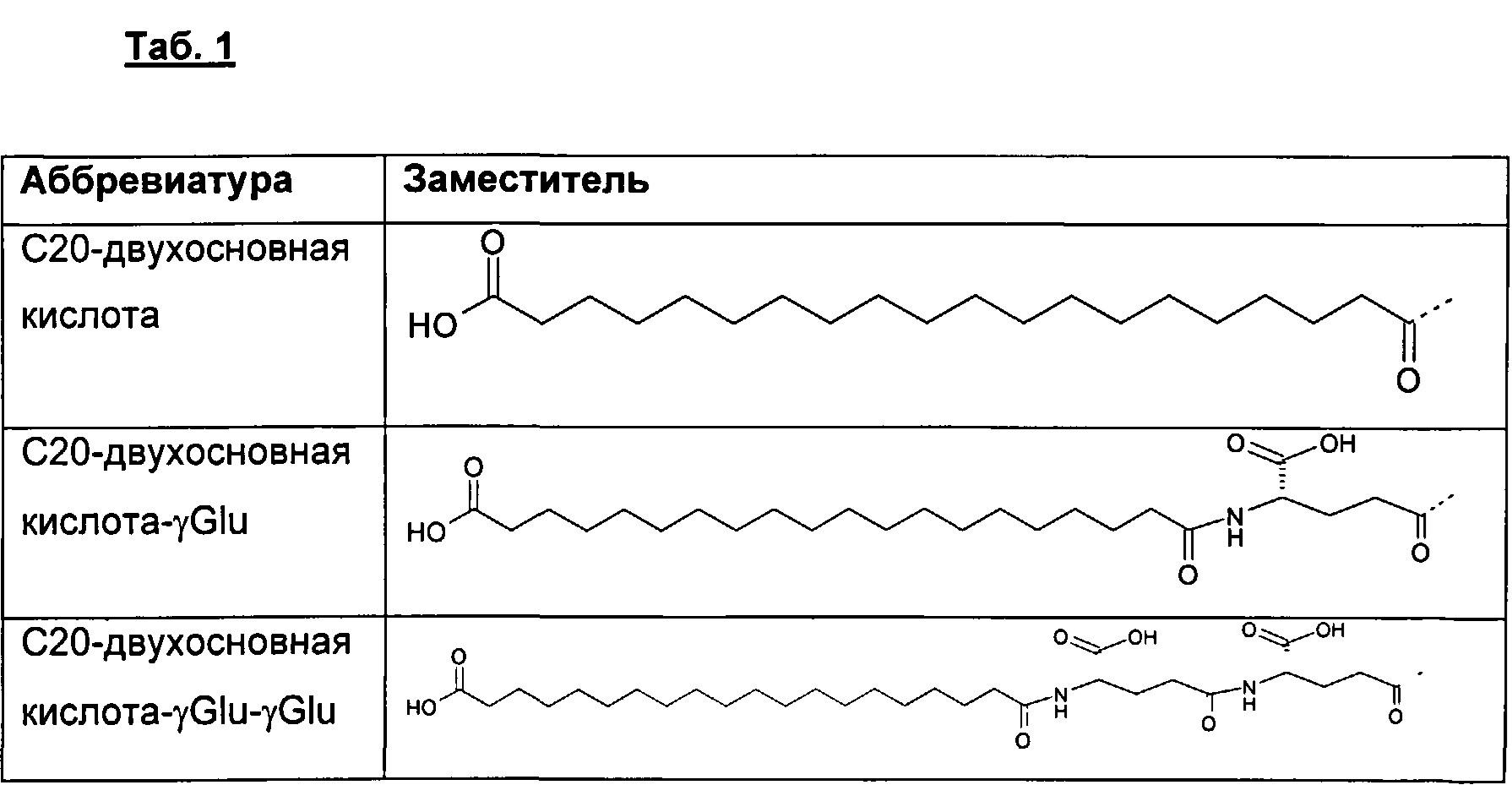
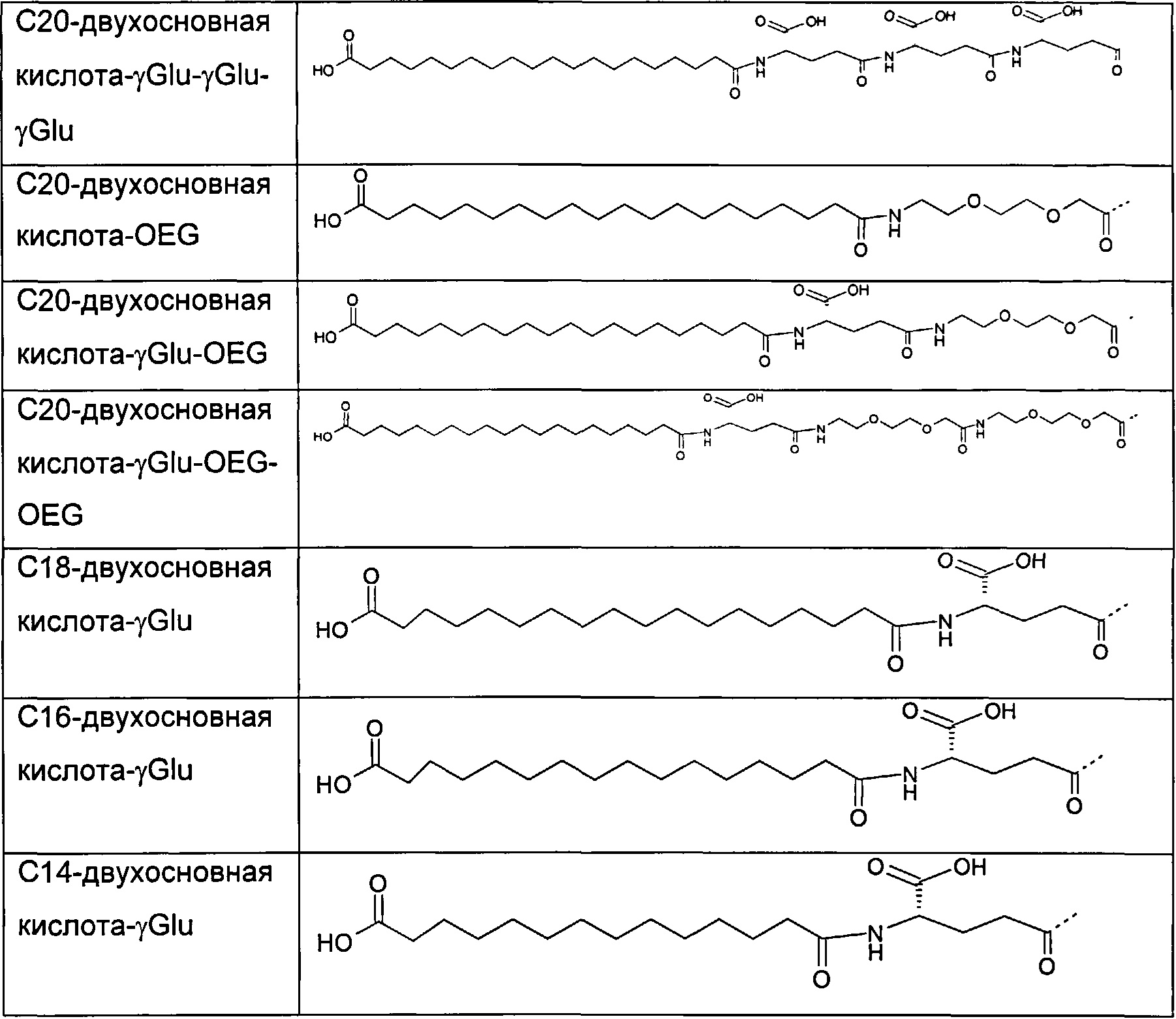
Предпочтительно, полипептиды данного изобретения содержат один заместитель.
Предпочтительно, полипептиды данного изобретения содержат один заместитель, присоединенный к N-концевой аминогруппе полипептида, где N-концевой аминокислотный остаток соответствует позиции 1 аналога SEQ ID №2.
Предпочтительно заместитель представляет собой:
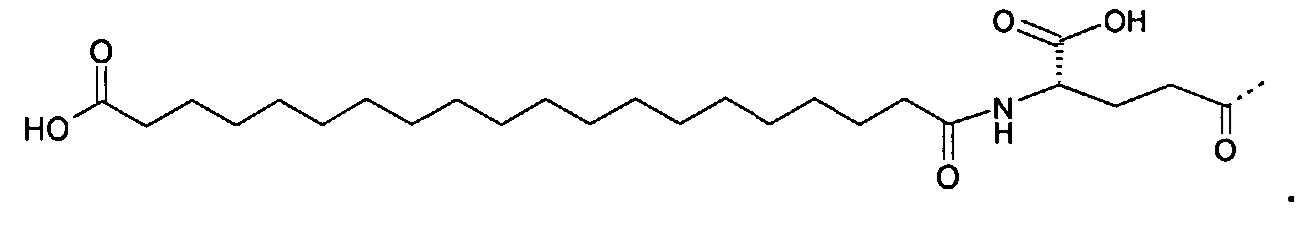
Предпочтительно заместитель
присоединен к N-концевой аминогруппе полипептида.
В воплощениях, которые содержат альбуминсвязывающую группировку, полипептиды данного изобретения могут демонстрировать длительный фармакокинетический профиль и хорошие фармакодинамические свойства. Поэтому полипептиды изобретения не нужно вводить так же часто, как известные продукты амилина.
Другие полипептиды изобретения вызывают снижение потребления пищи. Снижение потребления пищи превосходит таковое для известных продуктов амилина.
В одном воплощении альбуминсвязывающая группировка связывается нековалентно с альбумином. Предпочтительно альбуминсвязывающая группировка имеет аффинность связывания с человеческим сывороточным альбумином менее примерно 10 мкМ или менее примерно 1 мкм.
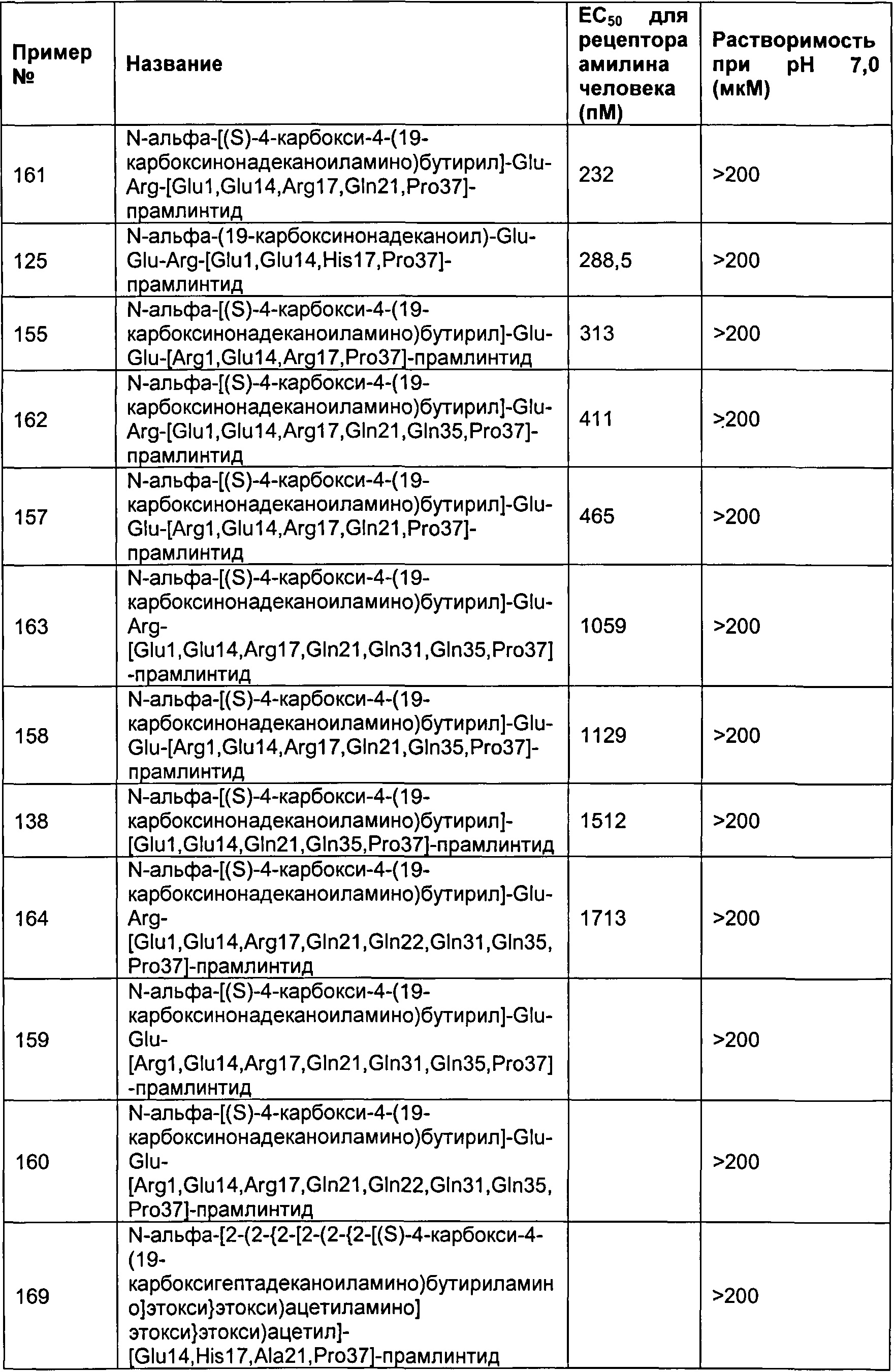
В одном воплощении полипептид данного изобретения выбран среди следующих соединений, представленных в Табл. 2 (ниже). Табл. 2 представляет список соединений, которые имеют растворимость более 100 мкМ на рН 4.
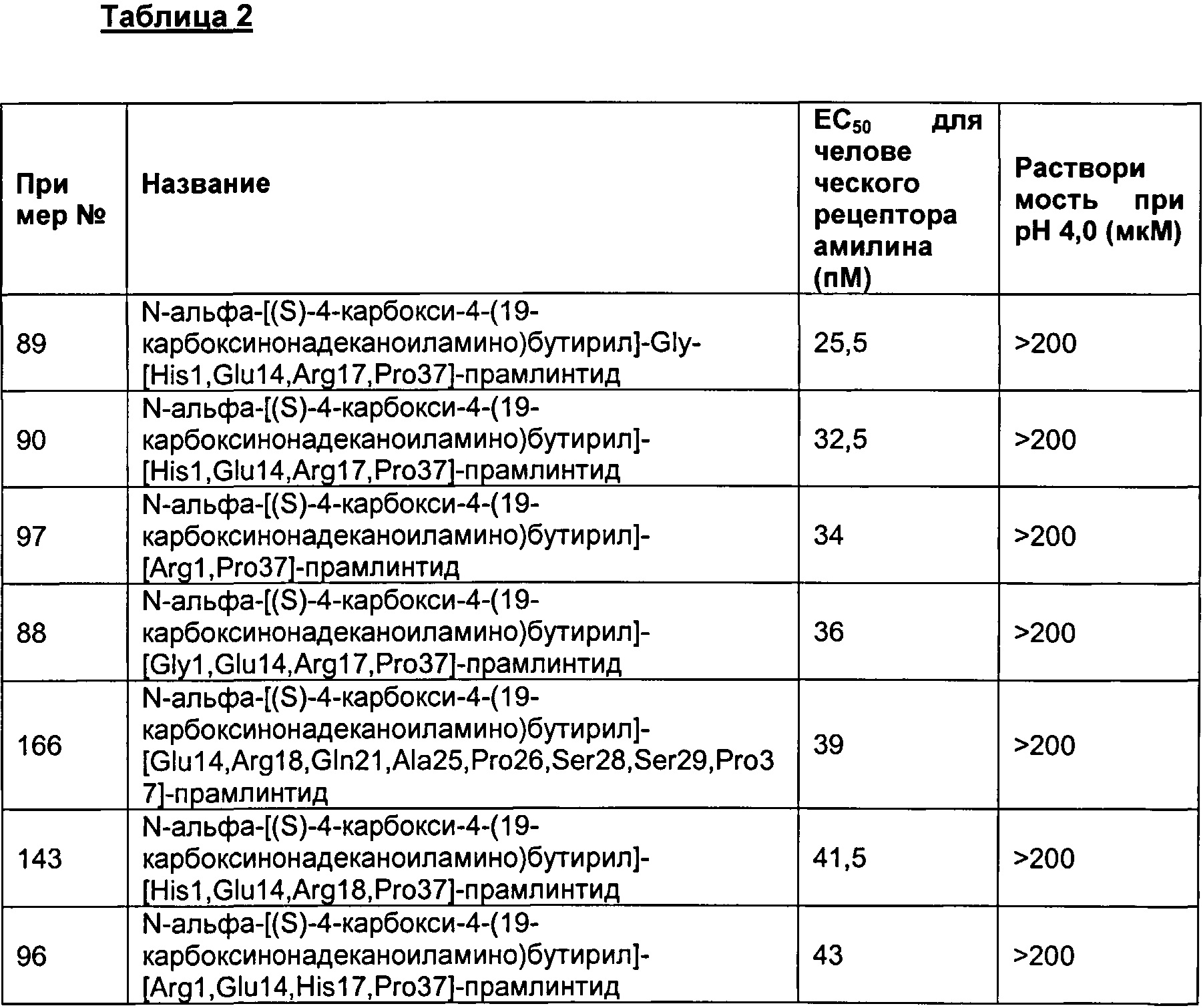
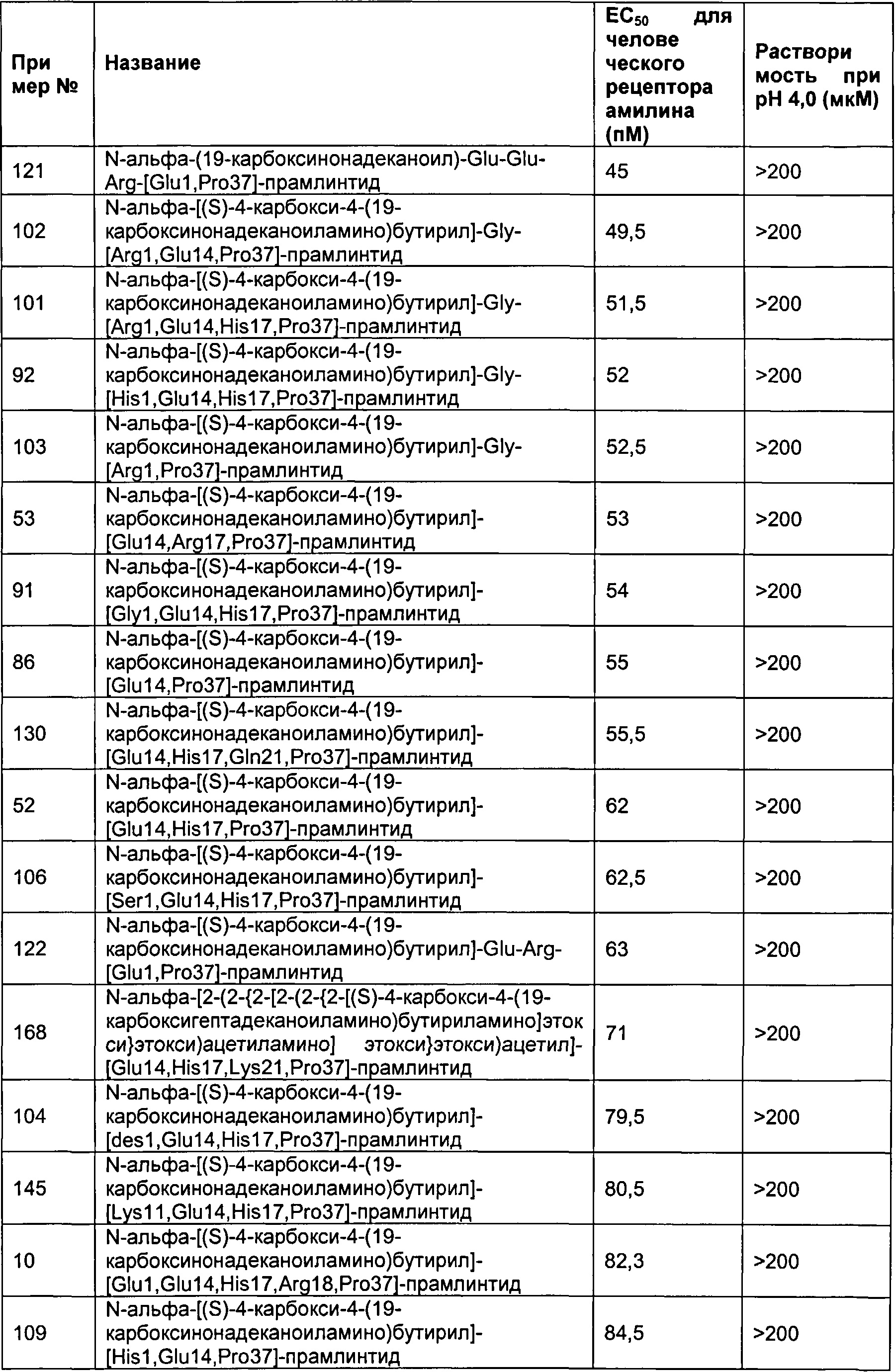
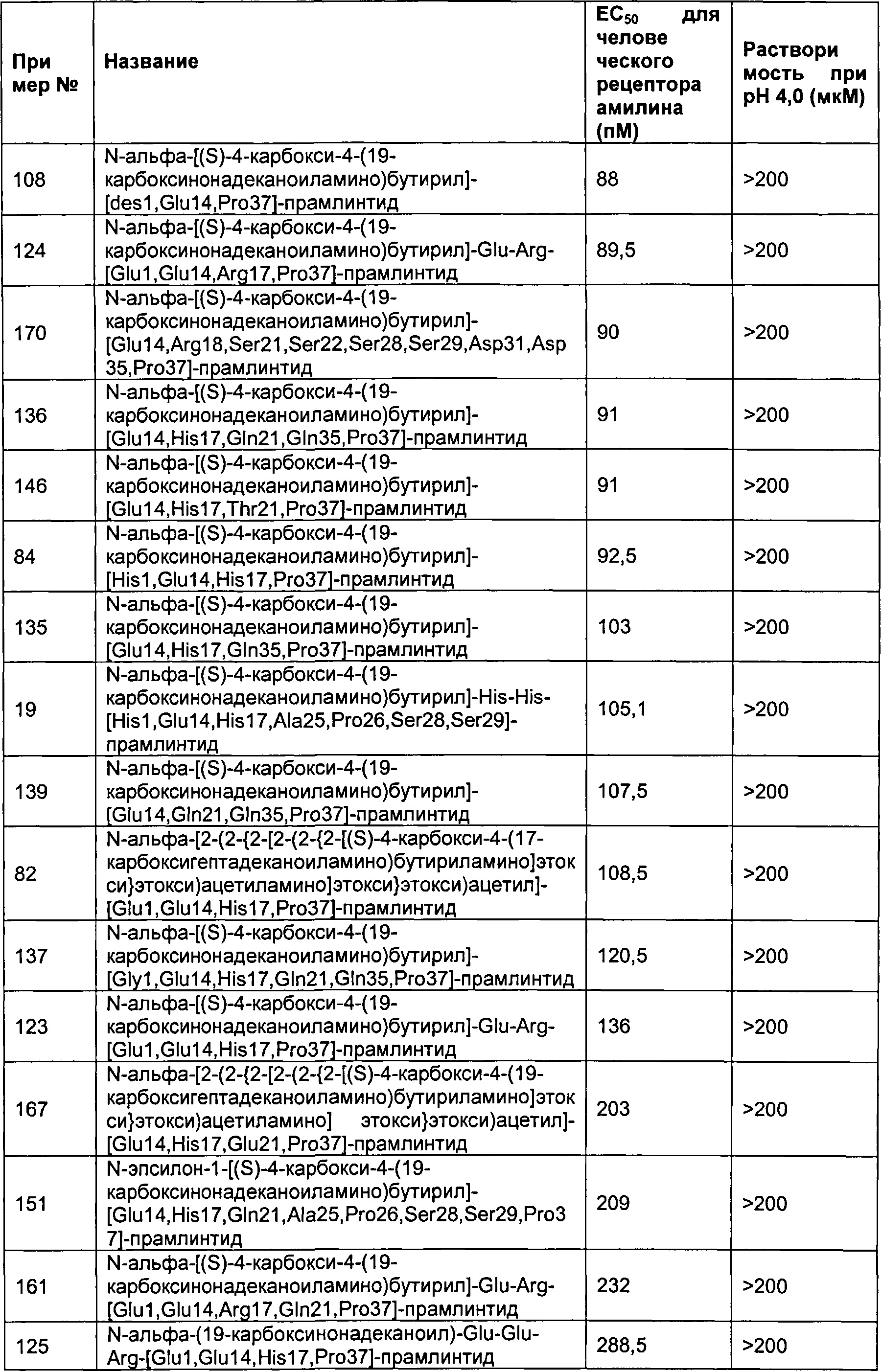
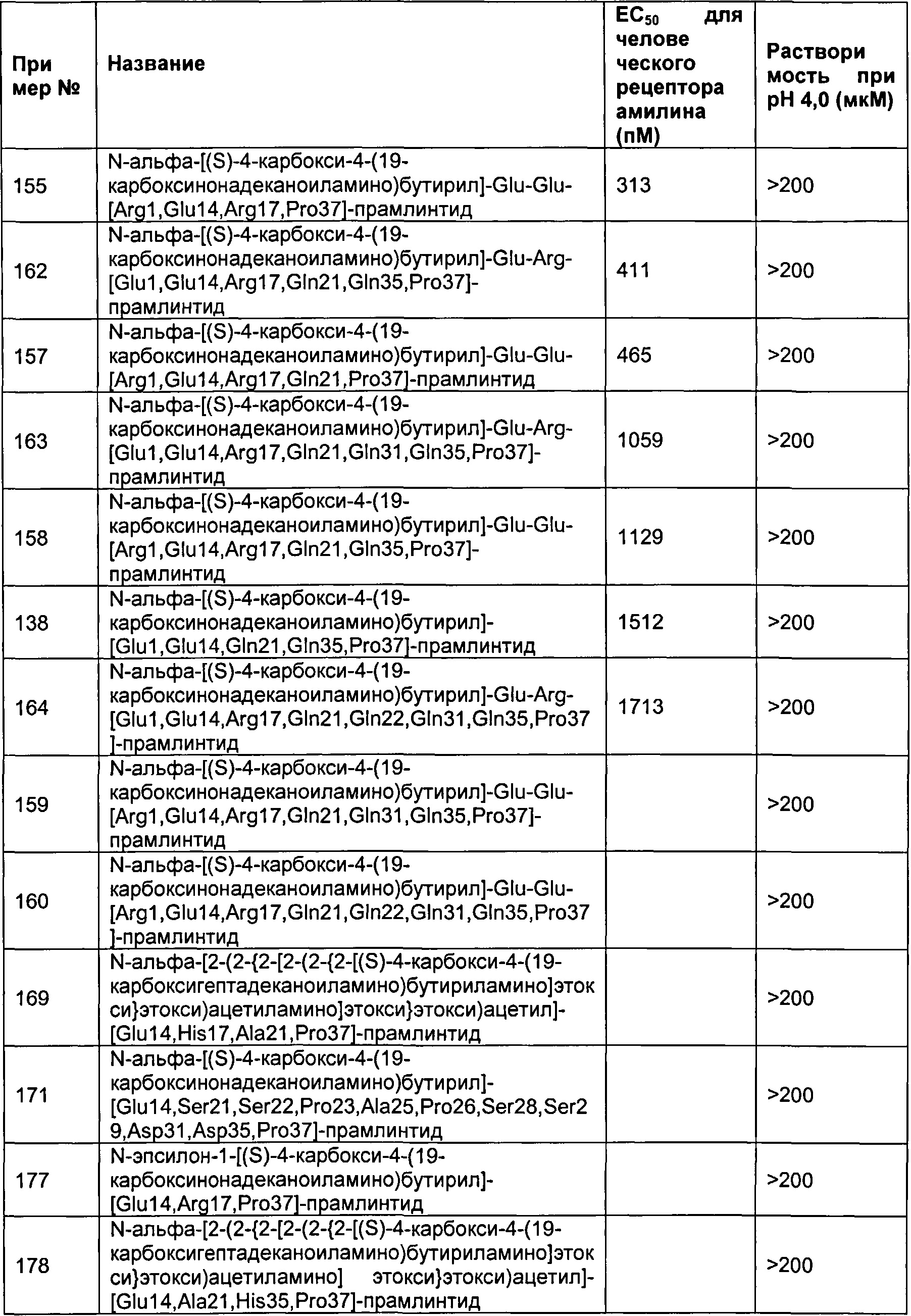
Как показано в разделе Примеры в данном документе полипептиды, представленные выше, обладают растворимостью, превышающей или равной 100 мкМ (микромоль) при рН 4.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 125 мкМ (микромоль) при рН 4.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 150 мкМ (микромоль) при рН 4.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 175 мкМ (микромоль) при рН 4.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 200 мкМ (микромоль) при рН 4.
В одном воплощении растворимость измеряется в анализе растворимости, представленном в данном документе.
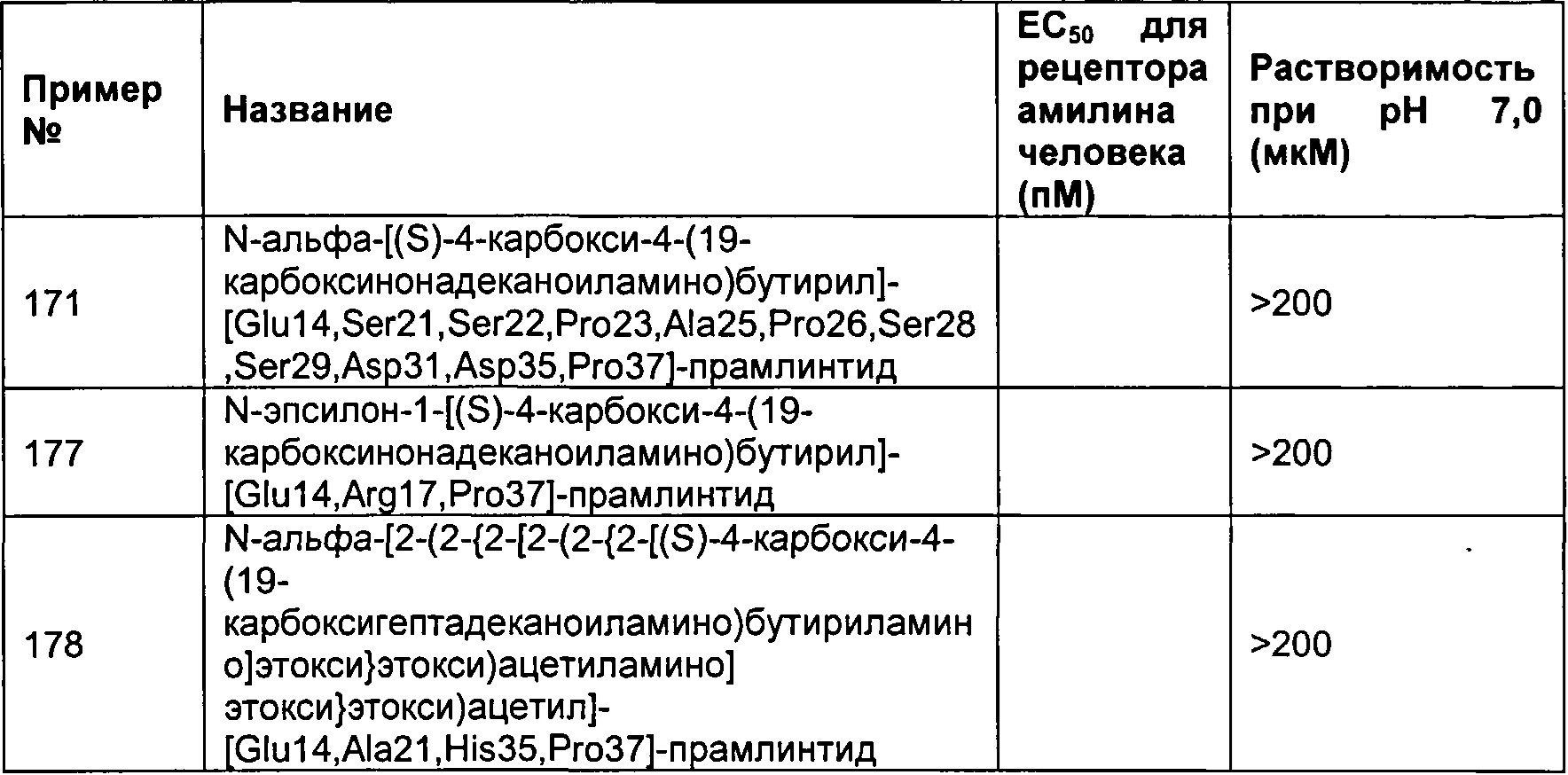
В другом воплощении полипептид данного изобретения выбран среди следующих соединений, прдставленных в Табл. 3 (ниже).
Табл. 3 представляет список соединений, которые обладают растворимостью более 100 мкМ при рН7.
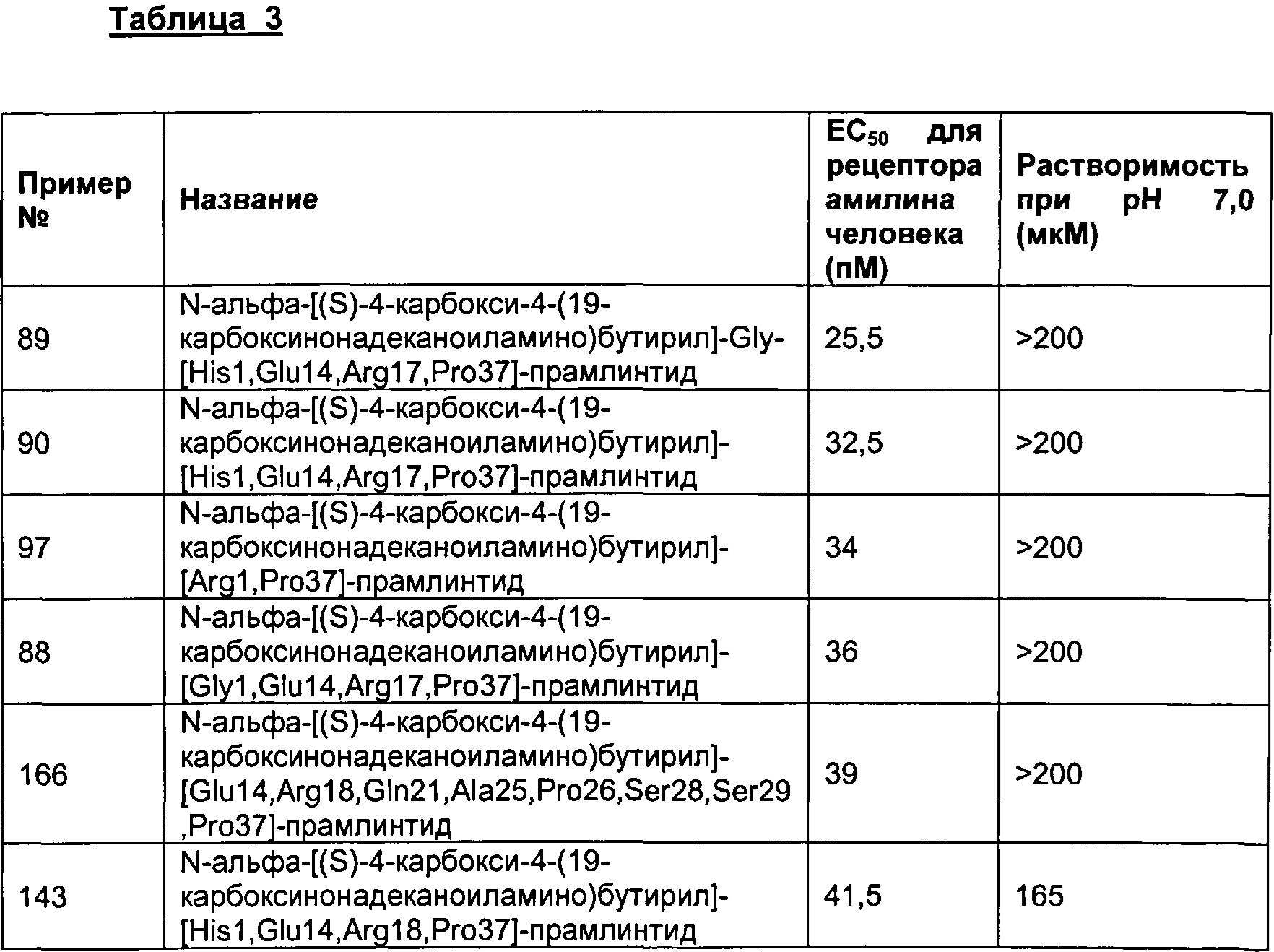
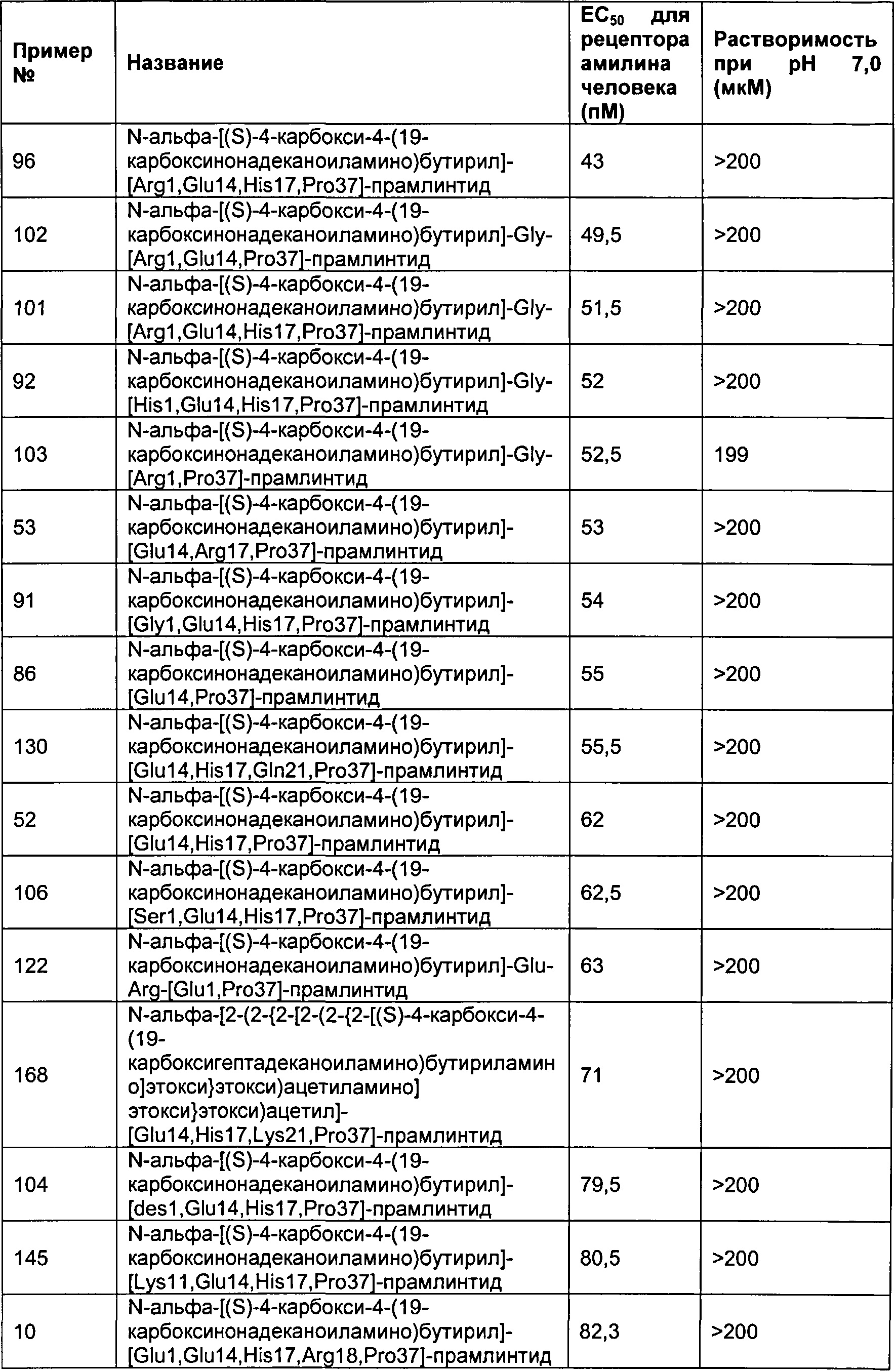
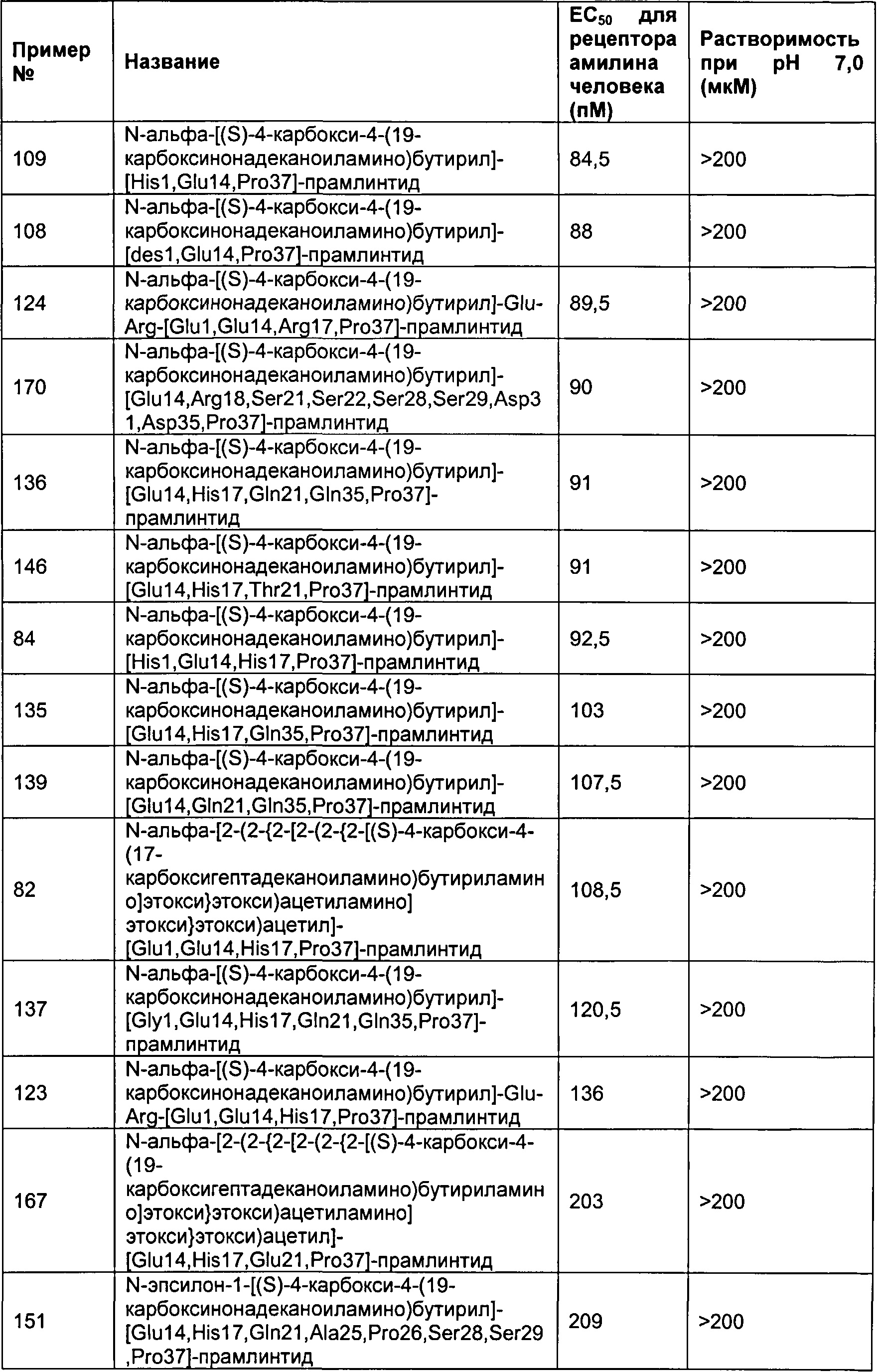
Как показано в разделе Примеры в данном документе, полипептиды, представленные выше, обладают растворимостью, превышающей или равной 100 мкМ (микромоль) при рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 125 мкМ (микромоль) при рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 150 мкМ (микромоль) при рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 175 мкМ (микромоль) при рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 200 мкМ (микромоль) при рН 7.
В одном воплощении растворимость измеряется в анализе растворимости, представленном в данном документе.
Табл. 4 представляет список соединений, которые обладают растворимостью более 100 мкМ при рН 4 и рН 7.

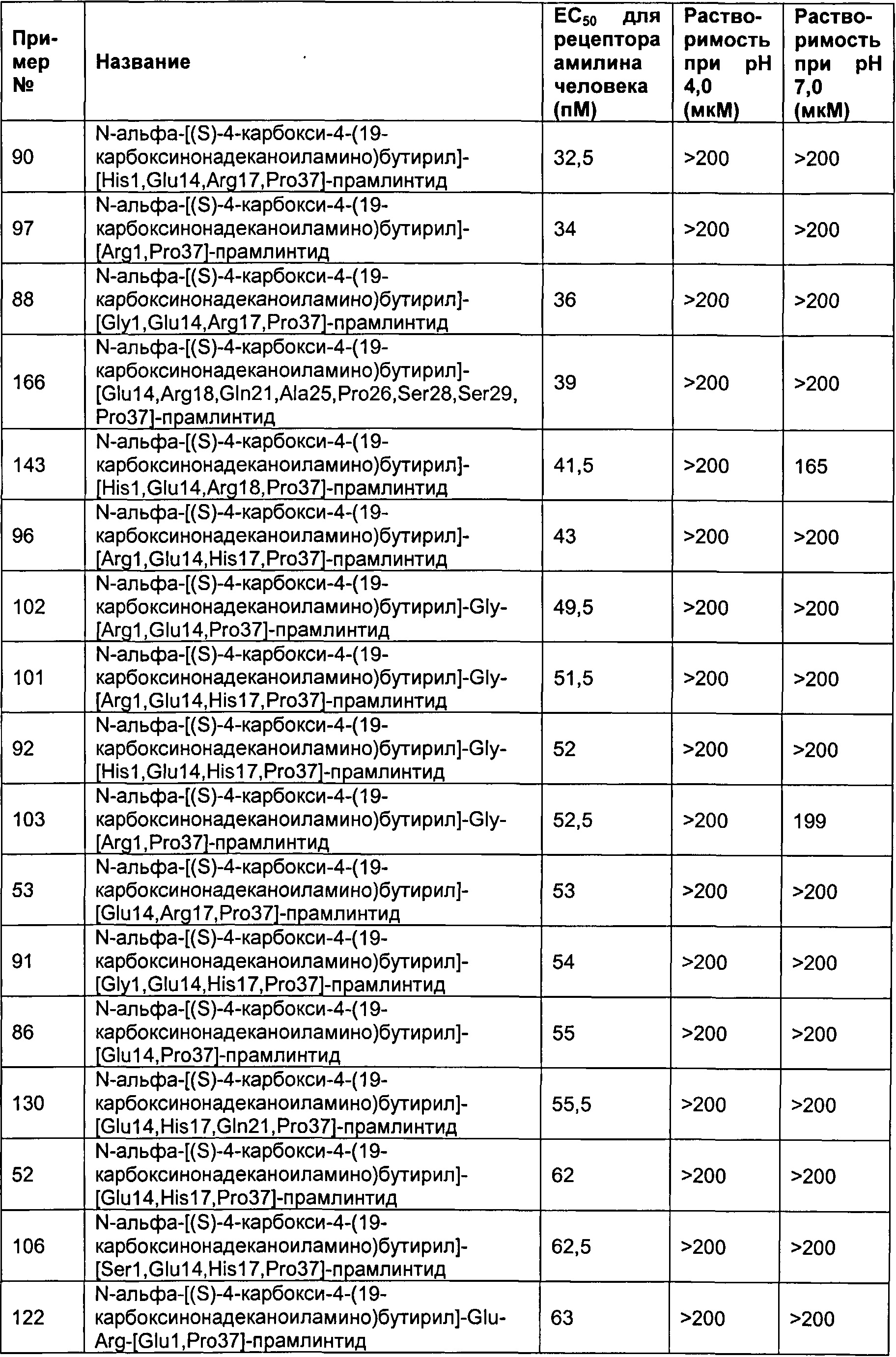
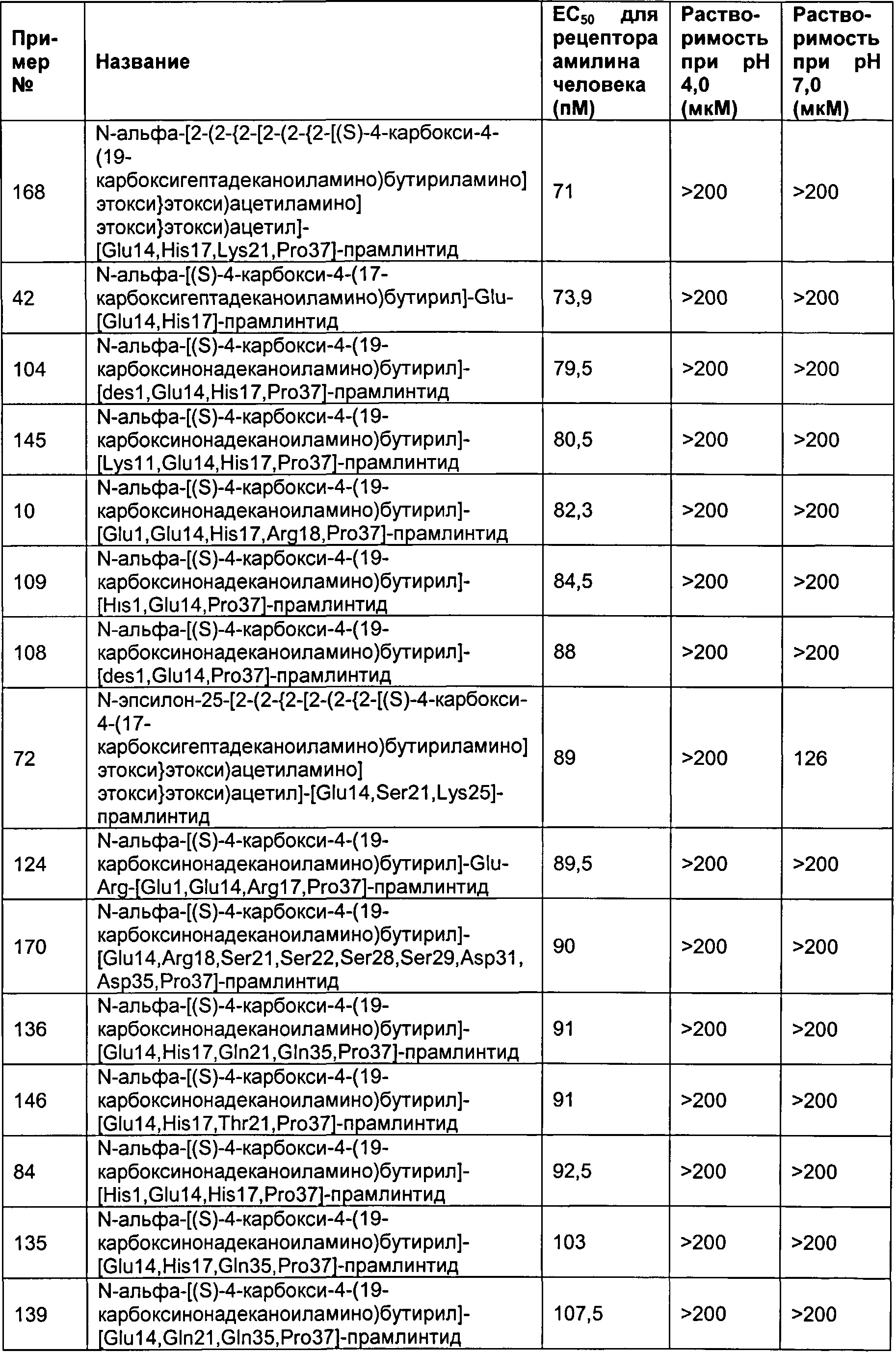
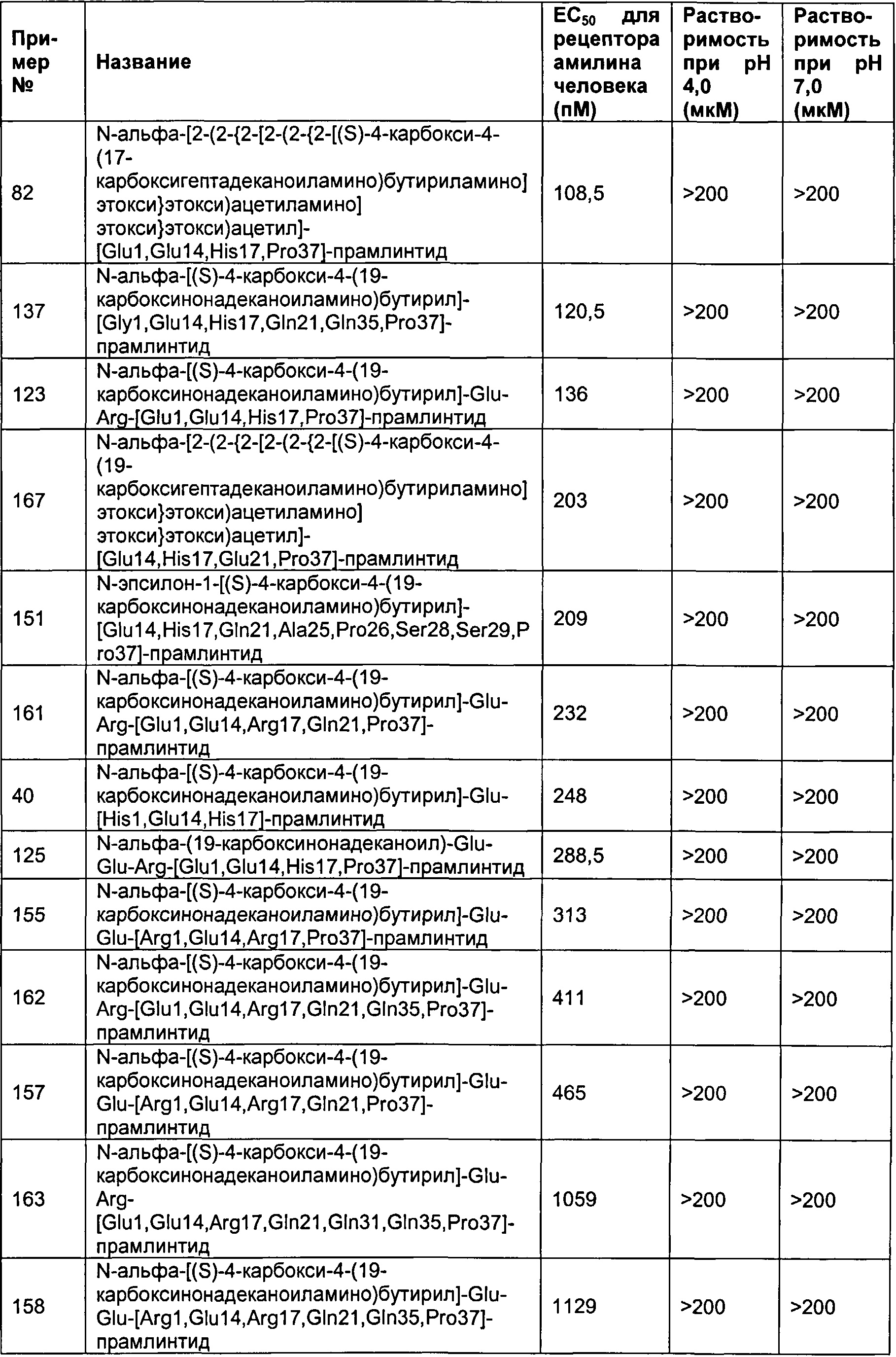
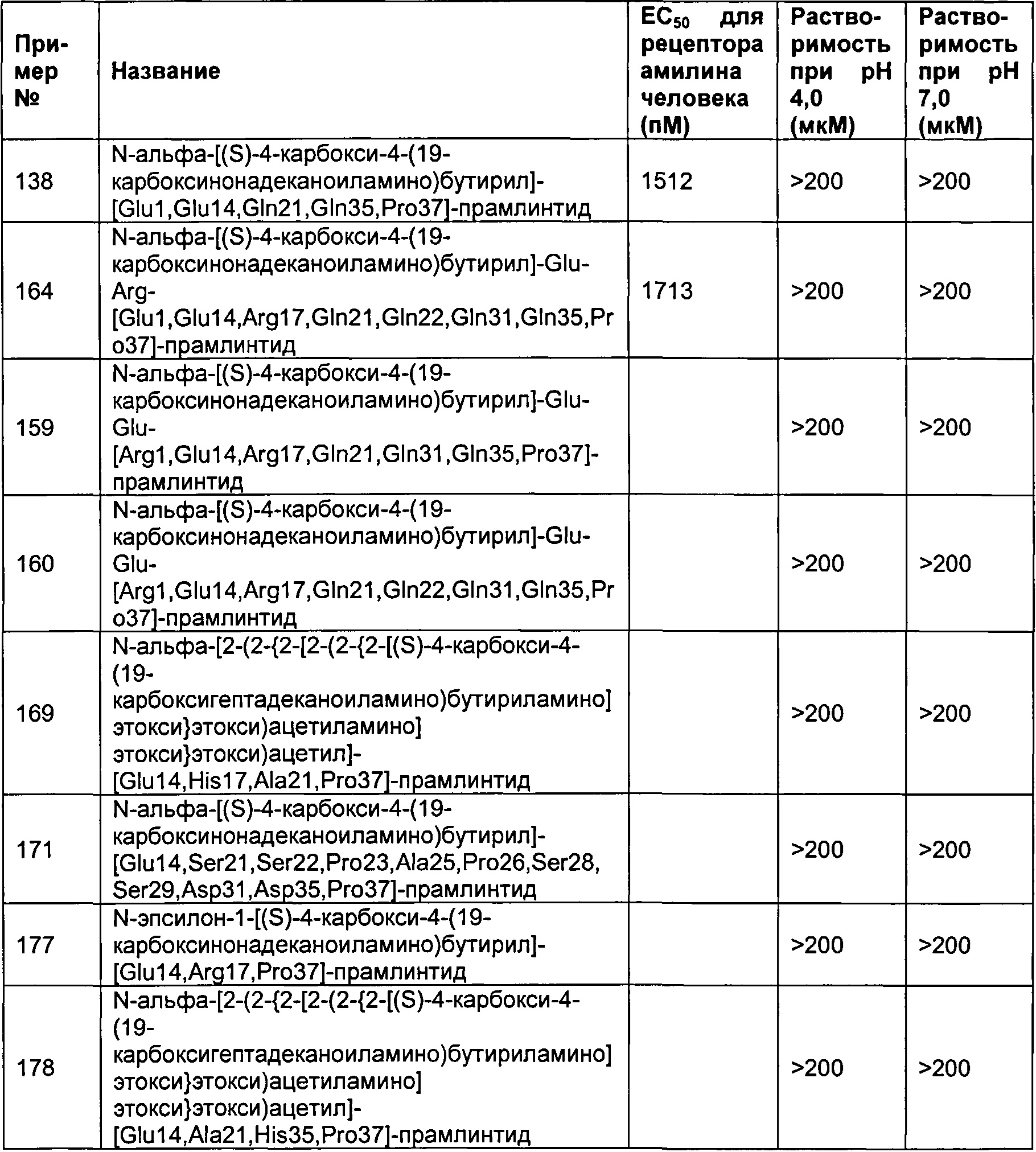
Как показано в разделе Примеры в данном документе, полипептиды, представленные выше, обладают растворимостью, превышающей или равной 100 мкМ (микромоль) при рН 4 и рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 125 мкМ (микромоль) при рН 4 и рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 150 мкМ (микромоль) при рН 4 и рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 175 мкМ (микромоль) при рН 4 и рН 7.
В одном воплощении полипептиды данного изобретения обладают растворимостью, превышающей или равной 200 мкМ (микромоль) при рН 4 и рН 7.
В одном воплощении растворимость измеряется в анализе растворимости, представленном в данном документе.
Табл. 5 представляет список соединений, обладающих физической стабильностью, превышающей или равной 25 часов в анализе образования фибрилл.
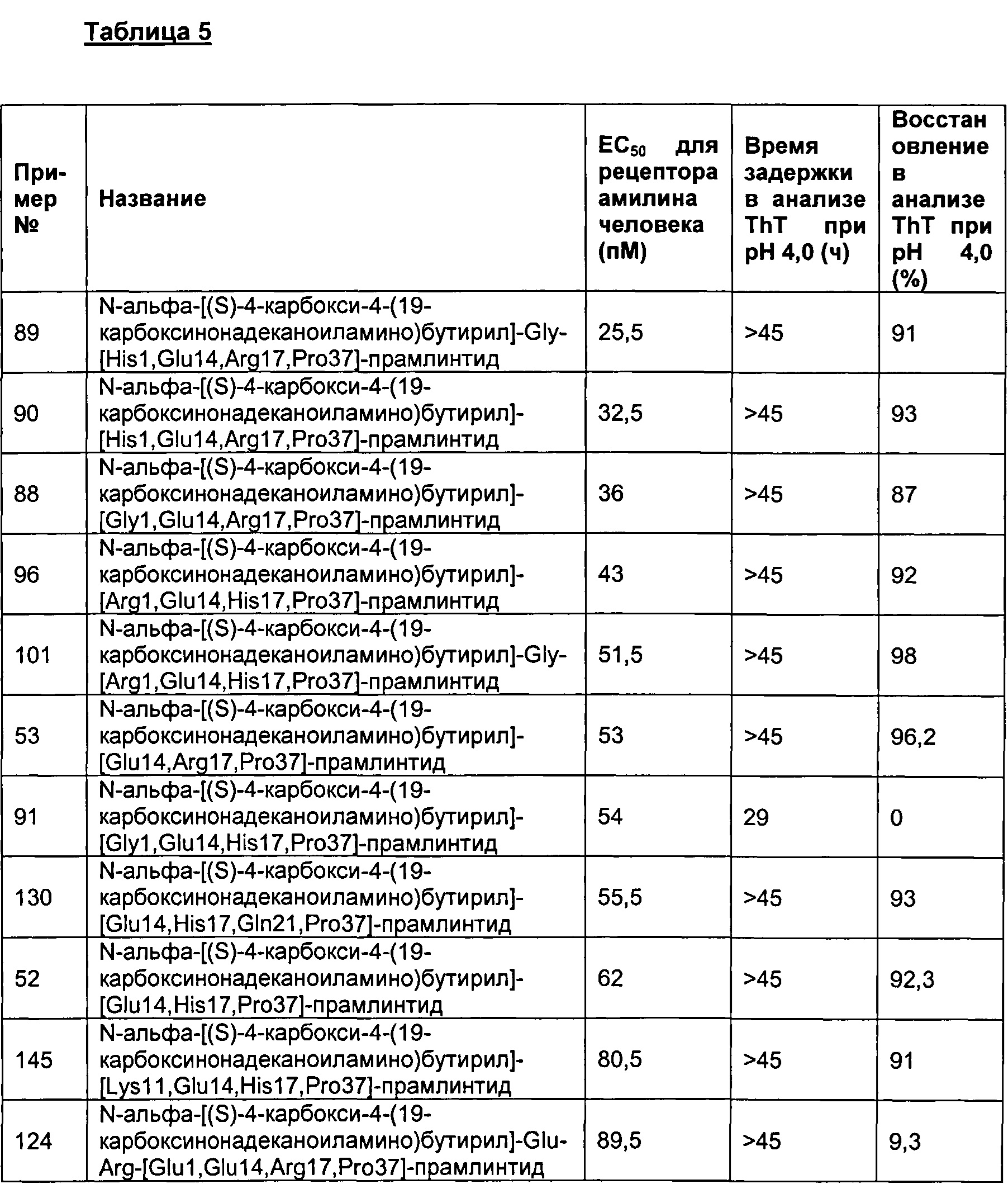
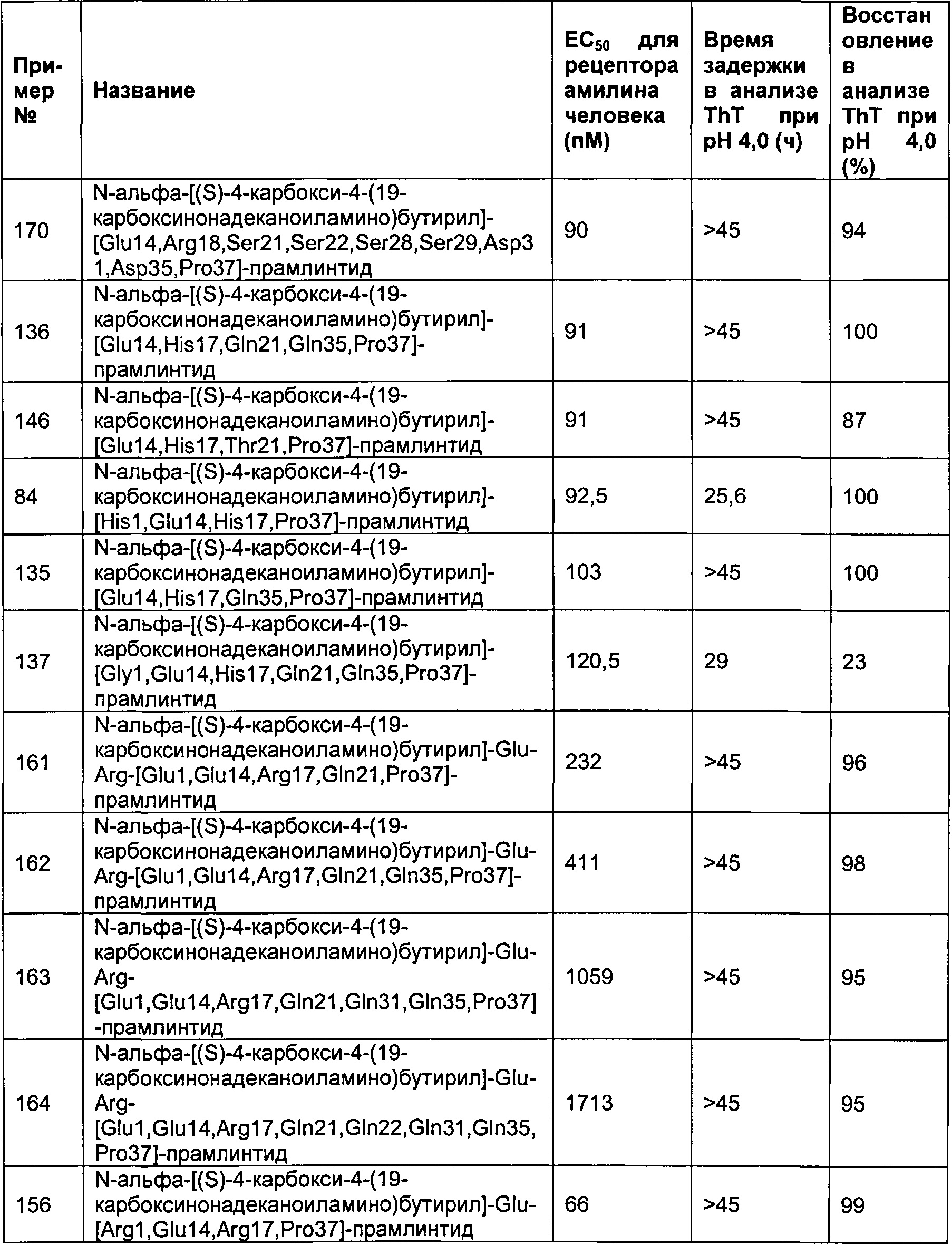
Как показано в разделе Примеры в данном документе, полипептиды, представленные выше, обладают физической стабильностью, превышающей или равной 25 часов в анализе образования фибрилл.
В одном воплощении полипептиды данного изобретения обладают физической стабильностью, превышающей или равной 30 часов.
В одном воплощении полипептиды данного изобретения обладают физической стабильностью, превышающей или равной 35 часов.
В одном воплощении полипептиды данного изобретения обладают физической стабильностью, превышающей или равной 40 часов.
В одном воплощении полипептиды данного изобретения обладают физической стабильностью, превышающей или равной 45 часов.
В одном воплощении физическая стабильность измеряется в анализе образования фибрилл, представленном в данном документе.
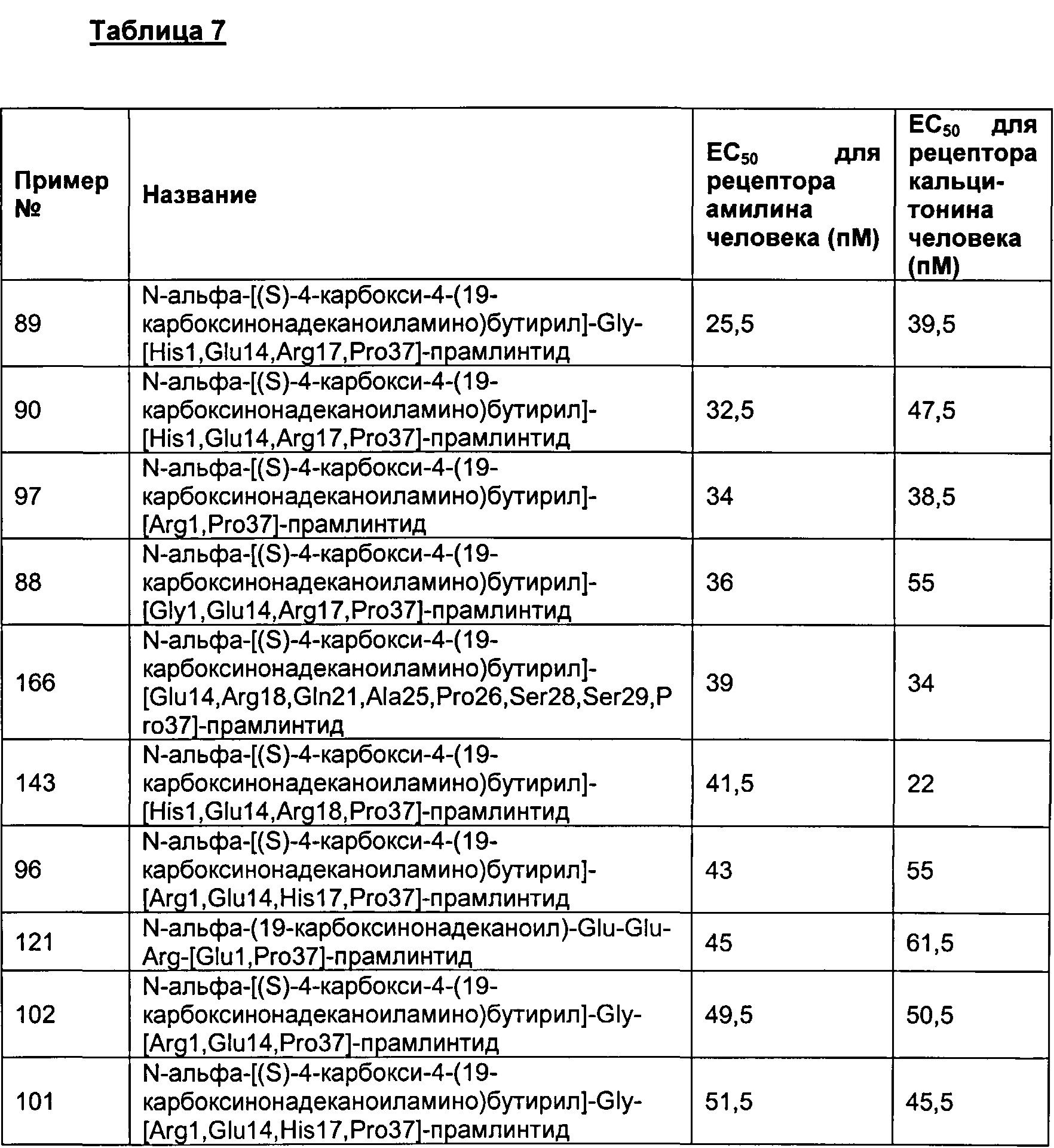
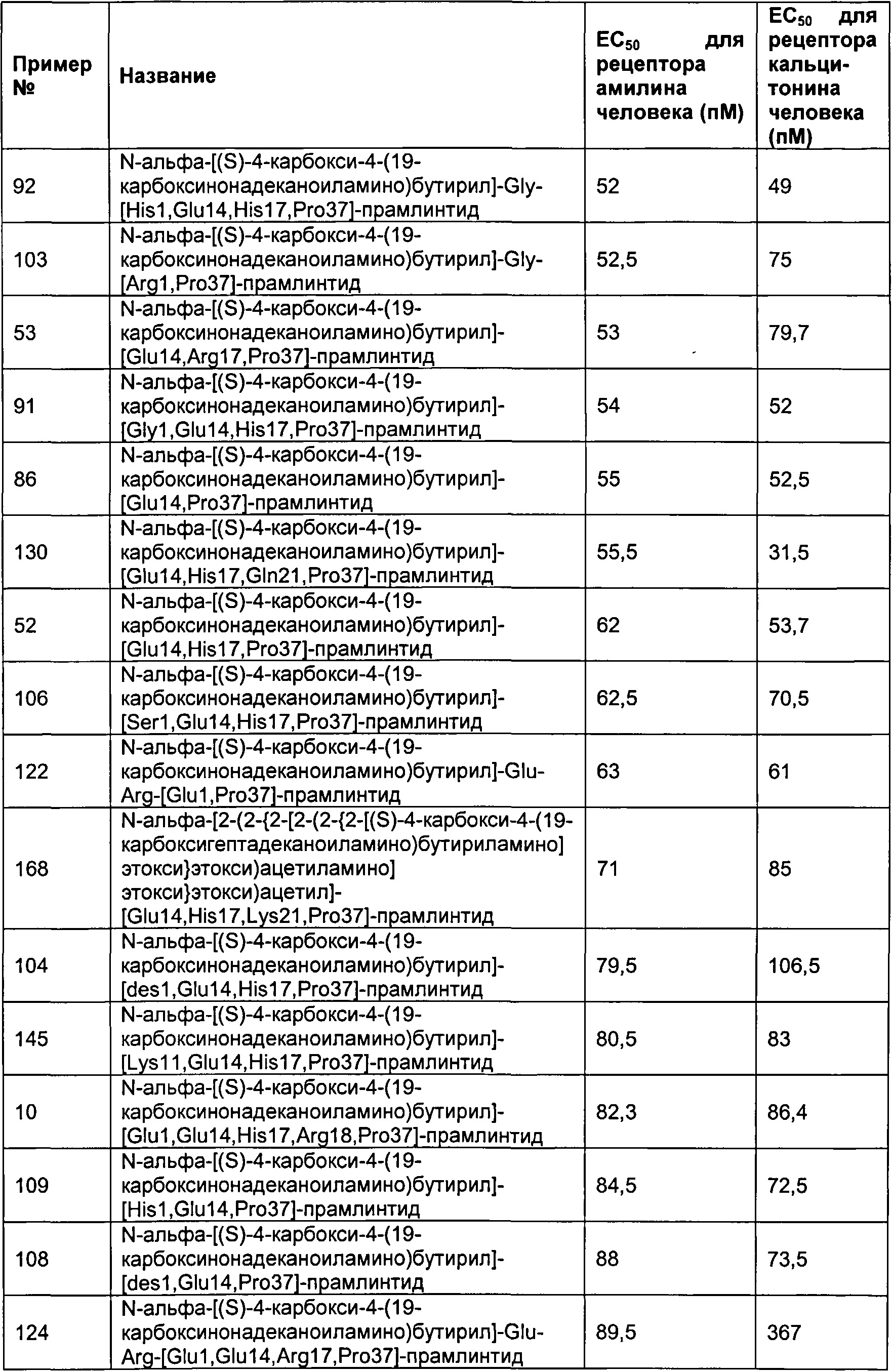
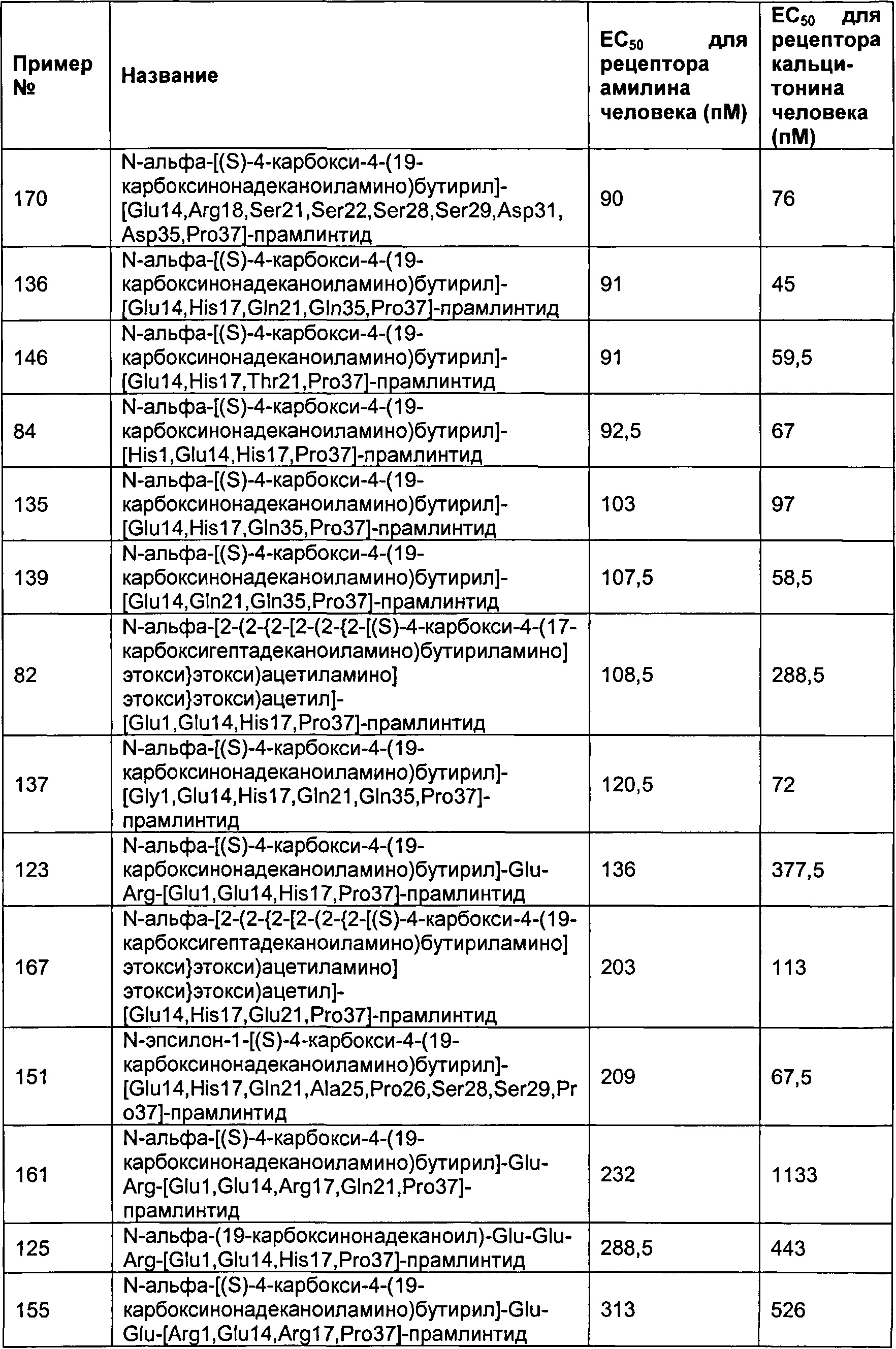
Табл. 6 представляет список соединений, которые имеют значение ЕСбо для человеческого рецептора амилина 1800 пМ (пикомоль) или менее.
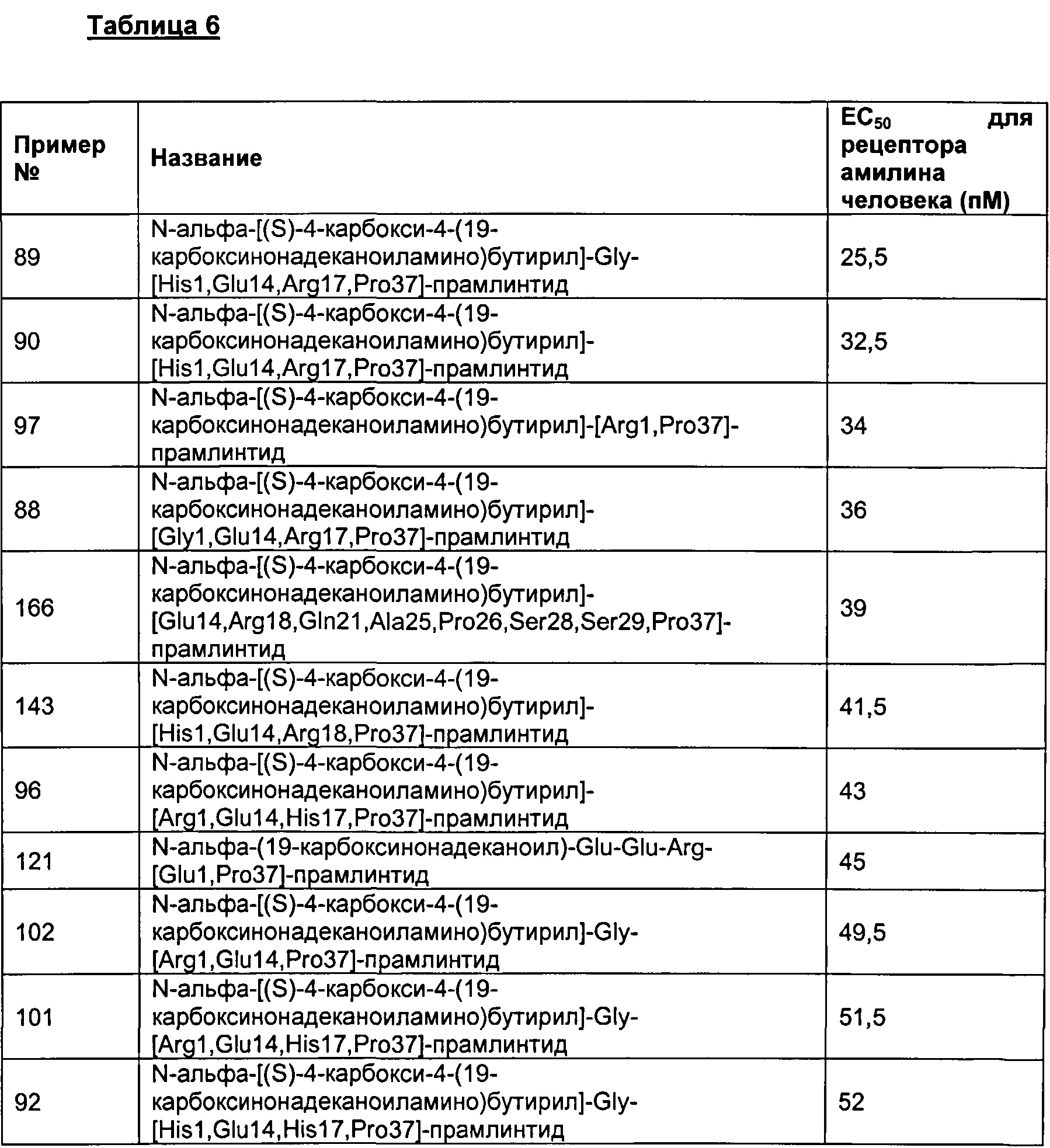
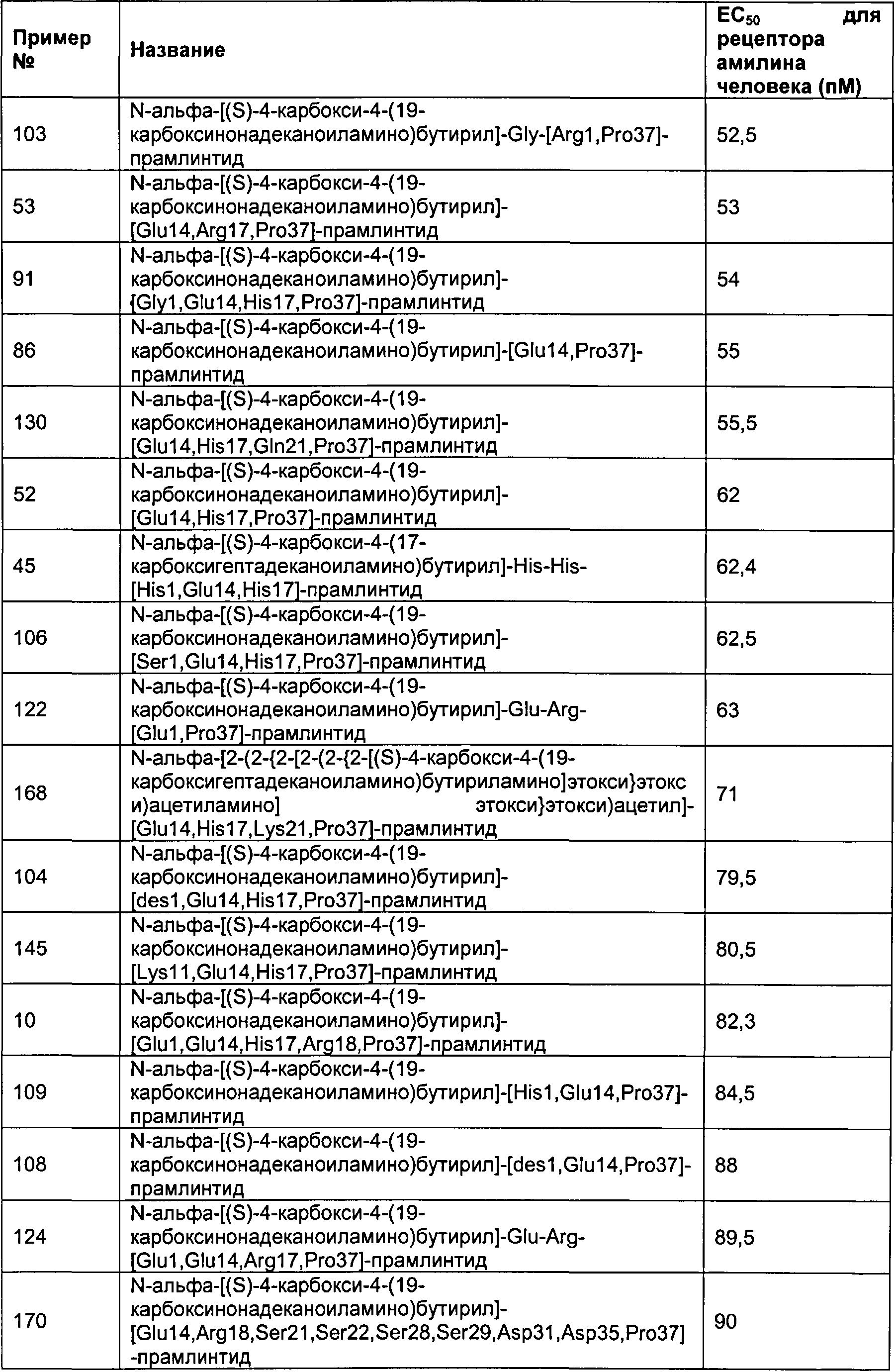
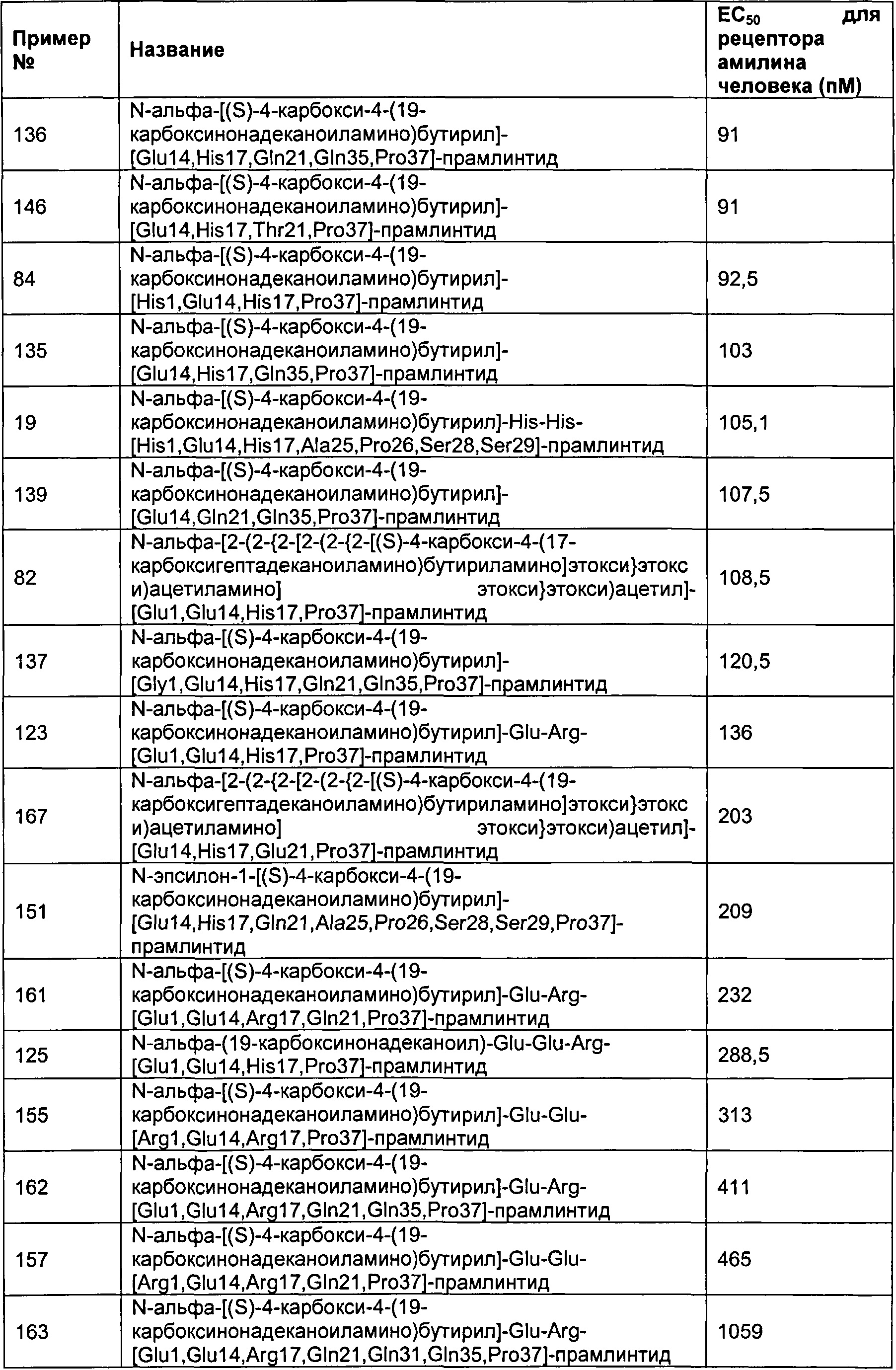
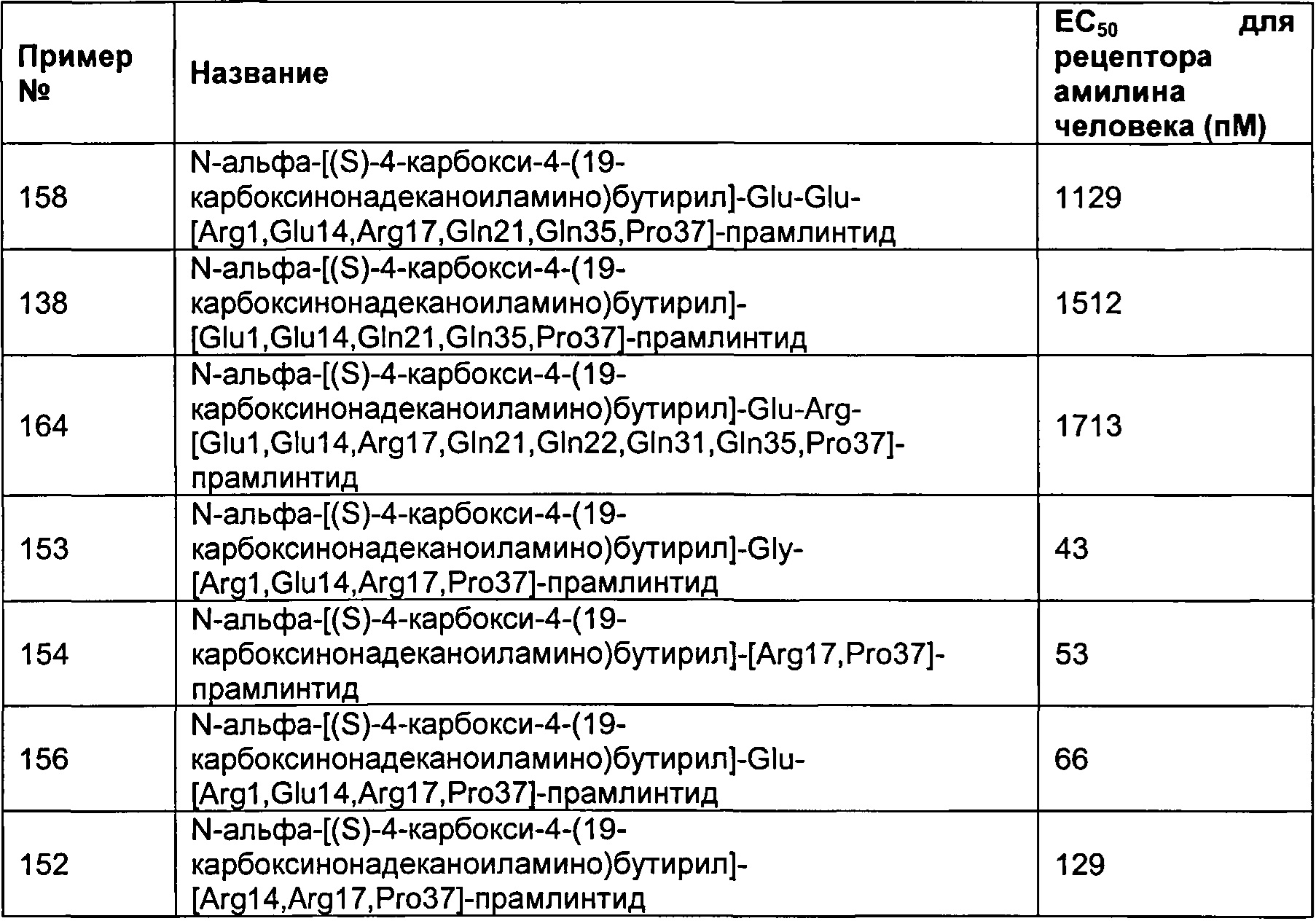
Как показано в разделе Примеры в данном документе, полипептиды, представленные выше, имеют значение EC50 для человеческого амилина 1800 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 1500 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 1200 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 1000 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 800 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 600 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 400 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для человеческого амилина 200 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 100 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для человеческого амилина 75 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для человеческого амилина 60 пМ (пикомоль) или менее.
В одном воплощении EC50 для человеческого амилина измеряется в анализе, представленном в данном документе.
Табл. 7 представляет список соединений со значением EC50 для человеческого амилина 1800 пМ (пикомоль) или менее.
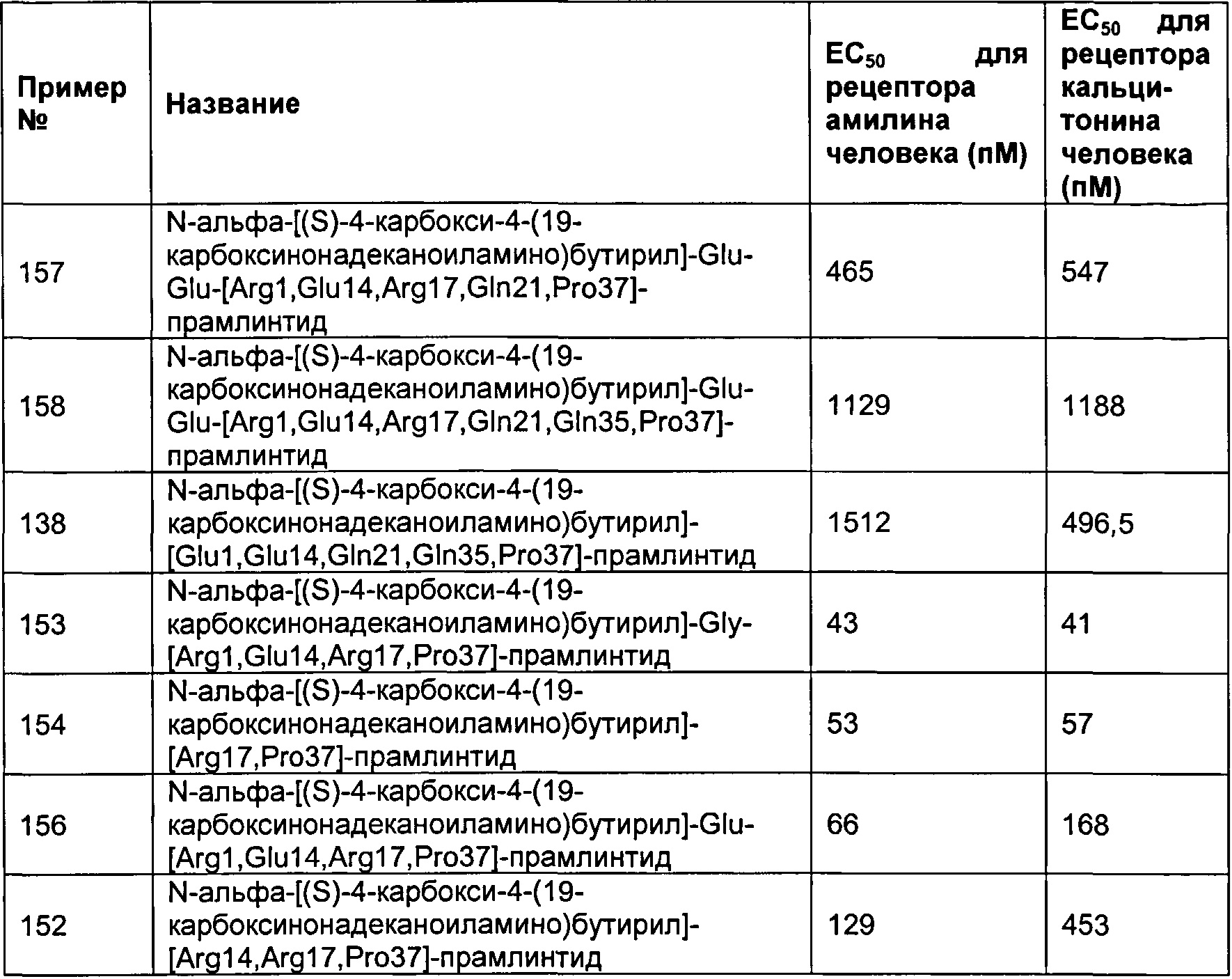
Как показано в разделе Примеры в данном документе, полипептиды, представленные выше, имеют значение EC50 для кальцитонина человека 1800 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для кальцитонина человека 1500 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 1200 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для кальцитонина человека 1000 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для кальцитонина человека 800 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 600 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 400 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 200 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 100 пМ (пикомоль) или менее.
В одном воплощении полипептиды данного изобретения имеют значение EC50 для кальцитонина человека 80 пМ (пикомоль) или менее.
В одном воплощении EC50 для кальцитонина человека измеряется в анализе, представленном в данном документе.
Табл. 8 представляет список соединений, имеющих значение ЕС50 для рецептора амилина человека 1800 пМ (пикомоль) или менее, растворимость 150 мкМ или более при рН 7 и физическую стабильность 25 часов или более в анализе фибриллогенеза.
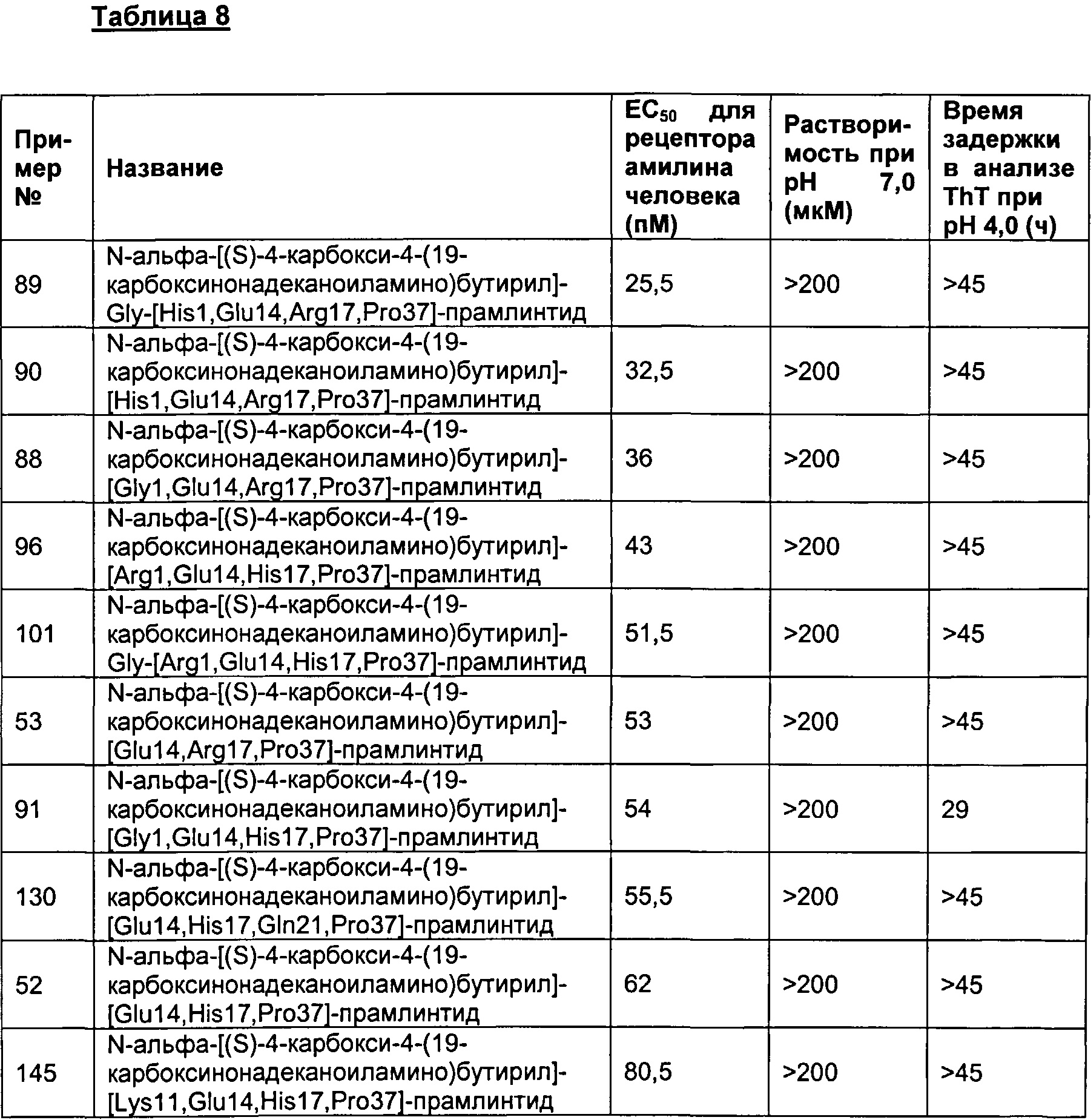
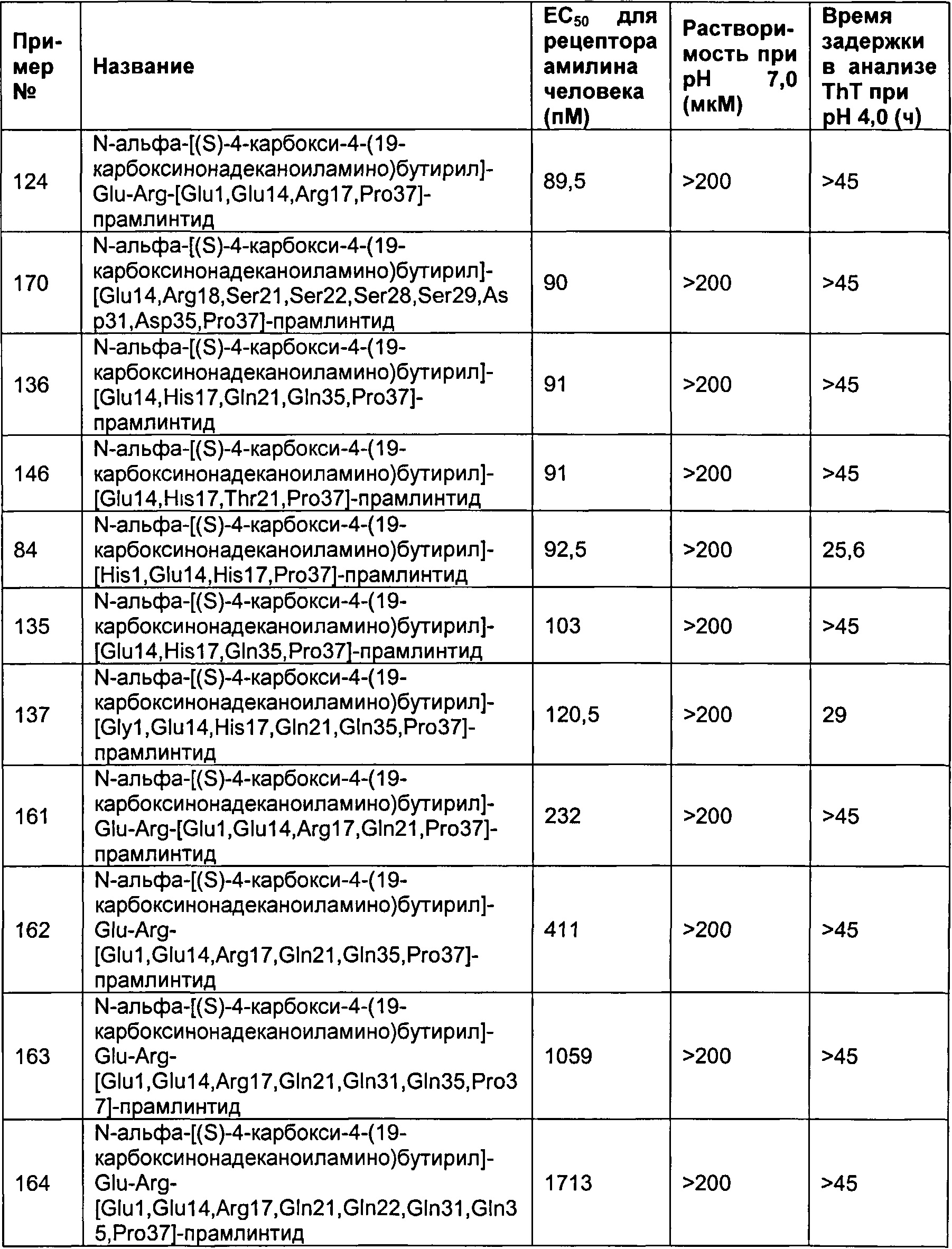
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для человеческого амилина 1800 пМ (пикомоль) или менее и растворимость более 150 мкМ при рН 7, и физическую стабильность более или равную 25 ч в анализе образования фибрилл.
В одном воплощении ЕС50 человеческого амилина, растворимость при рН 7 и физическая стабильность измеряются а анализах, представленных в данном документе.
Табл. 9 представляет список соединений, имеющих значение EC50 для рецептора амилина человека 1800 пМ (пикомоль) или менее, растворимость 200 мкМ или более при рН 7, и физическую стабильность 45 ч или более в анализе образования фибрилл.
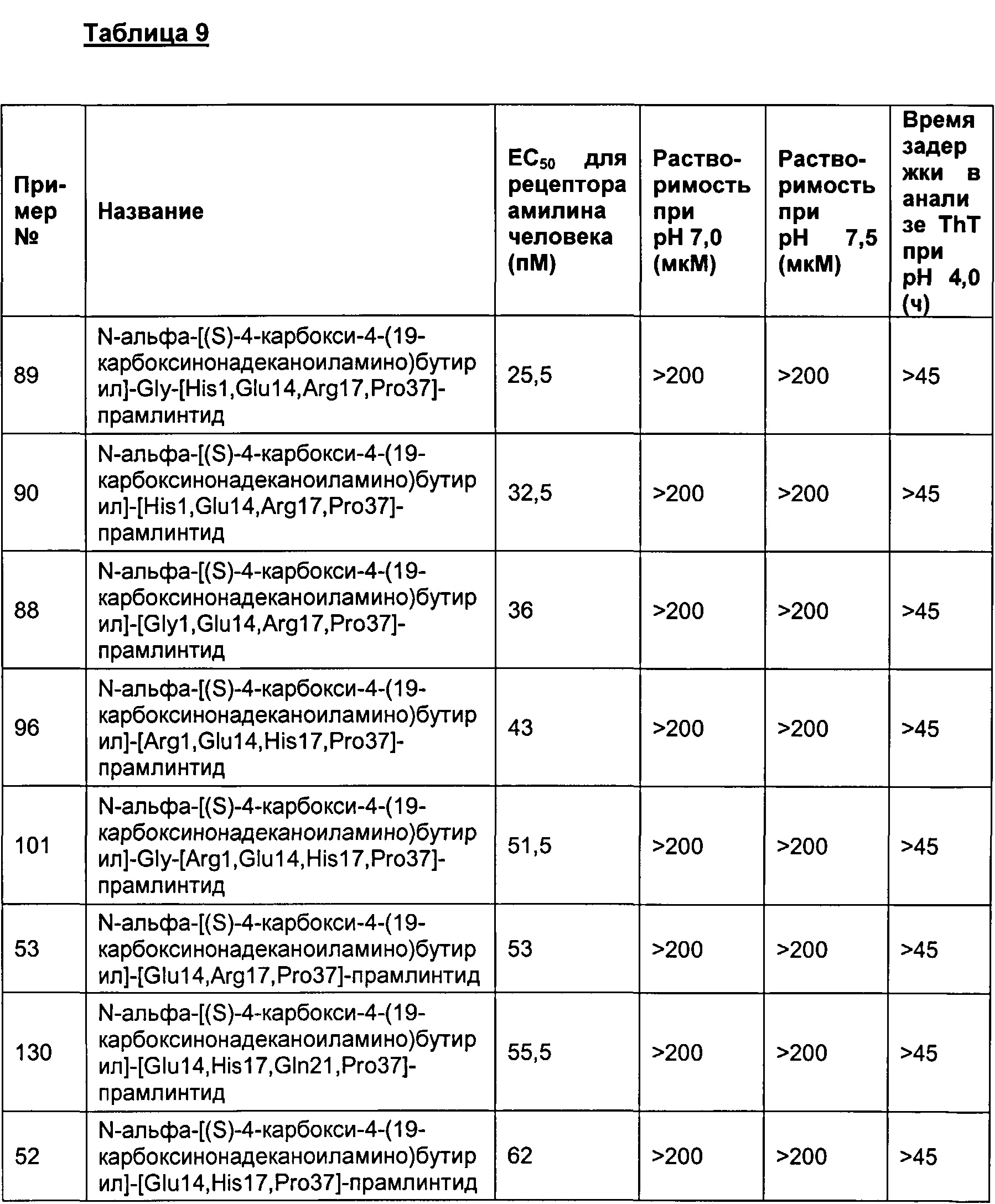
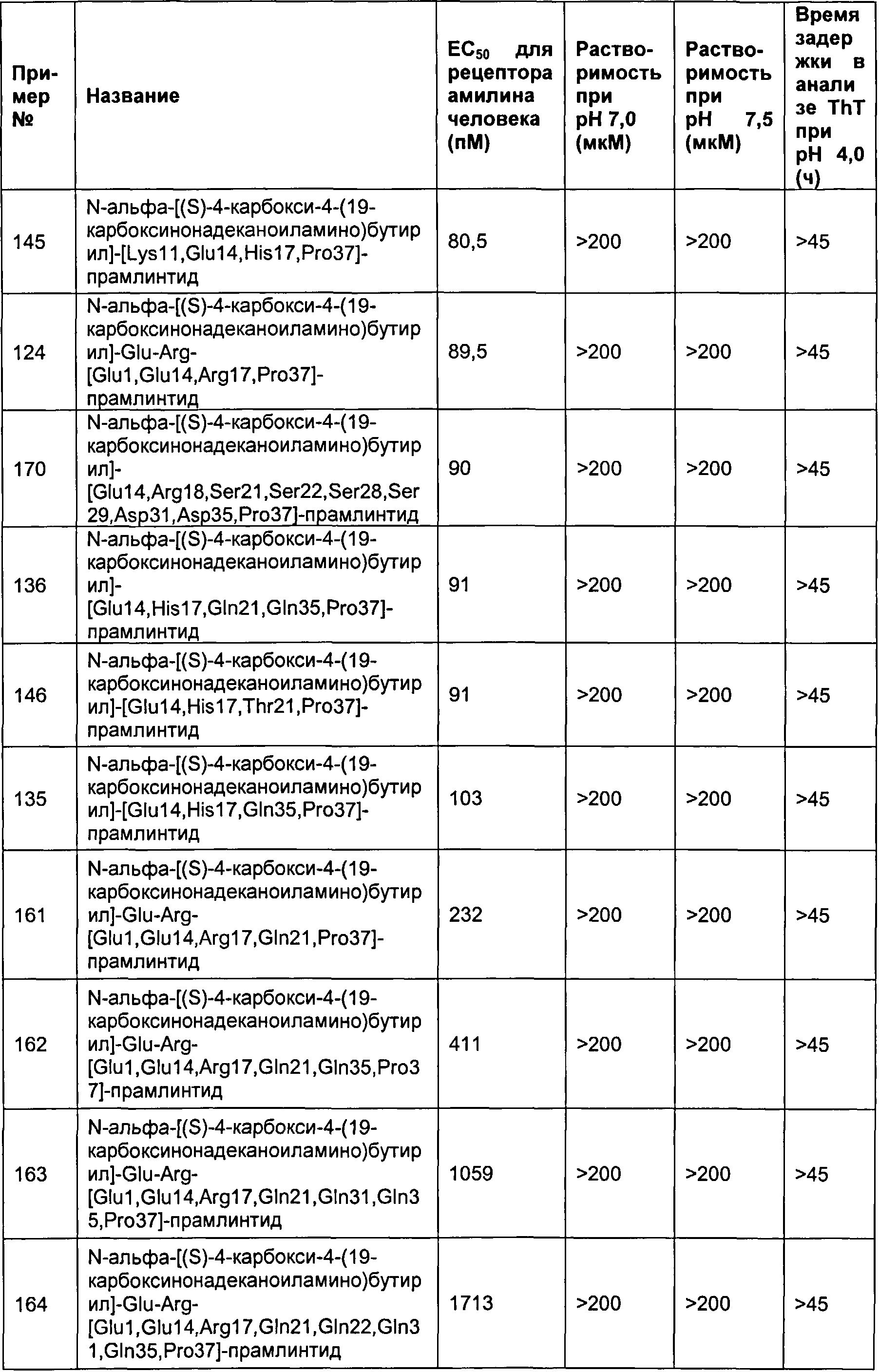
В одном воплощении полипептиды данного изобретения имеют значение ЕС50 для человеческого амилина 1800 пМ (пикомоль) или менее, растворимость более 200 мкМ при рН 7, и физическую стабильность равную 45 часам или более в анализе образования фибрилл.
В одном воплощении ЕС50 для амилина человека, растворимость при рН 7 и физическая стабильность измеряются в анализах, представленных в данном документе.
В одном аспекте изобретения производные амилина выбраны из группы, включающей: N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu8,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Gln21,Gln22,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu25,Ser28,Arg29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu22,Ala25,Arg26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ser21,Ser22,Asp31,Asp35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,Arg17]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Arg1,Glu14,His17,Arg18,Lys21]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Gly3,Glu14,His17,Arg18,Ser21,Ser22,Glu31,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Arg3,Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Arg18,Ala19,Thr20,Gln21,Glu22,Leu23]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Gly3,Glu14,Arg18,Ser21,Ser22,Ala25,Pro26,Ser28,Ser29,Glu31,Arg35]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18,Ala21,Ser35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-[Gly1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-Gly-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]бутирил}-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu10,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ser21,Lys25]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Glu14,His17,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Glu14,His17,Lys21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Glu14,His17,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Lys35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His36]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His34]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His32]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,His35)-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Orn1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Pro37]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Glu14,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Glu14,Lys21,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Asp21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,Gln21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино] этокси}этокси)ацетил]-[Glu14,His17,Ser21,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,His21,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys21,Ser28,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Lys11,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Thr21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Arg29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Arg-[Glu14,Arg17,His35,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Arg18,Lys21,Ser28,Arg29,Arg35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Glu21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ala21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Ser21,Ser22,Ser28,Ser29,Asp31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Ser21,Ser22,Pro23,Ala25,Pro26,Ser28,Ser29,А5р31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp31,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp22,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Asp3,Glu14,Arg17,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ala21,His35,Pro37]-прамлинтид.
В некоторых воплощениях полипептид данного изобретения обладает фармако-кинетическим профилем, удлиненным по сравнению с прамлинтидом при измерении в анализе (IX), описанном в разделе Анализы.
В некоторых воплощениях полипептид данного изобретения имеет Т½ в плазме по меньшей мере 30 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 40 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 50 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 60 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 70 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 75 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 80 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 85 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 90 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 95 часов.
В некоторых воплощениях полипептид данного изобретения имеет T½ в плазме по меньшей мере 100 часов.
ПРОЦЕСС
Производство полипептидов, таких как амилин или его аналоги, хорошо известно в данной области. Полипептиды изобретения могут, таким образом, быть получены путем классического полипептидного синтеза, например твердофазного полипептидного синтеза с использованием t-Boc- или Fmoc-химических групп или других хорошо отлаженных методик, см., например, Greene and Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999. Полипептиды могут быть также получены с помощью способа, который включает культивирование клетки-хозяина, содержащей ДНК-последовательность, кодирующую полипептид, и способной экспрессировать полипептид в подходящей питательной среде в условиях, допускающих экспрессию полипептида. Для полипептидов, содержащих неприродные аминокислотные остатки, рекомбинантная клетка должна быть изменена таким образом, чтобы неприродные аминокислоты встраивались в полипептид, например с использованием тРНК-мутантов.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
В одном аспекте изобретение касается фармацевтической композиции, содержащей полипептид в соответствии с изобретением и фармацевтически приемлемый эксципиент. Композиции подходят для парентерального введения.
В одном воплощении полипептид находится в составе в концентрации от примерно 0,1 мг/мл до примерно 25 мг/мл. В другом аспекте полипептид находится в составе в концентрации от примерно 1 мг/мл до примерно 10 мг/мл.
В другом воплощении состав имеет рН от 2,0 до 10,0. В другом воплощении состав имеет рН от 2,0 до 7,0. В другом воплощении состав имеет рН от 2,5 до 4,5. В другом воплощении состав имеет рН от 3,5 до 4,5.
Фармацевтические композиции, содержащие полипептид в соответствии с данным изобретением, могут быть изготовлены путем стандартных методик, например, описанных в Remington's Pharmaceutical Sciences, 1985 или в Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Состав также может содержать буферную систему, консервант(ы), изотонический агент(ы), хелатирующий агент(ы), стабилизаторы и/или поверхностно-активные вещества. Применение таких эксципиентов в фармацевтической композиции хорошо известно специалистам в данной области. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В одном воплощении фармацевтический состав является водным составом, т.е. составом, содержащим воду. Такой состав, как правило, является раствором или суспензией. В другом воплощении данного изобретения фармацевтический состав представляет собой водный раствор.
Термин «водный состав» определяется как состав, содержащий по меньшей мере 50% (по весу) воды.
Подобным же образом термин «водный раствор» определяется как раствор, содержащий по меньшей мере 50% (по весу) воды, а термин «водная суспензия» определяется как суспензия, содержащая по меньшей мере 50% (по весу) воды.
В другом воплощении фармацевтический состав является лиофилизированным составом, к которому врач или пациент добавляет растворители и/или разбавители перед применением. В другом воплощении фармацевтический состав является высушенным составом (например, лиофилизированным или высушенным распылением), готовым для применения без предварительного растворения.
Под «высушенной формой» понимается жидкая фармацевтическая композиция или состав, высушенный либо путем замораживания (т.е. лиофилизации, см., например Williams and Polli (1984) J. Parenteral Sci. Technol. 38:48-59), либо путем расылительной сушки (см. Masters (1991) в Spray-Drying Handbook (5th ed; Longman Scientific and Technical, Essez, U.K.), pp.491-676; Broadhead et al. (1992) Drug Devel. Ind. Pharm. 18:1169-1206; и Mumenthaler et al. (1994) Pharm. Res. 11:12-20), либо высушивания на воздухе (Carpenter and Crowe (1988) Cryobiology 25:459-470; и Roser (1991) Biopharm. 4:47-53).
В другом воплощении изобретения буфер выбран из группы, состоящей из ацетата, карбоната, цитрата, глицилглицина, гистидина, глицина, лизина, аргинина, дигидрофосфата, гидрофосфата, фосфата и трис(гидроксиметил)аминометана, бицина, трицина, яблочной кислоты, молочной кислоты, сукцината, малеиновой кислоты, фумаровой кислоты, винной кислоты, аспарагиновой кислоты или их смесей. Каждый из этих конкретных буферов представляет собой альтернативное воплощение изобретения.
В другом воплощении изобретения состав также содержит фармацевтически приемлемый консервант. В другом воплощении изобретения состав также содержит изотонический агент, например пропиленгликоль, маннит или глицерин. В другом воплощении изобретения состав также содержит хелатирующий агент.
В другом воплощении изобретения состав также содержит стабилизатор. Применение стабилизатора в фармацевтической композиции хорошо известно специалистам в данной области. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
Формирование агрегатов полипептида во время хранения жидкой фармацевтической композиции может отрицательно влиять на биологическую активность данного полипептида, что приводит к потере терапевтической эффективности фармацевтической композиции. Кроме того, образование агрегатов может привести к другим проблемам, таким как закупорка трубок, мембран или насосов, когда фармацевтическую композицию, содержащую полипептид, вводят с помощью инфузионной системы.
Композиции изобретения являются стабилизированными жидкими фармацевтическими композициями, в которых терапевтически активные компоненты включают полипептид, который может демонстрировать формирование агрегатов во время хранения жидких фармацевтических составов.
Под «формированием агрегатов» понимается физическое взаимодействие между полипептидными молекулами, которое приводит к образованию олигомеров, которые могут оставаться растворимыми, или крупных видимых агрегатов, которые выпадают из раствора в осадок.
Определение «во время хранения» подразумевает жидкую фармацевтическую композицию или состав, сразу приготовленный, но не вводимый субъекту немедленно. Напротив, после изготовления его упаковывают для хранения либо в жидкой форме, либо в замороженном состоянии, либо в высушенной форме для последующего восстановления в жидкую форму или другую форму, пригодную для введения субъекту.
Фармацевтические композиции данного изобретения могут также содержать определенное число аминокислотных оснований, достаточное для уменьшения образования полипептидом агрегатов во время хранения композиции.
Под «аминокислотным основанием» понимается аминокислота или комбинация аминокислот, если любая данная аминокислота присутствует либо в форме свободного основания, либо в форме соли. В тех случаях, когда используется комбинация аминокислот, все аминокислоты могут находиться в форме свободных оснований, все могут находиться в форме солей, или некоторые из них могут находиться в форме свободных оснований, в то время как другие находятся в форме солей. В одном воплощении аминокислоты, которые используются для изготовления композиций изобретения, представляют собой аминокислоты, несущие заряженную боковую цепь, такие как аргинин, лизин, аспарагиновая кислота и глутаминовая кислота. Любой стереоизомер (т.е. L, D или их смесь) конкретной аминокислоты (например, метионина, гистидина, имидазола, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана, треонина и их смесей) или комбинация этих стереоизомеров может присутствовать в фармацевтических композициях изобретения до тех пор, пока данная аминокислота присутствует либо в форме свободного основания, либо в форме соли. В одном воплощении используется L-стереоизомер. Композиции изобретения могут быть также собраны в состав с производными этих аминокислот. Подходящие производные аргинина включают, например, аминогуанидин, орнитин и N-моноэтил-L-аргинин, подходящие аналоги метионина включают этионин и бутионин, а подходящие аналоги цистеина включают S-метил-L-цистеин. Как и другие аминокислоты, аминокислотные аналоги входят в композицию либо в форме свободного основания, либо в форме соли. В другом воплощении изобретения аминокислоты или аминокислотные производные используются в концентрации, которая является достаточной для предотвращения или задержки агрегации белка.
В другом воплощении изобретения состав также содержит поверхностно-активное вещество. В другом воплощении изобретения состав также содержит ингибиторы протеаз. Применение ингибитора протеаз особенно полезно в фармацевтических композициях, содержащих проферменты протеаз, для ингибирования аутокатализа.
В фармацевтическом составе полипептида данного изобретения также могут присутствовать другие ингредиенты. Такие дополнительные ингредиенты могут включать смачивающие агенты, эмульгаторы, антиоксиданты, агенты, увеличивающие объем фармацевтического состава, агенты, изменяющие тоничность, хелатирующие агенты, ионы металлов, маслянистые связующие вещества, белки (например, человеческий сывороточный альбумин, желатин или белки) и цвиттер-ионы (например, аминокислоты, такие как бетаин, таурин, аргинин, глицин, лизин и гистидин). Разумеется, наличие таких дополнительных ингредиентов не должно негативно сказываться на общей стабильности фармацевтического состава данного изобретения.
Фармацевтические композиции, содержащие полипептид в соответствии с данным изобретением, можно вводить пациентам, нуждающимся в таком лечении, на нескольких участках, например, на участках местного применения, например, на коже и слизистых оболочках, на участках, которые обходят адсорбцию, например, введение в артерию, в вену, в сердце, и на участках, которые включают адсорбцию, например, введение в кожу, под кожу, в мышцу или в брюшную полость.
Введение фармацевтических композиций в соответствии с изобретением пациентам, нуждающимся в таком лечении, можно проводить несколькими путями, например, на язык, под язык, буккально, в рот, орально, внутрижелудочно и внутрикишечно, через нос, внутрилегочно, например, в бронхиолы и альвеолы, или комбинируя их, эпидермально, дермально, трансдермально, вагинально, ректально, окулярно, например через конъюнктиву, уретрально и парентерально.
Композиции данного изобретения могут быть введены в нескольких дозированных формах, например, в виде растворов, суспензий, эмульсий, микроэмульсий, множественных эмульсий, пен, бальзамов, паст, пластырей, мазей, таблеток, таблеток, покрытых оболочкой, ополаскивателей, капсул, например, твердых желатиновых капсул и мягких желатиновых капсул, свечей, ректальных капсул, драже, гелей, спреев, порошков, аэрозолей, ингалянтов, глазных капель, глазных мазей, глазных ополаскивателей, вагинальных пессариев, вагинальных колец, вагинальных мазей, инъекционных растворов, растворов, трансформируемых in situ, например, загустевающих in situ, фиксирующихся in situ, осаждающихся in situ, кристализующихся in situ, инфузионных растворов, а также имплантатов.
Композиция данного изобретения может быть также усложнена или дополнена с помощью хорошо известных специалистам способов, например, посредством ковалентных, гидрофобных и электростатических взаимодействий, носителя лекарственного препарата, системы доставки лекарства и улучшенной системы доставки лекарства в целях еще большего увеличения стабильности производного амилинового аналога, увеличения биодоступности, увеличения растворимости, уменьшения неблагоприятных последствий, обеспечения хронотерапии, хорошо известной специалистам в данной области, а также улучшения взаимодействия с пациентом, или любых их сочетаний.
Композиции данного изобретения используют в форме твердых веществ, полутвердых веществ, порошков и растворов для легочного введения производного амилинового аналога, например с помощью дозирующих ингаляторов, сухопорошковых ингаляторов и небулайзеров; все эти устройства хорошо известны специалистам в данной области.
Композиции данного изобретения также используются в форме систем доставки лекарств с контролируемым, постепенным, удлиненным, запаздывающим и замедленным высвобождением.
Парентеральное введение может быть осуществлено путем подкожных, внутримышечных, интраперитонеальных или внутривенных инъекций с помощью шприца, возможно ручки-шприца. Альтернативно, парентеральное введение может быть выполнено с помощью инфузионного насоса. Другой возможностью является композиция в виде раствора или суспензии для введения производного амилинового аналога в форме назального или пульмонального спрея. В качестве другой возможности фармацевтические композиции, содержащие полипептид изобретения, могут быть адаптированы для чрескожного введения, например с помощью безыгольных инъекций или трансдермальных пластырей, возможно путем ионофореза, или введением через слизистую оболочку, например буккальную.
Полипептид изобретения может быть введен пульмональным путем в носителе, таком как раствор, суспензия или сухой порошок, с помощью любого из известных типов устройств, подходящих для пульмональной доставки лекарственного средства. Их примеры содержат, но не ограничиваясь ими, три типа устройств, образующих аэрозоль для пульмональной доставки лекарственного средства, и могут включать струйный или ультразвуковой небулайзер, дозирующие ингаляторы или сухопорошковые ингаляторы (см. Yu J, Chien YW. Pulmonary drug delivery: Physiologic and mechanistic aspects. Crit Rev Ther Drug Carr Sys 14(4) (1997) 395-453).
В одном воплощении изобретения фармацевтический состав, содержащий полипептид изобретения, является стабильным в течение более 6 недель применения и в течение более 3 лет хранения.
В другом воплощении изобретения фармацевтический состав, содержащий полипептид изобретения, является стабильным в течение более 4 недель применения и в течение более 3 лет хранения.
В другом воплощении изобретения фармацевтический состав, содержащий производное амилинового аналога, является стабильным в течение более 4 недель применения и в течение более двух лет хранения.
В другом воплощении изобретения фармацевтический состав, содержащий производное амилинового аналога, является стабильным в течение более двух недель применения и в течение более двух лет хранения.
В одном аспекте процесс изготовления фармацевтической композиции, содержащей производное в соответствии с изобретением, включает смешивание производного в соответствии с изобретением и по меньшей мере одного фармацевтически приемлемого эксципиента.
ТЕРАПЕВТИЧЕСКИЕ ПОКАЗАНИЯ
В одном аспекте полипептид в соответствии с изобретением может быть использован в качестве лекарственного средства.
В одном аспекте полипептид в соответствии с изобретением может быть использован в качестве лекарственного средства для лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертензии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечно-сосудистых расстройств, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка.
В одном аспекте полипептид применяется для задержки или профилактики прогрессирования заболевания при диабете 2 типа.
В одном аспекте полипептид в соответствии с изобретением может быть использован в качестве лекарственного средства для лечения или профилактики ожирения.
В одном аспекте полипептид в соответствии с изобретением может быть использован в качестве лекарственного средства для лечения или профилактики гиперкальциемии, остеопороза или деформирующего остита. В одном аспекте полипептид может быть использован в качестве лекарственного средства для уменьшения массы тела. В одном аспекте полипептид может быть использован в качестве лекарственного средства для лечения или профилактики ожирения, или в качестве лекарственного средства для профилактики увеличения массы тела. В одном аспекте полипептид может быть использован в качестве лекарственного средства для изменения потребления пищи, например, для снижении потребления пищи.
В одном аспекте медикамент может быть использован для снижения потребления пищи, уменьшения апоптоза β-клеток, повышения функции β-клеток и массы β-клеток и/или для восстановления чувствительности β-клеток к глюкозе.
В одном аспекте полипептид в соответствии с изобретением может быть использован для изготовления лекарственного средства.
В одном аспекте полипептид может быть использован для изготовления лекарственного средства для лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертензии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечнососудистых расстройств, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка
В одном аспекте полипептид может быть использован для изготовления лекарственного для задержки или профилактики прогрессирования заболевания при диабете 2 типа.
В одном аспекте полипептид может быть использован для изготовления лекарственного средства для снижения потребления пищи, уменьшения апоптоза β-клеток, повышения функции β-клеток и массы β-клеток и/или для восстановления чувствительности β-клеток к глюкозе.
Лечение полипептидом в соответствии с данным изобретением также может быть объединено со вторым или более фармакологически активным веществом, например, выбранным среди противодиабетических агентов, агентов против ожирения, агентов, регулирующих аппетит, антигипертензивных агентов, агентов для лечения и/или профилактики осложнений, развившихся в результате сахарного диабета или связанных с ним, и агентов для лечения и/или профилактики осложнений и расстройств, развившихся в результате ожирения или связанных с ним. Примерами таких фармакологически активных веществ являются: инсулин, производное инсулина, GLP-1, производные GLP-1, аналоги GLP-1, производные оксинтомодулина, сульфонилмочевины, бигуаниды, меглитиниды, ингибиторы глюкозидазы, антагонисты глюкагона, ингибиторы DPP-IV (дипептидилпептидазы-IV), ингибиторы печеночных ферментов, вовлеченных в стимуляцию глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, соединения, модифицирующие метаболизм липидов, такие как антигиперлипидемические агенты, такие как ингибиторы ГМГ-КоА (статины), соединения, снижающие потребление пищи, агонисты RXR и агенты, действующие на АТФ-зависимый калиевый канал β-клеток; холестирамин, колестипол, клофибрат, гемфиброзил, ловастатин, правастатин, симвастатин, пробукол, декстротироксин, нетеглинид, репаглинид; β-блокаторы, такие как алпренолол, атенолол, тимолол, пиндолол, пропранолол и метопролол, ингибиторы АСЕ (ангиотензин-превращающего фермента), такие как беназеприл, каптоприл, эналаприл, фозиноприл, лизиноприл, алатриоприл, хинаприл и рамиприл, блокаторы кальциевых каналов, такие как нифедипин, фелодипин, никардипин, исрадипин, нимодипин, дилтиазем и верапамил, и α-блокаторы, такие как доксазозин, урапидил, празозин и теразозин; агонисты CART (кокаин- и амфетамин-регулируемого транскрипта), антагонисты NPY (нейропептида Y), агонисты МС4 (меланокортина 4), антагонисты орексина, агонисты TNF (фактора некроза опухоли), агонисты CRF (кортикотропного рилизинг-фактора), антагонисты CRF ВР (белка, связывающего кортикотропный рилизинг-фактор), агонисты урокортина, β3-агонисты, агонисты MSH (меланин-стимулирующего гормона), антагонисты МСН (меланин-концентрирующего гормона), агонисты ССК (холецистокинина), ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, смесь серотонина и норадренергический соединений, агонисты 5НТ (серотонина), агонисты бомбезина, антагонисты галанина, гормон роста, соединения, высвобождающие гормон роста, агонисты TRH (гормона, высвобождающего тиреотропин), модуляторы UCP 2 или 3 (разобщающих белков 2 или 3), агонисты лептина, агонисты DA (бромокриптин, допрексин), ингибиторы липазы/амилазы, модуляторы RXR (ретиноидного Х-рецептора), TR β-агонисты, антагонисты гистамина Н3, гастрин и аналоги гастрина.
Следует понимать, что любая подходящая комбинация соединений в соответствии с изобретением с одним или более чем одним из вышеуказанных соединений и возможно одним или более чем одним другим фармакологически активным веществом считается входящей в объем данного изобретения.
Изобретение также будет суммировано в пунктах ниже:
1. Полипептид, выбранный среди:
(i) полипептида, содержащего аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
(ii) полипептида, содержащего аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
(iii) полипептида, содержащего аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
(iv) полипептида, содержащего аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
(v) полипептида, содержащего аминокислотную последовательность, которая является аналогом SEQ ID №2, где:
(a) указанный аналог содержит остаток пролина в позиции 37;
где нумерация аминокислотной последовательности аналога соответствует нумерации аминокислотной последовательности SEQ ID №2; и
(b) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 4; и
(c) указанный полипептид обладает растворимостью примерно 100 мкМ или более при рН 7; и
(d) указанный полипептид обладает физической стабильностью примерно 25 часов или более в анализе образования фибрилл; и
возможно, полипептид имеет по меньшей мере один заместитель, прикрепленный по меньшей мере к одному аминокислотному остатку.
2. Полипептид по пункту 1, где указанный аналог содержит остаток в позиции 14, который независимо выбран среди аспарагина и глутаминовой кислоты; предпочтительно глутаминовой кислоты.
3. Полипептид по одному из пунктов 1 и 2, где указанный аналог содержит остаток в позиции 17, который независимо выбран среди гистидина, аргинина, лизина и валина; предпочтительно гистидина и аргинина; более предпочтительно аргинина.
4. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 35, который независимо выбран среди гистидина, аргинина, лизина, аспарагиновой кислоты, глутаминовой кислоты, аспарагина и глутамина; предпочтительно гистидина, аспарагина, глутамина и глутаминовой кислоты; более предпочтительно гистидина, глутамина и аспарагина; более предпочтительно аспарагина.
5. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 1, который удален или независимо выбран среди аланина, цистеина, глутаминовой кислоты, глицина, гистидина, аргинина, серина и лизина; предпочтительно глицина, гистидина, аргинина и лизина; более предпочтительно лизина.
6. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 3, который независимо выбран среди глицина, гистидина, аргинина, серина и аспарагина; предпочтительно аспарагина.
7. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 18, который независимо выбран среди аргинина, лизина и гистидина; предпочтительно гистидина.
8. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 21, который независимо выбран среди аланина, лизина, глутамина, серина, треонина и аспарагина; предпочтительно глутамина и аспарагина; более предпочтительно аспарагина.
9. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 22, который независимо выбран среди глутаминовой кислоты, глутамина, серина, треонина и аспарагина; предпочтительно серина и аспарагина; более предпочтительно аспарагина.
10. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 26, который независимо выбран среди пролина, аргинина и изолейцина; предпочтительно аспарагина.
11. Полипептид по любому из предыдущих пунктов, где указанный аналог содержит остаток в позиции 31, который независимо выбран среди серина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина; предпочтительно аспарагиновой кислоты и аспарагина; более предпочтительно аспарагина.
12. Полипептид по любому из предыдущих пунктов, где аналог содержит аминокислотный остаток в позиции 14, который представляет собой глутаминовую кислоту, остаток в позиции 17, который представляет собой аргинин, и остаток в позиции 37, который представляет собой пролин.
13. Полипептид по пунктам 1-11, где аналог содержит аминокислотный остаток в позиции 14, который представляет собой глутаминовую кислоту, остаток в позиции 17, который представляет собой гистидин, и остаток в позиции 37, который представляет собой пролин.
14. Полипептид по пунктам 1-11, где аналог содержит аминокислотный остаток в позиции 14, который представляет собой глутаминовую кислоту, остаток в позиции 17, который представляет собой гистидин, остаток в позиции 35, который представляет собой глутамин, и остаток в позиции 37, который представляет собой пролин.
15. Полипептиды по любому из предыдущих пунктов, где остальные остатки являются такими же, как в SEQ ID №2.
16. Полипептиды по любому из предыдущих пунктов, где аналог содержит такие же аминокислотные остатки в позицииях 2, 4-16, 19, 20, 23-25, 27-30, 32-34 и 36, как и остатки в позициях 2, 4-16, 19, 20, 23-25, 27-30, 32-34 и 36 в SEQ ID №2.
17. Полипептид по пункту 1, содержащий аминокислотную последовательность, которая является аналогом SEQ ID №2 формулы (I):

где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди Gly, His, Arg, Ser и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg, Lys и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Ala, Lys, Gln, Ser и Asn;
Хаа22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro, Arg и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp, Gln и Glu;
и где С-конец, возможно, находится в форме производного.
18. Полипептид по пункту 17, где Xaa14 представляет собой Glu.
19. Полипептид по одному из пунктов 17 и 18, где Хаа17 представляет собой Arg или His.
20. Полипептид по одному из пунктов 17-19, где Хаа35 представляет собой Asn или Gln.
21. Полипептид по одному из пунктов 17-19, где:
Xaa1 представляет собой Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu
Xaa17 представляет собой His или Arg;
Xaa18 представляет собой His;
Xaa21 представляет собой Asn;
Хаа22 представляет собой Asn;
Хаа26 представляет собой Ile;
Хаа31 представляет собой Asn;
Хаа35 представляет собой Asn.
22. Полипептид по пункту 17, где
Xaa1 удален или независимо выбран среди His, Arg и Lys;
Хаа3 независимо выбран среди Gly, His и Asn;
Xaa14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ser и Asn;
Хаа22 представляет собой Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp, Gln и Glu.
23. Полипептид по любому из пунктов 17, где
Xaa1 удален или независимо выбран среди Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди His и Asn;
Хаа14 независимо выбран среди Glu и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln, Ser и Asn;
Хаа22 представляет собой Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 представляет собой Asn;
Хаа35 представляет собой Asn;
24. Полипептид по пункту 17, где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Thr и Asn;
Хаа26 представляет собой Ile;
Хаа31 представляет собой Asn;
Хаа35 независимо выбран среди Gln, Gly и Asn;
25. Полипептид по пункту 17, где
Xaa1 удален;
Хаа3 независимо выбран среди Gly и Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Gln и Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди Asn, Gln и Glu.
26. Полипептид по пункту 17, где
Xaa1 представляет собой Lys;
Хаа3 представляет собой Asn;
Xaa14 представляет собой Glu;
Xaa17 независимо выбран среди His, Lys, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ala, Lys, Gln и Ser;
Хаа22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди Gln, Glu и Asn.
27. Полипептид по любому из предыдущих пунктов, содержащий C-концевой амид.
28. Полипептид по пункту 27, где C-концевой амид имеет формулу (II):
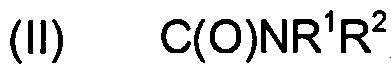 ,
,
где R1 и R2 независимо выбраны среди Н и алкила. Предпочтительно R1 и R2 оба являются Н.
29. Полипептид по пункту 28, где R1 и R2 оба являются Н.
30. Полипептид по любому из предыдущих пунктов, где по меньшей мере один заместитель присоединен к одному из аминокислотных остатков.
31. Полипептид по пункту 30, где заместитель выбран среди углеводородной группы, гидроксильной группы и атома галогена.
32. Полипептид по любому из пунктов 30 и 31, где замещающая группа имеет формулу (II):
 ,
,
где
L представляет собой линкер;
n=0 или 1,
Y является альбуминсвязывающей группировкой.
33. Полипептид по пункту 32, где альбуминсвязывающая группировка является ацильной группой, выбранной среди:
(a) СН3(СН2)rCO-, где r является целым числом от 12 до 20;
(b) HOOC(CH2)sCO-, где s является целым числом от 12 до 22, либо s является целым числом от 12 до 18, либо s составляет от 16 до 18, либо, предпочтительно, s составляет 18.
34. Полипептид по одному из пунктов 32 и 33, где линкер выбран из группы, состоящей из γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, Glu, Glu-Glu, Glu-γGlu, Glu-Arg, Glu-Glu-Arg, His, His-His, His-γGlu, His-His-γGlu, Gly, Gly-γGlu, Ser, Ser-γGlu, D-Arg-D-Arg, Arg, Arg-Arg, Arg-Arg-γGlu, Ser-Ser,-Gly-Ser-Ser, Ser-Ser,-Gly-Ser-Ser-γGlu, Ser-Ser-Gly-Ser-Ser-Gly и Ser-Ser-Gly-Ser-Ser-Gly-γGlu, γGlu-OEG, yGlu-OEG-OEG и OEG, предпочтительно линкер выбран среди γGlu, γGlu-γGlu, γGlu-OEG, γGlu-OEG-OEG и OEG, более предпочтительно линкер представляет собой γGlu.
35. Полипептид по любому из предыдущих пунктов, где замещающая группа выбрана среди групп, представленных в Табл. 1 (представлена ранее).
36. Полипептид по любому из предыдущих пунктов, где заместитель присоединен к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys.
37. Полипептид по любому предыдущему пункту, где заместитель присоединен к аминокислотному остатку только в позиции 1.
38. Полипептид по любому из предыдущих пунктов, выбранный из группы, состоящей из любых полипептидов, представленных в Табл. 2 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 3 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 4 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 5 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 6 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 7 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 8 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 9 (представлена ранее); или из группы, состоящей из любых полипептидов, представленных в Табл. 10 (представлена ниже); или из группы, состоящей из любых полипептидов, представленных в Табл. 11 (представлена ниже); или из группы, состоящей из любых полипептидов, представленных в Табл. 12 (представлена ниже); или из группы, состоящей из любых полипептидов, представленных в Табл. 13 (представлена ниже); или из группы, состоящей из любых полипептидов, представленных в Табл. 14 (представлена ниже); или из группы, состоящей из любых полипептидов, представленных в Табл. 15 (представлена ниже).
39. Полипептид по любому из предыдущих пунктов, выбранный из группы, состоящей из любых полипептидов, представленных в Табл. 8 (представлена ранее).
40. Полипептид по любому из предыдущих пунктов, выбранный из группы, состоящей из любых полипептидов, представленных в Табл. 9 (представлена ранее).
41. Полипептид по любому из предыдущих пунктов, который представляет собой: N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид [пример 53]
42. Фармацевтическая композиция, содержащая полипептид по любому из предыдущих пунктов и фармацевтически приемлемый эксципиент.
43. Фармацевтическая композиция по пункту 42, которая подходит для парентерального введения.
44. Процесс получения фармацевтической композиции по пункту 42 или пункту 43, включающий смешивание полипептида по любому из предыдущих пунктов по меньшей мере с одним фармацевтически приемлемым эксципиентом.
45. Полипептид по любому из предыдущих пунктов для применения в качестве лекарственного средства.
46. Полипептид по любому из предыдущих пунктов для применения в лечении или профилактике гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертензии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечно-сосудистых расстройств, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка.
47. Полипептид по любому из предыдущих пунктов для применения в задержке или профилактике прогрессирования заболевания при диабете 2 типа.
48. Полипептид по любому из предыдущих пунктов для применения в профилактике или лечении ожирения.
49. Полипептид по любому из предыдущих пунктов для применения в снижении потребления пищи, уменьшении апоптоза β-клеток, повышении функции β-клеток и массы β-клеток и/или восстановлении чувствительности β-клеток к глюкозе.
50. Полипептид по любому из предыдущих пунктов для применения в лечении или профилактике гиперкальциемии, остеопороза или деформирующего остита.
51. Способ лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушенной толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертонии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечно-сосудистых заболеваний, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка путем введения животному полипептида по любому из предыдущих пунктов.
52. Способ задержки или предотвращения прогрессирования заболевания при диабете 2 типа путем введения полипептида по любому из предыдущих пунктов животному.
53. Способ уменьшения потребления пищи, снижения апоптоза β-клеток, повышения функции β-клеток и массы β-клеток, и/или восстановления чувствительности β-клеток к глюкозе путем введения животному полипептида по любому из предыдущих пунктов.
54. Способ лечения или профилактики гиперкальциемии, остеопороза или деформирующего остита путем введения животному полипептида по любому из предыдущих пунктов.
55. Полипептид по любому из предыдущих пунктов, где указанный полипептид имеет EC50 для рецептора амилина человека примерно 1800 пМ или менее.
56. Полипептид по любому из предыдущих пунктов, где указанный полипептид имеет EC50 для рецептора кальцитонина человека примерно 1800 пМ или менее.
Изобретение далее будет кратко изложено в следующих пунктах:
1. Производное амилина, которое является аналогом амилина, содержащим до десяти модификаций аминокислотных остатков по сравнению с SEQ ID №2 и содержащим заместитель, присоединенный к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys в аналоге амилина, где указанный заместитель содержит альбуминсвязывающую группировку, и где
а. аминокислотный остаток в позиции 14 аналога амилина представляет собой Glu, или
b. аминокислотный остаток в позиции 35 аналога амилина представляет собой His, Arg, Lys, Asp или Glu, или
c. аминокислотный остаток в позиции 37 аналога амилина представляет собой Pro.
2. Производное по пункту 1, где аминокислотный остаток в позиции 14 представляет собой Glu.
3. Производное по пунктам 1-2, где
а. аминокислотный остаток в позиции 14 представляет собой Glu, а аминокислота в позиции 35 представляет собой His, Arg, Lys, Asp или Glu, или
b. аминокислотный остаток в позиции 14 представляет собой Glu, а аминокислота в позиции 37 представляет собой Pro.
4. Производное по пунктам 1-3, где
а. аминокислотный остаток в позиции 14 представляет собой Glu, а аминокислота в позиции 35 представляет собой His.
5. Производное по пунктам 1-4, где аминокислотный остаток в позиции 17 представляет собой His.
6. Производное по пунктам 1-5, где аналог амилина содержит 1, 2, 3, 4, 5 или 6 замен.
7. Производное по пунктам 1-6, где аминокислота в позиции 1 аналога амилина замещена или удалена.
8. Производное по пунктам 1-7, где аминокислота в позиции 1 выбрана из группы, состоящей из Lys, Glu, Arg, Ala, Ser, Cys, Gly и His.
9. Производное по пунктам 1-8, где заместитель содержит линкер.
10. Производное по пунктам 1-9, где линкер содержит 1-10 аминокислот, которые присоединены к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys в аналоге амилина.
11. Производное по пункту 10, где аминокислоты выбраны из группы, состоящей из γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, Glu, Glu-Glu, Glu-γGlu, Glu-Arg, Glu-Glu-Arg, His, His-His, His-γGlu, His-His-γGlu, Gly, Gly-γGlu, Ser, Ser-γGlu, D-Arg-D-Arg, Arg, Arg-Arg, Arg-Arg-γGlu, Ser-Ser,-Gly-Ser-Ser, Ser-Ser,-Gly-Ser-Ser-γGlu, Ser-Ser-Gly-Ser-Ser-Gly и Ser-Ser-Gly-Ser-Ser-Gly-γGlu.
12. Производное по пунктам 1-11, где линкер содержит -С(O)-(CH2)l-O-[СН2СН2-O]m-(СН2)p-[NHC(O)-(CH2)l-O-[(CH2)n-O]m-(CH2)p]q-NH-, где l, m, n, и p независимо составляют 1-7, a q составляет 0-5.
13. Производное по пунктам 1-12, где линкер выбран из группы, состоящей из -С(O)-СН2-О-СН2-CH2-О-СН2-CH2-NH- или -С(O)-CH2-O-СН2- СН2-О-СН2-СН2-[NHC(О)-CH2-О-CH2-CH2-O-СН2-CH2-]1-NH- и -С(O)-(СН2)2-O-[CH2CH2-O]7-(СН2)2-NH-.
14. Производное по пунктам 1-13, где линкер выбран из группы, состоящей из γGlu-C(O)-СН2-О-СН2-СН2-О-СН2-СН2-[NHC(O)-СН2-О-СН2-СН2-O-CH2-CH2-]1-NH- и Arg-Arg-γGlu-C(O)-СН2-О-СН2-СН2-О-СН2-СН2-[NHC(O)-СН2- О-СН2-СН2-O-СН2-CH2-]1-NH-.
15. Производное по любому из пунктов 1-14, где альбуминсвязывающий остаток является ацильной группой, выбранной среди группы, содержащей HOOC(CH2)sCO-, где s является целым числом от 14 до 20, например 16 или 18.
16. Производное по пунктам 1-15, где производное содержит γGlu-линкер, присоединенный к N-концу амилинового аналога, и HOOC(CH2)18CO или НООС(СН2)16СО- в качестве альбуминсвязывающего остатка, и где последовательность аналога амилина содержит:
a. Glu в позиции 14,
b. His или Arg в позиции 17,
с. His в позиции 35 или Pro в позиции 37.
17. Производное по пункту 1, где аналог амилина содержит аминокислотную последовательность формулы 1:

где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди Gly, His, Arg, Ser и Asn;
Xaa17 независимо выбран среди His, Arg, Lys и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Ala, Lys, Gln, Ser и Asn;
Xaa22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro, Arg и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp и Glu;
Хаа37 независимо выбран среди Pro и Tyr;
и где С-конец, возможно, может присутствовать в форме амида.
18. Производное по пунктам 1 и 17, где
Xaa1 удален или независимо выбран среди His, Arg и Lys;
Хаа3 независимо выбран среди Gly, His и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ser и Asn;
Xaa22 представляет собой Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp и Glu;
Хаа37 независимо выбран среди Pro и Tyr.
19. Производное по любому из пунктов 1 и 17, где
Xaa1 удален или независимо выбран среди Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди His и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln, Ser и Asn;
Хаа22 представляет собой Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 представляет собой Asn;
Хаа35 представляет собой His;
Хаа37 представляет собой Tyr.
20. Производное по пунктам 1 и 17, где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 представляет собой Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Thr и Asn;
Хаа26 представляет собой Ile;
Хаа31 представляет собой Asn;
Хаа35 независимо выбран среди Gly и Asn;
Хаа37 представляет собой Pro.
21. Производное по любому из пунктов 1 и 17, где
Xaa1 удален;
Хаа3 независимо выбран среди Gly и Asn;
Xaa17 независимо выбран среди His, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Gln и Asn;
Хаа22 независимо выбран среди Gln и Asn;
Хаа26 представляет собой Ile;
Хаа31 независимо выбран среди Glu и Asn;
Хаа35 независимо выбран среди His и Ser;
Хаа37 независимо выбран среди Pro и Tyr.
22. Производное по пунктам 1 и 17, где
Xaa1 представляет собой Lys;
Хаа3 представляет собой Asn;
Xaa17 независимо выбран среди His, Lys, Arg и Val;
Xaa18 независимо выбран среди Arg и His;
Xaa21 независимо выбран среди Ala, Lys, Gln и Ser;
Xaa22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Glu и Asn;
Хаа37 независимо выбран среди Pro и Tyr.
23. Производное по пунктам 1 и 17-22, где альбуминсвязывающий остаток нековалентно связывается с альбумином.
24. Производное по любому из пунктов 1 и 17-23, где альбуминсвязывающий остаток имеет аффинность связывания с человеческим сывороточным альбумином менее примерно 10 мкМ или менее примерно 1 мкМ.
25. Производное по любому из пунктов 1 и 17-24, где альбуминсвязывающий остаток содержит группу, которая может быть отрицательно заряженной при рН 7,4.
26. Производное по любому из пунктов 1 и 17-25, где альбуминсвязывающий остаток содержит карбоксильную группу.
27. Производное по любому из пунктов 1 и 17-26, где альбуминсвязывающий остаток является ацильной группой, выбранной среди группы, содержащей HOOC(CH2)sCO-, где s является целым числом от 12 до 22, например 17, 18, 19, 20, 21 или 22.
28. Производное по пунктам 1 и 27, где s составляет 16 или 18.
29. Производное по пунктам 1 и 17-28, где заместитель содержит линкер.
30. Производное по пунктам 1 и 17-29, где линкер содержит 1-10 аминокислот, которые присоединены к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys в аналоге амилина.
31. Производное по пунктам 1 и 17-30, где аминокислоты выбраны из группы, состоящей из производного по пункту 10, где аминокислоты выбраны из группы, состоящей из γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, Glu, Glu-Glu, Glu-γGlu, Glu-Arg, Glu-Glu-Arg, His, His-His, His-γGlu, His-His-γGlu, Gly, Gly-γGlu, Ser, Ser-γGlu, D-Arg-D-Arg, Arg, Arg-Arg, Arg-Arg-γGlu, Ser-Ser,-Gly-Ser-Ser, Ser-Ser,-Gly-Ser-Ser-γGlu, Ser-Ser-Gly-Ser-Ser-Gly и Ser-Ser-Gly-Ser-Ser-Gly-γGlu.
32. Производное по пунктам 1 и 17-31, где линкер содержит γGlu.
33. Производное по пунктам 1 и 17-32, где линкер содержит -С(O)-(CH2)l-O-[CH2CH2-O]m-(CH2)p-[NHC(O)-(CH2)l-O-[(CH2)n-O]m-(CH2)p]q-NH-, где l, m, n и p независимо составляют 1-7, a q составляет 0-5.
34. Производное по пунктам 1 и 17-33, где линкер выбран из группы, состоящей из -С(O)-CH2-О-CH2-СН2-О-СН2-СН2-NH- или -С(O)-CH2-O-СН2-СН2-О-СН2-СН2-[NHC(O)-СН2-О-СН2-СН2-O-СН2-CH2-]1-NH- и -С(O)-(СН2)2-O-[СН2СН2-O]7-(CH2)2-NH-.
35. Производное по пунктам 1 и 17-34, где линкер выбран из группы, состоящей из γGlu-C(O)-СН2-О-СН2-СН2-О-СН2-СН2-[NHC(O)-СН2-O-СН2-СН2-O-СН2-CH2-]1-NH- и Arg-Arg-γGlu-C(O)-СН2-O-СН2-СН2-О-CH2-СН2-[NHC(O)-СН2-О-СН2-СН2-O-СН2-CH2-]1-NH-.
36. Производное по пунктам 1 и 17-28, где линкер представляет собой γGlu-γGlu-γGlu-γGlu-С(O)-СН2-O-CH2-СН2-О-СН2-СН2-[NHC(O)-CH2-O-СН2-СН2-O-СН2-CH2-]1-NH-.
37. Производное по пункту 1, где производное выбрано из группы, включающей:
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu8,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Gln21,Gln22,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu25,Ser28,Arg29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu22,Ala25,Arg26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ser21,Ser22,Asp31,Asp35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,Arg17]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Arg1,Glu14,His17,Arg18,Lys21]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Gly3,Glu14,His17,Arg18,Ser21,Ser22,Glu31,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Arg3,Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Arg18,Ala19,Thr20,Gln21,Glu22,Leu23]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Gly3,Glu14,Arg18,Ser21,Ser22,Ala25,Pro26,Ser28,Ser29,Glu31,Arg35]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18,Ala21,Ser35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-[Gly1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-Gly-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]бутирил}-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu10,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ser21,Lys25]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Glu14,His17,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Lys35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His36]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His34]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His32]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,His35)-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Orn1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Pro37]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Asp21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,Gln21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ser21,Lys25,Ser28,Ser29.His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,His21,Lys25,Ser28,Ser29.His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys21,Ser28,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Lys11,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Thr21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Arg29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Arg-[Glu14,Arg17,His35,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Arg18,Lys21,Ser28,Arg29,Arg35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Glu21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ala21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Ser21,Ser22,Ser28,Ser29,Asp31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Ser21,Ser22,Pro23,Ala25,Pro26,Ser28,Ser29,Asp31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp31,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp22,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Asp3,Glu14,Arg17,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ala21,His35,Pro37]-прамлинтид.
38. Фармацевтическая композиция, содержащая производное по любому из пунктов 1-37 и фармацевтически приемлемый эксципиент.
39. Фармацевтическая композиция по пункту 38, которая подходит для парентерального введения.
40. Производное по любому пункту 1-37 для применения в качестве лекарственного средства.
41. Производное по любому пункту 1-37 для применения в качестве лекарственного средства для лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертензии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечнососудистых расстройств, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка.
42. Производное по любому пункту 1-37 для применения в качестве лекарственного средства для задержки или профилактики прогрессирования заболевания при диабете 2 типа.
43. Производное по любому пункту 1-37 для применения в качестве лекарственного средства для снижения потребления пищи, уменьшения апоптоза β-клеток, повышении функции β-клеток и массы β-клеток и/или восстановления чувствительности β-клеток к глюкозе.
44. Применение производного по любому пункту 1-37 для изготовления лекарственного средства.
45. Применение производного по любому пункту 1-37 для изготовления лекарственного средства для лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушения толерантности к глюкозе, сахарного диабета 1 типа, ожирения, гипертензии, синдрома X, дислипидемии, когнитивных расстройств, атеросклероза, инфаркта миокарда, ишемической болезни сердца и других сердечнососудистых расстройств, инсульта, синдрома воспаленного кишечника, диспепсии и язвы желудка.
46. Применение производного по любому пункту 1-37 для изготовления лекарственного средства для задержки или профилактики прогрессирования заболевания при диабете 2 типа.
47. Применение производного по любому пункту 1-37 для изготовления лекарственного средства для лечения ожирения, снижения потребления пищи, уменьшения апоптоза β-клеток, повышения функции β-клеток и массы β-клеток и/или для восстановления чувствительности β-клеток к глюкозе.
48. Способ изготовления фармацевтической композиции по пунктам 38-39, включающий смешивание производного по одному из пунктов 1-37 по меньшей мере с одним фармацевтически приемлемым эксципиентом.
49. Производное амилина в соответствии с примерами.
Изобретение далее будет кратко изложено в следующих пунктах:
1. Производное амилина, которое является аналогом амилина, содержащим до десяти модификаций аминокислотных остатков по сравнению с SEQ ID №2 и содержащим заместитель, присоединенный к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys в аналоге амилина, где указанный заместитель содержит альбуминсвязывающую группировку, и где
а. аминокислотный остаток в позиции 14 аналога амилина представляет собой Glu, или
b. аминокислотный остаток в позиции 35 аналога амилина представляет собой His, Arg, Lys, Asp или Glu, или
c. аминокислотный остаток в позиции 37 аналога амилина представляет собой Pro.
2. Производное по пункту 1, где аминокислотный остаток в позиции 14 представляет собой Glu.
3. Производное по пунктам 1-2, где
c. аминокислотный остаток в позиции 14 представляет собой Glu, а аминокислота в позиции 35 представляет собой His, Arg, Lys, Asp или Glu, или
d. аминокислотный остаток в позиции 14 представляет собой Glu, а аминокислота в позиции 37 представляет собой Pro.
4. Производное по пунктам 1-4, где аминокислотный остаток в позиции 17 представляет собой His.
5. Производное по пункту 1, где аналог амилина содержит аминокислотную последовательность формулы 1:

где
Xaa1 удален или независимо выбран среди Ala, Cys, Glu, Gly, His, Arg, Ser и Lys;
Хаа3 независимо выбран среди Gly, His, Arg, Ser и Asn;
Xaa17 независимо выбран среди His, Arg, Lys и Val;
Xaa18 независимо выбран среди Arg, Lys и His;
Xaa21 независимо выбран среди Ala, Lys, Gln, Ser и Asn;
Хаа22 независимо выбран среди Glu, Gln, Ser, Thr и Asn;
Хаа26 независимо выбран среди Pro, Arg и Ile;
Хаа31 независимо выбран среди Ser, Glu, Asp и Asn;
Хаа35 независимо выбран среди His, Arg, Lys, Asp и Glu;
Xaa37 независимо выбран среди Pro и Tyr;
и где С-конец, возможно, присутствует в форме амида.
6. Производное по пунктам 1-5, где заместитель содержит линкер с 1-10 аминокислотами, которые присоединены к α-аминогруппе N-концевого аминокислотного остатка или к остатку Lys в аналоге амилина.
7. Производное по пунктам 1-6, где линкер содержит γGlu.
8. Производное по пунктам 1-7, где линкер выбран из группы, состоящей из γGlu-C(O)-СН2-О-СН2-СН2-О-СН2-СН2-[NHC(O)-СН2-О-СН2-СН2-O-СН2-СН2-]1-NH- и Arg-Arg-γGlu-C(O)-СН2-О-CH2-СН2-О-CH2-CH2-[NHC(O)-СН2-О-СН2-СН2-О-CH2-CH2-]1-NH-.
9. Производное по пунктам 1-8, где производное содержит γGlu линкер, присоединенный к N-концу амилинового аналога, и HOOC(CH2)18CO или HOOC(CH2)16CO- в качестве альбуминсвязывающего остатка, и где последовательность аналога амилина содержит:
a. Glu в позиции 14,
b. His или Arg в позиции 17,
c. His в позиции 35 или Pro в позиции 37.
10. Производное по пункту 1, которое выбрано из группы, включающей:
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu8,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Gly3,Glu14,His17,Arg18,Gln21,Gln22,Glu31,Gly35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu25,Ser28,Arg29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Glu22,Ala25,Arg26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,Ser21,Ser22,Asp31,Asp35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,Arg17]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Arg1,Glu14,His17,Arg18,Lys21]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Gly3,Glu14,His17,Arg18,Ser21,Ser22,Glu31,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ala25,Pro26,Ser28,Ser29]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Arg3,Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Arg18,Ala19,Thr20,Gln21,Glu22,Leu23]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Gly3,Glu14,Arg18,Ser21,Ser22,Ala25,Pro26,Ser28,Ser29,Glu31,Arg35]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,His3,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,His29]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Glu14,His17,Arg18,Ala21,Ser35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-[Gly1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-Ser-Gly-Ser-Ser-Gly-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[His1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[His1,Glu14,His17]-прамлинтид,
N-альфа-{(S)-4-карбокси-4-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]бутирил}-[des1,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu10,Glu14,His17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-Glu-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[His1,Glu14,His17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Ala25,Pro26,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-His-His-[Glu14,Arg17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-His-[Glu14,Arg17,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ser21,Lys25]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg18]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Glu14,His17,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-17-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys17,Ser21,Glu35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Ser-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[His1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутирил]-[Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Ser1,Glu14,His17,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[des1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg17,Ser21,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Arg35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Lys35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His36]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His34]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,His32]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,His35)-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His1,Glu14,His17,Ser21,His35]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-D-Arg-D-Arg-[Orn1,Glu14,His17,Arg18]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Pro37]-прамлинтид
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-(19-карбоксинонадеканоил)-Glu-Glu-Arg-[Glu1,Glu14,His17,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys25]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Asp21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Glu14,His17,Gln21,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ser21,Lys25,Ser28,Ser29.His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,His21,Lys25,Ser28,Ser29.His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Gly1,Glu14,His17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu1,Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Gln21,Gln35,Pro37]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[His17,Lys21,Ser28,His35]-прамлинтид,
N-эпсилон-25-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys25,Ser28,Ser29,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[His1,Glu14,Arg18,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,His35]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Lys11,Glu14,His17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Thr21,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Lys21,Ser28,Arg29,His35]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(3)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Ser28,Ser29,His35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Arg-[Glu14,Arg17,His35,Pro37]-прамлинтид,
N-эпсилон-21-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Arg18,Lys21,Ser28,Arg29,Arg35]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,His17,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Gly-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-[Arg1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Arg1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Arg-[Glu1,Glu14,Arg17,Gln21,Gln22,Gln31,Gln35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-Glu-Glu-[Glu1,Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Gln21,Ala25,Pro26,Ser28,Ser29,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Glu21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Lys21,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,His17,Ala21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg18,Ser21,Ser22,Ser28,Ser29,Asp31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Ser21,Ser22,Pro23,Ala25,Pro26,Ser28,Ser29,Asp31,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp21,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp35,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp31,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Asp22,Pro37]-прамлинтид,
N-альфа-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Asp3,Glu14,Arg17,Pro37]-прамлинтид,
N-эпсилон-1-[(S)-4-карбокси-4-(19-карбоксинонадеканоиламино)бутирил]-[Glu14,Arg17,Pro37]-прамлинтид,
N-альфа-[2-(2-{2-[2-(2-{2-[(S)-4-карбокси-4-(19-карбоксигептадеканоиламино)бутириламино]этокси}этокси)ацетиламино]этокси}этокси)ацетил]-[Glu14,Ala21,His35,Pro37]-прамлинтид.
11. Фармацевтическая композиция, содержащая производное по любому из пунктов 1-10 и фармацевтически приемлемый эксципиент.
12. Производное по любому из пунктов 1-10 для применения в качестве лекарственного средства.
13. Производное по любому из пунктов 1-10 для применения в качестве лекарственного средства для лечения ожирения, снижения потребления пищи, уменьшения апоптоза β-клеток, повышения функции β-клеток и массы β-клеток и/или для восстановления чувствительности β-клеток к глюкозе.
14. Применение производного по любому из пунктов 1-10 для изготовления лекарственного средства.
15. Способ изготовления фармацевтической композиции, включающий смешивание производного по одному из пунктов 1-10 по меньшей мере с одним фармацевтически приемлемым эксципиентом.
Теперь данное изобретение будет описано только путем примеров.
ПРИМЕРЫ
Полученные полипептиды показаны в Табл. 10.

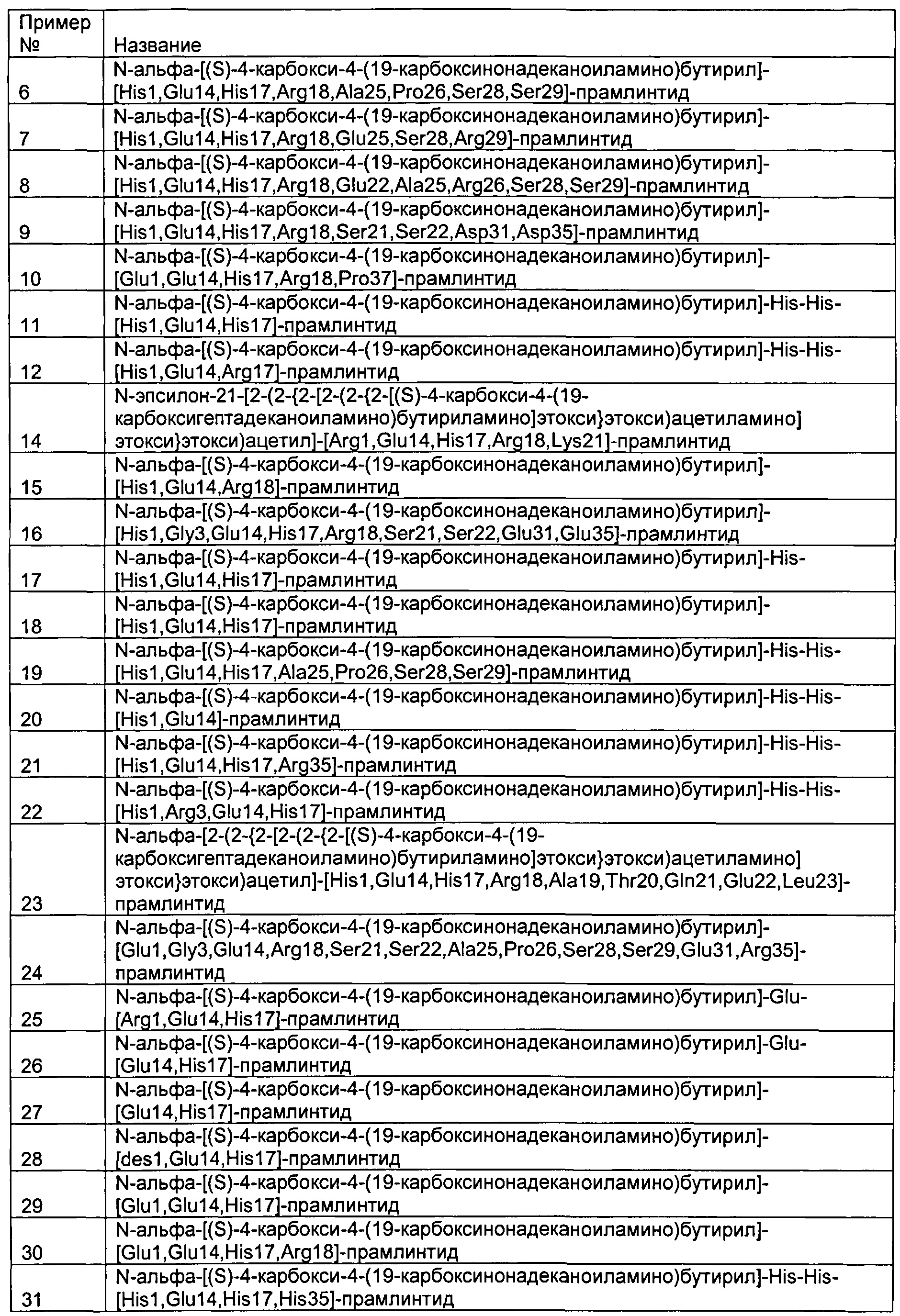
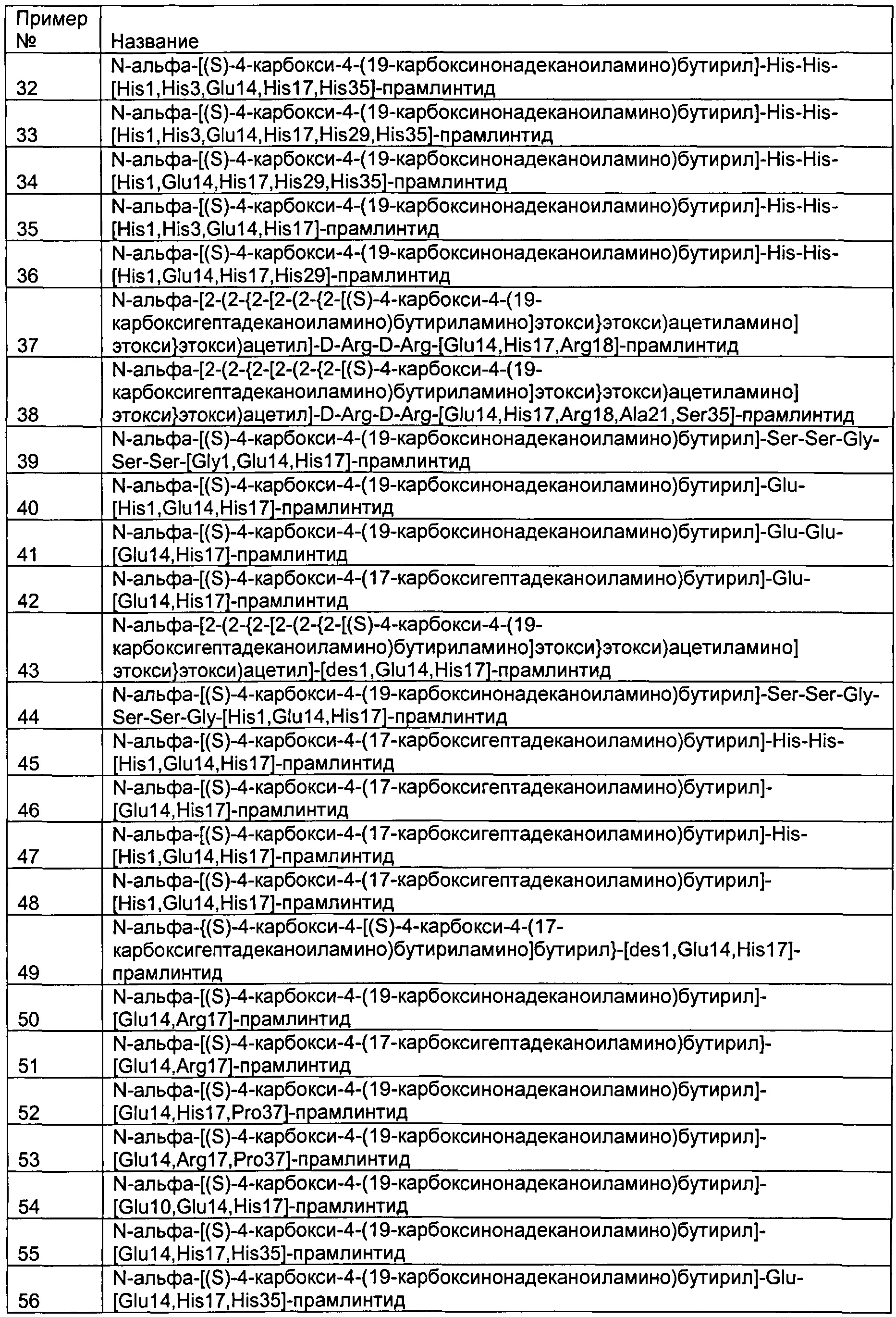
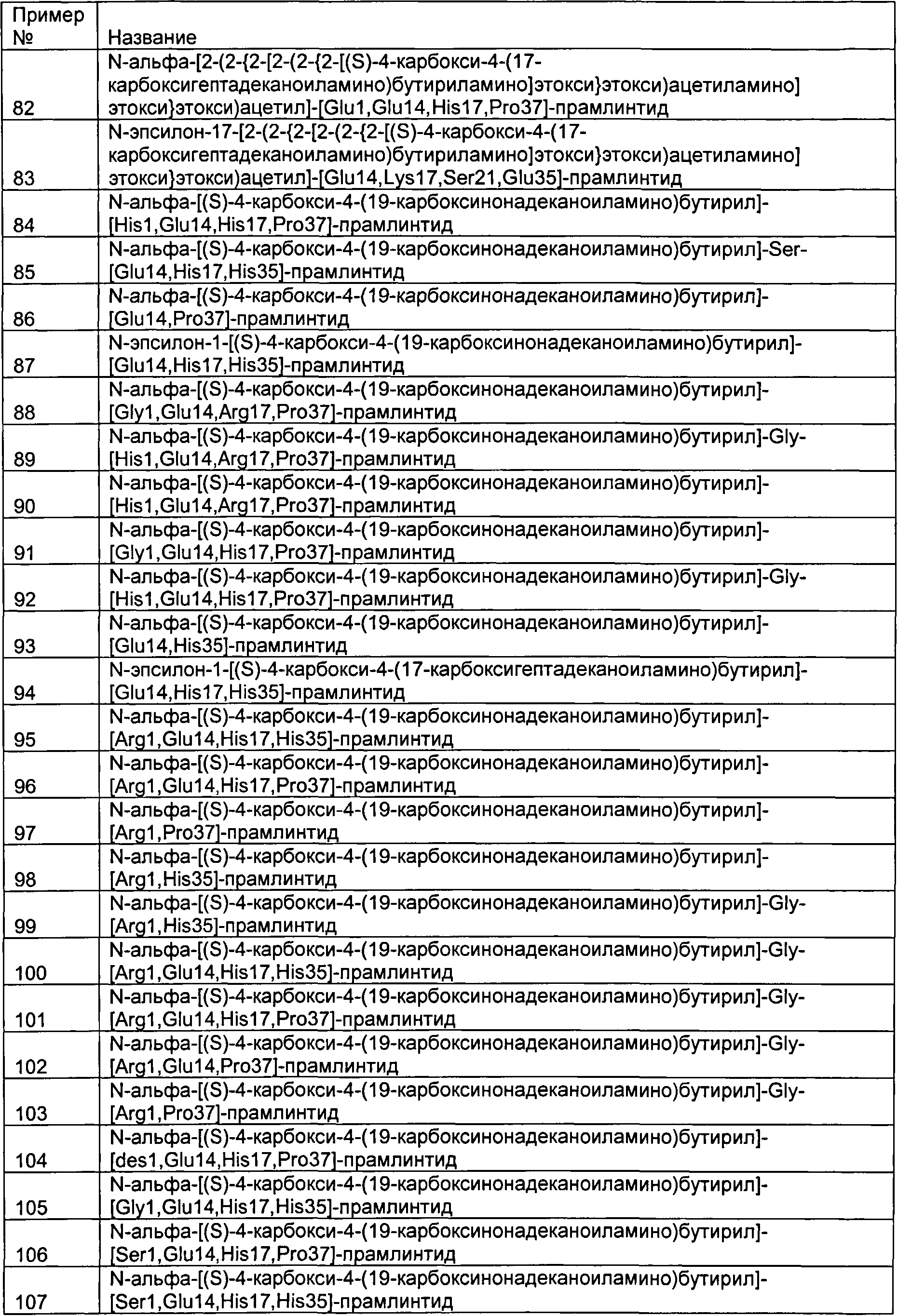


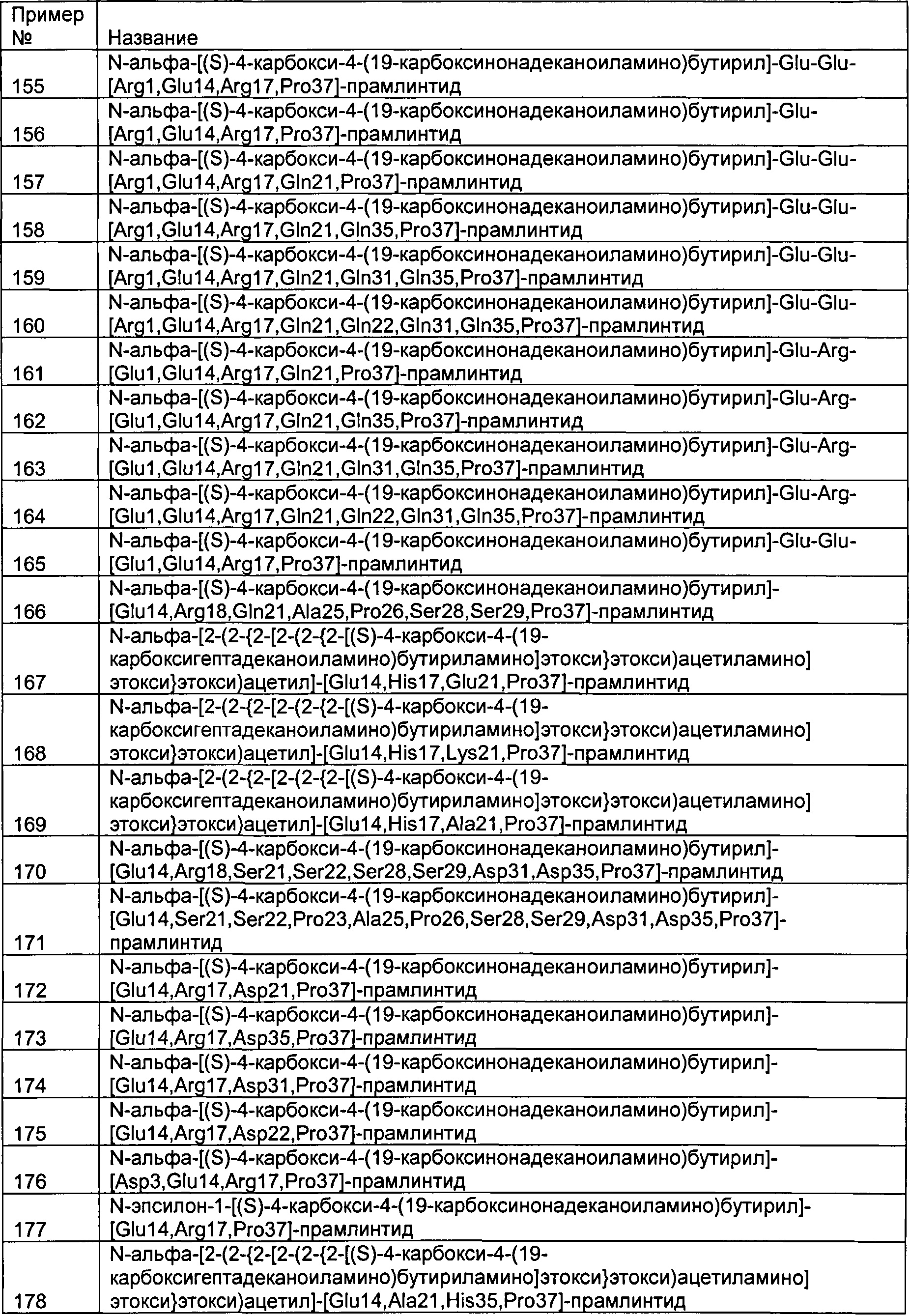
Активность полипептидов in vitro по сравнению с рецепторами амилина и рецепторами кальцитонина мыши и человека (как описано в анализе (II)) показана в Табл. 11.
|
|
|
|
Растворимость полипептидов оценивали, как описано в анализе (IV), и результаты показаны в Табл. 12.
|
|
|
|
Производные амилина анализировали на предмет из физической стабильности в анализе ThT (анализ (III)), данные приведены в Табл. 13.
|
|
|
|
Производные амилина анализировали в отношении их влияния в анализе потребления пищи (Анализ (I)), и результаты показаны в Табл. 14.
|
|
Время полужизни производных амилина изобретения анализировали на мини-свиньях, как описано в анализе (IX), и данные приведены в Табл. 15.
|
АББРЕВИАТУРЫ
Некоторые из аббревиатур, используемые в примерах, приведены далее:
Acm: ацетамидометил
HATU: (O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат)
HBTU: 2-(1Н-бензотриазол-1-ил)-1,1,3,3 тетраметилурония гексафторфосфат
Fmoc: 9Н-флуорен-9-илметоксикарбонил
Boc: трет-бутилоксикарбонил
Mtt: 4-метилтритил
DCM: дихлорметан
TIPS: триизопропилсилан
TFA: трифторуксусная кислота
NMP: 1-метил-пирролидин-2-он
HOAt: 1-гидрокси-7-азабензотриазол
DIC: диизопропилкарбодиимид
Trt: трифенилметил
АНАЛИЗЫ
В следующих примерах ссылки сделаны на следующие анализы:
Анализ (I) - Протокол эксперимента для тестирования влияния на аппетит с использованием модели крысы с кормлением ad libitum (без ограничения)
АНАЛИЗ (II)а - Функциональный анализ - Анализ рецептора кальцитонина и амилина человека
АНАЛИЗ (II)b - Функциональный анализ - Анализ рецептора кальцитонина и амилина крысы
АНАЛИЗ (III) - Анализы образования фибрилл ThT для оценки физической стабильности белковых составов
Анализ (IV) - Определение растворимости
Анализ (V) - Определение связывания с рецептором амилина человека
Анализ (VI) - Определение связывания с рецептором амилина крысы
Анализ (VII) - Определение связывания с рецептором кальцитонина человека
Анализ (VIII) - Определение связывания с рецептором кальцитонина крысы
АНАЛИЗ (IX) - pK - Определение T½ у мини-свиней
АНАЛИЗ (X) - pK - Определение T½ у крыс
АНАЛИЗ (I) - Протокол эксперимента для тестирования влияния на аппетит с использованием модели крысы с кормлением ad libitum (без ограничения)
Для экспериментов использовали крыс Sprague Dawley (SD) от Taconic Europe, Дания. В начале эксперимента крысы имели вес тела 200-250 г. Крыс доставляли по меньшей мере за 10-14 дней до начала эксперимента, чтобы провести акклиматизацию к экспериментальным условиям. За этот период животных обрабатывали по меньшей мере 2 раза. После получения крыс помещали по отдельности на одну неделю в обратный режим фазы света/темноты (имеется в виду, что свет выключен в дневное время и включен в ночное время) в течение двух недель. Поскольку крысы, как правило, активны и съедают большую часть своего ежедневного рациона питания во время темного периода, то дозу препарата крысам вводили утром прямо перед выключением света. Эти установки приводят к наименьшей изменчивости данных и наибольшей чувствительности анализа. Эксперимент проводили в домашних клетках крыс, и у крыс имелся свободный доступ к пище и воде в течение периода акклиматизации и периода эксперимента. Каждую дозу производного тестировали на группе из 5-8 крыс. В каждый набор тестирования входила группа из 6-8 крыс, получавших носитель. Крысам вводили дозу препарата один раз в соответствии с массой тела в расчете 0,01-3 мг/кг раствора внутрибрюшинно (ip), перорально (po) или подкожно (sc). Время введения дозы препарата записывали для каждой группы. После введения дозы препарата крыс возвращали в их клетки, где они затем имели доступ к пище и воде. Потребление пищи записывали индивидуально непрерывно путем он-лайн регистрации или вручную каждый час в течение 7 часов, а затем через 24 часа и иногда через 48 часов. В конце экспериментальной сессии животных умерщвляли.
Индивидуальные данные записывали в листы Microsoft Excel. Выбросы исключали после применения статистического теста для оценки выбросов с помощью критерия Граббса, и результат представляли графически с использованием программы GraphPad Prism.
АНАЛИЗ (II) - Функциональные анализы
Анализ (II)а - Анализ рецепторов кальцитонина и амилина человека
1. Схема люциферазного анализа
Активация рецепторов кальцитонина и амилина (коэкспрессия рецептора кальцитонина и белков, модифицирующих активность рецепторов (RAMP)) приводит к увеличению внутриклеточной концентрации цАМФ. Следовательно, транскрипция активируется промоторами, содержащими множественные копии цАМФ-зависимого элемента (CRE). Таким образом, можно измерить активность амилина, используя репортерный ген CRE-люциферазы, введенный в клетки ВНК, также экспрессирующие рецепторы кальцитонина или амилина.
2. Конструирование клеточной линии кальцитонин(а)- и амилин3(а)-рецептор/CRE-LUC.
Клеточную линию BHK570 стабильно трансфицировали человеческим рецептором кальцитонина и репортерного гена CRE-зависимой люциферазы. Клеточную линию также трансфицировали RAMP-3 с использованием стандартных способов. Это превращало рецептор кальцитонина в амилин3(а)-рецептор. Метотрексат, неомицин и гигромицин являются маркерами селекции для люциферазы, рецептора кальцитонина и RAMP-3, соответственно.
3. Люциферазные анализы
Для выполнения анализов активности клетки BHK кальцитонин(а)-рецептор- или амилин3(а)-рецептор/CRE-luc высевали в белые 96-луночные культуральные планшеты с плотностью примерно 20000 клеток/лунка. Клетки находились в 100 мкл ростовой среды (DMEM с 10% FBS, 1% Pen/Strep, 1 мМ Na-пируват, 250 нМ метотрексат, 500 мкг/мл неомицин и 400 мкг/мл гигромицин). После инкубации в течение ночи при 37°С и 5% CO2 ростовую среду заменяли на 50 мкл/лунку среды для анализа (DMEM (без фенолового красного), Glutamax™, 10% FBS и 10 мМ Hepes, pH 7,4). Далее добавляли 50 мкл/лунку стандарта или образца в буфере для анализа. Через 3 часа инкубации при 37°С и 5% CO2 среду для анализа со стандартом или образцом удаляли и заменяли на 100 мкл/лунку PBS. Далее добавляли 100 мкл/лунку LucLite™. Планшеты герметизировали и инкубировали при комнатной температуре в течение 30 минут. Наконец, измеряли люминесценцию на TopCounter (Packard) в режиме SPC (подсчет одиночных фотонов).
Анализ (II)b - Анализы рецепторов крысиного кальцитонина и крысиного амилина
Схема анализа цАМФ
Активация рецепторов кальцитонина и амилина (коэкспрессия рецептора кальцитонина и белков, модифицирующих активность рецепторов (RAMP)) приводит к увеличению внутриклеточной концентрации цАМФ. Для количественной оценки уровней цАМФ во временно трансфицированных клетках использовали анализ Adenylyl Cyclase Activation FlashPlate® от Perkin Elmer. Основной принцип анализа FlashPlate® заключается в конкуренции между радиоактивным и нерадиоактивным цАМФ, образованным клетками на фиксированном числе сайтов связывания.
Конструирование клеток с крысиным кальцитонин(а)- и амилин3(а)-рецептором.
Клетки ВНК tk'ts 13 временно трансфицировали крысиным кальцитонин(а)-рецептором или крысиным амилин3(а)-рецептором (крысиный кальцитонин(а)-рецептор + крысиный RAMP3) с помощью FuGENE® 6 (Roche) в соответствии с рекомендациями производителя.
Анализ цАМФ
Через 24 часа после временной трансфекции клетки (крысиный кальцитонин(а)- или крысиный амилин3(а)-рецепторные клетки) вносили (100000 клеток/лунка) в 96-луночный планшет FlashPlates® с образцами или стандартом в буфере для стимуляции FlashPlate с IBMX и инкубировали в течение 30 мин. Смесь для обнаружения готовили в соответствии с протоколом производителей, и через 3 часа инкубации измеряли сцинтилляцию на TopCounter™ (Packard).
АНАЛИЗ (III) - Анализ образования фибрилл ThT для оценки физической стабильности белковых составов
Низкая физическая стабильность полипептида может привести к образованию фибрилл амилоида, которые наблюдаются как хорошо упорядоченные нитевидные высокомолекулярные структуры в образце, в конечном итоге приводящие к образованию геля. Традиционно это измеряется при визуальном осмотре образца. Тем не менее, такого рода измерение является очень субъективным и зависит от наблюдателя. Таким образом, применение низкомолекулярного индикаторного зонда является гораздо более выгодным. Тиофлавин Т (ThT) является таким зондом и имеет отличающийся характер флуоресценции при связывании с фибриллами [Naiki et al. (1989) Anal. Biochem. 177, 244-249; LeVine (1999) Methods. Enzymol. 09, 274-284].
Временной ход формирования фибрилл может быть описан сигмоидальной кривой со следующим выражением [Nielsen et al. (2001) Biochemistry 40, 6036-6046]:
Здесь F является флуоресценцией ThT в момент времени t. Константа t0 представляет собой время, необходимое для достижения 50% максимальной флуоресценции. Двумя важными параметрами, которые описывают образование фибрилл, являются период задержки, который рассчитывается как t0 - 2τ, и кажущаяся константа скорости kapp=1/τ.
Формирование частично свернутого промежуточного продукта полипептида предлагается в качестве общего механизма, инициирующего образование фибрилл. Небольшое количество таких промежуточных продуктов образуют ядро, формируя матрицу, на которой могут собираться другие промежуточные продукты и формировать фибриллы. Время задержки соответствует интервалу, за который образуется критическая масса ядра, а кажущаяся константа скорости является скоростью, с которой формируется сам фибрилла.
Подготовка образца
Свежие образцы готовили перед каждым анализом. Каждый образец композиции описан в каждом примере. Значение рН образца доводили до желаемой величины с помощью соответствующего количества концентрированного NaOH и HClO4 или HCl. Тиофлавин Т добавляли к образцам из стокового раствора в H2O до конечной концентрации 1 мкМ.
Аликвоты образцов 200 мкл помещали в 96-луночный микротитровальный планшет (Packard OptiPlate™-96, белый полистирол). Как правило, в одну колонку лунок помещали четыре или восемь повторов каждого образца (соответствующих одному тестируемому условию). Планшет запечатывали с помощью Scotch Pad (Qiagen).
Инкубация и измерение флуоресценции
Инкубацию при заданной температуре, встряхивание и измерение флуоресценции ThT проводили во флуоресцентном планшетном ридере Fluoroskan Ascent FL или планшетном ридере Varioskan (Thermo Labsystems). Температуру доводили до 37°С. Скорость орбитального перемешивания доводили до 960 об/мин с амплитудой 1 мм во всех представленных данных. Измерение флуоресценции проводили с использованием возбуждения через фильтр 444 нм, а измерение излучения через фильтр 485 нм.
Каждый прогон начинали с инкубации планшета при анализируемой температуре в течение 10 мин. Планшет измеряли каждые 20 минут в течение желаемого периода времени. Между измерениями планшет встряхивали и нагревали, как описано выше.
Обработка данных
Точки измерения сохраняли в формате Microsoft Excel для дальнейшей обработки, построение кривой и подгонку проводили с использованием GraphPad Prism. Фоновое излучение от ThT в отсутствие фибрилл было незначительным. Точки данных, как правило, были средним значением от четырех или восьми образцов и показаны со стандартными планками погрешностей. На одном графике представлены только те данные, которые получены в одном и том же эксперименте (т.е. от образцов на одном планшете), что обеспечивает относительное измерение образования фибрилл между экспериментами.
Набор данных может быть установлен по уравнению (1). Тем не менее, так как в этом случае за время измерения не всегда достигаются полностью сигмоидальные кривые, степень образования фибрилл выражается как флуоресценция ThT, приведенная в таблице как среднее значение образцов и показанная со стандартным отклонением в различные моменты времени.
Измерение начальных и конечных концентраций
Концентрацию полипептида в каждом из анализируемых составов измеряли перед применением в анализе образования фибрилл ThT («начальный») и после завершения анализа образования фибрилл ThT («после ThT-анализа»). Концентрации определяли путем обратной HPLC с использованием стандарта прамлинтида в качестве референса. Перед измерением после завершения из каждого повтора отбирали 150 мкл и переносили в пробирку Эппендорфа. Центрифугировали их при 30000 g в течение 40 минут. Супернатанты фильтровали через фильтр 0,22 мкМ перед нанесением на систему HPLC.
АНАЛИЗ (IV) - Определение растворимости
Полипептид растворяли в воде при температуре примерно 500 нмоль/мл и смешивали 1:1 с серией буферов (100 мМ глицилглицина рН 3,0, 100 мМ глицилглицина рН 4,0, 100 мМ глицилглицина рН 5,0, 100 мМ бистриспропана рН 6,0, 100 мМ бистриспропана рН 6,5, 100 мМ бистриспропана рН 7,0, 100 мМ бистриспропана рН 7,5, 100 мМ бистриспропана рН 8,0). После 18 часов при комнатной температуре образцы центрифугировали и определяли концентрацию полипептида путем UPLC.
АНАЛИЗ (V) - Определение связывания с человеческим рецептором амилина
Анализ связывания проводили с использованием бусин для анализа сцинтилляционной близости (SPA) (RPNQ0001) от PerkinElmer, и использовали клеточные мембраны от клеток амилин3(а)/CRE-LUC (как описано в анализе (II)). Мембраны получали следующим образом: клетки промывали PBS и инкубировали с версеном в течение примерно 5 мин до сбора. Клетки промывали в PBS и клеточную суспензию центрифугировали в течение 5 мин со скоростью 1000 об/мин. Клетки гомогенизировали (Ultrathurrax) в буфере, содержащем 20 мМ Na-HEPES и 10 мМ EDTA (рН 7,4) и центрифугировали в течение 15 мин со скоростью 20000 об/мин. Полученный осадок ресуспендировали, гомогенизировали и центрифугировали (15 минут, 20000 об/мин) в буфере, содержащем 20 мМ Na-HEPES и 0,1 мм EDTA (рН 7,4, буфер 2). Полученный осадок ресуспендировали в буфере 2 и измеряли концентрацию белка (ВСА protein Assay, Pierce). Гомогенат держали в холоде в течение всей процедуры. Мембраны хранили при -80°С до использования. Анализ проводили в 384-луночном планшете Optiplate (PerkinElmer) в общем объеме 40 мкл. Мембраны смешивали со SPA-бусинами. Конечная концентрация мембран составляла 35 нг/мкл, а конечная концентрация SPA-бусин составляла 0,05 мг/лунка. Анализируемые соединения растворяли в DMSO и далее разводили в буфере для анализа (50 мМ Hepes, рН 7,4, 1 мМ CaCl2, 5 mM MgCl2, 0,1% ОА и 0,02% Tween20). 125I-меченый крысиный амилин (NEX448 PerkinElmer) растворяли в буфере для анализа и вносили в Optiplate в конечной концентрации 50 пМ/лунку (примерно 20000 cpm/10 мкл). Конечную смесь инкубировали со встряхиванием со скоростью 400 об/мин в течение 120 мин при 25°С перед центрифугированием (1500 об/мин, 10 минут). Образцы анализировали на TopCounter™ (Packard). IC50 рассчитывали как меру аффинности к рецептору, используя (конкурентный анализ связывания с одним сайтом) GraphPad Prism5.
АНАЛИЗ (VI) - Определение связывания с рецептором амилина крысы
Анализ проводили, как описано выше (Анализ (V) - Определение связывания с рецептором амилина человка) с тем исключением, что мы использовали мембраны, полученные из ВНК tk'ts 13-клеток, которые были временно трансфицированы рецептором крысиного кальцитонина и крысиного RAMP 3 в эквимолярном соотношении (1:2). ВНК tk'ts 13-клетки трансфицировали рецептором крысиного кальцитонина с помощью FuGENE® 6 (Roche) в соответствии с рекомендациями изготовителя. Клетки выращивали в DMEM с 10% FBS и 1% Pen/Strep. Примерно через 48 часов после трансфекции клетки собирали и получали мембраны.
АНАЛИЗ (VII) - Определение связывания с рецептором кальцитонина человека
Анализ связывания проводили с использованием бусин для анализа сцинтилляционной близости (SPA) (RPNQ0001) от PerkinElmer, а клеточные мембраны получали из ВНК tk'ts 13-клеточной линии, стабильно трансфицированной рецептором кальцитонина человека и репортерным геном CRE-зависимой люциферазы. Мембраны получали следующим образом: клетки промывали в PBS и инкубировали с версеном в течение примерно 5 мин до сбора. Клетки промывали в PBS и клеточную суспензию центрифугировали в течение 5 мин со скоростью 1000 об/мин. Клетки гомогенизировали (Ultrathurrax) в буфере, содержащем 20 мМ Na-HEPES и 10 мМ EDTA (рН 7,4) и центрифугировали в течение 15 мин со скоростью 20000 об/мин. Полученный осадок ресуспендировали, гомогенизировали и центрифугировали (20000 об/мин, 15 мин) в буфере, содержащем 20 мМ Na-HEPES и 0,1 мм EDTA (рН 7,4, буфер 2). Полученный осадок ресуспендировали в буфере 2 и измеряли концентрацию белка (ВСА protein Assay, Pierce). Гомогенат держали в холоде в течение всей процедуры. Мембраны хранили при -80°С до использования. Анализ проводили в 384-луночном планшете Optiplate (PerkinElmer) в общем объеме 40 мкл. Мембраны смешивали со SPA-бусинами. Конечная концентрация мембран составляла 35 нг/мкл, а конечная концентрация SPA-бусин составляла 0,05 мг/лунка. Анализируемые соединения растворяли в DMSO и далее разводили в буфере для анализа (50 мМ Hepes, рН 7,4, 1 мМ CaCl2, 5 mM MgCl2, 0,1% ОА и 0,02% Tween20). 125I-меченый кальцитонин (NEX422 PerkinElmer) растворяли в буфере для анализа и вносили в Optiplate в конечной концентрации 75 пМ/лунку (примерно 30000 cpm/10 мкл). Конечную смесь инкубировали со встряхиванием со скоростью 400 об/мин в течение 120 мин при 25°С перед центрифугированием (1500 об/мин, 10 минут). Образцы анализировали на TopCounter™ (Packard). IC50 рассчитывали как меру аффинности к рецептору, используя (конкурентный анализ связывания с одним сайтом) GraphPad Prism5.
АНАЛИЗ (VIII) - Определение связывания с рецептором кальцитонина крысы
Анализ проводили, как описано выше (Анализ (VII) - Определение связывания с рецептором кальцитонина человека) с тем исключением, что мы использовали мембраны, полученные из ВНК tk'ts 13-клеток, которые временно трансфицировали рецептором кальцитонина крысы. ВНК tk'ts 13-клетки трансфицировали рецептором кальцитонина крысы с помощью FuGENE® 6 (Roche) в соответствии с рекомендациями изготовителя. Клетки выращивали в DMEM с 10% FBS и 1% Pen/Strep. Примерно через 48 часов после трансфекции клетки собирали и получали мембраны.
АНАЛИЗ (IX) - pK - Определение T½ у мини-свиней
T½ является конечным периодом полужизни =ln2/λz соединения в плазме. λz является константой скорости первого порядка, связанной с конечной (логлинейной) частью кривой «концентрация в плазме - время», и оценивается с помощью линейной регрессии времени в зависимости от логарифма концентрации.
Значения T½ аналогов амилина изобретения определяли с помощью фармакокинетических исследований у самцов геттингенских мини-свиней из Ellegaard Gottingen Minipigs ApS, следуя принципам ухода за лабораторными животными.
Перед тем как животных включали в исследование, проводилась акклиматизация в течение примерно 6-10 дней. В начале периода акклиматизации мини-свиньи были в возрасте примерно 5-12 месяцев, а их вес находился в диапазоне 7-35 кг. Мини-свиньям вставляли два центральных венозных катетера, которые использовали для забора крови.
Исследования проводили в комнате для животных, в которой освещение было цикличным: примерно 12 часов света и 12 часов темноты. Животных содержали по отдельности.
Во время исследования животные имели свободный доступ к питьевой воде домашнего качества, но, как правило, они не получали корм в течение ночи перед введением дозы препарата и примерно 6-12 часов после введения дозы препарата. Животных взвешивали по прибытии и в дни введения дозы препарата.
В данных исследованиях анализируемые вещества вводили подкожно в дозе примерно 2 нмоль/кг. Животные получали одну подкожную инъекцию. Подкожные инъекции делали на правой стороне шеи, примерно в 5-7 см от уха и 7-9 см от середины шеи. Инъекции проводили с заглушкой на игле, чтобы вводить иглу примерно на 0,5 см. Каждое анализируемое вещество, как правило, вводили трем, но в некоторых случаях двум или четырем животным.
Для каждого животного получали полный профиль «концентрация в плазме - время», используя 12-16 точек забора образца. Например, образцы крови собирали в соответствии со следующим графиком:
После подкожного введения:
Перед введением дозы (0), 0,5, 1, 2, 4, 6, 8, 12, 24, 48, 72, 96, 120, 168 и 240 часов после инъекции.
В некоторых случаях также отбирали дополнительные образцы крови вплоть до 288 часов после инъекции.
Во время каждого забора образца у каждого животного отбирали 0,5-2 мл крови. Образцы крови отбирали через центральный венозный катетер.
Образцы крови собирали в пробирки для анализа с EDTA (Sarstedt Micro tube 1,3 мл K3E). Образцы крови хранили на льду в течение максимум 20 минут до центрифугирования. Плазму отделяли путем центрифугирования (4°С, 10 мин., 1500 g) и сразу же переносили в пробирки Micronic. В каждую пробирку Micronic переносили примерно 200 мкл плазмы. Плазму хранили при -20°С до анализа. Образцы плазмы анализировали на содержание амилина с помощью ELISA.
Профили «концентрация в плазме - время» анализировали с помощью фармакокинетического анализа без компартментализации (NCA), используя WinNonlin Professional 5.0 (Pharsight Inc., Маунтин-Вью, Калифорния, США). NCA проводили с использованием отдельных профилей «концентрация в плазме - время» от каждого животного. T½ является конечным временем полужизни =ln2/λz, и оценивается из λz, константой скорости первого порядка, связанной с конечной (логлинейной) частью кривой «концентрация в плазме - время», оцениваемой по линейной регрессии времени в зависимости от логарифма концентрации.
ELISA для количественной оценки амилина в плазме
ELISA на человеческий амилин представляет собой иммуноанализ «сэндвич»-типа, основанный на применении моноклонального антитела для определения уровней амилина в плазме человека. Антитело захвата распознает человеческий амилин, амилиновую кислоту (дезамидированный амилин), фрагмент амилина 1-20, но не восстановленный амилин. Антитело обнаружения связывается с восстановленным или невосстановленным человеческим амилином, но не с амилиновой кислотой, и образует комплекс с конъюгатом стрептавидин-щелочной фосфатазы. Субстрат, 4-метилумбеллиферила фосфат, добавляют к полному «сэндвичу», и флуоресцентный сигнал, контролируемый при 355 нм/460 нм, является пропорциональным количеству амилина, присутствующего в образце.
MS-методика количественной оценки амилина
40 мкл плазмы разводили в 120 мкл 66,67% EtOH + 1% НСООН и перемешивали. Центрифугировали в течение 20 мин со скоростью 13000 об/мин, 4°С. Супернатант анализировали путем LC-MS на Sciex API 3000 и количественно оценивали с помощью стандарта в плазме.
АНАЛИЗ (X) - pK - Определение T½ у крыс
T½ является конечным периодом полужизни =ln2/λz соединения в плазме. λz является константой скорости первого порядка, связанной с конечной (логлинейной) частью кривой «концентрация в плазме - время», и оценивается с помощью линейной регрессии времени в зависимости от логарифма концентрации.
Значения T½ аналогов амилина изобретения определяли с помощью фармакокинетических исследований у самцов крыс Sprague Dawley от Taconic Europe, следуя принципам ухода за лабораторными животными.
Перед тем как животных включали в исследование, проводилась акклиматизация в течение примерно 7 дней. В начале периода акклиматизации вес крыс находился в диапазоне 300-400 г. Крысам вставляли постоянные катетеры в a. carotis (сонную артерию), которые использовали для забора крови.
Исследования проводили в комнате для животных, в которой освещение было цикличным: 12 часов света и 12 часов темноты. Животные содержались по отдельности из-за катетеров и имели доступ к корму и воде без ограничения. Животных взвешивали в дни введения дозы препарата.
В данных исследованиях анализируемые вещества вводили подкожно в дозе примерно 20 нмоль/кг. Животные получали одну подкожную инъекцию в шею с помощью шприца с иглой 25G. Каждое анализируемое вещество, как правило, вводили трем, но в некоторых случаях двум или четырем животным.
Для каждого животного получали полный профиль «концентрация в плазме - время», используя 8-10 точек забора образца. Например, образцы крови собирали в соответствии со следующим графиком:
После подкожного введения:
Перед введением дозы 0,5, 1, 1,5, 2, 4, 6, 12, 24, 48 и 72 часа после инъекции.
Во время каждого забора образца у каждого животного отбирали 0,08-0,10 мл крови. Образцы крови отбирали через катетер.
Образцы крови собирали в пробирки для анализа с EDTA. Образцы крови хранили на льду в течение максимум 20 минут до центрифугирования. Плазму отделяли путем центрифугирования (4°С, 10 мин., 1500 g) и сразу же переносили в пробирки Micronic или планшеты для ПЦР. Переносили примерно 40 мкл плазмы и сохраняли ее при -20°С до анализа. Образцы плазмы анализировали на содержание амилина с помощью ELISA.
Профили «концентрация в плазме - время» анализировали с помощью фармакокинетического анализа без компартментализации (NCA), используя WinNonlin Professional 5.0 (Pharsight Inc., Маунтин-Вью, Калифорния, США). NCA проводили с использованием отдельных профилей «концентрация в плазме - время» от каждого животного. T½ является конечным временем полужизни =ln2/λz, и оценивается из λz, константой скорости первого порядка, связанной с конечной (логлинейной) частью кривой «концентрация в плазме - время», оцениваемой по линейной регрессии времени в зависимости от логарифма концентрации.
Препараты
Полипептидные последовательности получали в соответствии с описанным ниже полипептидным синтезом, а соединения, представленные в таблицах (например, Табл. 10), получали в соответствии с описанным ниже синтезом.
Одним из способов полипептидного синтеза был синтез с помощью Fmoc-химической реакции в полипептидном синтезаторе Liberty на микроволновой основе (СЕМ Corp., Северная Каролина). Смолой был Tentagel S RAM с загрузкой примерно 0,25 ммоль/г или PAL-ChemMatrix с загрузкой примерно 0,43 ммоль/г. Химическую реакцию связывания проводили с помощью DIC/HOAt в NMP с использованием аминокислотного раствора 0,3 М в NMP и молярного избытка в 6-8 раз. Условия связывания были следующими: 5 минут при 70°С. Удаление защитной группы проводили с помощью 5% пиперидина в NMP при 70°С. Используемыми защитными аминокислотами были стандартные Fmoc-аминокислоты (поставляемые, например, AnaSpec или Novabiochem), растворенные в концентрации 0,3 М в NMP, содержащем 0,3 М HOAt.
Другим способом полипептидного синтеза был синтез с помощью Fmoc-химической реакции в полипептидном синтезаторе Prelude (Protein Technologies, Аризона). Смолой был Tentagel S RAM с загрузкой примерно 0,25 ммоль/г или PAL-ChemMatrix с загрузкой примерно 0,43 ммоль/г. Химическую реакцию связывания проводили с помощью DIC/HOAt в NMP с использованием аминокислотного раствора 0,3 М в NMP и молярного избытка в 6-8 раз. Условия связывания были следующими: одинарное или двойное связывание в течение 1 или 2 часов при комнатной температуре. Удаление защитной группы проводили с помощью 20% пиперидина в NMP. Используемыми защитными иаминокислотами были стандартные Fmoc-аминокислоты (поставляемые, например, Anaspec или Novabiochem), растворенные в концентрации 0,3 М в NMP, содержащем 0,3 М HOAt.
Другой способ полипептидного синтеза осуществлялся на полипептидном синтезаторе Applied Biosystems 433 в масштабе 0,25 ммоль или 1,0 ммоль с использованием протоколов FastMoc UV, предоставленных изготовителем, в которых используется HBTU- или HATU-опосредованное связывание в NMP и УФ-мониторинг удаления защитной Fmoc-группы. Исходной смолой, используемой для синтеза амидов полипептидов, была смола Rink-Amide. Используемыми производными защитных аминокислот были стандартные Fmoc-аминокислоты (поставляемые, например, Anaspec или Novabiochem), поставляемые в предварительно взвешенных картриджах, подходящих для синтезатора ABI433A.
Когда была необходима химическая модификация боковой цепи лизина, лизин встраивали как Lys(Mtt), a N-концевую аминокислоту либо встраивали в последовательность как Вос-аминокислоту, либо, если N-концевую аминокислоту встраивали как Fmoc-аминокислоту, то Fmoc-группу удаляли, и N-конец защищали путем обработки 6 эквивалентами Вос-карбоната и 6 эквивалентами DIPEA в NMP в течение 30 минут. Смолу промывали в NMP и DCM, и группу Mtt удаляли путем суспендирования смолы в чистом гексафторизопропаноле в течение 20 минут с последующим промыванием DCM и NMP. Химическую модификацию лизина проводили путем добавления одного или более чем одного структурного блока, перечисленных ниже, теми же способами, которые использовались для полипептидного синтеза, т.е. с помощью одного или более чем одного автоматизированного этапа на Liberty или ABI 433 или одного или более чем одного этапа ручного связывания при комнатной температуре. После синтеза смолу промывали в DCM и сушили, и отщепляли полипептид от смолы путем 2-часовой обработки TFA/TIPS/водой (92,5/5/2,5 или 95/2,5/2,5) с последующим осаждением четырьмя объемами диэтилэфира, затем промыванием диэтилэфиром и высушиванием. Если полипептид содержал цистеины, защищенные Acm-группами, то полипептид снова растворяли в воде в концентрации 2-5 мг/мл, рН доводили до менее 4 и формировали дисульфидный мостик путем обработки четырьмя эквивалентами йода (2% вес/объем в метаноле) в течение 15 минут. Альтернативно, дисульфидный мостик формировали на смоле с использованием Trt в качестве защитной группы для цистеина и обработкой десятью эквивалентами йода в NMP в течение 1 часа. В этом случае неочищенный полипептид очищали непосредственно после расщепления и осаждения диэтилэфиром.
Очистка: неочищенный полипептид очищали путем полупрепаративной HPLC на колонке 20 мм × 250 мм, заполненной либо 5u, либо 7u С-18-диоксида кремния. Полипептидные растворы перекачивали в колонку HPLC и осажденные полипептиды растворяли в 5 мл 50% уксусной кислоты в воде, разбавляли до 20 мл водой и вводили в колонку, затем элюировали градиентом 40-60% CH3CN в 0,1% TFA 10 мл/мин в течение 50 мин при 40°С. Собирали фракции, содержащие полипептид. Очищенный полипептид лиофилизировали после разбавления элюата водой.
Для анализа HPLC-фракций и конечного продукта проводили анализ RP-HPLC с использованием УФ-детекции при 214 нм и, например, колонки с С-18-диоксидом кремния Vydac 218TP54 4,6 мм × 250 мм 5 u (The Separations Group, Гесперия, США) и элюировали, например, 1 мл/мин при 42°С. Чаще всего использовали одно из четырех различных условий элюирования:
А1: Уравновешивание колонки буфером, состоящим из 0,1 М (NH4)2SO4, который доводили до рН 2,5 с помощью концентрированной H2SO4, и элюирование градиентом от 0% до 60% CH3CN в том же буфере в течение 50 мин.
В1: Уравновешивание колонки 0,1% TFA/H2O и элюирование градиентом от 0% CH3CN/0,1% TFA/H2O до 60% CH3CN/0,1% TFA/H2O в течение 50 мин.
В6: Уравновешивание колонки 0,1% TFA/H2O и элюирование градиентом от 0% CH3CN/0,1% TFA/H2O до 90% CH3CN/0,1% TFA/H2O в течение 50 мин.
Альтернативно анализ RP-HPLC проводили с использованием УФ-детекции при 214 нм и колонки С-18-диоксида кремния Symmetry300, 3,6 мм × 150 мм, 3,5 u (Waters), элюируя при 1 мл/мин и 42°С.
В4: Уравновешивание колонки 0,05% TFA/H2O и элюирование градиентом от 5% CH3CN/0,05% TFA/H2O до 95% CH3CN/0,05% TFA/H2O в течение 15 мин.
Идентичность полипептида подтверждали путем MALDI-MS на Bruker Microflex.
Полученные полипептиды показаны в Табл. 10 (представлена ранее):
Наблюдения
Все ссылки, включая публикации, патентные заявки и патенты, приведенные в данном документе, настоящим включены путем ссылки в той же степени, как если бы каждая ссылка была отдельно и конкретно указана, и должны быть включены путем ссылки и изложены целиком в данном документе (в максимальной степени, разрешенной законом).
Все заголовки и подзаголовки используются в данном документе только для удобства и не должны быть истолкованы как ограничивающие изобретение ни в каком случае.
Любые использованные или все примеры или обороты (например «такой как»), содержащиеся в данном документе, предназначены только для лучшего освещения изобретения и не ставят ограничений в сфере применения изобретения, если не утверждается иное. Никакие обороты в описании не должны толковаться как указывающие на то, что какой-либо элемент, не включенный в формулу изобретения, является необходимым для осуществления изобретения.
Цитирование и вставление в данный документ патентных документов делается только для удобства и не отражает какой-либо связи с обоснованностью, патентоспособностью и/или законной силой этих патентных документов.
Данное изобретение включает в себя все модификации и эквиваленты объектов изобретения, включенных в формулу изобретения в соответствии с разрешением действующего законодательства.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID №1
Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Ala-Ile-Leu-Ser-Ser-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr
SEQ ID №2
Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Pro-Ile-Leu-Pro-Pro-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr
SEQ ID №3
Xaa1-Cys-Xaa3-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Xaa14-Phe-Leu-Xaa17-Xaa18-Ser-Ser-Хаа21-Хаа22-Phe-Gly-Pro-Xaa26-Leu-Pro-Pro-Thr-Xaa31-Val-Gly-Ser-Хаа35-Thr-Pro