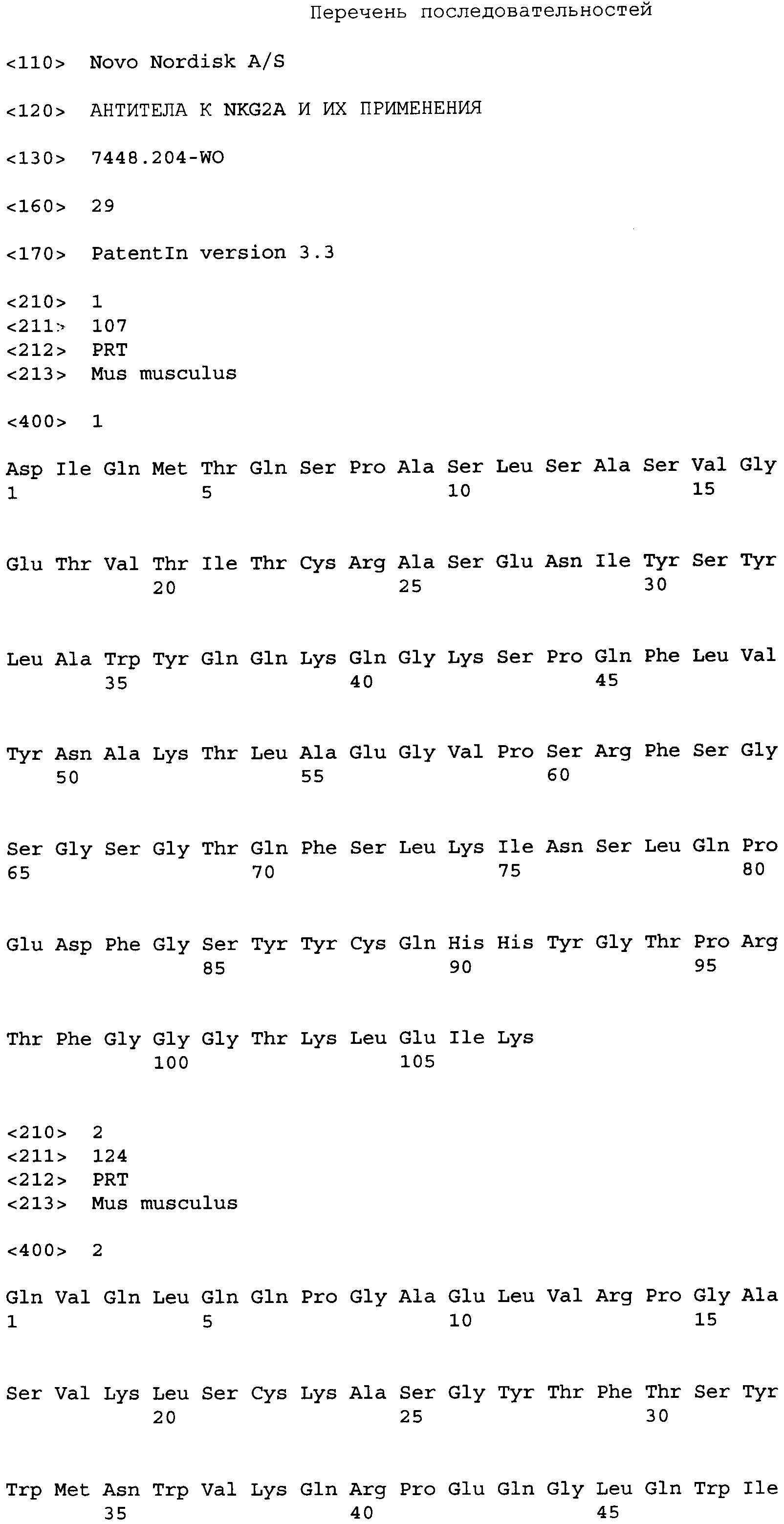Результат интеллектуальной деятельности: АНТИТЕЛА К NKG2A И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к анти-NKG2A антителам, в частности к гуманизированным версиям мышиных анти-NKG2A антител Z270, а также к способам получения и применения таких антител.
УРОВЕНЬ ТЕХНИКИ
CD94/NKG2A представляет собой цитотоксический ингибиторный рецептор, находящийся на субпопуляциях НК-, НКТ- и Т-клеток, который ограничивает уничтожение ими клеток, экспрессирующих CD94/NKG2A-лиганд HLA-E (см., например, WO99/28748). Антитела, которые ингибируют CD94/NKG2A, могут увеличивать цитолитическую активность опухолеспецифичных лимфоцитов против опухолевых клеток. Таким образом, терапевтические антитела, которые ингибируют CD94/NKG2A у онкологических больных без уничтожения CD94/NKG2A-экспрессирующих клеток, могут контролировать опухолевый рост. Кроме того, некоторые виды лимфом, например, такие как НК-лимфома, характеризуются CD94/NKG2A-экспрессией. У таких пациентов терапевтические антитела, которые поражают и уничтожают CD94/NKG2A-экспрессирующие клетки, могут ликвидировать опухолевые клетки. Анти-NKG2A антитела также были предложены для использования в лечении аутоиммунных и воспалительных заболеваний (см., например, US20030095965A1, WO2006070286).
Различные антитела против CD94/NKG2A были описаны в этой области. Например, Sivori и др. (Eur J Immunol 1996; 26:2487-92) обращаются к мышиному анти-NKG2A антителу Z270; Carretero и др. (Eur J Immunol 1997; 27:563-7) описывают мышиное aнти-NKG2A антитело Z199 (в настоящее время коммерчески доступное через Coulter, Inc., продукт № IM2750, США); Vance и др. (J Exp Med 1999:190: 1801-12) обращаются к мышиным анти-NKG2-20D5 антителам (в настоящее время коммерчески доступны через BD Biosciences Pharmingen, Catalog No. 550518, USA), а публикация патентной заявки США 20030095965 описывает мышиные антитела 3S9, которые предположительно связываются с NKG2A, NKG2C и NKG2E.
Доступные в настоящее время анти-CD94/NKG2A антитела являются антителами нечеловеческого происхождения, что делает их непригодными для большей части способов терапевтического применения у людей в связи с их иммуногенностью. Хотя доступны простые подходы к гуманизации, такие, например, как CDR-прививка, но, как правило, для получения оптимального гуманизированного варианта необходим индивидуальный подход к гуманизации, уменьшающий иммуногенность, но при этом в достаточной степени сохраняющий или улучшающий функциональные свойства. Соответственно, существует потребность в анти-СВ94/NKG2A антителах, которые подходят для лечения людей.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предлагает анти-NKG2A антитела, а также композиции, содержащие такие антитела, а также способы получения и использования таких антител. В одном воплощении антитело является гуманизированной версией мышиного анти-NKG2A антитела Z270, обозначенной в данном документе как "humZ270". В другом воплощении антитело является гуманизированной версией анти-NKG2A антитела, имеющей в существенной степени идентичные с Z270 вариабельные домены тяжелых цепей (VH) и/или вариабельные домены легких цепей (VL).
Представлены типичные остатки участков, определяющих комплементарность (CDR), и/или сайты для аминокислотных замен в каркасном участке (framework region, FR) и/или в таких антителах для получения антител с улучшенными свойствами, такими как, например, более низкая иммуногенность, усиленное связывание антигенов или другие функциональные свойства, и/или с улучшенными физико-химическими свойствами, такими как, например, увеличение стабильности. В одном аспекте изобретение предлагает гуманизированные антитела, в которых по меньшей мере часть CDR Кабата идентична соответствующей части человеческой акцепторной последовательности. В одном воплощении человеческая акцепторная каркасная последовательность не включает никаких аминокислотных замен или бэк-мутаций. В другом воплощении человеческая каркасная последовательность включает по меньшей мере одну аминокислотную замену. Позиции по Кабату для таких типичных аминокислотных замен включают 5, 66, 67, 69, 71, 73 и 75 в каркасном участке домена VH, 46 и 48 в каркасном участке домена VL и 60, 63, 64 и 65 в CDR-H2.
В других аспектах изобретение предлагает фармацевтические композиции, содержащие такие антитела и носитель, а также иммуноконъюгаты, содержащие такие антитела, конъюгированные с цитотоксическим или обнаруживаемым агентом.
В других аспектах изобретение предлагает нуклеиновые кислоты и векторы, кодирующие такие антитела, а также принимающие клетки, содержащие такие нуклеиновые кислоты и/или векторы. Также предложены рекомбинантные способы получения анти-NKG2A антител путем культивирования таких принимающих клеток с тем, чтобы продуцировать нуклеиновые кислоты.
В других аспектах изобретение предлагает изделия, содержащие контейнер, содержащий такие анти-NKG2A антитела, и инструкции с руководством пользователя для лечения у пациента заболеваний, таких как рак или вирусные заболевания. Возможно, изделие может содержать другой контейнер, содержащий другой агент, и инструкцию с руководством пользователя для лечения заболевания антителом в сочетании с агентом.
Изобретение также предлагает способы использования таких анти-NKG2A антител в лечении заболеваний, таких как рак, вирусные заболевания, воспалительные или аутоиммунные нарушения у пациента, возможно в сочетании с другим противораковым, противовирусным или противовоспалительным агентом.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
Фиг.1 показывает согласование Z270VL и Z270VH с выбранными зародышевыми V- и J-сегментами и типичными последовательностями humZ270VL1 (SEQ ID NO:4) и humZ270VH1 (SEQ ID NO:5) с нумерацией аминокислотных остатков в соответствии со схемой Кабата (Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD.). Матричные остатки затенены в схеме Кабата; остатки CDR выделены жирным шрифтом в схеме Кабата; мышиные/зародышевые различия затенены в последовательностях VKI_02/JK4 (SEQ ID NO:9) и VH1_18/JH6 (SEQ ID NO:10); остатки потенциальных бэк-мутаций затенены в последовательностях humZ270VH/VL. Выявленные потенциальные бэк-мутации в VL были L46F и I48V. Выявленные потенциальные бэк-мутации в тяжелой цепи были V5Q, M69L, T71V, Т73К и T75S. Также показаны полученные в результате консенсусные последовательности humZ270VL («humZ270VL1 cons»; SEQ ID NO:6) и humZ270VH1 («humZ270VH1 cons»; SEQ ID NO:7). В humZ270VL1 cons аминокислота в позиции 46 представляет собой L или F, аминокислота в позиции 48 представляет собой I или V. В humZ270VH1 cons аминокислота в позиции 5 представляет собой V или Q; аминокислота в позиции 69 представляет собой М или L; аминокислота в позиции 71 представляет собой Т или V; аминокислота в позиции 73 представляет собой Т или K и/или аминокислота в позиции 75 представляет собой Т или S. В альтернативных humZ270VH1, humZ270VH1 cons2 (SEQ ID NO:8) аминокислота в позиции 5 представляет собой V или Q; аминокислота в позиции 60 представляет собой S или А; аминокислота в позиции 63 представляет собой L или F; аминокислота в позиции 64 представляет собой Q или K; аминокислота в позиции 65 представляет собой G или D; аминокислота в позиции 66 представляет собой R или K; аминокислота в позиции 67 представляет собой V или А; аминокислота в позиции 69 представляет собой М или L; аминокислота в позиции 71 представляет собой Т или V; аминокислота в позиции 73 представляет собой Т или K и/или аминокислота в позиции 75 представляет собой Т или S.
Фиг.2 показывает CDR типичного антитела humZ270 в соответствии с определениями Кабата. Различия при сравнении с мышиными CDRs 2270 выделены жирным шрифтом.
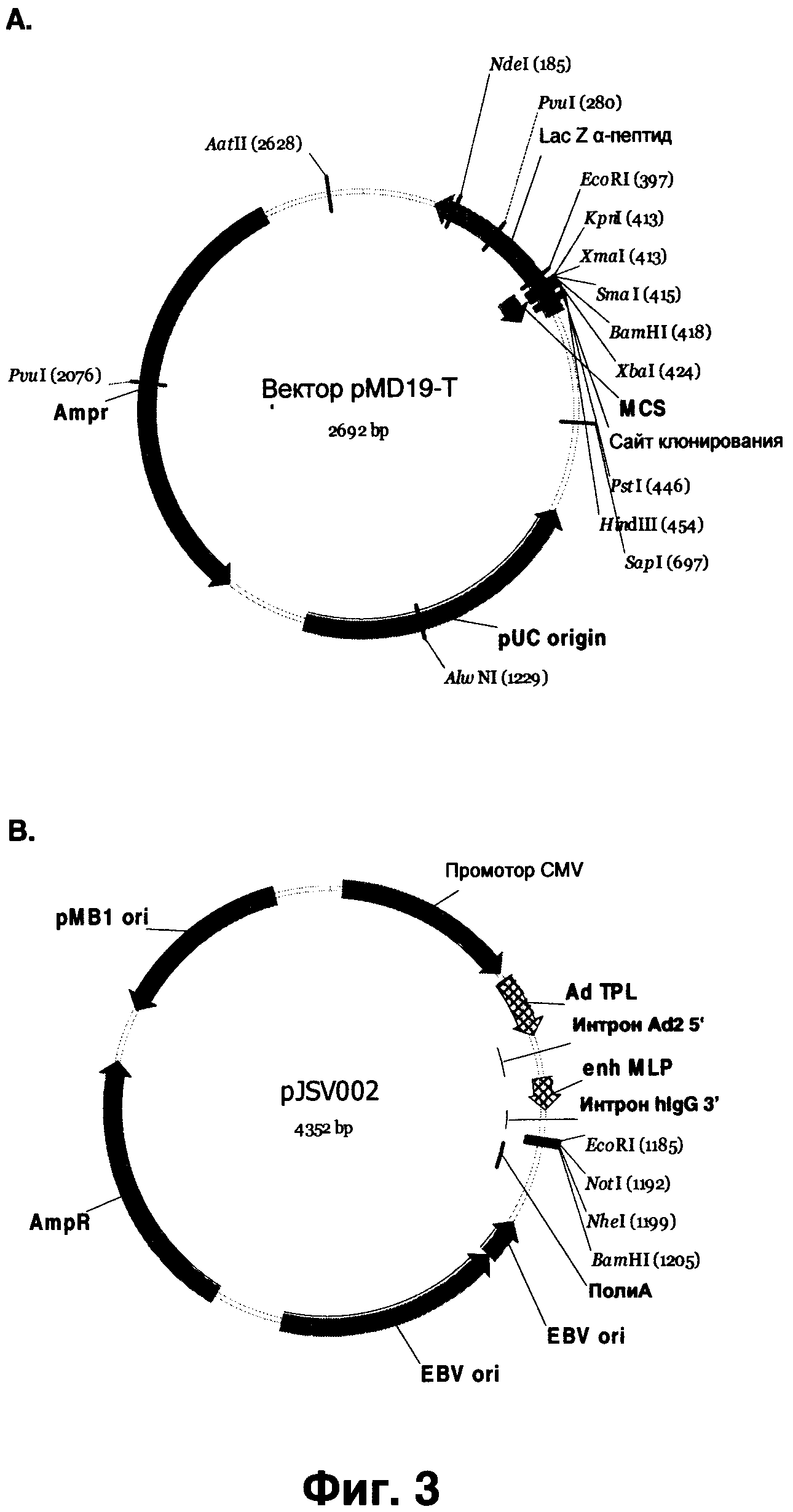
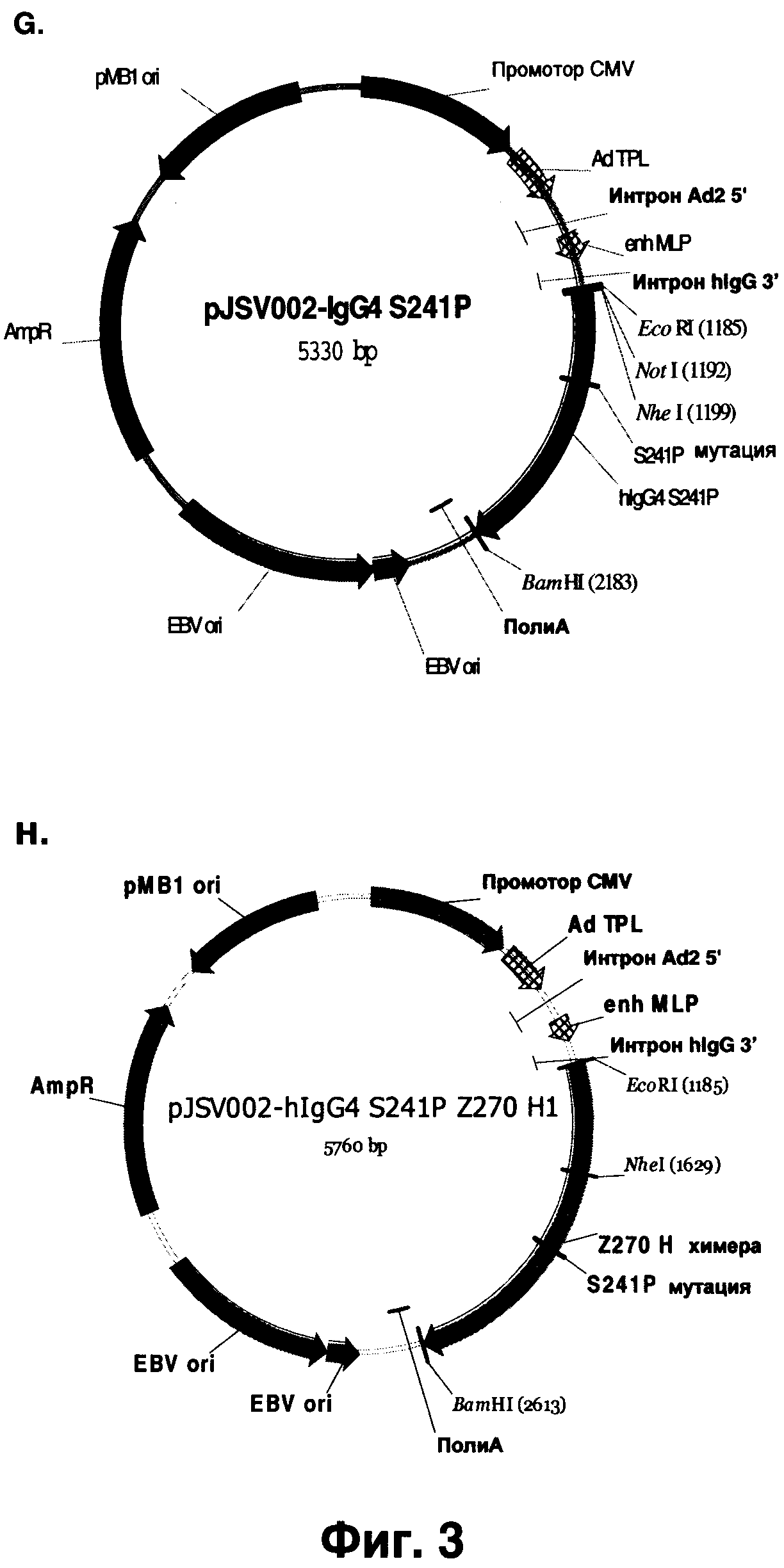
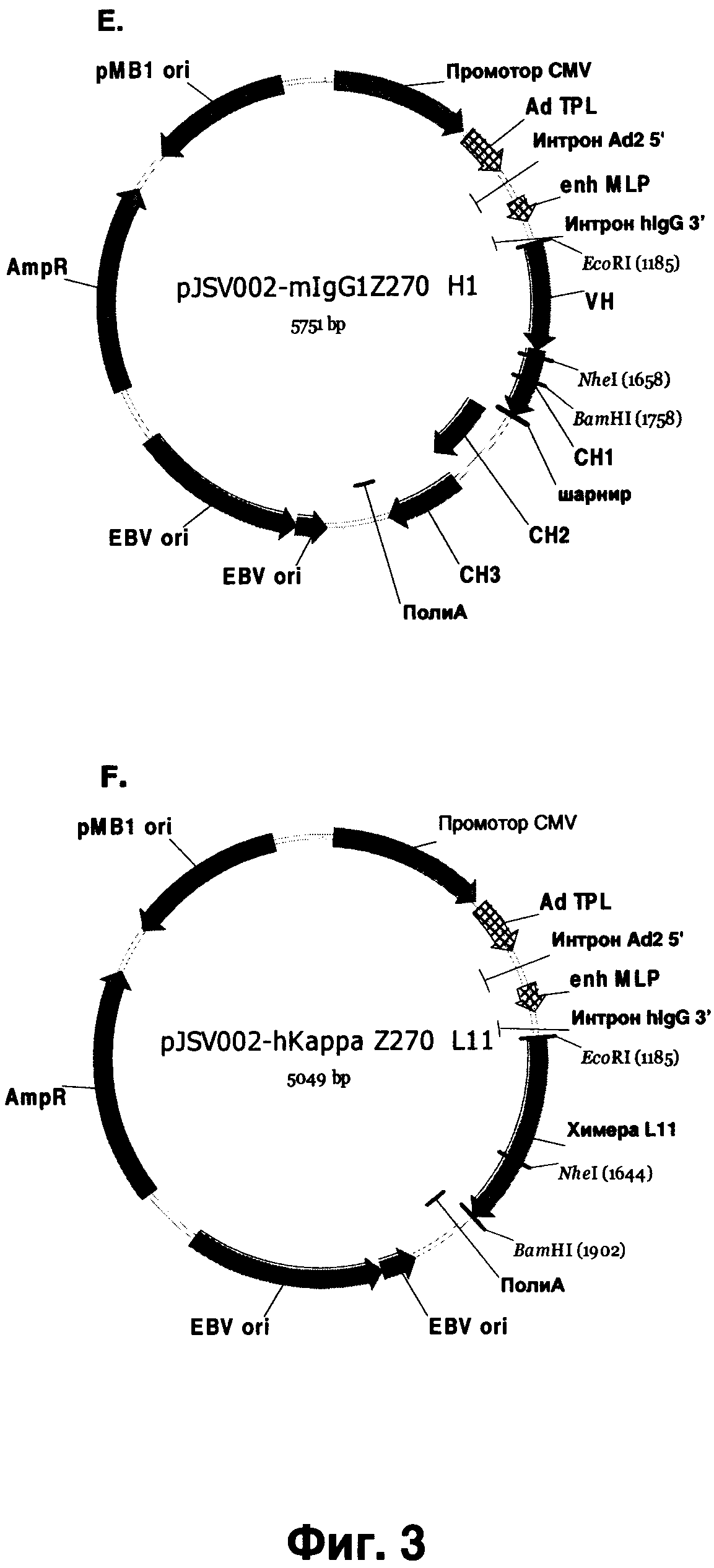
Фиг.3А-Н показывает плазмиды, приведенные в разделе Примеры. (А) pMD19-T векторная карта для клонирования в Т-вектор (ТА cloning). (В) карта клонирующего вектора pJSV002 для транзиентной экспрессии. (С) Легкая цепь, вставленная в pJSV002 с мышиным константным каппа-регионом. (D) Вариант pJSV002-mlgG1, содержащий мышиный константный регион lgG1. (E) pJSV002-mlgG1 Z270 H1, содержащий вариабельный регион тяжелой цепи Z270 и константный регион тяжелой цепи lgG1. (F) pJSV002-hKappa Z270 L11, содержащий вариабельный регион легкой цепи и константный регион человеческой каппа-цепи. (G) pJSV002-lgG4-S241P. (H) pJSV002-lgG4-S241PZ270H1.
Фиг.4 показывает различные последовательности, полученные из Z270, от (А) до (J), SEQ ID NOS:14-23 соответственно, или основанные на них. См. подробности в Примерах 2-5.
Фиг.5 показывает типичный дизайн вектора для экспрессии гуманизированных тяжелых цепей Z270.
Фиг.6 показывает типичный дизайн вектора для экспрессии гуманизированных легких цепей Z270.
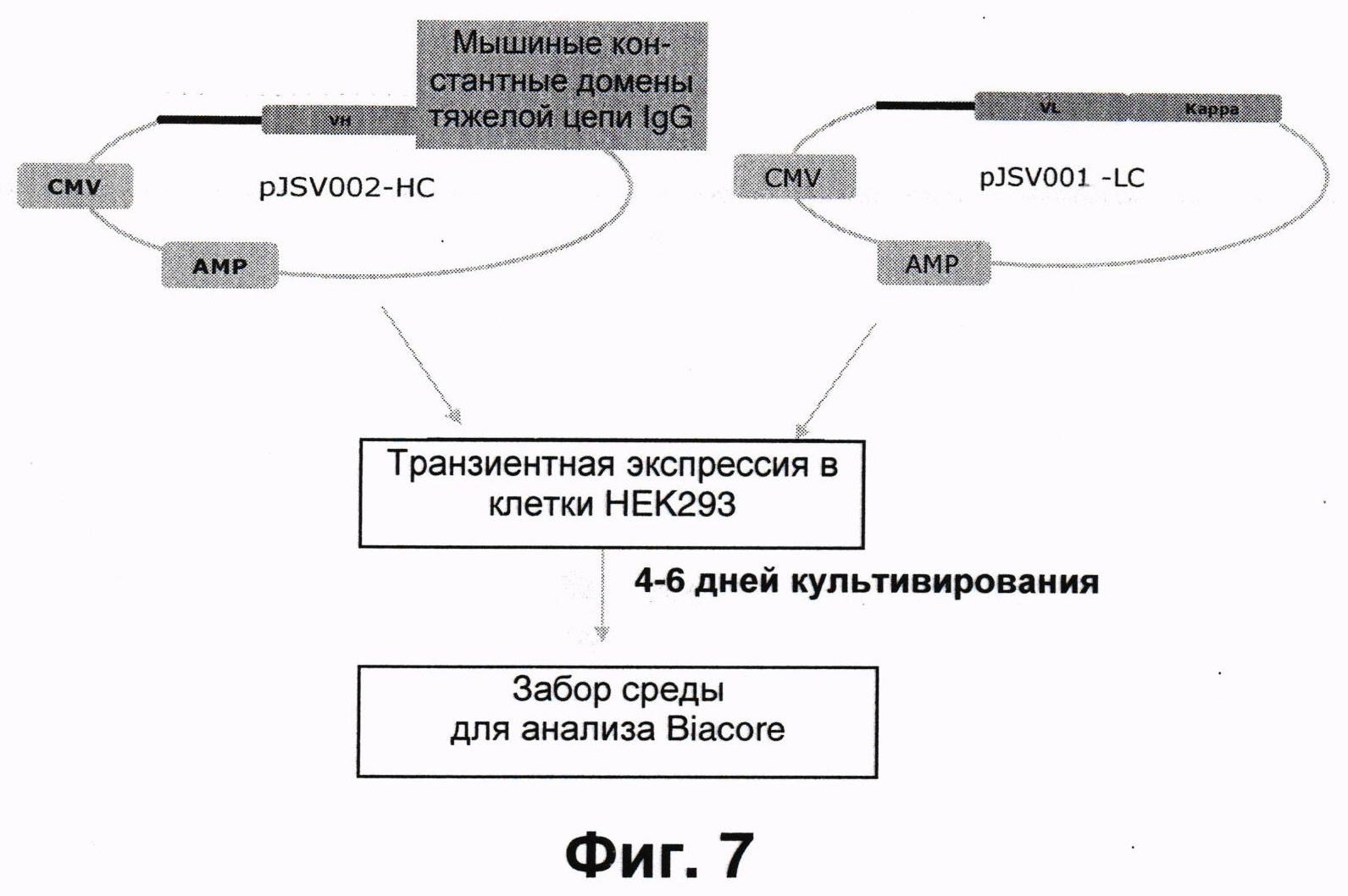
Фиг.7 показывает в общих чертах типичное проведение транзиентной экспрессии гуманизированных антител Z270 в клетках НЕК293.
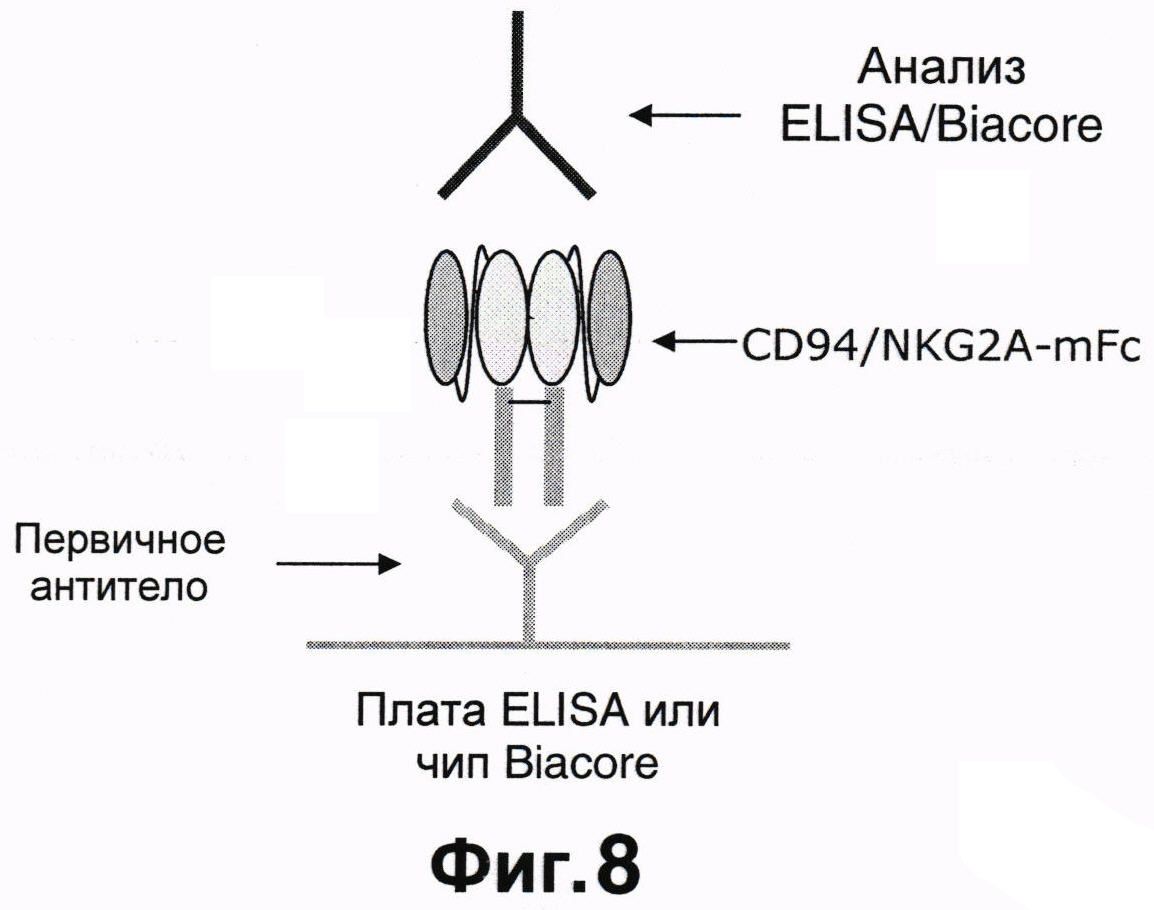
Фиг.8 показывает типичный анализ Biacore для определения humZ270, аффинно связывающегося с антигеном.
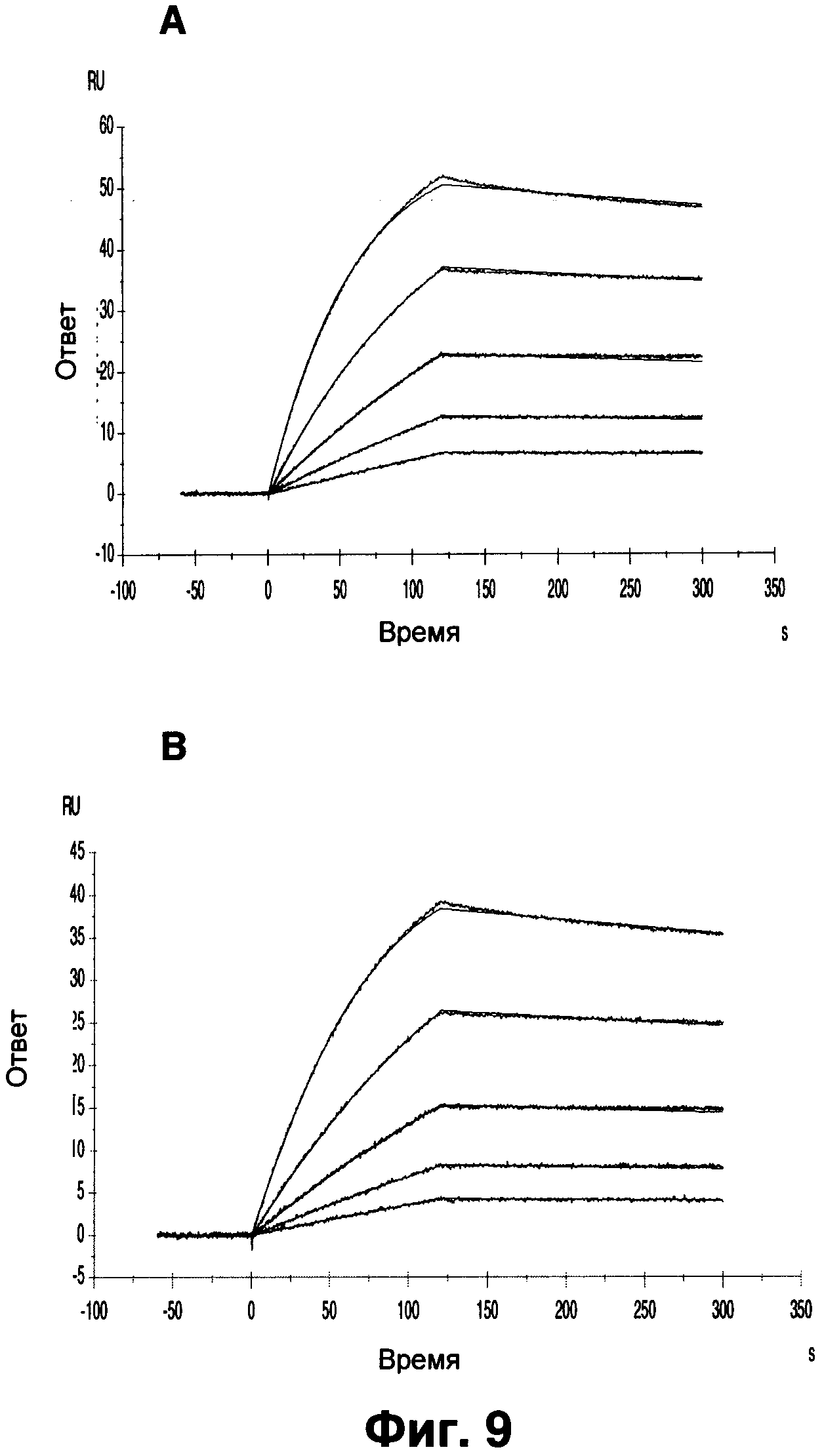
Фиг.9 показывает детерминанты аффинности химерного Z270 (А) и humZ270VL1/VH1 (В).
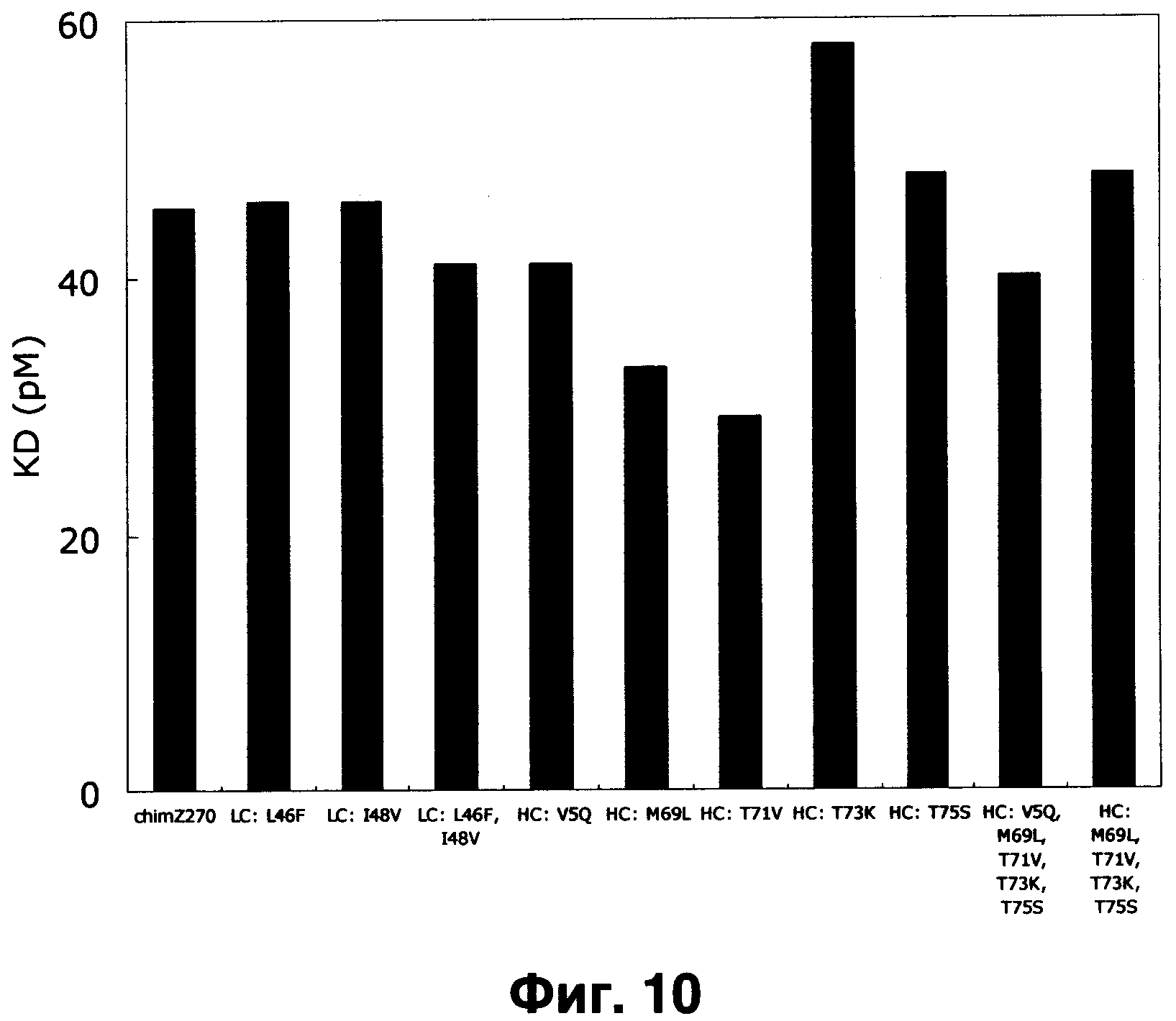
Фиг.10 показывает детерминанту аффинности humZ270VL1/VH1, имеющего различные бэк-мутации в легкой или тяжелой цепях. Химерный Z270 используется для сравнения.
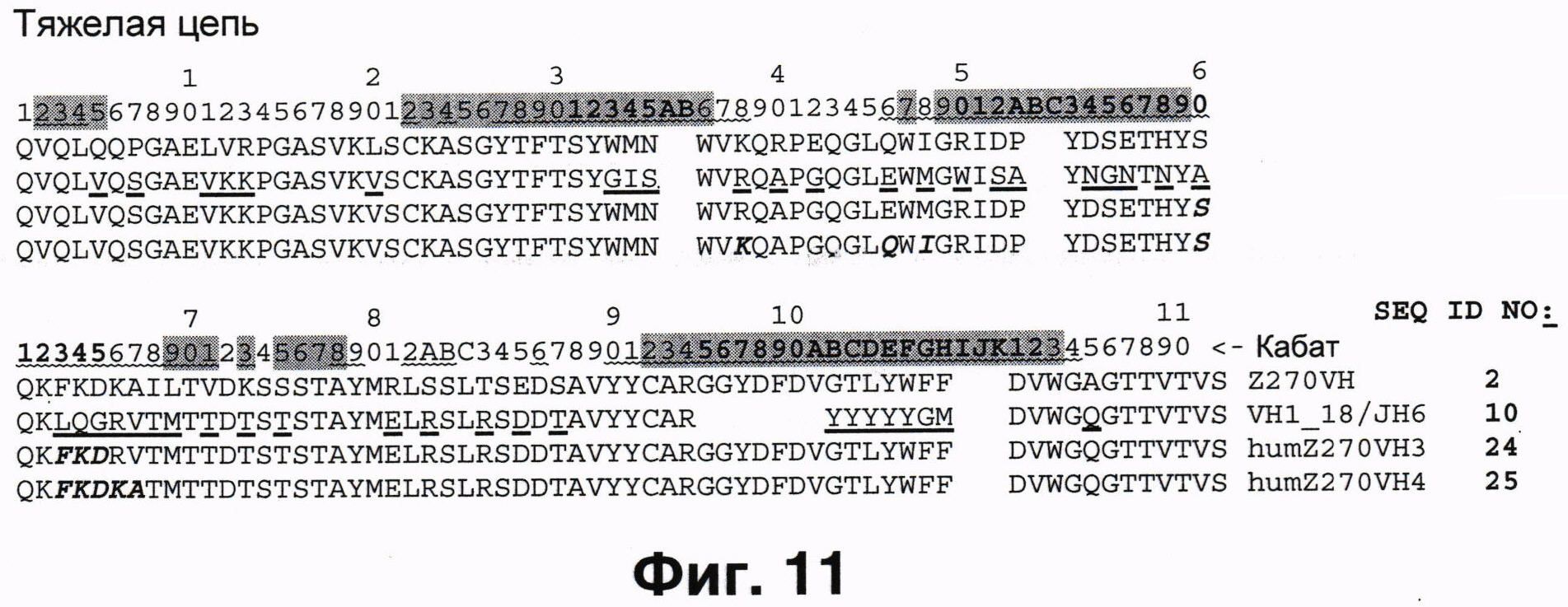
Фиг.11 показывает стратегию стандартной CDR-прививки мышиных CDRs Кабата Н1-Н3 в акцепторный каркас тяжелой цепи VH1_18/JH6, без (humZ270H3) или с (humZ270VH4) бэк-мутациями.
Фиг.12 показывает соответствие между конструкциями humZ270VH в различных человеческих акцепторных последовательностях, все частично с человеческой частью CDR-H2.
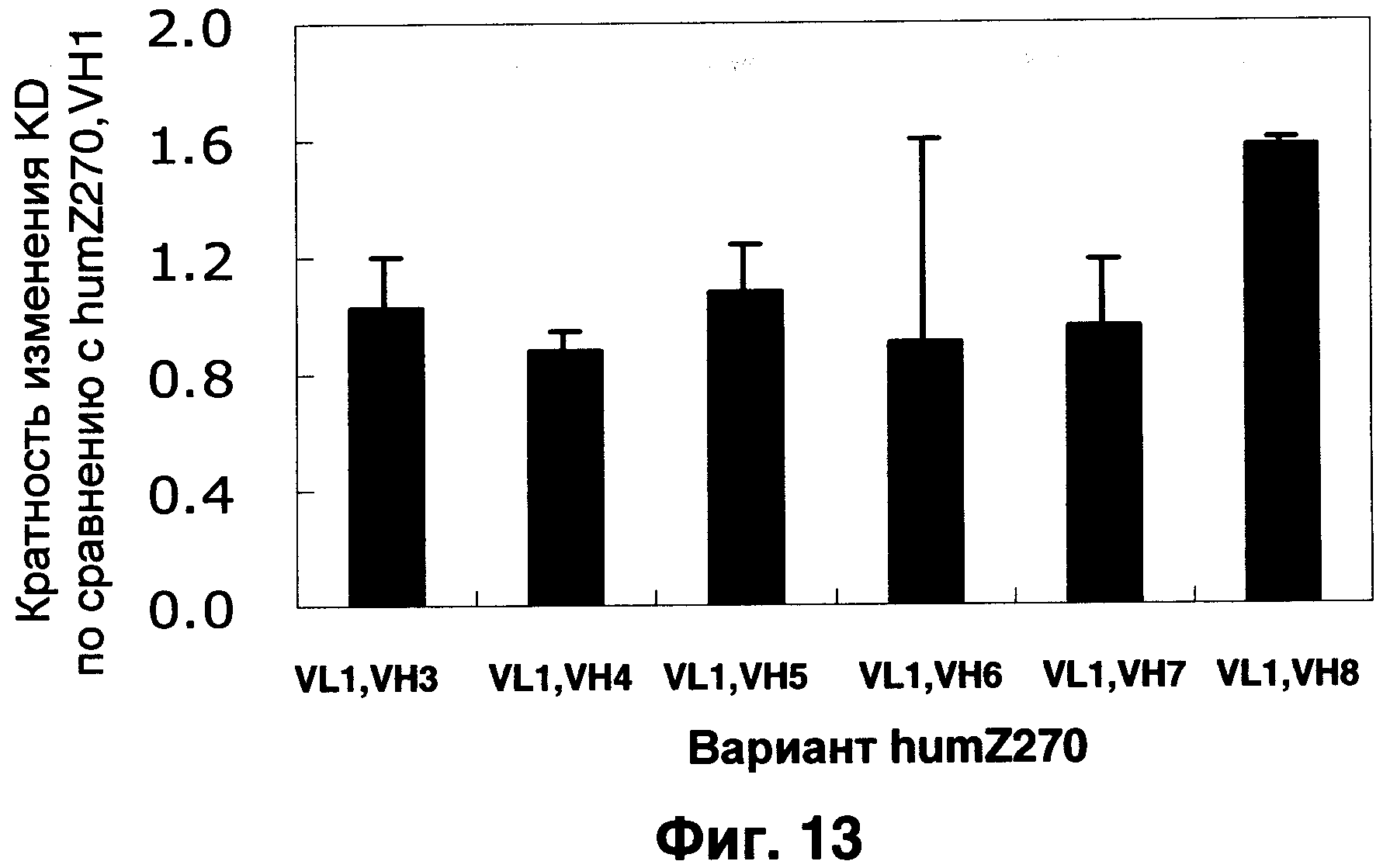
Фиг.13 показывает результаты оценки аффинности вариантов humZ270 VL1/VH1 и VH3-VH8 при анализе Biacore, нормализованные по KD hZ270VL1/VH1.
Фиг.14 показывает остатки, выбранные для аланининового сканирующего мутагенеза, чтобы выявить критические остатки рецепторных зон в VL и VH сегментах Z270.
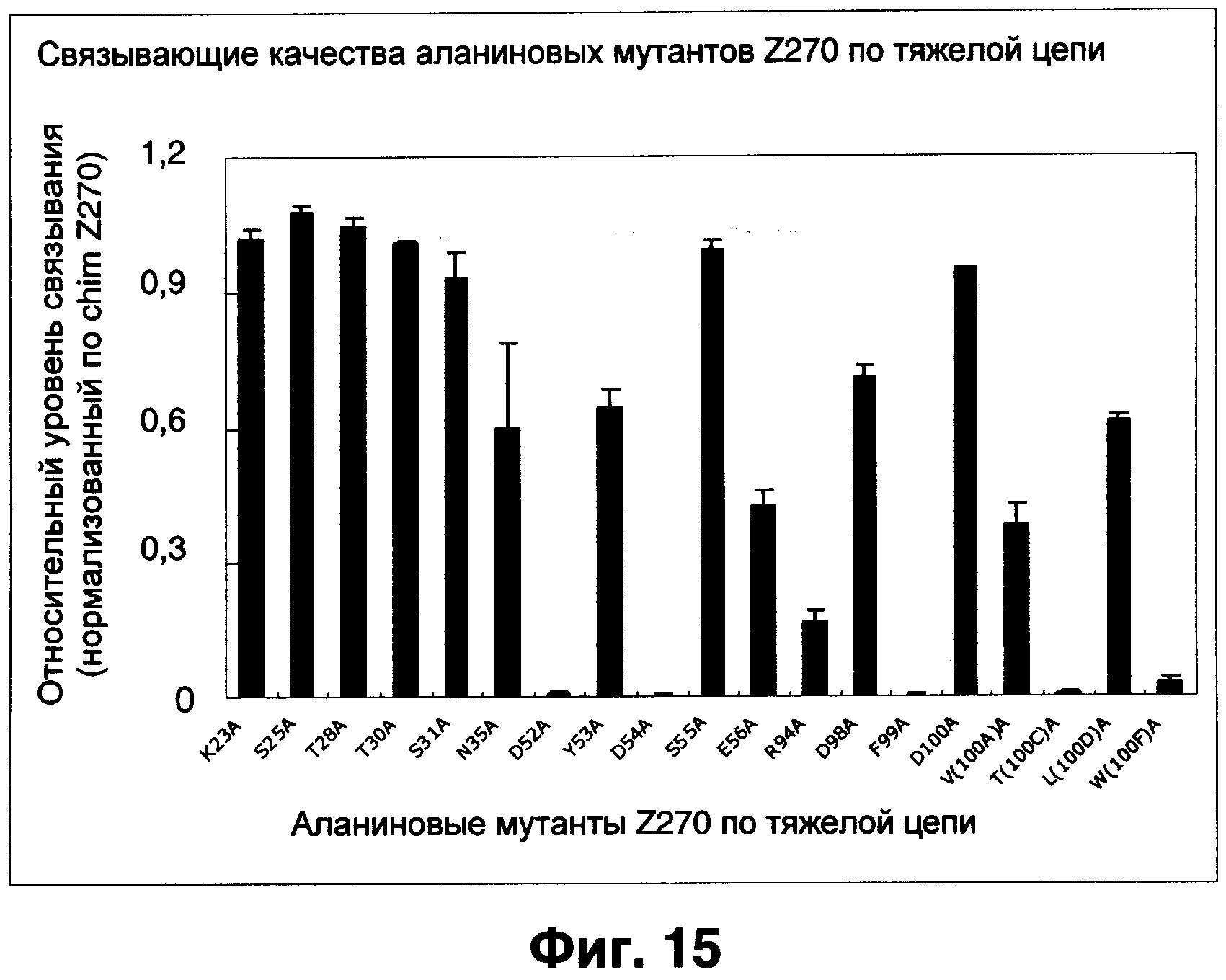
Фиг.15 показывает результаты оценки аффинности Z270VH апаниновых мутантов при анализе Biacore, нормализованные по связыванию химерного Z270.
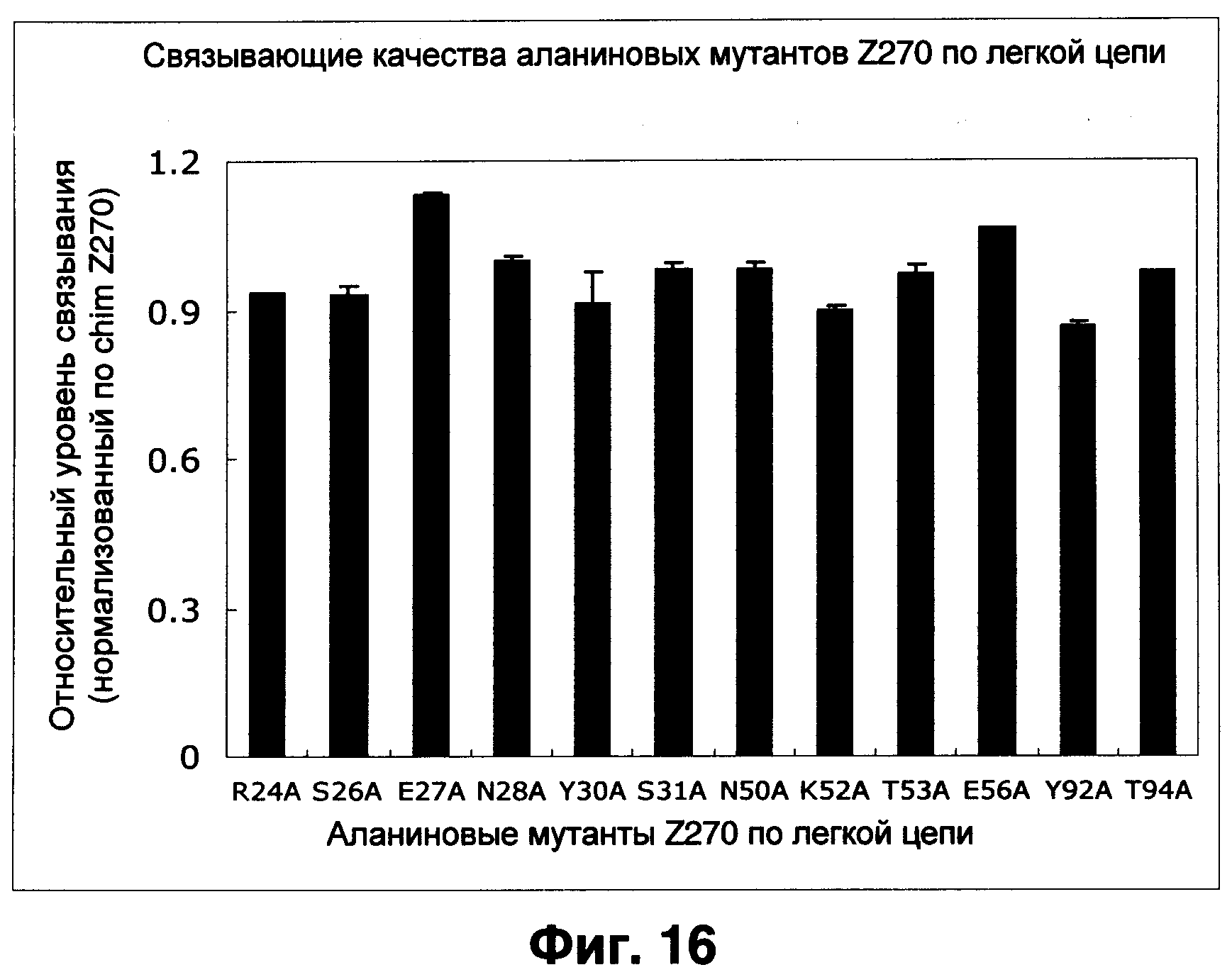
Фиг.16 показывает результаты оценки аффинности Z270VL аланиновых мутантов при анализе Biacore, нормализованные по связыванию химерного Z270.
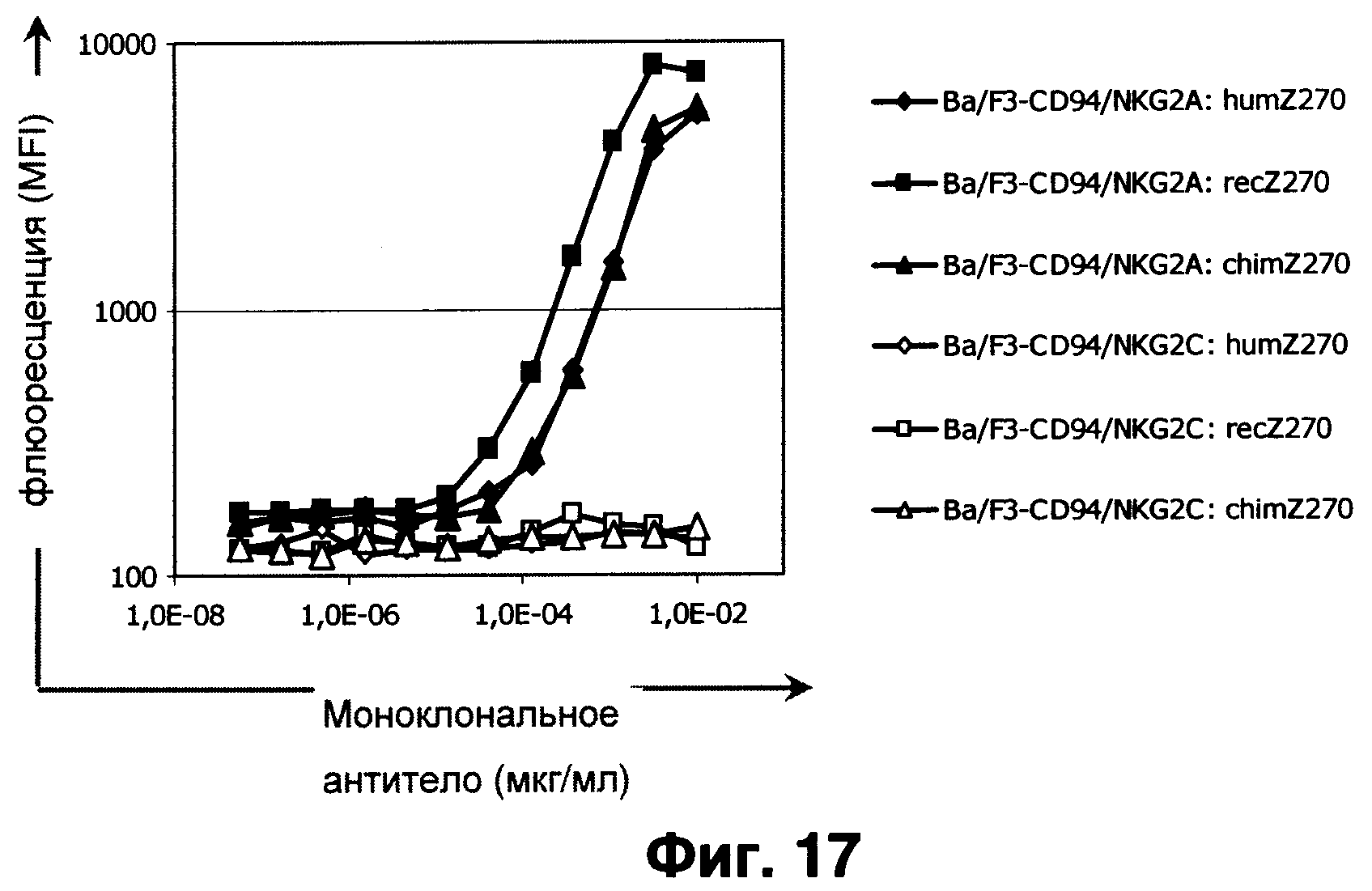
Фиг.17 показывает связывание различных рекомбинантных вариантов Z270 с клетками Ba/F3 со стабильной сверхэкспрессией или CD94/NKG2A, или CD94/NKG2C, выявленное путем проточной цитометрии.
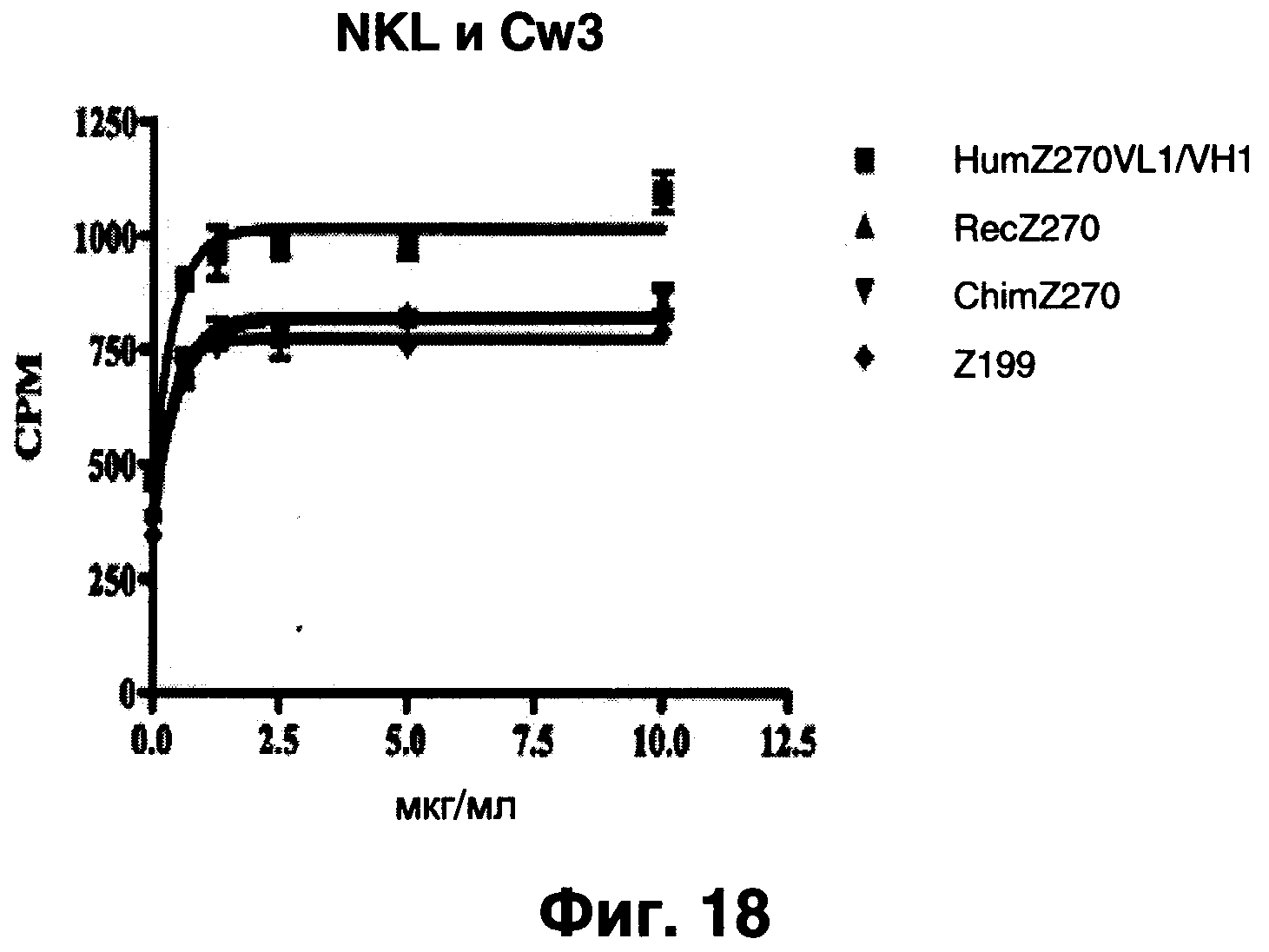
Фиг.18 показывает результаты анализа оценки способности рекомбинантного Z270, химерного Z270, humZ270VL1/VH1 и Z199 к индуцированию уничтожения 51Cr-меченых LCL 721221-Cw3 клеток CD94/NKG2A+NKL-клетками, свидетельствующие, что humZ270VL1/VH1 более эффективен в индукции уничтожения.
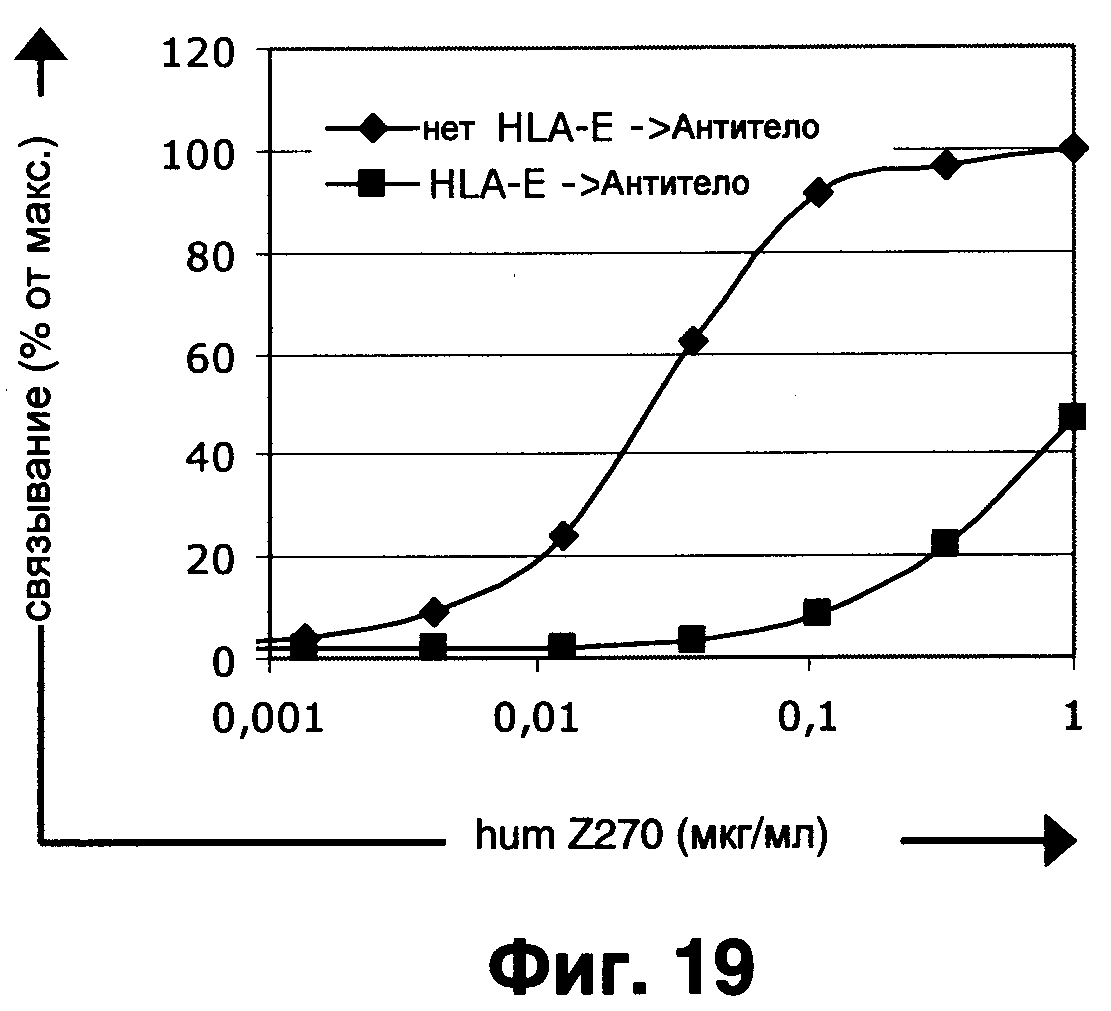
Фиг.19 показывает, что humZ270VL1/VH1 эффективно связывается с Ba/F3-CD94/NKG2A клетками в зависимости от концентрации (ромбы). Однако после предварительной инкубации клеток с HLA-E тетрамерами связывание humZ270VL1/VH1 с Ba/F3-CD94/NKG2A клетками было предотвращено (квадраты).
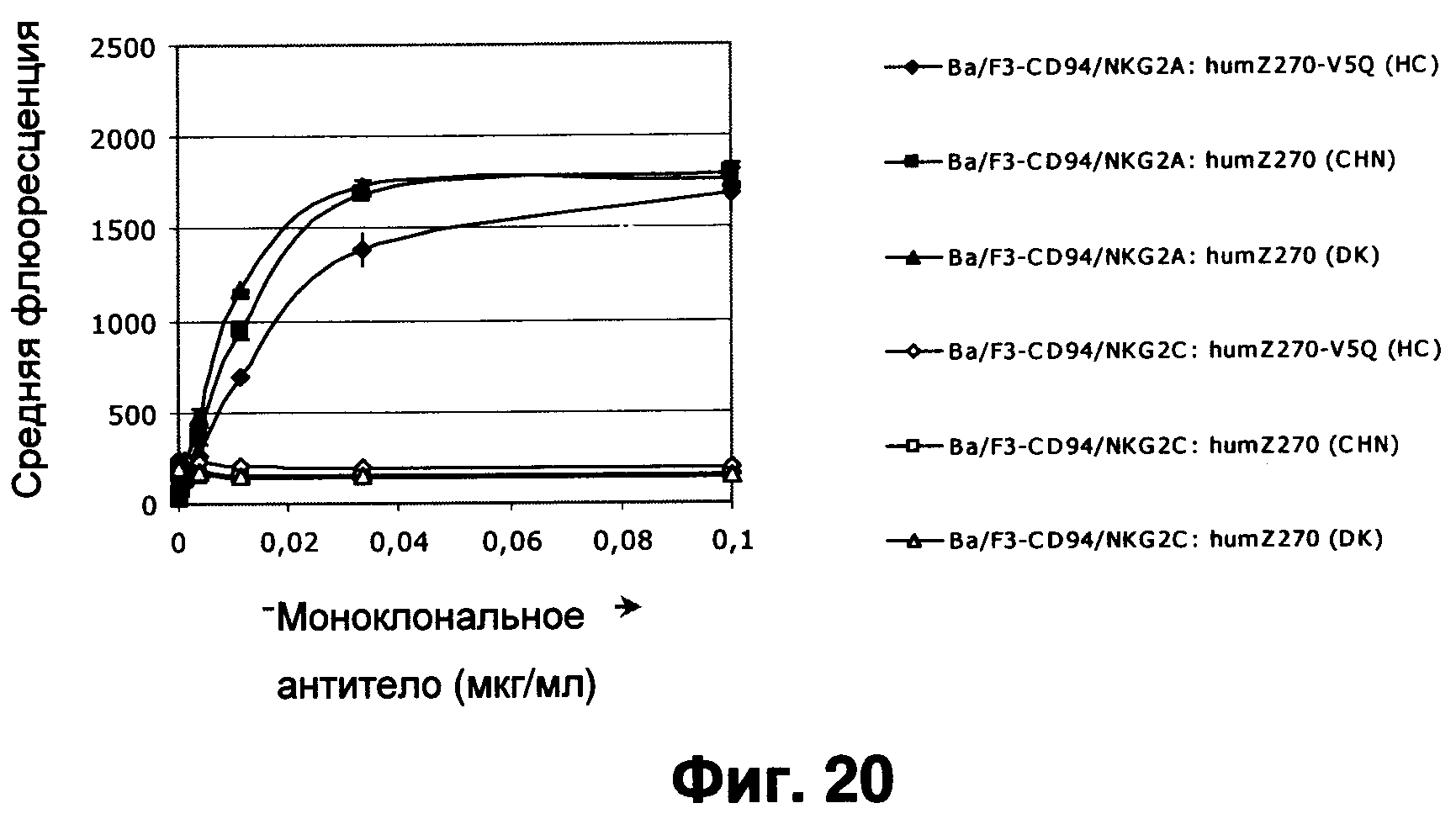
Фиг.20 показывает, что два различных препарата humZ270VL1/VH1 и варианта humZ270 с V5Q мутацией в VH связываются с CD94/NKG2A-, но не CD94/NKG2C-экспрессирующими клетками, хотя VSQ-вариант чуть менее эффективно.
ОПРЕДЕЛЕНИЯ
Термин "антитело" используется в данном документе в самом широком смысле и конкретно включает в себя моноклональные антитела полной длины, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), а также фрагменты антител до тех пор, пока они проявляют требуемую биологическую активность. Представлены различные методики, имеющие отношение к получению антител, например, Harlow и др., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988).
"Фрагмент антитела" включает в себя часть антитела полной длины, предпочтительно его антиген-связывающие или вариабельные участки. Примеры фрагментов антитела включают Fab, Fab', F(ab)2, F(ab')2, F(ab)3, Fv (как правило, VL и VH домены из одной ветви антитела), одноцепочечные Fv (scFv), dsFv, Fd фрагменты (как правило, VH и СН1 домен) и dAb фрагменты (как правило, VH домен); VH, VL, VhH и V-NAR домены; миниантитела, би-, трех-, четырехвалентные антитела и каппа-антитела (см., например, III et al., Protein Eng 1997; 10: 949-57); верблюжий IgG; IgNAR и полиспецифичные фрагменты антитела, сформированные из фрагментов антитела, а также один или более изолированных CDRs или функциональную рецепторную зону, где изолированные CDRs или антиген-связывающие остатки или полипептиды могут быть ассоциированы или связаны друг с другом с тем, чтобы сформировать функциональный фрагмент антитела. Различные типы фрагментов антитела были описаны и рассмотрены, например, в Holliger and Hudson, Nat Biotechnol 2005;23, 1126-1136; WO2005040219, и опубликованных патентных заявках США 20050238646 и 20020161201.
Термин "производное антитела" в значении, в котором он используется в данном документе, включает в себя антитело полной длины или фрагмент антитела, предпочтительно содержащий по меньшей мере его антиген-связывающий или вариабельный регионы, где одна или более аминокислот химически модифицированы, например, путем алкилирования, ПЭГилирования, ацилирования, формирования эфира или амида или, например, путем связывания антитела со второй молекулой. Он включает ПЭГилированные антитела, цистеин-ПЭГилированные антитела, а также их варианты, но не ограничивается ими.
"Иммуноконъюгат" включает производное антитела, ассоциированное или связанное со вторым агентом, таким как цитотоксический агент, обнаруживаемый агент и т.д.
"Гуманизированное" антитело является человеческим/нечеловеческим химерным антителом, которое содержит минимальную последовательность, полученную из нечеловеческого иммуноглобулина. По большей части гуманизированные антитела являются иммуноглобулинами (реципиентными антителами), в которых остатки из гипервариабельного региона реципиента заменяются остатками из гипервариабельного региона нечеловеческих видов (донорского антитела), например, мыши, крысы, кролика или примата, не являющегося человеком, с необходимой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасного участка (framework region, FR) человеческого иммуноглобулина заменяются соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут включать остатки, которые не были найдены в реципиентном или донорском антителе. Эти модификации производятся в целях дальнейшего улучшения показателей антитела. Как правило, гуманизированное антитело будет содержать по существу весь, по меньшей мере один или, как правило, два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют этим нечеловеческим иммуноглобулинам, и все или по существу все остатки FR являются теми же последовательностями человеческого иммуноглобулина. Гуманизированное антитело, возможно, может также включать по меньшей мере часть константного участка (Fc) иммуноглобулина, как правило, человеческого. Для получения более подробной информации см., например, Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992), WO 92/02190, патентную заявку США 20060073137 и патенты США 6750325, 6632927, 6639055, 6548640, 6407213, 6180370, 6054297, 5929212, 5895205, 5886152, 5877293, 5869619, 5821337, 5821123, 5770196, 5777085, 5766886, 5714350, 5693762, 5693761, 5530101, 5585089 и 5225539.
Термин "гипервариабельный участок" в значении, в котором он используется в данном документе, относится к аминокислотным остаткам антитела, которые отвечают за связывание с антигеном. Гипервариабельный участок обычно содержит аминокислотные остатки из "участков, определяющих комплементарность", или "CDR" (остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al. 1991, см. выше) и/или такие же остатки из "гипервариабельных петель" (остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol 1987:196:901-917). Как правило, нумерация аминокислотных остатков в этом участке производится способом, описанным Кабатом и др., см. выше. Такие фразы, как "позиция Кабата", "используя нумерацию Кабата", "нумерация остатков вариабельного домена по Кабату" и "по Кабату", используемые в данном документе, ссылаются на эту систему нумерации для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи. При использовании системы нумерации Кабата фактическая линейная последовательность аминокислот в пептиде может содержать меньше аминокислот, что укорачивает FR или CDR вариабельного домена, а может содержать дополнительные аминокислоты, вставленные в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать одиночную аминокислотную вставку (остаток 52А по Кабату) после остатка 52 в CDR H2, а также вставленные остатки (например, остатки 82а, 82b, 82с и т.д. по Кабату) после остатка 82 FR тяжелой цепи. Нумерация остатков по Кабату может быть определена для данного антитела путем согласования регионов гомологичных последовательностей антител со "стандартной", нумерованной по Кабату последовательностью. Позиции всех аминокислотных остатков в VL или VH последовательностях, описанных в данном документе, даны по Кабату, если нет иного указания или противоречия контексту.
Остатки "каркасного участка", или "FR", представляют собой VH или VL остатки помимо остатков CDRs, как они здесь определены.
"Вариант" полипептида относится к полипептиду с аминокислотной последовательностью, которая в существенной степени идентична указанному (эталонному) полипептиду, как правило, нативному или "родительскому". Вариант полипептида может иметь одну или более аминокислотных замен, делеций и/или вставок в определенных позициях в нативной аминокислотной последовательности.
"Консервативными" аминокислотными заменами являются те замены, в которых аминокислотный остаток заменяется аминокислотным остатком, имеющим боковую цепь со сходными физико-химическими свойствами. Семейства аминокислотных остатков, имеющих сходные боковые цепи, известны в данной области и включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
Термин "в существенной степени идентичны" в контексте двух аминокислотных последовательностей означает, что последовательности при оптимальном совмещении, например, с помощью программ Gap и BestFit, использующих по умолчанию разницу в весе, имеют по меньшей мере примерно 50, по меньшей мере примерно 60, по меньшей мере примерно 70, по меньшей мере примерно 80, по меньшей мере примерно 90, по меньшей мере примерно 95, по меньшей мере примерно 98 или по меньшей мере примерно 99 процентов идентичной последовательности. В одном воплощении позиции остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. Идентичность последовательностей, как правило, измеряется с помощью программного анализа последовательностей. Белковый программный анализ подбирает одинаковые последовательности, используя оценку установленного сходства по различным заменам, делециям и другим модификациям, включая консервативные аминокислотные замены. Например, публично доступное программное обеспечение GCG содержит программы, такие как "Gap" и "BestFit", которые могут быть использованы с параметрами по умолчанию для определения гомологии и идентичности последовательностей тесно связанных полипептидов, таких как гомологичные полипептиды организмов разных видов или белок дикого типа и его мутированная форма. См., например, GCG версии 6.1. Полипептидные последовательности также могут быть сравнены с помощью FASTA или ClustalW с применением параметров по умолчанию или рекомендованных параметров. Программа FASTA (например, FASTA2 и FASTA3) в GCG версии 6.1. предоставляет совмещение и процентную идентичность последовательностей в регионах лучшего совпадения запрашиваемой и исследуемой последовательностей (Pearson, Methods Enzymol. 1990:183:63-98; Pearson, Methods Mol. Biol. 2000:132:185-219). Другим предпочтительным алгоритмом при сравнении последовательности с базой данных, содержащей большое число последовательностей различных организмов, или выведенных последовательностей является компьютерная программа BLAST, особенно blastp, использующая параметры по умолчанию. См., например, Altschul et al., J. Mol. Biol. 1990:215:403-410; Altschul et al., Nucleic Acids Res. 1997:25:3389-402 (1997); все включены сюда путем ссылки. "Соответствующими" аминокислотными позициями в двух в существенной степени идентичных аминокислотных последовательностях являются те позиции, которые выровнены с помощью какого-либо белкового программного анализа, описанного здесь, как правило, с использованием параметров по умолчанию.
Антитело с "биологической характеристикой" эталонного антитела (например, Z270) обладает одной или более биологическими характеристиками этого антитела, которые отличают его от других антител, связывающихся с тем же антигеном (например, NKG2A). Например, антитело с биологической характеристикой Z270 может блокировать активацию NKG2A и/или перекрестно конкурировать с Z270 в связывании с внеклеточным доменом NKG2A.
NKG2A (OMIM 161555, полное раскрытие которого включено сюда путем ссылки) является членом группы транскриптов NKG2 (Houchins, et al. (1991) J. Exp.Med. 173:1017-1020). NKG2A кодируется 7 экзонами, охватывающими 25 т.н., с возможностью альтернативного сплайсинга. NKG2A является ингибиторным рецептором, находящимся на поверхности субпопуляции НК клеток, α/β Т-клеток, γ/δ Т-клеток и НКТ-клеток. Как ингибиторные KIR рецепторы, он имеет ITIM (иммунорецепторный основанный на тирозине ингибиторный мотив) в цитоплазматическом домене. Используемый в данном документе термин "NKG2A" относится к любому варианту, производному или изоформе гена NKG2A или закодированного им белка. Он также включает любые последовательности нуклеиновых кислот или белковые последовательности, имеющие одно или более биологических свойств и функций, общих с NKG2A дикого типа, NKG2A полной длины, а также имеющие нуклеотидную или аминокислотную идентичность не менее 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более. Человеческий NKG2A содержит 233 аминокислоты в 3 доменах: цитоплазматическом домене, содержащем остатки 1-70, трансмембранном регионе, содержащем остатки 71-93, и внеклеточном регионе, содержащем остатки 94-233, в следующей последовательности:
MDNQGVIYSDLNLPPNPKRQQRKPKGNKSSILATEQEITYAELNLQKASQDFQGNDKTYHCKDLPSAPEKLIVGILGIICLILMASWTIVVIPSTLIQRHNNSSLNTRTQKARHCGHCPEEWITYSNSCYYIGKERRTWEESLLACTSKNSSLLSIDNEEEMKFLSIISPSSWIGVFRNSSHHPWVTMNGLAFKHEIKDSDNAELNCAVLQVNRLKSAQCGSSIIYHCKHKL (SEQ ID NO:11)
NKG2C (OMIM 602891, полное раскрытие которого включено сюда путем ссылки) и NKG2E (OMIM 602892, полное раскрытие которого включено сюда путем ссылки) являются двумя другими членами группы транскриптов NKG2 (Gilenke, et al. (1998) Immunogenetics 48:163-173). NKG2C и NKG2E являются активирующими рецепторами, находящимися на поверхности НК-клеток.
HLA-E (OMIM 143010, полное раскрытие которого включено сюда путем ссылки) является неклассической молекулой МНС, которая экспрессируется на клеточной поверхности и регулируется путем связывания с пептидами, образованными из сигнальных последовательностей других молекул МНС I класса.
HLA-E связывается с натуральными киллерами (НК-клетками) и некоторыми Т-клетками, специфично связываясь с CD94/NKG2A, CD94/NKG2B и CD94/NKG2C (см., например, Braud et al. (1998). Nature 391:795-799, полное раскрытие которого включено сюда путем ссылки). Поверхностной экспрессии HLA-E достаточно, чтобы защитить клетки-мишени от лизиса клетками CD94/NKG2A+клональными НК-, Т- или НКТ-клетками. Используемый здесь термин "HLA-E" относится к любому варианту, производному или изоформе гена HLA-E или закодированного им белка. Он также включает любые последовательности нуклеиновых кислот или белковые последовательности, имеющие одно или более биологических свойств и функций, общих с HLA-E дикого типа, HLA-E полной длины, и имеющие нуклеотидную или аминокислотную идентичность не менее 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более.
Нуклеиновая кислота является "функционально связанной", когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК предпоследовательности или секреторного лидерного пептида функционально связана с ДНК полипептида, если он экспрессируется как препротеин, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если она затрагивает транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если она расположена так, чтобы облегчить трансляцию. Как правило, "функциональная связь" означает, что связанные последовательности ДНК являются смежными и, в случае секреторного лидерного пептида, непрерывны и в фазе считывания. Вместе с тем, энхансеры не должны быть смежными. Связывание достигается путем лигирования в удобных рестрикционных сайтах. Если таких сайтов нет, то в соответствии с обычной практикой используются синтетические олигонуклеотидные адаптеры или линкеры.
"Изолированная" молекула представляет собой молекулу, которая в композиции, в которой она находится, является преобладающей разновидностью по отношению к молекулам, к классу которых она принадлежит (например, она составляет по меньшей мере примерно 50% от всех типов молекул в композиции и, как правило, будет составлять по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или более из разновидностей молекул, например, пептидов). Как правило, гомогенность молекул антитела композиции среди молекул антител будет составлять 98%, 98% или 99% в контексте всех присутствующих в композиции видов пептидов или по меньшей мере в связи с существенно активными видами пептидов в контексте предлагаемого использования.
В контексте данного изобретения "лечение" означает предотвращение, облегчение, управление, удаление или уменьшения одного или более симптомов или соответствующих клинических проявлений болезни или нарушения, если это не противоречит контексту. Например, "лечение" пациента, у которого не были выявлены симптомы или соответствующие клинические проявления болезни или нарушения, является превентивной или профилактической терапией, в то время как "лечение" пациента, у которого были определены симптомы заболевания или соответствующие клинические проявления болезни или нарушения, обычно не является превентивной или профилактической терапией.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение касается антител, связывающихся с NKG2A. В одном аспекте антитело представляет собой гуманизированную версию антитела Z270, которое является мышиным моноклональным антителом, специфично связывающимся с NKG2A, но не с человеческими NKG2C и NKG2E. Z270 может блокировать функцию человеческого CD94/NKG2A и специфично индуцировать уничтожение клеток CD94/NKG2A-несущими лимфоцитами в зависимости от концентрации.
Изобретение предлагает, например, варианты humZ270, в которых по меньшей мере часть VH CDR, такая как CDR-H2, идентична соответствующей части человеческой VH акцепторной последовательности, что позволяет снизить иммуногенность гуманизированного антитела. Удивительно, что такие гуманизированные варианты могут быть более эффективны в потенциировании цитотоксичности CD94/NKG2A-экспрессирующих цитотоксических лимфоцитов, чем мышиные или химерные формы Z270. В других аспектах изобретение предлагает антитела, имеющие CDRs, содержащие определенные антиген-связывающие остатки, соответствующие таким же остаткам в мышином антителе Z270, и человеческие последовательности каркасного участка. Эти и другие аспекты более подробно описаны в следующих разделах и разделе Примеры.
Гуманизированные анти-NKG2A антитела
В уровне техники описан ряд способов гуманизации нечеловеских антител. Как правило, в процессе гуманизации нуклеотиды, кодирующие регионы взаимодействия мышиного антитела, могут быть клонированы в кДНК-вектор, кодирующий человеческий IgG, который может быть сделан таким образом, чтобы вырабатывалось химерное антитело, состоящее главным образом из человеческого IgG, несущего мышиные CDRs. Такие химерные антитела могут иметь пониженную аффинность, пониженную стабильность или другие нежелательные особенности в сравнении с оригинальным мышиным антителом, а также могут быть иммуногенными. Таким образом, возможно, отдельные аминокислоты в химерном антителе необходимо будет оптимизировать для получения функционального моноклонального антитела высокого качества для терапевтических применений у людей.
Как правило, гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него из источника, который не является человеком. Эти нечеловеческие аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортного" вариабельного домена. Гуманизация может быть выполнена при помощи способа Winter и сотрудников (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), путем замены последовательностей гипервариабельного региона на соответствующие последовательности человеческого "акцепторного" антитела. Соответственно, такие "гуманизированные" антитела являются химерными антителами (патент США №4816567), в которых существенно меньшая часть, чем интактный человеческий вариабельный домен, заменена на соответствующую последовательность от нечеловеческих видов. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки гипервариабельного региона и, возможно, некоторые остатки FR заменены на остатки аналогичных сайтов антител грызунов.
Другой способ получения гуманизированных антител описан в публикации патентной заявки США 2003/0017534, где гуманизированные антитела и препараты антител получают с помощью трансгенных животных, не являющихся человеком. С помощью генной инженерии получают животных, не являющихся человеком, содержащих один или более гуманизированных иммуноглобулиновых локусов, которые способны проходить генную перегруппировку и генную конверсию в трансгенных животных, не являющихся человеком, чтобы продуцировать разнообразные гуманизированные иммуноглобулины.
Выбор обоих человеческих вариабельных доменов, и легкого, и тяжелого, которые будут использоваться в производстве гуманизированных антител, имеет очень важное значение для уменьшения антигенности. Согласно так называемому "best-fit" (наиболее подходящему) способу, последовательность вариабельного домена антитела грызунов просматривается в библиотеке известных человеческих последовательностей вариабельного домена или в библиотеке человеческих зародышевых последовательностей. Человеческая последовательность, наиболее близкая к последовательности грызуна, может быть принята в качестве человеческого каркасного участка для гуманизированного антитела (Sims et al., J. Immunol. 1993:151:2296 et seq.; Chothia et al., Chothia and Lesk, J. Mol. Biol 1987; 196:901-917). Другой способ использует особенности каркасного участка, полученного из консенсусной последовательности всех человеческих антител, в частности, подгруппы легких или тяжелых цепей. Тот же каркасный участок может быть использован для нескольких различных гуманизированных антител (Carter et al., PNAS USA, 1992:89:4285 et seq.; Presta et al., J Immunol 1993:151:2623 et seq.). Другие способы, направленные на снижение иммуногенности молекул антител у пациента, являющегося человеком, включают "шпон" антител (см., например, патент США 6797492 и публикации патентных заявок США 20020034765 и 20040253645) и модификацию антител путем анализа Т-клеточных эпитопов и их удаления (см., например, публикацию патентной заявки США 20030153043 и патент США №5712120).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели в соответствии с предпочтительным способом гуманизированные антитела получают в процессе анализа родительских последовательностей и различных эскизных гуманизированных продуктов, проводимого с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов, как правило, доступны и известны специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных, кандидатных иммуноглобулиновых последовательностей. Исследование этих изображений позволяет анализировать вероятную роль остатков в функционировании кандидатной иммуноглобулиновой последовательности, т.е. проводится анализ остатков, которые влияют на способность кандидатного иммуноглобулина связать свой антиген. Таким образом, остатки FR могут быть выбраны из реципиентых и импортных последовательностей и комбинированы для достижения желаемой характеристики антитела, такой как повышенная аффинность к целевому антигену(ам). Обычно остатки гипервариабельного региона непосредственно и наиболее существенно вовлечены в связывание оказывающего влияние антигена.
Пример 1, приведенный ниже, описывает конструирование типичных гуманизированных анти-NKG2A антител, которые связываются с NKG2A, а на Фиг.1 по меньшей мере частично показан анализ. Как показано на Фиг.1, в одном антителе humZ270 изобретения С-концевая часть CDR-H2 (соответствующая по Кабату остаткам 61-65) идентична соответствующей части человеческой акцепторной последовательности. Кроме того, как указано на Фиг., последовательность humZ270VL (SEQ ID NO:4), возможно, может включать мутации в одном или обоих из указанных остатков FR L46 и 148, а последовательность humZ270VH (SEQ ID NO:5), возможно, может включать мутации в одном или более из указанных остатков FR V5, М69, Т71, Т73 и Т75 с аминокислотой нумерацией по Кабату. Таблица 1 описывает типичные варианты humZ270VL и humZ270VH, содержащие типичные человеческо-мышиные бэк-мутации в последовательностях FR humZ270VH и humZ270VL, а также типичные комбинации FR мутаций. В Таблице 1 и в других, имеющихся в данном документе, аминокислотные позиции обозначаются по Кабату, где аминокислоты V5, М69, Т71, Т73 и Т75 в домене humZ270VH соответствуют аминокислотам V5, М70, Т72, Т74 и Т76 в SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:8 или других типичных последовательностях humZ270VH, описанных в данном документе.

Соответственно, данное изобретение предлагает гуманизированные версии анти-NKG2A антитела, полученные с помощью гибридомы Z270, а также гуманизированные версии нечеловеческих антител с измененными биологическими характеристиками и/или существенной идентичностью последовательности с Z270. В другом воплощении моноклональное антитело или его фрагмент или производное способно к связыванию с нечеловеческим NKG2A, полученным от примата.
Гуманизированное антитело в данном случае включает нечеловеческий гипервариабельный участок или CDR остатки, вставленные в человеческие домены VH и VL.
В одном аспекте изобретение предлагает гуманизированное антитело, содержащее антиген-связывающие остатки из CDRs мышиных антител Z270 в человеческом акцепторном каркасе, где по меньшей мере шесть С-концевых аминокислотных остатков CDR-H2 являются такими же, как и в человеческой акцепторной последовательности. Такие гуманизированные антитела могут быть более эффективны, чем оригинальное мышиное антитело Z270 или его химерная версия, например, они могут усиливать цитотоксическую активность CD94/NKG2A-экспрессирующего цитотоксического лимфоцита, например, такого как НК-клетка, НКТ-клетка, α/β Т-клетка и/или γ/δ Т-клетка, или популяции CD94/NKG2A-экспрессирующих цитотоксических лимфоцитов.
Типичные антитела изобретения включают антиген-связывающие остатки, соответствующие или являющиеся частью CDR-H2 и CDR-H3 Z270: D52, D54, R94, F99, Т(100C) и W(100F) из SEQ ID NO:2 или SEQ ID NO:5, которые были показаны в разделе Примеры, будучи важными для связывания антигена. Возможно, антитела также могут содержать VH остатки N35, Y53, Е56, D98, V(100A) и L(100D).
В другом аспекте гуманизированное антитело содержит последовательность CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:5, и последовательность CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:5, где CDR-H2 последовательность включает остатки 50-59 из SEQ ID NO:5. В таких гуманизированных антителах регион VH может быть идентичен последовательности SEQ ID NO:5, например, на 50% или более, например, по меньшей мере на 60%, по меньшей мере на 70% или по меньшей мере на 75%. Типичные гуманизированные VH домены, имеющие такие последовательности, описаны среди примеров и ниже.
В одном воплощении в таких гуманизированных антителах аминокислота в позиции 5 региона VH может быть V или Q; аминокислота в позиции 69 региона VH может быть М и L; аминокислота в позиции 71 региона VH может быть Т или V; аминокислота в позиции 73 региона VH может быть Т или K и/или аминокислота в позиции 75 региона VH может быть Т или S. В отдельных воплощениях регион VH содержит остатки V5 или Q5, М69 или L69, Т71 или V71, Т73 или K71 и/или Т75 или S75. В другом воплощении в позиции 69 находится аминокислота L. В другом дополнительном или альтернативном воплощении в позиции 71 находится аминокислота V.
Гуманизированное антитело может содержать человеческий акцепторный каркас VH из человеческой акцепторной последовательности, выбранной, например, среди VH1_18, VH5_a, VH5_51, VH1J и VH1_46, и J-сегмент, представляющий собой JH6, такой как, например, VH1_18, VH5_a, VH5_51 или VH1_f, или другие человеческие зародышевые последовательности каркасного участка VH, известные в данной области. В одном воплощении сегмент VH представляет собой VH1_18. В частном воплощении регион VH содержит последовательность SEQ ID NO:8. В другом частном воплощении регион VH содержит последовательность SEQ ID NO:7. Например, регион VH может содержать последовательность SEQ ID NO:5.
Человеческая акцепторная последовательность региона VL может представлять собой, например, VKI_O2/JK4. В частном воплощении регион VL включает SEQ ID NO:4.
В одном аспекте гуманизированное антитело изобретения включает CDR-Н2 с мышиной частью, содержащей остатки 50-59 из SEQ ID NO:2, связанной через подходящие FR последовательности с CDR-H3, содержащей остатки 95-102 из SEQ ID NO:2.
Как здесь указано, в одном воплощении гуманизированное антитело не имеет замен FR в домене VH. В другом воплощении гуманизированное антитело содержит замены FR в домене VH в одной или более позициях, выбранных среди 5, 69, 71, 73 и 75, используя систему нумерации вариабельного домена по Кабату. В другом воплощении гуманизированное антитело содержит FR замены домена VH в двух или более позициях 5, 69, 71, 73 и 75; в других воплощениях таковыми являются три, четыре или все эти позиции. В отдельных и независимых воплощениях гуманизированное антитело содержит одну FR замену в домене VH в позиции, выбранной среди 5, 69, 71, 73 и 75. В других отдельных и независимых воплощениях гуманизированное антитело содержит FR замены в домене VH в позиции 5 и 69, или 5 и 71, или 5 и 73, или 5 и 75, или 69 и 71, 69 и 73, или 69 и 75, или 71 и 73, или 71 и 75, или 73 и 75, или 5, 69 и 71, или 5, 69 и 73, или 5, 69 и 75, или 69, 71 и 73, или 69, 71 и 75, или 71, 73 и 75, или 5, 69, 71 и 73, или 5, 69, 71 и 75, или 5, 71, 73 и 75, или 69, 71, 73, 75, или 5, 69, 71, 73 и 75. Замены в каркасном участке могут минимизировать иммуногенность в той или иной степени, но эффективность связывания может быть важным фактором для некоторых применений. Таким образом, предпочтительными заменами являются бэк-мутации, т.е. мутации, при которых аминокислота в определенной позиции в человеческом FR заменяется на аминокислоту, стоящую в соответствующей позиции в нечеловеческом донорском FR. Таким образом, в отдельных и независимых воплощениях аминокислотная замена домена VH в позиции 5 представляет собой V5Q, аминокислотная замена в позиции 69 представляет собой M69L, аминокислотная замена в позиции 71 представляет собой T71V, аминокислотная замена в позиции 73 представляет собой T73K, и аминокислотная замена в позиции 75 представляет собой T75S. В частном воплощении гуманизированное антитело включает V в позиции 71 и/или L в позиции 69.
Гуманизированное антитело здесь также содержит остатки нечеловеческого гипервариабельного участка, вставленные в человеческий домен VL. В одном воплощении гуманизированное антитело не содержит FR замен домена VL. В другом воплощении гуманизированное антитело содержит FR замену домена VL в одной из позиций 46 или 48, используя систему нумерации вариабельного домена по Кабату. В другом воплощении гуманизированное антитело содержит FR замены домена VL в обеих позициях, 46 и 48. Предпочтительными заменами являются бэк-мутации, т.е. мутации, при которых аминокислота в определенной позиции в человеческом FR заменяется на аминокислоту, стоящую в соответствующей позиции в нечеловеческом донорском FR. Таким образом, в отдельных и независимых воплощениях аминокислотная замена домена VL в позиции 46 представляет собой L46F, а аминокислотная замена домена VL в позиции 48 представляет собой I48V.
Типичное гуманизированное антитело содержит VH домен, содержащий CDR-H1 последовательность, соответствующую остаткам 31-35 из SEQ ID NOS:5 или 7, CDR-H2 последовательность, соответствующую остаткам 50-66 из SEQ ID NOS:5 или 7, и CDR-H3 последовательность, соответствующую остаткам 95-102 из SEQ ID NOS:5 или 7. Гуманизированное антитело может также содержать в VH домене аминокислоту в позиции 5 по Кабату, которая является V и Q, аминокислоту в позиции 69 по Кабату, которая является М или L, аминокислоту в позиции 71 по Кабату, которая является Т и V, аминокислоту в позиции 73 по Кабату, которая является Т или K, и/или аминокислоту в позиции 75 по Кабату, которая является Т или S. В одном варианте VH домен содержит замену в каркасном участке по меньшей мере в одной позиции по Кабату, выбранной среди 5, 69, 71, 73 и 75, например, соответствующей любой из замен VH FR или их комбинаций, перечисленных в таблице 1. В одном варианте домен VH содержит последовательность SEQ ID NO:7. В другом варианте домен VH содержит последовательность SEQ ID NO:5.
Типичное гуманизированное антитело может также или альтернативно содержать домен VL, содержащий последовательность CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:4, последовательность CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:4, и последовательность CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:4. Гуманизированное антитело может также содержать аминокислоту в позиции 46 по Кабату, которая является L или F, и/или аминокислоту в позиции 48 по Кабату, которая является I или V. В одном воплощении домен VL содержит замену в каркасном участке по меньшей мере в одной из позиций по Кабату, выбранной между 46 и 48, например, соответствующую любой из VL FR замен или их комбинаций, перечисленных в таблице 1. В одном воплощении домен VL содержит аминокислотную последовательность из SEQ ID NO:4. В другом воплощении домен VL содержит последовательность из SEQ ID NO:6.
В другом аспекте изобретение предлагает гуманизированное антитело, связывающее человеческий NKG2A и содержащее домен VH, который содержит аминокислотную последовательность из SEQ ID NO:5, возможно с одной или более FR заменами в позициях 5, 69, 71, 73 и/или 75 по Кабату. Возможные FR замены могут быть выбраны, например, среди V5Q, M69L, T71V, T73K и/или T75S, а также любых их комбинаций. Такое гуманизированное антитело может также или альтернативно содержать домен VL, который содержит аминокислотную последовательность из SEQ ID NO:4, возможно с одной или более FR заменами в позициях 46 и/или 48 по Кабату. Возможные FR замены могут быть выбраны, например, между L46F и/или I48V.
Возможно, в частном аспекте домен VH содержит аминокислотные модификации одного или более CDR остатков, например, модификации, значительно сохраняющие или улучшающие аффинность антитела. Например, вариант антитела может иметь одну, две, три или от одной до семи аминокислотных замен в указанных выше VH CDR последовательностях.
В частном аспекте аминокислоты в гуманизированном антителе VH CDRs, которые отличаются от аминокислот в соответствующих позициях нечеловеческих донорских VH CDRs, могут быть заменены для улучшения связывающих качеств и/или стабильности гуманизированного антитела. Например, одна или более таких аминокислот могут быть заменены аминокислотами в соответствующей позиции (позициях) нечеловеческих донорских VH CDRs. В одном воплощении вариант антитела включает CDRH2 замены в одной или более позициях, выбранных среди 60, 63, 64 и 65 по Кабату (соответствующих позициям 61, 64, 65 и 66 в SEQ ID NO:5 или 7). В отдельных и независимых воплощениях вариант антитела включает CDRH2 аминокислотную замену в одной позиции, выбранной среди 60, 63, 64 и 65. В других отдельных и независимых воплощениях вариант антитела включает CDRH2 аминокислотную замену в позициях 60 и 63, или 60 и 64, или 60 и 65, или 63 и 64, или 63 и 65, или 64 и 65, или 60, 63, и 64, или 60, 63 и 65, или 60, 64 и 65, или 63, 64 и 65, или 60, 63, 64 и 65. Предпочтительными заменами являются бэк-мутации, т.е. мутации, при которых происходит замена аминокислоты в определенной позиции в гуманизированном CDR на аминокислоту в соответствующей позиции в нечеловеческом донорском CDR. Таким образом, в отдельных и независимых вариантах CDRH2 аминокислотная замена в позиции 60 представляет собой A60S, аминокислотная замена в позиции 63 представляет собой L63F, аминокислотная замена в позиции 64 представляет собой Q64K, и аминокислотная замена в позиции 65 представляет собой G65D. В аспектах, где вариант антитела содержит одну или более CDRH2 аминокислотных замен A60S, L63F, Q64K и G65D, он содержит VH FR аминокислотные замены в позициях 66 и 67 по Кабату, возможно в сочетании с одной или более VH FR заменами, описанными ранее. Предпочтительно, когда аминокислотные замены представляют собой R66K и V67A. Например, в одном воплощении вариант антитела содержит домен VH, содержащий последовательность CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:5, последовательность CDR-H2, соответствующую остаткам 50-66 из SEQ ID NO:5, и последовательность CDR-Н3, соответствующую остаткам 95-102 из SEQ ID NO:5, с "бэк-мутациями" A60S, L63F, Q64K, G65D, R66K и V67A, возможно в сочетании с дополнительными аминокислотными модификациями.
В другом частном аспекте изобретение предлагает гуманизированное антитело, которое связывается с человеческим NKG2A и содержит домен VH, который содержит нечеловеческие CDR остатки, вставленные в человеческий домен VH, при этом домен VH содержит последовательность CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:8, последовательность CDR-Н2, соответствующую остаткам 50-66 из SEQ ID NO:8, и последовательность CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:8, где аминокислоты в позициях 63, 64, 65, 66, 67 по Кабату являются F, K, D, K, А соответственно. В одном воплощении домен VH содержит аминокислотную последовательность из SEQ ID NO:8. В другом воплощении остаток в позиции 60 по Кабату представляет собой А. В другом воплощении остаток в позиции 60 по Кабату представляет собой S, а гуманизированное антитело содержит CDR-H1, -Н2 и -Н3 последовательности Z270, с FR бэк-мутациями в двух аминокислотах, прилегающих к С-концу CDR-H2. Гуманизированные антитела, описанные в данном разделе, могут также содержать FR бэк-мутации в других остатках, например в позициях 5, 69, 71, 73, и/или 75 по Кабату, как здесь описано.
В другом аспекте изобретение предлагает гуманизированное антитело, где все CDRs по Кабату в регионе VH получены из мышиного Z270VH (SEQ ID NO:2), также содержащего S60A, F63L, K64Q и/или D65G мутации. В одном воплощении гуманизированное антитело содержит все эти мутации: S60A, F63L, K64Q и/или D65G.
Гуманизированное антитело может также содержать домен VL, содержащий последовательность CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:6, последовательность CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:6, и последовательность CDR - L3, соответствующую остаткам 89-97 из SEQ ID NO:6, например в дополнение к CDRs домена VH, описанным выше. В одном воплощении домен VL гуманизированного антитела содержит аминокислотную последовательность из SEQ ID NO:6. В другом воплощении домен VL гуманизированного антитела содержит аминокислотную последовательность из SEQ ID NO:4. Возможно, такое гуманизированное антитело содержит аминокислотные модификации одного или более VL CDR остатков, например, такие модификации, которые сохраняют в значительной степени или улучшают аффинность антитела. Например, вариант антител может иметь одну, две, три или от одной до семи аминокислотных замен в приведенной выше VL CDR последовательности.
Данная заявка также предусматривает аффинно созревшие антитела, которые связываются с анти-NKG2A, содержащие дополнительные CDR или FR мутации, которые повышают аффинность гуманизированного антитела к антигену. Способы получения таких аффинно созревших антител хорошо известны в данной области. Родительское антитело может быть гуманизированным антителом, например, содержащим последовательности VL/VH из SEQ ID NOS:4 и 5 (возможно с одной или более CDRH2 и/или FR заменами, описанными здесь) или консенсусные последовательности VL/VH из SEQ ID NOS:6 и 7 соответственно. Аффинно созревшие антитела предпочтительно связываются с NKG2A с такой же аффинностью, что и мышиное Z270, или с повышенной аффинностью; например, наблюдается повышение аффинности от по меньшей мере одно-, дву- или четырехкратного до примерно 100-кратного или 1000-кратного, что оценивается с помощью анализа связывания, описанного ниже.
В другом аспекте изобретение предлагает гуманизированные антитела, которые содержат домен VH, последовательность которого по меньшей мере примерно на 50%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80% идентична (например, по меньшей мере примерно на 85%, 90%, 95%, 97% или более идентична) домену VH из Z270, humZ270, humZ270cons и/или humZ270cons2 (SEQ ID NOS:2, 5, 7 и 8 соответственно). В другом частном аспекте изобретение предлагает гуманизированное антитело, связывающееся с NKG2A и содержащее домен VH, который включает нечеловеческие CDR остатки, вставленные в человеческий домен VH, где домен VH по меньшей мере примерно на 50% идентичен humZ270VH1 (SEQ ID NO:5). В одном воплощении домен VH по меньшей мере на 90% идентичен SEQ ID NO:5. Например, гуманизированное антитело может содержать последовательность CDR-H1, соответствующую остаткам 31-35 SEQ ID NO:5, последовательность CDR-H2, соответствующую остаткам 50-66 из SEQ ID NO:5, и последовательность CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:5. Гуманизированное антитело может также или альтернативно содержать в домене VH V или Q в позиции 5 по Кабату, М и L в позиции 69 по Кабату, Т или V в позиции 71 по Кабату, Т или K в позиции 73 по Кабату и Т или S в позиции 75 по Кабату.
В другом аспекте изобретение предлагает молекулу антитела, которая также или альтернативно содержит домен VL, последовательность которого по меньшей мере примерно на 50%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80% идентична (например, по меньшей мере примерно на 85%, 90%, 95%, 97% или более идентична) домену VL из Z270, humZ270 и/или humZ270cons (SEQ ID NOS:1, 4 и 6, соответственно). В другом частном аспекте изобретение предлагает гуманизированное антитело, связывающее NKG2A и содержащее регион VL, который включает нечеловеческие CDR остатки, вставленные в человеческий домен VL, где домен VL по меньшей мере примерно на 50% идентичен SEQ ID NO:4. В одном воплощении регион VL по меньшей мере на 90% идентичен SEQ ID NO:4. Например, гуманизированное антитело может содержать последовательность CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:4, последовательность CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:4, и последовательность CDR - L3, соответствующую остаткам 89-97 из SEQ ID NO:4. Гуманизированное антитело может также или альтернативно содержать в VL домене L или F в позиции 46 по Кабату и/или I или V в позиции 48 по Кабату.
В другом аспекте изобретение предлагает изолированное гуманизированное антитело, которое специфично связывается с NKG2A и содержит либо (а) последовательности CDR-L1, CDR-L2 и/или CDR-L3 из VL Z270 (SEQ ID NO:1), VL humZ270 (SEQ ID NO:4) или VL humZ270 cons (SEQ ID NO:6) либо (b) последовательности CDR-H1, CDR-H2 и/или CDR-H3 из VH Z270 (SEQ ID NO:2), humZ270 (SEQ ID NO:5), humZ270 cons (SEQ ID NO:7) или humZ270 cons2 (SEQ ID NO:8). В другом аспекте изобретение предлагает молекулу антитела, которая содержит по меньшей мере полный набор VH CDRs из Z270, humZ270 или humZ270 cons, где шесть С-концевых аминокислот идентичны таким же аминокислотам человеческой акцепторной последовательности. В частном аспекте изобретение предлагает молекулу антитела, содержащую CDR-H1, CDR-H2 (или ее N-концевую часть) и CDR-H3 из Z270, humZ270 или humZ270 cons и по меньшей мере некоторые из CDR-L1, CDR-L2 и CDR-L3 из Z270, humZ270 или humZ270 cons. В более частном аспекте изобретение предлагает молекулу антитела, содержащую CDR-L1, CDR-L2 и CDR-L3, CDR-H1, CDR-H2 и CDR-H3 из Z270, humZ270 или humZ270 cons, где с помощью подходящих FR последовательностей CDR-L1 связан с CDR-L2, CDR-L2 связан с CDR-L3, CDR-H1 связан с CDR-H2, а CDR-H2 связан с CDR-H3.
В частном аспекте изобретение предлагает молекулы антитела, содержащие практически все домены VH и/или VL из humZ270, humZ270 cons или humZ270 cons2.
Гуманизированное анти-NKG2A антитело в соответствии с изобретением может включать целиком или частично тяжелую цепь (heavy-chain, НС), содержащую описанный здесь humZ270VH, при этом любая целая НС или ее часть, содержащая humZ270VH, может быть комбинирована с любым описанным здесь humZ270VL, и образующееся в результате этого антитело или его фрагмент тестируется на эффективность антиген-связывания, функциональный эффект на CD94/NKG2A-экспрессирующие клетки и/или иммуногенность.
Предусматриваются различные формы гуманизированного антитела. Например, гуманизированное антитело может быть фрагментом антитела, таким как Fab или другой описанный здесь тип фрагмента. Кроме того, гуманизированное антитело может иметь полную длину или быть интактным антителом, таким как антитела lgG1 или lgG4 полной длины или интактные lgG1 или lgG4. В одном воплощении гуманизированное антитело представляет собой антитело lgG4 полной длины или его фрагмент.
В одном аспекте данное изобретение предлагает гуманизированное антитело, которое характеризуется: а) специфичным связыванием с NKG2A; b) неспецифичным связыванием с Fc-рецептором; и с) связыванием с NKG2A на человеческой НК-клетке при вступлении указанной НК-клетки в контакт с целевой человеческой клеткой, несущей HLA-E на своей поверхности, в результате чего указанная НК-клетка лизирует указанную целевую клетку. В одном воплощении гуманизированное антитело содержит мышиный или человеческий константный регион lgG1, который был модифицирован с целью предотвращения связывания с Fc рецептором, или человеческий константный регион lgG4. Такие антитела, а также фрагменты антител, которые не связываются с Fc рецептором, особенно удобно использовать в тех случаях, когда желательно активировать НК-клетки (например, при раке, инфекционных болезнях), не вызывая при этом самоистощения НК-клеток, что может быть опосредовано антитело-зависимой клеточной цитотоксичностью; такие антитела могут упоминаться как "неистощающие" антитела.
В другом аспекте гуманизированное антитело включает мышиный или человеческий константный регион lgG1, который связывается с Fc-рецептором, или человеческий константный регион lgG1, 2, 3 или 4, который был модифицирован с целью связывания с Fc-рецептором или усиления связывания с Fc-рецептором, или человеческий константный регион lgG4. В другом воплощении моноклональное антитело или его фрагмент связан с группировкой, токсичной для клеток, с которыми связывается антитело. Такие антитела особенно удобно использовать в тех случаях, когда желательно истощить пул НК-клеток, что полезно в некоторых случаях, например, при NK-LDGL (НК-тип лимфопролиферативного заболевания гранулярных лимфоцитов; также может называться NK-LGL); такие антитела могут упоминаться как "истощающие" антитела.
Для рекомбинантной продукции гуманизированных антител гуманизированные регионы VH и VL или их вариантные версии могут быть клонированы в векторы экспрессии, кодирующие константые регионы человеческого антитела полной или частичной длины в соответствии со стандартными рекомбинантными способами (см., например, Sambrook et at., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989). Результатом является трансфицированная клеточная линия, которая экспрессирует и секретирует целевую молекулу гуманизированного антитела, содержащую выбранные регионы VH и VL и константные регионы. Известны последовательности кДНК, кодирующие константные регионы человеческих антител. Типичными последовательностями кДНК, доступными, например, через GenBank, являются следующие (каждая включена в полном объеме путем ссылки на нее):
константный регион тяжелой цепи человеческого lgG1: номер в GenBank: J00228;
константный регион тяжелой цепи человеческого lgG2: номер в GenBank: J00230;
константный регион тяжелой цепи человеческого lgG3: номер в GenBank: Х04646;
константный регион тяжелой цепи человеческого lgG4: номер в GenBank: K01316;
и константный регион легкой каппа-цепи: номер в GenBank: J00241.
При необходимости класс гуманизированного антитела также может быть "переключен" известными способами. Например, антитела, которые изначально продуцируются как молекулы IgM, могут быть переключены на антитела класса IgG. Методики переключения класса также могут быть использованы для преобразования одного подкласса IgG в другой, например, lgG1 в lgG2. Таким образом, эффекторная функция антител изобретения может быть изменена путем переключения изотипа, например антител lgG1, lgG2, lgG3, lgG4, IgD, IgA, IgE или IgM в различных терапевтических целях.
Константный регион также может быть модифицирован в соответствии с известными способами. Например, в константном регионе lgG4 остаток S241 может мутировать в остаток пролина (Р), благодаря чему образуется дисульфидный мостик и формируется петля (см., например, Angal et al., Mol Immunol. 1993:30:105-8).
Фрагменты антител
Гуманизированные антитела изобретения могут быть получены как фрагменты антител, или фрагменты антител могут быть получены из гуманизированных антител полной длины.
Были разработаны различные методики для получения фрагментов антител из гуманизированных антител. Традиционно эти фрагменты получают путем протеолитического расщепления антител полной длины (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods, 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты могут быть получены непосредственно из рекомбинантных принимающих клеток (клеток-хозяев). Кроме того, фрагменты Fab'-SH могут быть получены непосредственно от Е.coli и химически связаны для формирования F(ab')2-фрагментов (Carter et al., Bio/Technology, 10:163-167 (1992)). В соответствии с другим подходом, F(ab')2-фрагменты могут быть изолированы непосредственно из принимающих клеток рекомбинантной клеточной культуры. Другие методики получения фрагментов антител специалисту будут очевидны. В других воплощениях антитело выбора представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 1993/16185; патент США №5571894, а также патент США №5587458. Фрагмент антитела также может быть "линейным антителом", например как описано в патенте США №5641870. Такие линейные фрагменты антител могут быть моно- и биспецифическими.
Биспецифические антитела являются антителами, которые обладают специфичностью связывания по меньшей мере в двух различных эпитопах. Способы получения биспецифических антител хорошо известны в данной области, и традиционное получение биспецифических антител полной длины обычно основывается на коэкспрессии двух иммуноглобулиновых пар «тяжелая цепь-легкая цепь», где две эти цепи имеют разную специфичность (Millstein et al., Nature, 305: 537-539 (1983)). В биспецифических антителах в соответствии с данным изобретением по меньшей мере один эпитоп связывания представляет собой NKG2A-белок. Анти-NKG2A-связывающая "ветвь" может быть комбинирована с "ветвью", которая связывается с триггерной молекулой, находящейся на лейкоците, например с молекулой Т-клеточного рецептора (например, CD2 или CD3) или с Fc-рецептором к IgG (Fcgamma-R), с Fc-гамма-RI (CD64.), FC-гамма-RII (CD32) и FC-гамма-RIII (CD16), с тем, чтобы сосредоточить защитные клеточные механизмы на NKG2A-экспрессирующей клетке. Биспецифические антитела могут быть также использованы для локализации цитотоксических агентов на клетках, экспрессирующих NKG2A. Эти антитела обладают NKG2A-связывающей ветвью и ветвью, которая связывает цитотоксический агент (например, сапонин, анти-интерферон-альфа, алкалоид Барвинка, А-цепь рицина, метотрексат или радиоактивный изотопный гаптен). Биспецифические антитела могут быть получены как антитела полной длины или фрагменты антител (например, F(ab')2-биспецифические антитела). Предусматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al., J. Immunol, 147:60 (1991).
Типичные антитела, фрагменты антител и мультиспецифические антитела изобретения содержат части CDR-H2 и CDR-H3, которые содержат остатки D52, D54, R94, F99, Т(100C) и W (100F) из SEQ ID NO:2 или SEQ ID NO:5, которые, как было показано, имеют решающее значение для антигенного связывания (см. раздел Примеры). Возможно, фрагменты гуманизированных антител и мультиспецифические антитела также содержат остатки N35, Y53, Е56, D98, V(100A) и L(100D) тяжелой цепи Z270. В одном аспекте фрагмент гуманизированного антитела или мультиспецифическое антитело изобретения содержит остатки 50-59 из CDR-H2 и остатки 95-102 из CDR-H3 из SEQ ID NO:2 или SEQ ID NO:5. В одном воплощении фрагмент гуманизированного антитела или мультиспецифическое антитело не содержит один, два или все CDR-L1, CDR-L2 и L3-CDR Z270. В дополнительном или альтернативном воплощении фрагмент антитела или мультиспецифическое антитело не содержит CDR-H1 Z270.
Производные антител
Производные антител в рамках данного изобретения содержат гуманизированные антитела, конъюгированные или ковалентно связанные со вторым агентом.
Например, в одном аспекте изобретение предлагает иммуноконъюгаты, содержащие гуманизированное антитело, конъюгированное или ковалентно связанное с цитотоксическим агентом. Термин "цитотоксический агент", используемый в данном документе, означает молекулу, которая способна уничтожить клетку, несущую NKG2A-рецептор на своей поверхности. Группировки любого типа с цитотоксическим или цитоингибиторным эффектом могут быть конъюгированы с данными антителами для формирования цитотоксического конъюгата данного изобретения и для ингибирования или уничтожения клеток, экспрессирующих специфический НК-рецептор, включая терапевтические радиоизотопы, токсические белки, токсические малые молекулы, например лекарства, токсины, иммуномодуляторы, гормоны, антагонисты гормонов, ферменты, олигонуклеотиды, ингибиторы ферментов, терапевтические радионуклиды, ингибиторы ангиогенеза, химиотерапевтические лекарства, алкалоиды Барвинка, антрациклины, эпидофиллотоксины, таксаны, антиметаболиты, алкилирующие агенты, антибиотики, ингибиторы ЦОГ-2, SN-38, антимитотики, антиангиогенные и апоптотические агенты, в частности, доксорубицин, метотрексат, таксол, СРТ-11, камптотеканы, горчичный азот, гемцитабин, алкилсульфонаты, нитрозомочевины, триазены, аналоги фолиевой кислоты, пиримидиновые аналоги, пуриновые аналоги, координационные комплексы платины, экзотоксин Pseudomonas, рицин, абрин, 5-фторуридин, рибонуклеаза (РНКаза), ДНКаза I, стафилококковый энтеротоксин-А, антивирусный белок лаконоса, гелонин, дифтерийный токсин, экзотоксин Pseudomonas, эндотоксин Pseudomonas и др. (см., например, Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co. 1995); Goodman and Oilman's The Pharmacological Basis of Therapeutics (McGraw Hill, 2001); Pastan et al. (1986) Cell 47:641; Goldenberg (1994) Cancer Journal for Clinicians 44:43; патент США №6077499, полное раскрытие которых включено сюда путем ссылки на них). Важно, что токсин может быть животного, растительного, микробного происхождения, может быть получен из грибов или создан de novo путем химического синтеза.
В другом воплощении антитело представляет собой производное с радиоактивным изотопом, таким как терапевтический радионуклид или радионуклид, подходящий для выявления целей. Может быть использован любой из числа подходящих радиоактивных изотопов, включая 1-131, индий-111, лютеций-171, висмут-212, висмут-213, астат-211, медь-62, медь-64, медь-67, иттрий-90, йод-125, йод-131, фосфор-32, фосфор-33, скандий-47, серебро-111, галлий-67, празеодим-142, самарий-153, тербий-161, диспрозий-166, гольмий-166, рений-186, рений-188, рений-189, свинец-212, радий-223, актиний-225, железо-59, селен-75, мышьяк-77, стронций-89, молибден-99, родий-105, палладий-109, празеодим-143, прометий-149, эрбий-169, иридий-194, золото-198, золото-199 и свинец-211, но не ограничиваясь ими. Обычно радионуклид предпочтительно имеет энергию распада в диапазоне от 20 до 6000 кэВ, предпочтительно в диапазоне от 60 до 200 кэВ для Оже эмиттера, 100-2500 кэВ для бета-эмиттера и 4000-6000 кэВ для альфа-эмиттера. Также предпочтительными являются радионуклиды, которые в существенной степени распадаются с образованием альфа-частиц.
В других воплощениях второй агент является обнаруживаемой группировкой, которой может быть любая молекула, которую можно количественно или качественно наблюдать или измерять. Примерами обнаруживаемых маркеров, используемых в конъюгированных антителах данного изобретения, являются радиоизотопы, флюоресцентные метки или члены комплементарно связанной пары, например, одной из следующих: антиген/антитело (помимо антител к NKG2A), лектин/углевод; авидин/биотин; рецептор/лиганд; или молекулярные системы полимер-отпечаток/молекула штамп.
Второй агент может также или альтернативно быть полимером, предназначенным для увеличения времени полужизни гуманизированного антитела в кровотоке. Типичные полимеры и способы присоединения к пептидам таких полимеров проиллюстрированы, например, в патентах США №№4766106; 4179337; 4495285 и 4609546. Дополнительные проиллюстрированные полимеры включают полиоксиэтилированные полиолы и полиэтиленгликольные (ПЭГ) группировки (например, антитело полной длины или фрагмент антитела может быть конъюгирован с одной или более ПЭГ-молекулами с молекулярной массой от примерно 1000 до примерно 40000, такой как от примерно 2000 до примерно 20000, например примерно 3000-12000).
Цитотоксические агенты или другие соединения могут быть связаны с антителом непосредственно или косвенно, с использованием любого из большого числа доступных способов. Например, агент может быть присоединен к петельному региону компонента редуцированного антитела через образование дисульфидного мостика с использованием веществ, образующих поперечные мостики (кросс-линкеров), таких как N-сукцинил-3-(2-пиридилдитио)проприонат (SPDP), или через углеводную группировку в Fc-регионе антитела (см., например, Yu et al. (1994) Int. J. Cancer 56:244; Wong, Chemistry of Protein Conjugation and Cross-linking (CRC Press 1991); Upeslacis et al., "Modification of Antibodies by Chemical Methods," in Monoclonal antibodies: principles and applications, Birch et al. (eds.), pages 187-230 (Wiley-Liss, Inc. 1995); Price, "Production and Characterization of Synthetic Peptide-Derived Antibodies," in Monoclonal antibodies: Production, engineering and clinical application, Ritter et al. (eds.), pages 60-84 (Cambridge University Press 1995). Cattel et al. (1989) Chemistry today 7:51-58, Delprino et al. (1993) J. Pharm. Sci 82:699-704; Arpicco et al. (1997) Bioconjugate Chemistry 8:3; Reisfeld et al. (1989) Antihody, Immunicon. Radiopharrn. 2:217, полное раскрытие которых включено сюда путем ссылки на них).
Кроме того, синтез белка, содержащего анти-NKG2A антитело и второй (цитотоксический или другой) полипептидный агент, может быть проведен, например, в соответствии с рекомбинантными методиками или посредством пептидного синтеза.
Анализ связывания
Данное изобретение предлагает антитела, связывающиеся с человеческим NKG2A, в частности, гуманизированные версии анти-NKG2A антитела, полученные с помощью Z270 гибридомы.
Любые самые разнообразные анализы могут быть использованы для оценки связывания антитела с человеческим NKG2A. Хорошо известны в данной области и пригодны для использования протоколы, основанные среди прочего на ИФА, радиоиммуноанализе, Вестерн-блоттинге, исследовании BIACORE и других конкурентных анализах.
Например, могут быть использованы простые анализы связывания, когда тестируемое антитело инкубируют в присутствии целевого белка или эпитопа (например, NKG2A или его части), несвязанные антитела отмывают, а имеющиеся связанные антитела оценивают с использованием, например, радиометок, физических способов, таких как масс-спектрометрия, или прямых или непрямых флюоресцентных меток, которые можно обнаружить, например, с помощью цитофлуометрического анализа (например, FACScan). Такие способы хорошо известны специалистам в данной области. Если количество связей больше, чем при связывании с контрольным неспецифические антителом, то это свидетельствует о специфическом связывании антитела с целью.
В таких анализах способность тестируемого антитела к связыванию с целевой клеткой или человеческим NKG2A можно сравнить со способностью (отрицательно) контрольного белка, который связывается с той же целью, например, это может быть антитело с увеличенным структурным несоответствием антигену, или не-lg пептид, или белок. Если антитела или фрагменты связываются с целевыми клетками или NKG2A с аффинностью, определенной с помощью любого подходящего анализа и увеличенной на 25%, 50%, 100%, 200%, 1000% или более по сравнению с аффинностью контрольного белка, то о таких антителах или фрагментах говорят, что они "специфично связываются" или "специфично взаимодействуют" с целью и они являются предпочтительными для использования в терапевтических способах, описанных ниже. Также может быть оценена способность тестируемого антитела вызывать связывание (положительно) контрольного антитела против NKG2A, например Z270, или его производных.
Гуманизированные анти-NKG2A антитела могут или не могут связываться с человеческими NKG2C, могут или не могут связываться с человеческими NKG2E или могут или не могут связываться с человеческими NKG2C и Е. В частном воплощении моноклональное антитело или фрагмент не связывается с другими человеческими NKG2 рецепторами, специфично активируя рецепторы NKG2C или NKG2E. NKG2C и NKG2E-связывающие свойства антител изобретения можно оценить с помощью подобных описанным выше анализов, просто заменяя NKG2A на интересующую молекулу.
В одном аспекте изобретение предлагает гуманизированные версии нечеловеческих антител с измененными биологическими характеристиками и/или существенной идентичностью последовательности с Z270. Одной типичной биологической характеристикой является связывание с эпитопом Z270, т.е. с регионом во внеклеточном домене NKG2A, с которым связывается антитело Z270. Для выявления антител, которые связывают с эпитопом Z270, может быть выполнен обычный анализ перекрестного связывания, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
В типичном перекрестном или конкурентном анализе антитело Z270 (контрольное) и тестируемое антитело смешаны (или предварительно адсорбированы) и внесены к образцам, содержащим NKG2A. В некоторых воплощениях можно предварительно смешивать контрольные антитела с различным количеством тестируемых антител (например, 1:10 или 1:100) в течение определенного периода времени до внесения в NKG2A-содержащий образец. В других воплощениях контрольное антитело и различное количество тестируемого антитела могут быть просто смешаны перед воздействием антигена/целевого образца. До тех пор, пока можно отделить связанные антитела от свободных (например, с помощью методик разделения или отмывки для элиминации несвязанных антител), а также контрольное антитело от тестируемого (например, с использованием видоспецифических или изотипспецифических вторичных антител, специфически связывая контрольное антитело с обнаруживаемой меткой, или с помощью физических способов, таких как масс-спектрометрия, для разделения различных соединений), можно будет определить, уменьшает ли тестируемое антитело связывание контрольного антитела с антигеном, что свидетельствует о том, что тестируемое антитело распознает по существу тот же эпитоп, что и контрольное антитело. В данном анализе связывание (меченого) контрольного антитела в присутствии полностью несоответствующего антитела является контролем высокого качества. Контроль низкого качества будет получен путем инкубации меченого (позитивного) контрольного антитела (Z270) с немеченым контрольным антителом, при этом возникнет конкуренция и уменьшится связывание меченых антител.
В тестовом анализе значительное снижение реактивности меченого антитела в присутствии тестируемого антитела свидетельствует о том, что тестируемое антитело распознает тот же эпитоп, т.е. имеет место "перекрестная реакция" с меченым контрольным антителом. Если тестируемое антитело или соединение уменьшает связывание меченого контроля с антигеном/целью по меньшей мере на 50% или более предпочтительно на 70%, в любом соотношении контроль:тестируемое антитело (или соединение) между 1:10 и 1:100, то считается, что такое антитело или соединение связывает по существу тот же эпитоп или детерминанту, что и контроль. Предпочтительно, чтобы такое тестируемое антитело или соединение уменьшало связывание контрольного антигена/цели по меньшей мере на 90%. Тем не менее, любое соединение или антитело, которое уменьшает связывание контрольного антитела или соединения в любой измеримой степени, может быть использовано в данном изобретении.
Аналогичные перекрестные анализы также могут быть использованы для определения, влияет ли тестируемое (гуманизированное) антитело на связывание HLA-E (природного лиганда для человеческого NKG2A) с NKG2A, путем замены Z270 на подходящую форму HLA-Е. Например, чтобы определить, является ли гуманизированное анти-NKG2A антитело препаратом, снижающим или блокирующим CD94/NKG2A взаимодействие с HLA-E, можно выполнить следующие тесты: Клеточную линию, экспрессирующую CD94/NKG2A, такую как Ba/F3-CD94/NKG2A, NKL или NK92, инкубируют в течение 30 минут на льду с повышенной концентрацией тестируемого анти-NKG2A антитела. Затем клетки инкубируют с РЕ-мечеными тетрамерами HLA-E в течение 30 минут на льду, снова промывают, и связанные тетрамеры HLA-E анализируют с помощью поточной цитометрии (FACScalibur, Beckton Dickinson) стандартными способами. В отсутствие тестируемых антител тетрамер HLA-E связывается с клетками. В присутствии препарата антитела, блокирующего CD94/NKG2A-связывание с HLA-E, наблюдается уменьшение связывания тетрамеров HLA-E с клетками, и такие моноклональные антитела обозначаются как "блокирующие антитела".
В некоторых аспектах изобретения, например, когда уничтожение NKG2A-экспрессирующих клеток нежелательно, гуманизированные антитела данного изобретения предпочтительно не демонстрируют существенное специфическое связывание с Fc-рецепторами. Такие антитела могут включать константные регионы различных тяжелых цепей, которые, как известно, не связываются с Fc-рецепторами. Одним из таких примеров является константный регион lgG4. Кроме того, фрагменты антител, которые не содержат константные регионы, например, фрагменты Fab и F(ab')2, могут быть использованы для избежания Fc-рецепторного связывания. Fc-рецепторное связывание может быть оценено при помощи известных в данной области способов, включая, например, пробное связывание антитела с Fc-рецепторным белком в анализе BIACORE. Также может быть использован любой другой тип антител, в котором Fc-часть модифицирована в целях минимизации или устранения связывания с Fc-рецепторами (см., например, WO03101485, который включен сюда путем ссылки на него). Анализы для оценки Fc-рецепторного связывания, такие как основные клеточные анализы, хорошо известны в данной области и описываются, например, в WO03101485.
Анализ цитотоксичности
Если анти-NKG2A антитело уменьшает или блокирует CD94/NKG2A взаимодействия с HLA-E, оно может увеличить цитотоксичность CD94/NKG2A-несущих лимфоцитов. Она может быть оценена с помощью типичного анализа цитотоксичности, примеры которого приведены ниже.
Способность антитела к уменьшению CD94/NKG2A-опосредованной сигнализации может быть протестирована в стандартном четырехчасовом анализе цитотоксичности in vitro с использованием, например, NKL-клеток, которые экспрессируют CD94/NKG2A, и целевых клеток, которые экспрессируют HLA-E. Такие NKL-клетки неэффективно уничтожают цели, экспрессирующие HLA-E, поскольку CD94/NKG2A распознает HLA-E, что приводит к инициации и распространению ингибиторных сигналов, предотвращая опосредованный лимфоцитами цитолиз. Такой анализ цитотоксичности in vitro может проводиться по стандартным способам, хорошо известным в данной области и описанным, например, в Coligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience, N.Y., (1992, 1993). Целевые клетки метятся 51Cr перед добавлением NKL-клеток, а затем их уничтожение оценивается как пропорциональное высвобождению 51Cr из клеток к среду, происходящему в результате уничтожения. Дополнительное антитело, которое препятствует связыванию CD94/NKG2A с HLA-E, предотвращает инициирование и распространение ингибиторного сигнала через CD94/NKG2A. Поэтому добавление таких агентов приводит к увеличению опосредованного лимфоцитами уничтожения целевых клеток. Этот этап тем самым определяет агенты, которые препятствуют CD94/NKG2A-индуцированному негативному сигналу, например путем блокирования связывания лиганда. В частном анализе цитотоксичности с высвобождением 51Cr CD94/NKG2A-экспрессирующие эффекторные NKL-клетки могут уничтожать HLA-E-негативные LCL 721.221 целевые клетки, но не столь хорошо, как HLA-E-экспрессирующие LCL 721.221-Cw3 контрольные клетки. Напротив, эффекторные YTS-клетки без CD94/NKG2A эффективно уничтожают обе клеточные линии. Таким образом, эффекторные NKL-клетки уничтожают менее эффективно HLA-E+ LCL 721.221-Cw3 клетки в связи с HLA-E-индуцированным ингибиторным сигналом через CD94/NKG2A. Когда NKL-клетки предварительно инкубировали с блокирующими анти-CD94/NKG2A антителами в соответствии с данным изобретением в таком анализе цитотоксичности с высвобождением 51Cr, HLA-E-экспрессирующие LCL 721.221-Cw3 клетки уничтожались более эффективно в зависимости от концентрации антитела.
Ингибиторная или потенцирующая активность антитела этого изобретения может быть оценена одним из множества других способов, например, путем его влияния на внутриклеточный свободный кальций, как описано, например, в Sivori et al., J. Exp. Med. 1997; 186:1129-1136, раскрытие которого включено сюда путем ссылки. Активность НК-, Т- или НКТ-клеток также можно оценить с помощью основных анализов цитотоксичности клеток, например, измеряя высвобождение хрома или другие параметры оценки способности антитела стимулировать НК-клетки к уничтожению целевых клеток, таких как клетки Р815, К562, или соответствующих опухолевых клеток, раскрытых в Sivori et al., J. Exp.Med. 1997; 186:1129-1136; Vitale et al., J. Exp. Med. 1998; 187:2065-2072; Pessino et al. J. Exp. Med. 1998; 188:953-960; Neri et al. Clin. Diag. Lab. Immun. 2001; 8:1131-1135; Pende et al. J. Exp. Med. 1999; 190:1505-1516, полное раскрытие которых включено сюда путем ссылки.
В одном воплощении получение антитела приводит к увеличению цитотоксичности CD94/NKG2A-несущих лимфоцитов по меньшей мере на 10%, предпочтительно увеличение цитотоксичности НК по меньшей мере на 40% или 50% или более предпочтительно увеличение цитотоксичности НК по меньшей мере на 70%.
Активность цитотоксического лимфоцита также может быть оценена с помощью анализа высвобождения цитокинов, при котором НК-клетки инкубируют с антителом для стимуляции цитокиновой продукции НК-клетками (например, продукции ИФН-γ и ФНО-α). В типичном протоколе продукция ИФН-γ РВМС-клетками (мононуклеарами периферической крови) оценивается после 4 дней культивирования путем окрашивания клеточной поверхности и внутрицитоплазматического окрашивания и анализа с помощью проточной цитометрии. Описывая кратко, Brefeldin (Sigma Aldrich) добавляют в конечной концентрации 5 мкг/мл в течение последних 4 часов культивирования. Затем клетки инкубируют с анти-CD3 и анти-CD56 моноклональными антителами, после чего проводят пермеабилизацию (IntraPrep™; Beckman Coulter) и окрашивание РЕ-анти-ИФН-γ или PE-lgG1 (Pharmingen). Продукция ГМ-КСФ и ИФН-γ активированными поликлональными НК-клетками измеряется в супернатантах с помощью ELISA (ГМ-КСФ: DuoSet Elisa, R&D Systems, Minneapolis, MN, ИФН-γ: OptEIA set, Pharmingen).
В частном аспекте изобретение предлагает антитела, которые обладают большей способностью или большей эффективностью в увеличении цитотоксичности CD94/NKG2A-несущих лимфоцитов, в потенцировании цитотоксической активности CD94/NKG2A-несущего лимфоцита или в уменьшении или ингибировании CD94/NKG2A-опосредованной сигнализации по сравнению с оригинальным негуманизированным антителом и/или его химерной версией. Такие антитела могут обладать способностью или эффективностью, увеличенной, например, по меньшей мере на 2%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, или по меньшей мере на 20% по сравнению с оригинальным негуманизированным антителом и/или его химерной версией.
Рекомбинантные способы
Изобретение также предлагает изолированные нуклеиновые кислоты, кодирующие анти-NKG2A антитела, описанные в данном документе, а также векторы и принимающие клетки, содержащие такие нуклеиновые кислоты. Также предлагаются способы получения таких анти-NKG2A антител с помощью рекомбинантных методик, таких как, например, культивирование подходящих принимающих клеток, содержащих такие нуклеиновые кислоты или векторы, и таким образом экспрессирующих нуклеиновую кислоту и продуцирующих гуманизированное антитело. Перед культивированием принимающая клетка может, например, быть котрансфицирована с вектором, содержащим нуклеиновые кислоты, кодирующие вариабельный домен тяжелой цепи, или с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный домен легкой цепи. Кроме того, антитело может быть извлечено и/или очищено от культуры принимающих клеток с помощью известных методик. Используемые векторы, принимающие клетки, а также методики описаны ниже и в разделе Примеры. Кроме того, стратегии экспрессии гуманизированных анти-NKG2A антител изложены на Фиг.4-6.
Как правило, для рекомбинантной продукции антитела нуклеиновую кислоту, кодирующую его, изолируют и вставляют в способный к репликации вектор, как правило, функционально связанный с одним или более элементами контроля экспрессии, для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую моноклональное антитело, быстро изолируют и секвенируют с помощью обычных процедур (например, с помощью олигонуклеотидных зондов, которые могут специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие векторы известны и доступны. Векторные компоненты, как правило, включают одну или более следующих частей: сигнальную последовательность, репликатор, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции, но не ограничиваются ими.
Компонент сигнальной последовательности
Анти-NKG2A антитело этого изобретения может быть получено рекомбинантно не только непосредственно, но также в полипептидном соединении с гетерологичным полипептидом, который предпочтительно является сигнальной последовательностью или другим полипептидом, имеющим специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно является последовательностью, которая распознается и обрабатывается (например, расщепляется сигнальной пептидазой) принимающей клеткой. См., например, пример 2, где показаны типичные сигнальные последовательности для экспрессии гуманизированных тяжелых и/или легких цепей анти-NKG2A антител, например гуманизированных Z270 антител.
Для прокариотических принимающих клеток, которые не распознают и не обрабатывают нативную сигнальную последовательность анти-NKG2A антитела, сигнальная последовательность заменяется прокариотической сигнальной последовательностью, выбранной, например, среди щелочной фосфатазы, пенициллиназы, липопротеина или лидерных последовательностей термоустойчивого энтеротоксина II. Для дрожжевой секреции нативная сигнальная последовательность может быть заменена, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью альфа-фактора (в том числе лидерной последовательностью альфа-фактора Saccharomyces и Kluyveromyces), лидерной последовательностью кислотной фосфатазы, лидерной последовательностью гликоамилазы С.albicans или сигналом, указанным в WO 1990/13646. Для экспрессии в клетках млекопитающих могут использоваться сигнальные последовательности млекопитающих, а также секреторные лидерные последовательности вирусов, например сигнальная последовательность вируса простого герпеса.
ДНК таких регионов предшественников лигируют в рамке считывания с ДНК, кодирующей анти-NKG2A антитело.
Компонент начала репликации (origin)
И векторы экспрессии, и векторы клонирования содержат последовательности нуклеиновых кислот, которые позволяют им реплицироваться в одной или более чем одной выбранной принимающей клетке. Обычно в клонирующих векторах она представляет собой последовательность, которая позволяет вектору реплицироваться независимо от хромосомной ДНК принимающей клетки, и включает в себя репликаторы (origin of replication) или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для различных бактерий, дрожжей и вирусов. Для клонирования векторов в клетки млекопитающих используется репликатор из плазмиды pBR322, подходящий для большинства грамотрицательных бактерий, репликатор плазмиды 2µ, подходящий для дрожжей, а также различные вирусные репликаторы (вируса SV40, вируса полиомы, аденовируса, вируса VSV, ВЭБ или вируса BPV). Обычно репликаторный компонент не является необходимым для векторов экспрессии у млекопитающих (репликатор SV40 может, как правило, быть использован только потому, что он включает ранний промотор).
Компонент «селектируемый ген»
Векторы экспрессии и клонирования могут содержать селектируемый ген, который также называют селектируемым маркером. Типичные селектируемые гены кодируют белки, которые (а) обеспечивают резистентность к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) восполняют ауксотрофную недостаточность или (с) поставляют важные питательные вещества, недоступные в комплексных средах, например, ген, кодирующий рацемат D-аланина для бацилл.
Один пример селектируемой схемы использует лекарства для задержки роста принимающей клетки. Те клетки, которые успешно переходят на продукцию белка с помощью гетерологичных генов, получают лекарственную резистентность и таким образом выживают в выбранном режиме. Например, такую доминантную селекцию используют по отношению к лекарствам неомицин, микофеноловая кислота и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются те маркеры, которые позволяют идентифицировать клетки, способные к восприятию нуклеиновой кислоты, кодирующей анти-NKG2A антитело, например, DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеинов приматов, аденозиндеаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные с селектируемым геном DHFR, в первую очередь выявляются путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (МТХ), конкурентный антагонист DHFR. Соответствующая принимающая клетка, в которой используется дикий тип DHFR, представляет собой клеточную линию яичника китайского хомячка (СНО) с недостаточной активностью DHFR.
С другой стороны, принимающие клетки (особенно клетки дикого типа, которые содержат эндогенный DHFR), трансформированные или котрансформированные с ДНК последовательностями, кодирующими анти-NKG2A антитело, белок DHFR дикого типа и другой селектируемый маркер, например аминогликозид 3'-фосфотрансфераза (АРН), могут быть отобраны путем клеточного роста в среде, содержащей селектируемый агент для селектируемого маркера, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США №4965199.
Подходящим селектируемым геном для использования у дрожжей является ген trp1, представленный в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 предоставляет селектируемый маркер для мутантного штамма дрожжей, который не способен расти в триптофановой среде, например, АТСС №44076 или РЕР4-1. Jones, Genetics, 85:12 (1977). Наличие дефекта в геноме дрожжевой принимающей клетки затем обеспечивает эффективную среду для выявления трансформации путем роста в отсутствие триптофана. Кроме того, Leu2-дефицитные штаммы дрожжей (АТСС 20622 или 38626) дополняют известными плазмидами, несущими ген Leu2.
Кроме того, векторы, полученные из 1,6 мкм кольцевой плазмиды PKD1, могут использоваться для трансформации дрожжей рода Kluyveromyces. С другой стороны, для K. lactis была представлена система экспрессии для продукции рекомбинантного телячьего химозина в большом количестве (Van den Berg, Bio/Technology, 8:135 (1990). Также были раскрыты стабильные многократно копируемые векторы экспрессии для секреции зрелого рекомбинантного человеческого сывороточного альбумина промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technolog, 9: 968-975 (1991).
Промоторный компонент
Векторы экспрессии и клонирования, как правило, содержат промотор, который распознается принимающим организмом и функционально связан с нуклеиновой кислотой, кодирующей анти-NKG2A антитело. Промоторы, подходящие для использования с прокариотическими хозяевами, включают phoA промотор, β-лактамазную и лактозную промоторные системы, щелочную фосфатазу, триптофановую (ТРП) промоторную систему, а также гибридные промоторы, такие как tac-промотор. Однако подходящими являются и другие известные бактериальные промоторы. Промоторы, использующиеся в бактериальных системах, также будут содержать последовательность Шайн-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей анти-NKG2A антитело.
Для эукариот известны различные промоторные последовательности. Практически во всех эукариотических генах есть АТ-богатый регион, расположенный примерно в 25-30 парах оснований вверх от сайта инициации транскрипции. Другая последовательность, расположенная в 70-80 парах оснований вверх от места начала транскрипции многих генов, представляет собой CNCAAT регион, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится ААТААА последовательность, которая может быть сигналом для добавления полиаденилатного хвоста к 3'-концу кодирующей последовательности. Все эти последовательности подходят для вставки в эукариотические векторы экспрессии. Примеры подходящих промоторных последовательностей для использования их с дрожжевыми хозяевами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфат-дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфат-изомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые являются индуцируемыми промоторами с дополнительным преимуществом контроля транскрипции условиями роста, представляют собой промоторные регионы для алкогольдегидрогеназы-2, изоцитохрома С, кислотной фосфатазы, деградирующих ферментов, связанных с метаболизмом азота, металлотионенина, глицеральдегид-3-фосфат-дегидрогеназы, а также ферментов, ответственных за утилизацию мальтозы и галактозы. Векторы и промоторы, подходящие для использования в экспрессии у дрожжей, описаны кроме того в ЕР73657. Дрожжевые энхансеры также выгодно использовать с дрожжевыми промоторами.
Транскрипция анти-NKG2A антитела из векторов в принимающих клетках млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы кур, аденовирус (такой как Adenovirus 2), вирус папилломы быка, птичий вирус саркомы, цитомегаловирус (CMV), ретровирус, вирус гепатита В и наиболее предпочтительный обезьяний вирус 40 (SV40), гетерологичными промоторами млекопитающих, например актиновым промотором или иммуноглобулиновым промотором, и промоторами генов теплового шока, при условии, что такие промоторы совместимы с системами принимающей клетки.
Ранние и поздние промоторы вируса SV40 удобно получать в виде рестрикционного фрагмента SV40, который также содержит репликатор вируса SV40. Немедленно-ранний промотор человеческого цитомегаловируса удобно получать как рестрикционный фрагмент HindIII E. Система экспрессии ДНК у млекопитающих хозяев с использованием вируса папилломы быка в качестве вектора описана в патенте США №4419446. Модификация этой системы описана в патенте США №4601978. См. также Reyes et al., Nature, 297:598-601 (1982) об экспрессии человеческой кДНК бета-интерферона в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Кроме того, в качестве промотора могут быть использованы длинные концевые повторы вируса саркомы Рауса.
Компонент «энхансерный элемент»
Транскрипция ДНК, кодирующей анти-NKG2A антитело этого изобретения, высшими эукариотами часто усиливается путем вставления энхансерной последовательности в вектор. В настоящее время известно большое количество энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, как правило, используется энхансер из вируса эукариотической клетки. Такими примерами являются энхансер SV40 в конечной части репликатора (100-270 п.о.), энхансер раннего промотора цитомегаловируса, энхансер полиомы в конечной части репликатора и энхансеры аденовируса. См. также Yaniv, Nature, 297:17-18 (1982) об энхансерных элементах для активации эукариотических промоторов. Энхансер может быть введен в векторе в положении 5' или 3' в последовательность, кодирующую NKG2A-антитело, но предпочтительно, чтобы он был расположен на 5'-участке от промотора.
Компонент терминации транскрипции
Векторы экспрессии, используемые в эукариотических принимающих клетках (например, в клетках дрожжей, грибов, насекомых, растений, животных, человека или ядросодержащих клетках других многоклеточных организмов), будут также содержать последовательности, необходимые для терминации транскрипции, а также для стабилизации мРНК. Такие последовательности, как правило, доступны с 5'- иногда с 3'-конца нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти регионы включают нуклеотидные сегменты, которые транскрибируются как полиаденилатные фрагменты в нетранслируемой части мРНК, кодирующей анти-NKG2A антитело. Одним из используемых компонентов терминации транскрипции является полиаденилатный регион бычьего гормона роста. См. WO 1994/11026 и вектор экспрессии, раскрытый в нем.
Селекция и трансформация принимающих клеток
Подходящие принимающие клетки (клетки-хозяева) для клонирования или экспрессии ДНК в векторах здесь представляют собой прокариотические, дрожжевые клетки или клетки высших эукариот, описанные выше. Подходящие для этой цели прокариоты включают эубактерии, такие как грамотрицательные и грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например Е.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как В. subtilis и В. licheniformis (например, В. licheniformis 41 Р, раскрытый в DD 266710, опубликованном 12 апреля 1989), Pseudomonas, такие как Р. aeruginosa, и Streptomyces. Среди Е.coli предпочтительным для клонирующего хозяина является штамм Е.coli 294 (АТСС 31446), хотя подходят и другие штаммы, например, Е.coli В, Е.coli Х1776 (АТСС 31537) и Е.coli W3110 (АТСС 27325). Эти примеры являются скорее иллюстративными, чем ограничивающими.
Помимо прокариот, для клонирования или экспрессии принимающей клеткой векторов, кодирующих анти-NKG2A антитело, подходят также эукариотические микроорганизмы, такие как нитчатые грибы и дрожжи. Наиболее широко используемыми среди низших эукариотических принимающих микроорганизмов являются Saccharomyces cerevisiae, или пекарские дрожжи. Тем не менее, широко доступен и используется в данном изобретении целый ряд организмов других родов, видов и штаммов, таких как: Schizosaccharomyces pombe; Kluyveromyces, таких как K. lactis, K. fragilis (АТСС 12424), K. Bulgaricus (АТСС 16045), K. wickeramii (АТСС 24178), K. waltii (АТСС 56500), K. drosophilarum (АТСС 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia Pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidenttalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Подходящие принимающие клетки для экспрессии гликозилированного анти-NKG2A антитела могут быть получены из многоклеточных организмов. Примерами клеток беспозвоночных организмов являются клетки растений и насекомых. Были выявлены многочисленные бакуловирусные штаммы и варианты и принимающие клетки соответствующих пермиссивных насекомых, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступными являются такие разновидности вирусных штаммов для трансфекции, как, например, L-1 вариант Autographa californica NPV и Bm-5 штамм Bombyx mori NPV, и такие вирусы могут быть здесь использованы в качестве вируса в соответствии с данным изобретением, в частности для трансфекции клеток Spodoptera frugiperda.
Клеточные культуры растений хлопчатника, кукурузы, картофеля, сои, петунии, помидоров и табака также могут быть использованы в качестве принимающих клеток.
Тем не менее, наибольший интерес вызывают клетки позвоночных, а размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой. Примерами используемых принимающих клеточных линий млекопитающих являются линия почек обезьяны CV1, трансформированная SV40 (COS-7, АТСС CRL 1651); линия эмбриональной почки человека (НЕК) (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol., 36:59 (1977)); клетки почек детенышей хомяка (ВНК, АТСС CCL 10); клетки яичников китайского хомячка/-DHFR (СНО, Uriaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980), включая клеточные линии DG44 (Uriaub et al., Som. Cell and Mol. Gen., 12: 555-566 (1986)) и DP12); мышиные клетки Сертоли ((ТМ4, Mather, Biol. Reprod., 23:243-251 (1980)); клетки почек обезьян (CV1 АТСС CCL 70); клетки почек африканских зеленых мартышек (VERO-76, АТСС CRL-1587); клетки человеческой карциномы шейки матки (HELA, АТСС CCL 2); клетки почек собаки (MDCK, АТСС CCL 34); клетки печени крыс линии buffalo (BRL 3А, АТСС CRL 1442); клетки легких человека (W138, АТСС CCL 75); клетки печени человека (Hep G2, НВ 8065); клетки опухоли молочной железы мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci., 383:44-68 (1982)); клетки MRC 5; клетки FS4, а также клетки линии гепатомы человека (Мер G2).
Принимающие клетки трансформируют с помощью описанных выше векторов экспрессии или клонирования для производства анти-NKG2A антител и культивируют на обычных питательных средах, модифицированных соответственно для индуцирования промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности.
Культивирование принимающих клеток
Принимающие клетки, используемые для получения анти-МКе2А антитела данного изобретения, могут быть культивированы в различных средах. Коммерчески доступные среды, такие как среда Хама F10 (Sigma), MEM (Minimal Essential Medium, Sigma), RPMI-1640 (Sigma), FreeStyle™ (Cibco) и DMEM (Dulbecco's Modified Eagle's Medium, Sigma), пригодны для культивирования принимающих клеток. Кроме того, любая из сред, описанных, например, в Ham et al., Meth. Enz. 58:44 (1979); Barnes et al., Anal. Biochem., 102:255 (1980); патентах США №№4767704; 4657866; 4927762; 4560655 или 5122469; WO 1990/03430; WO 1987/00195; или патенте США Re. 30985, может быть использована в качестве среды для культивирования принимающих клеток. Любая из этих сред может быть дополнена по мере необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлористый натрий, кальций, магний и фосфат), буферами (таким как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарство GENTAMYCIN.TM.), микроэлементами (определенными как неорганические соединения, как правило, присутствующие в конечной концентрации в микромолярных дозах) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, рН и т.д., выбирают такие же, как использовались ранее для принимающих клеток, отобранных для экспрессии, и будут понятны специалистам.
Очистка анти-NKG2A антитела
При использовании рекомбинантных методик антитело может продуцироваться внутриклеточно или в периплазматическом пространстве, или секретироваться непосредственно в среду. Если антитело продуцируется внутриклеточно, то в качестве первого этапа разрушенные обломки либо принимающих клеток, либо лизированных фрагментов удаляются, например, путем центрифугирования или ультрафильтрации. Carter et al., Bio/Technology, 10: 163-167 (1992) описывает процедуру изоляции антител, секретируемых в периплазматическое пространство Е.coli. Описывая кратко, клеточную массу размораживают в присутствии ацетата натрия (рН 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение примерно 30 мин. Клеточные обломки могут быть удалены центрифугированием. В тех случаях, когда антитело секретируется в среду, супернатант от каждой системы экспрессии обычно вначале концентрируют с использованием коммерчески доступных фильтров для концентрирования белка, например, ультрафильтрационных систем AMICON™ или MILLIPORE PELLICON™. В любой из указанных ранее этапов может быть включен ингибитор протеазы, такой как фенилметилсульфонилфторид (PMSF), для ингибирования протеолиза, а также антибиотики для предотвращения роста случайных загрязнителей.
Композиция антитела, полученная из клеток, может быть очищена, например, с помощью хроматографии с гидроксилапатитом, гель-электрофореза, диализа, а также аффинной хроматографии; методика очистки с использованием аффинной хроматографии является предпочтительной. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа конкретного иммуноглобулинового Fc-домена, имеющегося в данном антителе. Белок А может быть использован для очистки антител, основанных на человеческих тяжелых цепях гамма1, гамма, или гамма4 (Lindmark et al., J J. Immunol. Meth., 62:1-13 (1983)). Белок G рекомендован для всех мышиных изотипов и человеческого y3 (Guss и др., ЕМВО J., 5:15671575 (1986)). Матрицей, к которой присоединяется аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или полистирол-дивинилбензол, позволяют достигать большей скорости потока и более короткого времени процесса, чем при использовании агарозной матрицы. В тех случаях, когда антитело содержит домен СН3, для очистки используются смолы BAKERBOND АВХ™ (J. Т. Baker, Phillipsburg, N.J.). Также в зависимости от антител, подлежащих восстановлению, могут использоваться другие методики очистки белка, такие как фракционирование на ионообменные колонки, осаждение этанолом, ВЭЖХ обратной фазы, хроматография на кремнеземе, хроматография на гепарин-сефарозе. Sepharose™, хроматография на анион- или катион-обменных смолах (например, на колонке с полиаспарагиновой кислотой), хроматофокусировка, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и осаждение сульфатом аммония.
Типичный способ очистки Z270 или его гуманизированных версий, основанный на использовании белка А, описан в примере 6.
Фармацевтические составы
В одном воплощении данное изобретение предлагает фармацевтическую композицию, содержащую антитела, описанные в данном документе, вместе с одним или более носителями.
Соответственно, одним объектом изобретения является предложение фармацевтического состава, содержащего такое антитело в концентрации от 1 мг/мл до 500 мг/мл, и при этом указанный состав имеет pH от 2,0 до 10,0. Состав также может содержать буферную систему, консервант(ы), агент(ы), изменяющий(е) тоничность, хелатирующий(е) агент(ы), стабилизаторы и поверхностно-активные вещества. В одном воплощении фармацевтический состав представляет собой водный состав, т.е. состав, содержащий воду. Такой состав, как правило, является раствором или суспензией. В другом воплощении фармацевтический состав представляет собой водный раствор. Термин "водный состав" определяется как состав, содержащий по меньшей мере 50% воды по массе. Кроме того, термин "водный раствор" определяется как раствор, содержащий по меньшей мере 50% воды по массе, а термин "водная суспензия" определяется как суспензия, содержащая по меньшей мере 50% воды по массе.
В другом воплощении фармацевтический состав представляет собой лиофилизированный состав, к которому врач или пациент перед использованием добавляет растворители и/или разбавители.
В другом воплощении фармацевтический состав представляет собой высушенный состав (например, лиофилизированный или высушенный струей газа), готовый к использованию без предварительного растворения.
В другом аспекте фармацевтический состав содержит водный раствор такого антитела и буфер, в котором антитело присутствует в концентрации от 1 мг/мл и выше, и при этом указанный состав имеет рН от 2,0 до 10,0.
В другом воплощении рН состава находится в диапазоне величин, выбранном из списка, содержащего от примерно 2,0 до примерно 10,0, от примерно 3,0 до примерно 9,0, от примерно 4,0 до примерно 8,5, от примерно 5,0 до примерно 8,0 и от примерно 5,5 до примерно 7,5.
В другом воплощении буфер выбирают из группы, содержащей ацетат натрия, карбонат натрия, цитрат, глицилглицин, гистидин, глицин, лизин, аргинин, дигидрофосфат натрия, двузамещенный фосфат натрия, фосфат натрия и трис-(гидроксиметил)-аминометан, бицин, трицин, яблочную кислоту, сукцинат, малеиновую кислоту, фумаровую кислоту, винную кислоту, аспарагиновую кислоту или их смеси. Каждый из этих конкретных буферов представляет собой альтернативное воплощение изобретения.
В другом воплощении состав также содержит фармацевтически приемлемый консервант. Консервант может быть выбран, например, из группы, содержащей фенол, о-крезол, м-крезол, п-крезол, метил-п-гидроксибензоат, пропил-п-гидроксибензоат, 2-феноксиэтанол, бутил-п-гидроксибензоат, 2-фенилэтанол, бензиловый спирт, хлорбутанол и тиомерсал, бронопол, бензойную кислоту, имидурею, хлоргексидин, дегидроацетат натрия, хлорокрезол, этил-п-гидроксибензоат, бензетониума хлорид, хлофенезин (3p-хлорфеноксиропан-1,2-диол) или их смеси. Консервант может присутствовать в концентрации, например, от 0,1 мг/мл до 20 мг/мл, от 0,1 мг/мл до 5 мг/мл, от 5 мг/мл до 10 мг/мл или 10 мг/мл до 20 мг/мл. Каждый из этих конкретных консервантов представляет собой альтернативное воплощение изобретения. Специалистам хорошо известно использование консерванта в фармацевтических композициях. Для удобства даны ссылки на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В следующем воплощении состав кроме того содержит изотонический агент. Изотонический агент может быть выбран, например, из группы, включающей соль (например, хлорид натрия), сахар и сахарный спирт, аминокислоту (например, L-глицин, L-гистидин, аргинин, лизин, изолейцин, аспарагиновую кислоту, триптофан, треонин), многоатомный спирт (например, глицерол (глицерин), 1,2-пропандиол (пропиленгликоль), 1,3- пропандиол, 1,3-бутандиол), полиэтиленгликоль (например, PEG400) или их смеси. Могут быть использованы любые сахара, такие как моно-, ди- и полисахариды или водорастворимые гликаны, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтилкрахмал и Na-карбоксиметилцеллюлозу. В одном воплощении сахарной добавкой является сахароза. Сахарный спирт определяется как С4-С8 углеводород, имеющий по меньшей мере одну ОН-группу, и включает, например, маннит, сорбит, инозит, галактитол, дульцит, ксилитол и арабитол. В одном варианте сахарноспиртовой добавкой является маннит. Сахара или сахарные спирты, упомянутые выше, могут использоваться по отдельности или в комбинации друг с другом. Не существует определенного предела в их использовании, и они могут добавляться до тех пор, пока сахар или сахарный спирт растворяется в жидком препарате и не оказывает негативного воздействия на стабилизирующий эффект, который достигается использованием способов изобретения. Концентрация сахара или сахарного спирта может составлять, например, от примерно 1 мг/мл до примерно 150 мг/мл. Изотонический агент может находиться в концентрации, например, от 1 мг/мл до 50 мг/мл, от 1 мг/мл до 7 мг/мл, от 8 мг/мл до 24 мг/мл или от 25 мг/мл до 50 мг/мл. Каждый из этих конкретных изотонических агентов представляет собой альтернативное воплощение изобретения. Специалистам хорошо известно использование изотонических агентов в фармацевтических композициях. Для удобства даны ссылки на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В другом воплощении состав также содержит хелатирующий агент. Хелатирующий агент может быть выбран, например, среди солей этилендиаминтетрауксусной кислоты (ЭДТА), лимонной кислоты и аспарагиновой кислоты, а также их смесей. Хелатирующий агент может присутствовать в концентрации, например, от 0,1 мг/мл до 5 мг/мл, от 0,1 мг/мл до 2 мг/мл или 2 мг/мл до 5 мг/мл. Каждый из этих конкретных хелатирующих агентов представляет собой альтернативное воплощение изобретения. Специалистам хорошо известно использование хелатирующих агентов в фармацевтических композициях. Для удобства даны ссылки на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В другом воплощении изобретения состав также содержит стабилизатор. Специалистам хорошо известно использование стабилизатора в фармацевтических композициях. Для удобства даны ссылки на Remington: The Science and Practice of Pharmacy, 19th edition, 1995. В частности, композиция изобретения может представлять собой стабилизированную жидкую фармацевтическую композицию, в которой терапевтически активные компоненты включают полипептид, который может формировать агрегатные образования во время хранения в жидких фармацевтических составах. Под "агрегатными образованиями" понимается физическое взаимодействие между полипептидными молекулами, что приводит к образованию олигомеров, которые могут оставаться растворимыми, или крупных видимых агрегатов, которые выпадают из раствора в осадок. Определение "во время хранения" подразумевает жидкую фармацевтическую композицию или состав, сразу приготовленный, но не вводимый субъекту немедленно. Напротив, после изготовления его упаковывают для хранения либо в жидкой форме, либо в замороженном состоянии, либо в высушенной форме для последующего восстановления в жидкую форму или другую форму, пригодную для введения субъекту. Под "высушенной формой" понимается жидкая фармацевтическая композиция или состав, высушенный либо сушкой вымораживанием (т.е. лиофилизацией; см., например, Williams and Polli (1984) J. Parenteral Sci. Technol. 38:48-59), либо сушкой струей газа (см. Masters (1991) в Spray-Drying Handbook (5th ed; Longman Scientific and Technical, Essez, U.K.), pp.491-676; Broadhead et al. (1992) Drug Devel. Ind. Pharm. 18:1169-1206; и Mumenthaler et al. (1994) Pharm. Res. 11:12-20), либо сушки воздухом (Carpenter and Crowe (1988) Cryobiology 25:459-470; и Roser (1991) Biopharm. 4:47-53). Агрегатные образования, сформированные полипептидом во время хранения жидкой фармацевтической композиции, могут негативно повлиять на биологическую активность этого полипептида, что приводит к потере терапевтической эффективности фармацевтической композиции. Кроме того, агрегатные образования могут стать причиной других проблем, таких как блокирование трубок, мембран или насосов, если фармацевтическую композицию, содержащую полипептид, вводят с помощью инфузионной системы.
Фармацевтические композиции изобретения могут также содержать определенное число аминокислотных оснований, достаточное для уменьшения образования полипептидами агрегатов во время хранения композиции. Под "аминокислотным основанием" понимается аминокислота или комбинация аминокислот, если любая данная аминокислота присутствует либо в форме свободного основания, либо в форме соли. В тех случаях, когда используется комбинация аминокислот, все аминокислоты могут находиться в форме свободных оснований, все могут находиться в форме солей, или некоторые из них могут находиться в форме свободных оснований, в то время как другие находятся в форме солей. В одном воплощении аминокислоты, которые используются для изготовления композиций изобретения, представляют собой аминокислоты, несущие заряженную боковую цепь, такие как аргинин, лизин, аспарагиновая кислота и глутаминовая кислота. Любой стереоизомер (т.е. L, D или их смесь) частной аминокислоты (например, метионина, гистидина, имидазола, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана, треонина и их смесей) или комбинация этих стереоизомеров может присутствовать в фармацевтической композиций изобретения до тех пор, пока данная аминокислота присутствует либо в форме свободного основания, либо в форме соли. В одном воплощении используется L-стереоизомер. Композиции изобретения могут быть также сформированы с аналогами этих аминокислот. Под "аминокислотным аналогом" понимается производное природной аминокислоты, которое приносит желаемый эффект уменьшения образования полипептидом агрегатов во время хранения жидких фармацевтических композиций изобретения. Подходящие аналоги аргинина включают, например, аминогуанидин, орнитин и N-моноэтило-L-аргинин, подходящие аналоги метионина включают этионин и бутионин, а подходящие аналоги цистеина включают S-метил-L-цистеин. Как и другие аминокислоты, аминокислотные аналоги входят в композицию либо в форме свободного основания, либо в форме соли. В другом воплощении изобретения аминокислоты или аминокислотные аналоги используются в концентрации, которая является достаточной для предотвращения или задержки агрегации белка.
В другом воплощении изобретения метионин (или другие сульфоаминокислоты или сульфоаминокислотные аналоги) может быть добавлен для ингибирования окисления метиониновых остатков в сульфоксид метионина, когда полипептид, действующий в качестве терапевтического агента, является полипептидом, содержащим по меньшей мере один метиониновый остаток, чувствительный к такому окислению. Под "ингибированием" понимается минимальное накопление окисленного метионина с течением времени. Ингибирование окисления метионина приводит к лучшему удержанию полипептидов в надлежащей молекулярной форме. Могут быть использованы любые стереоизомеры метионина (L или D) или их комбинации. Число добавленных метионинов должно быть достаточным для препятствования окислению остатков метионина, так чтобы количество сульфоксида метионина оставалось приемлемым для регулирующих органов. Как правило, это означает, что композиция содержит не более чем от примерно 10% до примерно 30% сульфоксида метионина. Обычно этого можно достигнуть путем добавления метионина так, чтобы соотношение добавленного метионина и остатков метионина колебалось в пределах от примерно 1:1 до примерно 1000:1, например, от 10:1 до 100:1.
В другом воплощении состав кроме того содержит стабилизатор, выбранный из группы, включающей высокомолекулярные полимеры и низкомолекулярные соединения. В другом воплощении изобретения стабилизатор выбирают среди полиэтиленгликоля (например, PEG 3350), поливинилового спирта (PVA), поливинилпирролидона, карбокси-/гидроцеллюлозы или ее производных (например, НРС, HPC-SL, HPC-L и НРМС), цикподекстринов, серосодержащих веществ, таких как монотиоглицерин, тиогликолевая кислота и 2-метилитиоэтанол, и различных солей (например, хлорида натрия). Каждый из этих конкретных стабилизаторов представляет собой альтернативное воплощение изобретения.
Фармацевтические композиции могут также содержать дополнительные стабилизирующие агенты, которые еще больше увеличивают стабильность данного терапевтически активного полипептида. Стабилизирующие агенты, представляющие частный интерес для данного изобретения, включают метионин и ЭДТА, которые защищают полипептид от окисления метионина, и неионогенные поверхностно активные вещества, которые защищают полипептид от агрегации, связанной с замораживанием-размораживанием или механическим воздействием, но не ограничиваются ими.
В другом воплощении состав также содержит поверхностно активное вещество. Поверхностно активное вещество может быть выбрано, например, среди детергента, этоксилированного касторового масла, полигликозилированных глицеридов, ацетилированных моноглицеридов, эфиров сорбита и жирных кислот, блоксополимеров полиоксиэтилена и полиоксипропилена (например, полоксамеров, таких как Pluronic ® F68, полоксамера 188 и 407, Triton X-100), полиоксиэтиленовых эфиров сорбита и жирных кислот, полиоксиэтилена и производных полиэтилена, например, алкилированных и алкоксилированных производных («твинов», например, Tween-20, Tween-40, Tween-80 и Brij-35), моноглицеридов и их этоксилированных производных, диглицеридов или их полиоксиэтилированных производных, спиртов, глицерина, пектинов и фосфолипидов (например, фосфатидилсерина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилинозита, дифосфатидил-глицерина и сфингомиелина), производных фосфолипидов (например, дипальмитоил-фосфатидной кислоты) и лизофосфолипидов (например, пальмитоил-лизофосфатидил-L-серина и 1-ацил-sn-глицеро-3-фосфатного эфира этаноламина, холина, серина или треонина), а также алкил-, алкоксил-, (алкил сложного эфира), алкокси- (алкил простого эфира) производных липофосфатидила и фосфатидилхолинов, например, лауроиловых и миристоиловых производных лизофосфатидилхолина, дипальмитоил-фосфатидилхолина, и модификаций в полярных концевых группах, то есть в холине, этаноламине, фосфатидной кислоте, серине, треонине, глицерине, инозите, и положительно заряженных DODAC, DOTMA, DCP, BISHOP, лизофосфатидилсерина и лизофосфатидилтреонина, а также глицерофосфолипидов (например, цефалинов), глицерогликолипидов (например, галактопиранозида), сфингогликолипидов (например, церамидов, ганглиозидов), додецилфосфохолина, лизолецитина куриных яиц, производных фузидовой кислоты (например, тауро-дигидросульфата натрия и т.д.), длинно-цепочечных жирных кислот и их солей С6-С12 (например, олеиновой и каприловой кислот), ацилкарнитинов и их производных, Nα-ацетилированных производных лизина, аргинина и гистидина, или производных лизина или аргинина, полученных путем ацетилирования их боковых цепей, Nα-ацетилированных производных дипептидов, содержащих любую комбинацию лизина, аргинина и гистидина и нейтральных или кислых аминокислот, Nα-ацетилированных производных трипептидов, содержащих любую комбинацию нейтральной аминокислоты и двух заряженных аминокислот, DSS (докузата натрия, регистрационный номер CAS [577-11-7]), докузата кальция (регистрационный номер CAS [128-49-4]), докузата калия (регистрационный номер CAS [7491-09-0]), SDS (додецилсульфата натрия или лаурилсульфата натрия), каприлата натрия, холевой кислоты или ее производных, желчных кислот, их солей и конъюгатов с глицином и таурином, урсодезоксихолевой кислоты, холата натрия, дезоксихолата натрия, таурохолата натрия, гликохолата натрия, N-гексадецил-N,N-диметил-3-аммонио-1-пропаносульфоната, анионных (алкил-арил-сульфонатные) моновалентных поверхностно-активных веществ, цвиттер-ионных поверхностно активных веществ (например, N-алкил-N,N-диметиламмонио-1-пропаносульфонаты, 3-холамидо-1-пропилдиметиламмонио- 1-пропаносульфоната), катионных поверхностно активных веществ (оснований четвертичного аммония) (например, бромида цетилтриметиламмония, хлорида цетилпиридиния), неионных поверхностно активных веществ (например, додецил-β-D-глюкопиранозид), полоксаминов (например, компании Tetronic), которые являются тетрафункциональными блоксополимерами, полученными в результате последовательного добавления оксида пропилена и оксида этилена к этилендиамину, либо поверхностно активные вещества могут быть выбраны из группы имидазольных производных или их смесей. Каждое из этих конкретных поверхностно активных веществ представляет собой альтернативное воплощение изобретения.
Специалистам хорошо известно использование поверхностно активного вещества в фармацевтической композиции. Для удобства дана ссылка на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В другом воплощении состав также включает ингибиторы протеаз, такие как ЭДТА (этилендиаминтетрауксусная кислота) и бензамидинHCl, а также могут быть использованы и другие коммерчески доступные ингибиторы протеаз. Использование ингибитора протеазы является особенно полезным в фармацевтических композициях, содержащих зимогены протеаз, для того, чтобы ингибировать автокатализ.
Возможно также присутствие в пептидной фармацевтической форме данного изобретения и других составляющих. Такие дополнительные составляющие могут включать смачивающие агенты, эмульгаторы, антиоксиданты, агенты, увеличивающие объем фармацевтической формы, агенты, изменяющие тоничность, хелатирующие агенты, ионы металлов, маслянистые связующие вещества, белки (например, человеческий сывороточный альбумин, желатин или белки) и цвиттер-ионы (например, аминокислоты, такие как бетаин, таурин, аргинин, глицин, лизин и гистидин). Разумеется, наличие таких дополнительных составляющих не должно негативно сказаться на общей стабильности фармацевтической формы данного изобретения.
Фармацевтические композиции, содержащие антитела в соответствии с данным изобретением, можно вводить пациентам, нуждающимся в таком лечении, в несколько различных областей, например, в наиболее актуальные области, такие как кожа и слизистая оболочка, в области, обходящие адсорбцию, например, в артерию, в вену, в сердце, и в области, включающие адсорбцию, например, в кожу, под кожу, в мышцу или в брюшинную полость.
Введение фармацевтических композиций в соответствии с изобретением пациентам, нуждающимся в таком лечении, можно проводить несколькими путями, например, подкожно, внутримышечно, внутрибрюшинно, внутривенно, на язык, под язык, буккально, в рот, орально, внутрижелудочно и внутрикишечно, через нос, внутрилегочно, например, через бронхиолы и альвеолы, или комбинируя их, эпидермально, дермально, трансдермально, вагинально, ректально, окулярно, например через конъюнктиву, уретрально и парентерально.
Композиции данного изобретения могут быть введены в нескольких дозированных формах, например, в виде растворов, суспензий, эмульсий, микроэмульсий, множественных эмульсий, пен, бальзамов, паст, пластырей, мазей, таблеток, таблеток, покрытых оболочкой, ополаскивателей, капсул, например, твердых желатиновых капсул и мягких желатиновых капсул, свечей, ректальных капсул, драже, гелей, спреев, порошков, аэрозолей, ингалянтов, глазных капель, глазных мазей, глазных ополаскивателей, вагинальных пессариев, вагинальных колец, вагинальных мазей, инъекционных растворов, растворов, трансформируемых in situ, например, загустевающих in situ, фиксирующихся in situ, осаждающихся in situ, кристаллизующихся in situ, инфузионных растворов, а также имплантатов.
Композиция изобретения может быть также усложнена или дополнена с помощью хорошо известных специалистам способов, например, посредством ковалентных, гидрофобных и электростатических взаимодействий, лекарственного носителя, системы доставки лекарства и улучшенной системы доставки лекарства в целях еще большего увеличения стабильности антитела, увеличения биодоступности, увеличения растворимости, уменьшения неблагоприятных последствий, обеспечения хронотерапии, а также улучшения взаимодействия с пациентом, или любых их сочетаний. Примерами носителей, систем доставки лекарства и улучшенных систем доставки лекарства являются полимеры, например целлюлоза и производные, полисахариды, например декстран и производные, крахмал и производные, полвиниловый спирт, акрилатные и метакрилатные полимеры, полимолочная кислота и полигликолевая кислота и их блоксополимеры, полиэтиленгликоли, переносчики белков, например альбумин, гели, например термогелевые системы, например блоксополимерные системы, хорошо известные специалистам, мицеллы, липосомы, микросферы, наночастицы, жидкие кристаллы и их дисперсии, фаза L2 и ее дисперсии, хорошо известные специалистам в области фазового поведения систем липид - вода, полимерные мицеллы, множественные эмульсии, самостоятельно эмульгирующие, самостоятельно микроэмульгирующие, циклодекстрин и его производные и дендримеры, но не ограничиваются ими.
Композиции данного изобретения используют в форме твердых веществ, полутвердых веществ, порошков и растворов для легочного введения антитела, например с помощью дозированных ингаляторов, сухопорошковых ингаляторов и небулайзеров; все эти устройства хорошо известны специалистам в данной области.
Композиции данного изобретения также используют в форме систем доставки лекарств с контролируемым, постепенным, удлиненным, запаздывающим и замедленным высвобождением. Для большей специфичности композиции используют в форме хорошо известных специалистам систем доставки лекарств с парентеральным контролируемым высвобождением и постепенным высвобождением (обе эти системы ведут к многократному сокращению числа введений), но не ограничиваются этим. Еще более предпочтительными являются системы доставки лекарств с подкожным контролируемым и постепенным высвобождением. Без ограничения сферы применения изобретения, примерами используемых контролируемых систем доставки и композиций являются гидрогели, масляные гели, жидкие кристаллы, полимерные мицеллы, микросферы, наночастицы.
Способы получения систем контролируемого высвобождения, используемых для композиций данного изобретения, включают кристаллизацию, конденсацию, сокристаллизацию, преципитацию, копреципитацию, эмульгирование, диспергирование, гомогенизацию под высоким давлением, инкапсуляцию, распылительную сушку, микроинкапсуляцию, коацервацию, фазовое расслоение, испарение растворителя для получения микросфер, экструзию и процессы со сверхкритическими флюидами, но не ограничиваются ими. Общие ссылки сделаны на Handbook of Pharmaceutical Controlled Release (Wise, D.L, ed. Marcel Dekker, New York, 2000) и Drug and the Pharmaceutical Sciences vol. 99: Protein Formulation and Delivery (MacNally, E.J., ed. Marcel Dekker, New York, 2000).
Парентеральное введение может быть осуществлено путем подкожных, внутримышечных, интраперитонеальных или внутривенных инъекций с помощью шприца, возможно ручки-шприца. В альтернативном варианте парентеральное введение может быть выполнено с помощью инфузионного дозатора. Другой возможностью является использование композиции в виде раствора или суспензии для введения соединения антитела в форме назального или пульмонального спрея. В качестве другой возможности введения фармацевтические композиции, содержащие антитело изобретения, могут быть адаптированы для чрескожного введения, например с помощью безыгольных инъекций или трансдермальных пластырей, возможно способом ионтофореза, или введением через слизистую оболочку, например буккальную.
Антитело можно вводить через дыхательные пути в носителе, таком как раствор, суспензия или сухой порошок, используя любой из известных типов устройств, пригодных для внутрилегочного введения лекарств. Примерами их являются три общих типа систем для внутрилегочного введения лекарств, образующих аэрозоль, и могут включать струйный или ультразвуковой небулайзеры, дозированные ингаляторы или сухопорошковые ингаляторы, но не ограничиваются ими (См. Yu J, Chien YW. Pulmonary drug delivery: Physiologic and mechanistic aspects. Crit Rev Ther Drug Carr Sys 14(4) (1997) 395-453).
На основе стандартизованной методологии тестирования, аэродинамический диаметр (da) частицы определяется как геометрически эквивалентный диаметр эталонной сферической частицы единицы плотности (1 г/см3). В простейшем случае, для сферических частиц, da связана со стандартным диаметром (d) как функция квадратного корня из коэффициента плотности, что описывается следующей формулой:
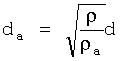
Модификации в этом отношении возникают для несферических частиц (см. Edwards DA, Ben-Jebria A, Langer R. Recent advances in pulmonary drug delivery using large, porous inhaled particles. J AppI Physiol 84(2) (1998) 379-385). Термины "MMAD" и "MMEAD" хорошо известны в данной области и описаны (см. Edwards DA, Ben-Jebria A, Langer R and represents a measure of the median value of an aerodynamic particle size distribution. Recent advances in pulmonary drug delivery using large, porous inhaled particles. J AppI Physiol 84(2) (1998) 379-385). Взаимозаменяемые параметры средний массовый аэродинамический диаметр (MMAD) и средний массовый эффективный аэродинамический диаметр (MMEAD) являются статистическими параметрами и эмпирически описывают размер аэрозольных частиц в соотношении с их потенциалом для введения в легкие, независимо от фактической формы, размера и плотности (см. Д Edwards DA, Ben-Jebria A, Langer R. Recent advances in pulmonary drug delivery using large, porous inhaled particles. J AppI Physiol 84(2) (1998) 379-385). MMAD, как правило, рассчитывается на основе измерений с импактором, который измеряет инерциальное поведение частицы в воздухе.
В другом воплощении состав может быть переведен в аэрозоль каким-либо известным способом аэрозолирования, таким как небулизация, для достижения MMAD аэрозольных частиц менее 10 мкм, более предпочтительно 1-5 мкм и наиболее предпочтительно 1-3 мкм. Предпочтительный размер частиц основан на наиболее эффективном размере для доставки лекарства глубоко в легкие, где белок оптимально абсорбируется (см. Edwards DA, Ben-Jebria A, Langer A, Recent advances in pulmonary drug delivery using large, porous inhaled particles. J AppI Physiol 84(2) (1998) 379-385).
Глубокую легочную депозицию пульмональных составов, содержащих антитело, возможно, можно также оптимизировать путем модификации ингаляционных техник, например, используя медленный ингаляционный поток (например, 30 л/мин), задерживая дыхание, изменяя время срабатывания, но не ограничиваясь ими.
Термин "стабилизированный состав" относится к составу с повышенной физической стабильностью, повышенной химической стабильностью или повышенной физической и химической стабильностью.
Термин "физическая стабильность" белкового состава, используемый в данном документе, подразумевает склонность белка к формированию биологически неактивных и/или нерастворимых агрегатов белка в результате воздействия на белок термомеханической нагрузки и/или в результате взаимодействия с дестабилизирующими внутренними или внешними поверхностями, например гидрофобными поверхностями. Физическую стабильность водных составов белка оценивают путем визуального осмотра и/или измерения мутности после экспонирования состава в соответствующем контейнере (например, в картридже или флаконе) в условиях механической/физической нагрузки (например, взбалтывания) при различных температурах в течение различных периодов времени. Визуальный осмотр составов выполняют в резком фокусированном свете на темном фоне. Мутность состава характеризуется визуальной оценкой степени мутности по классификации, например по шкале от 0 до 3 (состав, показывающий отсутствие мутности, соответствует визуальной оценке 0, а состав, показывающий визуальную мутность в дневном свете, соответствует визуальной оценке 3). Состав классифицируют как физически нестабильный в связи с белковой агрегацией, если он показывает визуальную мутность в дневном свете. Кроме того, мутность состава может быть оценена простыми способами измерения мутности, хорошо известными специалистам. Физическая стабильность водных белковых составов также может быть оценена с помощью спектроскопического агента или зонда конформационного состояния белка. Зондом предпочтительно является небольшая молекула, которая предпочтительно связывается с ненативным конформером белка. Одним примером небольшого молекулярного спектроскопического зонда белковой структуры является тиофлавин Т. Тиофлавин Т представляет собой флюоресцентный краситель, который широко используется для выявления амилоидных фибрилл. В присутствии фибрилл и, возможно, также и других белковых конфигураций, тиофлавин Т дает новый максимум возбуждения при примерно 450 нм и усиливает эмиссию при примерно 482 нм, когда связывается с белковыми фибриллами. Несвязанный тиофлавин Т в основном не флюоресцирует при этих длинах волн.
Другие небольшие молекулы могут быть использованы в качестве зондов для выявления изменений в нативной структуре белка по сравнению с ненативными формами. Например, зонды "гидрофобные патчи" избирательно связываются для выявления гидрофобных участков белка. Гидрофобные участки обычно скрыты в третичной структуре белка в его нативном состоянии, но становятся открытыми для воздействия, когда белок начинает разворачиваться или денатурировать. Примерами таких малых молекулярных спектроскопических зондов являются ароматические гидрофобные красители, такие как антрацин, акридин, фенантролин и т.п. Другие спектроскопические зонды представляют собой аминокислотные металлокомплексы, например кобальтовые металлокомплексы гидрофобных аминокислот, таких как фенилаланин, лейцин, изолейцин, метионин, валин и т.п.
Термин "химическая стабильность" белкового состава, используемый в данном документе, относится к химическим ковалентным изменениям в структуре белка, ведущим к формированию продуктов химической деградации с потенциальной потерей биологической активности и/или потенциальным увеличением иммуногенных свойств по сравнению с нативной структурой белка. В зависимости от типа и природы нативного белка и среды, в которой он находится, могут формироваться различные продукты химической деградации. Наиболее вероятно, что химической деградации полностью избежать невозможно, и во время хранения и использования белкового состава часто наблюдается увеличение количества продуктов химической деградации, что хорошо известно специалистам в данной области. Большинство белков подвержено дезамидированию, процессу, в котором амидная группа боковой цепи в остатках глутамина или аспарагина гидролизуется с формированием свободной карбоновой кислоты. Другие пути деградации включают формирование высокомолекулярных продуктов трансформации, в которых две или более белковые молекулы ковалентно связаны друг с другом путем трансамидирования и/или дисульфидного взаимодействия, что ведет к формированию ковалентно связанных димерных, олигомерных и полимерных продуктов деградации (Stability of Protein Pharmaceuticals, Ahem. T.J. & Manning M.C., Plenum Press, New York 1992). Окисление (например, остатков метионина) может быть упомянуто в качестве еще одного варианта химической деградации. Химическая стабильность белкового состава может быть оценена путем измерения количества продуктов химической деградации в различных временных точках после воздействия различных условий окружающей среды (образование продуктов деградации часто может быть ускорено, например, повышением температуры). Количество каждого отдельного продукта деградации часто определяют путем разделения продуктов деградации в зависимости от размера молекулы и/или заряда с использованием различных методик хроматографии (например, SEC-HPLC и/или RP-HPLC).
Таким образом, как указано выше, "стабилизированный состав" относится к составу с повышенной физической стабильностью, повышенной химической стабильностью или повышенной физической и химической стабильностью. Обычно состав должен быть стабильным в течение времени использования и хранения (при соответствии с рекомендуемыми условиями использования и хранения) до истечения срока действия.
В одном воплощении изобретения фармацевтический состав, содержащий антитело, является стабильным при применении более 6 недель и при хранении более 3 лет.
В другом воплощении изобретения фармацевтический состав, содержащий антитело, является стабильным при применении более 4 недель и при хранении более 3 лет.
В другом воплощении изобретения фармацевтический состав, содержащий антитело, является стабильным при применении более 4 недель и при хранении более 2 лет.
В еще одном воплощении изобретения фармацевтический состав, содержащий антитело, является стабильным при применении более 2 недель и при хранении более 2 лет.
Подходящие составы антитела также могут быть определены на основе изучения опыта других, уже разработанных терапевтических моноклональных антител. Свою эффективность в клинических случаях показали некоторые моноклональные антитела, такие как Rituxan (Rituximab), Herceptin (Trastuzumab), Xolair (Omalizumab), Bexxar (Tositumomab), Campath (Alemtuzumab), Zevalin, Oncolym и похожие составы, которые могут быть использованы с антителами данного изобретения. Например, моноклональное антитело может находиться в концентрации 10 мг/мл во флаконах для однократного использования объемом либо 100 мг (10 мл), либо 500 мг (50 мл), разработанных для внутривенного введения в 9,0 мг/мл натрия хлорида, 7,35 мг/мл дигидрата цитрата натрия, 0,7 мг/мл полисорбата 80 и в стерильной воде для инъекций. рН корректируется до 6,5. В другом воплощении антитела представлены в составе, содержащем примерно 20 мМ цитрата натрия, примерно 150 мМ хлорида натрия, при рН примерно 6,0.
Терапевтические применения
Способы лечения пациентов с использованием анти-NKG2A антитела, описанного в данном документе, также предусмотрены. В одном воплощении изобретение предлагает использование антитела, описанного в данном документе, для приготовления фармацевтической композиции для введения пациенту. Как правило, пациент страдает от рака, вирусного заболевания, воспалительного нарушения или аутоиммунного нарушения или находится в группе риска по этим заболеваниям. Кроме того, антитело изобретения используют для улучшения трансплантации костного мозга у пациента.
Например, в одном аспекте изобретение предлагает способ усиления активности CD94/NKG2A-несущих лимфоцитов у пациента, который в этом нуждается, содержащий этап введения человеческого или гуманизированного анти-NKG2A антитела указанному пациенту, при этом данное антитело снижает или предотвращает HLA-E-опосредованную активацию рецептора CD94/NKG2A. В одном воплощении способ направлен на повышение активности таких лимфоцитов у пациентов с заболеваниями, при которых полезно увеличение активности НК-, Т- и/или НКТ-клеток, которые вовлечены, влияют или вызваны клетками, чувствительными к лизису НК-, Т- или НКТ-клетками, или которые вызваны или характеризуются недостаточной деятельностью НК-, Т- или НКТ-клеток, такими как рак, инфекционное заболевание или иммунологическое нарушение.
Более конкретно, способы и композиции данного изобретения используют для лечения различных раковых и других пролиферативных заболеваний, включая: карциному, в т.ч. и мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, яичника, простаты, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи, включая плоскоклеточную карциному; гемопоэтические опухоли лимфоидного происхождения, включая лейкемию, острую лимфоцитарную лейкемию, хроническую лимфоцитарную лейкемию, острый лимфолейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосатоклеточную лимфому и лимфому Беркитта, и множественную миелому; гемопоэтические опухоли миелоидного происхождения, в т.ч. острый и хронический миелолейкоз, промиелоцитарный лейкоз и миелодиспластический синдром; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; другие опухоли, включая меланому, семиному, тератокарциному, нейробластому и глиому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванномы; опухоли мезенхимального происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, пигментную ксеродерму, кератоакантому, семиному, фолликулярный рак щитовидной железы и тератокарциному, но не ограничиваясь ими.
Особые нарушения, которые могут подвергаться лечению в соответствии с изобретением, включают гемопоэтические опухоли лимфоидного происхождения, например Т-клеточные и В-клеточные опухоли, включая Т-клеточные нарушения, такие как Т-промиелоцитарный лейкоз (T-PLL), включая мелкоклеточный и церебриформный типы; лейкоз из больших гранулярных лимфоцитов (LGL), предпочтительно Т-клеточного типа; синдром Сезари (СС); Т-клеточный лимфолейкоз взрослых (ATLL); T-NHL гепатоспленолимфома; периферическую/посттимическую Т-клеточную лимфому (плеоморфный и иммунобластный подтипы); ангиоиммунобластную Т-клеточную лимфому; ангиоцентричную (назальную) Т-клеточную лимфому; анапластическую (Ki 1+) крупноклеточную лимфому; кишечную Т-клеточную лимфому; Т-лимфобластную лимфому/лейкемию (T-Lbly/T-ALL), множественную миелому, но не ограничиваясь ими.
В соответствии с изобретением также могут подвергаться лечению и другие пролиферативные нарушения, включая, например, гиперплазию, фиброз (особенно легочный, но также и другие виды фиброза, например, почечный фиброз), ангиогенез, псориаз, атеросклероз и пролиферацию гладкой мускулатуры кровеносных сосудов, такую как стеноз или рестеноз после ангиопластики.
В частном аспекте антитела изобретения используют для лечения НК-типа лимфопролиферативной болезни гранулоцитов (также называемой NK-LGL), относящейся к классу пролиферативных нарушений, вызванных клональной экспансией НК клеток или НК-подобных клеток, т.е. больших гранулярных лимфоцитов, имеющих характерную комбинацию поверхностных экспрессированных антигенов (например, CD3-, CD56+, CD16+ и т.д.; см., например, Loughran (1993) Blood 82:1). Клеточная пролиферация, лежащая в основе этих нарушений, может иметь различные эффекты, начиная от легкой симптомов, наблюдаемых у некоторых пациентов, и вплоть до агрессивной, часто смертельной формы заболевания, которая называется НК-ЛДГЛ лейкемией. Симптомы этого класса нарушений могут включать лихорадку, мягкую нейтропению, тромбоцитопению, анемию, лимфоцитоз, спленомегалию, гепатомегалию, лимфаденопатию, инфильтрацию костного мозга и др. (см., например, Zambello et al. (2003) Blood 102:1797; Loughran (1993) Blood 82:1; EpIing-Burnette et al. (2004) Blood-2003-02-400).
Введение CD94/NKG2A антитела также может быть использовано для лечения или предотвращения инфекционных заболеваний, включая предпочтительно любые инфекции, вызванные вирусами, бактериями, простейшими, плесневыми и другими грибами. Такие вирусные инфекционные организмы включают вирус гепатита типа А, вирус гепатита типа В, вирус гепатита типа С, вирус гриппа, вирус Varicella zoster, аденовирус, вирус простого герпеса 1 типа (HSV-1), вирус простого герпеса 2 типа (HSV-2), вирус чумы крупного рогатого скота, риновирус, эховирус, ротавирус, синцитиальный респираторный вирус, вирус папилломы, цитомегаловирус, эхиновирус, арбовирус, хантавирус, вирус Коксаки, вирус эпидемического паротита, вирус кори, вирус краснухи, вирус полиомиелита и вирус иммунодефицита человека 1 или 2 типа (ВИЧ-1, ВИЧ-2), но не ограничиваются ими. Бактерии представляют собой другой предпочтительный класс инфекционных организмов, включающий: Staphylococcus; Streptococcus, включая S. pyogenes; Enterococci; Bacillus, включая Bacillus anthracis, и Lactobacillus; Listeria; Corynebactenum diphtheriae; Gardnerella, включая G. vaginalis; Nocardia; Streptomyces; Thennoactinomyces vulgaris; Treponerna; Camplyobacter, Pseudomonas, включая Р. aeruginosa; Legionella; Neisseria, включая N. gonorrhoeae и N. meningitides; Flavobacterium, включая F. meningosepticum и F. odoraturn; Brucella; Bordetella, включая В. pertussis и В. bronchiseptica; Escherichia, включая E.coli, Klebsiella; Enterobacter, Serratia, включая S. marcescens и S. liquefaciens; Edwardsiella; Proteus, включая P. mirabilis и P. vulgaris; Streptobacillus; Rickettsiaceae, включая R. fickettsfi, Chlamydia, включая С.psittaci и С.trachomatis; Mycobacterium, включая М. tuberculosis, М. intracellulare, М. folluiturn, М. laprae, М. avium, М. bovis, М. africanum, М. kansasii, М. intracellulare и М. lepraernurium; и Nocardia, но не ограниченный ими. Простейшие могут включать лейшманию, кокцидию и трипаносому, но не ограничиваются ими. Паразиты включают хламидию и риккетсию, но не ограничиваются ими. Полный перечень инфекционных заболеваний можно найти на веб-сайте Национального центра инфекционных болезней (NCID) в Центре по контролю над заболеваниями (CDC) (World-Wide Web (WWW) адрес cdc.gov/ncidod/diseases/), в данный документ он включен путем ссылки на него. Все эти заболевания являются кандидатами на лечение с использованием ингибиторных анти-CD94/NKG2A антител данного изобретения.
В альтернативном аспекте анти-NKG2A антитела используют для нахождения и уничтожения NKG2A-экспрессирующих клеток, например у пациентов, страдающих раком, характеризующимся экспрессией CD94/NKG2A на раковых клетках, например НК-лимфомой. В одном воплощении гуманизированное антитело вводится в форме иммуноконъюгата, состоящего из гуманизированного антитела и цитотоксического агента.
В альтернативном аспекте анти-NKG2A антитела используют для лечения или предотвращения аутоиммунного или воспалительного нарушения. Примерами аутоиммунных нарушений, которые можно лечить с использованием данных способов, являются, среди прочего, гемолитическая анемия, пернициозная анемия, узелковый полиартериит, системная красная волчанка, гранулематоз Вегенером, аутоиммунный гепатит, болезнь Бекета, болезнь Крона, первичный билиарный цирроз, склеродермия, язвенный колит, синдром Шегрена, сахарный диабет 1 типа, увеит, базедова болезнь, болезнь Альцгеймера, тироидит, миокардит, ревматическая лихорадка, склеродермия, анкилозирующий спондилит, ревматоидный артрит, гломерулонефрит, саркоидоз, дерматомиозит, миастения гравис, полимиозит, синдром Гийена-Барре, рассеянный склероз, очаговое облысение, пемфигус/пемфигоид, буллезный пемфигоид, тироидит Хашимото, псориаз и витилиго.
Примерами воспалительных нарушений, которые можно лечить с использованием данных способов, являются, среди прочего, воспаление надпочечника, альвеолит, ангиохолецистит, аппендицит, баланит, блефарит, бронхит, бурсит, кардит, целлюлит, цервицит, холецистит, хордит, кохлеит, колит, конъюнктивит, цистит, дерматит, дивертикулит, энцефалит, эндокардит, эзофагит, евстахиит, фиброзит, фолликулит, гастрит, гастроэнтерит, гингивит, глоссит, гепатоспленит, кератит, лабиринтит, ларингит, лимфангит, мастит, средний отит, менингит, метрит, воспаление слизистой оболочки, миокардит, миозит, мирингит, нефрит, неврит, орхит, остеохондроз, отит, перикардит, перитендинит, перитонит, фарингит, флебит, полиомиелит, простатит, пульпит, ретинит, ринит, сальпингит, склерит, скперохориоидит, скротит, синусит, спондилит, стеатит, стоматит, синовит, воспаление евстахиевой трубы, тендинит, тонзиллит, уретрит и вагинит.
Было также показано, что аллореактивная НК-клетка, уничтожающая дендритные клетки, улучшает приживление гемопоэтических клеток трансплантата костного мозга (L. Ruggeri et al., Science, 2002, 295:2097-2 100). Таким образом, в другом воплощении изобретение предлагает способ улучшения приживления гемопоэтических клеток у пациента, содержащий этап введения указанному пациенту композиции данного изобретения, содержащей активирующее антитело. Улучшение приживления проявляется либо снижением числа заболеваний, либо уменьшением серьезности реакции имплантат-против-хозяина, либо удлиненным временем выживания имплантата, либо уменьшением или устранением симптомов заболевания, от которого пациент лечился путем имплантации (например, гемопоэтический рак). Этот способ предпочтительно использовать в лечении лейкемии.
Комбинации
Ряд терапевтических агентов пригоден для лечения раковых заболеваний. Композиции антитела и способы данного изобретения могут также использоваться в сочетании с любыми другими способами, обычно использующимися в лечении конкретного заболевания, в частности опухоли, ракового заболевания или другого заболевания или нарушения, которое представлено у пациента. До тех пор, пока о конкретном терапевтическом подходе неизвестно, что он будет пагубным для состояния больного сам по себе, между ним и лечением анти-CD94/NKG2A антителами не будет значительного противодействия, что предусматривается в данном изобретении. При лечении солидной опухоли данное изобретение может быть использовано в комбинации с классическими подходами, такими как хирургия, лучевая терапия, химиотерапия и т.п. Изобретение предлагает комбинированные способы терапии, при которых анти-CD94/NKG2A антитела в соответствии с изобретением используют одновременно, до или после хирургического вмешательства или лучевой терапии, или вводят пациенту одновременно, до или после введения другого противоракового агента. Можно гарантировать, что хирургическое вмешательство, лучевая терапия или противораковый агент в сочетании с активным агентом в композиции данного изобретения проявят выгодный совокупный эффект против рака.
Примерами противораковых агентов являются химиотерапевтические агенты, гормональные агенты, антиангиогенные агенты, антиметастатические агенты, противораковые антитела (например, Rituximab), антитела против ингибиторных KIR-молекул, ингибиторы факторов роста, соединения, усиливающие апоптоз, цитокины и другие иммуномодулирующие агенты, противоопухолевые агенты, конъюгированные с токсинами и радионуклидами, соединения, которые затрудняют репликацию ДНК, митоз и сегрегацию хромосом, и агенты, которые нарушают синтез и правильность полинуклеотидных предшественников.
В отношении аутоиммунных и воспалительных нарушений, одного или нескольких типов аутоиммунных или воспалительных нарушений, либо в отношении какого-либо симптома или признака аутоиммунных или воспалительных нарушений известна эффективность и других соединений, включая, помимо прочих, иммуносупрессоры, например азатиоприн (например, Imuran), хлорамбуцил (например, Leukeran), циклофосфамид (например, Cytoxan), циклоспорин (например, Sandimmune, Neoral), метотрексат (например, Rheumatrex), кортикостероиды, преднизон (например, Deltasone, Meticorten), этанерцепт (например, Enbrel), инфликсимаб (например, Remicade), ингибиторы ФНО, FK-506, рапамицин, микофенолата мофетил, лефлуномид, антилимфоцитарный глобулин, дезоксиспергуалин или ОКТ (монокпональные антитела).
Предпочтельными примерами иммуномодулирующих соединений являются цитокины. Другие примеры включают соединения, предпочтительно имеющие эффект активации или потенцирования активности НК-клеток, или индуцирования или поддержки пролиферации НК-клеток. Другие соединения для введения до, одновременно с или после композиций, содержащих агенты изобретения, представляют собой дополнительные вещества (например, противорвотные и анальгетические агенты) и антивирусные агенты.
Как должно быть понятно специалистам в данной области, соответствующие дозы противораковых агентов будут приблизительно такими же, которые уже используют в клинических способах терапии, когда противораковые агенты вводят отдельно или в комбинации с другими агентами. Изменение дозировки скорее всего будет происходить в зависимости от состояния, которое будет подвергаться лечению. Врач, управляющий лечением, может определить надлежащую дозу в конкретном случае.
Изделия
В другом воплощении изобретения предложено изделие, содержащее материалы, используемые для лечения указанных выше нарушений. Например, изделие может включать контейнер, содержащий антитело, описанное здесь, вместе с инструкциями с руководством пользователя для лечения у млекопитающего нарушения, такого как рак или вирусное заболевание, антителами в эффективном количестве. В предпочтительном воплощении млекопитающее является человеком. Изделие, как правило, включает контейнер и этикетку или упаковку, вложенную в контейнер или связанную с ним. Подходящими контейнерами являются, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть сделаны из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая эффективна в лечении состояния, и может иметь стерильный порт (например, контейнер может быть резервуаром для раствора, вводимого внутривенно, или флаконом с пробкой, которую можно проткнуть иглой для подкожной инъекции). По меньшей мере одним активным агентом в композиции является гуманизированное анти-NKG2A антитело данного документа или производное антитела (например, иммуноконъюгат), содержащее такое гуманизированное антитело. Этикетка или вкладка в упаковку показывает, что композиция используется для лечения состояния выбора, такого как рак или вирусное заболевание.
Кроме того, изделие может содержать (а) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело, описанное в данном документе, и (b) второй контейнер с композицией, содержащейся в нем, где композиция содержит терапевтический агент, отличающийся от первого антитела. Изделие в этом воплощении изобретения может также содержать вкладку в упаковку, указывающую, что первая и вторая композиции могут использоваться в комбинации для лечения рака или вирусного заболевания. Такой терапевтический агент может быть любым из способов лечения, описанных в предыдущем разделе (например, химиотерапевтическим агентом, антиангиогенным агентом, антигормоном, кардиопротектором и/или регулятором иммунной функции у млекопитающих, в том числе цитокином). Альтернативно или дополнительно изделие может также включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Оно может также содержать другие материалы, желательные с коммерческой точки зрения и с точки зрения пользователей, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Введение
Как было описано выше, некоторые моноклональные антитела показали свою эффективность в клинических ситуациях (например, Rituxan (Rituximab) и другие), и подобные режимы введения (т.е. дозы и/или протоколы введения) могут быть применимы к антителам данного изобретения. Графики и дозировки для введения могут быть определены в соответствии с известными для этих продуктов способами, например, используя инструкции производителей. Например, препарат антитела может поставляться в концентрации 10 мг/мл во флаконах однократного использования объемом 100 мг (10 мл) или 500 мг (50 мл). Типичная подходящая доза для антитела изобретения может находиться в диапазоне между примерно 10 мг/м2 и 500 мг/м2. Количество и график инъекций анти-NKG2A антител, которые, например, насыщают клетки на 24 часа, 48 часов, 72 часа, неделю или месяц, могут быть определены с учетом аффинности антитела и его фармакокинетических параметров. Тем не менее, необходимо признать, что эти графики являются примерными, а оптимальное расписание и режим, а также толерантность к антителам должны быть определены в клинических испытаниях.
Нетерапевтические применения
Антитела (например, гуманизированные анти-NKG2A антитела) данного изобретения также имеют нетерапевтические применения.
Например, антитела могут быть использованы в качестве агентов для аффинной очистки. Для этого процесса антитела иммобилизуют на твердой фазе, такой как смола SEPHADEX™ или фильтровальная бумага, используя хорошо известные в данной области способы. Иммобилизованные антитела контактируют с образцом, содержащим белок NKG2A (или его фрагмент), для его очистки, далее основу промывают подходящим растворителем, который удаляет практически весь материал в образце за исключением белка NKG2A, связанного с иммобилизованным антителом. В конце основу промывают другим подходящим растворителем, таким как глициновый буфер, рН 5.0, который отсоединяет белок NKG2A от антитела.
AHTИ-NKG2A антитела также могут оказаться полезными в диагностических анализах на белок NKG2A, например, для обнаружения его экспрессии в конкретных клетках, тканях или сыворотке.
Для диагностических применений антитело, как правило, метят обнаруживаемой группировкой. Имеются многочисленные метки, которые, как правило, могут быть сгруппированы по следующим категориям:
(a) радиоизотопы, такие как 35S, 14C, 125I, 3H и 131I. Антитела могут быть помечены радиоизотопами с использованием методик, описанных, например, в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, N.Y., Pubs. (1991), и радиоактивность может быть измерена путем сцинтилляционного счета;
(b) флюоресцентные метки, такие как редкоземельные хелаты (хелаты европия) или флюоресцеин и его производные, родамин и его производные, дансил, Lissamine, фикоэритрин и Texas Red. Флюоресцентные метки могут быть конъюгированы с антителом посредством методик, раскрытых, например, в Current Protocols in Immunology, см. выше. Флюоресценция может быть количественно определена с помощью флуориметра;
(c) различные доступные фермент-субстратные метки, в патенте США №4275149 приводится обзор некоторых из них. Фермент обычно катализирует химическое изменение хромогенного субстрата, которое может быть измерено с помощью различных методик. Например, фермент может катализировать изменение цвета субстрата, которое измеряется спектрофотометрически. Кроме того, фермент может изменить флюоресценцию или хемилюминесценцию субстрата. Методики количественного измерения флюоресценции описаны выше. Хемилюминесцентный субстрат в результате химической реакции становится электронно возбужденным и может излучать свет, который можно измерить (например, с помощью хемилюминометра), или отдает энергию флюоресцентному акцептору. Примерами ферментных меток являются люциферазы (например, люцифераза светлячка и бактериальная люцифераза; патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, такая как пероксидаза хрена (HRPO), щелочная фосфатаза, бета-галактозидаза, глюкоамилаза, лизоцим, углеводные оксидазы (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфат дегидрогеназа), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза и т.п. Методики конъюгации ферментов с антителами описаны в O'Sullivan et al., "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay," в Methods in Enzym. (Ed., J. Langone & H. Van Vunakis), Academic Press, New York, 73:147-166(1981).
Примерами фермент-субстратных комбинаций являются, например:
(i) пероксидаза хрена (HRPO) с перекисью водорода в качестве субстрата, где перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидина гидрохлорид (ТМВ));
(ii) щелочные фосфатазы (АР) с пара-нитрофенил-фосфатом в качестве хромогенного субстрата; и
(iii) бета-D-галактозидаза (beta-D-Gal) с хромогенным субстратом (например, р-нитрофенил-бета-D-галактозидазой) или флюорогенным субстратом 4-метиллумбеллиферил-р-бета-галактозидазой.
Другие многочисленные фермент-субстратные комбинации также доступны специалистам в данной области. Общий их обзор дан в патентах США №№4275149 и 4318980.
Иногда метка конъюгирована с антителом не напрямую. Специалистам известны различные способы достижения этого. Например, антитело может быть конъюгировано с биотином, а любая из трех категорий меток, упомянутых выше, может быть конъюгирована с авидином или наоборот. Биотин избирательно связывается с авидином, и таким образом метка может быть конъюгирована с антителом не напрямую. Кроме того, для достижения непрямой конъюгации метки с антителом, антитело может быть конъюгировано с небольшим гаптеном (например, дигоксином), а одна из различных типов меток, упомянутых выше, конъюгирована с антителом против гаптена (например, антидигоксиновым антителом). Таким образом может быть достигнута непрямая конъюгация метки с антителом.
В другом воплощении изобретения анти-NKG2A антитело не нужно метить, а его присутствие может быть обнаружено с помощью меченого вторичного антитела, которое связывается с NKG2A антителом.
Антитела данного изобретения могут быть использованы в любых известных способах анализов, таких как конкурентно-связывающий анализ, прямой и непрямой иммунорадиометрический анализ типа «сэндвич» и иммунопреципитационный анализ. Zola, Monoclonal Antibodies: A Manual of Techniques, pp.147-158 (CRC Press, Inc. 1987).
Для иммуногистохимии образцы опухоли могут быть свежими или замороженными или могут быть залитыми в парафин или фиксированными в консерванте, например, таком как формалин.
Антитела могут быть использованы в диагностических анализах in vivo. Как правило, антитела мечены радионуклидным или нерадиактивным индикатором, который можно выявлять, например, ядерно-магнитным резонансом или другими известными способами. Предпочтительно, когда метка является радиоактивной, такой как, например, 125I, 131I, 67Cu, 99mTc или 111In. Меченое антитело вводят хозяину, предпочтительно в кровоток, и затем анализируют наличие и расположение меченого антитела в хозяине. Эту отображающую методику можно использовать для выявления, определения стадии и лечения новообразований. Радиоизотоп может быть конъюгирован с белком любым способом, включая использование металл-хелатирующих соединений или лактопероксидазы или йодогенных методик йодирования.
Что касается удобства, антитела данного изобретению могут быть представлены в наборе (ките), т.е. в упакованной комбинации реагентов в определенных количествах с инструкциями для проведения диагностического анализа. В тех случаях, когда антитело мечено ферментом, набор будет включать субстраты и кофакторы, необходимые для работы фермента (например, субстратный предшественник, который предоставляет обнаруживаемый хромофор или флюорофор). Кроме того, могут быть включены другие добавки, например, стабилизаторы, буферы (например, блокирующий буфер или лизирующий буфер) и т.п. Относительное количество различных реагентов может широко варьировать для обеспечения в растворах таких концентраций реагентов, которые значительно оптимизируют чувствительность анализа. В частности, реагенты могут быть предоставлены в виде сухих порошков, обычно лиофилизованных, включая эксципиенты, которые при растворении дают растворы реагентов с необходимой концентрацией.
Депозиты
Гибридома Z270 была депонирована 22 декабря 2005 года в Nationale de Culture de Microorganismes, Institute Pasteur, 25, Rue du Docteur Roux, F-75725 Paris, France, под номером I-3549.
ПРИМЕРЫ
Более детально изобретение проиллюстрировано нижеследующими примерами, но не ограничено ими.
Пример 1 - Выбор родительских humZ270VL и humZ270VH последовательностей
Этот пример описывает выбор родительских humZ270VL и humZ270VH последовательностей, а также возможных бэк-мутаций для последовательностей вариантных h270VL и humZ270VH.
В соответствии с описанием в примере 2 была клонирована гибридома Z270, а последовательности VH и VL цепей Z270 соответствующего антитела были определены как:
Z270VL:
DIQMTQSPASLSASVGETVTITCRASENIYSYLAWYQQKQGKSPQFLVYNAKTLAEG VPSRFSGSGSGTQFSLKINSLQPEDFGSYYCQHHYGTPRTFGGGTKLEIK (SEQ ID NO:1) с возможным аргининовым остатком (R) в позиции 108 по Кабату.
Z270VH:
QVQLQQPGAELVRPGASVKLSCKASGYTFTSYWMNWVKQRPEQGLQWIGRIDPYD SETHYSQKFKDKAILTVDKSSSTAYMRLSSLTSEDSAVYYCARGGYDFDVGTLYWFF DVWGAGTTVTVS (SEQ ID NO:2) с возможным С-концевым сериновым остатком (S).
Вторая легкая цепь, Z270VL-NB, также была идентифицирована. Тем не менее, это была общая миеломная легкая цепь.
Z270VL-NB:
NIVMTQSPKSMSMSVGERVTLTCKASENVVTYVSWYQQKPEQSPKLLIYGA-SNRYTGVPDRFTGSGSATDFTLTISSVQAEDLADYHCGQGYSYPYTFGGGTKLEIKR A (SEQ ID NO:3) с возможным аргининовым остатком (R) в позиции 108 по Кабату, а также с возможным аланиновым остатком (А) в позиции 109 по Кабату.
При анализе мышиных Z270 последовательностей CDRs по Кабату были определены как:
CDR-L1: RASENIYSYLA (остатки 24-34 из SEQ ID NO:1)
CDR-L2: NAKTLAE (остатки 50-56 из SEQ ID NO:1)
CDR-L3: QHHYGTPRT (остатки 89-97 из SEQ ID NO:1)
CDR-H1: SYWMN (остатки 31-35 из SEQ ID NO:2)
CDR-H2: RIDPYDSETHYSQKFKD (остатки 50-66 из SEQ ID NO:2)
CDR-H3: GGYDFDVGTLYWFFDV (остатки 95-102 из SEQ ID NO:2).
3D-модель структуры белка была построена с использованием МОЕ (молекулярная операционная система; доступна на www.chemcomp.com) со структурными матрицами из Базы данных структур белков (Protein Database Bank, PDB): 10PG и 1XF4. PDB описана в Berman et al. (Nucl Acids Res 2000:28:235-242) и доступна на www.rcsb.org/PDB. На основе статистического анализа 201 комплекса антитело-антиген в базе данных PDB было установлено, что наиболее вероятными остатками в рецепторной зоне являются:
Z270VL: остатки 24-34, 49-56, 89-97 из SEQ ID NO:1
Z270VH: остатки 23-35, 49-58, 93-102 из SEQ ID NO:2.
Используя МОЕ, выявили остатки, взаимодействующие (гидрофобно, с помощью водородных связей или электростатически) с рецепторной зоной, и эти комбинированные группы остатков (рецепторная зона + взаимодействующие остатки) были приняты в качестве шаблона Z270.
Поиск Z270VL и Z270VH по V базам данных зародышевых линий (V-база; доступна на vbase.mrc-cpe.cam.ac.uk/) дает следующие возможные матричные структуры (Е-номера приведены в скобках):
Тяжелая цепь: VH1_46 (2e-036), VH1_f (2е-035), VH1_02 (3е-035), VH1_18 (4Е-035), VH1_03 (6E-035); и
Легкая цепь: VKI_O2 (1e-039), VKI_O12 (1e-039), VKI_L12 (9E-038), VKI_L8 (9Е-038), VKI_A20 (9E-038).
Поиск матрицы по базам данных зародышевых линий дает следующие возможные матричные структуры (Е-номера приведены в скобках):
Тяжелая цепь: VH5_a (4E-013), VH5_51 (3е-011) VH1_f (1е-010), VH1_18 (2е-010), VH1_46(4Е-010); и
Легкая цепь: VKI_L9 (2e-012), VKI_02 (3е-012), VKI_O12 (3е-012), VKI_L24 (2е-011), VKI_A20 (2e-011).
После ручной проверки совместимости и правильности VH1_18 и VKI_O2 были выбраны в качестве человеческих платформ. JH6 и JK4 были выбраны в качестве зародышевых J-сегментов.
Гуманизация была разработана по следующим правилам:
- Остатки вне матрицы взяты те же, что и у человека.
- Остатки внутри матрицы и внутри CDR по Кабату взяты те же, что и у мыши.
- Остатки внутри матрицы и вне CDR по Кабату, одинаковые в мышиной и зародышевой последовательностях, взяты те же, что и в консенсусной последовательности.
- Остатки внутри матрицы и вне CDR по Кабату, различные в мышиной и зародышевой последовательностях, являются предметом для потенциальных бэк-мутаций.
Анализ проиллюстрирован на Фиг.1 для Z270VL и Z270VH, где матричные остатки затенены в схеме Кабата; CDR остатки выделены жирным шрифтом в схеме Кабата; и мышиные/зародышевые различия затенены в VKI_02/JK4 и VH1_18/JH6 последовательностях. Z270VL и humZ270VL1 и humZ270VL1 cons могут возможно включать аргининовый остаток (R) в позиции 108 по Кабату.
Образованные в результате последовательности, humZ270VL1 и humZ270VH1, даны с остатками потенциальных бэк-мутаций, как у человека.
CDRs гуманизированного антитела Z270 в соответствии с определениями Кабата показаны на Фиг.2. Из humZ270 CDRs только последовательность CDR-Н2 отличается от соответствующей мышиной CDR, при этом отличается по 4 позициям. Однако по сути это означает, что остатки 60-65 CDR-H2 по Кабату идентичны человеческой акцепторной последовательности, что делает молекулу более человеческой и уменьшает риск иммуногенности. На Фиг.2 различия указаны жирным шрифтом.
Пример 2 - Клонирование VH и VL регионов lgG1 Z270
Этот пример описывает клонирование и секвенирование мышиных регионов VH и VL Z270.
Z270 гибридомная клеточная культура для выделения общей РНК. Гибридома Z270 была культивирована в среде RPMI 1640 (Hyclone Cat#SH30011.04) с добавлением 10% FCS (Biochrom Cat#S0115). Для выделения общей РНК было собрано от 5×106 до 1×107 клеток.
Z270 гибридомная клеточная культура для продукции антитела. Для получения моноклональных антител Z270 была принята стратегия выращивания периодической культуры с периодичностью в одну неделю. Культуральной средой была RPMI 1640 с 10% FCS. Супернатант собирали каждые 7 дней. Начальная клеточная плотность в культуральной камере (матрасе для культвирования) CL-1000 (INTEGRA Biosciences, Item No. 90005, Lot No. 08541150) составляла 2×106 клеток/мл. В течение культивирования плотность и жизнеспособность клеток регулярно проверяли. После трех дней культивирования в CL-1000 матрасе плотность была более 1×107, а жизнеспособность составляла примерно 85%. В течение следующих четырех дней клеточная плотность колебалась в пределах 1,5-2,5×107 клеток/мл, а жизнеспособность постепенно сократилась до 60-70%. На седьмой день супернатант был собран, и для оценки концентрации антитела был использован способ SDS-PAGE в восстанавливающих условиях с количественным контролем (A-TNP-20050118 2 мг/мл).
Выделение общей РНК Z270. Выделение было проведено с использованием реагента TRIZOL, Invitrogen, Cat. No. 15596-026, в соответствии с инструкциями изготовителя.
5'-RACE (быстрая амплификация концов кДНК). Протокол был взят из инструкции производителей для использования набора SMART™ RACE cDNA Amplification Kit, произведенного Clontech, Catalog no. 634914, и адаптирован с учетом следующего дизайна ген-специфических праймеров (GSPs):
GSP1 для амплификации вариабельного региона тяжелой цепи lgG1
RacePrimerheavy: 5'-GCCAGTGGATAGACAGATGG-3' (SEQ ID NO:12)
GSP2: для амплификации вариабельного региона Каппа цепи lgG1
RacePrimerkappa: 5'-GATGGATACAGTTGGTGCAGC-3' (SEQ ID NO:13).
После синтеза одноцепочечной кДНК, проведения RACE и анализа полученных в результате образцов на 1,5% агарозном геле, RACE ДНК полоска была вырезана и очищена с помощью набора Gel purification kit (QIAGEN QIAquick Cat#28706), а затем клонирована в pMD-19 с использованием набора DNA Ligation Kit (Cat#D6022 от TAKARA) Ver. 2.0 путем ТА клонирования (Фиг.3А). Положительные клоны были отосланы для секвенирования ДНК.
Некоторые клоны легкой цепи и тяжелой цепи были секвенированы с идентичной последовательностью, как показано на Фиг.4A-D (сигнальные пептидные последовательности выделены жирным шрифтом):
Z270 VL кДНК: (SEQ ID NO:14)
Z270 VL белка: (SEQ ID NO:15)
Z270 VH кДНК: (SEQ ID NO:16)
Z270 VH белка: (SEQ ID NO:17).
Пример 3 - Клонирование легкой и тяжелой цепей мышиного lgG1 в PJSV002
Для определения аффинности антитела и для его использования в качестве положительного контроля легкую и тяжелую цепи антитела Z270 вставляют в pJSV002, как мышиное антитело lgG1. pJSV002 является вектором для транзиентной экспрессии, который может быть использован в комбинации с клетками HEK293 6Е для транзиентной экспрессии Z270 (Фиг.3В).
VL Z270 и константный регион lgG1 клонируют в сайты EcoRI и Nhe I в pJSV002. Полученная плазмида показана на Фиг.3C. Вставленная последовательность с EcoRI и Nhe I (прописные буквы) на обоих концах показана на Фиг.4Е (SEQ ID NO:18).
Вариабельный регион Н1 и константный регион lgG1 клонированы в сайты EcoRI и Nhe I в mlgG1 -вариант pJSV002 (Рис.3D). mlgG1-вариант PJSV002 содержит мышиный константный регион тяжелой цепи lgG1 (Рис.3Е). Последовательность, вставленная между сайтами EcoRI и Nhe I (gctagc), с рестрикционными сайтами и мышиным константным регионом lgG1, обозначенным строчными буквами, показана на Фиг.4F (SEQ ID NO:19).
Пример 4 - Плазмидые конструкции для химерного антитела Z270
Для определения аффинности антитела и для использования его в качестве положительного контроля легкую и тяжелую цепи мышиного антитела 2270 вставляют в pJSV002, как человеческое химерное антитело lgG4 S241P. Антитело содержит мышиный вариабельный регион и человеческий константный регион lgG4 с мутацией S241 Р в тяжелой цепи.
Для экспрессии химерного антитела Z270 (chimZ270) последовательность Z270VL и человеческий константный регион легкой цепи (каппа) вставляют в сайты EcoR I и BamH I в pJSV002 (Фиг.3F). Используется последовательность, показанная на Фиг.4G, где прописными буквами обозначены рестрикционные сайты (SEQ ID NO:20).
Z270 VH и человеческий константный регион тяжелой цепи вставляют в сайты EcoR I и Nhe I в pJSV002-lgG4-S241 Р (Фиг.3G и 3Н). Используется последовательность, показанная на Фиг.4Н с последовательностью, вставленной между EcoR I и Nhe I (gctagc) сайтами, где прописными буквами обозначены рестрикционные сайты (SEQ ID NO:21).
Пример 5 - Экспрессия гуманизированного 2270
По стратегии гуманизации Z270, описанной в примере 1, CDRs легкой цепи Z270 прививают матрице VKI_02/JK4 для получения humZ270VL1. Последовательность, показанная на Фиг.4I, является результатом синтезирования последовательности между сайтами EcoRI и KasI и вставления ее в pJSV002-hKappaC (с человеческим константным регионом каппа-цепи в pJSV002); CDR-кодирующие последовательности обозначены прописными буквами, а рестрикционные сайты выделены жирным шрифтом (SEQ ID NO:22).
Для гуманизации тяжелой цепи CDRs тяжелой цепи Z270 (возможно, с оптимизированным CDR-H2) прививают VH1_18/JK6 матрице для получения humZ270VH1. Последовательность между сайтами EcoRI и Nhel синтезируют и клонируют в pJSV002-hlgG4 S241P (человеческий константный регион lgG4 S241P в pJSV002, Фиг.3G) с CDR-кодирующими последовательностями, отмеченными прописными буквами, и рестрикционными сайтами, выделенными жирным шрифтом (Фиг.4J, SEQ ID NO:23).
Мутированные конструкции аналогично клонируют в pJSV002 с соответствующим константным регионом lgG4 S241P и человеческим константным регионом каппа-цепи с учетом следующих комбинаций бэк-мутаций в каркасном участке humZ270VL и humZ270VH:
humZ270VL: Wt (т.е. отсутствие бэк-мутаций), L46F, I48V, L46F_48V
humZ270VH: Wt (т.е. отсутствие бэк-мутаций), V5Q, M69L, T71V, T73K, T75S, V5Q_M69L, V5Q_T71V, V5Q_T73K, V5Q_T75S, M69L_T71V, M69L_T73K, M69L_T75S, T71V_T73K, T71V_T75S, T73K_T75S, V5Q_M69L_T71V_T73K_T75S, M69L_T71V_T73K_T75S, V5Q_ T71V_T73K_T75S, V5Q_M69L_T73K_T75S, V5CLM69L_T71V_ T75S, V5Q_M69L_T71V_T73K, T71V_T73K_T75S, M69L_T73K_T75S, M69L_T71V_T75S, M69L_T71_V_T73K, V5Q_T73K_T75S, V5Q_T71V_T75S, V5Q_T71V_T73K, V5Q_M69L_T75S, V5Q_M69L_T73K, V5Q_M69L_T71V. Типичный векторный дизайн тяжелой цепи (НС) проиллюстрирован на Фиг.5, а типичный векторный дизайн легкой цепи (LC) представлен на Фиг.6.
Плазмиды трансфицируют в HEK293 6Е для транзиентной экспрессии с использованием 293fectin.
Материалы
Клетки: клетки HEK 293 6Е (293-6Е) выращивают в фазе экспоненциального роста (от 0,8 до 1,2×106 клеток/мл).
Культуральная среда: FreeStyleTM (каталоговый номер 12338-018 от Gibco); 25 мкг/мл Geneticin 418 (каталоговый номер 10131-019 от Gibco); 0,1% pluronic F-68 (каталоговый номер 24040-032 от Gibco).
Трансфекционная среда: Opti-MEM (каталоговый номер 51985-026 от Gibco); 293fectin (каталоговый номер 12347019 от Invitrogen).
Плазмидная ДНК: целевая очищенная плазмидная ДНК (см. выше).
Клеточный подсчет и инокуляция. За два дня до трансфекции в матрас объемом 125 мл переносят необходимый объем, содержащий 7,5×106 клеток, и добавляют свежую среду Freestyle до объема 30 мл (конечная плотность клеток должна составлять 0,25×106 клеток/мл). Через два дня (в день трансфекции) плотность клеток должна быть в пределах 1-1,2×106 клеток/мл. В альтернативном варианте за один день до трансфекции в матрас объемом 125 мл переносят необходимый объем, содержащий 1,5×107 клеток, и добавляют свежую среду Freestyle до объема 30 мл (конечная плотность клеток должна составлять 0,50×106 клеток/мл). Через 24 часа (в день трансфекции) плотность клеток должна быть в пределах 0,9-1,2×106 клеток/мл.
Приготовление комплекса 293fectin-HHK. Для приготовления раствора ДНК 30 мкг ДНК разводят в общем объеме 1 мл Opti-MEM. Для приготовления раствора 293fectin 40 мкл его разводят в 960 мкл Opti-MEM. Через 5 мин инкубации при комнатной температуре раствор 293fectin и раствор ДНК смешивают, а затем смесь инкубируют в течение 25 минут при комнатной температуре. Затем клетки трансфицируют 2 мл 2931ес11п-ДНК смеси и инкубируют при 37°C в CO2-инкубаторе (на орбитальном шейкере) с 5% содержанием CO2 в течение 4-6 дней. На Фиг.7 схематично изложена общая процедура транзиентной экспрессии в клетках HEK293, таких как, например, клетки HEK693 6Е.
Пример 6 - Очистка lgG1 из гибридомной культуры Z270
Антитела lgG1 Z270 очищают из культуральной жидкости гибридомных клеток Z270 путем добавления образца в HiTrap Protein A HP (1 мл) колонку, уравновешенную 3М NaCl 50 мМ Tris pH8,5, со скоростью потока: 1,0 мл/мин, и элюирования антитела с помощью с помощью 25 мМ лимонной кислоты, 4,5 мМ натриевой соли лимонной кислоты pH3.0.
Пример 7 - Определение количества и аффинности антитела
Плазмиды, содержащие легкую цепь и эквивалентную тяжелую цепь экспрессионной конструкции, смешивают парами, и плазмиды используют для трансфекции клеток НЕК6Е. Затем собирают культуральный супернатант.
Для количественной оценки мышиных антител lgG1 (или lgG4) платы для ELISA покрывают первичными антителами (антителами захвата) - козлиными противомышиными Fc-специфическими полиантителами lgG1 (или lgG4). Присоединяются антитела, экспрессированные в супернатанте, а за ними следуют вторичные козлиные антимышиные HRP-полиантитела против каппа-цепи или Fab. Добавляют HRP-субстрат и выявляют конверсию оптической плотности при 450 нм.
Для анализа антигенного связывания гуманизированных антител Z270 используют следующий анализ Biacore, проиллюстрированный на Фиг.8. Антитело, захватывающее антиген, иммобилизуют на чипе Biacore. Добавляют антиген и культуральный супернатант. Для вычисления аффинности анализируют on- и off-показатели.
Пример 8 - Biacore анализ химерного, гуманизированного и бэк-мутантного вариантов Z270
Материалы и способы
Химерный Z270 и humZ270 в акцепторных каркасах легкой цепи VKI_O2/JK4 и тяжелой цепи VH1_18/JH6 были получены в соответствии со способами, описанными в примерах 4 и 5. Антиген-связывающие свойства химерного Z270, humZ270 и бэк-мутантного вариантов были проанализированы на системе Biacore T100 (Biacore AB, Uppsala, Sweden). Антиген в виде одноцепочечной конструкции NKG2A-CD94-mFc был ковалентно иммобилизирован на сенсорном чипе СМ5 (Biacore AB, Uppsala, Sweden) через аминогруппы с использованием 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида (EDC) и N-гидроксисукцинимида (NHS). Целевым уровнем иммобилизации был уровень 300 RU (единиц относительной спектральной чувствительности). Варианты антитела Z270 были разведены в серии концентраций (0,157, 0,313, 0,625, 1,25, 2,5 нМ) рабочим буфером HBS-ЕР (10 мМ HEPES pH 7,4, 150 мМ NaCl, 3 мМ ЭДТА, 0,005% (v/v) Твин-20). Все образцы затем пропускали через иммобилизованный антиген в течение 2 мин со скоростью потока 40 мкл/мин. Затем в течение 3 мин вводили рабочий буфер со скоростью потока 40 мкл/мин для анализа диссоциации антитела. После каждого прогона вводили регенерационный буфер (10 мМ NaOH, 500 мМ NaCl) (30 секунд, 10 л/мин), чтобы полностью удалить антиген с оставшихся антител. Данные были оценены с помощью программного обеспечения Biacore Т100.
Результаты
Аффинность humZ270 была определена как 67 рМ. Это значение KD было выше, чем у химерного Z270 (50 рМ) (Фиг.9 и Таблица 2). Введение бэк-мутации в humZ270 в акцепторные каркасы легкой цепи VKI_O2/JK4 и тяжелой цепи VH1_18/JH6 не существенно увеличило аффинность (Фиг.10).

Пример 9 - Формирование humZ270 с CDR-H2 полной длины
В соответствии с альтернативной стратегией, показанной на Фиг.11, было исследовано, действительно ли CDRs Кабата полной длины (включая CDR-H2 полной длины) приведет к улучшению аффинности humZ270 в акцепторных каркасах легкой VKI_O2/JK4 и тяжелой VH1_18/JH6 цепей. humZ270VH3 (SEQ ID NO:24) следует непосредственно из разницы в определениях CDR, образуя в результате в основном гуманизированное антитело Z270 с привитым CDR Кабата. humZ270VH4 (SEQ ID NO:25) следует из наблюдений, что K38, Q46, W47, I48, G49, Y59, Q61, K62, K66 и А67 находятся поблизости от S60, F63, K64, D65 боковых цепей, в результате чего образуется CDR-привитое гуманизированное антитело Z270 с бэк-мутациями R38K, E46Q, M48I, R66K и V67A.
Пример 10 - Формирование humZ270 в других человеческих акцепторных каркасах
Для выбора каркаса были изучено множество различных гуманизированных конструкций с различными человеческими последовательностями акцепторного каркаса тяжелой цепи.
Фиг.12 показывает согласование между различными полученными гуманизированными конструкциями Z270VH. humZ270VH5 (SEQ ID NO:26) основана на VH5_a, humZ270VH6 (SEQ ID NO:27) основана на VH5_51, humZ270VH7 (SEQ ID NO:28) основана на VH1_f, a humZ270VH8 (SEQ ID NO:29) основана на VH1_46, все с JH6 J-сегментом. Шесть С-концевых аминокислотных остатков из CDR-H2 Кабата всех гуманизированных конструкций были идентичны человеческому акцепторному каркасу.
Используя программу для согласования VectorNTI, получили следующие значения идентичности последовательностей humZ270VH1 и humZ270VH5, -6, -7 и -8: 78,2% (VH1 и VH5), 79,0% (VH1 и VH6), 88,7% (VH1 и VH7) и 96,0% (VH1 и VH8).
Пример 11 - Анализ Biacore различных вариантов humZ270
Была проанализирована аффинность вариантов huZ270, каждый из которых содержит последовательность humZ270VL1, но с разными стратегиями гуманизации последовательности VH.
Материалы и способы
Была использована система Biacore T100 (Biacore AB, Uppsala, Sweden). Антиген CD94/NKG2A использовался в форме одноцепочечной конструкции NKG2A-CD94-mFc, ковалентно иммобилизованной на сенсорном чипе СМ5 (Biacore AB, Uppsala, Sweden) через аминогруппы с использованием 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида (EDC) и N-гидроксисукцинимида (NHS). Целевым уровнем иммобилизации был уровень 300 RU. Варианты антитела Z270 были разведены в серии концентраций (0,157, 0,313, 0,625, 1,25, 2,5 нМ) рабочим буфером HBS-ЕР. Все образцы затем пропускали через иммобилизованный антиген в течение 2 мин со скоростью потока 40 мкл/мин. Затем в течение 3 мин вводили форезный буфер со скоростью потока 40 мкл/мин для анализа диссоциации антитела. После каждого прогона вводили регенерационный буфер (10 мМ NaOH, 500 мМ NaCl) (30 секунд, 10 л/мин), чтобы полностью удалить антиген с оставшихся антител. Данные были оценены с помощью программного обеспечения Biacore T100. Значение KD каждого варианта было разделено на значение KD для huZ270 с тяжелой цепью humZ270VH1, чтобы получить относительное значение и кратность изменения KD.
Результаты и выводы
Результаты показаны на Фиг.13, где значение KD для каждого варианта было нормализовано по отношению к huZ270 с тяжелой цепью humZ270VH1 для получения относительного изменения KD. Как показано на Фиг.13, между CDR-привитыми вариантами (VH3, VH4) и вариантом humZ270, содержащим меньше мышиных остатков в сегменте CDR-H2 (humZ270VL1/VH1), существенных различий не было. Также не было существенных различий между "гуманизированными CDR-H2" вариантами в различных человеческих акцепторных каркасах. Поскольку человеческое антитело humZ270 имеет преимущество, заключающееся в более низком риске иммунного ответа у пациента, являющегося человеком, то гуманизированные CDR-H2 варианты, такие как VH1, VH5, VH6 и VH7, могут быть выбраны для терапевтических применений без угрозы значительного снижения аффинности по сравнению со стандартным CDR-привитым антителом humZ270, но с более низкой вероятностью иммунного ответа хозяина.
Пример 12 - Выявление критических остатков в Z270VL и VH
Для идентификации рецепторной зоны Z270 был проведен аланиновый сканирующий мутагенез в CDRs мышиных антител. Для аланинового мутагенеза были отобраны следующие аминокислоты (Фиг.14):
Z270VL: R24A, S26A, Е27А, N28A, Y30A, S31A, N50A, K52A, Т53А, Е56А, Y92A, Т94А
Z270VH: K23A, S25A, Т28А, Т30А, S31A, N35A, D52A, Y53A, D54A, S55A, Е56А, R94A, D98A, F99A, D100A, V(100A)A, T(100C)A, L(100D)A, W(100F)A, D101A.
Материалы и способы
Антиген-связывающие свойства аланиновых мутантов были проанализированы на Biacore Т100 (Biacore AB, Uppsala, Sweden). Антиген в форме sc-NKG2A-CD94-mFc был ковалентно иммобилизован на сенсорном чипе СМ5 (Biacore AB, Uppsala, Sweden) через аминогруппы с использованием 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида (EDC) и N-гидроксисукцинимида (NHS). Целевым уровнем иммобилизации был уровень 300 RU. Очищенные аланиновые мутанты Z270 были разведены до концентрации 0,75 нМ или 1,5 нМ рабочим буфером HBS-EP. Все образцы затем пропускали через иммобилизованный антиген в течение 3 мин со скоростью потока 10 мкл/мин. Затем в течение 1 мин вводили рабочий буфер со скоростью потока 10 л/мин для анализа стабильности связывания антитела. После каждого прогона вводили регенерационный буфер (10 мМ NaOH, 500 мМ NaCl) (35 секунд, 10 мкл/мин), чтобы полностью удалить антиген с оставшихся антител. Данные были оценены с помощью программного обеспечения Biacore T100. Относительное связывание каждого мутанта было рассчитано путем деления значения его уровня связывания (RU), полученного с помощью Biacore, на значение уровня связывания chimZ270.
Результаты и выводы
Как показано на Фиг.15, Z270VH аланиновые мутанты D52A, D54A, F99A, Т(100С)А и W(100F)A полностью утратили свои антиген-связывающие свойства. Мутант по тяжелой цепи R94 сохраняет примерно 20% антиген-связывающей способности. Относительные уровни связывания мутантов по тяжелым цепям N35A, Y53A, Е56А, D98A, V(100A)A и L(100D)A составляют 40-70% (Фиг.1). Таким образом, аминокислоты D52, D54, R94, F99, Т(100C) и W(100F) в CDR-H2 и CDR-H3 тяжелой цепи Z270 являются критическими остатками для распознавания антигена. Между тем, аминокислоты N35, Y53, Е56, D98, V(100A) и L(100D) в тяжелой цепи умеренно влияют на связывание антигена. Интересно, что все аланиновые мутанты по легкой цепи Z270 сохраняют антиген-связывающие свойства, сопоставимые со свойствами химерного Z270 (Фиг.16). Поэтому никакие аминокислоты в легкой цепи Z270 не способствуют значительно распознаванию антигена.
Пример 13 - HumZ270 конкретно связывает клетки выразил CD94/NKG2A
Сила и специфика связывания humZ270 с CD94/NKG2A была оценена с помощью проточной цитометрии, путем анализа связывания в клетках НЕК293 продуцированного Z270 дикого типа (recZ270), химерного Z270 с человеческим lgG4 (chimZ270) или гуманизированного Z270 (humZ270VL1/VH1) с клетками Ba/F3 со стабильной сверхэкспрессией CD94/NKG2A или CD94/NKG2C. Для этой цели Ba/F3-CD94/NKG2A и С-клетки инкубировали с различными концентрациями вариантов Z270 в среде для тканевой культуры, содержащей 2% FCS, по меньшей мере 30 минут на льду. Затем клетки отмывали и инкубировали в аналогичной среде с АРС, конъюгированным со вторичными антителами, снова по меньшей мере 30 минут на льду. После двукратного отмывания ледяным PBS связывание моноклональных антител с клетками было визуализировано с помощью анализатора BD Biosciences FACSarray.
Как показано на Фиг.17, все варианты Z270 связываются в зависимости от дозы с клетками Ba/F3-CD94/NKG2A, но не с клетками Ba/F3-CD94/NKG2C. Таким образом все варианты специфично связывают NKG2A, humZ270 связывается с NKG2A с эффективностью, аналогичной chimZ270, тогда как recZ270 связывается несколько более эффективно.
Пример 14 - humZ270 индуцирует уничтожение HLA-E+ целевых клеток CD94/NKG2A-экспрессирующими NKL-клетками
Была исследована способность recZ270, chimZ270, humZ270VL1/VH1 и Z199 индуцировать уничтожение 51Cr-меченых LCL 721221-Cw3 клеток CD94/NKG2A+NKL-клетками. В этом анализе 51Cr-меченые LCL 721221-Cw3 целевые клетки (HLA-E+) инкубировали с NKL-клетками в СО2-инкубаторе, содержащем 5% СО2, в течение 4 часов при температуре 37°C (соотношение Е:Т=6:1) в присутствии или отсутствие различных концентраций моноклональных анти-NKG2A антител. Уничтожение целевых клеток было проанализировано путем измерения количества 51Cr в культуральной среде ткани, который высвобождался из целевых клеток после их уничтожения.
На Фиг.18 показано, что увеличенные концентрации анти-NKG2A антитела индуцировали уничтожение LCL 721221-Cw3 клеток NKL-клетками. Z199, chimZ270 и recZ270 были одинаково эффективны, в то время humZ270 индуцировал повышенное уничтожение LCL721221-Cw3 клеток NKL-клетками. Таким образом, humZ270 может эффективно блокировать ингибиторные функции CD94/NKG2A на CD94/NKG2A-экспрессирующих цитотоксических лимфоцитах, таких как подтипы НК-клеток, НКТ-клеток, α/β Т-клеток и γ/δ Т-клеток, и он был более эффективным, чем другие протестированные рекомбинантные варианты.
Пример 15 - humZ270 является конкурентным антагонистом CD94/NKG2A
Чтобы проверить, позволяет ли humZ270VL1/VH1 лиганду (например, HLA-Е) связываться с CD94/NKG2A, мы проанализировали, может ли humZ270 предотвратить связывание тетрамера HLA-E с CD94/NKG2A, сверхэкспрессирующимся на Ba/F3 клетках (Ba/F3 -CD94/NKG2A). Для этого Ba/F3-CD94/NKG2A инкубировали с 1) различными концентрациями humZ270 или 2) вначале инкубировали с насыщенной концентрацией тетрамера HLA-E (4,7 мкг/мл), а затем инкубировали с различными концентрациями humZ270. Все инкубации выполняли в культуральной среде для ткани, содержащей 2% FCS, на льду. Затем клетки инкубировали с АРС-конъюгированными вторичными антителами, специфичными для мышиных антител, и анализировали с помощью проточной цитометрии с использованием анализатора BD Bioscinces FACSarray.
Как показано на Фиг.19, humZ270 эффективно связывается с Ba/F3-CD94/NKG2A клетками в зависимости от концентрации (ромбы). Однако если клетки предварительно инкубировать с тетрамерами HLA-E, humZ270 лишается возможности связываться с клетками Ba/F3-CD94/NKG2A. Таким образом, humZ270 и HLA-E связывают перекрывающиеся эпитопы на CD94/NKG2A. Поэтому CD94/NKG2A-ингибиторный эффект humZ270 в анализе цитотоксичности НК-клеток скорее всего является следствием предотвращения способности HLA-E, что ведет к индукции негативных сигналов для цитотоксических лимфоцитов через CD94/NKG2A. Таким образом, humZ270 можно считать конкурентным антагонистом CD94/NKG2A.
Пример 16 - humZ270 конкретно связывается с CD94/NKG2A
Специфичность и эффективность humZ270VL1/VH1, а также различных вариантов humZ270VL1/VH1 с бэк-мутациями в вариабельном легком (VL) или варабельном тяжелом (VH) регионах были проверены при связывании с CD94/NKG2A в проточной цитометрии. Для этого клетки Ba/F3-CD94/NKG2A инкубировали с humZ270-L46F (VL), humZ270-l48V (VL), humZ270-L46F/l48V (VL), humZ270-V5Q (VH), humZ270-M69L (VH), humZ270-T71V (VH), humZ270-T73K (VH), humZ270-T75S (VH), humZ270-V5Q/M69UT71V/T73K/T75S (VH), humZ270-M69L/T71V/T73K/T75S (VH) или двумя различными партиями humZ270VL1/VH1 без бэк-мутации ("DK" и "CHN"). Для этой цели Ba/F3-CD94/NKG2A или С-клетки инкубировали с различными концентрациями вариантов humZ270 в культуральной среде для ткани, содержащей 2% FCS, по меньшей мере 30 минут на льду. Затем клетки промывали и инкубировали в аналогичной среде с АРС, конъюгированным со вторичными антителами, специфичными для человеческих антител, снова по меньшей мере 30 минут на льду. После двукратного промывания с ледяным PBS связывание вторичных антител на клетках было визуализировано с помощью анализатора BD Bioscinces FACSarray.
Все варианты специфично связывались с CD94/NKG2A, но не с CD94/NKG2C. Все варианты связывались с CD94/NKG2A с одинаковой эффективностью, за исключением вариантов, содержащих V5Q (VL) мутацию, которые связывались чуть менее эффективно (см. Фиг.20).
ПРИМЕРЫ ВОПЛОЩЕНИЯ
В следующих пунктах описываются типичные воплощения изобретения.
1. Антитело, которое специфично связывается с NKG2A, содержащее антиген-связывающие остатки из участков, определяющих комплементарность (CDRs) мышиного антитела 2270, и последовательности человеческого акцепторного каркасного участка, где по меньшей мере шесть С-концевых аминокислотных остатков из CDR-Н2 являются такими же, как и в вариабельной области тяжелой цепи (VH) человеческой акцепторной последовательности.
2. Антитело воплощения 1, которое является более эффективным, чем антитело, содержащее последовательности вариабельной области легкой цепи (VL) и VH мышиного антитела Z270, в потенциировании цитотоксической активности CD94/NKG2A-экспрессирующего цитотоксического лимфоцита.
3. Антитело воплощения 1, которое является более эффективным, чем антитело, содержащее последовательности вариабельной области легкой цепи (VL) и VH мышиного антитела Z270, в нейтрализации ингибиторной активности CD94/NKG2A рецептора, экспрессированного на поверхности цитотоксического лимфоцита.
4. Антитело воплощения 1, которое является более эффективным, чем антитело, содержащее последовательности вариабельной области легкой цепи (VL) и VH мышиного антитела Z270, в уменьшении CD94/NKG2A-опосредованного ингибирования цитотоксической активности CD94/NKG2A-экспрессирующего цитотоксического лимфоцита.
5. Антитело воплощения 1, которое является более эффективным, чем антитело, содержащее последовательности вариабельной области легкой цепи (VL) и VH мышиного антитела Z270, в индукции уничтожения Cw3-экспрессирующей целевой клетки CD94/NKG2A-экспрессирующим цитотоксическим лимфоцитом.
6. Антитело любого из воплощений 2-5, где CD94/NKG2A-экспрессирующий цитотоксический лимфоцит является НК-клеткой, НКТ-клеткой, α/β Т-клеткой или γ/δ Т-клеткой.
7. Антитело воплощения 6, где CD94/NKG2A-экспрессирующий цитотоксический лимфоцит является НК-клеткой.
8. Антитело любого из воплощений 1-7, где домен VH антитела содержит остатки D52, D54, F99, Т(100C) и W(100F) из VH CDRs мышиного антитела Z270.
9. Антитело воплощения 8, где домен VH антитела также содержит остатки N35, Y53, Е56, D98, V(100A) и L(100D) из VH CDRs мышиного антитела Z270.
10. Антитело любого из воплощений 1-9, содержащее CDR-H1, соответствующую остаткам 31-35 SEQ ID NO:5, и CDR-H3, соответствующую остаткам 95-102 от SEQ ID NO:5, где CDR-H2 содержит остатки 50-59 из SEQ ID NO:5.
11. Антитело любого из воплощений 1-10, где последовательность человеческого акцепторного каркасного участка VH домена на 70% и более идентична SEQ ID NO:5.
12. Антитело любого из воплощений 1-11, где сегмент VH человеческого акцепторного каркаса VH представляет собой VH1_18, VH5_a, VH5_51, VH1_f или VH1_46, a J-сегмент представляет собой JH6.
13. Антитело воплощения 12, где сегмент VH представляет собой VH1_18, VH5_a, VH5_51 или VH1_f.
14. Антитело воплощения 13, где сегмент VH представляет собой VH1_18.
15. Антитело любого из воплощений 1-14, где домен VH человеческой акцепторной последовательности не имеет никаких бэк-мутаций.
16. Антитело любого из воплощений 1-14, где
(a) аминокислота в позиции 5 домена VH представляет собой V или Q;
(b) аминокислота в позиции 69 домена VH представляет собой М или L;
(c) аминокислота в позиции 71 домена VH представляет собой Т или V;
(d) аминокислота в позиции 73 домена VH представляет собой Т или K; или
(e) аминокислота в позиции 75 домена VH представляет собой Т или S.
17. Антитело воплощения 16, где аминокислота в позиции 69 представляет собой L.
18. Антитело воплощения 16, где аминокислота в позиции 71 представляет собой V.
19. Антитело любого из воплощений 1-15, где домен VH содержит последовательности SEQ ID NO:5.
20. Антитело любого из воплощений 1-19, содержащее CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:4, CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:4, и CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:4.
21. Антитело воплощения 20, где человеческая акцепторная последовательность домена VL не имеет никаких бэк-мутаций.
22. Антитело любого из воплощений 20-21, где человеческий акцепторный каркас домена VL представляет собой последовательность из VKI_O2/JK4.
23. Антитело любого из воплощений 20-22, где человеческий акцепторный каркас домена VL содержит SEQ ID NO:4.
24. Гуманизированное антитело или фрагмент антитела, которое специфично связывается с NKG2A, содержащее
(a) CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:4;
(b) CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:4;
(c) CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:4;
(d) CDR-H1, соответствующую остаткам 31-35 SEQ ID NO:5;
(e) CDR-H3, соответствующую остаткам 95-102 от SEQ ID NO:5; и
(f) CDR-H2, содержащую остатки 50-59 из SEQ ID NO:5; и
(g) последовательности человеческого акцепторного каркасного участка;
где остатки 60-65 в CDR-H2 взяты из человеческой акцепторной последовательности VH, и
где гуманизированное антитело является более эффективным в потенцировании цитотоксической активности CD94/NKG2A-экспрессирующих НК клеток, чем антитело, содержащее последовательность вариабельной области легкой цепи (VL), соответствующую последовательности SEQ ID NO:1, и VH последовательность, соответствующую SEQ ID NO:2.
25. Гуманизированное антитело, которое связывается с человеческим NKG2A, антитело, содержащее домен VH, который включает нечеловеческие CDR остатки и человеческий акцепторный каркас VH, домен VH, содержащий CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:5, CDR-H2, соответствующую остаткам 50-65 из SEQ ID NO:5, CDR -НЗ, соответствующую остаткам 95-102 из SEQ ID NO:5.
26. Гуманизированное антитело воплощения 25, где человеческий акцепторный каркас VH не содержит каких-либо бэк-мутаций.
27. Гуманизированное антитело воплощения 25, где аминокислота домена VH в позиции 5 по Кабату представляет собой V или Q.
28. Гуманизированное антитело воплощения 25, где аминокислота домена VH в позиции 69 по Кабату представляет собой М или L.
29. Гуманизированное антитело воплощения 25, где аминокислота домена VH в позиции 71 по Кабату представляет собой Т или V.
30. Гуманизированное антитело воплощения 25, где аминокислота домена VH в позиции 73 по Кабату представляет собой Т или K.
31. Гуманизированное антитело воплощения 25, где аминокислота домена VH в позиции 75 по Кабату представляет собой Т или S.
32. Гуманизированное антитело воплощения 25, где домен VH содержит замены каркасного участка по меньшей мере в одной позиции по Кабату, выбранной среди 5, 69, 71, 73 и 75.
33. Гуманизированное антитело воплощения 32, где домен VH содержит аминокислотную последовательность SEQ ID NO:5 с замещениями в каркасе, соответствующими одному из следующих вариантов:
(a) нет замены
(b) V5Q
(c) M69L
(d) T71V
(e) T73K
(f) T75S
(g) V5Q и M69L
(h) V5Q и T71V
(i) V5Q и T73K
(j) V5Q и T75S
(k) M69L и T71V
(l) M69L и T73K
(m) M69L и T75S
(n) T71V и T73K
(о) T71V и T75S
(p) T73K и T75S
(q) V5Q, T73K и T75S
(r) V5Q, T71V и T75S
(s) V5Q, T71V и T73K
(t) V5Q, M69L и T75S
(u) V5Q, M69L и T73K
(v) V5Q, M69L и T71V
(w) T71V, T73K и T75S
(x) M69L, T73K и T75S
(y) M69L, T71V и T75S,
(z) M69L, T71V и T73K,
(aa) V5Q, M69L, T71V и T73K,
(bb) V5Q, M69L, T71V и T75S,
(cc) V5Q, M69L, T73K и T75S,
(dd) V5Q, T71V, T73K и T75S,
(ее) M69L, T71V, T73K и T75S, и
(ff) V5Q, M69L, T71V, T73K и T75S.
34. Гуманизированное антитело любого из воплощений 25-32, содержащее VL домен, который включает в себя нечеловеческие CDR остатки, включенные в человеческий VL акцепторный каркас, причем VL домен, содержит CDR-L1, соответствующий остаткам 24-34 из SEQ ID NO:4, CDR-L2, соответствующий остаткам 50-56 из SEQ ID NO:4, и CDR-L3, соответствующий остаткам 89-97 из SEQ ID NO:4.
35. Гуманизированное антитело воплощения 34, где человеческий акцепторный каркас VL не содержит каких-либо бэк-мутаций.
36. Гуманизированное антитело воплощения 34, где аминокислота домена VL в позиции 46 по Кабату представляет собой L или F.
37. Гуманизированное антитело воплощения 34, где аминокислота домена VL в позиции 48 по Кабату представляет собой I или V.
38. Гуманизированное антитело воплощения 34, где домен VL содержит замены каркасного участка по меньшей мере в одной позиции по Кабату, выбранной между 46 и 48.
39. Гуманизированное антитело воплощения 38, где домен VL содержит аминокислотную последовательность SEQ ID NO:4 с замещениями в каркасе в соответствии с одним из следующих вариантов:
(а) Нет замен
(б) L46F
(c) I48V
(d) L46 и I48V.
40. Гуманизированное антитело, которое связывает человеческий NKG2A, причем это антитело содержит домен VH, который содержит нечеловеческие CDR остатки, вставленные в человеческий домен VH, в свою очередь содержащий замены каркасного участка по меньшей мере в одной позиции по Кабату в SEQ ID NO:7, выбранной среди 5, 69, 71, 73 и 75.
41. Гуманизированное антитело воплощения 40, содержащее V5Q замену.
42. Гуманизированное антитело воплощения 40, содержащее M69L замену.
43. Гуманизированное антитело воплощения 40, содержащее T71V замену.
44. Гуманизированное антитело воплощения 40, содержащее Т73К замену.
45. Гуманизированное антитело воплощения 40, содержащее T75S замену.
46. Гуманизированное антитело воплощения 40, содержащее домен VL, который содержит нечеловеческие CDR остатки, вставленные в человеческий домен VL, в свою очередь содержащий замены каркасного участка по меньшей мере в одной позиции по Кабату в SEQ ID NO:6, выбранной между 46 и 48.
47. Гуманизированное антитело воплощения 40, содержащее L46F замену.
48. Гуманизированное антитело воплощения 40, содержащее I48V замену.
49. Гуманизированное антитело любого из воплощений 40-48, содержащее CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:5, CDR-H2 соответствующую остаткам 50-66 из SEQ ID NO:5, и CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:5.
50. Гуманизированное антитело любого из воплощений 40-49, содержащее домен VH с последовательностью SEQ ID NO:7.
51. Гуманизированное антитело любого из воплощений 40-50, содержащее CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:6, CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:6, и CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:6.
52. Гуманизированное антитело любого из воплощений 40-52, содержащее домен VL с последовательностью SEQ ID NO:6.
53. Гуманизированное антитело, которое связывает человеческий NKG2A, антитело, содержащее домен VH, который включает аминокислотную последовательность SEQ ID NO:5 с дополнительными одной или более FR заменами в позиции 5, 69, 71, 73 и/или 75 по Кабату.
54. Гуманизированное антитело воплощения 53, где дополнительными FR заменами являются V5Q, M69L, T71V, Т73К, и/или T75S.
55. Гуманизированное антитело воплощения 52, содержащее также домен VL, который содержит аминокислотную последовательность SEQ ID NO:4 с дополнительными одной или более FR заменами в позициях 46 и/или 48 по Кабату.
56. Гуманизированное антитело воплощения 55, где дополнительными FR заменами являются L46F и/или I48V.
57. Гуманизированное антитело, которое связывает NKG2A, содержащее VH домен, который включает нечеловеческие CDR остатки, вставленные в человеческий домен VH, где домен VH по меньшей мере на 50% идентичен SEQ ID NO:5.
58. Гуманизированное антитело воплощения 46, где домен VH по меньшей мере на 90% идентичен SEQ ID NO:5.
59. Гуманизированное антитело любого из воплощений 57 и 58, содержащее CDR-H1, соответствующую остаткам 31-35 из SEQ ID NO:5, CDR-H2, соответствующую остаткам 50-66 из SEQ ID NO:5, и CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:5.
60. Гуманизированное антитело любого из воплощений 57-59, содержащее в VH домене V или Q в позиции 5 по Кабату, М или L в позиции 69 по Кабату, Т или V в позиции 71 по Кабату, Т или K в позиции 73 по Кабату, и Т или S в позиции 75 по Кабату.
61. Гуманизированное антитело любого из воплощений 57-60, содержащее домен VL, нечеловеческие CDR остатки, вставленные в человеческий домен VL, где домен VL по меньшей мере на 50% идентичен SEQ ID NO:4.
62. Гуманизированное антитело любого из воплощений 57-61, содержащее домен VL, по меньшей мере на 90% идентиченный SEQ ID NO:4.
63. Гуманизированное антитело любого из воплощений 57-62, содержащее последовательность CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:4, последовательность CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:4, и последовательность CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:4.
64. Гуманизированное антитело любого из воплощений 57-63, содержащее L или F в позиции 46 по Кабату и/или I или V в позиции 48 по Кабату.
65. Гуманизированное антитело, которое связывает человеческий NKG2A, антитело, содержащее домен VH, который содержит нечеловеческие CDR остатки, вставленные в человеческий домен VH, содержащий CDR-Н1, соответствующую остаткам 31-35 из SEQ ID NO:8, CDR-H2, соответствующую остаткам 50-66 из SEQ ID NO:8, CDR-H3, соответствующую остаткам 95-102 из SEQ ID NO:8, где аминокислоты в позициях 63, 64, 65, 66, и 67 по Кабату представляют собой F, K, D, K, А соответственно.
66. Гуманизированное антитело воплощения 65, где аминокислота в позиции 60 по Кабату представляет собой А.
67. Гуманизированное антитело любого из воплощений 65 и 66, где домен VH содержит аминокислотную последовательность SEQ ID NO:8.
68. Гуманизированное антитело любого из воплощений 65-67, также содержащее домен VL, содержащий CDR-L1, соответствующую остаткам 24-34 из SEQ ID NO:6, CDR-L2, соответствующую остаткам 50-56 из SEQ ID NO:6, и CDR-L3, соответствующую остаткам 89-97 из SEQ ID NO:6.
69. Гуманизированное антитело любого из воплощений 65-68, где домен VL содержит аминокислотную последовательность из SEQ ID NO:6.
70. Гуманизированная версия анти-NKG2A антитела, полученная с помощью Z270 гибридомы.
71. Антитело любого из воплощений 1-70, которое является мультиспецифичным антителом или фрагментом антитела.
72. Антитело воплощения 71, которое является фрагментом антитела, выбранным среди Fab, Fab', F(АВ)2, F(AB')2, F(АВ)3, Fv, одноцепоченым Fv, dsFv, Fd фрагментом, dAb фрагментом, мини-антителом, димерным, тримерным, четырехмерным антителом и каппа-антителом; верблюжьим IgG; IgNAR и мультиспецифичным фрагментом антитела.
73. Антитело воплощения 72, которое является биспецифическим антителом.
74. Антитело любого из воплощений 1-70, которое является антителом lgG4 полной длины или его фрагментом.
75. Антитело воплощения 74, где константный домен тяжелой цепи содержит мутацию S241P.
76. Изолированная нуклеиновая кислота, кодирующая антитело любого из предшествующих воплощений.
77. Вектор, содержащий нуклеиновую кислоту воплощения 76.
78. Принимающая клетка (клетка-хозяин), содержащая вектор воплощения 76.
79. Способ получения антитела, содержащий культивирование принимающей клетки воплощения 78 с целью экспрессии нуклеиновой кислоты и получения антител.
80. Способ воплощения 79, также содержащий выделение антитела из культуры принимающих клеток.
81. Способ воплощения 79, где до культивирования принимающая клетка котрансфецируется с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный тяжелый домен, и с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный легкий домен.
82. Иммуноконъюгат, содержащий антитело в соответствии с любым из воплощениий 1-75 и второй агент.
83. Иммуноконъюгат воплощения 82, где второй агент является цитотоксическим агентом.
84. Иммуноконъюгат воплощения 82, где второй агент является молекулой ПЭГ.
85. Фармацевтическая композиция, содержащая антитело любого из воплощений 1-75 или иммуноконъюгат любого из воплощений 82-84 и носитель.
86. Фармацевтическая композиция воплощения 74, содержащая буфер, выбранный среди цитрата, фосфата и их комбинации, с рН от примерно 6,0 до примерно 7,5.
87. Изделие, содержащее контейнер, содержащий антитело любого из воплощений 1-75, и инструкции с руководством пользователя для лечения нарушения, выбранного среди рака, вирусного заболевания, воспалительного нарушения, а также аутоиммунного нарушения, у млекопитающего с помощью антитела в эффективном количестве.
88. Изделие воплощения 87, где млекопитающее является человеком.
89. Антитело любого из осуществлений 1-75 для нейтрализации ингибиторной активности CD94/NKG2A рецептора, экспрессированного на поверхности цитотоксического лимфоцита у пациента, который является человеком.
90. Антитело любого из осуществлений 1-75 для уменьшения CD94/NKG2A-опосредованного ингибирования цитотоксической активности CD94/NKG2A-экспрессирующего цитотоксического лимфоцита у пациента, который является человеком.
91. Антитело любого из осуществлений 1-75 для потенциирования цитотоксической активности CD94/NKG2A-экспрессирующего цитотоксического лимфоцита у пациента, который является человеком.
92. Антитело любого из осуществлений 1-75 для индуцирования уничтожения Cw3-экспрессирующей целевой клетки CD94/NKG2A-экспрессирующим цитотоксическим лимфоцитом у пациента, который является человеком.
93. Антитело любого из осуществлений 89-92, где CD94/NKG2A-экспрессирующий цитотоксический лимфоцит представляет собой НК-клетку, НКТ-клетку, α/β Т-клетку или γ/δ Т-клетку.
94. Способ лечения пациента, который является человеком, страдающего нарушением, выбранным среди рака, вирусного заболевания, воспалительного нарушения, а также аутоиммунного нарушения, включающий введение фармацевтической композиции любого из осуществлений 85-86.
95. Применение антитела любого из осуществлений 1-75 в изготовлении лекарства для введения больному человеку, страдающему нарушением, выбранным среди рака, вирусного заболевания, воспалительного нарушения и аутоиммунного нарушения.
96. Антитело любого из осуществлений 1-75 для применения в лечении больного человека, страдающего нарушением, выбранным среди рака, вирусного заболевания, воспалительного нарушения, а также аутоиммунного нарушения.
97. Способ, применение или антитело любого из осуществлений 89-96, где пациент страдает от плоскоклеточной карциномы, лейкемии, острого лимфоцитарного лейкоза, острого лимфобластного лейкоза, В-клеточной лимфомы, Т-клеточной лимфома, лимфомы Ходжкина, неходжкинской лимфомы, волосатоклеточной лимфомы, лимфомы Беркитта, множественной миеломы, острого или хронического миелолейкоза, промиелоцитарного лейкоза, фибросаркомы, рабдомиосаркомы; меланомы, семиномы, тератокарциномы, нейробластомы, глиомы, астроцитомы, нейробластомы, глиомы, шванномы; фибросаркомы, рабдомиосаркомы, остеосаркомы, меланомы, пигментной ксеродермы, кератоксантомы, семиномы, фолликулярного рака щитовидной железы, тератокарциномы, другой карциномы мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, яичника, простаты, поджелудочной железы, желудка, шейки матки, щитовидной железы или кожи, других гемопоэтических опухолей лимфоидной линии, других гемопоэтических опухолей миелоидной линии, других опухолей мезенхимального происхождения, других опухолей центральной и периферической нервной системы или других опухолей мезенхимального происхождения.
98. Применение в соответствии с осуществлением 97, где пациент страдает от множественной миеломы, неходжкинской лимфомы или острого миелолейкоза.
Все ссылки, включая публикации, патентные заявки и патенты, приведенные в данном документе, настоящим включены путем ссылки в той же степени, как если бы каждая ссылка была отдельно и конкретно указана, и должны быть включены путем ссылки и изложены в целом здесь.
Все заголовки и подзаголовки используются здесь только для удобства и не должны быть истолкованы как ограничивающие изобретение ни в каком случае.
Любая комбинация описанных выше элементов во всех возможных их вариантах охватывается изобретением, если это явно не противоречит контексту или в документе прямо не утверждается иное.
Термин "или" в данном документе используется в широком смысле "и/или", и соответственно косвенно поддерживает воплощение или аспект, в котором этот термин следует толковать в исключительном смысле "или то, или другое", если это явно не противоречит контексту или в документе прямо не утверждается иное.
Все термины и обращения, которые используются в контексте описания изобретения, должны быть истолкованы как охватывающие и единственное, и множественное число, если это явно не противоречит контексту или в документе прямо не утверждается иное.
Перечисление диапазонов значений здесь предназначено просто для упрощения способа передачи индивидуально каждого отдельного значения, входящего в диапазон, если иное не утверждается в документе, и все отдельные значения включены в подробное описание, как если бы они были индивидуально перечислены в документе. Если в документе не утверждается иное, все точные значения, предложенные в документе, представлены соответствующими приближенными значениями (например, все точные типичные значения, предложенные по отношению к конкретному фактору или измерению, могут быть рассмотрены также как соответствующие приблизительные оценки, скорректированные добавлением "примерно" в случае необходимости).
Все способы, описанные здесь, могут быть выполнены в любом подходящем порядке, если это явно не противоречит контексту или в документе прямо не утверждается иное.
Любые использованные или все примеры или обороты (например, "такой как"), содержащиеся в данном документе, предназначены только для лучшего освещения изобретения и не ставят ограничений в сфере применения изобретения, если не утверждается иное. Никакие обороты в описании не должны толковаться как указывающие на то, что какой-либо элемент, не включенный в формулу изобретения, является необходимым для осуществления изобретения.
Цитирование и использование здесь патентных документов делается только для удобства и не отражает какой-либо связи с обоснованностью, патентоспособностью и/или законной силой этих патентных документов.
Описание здесь какого-либо аспекта или воплощения изобретения, использующее такие термины, как "содержащий", "имеющий" или "включающий" со ссылкой на элемент или элементы, предназначено для оказания поддержки аналогичному аспекту или воплощению изобретения, которое "состоит из", "состоит в основном из" или "по существу содержит" конкретный элемент или элементы, если это явно не противоречит контексту или не утверждается иное (например, композицию, описанную здесь как содержащую конкретный элемент, следует понимать как так же описанную композицию, состоящую из этого элемента, если это явно не противоречит контексту или не утверждается иное).
Это изобретение включает в себя все модификации и эквиваленты объектов изобретения, включенных в формулу изобретения в соответствии с разрешением действующего законодательства.