Результат интеллектуальной деятельности: Способ получения 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, а именно, к способу получения неописанного в литературе 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина (1), который может найти применение в качестве исходного соединения в синтезе органических солнечных ячеек с объемным гетеропереходом с повышенными значениями ширины запрещенной зоны, плотности тока короткого замыкания и коэффициентом заполнения, от которых напрямую зависит значение фотовольтаической эффективности солнечной ячейки -величины, которая характеризует производительность фотовольтаического устройства.
Фотовольтаический метод преобразования солнечной энергии в электрическую, по мнению лауреата Нобелевской премии по физике академика Ж.И. Алферова, является одним из наиболее эффективных. Одной из наиболее перспективных альтернатив кремниевых и других неорганических преобразователей солнечной энергии являются солнечные батареи на основе органических фотосенсибилизаторов. Существует несколько типов органических фотовольтаических структур, среди которых можно выделить ячейки с объемным гетеропереходом, когда фрагменты донора и акцептора находятся в одном фотоактивном слое и формируют трехмерные взаимопроникающие наноразмерные сети из доменов с дырочной и электронной проводимостью, а также ячейки слоистого типа, в которых фотоактивные компоненты образуют отдельные слои. Фотовольтаические структуры с объемным гетеропереходом, как правило, содержат в качестве донора полисопряженные гетероциклические соединения, а в качестве акцептора производные фуллерена. Для увеличения эффективности преобразования света необходимо получать красители как с высокой плотностью тока короткого замыкания для увеличения ширины спектра поглощения, так и с высоким напряжением холостого хода для уменьшения ширины запрещенной зоны. Поэтому сегодня в мире широко исследуются новые компоненты для органических фотоактивных материалов, которые будут удовлетворять этим требованиям. Одной из наиболее перспективных групп такого рода соединений являются структуры полициклического характера, содержащие электронодефицитные гетероциклы в своей структуре. В литературе описаны соединения на основе 2,1,3-бензотиадиазолов (В. А. D. Neto, А. А. М. Lapis, Е. N. da Silva  , J. Dupont, 2,1,3-Benzothiadiazole and Derivatives: Synthesis, Properties, Reactions, and Applications in Light Technology of Small Molecules. Eur. J. Org. Chem., 2013, 228; L. S. Konstantinova, E. A. Knyazeva, O. A. Rakitin, Recent Developments in the Synthesis and Applications of 1,2,5-Thia- and Selenadiazoles. A Review. Org. Prep. Proc. Int., 2014, 46, 475). Для этих соединений достигнуты значения эффективности преобразования солнечного света в электричество до 5.8%. Между тем, считается, что коммерциализация органических солнечных элементов возможна при значениях эффективности действия солнечного света не менее 10-15%. Недавними расчетами (D. Wang, X. Zhang, W. Ding, X. Zhao, Z. Geng, Density functional theory design and characterization of D-A-A type electron donors with narrow band gap for small-molecule organic solar cells. Comp. Theoret. Chem., 2014, 1029, 68) было показано, что солнечные элементы на основе [1,2,5]тиадиазоло[3,4-d]пиридазинов могут достигать высоких значений эффективности преобразования солнечного света в электричество. Этот гетероцикл является практически идеальным билдинг-блоком с точки зрения значений ширины запрещенной зоны, плотности тока короткого замыкания и коэффициентом заполнения, величин от которых напрямую зависит фотовольтаическая эффективность солнечной ячейки.
, J. Dupont, 2,1,3-Benzothiadiazole and Derivatives: Synthesis, Properties, Reactions, and Applications in Light Technology of Small Molecules. Eur. J. Org. Chem., 2013, 228; L. S. Konstantinova, E. A. Knyazeva, O. A. Rakitin, Recent Developments in the Synthesis and Applications of 1,2,5-Thia- and Selenadiazoles. A Review. Org. Prep. Proc. Int., 2014, 46, 475). Для этих соединений достигнуты значения эффективности преобразования солнечного света в электричество до 5.8%. Между тем, считается, что коммерциализация органических солнечных элементов возможна при значениях эффективности действия солнечного света не менее 10-15%. Недавними расчетами (D. Wang, X. Zhang, W. Ding, X. Zhao, Z. Geng, Density functional theory design and characterization of D-A-A type electron donors with narrow band gap for small-molecule organic solar cells. Comp. Theoret. Chem., 2014, 1029, 68) было показано, что солнечные элементы на основе [1,2,5]тиадиазоло[3,4-d]пиридазинов могут достигать высоких значений эффективности преобразования солнечного света в электричество. Этот гетероцикл является практически идеальным билдинг-блоком с точки зрения значений ширины запрещенной зоны, плотности тока короткого замыкания и коэффициентом заполнения, величин от которых напрямую зависит фотовольтаическая эффективность солнечной ячейки.
Известен способ получения 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона (2) (I. Sekikawa, Oxidation of 5-Methyl-2,1,3-benzothiadiazole with Potassium Permanganate. Bull. Chem. Soc. Japan, 1960, 33, 1229). Известное соединение 2 является наиболее близким по структуре предлагаемому 1 и по способу получения. 5,6-Дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-дион получают путем нагревания 1,2,5-тиадиазол-3,4-дикарбогидразида в разбавленной соляной кислоте в течение 8 часов при 75°C с выходом 48%. В свою очередь 1,2,5-тиадиазол-3,4-дикарбогидразид, который не является коммерчески доступным реагентом, получают пятистадийным синтезом из коммерчески доступных диметилового эфира ацетилендикарбоновой кислоты и дихлорида дисеры. Всего общий способ получения 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона 2 включает 6 стадий и заключается в обработке дихлорида дисеры хлором в четыреххлористом углероде с образованием дихлорида серы с выходом 100%, с последующей обработкой дихлорида серы газообразным аммиаком с образованием тетранитрида тетрасеры с 14%-ным выходом (М. Villena-Blanco, W. L. Jolly, Tetrasulfur tetranitride, S4N4. Inorganic syntheses, 1967, Volume IX, 98), с последующей реакцией тетранитрида тетрасеры с хлористым тионилом с образованием тритиазил трихлорида с 95%-ным выходом (G. G. Alange, А. J. Banister, В. Bell, Reactions of Tetrasulphur Tetranitride with Halides. Part III. Two New Methods of Preparing Trichlorocyclotrithiazene. J. Chem. Soc., Dalton Trans., 1972, 2399), с последующей реакцией с диметиловым эфиром ацетилендикарбоновой кислоты с образованием диметилового эфира 1,2,5-тиадиазол-3,4-дикарбоновой кислоты с 84%-ным выходом (X.-G. Duan, X.-L. Duan, С.W. Rees, T.-Y. Yue, Reaction of trithiazyl trichloride with alkenes and alkynes. J. Chem. Soc., Perkin Trans. 1, 1997, 2597), с последующей реакцией с гидразин гидратом в изопропаноле с образованием 1,2,5-тиадиазол-3,4-дикарбогидразида с 94%-ным выходом (S. Mataka, K. Takahashi, Y. Yamada, М. Tashiro, Sulfur nitride in organic chemistry. 6. Preparation of 3,4-disubstituted 1,2,5-thiadiazoles by the reaction of sulfur nitride with acetylenes. J. Heterocycl. Chem., 1979, 16, 1009). Недостатками известного процесса являются общий низкий выход продукта 2 5% в расчете на коммерчески доступный дихлорид дисеры, необходимость использования в процессе шести стадий, применение взрывоопасного соединения тетранитрида тетрасеры и высокотоксичного и неудобного в обращении хлора. Кроме этого, соединение 2 не представляет интерес в качестве непосредственного исходного субстрата для получения фотовольтаических структур, так как не содержит в своей молекуле активных атомов брома, способных замещаться на фрагменты, влияющие на фотовольтаическую эффективность.
Технической задачей настоящего изобретения является создание ранее неизвестного 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина (1) - потенциального полупродукта для получения фотовольтаических структур, а также разработка безопасного способа его получения с улучшенным выходом промежуточного продукта 2.
Поставленная техническая задача достигается предлагаемым способом получения 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина (1), заключающимся в том, что диаминомалетонитрил подвергают взаимодействию с тионилхлоридом в ацетонитриле в присутствии пиридина при пониженной температуре и полученный при этом 1,2,5-тиадиазол-3,4-дикарбонитрил подвергают кипячению в разбавленной соляной кислоте, с последующей обработкой полученной при этом 1,2,5-тиадиазол-3,4-дикарбоновой кислоты метанолом в присутствии хлористого тионила с образованием диметилового эфира 1,2,5-тиадиазол-3,4-дикарбоновой кислоты и взаимодействием его с гидразин-гидратом в изопропаноле и образующийся при этом 1,2,5-тиадиазол-3,4-дикарбогидразид подвергают нагреванию в разбавленной соляной кислоте с образованием 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона с последующей обработкой его смесью трехбромистого фосфора и брома либо оксобромидом фосфора в среде диметилформамида при температуре от 0 до 105°C. Процесс протекает по следующей схеме:
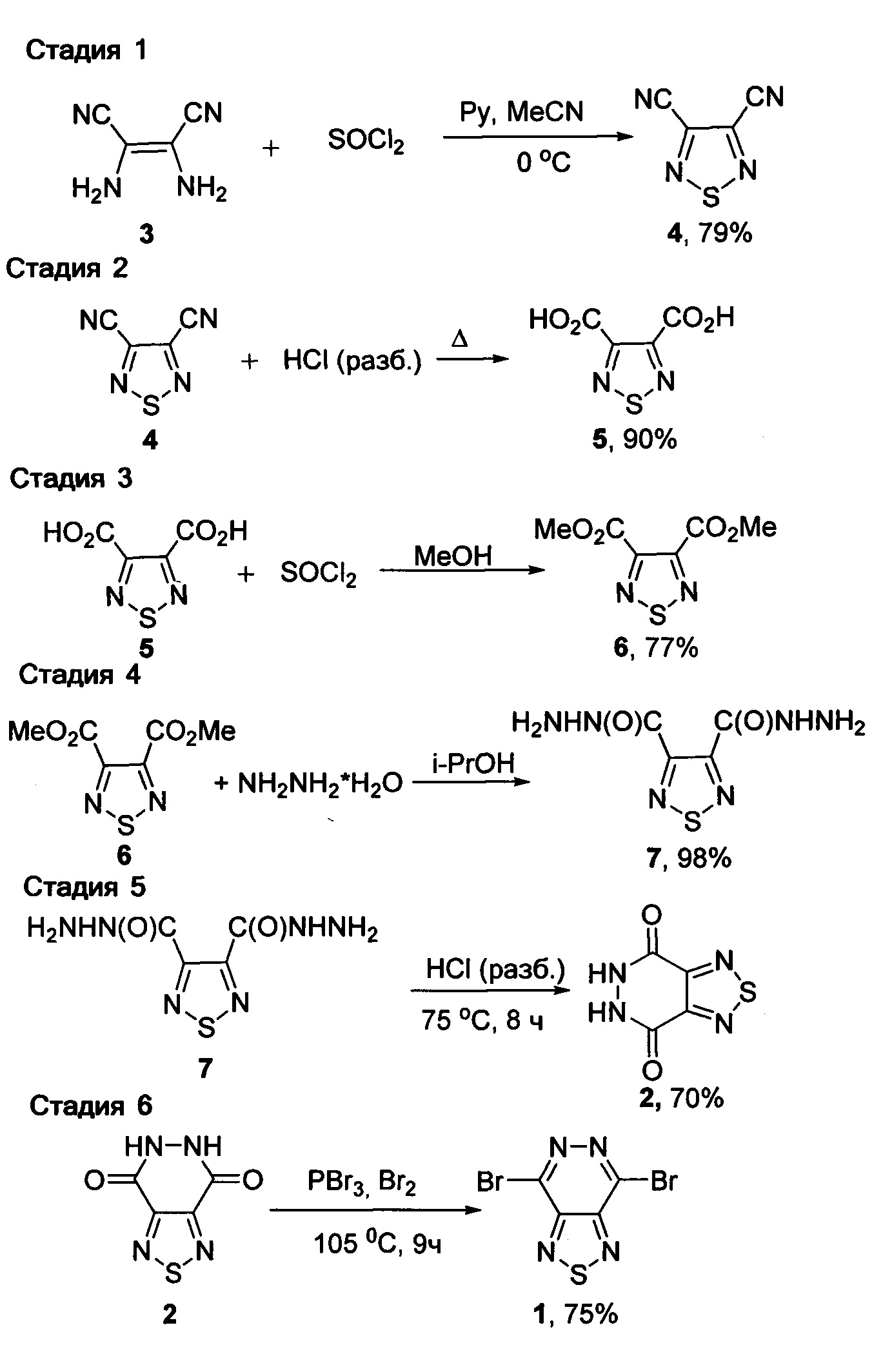
4,7-Дибром[1,2,5]тиадиазоло[3,4-d]пиридазин 1 получают в несколько стадий из коммерчески доступного диаминомалетонитрила и тионилхлорида. На первой стадии диаминомалетонитрил 3 обрабатывают тионилхлоридом в ацетонитриле в присутствии пиридина с образованием 1,2,5-тиадиазол-3,4-дикарбонитрила 4 с выходом 79%, с последующим кипячением 1,2,5-тиадиазол-3,4-дикарбонитрила 4 в разбавленной соляной кислоте в течение 24 часов с образованием 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 5 с 90%-ным выходом, с последующей этерификацией 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 5 метанолом в присутствии хлористого тионила с образованием диметилового эфира 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 6 с 77%-ным выходом, с последующей реакцией с гидразин-гидратом в изопропаноле с образованием 1,2,5-тиадиазол-3,4-дикарбогидразида 7 с 98%-ным выходом, с последующим нагреванием в разбавленной соляной кислоте в течение 8 часов с образованием 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона 2 с 70%-ным выходом с последующей обработкой 2 смесью трехбромистого фосфора и брома либо оксобромидом фосфора в среде диметилформамида при температуре от 0 до 105°C в течении 9-10 часов и выделением целевого продукта с выходом 75% методом хроматографии на силикагеле.
Общий выход продукта 1 составляет 11-28% в расчете на коммерчески доступный диаминомалеонитрил (3). При этом общий выход известного промежуточного продукта 2 составляет 37% в расчете на коммерчески доступный диаминомалеонитрил (3), что почти в семь с половиной раз выше в сравнении с известным способом (с 5% до 37%). Техническим результатом предлагаемого изобретения является разработка способа получения нового, неописанного в литературе, 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина с использованием коммерчески доступного и дешевого исходного диаминомалетонитрила вместо диметилового эфира ацетилендикарбоновой кислоты и малодоступного дисеры дихлорида, что позволило сократить количество стадий получения промежуточного продукта 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона 2 с шести до пяти и увеличить общий выход его почти в семь с половиной раз с 5% до 37% и повысить безопасность процесса в целом путем исключения из процесса взрывоопасного тетранитрида тетрасеры и высокотоксичного и неудобного в обращении хлора.
4,7-Дибром[1,2,5]тиадиазоло[3,4-d]пиридазин (1) может представить интерес в качестве непосредственного исходного соединения для получения компонентов солнечных ячеек с улучшенными значениями ширины запрещенной зоны, плотности тока короткого замыкания, и коэффициентом заполнения и, в конечном счете, фотовольтаической эффективности солнечной ячейки, так как содержит в своей молекуле одновременно как [1,2,5]тиадиазоло[3,4-d]пиридазиновый фрагмент, отвечающий за высокие фотовольтаические характеристики, так и высоко реакционноспособные атомы брома, которые позволяют вводить в молекулу заместители, влияющие на фотовольтаическую эффективность.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение 4.7-дибром[1,2,5]тиадиазоло[3<4-d]пиридазина.
А. Синтез 1,2,5-тиадиазол-3,4-дикарбонитрила 4.
К диаминомалетонитрилу 3 (1000 мг, 9.26 ммоль) в 10 мл ацетонитрила и 2.2 мл пиридина при перемешивании при 0°C добавляли по каплям раствор (1210 мг, 10.18 ммоль) тионилхлорида в 3 мл ацетонитрила, следя за тем, чтобы температура реакционной среды не превышала 5°C. После прибавления всего тионилхлорида температуру реакционной среды довели до 25°C и перемешивали еще 3 часа. Затем растворитель отогнали при пониженном давлении при 35-40°C на роторном испарителе. Полученное темное масло растворили в 25 мл хлористого метилена и хорошо промыли (3×20 мл) 1.5 N раствором соляной кислоты, затем раствором соли, органический слой сушили над сульфатом магния. Растворитель упарили при пониженном давлении, получив 1000 мг (79%) 1,2,5-тиадиазол-3,4-дикарбонитрила 4 в виде желтых кристаллов.
Б. Синтез 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 5.
К 1,2,5-тиадиазол-3,4-дикарбонитрилу 4 (2500 мг, 18.38 ммоль) добавили 27 мл 6N соляной кислоты. Смесь кипятили в течении 24 часов. После охлаждения до комнатной температуры осадок отфильтровали, а водный слой экстрагировали горячим этилацетатом (5×30 мл). Органический слой сушили над сульфатом магния. Отфильтрованный осадок осушили при пониженном давлении. Растворитель упарили при пониженном давлении. В результате получили белое твердое вещество, которое объединили с отфильтрованным осадком.
Выход 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 5 составил 2878 мг (90%).
В. Синтез диметилового эфира 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 6.
К 1,2,5-тиадиазол-3,4-дикарбоновой кислоте 5 (2000 мг, 11.49 ммоль) в 20 мл метанола добавили при 0°C по каплям хлористый тионил (732 мг, 6.15 ммоль). Реакционную смесь кипятили при перемешивании в течение 4 часов. После завершения кипячения реакционную смесь охладили до комнатной температуры. Растворитель упарили при пониженном давлении. Остаток растворили в 40 мл хлористого метилена, промыли водой (5×30 мл), органический слой сушили над сульфатом магния. Растворитель упарили при пониженном давлении. В результате был получен чистый диметиловый эфир 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 6 в виде бесцветного масла 1800 мл (77%).
Г. Синтез 1,2,5-тиадиазол-3,4-дикарбогидразида 7.
К диметиловому эфиру 1,2,5-тиадиазол-3,4-дикарбоновой кислоты 12 (1207 мг, 5.97 ммоль) в 20 мл изопропилового спирта добавили по каплям при комнатной температуре 1.42 мл гидразин гидрата. Смесь перемешивали в течение 9 часов при комнатной температуре. Образовавшийся осадок отфильтровали, высушили на воздухе. В результате получили 1,2,5-тиадиазол-3,4-дикарбогидразид 7 1189 мг (98%) в виде оранжевого твердого вещества.
Д. Синтез 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона 2.
К раствору 3.3 мл концентрированной соляной кислоты в 110 мл воды добавляли небольшими порциями 1,2,5-тиадиазол-3,4-дикарбогидразид 9 (2200 мг, 10.89 ммоль). После растворения всего 1,2,5-тиадиазол-3,4-дикарбогидразида 7, смесь перемешивали при кипячении в течение 8 часов. После завершения кипячения реакционную смесь охладили до комнатной температуры, осадок отфильтровали, высушили под вакуумом. В результате был получен 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-дион 2 1300 мг (70%) в виде белых кристаллов.
Е. Синтез 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина 1.
5,4-Дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-дион 2 (650 мг, 3.82 ммоль) добавляли к смеси трехбромистого фосфора (2.16 мл, 22.92 ммоль) и брома (1.18 мл, 22.92 ммоль) при 0°C. Реакционную смесь перемешивали в течение 9 ч при 105°C. Затем смесь охлаждали до комнатной температуры, выливали на лед, промывали четыреххлористым углеродом, экстрагировали хлороформом (3×40 мл) и сушили над сульфатом магния. Хлороформ упарили при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент - хлористый метилен). Выход 845 мг (75%), желтое твердое вещество. Т. пл.=199-200°C. (Rf=0.5, CH2Cl2). Найдено (%): С, 16.37; N, 19.05. C4Br2N4S. Вычислено (295.94): С, 16.23; N, 18.93. ИК-спектр νmax (KBr, cm-1): 1369, 1361, 1343, 1257, 959, 863, 504. Спектр ЯМР 13С (75 МГц, CDCl3): δ 142.5, 149.6. Масс-спектр высокого разрешения (ESI-TOF), m/z: вычислено для C481Br2HN4S [М+Н]+, 296.8262, найдено, 296.8269. Масс-спектр, m/z (%): 298 ([М+2]+, 22), 296 (М+, 49), 294 ([М-2]+, 28), 217 (27), 215 (28), 136 (52), 84 (67), 32(100)
Пример 2. Получение 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина.
Аналогично примеру 1 получают 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазин, но 5,4-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-дион 2 (500 мг, 2.9 ммоль) обрабатывают оксобромидом фосфора (1.18 мл, 22,92 ммоль) в диметилформамиде (40 мл) при 0°C. Реакционную смесь перемешивали в течение 6 ч при 80°C. Затем смесь охлаждали до комнатной температуры, выливали на лед, экстрагировали хлороформом (3×40 мл) и сушили над сульфатом магния. Хлороформ упарили при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент - хлористый метилен). Выход 256 мг (30%), желтое твердое вещество.
Способ получения 4,7-дибром[1,2,5]тиадиазоло[3,4-d]пиридазина, заключающийся в том, что диаминомалетонитрил подвергают взаимодействию с тионилхлоридом в ацетонитриле в присутствии пиридина при пониженной температуре и полученный при этом 1,2,5-тиадиазол-3,4-дикарбонитрил подвергают кипячению в разбавленной соляной кислоте, с последующей обработкой полученной при этом 1,2,5-тиадиазол-3,4-дикарбоновой кислоты метанолом в присутствии хлористого тионила с образованием диметилового эфира 1,2,5-тиадиазол-3,4-дикарбоновой кислоты и взаимодействием его с гидразин-гидратом в изопропаноле и образующийся при этом 1,2,5-тиадиазол-3,4-дикарбогидразид подвергают нагреванию в разбавленной соляной кислоте с образованием 5,6-дигидро[1,2,5]тиадиазоло[3,4-d]пиридазин-4,7-диона с последующей обработкой его смесью трехбромистого фосфора и брома либо оксобромидом фосфора в среде диметилформамида при температуре от 0 до 105°С.
