Результат интеллектуальной деятельности: Способ подбора условий для криоконсервации биологических объектов в вязких средах с использованием гидратообразующих газов и устройство для его осуществления
Вид РИД
Изобретение
Область техники
Изобретение предназначено для реализации процесса криоконсервации при пониженной концентрации криопротектора в вязких средах, что может быть применено для криосохранения клеток, тканей и органов.
Уровень техники
Для криоконсервации биообъектов используют методы витрификации (стеклования), сущность которых сводится к насыщению растворов специальными веществами, криопротекторами, которые увеличивают вязкость среды, - это и способствует реализации процесса витрификации.
Известна заявка РФ №2012103059/10 «СПОСОБ ВИТРИФИКАЦИИ ЯИЧНИКОВОЙ ТКАНИ», заявители: Грязнов Алексей Юрьевич [RU], Мотовилова Наталия Олеговна [RU]. Способ витрификации яичниковой ткани, включает поэтапное насыщение препарата проникающими криопротекторами, входящими в композицию, состоящую из: диметилсульфоксида - 19,52%, ацетамида - 14,75%, этиленгликоля - 15,51%, полиэтиленгликоля с молекулярной массой 4 кДа - 4%, яичного лецитина - 4%, поливинилового спирта с молекулярной массой 6 кДа - 1%, тетраполиглицерина - 1%, кардиоплегического раствора - остальное.
Известен патент США № US 7157222 «Method of cryopreservation of tissues by vitrification», заявитель: фирма ORGAN RECOVERY SYSTEMS INC [US]. Описанный способ витрификации ткани или органа включает погружение ткани или органа в раствор с повышенной концентрацией криопротектора, при температурах выше -15°С. Охлаждение ткани или органа проводят со скоростью 2.5-100°С/мин до температуры -80°С, затем со скоростью 30°С/мин - до температуры стеклования.
Известна международная заявка № WO 9745010 «LOADING AND UNLOADING OF PERMEATING PROTECTANTS FOR CELL, TISSUE, AND ORGAN CRYOPRESERVATION BY VITRIFICATION», заявители: UNIVERSAL PRESERVATION TECHNOLOGY, BRONSHTEIN VICTOR [US].
Настоящее изобретение относится к методам криоконсервации биологического образца и включает в себя постепенную или ступенчатую загрузку образца в серию растворов, содержащих криопротектор. В изобретении рассматривается использование дополнительного реагента, ограничивающего проникновение криопротектора в клетку. Способ также включает в себя постепенную или ступенчатую отмывку образца серией растворов с понижением концентрации криопротектора и агента, препятствующего проникновению в клетку. Максимальные концентрации криопротектора, применяемые в способе, определяются с помощью оценки уровня токсического эффекта криопротектора при температурах от 0 до 20°С.
Особый интерес в области витрификации биологических объектов представляют разработки двух авторов изобретений FAHY GREGORY [US] и WOWK BRIAN [US].
Авторы изобретений FAHY GREGORY и WOWK BRIAN запатентовали технические решения по составу криопротекторов и предотвращению образования кристаллов льда в следующих патентах: патент США № US 6395467 «Cryoprotectant solution containing dimethyl sulfoxide, an amide and ethylene glycol», патент США № US 6869757 «Advantageous carrier solution for vitrifiable concentrations of cryoprotectants, and compatible cryoprotectant mixtures», патент США № US 7741018 «Advantageous carrier solution for vitrifiable concentration of cryoprotectants, and compatible cryoprotectant mixtures».
Объединяющим началом в этих патентах и других патентах, связанных с методом витрификации, является использование высоких концентраций криопротекторов с целью достижения вязкости, необходимой для реализации процессов стеклования в биологическом объекте. Так средняя суммарная концентрация, рассчитанная на основе 4 перспективных витрифицирующих растворов, приведенных в обзоре FAHY 2015 года (Fahy G.M., Wowk В. Principles of Cryopreservation by Vitrification // Methods Molecular Biology: Cryopreservation and Freeze- Drying Protocols. Wolkers W.F. & Oldenhof H. (eds), Humana Press, UK. 2015, P. 305-320) составляет 8,77 M (растворы VS41A 8,41M; Veg 8,91M; VM3 8,41M; M22 9,345M). Насыщение биологических объектов такими концентрациями криопротекторов сопряжено с тяжелым токсическим эффектом, что и ограничивает набор мишеней, которые стало возможным криоконсервировать в настоящее время методом витрификации. Актуальным является поиск способов достижения вязкости, необходимой для стеклования, в условиях пониженных концентраций криопротекторов за счет иных воздействий.
В статье Артюхова и соавторов (Artyukhov V.I., Pulver A.Y., Peregudov А., Artyuhov I. Can xenon in water inhibit ice growth? Molecular dynamics of phase transitions in water-Xe system. // J Chem Phys. 2014, V. 141(3), P. 034503) на основе метода математического моделирования было сделано предположение, что увеличить вязкость водного раствора можно путем насыщения его гидратообразующим газом ксеноном, причем вязкость предположительно увеличивается за счет явления гидрофобной гидратации, когда молекулы воды группируются вокруг молекулы ксенона. Имеется ряд патентов, в которых гидратообразующие газы используют для криоконсервации.
Известен патент РФ №2433173 «СПОСОБ КРИОКОНСЕРВАЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК», заявители: Макеев Олег Германович, Понамарев Александр Игоревич, Короткое Артем Владимирович. Способ криоконсервации мультипотентных мезенхимальных стромальных клеток (ММСК) включает подготовку смеси культуры в культуральной среде, смешивание культуры клеток в культуральной среде с криопротектором, ступенчатое контролируемое охлаждение и замораживание смеси культуральной среды с криопротектором до температуры хранения и последующее хранение замороженной смеси при низких температурах. При этом в качестве криопротектора для насыщения смеси используют газ ксенон, вводимый до насыщения в подготовленную смесь клеточной культуры ММСК в среде DMEM, находящуюся в открытых криопробирках путем продувания культуральной среды ксеноном при 0°C с дальнейшим охлаждением и образованием первичного монолита культуральной среды с криопротектором, направляемым затем на замораживание до температуры хранения. Изобретение обеспечивает сохранность клеток при криоконсервации.
Известен патент РФ №2268590 «СПОСОБ КРИОКОНСЕРВАЦИИ ОРГАНОВ И ТКАНЕЙ IN SITU», заявитель: Государственное образовательное учреждение высшего профессионального образования Московская медицинская академия им. И.М. Сеченова. Способ криоконсервации органов и тканей in situ заключается в том, что биологический объект (сердце, почка и др.) охлаждают в воде до 0°C с одновременным насыщением смесью ксенона, криптона, аргона в соотношении 2,5:47,5:50 об. %, затем вытесняют воду указанной смесью газов и при давлении 1,5 атм понижают температуру до -43°С, далее снижают давление газовой среды до нормального и продолжают охлаждение до -196°С. Способ описывает криоконсервацию сердца животного в составе всего организма (in situ). У пересаженного трансплантата, консервированного в течение шести часов от времени холодовой кардиоплегии, удалось добиться восстановления сокращений сердца.
Известен патент РФ № RU 2543534 «СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ЛЕЙКОЦИТОВ С КСЕНОНОМ», заявители: Федеральное государственное бюджетное учреждение науки Институт физиологии Коми научного центра Уральского отделения Российской академии наук, Федеральное государственное бюджетное учреждение науки "Кировский научно-исследовательский институт гематологии и переливания крови Федерального медико-биологического агентства". Способ включает насыщение клеток в контейнере «Компопласт 300», помещенном в металлический криобароконтейнер, инертным газом ксеноном под давлением 0,6 атм в течение 20 мин в условиях комнатной температуры 21±2°C с последующим удалением избытка газа и извлечением из металлического контейнера, замораживанием биообъекта до -28°С в этиловом спирте и перемещением в электроморозильник на -80°С. Размораживание биообъекта осуществляется в водяной ванне 39±1,5°С в течение 1,5 мин. Осуществление изобретения обеспечивает криоконсервирование лейкоцитов в среде инертного газа и высокий уровень количественной и морфологической сохранности лейкоцитных концентратов крови человека.
Известен патент США № US 8124329 «HYPOTHERMIC PRESERVATION OF BIOLOGICAL TISSUES AND CELLS», заявитель: IBPT CORP. В изобретении описан способ сохранения биологической ткани за счет образования клатратов ксенона или гексафторида серы. Способ включает повышение давления в биологической ткани газовой смесью, которая будет образовывать клатраты внутри биологической ткани в широком интервале температур (от гипотермических +1°С до +5°С до криогенных -196°С). Способ включает стадию охлаждения биоткани до нужной температуры хранения.
В изобретении иссеченное сердце мыши в небольшом количестве физиологического раствора Кребса-Хенселита помещали в металлическую барокамеру, насыщали смесью ксенона и кислорода (9:1) под давлением около 7 атм (100 psi), охлаждали в парах азота 15 мин, затем погружали в жидкий азот. Классических криопротекторов не использовали. В жидком азоте камера оставалась в течение 15 мин, после чего ее разогревали при комнатной температуре и исследовали состояние тканей визуально и с помощью электронной микроскопии. Сохранность тканей, замороженных под давлением ксенона, оценивали выше по сравнению с тканями, замороженными аналогичным образом без ксенона. В митохондриях опытных образцов отсутствовали вздутия, разрывы внутренней и наружной мембран и утечки внутреннего матрикса, в то время как в контрольных образцах перечисленные повреждения наличествовали. Авторы делают вывод о том, что ксенон способен защищать внутренние структуры клеток в процессе замораживания.
Однако, в перечисленных патентах замораживание биообъекта достигается не путем стеклования, а с образованием кристаллов льда по принципу классического медленного программного замораживания, где ключевым параметром является оптимальная для конкретного биологического объекта скорость замораживания, либо с образованием вместо кристаллов льда кристаллов газовых гидратов. При этом криопротекторы либо вообще не используются, либо используются в небольших концентрациях не более 10% (≈1 М). Также не рассматривается вопрос повреждения клеток кристаллами газовых гидратов, которое может быть не менее травмоопасно, чем образование кристаллов льда.
В настоящем патенте рассматривается сочетанное использование верифицирующих растворов и гидратообразующего инертного газа для достижения вязкости, необходимой для стеклования. При этом инертный газ используется для снижения суммарной концентрации криопротекторов в витрифицирующем растворе. Ключевым элементом, на основе которого осуществляется подбор условий, является определение вязкости среды, реализуемое в условиях повышенного давления газа (1-500 атм) и температур (от +20°С до криогенных) с помощью оригинального устройства. Принцип измерения вязкости основан на методе динамического светорассеяния.
Известен патент США US 4571081 (Ford N. Light scattering apparatus and method), в котором поверхностное натяжение и вязкость жидкости определяют с помощью измерения рассеяния света. К недостатку можно отнести измерение вязкости при отсутствии высокого давления.
В работе Uchida Т. et al. (Viscosity of Aqueous СО2 Solutions Measured by Dynamic Light Scattering. // J. Chem. Eng. Data, v. 48, p. 1225-1229 (2003), метод измерения динамического светорассеяния (DLS) был опробован для измерения вязкости воды, насыщенной углекислым газом. К недостаткам установки, описанной в данной работе можно отнести то, что измерения проводят в узком диапазоне температур (от +2 до +11 градусов), узком диапазоне давлений (до 5 атмосфер) и с использованием одного газа - СО2.
Задачей настоящего изобретения является создание нового способа подбора условий для криоконсервации биологических объектов в вязких средах с использованием гидратообразующих газов и устройства для реализации способа позволяющего осуществлять подбор подбора условий для криоконсервации в широком диапазоне температур, давлений и значений вязкости криопротекторов.
Сущность изобретения
Одним из аспектов изобретения является способ подбора параметров криопротекторов для криоконсервации биологических образцов, который включает измерение зависимости вязкости растворов с использованием определения динамического рассеяния света наночастиц в ячейке в выбранном диапазоне температур. На первом этапе измеряют зависимость вязкости контрольного раствора, содержащего выбранный криопротектор или композиции криопротекторов и наночастицы в диапазоне температур от +20 до целевой температуры, выбранной в интервале от -10°С до -130°С, с помощью измерения динамического рассеяния света в ячейке, при этом концентрацию криопротектора или композиции криопротекторов выбирают достаточной для криоконсервации путем стеклования. На втором этапе проводят подготовку раствора криопротектора или композиции криопротекторов с наночастицами с пониженной концентрацией криопротектора (криопротекторов) на 5-45% относительно первого этапа, размещают раствор в измерительной ячейке, в которой создают внутреннее давление путем подачи в нее выбранного инертного газа в диапазоне от 1 до 500 атм и проводят измерение зависимости вязкости раствора с криопротектором или композиции криопротекторов и наночастицами в диапазоне температур от +20 до целевой температуры. На третьем этапе осуществляют сравнение данных по вязкости измерений первого и второго этапов. При этом при достижении показателя вязкости раствора с пониженной концентрацией криопротектора или композиции криопротекторов значения полученного при измерении вязкости контрольного раствора, проводят дополнительное измерение динамического рассеяния света в ячейке без применения наночастиц, используя при этом параметры концентрации криопротектора и давление газа применяемые на втором этапе. По данным измерения размеров образуемых кристаллогидратов и принимают решение о снижении или повышении концентрации криопротектора (криопротекторов) по пороговому размеру кристаллов.
Другим аспектом способа является то, что для создания давления от 1 до 500 атм в ячейке используют инертный газ, который выбирают из группы гидратообразующих газов, включающей в себя ксенон, криптон, аргон, гексафторид серы, азот и др., а также их комбинации. При этом анализируют вязкость раствора криопротектора или композиции криопротекторов предпочтительно при давлении ксенона от 2 до 12 атм, или давлении криптона от 30 до 80 атм, или давлений аргона от 100 до 500 атм.
Другим аспектом способа является то, что на первом и втором этапах измерений исследуемый объем с раствором криопротектора или композиции криопротекторов содержит не более 2% суспензии наночастиц, радиус которых составляет от 50 до 500 нм.
Следующий аспект изобретения состоит в том, что скорость охлаждения измерительной ячейки выбирают не менее 1°С/мин.
В другом варианте осуществления изобретения рассматривается устройство для реализации способа подбора параметров криопротекторов или композиции криопротекторов для криоконсервации биологических объектов. Устройство содержит ячейку с возможностью ввода в измерительный объем жидкости, наночастиц и газа, систему управления температурой ячейки, систему измерения динамического светорассеяния содержащей источник облучения и детектор, а также систему обработки данных. При этом система управления температурой ячейки в диапазоне от +20 до целевой температуры включает рубашку для охлаждения измерительной ячейки, емкость с жидким азотом, нагреватель, блок управления нагревателем. Выход блока управления нагревателем подключен к нагревателю, который установлен в емкости с жидким азотом, через газовый выход испаряемый азот поступает через термоизолированный канал в объем рубашки, в которой установлена измерительная ячейка. В режиме измерения вязкости раствора криопротектора или композиции криопротекторов исследуемый объем содержит не более 2% суспензии наночастиц с радиусом от 50 до 500 нм. Ввод газа в ячейку осуществляют через редуктор в диапазоне давлений от 1 до 500 атмосфер. При измерении вязкости и размеров частиц газогидратов угол установки детектора по отношению к направлению распространения лазерного луча в системе измерения динамического светорассеяния составляет от 10 до 140 градусов.
Следующим аспектом изобретения является то, что в качестве детектора светорассеяния используют лавинный фотодиод, а в качестве источника облучения в составе системы измерения динамического светорассеяния используют лазер с длиной волны облучения от 400 до 650 нм и мощностью источника облучения от 10 до 100 мВт.
Другим аспектом изобретения является то, что угол установки лавинного фотодиода составляет 135 градусов по отношению к направлению лазерного луча. При этом данные от детектора светорассеяния поступают на систему обработки данных, которая содержит усилитель, преобразователь и компьютер.
Перечень чертежей
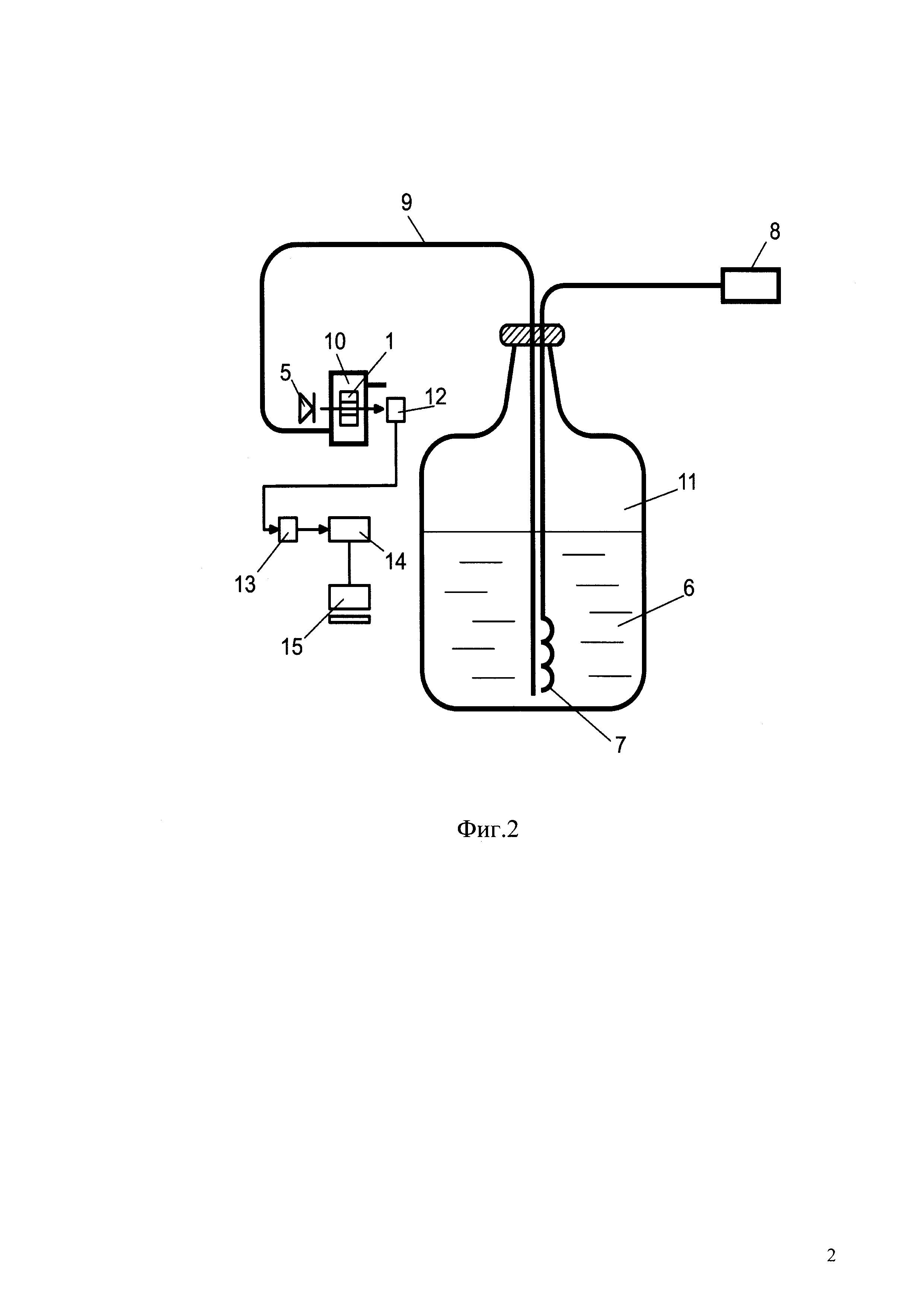
Фиг. 1. Эскиз кюветы-барокамеры для измерения вязкости среды методом динамического светорассеяния под давлением и с контролем температуры.
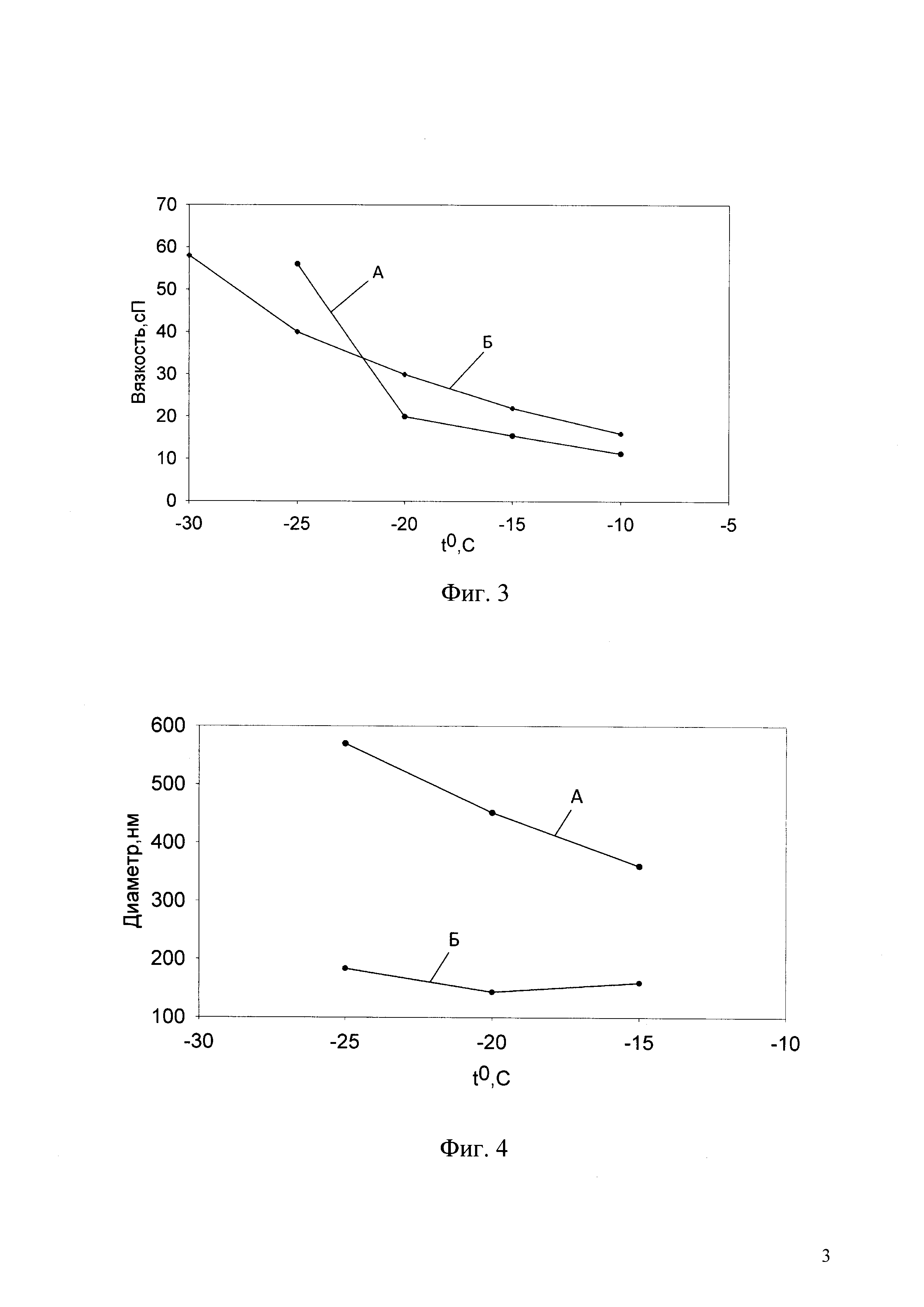
Фиг. 2. Система охлаждения кюветы-барокамеры.
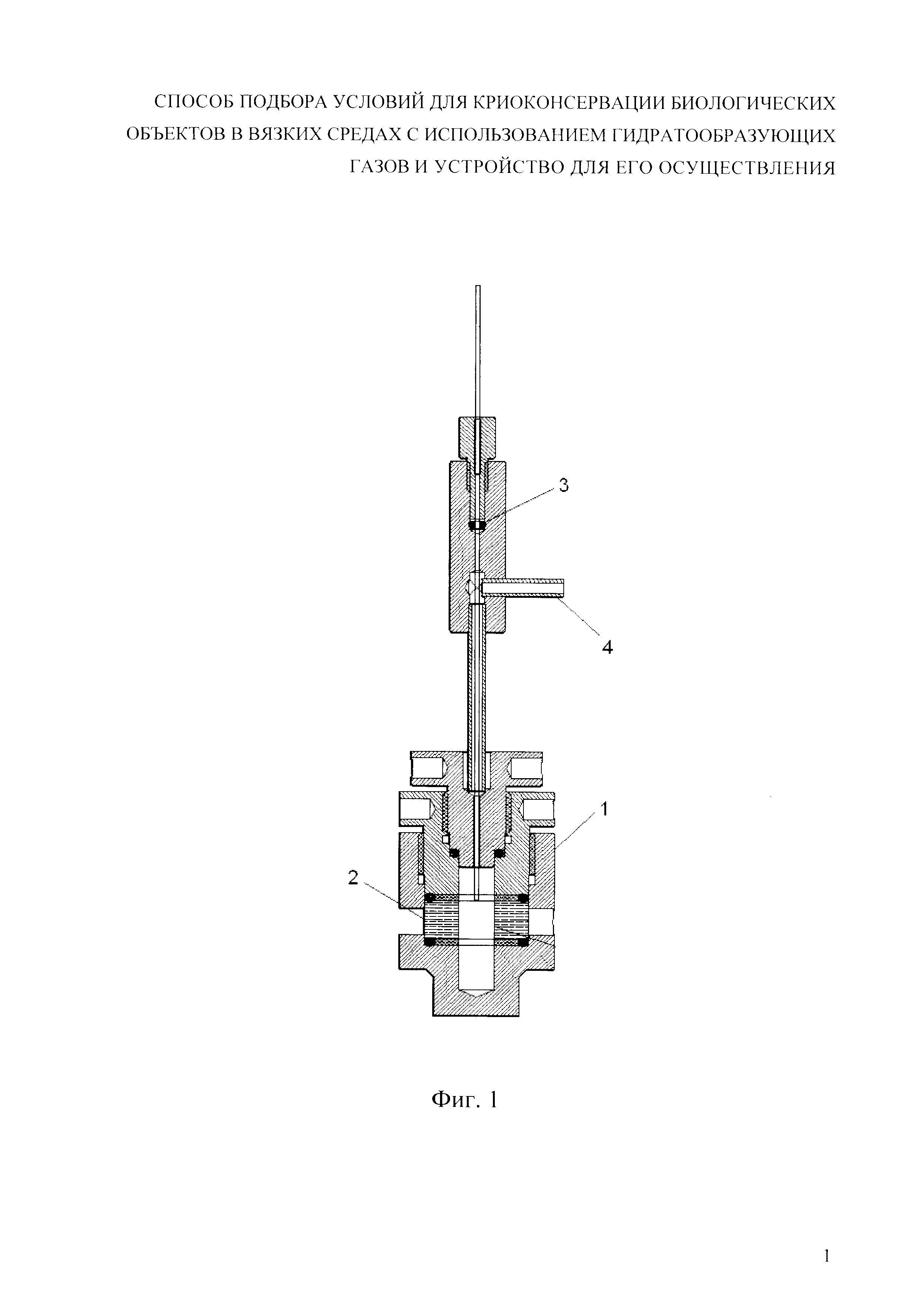
Фиг. 3. Температурная зависимость вязкости растворов этиленгликоля: А - раствор 48 w/w% этиленгликоля, охлаждаемый под давлением ксенона 8 атм; Б - контрольный раствор этиленгликоля (55 w/w%), охлаждаемый без давления.
Фиг. 4. Размеры кристаллов газогидрата ксенона, образующихся в растворах этиленгликоля при охлаждении под давлением ксенона 8 атм: А - раствор 35 w/w% этиленгликоля; Б - раствор 48 w/w% этиленгликоля.
Описание изобретения
В процессе изучения свойств верифицирующих криопротекторов и способов криоконсервации было показано, что в процессе криоконсервации под давлением гидратообразующих газов раствор криопротектора насыщается газами, и при снижении температуры раствора до значений от -10°С и ниже в растворе начинается образование газогидратов, что сопровождается связыванием части воды из раствора. Это приводит к увеличению концентрации криопротектора в растворе и увеличению вязкости раствора. Поскольку вязкость является ключевым параметром, определяющим способность раствора к криоконсервации путем стеклования, увеличение вязкости раствора за счет гидратообразования позволяет снизить исходную концентрацию криопротектора при сохранении его способности к криоконсервации. Важно отметить, что повышение концентрации криопротектора при гидратообразовании на низких температурах не приводит к существенному увеличению токсичности, поскольку токсичность криопротекторов при понижении температуры снижается (М. Kasai, М. Nishimori at al. Survival of mouse morulae vitrified in en ethylene glycol-based solution after axposure to the solution at various temperatures. Biology of reproduction, 47, 1134-1139 (1992), Gregory M. Fahy, Brian Wowk Improved vitrification solutions based on the predictability of vitrification solution toxicity, Cryobiology v.48, p. 22-35 (2004), Edyta A. Szurekl, Ali Eroglu Comparison and Avoidance of Toxicity of Penetrating Cryoprotectants, PLoS ONE, v. 6, p. 11 (2011), Alison Lawson, Hajira Ahmad Cytotoxicity effects of cryoprotectants as single-component and cocktail vitrification solutions,, Cryobiology, v. 62 p. 115-122 (2011), Monica C. Wusteman, David E. Pegg at al., Vitrification media: toxicity, permeability, and dielectric properties, Cryobiology v. 44, p. 24-37 (2002).
Образующиеся при этом частицы газогидрата не вырастают до крупных размеров, способных разрушать клетки биообъекта, поскольку рост кристалла газогидрата лимитирован диффузией газовых молекул из раствора, а в растворе с высокой вязкостью и с небольшим содержанием газа этот процесс сильно замедлен. При этом при отогреве объекта реализуется обратный процесс: с повышением температуры начинает разлагаться гидрат, который высвобождает воду и снижает концентрацию криопротектора в растворе.
Таким образом, была обнаружена возможность определять значение сниженной концентрации криопротектора или композиции криопротекторов, обеспечивающей под давлением инертного газа те же значения вязкости, которые требуются для эффективной криоконсервации путем стеклования, за счет измерения параметров вязкости раствора в диапазоне температур охлаждения и за счет дополнительного контроля размеров кристаллов, образующихся в процессе гидратообразования.
С учетом особенностей проведения криоконсервации способ подбора оптимальной концентрации криопротектора или композиции криопротекторов сводится к нескольким этапам:
а) Выбирается значение целевой температуры в интервале от -10°С до -130°С, в области которого требуется обеспечить подъем вязкости раствора за счет гидратообразования. Выбор значения целевой температуры определяется имеющимися данными по токсическому эффекту конкретного состава криопротекторов применительно к конкретному биологическому объекту. Поскольку гидратообразование сопровождается связыванием части воды из раствора, это приводит к увеличению концентрации криопротектора (криопротекторов), и значение температуры должно быть таким, чтобы увеличение концентрации при данной температуре не оказывало токсического эффекта совсем либо сопровождалось минимальным токсическим эффектом. Предпочтительно, значение целевой температуры выбирается в диапазоне от -10 до -40°С. В приведенных примерах в качестве целевой температуры выбрано значение -30°С.
б) на первом этапе измеряют вязкость контрольного раствора криопротектора или композиции криопротекторов дополнительно содержащего наночастицы при его охлаждении в рабочем диапазоне температур (см. пример 1);
в) на втором этапе измеряют вязкость раствора криопротектора или композиции криопротекторов дополнительно содержащего наночастицы с пониженной концентрацией на 5-45% под давлением гидратообразующего газа 1-500 атм (предпочтительно для ксенона: 2-12 атм, для криптона: 30-80 атм, для аргона: 100-500 атм) в процессе охлаждении раствора (см. пример 2);
г) если значение вязкости криопротектора или композиции криопротекторов с пониженной концентрацией не достигает вязкости контрольного раствора вплоть до целевой температуры, то сниженную концентрацию криопротектора необходимо повышать и снова проводить измерение согласно примеру 2;
д) если же в интервале до целевой температуры значение вязкости криопротектора или композиции криопротекторов с пониженной концентрацией достигает значения параметра вязкости в контрольном растворе, то проводится третий этап. При этом готовят новый раствор той же сниженной концентрации и подают то же давление газа (согласно примеру 2) и дополнительно проводят измерение размеров, образующихся в нем кристаллов при охлаждении раствора криопротектора или композиции криопротекторов. Измерение размеров кристаллов необходимо проводить в связи с тем, что при слишком низкой концентрации криопротектора они приобретают слишком большой размер (диаметр более 300 нм), что может приводить к повреждению клеток биообъектов при помещении в данный раствор (Takahashi Т, Hirsh A, Erbe Е, Williams RJ (1988) Mechanism of cryoprotection by extracellular polymeric solutes. Biophys J 54: 509-518).
е) если размеры кристаллов не превышают пороговый размер (диаметр 300 нм), то можно снижать концентрацию криопротектора или композиции криопротекторов, если же превышают, то необходимо концентрацию криопротектора или композиции криопротекторов повысить.
Под контрольным раствором криопротектора или композиции криопротекторов здесь и далее подразумевается водный раствор с такой концентрацией криопротектора или композиции криопротекторов, который обеспечивает эффективную криоконсервацию путем стеклования при охлаждении раствора с заданной скоростью. Список криопротекторов или композиций на их основе, включает в себя, но не ограничивается, следующими веществами: глицерин, этиленгликоль, пропиленгликоль, ДМСО, ДМФА, формамид. Концентрации однокомпонентных и многокомпонентных контрольных растворов известны из литературы (Benjamin P. Best. Cryoprotectant. Toxicity: Facts, Issues, and Questions, REJUVENATION RESEARCH, v. 18, n. 5, (2015), Ben Best. Vitrification in Cryonics (http://www.benbest.eom/cryonics/vitrify.html#fracture), Fahy G.M., Wowk B. Principles of Cryopreservation by Vitrification // Methods Molecular Biology: Cryopreservation and Freeze- Drying Protocols. Wolkers W.F. & Oldenhof H. (eds)., Humana Press, UK. 2015, P. 305-320), например, глицерин - 65%w/w, этиленгликоль - 55%w/w, пропиленгликоль - 44%w/w., многокомпонентный M22 - 59%w/v (ДМСО 22,305% w/v, Формамид 12,858% w/v, Этиленгликоль 16,83% w/v, N-Метилформамид 3% w/v, 3-метокси, 1,2-пропандиол 4% w/v).
Для определения возможного снижения концентрации криопротектора или композиции криопротекторов, а также для измерения размеров частиц гидрата в растворе криопротектора разработано устройство, позволяющее проводить измерение вязкости и размеров частиц бесконтактным образом с использованием оптического метода динамического светорассеяния (DLS).
Суть метода DLS заключается в следующем. Измеряется корреляционная функция интенсивности рассеянного лазерного луча от среды, содержащей частицы. Поскольку частицы подвержены броуновскому движению, то возникают флуктуации их концентрации и, следовательно, флуктуации коэффициента преломления. Рассеянное на этих флуктуация излучение регистрируется под определенным углом и определяется временная корреляционная функция интенсивности. Временные корреляции полностью определяются коэффициентами диффузии частиц. Для монодисперсного распределения частиц корреляционная функция G(τ) связана с коэффициентом диффузии следующим образом:

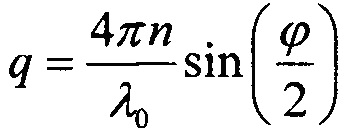 ,
,
где τ - время задержки, а и b - экспериментальные константы, q - вектор рассеяния, D - коэффициент диффузии частиц, λ0 - длина волны лазерного излучения в вакууме, n - коэффициент преломления жидкой фазы, ϕ - угол рассеяния.
Таким образом, метод позволяет определить коэффициент диффузии частиц (в более общем случае распределение коэффициентов диффузии), а после этого на основании соотношения Стокса-Эйнштейна рассчитывается гидродинамический радиус частиц R, в предположении их сферической формы:

При этом, как следует из формулы (2), для корректного определения размера необходимо точное задание динамической вязкости η. Однако возможна постановка обратной задачи: использовать измеренные значения коэффициентов диффузии частиц известного размера для расчета вязкости среды по формуле:

Поскольку метод DLS является бесконтактным, то можно в широких пределах температур и давлений производить измерения вязкости среды. Единственным условием является оптическая прозрачность рабочей камеры.
Как следует из формулы (3), для измерения вязкости методом DLS необходимо использовать частицы с известным радиусом R. Материал частиц сам по себе не имеет значения в контексте использующегося метода, однако необходимо соблюдение ряда условий. Первое условие связано с тем, что распределение размеров частиц должно быть близким к мономодальному; второе условие связано с тем, что частицы должны обладать агрегационной стабильностью в течение времени проведения эксперимента; третье условие связано с тем, что радиус частиц должен быть не очень велик - менее 500 нанометров и в то же время не очень мал (желательно, более 50 нанометров) для обеспечения достаточной интенсивности рассеяния при небольших концентрациях частиц. Четвертое условие связано с тем, что частицы не должны обладать химической активностью к среде, в которой они диспергированы.
В качестве наиболее доступных в продаже частиц могут быть выбраны латексные частицы с радиусом от 50 до 500 нм. В данном случае были выбраны латексные частицы со средним радиусом 52 нм. При измерении вязкости в раствор добавляются частицы. Они добавляются в таких концентрациях, при которых интенсивность рассеяния света, обусловленная их присутствием в растворе, превышает не менее чем в 20 раз интенсивность рассеяния от среды без частиц. При понижении температуры начинают образовываться кристаллы гидрата, что обусловливает рост вязкости среды. При этом важно, чтобы интенсивность рассеяния от образующихся частиц гидрата была намного меньше, чем интенсивность рассеяния от добавленных частиц - от этого зависит точность определения вязкости. Обычно интенсивность рассеяния от образующихся частиц гидрата не превышает трехкратную величину по сравнению с интенсивностью рассеяния от чистого раствора. Это обусловлено близкими коэффициентами преломления частиц гидрата и раствора. Поэтому 20-тикратное превышение интенсивности рассеяния от добавленных частиц по сравнению с чистым раствором позволяет с хорошей точностью пренебречь вкладом рассеянного света от образовавшихся частиц гидрата.
При этом необходимо использовать концентрированные суспензии частиц, такие, чтобы для обеспечения двадцатикратного увеличения интенсивности рассеяния в исследуемый раствор не приходилось добавлять более 2% от общего объема суспензии частиц. Такая небольшая добавка водной суспензии не оказывает искажающего влияния на вязкость исследуемого раствора и не изменяет заметно концентрацию криопротектора.
Устройство для бесконтактного определения вязкости или размеров частиц гидрата при высоком давлении и низких температурах состоит из кюветы, узла регулирования давления, системы регулирования температуры, анализатора динамического рассеяния света, компьютера.
Кювета, для работы с высоким давлением и в диапазоне низких температур схематично изображена на фиг. 1. Кювета содержит корпус 1, оптическое окно 2, вход 3 для датчика температуры, вход 4 для подачи газа. Корпус кюветы изготовлен из бронзы или латуни. Оптическое окно 2 изготовлено из сапфира в форме цилиндрического кольца с внутренним диаметром 10 мм, внешним диаметром 30 мм и высотой 10 мм. Пространство внутри кольца - формирует анализируемую область (далее - Ячейка), которую заполняют исследуемым раствором, и в которую направлен лазерный луч. Мощность источника облучения составляет от 10 до 100 мВт. Предпочтительно, если мощность источника облучения составляет 25 мВт. Используют лазеры с длиной волны облучения измерительной Ячейки в пределах от 400 до 650 нм. Предпочтительно если длина волны облучения измерительной Ячейки составляет 451 нм. Для измерения сигнала и измерения динамического светорассеяния в качестве детектора используют лавинный фотодиод 12 при этом угол установки детектора по отношению к направлению распространения лазерного луча в системе измерения динамического светорассеяния составляет от 10 до 140 градусов. Предпочтительно проводить измерение, если угол установки лавинного фотодиода составляет 135 градусов по отношению к направлению распространения лазерного луча.
Система обработки данных устройства содержит усилитель 13, преобразователь 14 и компьютер 15.
В кювету могут подаваться газы под различным давлением, которое измеряется манометром непосредственно перед кюветой с точностью 0,5 атм. Сверху в кювету через вход для датчика температуры 3 вводят термопару (на фиг. 1 не показана), которая измеряет температуру раствора криопротектора с точностью 0,1°С.
Структурная схема системы регулирования температуры измерительной кюветы приведена на фиг. 2. Система состоит из: сосуда Дьюара 11, в котором размещен жидкий азот 6, нагревателя 7, блока управления нагревателем 8, термоизолированного канала 9, рубашки охлаждения 10. В сосуд Дьюара 11, заполненный жидким азотом 6, вводится термоизолированный газовый канал 9 и нагреватель 7, подключенный к блоку управления нагревателем 8. Пространство между внешней стороной трубки и горловиной сосуда Дьюара герметизируется. После включения нагревателя начинается интенсивное испарение азота и выход его под давлением по трубке, которая соединена шлангом с рубашкой кюветы. Регулируя напряжение на выходе блока управления нагревателем 8, можно регулировать количество выделяющегося тепла, которое полностью затрачивается на испарение азота. Таким образом, поток холодного азота и, соответственно, скорость охлаждения прямо определяются напряжением, подаваемым на нагреватель.
Существенной деталью системы охлаждения является то, что при выходе азота из охлаждающей рубашки кюветы он по трубке направляется в рубашку, создающую термостатирующий объем для охлаждения кюветы и для обдува оптической части кюветы. Это позволяет усилить охлаждение кюветы, сделать его более равномерным и предотвратить конденсацию воды на окнах кюветы.
Устройство работает следующим образом. Наночастицы добавляют в исследуемый раствор криопротектора или композиции криопротекторов, который заливается в ячейку. Ее герметично закрывают, помещают в кюветное отделение установки Photocor Complex (производитель ООО «Фотокор», Россия), подключают к баллону с газом и подают требующееся давление газа на вход 4, затем охлаждают с помощью системы регулирования температуры с заданной скоростью 1-3°С/мин. При наличии более мощного охлаждения можно снижать температуру и с большими скоростями. Анализатор размеров частиц с указанными выше настройками измеряет корреляционную функцию G(x) (см. формулу (1)) с необходимым шагом по времени. Каждая измеренная корреляционная функция открывается в специальном программном обеспечении «Dyna LS» и при задании параметров температуры Т (считывается показание с термопары, опущенной к кювету с раствором), коэффициента преломления n (с небольшой погрешностью можно приравнять к коэффициенту преломления воды), угла рассеяния ϕ, радиуса частиц (размер частиц деленный на 2) и длины волны лазерного излучения λ0 (в данном случае - 451 нм) по формуле (3) рассчитывается вязкость раствора.
Примеры
Пример 1. Измерение вязкости контрольного раствора при пониженных температурах
Для измерения вязкости контрольного раствора при пониженных температурах способом измерения динамического рассеяния света в ячейку с раствором криопротектора добавляют суспензию наночастиц со средним радиусом 52 нм в концентрации 3*1010 частиц/мл. При этом интенсивность рассеяния увеличивалась в 20 раз по сравнению с раствором, не содержащим частицы.
Целевой температурой, в области которого требуется обеспечить подъем вязкости раствора за счет гидратообразования выбрано значение -30°С.
Ячейку герметично закрывают и помещают в кюветное отделение 10 установки (см. фиг. 2). Охлаждение кюветы проводят с заданной скоростью не менее 1°С/мин. Температура контролируется термопарой, введенной в кювету с раствором.
При достижении температуры -10°С через штатное программное обеспечение устройства запускается измерение корреляционной функции рассеянного в кювете лазерного излучения. После измерения корреляционной функции ее параметры загружают с помощью программы «Dyna LS». В программе Dyna LS в соответствующих окнах ввода задают параметры: температуру Т в °К (считывается показание с термопары); коэффициент преломления n (с небольшой погрешностью можно приравнять к коэффициенту преломления воды); угол рассеяния ϕ (в данном случае 135°); длину волны лазерного излучения λ0 (в данном случае - 451 нм); также необходимо задать гидродинамический радиус частиц (52 нм). На основании этих параметров в программе рассчитывается вязкость раствора.
Процедура измерения корреляционной функции и расчета вязкости повторяется при снижении температуры на каждые 5°С в диапазоне от -10 до -30°С. Данные фиксируются, и строится зависимость вязкости от температуры. После достижения температурой -30°С и определения вязкости при этой температуре ячейку отогревают до комнатной температуры, содержимое выливают, ячейку промывают деионизованной или дистиллированной водой.
Пример 2. Измерение вязкости раствора криопротектора с пониженной концентрацией
Готовится водный раствор того же криопротектора или композиции криопротекторов с концентрацией на 5-45% меньшей по сравнению с контрольным раствором и заливается в ячейку. Объем содержимого должен совпадать с объемом контрольного образца. В раствор добавляются наночастицы аналогично примеру 1. Ячейку герметично закрывают, помещают в кюветное отделение установки и подключают к баллону с газом, способным к гидратообразованию. Предпочтительно использовать инертные газы или их комбинации. Перечень используемых газов включает, но не ограничивается ксеноном, криптоном, аргоном, гексафторидом серы, азотом. В объем ячейки подают давление газа, которое выбирают в зависимости от типа газа. Предпочтительно использовать следующие диапазоны давлений для газов: ксенон 2-12 атм, криптон 30-80 атм, аргон 100-500 атм. Образец выдерживают для насыщения газом при комнатной температуре (15-30°С) в течение 1 часа. Затем кювету охлаждают до -5°С. Температуру стабилизируют на -5°С и образец насыщают газом еще в течение 2 часов. Затем производят охлаждение кюветы с постоянной скоростью не менее 1°С/мин, аналогичной скорости охлаждения контрольного раствора.
Во время охлаждения, начиная с -10°С, через каждые 5°С производят измерение вязкости раствора описанным выше способом. При температуре от -10 до целевой температуры начинается резкий рост вязкости, свидетельствующий о начале процесса гидратообразования. Процедуру измерения вязкости необходимо производить до того момента, когда вязкость данного раствора сравняется или превысит вязкость контрольного раствора в этом диапазоне температур. Это свидетельствует о достижении параметром вязкости исследуемого раствора такого значения, которое требуется для эффективной криоконсервации путем стеклования. После этого ячейку с раствором отогревают до комнатной температуры, содержимое выливают, а ячейку промывают деионизованной или дистиллированной водой.
На фиг. 3 представлена температурная зависимость вязкости растворов этиленгликоля: А - раствор 48w/w% этиленгликоля, охлаждаемый под давлением ксенона 8 атм; Б - контрольный раствор этиленгликоля (55w/w%), охлаждаемый без давления.
Проведение измерений для нескольких значений пониженных концентраций криопротектора позволяет определить минимальную исходную концентрацию криопротектора, при которой за счет гидратообразования можно повысить вязкость до значений, соответствующих контрольному раствору. Однако, поскольку данный способ предназначен для криоконсервации биообъектов, необходимо контролировать размер образующихся кристаллов газогидрата, поскольку они при достижении достаточно больших размеров, как и кристаллы льда, могут разрушать клетки биообъекта. Их размер не должен превышать пороговый уровень, составляющий по данным (Takahashi Т, Hirsh A, Erbe Е, Williams RJ (1988) Mechanism of cryoprotection by extracellular polymeric solutes. Biophys J. 54: 509-518) 300 нм. При слишком низких концентрациях криопротектора размер образующихся кристаллов газогидрата может достигать слишком больших размеров (превышает пороговое значения), а также становится возможным образование кристаллов льда. Для контроля размеров кристаллов газовых гидратов проводится регистрация их в растворе с измерением размеров.
Пример 3. Измерение размеров кристаллов газогидрата в растворе с пониженной концентрацией криопротектора
Для измерения размеров кристаллов газогидрата готовится водный раствор криопротектора с пониженной концентрацией (см. пример 2) без включения в раствор наночастиц и заливается в ячейку. Объем содержимого должен совпадать с объемом контрольного образца. Ячейку герметично закрывают, помещают в кюветное отделение установки и подключают к баллону с газом. Тип газа и давление используют те же самые, которые использовались при измерении вязкости криопротектора с пониженной концентрацией (см. пример 2). Погрешность в давлении не должна превышать погрешность используемого манометра. Образец выдерживают для насыщения газом при комнатной температуре (15-30°С) в течение 1 часа, затем кювету охлаждают до -5°С. Температуру стабилизируют на -5°С и образец насыщают газом еще в течение 2 часов. Затем производят охлаждение кюветы с постоянной скоростью не менее 1°С/мин, аналогичной скорости охлаждения контрольного раствора.
При достижении температуры -10°С через штатное программное обеспечение устройства запускают измерение корреляционной функции рассеянного в кювете лазерного излучения. После измерения корреляционной функции ее параметры загружают с помощью программного обеспечения «Dyna LS». В программе Dyna LS в соответствующих окнах ввода необходимо задать температуру Т в °К (считывается показание с термопары), коэффициент преломления n (с небольшой погрешностью можно приравнять к коэффициенту преломления воды), угол рассеяния ϕ (в данном случае 135°), длину волны лазерного излучения λ0 (в данном случае - 451 нм) и значение вязкости при данной температуре (вязкость была определена в примере 2). После задания указанных параметров программа рассчитывает распределение размеров кристаллов, образовавшихся в растворе. Описанная процедура измерения размеров повторяется при снижении на каждые 5°С до минимальной температуры, при которой была измерена вязкость раствора с данной концентрацией. Размер кристаллов анализируется на предмет превышения порогового значения - 300 нм.
На фиг. 4 представлена диаграмма по размерам кристаллов газогидрата ксенона, образующихся в растворах этиленгликоля при охлаждении под давлением ксенона 8 атм: А - раствор 35w/w% этиленгликоля; Б - раствор 48w/w% этиленгликоля.
Промышленная применимость
Поскольку метод DLS является бесконтактным, то можно в широких пределах температур и давлений производить измерения вязкости растворов и размеров кристаллов в нем при высоких давлениях и низких температурах. Достоинством предлагаемого подхода является то, что он позволяет определить пониженные концентрации криопротектора (криопротекторов), обеспечивающие в условиях давления инертного газа значения вязкости, достаточные для эффективной криоконсервации путем стеклования биологических объектов. При этом за счет снижения концентрации криопротектора (криопротекторов) обеспечивается снижение токсического эффекта.