Результат интеллектуальной деятельности: Способ оценки продуктивности рекомбинантных трансформантов дрожжей Pichia pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам
Вид РИД
Изобретение
Изобретение относится к биотехнологии и предназначено для отбора высокопродуктивных рекомбинантных трансформантов дрожжей Pichia pastoris при конструировании штаммов-продуцентов, секретирующих фитазы, относящиеся к классу кислых гистидиновых фосфатаз.
Для улучшения питательных свойств растительных кормов в сельском хозяйстве широкое распространение получили ферменты - фитазы, относящиеся к классу кислых гистидиновых фосфатаз, катализирующие гидролиз фитатов (миоинозитол гексакисфосфатов) с отщеплением неорганического фосфата при кислых значениях рН среды. В настоящее время фитазы для сельскохозяйственных нужд производятся микробиологическим способом, в основном с использованием рекомбинантных дрожжевых продуцентов. Потребность промышленности в эффективных продуцентах постоянно возрастает [Hosseinkhani В., Emtiazi G., Nahvi I. Analysis of phytase producing bacteria (Pseudomonas sp.) from poultry faeces and optimization of this enzyme production. Afr. J. Biotechnol, 2009, 8(17), 4229-4232.]. Наиболее часто для высокоэффективной продукции гетерологичных белков используют метилотрофные дрожжи Pichia pastoris [Daly R., Hearn M.T. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production. J. Mol Recognit., 2005, 18(2), 119-138. doi: 10.1002/jmr.687].
Известен способ отбора природных бактериальных штаммов, продуцирующих внеклеточную фитазу [S. Sreedevi, B.N. Reddy Screening for efficient phytase producing bacterial strains from different soils. International Journal of Biosciences Vol. 3, No. 1, p.76-85, 2013.] Способ заключается в том, что колонии исследуемых бактериальных штаммов высевают на чашки с диагностической средой, в качестве которой используют полную питательную среда (рН 7,0), содержащую в своем составе нерастворимый фитат кальция, и инкубируют при 37°С в течение 72 часов. Образование зоны просветления вокруг колонии свидетельствует о наличии фитазной активности, так как происходит гидролиз фитата кальция. Оценку продуктивности осуществляют по соотношению диаметров зоны просветления и зоны нанесенной колонии.
Однако, данный способ не подходит для дрожжей P. pastoris, так как для их роста полную питательную среду необходимо дополнить источником углерода, а фитазы класса кислых гистидиновых фосфатаз практически не диагностируются при нейтральном рН (оптимум рН для работы таких ферментов лежит в кислой области).
Известен способ отбора наиболее продуктивных трансформантов дрожжей Р. pastoris [Cheng Li, Ying Lin, Xueyun Zheng, Nuo Pang, Xihao Liao, Xiaoxiao Liu, Yuanyuan Huang Shuli Liang Combined strategies for improving expression of Citrobacter amalonaticus phytase in Pichia pastoris, BMC Biotechnology 2015, 15:88], основанный на двустадийном культивировании трансформантов в жидких полных питательных средах: сначала BMGY, где в качестве единственного источника углерода содержится глицерин, а затем в среде BMMY с индуктором экспрессии метанолом. Процесс культивирования занимает 5 суток, и затем измеряют фитазную активность в культуральной жидкости по модифицированной методике Зиля [Zyla К, Koreleski J, Swiatkiewicz S, Wikiera A, Kujawski M, Piironen J, et al. Effects of phosphorolytic and cell wall-degrading enzymes on the performance of growing broilers fed wheat-based diets containing different calcium levels. Poult Sci. 2000;79(l):66-76].
Методика заключается в приготовлении реакционной смеси, содержащей в своем составе 5 мМ фитат натрия, 100 мМ натрий ацетатный буфер (рН 5,5) и исследуемый образец супернатанта, с последующей инкубацией при температуре 37°С в течение 30 мин, окрашиванием колорирующим раствором в течение 10 мин и измерением оптической плотности на спектрофотометре при длине волны 415 нм. Такой способ отбора является длительным и трудоемким.
Задачей изобретения является расширение арсенала способов оценки продуктивности рекомбинантных трансформантов дрожжей Pichia pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам.
Поставленная задача решена путем разработки способа оценки продуктивности рекомбинантных трансформантов дрожжей Pichia pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам, включающего точечное высевание колоний оцениваемых трансформантов на модифицированную диагностическую среду, представляющую собой минимальную питательную среду след состава (мас.%): Na2HPO4 - 0,6; КН2РО4 - 0,3; NaCl - 0,05; NH4CL - 0,1; MgSO4 7Н2O - 0,065; агар - 2 с добавлением витаминов, микроэлементов и фитата натрия в концентрации (мас. %), фитат натрия 0,5 - 1.0, в которую последовательно добавляют молочную кислоту до конечной концентрации 0,17 - 0,18, CaCl2 до концентрации 0,5 - 0,8 и метанол до концентрации 1,0 - 1,5, инкубацию на ней при 28 - 32°С в течение 24-48 ч. и оценку продуктивности по соотношению диаметров зоны просветления и зоны нанесенной колонии, чем больше величина соотношения указанных диаметров, тем выше продуктивность трансформанта.
Существенными признаками данного изобретения являются использование молочной кислоты как подкисляющего агента, использование метанола в качестве единственного источника углерода, а также последовательность добавления компонентов среды (молочная кислота, затем CaCl2, затем метанол). Только совокупность указанных признаков обеспечивает решение поставленной задачи.
Витамины и микроэлементы добавляют в питательную среду с целью улучшить рост дрожжей. Для этого может быть использован любой витаминно-минеральный комплекс, подходящий для выращивания дрожжей на минимальной питательной среде [например, Бабьева И.П., Голубев В.И. методы выделения и идентификации дрожжей. М.: Пищевая промышленность, 1979, стр.48.].
Изобретение осуществляют следующим образом.
Готовят плотную минимальную питательную среду, содержащую фосфаты натрия и калия, хлорид натрия и аммония, сульфат магния и агар. Среду стерилизуют при нагревании, немного остужают, вносят стерилизованный раствор витаминов и микроэлементов, подходящих для дрожжей [например, Бабьева И.П., Голубев В.И. Методы выделения и идентификации дрожжей. М.: Пищевая промышленность, 1979, 2-254.] разливают по стерильным пробиркам, в которые добавляют стерилизованный раствор фитата натрия в концентрации (мас. %) 0,5 -1.0 и перемешивают. Фитат натрия можно добавить в среду и ранее, но предпочтительно добавлять его уже в пробирки, так как в этом случае легче осуществить тщательное перемешивание. Затем еще в горячий раствор последовательно добавляют молочную кислоту до конечной концентрации (мас. %), 0,17 - 0,18, CaCl2 до концентрации (мас. %.) 0,5 - 0,8 и метанол до концентрации (мас %.) 1,0 - 1,5. После добавления каждого компонента раствор тщательно перемешивают. Затем раствор переливают в чашки Петри и дают застыть. На чашку с диагностической средой точечно высевают тестируемые трансформанты дрожжей P. Pastoris и осуществляют инкубацию при 28 - 32°С в течение 24-48 ч. По окончании инкубации измеряют диаметры зон просветления (D) и колоний (Z) и по соотношению диаметров зоны просветления и зоны нанесенной колонии осуществляют оценку продуктивности тестируемых трансформантов.
Изобретение проиллюстрировано следующими фигурами графического изображения.
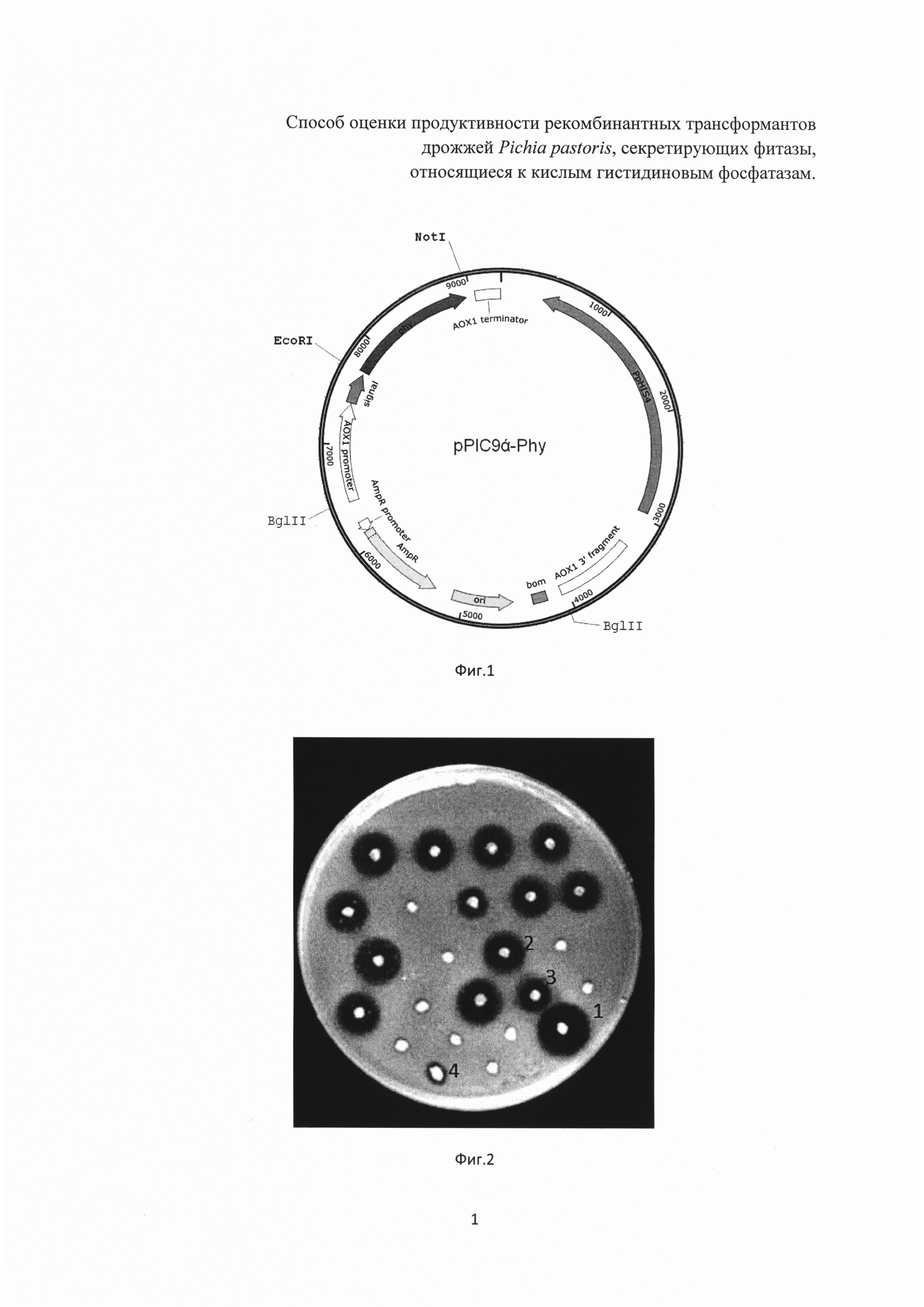
Фиг. 1 Экспрессионная плазмида pPIC9α-Phy, содержащая в своем составе ген, кодирующий бактериальную фитазу С. freundii
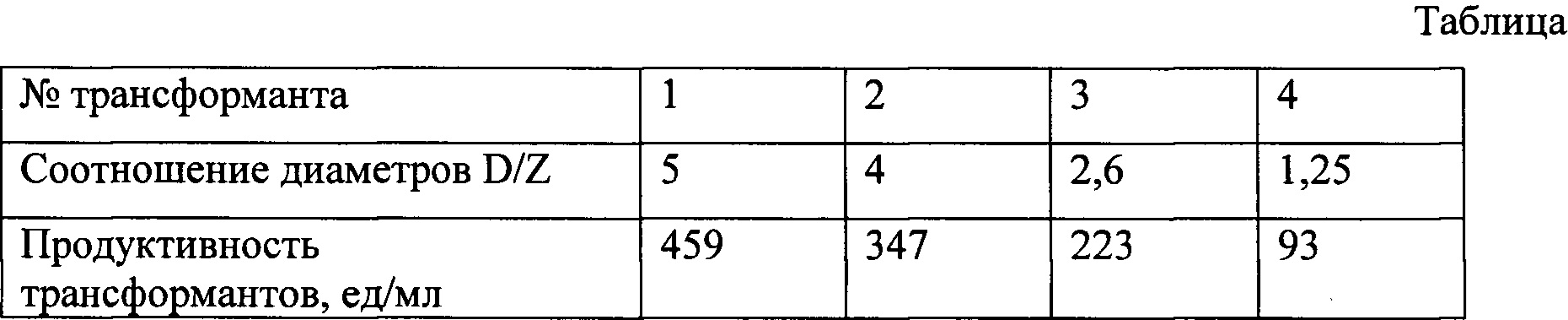
Фиг. 2. Зоны просветления вокруг колоний трансформантов P. pastoris на чашке с модифицированной диагностической средой после 24 часов культивирования.
Изобретение проиллюстрировано следующими примерами.
Пример 1. Получение трансформантов дрожжей P. pastoris, содержащих в составе хромосомы ген фитазы С.freundii
Клонирование гена, кодирующего бактериальную фитазу из Citrobacter freundii, относящуюся к классу кислых гистидиновых фосфатаз, осуществляют в составе коммерческого интеграционного экспрессионного вектора pPIC9α (Invitrogen) под сильным промотором АОХ1, индуцируемым метанолом.
Данная экспрессионная система наиболее востребована для получения ферментов в промышленности [Macauley-Patrick S., Fazenda M.L., McNeil В., et al. Heterologous protein production using the Pichia pastoris expression system. Yeast, 2005; 22, 249-270].
Фрагмент ДНК, содержащий кодирующую область гена бактериальной фитазы из С.freundii синтезируют методом ПЦР с использованием праймеров PhyC-F aagaattcgaagagcagaacggtatga и PhyC-R agcggccgcttacttattccgtaactg. В качестве матрицы используют общую ДНК бактерии С, freundii. Для получения экспрессионной плазмиды амплифицированные фрагменты ДНК обрабатывают эндонуклеазами рестрикции EcoRl, Notl и лигируют с ДНК аналогично расщепленного экспрессионного вектора pPIC9α. Полученной плазмидой трансформируют клетки Е. coli. Трансформанты отбирают по устойчивости к ампициллину. Плазмидную ДНК, выделенную из отобранных клонов, идентифицируют с помощью рестрикционного анализа.
Схематическое изображение плазмиды, содержащей в своем составе ген фитазы, представлено на фиг. 1.
Экспрессионную плазмиду обрабатывают эндонуклеазой рестрикции Bgfll, получаот экспрессионные кассеты, содержащие в своем составе плечи для интеграции, ген фитазы под индуцибельным промотором АOX1 и сигнальным пептидом, представляющим пре-про-последовательность α-фактора дрожжей S. cervisiae, селективный маркер HIS4.
Экспрессионными кассетами трансформируют клетки дрожжей P. pastoris. Трансформанты получают на минимальной среде следующего состава (мас. %): Na2HPO4 - 0,6; КН2РО4 - 0,3; NaCl - 0,05; NH4CL - 0,1; MgSO4 7Н2O - 0,065; агар - 2; глюкоза - 2; CaCl2 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота -0,05; CuSO4 - 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4- 0,04. Полученные трансформанты проверяют на наличие целевого гена в составе хромосомной ДНК методом ПЦР с использованием праймеров PhyC-F aagaattcgaagagcagaacggtatga и PhyC-R agcggccgcttacttattccgtaactg. Наличие ПЦР-фрагментов размера 1236 п.н. подтверждает присутствие гена фитазы С.freundii в составе хромосом полученных трансформантов.
Пример 2. Оценка продуктивности полученных трансформантов дрожжей P. pastoris в чашечном тесте с модифицированной диагностической средой
Диагностическую среду готовят следующим образом: раствор, содержащий (мас. %): Na2HPO4 - 0,6; КН2РO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7Н2O - 0,065; агар - 2; стерилизуют при 121°С и 0,8 атм, остужают до 60°, вносят в него стерильный раствор витаминов и микроэлементов следующего состава (мас. %): биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; меди сульфат - 0,004; калий йодид - 0,01; железа хлорид - 0,02; натрий молибдат - 0,02; цинк сульфат - 0,04 и разливают по стерильным пробиркам, в которые добавляют раствор фитата натрия (предварительно стерилизованный фильтрованием) до концентрации 0,75, перемешивают на вортексе.
Затем добавляют молочную кислоту (89%) до концентрации (мас. %) 0,18, перемешивают, добавляют стерильный раствор 1М CaCl2 до концентрации (мас. %) 0,56, перемешивают до однородного состояния образовавшийся белый осадок нерастворимого фитата кальция и добавляют метанол до концентрации (мас. %) 1,19%. Затем перемешивают и разливают по чашкам.
На чашку с диагностической средой точечно высевают полученные рекомбинантные трансформанты дрожжей P. pastoris. После 24 ч культивирования при 30°С измеряют диаметры зон просветления (D) и колоний (Z) (фиг. 2).
Наличие фитазной активности определяют по появлению зоны просветления вокруг колонии. О величине продуктивности трансформантов судят по соотношению значений диаметров зоны просветления и колонии.
Чем выше продуктивность трансформанта, тем больше величина соотношения указанных диаметров, т.е. значение D/Z. Результаты для трансформантов 1-4 приведены в таблице.
Для проверки выводов, сделанных на основе результатов чашечного теста, проведено количественное измерение активности тестируемой бактериальной фитазы.
Для этого штаммы выращивают на жидкой среде YPD [Бабьева И.П., Голубев В.И. Методы выделения и идентификации дрожжей. М.: Пищевая промышленность, 1979, 2-254.] с добавлением 1% глюкозы в течение 24 ч, затем индуцируют экспрессию гена фитазы путем добавления 2% метанола каждые 24 ч в течение 5 суток. Количественно продуктивность трансформантов оценивают по активности фитазы, образовавшейся в культуральной жидкости, для чего клетки осаждают центрифугированием и в отобранном супернатанте анализируют фитазную активность модифицированным методом Фиске-Субарроу [Bae L.J., Yanke K.J., Cheng H.D., et al. A novel staining method for detecting phytase activity. J Microbiol Methods, 1999, 39(1), 17-22.]. Результаты измерения продуктивности трансформантов представлены в таблице.
Как видно из данных, представленных в таблице 1, количественные измерения продуктивности трансформантов проведенные модифицированным методом Фиске-Субарроу, подтверждают результаты, полученные заявляемым способом.
Таким образом, заявляемый способ достаточно просто и быстро позволяет оценить продуктивность и отобрать наиболее продуктивные рекомбинантные трансформанты дрожжей P. pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам.
Способ оценки продуктивности рекомбинантных трансформантов дрожжей Pichia pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам, включающий точечное высевание колоний оцениваемых трансформантов на модифицированную диагностическую среду, представляющую собой минимальную питательную среду (мас.%): NaHPO - 0,6; КНРО - 0,3; NaCl - 0,05; NHCL - 0,1; MgSO 7НO - 0,065; агар - 2 с добавлением витаминов и микроэлементов, необходимых для роста указанных дрожжей, а также фитата натрия в концентрации (мас.%): фитат натрия 0,5-1.0, в которую последовательно добавляют молочную кислоту до конечной концентрации (мас.%) 0,17-0,18, СаСl до концентрации (мас.%) 0,5-0,8 и метанол до концентрации (мас.%) 1,0-1,5, инкубацию на ней при 28-32°С в течение 24-48 ч и оценку продуктивности по соотношению диаметров зоны просветления и зоны нанесенной колонии, чем больше величина соотношения указанных диаметров, тем выше продуктивность.