Результат интеллектуальной деятельности: НОВАЯ СОЛЬ ТЕНОФОВИРА ДИЗОПРОКСИЛА
Вид РИД
Изобретение
Область техники
Настоящее относится к новой соли тенофовира дизопроксила.
Предшествующий уровень техники
Соль в виде тенофовира дизопроксила фумарата (TDF) представляет собой соединение, имеющее химическое название 9-[2-(R)- [[бис[[(изопропоксикарбонил)окси]метокси]фосфиноил]метокси]пропил]аденин фумаровая кислота (1:1), является пролекарством, которое гидролизуется при всасывании, и представляет собой фосфонометоксинуклеотидный аналог, применимый при лечении ВИЧ-1 инфекции и хронического гепатита B.
TDF был разрешен в качестве терапевтического средства для лечения СПИДа, а затем был разрешен в качестве терапевтического средства для лечения гепатита B Управлением по контролю за продуктами и лекарствами США. Тенофовир, который является активным метаболитом TDF, обладает высокой способность к ингибированию ДНК вируса гепатита B у пациентов, резистентных к ламивудину (Zeffix), и является противовирусным средством, относящимся к категории В безопасности применения при беременности (которая представляет собой лекарственные средства, которые как было установлено, не несут опасности эмбриону в исследованиях ни животных) для оценки риска повреждения эмбриона, обусловленного фармацевтическим средством, в соответствии с отнесением к категории Управлением по контролю за продуктами и лекарствами США (FDA).
Однако обеспечение тенофовиру физико-химической стабильности, как известно, является трудным. Как сообщалось в опубликованной литературе (Pharmaceutical Research, 2001, 18, 234-237; Pharmaceutical Research, 2000, 17, 1098-1103), тенофовира дизопроксил гидролизуется в присутствии воды с получением формальдегида, который затем подвергается реакции конденсации с N6-аминогруппой тенофовира дизопроксила, образуя, таким образом, димер тенофовира дизопроксила в качестве примеси.
Как правило, чтобы ожидать унифицированные эффекты лекарственных средств, количество активного ингредиента нужно предохранять от распада не только непосредственно после производства лекарственных средств, но также во время их хранения, и к тому же нужно подавлять увеличение количеств примесей или специфических примесей, которые являются продуктами распада активного ингредиента в те же периоды времени. Следовательно, предотвращение включения примесей в лекарственные средства считается очень важным в плане контроля качества лекарственных средств.
Что касается официальных предписаний в виде краткого руководства отдельных стран в отношении проверки степени чистоты, в Корейской Фармакопеи имеется отдельное предписание в отношении специфических примесей в соответствии с разделом проверки степени чистоты, и в Фармакопеи США имеются предписания в отношении «обычных примесей», в которых сумма специфических примесей должна составлять 2,0% или менее, если не задано иное, или в которых количества специфических примесей регулируется на основе сопутствующих компонентов и хроматографической чистоты в соответствии с каждым разделом фармацевтических средств. Более того, Европейская и Британская Фармакопея регулирует специфические примеси, и Японская Фармакопея регулирует специфические примеси и их количества при проверке степени чистоты.
Поэтому авторы настоящего изобретения исследовали новые соли, способные свести к минимуму образование специфических примесей даже при длительном хранении и довести до максимума растворимость при проявлении физико-химических свойств, одинаковых с таковыми традиционной соли тенофовира дизопроксила фумарата или превосходящих их, что привело к разработке новой соли в виде тенофовира дизопроксила эдисилата с использованием эдисилата.
Описание
Техническая задача
Соответственно, настоящее изобретения предназначено для обеспечения нового соединения в виде соли тенофовира дизопроксила, которое обладает физико-химическими свойствами, одинаковые с таковыми соли - тенофовира дизопроксила фумарата или превосходящими их, может свести к минимуму образование специфических примесей даже при длительном хранении и может довести до максимума растворимость.
Техническое решение
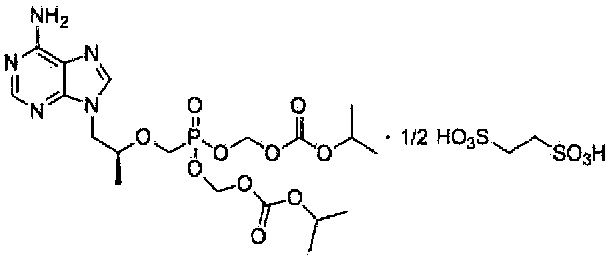
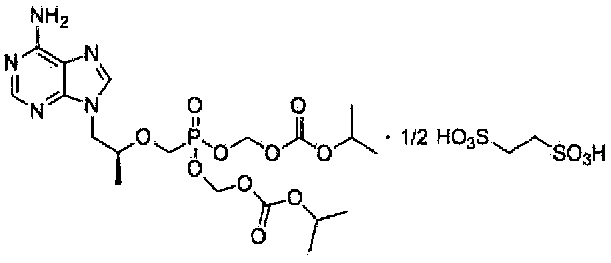
Настоящим изобретением обеспечивается соль в виде тенофовира дизопроксила эдисилата, представленная химической формулой 1, приведенной ниже.
<Химическая формула 1>
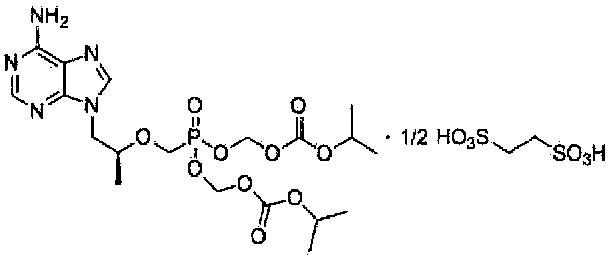
9-[(R)-2-[[бис[[(изопропоксикарбонил)окси]метокси]фосфинил]метокси]пропил]аденин гемиэдисилат
В одном варианте осуществления настоящего изобретения, соединение химической формулы 1 может быть гемиэдисилатом, в котором тенофовира дизопроксил и эдисилат связаны в молярном соотношении 1:0,5.
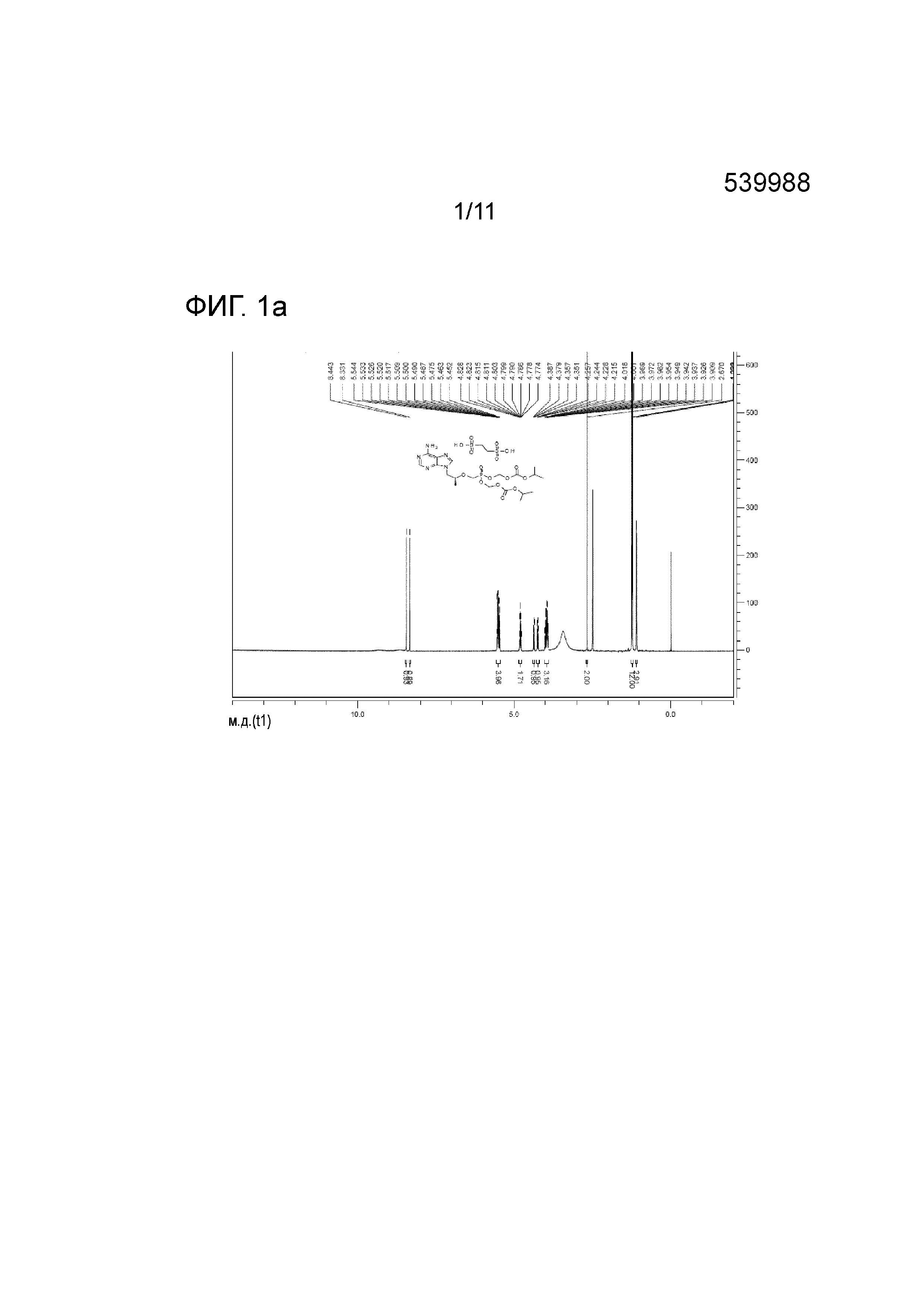
В другом варианте осуществления настоящего изобретения, соединение химической формулы 1 может представлять собой соль в виде тенофовира дизопроксила эдисилата, имеющую следующие пики в спектре 1H ЯМР (ядерного магнитного резонанса): 1H ЯМР (500 МГц, DMSO) 8,44 (с, 1H), 8,33 (с, 1H), 5,54-5,45 (м, 4H), 4,82-4,77 (м, 2H), 4,38-4,35 (дд, 1H), 4,25-4,421 (дд, 1H), 4,01-3,90 (м, 3H), 2,67 (с, 2H), 1,23-1,22 (д, 12H) и 1,09-1,08 (д, 3H) м.д.
В еще одном варианте осуществления настоящего изобретения, соединение химической формулы 1 может иметь следующие значения пиков на порошковой рентгеновской дифрактограмме: 4,14ο, 10,40ο, 11,67ο, 12,64ο, 12,90ο, 13,24ο, 15,64ο, 16,30ο, 16,86ο, 18,69ο, 18,74ο, 19,19ο, 19,82ο, 20,74ο, 21,36ο, 21,89ο, 22,46ο, 23,19ο, 23,72ο, 24,88ο, 25,56ο, 26,21ο и 27,04ο.
Кроме того, настоящим изобретением обеспечивается кристаллическая форма соли в виде тенофовира дизопроксила эдисилата, имеющая значения пиков на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 5: 3,32ο, 4,18ο, 5,13ο, 7,31ο, 8,59ο, 10,01ο, 10,42ο, 10,97ο, 11,56ο, 12,64ο, 12,95ο, 13,25ο, 14,67ο, 15,53ο, 16,39ο, 17,33ο, 18,15ο, 18,75ο, 19,28ο, 19,93ο, 20,44ο, 20,81ο, 21,37ο, 22,03ο, 22,49ο, 22,84ο, 23,28ο, 23,75ο, 24,66ο, 25,00ο, 25,65ο, 26,36ο, 27,1ο, 27,76ο, 28,16ο, 28,79ο, 30,31ο и 31,17ο.
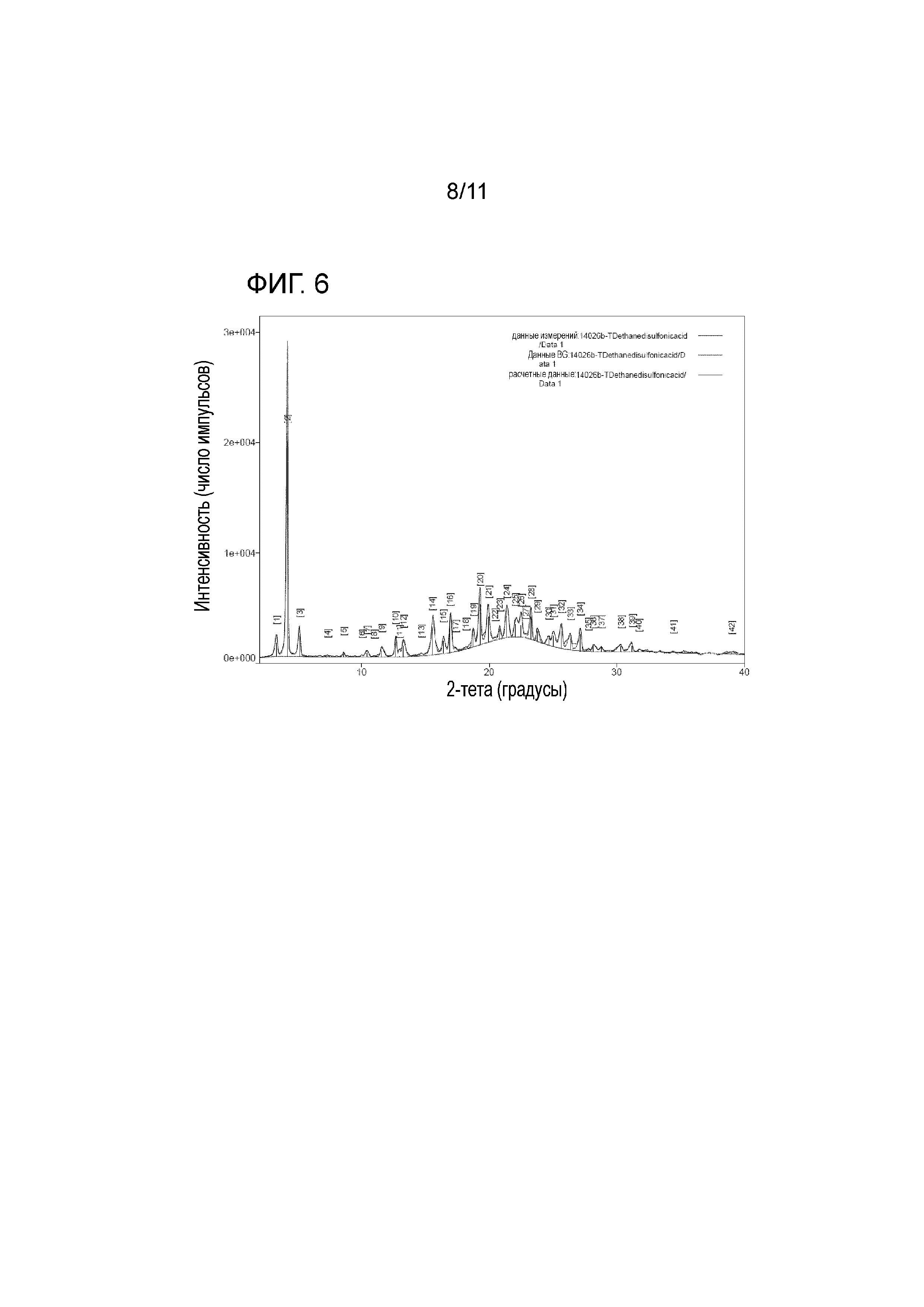
Настоящим изобретением обеспечивается кристаллическая форма соли в виде тенофовира дизопроксила эдисилата, имеющая значения пиков на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 6.
Настоящим изобретением обеспечивается фармацевтическая композиция для профилактики или лечения заболевания, связанного с вирусной инфекцией, при этом эта композиция включает терапевтически эффективное количество соли в виде тенофовира дизопроксила эдисилата.
В одном варианте осуществления настоящего изобретения, вирус может включать вирус иммунодефицита человека (HIV), вирус гепатита В (HBV), цитомегаловирус (CMV), вирус герпеса типа 1 (HSV-1), вирус герпеса типа 2 (HSV-2) или вирус герпеса человека.
В одном варианте осуществления настоящего изобретения, фармацевтическая композиция может быть предоставлена в лекарственной форме в виде таблетки, капсулы, порошка, гранулы, микропилюли, порошка, болюса, настойки или катаплазмы.
Настоящим изобретением обеспечивается способ профилактики или лечения вирусной инфекции у млекопитающего, включающий введение терапевтически эффективного количества соли в виде тенофовира дизопроксила эдисилата нуждающемуся в этом млекопитающему.
В одном варианте осуществления настоящего изобретения, вирус может включать вирус иммунодефицита человека (HIV), вирус гепатита В (HBV), цитомегаловирус (CMV), вирус герпеса типа 1 (HSV-1), вирус герпеса типа 2 (HSV-2) или вирус герпеса человека.
Полезные эффекты
В соответствии с настоящим изобретением, соль в виде тенофовира дизопроксила эдисилата может свести к минимуму образование специфических примесей со временем по сравнению с тенофовира дизопроксилол фумаратом, в соответствии с чем образование примесей может быть значительно уменьшено во время хранения продуктов, содержащих являющееся солью соединение настоящего изобретения, таким образом, увеличивая стабильность лекарственных средств и устраняя необходимость выполнения дополнительных исследований в отношении токсических эффектов. Являющееся солью соединение настоящего изобретения может быть значительно улучшено в плане стабильности несмотря на изменения pH, влагоустойчивости и растворимости и может проявлять превосходные физико-химические свойства, и может, таким образом, использоваться в качестве активного ингредиента фармацевтической композиции для лечения ВИЧ-1 инфекции и хронического гепатита B, вместе с фармацевтически приемлемым носителем. Более того, являющееся солью соединение настоящего изобретения обладает очень высокой растворимостью даже при изменениях pH по сравнению с другими солями тенофовира дизопроксила (например, оротатом, аспартатом, гиппуратом и т.п.).
Кроме того, даже при приготовлении тенофовира дизопроксила эдисилата настоящего изобретения с использованием простого процесса может быть достигнута намного большая степень чистоты тенофовира дизопроксила во время синтеза кислотно-аддитивной соли.
Описание чертежей
На фиг. 1a представлен спектр 1H ЯМР тенофовира дизопроксила гемиэдисилата;
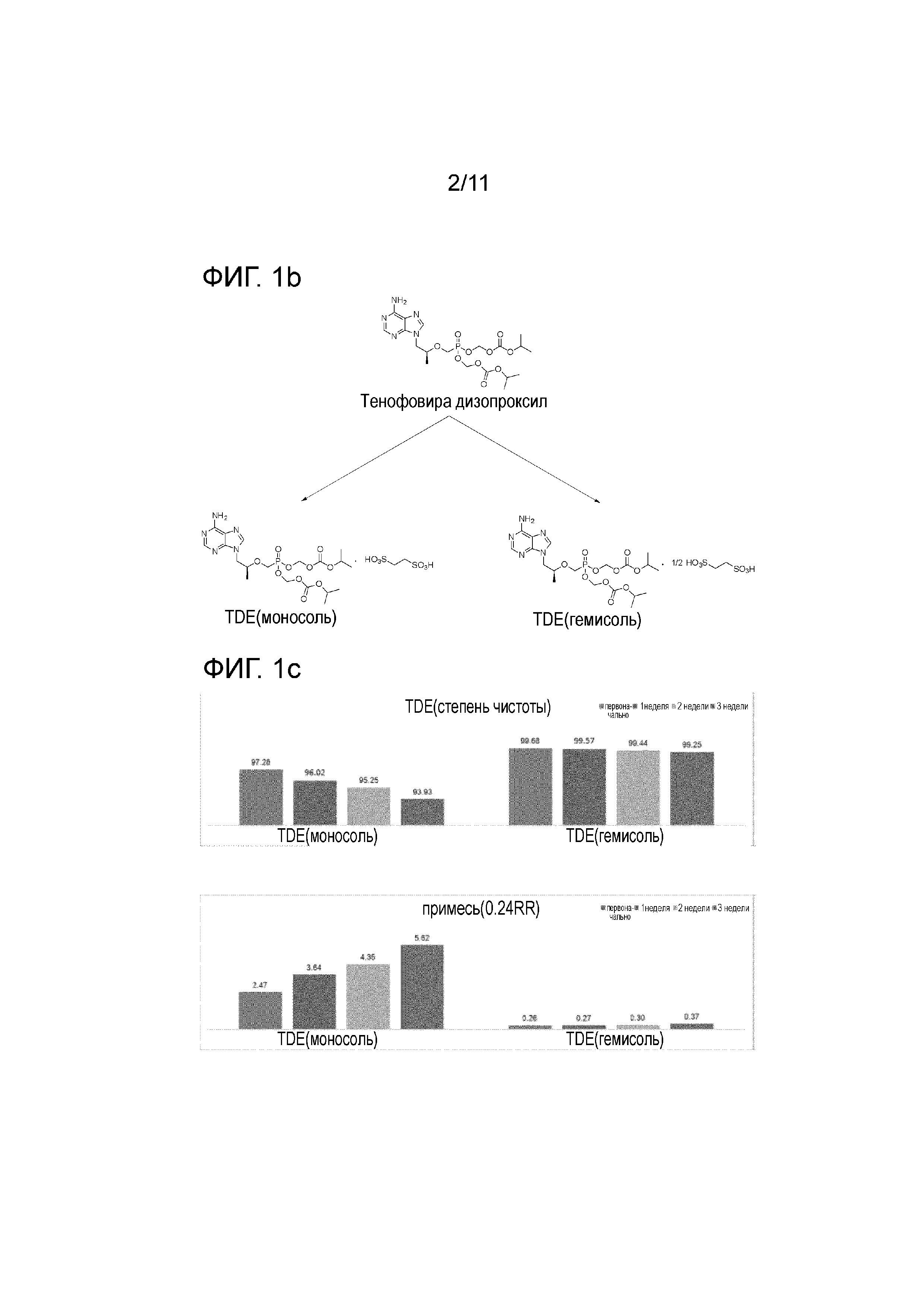
На фиг. 1b представлено сравнение структур тенофовира дизопроксила гемиэдисилата в соответствии с настоящим изобретением и тенофовира дизопроксила моноэдисилата;
Фиг. 1c представляет собой диаграммы, на которых представлены результаты оценки стабильности тенофовира дизопроксила гемиэдисилата и тенофовира дизопроксила моноэдисилата;
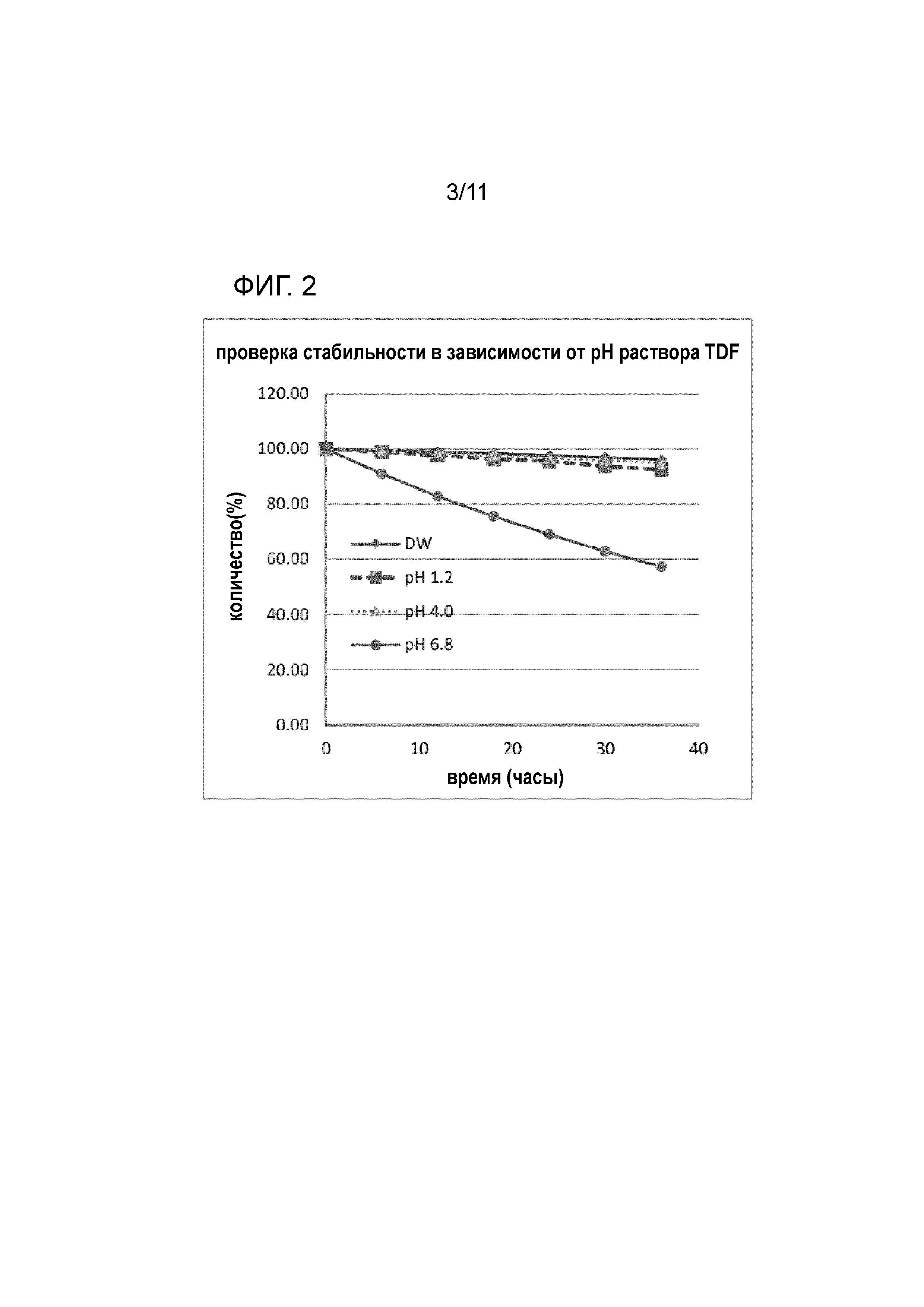
Фиг. 2 представляет собой график, на котором представлены результаты определения стабильности тенофовира дизопроксила фумарата (TDF, сравнительный пример 1) в зависимости от изменений pH;
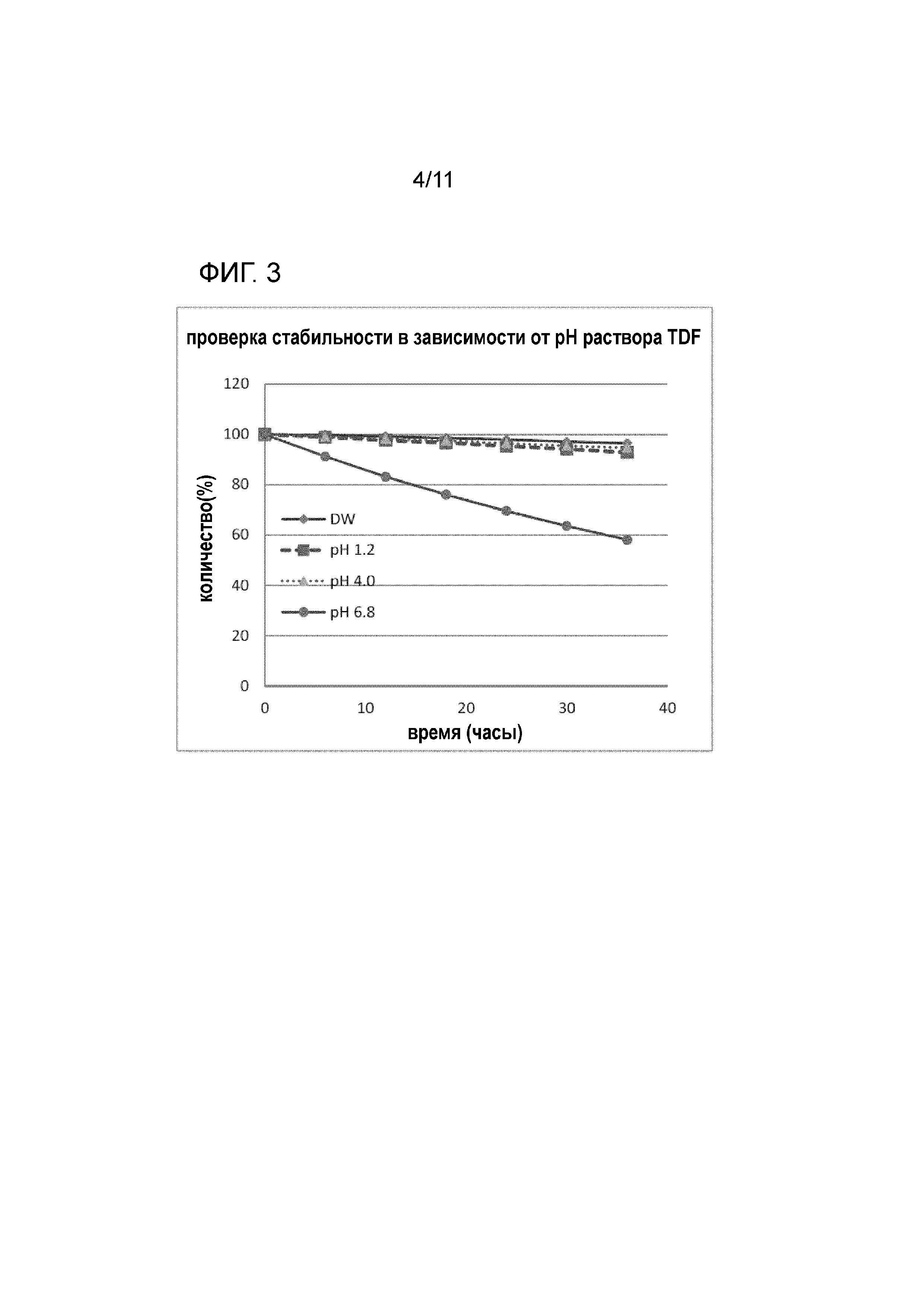
Фиг. 3 представляет собой график, на котором представлены результаты определения стабильности тенофовира дизопроксила гемиэдисилата (TDE, пример 1) в зависимости от изменений pH;
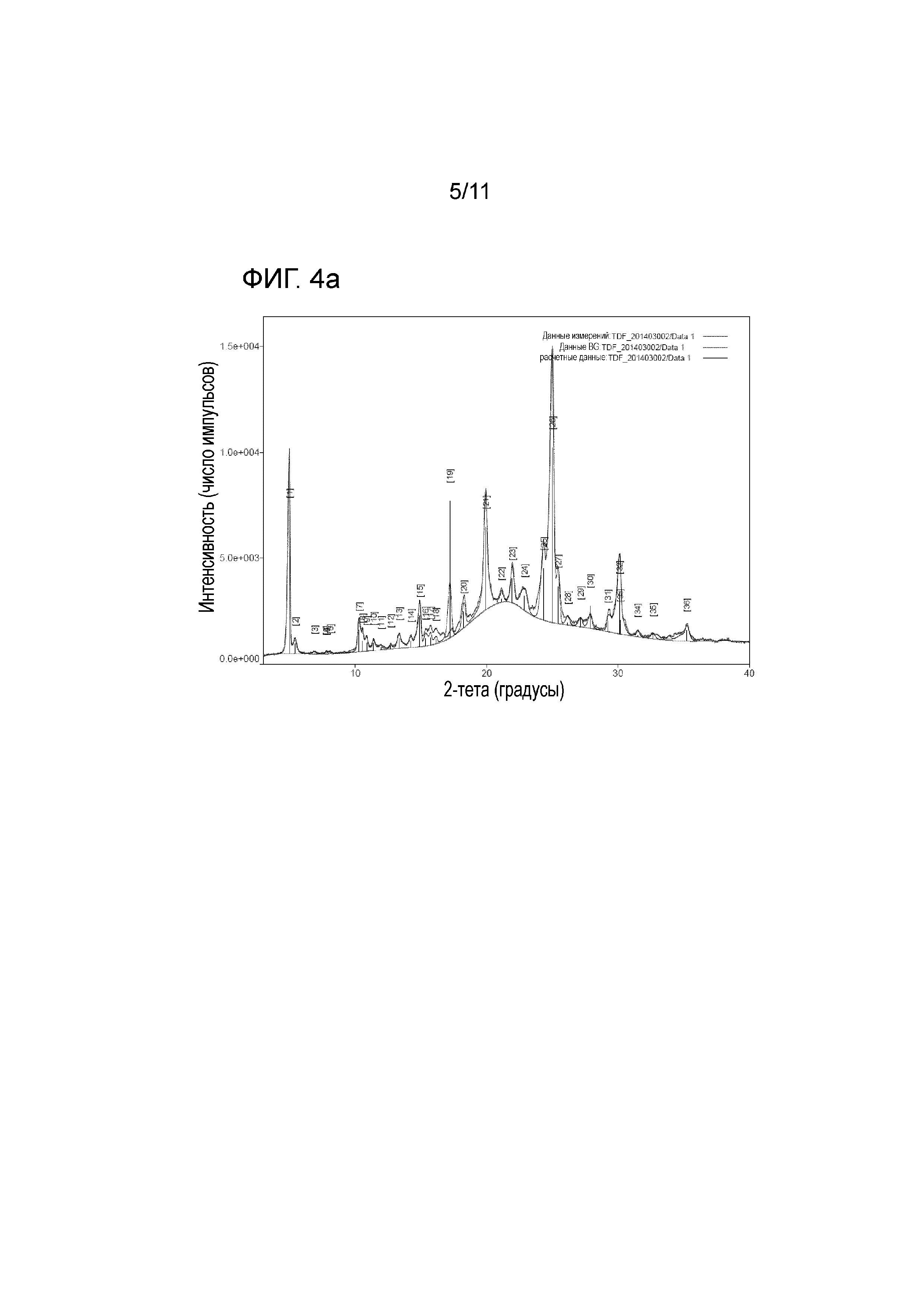
На фиг. 4a представлены результаты рентгеновского структурного анализа тенофовира дизопроксила фумарата;
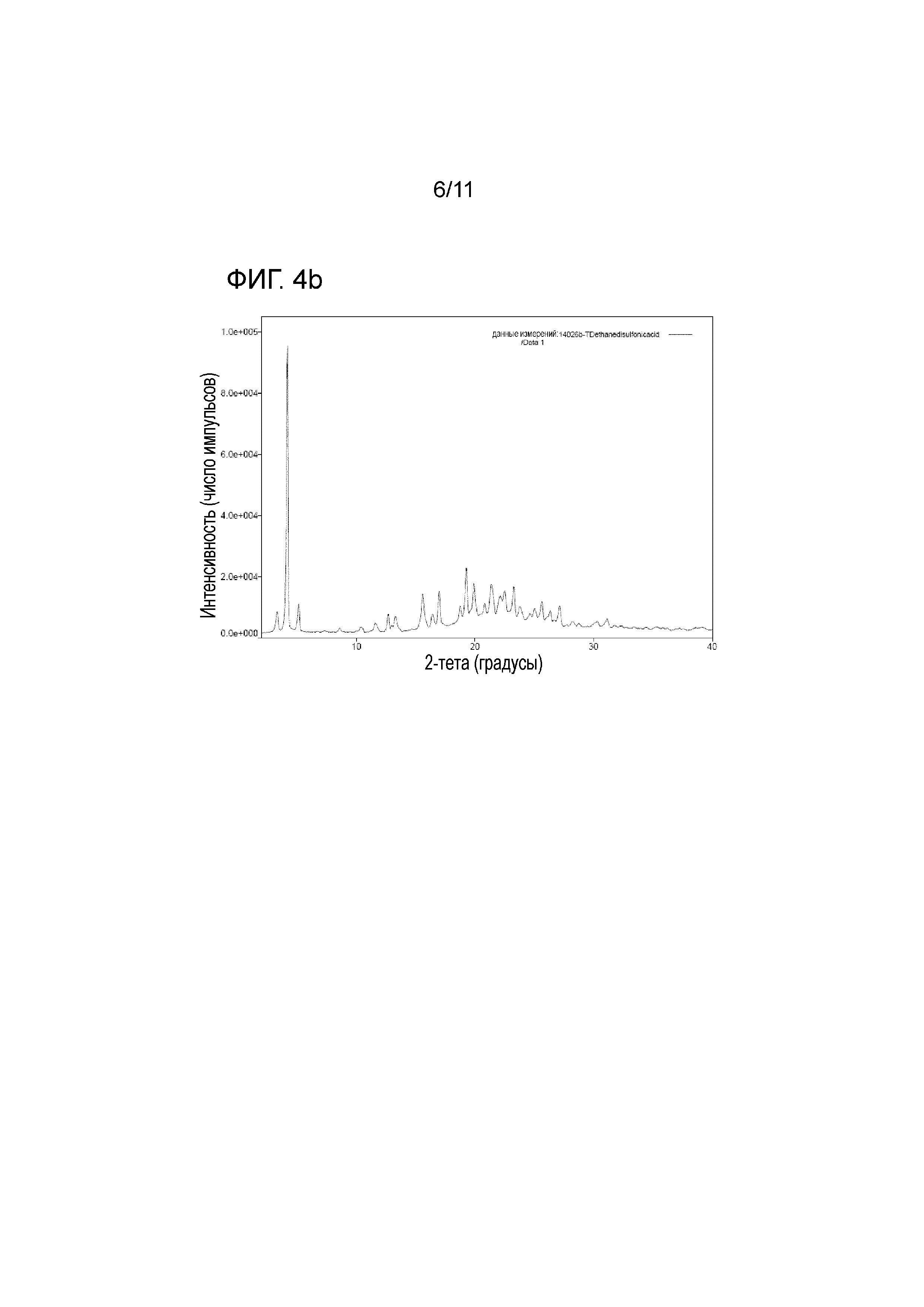
На фиг. 4b представлены результаты рентгеновского структурного анализа тенофовира дизопроксила моноэдисилата;
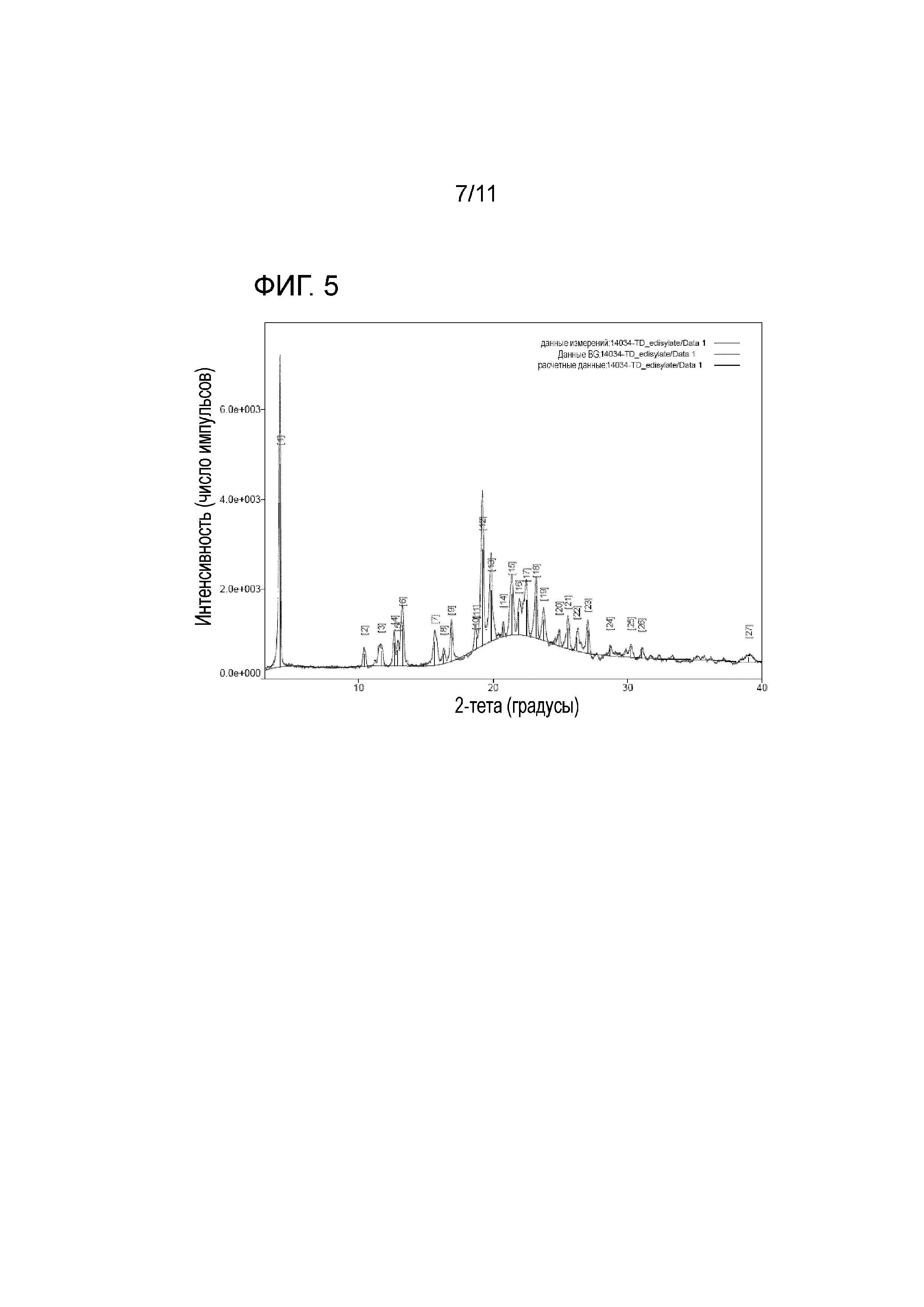
На фиг. 5 представлены результаты рентгеновского структурного анализа тенофовира дизопроксила гемиэдисилата A;
На фиг. 6 представлены результаты рентгеновского структурного анализа тенофовира дизопроксила гемиэдисилата B;
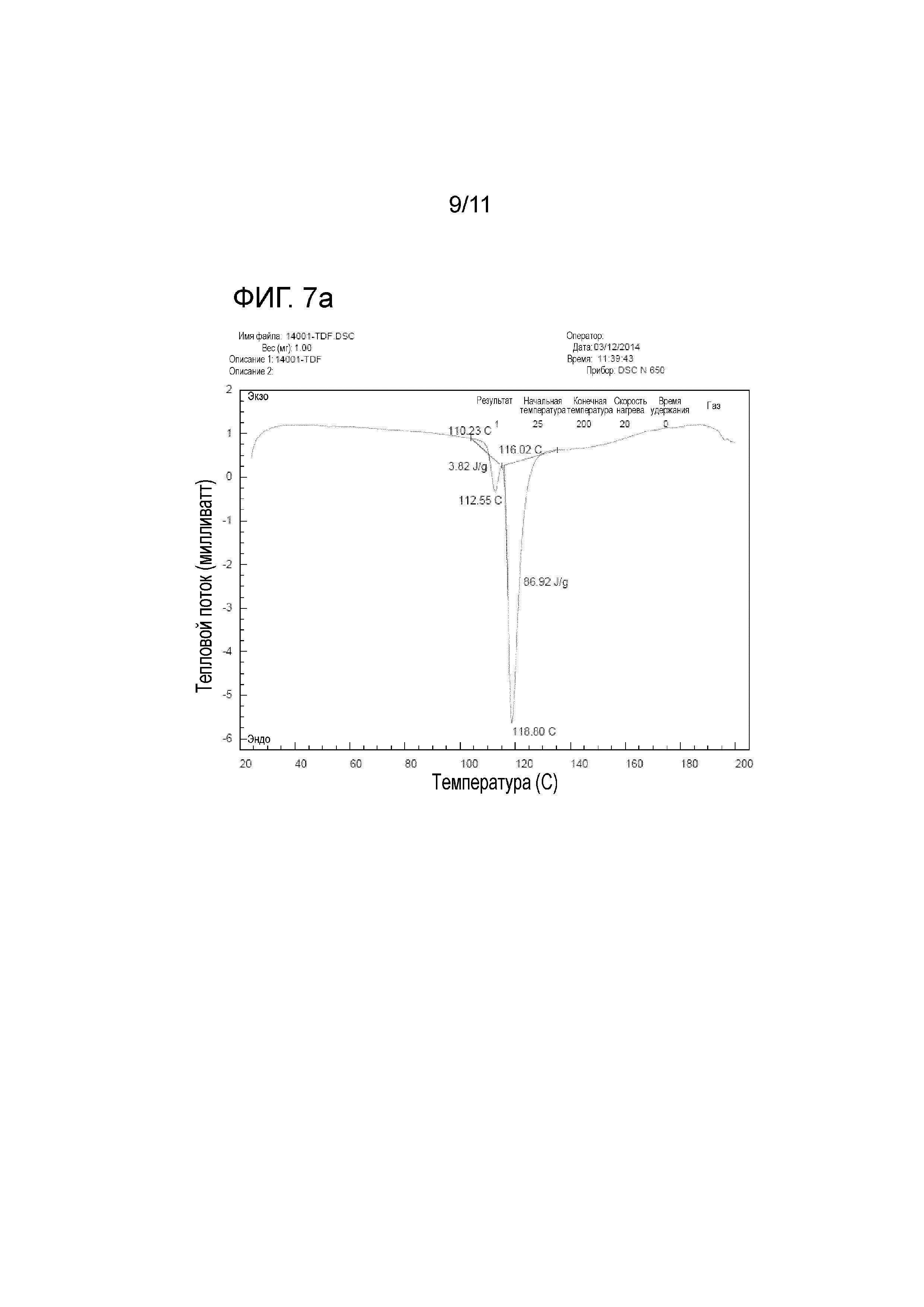
На фиг. 7a представлены значения измерений при дифференциальной сканирующей калометрии (DSC) тенофовира дизопроксила фумарата;
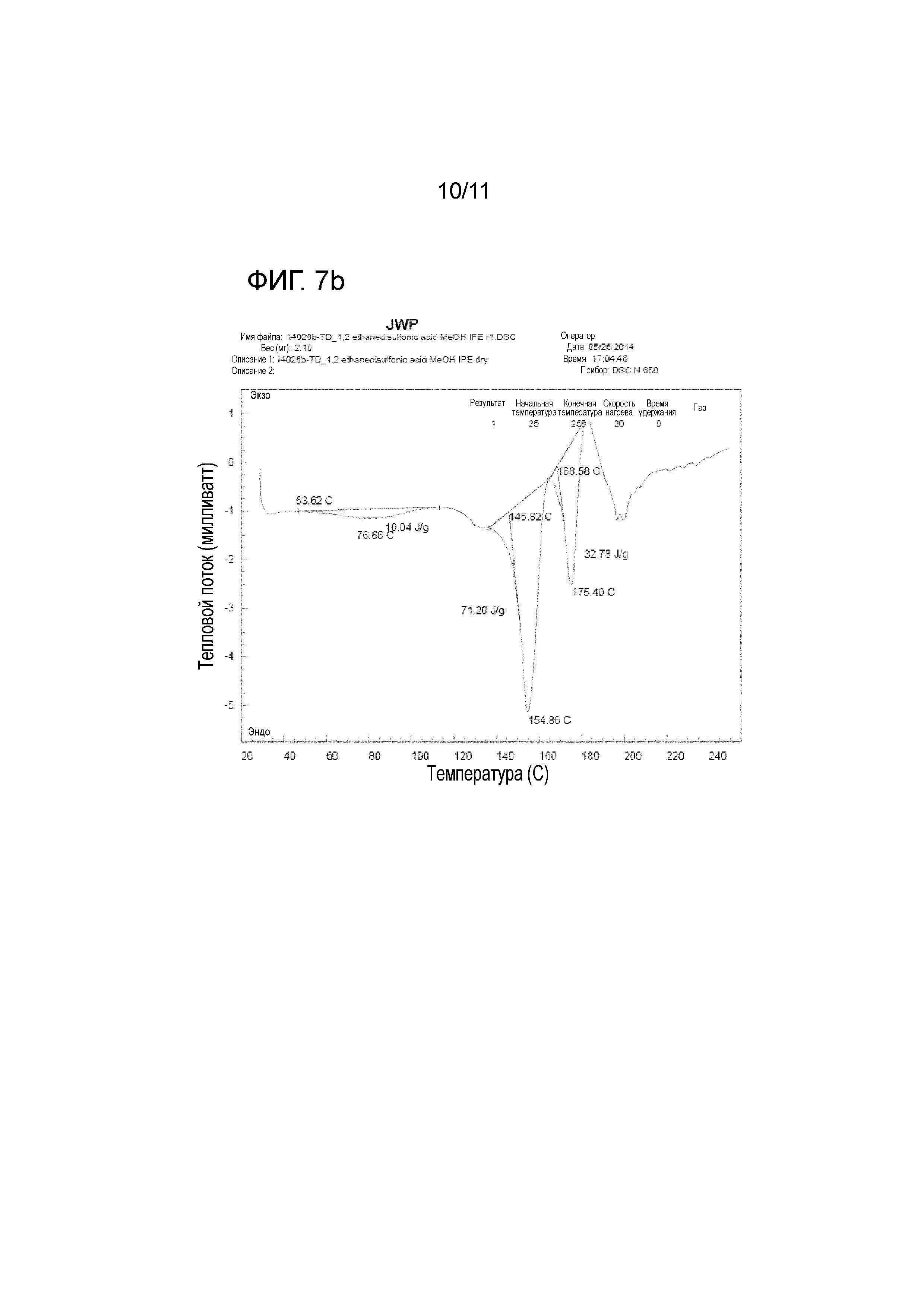
На фиг. 7b представлены значения измерений при DSC тенофовира дизопроксила моноэдисилата; и
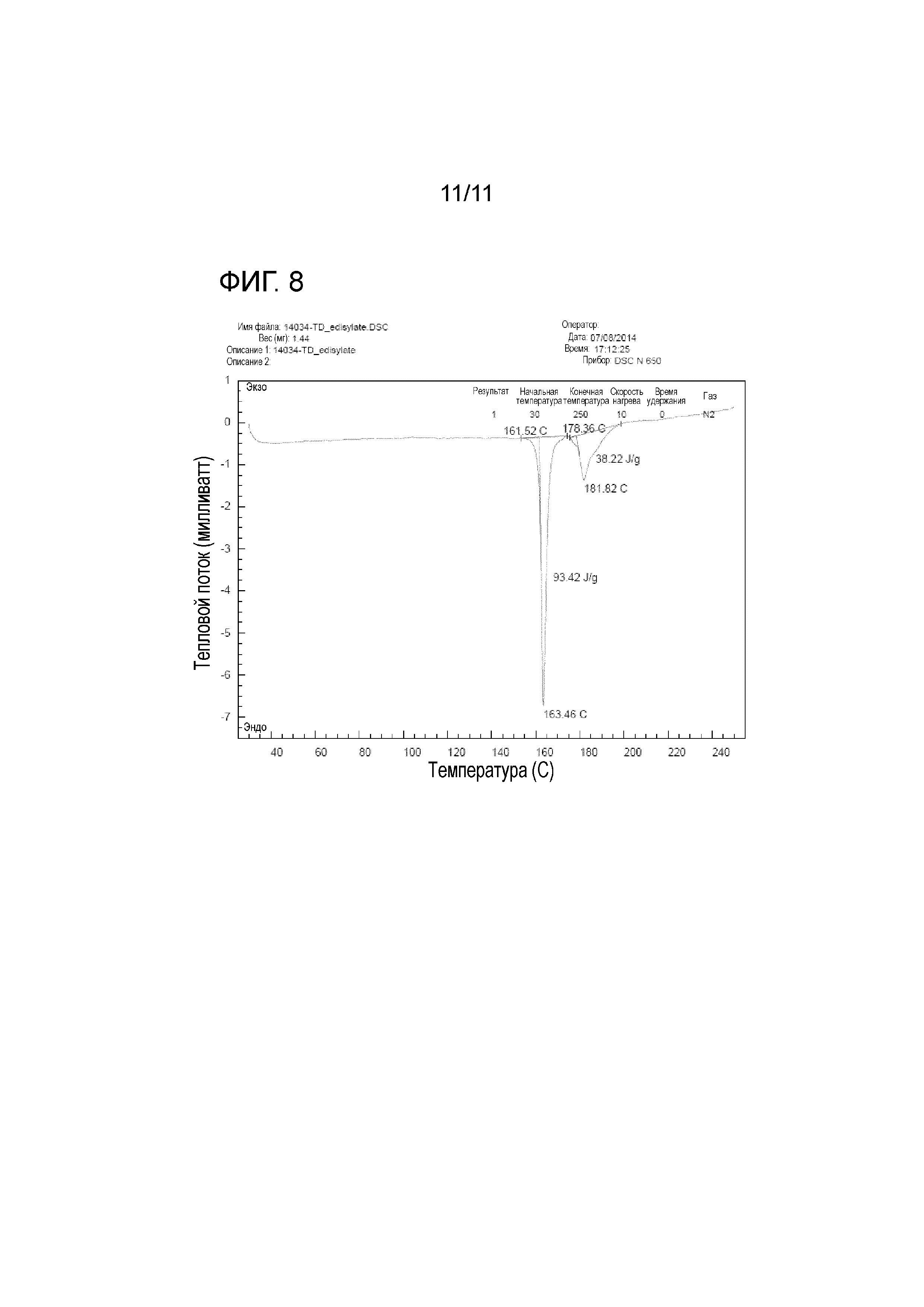
На фиг. 8 представлены значения измерений при DSC тенофовира дизопроксила гемиэдисилата.
Лучший вариант
Ниже приведено подробное описание настоящего изобретения.
Один аспект настоящего изобретения направлен на тенофовира дизопроксил эдисилат, представленный химической формулой 1, приведенной ниже.
<Химическая формула 1>

9-[(R)-2-[[бис[[(изопропоксикарбонил)окси]метокси]фосфинил]метокси]пропил]аденин гемиэдисилат
В одном варианте осуществления настоящего изобретения, соединение химической формулы 1 предпочтительно является гемиэдисилатом, в котором тенофовира дизопроксил и эдисилат связаны в молярном соотношении 1:0,5.
В другом варианте осуществления настоящего изобретения, соединение химической формулы 1 может представлять собой соль в виде тенофовира дизопроксила эдисилата, имеющую следующие пики в спектре 1H ЯМР: 1H ЯМР (500 МГц, DMSO) 8,44 (с, 1H), 8,33 (с, 1H), 5,54-5,45 (м, 4H), 4,82-4,77 (м, 2H), 4,38-4,35 (дд, 1H), 4,25-4,421 (дд, 1H), 4,01-3,90 (м, 3H), 2,67 (с, 2H), 1,23-1,22 (д, 12H) и 1,09-1,08 (д, 3H) м.д.
В еще одном варианте осуществления настоящего изобретения, соединение химической формулы 1 может иметь следующие значения пиков на порошковой рентгеновской дифрактограмме: 4,14ο, 10,40ο, 11,67ο, 12,64ο, 12,90ο, 13,24ο, 15,64ο, 16,30ο, 16,86ο, 18,69ο, 18,74ο, 19,19ο, 19,82ο, 20,74ο, 21,36ο, 21,89ο, 22,46ο, 23,19ο, 23,72ο, 24,88ο, 25,56ο, 26,21ο и 27,04ο.
Кроме того, настоящее изобретение направлено на кристаллическую форму соли в виде тенофовира дизопроксила эдисилата, имеющую значения пиков на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 5: 3,32ο, 4,18ο, 5,13ο, 7,31ο, 8,59ο, 10,01ο, 10,42ο, 10,97ο, 11,56ο, 12,64ο, 12,95ο, 13,25ο, 14,67ο, 15,53ο, 16,39ο, 17,33ο, 18,15ο, 18,75ο, 19,28ο, 19,93ο, 20,44ο, 20,81ο, 21,37ο, 22,03ο, 22,49ο, 22,84ο, 23,28ο, 23,75ο, 24,66ο, 25,00ο, 25,65ο, 26,36ο, 27,1ο, 27,76ο, 28,16ο, 28,79ο, 30,31ο и 31,17ο.
К тому же, настоящее изобретение направлено на кристаллическую форму соли в виде тенофовира дизопроксила эдисилата, имеющую значения пиков на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 6.
Другой аспект настоящего изобретения направлен на фармацевтическую композицию для профилактики или лечения заболевания, связанного с вирусной инфекцией, при этом эта композиция включает терапевтически эффективное количество соли в виде тенофовира дизопроксила эдисилата.
В одном варианте осуществления настоящего изобретения, вирус может включать вирус иммунодефицита человека (HIV), вирус гепатита В (HBV), цитомегаловирус (CMV), вирус герпеса типа 1 (HSV-1), вирус герпеса типа 2 (HSV-2) или вирус герпеса человека, и фармацевтическая композиция настоящего изобретения может, в частности, применяться при лечении ВИЧ-1 инфекции и хронического гепатита B.
Фармацевтическая композиция настоящего изобретения может включать, помимо терапевтически эффективного количества тенофовира дизопроксила эдисилата, фармацевтически приемлемый наполнитель. При необходимости, фармацевтическая композиция может, кроме того, включать дополнительное противовирусное средство и дополнительный терапевтический ингредиент или вспомогательный ингредиент, такой как иммуностимулятор, гепатопротектор и L-карнитин и их соли.
Фармацевтически приемлемый наполнитель может включать, но без ограничения, любой один или более агентов, выбираемых из числа связующего вещества, разбавителя, вызывающего дезинтеграцию агента, консерванта, диспергатора, обеспечивающего скольжение вещества (противоадгезионного вещества) и смазывающего вещества.
Как правило, фармацевтическую композицию настоящего изобретения можно вводить перорально, ректально, интравагинально, интраназально, местно (например, внутрь глаза, в полость рта и сублингвально) или парентерально (например, подкожно, внутримышечно, внутривенно, внутрикожно, интраспинально или эпидурально). Пероральное введение является предпочтительным.
Предпочтительно фармацевтическая композиция настоящего изобретения может быть предоставлена в лекарственной форме в виде таблетки, капсулы, порошка, гранулы, микропилюли, порошка, болюса, настойки или катаплазмы. Таблетка предпочтительно предоставляется в виде обычной таблетки, покрытой оболочной таблетки, диспергируемой таблетки, шипучей таблетки, таблетки с длительным высвобождением, таблетки с контролируемым высвобождением или таблетки с энтеросолюбильным покрытием. Капсула предпочтительно предоставляется в виде обычной капсулы, капсулы с длительным высвобождением, капсулы с контролируемым высвобождением или капсулы с энтеросолюбильным покрытием.
Когда фармацевтическая композиция настоящего изобретения представляет собой таблетку или капсулу, количество соли в виде тенофовира дизопроксила эдисилата, которая служит в качестве активного ингредиента, в стандартной лекарственной форме может меняться в зависимости от множества факторов, таких как симптомы и возраст. Как правило, однократная доза активного ингредиента, при пероральном введении, попадает в диапазон от 5 мг до 300 мг, а предпочтительно от 5 мг до 150 мг. К тому же, таблетка или капсула может, кроме того, включать наполнитель, такой как крахмал, сахароза, лактоза и т.д., связующее вещество, такое как вода, этиловый спирт, поливинилпирролидон, пептизированный крахмал и т.д., вызывающий дезинтеграцию агент, такой как микрокристаллическая целлюлоза, кроскармеллоза натрия, сшитый поливинилпирролидон и т.д., и смазывающее вещество, такое как стеарат магния, тальковая пудра, диоксид кремния и т.д.
Когда фармацевтическая композиция настоящего изобретения представляет собой таблетку или капсулу, она предпочтительно включает основной фармацевтический носитель, включая основной карбонат и основной гидроксид. Предпочтительными примерами основного карбоната являются карбонат кальция, карбонат магния, карбонат цинка, карбонат железа или карбонат алюминия. Предпочтительными примерами основного гидроксида являются гидроксид магния, гидроксид кальция, гидроксид алюминия или гидроксид железа.
Когда фармацевтическая композиция настоящего изобретения представляет собой диспергируемую таблетку, вызывающий дезинтеграцию агент по выбору присутствуют в количестве, составляющем приблизительно от 0,5 до 60%, с тем чтобы осуществлялась быстрая дезинтеграция.
Лекарственная форма фармацевтической композиции настоящего изобретения может представлять собой стерильный порошок для инъекции или инъецируемый раствор. Лекарственная форма может вводиться путем инъекции.
Еще один аспект настоящего изобретения направлен на способ профилактики или лечения вирусной инфекции у млекопитающего, включающий введение терапевтически эффективного количества соли в виде тенофовира дизопроксила эдисилата нуждающемуся в этом млекопитающему.
Еще один аспект настоящего изобретения направлен на применение соли в виде тенофовира дизопроксила эдисилата в производстве лекарственного средства для профилактики или лечения заболевания, связанного с вирусной инфекцией.
В настоящем изобретении, вирус включает вирус иммунодефицита человека (HIV), вирус гепатита В (HBV), цитомегаловирус (CMV), вирус герпеса типа 1 (HSV-1), вирус герпеса типа 2 (HSV-2) и вирус герпеса человека, и предпочтительно включает HIV или HBV. Соль в виде тенофовира дизопроксила эдисилата настоящего изобретения, в честности, применима при лечении ВИЧ-1 инфекции и хронического гепатита B.
В соответствии с настоящим изобретением, соль в виде тенофовира дизопроксила эдисилата, кристаллическая форма, кристаллический препарат и фармацевтическая композиция являются предпочтительно подходящими для применения для теплокровного животного, а предпочтительнее человека.
К тому же, настоящее изобретение направлено на способ приготовления соли в виде тенофовира дизопроксила эдисилата, включающий осуществление реакции тенофовира дизопроксила с эдисилата дигидратом. Предпочтительно, когда тенофовира дизопроксил и эдисилата дигидрат вступают в реакцию в молярном соотношении 1:(0,5-1,5). Предпочтительнее, когда способ приготовления соли в виде тенофовира дизопроксила эдисилата включает осуществление реакции тенофовира дизопроксила с эдисилата дигидратом в молярном соотношении 1:(0,5-0,6).
Вариант изобретения
Лучшее понимание настоящего изобретения может быть достигнуто с помощью следующих примеров, которые представлены с целью иллюстрации, но не должны рассматриваться как ограничение объема настоящего изобретения и могут быть соответствующим образом модифицированы и изменены квалифицированными в данной области техники специалистами в пределах объема настоящего изобретения.
<Пример 1> Приготовление тенофовира дизопроксила гемиэдисилата
200 мл безводного этилового спирта, 10,0 г тенофовира дизопроксила и 1,98 г 1,1-этандисульфона дигидрата помещали в 500-мл реактор, перемешивали при 20-30οC в течение 1 часа, охлаждали до 0-5οC, перемешивали в течение 0,5 часов, фильтровали, промывали с использованием 20 мл безводного этилового спирта и сушили при пониженном давлении при 40οC в течение 4 часов, продуцируя, таким образом, 11,2 г белого тенофовира дизопроксила гемиэдисилата (со степенью чистоты, составляющей 99,68%).
1H ЯМР (500 МГц, DMSO) 8,44 (с, 1H), 8,33 (с, 1H), 5,54-5,45 (м, 4H), 4,82-4,77 (м, 2H), 4,38-4,35 (дд, 1H), 4,25-4,421 (дд, 1H), 4,01-3,90 (м, 3H), 2,67 (с, 2H), 1,23-1,22 (д, 12H) и 1,09-1,08 (д, 3H) м.д.
На фиг. 1a представлен спектр 1H ЯМР тенофовира дизопроксила гемиэдисилата;
<Сравнительный пример 1> Приготовление тенофовира дизопроксила фумарата
Тенофовира дизопроксил фумарат был приготовленным активным фармакологическим ингредиентом (API), закупленным из Китая.
<Сравнительный пример 2> Приготовление тенофовира дизопроксила моноэдисилата
Тенофовира дизопроксил моноэдисилат был приготовлен следующим образом.
В 100-мл реактор помещали 30 мл деионизированной воды, 3,0 г тенофовира дизопроксила и 1,2 г (1,1 эквивалента) 1,1-этандисульфона дигидрата и перемешивали при 20-30οC в течение 1 часа. После завершения реакции, продукт реакции концентрировали с удалением деионизированной воды, пополняли с помощью 30 мл толуола и снова концентрировали с удалением, таким образом, остающейся деионизированной воды.
Сконцентрированный остаток растворяли в 6 мл метанола при комнатной температуре, перемешивали в течение 30 мин вместе с 6 мл изопропилового эфира, подвергали кристаллизации, фильтрации и сушке при пониженном давлении при 40οC в течение 4 часов, продуцируя, таким образом, 3,4 г белого тенофовира дизопроксила моноэдисилата (со степенью чистоты, составляющей 97,51%).
На фиг. 1b представлены структуры тенофовира дизопроксила гемиэдисилата в соответствии с настоящим изобретением и тенофовира дизопроксила моноэдисилата.
<Тестовый пример 1> Оценка стабильности (в условиях напряжения) в зависимости от образования специфических примесей
Сравнение с тенофовира дизопроксилом фумаратом
Для оценки стабильности (в условиях напряжения), в соответствии с руководствами Международной конференции по гармонизации (ICH), тенофовира дизопроксил эдисилат настоящего изобретения (пример 1: TDE) и тенофовира дизопроксил фумарат (сравнительный пример 1: TDF) в качестве контрольной группы использовали и анализировали, используя жидкостную хроматографию высокого разрешения (HPLC), как изложено в Фармакопеи США (USP). Результаты представлены в таблице 1, приведенной ниже (условия напряжения: 60±2οC).
[Таблица 1]
|
Как следует из таблицы 1, тенофовира дизопроксила гемиэдисилат настоящего изобретения был очень стабильный в условиях напряжения по сравнению с тенофовира дизопроксилом фумаратом. В частности, специфические примеси, которые были образованы из тенофовира дизопроксила фумарата, очень редко образовывались в случае тенофовира дизопроксила гемиэдисилата настоящего изобретения, из чего можно заключить, что тенофовира дизопроксил гемиэдисилат настоящего изобретения сохраняет высокую степень чистоты. Среди специфических примесей, появляющихся на начальной стадии, увеличивалось только количество тенофовира изопроксила моноэфира, а другие специфические примеси увеличивались очень редко. К тому же, тенофовира дизопроксил гемиэдисилат содержал основной продукт распада, т.е. тенофовира изопроксил моноэфир, в количестве, равном 0,37%, таким образом, значительно увеличивая стабильность.
(2) Тенофовира дизопроксил моноэдисилат
Тенофовира дизопроксил гемиэдисилат настоящего изобретения (пример 1: TDE (полусоль)), служащий в качестве тестируемой группы, и тенофовира дизопроксил моноэдисилат (сравнительный пример 2: TDE (моносоль)), служащий в качестве контрольной группы, были оценены на стабильность в течение 3 недель таким же образом, как и в (1) выше. Результаты представлены на фиг. 1c.
Как показано на фиг. 1c, тенофовира дизопроксил гемиэдисилат настоящего изобретения был очень стабильным в условиях напряжения по сравнению с тенофовира дизопроксилом моноэдисилатома. В частности, тенофовира дизопроксил гемиэдисилат настоящего изобретения почти не порождал специфические примеси со временем и, таким образом, сохранял высокую степень своей чистоты, и специфические примеси образовывались в очень небольшом количестве, равном 0,37, на 3-ей неделе, проявляя, таким образом, стабильность, превышающую по крайней мере в 15 раз таковую тенофовира дизопроксила моноэдисилата, в случае которого специфические примеси в количестве, равном 5,62, наблюдались в тот же период.
Следовательно, можно подтвердить, что тенофовира дизопроксил гемиэдисилат настоящего изобретения представляет собой лекарственное средство, которое способно свести к минимуму образование специфических примесей с позволением, таким образом, облегчения хранения в условиях, связанных с увеличением количеств специфических примесей, а также обеспечивает возможность длительного хранения.
<Тестовый пример 2> Оценка растворимости
Растворимость считается важной в плане производства лекарственных средств. В случае, когда лекарственное средство с высокой эффективностью обладает низкой растворимостью, разработка пролекарств может стать затруднительной. Если лекарственное средство обладает низкой растворимостью, оно может выпадать в осадок, и, таким образом, всасывание в ротовой полости может быть значительно уменьшено.
Растворимость при насыщении тенофовира дизопроксила гемиэдисилата настоящего изобретения (пример 1) и соли в виде тенофовира дизопроксила фумарата (сравнительный пример 1) в качестве контрольной группы была оценена. Результаты представлены в таблице 2, приведенной ниже.
[Таблица 2]
|
<Тестовый пример 3> Оценка стабильности в зависимости от изменений pH
При пероральном введении лекарственного средства оно всасывается in vivo через желудок, двенадцатиперстную кишку, тонкий кишечник и т.д. Следовательно, стабильность в зависимости от изменений pH оказывает огромное влияние на скорость высвобождения лекарственного средства. В настоящем изобретении, стабильность измеряли, используя деионизированную воду и три буферных раствора с различными pH (pH 1,2, 4,0 и 6,8) для проверки высвобождения. Способ измерения выполняли таким образом, что 5 мг каждого из тенофовира дизопроксила гемиэдисилата настоящего изобретения и тенофовира дизопроксила фумарата в качестве контрольной группы точно отвешивали, полностью растворяли в 1 мл смеси ацетонитрила и воды (1:19), а затем пополняли с использованием 9 мл каждого из буферных растворов с вышеуказанными pH. Приготовленные таким образом отдельные образцы помещали в камеру при 30οC и изменения их количеств со временем определяли, используя HPLC.
На фиг. 2 и 3 представлены результаты стабильности в зависимости от изменений pH в случае тенофовира дизопроксила гемиэдисилата (пример 1: TDE) и тенофовира дизопроксила фумарата (сравнительный пример 1: TDF). Как показано на фиг. 2 и 3, тенофовира дизопроксил гемиэдисилат настоящего изобретения проявлял стабильность, одинаковую с таковой традиционного продукта тенофовира дизопроксила фумарата.
<Тестовый пример 4> PXRD (порошковая рентгеновская дифракция, рентгеновский структурный анализ)
Что касается порошковой рентгеновской дифракции, картина дифракции меняется, когда кристаллическая структура и форма соединения материала являются отличными. Их результаты сравнивают с результатами стандартного материала для подтверждения, таким образом, кристаллической структуры материала. Тенофовира дизопроксил гемиэдисилат настоящего изобретения и контрольные группы, а именно тенофовира дизопроксил фумарат и тенофовира дизопроксил моноэдисилат, были проанализированы, используя Rigaku MiniFlex 600.
Соль в виде тенофовира дизопроксила гемиэдисилата A настоящего изобретения имела пики на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 5, со значениями в 4,14ο, 10,40ο, 11,67ο, 12,64ο, 12,90ο, 13,24ο, 15,64ο, 16,30ο, 16,86ο, 18,69ο, 18,74ο, 19,19ο, 19,82ο, 20,74ο, 21,36ο, 21,89ο, 22,46ο, 23,19ο, 23,72ο, 24,88ο, 25,56ο, 26,21ο и 27,04ο.
Соль в виде тенофовира дизопроксила гемиэдисилата В настоящего изобретения типично имела пики на порошковой рентгеновской дифрактограмме, продемонстрированные на фиг. 6, со значениями в 3,32ο, 4,18ο, 5,13ο, 7,31ο, 8,59ο, 10,01ο, 10,42ο, 10,97ο, 11,56ο, 12,64ο, 12,95ο, 13,25ο, 14,67ο, 15,53ο, 16,39ο, 17,33ο, 18,15ο, 18,75ο, 19,28ο, 19,93ο, 20,44ο, 20,81ο, 21,37ο, 22,03ο, 22,49ο, 22,84ο, 23,28ο, 23,75ο, 24,66ο, 25,00ο, 25,65ο, 26,36ο, 27,1ο, 27,76ο, 28,16ο, 28,79ο, 30,31ο и 31,17ο. Было установлено, что они имеют кристаллические формы, отличные от таковых тенофовира дизопроксила фумарата (патент США с № 5935946) и тенофовира дизопроксила моноэдисилата.
На фиг. 4a представлены результаты рентгеновского структурного анализа тенофовира дизопроксила фумарата.
На фиг. 4b представлены результаты рентгеновского структурного анализа тенофовира дизопроксила моноэдисилата.
На фиг. 5 представлены результаты рентгеновского структурного анализа тенофовира дизопроксила гемиэдисилата A.
На фиг. 6 представлены результаты рентгеновского структурного анализа тенофовира дизопроксила гемиэдисилата B.
<Тестовый пример 5> DSC (Дифференциальная сканирующая калометрия)
DSC широко используется для определения изменения теплового потока относительно температуры, связанного с теплоотдачей материала. Тенофовира дизопроксил гемиэдисилат настоящего изобретения и контрольные группы, а именно тенофовира дизопроксил фумарат и тенофовира дизопроксил моноэдисилат, измеряли при скорости нагрева, составляющей 20οC/мин, под азотной подушкой, используя SCINCO DSC N650. На фиг. 7a представлены значения измерений при DSC тенофовира дизопроксила фумарата. На фиг. 7b представлены значения измерений при DSC тенофовира дизопроксила моноэдисилата. На фиг. 8 представлены значения измерений при DSC тенофовира дизопроксила гемиэдисилата.
Промышленная применимость
В соответствии с настоящим изобретением, соль в виде тенофовира дизопроксила эдисилата может свести к минимуму образование специфических примесей со временем со сравнению с тенофовира дизопроксилом фумаратом, в соответствии с чем образование примесей может быть значительно уменьшено во время хранения продуктов, содержащих являющееся солью соединение настоящего изобретения, таким образом, увеличивая стабильность лекарственных средств и устраняя необходимость выполнения дополнительных исследований в отношении токсических эффектов.