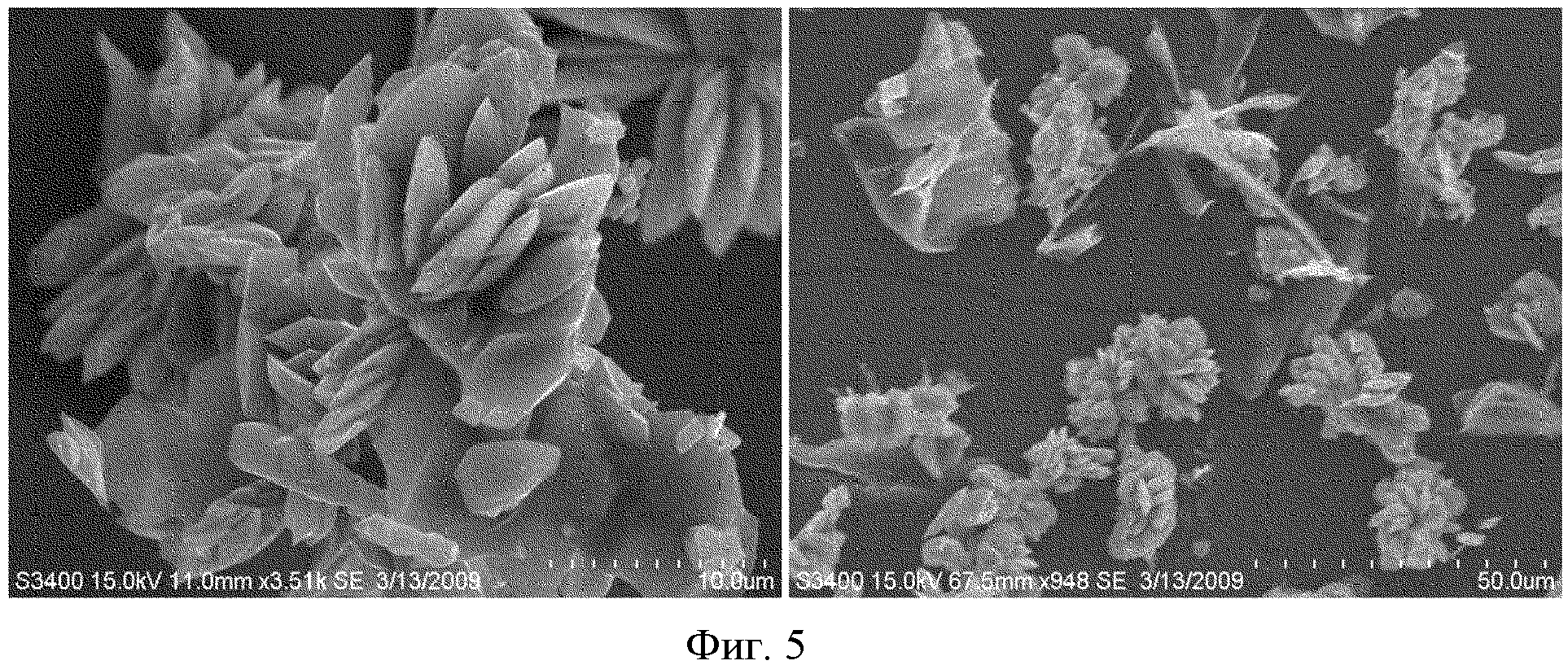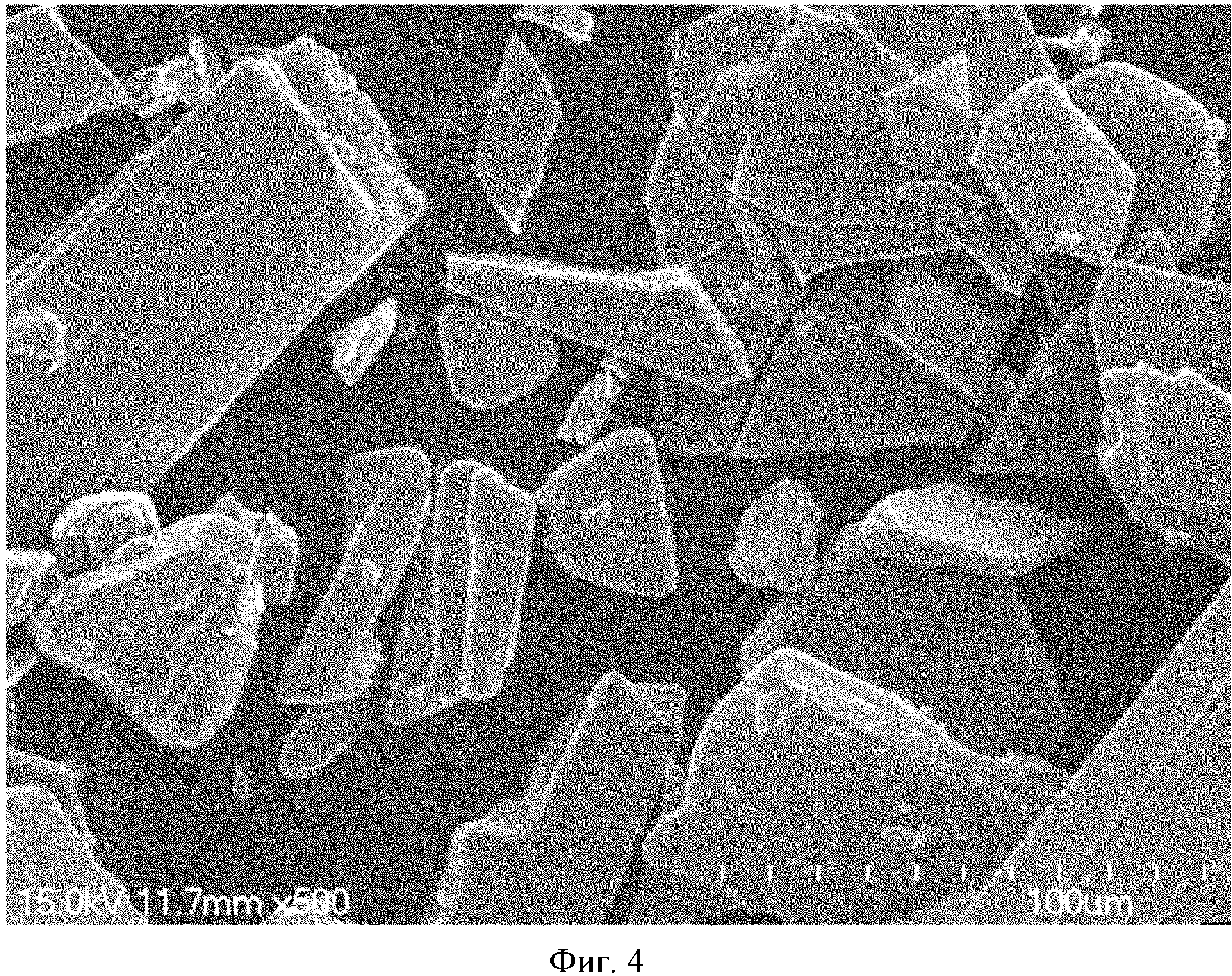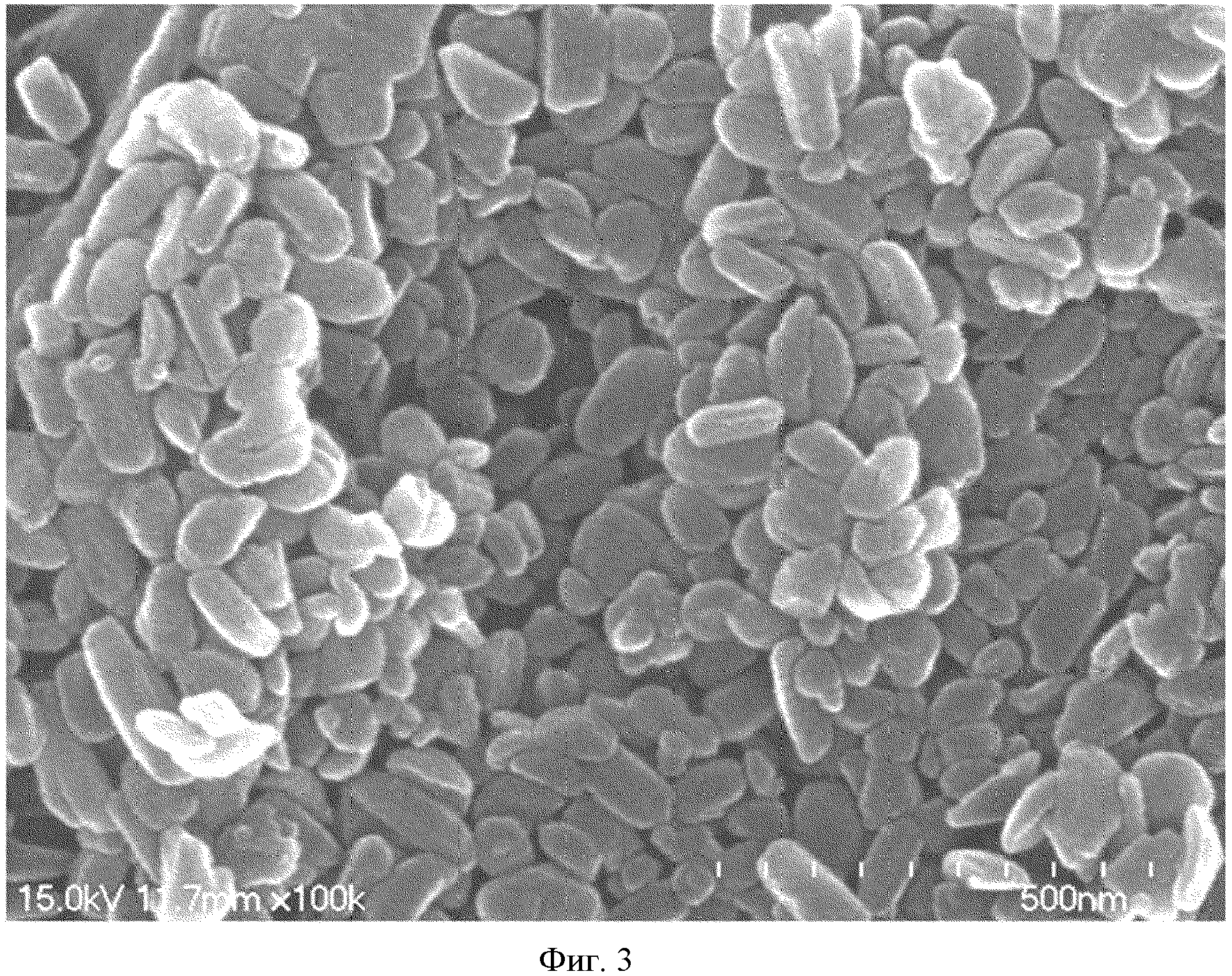Результат интеллектуальной деятельности: НАНОЧАСТИЦЫ ОКСАЛИПЛАТИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к наночастицам оксалиплатина, который представляет собой водорастворимое активное вещество, к фармацевтической композиции, содержащей его, и к способу получения вводимых перорально наночастиц оксалиплатина посредством эмульсифицирования липидного раствора смеси, где твердый липид смешан с поверхностно-активным веществом в водном растворе смеси, где оксалиплатин смешан с конкретным сорастворителем, с последующим удалением твердого липида и сорастворителя с использованием сверхкритического сжиженного газа.
Предшествующий уровень техники
Онкология представляет собой область медицины, в которой лечение больных раком пациентов главным образом проводят парентерально (внутривенно), чем с помощью пероральных лекарственных средств. В прошлом десятилетии преимущественно развивалось лечение с использованием парентеральных лекарственных средств, в то время как в пероральной лекарственной терапии имеется только небольшой прогресс. В настоящее время, известно более 20 цитотоксичных пероральных противораковых лекарственных средств. Большинство разработанных пероральных лекарственных средств получено из ранее известных парентеральных препаратов.
Некоторые из пероральных противораковых лекарственных средств одобрены недавно, а другие широко исследуются. Пероральная лекарственная терапия является преимущественной с точки зрения удобства и простоты введения. При ускорении разработки пероральных лекарственных средств ожидается, что пероральная лекарственная терапия также будет развиваться быстро.
Для противораковых лекарственных средств на основе таксана имеется попытка его совместного введения с ингибитором P-гликопротеинов для улучшения биологической доступности при пероральном введении и проводится множество исследований для осуществления перорального введения таксановых лекарственных средств.
5-фторурацил (5-FU), который обычно используется при лечении желудочно-кишечных раковых заболеваний, включая рак желудка, не является пригодным для перорального введения из-за низкой биологической доступности и, как известно, вызывает побочные воздействия, такие как диарея. Капецитабин представляет собой перорально вводимое химиотерапевтическое средство. Он представляет собой пролекарство, которое под действием ферментов преобразуется в опухоли в 5-фторурацил. Капецитабин демонстрирует токсичность, сравнимую с токсичностью внутривенно вводимого 5-фторурацила, и одобрен во всем мире для использования при раке груди и при раке толстой кишки, и представляет собой пример успешной разработки перорального противоракового лекарственного средства (VJ O'Neil и CJ Twelves, British Journal of Cancer (2002) 87: 933-937).
Среди противораковых лекарственных средств на основе платины, включая оксалиплатин, сатраплатин представляет собой первое и единственное перорально вводимое химиотерапевтическое лекарственное средство на основе платины.
Тысячи производных комплексов платины синтезируются и исследуются в предклинических фазах, но только примерно 30 из них доведены до клинической фазы (Lloyd R Kelland, Expert Opinion on Investigational Drugs (2000) 9(6): 1373-1382). В настоящее время только 3 из них, то есть, цисплатин, карбоплатин и оксалиплатин, одобрены USFDA (Администрации США по пищевым продуктам и лекарственным средствам), используются в форме инъекций (Hak Choy et al., Clin. Cancer Res. (2008) 14(6): 1633-1638).
Оксалиплатин представляет собой органический комплекс, состоящий из платины и 1,2-диаминоциклогексана и имеющий оксалатный лиганд как уходящую группу. Его наименование согласно IUPAC - (R,R)-1,2-диаминоциклогексан(этандиоато-O,O)платина. В настоящее время оксалиплатин продается на рынке для лечения запущенного рака толстой и прямой кишки и метастазирующего рака желудка под торговым наименованием Eloxatin®. Часто он вводится вместе с 5-фторурацилом или лейковорином.
Метастазирующий рак толстой кишки лечится с помощью химиотерапии с использованием Eloxatin® (оксалиплатина), FOLFOX (фторурацила/лейковорина/оксалиплатина) или FOLFIRI (фторурацила/лейковорина) и Avastin® (бевацизумба) от Genentech/Roche, одобренного в 2004 году USFDA.
Оксалиплатин вводится только как инъекция, и Eloxatin®, который находится в лиофилизированной форме, должен разбавляться водой для инъекций или раствором глюкозы перед его введением пациенту. Процесс лиофилизации является сложным, дорогостоящим и требует разбавления. Во время разбавления могут возникать такие проблемы, как потеря оксалиплатина, преципитация, образование нежелательных частиц, загрязнение, и тому подобное. В особенности, проблема загрязнения является очень важной, если рассматривать токсичность противоопухолевого вещества.
Жидкий препарат для инъекций продается на рынке в последнее время для уменьшения неудобств и проблем, связанных с лиофилизированным оксалиплатином для инъекций, но попытка получения оксалиплатина в перорально вводимой форме еще не известна.
Хотя сатраплатин был сначала разработан как перорально вводимое лекарственное средство на основе платины, и о нем сообщалось в 1993 году, он еще не получил одобрения от USFDA для лечения рака простаты (В-Sung Park, Recent Trends в KOTRA (2007)).
Хотя о причине того, почему оксалиплатин может использоваться только в форме инъекций, не сообщалось подробно, из клинических исследований следует, что как цисплатин, так и карбоплатин, которые представляют собой комплексы платины(II), подобно оксалиплатину, демонстрируют очень низкую биологическую доступность в желудочно-кишечном тракте, когда вводятся перорально (Lloyd R Kelland, Expert Opinion on Investigational Drugs (2000) 9(6): 1373-1382).
Сатраплатин представляет собой пероральное лекарственное средство на основе платины(IV), разработанное для решения проблемы с низкой биологической доступностью соединения платины(II). Недавно сообщалось о результатах фазы III клинических исследований для этого соединения (Hak Choy et al., Clin. Cancer Res. (2008) 14(6): 1633-1638).
Хотя необходимость разработки вводимых перорально противораковых лекарственных средств и множество их преимуществ по сравнению с инъекциями понятны, ряд ограничений, включая низкую биологическую доступность, замедляют их разработку.
Относительно оксалиплатина, делаются попытки получения стабильного водного раствора оксалиплатина для решения указанных выше проблем. Патент США № 5716988 описывает препарат оксалиплатина для парентерального введения, содержащий водный раствор оксалиплатина при концентрации 1-5 мг/мл и с pH в пределах от 4,5 до 6. И патенты США №№ 6476068 и 6306902 описывают препарат на основе фармацевтически стабильного раствора, содержащего оксалиплатин, и способ его получения. Патент Кореи № 367752 описывает стабильную лиофилизированную фармацевтическую композицию, патент Кореи № 913063 описывает готовый для использования раствор для инъекций, содержащий оксалиплатин, и Международный патент № WO/2005/020980 описывает препарат оксалиплатина для парентерального введения. В дополнение к этому, в опубликованных заявках на патент США №№ 2003-0109515 и 2004-0127557 описаны способы получения более стабильной композиции, и в опубликованной заявке на патент Кореи № 10-2007-0067768 описан способ получения стабильной композиции оксалиплатина со сведенной к минимуму токсичностью оксалиплатина.
В то же время в патенте США № 7217735 описана фармацевтическая композиция для перорального введения, содержащая наночастицы плохо растворимого паклитакселя. Однако поскольку растворители, описанные в описании, не могут растворять водорастворимые активные вещества, такие как оксалиплатин, патент является неприменимым для получения наночастиц водорастворимых активных веществ.
В настоящее время, для растворения лекарственных средств, которые имеют хорошие физиологически активности, но являются плохо растворимыми в водных растворах, используются нанотехнологии. Также нанотехнология дает возможность для улучшения биологической доступности посредством повышения стабильности лекарственных средств или поддержания концентрации лекарственного средства в крови посредством контроля скорости высвобождения. Стабилизация лекарственного средства с использованием нанотехнологии вносит вклад в улучшение биологической доступности и поддержание долговременной эффективности таких лекарственных средств как паклитаксель, доцетаксель, доксорубицин и тому подобное, которые имеют проблемы с растворимостью и стабильностью (KIPO, 2006 Patent Litigation Map Project - Development of Nanopharmaceuticals, (2006)).
Однако, несмотря на проведение исследований, направленных на улучшение композиций и способов их приготовления, на получение наночастиц плохо растворимых активных веществ, или чего-либо подобного для парентерального введения оксалиплатина, перорально вводимый препарат, содержащий только оксалиплатин, еще не разработан.
Описание
Техническая проблема
Авторы настоящего изобретения осуществили исследования для получения водорастворимых активных веществ, таких как оксалиплатин, в препарате для перорального введения. В результате, они обнаружили, что наночастицы могут быть получены посредством эмульсификации липидного раствора смеси, где твердые липиды смешаны с поверхностно-активным веществом, в водном растворе смеси, где оксалиплатин смешан с конкретным сорастворителем, с последующим повышением давления с использованием сверхкритического сжиженного газа, и что наночастицы могут быть получены в виде препарата для перорального введения.
Настоящее изобретение направлено на получение наночастиц оксалиплатина для перорального введения с высокой биологической доступностью, получаемых посредством эмульсификации липидного раствора смеси в водном растворе смеси, с последующим удалением твердых липидов с использованием сверхкритического сжиженного газа.
Техническое решение
В одном из общих аспектов, настоящее изобретение предусматривает наночастицы оксалиплатина для перорального введения, имеющие средний размер частиц от 10 до 1000 нм, и содержащую их фармацевтическую композицию для перорального введения.
В другом общем аспекте, настоящее изобретение предусматривает способ получения наночастиц оксалиплатина для перорального введения, включающий: (1) растворение оксалиплатина в сорастворителе, который представляет собой воду, диметилсульфоксид (ДМСО) или их смесь, с получением водного раствора смеси; (2) смешивание твердых липидов с поверхностно-активным веществом с получением липидного раствора смеси; (3) добавление липидного раствора смеси к водному раствору смеси с получением эмульсии, а затем ее охлаждение и сушку с получением твердого продукта; и (4) добавление твердого продукта в реактор, повышение давления выше сверхкритических условий посредством добавления сверхкритического сжиженного газа и удаление твердых липидов и сорастворителя с использованием сверхкритического сжиженного газа с получением наночастиц оксалиплатина.
Преимущественные воздействия
Посредством получения оксалиплатина, который в настоящее время доступен только в форме инъекции для парентерального введения, в форме наночастиц, настоящее изобретение делает возможной разработку перорально вводимого оксалиплатина, который является стабильным по отношению к желудочному соку и имеет улучшенную биологическую доступность, улучшая тем самым удобство для пациента посредством исключения неудобства инъекции и сильно сокращая медицинские расходы. Поскольку наночастицы оксалиплатина могут быть получены экономично с использованием относительно недорогого оборудования для получения сверхкритических флюидов, они могут быть получены с помощью простого способа с высоким выходом в промышленном масштабе.
Описание чертежей
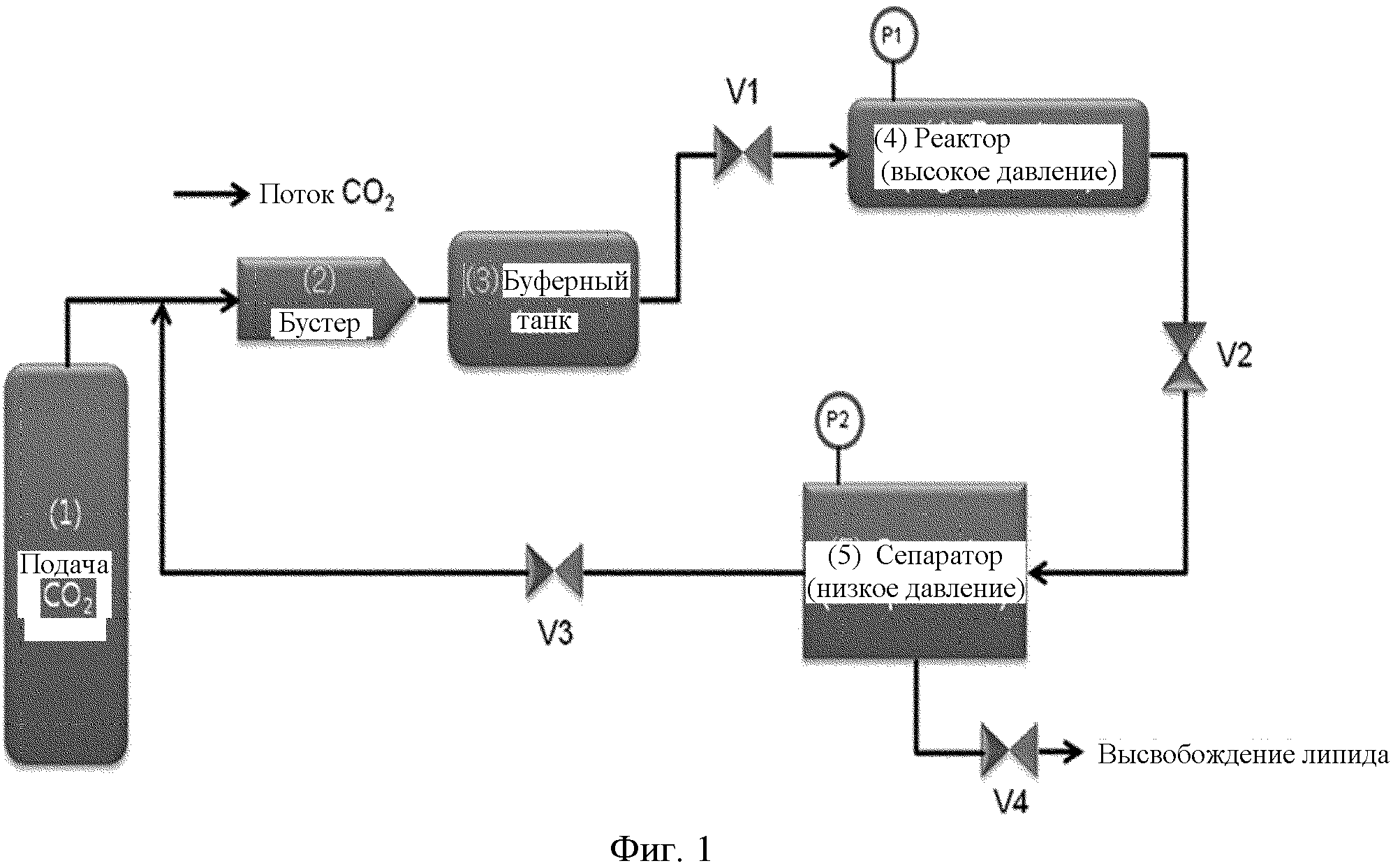
На фиг.1 схематически показан способ получения наночастиц оксалиплатина с использованием сверхкритического сжиженного газа.
На фиг.2 представлено изображение, сделанное с помощью SEM (сканирующего электронного микроскопа), наночастиц оксалиплатина, полученных в Примере 5.
На фиг.3 представлено изображение, сделанное с помощью SEM, наночастиц оксалиплатина, полученных в Примере 5.
На фиг.4 представлено изображение, сделанное с помощью SEM порошка оксалиплатина.
На фиг.5 представлено изображение, сделанное с помощью SEM, наночастиц оксалиплатина, полученных в Примере 6.
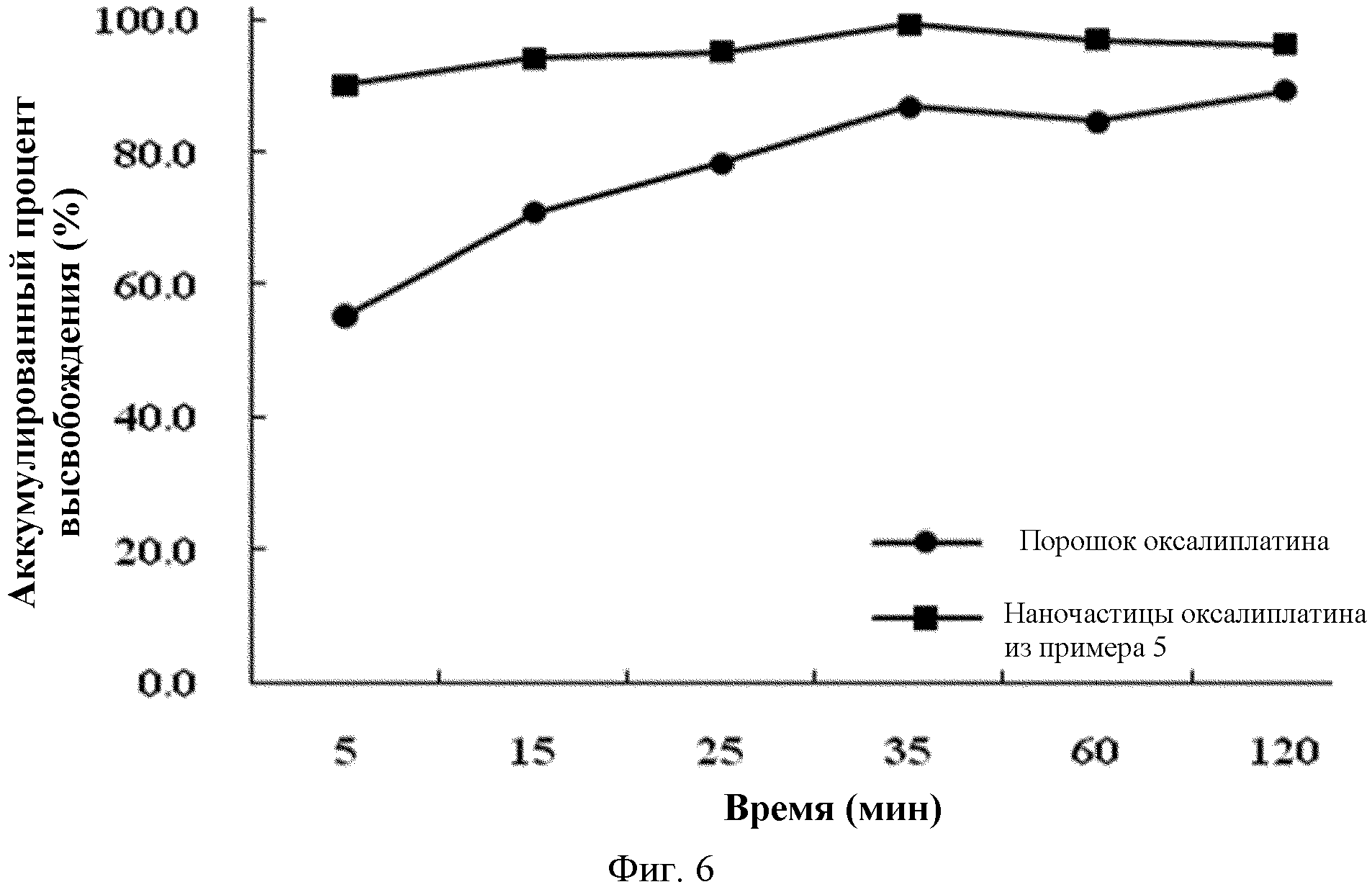
На фиг.6 показаны результаты сравнения растворимости наночастиц оксалиплатина, полученных в Примере 5, с растворимостью порошка оксалиплатина в разные моменты времени в ацетатном буфере USP (Фармакопея США), pH 4,0.
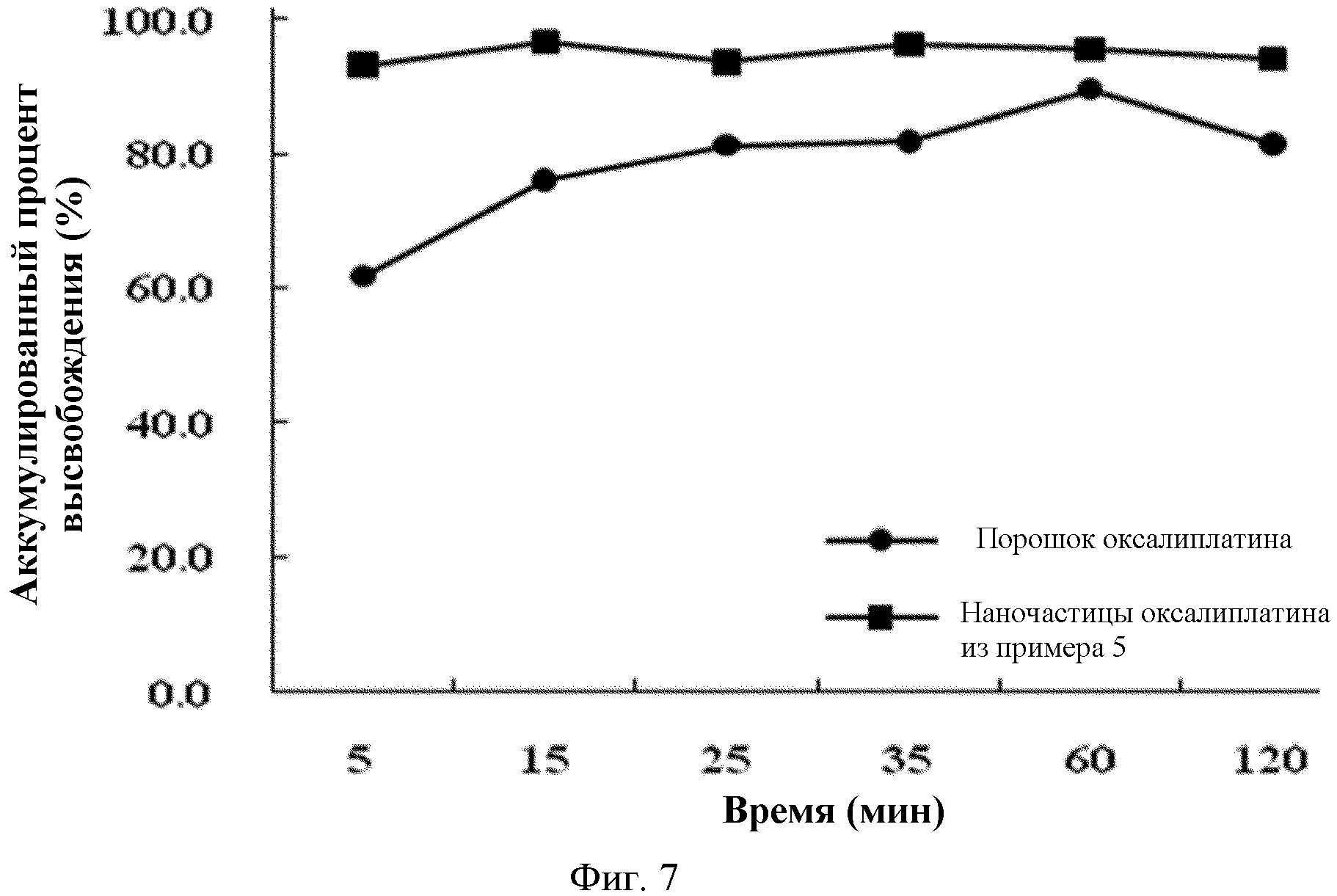
На фиг.7 показаны результаты сравнения растворимости наночастиц оксалиплатина, полученных в Примере 5, с растворимостью порошка оксалиплатина в разные моменты времени в фосфатном буфере USP pH 6.8.
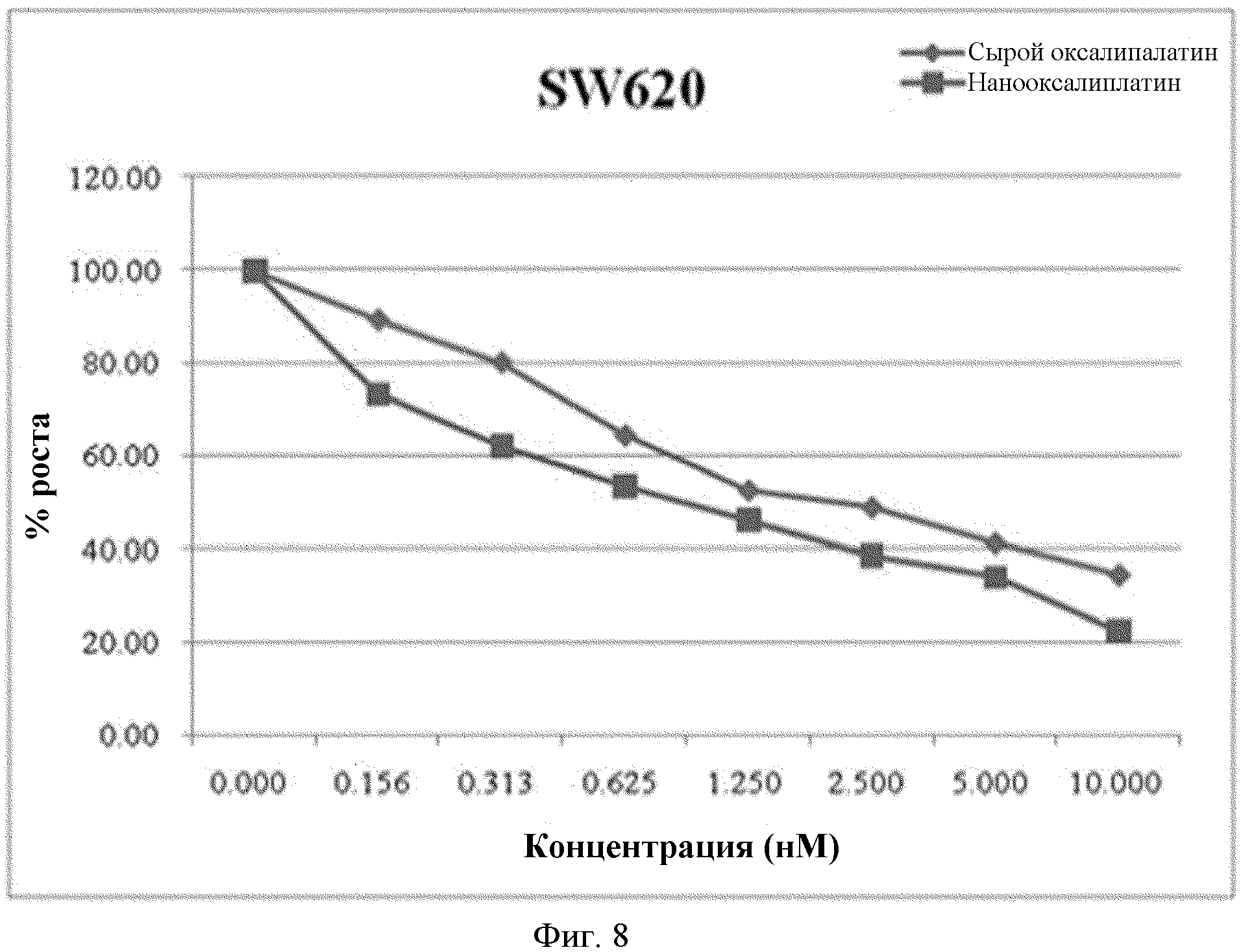
На фиг.8 показаны результаты сравнения значений GI50 для порошка оксалиплатина и наночастиц, для клеток SW620.
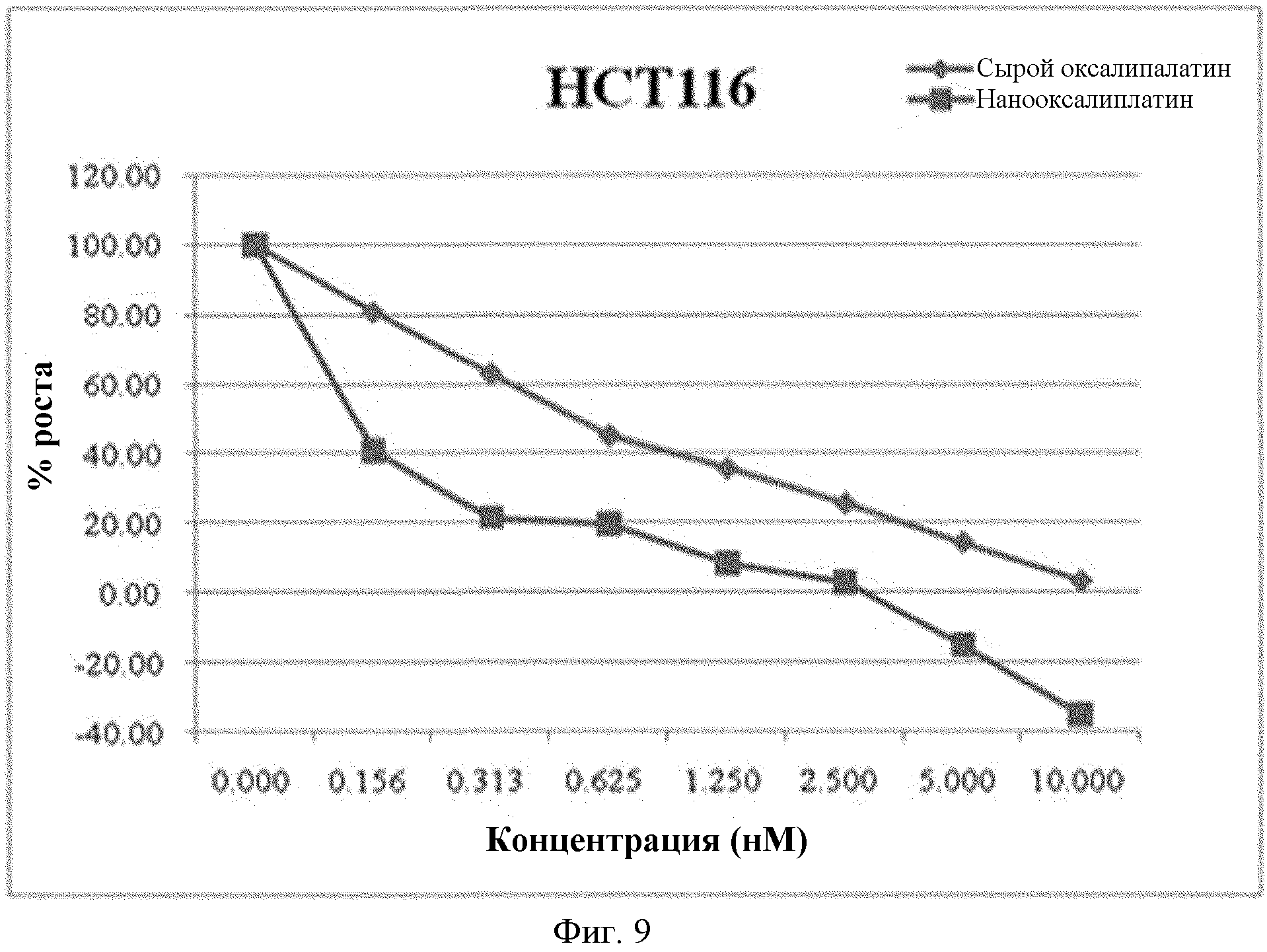
На фиг.9 показаны результаты сравнения значений GI50 для порошка оксалиплатина и наночастиц, для клеток HCT116.
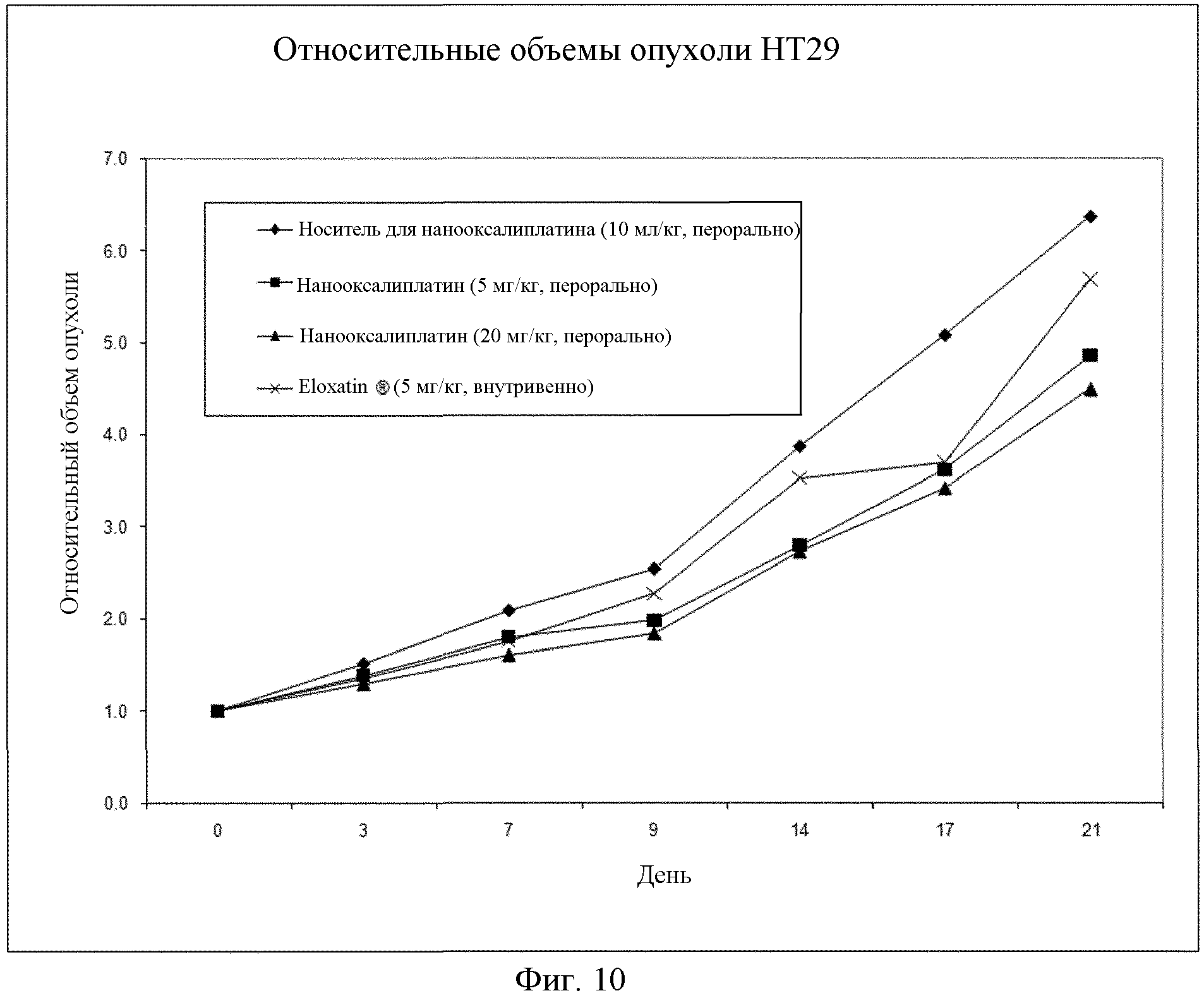
На фиг.10 показаны результаты сравнения относительного объема опухоли после перорального введения наночастиц оксалиплатина, полученных в Примере 5, или инъекции Eloxatin несущим опухоли голым мышам.
Наилучший способ осуществления
Настоящее изобретение относится к наночастицам оксалиплатина, который представляет собой водорастворимое активное вещество. Наночастицы получают с помощью способа, включающего: (1) растворение оксалиплатина в сорастворителе, который представляет собой воду, диметилсульфоксид (ДМСО) или их смесь, с получением водного раствора смеси; (2) смешивание твердых липидов с поверхностно-активным веществом с получением липидного раствора смеси; (3) добавление липидного раствора смеси к водному раствору смеси с получением эмульсии, а затем ее охлаждение и сушку с получением твердого продукта; и (4) добавление твердого продукта в реактор, где давление повышается выше сверхкритических условий посредством добавления сверхкритического сжиженного газа, и удаление твердых липидов и сорастворителя с использованием сверхкритического сжиженного газа, с получением наночастиц оксалиплатина.
Ниже каждая стадия способа получения наночастиц в соответствии с настоящим изобретением будет описываться подробно.
Сначала оксалиплатин, который представляет собой водорастворимое активное вещество, растворяется в сорастворителе, с получением водного раствора смеси. Это делается потому, что водорастворимое активное вещество не может растворяться в достаточной степени с помощью твердых липидов, используемых в настоящем изобретении. Сорастворитель может представлять собой воду, диметилсульфоксид (ДМСО) или их смесь. Сорастворитель в достаточной степени растворяет оксалиплатин, поскольку он является сильно полярным в отличие от повсеместно используемых спиртов и предотвращает нахождение остатков газообразного CO2 в композиции благодаря высокой растворимости в сверхкритических условиях.
При растворении оксалиплатина в сорастворителе, может дополнительно добавляться антикоагулянт для предотвращения агрегации наночастиц. Антикоагулянт может представлять собой моносахарид, полисахарид, пищевое волокно, смолу, белок, или что-либо подобное. Более конкретно, могут использоваться маннитол, сахароза, лактоза, глюкоза, трегалоза, глицерол, фруктоза, мальтоза, декстран, полиэтиленгликоль, глицин, аланин, лизин и тому подобное. Наиболее конкретно, может использоваться маннитол. Антикоагулянт может использоваться в количестве 10-100 частей массовых, более конкретно, 20-60 частей массовых, на 100 частей массовых оксалиплатина.
Затем твердый липид смешивается с поверхностно-активным веществом, с получением липидного раствора смеси.
Твердые липиды могут представлять собой липиды, которые находятся в твердой фазе при комнатной температуре, легко плавятся при нагреве, имея относительно низкую температуру плавления 30-100°C, так что они могут действовать в качестве растворителя для активного вещества и имеют высокую растворимость для сверхкритического флюида. Например, твердые липиды могут выбираться из группы, состоящей из C10-C22 спирта, насыщенной жирной кислоты и ее сложного эфира, моно- или диглицеридного соединения, имеющего группу C10-C22 жирной кислоты, C16 или более тяжелого углеводорода и восстановленного соединения жирной кислоты C10-C22 триглицеридного соединения. Конкретно, может использоваться C10-C22 спирт. Более конкретно, может использоваться C12-C15 спирт.
Поверхностно-активное вещество, используемое в настоящем изобретении, должно представлять собой такое вещество, способное к предотвращению агрегации оксалиплатина, которое, будучи хорошо растворенным с помощью твердых липидов, облегчает контроль размеров наночастиц с тем, чтобы эмульсификация осуществлялась соответствующим образом, и при этом не является таким, которое легко удаляется с помощью сверхкритического флюида. Конкретно, могут использоваться гелюцир, солютол, полоксамер или что-либо подобное. Будучи сильнодействующим, поверхностно-активное вещество делает возможным получение мелких и однородных наночастиц оксалиплатина.
Оксалиплатин и поверхностно-активное вещество вводятся при массовом отношении 1:0,1-2,0, более конкретно, при 1:0,5-1,5. Когда количество поверхностно-активного вещества меньше чем указанный выше диапазон, стабильность эмульсии может деградировать. А когда количество превышает указанные выше диапазоны, наночастицы могут не образовываться из-за агрегации с поверхностно-активным веществом.
Липидный раствор смеси добавляется к водному раствору смеси, с получением эмульсии. Конкретно, при медленном добавлении липидного раствора смеси с получением эмульсии, осуществляют нагрев при 40-100°C, более конкретно, при 50-80°C, так, что твердые липиды могут служить в качестве растворителя для водорастворимого активного вещества. Для получения наночастиц оксалиплатина в виде мелких и однородных наночастиц с размером 300 нм или меньше, процесс эмульсификации является очень важным. Когда к раствору липидной смеси добавляют раствор водной смеси, эмульсификации не происходит, поскольку происходит разделение фаз. Таким образом, липидный раствор смеси должен добавляться к водному раствору смеси медленно, при нагреве. Конкретно, когда раствор водной смеси содержит 1 г оксалиплатина, липидный раствор смеси может добавляться при скорости 50-100 г/мин.
Затем эмульсию охлаждают и сушат с получением твердого продукта. Когда отверждение происходит при комнатной температуре посредством самопроизвольного охлаждения, наночастицы не могут быть получены из-за увеличения размеров частиц. По этой причине эмульсию быстро охлаждают до 20-30°C за 10-60 секунд, а затем сушат при этой температуре.
Полученный твердый продукт добавляют в реактор сверхкритического экстрактора и, после добавления сверхкритического сжиженного газа, давление повышают выше сверхкритических условий. Конкретно, твердый продукт может распыляться. Распыление может осуществляться в соответствии со способом, известным в данной области. После распыления, полученные частицы имеют меньший размер и более высокую площадь поверхности, облегчая, таким образом, удаление твердого липида.
Сверхкритический сжиженный газ относится к инертному газу, который может стать сверхкритическим флюидом при конкретной температуре и давлении, то есть, при сверхкритической температуре и сверхкритическом давлении, к такому как газообразный диоксид углерода или азот.
После того, как сверхкритический сжиженный газ медленно добавляется в реактор, давление повышается выше сверхкритических условий. Давление внутри реактора, как правило, может контролироваться в пределах между 50 и 200 атм, хотя давление определяется в соответствии с размером реактора и количеством смеси. Температура внутри реактора поддерживается ниже температуры плавления твердых липидов, конкретно при 10-40°C. Когда температура реактора внутри реактора является слишком высокой, поверхностно-активное вещество расплавляется и, как следствие, активное вещество и антикоагулянт, которые однородно распределены в смеси, подвергаются воздействию роста кристаллов. В результате, однородные наночастицы не могут быть получены. После повышения давления внутри реактора выше того давления, где сверхкритический сжиженный газ становится сверхкритическим флюидом или подкритической жидкостью, реактор может вращаться для того, чтобы сверхкритический флюид или подкритическая жидкость могла в достаточной степени проникать в твердый продукт.
На фиг.1 показан иллюстративный способ получения наночастиц оксалиплатина с использованием сверхкритического сжиженного газа. Способ осуществляется в основном в трех частях, то есть, в буферном танке (1-3) для сверхкритического флюида (CO2), в реакторе (4) и в сепараторе (5). Сначала твердый продукт распыляется и добавляется в реактор. Затем реактор вращается, и в это время сверхкритический флюид подается в реактор из буферного танка для сверхкритического флюида. Впоследствии, сверхкритический флюид циркулирует для удаления твердых липидов и сорастворителя, при этом давление внутри реактора контролируется в пределах между 50 и 200 атм. Из-за разности давлений твердые липиды и сорастворитель растворяются в сверхкритическом флюиде и собираются с помощью сепаратора, а смесь наночастиц оксалиплатина и поверхностно-активного вещества остается в реакторе.
Наночастицы оксалиплатина, полученные с помощью этого способа, имеют размер 10-1000 нм, конкретно, 10-500 нм, более конкретно, 10-300 нм.
Имея зета-потенциал от -30 до -70 мВ, когда они диспергированы в сорастворителе, наночастицы оксалиплатина могут быть стабилизированы без агрегации между частицами. Зета-потенциал представляет собой электрический потенциал снаружи частицы и является мерой электростатического взаимодействия между индивидуальными частицами, означая стабильность дисперсии, в особенности, суспензии, в которой диспергированы частицы. Дисперсия может поддерживаться стабильной с помощью имеющегося зета-потенциала, поскольку частицы сильно отталкиваются друг от друга. Однако, когда абсолютное значение зета-потенциала меньше, чем указанный выше диапазон, частицы могут агрегировать под действием Ван-дер-Ваальсовых сил, из-за слабого отталкивания между частицами.
Настоящее изобретение дополнительно предусматривает фармацевтическую композицию, содержащую наночастицы оксалиплатина.
После удаления твердых липидов и сорастворителя, получается композиция, в которой смешаны наночастицы оксалиплатина и поверхностно-активное вещество. Композиция содержит наночастицы оксалиплатина и поверхностно-активное вещество при массовом отношении 1:0,1-2,0, конкретно, 1:0,5-1,5, без отклонения от начально добавляемого количества.
Фармацевтическая композиция может быть получена в виде препарата для перорального введения посредством дополнительного введения одного или нескольких вспомогательных веществ, выбранных из наполнителя, связующего вещества, разрыхлителя и смазывающего материала. Конкретно, она может быть получена в виде таблетки, суспензии, капсулы или чего-либо подобного.
Наполнитель может выбираться из лактозы, микрокристаллической целлюлозы, низкозамещенной гидроксипропилцеллюлозы, кукурузного крахмала, картофельного крахмала, пшеничного крахмала, белого сахара, D-маннитола, преципитировавшего карбоната кальция, декстрина или предварительно желатинизированного крахмала. Связующее вещество может представлять собой поливинилпирролидон, гидроксипропилцеллюлозу, декстрин, желатин, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиметилцеллюлозу, поливиниловый спирт, аравийскую пасту или смолу. Разрыхлитель может представлять собой натрий гликоляткрахмал, кроссповидон, натрий кросскармелозу, низкозамещенную гидроксипропилцеллюлозу, крахмал или кальций карбоксиметилцеллюлозу. Смазывающий материал может представлять собой коллоидный диоксид кремния, стеарат магния, тальк, безводный силикат или что-либо подобное.
Способ осуществления изобретения
Теперь будут описываться примеры и эксперименты. Следующие далее примеры и эксперименты предназначаются только для иллюстративных целей и не предназначены для ограничения рамок настоящего изобретения.
Пример 1
Оксалиплатин (1 г) полностью растворяют в диметилсульфоксиде (25 г) при 70°C, с получением водного раствора смеси. Отдельно от этого, полоксамер (0,5 г) полностью растворяют в твердом липиде, миристиловом спирте (60 г) в течение 5 минут, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше с использованием гомогенизатора, так что происходит эмульсификация при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C, с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и диметилсульфоксид полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 1,5 г композиции, содержащей наночастицы оксалиплатина со средним размером частиц 300 нм или меньше.
Пример 2
Оксалиплатин (1 г) полностью растворяют в диметилсульфоксиде (25 г) при 70°C, с получением водного раствора смеси. Отдельно от этого, солютол (0,2 г) полностью растворяют в твердом липиде, миристиловом спирте (60 г) при 70°C в течение 5 минут, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше с использованием гомогенизатора, так что происходит эмульсификация при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C, с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и диметилсульфоксид полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 1,2 г композиции, содержащей наночастицы оксалиплатина со средним размером частиц 300 нм или меньше.
Пример 3
Оксалиплатин (1 г) и маннитол (0,4 г) полностью растворяют в очищенной воде (90 г) при 70°C, с получением водного раствора смеси. Отдельно от этого, Gelucire 44/14 (1 г) полностью растворяют в твердом липиде, миристиловом спирте (90 г) при 70°C в течение 5 минут, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше, с использованием гомогенизатора, так что эмульсификация происходит при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и очищенная вода полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 2,4 г композиции, содержащей наночастицы оксалиплатина со средним размером частиц 300 нм или меньше.
Пример 4
Оксалиплатин (1 г) и маннитол (0,4 г) полностью растворяют в очищенной воде (90 г) при 70°C, с получением водного раствора смеси. Отдельно от этого, солютол (1 г) полностью растворяют в твердом липиде, миристиловом спирте (90 г) при 70°C, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше, с использованием гомогенизатора, так что эмульсификация происходит при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и очищенная вода полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 2,4 г композиции, содержащей наночастицы оксалиплатина со средним размером частиц 300 нм или меньше.
Пример 5
Оксалиплатин (1 г) и маннитол (0,4 г) полностью растворяют в очищенной воде (90 г) при 70°C, с получением водного раствора смеси. Отдельно от этого, полоксамер (1 г) полностью растворяют в твердом липиде, миристиловом спирте (90 г) при 70°C в течение 5 минут, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше, с использованием гомогенизатора, так что эмульсификация происходит при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C, с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и очищенная вода полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 2,4 г композиции, содержащей наночастицы оксалиплатина со средним размером частиц 300 нм или меньше.
Пример 6
Оксалиплатин (1 г) полностью растворяется в диметилсульфоксиде (25 г) при 70°C с получением водного раствора смеси. Отдельно от этого, полоксамер (3,0 г) полностью растворяют в твердом липиде, миристиловом спирте (90 г) в течение 5 минут, с получением липидного раствора смеси. Липидный раствор смеси медленно добавляют к водному раствору смеси, при этом медленно перемешивая при 10,000 об/мин или выше, с использованием гомогенизатора, так что эмульсификация происходит при 80°C. Полученную таким образом эмульсию быстро охлаждают до 25°C, с получением твердого продукта, при этом оксалиплатин однородно распределяется в липиде в виде мелкодисперсных частиц, которые затем распыляются с использованием пульверизатора. Распыленный твердый продукт добавляют в реактор сверхкритического экстрактора, и реактор вращается, при этом подается газообразный CO2. Твердый липид, миристиловый спирт и диметилсульфоксид полностью удаляются посредством циркуляции CO2, при этом давление внутри реактора поддерживается при 70 атм или выше. Наконец, получают 4,0 г композиции, содержащей наночастицы оксалиплатина.
Пример исследования 1: Измерение распределения размеров частиц и зета-потенциала наночастиц оксалиплатина
Наночастицы оксалиплатина (5 г), полученные в указанных выше примерах полностью диспергируют в безводном этаноле (10 мл) и распределение размеров частиц измеряют с использованием анализатора размеров частиц (Otsuka, ELS-Z). Результат приводится в Таблице 1.
|
Как видно из Таблицы 1, могут быть получены частицы со средним размером частиц 300 нм или меньше. Необходимо отметить, что полученные наночастицы имеют узкое распределение размеров частиц.
Для исследования стабильности наночастиц оксалиплатина, когда они диспергированы в растворителе, измеряют зета-потенциал в коллоидном состоянии с использованием ELS-8000 (Otsuka). Результат приводится в Таблице 2.
|
Как правило, известно, что агрегации или кристаллизации частиц не происходит, когда зета-потенциал составляет примерно -30 мВ. Поскольку наночастицы оксалиплатина по настоящему изобретению демонстрируют зета-потенциал в пределах примерно от -35 и примерно до -60 мВ, они показывают превосходную электростатическую стабильность в растворе.
Пример исследования 2: Измерение наночастиц оксалиплатина с помощью SEM
Размер и форму частиц для наночастиц оксалиплатина, полученных в Примере 5, наблюдают с использованием сканирующего электронного микроскопа (S-4700N, Hitachi). Результаты показаны на фиг.2 и 3. Для сравнения, изображение, полученное с помощью SEM, порошка оксалиплатина, используемого в качестве источника материала, показано на фиг.4.
Как видно из фиг.2 и 3, наночастицы оксалиплатина из Примера 5 имеют однородный размер частиц в нано-диапазоне.
Фиг.5 показывает полученное с помощью SEM изображение частиц оксалиплатина, полученных в Примере 6. Можно увидеть, что из-за избытка поверхностно-активного вещества, наночастицы агрегируют, в результате получается размер частиц больший, чем 50 мкм. Соответственно, подтверждается, что контроль содержания поверхностно-активного вещества является необходимым для получения стабильных наночастиц с однородным распределением размеров.
Пример исследования 3: Измерение растворимости наночастиц оксалиплатина
Наночастицы оксалиплатина (12 мг), полученные в Примере 5, диспергируют в USP ацетатном буфере, 50 мл, pH 4,0, и в фосфатном буфере, pH 6,8, соответственно, при 25°C. Затем, после отбора 1 мл образца в различные моменты времени, с последующим центрифугированием в течение 15 минут при 3500 об/мин, осуществляют анализ с помощью ВЭЖХ (Agilent 1200 series, Hewlett Packard, USA).
Условия для ВЭЖХ:
Колонка Capcell Pak C18, скорость потока 1,1 мл/мин, длина волны детектирования 210 нм.
Подвижная фаза: pH 3,0, фосфорная кислота/ацетонитрил = 99/1 (объем/объем).
Для сравнения, измеряют также концентрацию для порошка оксалиплатина (5 мг) в различные моменты времени, как описано выше. Результаты показаны на фиг.6 и 7.
Как видно из фиг.6 и 7, наночастицы оксалиплатина по настоящему изобретению показывают растворимость, близкую к 90%, через 5 минут, в то время как порошок оксалиплатин демонстрирует минимальную растворимость через 2 часа. Улучшение растворимости достигается благодаря увеличению площади поверхности наночастиц, и оно делает возможным более легкое приготовление препарата для перорального введения, такого как суспензия.
Пример исследования 4: Анализ жизнеспособности клеток
Клетки SW620 и HCT116 (ATCC CCL-227, USA) высеивают в 96-луночный планшет при 5×103 клетки/50 мкл на каждую лунку. Через 4 часа клетки обрабатывают частицами оксалиплатин из Примера 5 или порошком оксалиплатина при 10 мМ. После инкубирования при 37°C в течение 72 часов, клетки обрабатывают с помощью 100 мкл реагента CellTiter-Glo (CellTiter-Glo®, Promega, Cat. # G7573). Затем, после лизирования клеток в орбитальном шейкере в течение 2 минут, с последующей стабилизацией в течение 10 минут, измеряют люминесценцию с использованием люминометра (Envision, PerkinElmer).
Вычисляют значение GI50 из результатов измерения люминесценции. Противораковая активность порошка оксалиплатина и наночастиц при различных концентрациях показана на фиг.8 и 9.
Как видно из фиг.8 и 9, значение GI50 для порошка оксалиплатина, для клеток SW620 и HCT116, составляет 2,22 мкм и 0,55 мкм, соответственно, в то время как для наночастиц оксалиплатина это значение составляет только 0,92 мкм и 0,13 мкм. То есть, так сказать, наночастицы оксалиплатина демонстрируют примерно в 2,4 и 4,2 раза лучшую противораковую активность по отношению к клеткам рака толстой кишки.
Пример исследования 5: Сравнение противораковой активности in vivo
Клетки рака толстой кишки человека HT-29 смешивают с PBS при концентрации примерно при 7×107 клетки/мл и вводят 0,1 мл смеси голым мышам в виде подкожной инъекции. Когда площадь опухоли достигнет 5 см2, начинают введение исследуемого соединения.
Голых мышей, несущих опухоль, разделяют на 4 группы, которым вводят 0,5% натрий карбоксиметилцеллюлозу (10 мл/кг), наночастицы оксалиплатина из Примера 5 (5 мг/кг или 20 мг/кг) или Eloxatin (5 мг/кг). Натрий карбоксиметилцеллюлозу и наночастицы оксалиплатина вводят перорально каждый день в течение 20 дней, а Eloxatin вводят как внутривенную инъекцию раз в неделю, 3 раза каждой. Объем опухоли измеряют через 21 день, и результаты приводятся в Таблице 3. Результаты сравнения относительного объема опухоли в различные моменты времени показаны на фиг.10. Объем опухоли вычисляют как (W2×L)/2, где W представляет собой ширину и L представляет собой длину опухоли.
|
Как видно из Таблицы 3 и фиг.10, подтверждается, что наночастицы оксалиплатина по настоящему изобретению могут демонстрировать сравнимое или лучшее противораковое воздействие, когда вводится перорально, по сравнению с Eloxatin вводимым посредством инъекции.
Пример препарата 1: Суспензия
Наночастицы оксалиплатина из Примера 5 (10 г) просеивают (35 меш) и добавляют к очищенной воде (20 мл), содержащей натрий карбоксиметилцеллюлозу (100 мг), с получением суспензии.
Пример препарата 2: Таблетка
Наночастицы оксалиплатина из Примера 5 (12 г) просеивают (35 меш) и смешивают с кроссповидоном (3 г), лактозой (18,35 г) и поливинилпирролидоном (0,9 г). После смазки стеаратом магния (0,45 г) и коллоидным диоксидом кремния (0,3 г) в течение 5 минут, продукт прессуют в виде таблетки.
Пример препарата 3: Таблетка
Наночастицы оксалиплатина из Примера 5 (6 г) просеивают (35 меш) и смешивают с кросповидоном (3 г), лактозой (24,35 г) и поливинилпирролидоном (0,9 г). После смазки стеаратом магния (0,45 г) и коллоидным диоксидом кремния (0,3 г) в течение 5 минут, продукт прессуют в виде таблетки.
Пример препарата 4: Капсула
Наночастицы оксалиплатина Примера 5 (12 г) просеивают (35 меш) и смешивают с кросповидоном (1 г). После смазки стеаратом магния (0,1 г), полученную смесь заполняют в твердую желатиновую капсулу.
Сравнительный пример: Таблетка
Порошок оксалиплатина (5 г) просеивают (35 меш) и смешивают с полоксамером (5 г), маннитолом (2 г), кросповидоном (3 г), лактозой (18,35 г) и поливинилпирролидоном (0,9 г). После смазки стеаратом магния (0,45 г) и коллоидным диоксидом кремния (0,3 г) в течение 5 минут, продукт прессуют в виде таблетки.
Пример исследования 6: Измерение фармакокинетических параметров наночастиц оксалиплатина
Таблетки и суспензию, полученные в Примерах получения 1-3 и Сравнительном примере, вводят перорально крысам Sprague-Dawley (SD) при дозировке 10 мг/кг. Кровь отбирают через 5, 10, 15 и 30 минут и 1, 2, 4, 7 и 24 часов после введения, и анализируют концентрацию платины в крови для измерения фармакокинетических параметров. Среди фармакокинетических параметров, определяют биологическую доступность по сравнению с доступностью вводимого внутривенно в виде инъекции контрольного вещества Eloxatin (5 мг/кг) как 100.
|
Как видно из Таблицы 4, когда наночастицы оксалиплатина, полученные в соответствии с настоящим изобретением, вводятся в виде таблетки или суспензии, максимальная концентрация в сыворотке, AUC и биологическая доступность значительно улучшаются по сравнению с введением порошка оксалиплатина в виде внутривенной инъекции. Соответственно, можно увидеть, что наночастицы в соответствии с настоящим изобретением могут значительно увеличить биологическую доступность лекарственного средства.