ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1
Вид РИД
Изобретение
Настоящее изобретение относится к соединениям, которые пригодны в качестве ингибиторов активности киназы Wee-1. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и к способам применения указанных соединений при лечении онкологических заболеваний и к способам лечения онкологических заболеваний.
Уровень техники
Каждый день клетки непрерывно подвергаются испытаниям, в результате чего в ДНК возникают многочисленные повреждения. Если не осуществлять их репарацию, то повреждения могут привести к мутации или гибели клеток, поэтому существует сложная сеть сигнализации, которая обеспечивает обнаружение повреждений и их репарацию, с целью сохранения целостности ДНК.
Обнаружение повреждения ДНК инициирует ряд событий, которые являются ключевыми для поддержания генома. Контрольные точки клеточного цикла предназначены для того, чтобы остановить клеточный цикл и позволить осуществить репарацию повреждения, прежде чем клетка сможет продолжить митоз.
Идентифицированы две ключевые контрольные точки, одна в конце фазы G1 и вторая в G2, которые работают в тандеме и тем самым гарантируют, что все повреждения выявлены и осуществлена их репарация. В 50% онкологических заболеваниях человека контрольная точка G1 не функционируют вследствие мутаций в гене-супрессоре опухолей р53. Однако контрольная точка G2 редко подвергается мутации и часто активирована в раковых клетках. Раковые клетки используют это обстоятельство, чтобы приобрести устойчивость к способам лечения, включая повреждающие ДНК агенты и радиоактивное излучение.
В качестве ключевых регуляторов контрольной точки G2 идентифицированы три киназы, а именно Chk1, Chk2 и Wee-1. Ингибиторы указанных киназ проходят в настоящее время клинические испытания.
Wee-1 представляет собой ядерную тирозинкиназу, которая замедляет вступление в митоз в контрольной точке G2/M путем катализа фосфорилирования cdc2/комплекс циклин В - киназа. Фосфорилирование происходит по остатку тирозина 15, приводит к инактивации cdc2/комплекс циклин В - киназа, в конечном счете препятствуя митозу. Функция Wee-1 тесно связана с функциями Chk1 и Chk2 благодаря их фосфорилированию и инактивации cdc25 по серину 216, а также описанной активации Wee-1 посредством Chk1 & 2 (Ashwell et al., 2012, DNA Repair in Cancer Therapy, DOI: 10.1016/B978-0-12-384999-1.10010-1).
Wee-1 располагается ниже семейства Chk и является ключевым компонентом сигнального каскада контрольной точки, поскольку препятствует вступлению клетки в митоз, если обнаружены повреждения.
Обычно назначаемые противораковые соединения вызывают повреждение ДНК; в том числе, антиметаболиты, соединения платины, ингибиторы топоизомеразы и алкилирующие агенты. Тем не менее, их эффективность ограничена вследствие чрезмерной токсичности, стойкости и отсутствия селективности по отношению к опухоли. Могли бы оказаться чрезвычайно полезными соединения, которые работают в сочетании с указанными агентами, избирательно предотвращая репарацию ДНК в опухолевых клетках. Ген-супрессор опухолей р53 обычно подвергается мутации в опухолевых клеточных линиях, поэтому введение ингибитора киназы Wee-1, который нейтрализует контрольную точку G2, может привести к повышению чувствительности ДНК к действию повреждающих агентов. Потенциальная возможность этого описана, и подавление активности Wee-1 достаточно для повышения чувствительности клеток HeLa к доксорубицину, благодаря блокированию G2. Напротив, в обычном эпителии молочной железы, который имеет полностью комплементный р53, удаление функции Wee-1 оказывает незначительное дополнительное воздействие, по сравнению с одним лишь доксорубицином (Wang et al., 2004, Cancer Biology and Therapy, 3(3), 305-313).
Сообщалось, что клеточные линии, укрывающие мутации в гене-супрессоре опухолей р53, обладают повышенной чувствительностью к повреждающим ДНК агентам при их совместном введении с низкомолекулярными ингибиторами Wee-1. Имеются сообщения об in vitro и in vivo эффективности низкомолекулярных ингибиторов в сочетании с гемцитабином, 5-фторурацилом, карбоплатином, цисплатином (Hirai et al., 2010, Cancer Biology & Therapy 9:7, 514-522), цитарабином (Tibes et al., 2012, Blood, 119(12), 2863-2872) и ингибиторами Src (Cozzi et al., 2012, Cell Cycle 11(5), 1-11). Об апоптотической эффективности отдельных агентов, независимо от статуса p53, сообщалось для линии клеток саркомы и полученных у пациентов образцов саркомы (Kreahling et al., 2012, Mol. Cancer Ther., 11(1), 174-182).
Как известно, облучение усиливает фосфорилирование остатков Tyr15 и Thr14 в cdc2, что приводит к радиорезистентному фенотипу. Подавление активности Wee-1 низкомолекулярными соединениями (Wang et al., 2004, Cancer Biology and Therapy 3(3), 305-313) приводит к снижению фосфорилирования и эффекта радиосенсибилизации, при этом указанный эффект более выражен в мутантных по р53 клеточных линиях.
Соединения, оказывающие ингибирующее воздействие на киназу, например, обладающие ингибирующим действием на киназу Wee-1, описаны в WO 2007/126122, US 2010/0063024, ЕР 2213673, WO 2008/133866 и US 2007/0254892.
WO 2010/067886, WO 2010/067888, US 2011/0135601, ЕР 2168966, WO 2005/090344, US 2009/0048277 и Bioorg. Med. Chem. Lett 2005, 15, 1931-1935 описывают различные соединения, такие как производные дигидропиримидопиримидина и пиридопиримидинона, оказывающие ингибирующее действие на киназы. В частности, указывается, что соединения, раскрытые в WO 2005/090344, проявляют активность в качестве ингибиторов протеинкиназы, в частности, в качестве ингибиторов семейства тирозинкиназ Src. Указывается, что соединения, описанные в Bioorg. Med. Chem. Lett. 2005, 15, 1931-1935, являются в 10-100 раз более действенными ингибиторами с-Src, чем Wee-1, и изменение заместителей в 6-фенильном цикле не существенно изменяет этот параметр. Указывается, что солюбилизирующие заместители за пределами 2-анилинового цикла во многих случаях увеличивают активность Wee-1, снижая указанное предпочтение приблизительно в 10 раз. Сообщается, что 5-алкилзамещенные аналоги, как правило, селективны по отношению к Wee-1, но за счет абсолютной эффективности.
В WO 2013/013031 описываются [4,5-d]пиримидин(6H)-оновые ингибиторы Wee-1 киназы, которые, как указывается, пригодны для ингибирования киназ, таких как Wee-1, и для использования в способах лечения таких заболеваний как рак. Соединения, раскрытые в WO 2013/013031, имеют атом азота в ‘3-позиции’ цикла по отношению к карбонильной группе.
В US 2013/0018045 описываются различные трициклические 2-сульфонамидные соединений, которые пригодны для ингибирования киназ, таких как Wee-1, и в способах лечения таких заболеваний как рак. Соединения, раскрытые US 2013/0018045, имеют сульфонамидную группу в ‘1-позиции’ цикла, а атомы в ‘3-позиции’ и '4-позиции’ составляют часть конденсированного арильного или гетероарильного цикла (A).
Одной целью настоящего изобретения является преодоление, по меньшей мере, некоторых недостатков предшествующего уровня техники с тем, чтобы найти им коммерчески пригодные альтернативы.
Кроме того, целью настоящего изобретения является получение соединения, обладающего лучшей селективностью по отношению к киназе Wee-1, по сравнению с известными соединениями или композициями.
Еще одной целью настоящего изобретения является получение соединения, обладающего лучшей стабильностью в микросомах человека, например, микросомах печени человека, по сравнению с известными соединениями или композициями.
Еще одной целью настоящего изобретения является получение соединения, обладающего повышенным или аналогичным ингибирующим действием на киназы, по сравнению с известными соединениями или композициями.
Еще одной целью настоящего изобретения является получение соединения, обладающего повышенной эффективностью, по сравнению с известными соединениями или композициями.
Еще одной целью настоящего изобретения является получение соединения, имеющего улучшенную эффективность и переносимость при введении в комбинации с другими способами лечения, по сравнению с известными соединениями или композициями.
Еще одной целью настоящего изобретения является получение соединения, обладающего лучшей переносимостью, по сравнению с известными соединениями или композициями.
Сущность изобретения
В соответствии с первым аспектом, в настоящем изобретении предлагается соединение формулы (I):
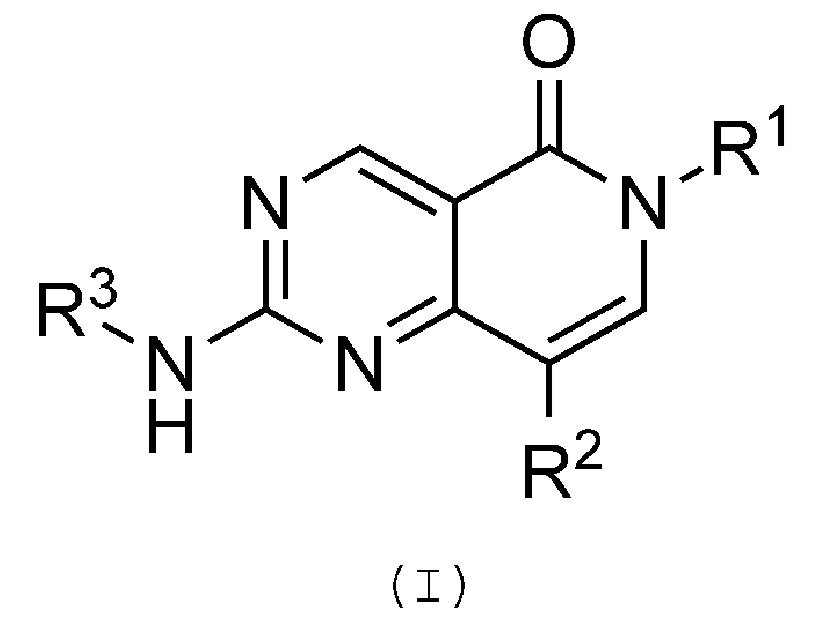
или его фармацевтически приемлемая соль, или его N-оксидное производное, где:
R1 обозначает необязательно замещенную арильную или гетероарильную группу;
R2 обозначает атом водорода, галогенсодержащую группу, цианогруппу или необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, гетероциклильную, амино или амидную группу;
R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную или гетероциклильную группу.
Каждый аспект или вариант осуществления настоящего изобретения, как указано в данном описании, может быть объединен с любым(и) другим(и) аспектом(ами) или вариантом(ами), если явно не указано иное. В частности, любой признак, указанный как предпочтительный или преимущественный, может быть объединен с любым другим признаком или признаками, указанными как предпочтительные или преимущественные.
В соответствии со вторым аспектом, в настоящем изобретении предлагается фармацевтическая композиция, содержащая соединение формулы (I), или его фармацевтически приемлемую соль, или его N-оксидное производное и, по крайней мере, один фармацевтически приемлемый наполнитель.
В соответствии с третьим аспектом, в настоящем изобретении предлагается соединение формулы (I), или его фармацевтически приемлемая соль, или его N-оксидное производное или фармацевтическая композиция, содержащая соединение формулы (I), для применения в терапии.
В соответствии с четвертым аспектом, в настоящем изобретении предлагается соединение формулы (I) для применения в качестве лекарственного средства.
В соответствии с пятым аспектом, в настоящем изобретении предлагается соединение формулы (I) для применения при лечении или предупреждении онкологического заболевания.
В соответствии с шестым аспектом, в настоящем изобретении предлагается соединение формулы (I) для изготовления лекарственного средства, предназначенного для лечения или предупреждения онкологического заболевания.
В соответствии с седьмым аспектом, в настоящем изобретении предлагается применение соединения формулы (I) для изготовления лекарственного средства, предназначенного для лечения или предупреждения онкологического заболевания.
В соответствии с восьмым аспектом, в настоящем изобретении предлагается способ лечения или предупреждения онкологического заболевания у пациента-человека или пациента-животного, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы (I) или фармацевтической композиции, содержащей соединение формулы (I).
Другие предпочтительные варианты соединений по настоящему изобретению приведены в описании и, в частности, в примерах. Наиболее предпочтительными являются такие соединения, которые по результатам испытаний обладают большей активностью. Соединения, проявляющие более высокую активность, более предпочтительны, по сравнению с теми, которые проявляют более низкую активность.
Авторы настоящего изобретения неожиданно обнаружили, что соединения по настоящему изобретению обладают лучшей селективностью по отношению к киназе Wee-1. В частности, соединения по настоящему изобретению, предпочтительно, селективны по отношению к членам семейства киназ Src, например, LCK (лимфоцит-специфичные белковые тирозинкиназы) и c-Src. Неожиданно оказалось, что соединения по настоящему изобретению показывают также бóльшую селективность, чем некоторые соединения, описанные в Bioorg. Med. Chem. Lett., 2005, 15, 1931-1935 (см примеры), и соединения, описанные в WO 2013/013031 и US 2013/0018045.
Авторы настоящего изобретения неожиданно обнаружили, что соединения по настоящему изобретению также демонстрируют сниженное или сопоставимое ингибирование hERG, улучшенную стабильность в микросомах печени человека или обладают сниженной или сопоставимой CVS токсичностью, по сравнению с ингибиторами киназы, известными из предшествующего уровня техники.
Не желая связывать себя какой-либо теорией, авторы настоящего изобретения полагают, что соединения по настоящему изобретению обладают лучшей селективностью, по сравнению с другими нецелевыми киназами, по крайней мере, частично, вследствие положения карбонильной группы (C=O), как показано в формуле (I), т.е. карбонильной группы, соседствующей с атомом азота, к которому присоединен заместитель R1.
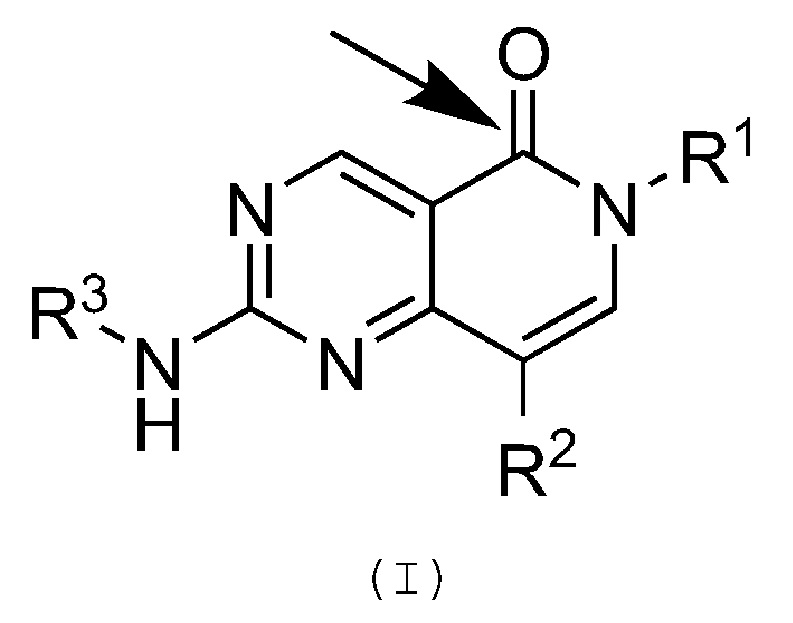
Дальнейшие факторы, которые приводят в улучшенной селективности, по сравнению с другими нецелевыми киназами, а также к улучшенной активности по отношению к hERG, улучшенной стабильности в микросомах печени человека и сниженной CVS токсичности, включают структурное сходство между карбонильной группой (C=O), N-R1 группой в ‘2-позиции’ цикла, С-Н в ‘3-позиции’ и группы С-R2 в '4-позиции’.
Например, неожиданно было обнаружено, что типичные соединения по настоящему изобретению обладают пониженной ингибирующей способностью по отношению к hERG и CVS токсичностью, по сравнению с эквивалентными соединениями, раскрытыми в WO 2013/013031, которые имеют атом азота в ‘3-позиции’ цикла:
|
Авторы настоящего изобретения неожиданно обнаружили, что соединения по настоящему изобретению обладают улучшенным или сходным ингибирующим эффектом по отношению к киназам, по сравнению с известными соединениями или композициями. В частности, соединения по настоящему изобретению, предпочтительно, обладают лучшим или сходным ингибирующим эффектом по отношению к киназе Wee-1, по сравнению с известными соединениями или композициями.
Соединения по настоящему изобретению, предпочтительно, обладают улучшенной стабильностью в микросомах человека, например, микросомах печени человека, и/или улучшенной переносимостью и/или сниженным ингибирующим действием по отношению к hERG и меньшей CVS токсичностью, по сравнению с известными соединениями или композициями.
Подробное описание изобретения
Если в данном описании не указано иное, научные и технические термины, используемые в настоящем изобретении, имеют значения, которые, как правило, понятны специалистам в данной области техники. Значение и объем охвата терминов должны быть ясными, однако в случае неясности, обусловленной лежащими вне данного документа обстоятельствами, приведенные в данном описании определения имеют приоритет перед любым приведенным в словарях или находящимся вне данного описания определением.
В данном описании и прилагаемой формуле изобретения, если не указано иное, следующие термины имеют указанные ниже значения:
Термин "алкильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает насыщенный углеводородный заместитель с линейной или разветвленной цепью, как правило, содержащий от 1 до 15 атомов углерода, например, от 1 до 10, от 1 до 8, от 1 до 6 или от 1 до 4 атомов углерода. Группа "Сn-алкил" относится к алифатической группе, содержащей n углеродных атомов. Например, C1-C10 алкильная группа содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода. Присоединение алкильной группы осуществляется посредством атома углерода. Примеры подобных заместителей включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил (разветвленный или неразветвленный), гексил (разветвленный или неразветвленный), гептил (разветвленный или неразветвленный), октил (разветвленный или неразветвленный), нонил (разветвленный или неразветвленный) и децил (разветвленный или неразветвленный).
Термин "алкенильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает углеводородный заместитель с линейной или разветвленной цепью, содержащий одну или несколько двойных связей и, как правило, от 2 до 15 атомов углерода; например, от 2 до 10, от 2 до 8, от 2 до 6 или от 2 до 4 атомов углерода. Примеры подобных заместителей включают этенил (винил), 2-пропенил, 3-пропенил, 1,4-пентадиенил, 1,4-бутадиенил, 1-бутенил, 2-бутенил, 3-бутенил, пентенил и гексенил.
Термин "алкинильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает углеводородный заместитель с линейной или разветвленной цепью, содержащий одну или несколько тройных связей и обычно от 2 до 15 атомов углерода; например, от 2 до 10, от 2 до 8, от 2 до 6 или от 2 до 4 атомов углерода. Примеры подобных заместителей включают этинил, 2-пропинил, 3-пропинил, 2-бутинил и 3-бутинил.
Термин "карбоциклильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает насыщенный циклический (т.е. "циклоалкил"), частично насыщенный циклический (т.е. "циклоалкенил") или полностью ненасыщенный (т.е. "арил") углеводородный заместитель, содержащий в цикле от 3 до 14 кольцевых атомов углерода ("кольцевые атомы" представляют собой атомы, связанные друг с другом с образованием цикла или циклов циклического заместителя). Карбоциклил может иметь структуру с единственным циклом (моноциклический карбоцикл) или полициклическую кольцевую структуру. Карбоциклил может иметь структуру с единственным циклом, который обычно содержит от 3 до 8 кольцевых атомов, более типично, от 3 до 6 кольцевых атомов и еще более типично, от 5 до 6 атомов в цикле. Примеры подобных карбоциклилов с единственным циклом включают циклопропил (циклопропанил), циклобутил (циклобутанил), циклопентил (циклопентанил), циклопентенил, циклопентадиенил, циклогексил (циклогексанил), циклогексенил, циклогексадиенил и фенил. В качестве альтернативы, карбоциклил может быть полициклическими (например, может содержать более одного цикла). Примеры полициклических карбоциклилов включают мостиковые, конденсированные и спироциклические карбоциклилы. В спироциклическом карбоциклиле один атом является общим для двух разных циклов. Примером спироциклического карбоциклила является спиропентанил. В мостиковом карбоциклиле циклы связаны, по крайней мере, двумя общими несмежными атомами. Примеры мостиковых карбоциклилов включают бицикло[2.2.1]гептанил, бицикло[2.2.1]гепт-2-енил и адамантанил. В карбоциклической системе с конденсированными циклами, два или несколько циклов могут быть конденсированы друг с другом таким образом, что два цикла имеют одну общую связь. Примеры карбоциклилов с двумя или тремя конденсированными циклами включают нафталинил, тетрагидронафталинил (тетралинил), инденил, инданил (дигидроинденил), антраценил, фенантренил и декалинил.
Термин "циклоалкильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает насыщенный циклический углеводородный заместитель, содержащий от 3 до 14 атомов углерода в цикле. Циклоалкил может иметь один углеродный цикл, который обычно содержит от 3 до 8 кольцевых атомов углерода и более типично от 3 до 6 кольцевых атомов. Должно быть понятно, что присоединение циклоалкильной группы осуществляется посредством кольцевого атома циклоалкильной группы. Примеры циклоалкилов с одним циклом включают циклопропил, циклобутил, циклопентил и циклогексил. В качестве альтернативы, циклоалкил может быть полициклическим или содержать больше, чем один цикл. Примеры полициклических циклоалкилов включают мостиковые, конденсированные и спироциклические карбоциклилы.
Термин "арильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает ароматический карбоцикл, содержащий от 6 до 14 кольцевых атомов углерода или от 3 до 8, от 3 до 6 или от 5 до 6 кольцевых атомов углерода. Арил может быть моноциклическим или полициклическим (т.е. может иметь больше одного цикла). В случае полициклических ароматических циклов лишь один цикл полициклической системе должен быть ненасыщенным, в то время как остальные циклы могут быть насыщенными, частично насыщенными или ненасыщенными. Присоединение арильной группе осуществляется посредством атома углерода, содержащегося в цикле. Примеры арильных групп включают фенил, нафтил, акридинил, тиенил, инденил, инданил и тетрагидронафтил.
Термин "гетероциклильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) обозначает насыщенную (т.е. "гетероциклоалкил"), частично насыщенную (т.е. "гетероциклоалкенил") или полностью ненасыщенную (т.е. "гетероарил") циклическую структуру, содержащую в общей сложности от 3 до 14 кольцевых атомов, где, по меньшей мере, один из кольцевых атомов представляет собой гетероатом (например, атом кислорода, азота или серы), а остальные кольцевые атомы представляют собой атомы углерода. Гетероциклильная группа может, например, содержать один, два, три, четыре или пять гетероатомов. Присоединение гетероциклильной группы может осуществляться либо посредством атома углерода и/или посредством одного или нескольких гетероатомов, которые содержатся в цикле. Гетероциклил может представлять собой циклическую структуру с единственным циклом (моноциклическую структуру) или полициклическую структуру.
Гетероциклильная группа может иметь единственный цикл, который обычно содержит от 3 до 7 кольцевых атомов, более типично от 3 до 6 кольцевых атомов и еще более типично от 5 до 6 кольцевых атомов. Примеры гетероциклилов с одним циклом включают фуранил, дигидрофуранил, тетрагидрофуранил, тиофенил (тиофуранил), дигидротиофенил, тетрагидротиофенил, пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, оксазолил, оксазолидинил, изоксазолидинил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, тиодиазолил, оксадиазолил (в том числе 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил (фуразанил) или 1,3,4-оксадиазолил, оксатриазолил (в том числе 1,2,3,4-оксатриазолил или 1,2,3,5-оксатриазолил), диоксазолил (в том числе 1,2,3-диоксазолил, 1,2,4-диоксазолил, 1,3,2-диоксазолил или 1,3,4-диоксазолил), оксатиазолил, оксатиолил, оксатиоланил, пиранил, дигидропиранил, тиопиранил, тетрагидротиопиранил, пиридинил (азинил), пиперидинил, диазинил (в том числе пиридазинил (1,2-диазинил), пиримидинил (1,3-диазинил) или пиразинил (1,4-диазинил)), пиперазинил, триазинил (в том числе 1,3,5-триазинил, 1,2,4-триазинил и 1,2,3-триазинил), оксазинил (в том числе 1,2-оксазинил, 1,3-оксазинил или 1,4-оксазинил), оксатиазинил (в том числе 1,2,3-оксатиазинил, 1,2,4-оксатиазинил, 1,2,5-оксатиазинил или 1,2,6-оксатиазинил), оксадиазинил (в том числе 1,2,3-оксадиазинил, 1,2,4-оксадиазинил, 1,4,2-оксадиазинил или 1,3,5-оксадиазинил), морфолинил, азепинил, оксепинил, тиепинил и диазепинил.
В качестве альтернативы, гетероциклильная группа может быть полициклической (например, может содержать более одного цикла). Примеры полициклических гетероциклильных групп включают мостиковые, конденсированные и спироциклические гетероциклические группы. В спироциклической гетероциклильной группе один атом является общим для двух разных циклов. В мостиковой гетероциклильной группе циклы связаны, по крайней мере, двумя общими несмежными атомами. В гетероциклильной группе с конденсированным циклом два или несколько циклов могут быть конденсированы друг с другом таким образом, что два цикла имеют одну общую связь. Примеры гетероциклильных групп с конденсированным циклом, имеющих два или три цикла, включают индолизинил, пиранопирролил, 4H-хинолизинил, пуринил, нафтиридинил, пиридопиридинил (в том числе пиридо[3,4-b]пиридинил, пиридо[3,2-b]пиридинил или пиридо[4,3-b]пиридинил) и птеридинил). Другие примеры гетероциклильных групп с конденсированным циклом включают бензо-конденсированные гетероциклильные группы, такие как индолил, изоиндолил (изобензазолил, псевдоизоиндолил), индоленинил (псевдоиндолил), изоиндазолил (бензпиразолил), бензазинил (в том числе хинолинил (1-бензазинил) или изохинолинил (2-бензазинил)), фталазинил, хиноксалинил, хиназолинил, бензодиазинил (в том числе циннолинил (1,2-бензодиазинил) или хиназолинил (1,3-бензодиазинил)), бензопиранил (в том числе хроманил или изохроманил), бензоксазинил (в том числе 1,3,2-бензоксазинил, 1,4,2-бензоксазинил, 2,3,1-бензоксазинил или 3,1,4-бензоксазинил) и бензизоксазинил (в том числе 1,2-бензизоксазинил или 1,4-бензизоксазинил).
Термин "гетероциклоалкильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает насыщенный гетероциклил.
Термин "гетероарильная группа" (сам по себе или в сочетании с другим(и) термином(ами)) означает ароматический гетероциклил, содержащий от 5 до 14 кольцевых атомов. Гетероарил может иметь единственный цикл, или 2, или 3 конденсированных цикла. Примеры гетероарильных заместителей включают 6-членные циклические заместители, такие как пиридил, пиразил, пиримидинил, пиридазинил и 1,3,5-, 1,2,4- или 1,2,3-триазинил; 5-членные циклические заместители, такие как имидазил, фуранил, тиофенил, пиразолил, оксазолил, изоксазолил, тиазолил, 1,2,3-, 1,2,4-, 1,2,5- или 1,3,4-оксадиазолил и изотиазолил; 6/5-членные конденсированные циклические заместители, такие как бензотиофуранил, бензизоксазолил, бензоксазолил, пуринил, и антралинил; и 6/6-членные конденсированные циклы, такие как бензопиранил, хинолинил, изохинолинил, циннолинил, хиназолинил и бензоксазинил.
Термин "азотсодержащая гетероциклильная группа" относится к моноциклической или бициклической гетероциклильной группе, содержащей, по крайней мере, один атом азота, в которой каждый цикл содержит от 3 до 7 кольцевых атомов и необязательно содержит, помимо атома азота, ноль, или один, или два, или больше одинаковых или различных гетероатомов, но предпочтительно ноль или один гетероатом, выбранный из группы, которая включает атом кислорода, атом азота и атом серы; и гетероциклильная группа может быть насыщенной (т.е. представлять собой "гетероциклоалкил"), частично насыщенной (т.е. представлять собой "гетероциклоалкенил") или полностью ненасыщенной (т.е. представлять собой "гетероарил"). Бициклическая гетероциклильная группа может иметь спироструктуру, в которой два цикла делят между собой один и тот же кольцевой атом, или может иметь бициклоструктуру, в которой циклы имеют два или больше общих кольцевых атомов. Примеры азотсодержащей гетероциклильной группы включают, например, пирролильную группу, имидазолильную группу, пиразолильную группу, тиазолильную группу, изотиазолильную группу, оксазолильную группу, изоксазолильную группу, триазолильную группу, тетразолильную группу, оксадиазолильную группу, 1,2,3-тиадиазолильную группу, 1,2,4-тиадиазолильную группу, 1,3,4-тиадиазолильную группу, пиридильную группу, пиразинильную группу, пиримидинильную группу, пиридазинильную группу, 1,2,4-триазинильную группу, 1,3,5-триазинильную группу, индолильную группу, бензимидазолильную группу, бензоксазолильную группу, бензизоксазолильную группу, бензотиазолильную группу, бензизотиазолильную группу, индазолильную группу, пуринильную группу, хинолильную группу, изохинолильную группу, фталазинильную группу, нафтиридинильную группу, хиноксалинильную группу, хиназолинильную группу, циннолинильную группу, птеридинильную группу, пиридо[3,2-b]пиридильную группу, азетидинильную группу, пирролидинильную группу, дигидро-1,2,4-триазолильную группу, дигидро-1,2,4-оксадиазолильную группу, дигидро-1,3,4-оксадиазолильную группу, дигидро-1,2,4-тиадиазолильную группу, дигидро-1,2,3,5-оксатиадиазолильную группу, пиперидинильную группу, пиперазинильную группу, дигидропиридильную группу, морфолинильную группу, тиоморфолинильную группу, 2,6-диазаспиро[3.5]нонильную группу, 2,7-диазаспиро[3.5]нонильную группу, 2,7-диазаспиро[4.5]децильную группу или 2,7-диазабицикло[3.3.0]октильную группу, 3,6-диазабицикло[3.3.0]октильную группу.
Азотсодержащая гетероциклильная группа необязательно может быть замещена ("замещенная азотсодержащая гетероциклильная группа") одним или несколькими заместителями, которые могут быть одинаковыми или разными.
Термин "аминогруппа" относится к группе -NH2. Аминогруппа может быть необязательно замещена ("замещенная аминогруппа") одним или несколькими заместителями, которые могут быть одинаковыми или разными. Заместителями в аминогруппе могут быть, однако этим не ограничиваясь, алкильная, алкенильная, арильная, алканоильная и/или гетероциклильная группа.
Термин "амидная группа" относится к группе -C(=O)-NR-. Присоединение может осуществляться посредством атома углерода и/или атома азота. Например, амидная группа может быть присоединена в качестве заместителя только через атом углерода, и в этом случае две группы R присоединены к атому азота (-C(=O)-NR2). Амидная группа может быть присоединена только по атому азота, и в этом случае одна группа R присоединена к атому углерода (-NR-C(=O)R).
Термин "алкокси группа" относится к группе алкил-O. Алкокси группа может относиться к линейной, разветвленной или циклической, насыщенной или ненасыщенной оксо-углеводородной цепи, в том числе, например, к метоксилу, этоксилу, пропоксилу, изопропоксилу, бутоксилу, трет-бутоксилу и пентоксилу. Алкокси группа необязательно может быть замещена ("замещенная алкокси группа") одним или несколькими заместителями алкокси группы.
Термин "гидроксил" относится к группе -ОН.
Термин "алканоильная группа" (например, ацильная группа) относится к группе органической кислоты, в которой -ОН карбоксильной группы замещен другим заместителем. Таким образом, алканоильную группу можно представить формулой RC(=O)-, где R включает, однако этим не ограничиваясь, алкильную, аралкильную или арильную группу, которая, в свою очередь, может быть замещена одним или несколькими заместителями. Примеры алканоильных групп включают ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валерильную группу, изовалерильную группу и пивалоильную группу.
Термин "сульфонильная группа" относится к группе сульфоновой кислоты, в которой -ОН сульфонильной группы замещен другим заместителем. Например, заместителем может быть алкильная группа ("алкилсульфонильная группа"). Алкилсульфонильную группу можно представить формулой RS(O)2-, где R обозначает алкильную группу, необязательно замещенную одним или несколькими заместителями. Примеры алкилсульфонильных групп включают метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу, бутилсульфонильную группу, втор-бутилсульфонильную группу, изобутилсульфонильную группу, трет-бутилсульфонильную группу, пентилсульфонильную группу, изопентилсульфонильную группу, гексилсульфонильную группу и изогексилсульфонильную группу.
Термин "сульфинильная группа" относится к двухвалентной группе -S(=O).
Термин "оксо группа" относится к группе (=O), т.е. атом кислорода заместителя присоединен к другому атому посредством двойной связи.
Термин "галогенсодержащая группа" относится к группе, выбранной из атома хлора, атома фтора, атома брома и атома иода.
Алкил-, алкенил-, алкинил-, амино-, амидо-, карбоциклил- (в том числе циклоалкил, циклоалкенил и арил), гетероциклил- (в том числе гетероциклоалкил, гетероциклоалкенил и гетероарил), сульфонил-, сульфинил- и азотсодержащая гетероциклильная группа необязательно может быть замещена одним или несколькими заместителями, которые могут быть одинаковыми или разными. Заместитель может быть присоединен через атом углерода и/или гетероатом в алкил-, алкенил-, алкинил-, амино-, амидо-, карбоциклил-, гетероциклил- или азотсодержащей гетероциклильной группе. Термин "заместитель" (или "радикал") включает, однако этим не ограничиваясь, алкил, замещенный алкил, аралкил, замещенный аралкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, атом галогена, циано, амино, амидо, алкиламино, ариламино, карбоциклил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, нитро, тио, алканоил, гидроксил, арилоксил, алкоксил, алкилтио, арилтио, аралкилоксил, аралкилтио, карбоксил, алкоксикарбонил, оксо, алкилсульфонил и арилсульфонил. Если группа, например, алкильная группа, "необязательно замещена", то следует понимать, что указанная группа имеет один или несколько присоединенных заместителей (замещена) или не имеет никаких присоединенных заместителей (не замещена).
Для полноты, следует также отметить, что некоторые химические формулы, используемые в данном описании, определяют делокализованные системы. Это определение известно в данной области как определение ароматичности и может указывать на наличие, например, моно-, ди- или трициклической системы, которая содержит (4n+2) электронов, где n является целым числом. Другими словами, эти системы могут отображать ароматичность по Хюккелю.
В соответствии с любым из аспектов, соединения по настоящему изобретению могут обладать некоторыми стереохимическими особенностями. Например, соединения могут иметь хиральные центры и/или плоскости и/или оси симметрии. Таким образом, указанные соединения могут быть получены в виде отдельных стереоизомеров, отдельных диастереомеров, смесей стереоизомеров или в виде рацемических смесей. Стереоизомеры известны из данной области техники как молекулы, которые имеют одну и ту же молекулярную формулу и последовательность связанных атомов, но различаются пространственной ориентацией своих атомов и/или групп.
Кроме того, соединения по настоящему изобретению могут обладать таутомерией. Следует понимать, что каждая таутомерная форма входит в объем настоящего изобретения.
Кроме того, соединения по настоящему изобретению могут быть приготовлены в виде пролекарства. Пролекарства трансформируются, как правило, в условиях in vivo из одной формы в активные формы препаратов, приведенных в данном описании. Например, пролекарство может быть образовано путем защиты группы -NH, к которой присоединен заместитель R3 со способной гидролизоваться группой, которая дает -NH при гидролизе.
В качестве альтернативы или дополнительно, любая группа -NH в соединении может быть защищена в виде физиологически гидролизуемого амида.
Кроме того, следует понимать, что элементы, указанные в данном описании, могут представлять собой обычный изотоп или быть изотопом, отличным от обычного изотопа. Например, атом водорода может представлять собой 1H, 2H (дейтерий) или 3H (тритий).
Кроме того, соединения по настоящему изобретению могут быть получены в виде их фармацевтически приемлемых солей или сокристаллов. Например, могут быть получены соединения, имеющие протонированные аминогруппы.
Термин "фармацевтически приемлемая соль" относится к ионным соединениям, образованным добавлением кислоты к основанию. Указанный термин относится к таким солям, которые считаются в данной области техники пригодными для использования в контакте с пациентом, например, в условиях in vivo, и фармацевтически приемлемые соли, как правило, выбираются благодаря их нетоксичным и не раздражающим свойствам.
Термин "сокристалл" относится к многокомпонентному молекулярному кристаллу, который может включать неионные взаимодействия.
Фармацевтически приемлемые соли и сокристаллы могут быть получены с помощью ионообменной хроматографии или путем взаимодействия свободного основания или кислотной формы соединения со стехиометрическими количествами или с избытком требуемой солеобразующей неорганической или органической кислоты или требуемого основания в одном или нескольких подходящих растворителях, или путем смешивания соединения с другим фармацевтически приемлемым соединением, способным образовывать сокристалл.
Соли, известные в данной области техники как в общем случае пригодные для использования в контакте с пациентом, включают соли, полученные из неорганических и/или органических кислот, в том числе гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат и тартрат. Они могут включать катионы щелочных и щелочноземельных металлов, таких как натрий, калий, кальций и магний, а также аммоний, тетраметиламмоний, тетраэтиламмоний. Далее делается ссылка на ряд литературных источников, в которых приводится обзор подходящих фармацевтически приемлемых солей, например, Handbook of pharmaceutical salts, опубликованный Международным союзом теоретической и прикладной химии.
Кроме того, соединения по настоящему изобретению могут иногда существовать как цвиттерионы, которые считаются частью настоящего изобретения.
Авторы настоящего изобретения обнаружили, что соединения по настоящему изобретению пригодны для лечения заболеваний, связанных с неупорядоченным ростом клеток, в том числе, однако этим не ограничиваясь, онкологических заболеваний, в частности, онкологических заболеваний, связанных с мутациями в гене-супрессоре опухолей р53.
Например, онкологические заболевания включают онкологические заболевания сердца, онкологические заболевания легких, онкологические заболевания желудочно-кишечного тракта, онкологические заболевания мочеполовой системы, онкологические заболевания печени, онкологические заболевания костей, онкологические заболевания нервной системы, гинекологические онкологические заболевания, гематологические онкологические заболевания, онкологические заболевания кожи и онкологические заболевания надпочечников.
Например, онкологические заболевания включают рак надпочечников, желчных протоков, мочевого пузыря, рак крови, рак костной и соединительной ткани, рак мозга и центральной нервной системы, рак груди, шейки матки, толстой и прямой кишки (колоректальный рак), эндометрия, пищевода, желчного пузыря, головы и шеи, лимфому Ходжкина, гипоглоточные онкологические заболевания, онкологические заболевания почек, гортани, лейкозы, опухоли печени, легких, лимфому, медиастинальные опухоли, меланому (злокачественную меланому), мезотелиому, множественную миелому, опухоли носовой полости, носоглотки, нейроэндокринные опухоли, неходжкинскую лимфому, опухоли ротовой полости, пищевода, ротоглотки, рак яичников, поджелудочной железы, придаточных пазух носа, опухоли паращитовидной железы, пениса, опухоли гипофиза, предстательной железы, слюнных желез, саркому, рак кожи, позвоночника, желудка, яичек, щитовидной железы, уретры, матки, влагалища и вульвы.
Соединения по настоящему изобретению также пригодны для получения лекарственного средства, которое пригодно при лечении вышеуказанных заболеваний, в частности, онкологического заболевания.
Настоящее изобретение также относится к способу ингибирования активности Wee-1, который включает введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по настоящему изобретению.
Соединения по настоящему изобретению могут назначаться млекопитающим, включая человека, либо по сами по себе, либо в сочетании с фармацевтически приемлемыми носителями, наполнителями или разбавителями, в составе фармацевтической композиции, в соответствии со стандартной фармацевтической практикой. Соединения могут быть введены перорально или парентерально, в том числе могут назначаться внутривенного, внутримышечного, внутрибрюшинного, подкожного, ректального и местно.
В объем настоящего изобретение также входит применение соединений по настоящему изобретению в комбинации со вторым или другими лекарственными средствами при лечении онкологического заболевания. Второй или другие лекарственные средства могут представлять собой препарат, который уже известен в данной области техники для лечения онкологического заболевания.
Настоящее изобретение также включает применение соединений по настоящему изобретению в схеме лечения, включающей этап лучевой терапии. Лучевая терапии может представлять собой обычный метод лечения с использованием облучения рентгеновскими лучами, гамма-лучами, пучком нейтронов, протонов или электронов. Совместное введение соединений, входящих в данное изобретение, может привести к усилению действия лучевой терапии, и таким образом указанные соединения можно классифицировать как радиосенсибилизирующие вещества.
В частности, онкологические заболевания часто приобретают резистентность к методам лечения. Развитие резистентности может быть отсрочено или преодолено путем введения комбинации препаратов, которая включает соединения по настоящему изобретению, например, в случае онкологических заболеваниях, которые, как известно, устойчивы к действию повреждающих ДНК агентов или к лучевой терапии.
Например, препараты, которые могут быть использованы в комбинации с соединениями по настоящему изобретению, могут быть нацелены на тот же самый или сходный биологический путь, на который нацеливаются соединения по настоящему изобретению, или могут действовать по другому или не связанному каскаду реакций.
В зависимости от подлежащего лечению заболевания, различные комбинации компонентов могут быть введены совместно с соединениями по настоящему изобретению. Второй активный ингредиент может включать, однако этим не ограничиваясь, алкилирующие агенты, в том числе циклофосфамид, ифосфамид, тиотепу, мелфалан, хлорэтилнитрозомочевину и бендамустин; производные платины, в том числе цисплатин, оксалиплатин, карбоплатин и сатраплатин; антимитотические агенты, в том числе алкалоиды барвинка (винкристин, винорелбин и винбластин), таксаны (паклитаксел, доцетаксел), эпотилоны и ингибиторы митотических киназ, включая киназы aurora и polo; ингибиторы топоизомеразы, в том числе антрациклины, эпиподофиллотоксины, камптотецин и аналоги камптотецина; антиметаболиты, в том числе 5-фторурацил, капецитабин, цитарабин, гемцитабин, 6-меркаптопурин, 6-тиогуанин, флударабин, метотрексат и преметрексед; ингибиторы протеинкиназы, в том числе иматиниб, гефитиниб, сорафениб, сунитиниб, эрлотиниб, дазатиниб и дапатиниб; протеосомальные ингибиторы, в том числе бортезомиб; ингибиторы гистондеацетилазы, в том числе вальпроат и SAHA; антиангиогенные препараты, в том числе бевацизумаб; моноклональные антитела, в том числе трастузумаб, ритуксимаб, алемтузумаб, тозитумомаб, цетуксимаб, панитумумаб; конъюгаты моноклональных антител, в том числе гемтузумаб, озогамицин, ибритумомаб, тиуксетан; гормональные методы лечения, в том числе антиэстрогены (тамоксифен, ралоксифен, анастразол, летрозол, экзаметастан), антиандрогены (флутамид, бикалутамид) и аналоги или антагонисты лютеинизирующего гормона.
Что касается комбинированной терапии, то соединения по настоящему изобретению могут вводиться раздельно, последовательно, одновременно, совместно или могут быть хронологически разделены одним или несколькими стандартными терапевтическими методами, такими как любой из указанных выше методов.
Предпочтительно, в настоящем изобретении предлагается соединение формулы (I):
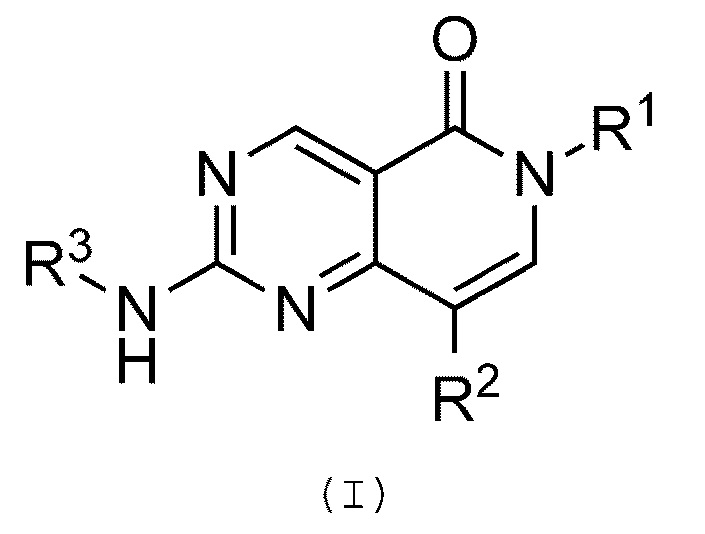
или его фармацевтически приемлемая соль, или его N-оксидное производное, где:
R1 обозначает необязательно замещенную арильную или гетероарильную группу;
R2 обозначает атом водорода, галогенсодержащую группу, цианогруппу или необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, гетероциклильную, амино или амидную группу;
R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную или гетероциклильную группу.
Предпочтительно, R1 обозначает группу, представленную формулой (а) или (h):
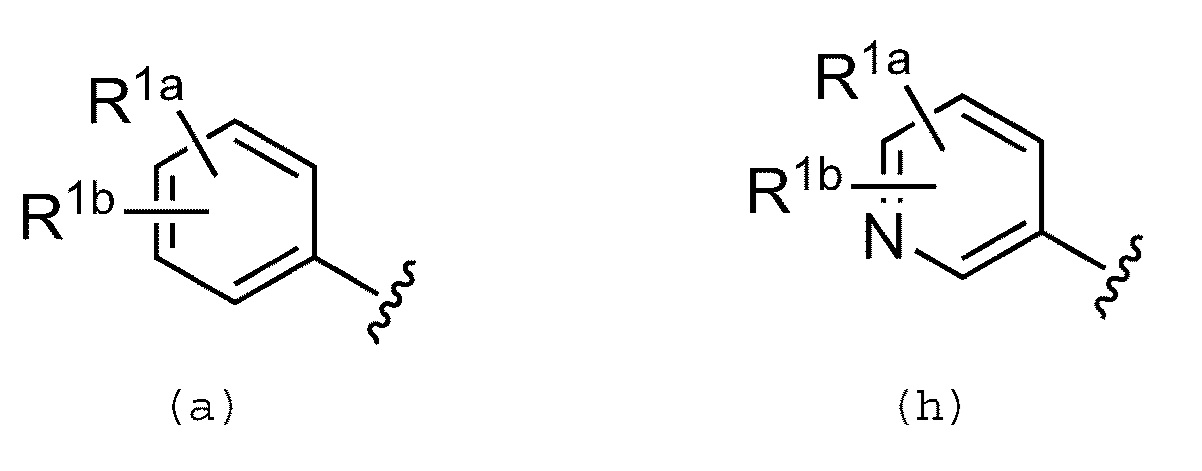
где каждый из заместителей R1a и R1b независимо выбран из группы, включающей атом водорода, галогенсодержащую группу, гидроксильную группу, цианогруппу, аминогруппу, С1-С6 алкильную группу, С2-С6 алкенильную группу, С1-С6 алкокси группу и С1-С6 алкокси-С1-С6 алкильную группу.
Предпочтительно, R1 обозначает группу, представленную формулой (b) или (i):
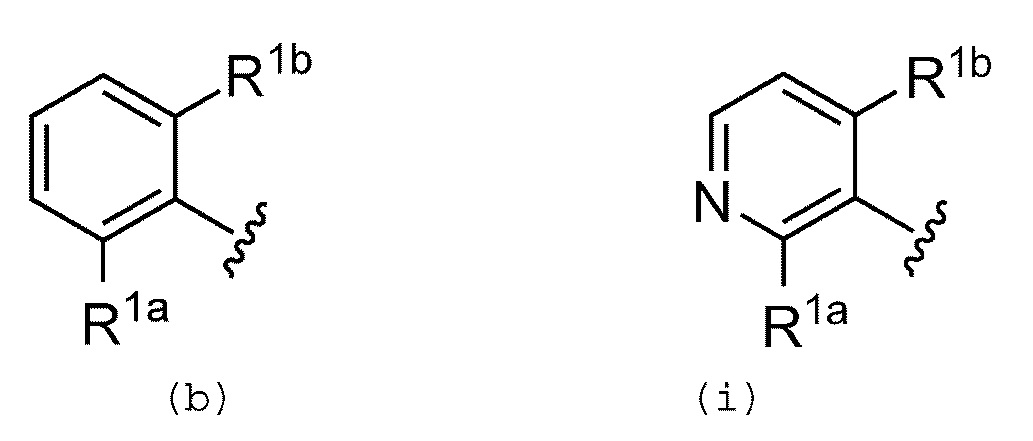
где каждый из заместителей R1a и R1b независимо выбран из группы, включающей атом водорода, галогенсодержащую группу, гидроксильную группу, цианогруппу, амидную группу, С1-С6 алкильную группу, С2-С6 алкенильную группу, С1-С6 алкокси группу и С1-С6 алкокси-С1-С6 алкильную группу.
Предпочтительно, в группах, представленных формулами (a), (h), (b) и/или (i), R1a обозначает атом водорода, галогенсодержащую группу, цианогруппу, метильную группу или метокси группу; а R1b обозначает галогенсодержащую группу. Более предпочтительно, R1a обозначает атом водорода или галогенсодержащую группу; а R1b обозначает галогенсодержащую группу. Еще более предпочтительно, R1a обозначает атом водорода или хлорсодержащую группу; а R1b обозначает хлорсодержащую группу.
Предпочтительно R1 обозначает 2-хлорфенильную группу или 2,6-дихлорфенильную группу. Наиболее предпочтительно, R1 обозначает 2,6-дихлорфенильную группу.
В качестве альтернативы, R1 обозначает группу, представленную формулой (j):
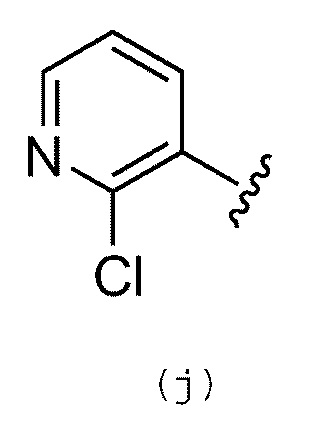
Предпочтительно, R2 обозначает атом водорода, галогенсодержащую группу, цианогруппу или необязательно замещенную арильную, С1-С3 алкильную или С2-С3 алкинильную, циклоалкильную, циклоалкенильную, гетероциклильную, амино или амидную группу. Следует понимать, что термин гетероциклил включает гетероциклоалкильную, гетероциклоалкенильную и гетероарильную группы. Более предпочтительно, R2 обозначает атом водорода, галогенсодержащую группу, метильную группу или необязательно замещенную амидную, С2-С3 алкинильную, фенильную, пиридильную или пиразолильную группу.
Предпочтительно, R2 обозначает атом водорода, метильную группу, бромсодержащую группу или замещенную амидную или С3-алкинильную группу или необязательно замещенную фенильную, пиридильную или пиразолильную группу.
Предпочтительно, R2 обозначает амидную группу, замещенную метильной группой. В качестве альтернативы, предпочтительно, R2 обозначает С3 алкинильную группу, замещенную гидроксильной группой или аминогруппой. Более предпочтительно, R2 обозначает атом водорода.
В качестве альтернативы, предпочтительно, R2 обозначает необязательно замещенную фенильную, пиридильную или пиразолильную группу. Предпочтительно, R2 обозначает незамещенную фенильную или пиридильную группу. В качестве альтернативы, предпочтительно, R2 обозначает фенильную или пиридильную группу, замещенную замещенной алкильной группы, такой как C1-С3-алкильная группа, замещенная группой -NR10R11, где R10 и R11 каждый независимо обозначает атом водорода или С1-С3 алкильную группу, С2-С3 алкенильную или алкинильную группу, или вместе они могут образовывать необязательно замещенную С2-С6 алкильную или алкенильную группу (в частности, атом азота, R10 и R11 могут быть частью одного и того же цикла). Предпочтительно, -NR10R11 обозначает -NH2, -NHMe, -N(Me)2, -NHEt, -NMeEt, -N(Et)2 или пиперазинильную или морфолинильную группу.
Предпочтительно, R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную или гетероциклильную группу, где гетероциклильная группа содержит 1 гетероатом, а каждый из остальных атомов в одном или нескольких циклах обозначает атом углерода.
Предпочтительно, R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную или гетероциклильную группу, где гетероциклильная группа содержит 1 или несколько гетероатомов, выбранных из группы, которая включает атом азота и атом кислорода, и где каждый из остальных атомов в одном или нескольких циклах обозначает атом углерода.
Предпочтительно, R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную или гетероциклоалкильную группы.
Предпочтительно, R3 обозначает необязательно замещенную арильную, алкильную, алкенильную, алкинильную, циклоалкильную или циклоалкенильную группу.
Предпочтительно, R3 обозначает группу, представленную формулой (c):
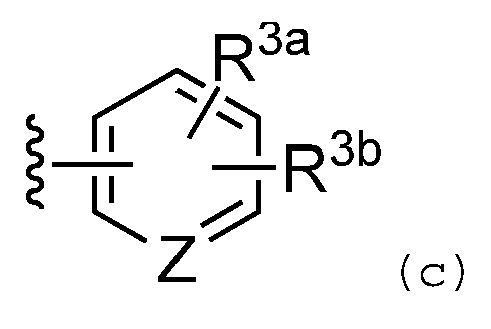
где Z обозначает атом азота или необязательно замещенную метиновую группу;
R3a обозначает атом водорода, галогенсодержащую группу, необязательно замещенную С1-C6 алкильную группу, необязательно замещенную С2-С6 алкенильную или алкинильную группу, необязательно замещенную С1-C6 алкокси группу или азотсодержащую гетероциклильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, которая включает галогенсодержащую группу, необязательно замещенную C1-C6 алкильную группу, необязательно замещенную C2-C6 алкенильную или алкинильную группу, одну, или две, или больше оксо групп и необязательно замещенную аминогруппу;
R3b обозначает атом водорода, галогенсодержащую группу, цианогруппу, необязательно замещенную С1-С6 алкильную группу, необязательно замещенную С2-С6 алкенильную или алкинильную группу, или необязательно замещенную C1-C6 алкокси группу;
или, когда R3a и R3b находятся на смежных кольцевых атомах группы формулы (d):
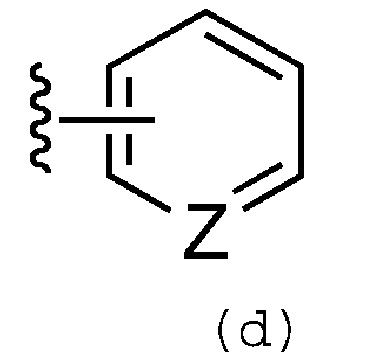
R3a и R3b и кольцевые атомы, к которым они присоединены, необязательно могут быть объединены и образовывать С3-С7 алкильную или алкенильную группу, в которой одна или две метиленовые группы, составляющие С3-С7 алкильную или алкенильную группу, необязательно могут быть независимо друг от друга замещены атомом кислорода или группой -N(R4a)-, а C3-C7 алкильная или алкенильная группа необязательно могут быть замещены одним или несколькими заместителями, выбранными из группы, которая включает галогенсодержащую группу, C1-C6 алкильную группу и С2-С6 алкенильную или алкинильную группу;
или R3a и R3b и кольцевые атомы, к которым они присоединены, необязательно могут быть объединены и образовывать спироцикл или бицикл, сформированный из от 5-членного до 7-членного алифатического цикла и любого другого от 3-членного до 7-членного алифатического цикла, в котором одна, или две, или несколько метиленовых групп, составляющих спироцикл или бицикл, необязательно каждая независимо друг от друга могут быть заменены атомом кислорода, атомом серы, сульфинильной группой, сульфонильной группой, оксо группой или группой -N(R4b)-, а спироцикл или бицикл независимо друг от друга могут быть замещены заместителем, выбранным из группы, которая включает галогенсодержащую группу, гидроксильную группу, C1-C6 алкильную группу и C2-С6 алкенильную или алкинильную группу; и
R4a и R4b каждый независимо обозначает атом водорода, C1-C6 алкильную группу или C2-C6 алкенильную или алкинильную группу, необязательно замещенную заместителем, выбранным из группы, которая включает галогенсодержащую группу, гидроксильную группу, цианогруппу, оксо группу, C1-C6 алкильную группу, C2-C6 алкенильную или алкинильную группу, C1-C6 алкокси группу, аминогруппу, замещенную аминогруппу и азотсодержащую гетероциклильную группу.
Предпочтительно, Z обозначает необязательно замещенную метиновую группу.
Предпочтительно, R3 обозначает группу, представленную формулой (e):
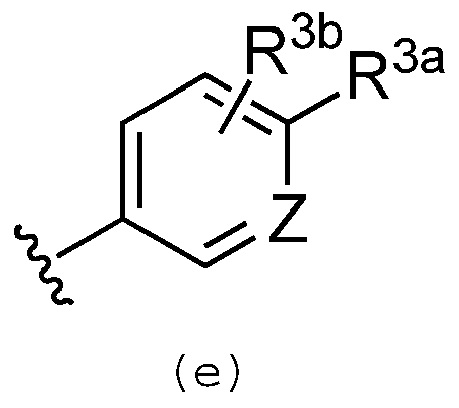
где R3a обозначает атом водорода, галогенсодержащую группу, C1-C6 алкильную группу, С2-С6 алкенильную или алкинильную группу, необязательно замещенную C1-C6 алкокси группу или обозначает азотсодержащую гетероциклильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, которая включает галогенсодержащую группу, C1-C6 алкильную группу, С2-С6 алкенильную или алкинильную группу, одну, или две, или больше оксо групп и группу -Q1-N(R4c)R4d;
R3b обозначает атом водорода, галогенсодержащую группу, необязательно замещенную C1-C6 алкильную группу, необязательно замещенную С2-С6 алкенильную или алкинильную группу, необязательно замещенную C1-C6 алкокси группу или цианогруппу;
R4c и R4d каждый независимо обозначает атом водорода или C1-C6 алкильную группу, C2-C6 алкенильную или алкинильную группу или же они могут быть объединены и образуют необязательно замещенную С2-С6 алкильную или алкенильную группу; и
Q1 обозначает простую связь, С1-С3 алкильную группу или C2-C3 алкенильную или алкинильную группу.
Предпочтительно, в группах, представленных формулой (c) и/или (e), R3a обозначает замещенную C1-C6 алкокси группу, замещенную С1-С3 алкильную группу или азотсодержащую гетероциклильную группу, необязательно замещенную заместителем, выбранным из группы, которая включает две оксо группы и необязательно замещенную С1-С3 алкильную группу; а R3b обозначает атом водорода, галогенсодержащую группу, метоксильную группу или C1-C2 алкильную группу, необязательно замещенную заместителем, выбранным из группы, которая включает гидроксильную группу и аминогруппу.
Предпочтительно, в группах, представленных формулой (c) и/или (e), R3a обозначает замещенную C1-С2 алкокси группу, замещенную C1-С2 алкильную группу или азотсодержащую гетероциклильную группу с заместителем, выбранным из группы, которая включает две оксо группы и необязательно замещенную C1-С3 алкильную группу; а R3b обозначает атом водорода, галогенсодержащую группу, метоксильную группу или C1-С2 алкильную группу, необязательно замещенную заместителем, выбранным из группы, которая включает гидроксильную группу и аминогруппу.
Предпочтительно, когда R3а обозначает замещенную C1-C6 алкокси группу, преимущественно, замещенную C1-C2 алкокси группу, заместителем является аминогруппа, замещенная одной или двумя метильными группами.
Предпочтительно, когда R3а обозначает замещенную C1-C3 алкильную группу, преимущественно, замещенную C1-C2 алкильную группу, заместителем является гидроксильная группа или аминогруппа, замещенная одной или двумя метильными группами.
Предпочтительно, R3a обозначает незамещенную азотсодержащую гетероциклильную группу.
В качестве альтернативы, R3a, предпочтительно, обозначает азотсодержащую гетероциклильную группу, замещенную заместителем, выбранным из группы, которая включает две оксо группы и необязательно замещенную С1-С3 алкильную группу. Предпочтительно, когда R3а является азотсодержащей гетероциклильной группой, которая замещена необязательно замещенной С1-С3 алкильной группой, необязательно замещенная С1-С3 алкильная группа выбрана из группы, состоящей из этильной группы, замещенной оксо группой, метильной группой, этильной группой и изопропильной группой. Предпочтительно, когда азотсодержащая гетероциклильная группа замещена двумя оксо группами, указанная азотсодержащая гетероциклильная группа содержит один атом серы, а обе оксо группы присоединены к указанному атому серы посредством двойных связей.
Предпочтительно, R3 обозначает группу, представленную формулой (f):

где R4e выбран из группы, которая включает атом водорода, необязательно замещенную алканоильную группу, необязательно замещенную C1-C6 алкильную группу и С2-С6 алкенильную группу. Более предпочтительно, R4e выбран из группы, которая включает атом водорода и необязательно замещенную C1-C6 алкильную группу. Предпочтительно, R4e выбран из группы, которая включает атом водорода и необязательно замещенную C1-С3 алкильную группу. Предпочтительно, когда R4e обозначает необязательно замещенную С1-С3 алкильную группу, то необязательно замещенная С1-С3 алкильная группа выбрана из группы, которая включает этильную группу, замещенную оксо группой, этильную группу, замещенную оксо группой и гидроксильной группой (т.е. -СН2-С(=O)ОН), метильную группу, этильную группу и изопропильную группу. Предпочтительно, необязательно замещенная C1-C3 алкильная группа обозначает метильную группу. В качестве альтернативы, предпочтительно, необязательно замещенная C1-C3 алкильная группа обозначает этильную группу, замещенную оксо группой и гидроксильной группой (т.е. -CH2-C(=O)ОН).
Предпочтительно, Z обозначает необязательно замещенную метиновую группу.
В качестве альтернативы, R3 предпочтительно обозначает группу, представленную формулой (g):
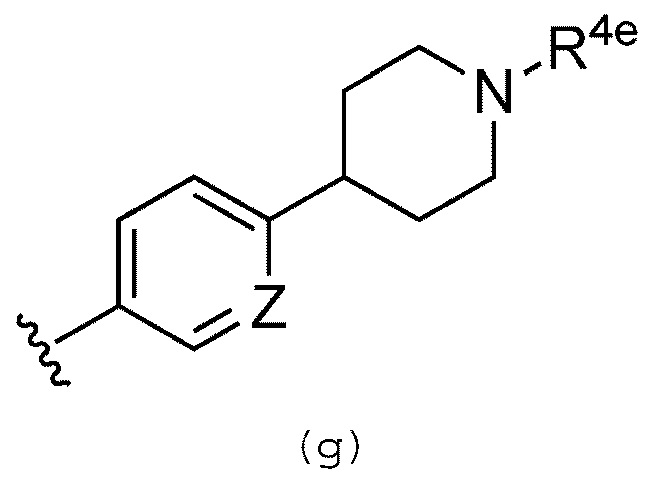
где R4e выбран из группы, которая включает атом водорода, необязательно замещенную алканоильную группу, необязательно замещенную C1-C6 алкильную группу и C2-C6 алкенильную группу. Предпочтительно, R4e выбран из группы, которая включает атом водорода и необязательно замещенную C1-C3 алкильную группу. Предпочтительно, когда R4e обозначает необязательно замещенную C1-C3 алкильную группу, то указанная необязательно замещенная C1-C3 алкильная группа обозначает метильную группу.
В качестве альтернативы, R3 предпочтительно, обозначает группу, представленную формулой (k):
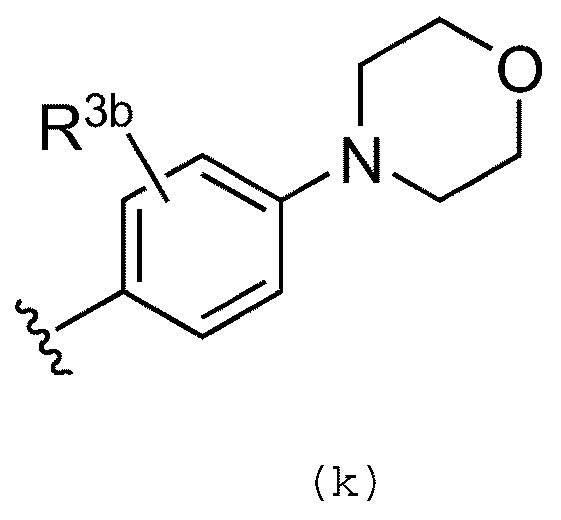
где R3b обозначает атом водорода, галогенсодержащую группу, циано группу, необязательно замещенную C1-C6 алкильную группу, необязательно замещенную C2-C6 алкенильную или алкинильную группу, или необязательно замещенную C1-C6 алкокси группу. Предпочтительно, R3b обозначает атом водорода или метильную группу, замещенную группой -NHMe.
В качестве альтернативы, предпочтительно, R3 обозначает группу, представленную формулой (m):
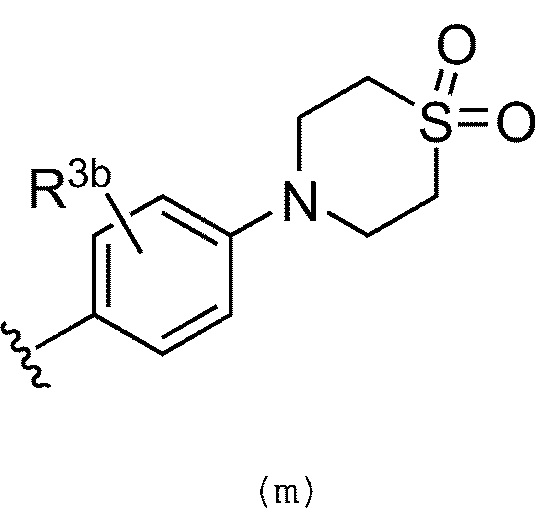
где R3b обозначает атом водорода, галогенсодержащую группу, циано группу, необязательно замещенную C1-C6 алкильную группу, необязательно замещенную C2-C6 алкенильную или алкинильную группу, или необязательно замещенную C1-C6 алкокси группу. Предпочтительно, R3b обозначает атом водорода или метильную группу, замещенную группой -NHMe.
Предпочтительно, в соединении формулы (I), R1 обозначает необязательно замещенную арильную группу; R2 обозначает атом водорода, C1-C2 алкильную группу, галогенсодержащую группу, замещенную амидную или С3-алкинильную группу или необязательно замещенную фенильную, пиридильную или пиразолильную группу; а R3 обозначает необязательно замещенную арильную группу.
Более предпочтительно, R1 обозначает группу, представленную формулой (a) или (h), как определено выше, и/или R2 обозначает атом водорода, метильную группу, бромсодержащую группу, замещенную амидную или С3-алкинильную группу или необязательно замещенную фенильную, пиридильную или пиразолильную группу, и/или R3 обозначает группу, представленную формулой (c), как определено выше.
Еще более предпочтительно, R1 обозначает группу, представленную формулой (b) или (i), как определено выше, и/или R2 обозначает атом водорода, метильную группу, бромсодержащую группу, замещенную амидную или С3-алкинильную группу или необязательно замещенную фенильную или пиридильную группу, и/или R3 обозначает группу, представленную формулой (е), как определено выше.
Еще более предпочтительно, R1 обозначает 2-хлорфенильную группу или 2,6-дихлорфенильную группу, R2 обозначает атом водорода, метильную группу, замещенную С3-алкинильную группу или необязательно замещенную фенильную или пиридильную группу, и/или R3 обозначает группу, представленную формулой (f), (g), (k) или (m), как определено выше.
Наиболее предпочтительно, R1 обозначает 2,6-дихлорфенильную группу, и/или R2 обозначает атом водорода, и/или R3 обозначает группу, представленную формулой (f) или (g), как определено выше.
Предпочтительно, соединение формулы (I) выбрано из следующих соединений:
(1) 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(2) 6-(2,6-дихлорфенил)-8-метил-2-((4-(пиперазин-1-ил)фенил)амино)пиридо [4,3-d]пиримидин-5(6H)-он;
(3) 6-(2-хлорпиридин-3-ил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(4) 6-(2,6-дихлорфенил)-2-((4-(2-(диэтиламино)этокси)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(5) 2-((4-(4-ацетилпиперазин-1-ил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он;
(6) 6-(2,6-дихлорфенил)-2-((4-(1,1-диоксидотиоморфолино)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
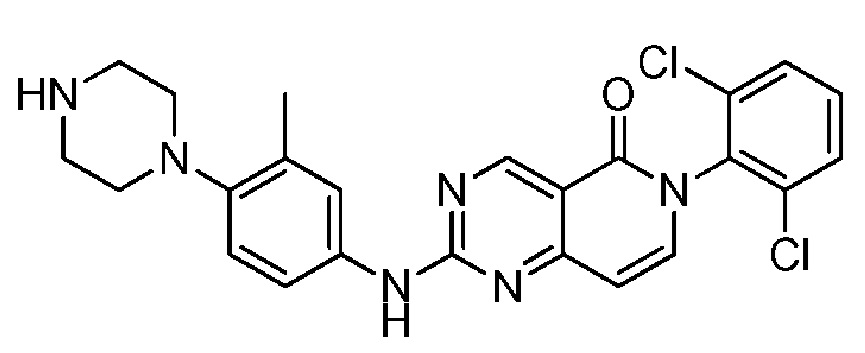
(7) 6-(2,6-дихлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
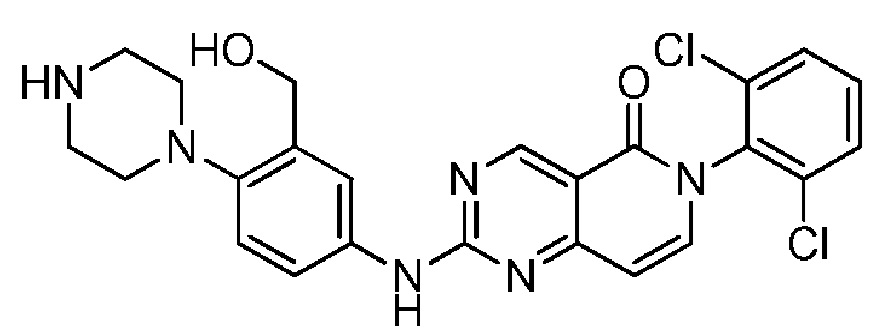
(8) 6-(2,6-дихлорфенил)-2-((3-(гидроксиметил)-4-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(9) 8-бром-6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он ;
(10) 6-(2,6-дихлорфенил)-2-((4-(1-метилпиперидин-4-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(11) 6-(2,6-дихлорфенил)-2-((4-(2-(диметиламино)этил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(12) 6-(2,6-дихлорфенил)-2-((3-метокси-4-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(13) 6-(2,6-дихлорфенил)-2-((3-метокси-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(14) 6-(2,6-дихлорфенил)-8-(3-гидроксипроп-1-ин-1-ил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(15) 6-(2,6-дихлорфенил)-2-((4-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(16) 6-(2,6-дихлорфенил)-2-((4-(2-(метиламино)этокси)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(17) 6-(2,6-дихлорфенил)-2-((4-(4-изопропилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(18) 6-(2,6-дихлорфенил)-2-((3-(гидроксиметил)-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(19) 6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(20) 6-(2,6-дихлорфенил)-2-((3-((метиламино)метил)-4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(21) 6-(2,6-дихлорфенил)-2-((4-(4-(2-гидроксиэтил)пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(22) 8-(3-аминопроп-1-ин-1-ил)-6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(23) 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)-8-(пиридин-3-ил)пиридо[4,3-d]пиримидин-5(6H)-он;
(24) 6-(2-хлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(25) 2-((3-(аминометил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он;
(26) 6-(2,6-дихлорфенил)-2-((3-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(27) 2-((3-хлор-4-(пиперазин-1-ил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он;
(28) N-(6-(2,6-дихлорфенил)-5-оксо-2-((4-(пиперазин-1-ил)фенил)амино)-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)ацетамид;
(29) 6-(2,6-дихлорфенил)-2-((3-фтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он ;
(30) 6-(2,6-дихлорфенил)-2-((3,5-дифтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(31) 6-(2,6-дихлорфенил)-2-((6-(4-метилпиперазин-1-ил)пиридин-3-ил)амино)пиридо[4,3-d]пиримидин-5(6H)-он;
(32) 6-(2,6-дихлорфенил)-2-((4-(4-метилпиперазин-1-карбонил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он; и
(33) 2-(4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-ил)уксусная кислота.
Предпочтительно, в данном изобретении предлагается соединение формулы (I), или его фармацевтически приемлемая соль, или его N-оксидное производное и, по меньшей мере, один фармацевтически приемлемый наполнитель.
Подходящие фармацевтически приемлемые наполнители должны быть известны специалисту в данной области, например, жиры, вода, физиологический раствор, спирт (например, этанол), глицерин, полиолы, водный раствор глюкозы, сухой разбавитель, разрыхлитель, связующее соединение, лубрикант, смачивающий агент, стабилизатор, эмульгатор, диспергатор, консервант, подсластитель, краситель, вкусовая добавка или ароматизатор, загуститель, разбавитель, буферная добавка, растворитель или солюбилизирующий агент, химическое вещество для увеличения длительности хранения, соль для изменения осмотического давления, глазировочное средство или антиоксидант, сахариды, такие как лактоза или глюкоза; кукурузный, пшеничный или рисовый крахмал; жирные кислоты, такие как стеариновая кислота; неорганические соли, такие как метасиликат алюминат магния или безводный фосфат кальция; синтетические полимеры, такие как поливинилпирролидон или полиалкиленгликоль; спирты, такие как стеариловый спирт или бензиловый спирт; синтетические производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, этилцеллюлоза или гидроксипропилметилцеллюлоза; и другие обычно используемые добавки, такие как желатин, тальк, растительное масло и гуммиарабик.
Предпочтительно, предложена фармацевтическая композиция, содержащая соединение формулы (I), или его фармацевтически приемлемую соль, или его N-оксидное производное и, по крайней мере, один фармацевтически приемлемый наполнитель.
Предпочтительно, предложена фармацевтическая композиция, содержащая соединение формулы (I) и один или несколько дополнительных фармацевтически активных агентов.
Предпочтительно, предлагается соединение формулы (I), или его фармацевтически приемлемая соль, или его N-оксидное производное, или предлагается фармацевтическая композиция, содержащая соединение формулы (I), для применения в терапии.
Предпочтительно, предлагается соединение формулы (I) для применения в качестве лекарственного средства.
Предпочтительно, предлагается соединение формулы (I) для применения при лечении или предотвращении онкологического заболевания.
Предпочтительно, предлагается соединение формулы (I), или его фармацевтически приемлемая соль, или его N-оксидное производное или предлагается фармацевтическая композиция, содержащая соединение формулы (I), для применения в качестве лекарственного средства и/или для использования при лечении или предотвращении онкологического заболевания.
Предпочтительно, предлагается использование соединения формулы (I) для изготовления лекарственного средства, предназначенного для лечения или предотвращения онкологического заболевания.
Предпочтительно, предлагается способ лечения или предотвращения онкологического заболевания у пациента-человека или пациента-животного, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы (I) или фармацевтической композиции, содержащей соединение формулы (I).
Предпочтительно, соединения по настоящему изобретению имеют значение IC50 для киназы Wee-1, равное от приблизительно 1 нМ до приблизительно 1000 нМ, более предпочтительно, от приблизительно 1 нМ до приблизительно 500 нМ, или от приблизительно 1 нМ до приблизительно 300 нМ, или от приблизительно 1 нМ до приблизительно 100 нМ, или от приблизительно 1 нМ до приблизительно 50 нМ, или от приблизительно 1 нМ до приблизительно 30 нМ, или от приблизительно 1 нМ до приблизительно 15 нМ, или от приблизительно 1 нМ до приблизительно 10 нМ, наиболее предпочтительно, менее чем 10 нМ. Способ определения значения IC50 соединения для киназы Wee-1 описан ниже (см. примеры).
При описании элементов настоящего изобретения или предпочтительных вариантов его осуществления неопределенные формы и термин "указанный" означают, что существует один или несколько указанных элементов. Термины "содержащий", "включающий" и "имеющий" являются охватывающими и означают, что могут быть и дополнительные элементы, отличные от перечисленных элементов.
Приведенное выше детальное описание дано для пояснения и иллюстрации и не предназначено для ограничения объема прилагаемой формулы изобретения. Многие вариации в приведенных в данном описании предпочтительных вариантов очевидны обычному специалисту в данной области техники и входят в объем прилагаемой формулы изобретения и ее эквивалентов.
Следующие не ограничивающие изобретение примеры дополнительно иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Настоящее изобретение далее описывается со ссылкой на несколько примеров.
Соединения в примерах с 1 по 33 синтезируют в соответствии с приведенными далее способами. Величины IC50 определяют, как описано ниже, и они представлены в следующей таблице.
|
Для типичных примеров, приведенных в таблице 1, активности Wee-1, НТ29 pCDC2, HLM и hERG классифицируются как следующие:
|
Соединения тестируют на предмет ингибирования гена специфических калиевых каналов сердца человека (hERG) с использованием метода IonWorks электрофизиологии с фиксацией потенциала в компании Essen Bioscience. 8-точечная кривая зависимости эффекта от концентрация соединения на ток hERG в процентах от предварительно сигнала соединения получают с использованием 3-кратных серийных разведений от 11 мкΜ, и результаты приведены в виде значений IC50, выраженных в мкΜ.
Все примерные соединения от 1 до 33 также демонстрируют повышенную стабильность в микросомах печени человека и имеют значение CLint<40.
Соединения по настоящему изобретению обладают хорошей стабильностью в инкубациях гепатоцитов человека и/или крысы. В частности, типичные соединения по примерам 7, 8, 13, 18, 20 имеют значение CLint<20 мкл/мин/106 клеток в анализе гепатоцитов человека и/или <40 мкл/мин/106 клеток в анализе гепатоцитов крысы.
Соединения по настоящему изобретению перорально биодоступны. В частности, типичные соединения по примерам 7, 13 и 20 имеют пероральную биодоступность у крыс >25%.
Соединения настоящего изобретения не обладают зависящим от длительности терапии ингибированием CYP. В частности, типичные соединения по примерам 13 и 20 не показывают зависимое от времени ингибирование CYP3A4, CYP1A2, CYP2C9, CYP2C19 или CYP2D6 (<2-кратный сдвиг в IC50 после 30-минутной преинкубации ±NADPH по отношению к прямому ингибированию IC50 без преинкубации).
Экспериментальная часть
Сокращения
aq: водный; dba: дибензилиденацетон; DCM: дихлорметан; DIPEA: диизопропилэтиламин; ДМФА: N,N-диметилформамид; ДМСО: диметилсульфоксид; dppf: 1,1'-бис(дифенилфосфино)ферроцен; EtOAc: этилацетат; ESI: ионизация при электрораспылении; час: часы; ВЭЖХ: высокоэффективная жидкостная хроматография; ЖХ: жидкостная хроматография; ЖХ-МС: жидкостная хроматография масс-спектрометрия; М: молярный; m/z: отношение массы к заряду; mCPBA: 3-хлорнадбензойная кислота; МеОН: метанол; мин: минуты; MС: масс-спектрометрия; NBS: N-бромсукцинимид; ЯМР: ядерный магнитный резонанс; RT: время удерживания; RT: температура в помещении; SM: исходное вещество; TFA: трифторуксусная кислота; ТГФ: тетрагидрофуран; Xantphos: 4,5-бис(дифенилфосфино)-9,9-диметилксантен.
Общие условия проведения эксперимента
Растворители и реагенты
Обычные органические растворители, которые используют при проведении реакций (например, ТГФ, ДМФА, DCM и метанол) приобретают в безводной форме у компании Sigma-Aldrich® в бутылках Sure/Seal™ и все операции с ними соответствующим образом проводят в атмосфере азота. Деионизованную воду получают, используя Elga PURELAB Option-Q. Все другие используемые растворители (например, для процедуры выделения и очистки), как правило, имеют степень чистоты ВЭЖХ и их используют в том виде, в котором они поступают из различных коммерческих источников. Если не указано иное, все исходные вещества получены из коммерческих источников и их используют в том виде, в котором они поступают.
Синтез в микроволновой печи
Если не указано иное, эксперименты в микроволновой печи проводят с использованием системы СЕМ Discover™/Explorer24™, контролируемой программным обеспечением Synergy 1.5. В других случаях используют Biotage Initiator™ Eight. Обе установки дают хорошую воспроизводимость и обеспечивают хороший контроль в диапазоне температур 60-250°С и при давлении до 20 бар максимум.
Флэш-хроматография
Очистку соединений с помощью флэш-хроматографии осуществляют с помощью системы Biotage Isolera Four. Если не указано иное, используют картриджные колонки Biotage KP-Sil SNAP (10-340 г) вместе с указанной системой растворителей и в соответствующем градиенте растворителей в зависимости от полярности соединения. В случае более полярных и более основных соединений используют картриджные колонки Biotage KP-NH SNAP (11 г).
ЯМР-спектроскопия
Спектры 1H ЯМР регистрируют при комнатной температуре на спектрометре Bruker Avance (500 МГц). Все химические сдвиги (δ) выражены в миллионных долях (м.д.). Сигналы остаточных растворителей используют в качестве внутреннего стандарта, а характеристические пики растворителя корректируют относительно справочных данных, приведенных в J. Org. Chem., 1997, 62, p. 7512-7515. В других случаях используемые для регистрации спектров ЯМР растворители содержат тетраметилсилан, который используют в качестве внутреннего стандарта.
Жидкостная хроматография высокого давления
Эксперименты с использованием метода жидкостной хроматографии масс-спектрометрии (ЖХ-МС) по определению времени удерживания (RT) и массы ассоциированных ионов проводят с использованием одного из следующих методов:
Способ А: Система состоит из одного квадрупольного масс-спектрометра Agilent Technologies 6140, связанного с ЖХ системой Agilent Technologies 1290 Infinity с диодно-матричным УФ-детектором и пробоотборником. В спектрометре используется многорежимный источник ионизации (электрораспыление и химическая ионизация при атмосферном давлении), который работает в режиме определения как положительных, так и отрицательных ионов. Эксперименты ЖХ-МС проводят для каждого представленного образца в следующих условиях: ЖХ колонка: Zorbax Eclipse Plus C18 RRHD 1,8 мкм 50*2,1 мм, которую термостатируют при температуре 40°С. Подвижные фазы: A) 0,1% (об./об.) муравьиная кислота в воде; B) 0,1% (об./об.) муравьиная кислота в ацетонитриле.
|
Метод B: Система состоит из масс-спектрометра ThermoFinnigan LCQ Avantage с системой Surveyor LC и пробоотборником с 200 позициями. ЖХ система сопрягается со встроенным детектором Surveyor DAD и ESI источником, который работает в режиме определения как положительных, так и отрицательных ионов. Эксперименты ЖХ-МС проводят для каждого представленного образца с использованием следующих условий: ЖХ колонка: Luna 3 мкм С18 50*2 мм. Подвижные фазы: A) 0,1% (об./об.) муравьиная кислота в воде; B) 0,1% (об./об.) муравьиная кислота в ацетонитриле.
|
Препаративная жидкостная хроматография высокого давления
Система состоит из одного квадрупольного масс-спектрометра Agilent Technologies 6120, связанного с препаративной ЖХ системой Agilent Technologies 1200 с кратными длинами волн и пробоотборником. В спектрометре используется многорежимный источник ионизации (электрораспыление и химическая ионизация при атмосферном давлении), который работает в режиме определения как положительных, так и отрицательных ионов. Фракции собирают в зависимости от массы (многорежимное определение как положительных, так и отрицательных ионов). Эксперименты по очистке, если не указано иное, осуществляют в основных условиях в соответствующем градиенте растворителей, который, как правило, определяют по времени удерживания, найденного по Способу А ВЭЖХ. В тех случаях, когда основные условия безуспешны, используют кислые условия.
Основные условия: ЖХ колонка: колонка Waters XBridge™ Prep C18 5 мкм OBDTM 19*50 мм при комнатной температуре. Подвижная фаза: A) 0,1% (об./об.) гидроксида аммония в воде; B) 0,1% (об./об.) гидроксида аммония в смеси 95:5 ацетонитрил/вода. Общее время эксперимента составляет приблизительно 10 мин и ниже приводится пример метода:
|
Кислые условия: ЖХ колонка: колонка Waters XBridge™ Prep C18 5 мкм OBDTM 19*50 мм при комнатной температуре. Подвижная фаза: A) 0,1% (об./об.) муравьиная кислота в воде; B) 0,1% (об./об.) муравьиная кислота в смеси 95:5 ацетонитрил/вода. Общее время эксперимента составляет приблизительно 10 мин и ниже приводится пример метода:
|
Чистые фракции объединяют и концентрируют с помощью Genevac EZ-2 Elite, если не указано иное.
Номенклатура
Если не указано иное, номенклатуру соединений определяют с помощью функции 'Convert Structure to Name' программного продукта ChemBioDraw Ultra 12.0.2 (CambridgeSoft/PerkinElmer).
Пример 1: 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
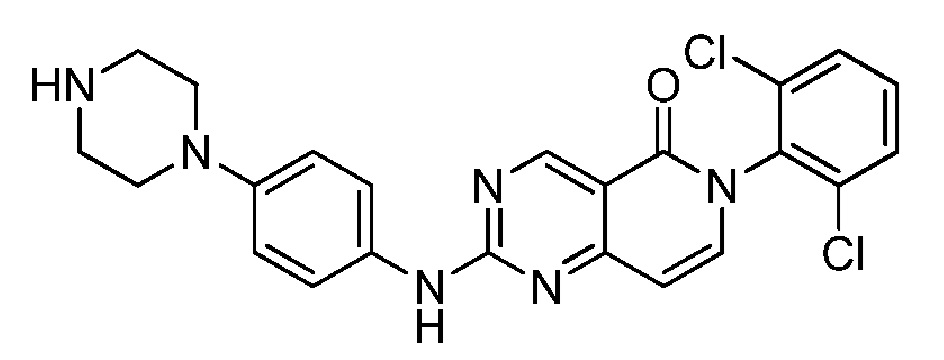
Стадия 1: N-(2,6-дихлорфенил)-4-метил-2-(метилтио)пиримидин-5-карбоксамид: Трихлорид фосфора (2,37 мл, 27,1 ммоль) добавляют к перемешиваемому раствору 4-метил-2-(метилтио)пиримидин-5-карбоновой кислоты (5,00 г, 27,1 ммоль) [коммерчески доступна] и 2,6-дихлоранилина (4,40 г, 27,1 ммоль) в хлорбензоле (100 мл) при температуре 135°С в атмосфере азота. Через 3 час растворители удаляют в вакууме, полученный остаток распределяют между DCM и 2М водным раствором карбоната натрия, отделяют, экстрагируют с помощью DCM (×2), сушат (в делительном сепараторе) и растворители удаляют в вакууме, получая указанное в названии соединение (6,86 г, 77%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,14 мин, m/z=328, 330 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-он: ДМФА-DMA (2,49 мл, 18,6 ммоль) добавляют к перемешиваемому раствору N-(2,6-дихлорфенил)-4-метил-2-(метилтио)пиримидин-5-карбоксамида (5,08 г, 15,5 ммоль) в ДМФА (50 мл) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают до 100°С. Через 2 час, поскольку реакция полностью не заканчивается, добавляют дополнительное количество ДМФА-DMA (1,0 мл, 7,74 ммоль). Еще через 2 ч, поскольку реакция полностью не заканчивается, добавляют дополнительное количество ДМФА-DMA (0,5 мл, 3,87 ммоль). Еще через 1 час реакционную смесь охлаждают до комнатной температуры и распределяют между диэтиловым эфиром и смесью 1:1 вода/насыщенный раствор соли, разделяют, экстрагируют (диэтиловый эфир ×2), сушат (в делительном сепараторе), растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане) и получают указанное в названии соединение (2,38 г, 46%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,29 мин, m/z=338, 340 [М+Н]+.
Стадия 3: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (23,0 мг, предположительно 0,102 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (30,0 мг, 0,089 ммоль) в толуоле (1,5 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,046 мл, 0,266 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (27,1 мг, 0,098 ммоль) [коммерчески доступен] и температуру повышают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане). Чистые фракции концентрируют и получают указанное в названии соединение (30,5 мг, 61%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,50 мин, m/z=567, 569 [М+Н]+.
Стадия 4: 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (30,5 мг, 0,054 ммоль) в DCМ (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между насыщенным раствором бикарбоната натрия (водный раствор) и DCM, разделяют, экстрагируют с помощью DCM (×2), сушат (в делительном сепараторе). Растворители удаляют в вакууме и получают указанное в названии соединение (24,9 мг, 98%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,82 мин, m/z=467, 469 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,69-7,60 (м, 4H), 7,52 (дд, 1H), 7,47 (д, 1Н), 7,01 (д, 2H), 6,60 (д, 1Н), 3,17-3,12 (м, 4H), 3,03-2,98 (м, 4H).
Пример 2: 6-(2,6-дихлорфенил)-8-метил-2-((4-(пиперазин-1-ил)фенил)аминопиридо[4,3-d]пиримидин-5(6H)-он
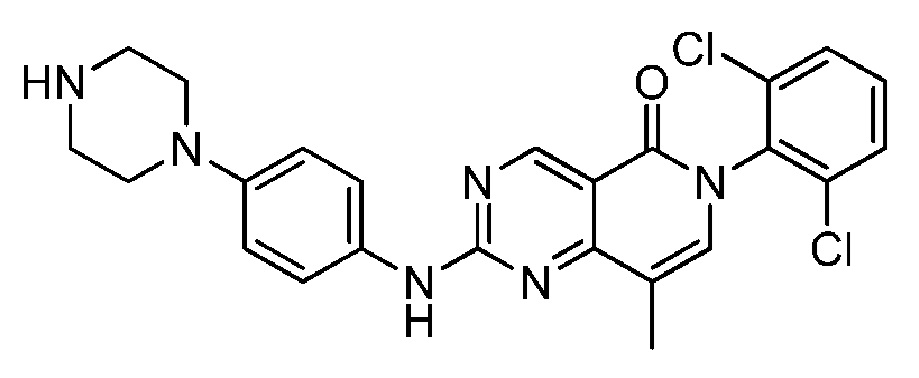
Стадия 1: 8-бром-6-(2,6-дихлорфенил)-2-(этилтио)пиридо[4,3-d]пиримидин-5(6H)-он: NBS (5,3 мг, 0,030 ммоль) добавляют при перемешивании к раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (10,0 мг, 0,030 ммоль) в ацетонитриле (1,0 мл) при 80°С в атмосфере азота в герметичном флаконе емкостью 4 мл. По прошествии 16 час анализ ЖХ-МС дает смесь 2:1 продукт/SM. Добавляют дополнительное количество NBS (2,6 мг, 0,5 экв.). Еще через 1 час реакционную смесь гасят 10%-ным раствором бисульфита натрия и распределяют в DCM, отделяют, экстрагируют с помощью DCM (×2), сушат (в делительном сепараторе), растворители удаляют в вакууме, а полученный остаток очищают с помощью флэш-хроматографии (0-100%, EtOAc в циклогексане) и получают указанное в названии соединение (9,5 мг, 77%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,47 мин, m/z=418 [М+Н]+. Спектр 1Н ЯМР (500 МГц, CDCl3): δ 9,36 (с, 1Н), 7,56 (с, 1Н), 7,54-7,50 (м, 2H), 7,42 (д, 1H), 2,73 (с, 3H).
Стадия 2: 6-(2,6-дихлорфенил)-8-метил-2-(этилтио)пиридо[4,3-d]пиримидин-5(6H)-он: PdCl2(dppf).DCM (0,9 мг, 1,14 мкмоль) добавляют к предварительно дегазированному раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (9,5 мг, 0,023 ммоль), 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана (6,4 мкл, 0,046 ммоль) и карбоната калия (9,4 мг, 0,068 ммоль) в 1,4-диоксане (1,0 мл) во флаконе емкостью 4 мл. Сосуд герметично закрывают и нагревают до 100°С. Через 16 час растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане) и получают указанное в названии соединение (6,1 мг, 76%) в виде белого твердого вещества. ЖХ-МС (способ А): RT=1,42 мин, m/z=352, 354 [М+Н]+.
Стадия 3: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-8-метил-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (4,5 мг, предположительно 0,020 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-8-метил-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (6,1 мг, 0,017 ммоль) в толуоле (1,0 мл) при комнатной температуре в атмосфере азота. Через 1,5 час последовательно добавляют DIPEA (9,0 мкл, 0,052 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (5,3 мг, 0,019 ммоль) [коммерчески доступен] в толуоле (0,5 мл) и температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, сразу же помещают в колонку и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая указанное в названии соединение (5,4 мг, 54%) в виде желтого масла. ЖХ-МС (способ А): RT=1,61 мин, m/z=581, 583 [М+Н]+.
Стадия 4: 6-(2,6-дихлорфенил)-8-метил-2-((4-(пиперазин-1-ил)фенил)аминопиридо[4,3-d]пиримидин-5(6H)-он: TFA (1,0 мл, 13,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-8-метил-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (5,4 мг, 9,29 мкмоль) в DCM (1,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе) и растворители удаляют в вакууме. Полученный остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc) и получают вещество, которое требует очистки с помощью препаративной ВЭЖХ. Чистые фракции концентрируют и получают указанное в названии соединение (2,0 мг, 44%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,85 мин, m/z=481, 483 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,77 (шир. с, 2Н), 7,65-7,60 (м, 2H), 7,52 (дд, 1H), 7,35 (с, 1H), 7,02 (д, 2H), 3,14 (т, 4Н), 3,01 (т, 4Н), 2,30 (с, 3H).
Пример 3: 6-(2-хлорпиридин-3-ил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
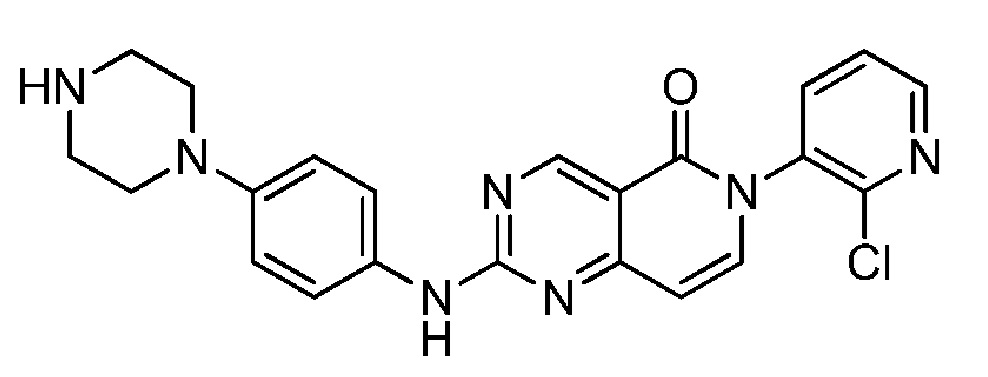
Стадия 1: N-(2-хлорпиридин-3-ил)-4-метил-2-(метилтио)пиримидин-5-карбоксамид: Трихлорид фосфора (0,047 мл, 0,543 ммоль) добавляют к перемешиваемому раствору 4-метил-2-(метилтио)пиримидин-5-карбоновой кислоты (100 мг, 0,543 ммоль) и 2-хлорпиридин-3-амина (69,8 мг, 0,543 ммоль) в хлорбензоле (2,0 мл) при температуре 135°С в атмосфере азота. Через 16 час растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане) и получают указанное в названии соединение (53,3 мг, 33%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,98 мин, m/z=295 [М+Н]+.
Стадия 2: 6-(2-хлорпиридин-3-ил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-он: ДМФА-DMA (0,048 мл, 0,362 ммоль) добавляют к перемешиваемому раствору N-(2-хлорпиридин-3-ил)-4-метил-2-(метилтио)пиримидин-5-карбоксамида (53,3 мг, 0,181 ммоль) в ДМФА (2,0 мл) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают до температуры 150°С. Через 20 час реакционную смесь распределяют, используя диэтиловый эфир и смесь 1:1 насыщенный раствор соли/вода, разделяют, экстрагируют (2× диэтиловый эфир), органические фазы объединяют, сушат (в делительном сепараторе), растворители удаляют в вакууме, а остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане) и получают указанное в названии соединение (18,2 мг, 33%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,00 мин, m/z=305 [М+Н]+.
Стадия 3: трет-бутил 4-(4-((6-(2-хлорпиридин-3-ил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (15,5 мг, предположительно 0,069 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2-хлорпиридин-3-ил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (18,2 мг, 0,060 ммоль) в толуоле (1,5 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,031 мл, 0,179 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (18,2 мг, 0,066 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH, очищают флэш-хроматографией (0-100%, EtOAc в циклогексане) и получают указанное в названии соединение (14,3 мг, 45%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,33 мин, m/z=534 [М+Н]+.
Стадия 4: 6-(2-хлорпиридин-3-ил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2-хлорпиридин-3-ил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (14,3 мг, 0,027 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме, полученный остаток очищают с помощью препаративной ВЭЖХ и получают указанное в названии соединение (7,0 мг, 60%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,62 мин, m/z=434 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,18 (с, 1H), 8,53 (дд, 1H), 8,01 (дд, 1H), 7,65 (шир. д, 2H), 7,60 (дд, 1H), 7,57 (д, 1Н), 7,04-6,98 (м, 2H), 6,58 (д, 1H), 3,14 (т, 4Н), 3,00 (т, 4Н).
Пример 4: 6-(2,6-дихлорфенил)-2-((4-(2-(диэтиламино)этокси)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
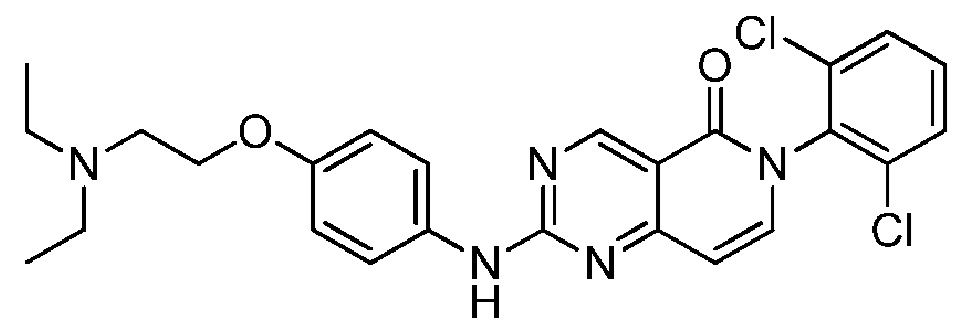
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50,0 мг, 0,148 ммоль) в толуоле (1,5 мл) при комнатной температуре в атмосфере азота. Через 15 мин, последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и 4-(2-(диэтиламино)этокси)анилин (33,9 мг, 0,163 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc), получая указанное в названии соединение (40,6 мг, 52%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,87 мин, m/z=498, 500 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,20 (с, 1H), 7,72-7,61 (м, 4H), 7,53 (дд, 1H), 7,48 (д, 1Н), 6,99-6,95 (м, 2H), 6,60 (д, 1H), 4,15 (т, 2H), 3,00 (шир. с, 2Н), 2,77 (ш, 4Н), 1,14 (т, 6Н).
Пример 5: 2-((4-(4-ацетилпиперазин-1-ил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он
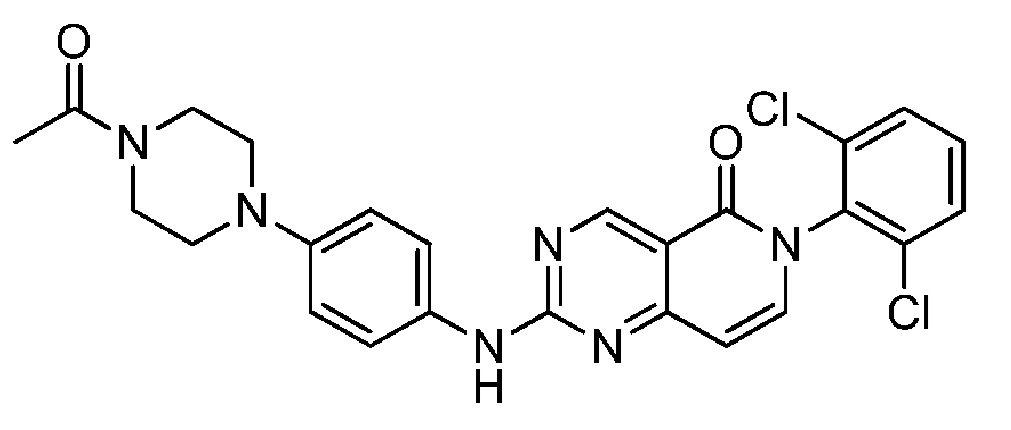
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50,0 мг, 0,148 ммоль) в толуоле (1,5 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и 1-(4-(4-аминофенил)пиперазин-1-ил)этанон (35,7 мг, 0,163 ммоль) [коммерчески доступен], и температуру увеличивают до 60°С. После 22 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая продукт, который дополнительно очищают растиранием с метанолом и получают указанное в названии соединение (47,5 мг, 63%) в виде твердого вещества ярко-желтого цвета. ЖХ-МС (способ А): RT=1,11 мин, m/z=509, 511 [М+Н]+. Спектр 1Н ЯМР (500 МГц, CDCl3): δ 9,32 (с, 1H), 7,61 (шир. д, 2H), 7,55-7,44 (м, 3H), 7,38 (т, 1H), 7,15 (д, 1H), 6,97 (д, 2H), 6,52 (д, 1H), 3,79 (с, 2H), 3,64 (с, 2H), 3,16 (ш, 4Н), 2,15 (с, 3H).
Пример 6: 6-(2,6-дихлорфенил)-2-((4-(1,1-диоксидотиоморфолино)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
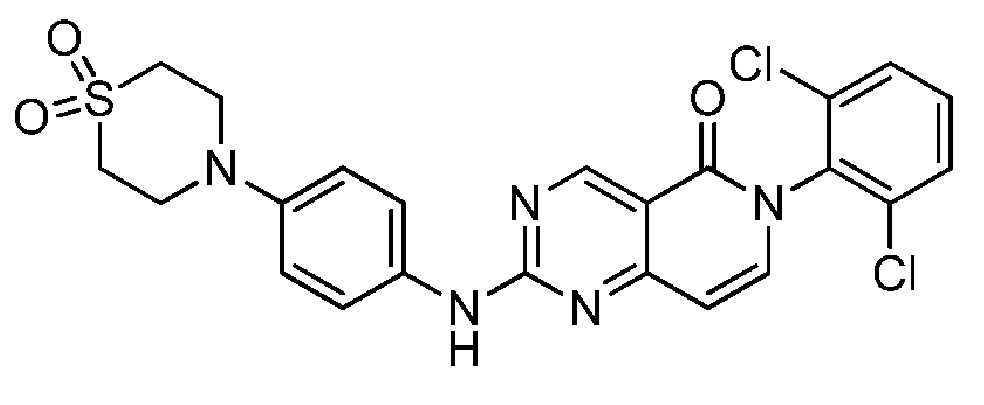
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50,0 мг, 0,148 ммоль) в толуоле (1,5 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и 1,1-диоксида 4-(4-аминофенил)тиоморфолина (36,8 мг, 0,163 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. По прошествии 22 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (41,2 мг, 54%) в виде ярко-желтого твердого вещества. ЖХ-МС (способ А): RT=1,15 мин, m/z=516, 518 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,69 (шир. д, 2H), 7,65-7,62 (м, 2H), 7,52 (дд, 1H), 7,48 (д, 1H), 7,10-7,06 (м, 2H), 6,59 (д, 1H), 3,83 (т, 4Н), 3,17 (т, 4Н).
Пример 7: 6-(2,6-дихлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
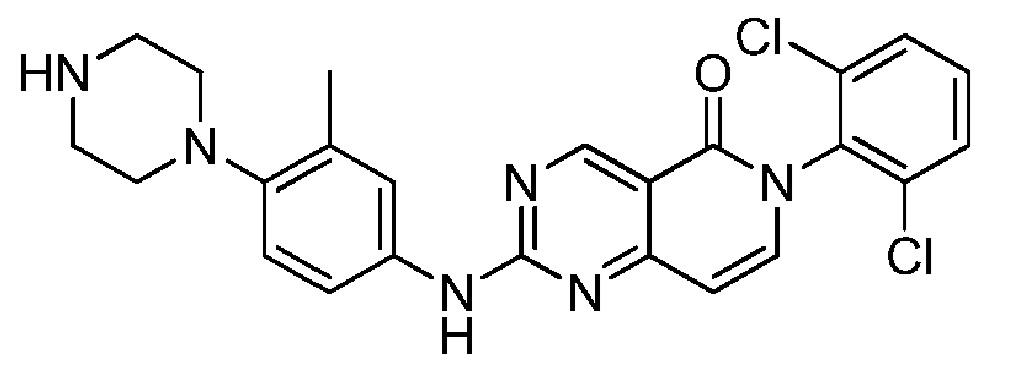
Стадия 1: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,148 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и трет-бутил 4-(4-амино-2-метилфенил)пиперазин-1-карбоксилат (47,4 мг, 0,163 ммоль) [коммерчески доступен], и температуру повышают до 60°С. Через 18 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане), получая указанное в названии соединение (59,7 мг, 69%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,68 мин, m/z=581, 583 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилата (59,7 мг, 0,103 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе) и растворители удаляют в вакууме, получая указанное в названии соединение (46,4 мг, 93%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,90 мин, m/z=481, 483 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,20 (с, 1H), 7,66-7,58 (м, 3H), 7,55-7,50 (м, 2H), 7,48 (д, 1Н), 7,08 (д, 1Н), 6,61 (д, 1H), 3,03 (т, 4Н), 2,91 (т, 4Н), 2,35 (с, 3H).
Пример 8: 6-(2,6-дихлорфенил)-2-((3-(гидроксиметил)-4-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
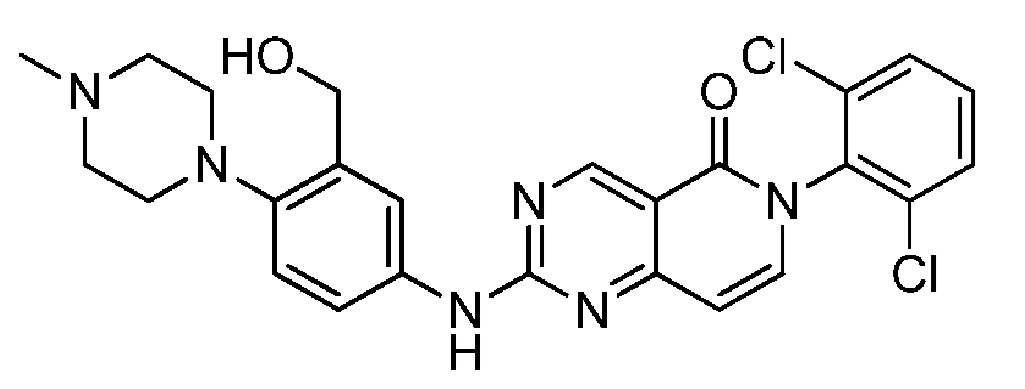
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,148 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и (5-амино-2-(4-метилпиперазин-1-ил)фенил)метанол (36,0 мг, 0,163 ммоль) [коммерчески доступен], и температуру повышают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане, затем 10% МеОН в EtOAc), получая нужное вещество, которое требует дальнейшей очистки с помощью препаративной ВЭЖХ, и получают указанное в названии соединение (25,9 мг, 34%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=0,80 мин, m/z=511, 513 [М+Н]+. Спектр 1Н ЯМР (500 МГц, CDCl3): δ 9,34 (с, 1H), 7,67 (дд, 1H), 7,53-7,48 (м, 3H), 7,42 (с, 1H), 7,38 (дд, 1H), 7,16 (д, 1H), 6,54 (д, 1H), 5,40 (с, 1H), 4,83 (с, 2H), 3,03 (т, 4Н), 2,63 (шир. с, 4H), 2,37 (с, 3H).
Пример 9: 8-бром-6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)аминопиридо[4,3-d]пиримидин-5(6H)-он
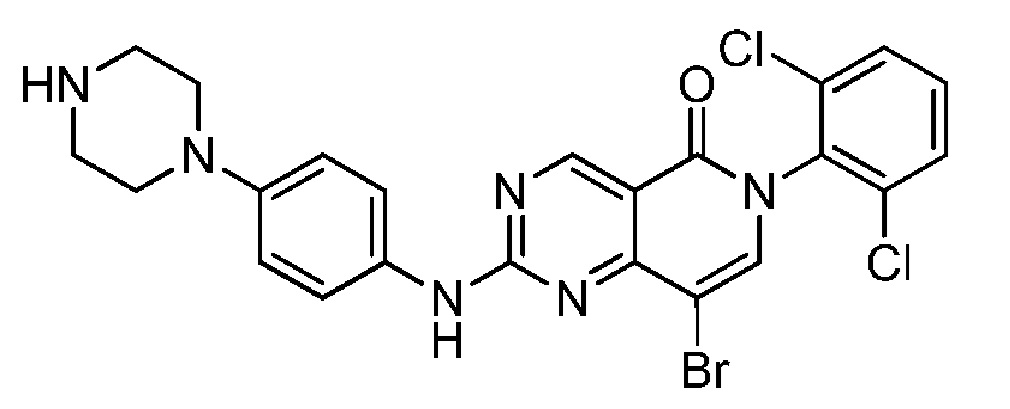
Стадия 1: трет-бутил 4-(4-((8-бром-6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (61,1 мг, предположительно 0,273 ммоль) в DCM (0,5 мл) добавляют к раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (98,4 мг, 0,236 ммоль) в толуоле (4,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,124 мл, 0,708 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (72,0 мг, 0,260 ммоль) [коммерчески доступен], и температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, загружают в колонку KP-NH, очищают флэш-хроматографией (0-50%, EtOAc в циклогексане) и получают указанное в названии соединение (125 мг, 82%) в виде коричневого твердого вещества. ЖХ-МС (способ А): RT=1,67 мин, m/z=647 [М+Н]+.
Стадия 2: 8-бром-6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (0,5 мл, 6,49 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((8-бром-6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (10,0 мг, 0,015 ммоль) в DCM (0,5 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (2×DCM), сушат (в делительном сепараторе), растворители удаляют в вакууме, полученный остаток помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане, затем 0-5% МеОН в EtOAc), получая указанное в названии соединение (2,5 мг, 29%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,97 мин, m/z=547 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,16 (с, 1H), 8,05-7,88 (м, 3H), 7,64 (д, 2H), 7,54 (дд, 1H), 7,02 (д, 2H), 3,14 (т, 4H), 3,00 (т, 4Н).
Пример 10: 6-(2,6-дихлорфенил)-2-((4-(1-метилпиперидин-4-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, HCl
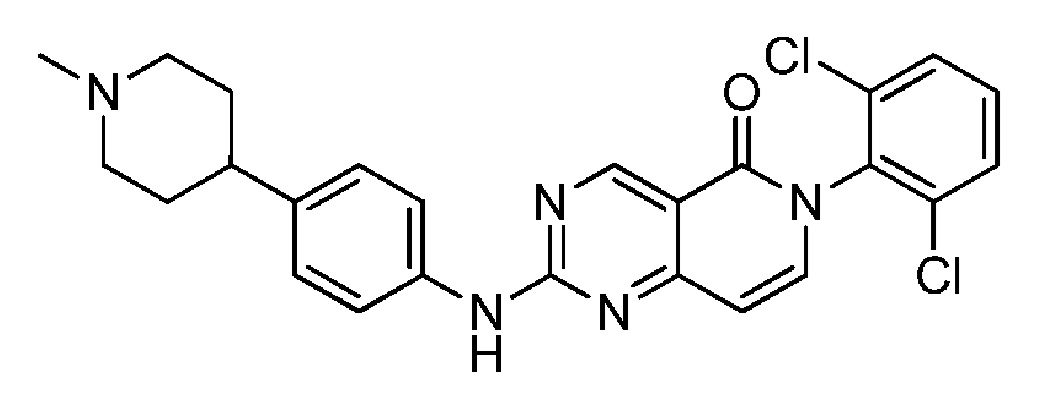
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,148 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и 4-(1-метилпиперидин-4-ил)анилин (30,9 мг, 0,163 ммоль) [коммерчески доступен], и температуру увеличивают до 60°C. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая вещество, которое нуждается в дальнейшей очистке с помощью препаративной ВЭЖХ. Чистые фракции концентрируют в вакууме, полученный остаток растворяют в метаноле (25 мл) и при перемешивании добавляют по каплям раствор ацетилхлорида (0,032 мл, 0,444 ммоль) в метаноле (1,5 мл) [приблизительно 3 экв. 1М раствора НСl в метаноле]. Через 30 мин растворители удаляют в вакууме, а полученный остаток подвергают сублимационной сушке и получают указанное в названии соединение (36,2 мг, 51%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,89 мин, m/z=480, 482 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,24 (с, 1H), 7,79 (д, 2H), 7,64 (д, 2H), 7,55-7,50 (м, 2H), 7,29 (д, 2H), 6,63 (д, 1Н) 3,63 (шир. д, 2H), 3,18 (уширен. т, 2H), 2,95-2,87 (м, 4H), 2,16 (шир. д, 2H), 2,02-1,92 (м, 2H).
Пример 11: 6-(2,6-дихлорфенил)-2-((4-(2-(диметиламино)этил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, HCl
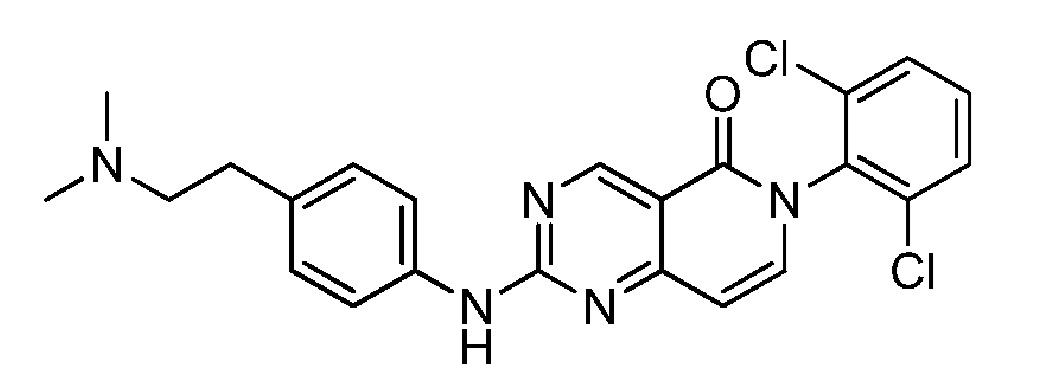
mСРВА (чистота <77%) (38,3 мг, предположительно 0,171 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,148 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин последовательно добавляют DIPEA (0,077 мл, 0,444 ммоль) и 4-(2-(диметиламино)этил)анилин (26,7 мг, 0,163 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане). Полученное в результате вещество требует дальнейшей очистки с помощью препаративной ВЭЖХ. Чистые фракции концентрируют в вакууме, остаток растворяют в метаноле (25 мл) и по каплям при перемешивании добавляют раствор ацетилхлорида (0,032 мл, 0,444 ммоль) в метаноле (1,5 мл) [приблизительно 3 экв. 1М раствора НСl в метаноле]. Через 30 мин растворители удаляют в вакууме, а полученный остаток подвергают сублимационной сушке и получают указанное в названии соединение (31,2 мг, 46%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,79 мин, m/z=454, 456 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,25 (с, 1H), 7,82 (д, 2H), 7,64 (д, 2H), 7,56-7,51 (м, 2H), 7,33 (д, 2H), 6,63 (д, 1H) 3,44-3,39 (м, 2H), 3,09-3,04 (м, 2H), 2,96 (с, 6Н).
Пример 12: 6-(2,6-дихлорфенил)-2-((3-метокси-4-(4-метилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, HCl

mСРВА (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 3-метокси-4-(4-метилпиперазин-1-ил)анилин (72,0 мг, 0,325 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане). Чистые фракции концентрируют в вакууме, полученный остаток растворяют в метаноле (35 мл) и при перемешивании добавляют ацетилхлорид (0,105 мл, 1,478 ммоль) в метаноле (1,5 мл) [приблизительно 5 экв. 1М раствора НСl в MeOH]. Через 30 мин растворители удаляют в вакууме, а полученный остаток подвергают сублимационной сушке, получая вещество, которое требует дополнительной очистки. Остаток растворяют в метаноле и добавляют диэтиловый эфир, чтобы высадить продукт из раствора. Осадок растирают с дополнительным количеством диэтилового эфира и полученное вещество подвергают сублимационной сушке, получая указанное в названии соединение (41,4 мг, 27%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,81 мин, m/z=511, 513 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,23 (с, 1H), 7,70-7,62 (м, 3H), 7,55-7,50 (м, 2H), 3,93 (с, 3H), 3,58 (ш, 4Н), 3,33 (вероятно т, 2H), перекрывается с растворителем, 3,05 (т, 2H), 2,98 (с, 3H).
Пример 13: 6-(2,6-дихлорфенил)-2-((3-метокси-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, НСl
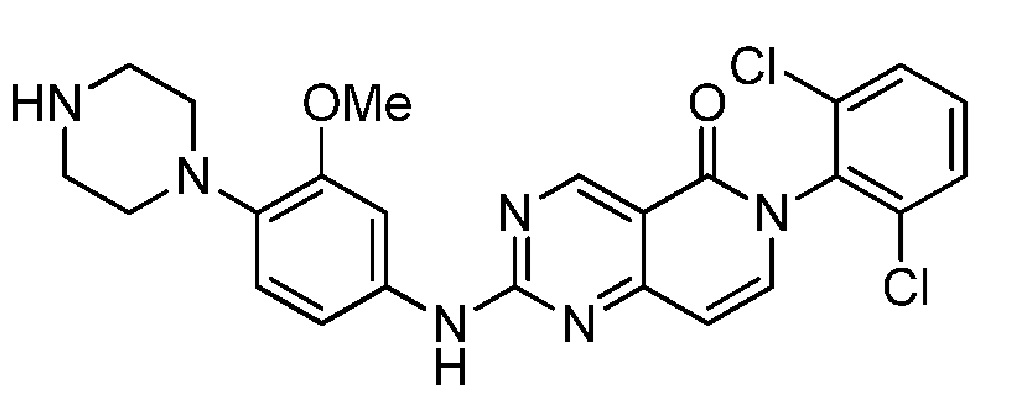
Стадия 1: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метоксифенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 4-(4-амино-2-метоксифенил)пиперазин-1-карбоксилат (100 мг, 0,325 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (149 мг, 84%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,51 мин, m/z=597, 599 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-((3-метокси-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, НСl: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метоксифенил)пиперазин-1-карбоксилата (149 мг, 0,249 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 1 час растворители удаляют в вакууме, и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), и растворители удаляют в вакууме. Полученный остаток растворяют в метаноле и добавляют 5 экв. 1М раствора НСl в метаноле [Примечание: получают путем добавления AcCl к МеОН]. После перемешивания в течение 30 мин растворители удаляют в вакууме, и полученный остаток подвергают сублимационной сушке, получая желаемое вещество, которое требует дальнейшей очистки. Вещество растворяют в МеОН и добавляют диэтиловый эфир, чтобы высвободить продукт. Полученный осадок растирают с дополнительным количеством диэтилового эфира и остатки растворителей удаляют в вакууме. Полученный остаток лиофилизуют и получают указанное в названии соединение (101 мг, 76%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,81 мин, m/z=497, 499 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,25 (с, 1H), 7,70-7,62 (м, 3H), 7,57-7,52 (м, 2H), 7,35 (дд, 1H), 7,07 (д, 1Н) 6,64 (д, 1H), 3,95 (с, 3H), 3,41 (т, 4Н), 3,34 (т, 4Н).
Пример 14: 6-(2,6-дихлорфенил)-8-(3-гидроксипроп-1-ин-1-ил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
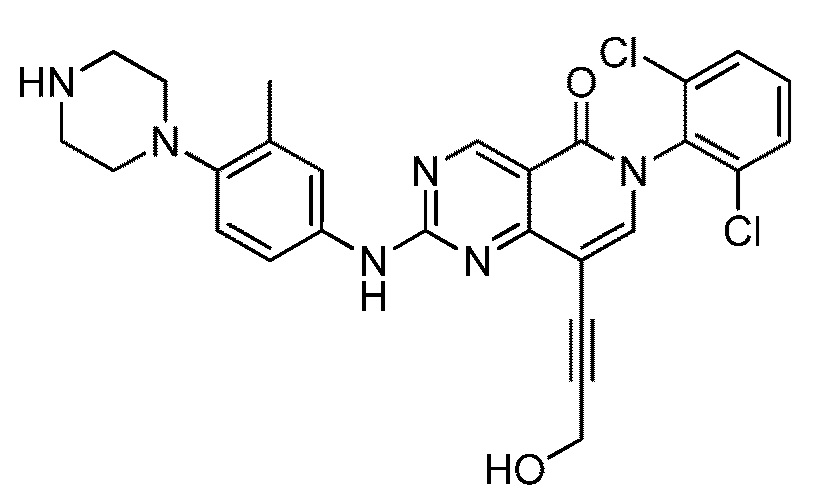
Стадия 1: 6-(2,6-дихлорфенил)-2-(метилтио)-8-(3-((тетрагидро-2Н-пиран-2-ил)окси)проп-1-ин-1-ил)пиридо[4,3-d]пиримидин-5(6H)-он: Иодид меди(I) (0,6 мг, 3,0 мкмоль) и хлорид бис(трифенилфосфин)палладия(II) (4,2 мг, 6,0 мкмоль) добавляют к предварительно дегазированному раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,120 ммоль), 2-(проп-2-ин-1-илокси)тетрагидро-2Н-пирана (33,6 мг, 0,240 ммоль) и иодида тетрабутиламмония (89 мг, 0,240 ммоль) в смеси триэтиламина (0,2 мл, 1,44 ммоль) и ДМФА (1,0 мл) во флаконе емкостью 10 мл. Реакционный сосуд герметично закрывают и нагревают в микроволновой печи (CEM Explorer/Discover) до температуры 100°С (максимум 80 Вт) в течение 15 мин. Поскольку реакция проходит не полностью, реакционную смесь повторно нагревают до температуры 100°C (максимум 80 Вт) в течение 15 мин. Поскольку реакция проходит не полностью, реакционную смесь вновь нагревают до 120°С в течение 20 мин. Реакционную смесь распределяют между диэтиловым эфиром и смесью 1:1 вода/насыщенный раствор соли, разделяют, экстрагируют (диэтиловый эфир ×3), органическую фазу сушат (в делительном сепараторе), растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (34,3 мг, 60%) в виде желтого масла. ЖХ-МС (способ А): RT=1,61 мин, m/z=476, 478 [М+Н]+.
Стадия 2: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-8-(3-((тетрагидро-2Н-пиран-2-ил)окси)проп-1-ин-1-ил)-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (18,6 мг, предположительно 0,083 ммоль) в DCM (0,5 мл) добавляют при перемешивании к раствору 6-(2,6-дихлорфенил)-2-(метилтио)-8-(3-((тетрагидро-2Н-пиран-2-ил)окси)проп-1-ин-1-ил)пиридо[4,3-d]пиримидин-5(6H)-она (34,3 мг, 0,072 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,038 мл, 0,216 ммоль) и трет-бутил 4-(4-амино-2-метилфенил)пиперазин-1-карбоксилат (21,0 мг, 0,072 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-30%, EtOAc в циклогексане), получая указанное в названии соединение (15,5 мг, 30%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=1,87 мин, m/z=719, 721 [М+Н]+.
Стадия 3: 6-(2,6-дихлорфенил)-8-(3-гидроксипроп-1-ин-1-ил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (1,0 мл, 13,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-8-(3-((тетрагидро-2Н-пиран-2-ил)окси)проп-1-ин-1-ил)-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилата (15,5 мг, 0,022 ммоль) в DCM (1,0 мл) при комнатной температуре в атмосфере азота. Через 4 час растворители удаляют в вакууме и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают с помощью флэш-хроматографии с использованием колонки KP-NH (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc), получая указанное в названии соединение (6,5 мг, 56%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,82 мин, m/z=535, 537 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 8,00-7,74 (м, 3H), 7,64 (д, 2H), 7,54 (т, 1H), 7,09 (д, 1Н), 4,50 (с, 2H), 3,04 (т, 4Н), 2,92 (т, 4Н), 2,37 (с, 3H).
Пример 15: 6-(2,6-дихлорфенил)-2-((4-(4-метилпиперазин-1-ил)фенил)аминопиридо[4,3-d]пиримидин-5(6H)-он
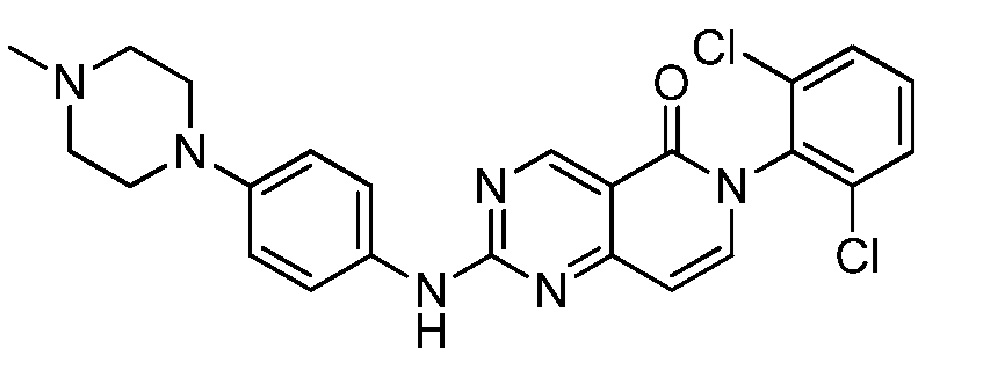
mСРВА (чистота <77%) (57,4 мг, предположительно 0,256 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (75 мг, 0,222 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин добавляют дополнительное количество mCPBA (20 мг). Еще через 15 мин последовательно добавляют DIPEA (0,116 мл, 0,665 ммоль) и 4-(4-метилпиперазин-1-ил)анилин (42,4 мг, 0,222 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая указанное в названии соединение (50,8 мг, 47%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,78 мин, m/z=481, 483 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,68-7,61 (м, 4H), 7,52 (дд, 1H), 7,47 (д, 1Н), 7.03-6.99 (м, 2H), 6,60 (д, 1H), 3,21 (т, 4Н), 2,64 (т, 4Н), 2,36 (с, 3H).
Пример 16: 6-(2,6-дихлорфенил)-2-((4-(2-(метиламино)этокси)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, HCl
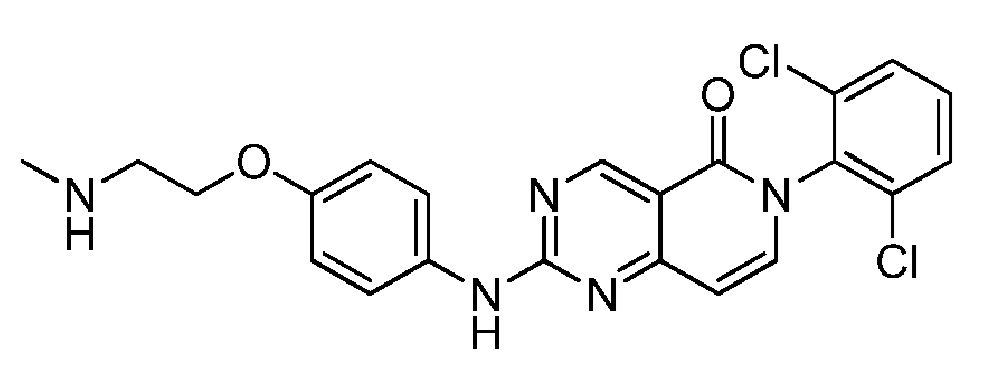
Стадия 1: трет-бутил (2-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенокси)этил)(метил)карбамат: mCPBA (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин добавляют дополнительное количество mCPBA (30 мг). Еще через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил (2-(4-аминофенокси)этил)(метил)карбамат (79 мг, 0,296 ммоль) [получают в соответствии с приведенной в литературе методикой из WO 2011/140009 (промежуточное соединение в примере 64)] в толуоле (0,5 мл), а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане), получая указанное в названии соединение (58,3 мг, 0,105 ммоль, 35%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=1,54 мин, m/z=556, 558 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-((4-(2-(метиламино)этокси)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он, НСl: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил (2-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенокси)этил)(метил)карбамата (58,3 мг, 0,105 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме, полученный остаток растворяют в МеОН (10 мл) и обрабатывают 5 эквивалентами приблизительно 1М раствора НСl в MeOH (предварительно получают, добавляя ацетилхлорид (0,037 мл, 0,524 ммоль) в 0,5 мл MeOH). Через 30 мин растворители удаляют в вакууме, а полученный остаток подвергают сублимационной сушке и получают указанное в названии соединение (48,7 мг, 90%) в виде темно-желтого твердого вещества. ЖХ-МС (способ Х): RT=0,78 мин, m/z=456, 458 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,22 (с, 1Н), 7,72 (шир. д, 2H), 7,64 (д, 2H), 7,56-7,50 (м, 2H), 7,08-7,03 (м, 2H), 6,60 (д, 1H), 4,30 (т, 2H), 3,47 (т, 2H), 2,81 (с, 3H).
Пример 17: 6-(2,6-дихлорфенил)-2-((4-(4-изопропилпиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
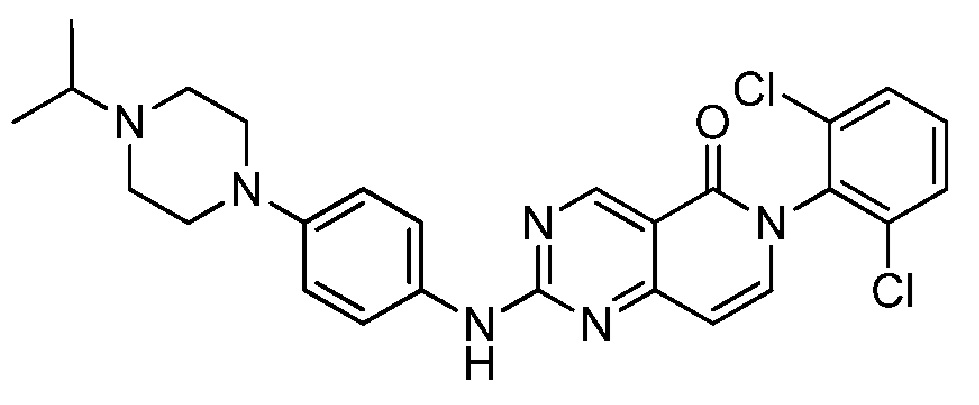
mСРВА (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 4-(4-изопропилпиперазин-1-ил)анилин (71,3 мг, 0,325 ммоль) [полученный согласно приведенной в литературе методике из WO 2008/065199 (примеры D.5 и D.6)], а температуру увеличивают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане). Полученное в результате вещество требует дальнейшей очистки с помощью препаративной ВЭЖХ. Полученное в результате вещество требует дальнейшей очистки с помощью флэш-хроматографии (0-30% EtOAc в циклогексане), в итоге получают указанное в названии соединение (59,0 мг, 39%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,84 мин, m/z=509, 511 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,68-7,59 (м, 4H), 7,52 (дд, 1H), 7,47 (д, 1Н), 7,04-6,99 (м, 2H), 6,60 (д, 1H), 3,21 (т, 4Н), 2,79-2,69 (м, 5Н), 1,15 (с, 3H), 1,13 (с, 3H).
Пример 18: 6-(2,6-дихлорфенил)-2-((3-(гидроксиметил)-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-один
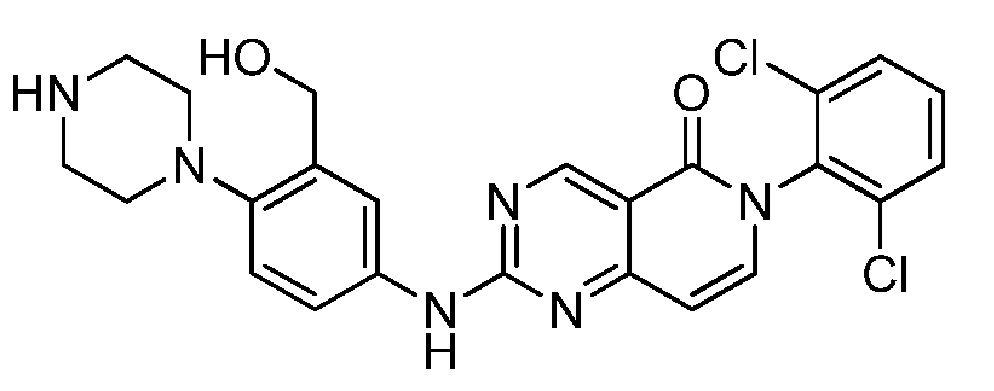
Стадия 1: трет-бутил 4-(4-амино-2-(гидроксиметил)фенил)пиперазин-1-карбоксилат: Формиат аммония (1,47 г, 23,2 ммоль) осторожно добавляют [примечание: реакция экзотермическая] при перемешивании к раствору трет-бутил 4-(2-(гидроксиметил)-4-нитрофенил)пиперазин-1-карбоксилата (1,57 г, 4,65 ммоль) [получают согласно приведенной в литературе методике из J. Med. Chem. 2011, 54 (13), 4638-4658 (соединения 9b и 10d)] и 10%-ного палладия на угле (0,247 г, 0,232 ммоль) в этаноле (15 мл) в круглодонной колбе емкостью 100 мл при комнатной температуре в атмосфере азота. Через 16 час реакционную смесь фильтруют через Celite® и растворители удаляют в вакууме. Полученный остаток распределяют между насыщенным водным раствором бикарбоната натрия (30 мл) и DCM (30 мл), разделяют и экстрагируют с использованием дополнительного количества DCM (2×15 мл). Органическую фазу объединяют, сушат (в делительном сепараторе) и растворители удаляют в вакууме, получая указанное в названии соединение (1,40 г, 98%) в виде бледно-коричневого пенообразного вещества. ЖХ-МС (способ А): RT=0,72 мин, m/z=308 [М+Н]+.
Стадия 2: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-(гидроксиметил)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 4-(4-амино-2-(гидроксиметил)фенил)пиперазин-1-карбоксилат (100 мг, 0,325 ммоль), и температурой повышают до 60°С. Через 16 час реакционной смеси дают охладиться, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане). Чистые фракции концентрируют и получают указанное в названии соединение (59,7 мг, 34%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,42 мин, m/z=597, 599 [М+Н]+.
Стадия 3: 6-(2,6-дихлорфенил)-2-((3-(гидроксиэтил)-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-(гидроксиметил)фенил)пиперазин-1-карбоксилата (59,7 мг, 0,100 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают с помощью флэш-хроматографии с использованием колонки KP-NH (0-100% EtOAc в циклогексане), получая вещество, которое нуждается в дальнейшей очистке с помощью препаративной ВЭЖХ. Чистые фракции концентрируют и получают указанное в названии соединение (14,5 мг, 29%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,75 мин, m/z=497, 498 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,22 (с, 1Н), 7,82 (с, 1H), 7,72 (шир. д, 1H), 7,64 (д, 2H), 7,53 (дд, 1H), 7,49 (д, 1Н), 7,18 (д, 1H), 6,64 (д, 1H), 4,77 (с, 2H, перекрывается с растворителем), 2,99 (т, 4Н), 2,91 (т, 4Н).
Пример 19: 6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
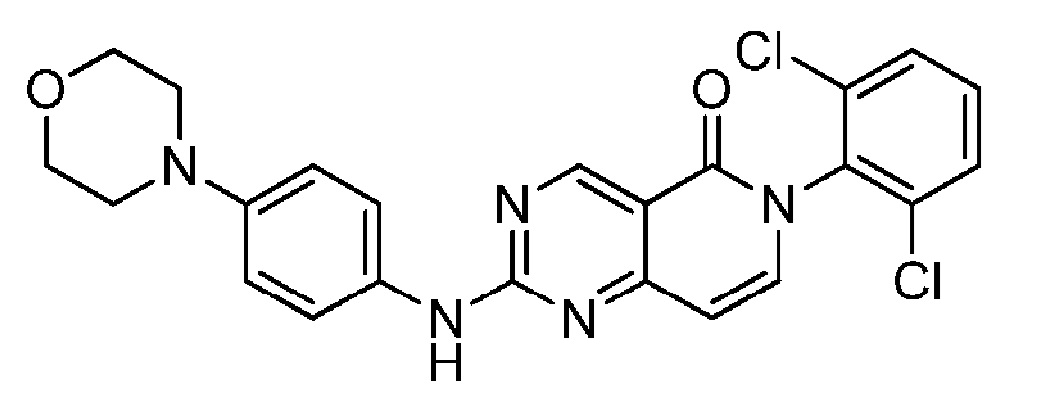
mСРВА (чистота <77%) (102 мг, предположительно 0,455 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 1 час последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 4-морфолиноанилин (52,7 мг, 0,296 ммоль) [коммерчески доступен], а температуру увеличивают до 60°С. Через 20 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая указанное в названии соединение (49,1 мг, 35%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,23 мин, m/z=468, 470 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,71-7,61 (м, 4H), 7,52 (дд, 1H), 7,47 (д, 1Н), 7,03-6,99 (м, 2H), 6,59 (д, 1H), 3,85 (т, 4Н), 3,14 (т, 4Н).
Пример 20: 6-(2,6-дихлорфенил)-2-((3-((метиламино)метил)-4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
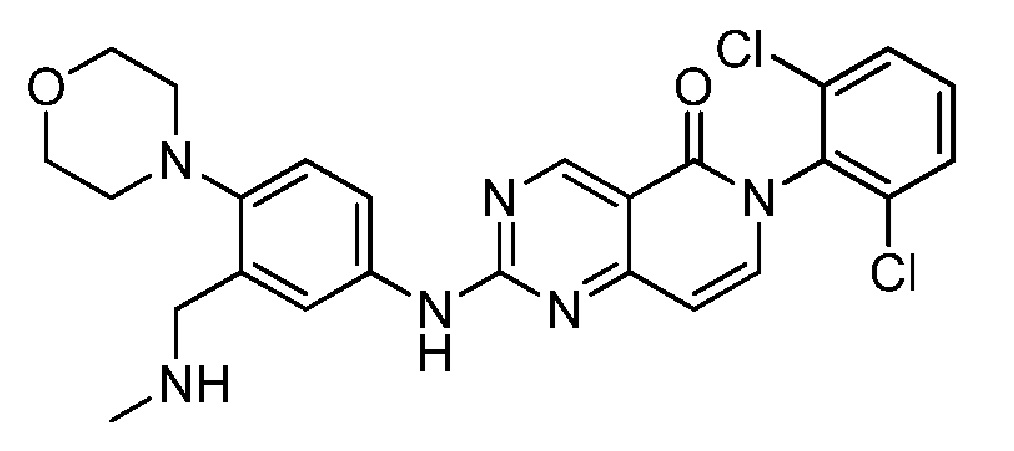
Стадия 1: 2-морфолино-5-нитробензальдегид: К раствору 2-хлор-5-нитробензальдегида (3,00 г, 16,2 ммоль) в ДМФА (20 мл) добавляют DIPEA (4,24 мл, 24,3 ммоль) и морфолин (1,55 г, 17,8 ммоль). Реакционную смесь перемешивают при 90°С в течение 4 час. Реакционную смесь охлаждают до комнатной температуры и добавляют воду. Смесь экстрагируют с помощью EtOAc. Органический слой промывают насыщенным раствором соли, сушат над Na2SO4, отфильтровывают и растворители удаляют в вакууме, получая указанное в названии соединение (3,2 г сырого продукта, 85%), которое используют на следующей стадии без дополнительной очистки. ЖХ-МС (способ А): RT=0,99 мин, m/z=237 [М+Н]+.
Стадия 2: N-метил-1-(2-морфолино-5-нитрофенил)метанамин: К суспензии бикарбоната натрия (0,356 г, 4,23 ммоль) в МеОН (6 мл) добавляют 2-морфолино-5-нитробензальдегид (0,5 г, 2,12 ммоль) и метиламин (2M раствор в MeOH) (1,27 мл, 2,54 ммоль). Реакционную смесь перемешивают при температуре 70°С. Через 4 час реакционную смесь охлаждают до 0°C и добавляют боргидрид натрия (0,096 г, 2,54 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 час. Добавляют несколько капель воды и растворители удаляют в вакууме. Полученный остаток распределяют между DCM и насыщенным раствором соли, разделяют, экстрагируют с помощью дополнительного количества DCM, сушат над Na2SO4, отфильтровывают и растворители удаляют в вакууме, получая указанное в названии соединение (сырой продукт, 450 мг, 85%), которое используют на следующей стадии без дальнейшей очистки. ЖХ-МС (способ А): RT=0,47 мин, m/z=221 [М+Н-30 (CH3NH)]+.
Стадия 3: трет-бутил метил(2-морфолино-5-нитробензил)карбамат: К раствору N-метил-1-(2-морфолино-5-нитрофенил)метанамина (450 мг, 1,79 ммоль) в ТГФ (5 мл) добавляют триэтиламин (0,50 мл, 3,58 ммоль) и Boc2O (0,46 мл, 1,97 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 час. Добавляют воду и реакционную смесь экстрагируют с помощью EtOAc. Органические фазы объединяют, промывают водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворители удаляют в вакууме, получая указанное в названии соединение (сырой продукт, 622 мг, 99%), которое используют на следующей стадии без дополнительной очистки. ЖХ-МС (способ А): RT=1,39 мин, m/z=296 [М+Н-56 (tBu)]+.
Стадия 4: трет-бутил 5-амино-2-морфолинобензил(метил)карбамат: К раствору трет-бутил метил(2-морфолино-5-нитробензил)карбамата (640 мг, 1,82 ммоль) в этаноле (4 мл) добавляют 10%-ный палладий на угле (194 мг, 0,182 ммоль) и формиат аммония (230 мг, 3,64 ммоль). Реакционную смесь перемешивают при температуре 60°С в течение 3 час. Смесь фильтруют через Celite® и фильтрат концентрируют в вакууме. Полученный остаток распределяют между EtOAc и насыщенным водным раствором бикарбоната натрия, разделяют, органическую фазу промывают насыщенным раствором соли, сушат над Na2SO4, отфильтровывают и растворители удаляют в вакууме, получая указанное в названии соединение (сырой продукт, 580 мг, 99%), которое использовали на следующей стадии без дополнительной очистки. ЖХ-МС (способ А): RT=0,83 мин, m/z=322 [М+Н]+.
Стадия 5: трет-бутил 5-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-морфолинобензил(метил)карбамат: mCPBA (чистота <77%) (102 мг, предположительно 0,455 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6) дихлорфенил-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 5-амино-2-морфолинобензил(метил)карбамата (95 мг, 0,296 ммоль) в ДМФА (0,5 мл), а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане), получая указанное в названии соединение (32,7 мг, 18%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=1,55 мин, m/z=611, 613 [М+Н]+.
Стадия 6: 6-(2,6-дихлорфенил)-2-((3-((метиламино)метил)-4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 5-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-морфолинобензил(метил)карбамата (32,7 мг, 0,053 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 2 час, поскольку реакция не закончилась, добавляют дополнительное количество TFA (2,0 мл, 26,0 ммоль). Через 6 час растворители удаляют в вакууме и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают с помощью флэш-хроматографии (0-100% EtOAc в циклогексане, затем 0-5% МеОН в EtOAc), получая указанное в названии соединение (16,2 мг, 58%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,84 мин, m/z=511, 513 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,22 (с, 1Н), 7,77 (шир. д, 1H), 7,70 (д, 1Н), 7,64 (д, 2H), 7,53 (дд, 1H), 7,50 (д, 1H), 7,26 (д, 1H), 6,64 (д, 1H), 3,87 (с, 2H), 3,85 (т, 4Н), 2,93 (т, 4Н), 2,45 (с, 3H).
Пример 21: 6-(2,6-дихлорфенил)-2-((4-(4-(2-гидроксиэтил)пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
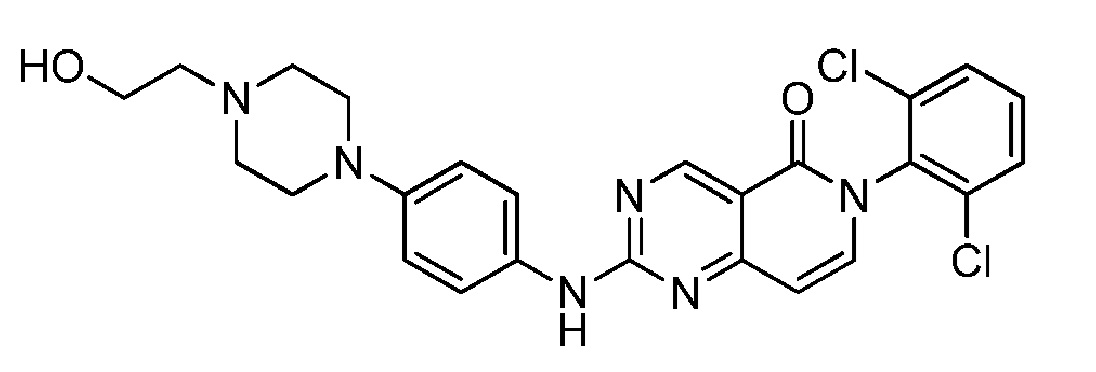
mСРВА (чистота <77%) (102 мг, предположительно 0,455 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 2-(4-(4-аминофенил)пиперазин-1-ил)этанол (65,4 мг, 0,296 ммоль) [коммерчески доступен], и температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая вещество, которое нуждается в дальнейшей очистке с помощью препаративной ВЭЖХ. Чистые фракции концентрируют и получают указанное в названии соединение (39,8 мг, 26%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,80 мин, m/z=511, 513 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,19 (с, 1H), 7,70-7,60 (м, 4H), 7,52 (дд, 1H), 7,47 (д, 1Н), 7,02 (д, 2H), 6,60 (д, 1Н), 3,75 (т, 2H), 3,23 (т, 4Н), 2,77 (м, 4Н), 2,66 (т, 2H).
Пример 22: 8-(3-аминопроп-1-ин-1-ил)-6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
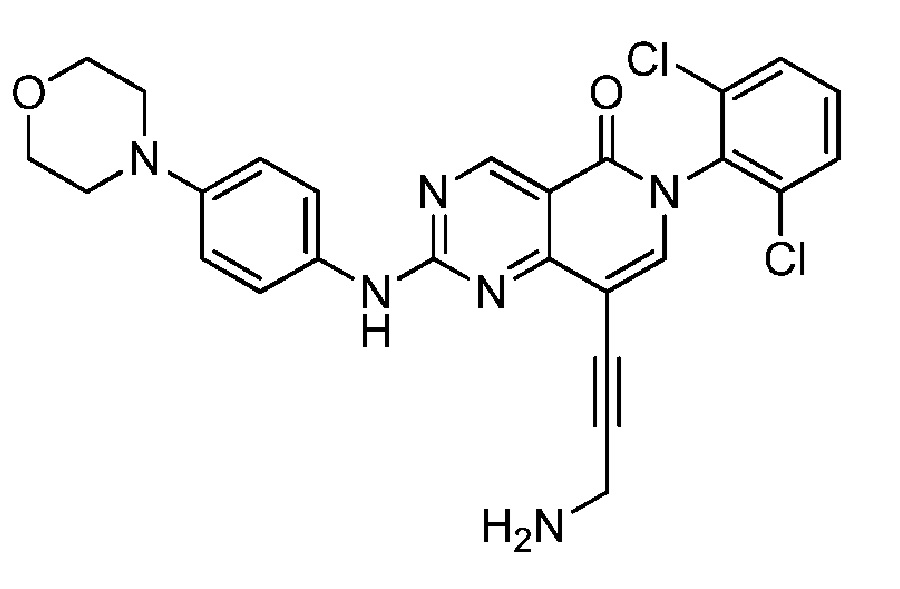
Стадия 1: трет-бутил (3-(6-(2,6-дихлорфенил)-2-(метилтио)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)проп-2-ин-1-ил)карбамат: Иодид меди(I) (0,6 мг, 3,0 мкмоль) и хлорид бис(трифенилфосфин)палладия(II) (4,2 мг, 6,0 мкмоль) добавляют к предварительно дегазированному раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,120 ммоль), трет-бутил проп-2-ин-1-илкарбамата (37,2 мг, 0,240 ммоль) и иодида тетрабутиламмония (89 мг, 0,240 ммоль) в смеси триэтиламина (0,2 мл, 1,435 ммоль) и ДМФА (1,0 мл) во флаконе емкостью 10 мл. Реакционный сосуд герметично закрывают и нагревают в микроволновой печи (CEM Explorer/Discover) до температуры 100°С (максимум 80 Вт) в течение 15 мин. Поскольку реакция проходит не полностью, смесь повторно нагревают до температуры 100°C (максимум 80 Вт) еще в течение 45 мин. Реакционную смесь распределяют между диэтиловым эфиром и смесью 1:1 вода/насыщенный раствор соли, разделяют, экстрагируют (диэтиловый эфир ×3), сушат (в делительном сепараторе), растворители удаляют в вакууме, а полученный остаток очищают с помощью флэш-хроматографии (0-100%, EtOAc в циклогексане) и получают указанное в названии соединение (45,4 мг, 77%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,50 мин, m/z=491, 493 [М+Н]+.
Стадия 2: трет-бутил (3-(6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)проп-2-ин-1-ил)карбамат: mCPBA (чистота <77%) (31,9 мг, предположительно 0,142 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору трет-бутил (3-(6-(2,6-дихлорфенил)-2-(метилтио)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)проп-2-ин-1-ил)карбамата (45,4 мг, 0,092 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,048 мл, 0,277 ммоль) и 4-морфолиноанилин (16,47 мг, 0,092 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50% EtOAc в циклогексане), получая указанное в названии соединение (19,8 мг, 35%) в виде желтого масла. ЖХ-МС (способ А): RT=1,45 мин, m/z=621, 623 [М+Н]+.
Стадия 3: 8-(3-аминопроп-1-ин-1-ил)-6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил (3-(6-(2,6-дихлорфенил)-2-((4-морфолинофенил)амино)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)проп-2-ин-1-ил)карбамата (45,4 мг, 0,073 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (12,0 мг, 31%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,83 мин, m/z=521, 523 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,18 (с, 1H), 7,91 (шир. с, 2Н), 7,83 (с, 1H), 7,65 (д, 2H), 7,54 (д, 1H), 7,04-6,99 (м, 2H), 3,85 (т, 4Н), 3,80 (с, 2H), 3,14 (т, 4Н).
Пример 23: 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)-8-(пиридин-3-ил)пиридо[4,3-d]пиримидин-5(6H)-он
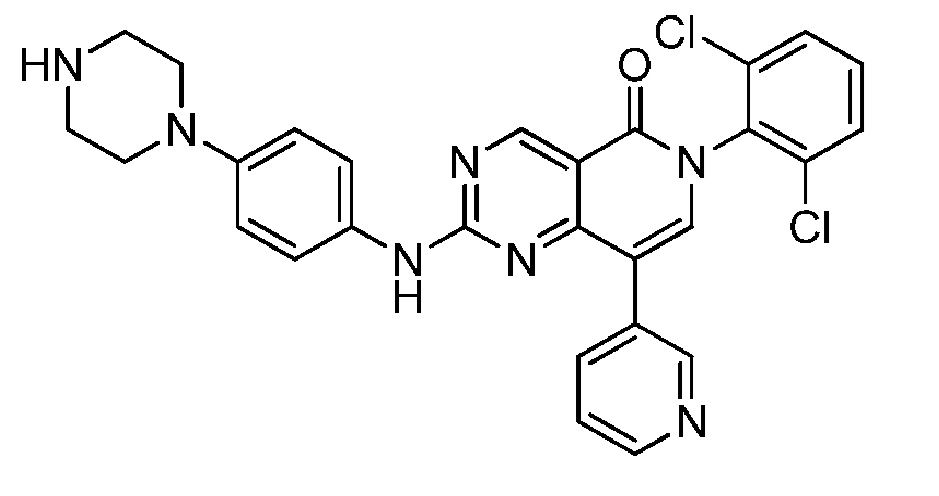
Стадия 1: 6-(2,6-дихлорфенил)-2-(метилтио)-8-(пиридин-ил)пиридо[4,3-d]пиримидин-5(6H)-он: PdCl2(dppf).DCM (2,9 мг, 3,6 мкмоль) добавляют к предварительно дегазированному раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (30 мг, 0,072 ммоль), пиридин-3-илбороновой кислоты (13,3 мг, 0,108 ммоль) и карбоната цезия (70,3 мг, 0,216 ммоль) в смеси 1,4-диоксана (1,8 мл) и воды (0,2 мл) во флаконе емкостью 10 мл. Сосуд закрывают и подвергают ВЧ облучению при 120°С в течение 20 мин (CEM Discover/Explorer24). Поскольку реакция проходит не полностью, реакционную смесь повторно нагревают в тех же условиях. Реакционную смесь концентрируют в вакууме, чтобы удалить 1,4-диоксан, а затем распределяют между DCM и насыщенным водным раствором бикарбоната натрия. Слои разделяют, водную фазу экстрагируют (DCM×2), объединенные органические фазы сушат (в делительном сепараторе), растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100%, EtOAc в циклогексане) и получают указанное в названии соединение (25,0 мг, 84%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,12 мин, m/z=415, 417 [М+Н]+.
Стадия 2: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-8-(пиридин-3-ил)-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (15,6 мг, предположительно 0,0693 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)-8-(пиридин-3-ил)пиридо[4,3-d]пиримидин-5(6H)-она (25,0 мг, 0,060 ммоль) в толуоле (2,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин добавляют последовательно DIPEA (0,032 мл, 0,181 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (16,7 мг, 0,060 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая указанное в названии соединение (15,5 мг, 40%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,40 мин, m/z=644, 646 [М+Н]+.
Стадия 3: 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)-8-(пиридин-3-ил)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (1,0 мл, 12,98 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-8-(пиридин-3-ил)-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (5,8 мг, 9,0 мкмоль) в DCM (1,0 мл) при комнатной температуре в атмосфере азота. Через 1 час растворители удаляют в вакууме и полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают с помощью флэш-хроматографии с использованием колонки KP-NH (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc), получая указанное в названии соединение (4,5 мг, 92%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,76 мин, m/z=544, 546 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,28 (с, 1H), 8,84 (д, 1H), 8,56 (д, 1Н), 8,14 (дт, 1H), 7,82 (с, 1Н), 7,66 (д, 2H), 7,60-7,51 (м, 4H), 6,92 (шир. дублет, 2H), 3,24 (ш, 4Н), 3,19 (ш, 4Н).
Пример 24: 6-(2-хлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
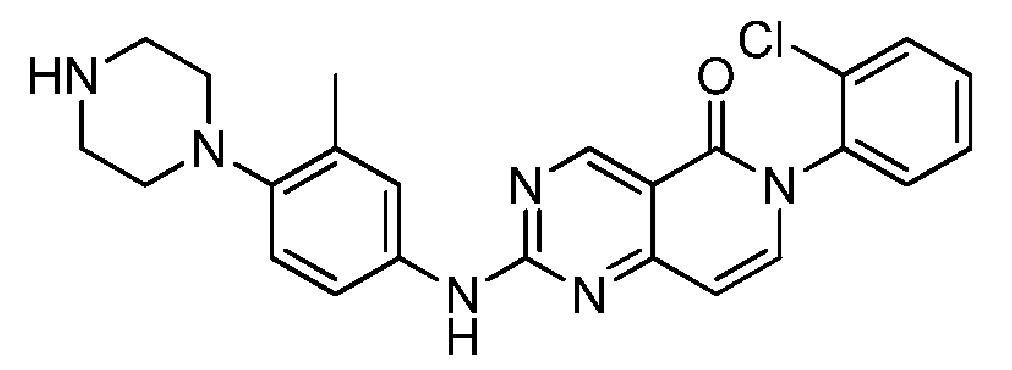
Стадия 1: N-(2-хлорфенил)-4-метил-2-(метилтио)пиримидин-5-карбоксамид: Трихлорид фосфора (0,237 мл, 2,71 ммоль) добавляют к перемешиваемому раствору 4-метил-2-(метилтио)пиримидин-5-карбоновой кислоты (500 мг, 2,71 ммоль) и 2-хлоранилина (0,285 мл, 2,71 ммоль) в хлорбензоле (10 мл) при температуре 135°С в атмосфере азота. Через 1 час реакционной смеси дают остыть и распределяют между DCM и 2М водным раствором карбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе) и растворители удаляют в вакууме, получая указанное в названии соединение (699 мг, 88%) в виде желтого твердого вещества, которое переносят на следующую стадию без дополнительной очистки. ЖХ-МС (способ А): RT=1,21 мин, m/z=294 [М+Н]+.
Стадия 2: 6-(2-хлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-он: ДМФА-DMA (0,382 мл, 2,85 ммоль) добавляют к перемешиваемому раствору N-(2-хлорфенил)-4-метил-2-(метилтио)пиримидин-5-карбоксамида (699 мг, 2,38 ммоль) в ДМФА (7,0 мл) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают до 150°С. Через 1 час реакционную смесь охлаждают и распределяют, используя диэтиловый эфир и смесь 1:1 насыщенный раствор соли/вода, разделяют, дополнительно промывают смесью 1:1 насыщенный раствор соли/вода, органическую фазу сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане), получая указанное в названии соединение (391 мг, 54%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=1,21 мин, m/z=304 [М+Н]+.
Стадия 3: трет-бутил 4-(4-((6-(2-хлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (85 мг, предположительно 0,380 ммоль) в DCM (0,5 мл) добавляют при перемешивании к раствору 6-(2-хлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,329 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,172 мл, 0,988 ммоль) и трет-бутил 4-(4-амино-2-метилфенил)пиперазин-1-карбоксилат (96 мг, 0,329 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50% EtOAc в циклогексане), получая указанное в названии соединение (134 мг, 75%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,63 мин, m/z=547 [М+Н]+.
Стадия 4: 6-(2-хлорфенил)-2-((3-метил-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (1,0 мл, 13,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2-хлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-метилфенил)пиперазин-1-карбоксилата (134 мг, 0,245 ммоль) в DCM (1,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, а полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают с помощью флэш-хроматографии с использованием колонки KP-NH (0-100% EtOAc в циклогексане), получая указанное в названии соединение (56,1 мг, 51%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,82 мин, m/z=447 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,20 (с, 1H), 7,67-7,63 (м, 1Н), 7,61 (шир. д, 1H), 7,55-7,49 (м, 5Н), 7,07 (д, 1H), 6,56 (д, 1H), 3,00 (т, 4Н), 2,89 (т, 4Н), 2,34 (с, 3H).
Пример 25: 2-((3-(аминометил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он
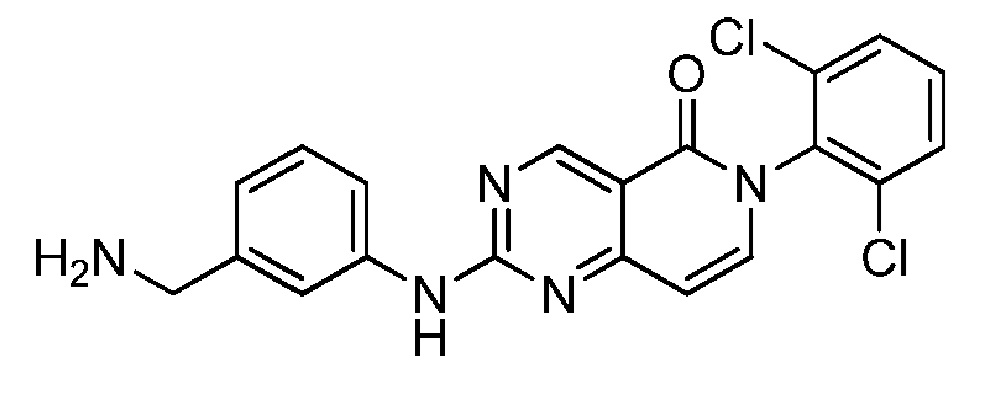
Стадия 1: трет-бутил 3-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)бензилкарбамат: mCPBA (<77% чистоты) (102 мг, предположительно 0,455 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 3-аминобензилкарбамат (65,7 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 18 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50% EtOAc в циклогексане), получая указанное в названии соединение (59,9 мг, 40%) в виде желтой смолы. ЖХ-МС (способ А): RT=1,43 мин, m/z=512, 514 [М+Н]+.
Стадия 2: 2-((3-(аминометил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) при перемешивании добавляют к раствору трет-бутил 3-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)бензилкарбамата (59,9 мг, 0,117 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc), получая указанное в названии соединение (33,7 мг, 70%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,80 мин, m/z=412, 414 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,24 (с, 1H), 7,77-7,71 (м, 2H), 7,66-7,62 (м, 2H), 7,53 (дд, 1H), 7,51 (д, 1Н) , 7,34 (т, 1H), 7,11 (шир. д, 1H), 6,66 (д, 1H), 3,84 (с, 2H).
Пример 26: 6-(2,6-дихлорфенил)-2-((3-(4-метилпиперазин-1-ил)фенил)аминопиридо[4,3-d]пиримидин-5(6H)-он
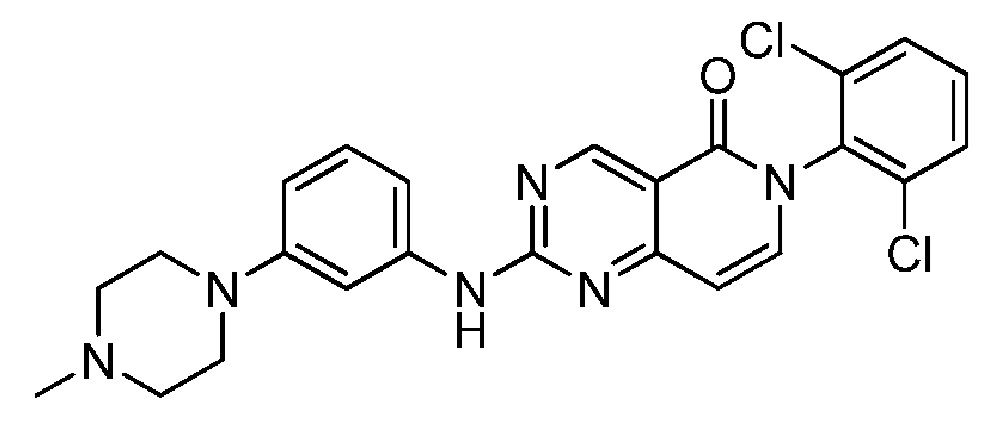
mСРВА (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин добавляют дополнительное количество mCPBA (23 мг). Еще через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 3-(4-метилпиперазин-1-ил)анилин (56,6 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (41,8 мг, 29%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=0,84 мин, m/z=481, 483 [М+Н]+. Спектр 1Н ЯМР (500 МГц, CDCl3): δ 9,35 (с, 1Н), 7,53-7,42 (м, 4H), 7,38 (дд, 1H), 7,17-7,11 (м, 2H), 6,71 (д, 1H), 6,53 (д, 1Н), 3,31 (шир. с, 4H), 2,67 (шир. с, 4H), 2,42 (с, 3H).
Пример 27: 2-((3-хлор-4-(пиперазин-1-ил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он
Стадия 1: трет-бутил 4-(2-хлор-4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) при перемешивании добавляют к раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 20 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 4-(4-амино-2-хлорфенил)пиперазин-1-карбоксилат (92 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 18 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане), получая указанное в названии соединение (125 мг, 70%) в виде твердого вещества бледно-желтого цвета. ЖХ-МС (способ А): RT=1,71 мин, m/z=601, 603 [М+Н]+.
Стадия 2: 2-((3-хлор-4-(пиперазин-1-ил)фенил)амино)-6-(2,6-дихлорфенил)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(2-хлор-4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (125 мг, 0,207 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученный остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-100% EtOAc в циклогексане), получая указанное в названии соединение (9,4 мг, 9%) в виде бледно-желтого твердого вещества. ЖХ-МС (способ А): RT=0,88 мин, m/z=501, 503 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,24 (с, 1H), 7,98 (с, 1Н), 7,70-7,60 (м, 3H), 7,53 (дд, 1H), 7,51 (д, 1Н), 7,14 (д, 1Н), 6,64 (д, 1H), 3,01 (с, 8H).
Пример 28: N-(6-(2,6-дихлорфенил)-5-оксо-2-((4-(пиперазин-1-ил)фенил)амино)-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)ацетамид
Стадия 1: N-(6-(2,6-дихлорфенил)-2-(этилтио)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)ацетамид: Pd2(dba)3 (2,2 мг, 2,4 мкмоль) добавляют к предварительно дегазированному перемешиваемому раствору 8-бром-6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (50 мг, 0,120 ммоль), ацетамида (10,6 мг, 0,180 ммоль), Xantphos (1,4 мг, 2,4 мкмоль) и карбоната цезия (78 мг, 0,240 ммоль) в 1,4-диоксане (1,0 мл) при комнатной температуре во флаконе емкостью 10 мл. Сосуд герметично закрывают и нагревают до 100°С. Через 2 час растворители удаляют в вакууме и полученный остаток распределяют между DCM и водой, разделяют, экстрагируют (DCM×2) и сушат (в делительном сепараторе). Растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией (0-100% EtOAc в циклогексане) и получают указанное в названии соединение (8,0 мг, 17%) в виде белого твердого вещества. ЖХ-МС (способ А): RT=1,13 мин, m/z=395, 397 [М+Н]+.
Стадия 2: трет-бутил 4-(4-((8-ацетамидо-6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (5,24 мг, предположительно 0,023 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору N-(6-(2,6-дихлорфенил)-2-(метилтио)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)ацетамида (8,0 мг, 0,020 ммоль) в толуоле (1,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин последовательно добавляют DIPEA (10,6 мкл, 0,061 ммоль) и трет-бутил 4-(4-аминофенил)пиперазин-1-карбоксилат (6,2 мг, 0,022 ммоль) [коммерчески доступен] в толуоле (0,5 мл), а температуру повышают до 60°С. Через 16 час реакционной смеси дают охладиться до комнатной температуры, помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (3,7 мг, 29%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,39 мин, m/z=624, 626 [М+Н]+.
Стадия 3: N-(6-(2,6-дихлорфенил)-5-оксо-2-((4-(пиперазин-1-ил)фенил)амино)-5,6-дигидропиридо[4,3-d]пиримидин-8-ил)ацетамид: TFA (1,0 мл, 13,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((8-ацетамидо-6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-карбоксилата (3,7 мг, 5,9 мкмоль) в DCM (1,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе) и растворители удаляют в вакууме. Полученный остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-100% EtOAc в циклогексане, затем 10% МеОН в EtOAc) и получают указанное в названии соединение (1,1 мг, 32%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,82 мин, m/z=524, 526 [М+Н]+.
Пример 29: 6-(2,6-дихлорфенил)-2-((3-фтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он

Стадия 1: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-фторфенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (78 мг, предположительно 0,348 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (102 мг, 0,302 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,158 мл, 0,905 ммоль) и трет-бутил 4-(4-амино-2-фторфенил)пиперазин-1-карбоксилат (89 мг, 0,302 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50% EtOAc в циклогексане), получая указанное в названии соединение (85,8 мг, 49%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,63 мин, m/z=585, 587 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-((3-фтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2-фторфенил)пиперазин-1-карбоксилата (85,8 мг, 0,147 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и получают указанное в названии соединение (66,6 мг, 91%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,86 мин, m/z=485, 487 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,23 (с, 1H), 7,80 (шир. д, 1H), 7,66-7,62 (м, 2H), 7,53 (дд, 1H), 7,51 (д, 1H), 7,43 (шир. д, 1H), 7,05 (т, 1H), 6,65 (д, 1H), 3,09-2,99 (м, 8H).
Пример 30: 6-(2,6-дихлорфенил)-2-((3,5-дифтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
Стадия 1: трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2,6-дифторфенил)пиперазин-1-карбоксилат: mCPBA (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и трет-бутил 4-(4-амино-2,6-дифторфенил)пиперазин-1-карбоксилат (93 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане). Чистые фракции концентрируют и получают указанное в названии соединение (19,6 мг, 11%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=1,71 мин, m/z=603, 605 [М+Н]+.
Стадия 2: 6-(2,6-дихлорфенил)-2-((3,5-дифтор-4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он: TFA (2,0 мл, 26,0 ммоль) добавляют к перемешиваемому раствору трет-бутил 4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)-2,6-дифторфенил)пиперазин-1-карбоксилата (19,6 мг, 0,032 ммоль) в DCM (2,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин растворители удаляют в вакууме, полученный остаток распределяют между DCM и насыщенным водным раствором бикарбоната натрия, разделяют, экстрагируют (DCM×2), сушат (в делительном сепараторе), растворители удаляют в вакууме и полученное вещество очищают флэш-хроматографией с использованием колонки KP-NH (0-100%, EtOAc в циклогексане), получая указанное в названии соединение (7,8 мг, 48%) в виде беловатого твердого вещества. ЖХ-МС (способ А): RT=0,89 мин, m/z=503, 505 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,27 (с, 1H), 7,66-7,62 (м, 2H), 7,57-7,49 (м, 4H), 6,69 (д, 1H), 3,15 (т, 4Н), 2,95 (т, 4Н).
Пример 31: 6-(2,6-дихлорфенил)-2-((6-(4-метилпиперазин-1-ил)пиридин-3-ил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
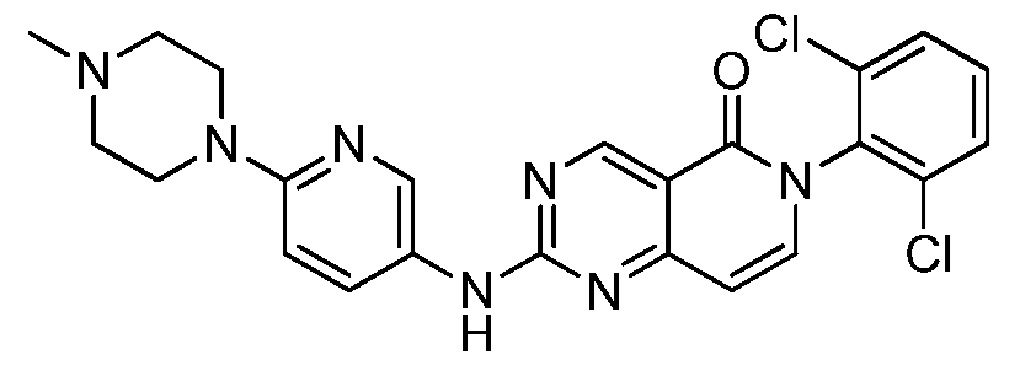
mСРВА (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6H)-она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 15 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и 6-(4-метилпиперазин-1-ил)пиридин-3-амин (56,8 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-50%, EtOAc в циклогексане). Чистые фракции концентрируют и получают указанное в названии соединение (31,1 мг, 22%) в виде желтого твердого вещества. ЖХ-МС (способ А): RT=0,76 мин, m/z=482, 484 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,20 (с, 1Н), 8,50 (шир. с, 1Н), 8,01 (шир. д, 1H), 7,65-7,61 (м, 2H), 7,52 (д, 1H) , 7,49 (д, 1H), 6,89 (д, 1H), 6,59 (д, 1H), 3,54 (т, 4Н), 2,59 (т, 4Н), 2,36 (с, 3H).
Пример 32: 6-(2,6-дихлорфенил)-2-((4-(4-метилпиперазин-1-карбонил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-он
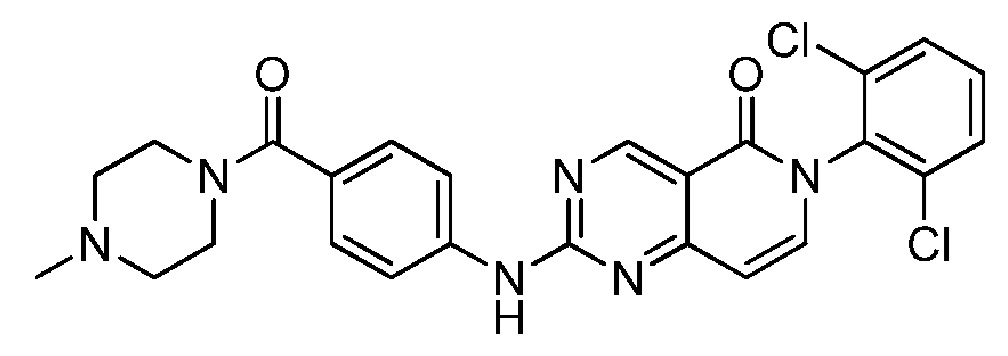
mСРВА (чистота <77%) (77 мг, предположительно 0,342 ммоль) в DCM (0,5 мл) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-(метилтио)пиридо[4,3-d]пиримидин-5(6Н)она (100 мг, 0,296 ммоль) в толуоле (3,0 мл) при комнатной температуре в атмосфере азота. Через 30 мин последовательно добавляют DIPEA (0,155 мл, 0,887 ммоль) и (4-аминофенил)(4-метилпиперазин-1-ил)метанон (64,8 мг, 0,296 ммоль) [коммерчески доступен], а температуру повышают до 60°С. Через 16 час реакционную смесь охлаждают, сразу же помещают в колонку KP-NH и очищают флэш-хроматографией (0-100%, EtOAc в циклогексане). Полученное в результате вещество необходимо подвергнуть повторной очистке флэш-хроматографией на колонке КP-Sil (0-10% MeOH в EtOAc). Полученный продукт необходимо дополнительно очистить с помощью препаративной ВЭЖХ. Чистые фракции концентрируют, полученное вещество подвергают сублимационной сушке и получают указанное в названии соединение (10,2 мг, 7%) в виде белого твердого вещества. ЖХ-МС (способ А): RT=0,79 мин, m/z=509, 511 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,28 (с, 1H), 7,98 (д, 2H), 7,66-7,62 (м, 2H), 7,56-7,51 (м, 2H), 7,48-7,43 (м, 2H), 6,69 (д, 1H), 3,68 (шир. с, 4H), 2,49 (шир. с, 4H), 2,34 (с, 3H).
Пример 33: 2-(4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-ил)уксусная кислота
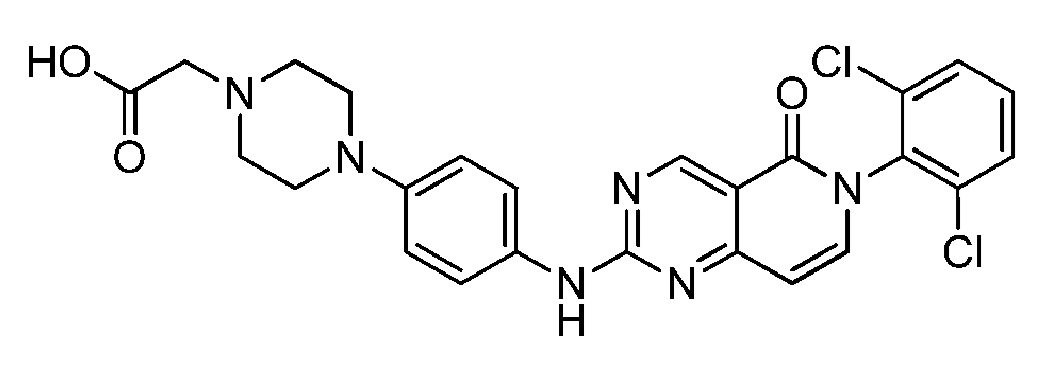
Стадия 1: этил 2-(4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-ил)ацетат: Этилбромацетат (0,024 мл, 0,217 ммоль) добавляют к перемешиваемому раствору 6-(2,6-дихлорфенил)-2-((4-(пиперазин-1-ил)фенил)амино)пиридо[4,3-d]пиримидин-5(6H)-она (67,7 мг, 0,145 ммоль) и триэтиламина (0,061 мл, 0,435 ммоль) в DCM (2,0 мл) при температуре 0°C в атмосфере азота. Через 1 час температуру повышают до комнатной температуры. Через 2 час, поскольку реакция прошла не полностью, добавляют дополнительное количество триэтиламина (30 мкл) и этилбромацетата (12 мкл). Еще через 2 час, поскольку реакция прошла не полностью, добавляют дополнительное количество триэтиламина (30 мкл) и этилбромацетата (12 мкл). Еще через 16 час растворители удаляют в вакууме, а полученный остаток очищают флэш-хроматографией с использованием колонки KP-NH (0-50%, EtOAc в циклогексане) и получают указанное в названии соединение (68,7 мг, 86%) в виде бледно-желтого твердого вещества ЖХ-МС (способ А): RT =. 0,94 мин, m/z=553, 555 [М+Н]+.
Стадия 2: 2-(4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-ил)уксусная кислота: Гидроксид лития (29,7 мг, 1,24 ммоль) добавляют к перемешиваемой суспензии этил 2-(4-(4-((6-(2,6-дихлорфенил)-5-оксо-5,6-дигидропиридо[4,3-d]пиримидин-2-ил)амино)фенил)пиперазин-1-ил)ацетата (68,7 мг, 0,124 ммоль) в смеси метанол (10 мл)/вода (15 мл) при комнатной температуре в атмосфере азота. Через 5 час реакционную смесь подкисляют до рН 3, добавляя 2 М водный раствор НСl. Полученный осадок собирают вакуумной фильтрацией и последовательно промывают водой (3×5 мл) и диэтиловым эфиром (3×5 мл). Полученное вещество подвергают сублимационной сушке и получают указанное в названии соединение (59,5 мг, 91%) в виде беловатого твердого вещества. ЖХ-МС (способ А): RT=0,84 мин, m/z=525, 527 [М+Н]+. Спектр 1Н ЯМР (500 МГц, метанол-d4): δ 9,20 (с, 1H), 7,70 (шир. д, 2H), 7.66-7.61 (м, 2H), 7,53 (дд, 1H), 7,48 (д, 1H), 7,06 (д, 2H), 6,60 (с, 1H), 3,65 (с, 2H), 3,45 (с, 8H).
Метод 1: определение активности киназы Wee-1
Для определения активности Wee-1, коммерческий пептид Poly(Lys Tyr (4:1)) гидробромид получают от компании Sigma Aldrich и используют в качестве субстрата. Активированную киназу Wee-1 приобретают у компании Invitrogen (PV3817), а люминесцентный набор ADP-Glo приобретают у компании Promega.
Все реакции проводят в рабочем буферном растворе объемом 60 мкл, содержащем 40 мМ Tris-HCl и 20 мМ хлорида магния, дополненном 0,1 мг/мл бычьего сывороточного альбумина и 2 мМ DDT. Соединения серийно разводят буферным раствором и по 5 мкл раствора для каждой концентрации вносят пипеткой на белый 384-луночный планшет (Sigma Aldrich M6186). Аликвоту 5 мкл фермента Wee-1 добавляют в каждую лунку и планшет центрифугируют в течение 1 мин, чтобы перемешать фермент и ингибитор.
Планшет инкубируют при комнатной температуре в течение 30 минут перед добавлением 2,0 мкг/мл субстрата и 30 мкΜ АТФ в аликвоте 5 мкл. Затем планшет центрифугируют в течение одной минуты и инкубируют в течение 1 час при комнатной температуре.
В каждую лунку добавляют 15 мкл стоп реагента ADP-Glo для прекращения реакции и снижения количества непрореагировавшего АТФ. Планшет инкубируют еще в течение еще 40 мин в темноте при комнатной температуре.
В каждую лунку добавляют 30 мкл реагента для обнаружения киназы ADP-Glo, превращающего АДФ в АТФ, катализирующего образование люциферина люциферазой. Планшет встряхивают в течение 1 мин и инкубируют в темноте еще в течение часа.
Люминесценцию от каждой лунки обнаруживают с помощью планшет-ридера Biotek Synergy4 HD и процент ингибирования активности киназы рассчитывают для каждого испытуемого ингибитора. Положительный (только киназа) и отрицательный (без киназы) контроли вносят в каждый планшет, чтобы вызвать специфическое взаимодействие киназы и ингибитора. Концентрацию IC50 для каждого ингибитора рассчитывают путем построения графика зависимости процента ингибирования киназы от концентрации ингибитора и с помощью кривой, полученной подгонкой методом нелинейной регрессии.
Метод 2: Определение влияния соединений на фосфорилирование cdc2 в Tyr15
Клеточные линии НТ-29 и HCT-116 колоректального рака приобретают в АТСС и обычным образом поддерживают в среде McCoy's Medium (Invitrogen), дополненной 10%-ной сывороткой плода коровы.
Клетки обрабатывают трипсином в сосуде для выращивания и подсчитывают; 100 мкл суспензии клеток, содержащей 6000 клеток, пипеткой вносят на черные 96-луночные планшеты CoStar и инкубируют в течение ночи, чтобы облегчить прикрепление к поверхности, при температуре 37°С и в атмосфере 5% СO2. Готовят составы тестируемых соединений в ДМСО и разбавляют в среде, дополненной сывороткой плода коровы. Инкубационную среду удаляют отсасыванием и в каждую лунку добавляют разбавленную среду, содержащую препарат.
Планшет возвращают в инкубатор еще на восемь часов при 37°С и в атмосфере 5% СO2. После инкубации дополненную препаратом среду отсасывают из каждой лунки и клетки промывают один раз ледяным фосфатно-солевым буферным раствором (PBS). В каждую лунку 96-луночного планшета добавляют 100 мкл буфера для лизиса клеток (Cell Signalling Technologies #9803), содержащего 20 мМ Tris, 150 мМ NaCl, 1 мМ ЭДТА, 1 мМ EGTA, 1% Triton-X100, 2,5 мМ пирофосфата натрия, 1 мМ глицерофосфата, 1 мМ Na3VO4 и 1 мкг/мл лейпептина и инкубируют при 4°С в течение 30 мин. Затем образцы на планшете быстро замораживают при температуре -80°С до использования.
Непосредственно перед продолжением анализа, планшет с образцами размораживают и центрифугируют при 4°С в течение 10 мин, а супернатант переносят во вторичные пробирки или на 96-луночный планшет.
Супернатант клеточной культуры смешивают в соотношении 1:1 с используемым для разведения образца буфере и энергично перемешивают в течение одной минуты. 100 мкл разбавленного образца добавляют с помощью пипетки на планшеты с предварительно нанесенным покрытием, содержащие поликлональные антитела кролика для phospho-cdc2 (Tyr15) (Cell Signalling Technologies PathScan kit #7176). Планшет герметично закрывают и оставляют инкубироваться на ночь при 4°С.
Планшеты раскрывают и содержимое ячеек отсасывают, а затем 3×5 мин промывают с помощью 200 мкл разбавленного промывочного буфера. Между каждой промывкой планшет плотно прижимают к промокательной бумаге, чтобы гарантированно удалить весь раствор, входящий в набор реагентов. 100 мкл набора реагентов для обнаружения антитела добавляют в каждую лунку, планшет повторно герметизируют и инкубируют при 37°С в течение 1 час. После инкубации планшет промывают и обрабатывают таким же образом, как описано выше.
В каждую тестовую ячейку добавляют 100 мкл связанного с пероксидазой хрена вторичного антитела, планшет герметично закрывают и инкубируют в течение тридцати минут при температуре 37°С. После инкубации планшет промывают, как указано ранее, а затем добавляют 100 мкл 3,3',5,5'-тетраметилбензидина (реагент ТМВ). Планшет герметично закрывают и инкубируют при комнатной температуре в течение 30 мин.
В каждую лунку добавляют 100 мкм стоп реагента, и донышко планшета перед проведением спектрофотометрического определения протирают безворсовой тканью. Поглощение из каждой лунки считывают при 450 нм в течение 30 мин после добавления раствора стоп реагента.
Процент phospho-cdc2 рассчитывают в сравнении с контролем ДМСО и наносят на график в зависимости от концентрации ингибитора с помощью GraphPad Prism. Данные эмпирически подбирают с помощью нелинейного регрессионного анализа и формируют значения IC50.
Метод определения оценочных значений CLint с использованием микросом печени человека
Тестируемые соединения (конечная концентрация=1 мкΜ; конечная концентрация ДМСО=0,1%) инкубируют в 0,1 М фосфатном буфере, рН 7,4, с микросомами печени человека (0,5 мг белка/мл) при 37°С. Реакции инициируют добавлением NADPH в 0,1 М фосфатном буфере с рН 7,4 (конечная концентрация 1 мМ). Берут аликвоты по 40 мкл через 2, 5, 10, 15, 20, 30, 40 и 50 мин. Реакции прерывают, добавив 80 мкл охлажденного льдом метанола. Образцы оставляют в замороженном состоянии на ночь, а затем центрифугируют при 3500 об./мин в течение 20 мин при 4°С. Жидкости над осадком извлекают, переносят на аналитические планшеты и анализируют методом ЖХ-МС/МС.
Метод ЖХ-МС/МС:
Все образцы анализируют на спектрометре Waters Acquity I-Class, сопряженном с масс-спектрометром Waters Xevo TQD. Используют колонку Waters BEH C18 2,1*50 мм 1,7 мкм, а мобильной фазой служат вода и метанол, содержащий 0,1%-ную муравьиную кислоту в качестве модификатора. Анализ представляет собой мониторинг множественных реакций, а условия оптимизируют для каждого испытуемого соединения.
Анализ данных:
Из графика логарифма площади пика от времени определяют градиент линии. Затем рассчитывают период полувыведения и собственный клиренс с использованием следующих уравнений.
Константа скорости элиминирования (k)=(- градиент)
Период полувыведения (t1/2) (мин)=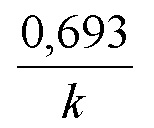
Собственный клиренс (CLint) (мкл/мин/миллион клеток)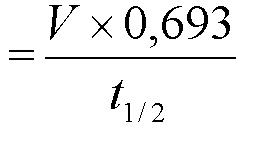
где V=инкубационный объем (мкл)/количество клеток
В приведенной ниже таблице 2 выявлена избирательность типичных соединений по настоящему изобретению по отношению к набору из 50 киназ (оценка проведена с использованием Invitrogen SelectScreen® Kinase Profiling Service). Неожиданно, отдельные ингибиторы Wee-1 по настоящему изобретению проявляют бóльшую селективность, чем типичные соединения, описанные в BMCL, 2005, p. 1931.
|
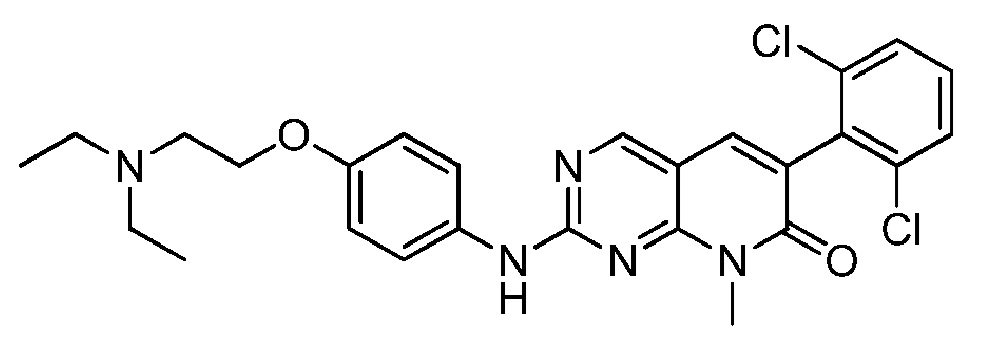
Соединение 1: Bioorg. Med. Chem. Lett. 2005, 15, 1931-1935.
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/4202754e0a57ad0b5723cb715c6c3ac1.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/b42b1f827fa79521f9b2f14f38009222.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/c75f17c17b966cd1d6b711d934400f95.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/a666db07c857b7d1cd0ef11ea66f4351.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/afb8ce475d9a49965aa2f341ab0fc006.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/4f4fe997c1bbfd9b97f3ec548ec13206.jpg)
![ПРОИЗВОДНЫЕ 2-АМИНОПИРИДО[4,3-d]ПИРИМИДИН-5-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ WEE-1](https://fips.edrid.ru/images/rid/92/8e/ce/01e1610e1babaa0bbd1b0adff72687d6.jpg)