Результат интеллектуальной деятельности: СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым солям сульфатам N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемым сольватам, их получению, фармацевтическим композициям, содержащим их, и применению при лечении и/или предупреждении нейродегенеративных заболеваний.
Уровень техники
N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин, который имеет структуру формулы I
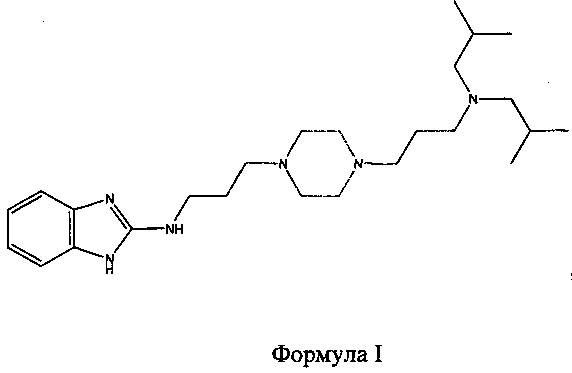
принадлежит к семейству производных 1,4-бис(3-аминопропил)пиперазина, раскрытых ранее в WO 2006/051489, и которые применимы для лечения и/или предупреждения нейродегенеративных заболеваний.
Форма свободного основания указанного соединения имеет проблемы устойчивости во времени, вероятно, из-за процессов окисления, происходящих в пиперазиновом цикле. Кроме того, форма свободного основания не кристаллизуется. В плане фармацевтической разработки кристаллические формы активных ингредиентов действительно являются предпочтительными. Они обычно преодолевают проблемы устойчивости и доступны для процессов кристаллизации и/или перекристаллизации, которые подходят для очистки в промышленном масштабе, высокой воспроизводимости от партии к партии, в частности, в отношении кристалличности.
Хотя известно, что образование соли фармацевтически активной молекулы (ФАМ (РАМ)) может улучшить ее физико-химические свойства, выбор подходящей соли остается сложным процессом. Действительно, улучшение физико-химических свойств выходит за пределы получения устойчивых твердых материалов. Такие твердые материалы должны включать кристаллическую фазу, которая имеет хорошую степень кристалличности и определенную морфологию. В других аспектах солевые формы могут предоставить другие преимущества, такие как улучшенная водорастворимость, но также могут быть в равной степени вредными из-за гигроскопичности, проблем устойчивости или присущей (intreseque) им токсичности. Поэтому выбор соли не может быть сделан случайно и в первую очередь служит основанием для глубоких исследований.
Оксалат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, о котором кстати сообщается в WO 2006/051489, частично преодолевает вышеуказанные недостатки, связанные со свободным основанием. Однако "необходимы 4 эквивалента щавелевой кислоты для получения оксалата в виде устойчивого порошка. В результате массовый процент фармацевтически активной молекулы с оксалатами падает весьма низко - до 54%. Поэтому количество лекарственного средства, вводимого для заданной дозы ФАМ, является существенно возросшим.
Более того, оксалаты уже больше не рассматриваются как одни из наиболее фармацевтически приемлемых солей. Оксалаты в некоторых случаях являются нефротоксичными, например, известно, что нафтидрофурила оксалат вызывает кальций оксалатную кристаллурию и, таким образом, почечнокаменную болезнь у престарелых пациентов. Кроме того, из-за низкой растворимости оксалата кальция возросшая концентрация оксалата кальция в жидкостях организма, включая урину (гипероксалурия), может привести к отложению оксалата кальция (оксалоз) в почечной ткани (нефрокальциноз) или мочевых путях (уролитиаз). Оксалоз может охватывать многие различные органы, когда почки не в состоянии вывести оксалат кальция. Отложения в кровеносных сосудах могут вызывать болезненные кожные язвы, которые не лечатся, отложения в костном мозгу вызывают анемию, и отложения в сердце вызывают анормальности сердечного ритма или ухудшение сердечной функции. Пациенты, страдающие от нейродегенеративных заболеваний, как правило, пожилого возраста и страдают от других патологий, в случае которых они получают другие лекарственные назначения. Их почки, таким образом, уже напряженно ведут экскрецию лекарственных средств, принимаемых такими пациентами, которые, кстати, менее чувствительны к ощущениям жажды и, таким образом, склонны к обезвоживанию. Избыточный оксалат кальция, в конце концов, выделяется у пациентов со здоровыми почками и кто пьет много воды. Избыточный оксалат кальция действительно является реальной проблемой в терапии, особенно для престарелых. Кроме того, лечение нейродегенеративных заболеваний часто является постоянным в течение очень длительных периодов времени, если не пожизненным. Авторы заявки считают, что из-за своей возможной токсичности для почек и мочевых путей оксалаты будут чрезмерной нагрузкой для пациентов, уже ослабленных своим состоянием. Поэтому авторы заявки рассматривают оксалаты как фармацевтически неприемлемые, в частности, потому, что для N-(3-(4-(3-(диизобутиламино)пропил)шшеразин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина требуется 4 эквивалента противоиона соли, чтобы оставаться устойчивым. Следовательно, даже хотя оксалаты позволяют получать устойчивые твердые материалы, они предполагают опасность побочного токсичного действия.
Таким образом, в технике все еще существует потребность в устойчивых кристаллических и негигроскопичных солях N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина, у которых не имеется вышеуказанных недостатков в смысле солеобразования и токсичности.
Раскрытие изобретения
Настоящее изобретение основано на неожиданном открытии, что соли сульфаты N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина дают устойчивые свободно текущие кристаллические порошки, которые негигроскопичны и удовлетворяют критериям, указанным выше.
Таким образом, изобретение относится к сульфату N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и его фармацевтически приемлемым сольватам.
Сульфаты N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их сольваты получают в виде порошков, которые имеют кристаллическую фазу с хорошей кристалличностью и определенной морфологией. Сульфаты по изобретению, более того, являются особенно подходящими для получения фармацевтических композиций, содержащих их. Они являются фармацевтически приемлемыми, и по сведениям авторов заявки, они не ассоциируются с характерной токсичностью любого рода. В этом отношении Заявитель выполнил несколько привычных исследований in vivo с сульфатами N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и до сих пор не наблюдал какого-либо неожиданного события токсичности.
Более того, при сравнении с другими солями, такими как оксалаты, допускается меньшая молекулярная масса сульфат-ионов для повышенного массового отношения N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина к общей массе его соли. Например, массовый процент ФАМ с дисульфатами составляет 60%. Следовательно, по сравнению с оксалатом, количество сульфата, требуемое для данной дозы N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, уменьшается. Это в свою очередь снижает затраты на получение фармацевтических композиций, содержащих N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин.
Осуществление изобретения
Соединения по изобретению представляют собой сульфаты N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемые сольваты. Конкретнее, сульфаты по изобретению и их сольваты являются соединениями формулы II
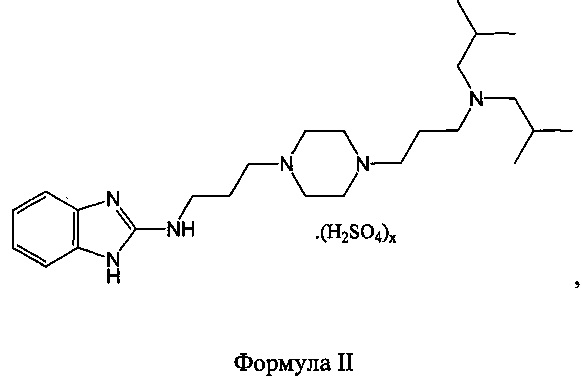
при этом x равен 0,5-4, предпочтительно, x равен 0,5-3,5, предпочтительнее, x равен 0,9-3.
Иными словами, сульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина содержит 0,5-4 эквивалента, предпочтительно, 0,5-3,5 эквивалента, предпочтительнее, 0,9-3 эквивалента, сульфата на одну молекулы Ν-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
В одном воплощении x равен 2,5-3,5, предпочтительно, 2,6-3,2, предпочтительнее, x равен 2,8-3, даже предпочтительнее, x равен примерно 2,9, или x равен 2,9.
В другом воплощении x равен 1,5-2,5, предпочтительно, x равен 1,5-2,1, предпочтительнее, x равен 1,7-1,9, даже предпочтительнее, x равен примерно 1,8, или x равен 1,8.
В еще одном воплощении x равен 0,5-1,5, предпочтительно, x равен 0,7-1,3, предпочтительнее, x равен 0,9-1,1, даже предпочтительнее, x равен примерно 1, или x равен 1.
В другом воплощении x равен 1,7-2,3, предпочтительно, x равен 1,9-2,1, предпочтительнее, x равен примерно 2, или x равен 2.
В отдельном воплощении сульфат формулы II находится в форме фармацевтически приемлемого сольвата, предпочтительно, гидрата. Стехиометрия сольвата от 0,5 до 5, предпочтительно, от 1 до 4, предпочтительнее, от 1,5 до 2,5, еще предпочтительнее, у равен 1,8-2,2, даже предпочтительнее, 2 или примерно 2 молекулы сольвата на 1 молекулу сульфата формулы II.
Предпочтительные фармацевтически приемлемые сольваты сульфатов формулы II представляют собой сольваты формулы III
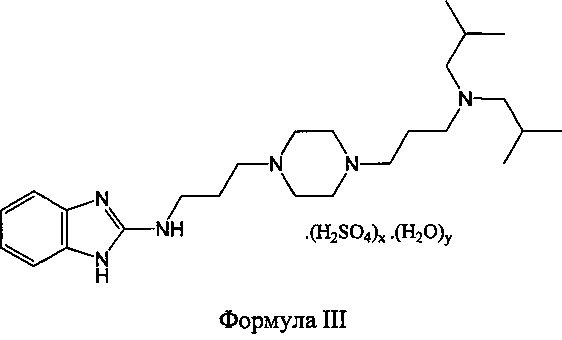
при этом
x имеет значения, указанные выше для формулы II, и
y равен 0,5-5, предпочтительно, y равен 1-4, предпочтительнее, y равен 1,5-2,5, еще предпочтительнее, y равен 1,8-2,2, даже предпочтительнее, y равен примерно 2, или y равен 2.
Предпочтительными соединениями формулы III являются соединения, в которых x равен 0,5-1,5, предпочтительно, 0,8-1,2, предпочтительнее, x равен 0,9-1,1, даже предпочтительнее, x равен примерно 1, или x равен 1.
Особенно предпочтительными соединениями по изобретению являются соединения формулы III, в которых x равен примерно 1, и y равен примерно 2, или x равен 1, и у равен 2.
Заявитель показал, что соль сульфат Ν-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и его фармацевтически приемлемые сольваты применимы для исправления метаболизма предшественника амилоидного белка (АРР) по четырем существенным моментам:
1) увеличение карбоксиконцевых фрагментов АРР (APP-CTF), которые все обычно обладают, по меньшей мере, 50 аминокислотами АРР, и в особенности, фрагментов с потенциальной физиологической активностью, таких как α-участки (APP-CTF-альфа) и γ-участки (APP-CTF-гамма или AICD для внутриклеточного домена АРР),
2) усиление секреции sAPP α, которые представляют нейрозащитные/нейротрофические свойства,
3) уменьшение продуцирования нейротоксичных побочных продуктов АРР, т.е., β-амилоидных (Αβ) пептидов, в особенности, в их форме х-42,
4) экспрессия АРР без изменения и отсутствие нейротоксичности.
Сульфаты по изобретению и их сольваты действительно применимы при ориентации метаболизма АРР в сторону неамилоидогенных путей в лобной коре головного мозга и гиппокампе.
Заявитель также показал, что сульфат Ν-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и его фармацевтически приемлемые сольваты применимы для изменения патологического фосфорилирования тау-белка, причем в то же время облегчаются процессы окислительного стресса. Тау-белки взаимодействуют с тубулином для стабилизации микротрубочек и промотируют сборку тубулина в микротрубочки, причем устойчивость микротрубочек регулируется изоформами и фосфорилированием. Тау-патологии включают механизмы, ведущие к анормальным модификациям связанных с микротрубочками тау-белков, прогрессирующую агрегацию и накопление в фибриллярном материале внутри дегенерирующих нейронов с образованием так называемых нейрофибриллярных клубков (NFT).
Кроме того, в отличие от других солей, их физико-химические свойства особенно полезны в отношении получения лекарственных средств или безопасности, растворимости, устойчивости, кристалличности, морфологии и токсичности.
Таким образом, сульфаты по изобретению применимы в качестве лекарственного средства, в частности, для лечения или предупреждения нейродегенеративных заболеваний и всех заболеваний, при которых наблюдают нарушение метаболизма АРР, включая, но не ограничиваясь указанным, болезнь Альцгеймера, амилоидные ангиопатии, деменцию с тельцами Леви (DLB) и синдром Дауна.
Таким образом, сульфаты по изобретению применимы в качестве лекарственного средства, в частности, для лечения или предупреждения нейродегенеративных заболеваний и всех заболеваний, при которых наблюдают нарушение фосфорилирования тау-белка, включая, но не ограничиваясь указанным, тауопатии, такие как фронтотемпоральная деменция с паркинсонизмом, связанным с хромосомой 17.
В результате, изобретение также относится к сульфату N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амина или его фармацевтически приемлемому сольвату, определенным в данном описании, для применения при лечении и/или предупреждении заболевания, выбранного из нейродегенеративных заболеваний, включая болезнь Альцгеймера, деменцию с тельцами Леви (DLB), амиотрофический боковой склероз (ALS) с фронтотемпоральной деменцией, миопатию с тельцами включения с болезнью костей Педжета и/или фронтотемпоральной деменцией (IBMPFD), фронтотемпоральную лобарную дегенерацию, синуклеопатии, болезнь Хантингтона и болезнь Паркинсона, амилоидопатии, включая амилоидные ангиопатии, тауопатии, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17, нервно-мышечные заболевания с белковыми включениями, а также болезни развития, включая синдром Дауна. Предпочтительно заболевание выбирают из болезни Альцгеймера, амиотрофического бокового склероза (ALS) с фронтотемпоральной деменцией, миопатии с тельцами включения с болезнью костей Педжета и/или фронтотемпоральной деменцией (IBMPFD), фронтотемпоральной лобарной дегенерации, синуклеопатий, болезни Хантингтона, амилоидопатий, включая амилоидные ангиопатии, тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17. Предпочтительнее заболевание выбирают из болезни Альцгеймера, синуклеопатий, амилоидопатий, включая амилоидные ангиопатии, и тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17. Даже предпочтительнее заболевание выбирают из болезни Альцгеймера и тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17.
В других отношениях изобретение также относится к способу лечения и/или предупреждения заболевания, выбранного из нейродегенеративных заболеваний, амилоидопатий, тауопатий и болезней развития, в частности, заболеваний, указанных выше, а также его воплощениям, включающим введение пациенту, нуждающемуся в этом, фармацевтически эффективного количества сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амина или его фармацевтически приемлемого сольвата, описанных в данном описании. В отдельном воплощении заболевание выбирают из болезни Альцгеймера и тауопатий.
В одном отдельном воплощении изобретение также относится к сульфату N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемому сольвату, определенным в данном описании, для применения при отсрочке начала заболевания, выбранного из нейродегенеративных заболеваний, включая болезнь Альцгеймера, деменции с тельцами Леви (DLB), амиотрофического бокового склероза (ALS) с фронтотемпоральной деменцией, миопатии с тельцами включения с болезнью костей Педжета и/или фронтотемпоральной деменцией (IBMPFD), фронтотемпоральной лобарной дегенерации, синуклеопатий, болезни Хантингтона и болезни Паркинсона, амилоидопатий, включая амилоидные ангиопатии, тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17, нервно-мышечных заболеваний с белковыми включениями, а также болезней развития, включая синдром Дауна. Предпочтительно заболевание выбирают из болезни Альцгеймера, амиотрофического бокового склероза (ALS) с фронтотемпоральной деменцией, миопатии с тельцами включения с болезнью костей Педжета и/или фронтотемпоральной деменцией (IBMPFD), фронтотемпоральной лобарной дегенерации, синуклеопатий, болезни Хантингтона, амилоидопатий, включая амилоидные ангиопатии, тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17. Предпочтительнее заболевание выбирают из болезни Альцгеймера, синуклеопатий, амилоидопатий, включая амилоидные ангиопатии, и тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17. Даже предпочтительнее заболевание выбирают из болезни Альцгеймера и тауопатий, включая фронтотемпоральную деменцию с паркинсонизмом, связанным с хромосомой 17.
В других отношениях изобретение относится к способу отсрочки у пациента начала заболевания, выбранного из нейродегенеративных заболеваний, амилоидопатий, тауопатий и болезней развития, в частности, заболеваний, перечисленных выше, включающему введение пациенту, нуждающемуся в этом, фармацевтически эффективного количества сульфата по изобретению или его фармацевтически приемлемого сольвата. В отдельном воплощении заболевание выбирают из болезни Альцгеймера и тауопатий.
Согласно другой своей особенности, настоящее изобретение относится к способу модуляции метаболизма АРР у пациента, предпочтительно, теплокровного животного, и даже предпочтительнее, у человека, нуждающегося в таком лечении, включающему введение указанному пациенту фармацевтически эффективного количества сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина по настоящему изобретению или его фармацевтически приемлемого сольвата.
Согласно еще одной своей особенности, настоящее изобретение относится к способу изменения патологического фосфорилирования тау-белка, причем в то же время облегчаются процессы окислительного стресса, у пациента, предпочтительно, теплокровного животного, и даже предпочтительнее, у человека, нуждающегося в таком лечении, включающему введение указанному пациенту фармацевтически эффективного количества сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина по настоящему изобретению или его фармацевтически приемлемого сольвата.
Изобретение также относится к фармацевтическим композициям, включающим сульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемый сольват, описанные в данном описании, и, по меньшей мере, один фармацевтически приемлемый носитель, разбавитель, эксципиент и/или адъювант. В одном воплощении изобретение также относится к фармацевтическим композициям, которые в качестве активного ингредиента содержат, кроме сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемого сольвата, дополнительные терапевтические средства и/или активные ингредиенты.
Согласно одному воплощению сульфаты N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, а также их фармацевтически приемлемые сольваты можно вводить как часть комбинированной терапии. Таким образом, в объем настоящего изобретения включены воплощения, включающие совместное введение композиций и лекарственных средств, которые содержат в качестве активного ингредиента, кроме сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемого сольвата, дополнительные терапевтические средства и/или активные ингредиенты. Такие схемы приема нескольких лекарственных средств, часто называемые «комбинированной терапией», можно использовать при лечении и/или предупреждении любого из заболеваний или состояний, опосредуемых или ассоциированных с модуляцией метаболизма АРР. Применение таких комбинаций терапевтических средств является особенно подходящим в отношении лечения вышеуказанных нейродегенеративных заболеваний у пациента, нуждающегося в лечении, или субъекта, находящегося в опасности стать таким пациентом.
Кроме требования терапевтической эффективности, которое может потребовать применения активных средств в дополнение к сульфатам N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амина или их фармацевтически приемлемым сольватам, могут иметься дополнительные основания, которые принуждают или настойчиво рекомендуют применять комбинации лекарственных средств, включающих активные ингредиенты, которые представляют вспомогательную терапию, т.е., которые дополняют и способствуют функции, выполняемой сульфатами N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина по настоящему изобретению или их фармацевтически приемлемыми сольватами. Подходящие дополнительные терапевтические средства, используемые для цели вспомогательного лечения, включают лекарственные средства, которые вместо непосредственного лечения и/или предупреждения заболевания или состояния, опосредуемого или ассоциированного с модуляцией метаболизма АРР, лечат заболевания или состояния, которые прямо являются результатом или косвенно сопровождают основное или имеющее основой модулированный метаболизм АРР заболевание или состояние.
Согласно другой особенности настоящего изобретения, сульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и его фармацевтически приемлемый сольват можно использовать в комбинированной терапии с другими лекарственными средствами, используемыми для лечения болезни Альцгеймера. Конкретнее, соединение формулы II, а также его фармацевтически приемлемый сольват можно использовать как вспомогательную терапию в комбинации с ингибиторами ацетилхолинэстераз, включая, но не ограничиваясь перечисленным, донепезил (CAS n° 120014-06-4) и его соли и сольваты, галантамин (CAS n° 357-70-0) и его соли и сольваты, ривастигмин (CAS n° 123441-03-2) и его соли и сольваты, такрин (CAS n° 321-64-2) и его соли и сольваты, или в комбинации с антагонистами глутаматного рецептора NMDA, включая, но не ограничиваясь перечисленным, мемантин (CAS n° 19982-08-2) и его соли и сольваты, или в комбинации с двойным ингибитором ацетилхолинэстеразы и антагонистом глутаматного рецептора NMDA, включая, но не ограничиваясь перечисленным, гуперзин (CAS n° 102518-79-6) и его соли и сольваты, или в комбинации с агонистами глюкагоноподобного пептида 1 (GLP-1), включая, но не ограничиваясь перечисленным, лираглутид (CAS n° 204656-20-2) и его соли и сольваты, экзенатид (CAS n° 141732-76-5) и его соли и сольваты, или в комбинации с ретиноидами, включая, но не ограничиваясь перечисленным, ацитретин (CAS n° 55079-83-9) и его соли и сольваты, или в комбинации с блокаторами кальциевых каналов (ССВ), включая, но не ограничиваясь перечисленным, нилвадипин (CAS n° 75530-68-6) и его соли и сольваты, нитрендипин (CAS n° 39562-70-4) и его соли и сольваты, нимодипин (CAS n° 66085-59-4) и его соли и сольваты, или в комбинации с блокаторами ангиотензиновых рецепторов, включая, но не ограничиваясь перечисленным, валсартан (CAS n° 137862-53-4) и его соли и сольваты, или в комбинации с тетрациклиновыми антибиотиками, включая, но не ограничиваясь перечисленным, миноциклин (CAS n° 10118-90-8) и его соли и сольваты.
Таким образом, в способах лечения и фармацевтических композициях по настоящему изобретению соль сульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемый сольват можно использовать в монотерапии. Однако в указанных способах и композициях также можно использовать множественную терапию, в которой один или несколько сульфатов N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемых сольватов вводят совместно в комбинации с одним или несколькими другими терапевтическими средствами.
В вышеописанном воплощении комбинации сульфатов N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемых сольватов и других терапевтически активных средств можно вводить, в плане лекарственных форм, или по отдельности или в сочетании друг с другом, и в плане времени их введения, или периодически или одновременно. Таким образом, введение одного составляющего средства можно осуществлять до, одновременно с или после введения другого(их) составляющего(их) средства(средств).
Как правило, для фармацевтического применения сульфаты N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемые сольваты могут быть включены в фармацевтическую композицию, включающую, по меньшей мере, один сульфат по изобретению или его фармацевтически приемлемый сольват и, по меньшей мере, один фармацевтически приемлемый носитель, разбавитель, эксципиент и/или адъювант и, необязательно, одно или несколько других терапевтических средств и/или активных ингредиентов.
Как примеры, не являющиеся ограничительными, фармацевтическая композиция может находиться в лекарственной форме, подходящей для перорального введения, для парентерального введения (например, внутривенной, внутримышечной или подкожной инъекции или внутривенной инфузии), для местного введения (включая окулярное), для введения с помощью ингаляции, кожного пластыря, имплантата, суппозитория и т.д.. Такие подходящие для введения формы, которые могут представлять собой твердое вещество, полутвердое вещество или жидкость, в зависимости от способа введения, а также способов и носителей, разбавителей и эксципиентов для применения при их получении, будут ясны для специалиста; можно сослаться на последнее издание Remington's Pharmaceutical Sciences. Фармацевтические композиции могут быть составлены в твердой форме и снова растворены или суспендированы перед применением.
Примеры некоторых предпочтительных, но без ограничения, лекарственных форм включают таблетки, пилюли, порошки, лепешки, саше, крахмальные облатки, эликсиры, суспензии, эмульсии, растворы, сиропы, аэрозоли, мази, кремы, лосьоны, мягкие и твердые желатиновые капсулы, суппозитории, капли, стерильные растворы для инъекции и стерильные упакованные порошки (которые обычно восстанавливают перед применением) для введения в виде болюса и/или длительного введения, которые могут быть получены с носителями, эксципиентами и разбавителями, которые подходят per se для таких препаратов, такими как лактоза, декстроза, сукроза, сорбит, маннит, крахмалы, аравийская камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, полиэтиленгликоль, целлюлоза, (стерильная) вода, метилцеллюлоза, метил- и пропилгидроксибензоаты, тальк, стеарат магния, съедобные масла, растительные масла и минеральные масла или их подходящие смеси. Фармацевтические композиции могут необязательно содержать другие вещества, которые обычно используются в фармацевтических препаратах, такие как смазывающие вещества, смачивающие вещества, эмульгаторы и суспендирующие вещества, диспергаторы, дезинтеграторы, стабилизаторы, средства, придающие изотоничность, средства, придающие объем, наполнители, консерванты, подслащивающие вещества, корригенты, отдушки, красители, антибактериальные средства и/или противогрибковые средства, такие как парабены, хлорбутанол, фенол, сорбиновая кислота, дозирующие средства, регуляторы текучести, высвобождающие средства и т.д. Композиции также могут быть получены так, чтобы обеспечивать быстрое, длительное или отсроченное высвобождение активного(ых) соединения(ий), содержащегося(ихся) в них.
Фармацевтические композиции по изобретению предпочтительно находятся в стандартной лекарственной форме и могут быть соответственно упакованы, например, в коробке, блистере, флаконе, пузырьке, саше, ампуле или в любом другом подходящем однодозовом или многодозовом держателе или контейнере (которые могут быть соответственно маркированы); необязательно, с одной или несколькими листовками, содержащими информацию о продукте и/или инструкции по применению. Как правило, такие стандартные лекарственные формы будут содержать от 0,05 до 1000 мг, обычно, от 1 до 500 мг, по меньшей мере, одного соединения по изобретению, например, примерно 10, 25, 50, 100, 200, 300 или 400 мг на стандартную форму.
Как правило, в зависимости от состояния, которое предупреждают или от которого лечат, и способа введения активное соединение по изобретению будет вводиться обычно в количестве от 0,01 до 100 мг на килограмм массы тела, чаще от 0,1 до 50 мг, например, от 1 до 25 мг, например, примерно 0,5, 1, 5, 10, 15, 20 или 25 мг на килограмм массы тела пациента в сутки, которое может быть введено в виде единой суточной дозы, разделенной на одну или несколько ежедневных доз, или по существу непрерывно, например, с использованием капельной инфузии.
Все упоминания о соединениях формулы II включают упоминания сольватов, в частности, соединений формулы III, многокомпонентных комплексов и их жидких кристаллических веществах.
Соединения, раскрытые в настоящей заявке, названы с использованием ChemDraw® Ultra, версия 12.0 (CambridgeSoft, Cambridge, MA, USA).
N-(3-(4-(3-(Диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амин можно получить так, как раскрыто в WO 2006/051489. Соли сульфаты и их сольваты можно получить согласно методам, известным в технике, таким как методы, включающие преципитацию, кристаллизацию, перекристаллизацию, лиофилизацию, фазовый перенос или ионообменные смолы.
Определения
Термин «сольват» используется в данном описании для описания соединения по данному изобретению, которое содержит стехиометрические или субстехиометрические количества одной или нескольких молекул фармацевтически приемлемого растворителя, такого как этанол. Термин «гидрат» упоминается, когда указанный растворитель представляет собой воду. Молекулы фармацевтически приемлемых носителей могут кристаллизоваться совместно с соединением по изобретению и/или присутствовать в кристаллической и/или аморфной фазах их твердых форм и/или адсорбироваться в них.
Термин «болезнь Альцгеймера», используемый в данном описании, обозначает все типы болезни Альцгеймера, включая, но не ограничиваясь указанным, спорадические и семейные типы.
Термин «миопатия с тельцами включения с болезнью костей Педжета и/или фронтотемпоральной деменцией (IBMPFD)», используемый в данном описании, представляет тип миопатии, конкретнее, наследственное начальное полисистемное заболевание взрослых, которое поражает мышцы, костную ткань и центральную нервную систему. Пациенты с таким состоянием могут представлять различные проявления, в том числе, миопатию с тельцами включения, болезнь костей Педжета, фронтотемпоральную деменцию и/или амиотрофический боковой склероз (болезнь Лу Герига).
Термин «деменция с тельцами Леви (DLB)», используемый в данном описании, обозначает деменцию, которая также известна как болезнь диффузных телец Леви, болезнь корковых телец Леви и сенильная деменция по типу Леви, относящуюся к типу деменции, тесно связанному с болезнями Альцгеймера и Паркинсона. Болезнь характеризуется наличием телец Леви, агрегациями альфа-синуклеина и белка убиквитина в нейронах, обнаруживаемых при посмертной гистологии головного мозга.
Термин «синуклеопатии», используемый в данном описании, обозначает заболевание центральной нервной системы, характеризующееся альфа-синуклеин положительными отложениями в нейронах.
Термин «амилоидные ангиопатии», используемый в данном описании, обозначает заболевания, связанные с амилоидными отложениями, образующимися на стенках кровеносных сосудов центральной нервной системы.
Термин «тауопатии», используемый в данном описании, обозначает нейродегенеративные заболевания, связанные с патологической агрегацией тау-белка в головном мозгу человека.
Термин «болезни развития», используемый в данном описании, обозначает любое состояние, которое возникает на некоторой стадии при развитии ребенка и задерживает или предотвращает развитие одной или нескольких физиологических функций, таких как речевые навыки. Болезни развития включают физилогические и психические болезни. Примерами, без ограничения, болезней развития являются расстройство спектра аутизма (ASD), синдром Дауна, дефицит внимания (ADD) и дефицит внимания с гиперактивностью (ADHD).
Термин «пациент» относится к теплокровному животному, предпочтительнее, человеку, которое/который ожидает получения или получает медицинскую помощь или является/будет объектом медицинской процедуры.
Термин «человек» относится к субъекту обоих полов и в любой стадии развития (например, новорожденному, ребенку, подростку, взрослому).
Термины «лечить», «лечащий» и «лечение», используемые в данном описании, включают облегчение, ослабление или устранение состояния или заболевания и/или сопутствующих им симптомов.
Термины «предупреждать», «предупреждающий» и «предупреждение», используемые в данном описании, относятся к способу задержки или предотвращения начала состояния или заболевания и/или сопутствующих им симптомов, ограждения пациента от приобретения состояния или заболевания или уменьшения опасности для пациента приобрести состояние или заболевание.
Термин «терапевтически эффективное количество» (или проще «эффективное количество»), используемый в данном описании, обозначает количество активного вещества или активного ингредиента (например, N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина), которое является достаточным для достижения желательного терапевтического или профилактического действия у пациента, которому его вводят.
Термин «введение» обозначает предоставление активного вещества или активного ингредиента (например, N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина), одного или как части фармацевтически приемлемой композиции, пациенту, у которого необходимо лечить или предупредить состояние, симптом или заболевание.
«Фармацевтически приемлемые» означает, что ингредиенты фармацевтической композиции совместимы друг с другом и не являются вредными для получающего их пациента.
Термин «фармацевтическая среда», используемый в данном описании, обозначает носитель или инертную среду, используемые в качестве растворителя или разбавителя, в которых фармацевтически активное вещество становится препаратом или вводится. Неограничительные примеры фармацевтических сред включают кремы, гели, лосьоны, растворы и липосомы.
Краткое описание чертежей
Фигура 1 показывает спектр ДСК соли тартрата (1 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина.
Фигура 2 показывает спектр ДСК соли фумарата (1 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 3 показывает спектр ДСК соли оксалата (2 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 4 показывает спектр ДСК соли оксалата (3 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d] имидазол-2-амина.
Фигура 5 показывает спектр ДСК соли оксалата (4 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 6 показывает спектр ДСК соли сульфата (1 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 7 показывает спектр ДСК соли сульфата (2 экв.) N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 8 показывает XPRD дифрактограмму соли оксалата, 4 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
Фигура 9 показывает XPRD дифрактограмму соли сульфата, 2,9 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 1.
Фигура 10 показывает XPRD дифрактограмму соли сульфата, 1,8 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 2 (линия более высокой интенсивности), наложенную на дифрактограмму сульфата, 2,9 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 1 (линия меньшей интенсивности).
Фигура 11 показывает XPRD дифрактограмму соли сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3.
Фигура 12 показывает XPRD дифрактограмму соли сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина из примера 3 (нижняя линия), наложенную на дифрактограмму N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (свободное основание) (верхняя линия).
Фигура 13-а показывает фотографии кристаллов соли оксалата, 4 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, которые наблюдают с помощью оптического микроскопа при увеличении х325 в проходящем свете.
Фигура 13-b показывает фотографии кристаллов соли оксалата, 4 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, которые наблюдают с помощью оптического микроскопа при увеличении х325 в кросс-поляризованном свете.
Фигура 14 показывает XPRD дифрактограмму соли сульфата, 2 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 4.
Фигура 15 показывает XPRD дифрактограмму соли сульфата, 2 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амина из примера 4 (нижняя линия), наложенную на дифрактограмму N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол-2-амина (свободное основание) (верхняя линия).
Фигура 16 показывает кривую сушки DVS при 25°С сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3.
Фигура 17 показывает графики изотермической сорбции/десорбции DVS при 25°С сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3.
Фигура 18 показывает графики изотермической сорбции/десорбции DVS при 25°С дегидратированной формы сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3.
Фигуры 19-а-19d показывают результаты, полученные для сульфата, 1,8 экв., N-(3 -(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина в анализе метаболизма АРР in vitro. На всех фигурах приводятся результаты для контроля (светлый столбик) и сульфата по изобретению в четырех концентрациях (темные столбики). Фигура 19-а показывает уровни AICD, фигура 19-b уровни CTFα, фигура 19-с уровни Аβ1-42 и фигура 19-d уровни sAPPα.
Фигура 20 показывает уровни CTFα, измеренные в лобной коре головного мозга мышей, обработанных различными дозами сульфата, 1,8 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (анализ метаболизма in vivo; 24 часа быстрой обработки). Приводятся результаты для среды (светлый столбик) и сульфата по изобретению в пяти дозах (темно-серые столбики).
Фигура 21 показывает уровни CTFα, измеренные в лобной коре головного мозга мышей, обработанных различными дозами сульфата, 2 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или оксалата из WO 2006/051489 (анализ метаболизма in vivo; мыши, 24 часа быстрой обработки). Приводятся результаты для среды (светлый столбик), оксалата (светло-серые столбики) и сульфата по изобретению в пяти дозах (темно-серые столбики) при 6 мг/кг.
Фигуры 22-а и 22-b показывают результаты, полученные для сульфата, 1,8 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина в анализе метаболизма АРР in vivo (крысы, 1 месяц, постоянное исследование). На всех фигурах приводятся результаты для среды (светлый столбик) и сульфата по изобретению в двух концентрациях (темно-серые столбики). Фигура 22-а показывает уровни CTFα в лобной коре головного мозга и фигура 22-b уровни CTFβ в гиппокампе.
Фигуры 23-а, 23-b и 23-с показывают результаты, полученные для сульфата, 1,8 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина в анализе метаболизма АРР in vivo (мыши, 3 месяца, постоянное исследование). На всех фигурах приводятся результаты для среды (светлый столбик) и сульфата по изобретению в трех концентрациях (темно-серые столбики). Фигура 23-а показывает уровни AT 100 в лобной коре головного мозга, фигура 23-b уровни АТ8 и фигура 23-с уровни LPO.
Химические примеры
В настоящей заявке используются следующие аббревиатуры: °C - градусы по Цельсию, DIPE - диизопропиловый эфир, ДСК - дифференциальная сканирующая калориметрия, DVS - динамическая сорбция/десорбция водяного пара, δ - химические сдвиги в ЯМР, выраженные в м.д., экв. - эквиваленты), ΙΡΑ - изопропанол, ИК -инфракрасный, л - литр(ы), ЖХМС - ВЭЖХ в сочетании с масс-спектрометром, M -моль/л, мМ - ммоль/л, мкМ - мкмоль/л, Me - метил, мг - милиграмм(ы), мин - минута(ы), мл - миллилитр(ы), моль - моль(и), ммоль - миллимоль(и), мкмоль - микромоль(и), МС -масс-спектрометрия, ЯМР - ядерный магнитный резонанс, м.д. - миллионные доли, RH -относительная влажность, pc (rm) - реакционная смесь, об/мин - число оборотов в минуту, rt - время удерживания, RT - комнатная температура (са 15-25°С), RV - реакционный сосуд, ТГФ - тетрагидрофуран, XRPD - рентгеновская порошковая дифрактометрия, Вт - ватт(ы).
Все приведенные температуры выражены в градусах по Цельсию (°С); все реакции осуществляют при комнатной температуре (RT), если не указано иное.
Предполагается, что когда постановка эксперимента или процедуры очистки, которые используются в данном изобретении, не описываются подробно, они известны специалистам в данной области техники и описаны в таких стандартных руководствах, как i) Gordon A.J.; Ford R.Α., "The Chemist's Companion - A Handbook of Practical Data, Techniques, and References", Wiley: New York, 1972; ii) Vogel's Textbook of Practical Organic Chemistry, Pearson Prentice Hall: London, 1989.
Анализ методом ВЭЖХ
Метод А
Спектры ВЭЖХ типично получают на системе ВЭЖХ Waters Alliance 2695. Прибор включает автоматический пробоотборник, четырехтактный насос и ультрафиолетовый многоволновый детектор. Используемая хроматографическая колонка представляет собой колонку Waters X-Terra, RP18 5 мкм, 4,6×250 мм.
Обычно используемый элюент представляет собой смесь раствора А (0,1% ТФК в H2O) и раствора В (0,1% ТФК в МеОН).
Применяют градиент при скорости потока 1 мл в минуту следующим образом: начальные условия - 5% раствора В в течение 0 мин, линейное возрастание до 40% раствора В за 50 мин, выдержка при 40% в течение 5 мин, возвращение к начальным условиям за 1 мин и поддержание в течение 5 мин.
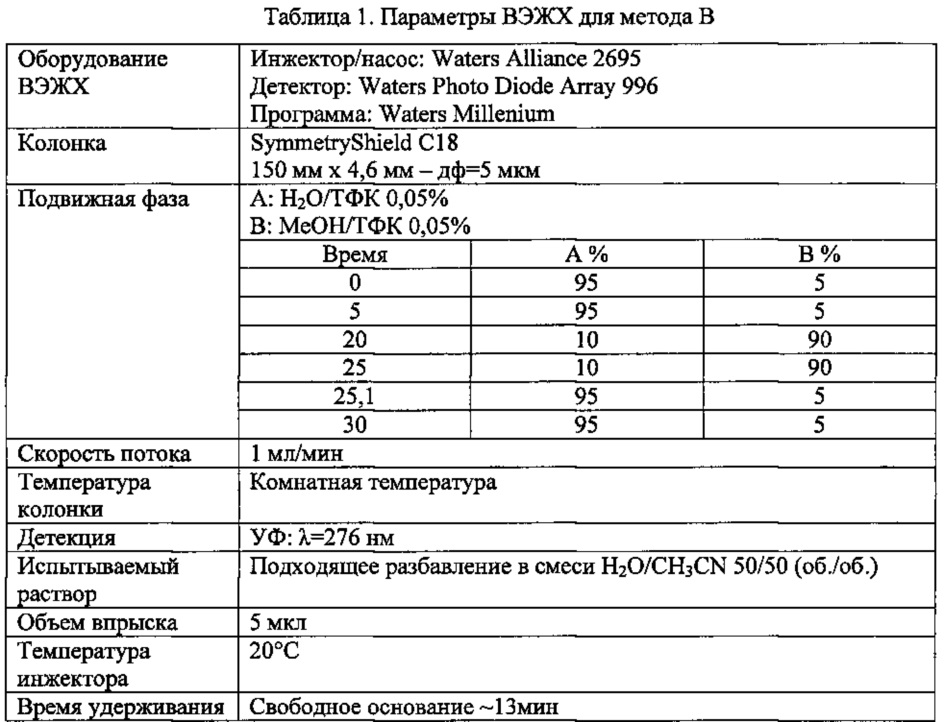
Метод В
Как вариант, анализ методом ВЭЖХ осуществляют согласно параметрам, раскрытым ниже в таблице 1.
Анализ методом ЯМР
Спектры 1Н (300 МГц) регистрируют на приборе Bruker Advance DRX, 300 МГц. Химические сдвиги выражают в миллионных долях (м.д., единицы δ). Константы взаимодействия выражают в герцах (Гц). Сокращения для мультиплетностей, наблюдаемых в спектрах ЯМР, следующие: с (синглет), д (дублет), т (триплет), к (квадруплет), м (мультиплет), уш (уширенный).
Спектры ДСК. Прибор ТА, DSC Q10.
Спектры ДСК регистрируют на приборе ТА, DSC Q10, в температурном интервале от -10°С до 300°С или 400°C с шагами 10°С.
Оптическая микроскопия
Наблюдения с помощью оптического микроскопа выполняют на микроскопе LEICA DMIRB, снабженном цифровой камерой и предметным столиком с электрическим приводом. Несколько крупинок порошка распределяют на предметном стекле с помощью минерального масла. Фотографии получают с помощью платформы для анализа изображений от Microvision Instruments как в проходящем свете, так и в поляризованном свете.
Порошковая рентгеновская дифракция
Анализ методом порошковой рентгеновской дифракции (XRPD) выполняют на дифрактометре Bruker - АХС D8 Advance с использованием медного антикатода, держателя образца из монокристаллического кремния и позиционно-чувствительного детектора. Условия работы прибора для сбора данных рентгенографии описаны в таблице 2.
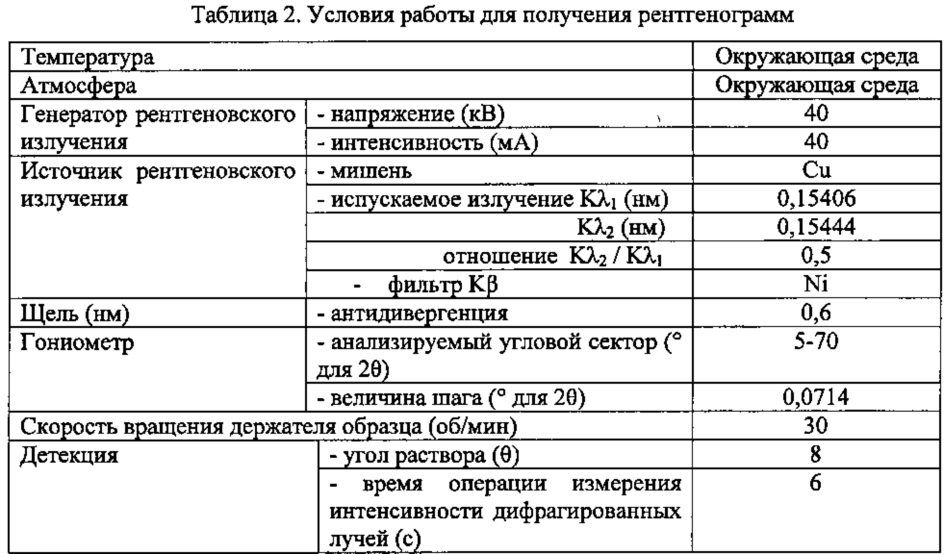
Образец порошка распределяют на кремниевом держателе образца так, чтобы избежать предпочтительной ориентации (кристаллов, ориентированных не случайно) и гарантировать плоскостность поверхности образца.
Динамическая сорбция паров
Анализы динамической сорбции паров (DVS) с водой выполняют в термостате DVS Intrisic от SMS Ltd., снабженном контрольной программой DVS-Intrisic Control Software 1.0.
Образец примерно в 5-10 мг, помещенный на алюминиевый держатель испарителя, подвергают полному циклическому анализу (сорбция с последующей десорбцией) в условиях, описанных в таблице 3.

Образец предварительно сушат в потоке сухого фильтрованного воздуха до тех пор, пока не получат постоянную массу. Затем повышают относительную влажность с шагом 5%. На каждой ступеньке образец оставляют до достижения равновесия (критерий dm/dt), и затем повышают относительную влажность далее. Относительную влажность поднимают до 95%. После уравновешивания на этой стадии подобным образом пошагово начинают десорбцию, позволяя стабилизироваться массе после каждой стадии снижения влажности.
Растворители и реагенты закупают и используют в таком виде, как получают от коммерческих поставщиков, если не указано иное.
Пример 1. Синтез соли сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, 2,9 экв.
Получают разбавленный раствор серной кислоты в DIPE, добавляя 4 мл (0,0751 моль) концентрированной серной кислоты к 28 мл (0,197 моль) DIPE.
К суспензии N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (16,1 г, 0,03756 моль) в DIPE (280 мл) добавляют по каплям 32 мл описанного выше разбавленного раствора серной кислоты. Наблюдают небольшое повышение температуры примерно на 10°C. реакционную смесь перемешивают при RT, и через один час смесь становится прозрачной. Полученный бесцветный раствор фильтруют и собирают. Затем полученный белый порошок сушат в вакууме при 50°С в течение 48 часов.
Аналитические данные
ВЭЖХ (метод A): rt 20,24 мин.
Элементный анализ:
вычислено %С=48,06; %Н=7,74; N=13,45; %S=10,26; %О=20,48;
эксперимент %С=41,43; %Н=6,95; %N=11,60%; %S=12,34; %0=26,53.
Пример 2. Синтез соли сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, 1,8 экв.
Названное в заголовке соединение получают согласно процедуре, подобной процедуре, описанной в примере 1.
Аналитические данные
ВЭЖХ (метод A): rt 29,207 мин.
ЯМР (D2O): δ (м.д.): 7,2 (м, 4Н, 2СН); 3,7 (уш, 8Н, 4CH2); 3,4-3,1 (м, 8Н, 4СН2); 2,9 (м 4Н, 2СН2); 2,3-1,9 (м, 6Н, 2СН+2СН2); 0,85(д, 12Н, 4СН3).
Элементный анализ:
вычислено %С=48,06; %Н=7,74; N=13,45; %S=10,26; %О=20,48;
эксперимент %С=49,55; %Н=7,89; N=13,87; %S=8,95; %0=19,29.
Пример 3. Синтез соли сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина, 1 экв.
К 99,6 мг синтезированного N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина добавляют 3 мл этанола, и достигают почти полного растворения после нагревания при 70°C. Добавляют эквимолярное количество 0,5 M водного раствора серной кислоты (465 мкл), и наблюдают полное растворение. Раствор сушат в вакууме при 70°С, и получают твердый остаток. Твердое вещество ресуспендируют в смеси IPA/EtOH при 70°С, и получают суспензию тонких частиц; затем объем растворителя частично уменьшают в вакууме. Суспензию охлаждают до комнатной температуры. Супернатант удаляют, порошок сушат в вакууме в течение 2 час при 70°С, и получают названное в заголовке соединение с выходом 89%.
Анализ методом ВЭЖХ (метод В): находят, что процент N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (свободное основание) в названном в заголовке соединении, определенный с помощью внешней калибровки, составляет 83,4%. Такой результат совместим с теоретически вычисленной величиной 81,4%.
Пример 4. Синтез соли сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, 2 экв.
К 101,7 мг синтезированного N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина добавляют 3 мл этанола, и достигают почти полного растворения после нагревания при 70°С. Добавляют двумолярное количество 0,5 M водного раствора серной кислоты (950 мкл), и наблюдают полное растворение. Раствор сушат в вакууме при 70°С, и получают полупрозрачную пленку, в которой по нарастающей происходит кристаллизация ожидаемой соли. Затем твердое вещество ресуспендируют в 3 мл этанола, и получают отчетливую суспензию, которую перемешивают при 60°С в течение 15 мин. Для окончательной кристаллизации соли добавляют 10 мл IPA, и полученную суспензию перемешивают при 80°С в течение 30 мин. Затем суспензию охлаждают до комнатной температуры и хранят в течение ночи при температуре, ниже температуры окружающей среды. Супернатант удаляют из колбы, порошок сушат в вакууме в течение 2,5 час при 70°С, и получают названное в заголовке соединение с выходом 71%.
Анализ методом ВЭЖХ (метод В): находят, что процент N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (свободное основание) в названном в заголовке соединении, определенный с помощью внешней калибровки, составляет 65,8%. Такой результат совместим с теоретически вычисленной величиной 68,6%.
В течение длительного времени неустойчивости сульфатов в твердом состоянии из-за окисления, в частности, окисления в пиперазиновом цикле, не наблюдают.
Пример 5. Физико-химический анализ различных солей
Получают соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина гидрохлорид, гидробромид, ацетаты, тартрат, фумарат, малат, оксалаты и сульфаты согласно процедурам, схожим с процедурами, описанными в предыдущих примерах, или стандартными способами образования солей, известными в технике. Результаты такого солеобразования приводятся в таблице 4.
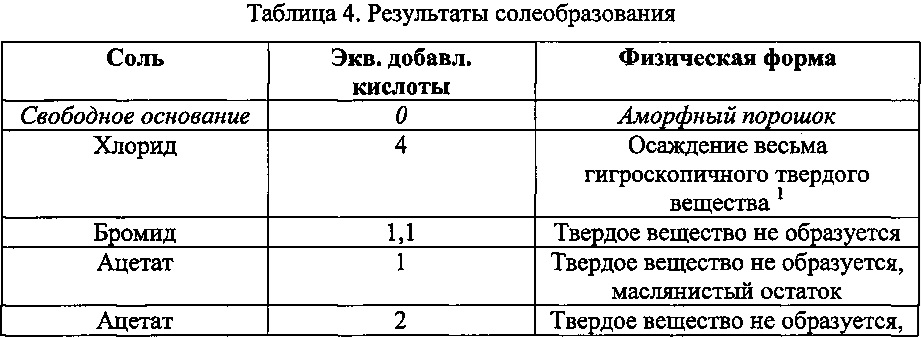
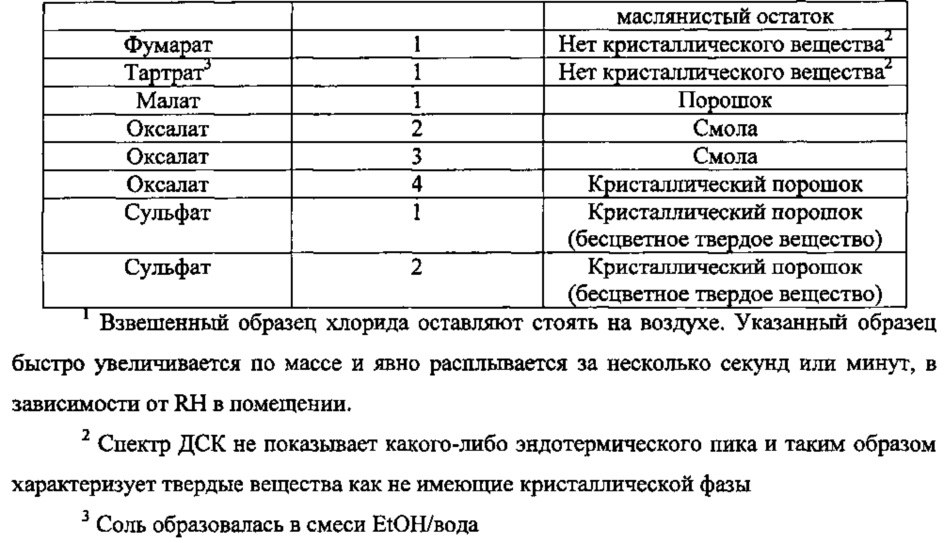
Непосредственно находят, что хлорид является очень гигроскопичным, в то время как ацетаты в твердой форме не получают. Хотя тартрат и фумарат получают в виде твердых веществ, анализ методом ДСК показывает, что они не являются кристаллическими веществами (см. фигуры 1 и 2). Такой недостаток может привести к изменениям от партии к партии в отношении твердых форм. Воспроизводимость от партии к партии является необходимым критерием при синтезе лекарственных соединений, в особенности, когда различные твердые формы могут иметь различные фармакокинетические и фармакодинамические свойства. Поэтому тартрат и фумарат не являются удовлетворительными солями.
Малат получают в виде порошка; однако он содержит асимметричный атом углерода. Хиральные центры существенно осложняют клиническую разработку, так как каждый стереоизомер в равной степени нуждается в характеризации как активный стереоизомер.
Что касается оксалатов, то для получения подходящих кристаллических порошков требуются 4 экв. противоиона оксалата. Кривые ДСК оксалатов (2 экв., 3 экв. и 4 экв.) показаны соответственно на фигурах 3, 4 и 5. Как показывают ДСК-спектры, тетраоксалат имеет наиболее хорошо очерченный и определенный эндотермический пик. Требование 4 эквивалентов оксалата является рискованным, так как массовый процент активной молекулы падает слишком низко - до 54%. Количество вводимого лекарственного средства для данной дозы ФАМ, поэтому существенно возрастает, как и опасность нейротоксичности, связанной с оксалатами.
Оба сульфата осаждаются в виде твердых веществ. Обнаружено, что они устойчивы, когда остаются на воздухе. В отличие от хлорида проблемы с гигроскопичностью не наблюдают. Анализ методом ДСК (фигуры 6 и 7) показывает четкие эндотермические пики, которые согласуются с твердыми веществами, включающими кристаллическую фазу.
Пример 6. Анализ оксалатов и сульфатов методом XRPD
Дифрактограмма XRPD соли 4 экв. оксалата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина показана на фиг. 8. В анализируемой угловой диафрагме детектируются несколько попутных дифрагированных лучей низкой интенсивности. Профиль XRPD показывает присутствие высокорассеивающего фона. Такой профиль XRPD характеризует порошок, имеющий кристаллическую фазу с небольшой или плохой степенью кристалличности (попутные лучи) при наличии аморфной фазы (высокорассеивающий фон).
Профиль дифракции рентгеновских лучей для сульфата из примера 1 (см. фигуру 9) показывает несколько отчетливых и резких дифракционных пиков между 5 и 25° по шкале 2-тета, показывающих, что твердая форма указанного сульфата включает фазу с хорошей степенью кристалличности. Дифракторамма также представляет ореол фона (между 10 и 30°), который интерпретируется как происходящий от аморфной фракции, присутствующей в твердом веществе. Сравнение профилей с сульфатом из примера 2 показывает несколько наложений между несколькими обнаруженными дифракционными пиками (см. фигуру 10).
Дифрактограмма XRPD сульфата из примера 3 (см. фигуру 11) подтверждает хорошую степень кристалличности этой соли с многочисленными, тонкими и хорошо определяемыми дифракционными пиками между 4 и 30° 2θ, и дает дифракционный профиль, отличающийся от синтезированного N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (свободное основание). Профиль XRPD такой соли сравнивают с профилем свободного основания, оба профиля, совмещенные в одном и том же хроматографе (фигура 12), сообразуются с различными кристаллическими формами сульфата и свободного основания. Такие результаты сообразны наблюдениям с помощью оптической микроскопии. Действительно, высокое двулучепреломление и хорошо определяемая палочкоподобная морфология частиц при наблюдении в проходящем свете (фигура 13а) и кросс-поляризованном свете (фигура 13b) показывают на соль сульфат хорошей степени кристалличности.
Дифрактограмма XRPD сульфата из примера 4 (см. фигуру 14) подтверждает хорошую степень кристалличности этой соли с многочисленными дифракционными пиками между 4 и 30° 2θ, и дает дифракционный профиль, отличающийся от синтезированного N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (свободное основание). Профиль XRPD такой соли сравнивают с профилем свободного основания, оба профиля, совмещенные в одном и том же хроматографе (фигура 15), сообразуются с различными кристаллическими формами сульфата и свободного основания.
В результате примеры 5 и 6 ясно показывают, что сульфаты превосходны по сравнению с солью любой другой кислоты и оксалатами, в частности. Сульфаты не имеют высокой гигроскопичности как хлориды. В отличие от бромидов они кристаллизуются и дают порошковые материалы. Их кристалличность действительно намного лучше кристалличности солей тартратов и фумаратов. Подобно сульфатам, оксалат со специфической стехиометрией 4 экв. дает твердые вещества, которые включают кристаллическую и аморфную фазу. Однако профили XRPD и оптическая микроскопия в проходящем и поляризованном свете показывают, что кристаллическая фаза сульфатов лучше определяется в смысле морфологии и степени кристалличности, чем кристаллическая фаза оксалата. Более того, сульфаты исправляют недостатки N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина (свободного основания), т.е. их можно выделить в твердой форме, имеющей кристаллическую фазу с хорошей степенью кристалличности, и у них нет явных проблем с устойчивостью. Более того, они расширяют возможности получения препаратов такой ФАМ вследствие своей весьма высокой водорастворимости. Оксалат 4 экв. не исправляет полностью недостатки свободного основания в смысле морфологии и степени кристалличности и нисколько не превосходит сульфаты в таких аспектах. Специалисты могут даже рассматривать оксалат 4 экв. как ухудшающий общие свойства свободного основания ФАМ, так как он содержит высокие количества противоиона оксалата, что может вызвать тяжелую нефротоксичность.
Пример 7. Профиль DVS сульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо [d]имидазол-2-амина, 1 экв.
Анализ методом DVS осуществляют согласно способу, описанному выше.
Результаты приводятся на фигурах 16 и 17, которые отображают кривую сушки DVS, а также графики изотерм DVS (записи сорбции/десорбции водяного пара) после предварительной сушки сульфата из примера 3. На фигуре 17 верхняя кривая соответствует фазе десорбции и нижняя кривая фазе сорбции.
После сушки при 25°C/RH 0% образец теряет 0,18% своей массы.
После сорбции по изменению массы образца наблюдают три интервала относительной влажности, соответствующие различным степеням сорбции воды и свойствам:
- RH от 0 до 80%: непрерывное и постепенное увеличение сорбции воды; поглощение воды при 25°C/RH 60% и 25°C/RH 80% составляет соответственно 0,7% и 1,5% по сравнению с массой образца, полученной после начальной сушки при RH 0%;
- RH от 80 до 90%: быстрое и почти постоянное увеличение сорбции воды; поглощение воды при 25°C/RH 90% составляет 9,7% по сравнению с массой образца, полученной после начальной сушки при RH 0%;
- затем сорбция воды нарастает, и поглощение паров воды при 25°C/RH 95% составляет 19,4% по сравнению с массой образца, полученной после начальной сушки при RH 0%.
После десорбции по изменению массы образца наблюдают три интервала относительной влажности, соответствующие различным степеням сорбции воды и свойствам:
- RH от 95% до 90%: быстрое снижение доли остаточной воды с оставшимися 10% при 25°C/RH 75% по сравнению с массой образца, полученной после начальной сушки при RH 0%;
- RH от 75% до 10%: образец сохраняет «адсорбированную» воду при сильном и почти постоянном гистерезисе (до 6,7% при 25°C/RH 75%);
- RH от 10% до 0%: образец теряет часть воды; оставшееся количество воды составляет 4,6% при 25°C/RH 0% по сравнению с массой образца, полученной после начальной сушки при RH 0%; на этой стадии масса образца стабилизируется и таким образом уравновешивается с окружающей средой.
На основании обычно используемых критериев (т.е. соединение называют гигроскопичным, если в нем присутствует более 2 мас. % воды, поглощенной при 25°C/RH 60%), сульфат из примера 3 не является гигроскопичным при 25°C/RH 60% только по приращению общей массы на этой стадии.
Полученное быстрое поглощение воды при RH 80%, а также сильный гистерезис (6-6,7% воды, остающейся после десорбции при RH от 80 до 10%) при высокой RH превращают сульфат из примера 3, исходно полученный в его несольватированной форме, в дегидратированную форму. Теоретическое поглощение воды для дигидратированной формы сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3 составляет 6,8% и соответствует определенным экспериментально 6,7%.
По окончании вышеописанного первого цикла DVS тот же образец подвергают второму циклу DVS со второй фазой сорбции и второй фазой десорбции. Результаты приводятся на фигуре 18. Вторые фазы, как сорбции, так и десорбции идентичны кривой первой фазы десорбции, полученной во время первого цикла DVS. Действительно, как можно видеть на фигуре 18, фаза десорбции и фаза сорбции перекрывают одна другую. Таким образом, дегидратированная форма сульфата, 1 экв., N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина из примера 3, которую получают после RH 80% при 25°С во время первого цикла, является устойчивой и негигроскопичной.
Биологические примеры Анализ метаболизма АРР in vitro
Анализ выполняют с использованием клеток SH-5Y5Y (клеточная линия нейробластомы человека, сверхэкспрессирующая АРР человека дикого типа), которые обрабатывают в течение 24 час сульфатом из примера 2. Такое испытание выполняют с четырьмя различными концентрациями соединения 0,3, 1, 3 и 10 мкМ. Количественное определение метаболитов осуществляют анализом методом вестерн-блоттинга. CTFα, CTFβ и AICD анализируют с использованием антиактина ((1-19) (SC-1616 Santa Cruz Biotechnology; 1:1000 от исходного раствора 200 мкг/мл) как внутреннего контроля и антител анти-С конца АРР (1:250000 в буфере для промывки). Концентрации белка определяют с помощью набора ВСА Protein Assay Kit (Thermo Scientific). Образцы (20 мкг общего белка) разделяют 16% SDS-PAGE согласно молекулярной массе каждого белка и переносят на нитроцеллюлозные мембраны.
Результаты приводятся на фигурах 19-а, 19-b, 19-с и 19-d. Они показывают возросшие в зависимости от дозы уровни AICD, CTFα и sAPPα и пониженный уровень Αβ1-42.
Таким образом, сульфат из примера 2 вызывает существенное усиление метаболизма АРР через неамилоидогенный путь, сопутствующий уменьшению образования вредных метаболитов, вовлеченных в образование амилоидных бляшек. Такие результаты являются еще более примечательными, так как Αβ1-42 является одним из наиболее вредных побочных продуктов метаболизма АРР в отношении образования амилоидных бляшек. Кроме того, пептид sAPPα не вызывает образования амилоидных бляшек и скорее известен как обладающий благоприятным нейрозащитным действием.
Кроме того, примечательно, что у этого сульфата не обнаружено цитотоксичности, обнаружено, что его СС50 в отношении клеточной линии SH-5Y5Y превышает 30 мкМ. В данном случае СС50 определяется как концентрация, при которой 50% посеянных клеток остаются живыми.
Анализ метаболизма АРР in vivo
Эксперименты in vivo выполняют на 4-месячных самках мышей С57 В16 или 2-месячных крысах Sprague Dawley.
Быстрое лечение: 24 часа, р.о.
Самок мышей обрабатывают per os (принудительный откорм) средой или соединением (пример 2) в количестве 0,25, 0,5, 1, 3 и 6 мг/кг (n=6 на группу) в течение 24 час. Продукт вводят с помощью зонда для искусственного кормления грызунов ECIMED Ref# V0104030 (4 мм × 30 мм). Животных умерщвляют через 24 часа, и головной мозг сразу же извлекают для препарирования. Уровни CTFα в лобной коре головного мозга (FC) и/или гиппокампе (HIP) измеряют анализом методом вестерн-блоттинга, как описано ранее. Коротко, ткани гомогенизируют с 200 мкл буфера для лизиса (10 мл буфера Лэммли для предлизиса и 1 таблетка коктейля ингибитора протеаз Complete Mini (Roche)) в керамическом сосуде. После обработки ультразвуком (5 мин) гомогенаты центрифугируют при 1600 об/мин 5 мин при 4°С. Супернатанты делят на аликвоты и хранят при -80°С до вестерн-блоттинга.
На фигуре 20 показаны результаты, зависимые от дозы. Соединение из примера 2 усиливает метаболизм АРР в лобной коре головного мозга через неамилоидогенный путь, как видно по возрастающим концентрациям CTFα. Лобная кора головного мозга вообще является первым участком головного мозга, который поражается образованием амилоидных бляшек при заболеваниях, связанных с анормальным метаболизмом АРР.
Соединение из примера 2 также сравнивают с оксалатом из WO 2006/051489 в таком же анализе (доза 6 мг/кг). Результаты, приведенные на фигуре 21, показывают превосходную эффективность сульфата по сравнению с оксалатом.
Длительная обработка: 1 месяц
Крысам дают в течение одного месяца 1 или 10 мг/кг/день соединения из примера 2, растворенного в их питьевой воде. Примечательная высокая растворимость этого сульфата дает возможность его легкого включения в композицию и введения животным. Животных умерщвляют по истечении одного месяца, и измеряют уровни CTFα и CTFβ в лобной коре головного мозга (FC) и/или гиппокампе (HIP) анализом методом вестерн-блоттинга, как описано ранее. Зависящие от дозы результаты показаны на фигурах 22-а и 22-b. Сульфат из примера 2 усиливает метаболизм в лобной коре головного мозга через неамилоидогенный путь, как видно из возрастающих концентраций CTFα (фигура 22-а). Сульфат из примера 2 ослабляет метаболизм АРР в гиппокампе через амилоидогенный путь, как видно из снижающихся концентраций CTFβ (фигура 22-b). Лобная кора головного мозга вообще является первым участком головного мозга, который поражается образованием амилоидных бляшек при заболеваниях, связанных с анормальным метаболизмом АРР, в то время как гиппокамп, который в высокой степени вовлекается в процессы запоминания и воспоминания, поражается позднее, но тяжелее. Таким образом, сульфат из примера 2 оказывает весьма положительное действие на метаболизм АРР как в лобной коре головного мозга, так и гиппокампе, и поэтому может представлять интерес при лечении нейродегенеративных заболеваний, в частности, как на ранних, так и на более поздних стадиях заболеваний, связанных с анормальным метаболизмом АРР. Длительная обработка: 3 месяца
Невропатологические расстройства также характеризуются анормальным фосфорилированием тау-белка (AT100). Гиперфосфорилирование тау-белка (в специфических участках) может привести к внутриклеточному накоплению нейрофибриллярных клубков (NFT), вовлекаемых в патогенез болезни Альцгеймера и других тауопатий. Поэтому одно направление исследования состоит в исследовании действия сульфата из примера 2 на такое анормальное фосфорилирование. Параллельно также контролируют такое действие в отношении непатологического фосфорилирования тау-белка (АТ8), на которое не должно быть воздействия. Таким образом, другим направлением такого исследования является воздействие сульфата из примера 2 на окислительный стресс (OS). Поэтому определяют уровни липидного перокисления - хорошо известного маркера для оценки окислительного стресса. Действительно, полагают, что окислительный стресс (OS) путем генерации токсичных реакционноспособных частиц кислорода (ROS) и окислительного повреждения (окисления жизненно важных клеточных компонентов, таких как липиды, белки и ДНК) вовлекается в патогенез нейродегенеративных расстройств. Исследуют, в частности, реакцию нейронов на OS на ее вклад в процессы нейродегенерации. OS является результатом нарушения баланса между генерацией ROS и антиокислительной защитой, ведущего к накоплению окислительных повреждений и в итоге гибели клеток. Окислительное повреждение также ассоциируется с патологической утратой нейронов при болезни Паркинсона (PD) и болезни Хантингтона (HD).
Самкам мышей С57В16 в возрасте 4 месяцев дают 0,5,1 или 3 мг/кг соединенней из примера 2, растворенного в их питьевой воде. Прежде всего всех мышей взвешивают и распределяют в каждую клетку для того, чтобы иметь приблизительно одинаковое значение массы ± ср.кв.откл. на клетку. Емкости с питьевой водой наполняют каждую неделю и взвешивают. Вычисляют потребленный объем, взвешивая каждую емкость по прошествии каждой недели, и остальной объем отбрасывают.
Измерения уровней фосфорилирования AT 100 выполняют на тканях головного мозга анализом методом вестерн-блоттинга (описанным ранее) с использованием специфических антител против AT 100 (моноклональные античеловеческие антитела PHF-тау MN1020, ThermoScientific/Pierce).
Измерения уровней фосфорилирования АТ8 выполняют на тканях головного мозга анализом методом вестерн-блоттинга (описанным ранее) с использованием специфических антител против АТ8 (моноклональные античеловеческие антитела PHF-тау MN1060, ThermoScientific/Pierce).
Измерения уровней LPO: уровень перокисления в гиппокампе определяют в виде эквивалентов гидропероксида кумола (СНР) и выражают в виде эквивалентов СНР на влажную массу ткани и в виде процента от данных контрольной группы после модифицированного FOX анализа.
Результаты показаны на фигурах 23-а, 23-b и 23-с. Сульфат по изобретению снижает патологическое фосфорилирование тау-белка (фигура 23-а), хотя не затрагивает нормальное фосфорилирование тау-белка (фигура 23-b). Более того, указанный сульфат вызывает существенное снижение уровней LPO и, таким образом, способен частично облегчать процессы окислительного стресса (фигура 23-с).
Принимая во внимание описанные выше экспериментальные результаты, соли сульфаты по изобретению применимы при ориентации метаболизма АРР в лобной коре головного мозга и гиппокампе в направлении неамилоидогенных путей. Они также изменяют патологическое фосфорилирование тау-белка, причем в то же время облегчают процессы окислительного стресса.
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/0b574e40759d29569814e74257597557.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/54869dbd51bb293619f5818460183e48.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/f5abbbdefd848a836848a829896ae931.jpg)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/2698f812791f06cde9ec028aa6edc9d5.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/acbf8f619056dc01324c3eb7eec304e8.jpg)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/85f338997566a1339969d231bb4558ef.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/290276c888012124986f124c43e712b8.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/d03d84546dba10f41563c57b0d456599.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/d31581719a3dbfc972977d9f19017973.jpg)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/d76a40909d42e33fe77e62f04e93dca5.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/a4903da09f29d54b501dd88247543e99.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/51e0b5a4afd95236393c72dcdcf03659.jpg)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/5c0b3a78b098743ce7e9a5f63d5e212f.png)
![СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d7/38/bb/3a0621cb152acb9642125d884d49adc2.jpg)

