Результат интеллектуальной деятельности: АНТАГОНИСТЫ СЕРОТОНИНОВЫХ 5-НТ3-РЕЦЕПТОРОВ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ВЕСТИБУЛЯРНЫХ НАРУШЕНИЙ С ПОВРЕЖДЕНИЯМИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение касается антагонистов серотониновых 5-НТ3-рецепторов или ингибиторов экспрессии генов серотониновых 5-НТз-рецепторов для применения при лечении или профилактике вестибулярных нарушений с повреждениями.
Уровень техники
Введение в вестибулярные нарушения
Вестибулярные нарушения (внутреннего уха) могут вызывать головокружения, вертиго, нарушение равновесия, изменения слуха, тошноту, усталость, тревогу, трудности в концентрации внимания и другие симптомы, которые могут оказывать разрушительное действие на повседневную жизнь, работоспособность, взаимоотношения в семье и с друзьями и качество жизни человека.
Например, вестибулярный неврит является главной причиной госпитализации при вертиго не неврологического происхождения. Поскольку его этиология почти неизвестна, эпидемиологические исследования разнятся в зависимости от источника (считается, что его встречаемость составляет от 3,5 до 50 новых случаев на 100000 лиц за год). В прошлом предполагалось, что вестибулярный неврит может вызывать либо воспаление вестибулярного нерва, либо ишемия лабиринта. В настоящее время предпочитают вирусную природу. Реактивация вируса герпеса 1 типа могла бы объяснить повторение приступов вертиго в таких обстоятельствах.
Вестибулярные нарушения также могут повлечь за собой большинство случаев падения у пожилых людей, поэтому их предотвращение становится приоритетным. Так, падение у пожилых составляет более 1% общего бюджета медицинского страхования во Франции (INSEE 1990). Оно затрагивает во Франции 30% людей старше 65 и 50% лиц старше 80 лет. Падение у пожилых людей влечет за собой 2/3 смертей, вызванных несчастными случаями у людей старше 65 лет, и в 4 раза увеличивает риск смертельного исхода на следующий год.
Этиология вестибулярных нарушений
Несмотря на то, что этиология вестибулярных нарушений почти неизвестна, общепризнано, что вестибулярные нарушения (которые также называют вестибулярным дефицитом) составляют обширное семейство заболеваний, связанных с вестибулярным органом. Эти заболевания могут различаться по их предполагаемому происхождению, а именно: (1) вестибулярные нарушения с повреждениями и (2) вестибулярные нарушения без повреждений.
1) Вестибулярные нарушения с повреждениями означают такие вестибулярные нарушения, при которых есть повреждения клеток внутреннего уха и/или вестибулярного нерва либо они появляются в процессе развития заболевания. В этом случае нарушается функциональность вестибулярного аппарата, что можно наблюдать с помощью клинических функциональных тестов (VOR, VNG). Вестибулярные нарушения с повреждениями включают:
- вестибулярные нарушения, при которых внутреннее ухо и/или вестибулярный нерв поражает инфекция, вызывая обратимые и/или необратимые повреждения. Одним из примеров заболеваний этой группы является вестибулярный неврит;
- вестибулярные нарушения, при которых затрагивается уровень жидкости внутреннего уха (отклонения в количестве, составе и/или давлении эндолимфы), такие заболевания обычно приводят к повреждениям в процессе развития заболевания. Примерами заболеваний этой группы являются болезнь Меньера и вторичная эндолимфатическая водянка. В настоящее время их связывают со звоном в ушах и потерей слуха;
- вестибулярные нарушения, вызванные инсультом или повреждениями концевых органов преддверия. Примером таких заболеваний является вертиго, вызванное локальной ишемией, воздействием эксцитотоксинов, травмами, затрагивающими височные кости.
2) Вестибулярные нарушения без повреждений означают такие вестибулярные нарушения, сопровождающиеся кратковременными и зачастую повторяющимися приступами вертиго, при которых не наблюдается повреждения клеток внутреннего уха и/или вестибулярного нерва. В этом случае функциональность вестибулярного аппарата при исследовании между приступами вертиго с помощью клинических функциональных тестов (VOR, VNG) не отличается от здорового вестибулярного аппарата. Вестибулярные нарушения без повреждений включают:
- вестибулярные нарушения, при которых в какой-то части внутреннего уха скапливаются осколки. Эти осколки, называемые отокониями, состоят из мелких кристаллов карбоната кальция, которые при их смещении посылают ложные сигналы в мозг. Примерами таких заболеваний являются позиционные вертиго;
- повторяющиеся вестибулярные нарушения неизвестного происхождения без звона в ушах или потери слуха.
Оценка потери функциональности вестибулярного аппарата
У человека морфофункциональные изменения концевых органов преддверия невозможно оценить непосредственно (за исключением крупных повреждений, которые можно определить методом MRI). В настоящее время скорее применяются непрямые методы для оценки потери функциональности вестибулярного аппарата. Эти методы поведенческого тестирования обычно выполняются в клиниках/больницах ENT. В их числе можно указать вестибулонистагмографию (VNG), оценку вестибулоокуломоторного рефлекса (VOR) с помощью калорического или ротационного теста.
Лечение вестибулярного дефицита
В настоящее время лечение вестибулярного дефицита в основном сосредоточено на уменьшении приступов вертиго с помощью вестибулоплегических препаратов и в то же время ограничении нейровегетативных реакций с помощью противорвотных препаратов. Кортикостероиды и антивирусные препараты являются единственным средством, направленным на ограничение распространения вестибулярных повреждений при вестибулярном неврите (которые предположительно вызваны бактериальной или вирусной инфекцией). Их действие остается спорным из-за отсутствия этиологии при большинстве вестибулярных дефицитов. Например, восстановление после вестибулярного неврита обычно остается неполным. При исследовании на 60 пациентах у 90% был выявлен парез горизонтального полукружного канала через один месяц после появления симптомов и у 80% через шесть месяцев; калорические ответы нормализовались только у 42%. Исходя из частоты этого заболевания, существенный и постоянный односторонний динамический дефицит вестибулоокулярного рефлекса, который не компенсируется другими механизмами, возникает примерно у 4000 человек в год в Соединенных Штатах. Этот дефицит приводит к ухудшению зрения и постуральному дисбалансу во время хождения и особенно во время движения головой в направлении пораженного уха.
Соответственно, имеется потребность в защитной или восстановительной терапии для предотвращения, уменьшения или лечения частоты и/или тяжести вестибулярных нарушений с повреждениями, если данные функциональные изменения клеток внутреннего уха и/или вестибулярного нерва обусловлены воспалением или повреждениями различного происхождения.
Авторы изобретения неожиданно обнаружили, что антагонисты серотониновых 5-НТ3-рецепторов, такие как ондансетрон, способны предотвратить или лечить вестибулярные повреждения, защищая клетки внутреннего уха и вестибулярного нерва от повреждения или дегенерации. По данным Jellish et al. (Journal of Clinical Anesthesia 2007, 9: 451-456), ондансетрон уменьшает послеоперационную тошноту или рвоту после хирургического лечения среднего уха. А по данным Rice et al. (Lancet 1995, 345: 1182-1183) ондансетрон лечит такие симптомы, как вертиго, тошнота и рвота при таких болезнях ствола мозга, как рассеянный склероз. Наконец, по данным US 2007265329 ондансетрон также предотвращает тошноту и рвоту, вызванные химиотерапией. Противорвотные свойства ондансетрона, как сообщалось, обусловлены антагонизмом серотониновых 5-НТ3-рецепторов, локализованных в рвотном центре (в латеральной ретикулярной формации ствола мозга), принимающем вестибулярные, соматические, висцеральные и лимбические афференты (Tyers MB, Freeman AJ. Oncology, 1992, 49: 263-268). Такое фармакологическое действие предотвращает рвотный рефлекс, обычно опосредованный серотонином.
Хотя ондансетрон применялся для лечения или предотвращения рвотных симптомов, связанных с вертиго, авторы изобретения обнаружили, что он также способен предотвращать и/или непосредственно лечить повреждения в вестибулярных органах.
Сущность изобретения
Изобретение касается антагонистов серотониновых 5-НТ3-рецепторов или ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для лечения вестибулярных нарушений с повреждениями.
Раскрытие сущности изобретения
Недавнее клиническое исследование, проведенное авторами изобретения, показало приемлемый восстановительный эффект антагониста серотониновых 5-НТ3-рецепторов (т.е. 1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-она, также известного как ондансетрон) при вестибулярных повреждениях, сопровождающих вестибулярный неврит. Этот антагонист серотониновых 5-НТ3з-рецепторов эффективно уменьшает функциональные изменения в концевых органах преддверия и последующий вестибулярный дефицит, возникающий при такой патологии внутреннего уха. Этот результат является выдающимся, так как он впервые показывает, что фармакологическая терапия, направленная на защиту и/или восстановление функциональности преддверия, может принести конкретное решение для сохранения функциональности преддверия после вестибулярных нарушений с повреждениями. Он также создает уникальную возможность для разработки первой лечебной терапии против вестибулярного дефицита с повреждениями.
Кроме того, авторы изобретения впервые показали, что белки серотониновых 5-НТ3-рецепторов экспрессируются в нескольких частях вестибулярного аппарата.
Таким образом, настоящим изобретением представлены способы и композиции (как-то фармацевтические композиции) для применения при лечении вестибулярных нарушений с повреждениями.
В настоящем изобретении термины "лечить", "лечение" и "терапия" относятся к лечебной терапии. Соответственно, целью изобретения является обеспечение стойкого прекращения вестибулярных нарушений или улучшения состояния субъекта путем восстановления функциональности или частичной функциональности концевых органов преддверия и тем самым восстановления функциональности самого преддверия. Изобретение не предусматривает способа контролирования нежелательных симптомов, связанных с вестибулярным дефицитом, таких как рвота и тошнота, но обеспечивает способ лечения вестибулярного дефицита. Изобретение также направлено на предотвращение любых повреждений или предотвращение усиления уже существующих повреждений.
Настоящим изобретением предусмотрены способы и композиции (как-то фармацевтические композиции) для применения в способе защиты/восстановления вестибулярной нейрональной сети и тем самым защиты/восстановления функциональности вестибулярного аппарата у субъекта, страдающего вестибулярным нарушением с повреждениями.
В настоящем изобретении термин "вестибулярное нарушение или вестибулярный дефицит с повреждением" относится к таким вестибулярным нарушениям, при которых имеются или в процессе развития заболевания появляются повреждения клеток внутреннего уха и/или вестибулярного нерва. В таком случае нарушается функциональность вестибулярного аппарата. Вестибулярные нарушения с повреждениями включают:
- вестибулярные нарушения, при которых внутреннее ухо и/или вестибулярный нерв поражает инфекция, вызывая обратимые и/или необратимые повреждения. Одним из примеров заболеваний этой группы является вестибулярный неврит;
- вестибулярные нарушения, при которых затрагивается уровень жидкости внутреннего уха (отклонения в количестве, составе и/или давлении эндолимфы), такие заболевания обычно приводят к повреждениям в процессе развития заболевания. Примерами заболеваний этой группы являются болезнь Меньера и вторичная эндолимфатическая водянка;
- вестибулярные нарушения, вызванные повреждениями концевых органов преддверия. Примером таких заболеваний является вертиго, вызванное локальной ишемией, воздействием эксцитотоксинов, травмами, затрагивающими височные кости.
Примеры вестибулярных нарушений с повреждениями, которые предусмотрены изобретением, включают, без ограничения, вестибулярный неврит, вирусный нейронит, лабиринтит, вирусный эндолимфатический лабиринтит, вызванная лекарствами ототоксичность, болезнь Меньера, эндолимфатическая водянка, травмы головы с вестибулярным дефицитом с повреждениями, кровоизлияния в лабиринте, хронические. или острые инфекции лабиринта, серозный лабиринтит, баротравматизм, аутоиммунные заболевания внутреннего уха, пресбивестибулия, токсические вестибулярные нарушения.
В соответствии с изобретением вестибулярные нарушения с повреждениями можно идентифицировать методом MRI (магнитно-резонансной интраскопии) при больших повреждениях и методами непрямой оценки, позволяющими оценить потерю функциональности вестибулярного аппарата. Эти методы обычно выполняются в клиниках/больницах ENT и включают вестибулонистагмографию (VNG) и оценку вестибулоокуломоторного рефлекса (VOR) с помощью калорического или ротационного теста. Функция вестибулоокулярного рефлекса (VOR) заключается в стабилизации зрительного образа на сетчатке при смещении. Измерение VOR обеспечивает удобный способ исследования функциональности вестибулярной системы. В основном парадигма основана на отслеживании движения глаз методом проекции в инфракрасном свете (Fetoni et al., 2003, Hearing Research 2003, 182: 56-64). Пациентов подвергают синусоидальным колебаниям в темноте вокруг вертикальной и продольной оси для того, чтобы вызвать горизонтальные и вертикальные реакции глаз. Любые функциональные нарушения преддверия связаны с изменениями размаха вызванной VNG. Помимо VOR и VNG, применяются методы постурографии для выявления отклонений положения тела, которые также связаны с нарушениями преддверия. Для выявления глубоких повреждений в концевых органах преддверия можно использовать морфофункциональные исследования типа функциональной интраскопии (MIR или CAT (компьютеризированная аксиальная томография) и их производные). На животных моделях вестибулярного дефицита для оценки амплитуды поражений или повреждений преддверия применяются специально адаптированные методы VNG, VOR и постурального тестирования. Также возможны гистологические исследования методами обычной световой или электронной микроскопии на фиксированных тканях (вестибулярных ганглиев и концевых органов преддверия). Такие исследования в основном проводятся на грызунах.
В настоящем изобретении термин "субъект" обозначает млекопитающих, таких как грызуны, кошки, собаки и приматы. Предпочтительно субъектом по изобретению является человек.
В одном аспекте изобретение касается антагонистов серотониновых 5-НТ3- рецепторов для применения при лечении вестибулярных нарушений с повреждениями.
В другом аспекте изобретение касается антагонистов серотониновых 5-НТ3-рецепторов для применения в способе восстановления функциональности вестибулярного аппарата у субъекта, страдающего вестибулярным нарушением с повреждениями. Такое восстановление можно оценивать методами VNG или VOR, как указано выше.
В настоящем изобретении термин "серотониновый 5-НТ3-рецептор" имеет общепринятое в данной области значение и относится к 5-гидрокситриптаминовым (серотониновым) рецепторам 3 подтипа. Термин может включать серотониновые 5-НТ3-рецепторы природного происхождения и их варианты и модифицированные формы. Серотониновый 5-НТ3-рецептор может происходить из любого источника, но обычно он является серотониновым 5-НТ3-рецептором млекопитающих (напр., человека или других приматов), предпочтительно серотониновым 5-НТ3-рецептором человека.
В настоящем изобретении термин "антагонист серотониновых 5-НТ3-рецепторов" охватывает любое химическое соединение, которое при введении пациенту приводит к ингибированию или к понижающей регуляции биологической активности, связанной с активацией серотониновых 5-НТ3-рецепторов у пациента, включая любые последующие биологические эффекты, которые так или иначе возникают при связывании с серотониновым 5-НТ3-рецептором его естественного лиганда (т.е. серотонина). Такие антагонисты серотониновых 5-НТ3-рецепторов включают любые агенты, которые могут блокировать активацию серотониновых 5-НТ3-рецепторов или любые последующие биологические эффекты вследствие активации серотониновых 5-НТ3-рецепторов. К примеру, такой антагонист серотониновых 5-НТ3-рецепторов может действовать, занимая сайт связывания лиганда или его часть в серотониновом 5-НТ3-рецепторе, тем самым делая рецептор недоступным для его естественного лиганда, так что его нормальная биологическая активность предотвращается или уменьшается. Антагонистическую активность соединений по отношению к серотониновым 5-НТ3-рецепторам можно определить различными способами, хорошо известными в этой области. Например, 5-НТ3-антагонистическую активность можно оценивать методом связывания радиолиганда и по вызванному 5-НТ рефлексу von Bezold-Jarisch у крыс, как это описано в работе Turconi М. et al. (1990), включенной сюда путем ссылки.
В одном воплощении антагонистом серотониновых 5-НТ3-рецепторов может быть малая органическая молекула.
Термин "малая органическая молекула" относится к молекулам, сравнимым по размеру с теми органическими молекулами, которые обычно применяются в фармацевтических препаратах. Термин исключает биологические макромолекулы (напр., белки, нуклеиновые кислоты и т.п.). Предпочтительные размеры малых органических молекул находятся в пределах до 5000 Да, более предпочтительно до 2000 Да и наиболее предпочтительно до 1000 Да.
Типичные антагонисты серотониновых 5-НТ3-рецепторов, которые предусмотрены изобретением, включают, без ограничения, малые органические молекулы, описанные в патентах US Nos. 4.695.578; 4.906.755; 4.86.808; 5.677.326; 5.202.333; 5.225.407; 5.360.800; 6.770.655; в патентных заявках UK Nos. 2100259, 2125398, 2153821, 2160871 и 2202530; опубликованных Европейских патентных заявках Nos. 94724, 99789, 200444, 242973. 247266,266730, 302699, 306323,307172,309423, 313393, 337547,339950, 353983, 356098, 358903, 381422, 397364 и 397365; и патентной заявке PCT No. 88/01866, которые включены сюда путем ссылки.
В предпочтительном воплощении антагонист серотониновых 5-НТ3-рецепторов для применения по изобретению может представлять собой соединение формулы (I):
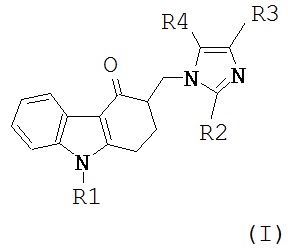
где R1 означает C3-7-Циклоалкил-(C1-4)-алкильную группу или C3-10-алкинильную группу; и одна из групп, представленных R2, R3 и R4, представляет собой атом водорода или C1-6-алкил, C3-7-циклоалкил, C2-6-алкенил или фенил-(C1-3)-алкильную группу, а каждая из двух других групп, которые могут быть одинаковыми или разными, представлена атомом водорода или C1-6-алкильной группой; и его физиологически приемлемые соли, свободные кислоты, свободные основания и сольваты (напр., гидраты).
Соединения формулы (I) были описаны в Европейском патенте No. 19156 и в патенте US No. 4,695,578, которые включены в настоящее описание путем ссылки.
Когда группа R1 в общей формуле (I) представлена C3-7-Циклоалкил-(C1-4)-алкильной группой, C3-7-циклоалкильная часть может быть, к примеру, циклопропиловой, циклобутиловой, циклопентиловой, циклогексиловой или циклогептиловой группой; a C1-4-алкильная часть может быть метиловой, этиловой, пропиловой, проп-2-иловой или бутиловой группой. Следовательно, группа R1 может представлять собой, напр., циклопропилметиловую, циклопентилпропиловую или циклогептилметиловую группу. Когда циклоалкильное кольцо содержит 5, 6 или 7 атомов углерода, то оно может необязательно содержать одну или две двойные связи. Примеры таких групп включают циклогексенильную и циклогексадиенильную группы.
Когда R1 означает C3-10-алкинильную группу, то это может быть, к примеру, 2-пропинильная или 2-октинильная группа. Следует иметь в виду, что если R означает C3-10-алкинильную группу, то тройная связь может не соседствовать с атомом азота.
Обращаясь к группам, представленным R2, R3 и R4 в общей формуле (I), алкильная группа может быть алкильной группой с неразветвленной или разветвленной цепью, к примеру, метиловой, этиловой, пропиловой или проп-2-иловой группой; алкенильная группа может быть, к примеру, пропениловой группой; фенил-(С1-3)-алкильная группа может быть, к примеру, бензиловой, фенетиловой или 3-фенилпропиловой группой; а циклоалкильная группа может быть, к примеру, циклопентиловой, циклогексиловой или циклогептиловой группой.
Следует иметь в виду, что атом углерода в положении 3 тетрагидрокарбазолонового кольца асимметричен и может существовать в R- или S-конфигурации. Также следует иметь в виду, чтоб в зависимости от природы групп R1, R2, R3 и R4 центры изомеризации могут встречаться и в другом месте молекулы. Настоящее изобретение охватывает все индивидуальные изомерные формы соединений формулы (I) и все их смеси.
В предпочтительном воплощении изобретение охватывает применение оптически чистых R(+) изомеров соединений формулы (I).
Подходящие физиологически приемлемые соли соединений общей формулы (I) включают соли кислот, образованные с органическими или неорганическими кислотами, к примеру, гидрохлориды, гидробромиды, сульфаты, фосфаты, цитраты, фумараты и малеаты. Сольваты, к примеру, могут быть гидратами.
Предпочтительным классом соединений, представленных общей формулой (I), является тот, в котором одна из групп, представленных R2, R3 и R4, является C1-3-алкильной или С3-6-алкенильной группой, а каждая из двух других групп, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-3-алкильную группу. Когда R2 представлен атомом водорода, то R3 и/или R4 предпочтительно представлен C1-3-алкильной группой. Когда R2 представлен C1-3-алкильной группой, то R3 и R4 оба предпочтительно представлены атомами водорода.
Предпочтительными соединениями формулы (I) могут быть 1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-9-(проп-2-енил)-4Н-карбазол-4-он; 9-циклопентил-1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-он; и 1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-9-(проп-2-ил)-4Н-карбазол-4-он, а также их физиологически приемлемые соли и сольваты.
Особенно подходящим антагонистом серотониновых 5-НТ3-рецепторов для применения по изобретению является ондансетрон®, что является одобренным названием для 1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазола-4-она, который можно представить формулой:
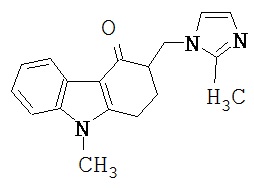
а также его физиологически приемлемые соли, свободные кислоты, свободные основания и сольваты (напр., гидраты).
Другие особенно подходящие антагонисты серотониновых 5-НТ3-рецепторов для применения по изобретению можно выбрать из группы, состоящей из палоносетрона, трописетрона, лерисетрона, алосетрона, гранисетрона, доласетрона, бернесетрона, рамосетрона, азасетрона, итасетрона, закоприда и цилансетрона.
Палоносетрон - это (3аS)-2-[(8)-1-азабицикло[2.2.2]окт-3-ил]-2,3,3а,4,5,6-гекса-гидро-1-оксо-1Н-бенз[де]изохинолин, который описан в US Patent No. 5,202,333.
Трописетрон - это (3-эндо)-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир (±)1Н-индол-3-карбоновой кислоты, который описан в US Patent No. 4,789,673.
Лерисетрон - это (1-(фенилметил)-2-(1-пиперазинил)-1Н-бензимидазол), который описан в US Patent No. 5,256,665.
Алосетрон - это 2,3,4,5-тетрагидро-5-метил-2-[(5-метил-1Н-имидазол-4-ил)метил]-1Н-пиридо[4,3-b]индол-1-он, который описан в US Patent No. 5,360,800.
Гранисетрон - это эндо-М-(9-метил-9-азабицикло[3.3.1]нон-3-ил)-1 -метил- 1Н-индазол-3-карбоксамид, который описан в US Patent No. 4,886,808.
Доласетрон - это (2[альфа],6[альфа],8[альфа],9[альфа][бета])-октагидро-3-оксо-2,6-метано-2Н-хинолизин-8-ил-1Н-индол-3-карбоксилат, который описан в US Patent No. 4,906,755.
Рамосетрон - это (-)-(R)-5-[(1-метил-1Н-индол-3-ил)карбонил]-4,5,6,7-тетрагидро-1Н-? который описан в Европейской патентной заявке No. 381422 A1.
Азасетрон - это N-азабицикло[2.2.2]окт-3-ил-6-хлоро-3,4-дигидро-4-метил-3-оксо-2Н-1,4-бензоксазин-8-карбоксамид гидрохлорид.
Итасетрон - это (3-альфа-тропанил)-1Н-бензимидазолон-3-карбоксамид гидрохлорид.
Закоприд - это 4-амино-N-(1-азабицикло[2.2.2]окт-3-ил)-5-хлоро-2-метоксибензамид, который описан в Европейской патентной заявке No. 099789 A1.
Цилансетрон - это R-(-)5,6,9,10-тетрагидро-10-[(2-метил-имидазол-1-ил)метил]-4Н-пиридо[3.2.1-jk]карбазол-11(8Н)-он, который описан bus Patent No. 4,939,136.
В другом воплощении антагонист серотониновых 5-НТ3-рецепторов для применения по изобретению может состоять из антитела (термин охватывает и фрагменты антител), которое может блокировать активацию серотониновых 5-НТ3-рецепторов.
В частности, антагонист серотониновых 5-НТ3-рецепторов может состоять из антитела, направленного против серотониновых 5-НТ3-рецепторов или лиганда серотониновых 5-НТ3-рецепторов таким образом, что данное антитело нарушает связывание лиганда с данным рецептором.
Антитела, направленные против серотониновых 5-НТ3-рецепторов, могут быть получены известными методами путем введения соответствующего антигена или эпитопа животному хозяину, выбранному, напр., из свиней, коров, лошадей, кроликов, коз, овец и мышей, среди прочего. Для усиления продукции антител можно применять различные адъюванты, известные в данной области. Хотя антитела, применимые в практике изобретения, могут быть поликлональными, однако предпочтительны моноклональные антитела. Моноклональные антитела против серотониновых 5-НТ3-рецепторов или лигандов серотониновых 5-НТ3-рецепторов могут быть получены и выделены любым методом, обеспечивающим продукцию молекул антител непрерывными клеточными линиями в культуре. Методики получения и выделения включают, без ограничения, метод гибридом, первоначально описанный Kohler and Milstein (1975); метод В-клеточной гибридомы человека (Cote et al., 1983); и метод EBV-гибридомы (Cole et al., 1085). В качестве альтернативы можно адаптировать методы, описанные для получения одноцепочечных антител (напр., см. US Patent No. 4,964,778), для получения одноцепочечных антител против 5-НТз-рецепторов или против лигандов 5-НТ3-рецепторов. Антагонисты серотониновых 5-НТ3-рецепторов, применимые в практике настоящего изобретения, также включают фрагменты антител против 5-НТ3-рецепторов или против 5-НТ3-лигандов, в том числе F(аb’)2-фрагменты, которые могут быть получены при расщепления пепсином интактной молекулы антитела, и Fab-фрагменты, которые могут быть получены при восстановлении дисульфидных мостиков в F(аb’)2-фрагментах. С другой стороны, можно сконструировать библиотеки, экспрессирующие Fab и/или scFv, что позволяет быстро идентифицировать фрагменты, обладающие требуемой специфичностью к серо-тониновым 5-НТ3-рецепторам.
Также можно получить гуманизированные антитела против серотониновых 5-НТ3- рецепторов или 5-НТ3-лигандов или их (антител) фрагменты согласно известным методам. "Гуманизированные антитела" - это разновидности химерных антител не человека, а других видов, напр., из грызунов, содержащие минимальную последовательность, полученную из иммуноглобулина не человека. По большей части гуманизированные антитела - это иммуноглобулины человека (антитело-реципиент), в которых остатки гипервариабельных участков (CDRs) реципиента заменены остатками из гипервариабельных участков другого вида (антитело-донор), как-то мыши, крысы, кролика или приматов (кроме человека), обладающих требуемой специфичностью, сродством и емкостью. В некоторых случаях остатки каркасного участка (FR) иммуноглобулина человека заменяются соответствующими остатками другого вида. Более того, гуманизированные антитела могут содержать остатки, которые не встречаются в антителе-реципиенте или в антителе-доноре. Эти модификации делаются для дальнейшего улучшения характеристик антитела. В общем, гуманизированное антитело должно содержать практически все из по меньшей мере одного, обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют таковым иммуноглобулина другого вида, а все или практически все участки FRs взяты из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно может содержать и по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Способы получения гуманизированных антител описаны, к примеру, в Winter (US Patent No. 5,225,539) и Boss (Celltech, US Patent No. 4,816,397).
Затем, после выработки антител, направленных против серотониновых 5-НТ3-рецепторов, как описано выше, специалист в данной области легко может отобрать антитела, блокирующие активацию серотониновых 5-НТ3-рецепторов.
В другом воплощении антагонистом серотониновых 5-НТ3-рецепторов для применения по изобретению является аптамер. Аптамеры - это класс молекул, представляющих альтернативу антителам в плане молекулярного распознавания. Аптамерами являются олигонуклеотидные или олигопептидные последовательности со способностью к распознаванию практически любого класса молекул мишени с высоким сродством и специфичностью. Такие лиганды могут быть выделены методом систематической эволюции лигандов путем экспоненциального обогащения (SELEX) библиотеки случайных последовательностей, как описано в Tuerk С.and Gold L., 1990. Библиотека случайных последовательностей может быть получена путем комбинаторного химического синтеза ДНК. В этой библиотеке каждый представитель является линейным олигомером, в конечном счете химически модифицированным, с уникальной последовательностью. Возможные модификации, применения и преимущества этого класса молекул рассмотрены в обзоре Jayasena S.D., 1999. Пептидные аптамеры состоят из конформационно ограниченного вариабельного участка антитела, выведенного на платформу белка типа тиоредоксина А Е. coli, которые отбираются из комбинаторных библиотек двугибридным методом (Colas et al., 1996).
Затем, после получения аптамеров, направленных против серотониновых 5-НТ3-рецепторов, как описано выше, специалист в данной области может легко отобрать аптамеры, блокирующие активацию серотониновых 5-НТ3-рецепторов.
Антагонисты серотониновых 5-НТз-рецепторов для применения по изобретению можно далее идентифицировать методами скрининга, описанными в данной области. Способы скрининга по изобретению могут выполняться согласно известным методам. В способе скрининга можно измерять связывание соединения-кандидата с 5-НТ3-рецептором либо с клетками или мембранами, несущими 5-НТ3-рецепторы, или с его слитым белком при помощи метки, прямо или косвенно связанной с соединением-кандидатом. С другой стороны, способ скрининга может включать измерение либо качественное или количественное детектирование конкуренции за связывание с 5-НТ3-рецептором соединения-кандидата с меченым конкурентом (напр., антагонистом или агонистом). Далее, в способе скрининга можно протестировать, дает ли соединение-кандидат сигнал, порождаемый антагонистом рецептора, используя системы детекции, подходящие для клеток, несущих рецептор. Антагонисты можно определять в присутствии известного агониста (напр., серотонина) и наблюдать, какой эффект на активацию агонистом оказывает присутствие соединения-кандидата. Также подходит конкурентное связывание с использованием известного агониста, такого как серотонин. Антагонистическую активность соединений по отношению к серотониновым 5-НТ3-рецепторам можно определить различными методами, хорошо известными в данной области. Например, 5-НТ3-антагонистическую активность можно определить методом связывания радиолиганда и по вызванному 5-НТ рефлексу von Bezold-Jarisch у крыс, как это описано в работе Turconi М. et al. (1990).
Следующий аспект изобретения касается ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для применения при лечении вестибулярных нарушений с повреждениями.
В другом аспекте изобретение касается ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для применения в способе восстановления вестибулярной функции у субъекта, страдающего вестибулярным нарушением с повреждениями.
"Ингибитор экспрессии гена" означает природное или синтетическое соединение, обладающее биологическим эффектом ингибирования или значительного снижения экспрессии гена. Поэтому "ингибитор экспрессии гена серотонинового 5-НТ3-рецептора" означает природное или синтетическое соединение, обладающее биологическим эффектом ингибирования или значительного снижения экспрессии гена, кодирующего серотониновый 5-НТ3-рецептор.
Ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении могут основываться на антисмысловых олигонуклеотидных конструкциях. Антисмысловые олигонуклеотиды, включая антисмысловые молекулы РНК и антисмысловые молекулы ДНК, могут действовать, непосредственно блокируя трансляцию мРНК серотонинового 5-НТ3-рецептора путем связывания с ней и тем самым предотвращения трансляции белка или усиления деградации мРНК, таким образом снижая уровень серотониновых 5-НТ3-рецепторов и их активность в клетке. Например, можно синтезировать антисмысловые олигонуклеотиды, состоящие из по меньшей мере 15 оснований и комплементарные уникальным участкам последовательности транскрипта мРНК, кодирующего серотониновый 5-НТ3-рецептор, напр., стандартными фосфоди-эфирными методами, и вводить их, напр., путем внутривенной инъекции или инфузии. Способы применения антисмысловых методов для специфического ингибирования экспрессии таких генов, последовательность которых известна, хорошо известны в данной области (напр., см. US Patent No. 6,566,135; 6,566,131; 6,365,354; 6,410,323; 6,107,091; 6,046,321; и 5,981,732).
Малые ингибиторные РНК (siRNA) тоже могут функционировать как ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении. Экспрессию гена серотонинового 5-НТ3-рецептора можно уменьшить путем контактирования субъекта или клеток с малой двунитевой РНК (dsRNA) либо с вектором или конструкцией, вызывающей продукцию малой двунитевтой РНК, так, чтобы специфически ингибировалась экспрессия гена серотонинового 5-НТ3-рецептора (т.е. это РНК интерференция, или RNAi). Способы отбора подходящей dsRNA или вектора, кодирующего dsRNA, хорошо известны в данной области для генов с известной последовательностью (напр., см. Tuschi Т. et al. (1999); Elbashir S.M. et al. (2001); Hannon GJ. (2002); McManus MT. et al. (2002); Brummelkamp TR. et al. (2002); US Patent Nos. 6,573,099 и 6,506,559; и International Patent Publication Nos. WO 01/36646, WO 99/32619 и WO 01/68836).
Рибозимы тоже могут функционировать как ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении. Рибозимы - это энзиматические молекулы РНК, способные катализировать специфическое расщепление РНК. Механизм действия рибозимов включает специфичную к последовательности гибридизацию молекулы рибозима с комплементарной РНК мишени с последующим эндонуклеолитическим расщеплением. Поэтому искусственные молекулы рибозимов с мотивами типа шпильки или молота, которые специфически и эффективно катализируют эндонуклеолитическое расщепление последовательностей мРНК серотонинового 5-НТ3-рецептора, применимы в рамках настоящего изобретения. Специфические рибозимные сайты расщепления в любой потенциальной РНК мишени сначала идентифицируют сканированием молекулы мишени на рибозимные сайты расщепления, которые обычно включают следующие последовательности: GUA, GUU и GUC. После этого можно провести оценку коротких последовательностей РНК длиной от 15 до 20 рибонуклеотидов, соответствующих участку гена-мишени, содержащему сайт расщепления, на предполагаемые структурные характеристики, такие как вторичная структура, которые может сделать олигонуклеотидную последовательность непригодной. Пригодность мишеней-кандидатов также можно оценивать тестированием их доступности для гибридизации с комплементарными олигонуклеотидами, используя, напр., методы защиты от рибонуклеаз.
Антисмысловые олигонуклеотиды и рибозимы, применимые в качестве ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов, могут быть получены известными способами. Они включают методы химического синтеза, такие, напр., как, твердофазный фосфоримидатный химический синтез. С другой стороны, антисмысловые молекулы РНК могут быть получены транскрипцией in vitro или in vivo последовательностей ДНК, кодирующих молекулу РНК. Такие последовательности ДНК могут быть вставлены в широкий круг векторов, содержащих подходящие промоторы РНК-полимеразы типа промоторов полимераз Т7 или SP6. Для повышения внутриклеточной стабильности и времени полужизни можно вводить различные модификации олигонук-леотидов изобретения. Возможные модификации включают, без ограничения, добавление фланкирующих последовательностей рибонуклеотидов или дезоксирибонуклеотидов на 5'- и/или 3'-концы молекулы либо использование фосфоротиоатных или 2'-O-метильных связей вместо фосфодиэстеразных связей в остове олигонуклеотида.
Антисмысловые олигонуклеотиды siRNA и рибозимы изобретения могут быть доставлены in vivo сами по себе или в составе вектора. В самом широком смысле "вектором" является любой переносчик, способный содействовать переносу siKNA антисмыслового олигонуклеотида или нуклеиновой кислоты рибозима в клетки и предпочтительно в клетки, экспрессирующие серотониновые 5-НТ3-рецепторы. Предпочтительно вектор транспортирует нуклеиновую кислоту в клетки с пониженной деградацией по сравнению со степенью деградации, которая может происходить в отсутствие вектора. В общем, вектора, применимые в изобретении, включают, без ограничения, плазмиды, фагемиды, вирусы, другие переносчики, происходящие из вирусных или бактериальных источников, которые подверглись обработке введением или включением последовательностей siRNA антисмыслового олигонуклеотида или нуклеиновой кислоты рибозима. Вирусные векторы являются предпочтительным типом вектора и включают, без ограничения, последовательности нуклеиновых кислот из следующих вирусов: ретровирусов, как-то вируса лейкемии Молони мыши, вируса саркомы мышей Харви, вируса рака молочной железы мыши и вируса саркомы Рауса; аденовирусов и аденоассоциированных вирусов; вирусов типа SV40; вирусов полиомы; вирусов Эпштейн-Барр; вирусов папилломы; вирусов герпеса; вирусов осповакцины; полиовирусов; и таких РНК-вирусов, как ретровирусы. Можно использовать и другие вирусы, не названные, но известные в данной области.
Предпочтительными вирусными векторами являются вектора на основе нецито-патических эукариотических вирусов, у которых ненужные гены заменены генами представляющими интерес.Нецитопатические вирусы включают ретровирусы (напр., лентивирусы), жизненный цикл которых включает обратную транскрипцию геномной РНК вируса в ДНК с последующим встраиванием провируса в ДНК клеток хозяина. Ретровирусы разрешены для испытаний по генной терапии на человеке. Наиболее полезны такие ретровирусы, которые дефектны по репликации (т.е. способные направлять синтез нужных белков, но не способные производить инфекционные частицы). Такие генетически измененные ретровирусные экспрессионные вектора имеют общее предназначение для высокоэффективной трансдукции генов in vivo. Стандартные методики получения дефектных по репликации ретровирусов (включая стадии введения экзогенного генетического материала в плазмиду, трансфекцию плазмидой сборочной линии клеток, продукцию рекомбинантных ретровирусов сборочной линией клеток, извлечение вирусных частиц из культуральной среды и инфицирование клеток мишени вирусными частицами) представлены в Kriegler, 1990; и Murry, 1991).
Предпочтительными вирусами для некоторых применений являются аденовирусы и аденоассоциированные вирусы, которые представляют собой вирусы с двунитевой ДНК и разрешены для применения в генной терапии на людях. Аденоассоциированные вирусы можно сделать дефектными по репликации методами генной инженерии, и они способны инфицировать широкий круг типов клеток и видов. Они обладают и другими преимуществами, такими как устойчивость к нагреванию и к липидным растворителям; высокая частота трансдукции в клетках различных линий, включая гемопоэтические клетки; и отсутствие ингибирования при суперинфекции, что позволяет проводить многократные серии трансдукций. По сообщениям, аденоассоциированные вирусы могут встраиваться в клеточную ДНК человека сайт-специфичным образом, тем самым сводя к минимуму возможность вставочного мутагенеза и вариабельность экспрессии введенного гена, характерную для ретровирусной инфекции. Кроме того, инфицирование аденоассоциированными вирусами дикого типа отслеживали в культуре тканей на протяжении более 100 пассажей в отсутствие давления отбора, что означает, что встраивание аденоассоциированных вирусов в геном является относительно стабильным событием. Аденоассоциированные вирусы могут функционировать и вне хромосом.
Другие векторы включают плазмидные векторы. Плазмидные векторы широко описаны и хорошо известны специалистам в данной области. Напр., см. Sambrook et al., 1989. За последние несколько лет плазмидные векторы применялись в качестве ДНК-вакцин для доставки кодирующих антигены генов в клетки in vivo. Для этого они особенно предпочтительны, так как не вызывают беспокойства по поводу безопасности, как со многими вирусными векторами. Эти плазмиды, если они обладают промотором, совместимым с клетками хозяина, могут экспрессировать пептиды из генов, функционально связанных в составе плазмиды. Некоторые широко используемые плазмиды включают pBR322, pUC18, pUC19, pRC/CMV, SV40 и pBlueScript. Другие плазмиды хорошо известны рядовым специалистам. Кроме того, плазмиды могут быть специально разработаны с помощью рестрикционных ферментов и реакций лигирования для удаления и добавления определенных фрагментов ДНК. Плазмиды могут быть доставлены разнообразными путями парентерально, через слизистые оболочки и топически. Например, ДНК-плазмиды можно вводить внутримышечно, интрадермально, подкожно или другим способом. Их также можно вводить с помощью интраназальных аэрозолей или капель, ректальных свечей или перорально. Их также можно вводить в эпидермис или слизистую поверхность с помощью генной пушки. Плазмиды можно вводить в водном растворе, высушенными на частицах золота или в составе другой системы доставки ДНК, включая, без ограничения, липосомы, дендримеры, спирали и микроинкапсуляцию.
Другой предмет изобретения касается способа лечения вестибулярного нарушения с повреждениями, который включает введение нуждающемуся в этом субъекту антагониста серотониновых 5-НТ3-рецепторов или ингибитора экспрессии гена серотониновых 5-НТ3-рецепторов.
Следующий предмет изобретения касается способа восстановления вестибулярной функции у субъекта, страдающего вестибулярным нарушением с повреждениями, который включает введение нуждающемуся в этом субъекту антагониста серотониновых 5-НТ3-рецепторов или ингибитора экспрессии гена серотониновых 5-НТ3-рецепторов.
Антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов могут вводиться в виде фармацевтической композиции, как определено ниже.
Предпочтительно данный антагонист или ингибитор вводится в терапевтически эффективном количестве.
"Терапевтически эффективное количество" означает количество антагониста серотониновых 5-НТ3-рецепторов или ингибитора экспрессии гена серотониновых 5-НТз3-рецепторов, достаточное для лечения или профилактики вестибулярного дефицита при разумном соотношении между пользой и риском, применимом к любому медицинскому лечению.
Следует понимать, что общее суточное потребление соединений и композиций настоящего изобретения должно определяться лечащим врачом в рамках здравого медицинского суждения. Конкретный уровень терапевтически эффективной дозы для любого конкретного пациента будет зависеть от ряда факторов, включая подлежащее лечению заболевание и тяжесть заболевания; активность конкретного используемого соединения, возраст, вес тела, общее состояние здоровья, пол и диету пациента; время введения, способ введения и скорость выведения конкретного используемого соединения;
длительность лечения; препаратов, используемых в комбинации или одновременно с данным используемым соединением; и других факторов, хорошо известных в области медицины. Например, в данной области принято начинать с доз соединения, меньших, чем дозы, необходимые для достижения требуемого терапевтического эффекта и постепенно повышать дозировку, пока не будет получен требуемый эффект. Однако суточная доза препаратов может колебаться в широких пределах от 0,01 до 1000 мг в день для взрослого человека. Предпочтительно композиции содержат 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 250 и 500 мг активного ингредиента для симптоматического подбора дозировки для пациента. Как правило, медикамент содержит от 0,01 мг до 500 мг активного ингредиента, предпочтительно от 1 мг до 100 мг активного ингредиента. Композиция изобретения может содержать антагонист серотониновых 5-НТ3-рецепторов в пределах от 0,01 мг до 500 мг, предпочтительно от 0,05 мг до 250 мг, от 0,1 мг до 100 мг, от 0,5 мг до 50 мг, от 1 мг до 25 мг, от 2,5 мг до 15 мг, от 5 мг до 15 мг, от 8 мг до 12 мг. Эффективное количество препарата обычно вводится при дозировке на уровне от 0,0002 мг/кг до 20 мг/кг массы тела в день, в особенности от 0,001 мг/кг до 7 мг/кг массы тела в день.
Антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов можно комбинировать с фармацевтически приемлемыми эксципиентами и необязательно с матрицами с замедленным высвобождением, такими как биоразлагаемые полимеры, с образованием терапевтических композиций.
Термин "фармацевтически приемлемый" относится к таким молекулярным соединениям и композициям, которые не дают отрицательных, аллергических или других неблагоприятных реакций при введении млекопитающим, особенно человеку, как положено. Фармацевтически приемлемый носитель или эксципиент означает нетоксический твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательное вещество любого типа.
В фармацевтических композициях настоящего изобретения действующее начало, само по себе или в комбинации с другим действующим началом, может вводиться животным и людям в виде стандартной лекарственной формы, в смеси со стандартными фармацевтическими наполнителями. Подходящие стандартные лекарственные формы единиц включают пероральные формы, такие как таблетки, гелевые капсулы, порошки, гранулы и пероральные суспензии или растворы, формы для подъязычного и буккального введения, аэрозоли, импланты, формы для подкожного, трансдермального, топического, внутрибрюшинного, внутримышечного, внутривенного, субдермального, трансдермального, интратекального и интраназального введения и формы для ректального введения.
Предпочтительно фармацевтические композиции содержат носители, которые фармацевтически приемлемы для лекарственных форм, предназначенных для инъекций. Они могут представлять собой, в частности, изотонические, стерильные солевые растворы (однозамещенного или двухзамещенного фосфата натрия, хлорида натрия, калия, кальция или магния и др. или смеси таких солей) или сухие, особенно лиофилизованные композиции, которые при добавлении, в зависимости от случая, стерильной воды или физиологического раствора, дают восстановленные растворы для инъекций.
Фармацевтические формы, пригодные для инъекций, включают стерильные водные растворы или дисперсии; формы, содержащие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для приготовления ex tempore стерильных растворов для инъекций или дисперсий. Во всех случаях форма должна быть стерильной и должна быть текучей в той степени, чтобы ее можно было легко ввести шприцем. Она должна быть стабильной в условиях производства и хранения и должна быть предохранена от загрязняющего действия таких микроорганизмов, как бактерии и грибки.
Растворы, содержащие соединения изобретения в виде свободного основания или фармакологически приемлемых солей, можно приготовить на воде, соответствующим образом смешанной с сурфактантом типа гидроксипропилцеллюлозы. Дисперсии можно также приготовить на глицерине, жидком полиэтиленгликоле и их смесях и на маслах. При обычных условиях хранения и применения эти препараты содержат консерванты для предотвращения роста микроорганизмов.
Антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов изобретения могут быть заключены в композицию в нейтральной или солевой форме. Фармацевтически приемлемые соли включают соли с кислотами (образованные по свободным аминогруппам белка), которые образованы с неорганическими кислотами, такими, к примеру, как соляная или фосфорная кислота, либо с такими неорганическими кислотами, как уксусная, щавелевая, виннокаменная, манделовая кислота и др. Соли, образованные по свободным карбоксильным группам, также могут быть получены из неорганических оснований, таких, к примеру, как гидроокиси натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и др.
Носитель также может быть растворителем или дисперсионной средой, содержащей, к примеру, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий пропиленгликоль и др.), их подходящие смеси и растительные масла. Надлежащая текучесть может поддерживаться, к примеру, при помощи покрытия типа лецитина, поддержанием требуемого размера частиц в случае дисперсий и при помощи сурфактантов (ПАВ). Предотвращение действия микроорганизмов может осуществляться с помощью различных антибактериальных и противогрибковых средств, к примеру, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимерозала и др. Во многих случаях стоит включать изотонические средства, к примеру, сахара или хлорид натрия. Пролонгированное всасывание композиций для инъекций может осуществляться путем применения в композициях средств, замедляющих всасывание, к примеру, моностеарата алюминия и желатина.
Стерильные растворы для инъекций готовят введением активных ингредиентов в требуемом количестве в подходящий растворитель с различными другими ингредиентами, перечисленными выше, как потребуется, с последующей стерилизацией фильтрованием. Обычно дисперсии готовят введением различных стерильных активных ингредиентов в стерильный носитель, содержащий основную дисперсионную среду и требуемые другие ингредиенты из числа перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются методы лиофилизации и высушивания замораживанием, которые дают порошок активного ингредиента вместе с любым желательным ингредиентом из предварительно стерилизованных фильтрованием растворов.
После приготовления растворы вводятся способом, совместимым с дозовой формой, и в таком количестве, которое терапевтически эффективно. Композиции легко вводятся в самых разных дозовых формах типа растворов для инъекций, описанных выше, а также можно использовать капсулы с замедленным высвобождением и др.
Для парентерального введения в виде водных растворов, к примеру, раствор при необходимости следует соответствующим образом забуферить, а жидкий разбавитель сначала сделать изотоничным при помощи достаточного количества солевого раствора или глюкозы. Именно эти водные. растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В этой связи стерильные водные среды, которые можно использовать, должны быть известны специалистам в свете настоящего описания. Например, одну дозу можно растворить в 1 мл изотонического раствора NaCl и либо внести в 1000 мл жидкости для инъекций, либо ввести в предполагаемое место для вливания. Некоторые вариации дозировки могут происходить по необходимости в зависимости от состояния подлежащего лечению субъекта. Лицо, отвечающее за введение, должно в любом случае определить надлежащую дозу для индивидуального субъекта.
Антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов изобретения могут быть заключены в терапевтическую смесь, содержащую от 0,0001 до 1,0 мг или от 0,001 до 0,1 или от 0,1 до 1,0 или даже 10 мг на дозу или около того. Можно вводить и множественные дозы.
Наряду с лекарственными формами соединений изобретения для парентерального введения типа внутривенных или внутримышечных инъекций включены и другие фармацевтически приемлемые формы, напр., таблетки или другие твердые формы для перорального введения; липосомные формы; капсулы с замедленным высвобождением; и любые другие используемые в настоящее время формы.
В предпочтительном воплощении антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов вводятся непосредственно во внутреннее ухо через барабанную перепонку. Такой способ введения может быть предпочтительным для оказания прямого и долговременного эффекта на преддверие. Соответственно в предпочтительном воплощении антагонисты серотониновых 5-НТ3-рецепторов или ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов вводятся в гелевой лекарственной форме, позволяющей продолжительное высвобождение данного антагониста или ингибитора во внутреннем ухе.
В следующем воплощении изобретения композиция изобретения составлена для назального введения. Назальное введение дает несколько преимуществ:
- доза активного соединения может быть уменьшена, так как оно быстро всасывается слизистой оболочкой и имеет высокую биодоступность;
- терапевтическое действие наступает быстро;
- обходится первоочередной метаболизм в печени;
- обходится метаболизм в желудочно-кишечном тракте;
- улучшается содействие пациента.
Назальный способ введения антагонистов серотониновых 5-НТ3-рецепторов обеспечивает быструю доставку активного препарата в кровь через высокопроницаемую слизистую носа и обходит эффект первоочередного метаболизма в печени. Преимущество такого способа введения состоит в том, что он не является агрессивным и позволяет самостоятельное введение. Другим преимуществом является быстрое начало действия после ингаляции и более высокая биодоступность по сравнению с пероральным введением, что ведет к улучшению эффективности. Этот способ также очень удобен для лечения пациентов, доставленных на скорой помощи. Они обычно подвергаются стрессу из-за головокружения, поэтому интраназальный способ легче для введения, чем в/в, и больше подходит, чем пероральное введение, особенно если пациенты страдают тошнотой или рвотой.
Другое преимущество заключается в избежании дополнительного приема внутрь (таблеток/капсул), что интересно для пожилых пациентов, получающих множественные лекарства от других заболеваний, которые смогут воспользоваться интраназальным способом. Пациентам с печеночной недостаточностью следует рекомендовать интраназальное введение ондансетрона и предпочесть его пероральному или в/в способу. При назальной лекарственной форме уменьшается риск случайной передозировки.
Итак, одним из предметов настоящего изобретения являются антагонисты серотониновых 5-НТ3-рецепторов для применения при лечении вестибулярных нарушений с повреждениями, как описано выше, при этом композиция, содержащая антагонист серотониновых 5-НТ3-рецепторов, имеет вид, подходящий для интраназального введения. Другим предметом изобретения является устройство для интраназального введения антагонистов серотониновых 5-НТ3-рецепторов для применения при лечении вестибулярных нарушений с повреждениями.
Данный способ введения способствует лучшей биодоступности активного агента по сравнению с другими способами применения и представляет интерес для лечения субъектов, страдающих тошнотой.
Подходящими формами для введения антагонистов серотониновых 5-НТ3-рецепторов в носовую полость являются капли или аэрозоли. Устройства для распыления могут представлять собой системы для разовой (единицы) дозы или для множественных доз, к примеру, содержать флакон, насос и исполнительный механизм.
Устройства для распыления обычно выдают от 0,04 до 0,25 мл при однократном срабатывании. Обычный режим интраназальной дозировки колеблется от однократного распыления в одну ноздрю до двух распылении в каждую ноздрю.
Композиции, содержащие антагонисты серотониновых 5-НТ3-рецепторов, могут дополнительно содержать носители или основы, регуляторы pH, консерванты, стабилизаторы, ароматизаторы и вещества, усиливающие всасывание.
Примеры носителей или основ включают, без ограничения, воду, гидроксипропилцеллюлозу, альгиновую кислоту, хитозан или гамма-полиглутамат. Примеры регуляторов pH включают, без ограничения, двухосновный фосфат натрия, лимонную кислоту или цитрат натрия. Примеры консервантов включают, без ограничения, хлорид натрия или сорбат калия. Примеры ароматизаторов включают, без ограничения, D-сорбитол, солодку, сахарин или стевию. Примеры веществ, усиливающих всасывание, включают, без ограничения, желчные кислоты.
Композиция изобретения для интраназального введения может содержать антагонист серотониновых 5-НТ3-рецепторов в пределах от 0,01 мг до 500 мг, предпочтительно от 0,05 мг до 250 мг, от 0,1 мг до 100 мг, от 0,5 мг до 50 мг, от 1 мг до 25 мг, от 2,5 мг до 15 мг, от 5 мг до 15 мг, от 8 мг до 12 мг.
Примером композиции по изобретению для интраназального введения является композиция на водной основе, содержащая основание ондансетрона, хлорид натрия, сорбат калия и цитрат.
Далее изобретение будет раскрыто на следующих фигурах и примерах. Однако эти примеры и фигуры не следует никоим образом интерпретировать как ограничивающие рамки настоящего изобретения.
Краткое описание фигур
Фиг.1. Иллюстрация клинических эффектов ондансетрона в сравнении с метоклопрамидом на выборке из 20 пациентов. Иллюстрация клинических эффектов 5-дневного лечения ондансетроном (8 мг/д, n=10) в сравнении с метоклопрамидом (30 мг/д, n=10) на выборке из 20 пациентов. Обе молекулы вводили вместе с вестибулоплегиками, кортикостероидами и противовирусными препаратам пациентам с подозрением на вестибулярный неврит. Для оценки развития вестибулярного дефицита проводилась вестибулонистагмография (А) через 48 часов и через 1 месяц после лечения (в течение 5 дней). По ранним калорическим тестам вестибулярный дефицит был менее выражен (56,53% против 84,38%, p=0,03) у пациентов, получавших ондансетрон в сравнении с метоклопрамидом. Через месяц отличие уже не было значимым на этой выборке (43,0% с ондансетроном против 63,4% с метоклопрамидом, p=0,07). У пациентов, получавших ондансетрон, также значительно уменьшалось время до первой прогулки (В) и продолжительность госпитализации (С).
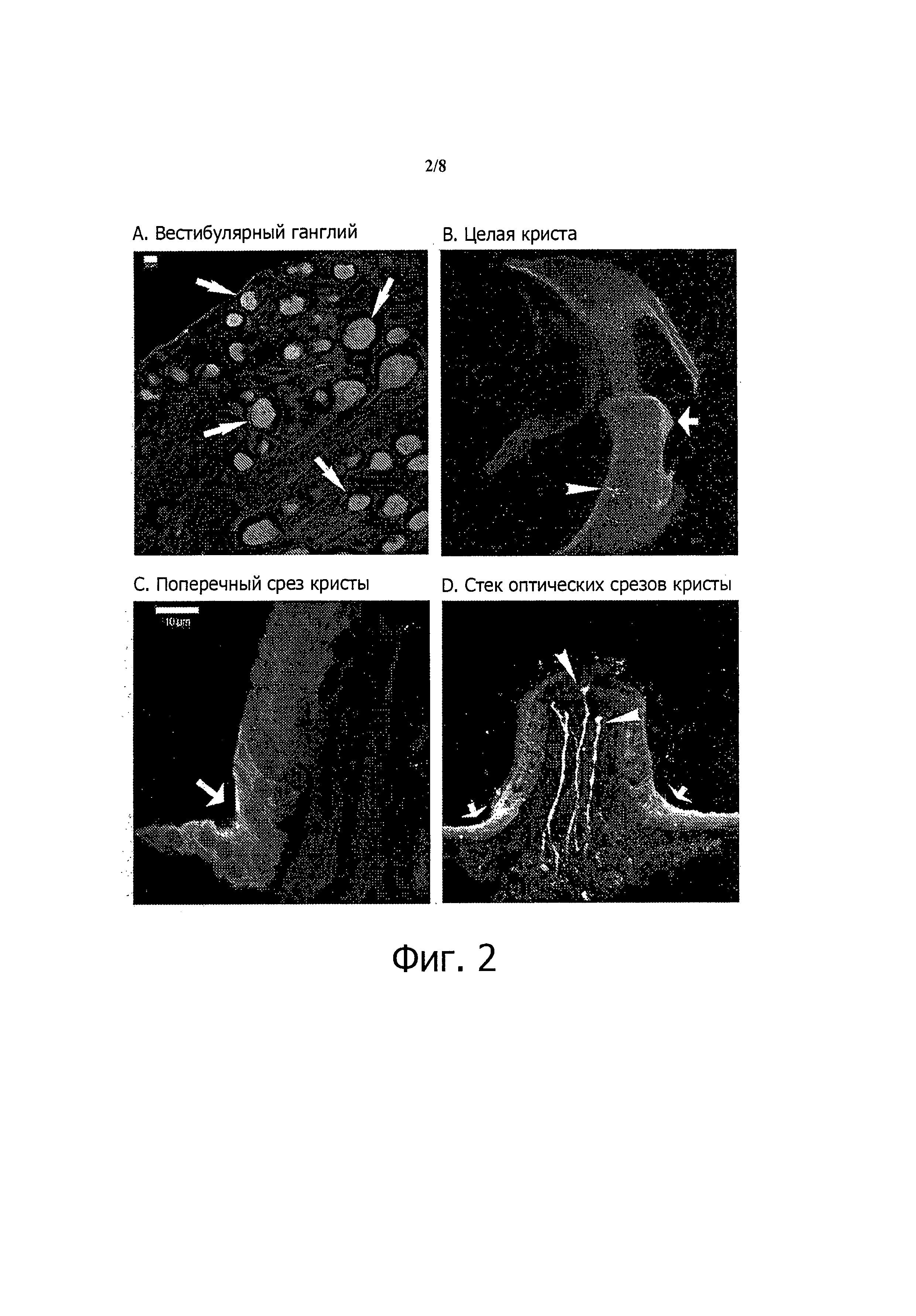
Фиг.2. Экспрессия 5-НТ3-рецепторов в преддверии млекопитающих. (А) Иммуноцитологическое определение 5-НТ3A-рецепторов в вестибулярном ганглии (А) и вестибулярном сенсорном эпителии (B-D). Отметим, что в А не метились шванновские клетки и эндотелиальные клетки. Отметим, что в B-D 5-НТ3A-рецепторы специфически экспрессировались в промежуточных клетках (большие стрелки), окружающих сенсорный эпителий, и в некоторых нервных волокнах (короткие стрелки).
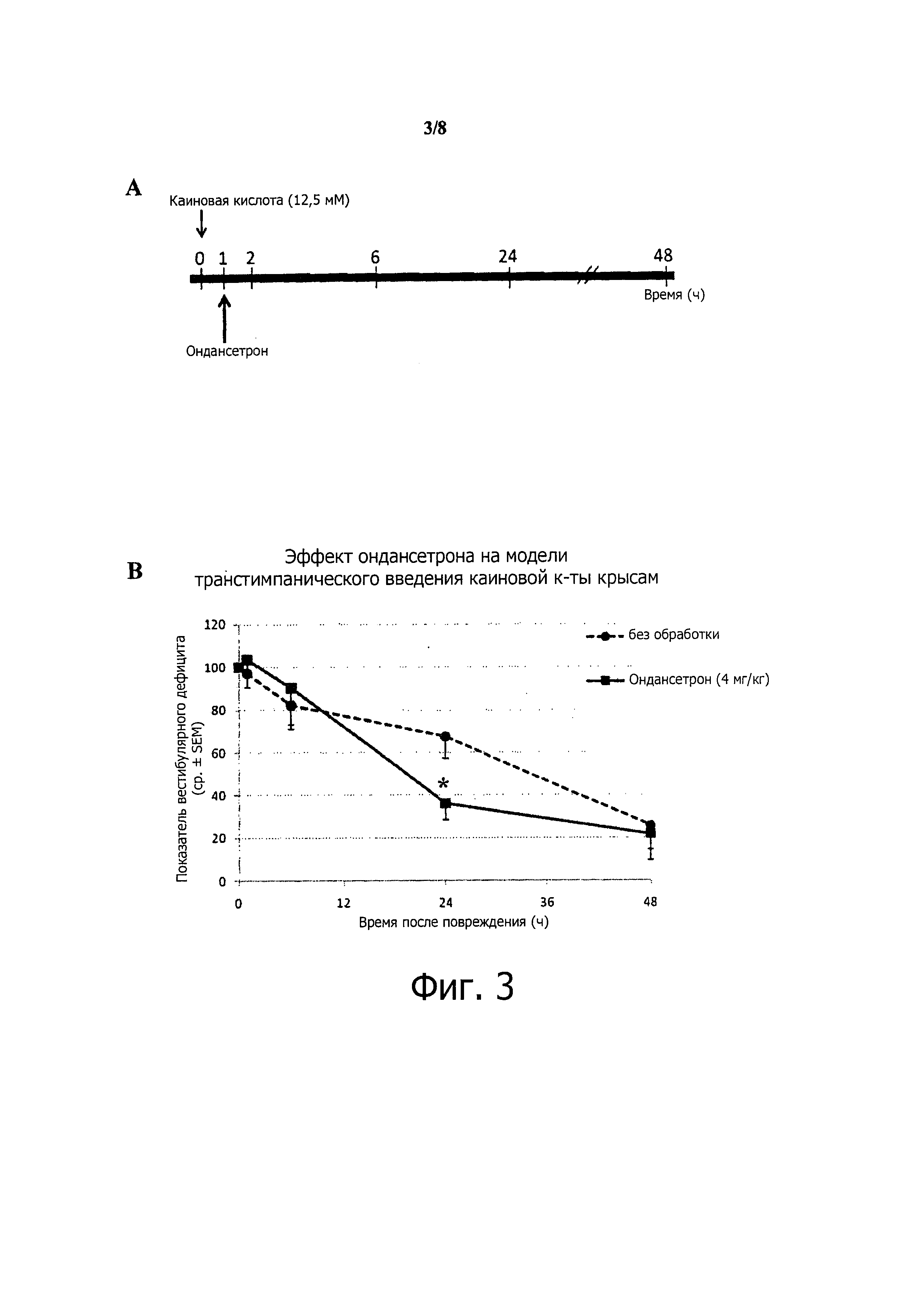
Фиг.3. Поведенческая оценка эффекта ондансетрона на вызванный эксцитотоксином (каинатом) вестибулярный дефицит.(А) Методика, использовавшаяся для индуцирования вестибулярного дефицита. Ондансетрон вводили внутрибрюшинно (в/б) в дозе 4 мг/кг. Через 1 час после инъекции каиновой кислоты (КА) тестировали вестибулярное поведение животных, а затем вводили ондансетрон в группе, подвергавшейся лечению. Контрольные животные не получали инъекции ондансетрона. После этого животных тестировали через 2 ч, 6 ч, 24 ч и 48 ч после инъекции КА. (В) Поведенческое проявление вызванного каинатом вестибулярного дефицита. После инъекции каиновой кислоты через барабанную перепонку у крыс проявлялся сильный вестибулярный дефицит, вызванный эксцитотоксином, который постепенно уменьшался в течение 48 часов. Такая динамика снижения вестибулярного дефицита менялась при обработке животных ондансетроном, со значительным снижением вестибулярного дефицита через 24 часа (*р=0,022, критерий Mann-Whithey; n≥8). После этого и опытные, и контрольные животные выходили на близкий уровень вестибулярного дефицита благодаря эндогенным компенсаторным механизмам.
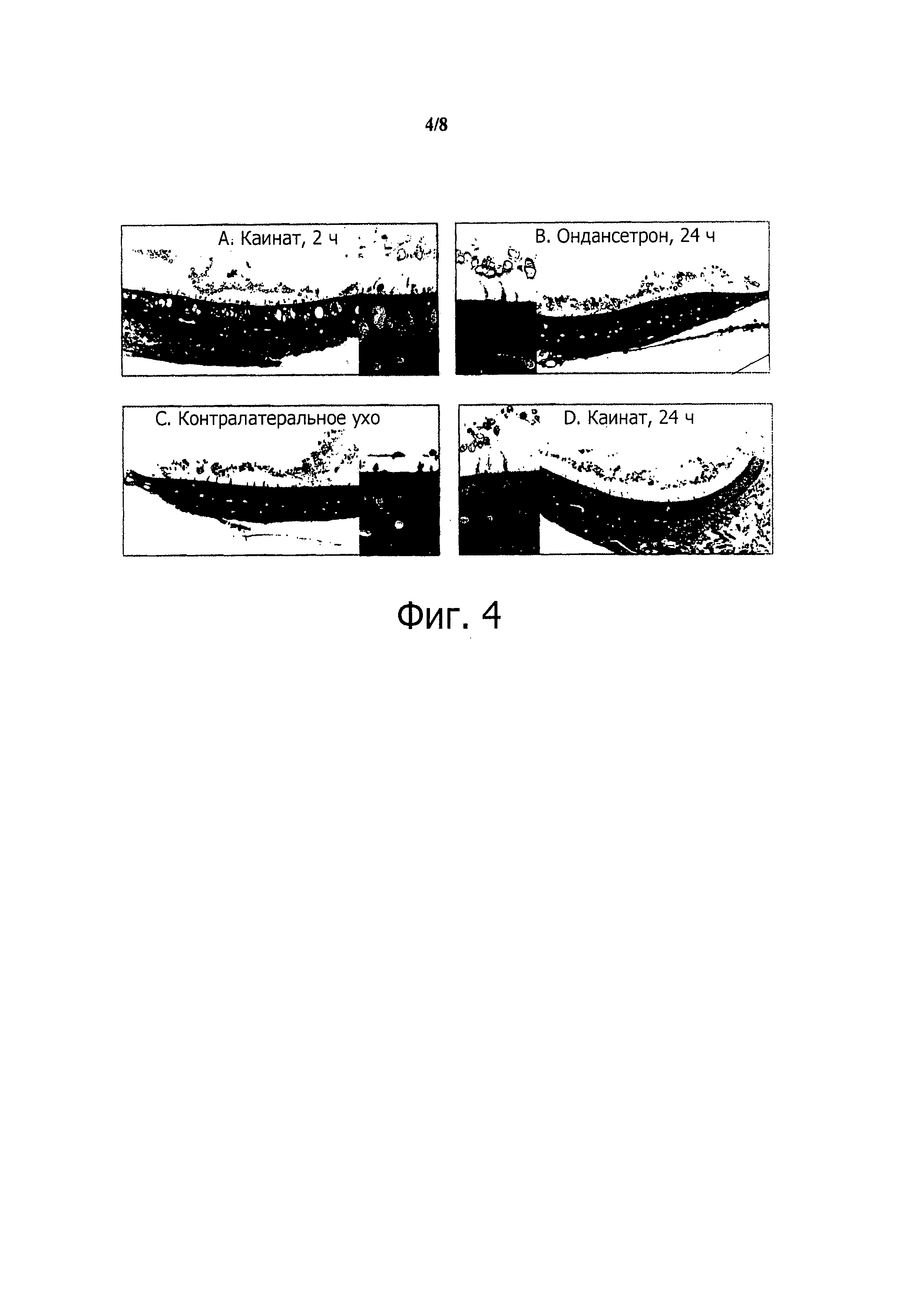
Фиг.4. Гистологическая оценка вызванных эксцитотоксином (каинатом) вестибулярных повреждений. КА вызывает большие эксцитотоксические повреждения вестибулярных афферентов в сенсорном эпителии через 2 часа после введения через барабанную перепонку (А), в отличие от контралатерального, не поврежденного уха (С). Наблюдались большие набухшие синаптические окончания вдоль волосковых клеток вместо типичных нервных окончаний - чашечек I типа и бутонов II типа. Через 24 часа после повреждения наблюдались новые окончания типа чашечек и бутонов при обработке ондансетроном (В) и без него (D).
Фиг.5. Морфометрический анализ вызванных эксцитотоксином (каинатом) вестибулярных повреждений. КА не вызывал потери волосковых или поддерживающих клеток при введении через барабанную перепонку. Напротив, КА сильно и значимо (p<0,001) уменьшала количество идентифицированных волосковых клеток I типа с окружающими их чашечками, что подтверждается возрастанием количества неопределенных волосковых клеток (р<0,01). При подсчете через 24 часа после эксцитотоксического повреждения значительно возрастало (p<0,01) количество новых идентифицированных волосковых клеток I типа, а количество неопределенных волосковых клеток уменьшалось незначительно. При обработке ондансетроном наблюдалось значительное повышение количества волосковых клеток I типа через 24 часа после вызванного КА повреждения (p<0,01). Количество неопределенных волосковых клеток значительно снижалось при обработке ондансетроном (р<0,01).
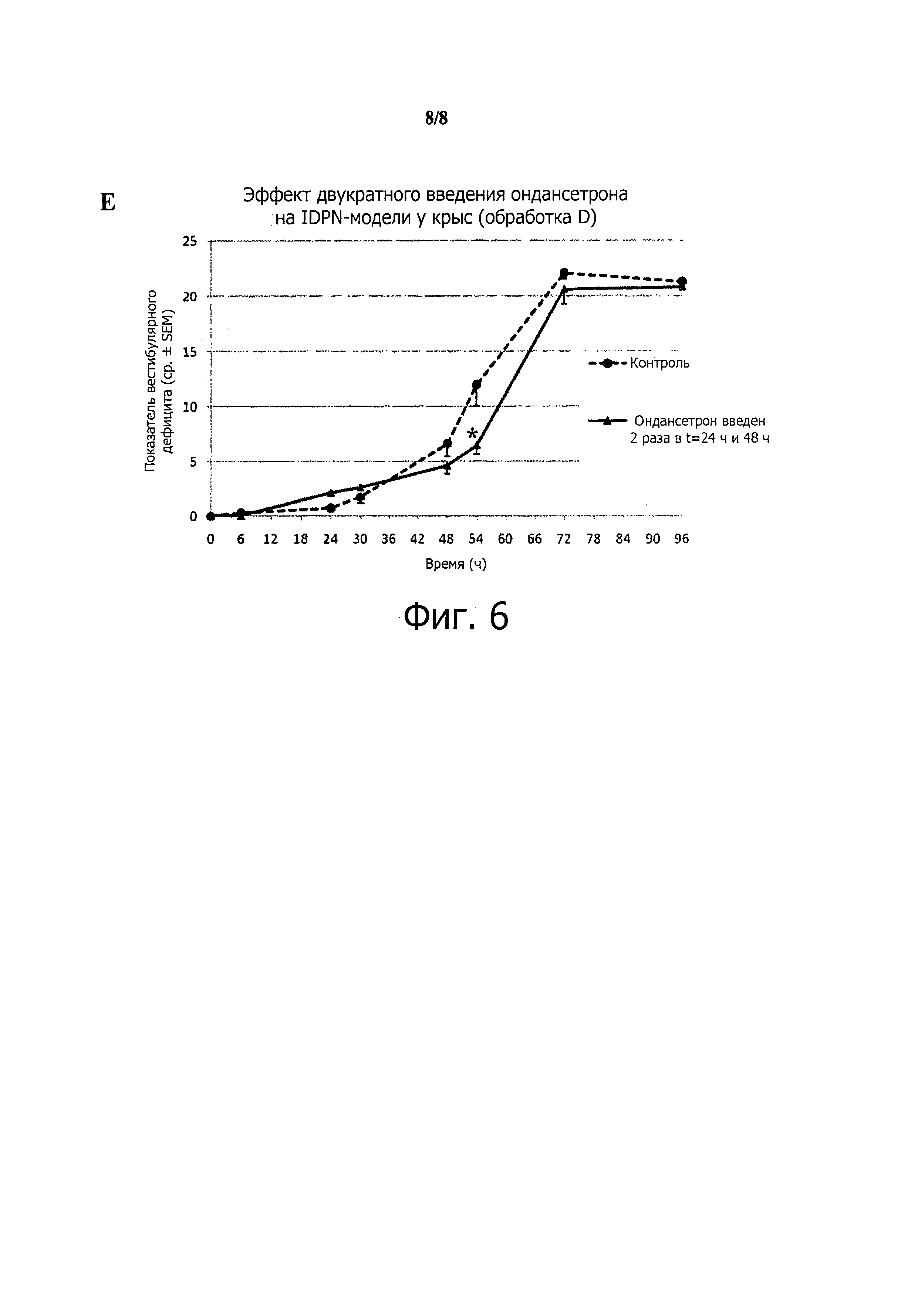
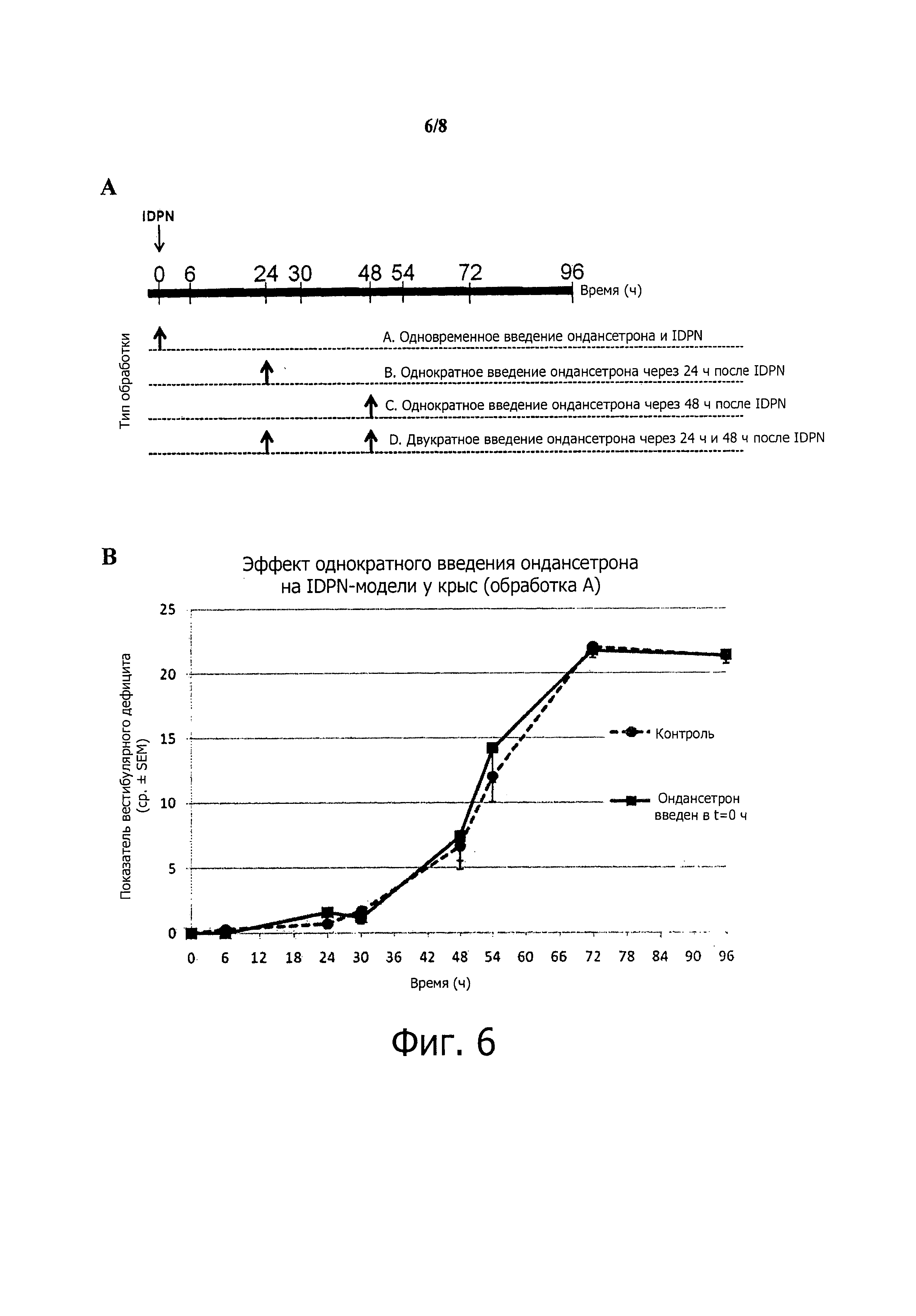
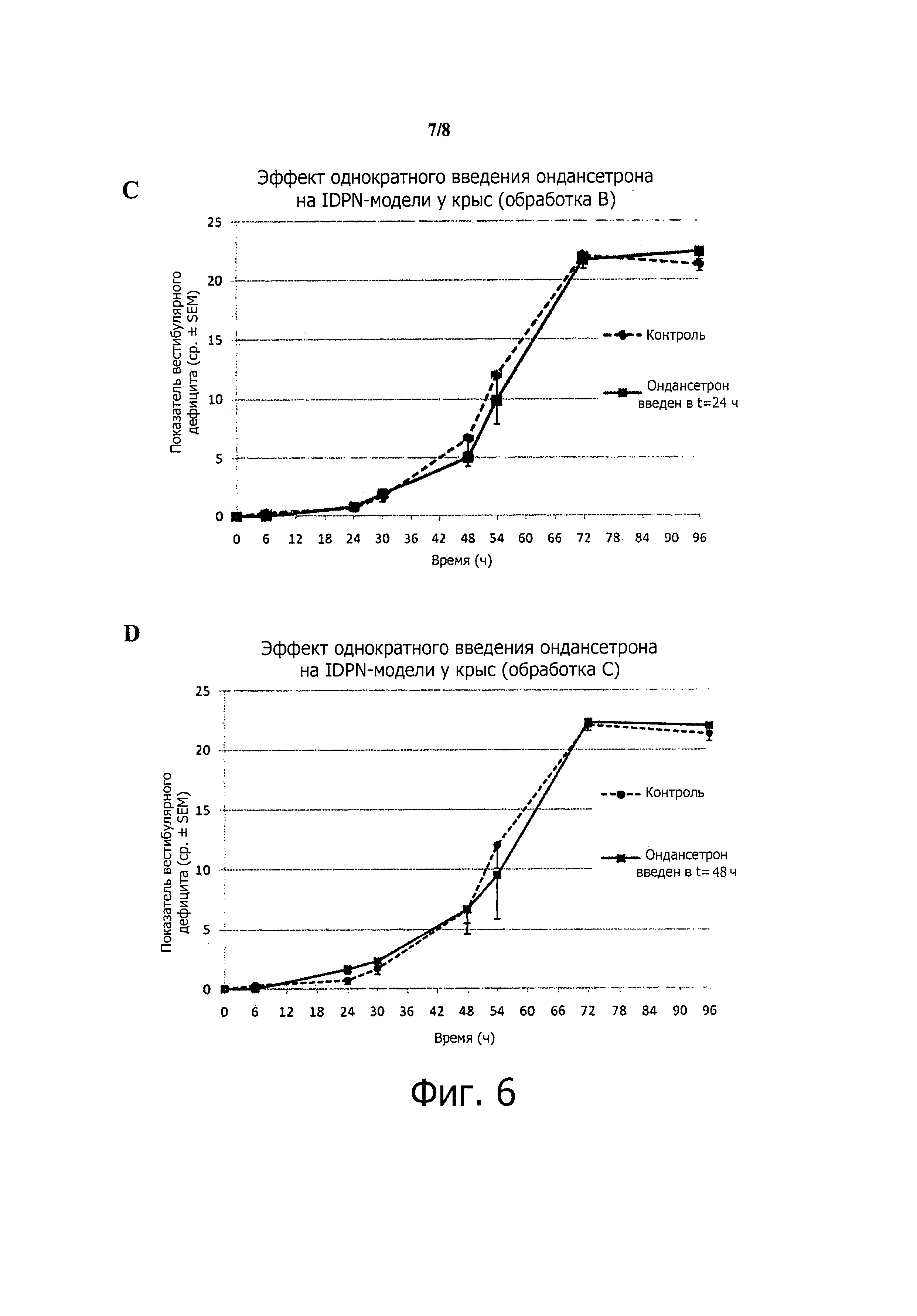
Фиг.6. Поведенческая оценка эффекта ондансетрона на двусторонний вызванный (нитрилом) вестибулярный дефицит.(А) Методика, использовавшаяся для индуцирования вестибулярного дефицита с билатеральными повреждениями. (В-Е) Динамика проявления вестибулярного дефицита при обработке ондансетроном или без нее. Возрастание вестибулярного дефицита существенно не менялось, когда животные получали ондансетрон одновременно (В), через 24 часа (С) или через 48 часов (D) после введения IDPN. Напротив, происходила значительная модификация динамики нарастания вестибулярного дефицита (p=0,029), когда ондансетрон вводили и через 24, и через 48 часов (Е) после индуцирования вестибулярного дефицита.
Примеры
В следующих примерах описаны некоторые предпочтительные способы создания и практики настоящего изобретения. Однако следует понимать, что примеры приводятся только в целях иллюстрации, но не должны ограничивать объем настоящего изобретения. Более того, за исключением случаев, когда пример приведен в прошедшем времени, то как сам текст примера, так и остальное описание, не предполагают, что эксперименты были действительно поставлены или данные были действительно получены.
Пример 1. Уменьшение ондансетроном вестибулярного дефицита после острого вестибулярного неврита (фиг.1)
Методы. Проведенное авторами изобретения клиническое исследование проводилось в Больничном центре (CHU) Университета Монпелье. Проводили рандомизированные клинические тесты на 20 пациентах. Пациентов отбирали по подозрению на вестибулярный неврит, начавшийся не менее чем за 24 часа до госпитализации. Всем пациентам вводили метилпреднизолон и валацикловир, а также 5-дневный курс либо метоклопрамида (30 мг/день, n=10), либо ондансетрона (8 мг/день, n=10). Функциональная оценка проводилась на основе тестирования ранней VNG (вестибулонистагмография) (проводилась через 24-48 часов после возникновения вестибулярного дефицита) и VNG через 1 месяц. Отмечали также продолжительность госпитализации и дату первой прогулки.
Результаты. Согласно ранней VNG, вестибулярный дефицит был менее выражен у пациентов, которым вводили ондансетрон (56,53% против 84,38%, p=0,03). Через 1 месяц вестибулярный дефицит не отличался в двух группах пациентов (43% О против 63,4% М, p=0,07). Продолжительность госпитализации значительно уменьшалась в группе ондансетрона (2,88 против 4,5 дней, p=0,03). Время до первой прогулки также значительно сокращалось (1,25 против 2,25 дней, p=0,001).
Клиническое исследование показало, что ондансетрон проявляет значительный эффект, уменьшая вестибулярный дефицит после острого вестибулярного неврита у людей (фиг.1А). Клинические исследования вестибулярной функции при помощи калорического теста свидетельствуют о прямом защитном или восстановительном действии на периферические концевые органы преддверия. Этот фармацевтический эффект не пересекается с долговременной центральной компенсацией. Его следствием является значительное облегчение головокружения и уменьшение продолжительности госпитализации (фиг.1В-С). Эти клинические наблюдения указывают, что ондансетрон и его производные могут быть полезными для поддержания и восстановления иннервации в преддверии.
Пример 2. Клеточные мишени 5-НТ3-антагонистов серотонина экспресси-руются в концевых органах преддверия
Предполагаемое прямое действие антагонистов серотониновых 5-НТ3-рецепторов на преддверие подтверждается предыдущим сообщением о том, что серотониновые рецепторы экспрессируются во внутреннем ухе и конкретно в концевых органах преддверия (Johnson and Heinemann, 1995; Gil-Loyzaga et al., 1997), а также недавними гистологическими данными авторов изобретения о том, что белки 5-НТ3-рецепторов присутствуют в вестибулярном эпителии.
Методы
Иммуногистохимическая локализация фармацевтических мишеней в преддверии
Взрослых самок крыс (Wistar; 200-220 г, n=2) анестезировали пентобарбиталом (0,4%). Животным делали транскардиальную перфузию раствором гепарин-PBS (0,01 М), а затем фиксирующим раствором (4% параформальдегида, 1% пикриновой кислоты, 5% сахарозы) с последующей постфиксацией образцов. Вестибулярные ганглии и эпителий заключали в 4% агарозу и делали срезы толщиной 40 мкм. Преинкубация в блокирующем растворе (0,5% рыбьего желатина, 0,5% тритон Х-100 и 1% BSA в PBS) предотвращала неспецифическое связывание. Затем образцы инкубировали с первичными антителами:
поликлональными антитела кролика против 5-НТ3A-рецепторов (1:200; АВ5657; Millipore, Billerica, MA). Для контроля исключали данное первичное антитело. Вторичные антитела показали специфическое мечение конъюгированной с Alexa 594 ослиной анти-кроличьей сывороткой (1:200, Molecular Probes, Eugene, OR). Образцы наносили на предметные стекла и исследовали методом двухлазерной сканирующей конфокальной микроскопии в реальном времени (RIO Imaging, Montpellier, Франция).
Результаты
Как видно из фиг.2, 5-НТ3-рецепторы экспрессируются в вестибулярном ганглии (фиг.2А). Все первичные вестибулярные нейроны (стрелки) давали окрашивание на 5-НТ3A-рецепторы, причем как большие, так и мелкие тела были иммунофлуоресцентными. Шванновские клетки и эндотелиальные клетки не метились. В сенсорном эпителии преддверия (фиг.2B-D) 5-НТ3A-рецепторы специфически экспрессировались в промежуточных клетках (большие стрелки), окружающих сенсорный эпителий, и в некоторых нервных волокнах (короткие стрелки). Совместное окрашивание с нейрофиламентами и кальций-связывающими белками (данные не приводятся) убедительно свидетельствует об очень ограниченной экспрессии в отдельных эфферентных волокнах.
Пример 3. Проверка восстановительного эффекта ондансетрона
Настоящий пример служит для подтверждения на животных моделях вестибулярного дефицита наблюдавшегося на людях восстановительного эффекта на концевые органы преддверия антагонистов серотониновых 5-НТ3-рецепторов, которые можно выбирать из группы, состоящей из ондансетрона, гранисетрона, трописетрона или палоносетрона. Он также служит для определения биологических процессов (защита/восстановление), вовлеченных в этот процесс. Это оценивалось сравнением динамики гистологических повреждений и вестибулярного дефицита на моделях одностороннего и двустороннего вестибулярного дефицита при применении данного антагониста серотониновых 5-НТ3-рецепторов. Комбинация двух различных животных моделей вестибулярного дефицита позволяет определить преимущества использования данного 5-НТ3-антагониста серотонина в условиях одностороннего или двустороннего вестибулярного дефицита. Насколько нам известно, они являются первыми парадигмами, ориентированными на вестибулярную систему млекопитающих. Определение биологического процесса, задействованного в восстановительном эффекте данного 5-НТ3- антагониста серотонина на преддверие, позволяет определить терапевтическое окно, которое будет использоваться в будущих клинических тестах.
Односторонний вестибулярный дефицит (фиг.3-5)
Проверка восстановительного эффекта данного 5-НТ3-антагониста серотонина проводилась путем анализа динамики появления и исчезновения эксцитотоксических повреждений и вестибулярного дефицита, которые возникают в концевых органах преддверия при интрааурикулярном введении агонистов глутамата. В концевых органах преддверия массивное введение каиновой кислоты вызывает эксцитотоксические повреждения нейрональной сети в чувствительных органах (набухание окончаний, контактирующих с волосковыми клетками - Brugeaud et al., 2007). Проводили гистологические исследования экспансии и ослабления эксцитотоксических повреждений методами световой и электронной микроскопии. Проводили поведенческое исследование вестибулярного дефицита с помощью специальных поведенческих тестов вестибулярной функции. Согласно парадигме, разработанной на крысах, введение каиновой кислоты через барабанную перепонку позволяет ее диффузию во внутреннее ухо. В большинстве случаев эксцитотоксические повреждения достигают высшей точки через 12 ч и исчезают через 2-3 дня. Исследовали защитное действие после введения данного 5-НТ3-антагониста серотонина при внутрибрюшинном введении данного 5-НТ3-антагониста серотонина через 1 час после повреждения каиновой кислотой.
Методы
Индуцирование одностороннего вестибулярного дефицита
Глутаматергический агонист - каиновую кислоту (КА) вводили через барабанную перепонку в среднее ухо, после чего она диффундирует через круглое окно во внутреннее ухо (преддверие и улитку), где она воздействует на афферентные нервные волокна. Это имитирует механизмы возникающего патологически эксцитотоксического повреждения, приводящего к вестибулярному дефициту. Эффект введения КА оценивали с помощью поведенческого тестирования вестибулярного дефицита и гистологического определения вызванных повреждений.
Ондансетрон вводили внутрибрюшинно (в/б) в дозе 4 мг/кг (фиг.3А).
Через 1 час после введения КА тестировали вестибулярное поведение животных, после чего опытной группе вводили ондансетрон. Контрольные животные не получали ондансетрон. После этого животных тестировали через 2 ч, 6 ч, 24 ч и 48 ч после введения КА. Проводили гистологический и морфометрический анализ через 2 и 24 часа после введения КА с обработкой ондансетроном и без нее.
Поведенческая оценка вестибулярного дефицита
Оценки по вестибулярной шкале определяли, как описано ранее (Brugeaud et al., 2007; Boadas-Vaello et al., 2005). Животным ставили оценки от 0 до 4 баллов, что соответствует шкале от нормального поведения до максимального вестибулярного дефицита. Оценка 1 означает, что поведение не является нормальным, но специфический вестибулярный дефицит не выявляется; оценка 2 соответствует идентифицируемому, но легкому вестибулярному дефициту; а оценка 3 соответствует идентифицируемому и явному дефициту. Для оценки вестибулярного дефицита ставили оценки по 6 различным тестам и суммировали их: 1 - покачивание головой, когда наблюдается аномальное периодическое оттягивание шеи назад; 2 - стереотипное движение по кругу, варьирующее от отсутствия до навязчивого кружения вокруг своего зада; 3 - ретропульсия, типичное попячивание назад, отражающее вестибулярное расстройство; 4 - рефлекс свисающего хвоста, который в норме вызывает вытягивание передних лап, чтобы попасть на землю, но приводит к вентральному сгибанию тела и захвату хвоста при максимальном вестибулярном дефиците; 5 - рефлекс контактного торможения в норме заставляет животное, вцепившееся в металлическую сетку, переворачиваться лежа на спине, когда его спина касается земли; в случае вестибулярного дефицита при отсутствии ориентира для положения тела этот рефлекс устраняется, а животное продолжает цепляться за решетку в положении лежа на спине; 6 - рефлекс выпрямления в воздухе, который нужен для того, чтобы животное приземлилось на ноги при падении из положения лежа на спине; при вестибулярной дисфункции это нормальное переворачивание нарушается, а при максимальном дефиците животное приземляется на спину при падении с высоты 40 см на пенопластовый мат.Оценки по вестибулярной шкале для каждого момента времени выражали в процентах от показателя в точке t0.
Гистологическая оценка вестибулярных повреждений
Препараты полутонких срезов сенсорного эпителия. Взрослых самок крыс (Wistar; 200-220 г, n=3) анестезировали пентобарбиталом (0,4%). Животным делали транскардиальную перфузию раствором гепарин-PBS (0,01 М), а затем фиксирующим раствором (4% параформальдегида, 2,5% глутаральдегида, 1% пикриновой кислоты, 5% сахарозы) с последующей постфиксацией образцов. Целые вестибулярные органы подвергали постфиксации в 2% 2OsO4, обезвоживали, заключали в аралдит и делали срезы толщиной 1 мкм. Образцы наносили на предметные стекла, рассматривали и сканировали на сканере Nanozoomer Slide Scanner (RIO Imaging, Montpellier, Франция).
Полученные на сканере Nanozoomer изображения полутонких срезов подвергали анализу. Подсчет количества волосковых клеток в перепончатых мешочках проводили с помощью программы Metamorph (Universal Imaging). Для каждого поврежденного и контралатерального уха анализировали по 3 среза, отстоящие друг от друга на 20-25 мкм. Таким образом было подсчитано по 400 клеток для каждой обработки у 3 животных с контралатеральным ухом в качестве контроля. Клетки подсчитывали как 1) волосковые клетки I типа, когда наблюдается грушевидная клетка с окружающей ее чашечкой; 2) волосковые клетки II типа, когда наблюдается удлиненная клетка с ядром в верхнем положении; 3) волосковые клетки неопределенного типа, когда набухшие синаптические окончания вокруг клетки мешают определению типа клетки по ее форме, когда не видна чашечка вокруг грушевидных клеток, когда клетки удлиненной формы содержат ядро в нижнем положении; 4) поддерживающие клетки, составляющие базальную часть эпителия. Для определения статистических отличий использовали ANOVA с последующим критерием Tukey при сравнении различных обработок.
Результаты
После введения каиновой кислоты через барабанную перепонку крысы проявляли сильный вестибулярный дефицит, вызванный эксцитотоксином, который постепенно уменьшался за 48 часов (фиг.3В). Такая динамика снижения вестибулярного дефицита менялась при обработке животных ондансетроном, со значительным снижением вестибулярного дефицита через 24 часа (*p=0,022, критерий Mann-Whitney; n>8). После этого и опытные, и контрольные животные выходили на близкий уровень вестибулярного дефицита благодаря эндогенным компенсаторным механизмам.
Как видно из фиг.4А, КА вызывает большие эксцитотоксические повреждения вестибулярных афферентов в сенсорном эпителии через 2 часа после введения через барабанную перепонку (фиг.4А). В отличие от контралатерального, не поврежденного уха (фиг.4С), наблюдались большие набухшие синаптические окончания вдоль волосковых клеток вместо типичных нервных окончаний - чашечек I типа и бутонов II типа. Через 24 часа после повреждения наблюдались новые окончания типа чашечек и бутонов при обработке ондансетроном (фиг.4В) и без него (фиг.4D). На уровне световой микроскопии ондансетрон как будто усиливал созревание этих "новообразованных" синаптических окончаний.
Как видно из фиг.5, морфометрический анализ показал, что введение КА через барабанную перепонку не вызывает потери волосковых или поддерживающих клеток. Напротив, КА сильно и значимо (p<0,001) уменьшала количество идентифицированных волосковых клеток I типа с окружающими их чашечками, что подтверждается возрастанием количества неопределенных волосковых клеток (p<0,01). При подсчете через 24 часа после эксцитотоксического повреждения значительно возрастало (p<0,01) количество новых идентифицированных волосковых клеток I типа, а количество неопределенных волосковых клеток уменьшалось незначительно. Этот результат доказывает способность к восстановлению синаптических окончаний после повреждения эксцитотоксином. При обработке ондансетроном наблюдалось значительное повышение количества волосковых клеток I типа через 24 часа после вызванного КА повреждения (p<0,01). Еще более интересно то, что количество неопределенных волосковых клеток значительно снижалось при обработке ондансетроном (p<0,01), что отражает защитное действие и/или облегчение восстановления синаптических окончаний при эксцитотоксическом повреждении.
Настоящие поведенческие наблюдения, показывающие, что вызванный каинатом вестибулярный дефицит значительно уменьшается (через 24 часа после эксцитотоксического повреждения) при обработке ондансетроном, можно интерпретировать как предотвращение увеличения повреждений или усиление восстановительных процессов у обработанных крыс. В любом случае можно утверждать, что улучшение состояния вестибулярной системы, наблюдавшееся у животных, получавших ондансетрон, подтверждается улучшением эффективности вестибулярной функции. Гистологические наблюдения подтверждают то, что у обработанных животных лучше сохраняется или лучше восстанавливается профиль ветвления волосковых клеток.
Двусторонний вестибулярный дефицит (фиг.6)
Проверка восстановительного эффекта данного 5-НТ3-антагониста серотонина также проводилась на животной модели двустороннего вестибулярного дефицита путем анализа динамики появления и исчезновения эксцитотоксических повреждений и вестибулярного дефицита после интоксикации нитрилами (в/б введение - Seoane et al., J. Сотр. Neurol. 2001, 439: 385-399). После своего метаболического превращения нитрилы вызывают ототоксические/эксцитотоксические повреждения и вестибулярные дефициты, идентифицируемые в пределах 3 дней после их острого введения. Защитное действие оценивали при введении данного 5-НТ3-антагониста серотонина по различным схемам (в начале хронической интоксикации; через 24 и 48 ч после нее).
Методы
IDPN (1 г/кг; в/б) вызывает билатеральное и постоянное повреждение, разрушая вестибулярный сенсорный эпителий. Это прогрессирующее повреждение достигает своей максимальной степени через 72 часа. Эффект введения IDPN оценивали при помощи поведенческого тестирования вестибулярного дефицита. Для определения вестибуло-защитного потенциала ондансетрона оценивали его защитное действие при однократном и двукратном введении в динамике прогрессирования повреждений после введения IDPN. Каждую дозу ондансетрона вводили внутрибрюшинно (в/б) в дозе 4 мг/кг.
Применяли 4 парадигмы лечения (фиг.6А):
А. Одновременное введение ондансетрона (1 доза) и IDPN.
В. Введение ондансетрона (1 доза) через 24 часа после введения IDPN.
С. Введение ондансетрона (1 доза) через 48 часов после введения IDPN.
D. Два введения ондансетрона (в сумме 2 дозы) через 24 и 48 часов после введения IDPN.
Поведенческое тестирование проводили через 6, 24, 30, 48, 54, 72 и 96 ч после введения IDPN.
Результаты
Динамика нарастания вестибулярного дефицита изменялась незначительно, когда животные получали ондансетрон одновременно с IDPN (p≤0,05, критерий Mann-Whitney; n≤5)(фиг.6В).
Динамика нарастания вестибулярного дефицита изменялась незначительно, когда животные получали ондансетрон через 24 ч после введения IDPN (p≤0,05, критерий Mann-Whitney; n≥7) (фиг.6С).
Динамика нарастания вестибулярного дефицита изменялась незначительно, когда животные получали ондансетрон через 48 ч после введения IDPN (p≤0,05, критерий Mann-Whitney; n≥6) (фиг.6D).
Ондансетрон также вводили через 24 и 48 часов (2 дозы) после индуцирования вестибулярного дефицита с помощью IDPN (t=0 ч). Поведенческое тестирование показало значительную модификацию динамики нарастания вестибулярного дефицита через 54 ч (p≤0,05, критерий Mann-Whitney; n≥7). Животные, получавшие ондансетрон через 24 и 48 ч, проявляли значительно менее тяжкий вестибулярный дефицит через 54 ч после вторичного введения ондансетрона (фигура 6Е).
Настоящие поведенческие наблюдения, показывающие, что вызванный нитрилом вестибулярный дефицит значительно уменьшается (через 24 и 48 ч после токсического повреждения) при обработке ондансетроном, можно интерпретировать скорее как раннее предотвращение увеличения повреждений, чем усиление восстановительных процессов у обработанных крыс. В самом деле, нитрилы уничтожают волосковые клетки в течение 3 дней, что предотвращает любое восстановление связей нервных афферентов, как это постулировано в отношении обработанных каинатом животных. В любом случае можно утверждать, что улучшение состояния вестибулярной системы, наблюдавшееся у животных, получавших ондансетрон, подтверждается улучшением эффективности вестибулярной функции. Дальнейшие гистологические исследования позволят установить, действительно ли профиль ветвления волосковых клеток через 24-48 часов после повреждения нитрилом лучше сохраняется у обработанных животных.
Пример 4. Примеры композиций, содержащих ондансетрон для интраназального введения
|
Стабильность раствора, содержащего основание ондансетрона
Раствор, содержащий 8 мг/мл основания ондансетрона, оказался физически стабильным после хранения 1 месяц при 25°C и после хранения 1 месяц при 4°C. Также определяли химическую стабильность раствора.
|
Эти наблюдения показывают, что модификации pH не связаны со значительным химическим разложением ондансетрона. Не наблюдалось выпадения осадка. Стабилизацию pH можно осуществлять с помощью цитратного буфера.
Библиография
По всей заявке в различных ссылках описан уровень техники в той области, к которой относится изобретение. Содержание этих ссылок включено в настоящее описание путем ссылки.
Brugeaud A, Travo С, Demêmes D, Lenoir M, Llorens J, Puel JL, Chabbert C. Control of hair cell excitability by vestibular primary sensory neurons. J Neurosci. 2007, 27 (13): 3503-11.
Gil-Loyzaga P, Bartolomé MV, Vicente-Torres MA. Serotoninergic innervation of the organ of Corti of the cat cochlea. Neuroreport 1997, 8 (16): 3519-22.
Johnson DS, Heinemann SF. Embryonic expression of the 5-НТ3 receptor subunit, 5-HT3R-A, in the rat: an in situ hybridization study. Mol Cell Neurosci. 1995, 6 (12): 122-38.
Seoane A, Demêmes D, Llorens J. Relationship between insult intensity and mode of hair cell loss in the vestibular system of rats exposed to 3,3'-iminodipropionitrile. J Comp Neurol. 2001, 439 (4): 385-99.
Turconi M, Nicola M, Quintero MG, Maiocchi L, Micheletti R, Giraldo E, Donetti A. Synthesis of a new class of 2,3-dihydro-2-oxo-1H-benzimidazole-1-carboxylic acid derivatives as highly potent 5-НТ3 receptor antagonists. J Med Chem. 1990, 33 (8): 2101-8.