Результат интеллектуальной деятельности: Способ визуализации глиобластомы человека
Вид РИД
Изобретение
Изобретение относится к способам диагностики опухолей головного мозга человека, в частности, к визуализации глиобластомы человека.
Мультиформная глиобластома, или глиобластома, принадлежит к группе опухолей головного мозга, известных как астроцитомы. Глиобластома - самая опасная и наиболее распространенная среди всех первичных опухолей мозга у взрослых. Данный тип опухоли характеризуется агрессивным биологическим поведением, выражающимся в неконтролируемой клеточной пролиферации, резистентности к апоптозу, повышенном ангиогенезе; а также прогрессирующей инвазией в нормальную паренхиму мозга и крайней нестабильностью генома. Глиобластома также характеризуется значительной неоднородностью на клеточном, транскрипционном и геномном уровнях. Особенностями глиобластомы являются инфильтративный рост и отсутствие четких границ. Часто встречаются терапевтически резистентные опухоли. Вследствие вышеуказанных особенностей глиобластомы, очень важно подобрать для ее визуализации способ, высокоспецифичный для данной опухоли, который позволил бы определить ее истинные границы, то есть обеспечил точность диагностики.
Обычно для диагностики глиобластомы применяют такие радиологические методы, как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография (ПЭТ) (Розуменко В.Д. Состояние и перспективы лечения опухолей головного мозга //  (УАН): Бюлетень. -
(УАН): Бюлетень. -  . - 1998. - №7).
. - 1998. - №7).
При обследовании головного мозга методом компьютерной томографии глиобластома проявляется в виде негомогенных зон повышенной плотности и может иметь центральный некроз или кистозный компонент. При обследовании методом МРТ опухоль представляет собой объемные образования с гетерогенным сигналом и нечеткими границами. Накопление контраста варьирует. Оценка размеров и распространения глиом более точна на МРТ, чем на КТ. Еще более точные диагностические данные обеспечивают магнитно-резонансная спектроскопия и ПЭТ (Олюшин В.Е. Глиальные опухоли головного мозга: краткий обзор литературы и протокол лечения больных // Нейрохирургия. - 2005. - №4. - С. 41-47).
Основной проблемой вышеописанных методов нейровизуализации глиальных опухолей выделяют сложность определения истинных границ опухоли. Участки тканей, трактуемые как отек белого вещества головного мозга, зачастую представляют собой зону инфильтрации опухолевыми клетками. Контрастное усиление опухоли отражает только рентгенологически видимую (макроскопическую) распространенность поражения мозга, а не истинную величину опухолевой инвазии (Журавлева М.А., Шершевер А.С., Бенцион Д.Л. Использование перфузионной КТ в динамическом наблюдении за результатами комбинированного и комплексного лечения глиом головного мозга // Лучевая диагностика и терапия. - 2012. - №2. - С. 58-64).
Известен метод визуализации глиомы с помощью 5-аминолевулиновой кислоты (препарат аласенс), являющейся предшественником протопорфирина IX в организме человека (Stummer W., Stocker S., Wagner S., Stepp H., Fritsch C., Alwin С.E., Kiefmann R., Reulen H. Intraoperative Detection of Malignant Gliomas by 5-Aminolevulinic Acid-induced Porphyrin Fluorescence // Neurosurgery. - 1998. - V. 42. - I.3. - P. 518-526), в основе которого лежит способность опухолевых клеток в присутствии экзогенной 5-аминолевулиновой кислоты накапливать фотоактивный протопорфирин IX, присутствие которого можно определить по специфической флюоресценции, вызываемой специальными источниками излучения, что позволяет наблюдать флюоресцентный контраст опухоли относительно окружающей ткани.
В качестве недостатков метода можно указать высокую стоимость препарата, а также неспецифическое накопление вещества в опухолевой ткани.
Известен способ лечения низкодифференцированных глиом RU 2457862 С1, A61K 39/395, 10.08.2012), включающий введение стандартизированного препарата анти-Сх43 антител, полученных к рекомбинантному фрагменту коннексина-43 Q173-1208 с аминокислотной последовательностью QWYIYGFSLSAVYTCKRDPCPHQVDCFLSRPT EKTI. Для определения способности полученных анти-Сх43 антител распознавать белок щелевых контактов Сх43 в нативной конформации их тестируют на живой (нефиксированной) культуре клеток глиомной линии С6 крысы и человека U2581 с целью визуализации плакоидных структур на мембране клеток глиомной линии.
Данный способ предназначен, в первую очередь, для лечения опухолей, при этом используемые как для лечения, так и для тестирования с целью визуализации антитела имеют высокую стоимость.
В настоящее время получают развитие методы визуализации опухолей, и, в частности, опухоли головного мозга - глиобластомы, с помощью подбора аптамеров, специфичных к некоторым клеточным культурам глиобластомы человека.
Известно, например, потенциальное применение аптамеров для диагностики или терапии глиомы головного мозга (Зубкова О.А. Современные направления исследований в области получения и практического применения аптамеров // Реферат по Информационно-коммуникационным технологиям в естественнонаучных исследованиях). При этом, данная работа, являясь теоретической и не основанной на экспериментальных исследованиях, не конкретизирует способ осуществления визуализации.
Известен способ визуализции ткани глиобластомы у экспериментальных животных (Wu X., Liang Н., Tan Y., Yuan С., Li S., Li X., Li G., Shi Y., Zhang X. Cell-SELEX aptamer for highly specific radionuclide molecular imaging of glioblastoma in vivo // PLoS One. - 2014. - V. 9, №6. - e90752), по которому осуществляли подбор аптамеров методом cell-SELEX к мутантному варианту рецептора эпидермального фактора роста, широко распространенному в клетках глиобластомы человека - EGFRvIII. В качестве мишени для позитивной селекции использовали клетки глиобластомы человека линии U87-EGFRvII, в качестве негативной мишени - клетки линии U87MG. Аффинность и специфичность аптамеров, меченных флуоресцентной меткой проверяли с помощью проточной цитометрии. Затем к наиболее аффинному и специфичному к EGFRvIII ДНК-аптамеру U2 (Kd 3,37±0,98 нМ) присоединяли радиоактивную метку (188Re) и успешно использовали в качестве молекулярного зонда для визуализации опухоли у мышей методом однофотонной эмиссионной компьютерной томографии.
Недостатком вышеуказанного способа является использование радиоактивной метки для визуализации ткани, что может использоваться только для выявления опухоли на начальном этапе до проведения операции. При оперативном вмешательстве с использованием хирургического микроскопа, выявить границы опухоли этот способ не позволяет, поскольку хирургический микроскоп не детектирует радиоактивные метки.
Известен также способ подбора аптамеров к клеточной культуре глиобластомы человека А172 (Bayrac А.Т., Sefah K., Parekh Р., Bayrac С., Gulbakan В., Oktem Н.A., Tan W. In vitro Selection of DNA Aptamers to Glioblastoma Multiforme // ACS Chemical Neuroscience. - 2011. - V. 2, №3. - P. 175-181). Аптамеры, подобранные к клеткам-мишеням линии А-172, связывались не только с данными мишенями, но также с другими клеточными линиями глиобластомы человека. При этом степень связывания аптамеров с клетками других типов опухолей (рак легкого, яичников и др.) была низкой или отсутствовала вовсе. Для анализа специфичности и аффинности аптамеров, меченных флуоресцентной меткой, использовали методы проточной цитометрии и конфокальной микроскопии. Данные о визуализации очагов глиобластомы в организме отсутствуют.
Известен также способ подбора аптамеров к клеточной культуре глиобластомы человека U118-MG методом cell-SELEX, названных GBM128 (Kd 20±10 nM) и GBM131 (Kd 37±13 nM) (Kang D., Wang J., Zhang W., Song Y., Li X., Zou Y., Zhu M., Zhu Z., Chen F., Yang C.J. Selection of DNA aptamers against glioblastoma cells with high affinity and specificity // PLoS One. - 2012. - V. 7, №10. - e42731), выбранный за прототип. Для оценки специфичности аптамеров культуры глиобластомы, проинкубированные с аптамерами, меченными флуоресцентной меткой, анализировали с помощью конфокальной микроскопии и проточной цитометрии. Также окрашивали гистологические срезы тканей глиобластомы и других опухолей головного мозга.
Аптамеры, подобранные методом cell-SELEX к клеточной культуре глиобластомы, являются аффинными и высокоспецифичными к своей мишени. Они не связывались ни с нормальными астроглиальными клетками, ни с другими нормальными или опухолевыми клеточными линиями.
При этом недостатком вышеуказанного способа является невысокая специфичность аптамеров к живой ткани глиобластомы, что снижает точность ее визуализации и определение истинных границ при оперативном вмешательстве с использованием описанных аптамеров.
В известных источниках информации о применении выбранных аптамеров для интраоперационной визуализации опухоли человека не приводится Кроме того, в приведенных источниках информации нет данных о токсичности выбранных аптамеров, в результате чего остается неизвестным можно ли использовать их для интраоперационной визуализации глиобластомы человека.
В настоящем изобретении аптамеры связаны с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм), что позволяет визуализировать аптамеры, связавшиеся с опухолью с помощью хирургического флуоресцентного микроскопа с использованием фильтра BL400.
Задачей настоящего изобретения является повышение специфичности способа визуализации ткани глиобластомы человека при проведении операции.
Технический результат изобретения выражается в повышении точности определения истинных границ глиобластомы человека во время операции.
Поставленная задача решается тем, что в способе визуализации глиобластомы человека, включающем обработку ткани мозга ДНК-аптамером, полученным с использованием технологии cell-SELEX с чередованием позитивной и негативной селекции и связанным с флуоресцентной меткой, согласно заявляемому изобретению, обработку ткани мозга осуществляют во время операции ДНК-аптамером, выбранным из ДНК-аптамеров с установленными последовательностями, отраженными как SEQ ID NO 1- SEQ ID NO 3, при выборе которых в качестве позитивной мишени использована послеоперационная опухолевая ткань глиобластомы головного мозга человека, в качестве негативных мишеней использованы ткани опухолей неглиального происхождения - менингиомы и метастазов в мозг опухолей различной локализации, визуализацию осуществляют с помощью хирургического флуоресцентного микроскопа.
Для интраоперационной визуализации ДНК-аптамер связывают с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм), что позволяет применять препарат для интраоперационной визуализации с использованием стандартных хирургических флуоресцентных микроскопов.
Перед обработкой ткани мозга ДНК-аптамером ткань мозга может быть обработана маскирующей нуклеиновой кислотой.
Обработка ткани мозга ДНК-аптамером может быть осуществлена орошением ткани мозга раствором ДНК-аптамера в фосфатном буфере, содержащем Са2+ и Mg2+.
После обработки ткани мозга ДНК-аптамером возможна промывка ткани фосфатным буфером, содержащим Са2+ и Mg2+.
Способ визуализации глиобластомы человека иллюстрируется фотографиями микроскопии, сделанными при визуализации тканей глиобластомы и менингиомы человека, полученных после оперативного удаления, а также фотографиями, полученными в ходе операции при удалении глиобластомы человека.
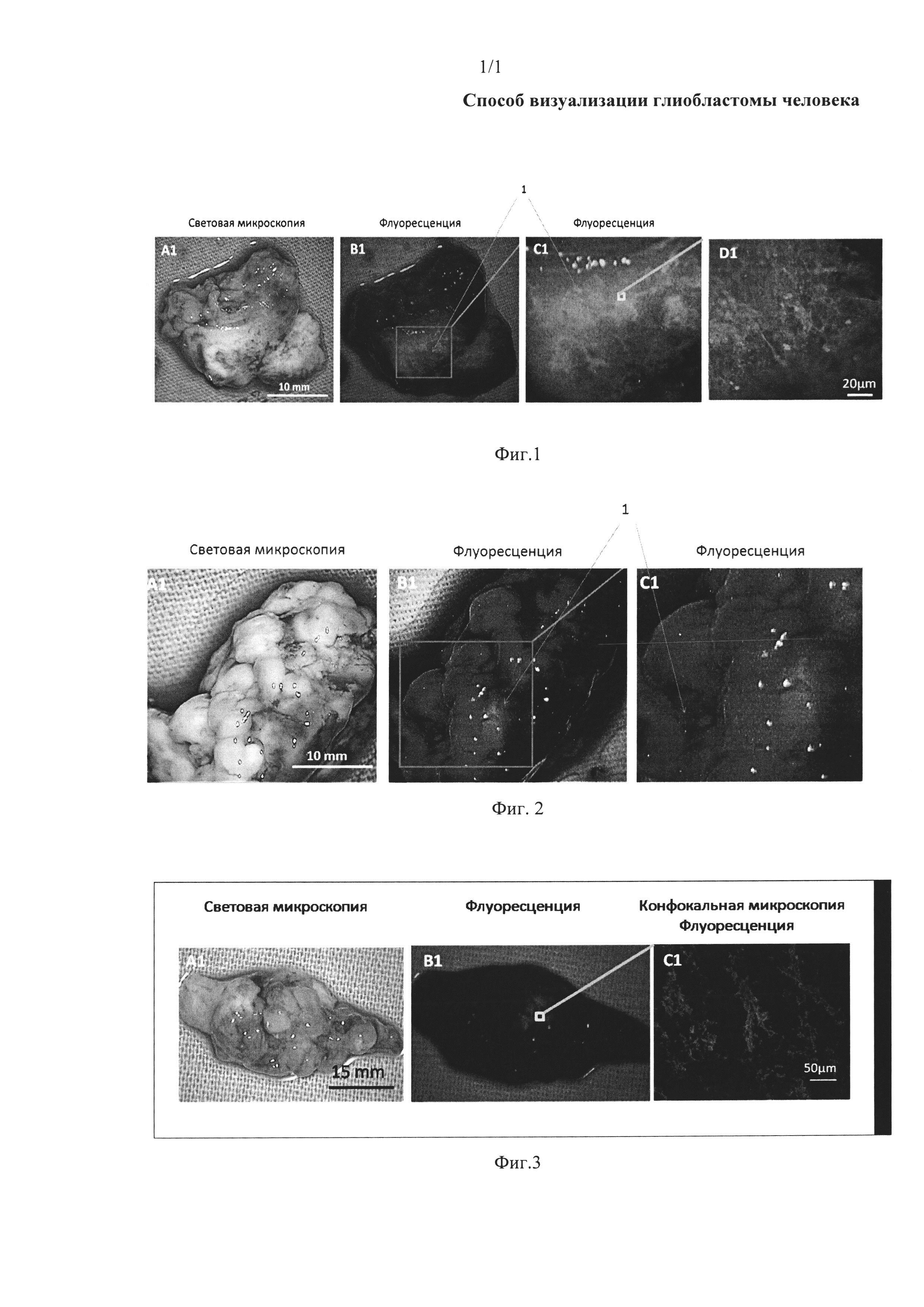
На фиг. 1 представлена световая флуоресцентная и конфокальная микроскопия ткани больного глиобластомой, окрашенной аптамером Gli-25, с установленной нуклеотидной последовательностью SEQ ID NO 3, связанным с флуоресцентной меткой Brilliant Violet.
На фиг. 2 представлена световая и флуоресцентная микроскопия ткани больного глиобластомой, окрашенной аптамером Gli-35, с установленной нуклеотидной последовательностью SEQ ID NO 2, связанным с флуоресцентной меткой Brilliant Violet.
На фиг. 3 представлена световая и флуоресцентная и конфокальная микроскопия ткани больного глиобластомой, окрашенной аптамером Gli-5566, с установленной нуклеотидной последовательностью SEQ ID NO 1, связанным с флуоресцентной меткой Brilliant Violet.
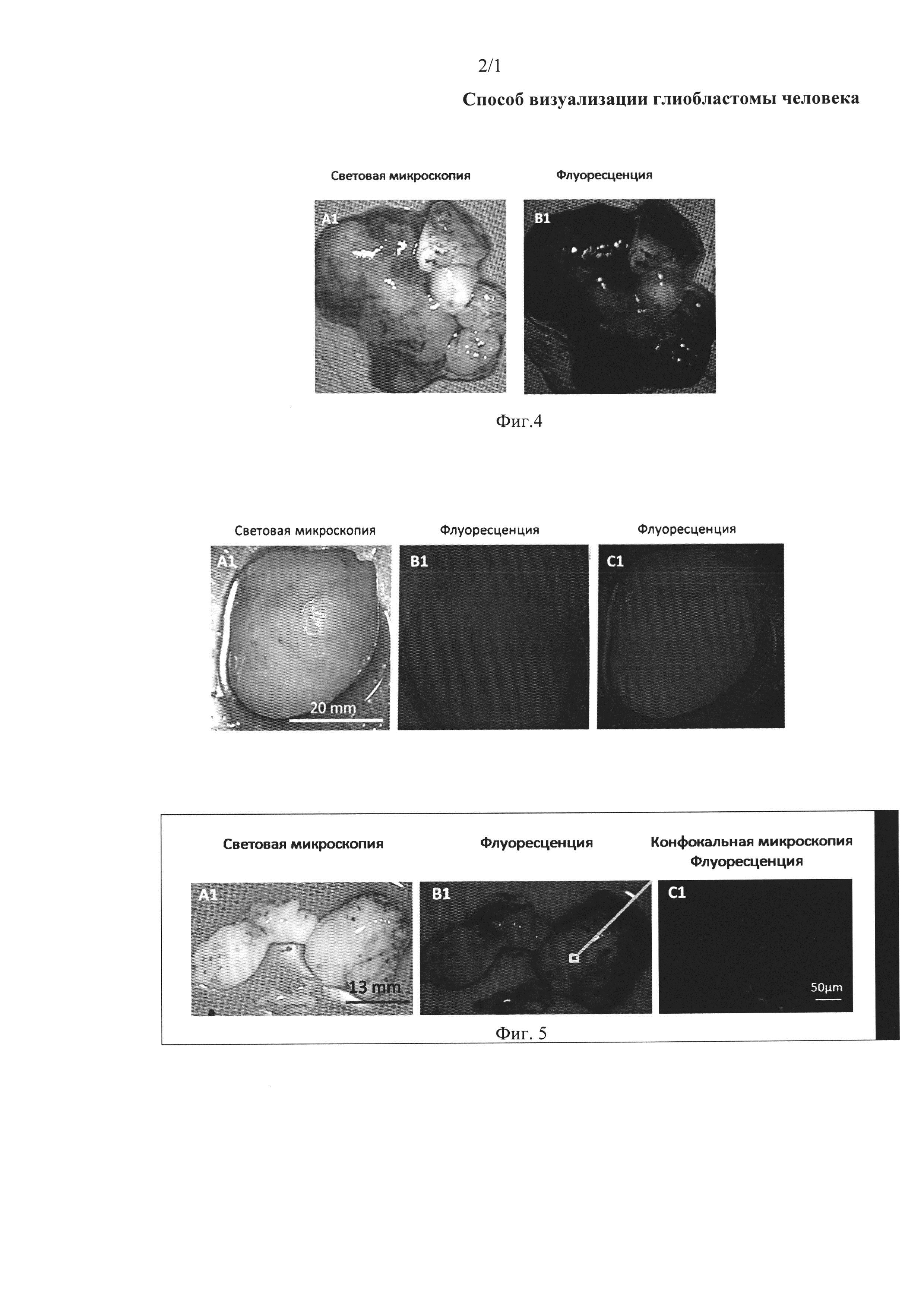
На фиг. 4 представлена световая и флуоресцентная микроскопия ткани больного менингиомой, окрашенной аптамером Gli-25, с установленной нуклеотидной последовательностью SEQ ID NO 3, связанным с флуоресцентной меткой Brilliant Violet.
На фиг. 5 представлена световая, флуоресцентная и конфокальная микроскопия переходной (условно здоровой, прилегающей к опухолевой) ткани больного глиобластомой, окрашенной аптамером Gli-25, с установленной нуклеотидной последовательностью SEQ ID NO 3, связанным с флуоресцентной меткой Brilliant Violet.
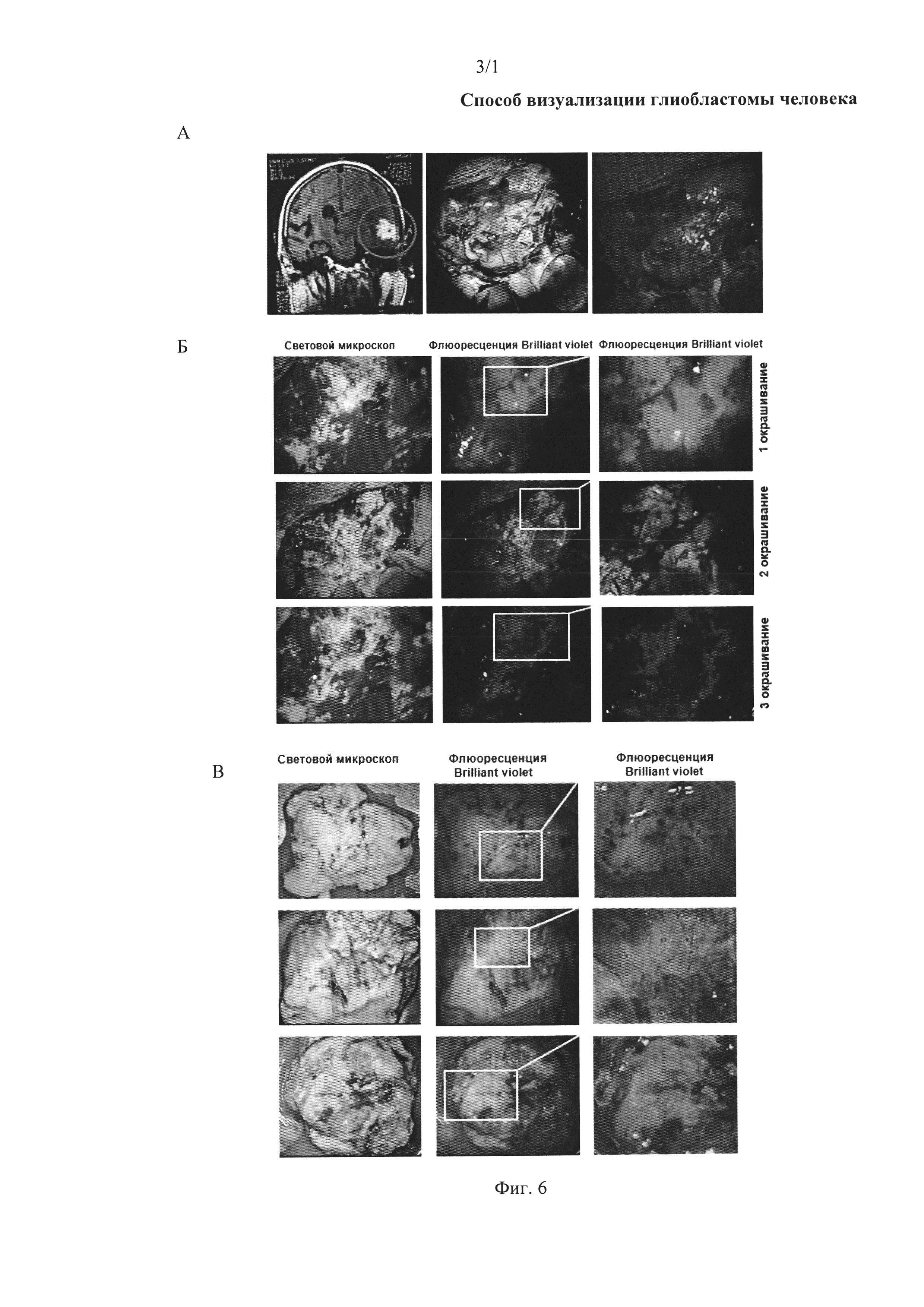
На фиг. 6. А Пациент с глиобластомой, повторная операция: а) снимок МРТ, б) световая микроскопия опухоли, в) флюоресценция глиобластомы, окрашенной аптамерами до удаления. Б Флюоресценция глиобластомы, окрашенной аптамерами после удаления некротической части опухоли. В Флюоресценция удаленных участков глиобластомы через 30 мин после удаления.
Способ визуализации глиобластомы человека осуществляют следующим образом. Ткань мозга, пораженную опухолью, которую предварительно диагностировали с помощью компьютерной томографии, во время операции обрабатывают ДНК-аптамером, выбранным из установленных последовательностей аптамеров, отраженных как SEQ ID NO 1- SEQ ID NO 3 в конечной концентрации 2 мкМ, связанными с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм) в течение 5-10 мин. Обработка может быть произведена орошением. За 5 мин до обработки ДНК-аптамером ткань мозга может быть обработана маскирующей нуклеиновой кислотой, в качестве которой может быть использована дрожжевая РНК в конечной концентрации 1 нг/мкл. После обработки ДНК-аптамером ткань мозга может быть промыта фосфатным буфером, содержащим Са2+ и Mg2 или физиологическим раствором (натрия хлоридом). Визуализацию ткани глиобластомы осуществляют путем детекции меченых флуоресцентным красителем аптамеров с помощью хирургического флуоресцентного микроскопа.
Аптамер, используемый в заявляемом способе, выбран из установленных последовательностей аптамеров, отраженных как SEQ ID NO 1 - SEQ ID NO 3, при выборе которых в качестве позитивной мишени использована послеоперационная опухолевая ткань глиобластомы головного мозга человека, в качестве негативных мишеней использованы ткани опухолей неглиального происхождения - менингиомы и метастазов в мозг опухолей различной локализации. При этом первый раунд включал в себя только позитивную селекцию, при проведении второго и последующих раундов чередовали негативную и позитивную селекции. Таким образом, для подбора аптамеров к заданной мишени было проведено 6 раундов селекции. В результате были получены 6 пулов аптамеров с различной степенью сродства к ткани глиобластомы. В результате полного секвенирования пула 5 раунда селекции аптамеров, обладающего наибольшей аффинностью к тканям глиобластомы было выбрано 3 последовательности аптамеров, отраженных как SEQ ID NO 1 - SEQ ID NO 3. Каждый из аптамеров указанных последовательностей был проинкубирован с тканями мозга, пораженными опухолью, и подтвердил свою специфичность к глиобластоме человека.
Было показано, что аптамеры, отраженные как SEQ ID NO 1 - SEQ ID NO 3, связанные с красителем Brilliant Violet, не оказывают токсического действия на ЦНС и сердечно-сосудистую систему, биохимические и гематологические показатели и не вызывают изменений морфологии внутренних органов и их массы (исследования были проведены в лаборатории биологических испытаний Филиала Федерального государственного бюджетного учреждения науки Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук (ФИБХ РАН), номер исследования 516/16). В заключении указанного исследования аптамеров, связанных с флуоресцентным красителем Brilliant Violet, на токсичность отмечено, что: «В ходе проведенного исследования было установлено, что тестируемый препарат в условиях данного эксперимента не влиял на общее состояние животных, прирост массы тела и потребление корма, не оказывал токсического действия на ЦНС и сердечнососудистую систему, биохимические и гематологические показатели, а также не вызывал изменений морфологии внутренних органов и их массы.
На основании проведенного исследования может быть сделано заключение о том, что тестируемый препарат ДНК-аптамеров при однократном внутривенном введении самцам и самкам крыс SD является безопасным в диапазоне исследованных доз и может быть рекомендован для проведения клинических исследований».
Таким образом, было показано, что аптамеры, отраженные как SEQ ID NO 1 - SEQ ID NO 3, могут использоваться для интраоперационной визуализации глиобластомы человека.
Способ визуализации ткани глиобластомы человека иллюстрируется следующими примерами.
Пример 1.
Для осуществления примера использовали послеоперационную ткань больного глиобластомой с подтвержденным диагнозом.
За 5 мин до окрашивания аптамерами ткань мозга, пораженную глиобластомой, обрабатывали дрожжевой РНК в конечной концентрации 1 нг/мкл. После этого ткань обрабатывали ДНК-аптамером Gli-25 с установленной нуклеотидной последовательностью SEQ ID NO 3, связанной с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм), конечная концентрация 2 мкМ. Через 10 мин ткань промывали фосфатным буфером, содержащим Са2+ и Mg2+. Идентификацию ткани глиобластомы осуществляли путем детекции связанного с флуоресцентным красителем аптамера с помощью хирургического флуоресцентного микроскопа OPMI Pentero (Carl Zeiss, Germany). Результаты визуализации глиобластомы человека приведены на фиг. 1. Как видно из приведенных фотографий, используемый способ визуализации глиобластомы человека позволил идентифицировать злокачественные очаги в ткани мозга.
Пример 2.
Для осуществления примера использовали послеоперационную ткань больного глиобластомой с подтвержденным диагнозом.
Ткань мозга обрабатывали дрожжевой РНК в конечной концентрации 1 нг/мкл. Через 5 мин ткань обрабатывали связанным с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм) ДНК-аптамером Gli-35 с установленной нуклеотидной последовательностью SEQ ID NO 2 в конечной концентрации 2 мкМ. Через 10 мин ткань промывали фосфатным буфером, содержащим Са2+ и Mg2+. Идентификацию ткани глиобластомы осуществляли путем детекции связанного с флуоресцентным красителем аптамера с помощью хирургического флуоресцентного микроскопа OPMI Pentero (Carl Zeiss, Germany). Результаты визуализации глиобластомы приведены на фиг. 2. Как видно из фотографий, используемый способ визуализации глиобластомы позволил идентифицировать злокачественные очаги в ткани мозга.
Пример 3.
Для осуществления примера использовали послеоперационную ткань больного глиобластомой с подтвержденным диагнозом.
За 5 мин до окрашивания аптамерами ткань мозга, пораженную глиобластомой, обрабатывали дрожжевой РНК в конечной концентрации 1 нг/мкл. После этого ткань обрабатывали ДНК-аптамером GH-5566 с установленной нуклеотидной последовательностью SEQ ID NO 1, связанной с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм), конечная концентрация 2 мкМ. Через 10 мин ткань промывали фосфатным буфером, содержащим Са2+ и Mg2+. Идентификацию ткани глиобластомы осуществляли путем детекции связанного с флуоресцентным красителем аптамера с помощью хирургического флуоресцентного микроскопа OPMI Pentero (Carl Zeiss, Germany). Результаты визуализации глиобластомы человека приведены на фиг. 3. Как видно из приведенных фотографий, используемый способ визуализации глиобластомы человека позволил идентифицировать злокачественные очаги в ткани мозга.
Пример 4.
Для осуществления примера использовали послеоперационную ткань больного менингиомой (с подтвержденным диагнозом).
Ткань мозга обрабатывали дрожжевой РНК в конечной концентрации 1 нг/мкл. Через 5 мин ткань обрабатывали связанным с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм) ДНК-аптамером Gli-25 с установленной нуклеотидной последовательностью SEQ ID NO 3 в конечной концентрации 2 мкМ. Через 10 мин ткань промывали фосфатным буфером, содержащим Са2+ и Mg2+. Ткань исследовали с помощью хирургического флуоресцентного микроскопа OPMI Pentero (Carl Zeiss, Germany). Результаты исследований приведены на фиг. 4.
Как видно из фотографий, используемый способ визуализации глиобластомы человека с помощью аптамера, специфичного к глиобластоме человека, не окрасил ткани менингиомы, что доказывает специфичность заявленного способа к тканям глиобластомы человека.
Пример 5. Для осуществления примера использовали переходную (условно здоровую, прилегающую к опухолевой) послеоперационную ткань больного глиобластомой с подтвержденным диагнозом.
За 5 мин до окрашивания аптамерами переходную ткань мозга, пораженного глиобластомой, обрабатывали дрожжевой РНК в конечной концентрации 1 нг/мкл. После этого ткань обрабатывали ДНК-аптамером Gli-25 с установленной нуклеотидной последовательностью SEQ ID NO 3, связанной с флуоресцентным красителем Brilliant Violet (длины волн возбуждения 400-410 нм и испускания 620-670 нм), конечная концентрация 2 мкМ. Через 10 мин ткань промывали фосфатным буфером, содержащим Са2+ и Mg2+. Идентификацию ткани глиобластомы осуществляли путем детекции связанного с флуоресцентным красителем аптамера с помощью хирургического флуоресцентного микроскопа OPMI Pentero (Carl Zeiss, Germany). Результаты визуализации глиобластомы человека приведены на фиг. 5. Как видно из приведенных фотографий, аптамер позволил выявить очаги опухоли в условно здоровой ткани мозга, пораженного глиобластомой.
Пример 6. Для осуществления примера была проведено оперативное удаление глиобластомы мозга, предварительно диагностированной с помощью компьютерной томографии.
Для визуализациии опухоли головного мозга использовали операционный флуоресцентный микроскоп OPMI Pentero (Carl Zeiss, Germany). Аналитические исследования клинических образцов проводили в стандартных условиях операционной при комнатной температуре, нормальном уровне влажности с учетом требований техники безопасности.
На фиг. 6 представлены данные интраоперационной визуализации глиобластомы головного мозга пациента, возникшей через восемь месяцев после первой резекции опухоли.
Опухоль промывали физиологическим раствором (натрия хлоридом) и распыляли аптамер Gli-35, заявленный как SEQ ID NO 2, с флюоресцентной меткой Brilliant Violet. На фиг. 7А видно, что опухоль имеет некротическую структуру. Аптамер Gli-35 не окрасил некротическую ткань опухоли, поскольку связывается только с живыми клетками глиобластомы. Во время операции очаг опухоли, а именно некроз тканей хорошо идентифицируется и поэтому без проблем удаляется хирургическим путем. Хорошо видимую зону некроза опухоли удаляли. Затем для более точного определения границы глиобластомы ткань мозга промывали физраствором и снова распыляли аптамер на ткань (фиг. 6Б). Через 3 мин ткань промывали физиологическим раствором. После первого окрашивания наблюдалась яркая флюоресценция тканей (фиг. 6Б-1), поэтому данный слой удаляли. Второе окрашивание также показало наличие опухолевых клеток, но уже в меньшем количестве (фиг. 6Б-2). Данный слой также был подвержен резекции. При последнем окрашивании аптамеров флюоресценция не наблюдалась, в связи с этим был сделан вывод, что во время операции опухолевые клетки были удалены.
Кусочки тканей, удаленные во время операции, продолжали флюоресцировать в течение 30 мин (фиг. 6Б-3).
Таким образом, было показано, что аптамер GLI-35, меченный флуоресцентной меткой, локализовался в опухолевых очагах ткани. Использованная методика проста в применении и может использоваться во время операций. При этом немаловажно, что используемые для визуализации опухолевых очагов аптамеры нетоксичны и неиммуногенны.
Заявленный способ визуализации глиобластомы человека позволяет повысить точность определения истинных границ глиобластомы человека во время операции и может быть использован для повышения радикальности хирургического лечения глиобластомы, что позволит уменьшить риск рецидива заболевания и улучшить отдаленные результаты лечения. Кроме того, в настоящее время данная методика может быть использована для оценки радикальности удаления опухоли на основании обследования удаленного макропрепарата.
Перечень последовательностей аптамеров, специфичных для глиобластомы человека
SEQ ID NO 1
<210> 1
<211> 80
<212> single stranded DNA
<213> искусственная последовательность
<220> Нуклеотидная последовательность, специфичная для глиобластомы человека
<223> Аптамер, полученный с помощью технологии SELEX
<400> 1
gtccggttca cctctagcat tcctggcgtt attaacggag cagtcctgtg gagtgggtga gcataggtag tccagaagcc 80
SEQ ID NO 2
<210> 2
<211> 35
<212> single stranded DNA
<213> искусственная последовательность
<220> Нуклеотидная последовательность, специфичная для глиобластомы человека
<223> Аптамер, полученный с помощью технологии SELEX
<400> 2
actattccac tgcaacaact gaacggactg gaaac 35
SEQ ID NO 3
<210> 3
<211> 25
<212> single stranded DNA
<213> искусственная последовательность
<220> Нуклеотидная последовательность, специфичная для глиобластомы человека
<223> Аптамер, полученный с помощью технологии SELEX
<400> 3
aaacactggt cataatcatg gtggc 25