Результат интеллектуальной деятельности: СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА
Вид РИД
Изобретение
Область техники
Изобретение относится к области медицины и может быть использовано для стимуляции восстановления мужской фертильности, в том числе при лечении нарушений фертильности, вызванной врожденным или приобретенным нарушением функции сперматогенной ткани семенников.
Уровень техники
Наиболее типичными проявлениями дисфункции органов мужской половой сферы является импотенция и мужское бесплодие, одной из основных причин которых могут служить нарушения сперматогенеза и сниженный уровень мужских половых гормонов. Подобные нарушения могут носить первичный характер или проявляться вторично как последствия иных заболеваний, в частности простатита или венерических заболеваний. По степени тяжести неблагоприятных социальных последствий ВОЗ поставила проблему мужского бесплодия сразу вслед за проблемами онкологических и сердечно-сосудистых заболеваний.
Лечение нарушений мужской половой функции очень часто носит симптоматический характер. Из уровня техники известно, что наиболее распространенным способом лечения андрогенной недостаточности, связанной с нарушениями сперматогенеза, является гормонотерапия, в первую очередь, с использованием тестостерона и его синтетических аналогов. Однако в большинстве случаев гормонотерапия не приводит к полному восстановлению нормальной репродуктивной и сексуальной функций, кроме того, наблюдаемый эффект от лечения является кратковременным.
Известен способ лечения андрогенной недостаточности при вторичном гипогонадизме путем трансплантации пациенту гипофизарно-гипоталамического комплекса (Кирпатовский И.Д. «Очерки по хирургической андрологии». М., 1989 г.). К недостаткам способа относятся высокая сложность операции и труднодоступность трупного донорского аллотрансплантата.
Другим известным способом лечения андрогенной недостаточности методом трансплантации является пересадка донорского яичка на сосудистых связях (Хирургическая коррекция эндокринной импотенции, И.Д. Кирпатовский, Д.Л. Горбатюк). Однако сложность и травматичность оперативного вмешательства, необходимость проведения иммуносупрессивной терапии, а также необходимость использования труднодоступного трупного или донорского материала делают этот метод малоприменимым.
Из уровня техники известны способы лечения больных с нарушением мужской половой функции методом трансплантации клеток Лейдига через семенной канатик (Патенты РФ №2200010, 2200012). Задачей изобретений является снижение травматичности и повышение приживаемости клеточного трансплантата. Поставленная задача достигается способом лечения больных с нарушениями мужской половой функции, заключающимся в том, что вводят 1,0 мл 2,5% суспензии гидрокортизона ацетата в толщу мошоночного отдела семенного канатика или проводят многократные инфузии озонированного физиологического раствора, а затем имплантируют не менее 2 млн жизнеспособных клеток Лейдига эмбрионального происхождения. Недостатком этих способов является недостаточное восстановление фертильности.
Из уровня техники известен способ восстановления репродуктивных функций яичников с помощью введения мезенхимных стволовых/стромальных клеток (МСК), выделенных из кожи (CN 103816184). Однако неизвестно, насколько этот способ может быть применен для лечения мужского бесплодия, поскольку механизмы образования женских и мужских половых клеток значительно различаются.
Другим источником стволовых и прогениторных клеток, которые могут быть использованы для профилактики и лечения инфертильности, является плацента, для этой же цели предлагается использовать экстракт плаценты (KR 20120022327). Однако в указанном способе описаны методы получения данных препаратов, в то время как способы их применения по заявленным показаниям не раскрыты.
Из уровня техники известен способ выделения сперматогенных стволовых клеток из яичка в препубертатном возрасте и их культивирования ex vivo (WO 2016004376 A1). Эти клетки в дальнейшем могут быть использованы для получения зрелых форм мужских половых клеток или трансплантированы обратно в яички для восстановления репродуктивной функции. Указанный способ обладает определенными преимуществами, однако достаточно сложен и требует значительных затрат для получения количества клеточного материала, достаточного для эффективной терапии бесплодия. Кроме того, он предполагает возрастные ограничения для выделения клеток по данному способу.
Наиболее близким к заявленному решению можно считать способ лечения бесплодия с помощью введения в системный кровоток или в репродуктивный тракт аутологичных стволовых и прогениторных клеток, выделенных из костного мозга, периферической крови или стромально-васкулярной фракции жировой ткани и секретирующих фактор роста гепатоцитов (HGF) (AU 2011100703). Однако не определена эффективная доза клеточного материала, в то же время с учетом предполагаемого механизма действия и путей введения клеток необходимо вводить огромное количество клеток для достижения эффекта, что связано со значительными затратами ресурсов на подготовку препарата и сопряжено с повышенным риском осложнений.
Раскрытие изобретения
Задачей изобретения является разработка способа восстановления мужской фертильности с помощью методов клеточной терапии путем комплексного воздействия на клетки сперматогенного эпителия и клетки яичка, поддерживающие сперматогенез.
Техническим результатом, на достижение которого направлено заявленное изобретение, является достижение высокой степени стимуляции сперматогенеза за счет введения в ткани яичка с помощью однократной инъекции под белочную оболочку прототипа биомедицинского клеточного продукта в виде суспензии мезенхимных стволовых/стромальных клеток (МСК) человека, способных стимулировать активацию эндогенных тканеспецифичных стволовых и прогениторных клеток.
Эффективность способа обеспечивается за счет локального введения в яички МСК, способных секретировать факторы, необходимые для поддержания роста, повышения выживаемости и восстановления функции сперматогенных клеток, а также клеток, поддерживающих сперматогенез (клетки Сертоли, клетки Лейдига). Так, большое значение для жизнедеятельности сперматогенных стволовых клеток имеют такие факторы, как нейротрофический фактор из глиальных клеток (GDNF), основный фактор роста фибробластов (FGF-2), фактор ингибирования лейкемии (LIF) и другие (Oatley Jon М., Brinster Ralph L., 2008; Park M.H., 2016). Например, для активации процессов дифференцировки сперматогенных стволовых клеток требуется повышение секреции FGF-2 и GDNF. Ключевым фактором, секретируемым клетками Сертоли, которые поддерживают клетки сперматогенного эпителия в семенных канальцах, является GDNF. В работах, посвященных изучению морфогенеза яичек, показано, что фактор роста эндотелия сосудов (VEGF) не стимулирует образование семенных канальцев и новых кровеносных сосудов, однако приводит к увеличению количества канальцев, содержащих сперматогонии, что указывает на протективную роль VEGF по отношению к сперматогенным стволовым клеткам (Dores С, Dobrinski I., 2014). Таким образом, использование по отдельности факторов роста, даже обладающих положительным действием на сперматогенные стволовые клетки, не позволяет эффективно стимулировать весь процесс сперматогенеза. Предлагаемый в данном изобретении способ включает в себя введение суспензии МСК человека, обладающих комплексным воздействием на клетки сперматогенного эпителия и клетки яичка, поддерживающие сперматогенез, за счет многофункционального действия секретируемых факторов роста и других биологически активных молекул. При этом использование живых клеток обеспечивает пролонгированный эффект, поскольку введенные МСК человека попадают в иммунопривилегированную зону и сохраняют способность секретировать биологически активные продукты в течение срока, достаточного для достижения терапевтического эффекта. Безопасность способа достигается путем использования малотравматичной процедуры введения суспензии клеток под белочную оболочку яичка, а также за счет того, что введенные клетки не контактируют напрямую со сперматогенными стволовыми клетками, а действуют опосредованно через секретируемые ими компоненты.
Поставленная задача решается тем, что для стимуляции сперматогенеза под белочную оболочку яичка инъекционно вводят суспензию мультипотентных мезенхимных стромальных клеток жировой ткани человека в бессывороточной среде роста, лишенной ксеногенных компонентов, в количестве 500-600 тысяч клеток, содержащихся в 400±100 мкл суспензии. Введение осуществляют однократно. При этом повторное введение суспензии МСК для усиления и пролонгации эффекта осуществляют не ранее чем через 3-6 месяцев после первого введения.
Способ стимуляции сперматогенеза включает в себя культивирование МСК человека до 4-5 пассажа в среде, поддерживающей рост недифференцированных мезенхимных клеток человека, открепление от пластика, отмывку клеток буферным раствором, разведение суспензии клеток в бессывороточной среде роста, лишенной ксеногенных компонентов, и введение суспензии под белочную оболочку яичка. Введенные локально МСК не проникают непосредственно в просвет канальцев, а действуют паракринным путем, продуцируя биоактивные факторы, способствующие поддержанию роста, повышению выживаемости и восстановлению функции сперматогенных клеток, а также клеток, поддерживающих сперматогенез (клетки Сертоли, клетки Лейдига). Это приводит к восстановлению процесса дифференцировки клеток сперматогенного эпителия в зрелые сперматозоиды, при этом в придатках увеличивается как общее число сперматозоидов, так и их подвижная фракция. Кроме того, введенные клетки способствуют уменьшению выраженности гипотрофии крипторхированных яичек, значительно снижают число атрофичных и склерозированных канальцев, обладают положительным воздействием на клетки Сертоли и клетки Лейдига, что приводит к восстановлению уровня андрогенов.
Для реализации данного способа нами использованы МСК человека, отвечающие за репарацию и регенерацию тканей и органов как в норме, так и при повреждениях. Одним из наиболее богатых источников МСК у человека является жировая ткань. МСК могут быть легко выделены в результате ферментативной обработки образцов жировой ткани, полученной в результате косметической липосакции или в ходе хирургического удаления жирового отложения. Культивирование изолированных МСК ЖТ приводит к получению относительно гомогенной популяции мультипотентных стромальных фибробластоподобных клеток.
В заявляемом изобретении могут быть использованы МСК, полученные самостоятельно по любому известному из уровня техники способу (см. Пример 1), так и в виде коммерческих препаратов МСК, имеющих сертификат качества и предназначенных, в том числе, для клинического применения, например, такие как продукт АТСС (АТСС® PCS-500-011), представляющий собой МСК человека, выделенные из липоаспирата, культивированные до 2 пассажа и подвергнутые криоконсервации, или аналогичные.
Ранее на моделях ишемии конечности и инфаркта миокарда и подкожно имплантированного матригеля у животных нами было показано, что локальное и системное введение МСК жировой ткани способствует увеличению количества сосудов в тканях с нарушенным кровоснабжением, приводит к улучшению кровотока в этих тканях и уменьшению или исчезновению симптомов ишемии. Кроме того, нами было выявлено, что введение МСК жировой ткани способствует прорастанию нервных окончаний в подкожно имплантированный матригель и улучшает восстановление периферических нервов после травматического повреждения. Согласно данным наших исследований и работ других научных коллективов, основным механизмом, лежащим в основе регенеративного эффекта МСК жировой ткани, является продукция этими клетками широкого спектра биологически активных цитокинов и факторов роста, ускоряющих процессы заживления и восстановления тканей после повреждения. Поскольку в секретоме МСК жировой ткани человека присутствуют ключевые факторы, такие как GDNF, VEGF, FGF2, HGF и др., необходимые для поддержания роста, повышения выживаемости и восстановления функции сперматогенных клеток, а также клеток, поддерживающих сперматогенез (клетки Сертоли, клетки Лейдига), предполагается, что комплексное воздействие этих факторов обеспечивает эффективность предлагаемого способа для стимуляции сперматогенеза.
Техническим преимуществом способа является введение относительно небольшого количества клеточного материала. При подборе дозы клеток мы вводили различное количество МСК жировой ткани под белочную оболочку яичка на модели экспериментального крипторхизма у крыс. Было показано, что при введении МСК в количестве 50-200 тыс. в крипторхированных яичках сохраняются признаки блока сперматогенеза на разных стадиях, не происходит восстановления сперматогенеза в виде повышения количества сперматозоидов на поздних стадиях созревания и значимого улучшения состояния канальцев и интерстиция яичек по данным гистологических исследований. В то же время введение клеток в количестве 250 и 500 тысяч приводило к значительной стимуляции восстановления сперматогенеза даже при однократном введении суспензии, при этом эффект для этих доз был сравнимым. Таким образом, за счет локального введения в яички относительно небольшого количества МСК (200-300 тысяч), введенных однократно, достаточно для достижения терапевтического эффекта. В частном случае, реализуемом в данном изобретении, вводили 100±10 мкл суспензии (200-300 тысяч клеток) в яички экспериментальных животных (крыс). Для применения у человека указанная доза может составлять 500-600 тысяч клеток на яичко однократно.
Техническим преимуществом изобретения также является малотравматичный способ введения МСК под белочную оболочку яичка в небольшом объеме бессывороточной среды роста, не сдавливающем подлежащие канальцы. Объем введения суспензии под белочную оболочку яичка по предлагаемому способу должен быть достаточным для разведения необходимого количества клеток для достижения терапевтического эффекта и в то же время не вызывать избыточной травматизации тканей яичка. В частном случае, реализуемом в данном изобретении, вводили 100±10 мкл суспензии (200-300 тысяч клеток) в яички экспериментальных животных (крыс), что является достаточным для достижения терапевтического эффекта и не приводит к сдавлению тканей паренхимы яичка. Для применения у человека объем суспензии для введения может составлять 400±100 мкл бессывороточной среды роста, в которой содержится 500-600 тысяч клеток.
Для введения используют бессывороточную и лишенную продуктов животного происхождения среду роста, в качестве последней может быть использована DMEM с низким содержанием глюкозы (HyClone, USA) или другая аналогичная среда роста, пригодная для терапевтического применения.
При реализации предлагаемого способа терапевтический эффект достигается через 3 месяца после моделирования повреждающего воздействия на яички и введения суспензии МСК человека. Повторное введение суспензии МСК для усиления и пролонгации эффекта может быть произведено не ранее чем через 3-6 месяцев после первого введения.
В результате осуществления данного изобретения стимулируют сперматогенез с помощью локального однократного введения в яички МСК человека биоматериала, содержащего МСК ЖТ человека, который может быть использован для лечения мужской инфертильности. При этом повторное введение суспензии МСК для усиления и пролонгации эффекта осуществляют не ранее чем через 3-6 месяцев после первого введения.
Краткое описание чертежей
Изобретение поясняется графическими материалами.
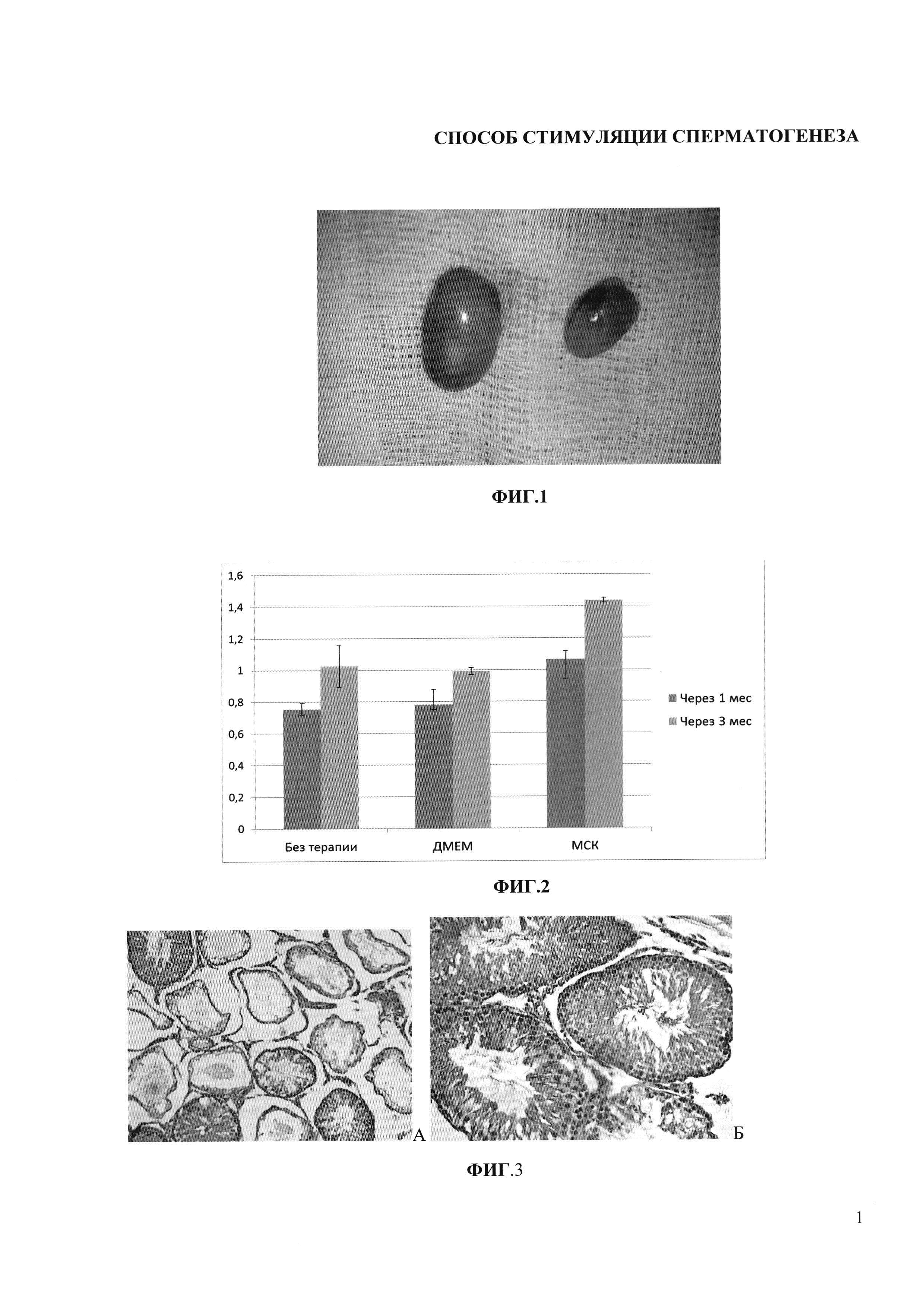
Фигура 1. Фотография, демонстрирующая внешний вид нормального (слева) и крипторхированного (справа) яичка.
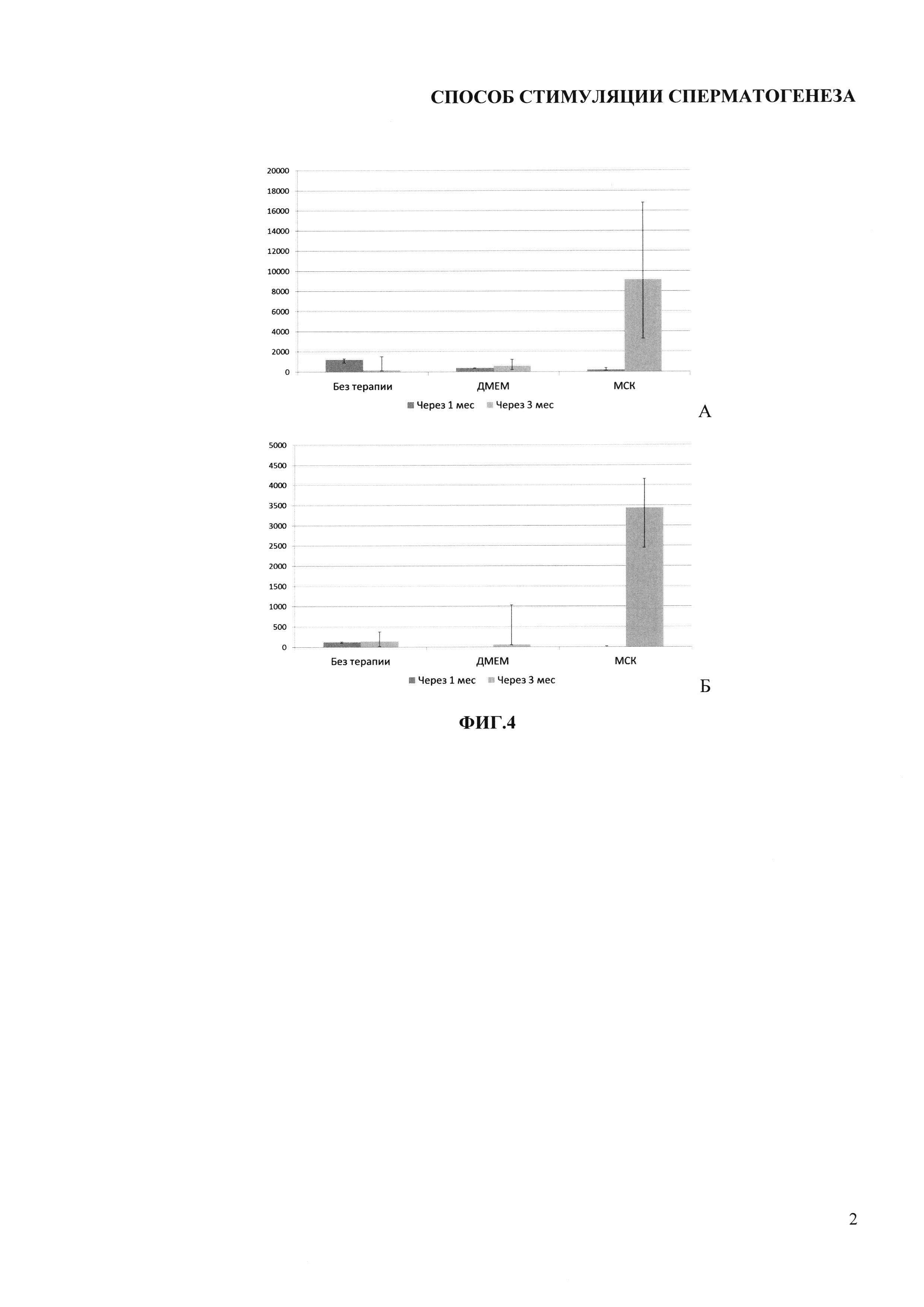
Фигура 2. Диаграмма, отражающая динамику массы крипторхированных яичек после их низведения в мошонку в различных группах экспериментальных животных. Данные представлены в виде медиана (25-, 75-процентили). * - р<0,05 (при сравнении с группой контроля ДМЕМ).
Фигура 3. А - Атрофичные канальцы в крипторхированных яичках через 3 месяца после низведения (контрольная серия). Б - восстановление сперматогенного эпителия через 3 месяца после низведения с введением в яичко МСК ЖТ. Окраска гематокислином и эозином, ув. 200х и 400х соответственно.
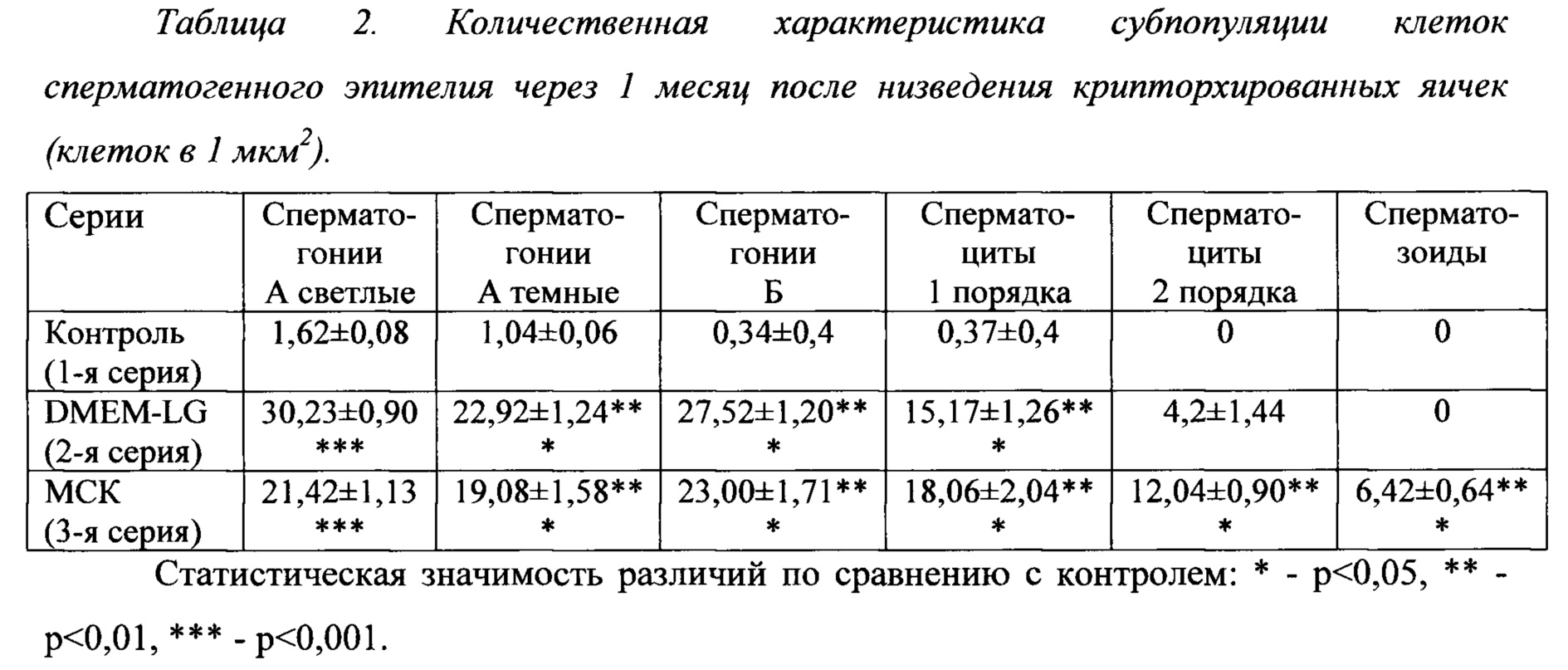
Фигура 4. Общее количество (А) и количество подвижных сперматозоидов (Б), выделенных из придатка яичка в исследуемых группах (тыс.на 1 придаток). Данные представлены в виде медиана (25-, 75-процентили). * - р<0,05 (при сравнении с группой контроля ДМЕМ).
Осуществление изобретения
Ниже представлено подробное описание изобретения на примерах конкретного выполнения, которые демонстрируют практическую осуществимость изобретения, но не ограничивают возможность осуществления изобретения с помощью иных средств и методов.
Пример 1. Получение МСК жировой ткани человека
МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone), содержащим 5-кратную концентрацию антибиотика 500 ед/мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEM™ (HyClone) /500 ед/мл антибиотика (HyClone), 200 ед/мл коллагеназы I типа и диспазы (40 ед/ml) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°С в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200 g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200 g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEM™ support expansion and maintenance of undifferentiated human MSCs (HyClone) в сочетании с добавлением 10% раствора добавок AdvanceSTEM™ Stem Cell Growth Supplement (HyClone) и 100 ед/мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани, без добавления сыворотки (http://www.thermo.com).
Выделенные МСК высевают в концентрации 200 тыс. в мл в чашках Петри и культивируют в среде роста в инкубаторе при 37°С и при 5%-ной концентрации СО2. При достижении 80% монослоя МСК ЖТ клетки пассируют. Для этого перед снятием с поверхности культурального пластика клетки трехкратно промывают раствором Версена. Затем наносят в каждую чашку по 1 мл реагента для диссоциации клеток HyQTase (HyClone). При приобретении клетками округлой формы и откреплении их от подложки в каждую культуральную емкость вносят по 9 мл среды роста и интенсивно пипетируют клеточную суспензию. Затем клетки рассевают в соотношении 1:4.
Для введения экспериментальным животным МСК ЖТ 2-5 пассажа открепляют от поверхности пластика с использованием раствора QTase (HyClone), подсчитывают их количество и разводят в среде DMEM-LG («HyClone», США) или аналогичной в концентрации 200-300 тыс. кл. на 100±10 мкл среды. Полученную суспензию клеток используют для введения под белочную оболочку яичка. В качестве контроля вводят среду DMEM-LG или аналогичную, использованную для разведения суспензии клеток. Отрицательным контролем также служит группа животных, которые не получали лечения после моделирования экспериментального крипторхизма.
Пример 2. Метод оценки концентрации ключевых факторов, опосредованно стимулирующих сперматогенез, в кондиционированной среде, содержащей продукты секреции МСК жировой ткани человека
Оценку содержания GDNF, VEGF и FGF basic (FGFb) в среде, кондиционированной МСК ЖТ, проводят методом иммуноферментного анализа (ELISA). Кондиционирование МСК ЖТ человека для оценки концентрации ключевых факторов, секретируемых клетками и опосредованно стимулирующих сперматогенез, проводят в бессывороточной среде роста DMEM-LG в течение 7 дней, затем собирают среду и очищают ее центрифугированием от остатков клеток, после чего в получившемся растворе должны определяться VEGF в концентрации не менее 200 пкг/мл, GDNF в концентрации не менее 50 пкг/мл, FGF basic в концентрации не менее 0,3 пкг/мл.
Оценка содержания VEGF с использованием набора фирмы R&D Systems Human VEGF Quantikine ELISA Kit.
Для определения концентрации VEGF методом ELISA используют коммерческий набор фирмы R&D Systems (Human VEGF Quantikine ELISA Kit, cat#DVE00) или аналогичный.
Используя стандартизированный раствор VEGF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл VEGF, каждая последующая содержала VEGF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора VEGF троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против VEGF человека. Через 3 часа инкубации планшеты отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания GDNF с использованием набора фирмы Cusabio Human GDNF ELISA Kit
Для определения концентрации GDNF методом ELISA используют коммерческий набор фирмы Cusabio или аналогичный.
Используя стандартизированный раствор GDNF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 1000 пг/мл GDNF, каждая последующая содержала GDNF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора GDNF троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против GDNF человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания FGFb с использованием набора фирмы R&D Systems Human FGF basic Quantikine ELISA Kit
Для определения концентрации FGFb методом ELISA используют коммерческий набор фирмы R&D Systems (Human FGF basic Quantikine ELISA Kit, cat#DFB50) или аналогичный.
Используя стандартизированный раствор FGFb, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл FGFb, каждая последующая содержала FGFb в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора FGFb троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против FGFb человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Пример 3. Способ стимуляции восстановления сперматогенеза с помощью введения МСК человека на модели экспериментального крипторхизм.
Эксперименты выполняли на 40 половозрелых крысах-самцах, породной группы Wistar, в возрасте 3,5-4,0 месяца, стандартных весовых характеристик. Все эксперименты выполняли в соответствии с требованием Хельсинкского соглашения о гуманном обращении с животными. Этим животным выполняли моделирование двухстороннего абдоминального крипторхизма. Для этого яички выводили из мошонки в брюшную полость через паховый канал (что у крыс не вызывает трудностей в связи с широким просветом канала) и фиксировали к брюшной стенке в области латеральных каналов узловым швом атравматической нитью «Prolene» 4/0, проведенной через дистальный полюс яичка, чтобы избежать возможного блокирования сообщения между выносящими семенными канальцами и придатком яичка. При этом обращали особое внимание на исключение возможности захватывания швом семявыносящего протока и кровеносных сосудов. Через 2 недели производили низведение яичек в мошонку путем удаления фиксирующей лигатуры и смещения яичек в паховый канал. Известно, что при этом сроке выдерживания яичек в брюшной полости происходят выраженные, но потенциально обратимые нарушения сперматогенеза. Затем перед низведением под белочную оболочку яичек пункционно с помощью инсулинового шприца вводили образцы МСК ЖТ. Оценку выраженности развившихся повреждений в яичках после 2-недельного пребывания в брюшной полости оценивали через 1 и 3 месяца после их низведения. Для этого удаляли яички с придатками и определяли их весовые характеристики. Также забирали образцы ткани яичек для гистологического исследования, которое проводили по стандартной методике с окраской гистологических срезов гематоксилином и эозином. Выраженность нарушения сперматогенеза оценивали по уровню его блокировки (определение наиболее зрелых клеточных форм в семенных канальцах), а также определению доли запустевших и склерозированных семенных канальцев. Придатки яичка гомогенизировали в растворе 5% глюкозы в соотношении ткань/раствор 1:10 с последующим определением в надосадочной жидкости количества активно-подвижных и неподвижных сперматозоидов в камере Горяева по стандартной методике анализа спермограммы.
Одним из негативных процессов, происходящих в крипторхированных яичках, является уменьшение их массы (гипотрофия). Наши исследования показали, что после 2-недельного пребывания в брюшной полости масса яичек уменьшалась в среднем с 1,98±0,09 г до 0,82±0,06 г (р<0,001) (Фиг. 1). Через 1 месяц после низведения в контрольных сериях масса органов практически не изменилась, тогда как в опытах с введением МСК возросла в среднем до 1,05-1,1 г (Фиг. 2). Через 3 месяца после низведения масса яичек в контрольной серии и в опытах с введением ДМЕМ возрастала незначительно (различия с данными при низведении яичек и через 1 месяц статистически незначимы), тогда как после введения МСК масса яичек продолжала возрастать достоверно, превышая значения в других опытах (р<0,05).
При гистологической оценке состояния сперматогенеза через 1 месяц после ликвидации двухстороннего абдоминального крипторхизма было установлено, что в контрольной серии (без терапии) наблюдаются резко выраженные нарушения с развитием блока созревания сперматозоидов уже на ранних стадиях. Так, даже темные сперматогонии А (начальные предшественники сперматозоидов) выявлялись только в 60% случаев, а более зрелые сперматогонии Б и сперматоциты 1-го порядка обнаруживались только в 20% препаратах. Более зрелые формы (сперматоциты 2 порядка, сперматозоиды) отсутствовали во всех случаях (табл. 1). То есть у этих животных развивался блок сперматогенеза на уровне сперматогоний или сперматоцитов 1-го порядка. Значительное улучшение состояния яичка отмечено при введении в яичко культуры МСК. В этих опытах выявляли завершенный сперматогенез (до стадии сперматозоидов) во всех экспериментах.

При количественном анализе распределения разных типов клеток сперматогенного эпителия (табл.2) выявили резкое обеднение канальцев всеми видами клеток как в контрольной серии, так и в опытах с введением ДМЕМ (Фиг. 3А). При введении МСК ЖТ клеточная популяция в значительной степени восстанавливалась как в отношении стволовых и прогениторных клеток (сперматогонии А), так и в отношении более дифференцированных клеточных форм вплоть до зрелых сперматозоидов (Фиг. 3Б).
В контрольной серии опытов выявляли значительное количество канальцев, полностью лишенных эпителиальной выстилки. Число пустых (атрофичных) канальцев в этой группе составило 63,24±5,16 канальцев на единицу условной площади препарата. В серии с ДМЕМ их количество было примерно таким же - 64,26±3,15. В то же время в опытах с введением МСК количество атрофичных канальцев было значительно меньше - 34,11±0,15 канальцев на единицу условной площади.
Через 3 месяца после низведения крипторхированных яичек во всех сериях отмечено улучшение сперматогенеза. Недифференцированные и малодифференцированные клеточные формы (светлые и темные сперматогонии А) практически полностью восстановились. Даже в контрольной серии в отдельных препаратах выявляли завершенный до стадии сперматозоидов сперматогенез, однако в большинстве случаев он был заблокирован на уровне сперматоцитов 1-го и 2-го порядка (табл. 3). В сериях опытов с введением ДМЕМ ситуация мало отличалась от контрольной серии. В то же время в опытах с введением МСК ЖТ выявляли завершенный сперматогенез во всех случаях.

Количественное определение различных клеточных популяций в семенных канальцах подтвердило восстановление популяции недифференцированных и малодифференцированных клеток (табл.4). Не выявили достоверных различий между количеством светлых и темных сперматогоний А между всеми группами опытов. В то же время степень восстановления популяции сперматогоний Б в контрольной серии оказалась достоверно ниже, чем в опытной серии. Количество более зрелых форм также в контроле в целом было меньше.

Статистическая значимость различий, как в табл.2.
Количество атрофичных канальцев через 3 месяца в контрольной серии существенно не изменилось по сравнению со сроком 1 месяц, составив 75,26±6,17 канальцев на единицу условной площади препарата, так же, как и в опытах с ДМЕМ - 52,12±2,19. В 3-ей серии их количество продолжало уменьшаться, составив 6,13±0,52 канальцев на единицу площади препарата.
Мы также изучили влияние исследуемого биоматериала на функцию крипторхированных яичек путем определения количества сперматозоидов, выделенных из придатка яичка, и их подвижности. Результаты показали, что у интактных крыс из придатка выделяли в среднем 61,375 (51,187; 71,562) тысяч клеток на придаток. Из них сохраняли подвижность после выделения в среднем 693 750 (534375; 853125) сперматозоидов. Через 1 месяц после низведения яичек во всех сериях выявили резкое уменьшение как общего количества, так и подвижных сперматозоидов на 88-100% (Фиг. 4). При этом в серии 3 отмечали некоторое увеличение общего количества выделенных сперматозоидов при сравнении с контрольными опытами, тогда как в отношении подвижных клеток различий не выявили. Иная картина наблюдалась через 3 месяца после низведения крипторхированных яичек. При этом сроке наблюдения отмечено значительное возрастание как общего количества, так и подвижных сперматозоидов в серии 3. У животных, получивших под белочную оболочку инъекцию культуры МСК, по сравнению с предыдущим месяцем было выявлено значительное увеличение общего количества сперматозоидов, которое составило в среднем 9.156 тысяч сперматозоидов. При этом 1 656 тысяч относились к подвижной фракции (18,1%), что говорит о серьезном клиническом эффекте культуры МСК в восстановлении сперматогенеза.
Таким образом, в результате осуществления данного изобретения стимулируют сперматогенез с помощью локального однократного введения под белочную оболочку яичка суспензии МСК жировой ткани человека, и этот способ может быть использован для лечения мужской инфертильности.