Результат интеллектуальной деятельности: СТАБИЛИЗИРОВАННЫЕ СОДЕРЖАЩИЕ АНТИТЕЛА ЖИДКИЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение касается содержащих антитела композиций, в частности, устойчивых высококонцентрированных содержащих антитела композиций.
Уровень техники
В последние годы существует возрастающая потребность в разработке самоинъектируемых содержащих антитела композициях для подкожных инъекций в соответствии с медицинскими потребностями. Разработка содержащих антитела композиций для подкожных инъекций вызывает необходимость в повышении концентрации антитела во вводимом растворе, поскольку отдельные дозы антитела очень высоки (приблизительно от 100 до 200 мг), и объем инъекции для подкожного введения, как правило, ограничен.
Высококонцентрированные содержащие антитела растворы имеют склонность к самостоятельному образованию высоковязких растворов из-за межмолекулярного взаимодействия и макромолекулярные характеристики белка. Кроме того, явление деградации, например, агрегация, становится проблематичным, когда белки хранятся в виде высококонцентрированных растворов, и, таким образом, такую деградацию необходимо предотвратить. В частности, высококонцентрированные содержащие антитела растворы склонны к образованию агрегатов во время замораживания-оттаивания или при хранении в жидком или замороженном состояниях в течение длительного времени (непатентные документы 1 и 2).
В настоящее время такие высококонцентрированные содержащие антитела композиции, как правило, приготавливают традиционным способом концентрирования путем лиофилизации (патентный документ 1), который представляет собой способ стабилизации высококонцентрированных содержащих антитела композиций. Согласно этому способу, высококонцентрированные содержащие антитела композиции получают путем лиофилизации раствора антитела относительно низкой концентрации и растворения в объеме воды, меньшем, чем объем до лиофилизации. В этом случае проблему вызывает повышенная вязкость растворенных композиций, поскольку должен добавляться криопротектор, такой, как сахар, для получения лиофилизированных композиций.
В этом аспекте этой проблемы можно избежать, если жидкую композицию приготавливать без лиофилизации. Однако, как описано выше, высококонцентрированные содержащие антитела жидкие композиции склонны к образованию агрегатов. Несмотря на это, в таких композициях существует большая потребность, поскольку содержащие антитела жидкие композиции легче поддаются обработке по сравнению с лиофилизированными композициями и легче могут быть рецептированы в композиции для предварительного наполнения шприцев.
Проводились разные исследования по стабилизации высококонцентрированных содержащих антитела жидких композиций (непатентные документы 1-4). Как известно из сообщений, гистидиновый буфер и аргинин могут использоваться в качестве буфера и стабилизатора, соответственно, в содержащих антитела жидких композициях (патентные документы 2, 3, 4, 5 и 6). Гистидиновый буфер обычно применяется в форме соли хлористоводородной кислоты. Недавно сообщалось о том, что гистидин-ацетат демонстрирует больший стабилизирующий эффект по сравнению с гистидин гидрохлоридом, и, таким образом, уксусная кислота может применяться как разновидность противоиона в гистидиновом буфере (патентный документ 6). В то же время, аргинин в качестве стабилизатора, как правило, применяется в форме аргинин гидрохлорида. Однако в некоторых случаях, достаточная устойчивость не достигается, когда хлористоводородную кислоту или уксусную кислоту используют в качестве разновидности противоиона к гистидину или аргинину. Таким образом, нужны более эффективные разновидности противоиона.
Документы существующего уровня техники
Патентные документы
Патентный документ 1: WO 1997/004801
Патентный документ 2: WO 2008/121615
Патентный документ 3: WO 2009/141239
Патентный документ 4: WO 2008/071394
Патентный документ 5: WO 2006/065746
Патентный документ 6: WO 2006/044908
Непатентные документы
Непатентный документ 1: Challenges in the development of high protein concentration formulations, J Pharm Sci, 2004, 93(6), 1390-1402
Непатентный документ 2: Curr Opin Biotechnol. 2009 Dec; 20(6): 708-14. Epub 2009 Oct 31
Непатентный документ 3: Antibody structure, instability, and formulation, J Pharm Sci, 2007, 96(1), 1-26
Непатентный документ 4: Formulation and delivery issues for monoclonal antibody therapeutics, Adv Drug Del Rev, 2006, 58(5-6), 686-706
Описание изобретения
[Проблемы, решаемые благодаря изобретению]
Цель настоящего изобретения состоит в обеспечении устойчивых высококонцентрированных содержащих антитела композиций, подходящих для подкожного введения.
[Средства решения проблем]
Для достижения вышеописанной цели авторы настоящего изобретения провели специальные исследования. В результате авторами настоящего изобретения было обнаружено, что значительно более высокий эффект стабилизации достигается благодаря применению кислой аминокислоты, аспарагиновой кислоты или глутаминовой кислоты в качестве разновидностей противоиона в гистидиновом буфере или трис(гидроксиметил)аминометановом буфере, т.е., гистидин-аспартатном буфере или гистидин-глутаматном буфере или трис(гидроксиметил)аминометан-аспартатном буфере или трис(гидроксиметил)аминометан-глутаматном буфере по сравнению с традиционными буферами для фармацевтических композиций, такими, как гистидин-гидрохлоридный буфер и гистидин-ацетатный буфер. Авторами настоящего изобретения также было обнаружено, что значительно более высокий эффект стабилизации достигается благодаря применению аргинин-аспартата или аргинин-глутамата в качестве стабилизатора, т.е., благодаря применению кислой аминокислоты, аспарагиновой кислоты или глутаминовой кислоты как разновидности противоиона к основной аминокислоте, такой, как аргинин, которая применяется в качестве стабилизатора, по сравнению с традиционными стабилизаторами для фармацевтических композиций, такими, как аргинин гидрохлорид. Таким образом, авторами настоящего изобретения было обнаружено, что устойчивые высококонцентрированные содержащие антитела жидкие композиции могут быть получены путем их добавления в качестве стабилизатора, и, таким образом, было выполнено настоящее изобретение.
Конкретно настоящее изобретение обеспечивает:
[1] устойчивую содержащую антитело композицию, включающую основную аминокислоту-аспартат или основную аминокислоту-глутамат;
[2] композицию [1], включающую гистидин-аспартатный буфер или гистидин-глутаматный буфер, причем основной аминокислотой является гистидин;
[3] композицию [1], включающую аргинин-аспартат или аргинин-глутамат, причем основной аминокислотой является аргинин;
[4] устойчивую содержащую антитело композицию, включающую гистидин-аспартатный буфер или гистидин-глутаматный буфер и аргинин-аспартат или аргинин-глутамат;
[5] устойчивую содержащую антитело композицию, включающую трис(гидроксиметил)аминометан-аспартатный буфер или трис(гидроксиметил)аминометан-глутаматный буфер;
[6] устойчивую содержащую антитело композицию, включающую трис(гидроксиметил)аминометан-аспартатный буфер и трис(гидроксиметил)аминометан-глутаматный буфер;
[7] композицию в соответствии с любым из пунктов с [1] по [6], которая по сути не содержат иона хлорида и ион ацетата;
[8] композицию в соответствии с любым из пунктов с [1] по [7], которая дополнительно включает сахар;
[9] композицию в соответствии с любым из пунктов с [1] по [8], причем антитело является гуманизированным антителом или человеческим антителом;
[10] композицию в соответствии с любым из пунктов с [1] по [9], причем антитело было модифицировано для обеспечения изоэлектрической точки (pI) от 5 до 8;
[11] композицию в соответствии с любым из пунктов с [1] по [10], причем концентрация антитела составляет 50 мг/мл или более;
[12] композицию в соответствии с любым из пунктов с [1] по [10], причем концентрация антитела составляет от 50 до 250 мг/мл;
[13] композицию в соответствии с любым из пунктов с [1] по [12], которая является жидкой композицией;
[14] композицию в соответствии с [13], причем вязкость жидкой композиции составляет 30 мПа⋅с или менее;
[15] композицию в соответствии с [13] или [14], причем жидкая композиция является устойчивой при температуре от 2°С до 8°С в течение как минимум шести месяцев;
[16] композицию в соответствии с любым из пунктов с [13] по [15], которая не подвергалась лиофилизации во время приготовления композиции;
[17] композицию в соответствии с любым из пунктов с [13] по [16], которую хранят в замороженном виде при температуре от -30°С до -10°С;
[18] композицию в соответствии с любым из пунктов с [1] по [12], причем композиция является лиофилизированной композицией;
[19] композицию в соответствии с любым из пунктов с [2], [4] и с [7] по [18], причем концентрация буфера составляет от 5 до 100 мМ;
[20] композицию в соответствии с любым из пунктов с [3] и с [7] по [19], причем концентрация аргинина составляет от 5 до 300 мМ;
[21] композицию в соответствии с любым из пунктов с [1] по [20], причем антитело является антителом к рецептору IL-6;
[22] композицию в соответствии с любым из пунктов с [2], [4] и с [7] по [21], причем буфер по сути включает только аминокислоту(ы);
[23] композицию в соответствии с любым из пунктов с [1] по [22], которая предназначается для подкожного введения;
[24] способ подавления образования агрегатов во время хранения высококонцентрированной содержащей антитело композиции в замороженном виде путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу в композиции;
[25] способ подавления образования агрегатов во время хранения высококонцентрированной содержащей антитело композиции в виде жидкости путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу в композиции;
[26] способ подавления образования агрегатов во время хранения высококонцентрированной содержащей антитело композиции в замороженном виде путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к стабилизатору в композиции; и
[27] способ подавления образования агрегатов во время хранения высококонцентрированной содержащей антитело композиции в виде жидкости путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к стабилизатору в композиции.
Кроме того, настоящее изобретение касается применения основной аминокислоты-аспартата или основной аминокислоты-глутамата в производстве устойчивой содержащей антитело композиции; и аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу или стабилизатору в высококонцентрированной содержащей антитело композиции, которые применяются согласно способу подавления агрегации во время хранения композиции в замороженном виде или в виде жидкости.
[Эффект изобретения]
Настоящее изобретение обеспечивает содержащие антитела композиции, обладающие превосходной устойчивостью. Настоящее изобретение также может обеспечивать высококонцентрированные содержащие антитела композиции путем подавления образования агрегатов в замороженных и жидких композициях. Высококонцентрированные содержащие антитела композиции согласно настоящему изобретению могут сохранять устойчивость при хранении в жидком или замороженном состоянии в течение длительного периода. Кроме того, композиции согласно настоящему изобретению обладают повышенной устойчивостью к нагрузкам при замораживании-оттаивании. Кроме того, в отношении осмотического давления стабилизация может достигаться без повышения осмотического давления путем применения аспарагиновой кислоты и глутаминовой кислоты вместо традиционно применяемых хлористоводородной кислоты и уксусной кислоты в качестве разновидности противоиона к гистидину, аргинину или трис(гидроксиметил)аминометану. Преимущество состоит в достижении стабилизации без повышения осмотического давления с целью получения почти изотонических, устойчивых композиций, таких, как композиции для подкожного (SC) введения.
Краткое описание фигур
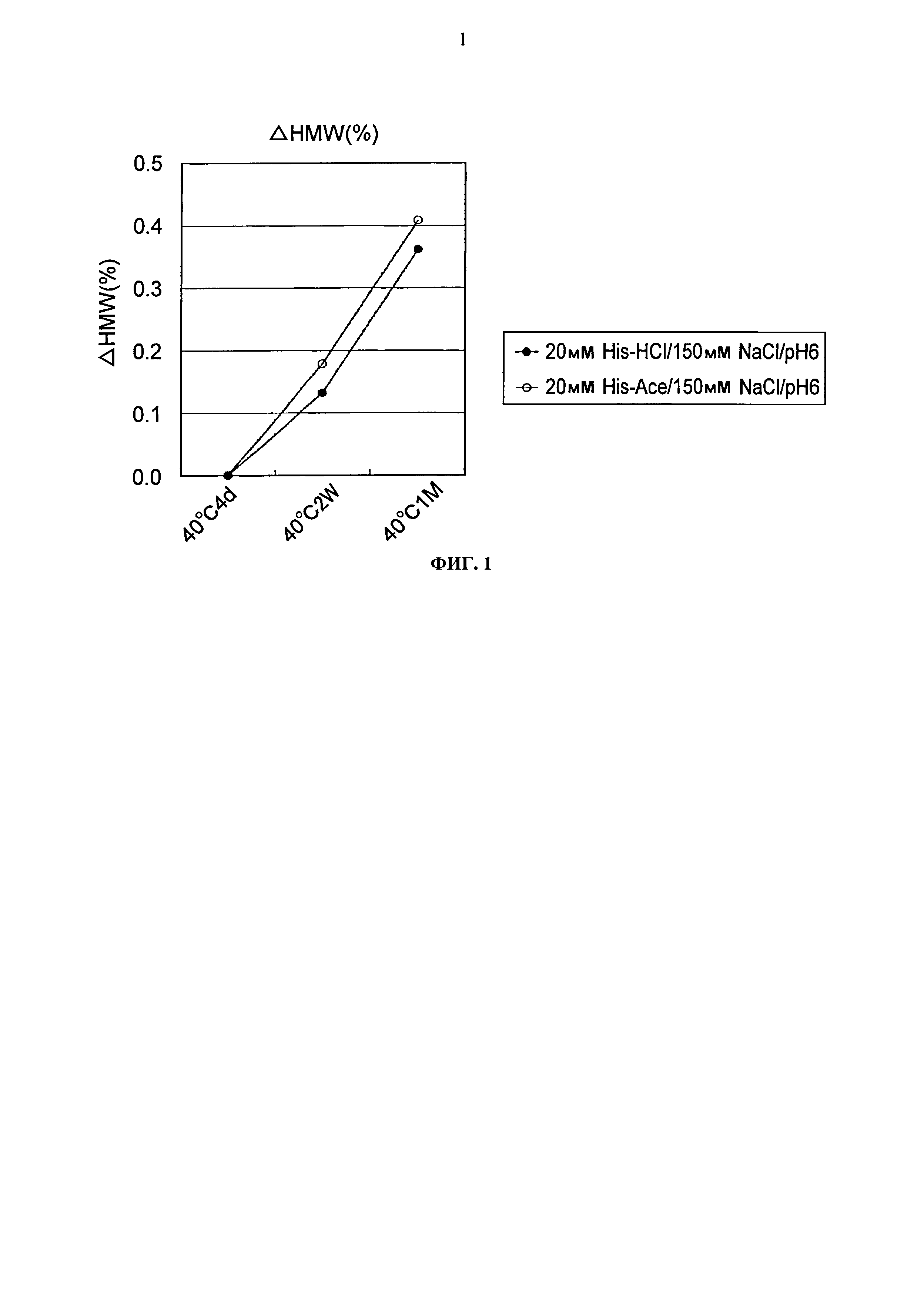
Фиг.1 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1 при 40°С на вертикальной оси.
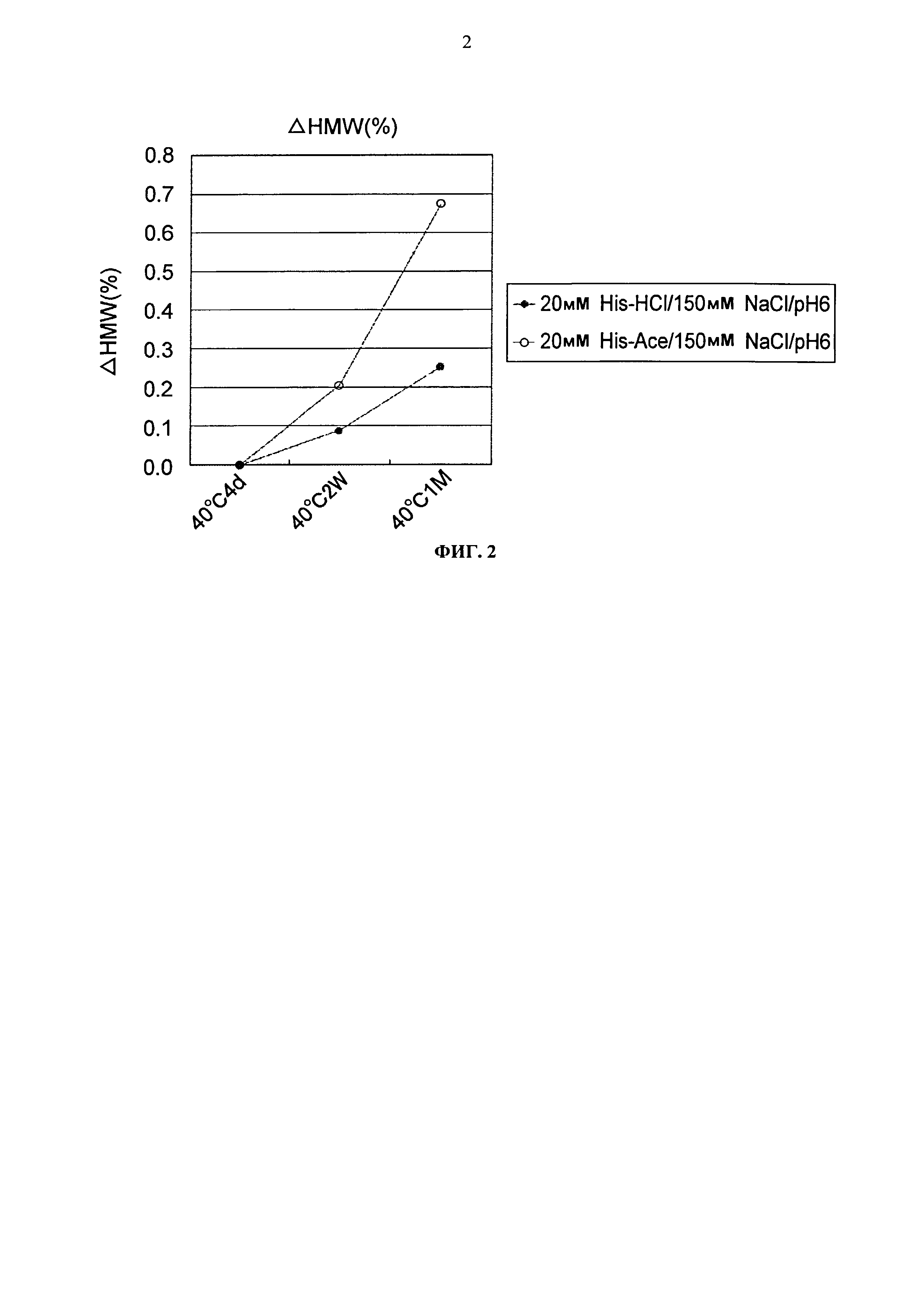
Фиг.2 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab2 при 40°С на вертикальной оси.
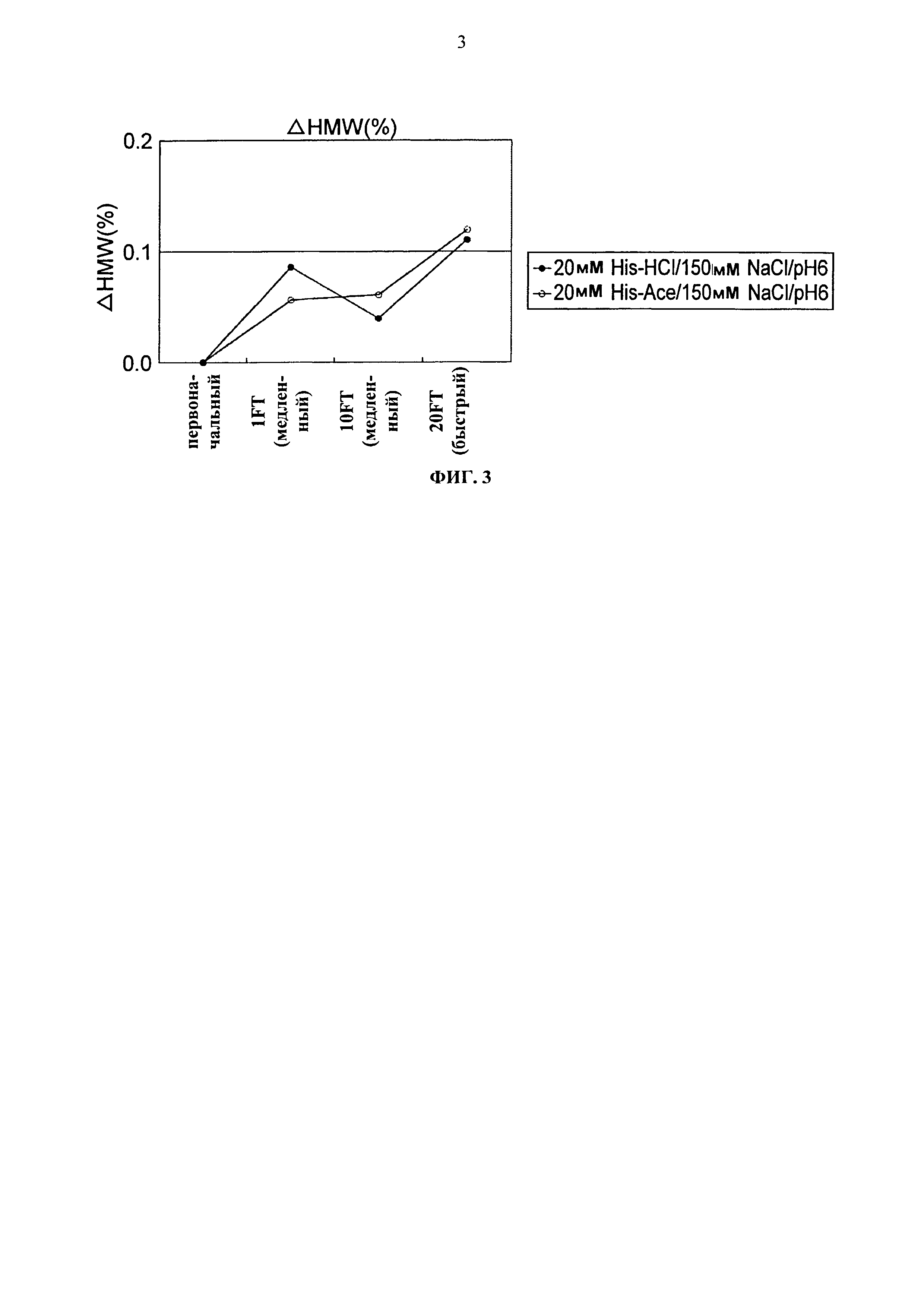
Фиг.3 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания Mab1 на вертикальной оси.
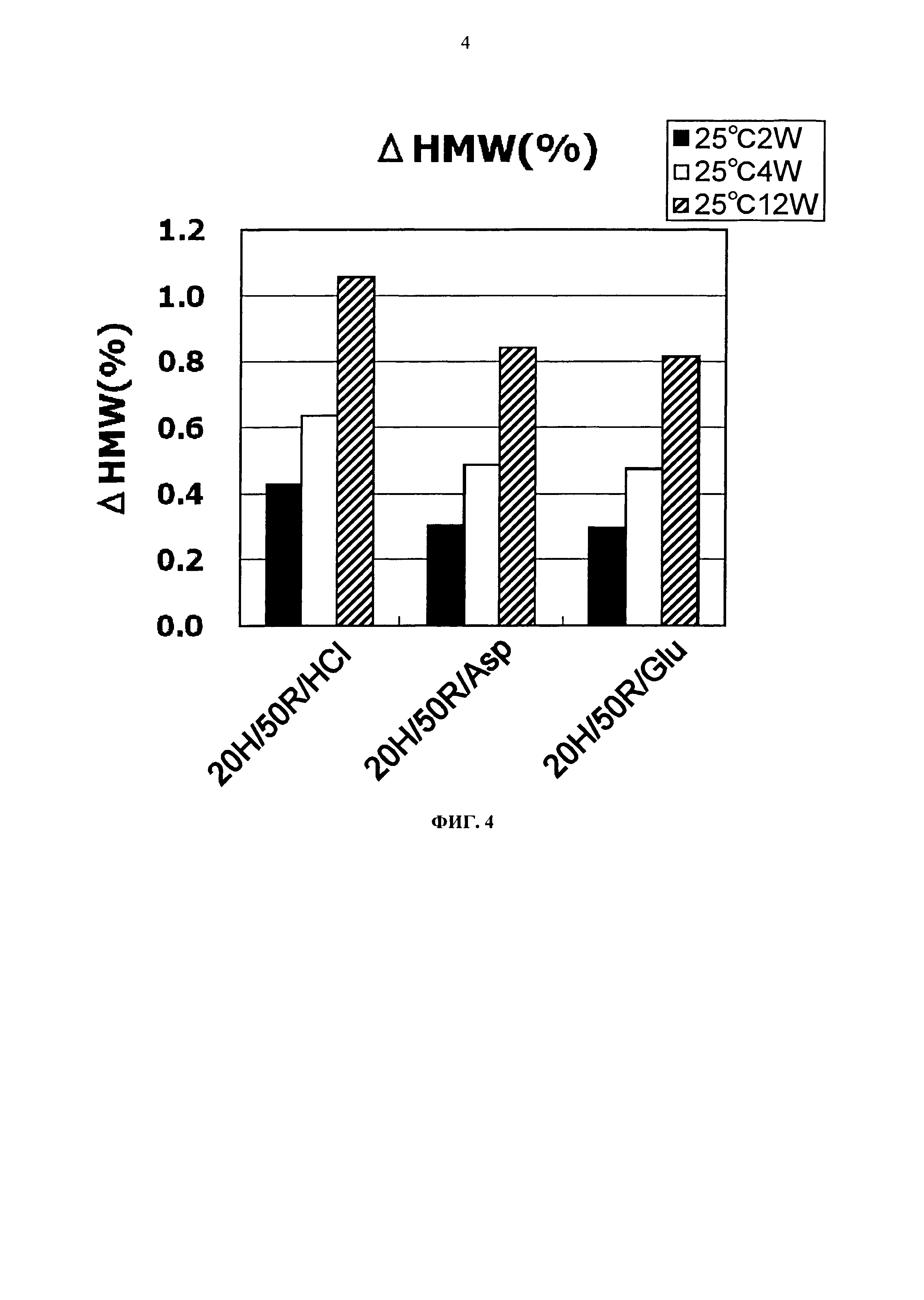
Фиг.4 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1 при 25°С на вертикальной оси.
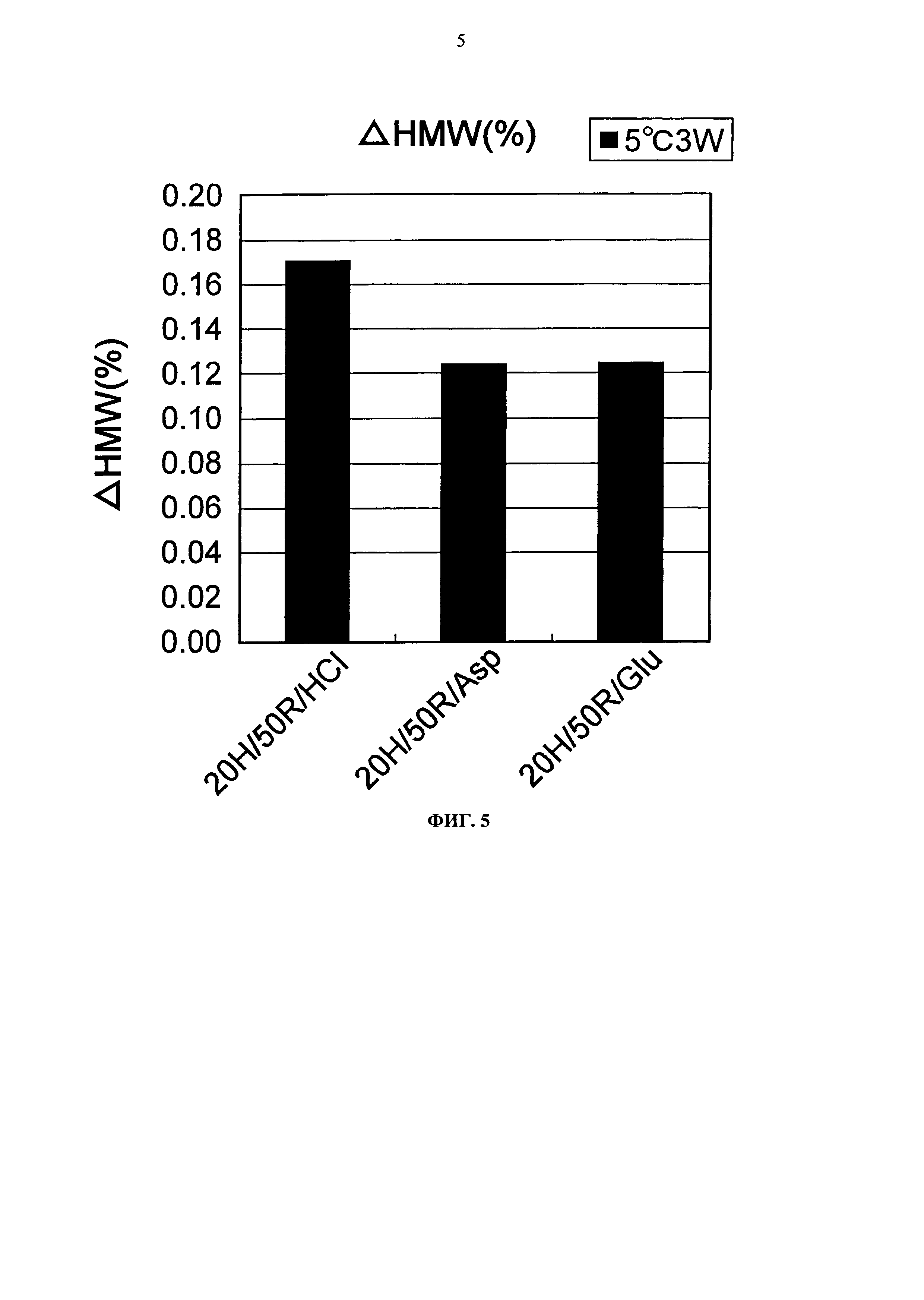
Фиг.5 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1 при 5°С на вертикальной оси.
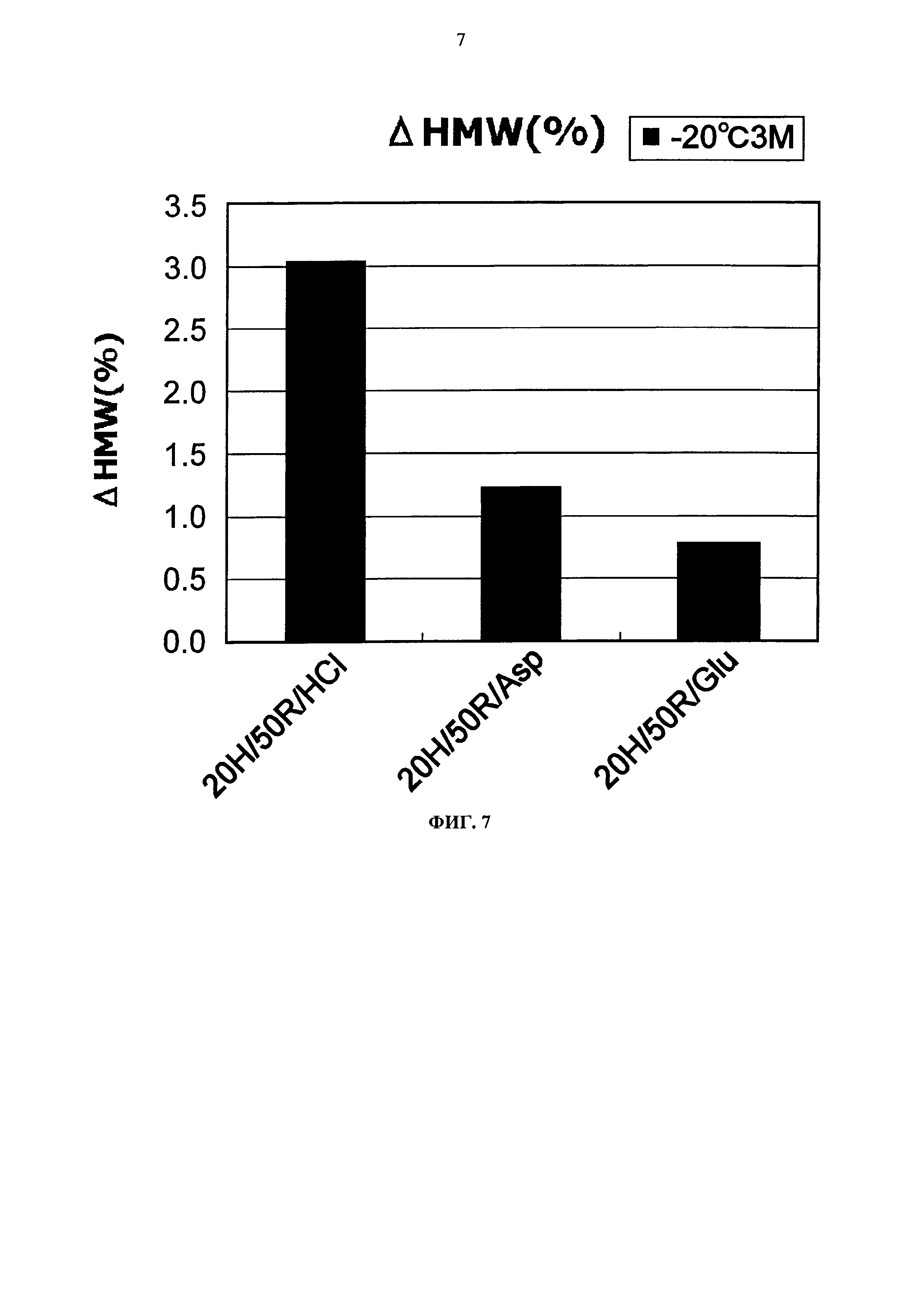
Фиг.6 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab1 на вертикальной оси.
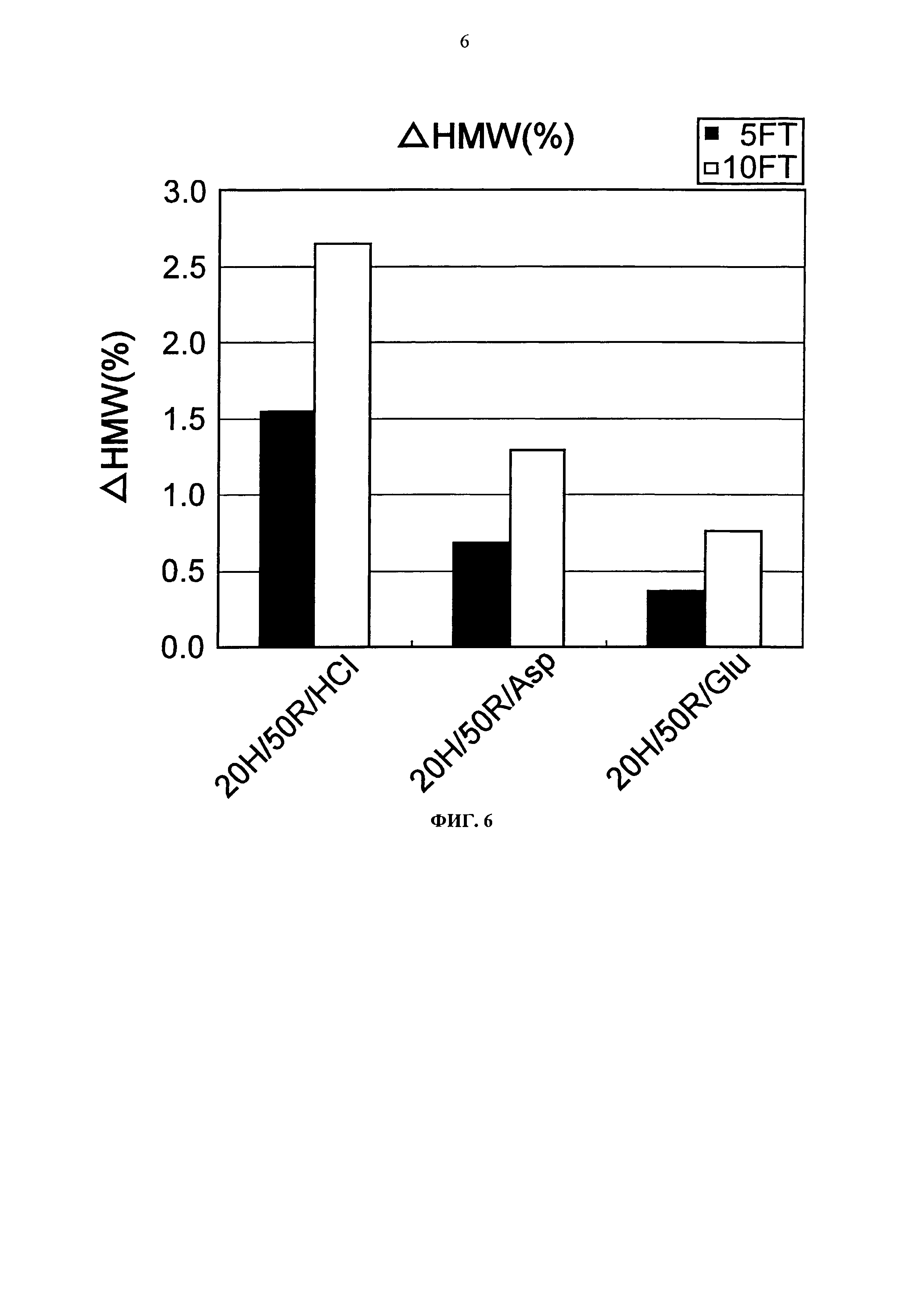
Фиг.7 представляет график, показывающий количество (%) агрегата после трех месяцев хранения Mab1 при -20°С на вертикальной оси.
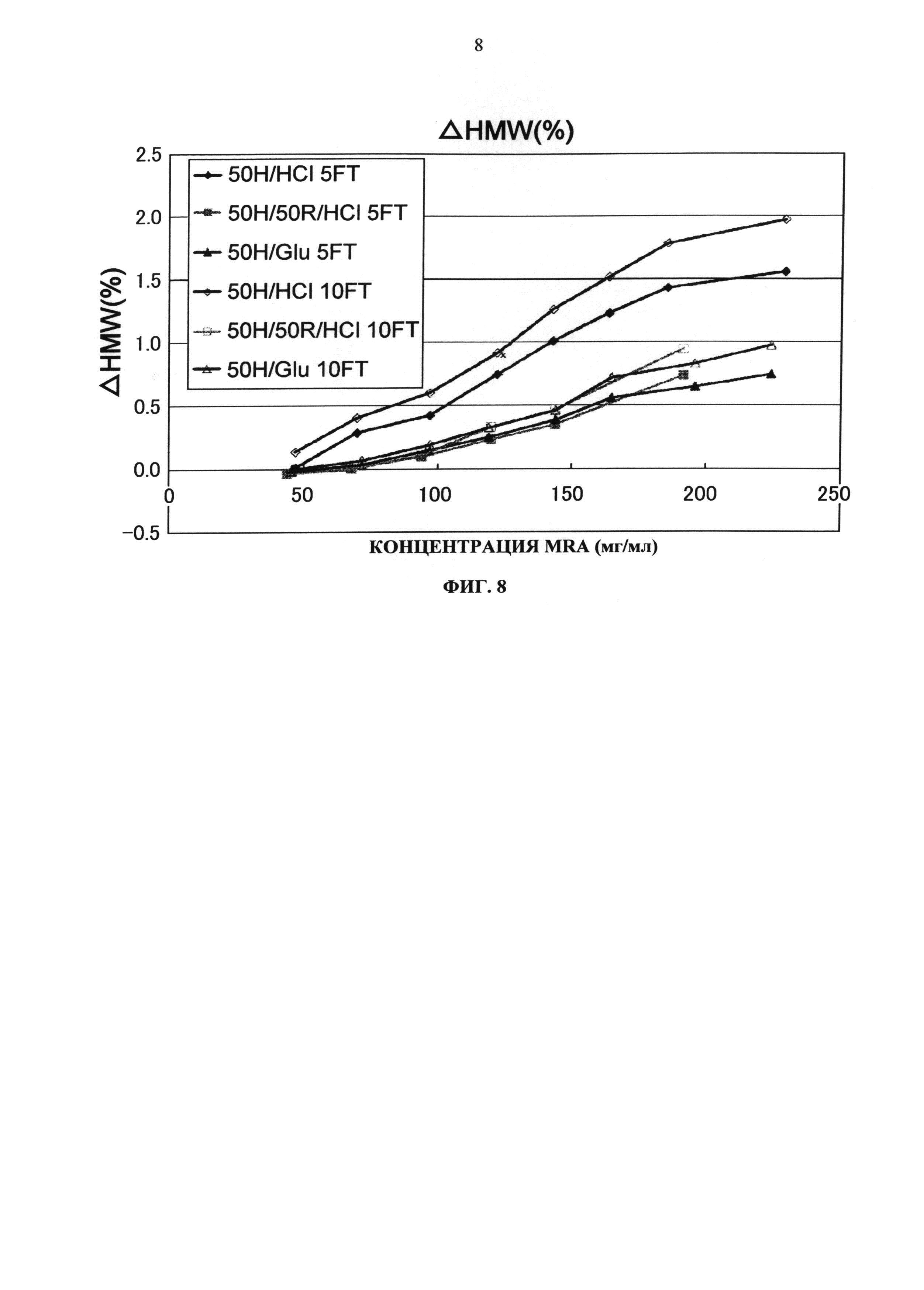
Фиг.8 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (-20°С до комнатной температуры) Mab2 на вертикальной оси.
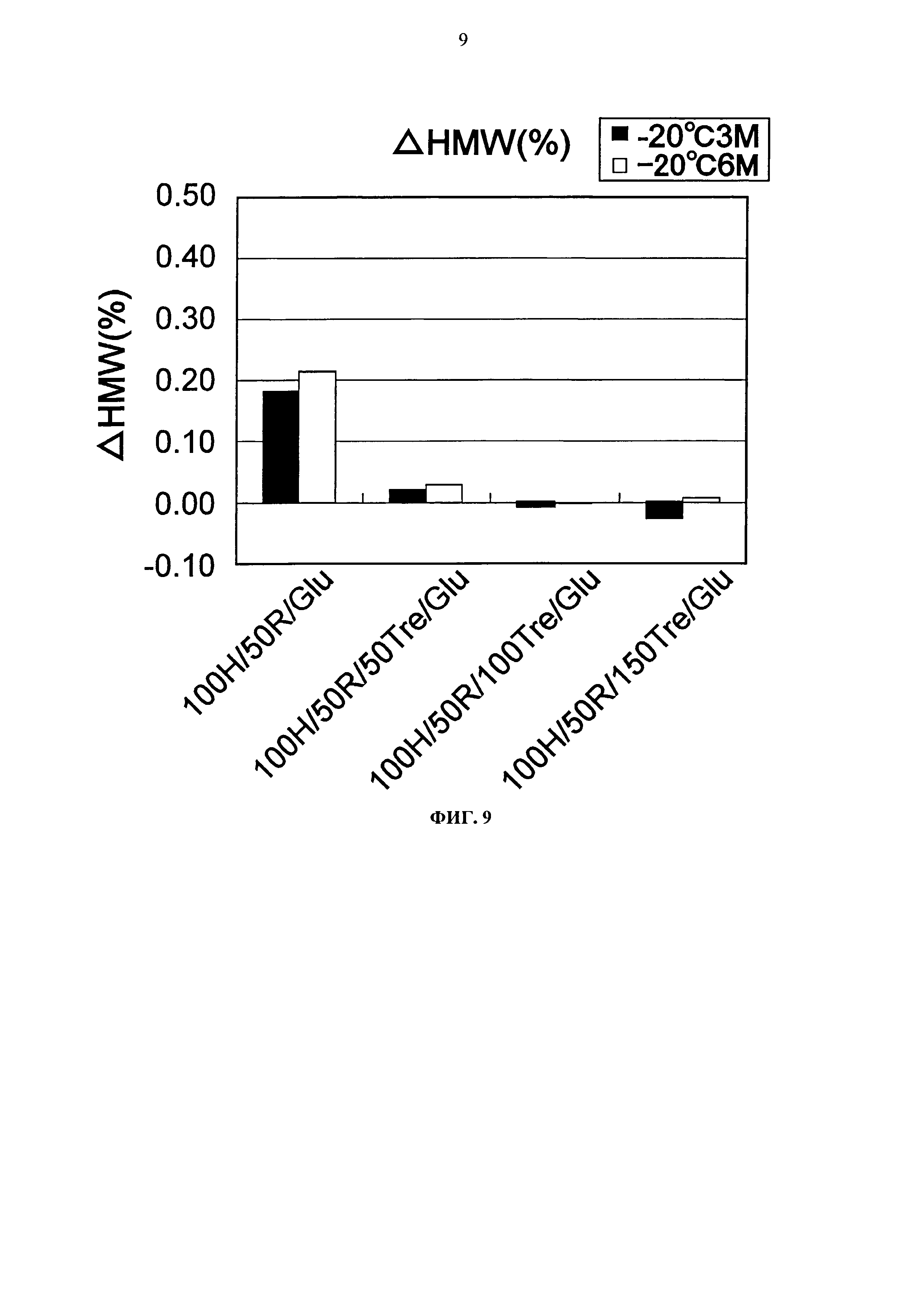
Фиг.9 представляет график, показывающий количество (%) агрегата после хранения Mab1 при -20°С на вертикальной оси.
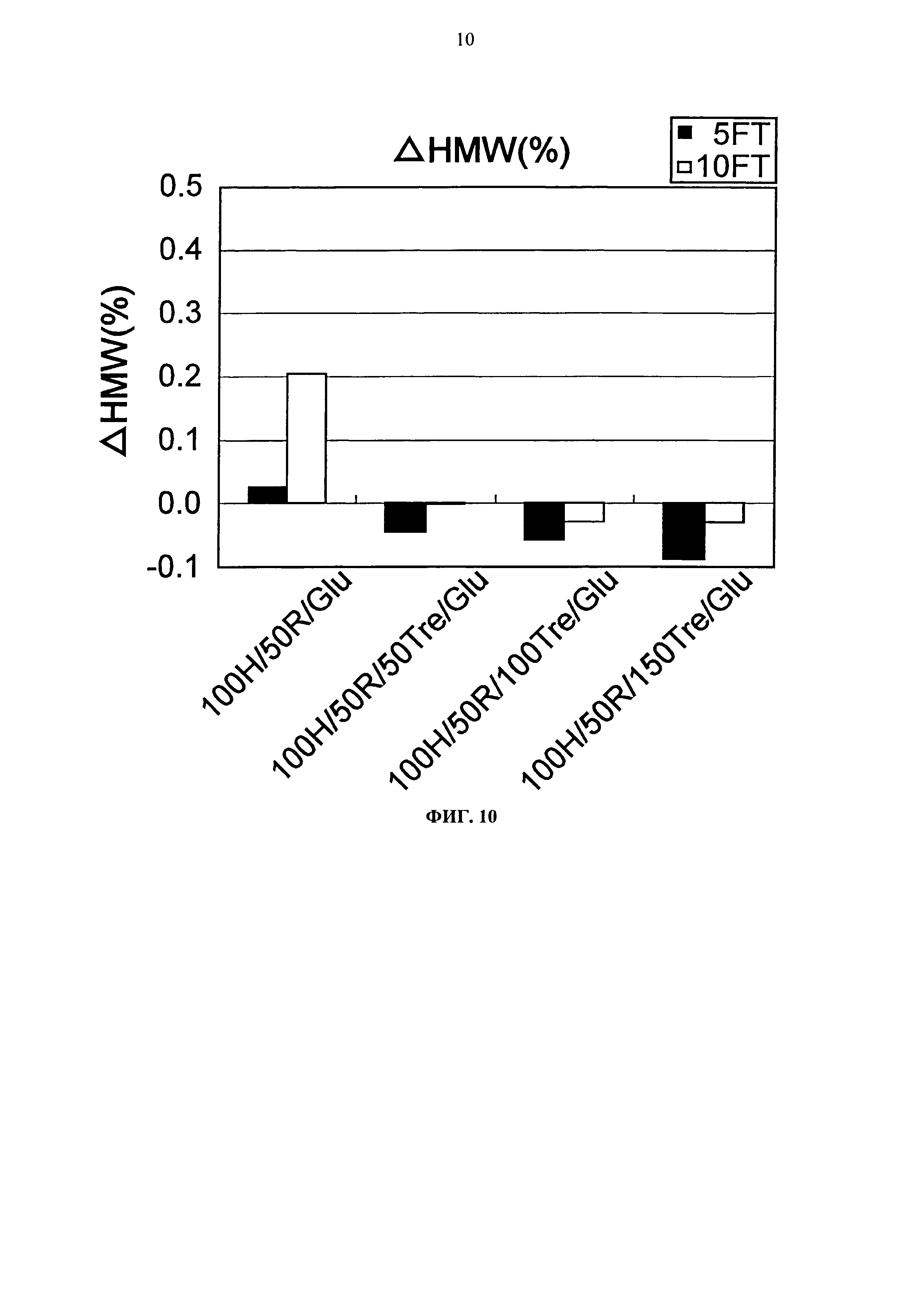
Фиг.10 представляет график, показывающий количество (%) агрегата после замораживания-оттаивания (-20°С до комнатной температуры) Mab1 на вертикальной оси.
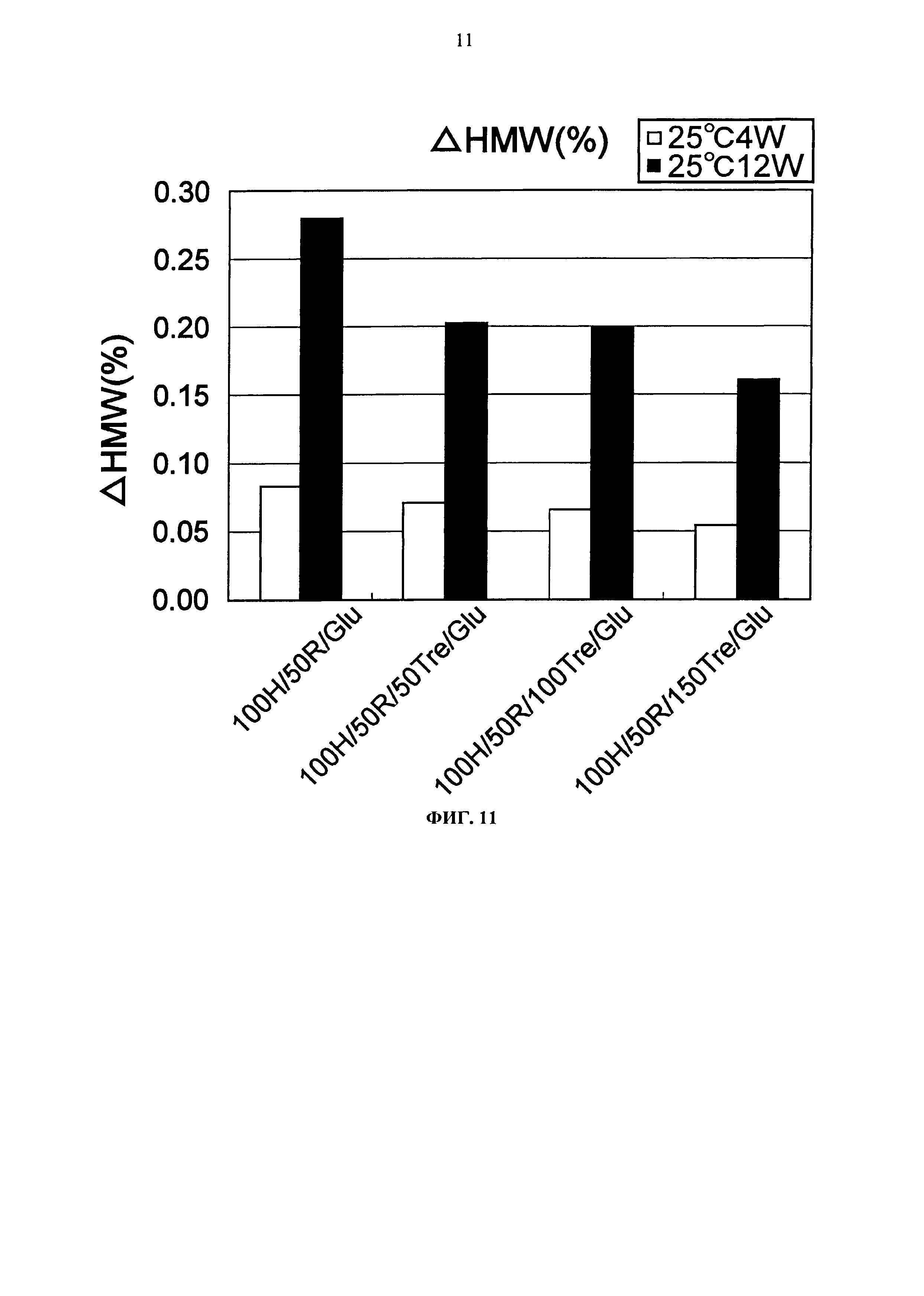
Фиг.11 представляет график, показывающий количество (%) агрегата после трех месяцев хранения Mab1 при 25°С на вертикальной оси.
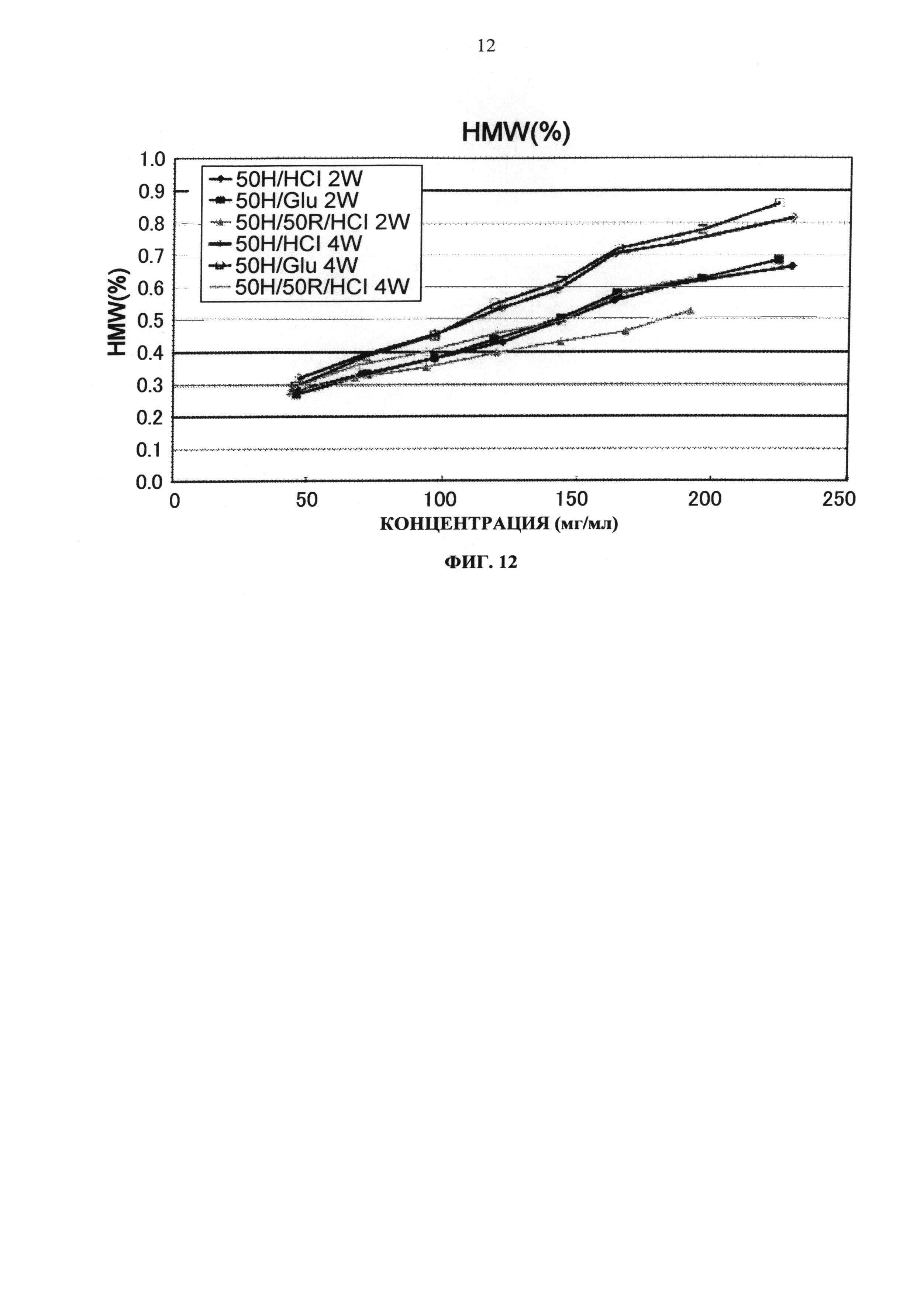
Фиг.12 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab2 при 25°С на вертикальной оси.
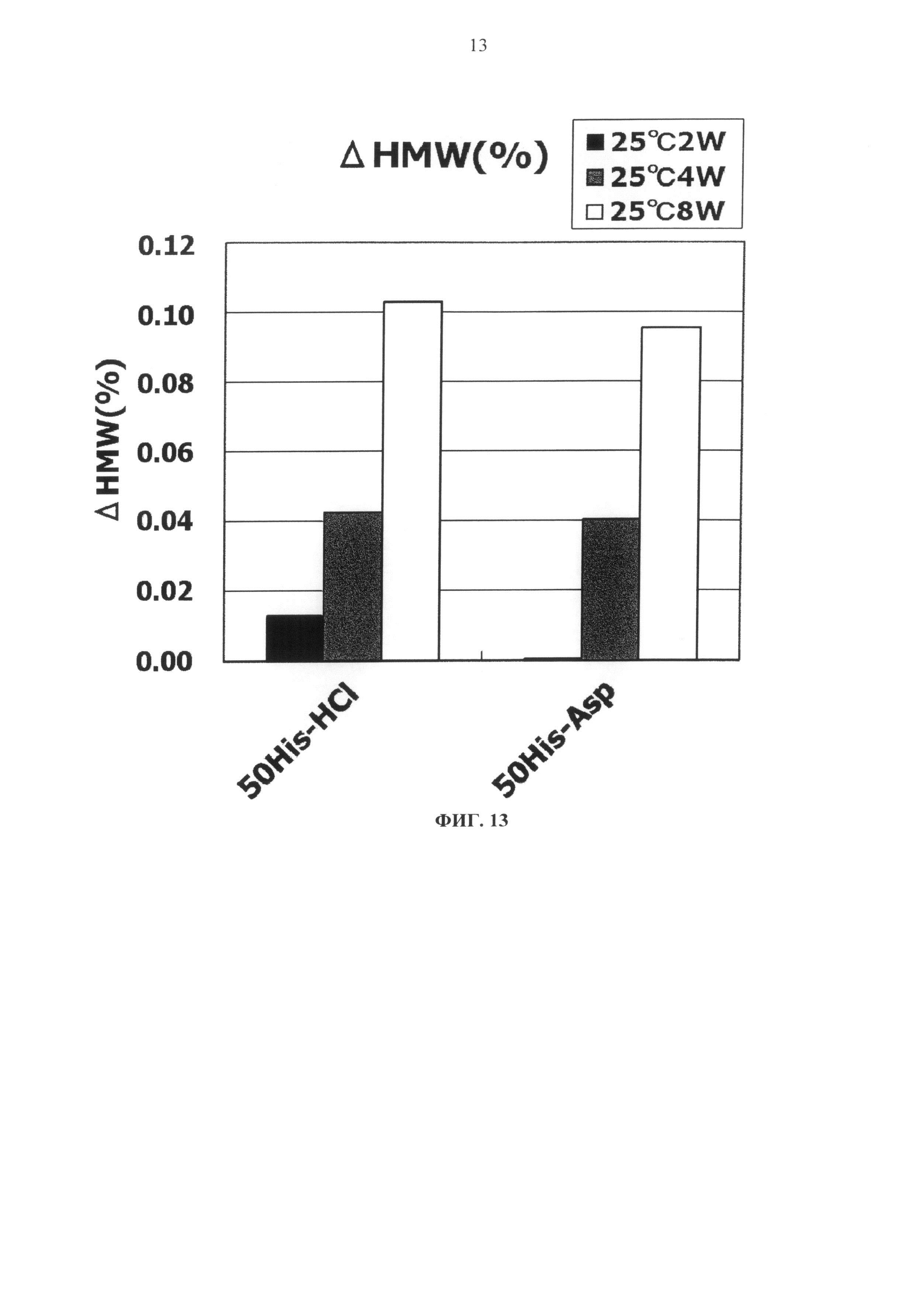
Фиг.13 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab3 при 25°С на вертикальной оси.
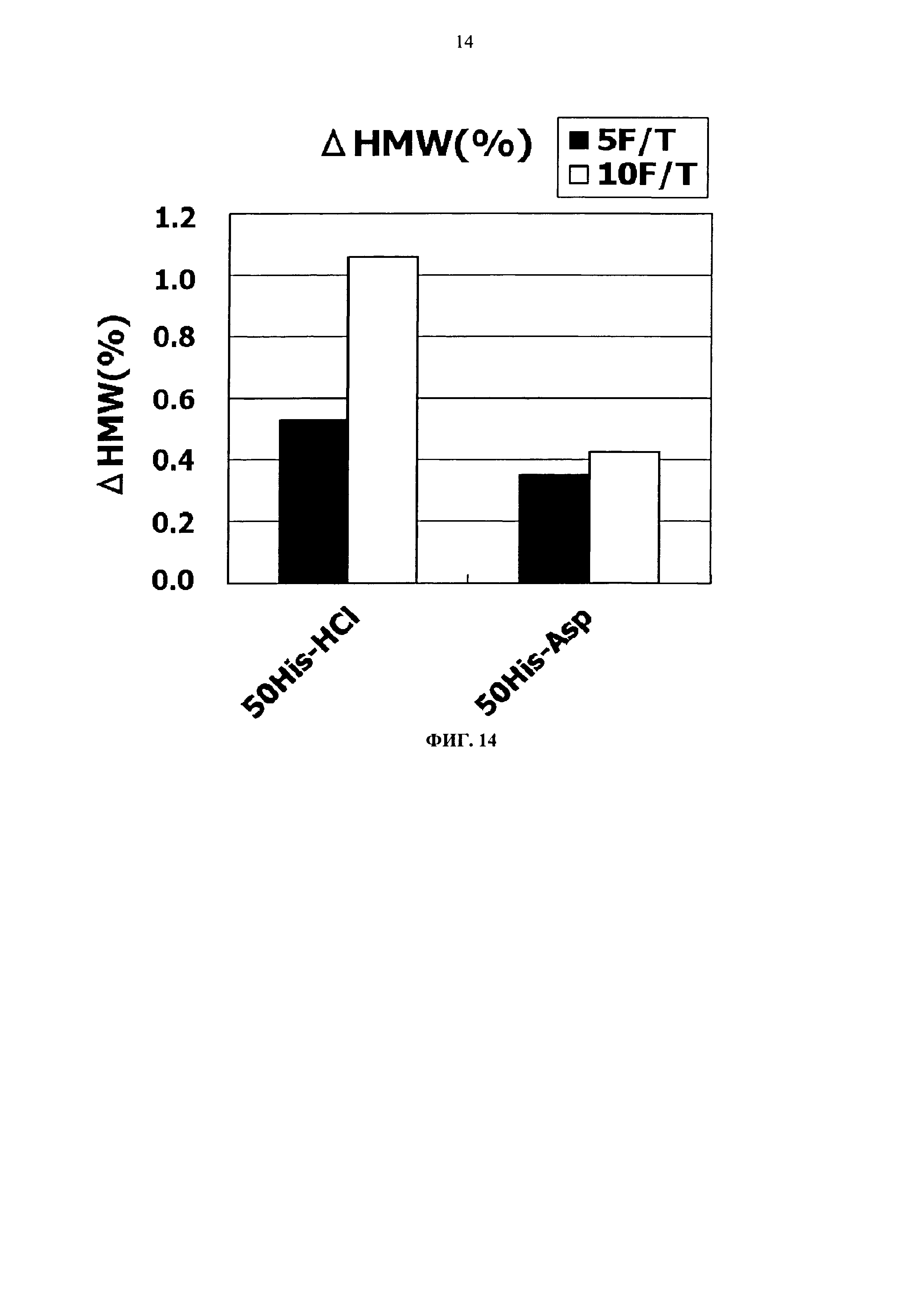
Фиг.14 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab3 на вертикальной оси.
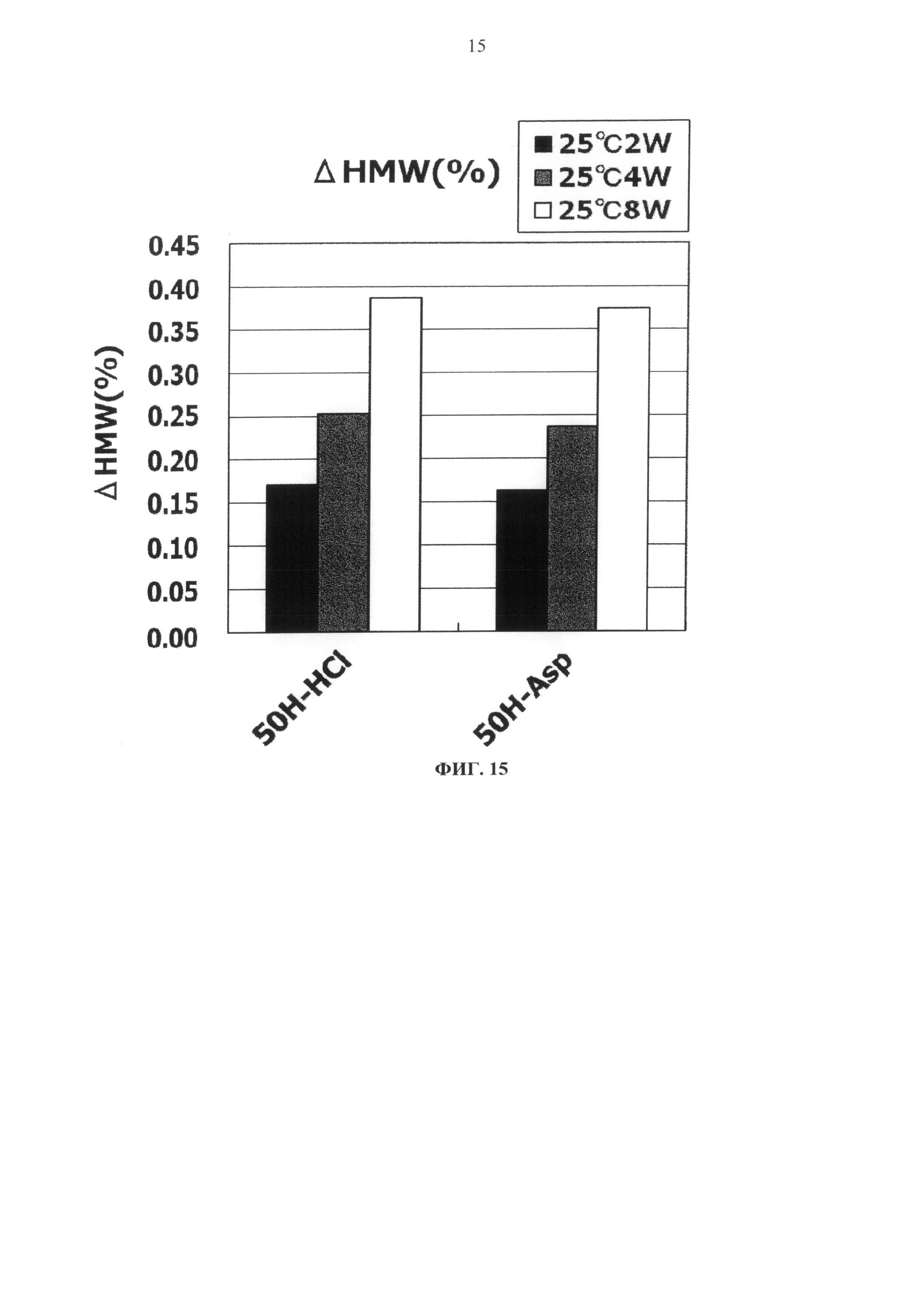
Фиг.15 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab4 при 25°С на вертикальной оси.
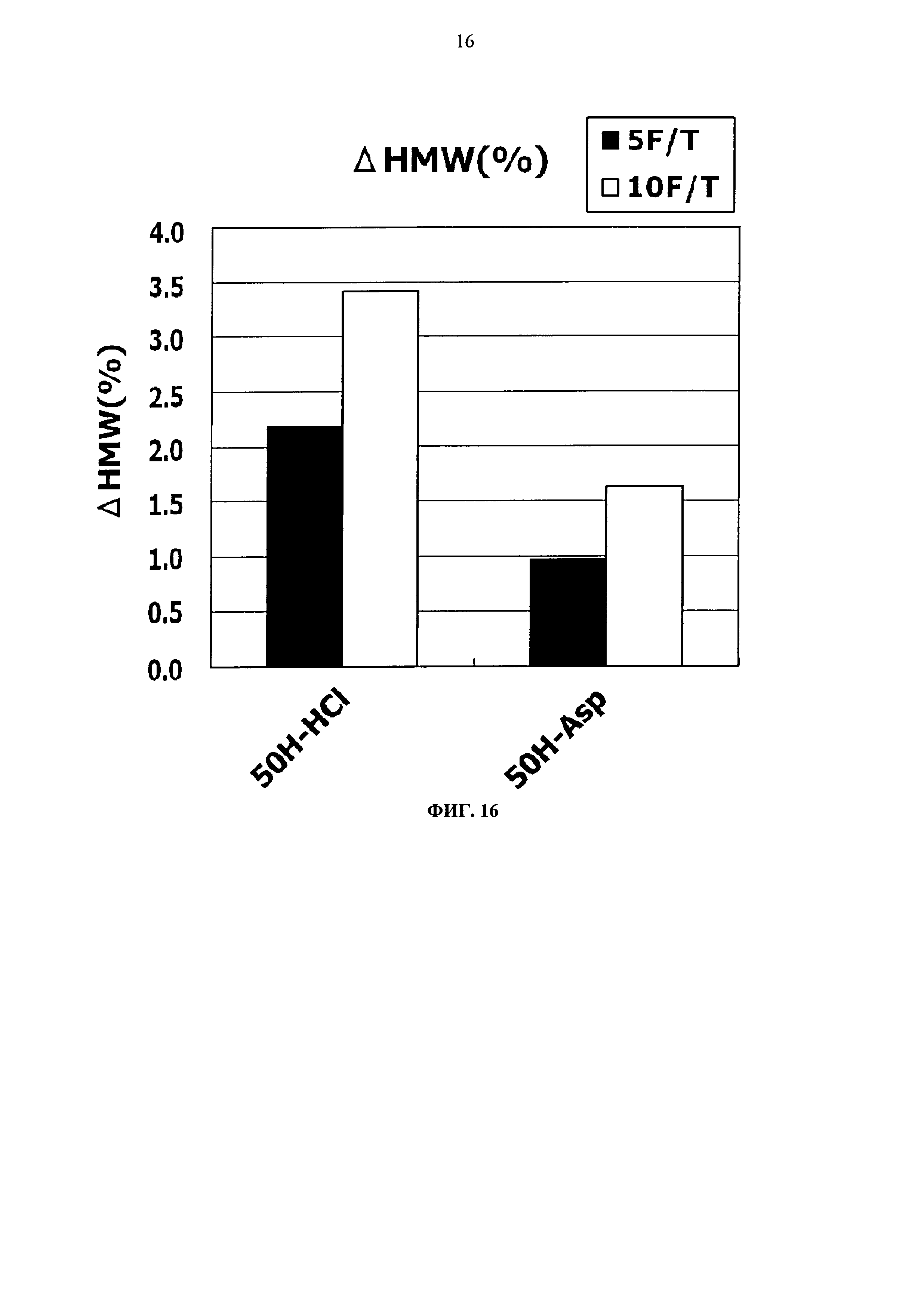
Фиг.16 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab4 на вертикальной оси.
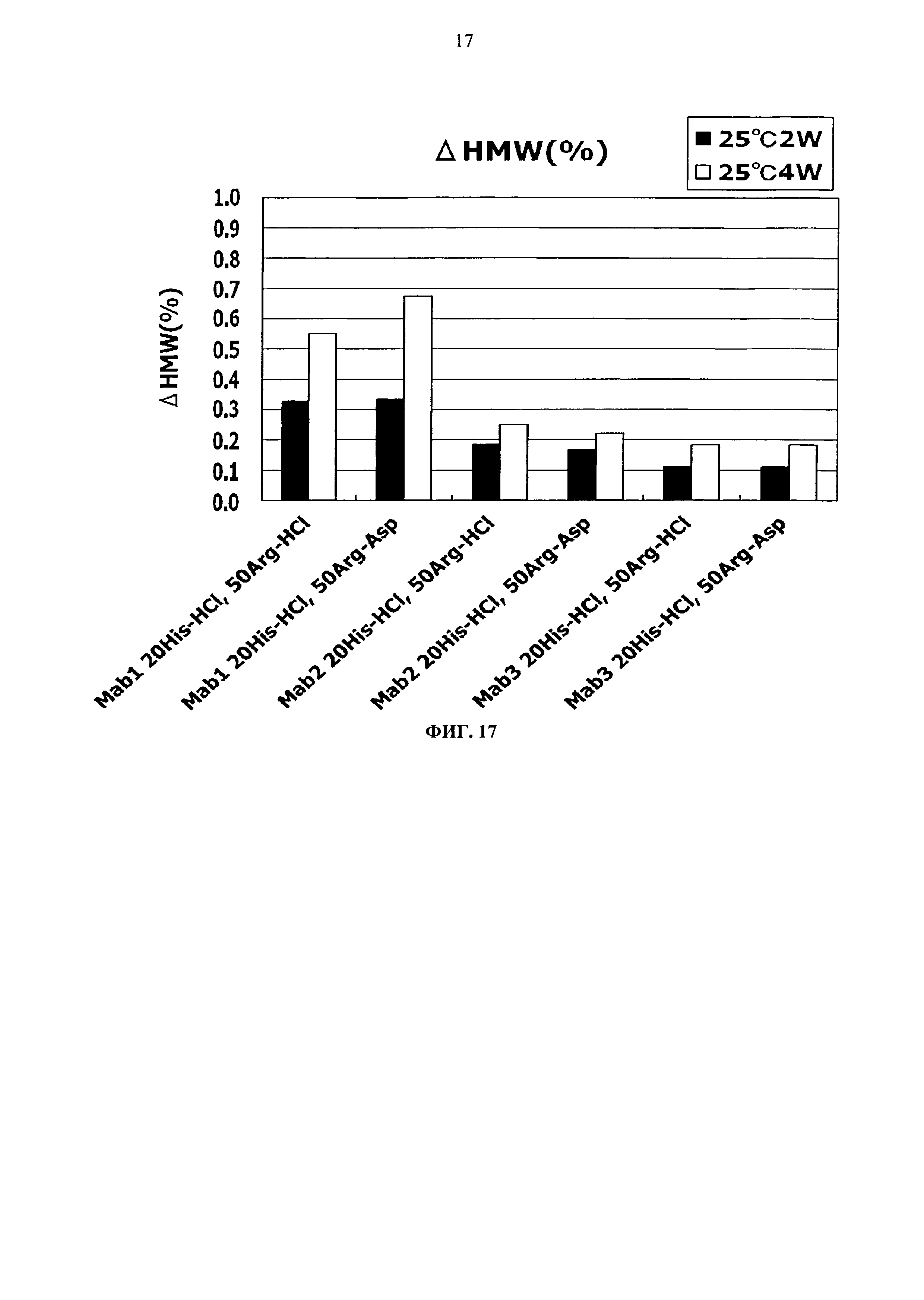
Фиг.17 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1, Mab2 и Mab3 при 25°С на вертикальной оси.
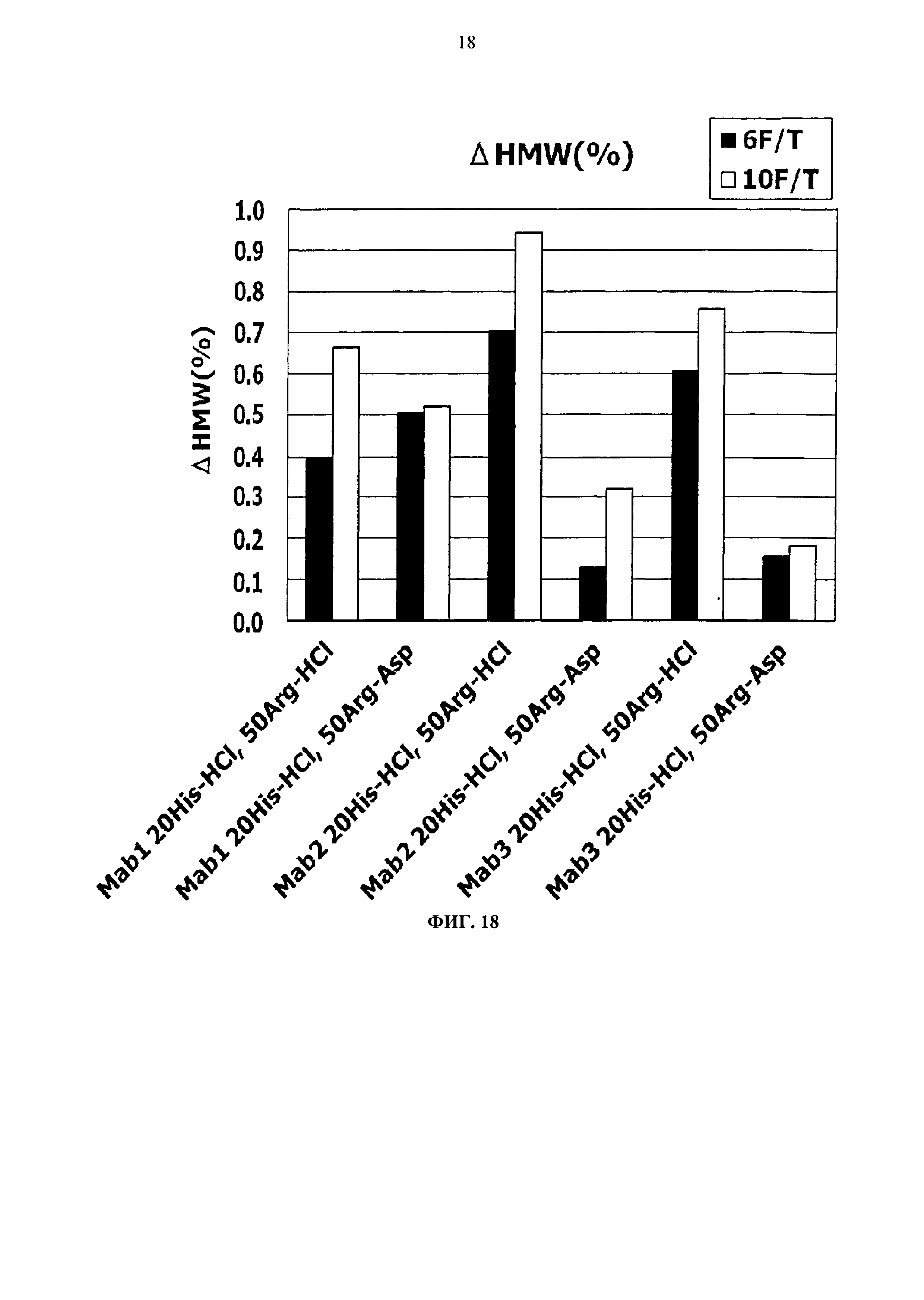
Фиг.18 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab1, Mab2 и Mab3 на вертикальной оси.
Фиг.19 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab5 при 25°С на вертикальной оси.
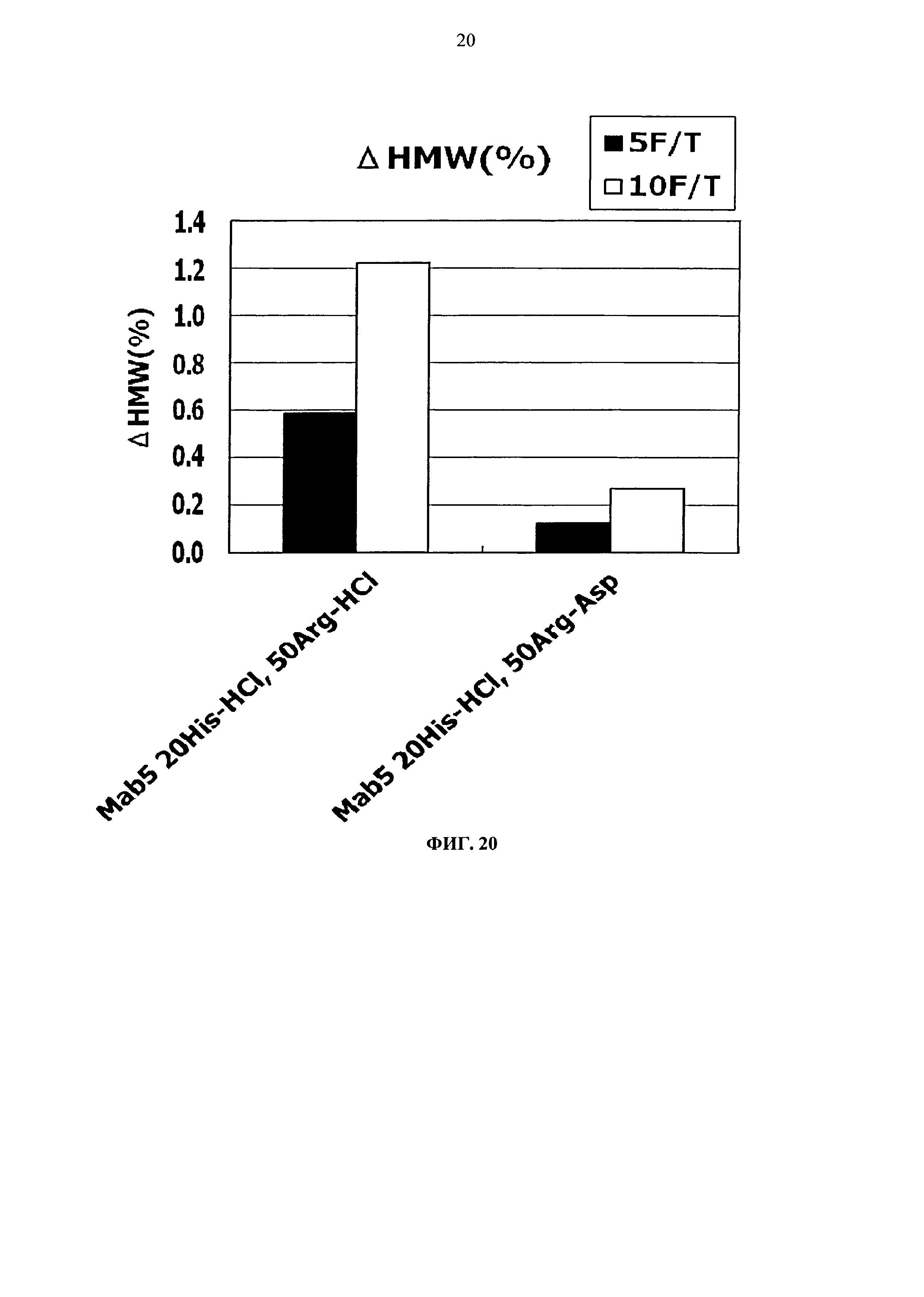
Фиг.20 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab5 на вертикальной оси.
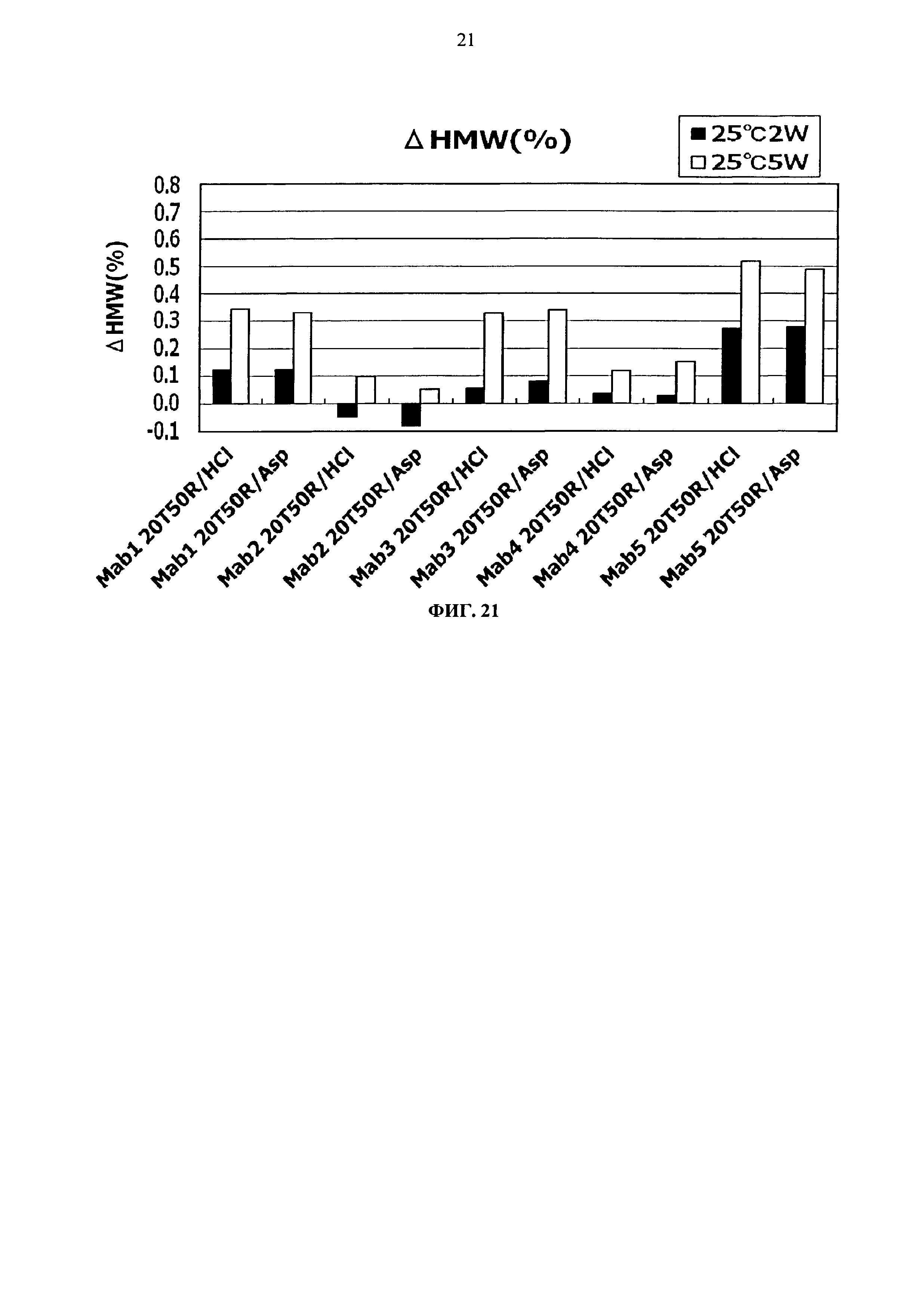
Фиг.21 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1, Mab2, Mab3 Mab4, и Mab5 при 25°С на вертикальной оси.
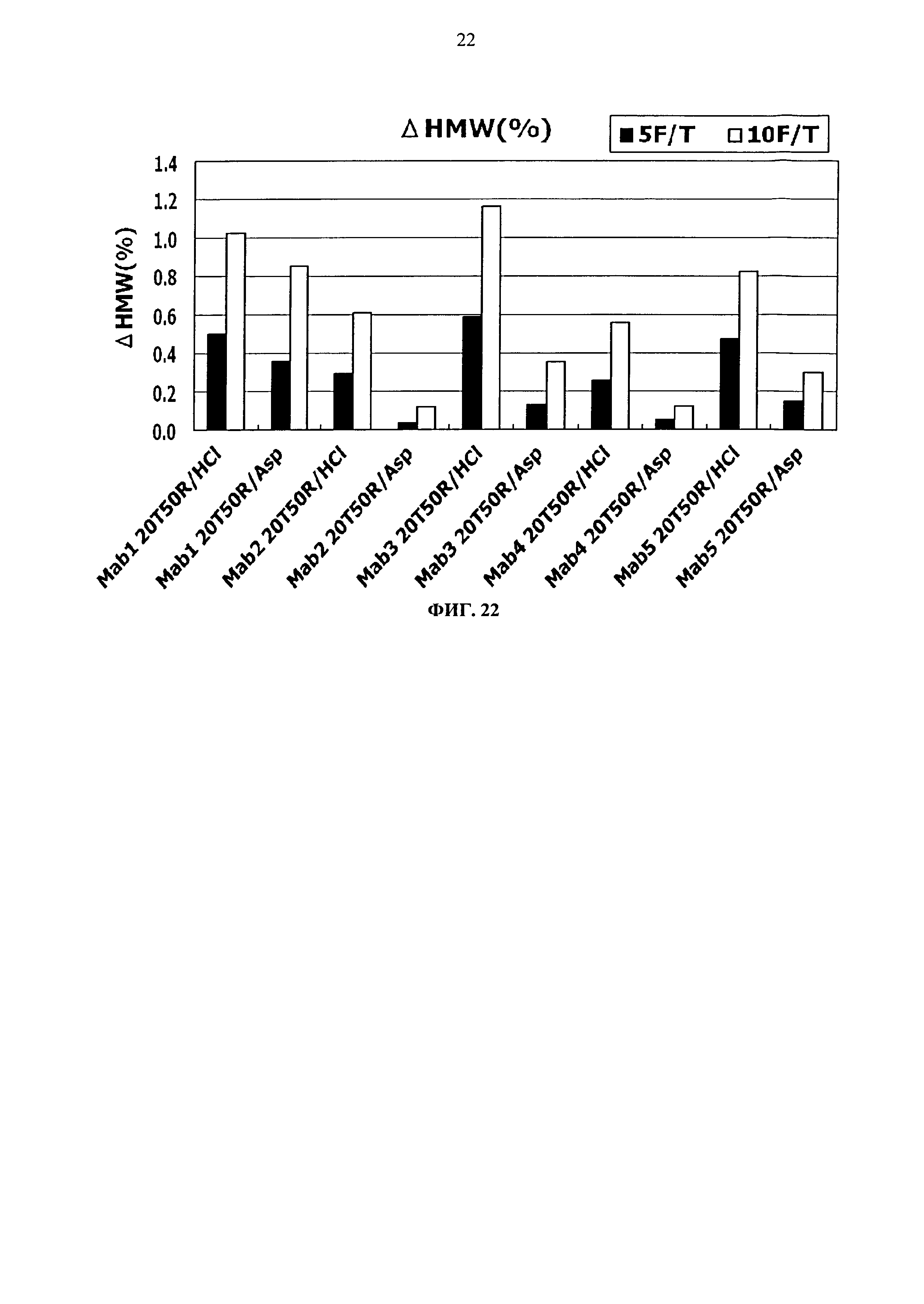
Фиг.22 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab1, Mab2, Mab3, Mab4 и Mab5 на вертикальной оси.
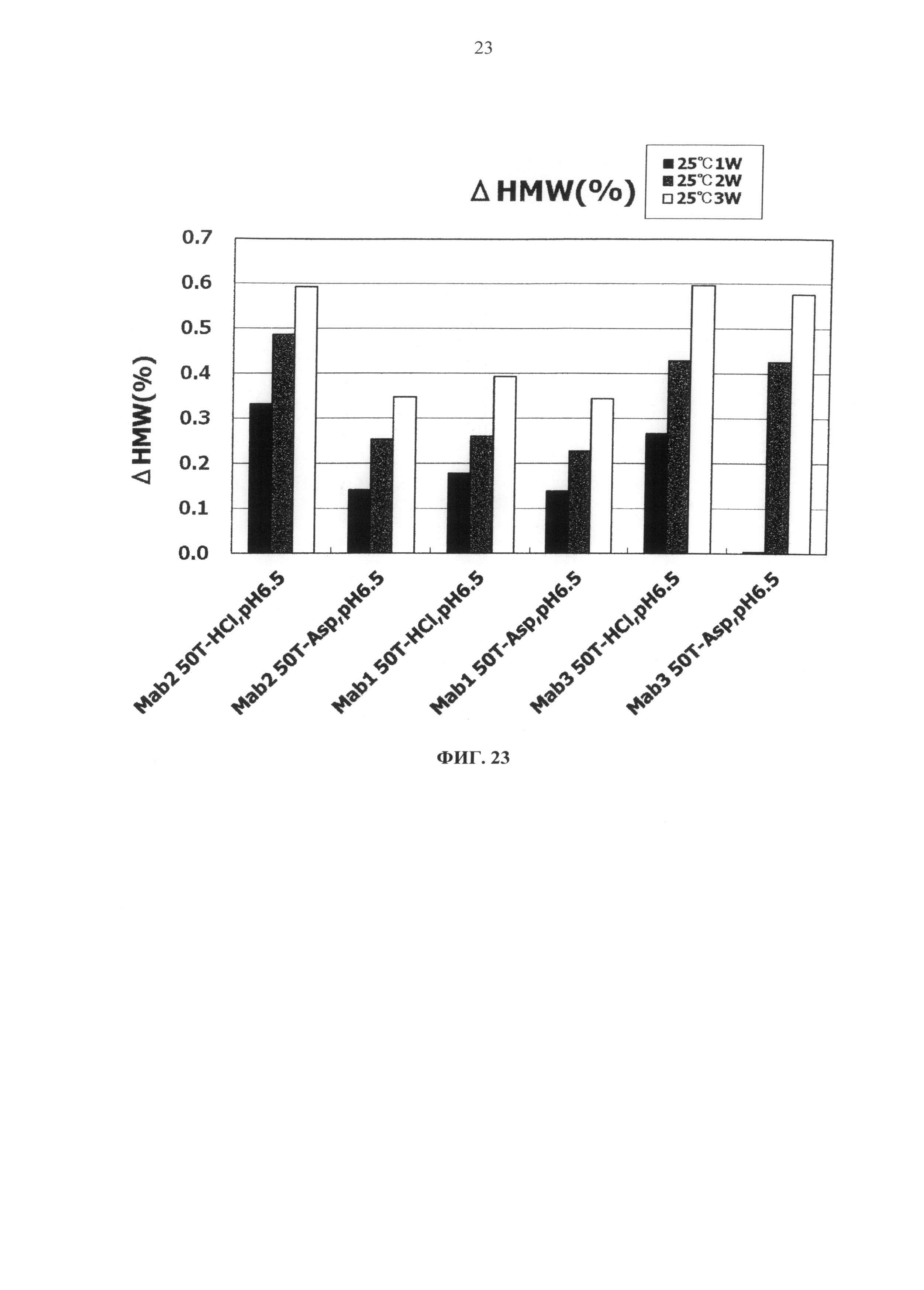
Фиг.23 представляет график зависящих от времени изменений количества (%) агрегата во время хранения Mab1, Mab2 и Mab3 при 25°С на вертикальной оси.
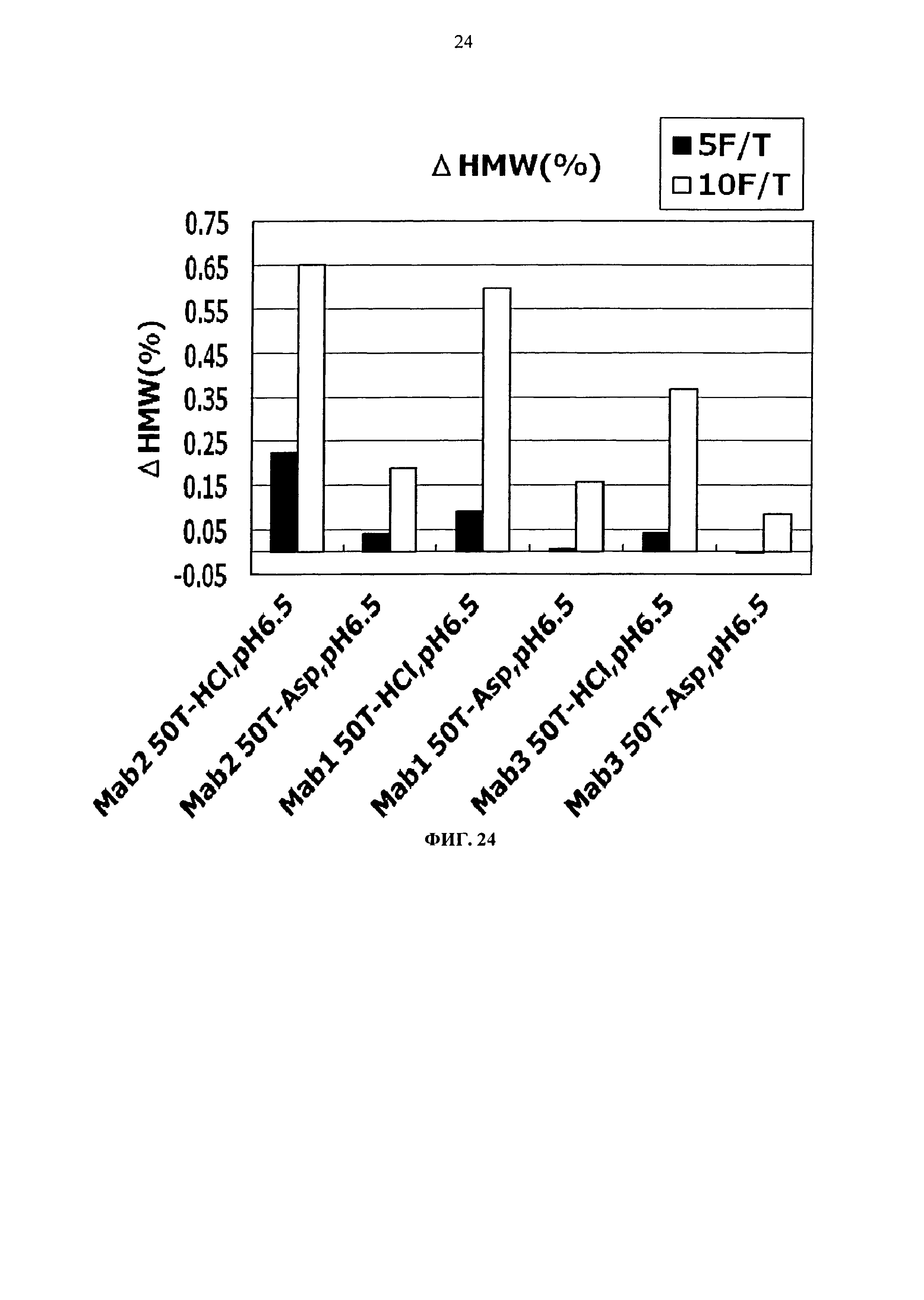
Фиг.24 представляет график зависящих от времени изменений количества (%) агрегата во время замораживания-оттаивания (от -20°С до комнатной температуры) Mab1, Mab2 и Mab3 на вертикальной оси.
Способ осуществления изобретения
Далее настоящее изобретение описывается более подробно.
Настоящее изобретение обеспечивает устойчивые содержащие антитела композиции, включающие основную аминокислоту-аспартат или основную аминокислоту-глутамат. Согласно настоящему изобретению, к основным аминокислотам относятся, например, гистидин, аргинин и лизин. Кроме того, согласно настоящему изобретению, буферы основных аминокислот, такие, как трис(гидроксиметил)аминометан, также включаются в определение основных аминокислот согласно настоящему изобретению.
Так, настоящее изобретение обеспечивает устойчивые содержащие антитела композиции, включающие гистидин-аспартатный буфер или гистидин-глутаматный буфер, в которых основной аминокислотой является гистидин. Кроме того, настоящее изобретение обеспечивает устойчивые содержащие антитела композиции, включающие аргинин-аспартат или аргинин-глутамат в качестве стабилизатора, в которых основной аминокислотой является аргинин. Настоящее изобретение также обеспечивает устойчивые содержащие антитела композиции, включающие гистидин-аспартатный буфер или гистидин-глутаматный буфер и аргинин-аспартат или аргинин-глутамат. Кроме того, настоящее изобретение обеспечивает устойчивые содержащие антитела композиции, включающие трис(гидроксиметил)аминометан-аспартатный буфер или трис(гидроксиметил)аминометан-глутаматный буфер. Настоящее изобретение также обеспечивает устойчивые содержащие антитела композиции, включающие трис(гидроксиметил)аминометан-аспартатный буфер и трис(гидроксиметил)аминометан-глутаматный буфер. Содержащая антитела композиция согласно настоящему изобретению означает композицию, включающую антитело в качестве активного ингредиента и приготавливается в форме, обеспечивающей возможность введения животным, включая человека.
В контексте данного описания "устойчивая содержащая антитела композиция" означает композицию, в которой практически не образуются агрегаты белков, таких, как антитело, в частности, композицию, в которой деградация, например, образование нерастворимых и растворимых агрегатов, практически не происходит во время хранения в жидком или замороженном состоянии.
Концентрация антитела в композиции согласно настоящему изобретению особенно не ограничивается; однако композиция предпочтительно содержит высококонцентрированное антитело. Концентрация антитела предпочтительно составляет 50 мг/мл или более, более предпочтительно - 100 мг/мл или более, еще более предпочтительно - 120 мг/мл или более, еще более предпочтительно - 150 мг/мл или более, и еще более предпочтительно - 180 мг/мл или более. Конкретного верхнего предела концентрации антитела в композиции согласно настоящему изобретению не предусмотрено; однако предельное значение, как правило, составляет 250 мг/мл.
В отношении антител, используемых согласно настоящему изобретению, особенных ограничений нет, и главным условием является их связывание с нужным антигеном. Антитела могут быть поликлональными или моноклональными антителами; однако моноклональным антителам отдается предпочтение, поскольку они могут устойчиво вырабатываться как гомогенные антитела.
К моноклональным антителам, используемым согласно настоящему изобретению, относятся не только антитела, взятые из организма животных, включая человека, мышей, крыс, хомяков, кролей, овец, верблюдов и обезьян, но и искусственно модифицированные гены рекомбинантных антител, таких, как химерные антитела, гуманизированные антитела и биспецифические антитела. К антителам согласно настоящему изобретению также относятся гены рекомбинантных антител, полученные в результате искусственной модификации постоянных областей антитела для изменения физических свойств молекулы антитела (в частности, изменения изоэлектрической точки (pI), улучшения аффинности к Fc-рецептору и т.п.) с целью улучшения устойчивости в крови и in vivo фармакокинетики.
Иммуноглобулиновый класс антител, используемых согласно настоящему изобретению, особенно не ограничивается; и этот класс может быть любым классом, включающим IgG, например, IgG1, IgG2, IgG3 и IgG4, IgA, IgD, IgE и IgM. Однако предпочтение отдается IgG и IgM.
Антитела, используемые согласно настоящему изобретению, также включают не только целые антитела, но и фрагменты антител, такие, как Fv, Fab, и F(ab)2, и мини-антитела (антитела с низкой молекулярной массой), такие, как одновалентные или двухвалентные одноцепочечные Fv, возникающие в результате связывания вариабельных областей антитела через линкер, такой, как пептидный линкер (scFv, sc(Fv)2, диатела, такие, как димер scFv, и т.п.).
Вышеописанные антитела, используемые согласно настоящему изобретению, могут быть получены способами, известными специалистам в данной области.
Как правило, вырабатывающие моноклональные антитела гибридомы могут быть получены описанными ниже традиционными способами. В частности, иммунизацию осуществляют традиционным способом иммунизации, применяя нужный антиген или клетки, экспрессирующие нужный антиген как сенсибилизирующий антиген. Подготовленные иммуноциты сливают с известными родительскими клетками, применяя традиционный способ слияния клеток. Слитые клетки отбирают на вырабатывающие моноклональные антитела клетки (гибридомы) традиционными способами отбора. Гибридомы могут быть получены, например, согласно способу, описанному в публикации Milstein et al. (Kohler, G. и Milstein, С., Methods Enzymol. (1981) 73: 3-46). Если антиген обладает низкой иммуногенностью, иммунизация может производиться с применением антигена, связанного с иммуногенными макромолекулами, такими, как альбумин.
В альтернативном варианте возможно использование генов рекомбинантных антител, полученных с применением технологий рекомбинации генов, при которых гены антител клонируют из гибридом и вставляют в соответствующие векторы, и полученные в результате векторы вводят в организмы-хозяева (см., например, Carl, А.К. Borrebaeck, James, W. Larrick, Therapeutic Monoclonal Antibodies, Published in the United Kingdom by Macmillan Publishers, 1990). Так, кДНК для вариабельных областей (V-областей) антитела синтезируют из мРНК гибридом с использованием обратной транскриптазы. Когда получают ДНК, кодирующую нужную V-область антитела, ДНК связывают с ДНК, кодирующей нужную константную область (С-область) антитела. Полученную в результате последовательность вставляют в вектор экспрессии. В альтернативном варианте Кодирующая V-область антитела ДНК может быть вставлена в вектор экспрессии, включающий ДНК С-области антитела. Полученную в результате последовательность вставляют в вектор экспрессии таким образом, чтобы она экспрессировалась под контролем участка регулирования экспрессии, например, энхансера и промотора. Затем клетки-хозяева трансформируют вектором экспрессии для экспрессии антитела.
Согласно настоящему изобретению, искусственно модифицированные гены рекомбинантных антител, таких, как химерные и гуманизированные антитела, могут применяться для снижения гетерологической антигенности против человека. Такие модифицированные антитела могут вырабатываться с применением известных способов. Химерное антитело является антителом, имеющим вариабельные области тяжелой цепи и легкой цепи антитела из организма отличного от человека млекопитающего, такого, как мышь, и тяжелой цепи и легкой цепи константных областей человеческого антитела. Химерное антитело может быть получено путем связывания ДНК, кодирующей вариабельные области антитела мыши с ДНК, кодирующей константные области человеческого антитела, вставки лиганда в вектор экспрессии с последующей вставкой вектора в организм-хозяин для экспрессии.
Гуманизированное антитело также называют реконструированным человеческим антителом, получаемым путем замещения гипервариабельного участка (CDR) человеческого антитела гипервариабельным участком антитела, взятого из организма отличного от человека млекопитающего, например, мыши. Традиционные технологии рекомбинации генов известны. Так, последовательность ДНК конструируют таким образом, чтобы она включала CDR антитела мыши, связанный с каркасным участком (FR) человеческого антитела, и синтезируют путем PCR с применением нескольких олигонуклеотидов, предусмотренных с перекрывающимися участками на концах. Полученную ДНК лигируют с ДНК, кодирующей константную область человеческого антитела, а затем вставляют в вектор экспрессии. Вектор экспрессии включают в организм-хозяин для образования гуманизированного антитела (см., Публикацию европейской патентной заявки № ЕР 239400 и WO 96/02576). FR CDR-связанного человеческого антитела выбирают таким образом, чтобы гипервариабельный участок образовывал предпочтительный антиген-связывающий домен. Аминокислоты в каркасном участке вариабельной области антитела могут быть замещены в соответствии с требованием, таким образом, чтобы гипервариабельный участок реконструированного человеческого антитела образовывал соответствующий антиген-связывающий домен (Sato, К. et al., Cancer Res. (1993) 53, 851-856).
Существуют способы замещения аминокислот в антителах для улучшения активности антител, их физических свойств, фармакокинетики, безопасности и т.п. Примеры таких способов описываются ниже. К антителам согласно настоящему изобретению также относятся имеющие такие аминокислотные замещения.
Описываются способы замещения аминокислот в вариабельных областях IgG-антител, и к ним относятся гуманизация (Tsurushita N, Hinton PR, Kumar S., Design of humanized antibodies: from anti-Tac to Zenapax., Methods. 2005 May; 36(1): 69-83); матричного созревания для повышения активности связывания через замещение аминокислот в гипервариабельном участке (CDR) (Rajpal A, Beyaz N, Haber L, Cappuccilli G, Yee H, Bhatt RR, Takeuchi T, Lerner RA, Crea R., A general method for greatly improving the affinity of antibodies by using combinatorial libraries., Proc Natl Acad Sci USA. 2005 Jun 14; 102(24): 8466-71); и улучшения физико-химической устойчивости через замещение аминокислот в каркасе (FR) (Ewert S, Honegger A, Pluckthun A., Stability improvement of antibodies for extracellular and intracellular applications: CDR grafting to stable frameworks and structure-based framework engineering., Methods. 2004 Oct; 34(2): 184-99. Review). Также известны способы повышения опосредованной антителами клеточной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC) путем замещения аминокислот в Fc-домене IgG-антитела (Kim SJ, Park Y, Hong HJ., Antibody engineering for the development of therapeutic antibodies., Mol Cells. 2005 Aug 31; 20(1): 17-29. Review). Кроме того, помимо способов повышения эффекторных функций, существуют публикации о способах улучшения времени полужизни антитела в крови путем замещения аминокислот в Fc (Hinton PR, Xiong JM, Johlfs MG, Tang MT, Keller S, Tsurushita N., An engineered human IgG1 antibody with longer serum half-life., J Immunol. 2006 Jan 1; 176(1): 346-56; Ghetie V, Popov S, Borvak J, Radu C, Matesoi D, Medesan C, Ober RJ, Ward ES., Increasing the serum persistence of an IgG fragment by random mutagenesis., Nat Biotechnol. 1997 Jul; 15(7): 637-40). Другая известная технология включает способ замещения аминокислот для контроля изоэлектрической точки (pI) антитела с целью улучшения устойчивости в крови или in vivo фармакокинетики, в частности, способ модификации аминокислотных остатков, открытых на поверхности антитела, для контроля pI антитела (документ WO 07/114319). Также известны различные способы замещения аминокислот в константных областях с целью улучшения физических свойств антитела (документ WO 09/41613).
Снижение дозы антитела в качестве фармацевтического средства или увеличение интервала введения антитела, очевидно, можно обеспечить путем увеличения периода полужизни антитела или его удерживания в плазме. Перспективные технологии, позволяющие этого достичь включают способ уменьшения изоэлектрической точки антитела (документ WO 07/114319). Композиции согласно настоящему изобретению обладают высоким стабилизирующим эффектом для антител с измененной изоэлектрической точкой. PI-модифицированное антитело означает модифицированное антитело, pI которого ниже, чем показатель исходного антитела, на один или более, предпочтительно два или более, и более предпочтительно - три или более. Как правило, предполагается, что природные (или обычные) антитела имеют изоэлектрическую точку в пределах от 7,5 до 9,5. Композиции согласно настоящему изобретению имеют высокое стабилизирующее влияние, в частности, на антитела с низкой изоэлектрической точкой, которая вряд ли существует в природе. Изоэлектрическая точка таких антител может составлять от 5,0 до 8,0, предпочтительно от 5,0 до 7,5, более предпочтительно - от 5,0 до 7,0, и еще более предпочтительно - от 5,5 до 6,5. Как описывается ниже в Примерах, изоэлектрическая точка Mab1, полученного путем модификации аминокислотной последовательности Mab2 (изоэлектрическая точка = 9,3) для контроля изоэлектрической точки, составляла 5,8.
Способы получения человеческих антител также известны. Например, нужные человеческие антитела с антигенсвязывающей активностью могут быть получены путем сенсибилизации человеческих лимфоцитов нужным антигеном или клетками, экспрессирующими нужный антиген in vitro; и слияния сенсибилизированных лимфоцитов с клетками человеческой миеломы, такими, как U266 (см. Публикацию японской патентной заявки Kokoku № (JP-B) Н01-59878 (прошедшая экспертизу утвержденная японская патентная заявка, опубликованная для противопоставления)). В альтернативном варианте нужные человеческие антитела также могут быть получены путем иммунизации трансгенных животных, имеющих полный набор генов человеческих антител, антигеном (см. документы WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735). Кроме того, известны способы получения человеческих антител путем пэннинга с библиотекой человеческих антител. Например, вариабельные области человеческих антител могут экспрессироваться как одноцепочечные антитела (scFvs) на поверхности фагов с применением фаг-дисплейного метода, и затем могут отбираться фаги, связывающиеся с антигеном. Гены отобранных фагов анализируют для определения последовательностей ДНК, кодирующих вариабельные области человеческих антител, которые связываются с антигеном. При распознавании последовательностей ДНК scFvs, которые связываются с антигеном, могут быть построены соответствующие векторы экспрессии, включающие эти последовательности, для получения человеческих антител. Такие способы уже хорошо известны. См. документы WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388. Антитела, применяемые согласно настоящему изобретению, также включают такие человеческие антитела.
Когда гены антител выделяют и вводят в соответствующие организмы-хозяева для вырабатывания антител, хозяева и векторы экспрессии могут использоваться в соответствующих комбинациях. Если в качестве хозяев используются эукариотные клетки, могут использоваться животные клетки, растительные клетки и грибковые клетки. К животным клеткам относятся: (1) клетки млекопитающих, такие, как СНО, COS, клетки миеломы, клетки почек новорожденного хомяка (ВНК), HeLa и Vero; (2) клетки земноводных, такие, как ооциты шпорцевой лягушки Xenopus; и (3) клетки насекомых, такие, как sf9, sf21 и Tn5. К известным растительным клеткам относятся клетки, полученные из рода Nicotiana, например, Nicotiana tabacum, которые могут культивироваться в виде каллюса. К известным грибковым клеткам относятся дрожжи, например, рода Saccharomyces, например, Saccharomyces cerevisiae, и нитчатые грибы, например, рода Aspergillus, например, Aspergillus niger. Если используются прокариотные клетки, могут использоваться продукционные системы, в которых используются бактериальные клетки. К известным бактериальным клеткам относятся Escherichia coli (E.coli) и Bacillus subtilis. Антитела могут быть получены путем введения нужных генов антител в эти клетки при помощи трансформации с последующим культивированием трансформированных клеток in vitro.
Антитела, применяемые согласно настоящему изобретению, также включают фрагменты антител, мини-антитела и модифицированные антитела. К таким фрагментам антител и мини-антителам относятся, например, Fab, F(ab’)2, Fv или одно-, двух- или многовалентные одноцепочечные Fv (scFv, sc(Fv)2 и т.п.), образующиеся в результате связывания Н-цепочечных и L-цепочечных Fv через соответствующие линкеры (Huston J.S. et al., (1988) Proc. Natl. Acad. Sci. U.S.A. 85: 5879-5883). В частности, такие фрагменты антител образуются при обработке антител ферментом, таким, как папаин или пепсин. В альтернативном варианте ген, кодирующий фрагмент антитела, строят, вставляют в вектор экспрессии и экспрессируют в соответствующих клетках-хозяевах (см., например, Со, М.S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. и Horwitz, A.H., Methods Enzymol. (1989) 178, 476-496; Pluckthun, А. и Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. et al., Methods Enzymol. (1986) 121, 663-669; Bird, R.E. и Walker, B.W., Trends Biotechnol. (1991) 9, 132-137).
К модифицированным антителам относятся антитела, связанные с полиэтиленгликолем (PEG) или разными молекулами, такими, как цитотоксические средства (Farmaco. 1999 Aug 30; 54(8): 497-516; Cancer J. 2008 May-Jun; 14(3): 154-69). К "антителам" согласно настоящему изобретению также относятся такие модифицированные антитела. Такие модифицированные антитела могут быть приготовлены путем химической модификации полученных антител. Такие способы являются традиционными в данной области.
К антителам, которые могут содержаться в композициях согласно настоящему изобретению, помимо прочих, относятся антитела против тканевого фактора, антитела против рецептора IL-6, антитела против IL-6, моноклональные антитела против HM1.24-антигена, антитела против родственного паратиреоидному гормону пептида (антитела против PTHrP), антитела против глипикана-3, антитела против ганглиозида GM3, антитела против агониста ТРО-рецептора, антитела в качестве функционального заместителя фактора коагуляции VIII, антитела против рецептора IL31, антитела против HLA, антитела против AXL, антитела против CXCR4, антитела против NR10 и биспецифические антитела против фактора IX и фактора X.
К предпочтительным реконструированным гуманизированным антителам, применяемым согласно настоящему изобретению, относятся гуманизированные антитела против рецептора интерлейкина 6 (IL-6) (тоцилизумаб, hPM-1 и MRA) (см. документ WO 92/19759), гуманизированные моноклональные антитела против НМ1.24-антигена (см. документ WO 98/14580), гуманизированные антитела против родственного паратиреоидному гормону пептида (антитела против PTHrP) (см. документ WO 98/13388), гуманизированные антитела против тканевого фактора (см. документ WO 99/51743), гуманизированные антитела против глипикана-3 IgG1κ (см. документ PCT/JP 05/013103) и гуманизированные антитела против NR10 (см. документ WO 2009/072604). Особое предпочтение среди гуманизированных антител, применяемых согласно настоящему изобретению, отдается гуманизированным антителам против рецептора IL-6.
К предпочтительным человеческим IgM-антителам относятся рекомбинантные человеческие IgM-антитела против ганглиозида GM3 (см. документ WO 05/05636).
К предпочтительным мини-антителам относятся диатела против агониста ТРО-рецептора (см. документ WO 02/33072) и диатела против агониста CD47 (см. документ WO 01/66737).
Кроме того, к антителам с улучшенной изоэлектрической точкой относятся, например, Mab1 (Н-цепь/SEQ ID NO: 1; L-цепь/SEQ ID NO: 2), которое является антителом к рецептору IL-6, описанным в документе WO 2009/041621, гуманизированные антитела против NR10 и полностью гуманизированные антитела NS22, получаемые при помощи способа, описанного в Примере 12 документа WO 2009/072604.
В предпочтительном варианте осуществления буфер композиции согласно настоящему изобретению (например, гистидин-аспартатный буфер, гистидин-глутаматный буфер, трис(гидроксиметил)аминометан-аспартатный буфер или трис(гидроксиметил)аминометан-глутаматный буфер) получают путем титрования водного раствора, содержащего основную аминокислоту, такую, как гистидин или трис(гидроксиметил)аминометан, в форме свободной аминокислоты водным раствором, содержащим аспарагиновую кислоту и/или глутаминовую кислоту в форме свободной аминокислоты. В альтернативном варианте буфер может быть получен путем добавления ингредиентов в обратном порядке или путем прямого титрования с порошками.
В предпочтительном варианте осуществления аргинин-аспартат или аргинин-глутамат в композиции согласно настоящему изобретению представляет собой соль, приготовленную путем титрования водного раствора, содержащего аспарагиновую кислоту (свободную аминокислоту) и/или глутаминовую кислоту (свободную аминокислоту) в форме свободной аминокислоты с водным раствором, содержащим аргинин (свободное основание) в форме свободной аминокислоты. В альтернативном варианте соль может быть получена путем добавления ингредиентов в обратном порядке или путем прямого титрования с порошками.
Авторы настоящего изобретения осуществляли исследование с замораживанием-оттаиванием, исследование с термическим ускорением, исследование долгосрочной устойчивости и исследование хранение в замороженном состоянии для оценки влияния различных добавок на устойчивость высококонцентрированных композиций антитела во время хранения. В результате авторами настоящего изобретения было обнаружено, что образование агрегатов значительно подавляется при использовании кислой аминокислоты, аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона в гистидиновом буфере, т.е., при использовании гистидин-аспартатного буфера или гистидин-глутаматного буфера в качестве буфера по сравнению с традиционными буферами для фармацевтических композиций, таких, как гистидин-гидрохлоридный буфер и гистидин-ацетатный буфер.
Авторами настоящего изобретения также было обнаружено, что больший стабилизирующий эффект достигается путем добавления аргинин-аспартата или аргинин-глутамата по сравнению с аргинин гидрохлоридом, о котором сообщалось в качестве стабилизатора для содержащей антитела композиции. Ниже в Примерах приведены результаты оценки с использованием гуманизированного антитела к рецептору IL-6.
В частности, устойчивые высококонцентрированные содержащие антитела композиции, имеющие низкий уровень агрегации антител, могут быть получены путем добавления гистидин-аспартатного буфера или гистидин-глутаматного буфера или трис(гидроксиметил)аминометан-аспартатного буфера или трис(гидроксиметил)аминометан-глутаматного буфера. Кроме того, более устойчивые высококонцентрированные содержащие антитела композиции, имеющие значительно более низкий уровень агрегации антител, могут быть получены путем добавления аргинин-аспартата или аргинин-глутамата в качестве стабилизатора. Таким образом, настоящее изобретение касается способов значительного подавления образования агрегатов путем использования гистидин-аспартатного буфера или гистидин-глутаматного буфера или трис(гидроксиметил)аминометан-аспартатного буфера или трис(гидроксиметил)аминометан-глутаматного буфера в качестве буфера для высококонцентрированных содержащих антитела растворов и способов значительного подавления образования агрегатов путем добавления аргинин-аспартата или аргинин-глутамата в качестве стабилизатора для высококонцентрированных содержащих антитела растворов.
В одном варианте осуществления к способам согласно настоящему изобретению относятся, например, способы подавления образования агрегатов во время хранения высококонцентрированных содержащих антитела композиций в замороженном состоянии или при замораживании-оттаивании путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу (например, гистидиновому буферу или трис(гидроксиметил)аминометановому буферу) или в качестве разновидности противоиона к стабилизатору (например, аргинину) в композициях.
В другом варианте осуществления к способам согласно настоящему изобретению относятся, например, способы подавления образования агрегатов во время хранения высококонцентрированных содержащих антитела композиций в жидком состоянии путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу (например, гистидиновому буферу или трис(гидроксиметил)аминометановому буферу) или в качестве разновидности противоиона к стабилизатору (например, аргинину) в композициях.
Согласно настоящему изобретению, буферы, которые могут применяться вместо гистидинового буфера, и в которых аспарагиновую кислоту или глутаминовую кислоту используют в качестве разновидности противоиона, включают трис(гидроксиметил)аминометан (Tris) и имидазол. Такие буферы также могут добавляться к гистидиновому буферу согласно настоящему изобретению.
Согласно настоящему изобретению, стабилизаторы, к которым аспарагиновая кислота или глутаминовая кислота могут использоваться в качестве разновидности противоиона, включают аргининамид, лизин, меглумин, спермин, спермидин, магний, кальций, натрий и калий, дополнительно к аргинину.
Как описано выше, настоящее изобретение обеспечивает устойчивые содержащие антитела композиции, включающие гистидин-аспартатный буфер или гистидин-глутаматный буфер, или трис(гидроксиметил)аминометан-аспартатный буфер или трис(гидроксиметил)аминометан-глутаматный буфер. Значительно больший стабилизирующий эффект достигается в содержащей антитела композиции согласно настоящему изобретению при дополнительном содержании в ней аргинин-аспартата или аргинин-глутамата. Таким образом, настоящее изобретение касается содержащей антитела композиции, включающей соль, которая сочетает в жидкости основную аминокислоту, такую, как гистидин или аргинин (предпочтительно гистидин и/или аргинин) или трис(гидроксиметил)аминометан с аспарагиновой кислотой или глутаминовой кислотой.
Гистидин, применяемый согласно настоящему изобретению, может представлять собой сам гистидин или его производную, причем особое предпочтение отдается L-гистидину. Аргинин применяемый согласно настоящему изобретению, может представлять собой сам аргинин, его производную или его соль, причем особое предпочтение отдается L-аргинину или его соли. Предпочтительно соли аргинина включают аспартатную соль и глутаматную соль.
В композициях согласно настоящему изобретению концентрация (количество) гистидин-аспартатного буфера или гистидин-глутаматного буфера предпочтительно составляет от 1 до 100 мМ, более предпочтительно - от 5 до 100 мМ, еще более предпочтительно - от 5 до 50 мМ, и еще более предпочтительно - от 10 до 25 мМ.
В композициях согласно настоящему изобретению концентрация (количество) аргинина предпочтительно составляет от 5 до 300 мМ, более предпочтительно - от 25 до 200 мМ, и еще более предпочтительно - от 50 до 150 мМ.
Композиции согласно настоящему изобретению могут быть растворами (содержащими жидкие композиции антител) или лиофилизированными композициями. Жидкие композиции согласно настоящему изобретению также включают растворы перед этапом(ами) лиофилизации и разбавленные растворы. Жидкие композиции согласно настоящему изобретению предпочтительно получают без этапа(ов) лиофилизации в процессе производства. В то же время, лиофилизированные композиции согласно настоящему изобретению могут быть получены путем лиофилизации жидких композиций согласно настоящему изобретению с применением способов, известных специалистам в данной области.
Уровень рН композиций согласно настоящему изобретению предпочтительно составляет от 4 до 8, более предпочтительно - от 5,0 до 7,5, и еще более предпочтительно - от 5,5 до 6,5.
Вязкость жидких композиций согласно настоящему изобретению при комнатной температуре (25°С) предпочтительно составляет 30 мПа⋅с или менее, более предпочтительно - 20 мПа⋅с или менее, и еще более предпочтительно - 15 мПа⋅с или менее.
Значительных изменений не наблюдается для жидких композиций согласно настоящему изобретению в течение как минимум 6 месяцев, предпочтительно 12 месяцев, более предпочтительно - двух лет, еще более предпочтительно - трех лет в низкотемпературных условиях (от 2°С до 8°С) или в течение как минимум шести месяцев, предпочтительно одного года, и более предпочтительно - двух лет при комнатной температуре (от 22°С до 28°С). В частности, настоящее изобретение касается жидких композиций, устойчивых в течение как минимум шести месяцев при температуре от 22°С до 28°С.
Жидкие композиции согласно настоящему изобретению могут замораживаться и храниться при температуре в пределах от -30°С до -10°С.
Композиции согласно настоящему изобретению дополнительно могут содержать поверхностно-активные вещества. Применяемые согласно настоящему изобретению предпочтительные поверхностно-активные вещества включают полиоксиэтиленовые эфиры сорбита и жирной кислоты и полиоксиэтилен-полиоксипропилен-алкиловые эфиры, более предпочтительно поверхностно-активные вещества включают полисорбаты 20 и 80 и Pluronic F-68 (полоксамер 188). Поверхностно-активные вещества могут добавляться к композициям согласно настоящему изобретению, как правило, в количестве от 0,0001% до 10% (масса/объем), предпочтительно от 0,001% до 5%, и более предпочтительно - от 0,005% до 3%.
Композиции согласно настоящему изобретению также могут включать аминокислоты. Согласно настоящему изобретению, к предпочтительным аминокислотам относятся природные аминокислоты и производные аминокислот, причем особенно предпочтительными аминокислотами являются L-метионин и L-пролин.
Композиции согласно настоящему изобретению также могут содержать сахара. Предпочтительными сахарами, применяемыми согласно настоящему изобретению, являются сахароза, трегалоза, меглумин и сорбит.
Количество аминокислоты или сахара, которое может добавляться к композициям согласно настоящему изобретению, обычно составляет от 1 до 1000 мМ, предпочтительно от 5 до 500 мМ, более предпочтительно - от 10 до 300 мМ.
Композиции согласно настоящему изобретению также могут содержать неорганические соли. К предпочтительным неорганическим солям, применяемым согласно настоящему изобретению, относятся соли магния и соли кальция.
Композиции согласно настоящему изобретению по сути состоят из нижеуказанных ингредиентов от А до D.
(A) антитело к рецептору IL-6;
(B) гистидин-аспартатный буфер и/или гистидин-глутаматный буфер;
(C) аргинин (включая аргинин-аспартат и аргинин-глутамат), аминокислоты, отличные от аргинина, и/или сахара в случае необходимости; и
(D) поверхностно-активные вещества.
"По сути состоят" означает, что концентрация описанных ниже необязательных добавок, которые являются ингредиентами, отличными от ингредиентов, обычно добавляемых к композициям, составляет 5 мМ или менее, предпочтительно 2 мМ или менее, более предпочтительно - 1 мМ или менее. К таким необязательным добавкам относятся криопротекторы, суспендирующие агенты, солюбилизирующие компоненты, изотонизирующие агенты, консерванты, ингибиторы адсорбции, разбавители, формообразующие, регуляторы рН, анальгетики, серосодержащие восстановители и антиоксидант.
Кроме того, композиции согласно настоящему изобретению предпочтительно не содержат анионов, отличных от аспарагиновой кислоты и глутаминовой кислоты, в качестве противоионов к буферу или стабилизатору. В одном варианте осуществления к таким композициям относятся, например, те, которые по сути не содержат иона хлорида и иона ацетата. "По сути не содержат иона хлорида и иона ацетата" означает, что концентрация иона хлорида и иона ацетата составляет, например, 5 мМ или менее, предпочтительно 2 мМ или менее, более предпочтительно - 1 мМ или менее. Высокоустойчивые содержащие антитела композиции могут быть получены без повышения осмотического давления, в результате использования аспарагиновой кислоты и глутаминовой кислоты, обеспечивающих более высокий стабилизирующий эффект качестве противоионов, и практически без содержания иона хлорида и иона ацетата с худшим стабилизирующим эффектом.
В случае необходимости композиции согласно настоящему изобретению также могут содержать соответствующие криопротекторы, суспендирующие агенты, солюбилизирующие компоненты, изотонизирующие агенты, консерванты, ингибиторы адсорбции, разбавители, формообразующие, регуляторы рН, анальгетики, серосодержащие восстановители, антиоксиданты и т.п.
К криопротекторам относятся, например, сахара, такие, как трегалоза, сахароза и сорбит.
К солюбилизирующим компонентам относятся, например, полиоксиэтилен-гидрогенизованное касторовое масло, полисорбат 80, никотинамид, полиоксиэтиленсорбитмонолаурат, макрогол и этиловый эфир жирной кислоты касторового масла.
К изотонизирующим агентам относятся, например, хлорид натрия, хлорид калия и хлорид кальция.
К консервантам относятся, например, метилпарагидроксибензоат, этилпарагидроксибензоат, сорбиновая кислота, фенол, крезол и хлорокрезол.
К ингибиторам адсорбции относятся, например, альбумин сыворотки человека, лецитин, декстран, сополимер этиленоксид/пропиленоксид, гидроксипропилцеллюлоза, метилцеллюлоза, полиоксиэтилен-гидрогенизованное касторовое масло и полиэтиленгликоль.
К серосодержащим восстановителям относятся, например, содержащие сульфгидрильные группы, такие, как N-ацетилцистеин, N-ацетилгомоцистеин, тиоктовая кислота, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбит, тиогликолевая кислота и ее соли, тиосульфат натрия, глутатион и тиоалкановые кислоты, имеющие от одного до семи атомов углерода.
К антиоксидантам относятся, например, эриторбиновая кислота, дибутилгидрокситолуол, бутилгидроксианизол, α-токоферол, токоферолацетат, L-аскорбиновая кислота и ее соли, пальмитат L-аскорбиновой кислоты, стеарат L-аскорбиновой кислоты, гидросульфит натрия, сульфит натрия, триамилгаллат, пропилгаллат и хелатообразующие реагенты, такие, как этилендиаминтетраацетат натрия двузамещенный (EDTA), пирофосфат натрия и метафосфат натрия.
Композиции согласно настоящему изобретению могут вводиться перорально или парентерально. Как правило, композиции вводят парентерально, в частности, путем инъекции, трансдермального введения, трансмукозального введения, назального введения, легочного введения и т.п. Инъекции включают, например, системное или локальное введение путем подкожной инъекции, внутривенной инъекции, внутримышечной инъекции и т.п. Объем инъекции при подкожной инъекции ограничен; однако отдельная доза антитела может включать большое количество (приблизительно от 100 до 200 мг). Таким образом, композиции согласно настоящему изобретению особенно приемлемы для подкожного введения (инъекции).
С точки зрения безболезненности предпочтительно, чтобы отношение осмотического давления буферного агента в композициях для подкожного введения было приближенным к изотоническому 1,0. Таким образом, отношение осмотического давления жидких композиций согласно настоящему изобретению предпочтительно составляет приблизительно 1. Аргинин, сахара и т.п. Добавляют для улучшения устойчивости композиций во время хранения. Однако, если осмотическое давление превышает изотонический уровень, оно может вызывать болевые ощущения при подкожном введении. Таким образом, добавление таких стабилизаторов с учетом осмотического давления является предпочтительным.
Кроме того, настоящее изобретение касается применения основной аминокислоты-аспартата или основной аминокислоты-глутамата в производстве устойчивой содержащей антитело композиции; и аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона к буферу или стабилизатору в высококонцентрированной содержащей антитело композиции, которые применяются согласно способу подавления агрегация во время хранения композиции в замороженном виде или в виде жидкости.
Все документы существующего уровня техники, приведенные в описании, включаются в это описание путем ссылки.
[Примеры]
Ниже настоящее изобретение подробнее описывается со ссылкой на Примеры, однако объем настоящего изобретения ими не ограничивается.
[Пример 1] Оценка стабилизирующего эффекта разновидностей противоиона с применением Mab1 и Mab2
Mab1 (Н-цепь/SEQ ID NO: 1; L-цепь/SEQ ID NO: 2) и Mab2 (Н-цепь/SEQ ID NO: 3; L-цепь/SEQ ID NO: 4; тоцилизумаб), которые описываются как антитело к рецептору IL-6 в документе WO 2009/041621, экспрессировали способом, известным специалистам в данной области, с применением устойчивой экспрессии линии клеток СНО, а затем очищали до высокой степени чистоты способом, известным специалистам в данной области, с применением белка А. Очищенные Mab1 и Mab2 использовали в исследовании устойчивости, описанном ниже в Примерах.
Устойчивость двух типов композиций, включающих гистидин-хлорид или гистидин-ацетат, оценивали путем замораживания-оттаивания или путем хранения при 40°С с применением Mab1 и Mab2. Композиции Mab1 и Mab2 приготавливали путем суточного диализа с применением каждого рецептированного раствора (Таблица 1) с последующим концентрированном растворов. Конечную концентрацию Mab1 и Mab2 доводили до 37 мг/мл. Исследование с замораживанием-оттаиванием осуществляли путем проведения десяти циклов медленного замораживания-оттаивания (замораживание при -20°С с последующим оттаиванием при комнатной температуре), с последующими десятью циклами быстрого замораживания-оттаивания (замораживание при -20°С с последующим оттаиванием в ванне теплой воды (37°С)). Количество агрегата в каждой композиции после замораживания-оттаивания или хранения при 40°С рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC). Увеличение агрегатов (%) свидетельствует о сниженной устойчивости Mab1 или Mab2. Таким образом, увеличение количества агрегатов использовали как показатель для сравнения устойчивости между соответствующими композициями.
Эксклюзионная хроматография (SEC)
Эксклюзионную хроматографию (SEC) выполняли для анализа количества агрегатов и низкомолекулярных продуктов деградации в каждой композиции. Каждую композицию разбавляли приблизительно до 0,4-2,0 мг/мл описанной ниже мобильной фазой, а затем анализировали, применяя колонку G3000SWXL (Tosoh Co.) при скорости потока 0,5 мл/мин с мобильной фазой из 50 мМ фосфатного буфера (рН 7,0), содержащего 300 мМ NaCl (длина волны детектирования: 220 нм). Пик элюирования, который появлялся раньше, чем мономерный пик, анализировали как агрегаты, а пик элюирования, который появлялся после мономерного пика, но раньше, чем образованный буфером пик, анализировали как низкомолекулярные продукты деградации. Соответствующее содержание (%) рассчитывали через процент от площади.
|
Результаты исследования устойчивости двух типов композиций, содержащих гистидин-хлорид или гистидин-ацетат, с применением Mab1 и Mab2 показаны на Фигурах с 1 по 3. Результаты продемонстрировали, что Mab1 было несколько устойчивее в гистидин-хлориде, чем в гистидин-ацетате как при хранении в жидком состоянии, так и при замораживании-оттаивании. Результат хранения в жидком состоянии показал, что Mab2 было приблизительно в два раза устойчивее в гистидин-хлориде, чем в гистидин-ацетате.
[Пример 2] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab1 (1)
Как правило, использовали хлористоводородную кислоту в качестве разновидности противоиона к гистидину и аргинину. В соответствии с более ранним сообщением (PCT/US 2005/037471), результаты оценки уксусной кислоты, фосфорной кислоты и серной кислоты в качестве разновидности противоиона к гистидину показали, что уксусная кислота обладает превосходящим стабилизирующим эффектом при использовании в качестве разновидности противоиона к гистидину. Однако, как описано выше в Примере 1, настоящее изобретение продемонстрировало, что хлористоводородная кислота несколько превосходит уксусную кислоту в качестве разновидности противоиона к гистидину при использовании для Mab1 и Mab2. Хлористоводородная кислота является распространенной разновидностью противоаниона, хотя известно, что хлористоводородная кислота имеет склонность к разъеданию нержавеющей стали, из которой обычно изготавливают тару (Dent. Mater. 17: 409-414 (2001); J. Pharm. Sci. 86: 1250-1255 (1997)). Кроме того, сообщалось об изменчивости уровня рН в уксусной кислоте из-за ее летучести (Injectable Drug Development, Authors: Pramod К. Gupta (Editor), Gayle A. Brazeau, Gayle A).
Таким образом, в этом Примере авторы настоящего изобретения пытались найти нелетучие противоионы, которые не являются разрушительными для нержавеющей стали и обладают превосходящим стабилизирующим эффектом по сравнению с уксусной кислотой и хлористоводородной кислотой в качестве разновидности противоиона в буфере для Mab1 и Mab2. Авторы настоящего изобретения оценивали разновидности анионов, отличные от хлористоводородной кислоты, уксусной кислоты, фосфорной кислоты и серной кислоты, о которых ранее сообщалось в PCT/US 2005/037471. В частности, в качестве разновидностей противоиона оценивали аспарагиновую кислоту и глутаминовую кислоту, которые являются аминокислотами. Как описано в Примере 1, было продемонстрировано, что гистидин-хлорид обладает превосходящим стабилизирующим эффектом по сравнению с гистидин-ацетатом в Mab1 и Mab2, поэтому стабилизирующий эффект разновидностей противоиона сравнивали с эффектом хлористоводородной кислоты. В частности, в соответствии с тремя композициями, показанными в Таблице 2, оценивали влияние хлористоводородной кислоты, аспарагиновой кислоты и глутаминовой кислоты на устойчивость в качестве разновидности противоиона к гистидину в качестве буфера или аргинину в качестве стабилизатора при использовании Mab1.
Каждую композицию приготавливали одним способом, как описано в Примере 1. Mab1 подвергали диализу с применением раствора каждой композиции (Таблица 2) в течение суток. Затем каждый раствор концентрировали и конечную концентрацию Mab1 доводили до 200 мг/мл. Исследование с замораживанием-оттаиванием осуществляли путем проведения десяти циклов медленного замораживания-оттаивания (замораживание при -20°С с последующим оттаиванием при комнатной температуре). Способ приготовления каждого рецептированного раствора описывается ниже. Образец композиции №3 приготавливали следующим образом: L-гистидин и L-аргинин растворяли в воде MilliQ при 20 мМ и 50 мМ, соответственно, и растворы титровали до рН 6 1 N хлористоводородной кислотой. Образцы композиций №№4 и 5 приготавливали следующим образом: L-гистидин, L-аргинин и L-аспарагиновую кислоту или L-глутаминовую кислоту растворяли в воде MilliQ при 20 мМ, 50 мМ и 60 мМ, соответственно, а затем растворы титровали до рН 6 раствором 30-40 мМ L-аспарагиновой кислоты или L-глутаминовой кислоты. Количество агрегата в каждом образце после замораживания-оттаивания или хранения при -20°С, 25°С и 5°С рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
Увеличение количества (%) агрегата во время замораживания-оттаивания или хранения при -20°С, 25°С и 5°С для каждой композиции показывается на Фигурах с 4 по 7. Увеличение количества (%) агрегата во время хранения при 5°С и 25°С показывало, что устойчивость повышается в следующем порядке: глутаминовая кислота = аспарагиновая кислота > хлористоводородная кислота в качестве разновидности противоиона к гистидину и аргинину. Таким образом, было продемонстрировано, что устойчивость Mab1 улучшается благодаря применению аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона вместо хлористоводородной кислоты. Такая же тенденция наблюдалась при замораживании-оттаивании и хранении в замороженном состоянии. Увеличение количества (%) агрегата во время хранения при -20°С в течение трех месяцев с глутаминовой кислотой, аспарагиновой кислотой или хлористоводородной кислотой составляло приблизительно 0,8%, 1,2%, или 3,0%, соответственно. Таким образом, стабилизирующий эффект глутаминовой кислоты был несколько выше эффекта аспарагиновой кислоты.
Примеры 1 и 2 продемонстрировали, что при применении в качестве разновидности противоиона глутаминовая кислота и аспарагиновая кислота обладают превосходящим Mab1-стабилизирующим эффектом по сравнению с хлористоводородной кислотой и уксусной кислотой. Сообщения о том, что глутаминовая кислота и аспарагиновая кислота являются летучими или вызывающими коррозию нержавеющей стали, отсутствуют. Таким образом, было обнаружено, что глутаминовая кислота и аспарагиновая кислота являются перспективными в качестве разновидности противоиона для Mab1. Так, гистидин-глутамат и гистидин-аспартат превосходят в качестве буфера гистидин-хлорид и гистидин-ацетат, а аргинин-глутамат и аргинин-аспартат превосходят в качестве стабилизатора аргинин-хлорид и аргинин-ацетат.
[Пример 3] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab2 (1)
Как описано в Примере 1, было обнаружено, что Mab2 более устойчиво в гистидин-хлоридном буфере, чем в гистидин-ацетатном буфере (так же, как и Mab1, Фиг.2). Кроме того, как описано в Примере 2, устойчивость Mab1 в жидком и замороженном состояниях значительно улучшалась при использовании аспарагиновой кислоты или глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину и аргинину. В частности, устойчивость Mab1 в замороженном состоянии значительно улучшалась (приблизительно в три таза) при использовании глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину и аргинину. В этом контексте глутаминовую кислоту и хлористоводородную кислоту оценивали в качестве разновидности противоиона к гистидину на их способность к стабилизации Mab2 во время замораживания-оттаивания. Содержащие аргинин композиции, обладающие высоким стабилизирующим эффектом, также оценивали в то же время и использовали в качестве контроля для сравнения стабилизирующего эффекта, наблюдаемого при использовании глутаминовой кислоты в качестве разновидности противоиона к гистидину.
Каждую композицию приготавливали одним способом, как описано в Примере 1. Mab2 подвергали суточному диализу с применением каждого рецептированного раствора (Таблица 3). Затем каждый раствор концентрировали и конечную концентрацию Mab2 доводили приблизительно до 40-230 мг/мл. Способ получения каждого рецептированного раствора описывается ниже. Образцы композиций №№6 и 8 приготавливали следующим образом: L-гистидин и L-аргинин (только композиция №8) растворяли в воде MilliQ при 50 мМ и растворы титровали до рН 6 1 N хлористоводородной кислотой. Образец композиции №7 приготавливали следующим образом: L-гистидин и L-глутаминовую кислоту растворяли в воде MilliQ при 50 мМ и 25 мМ, соответственно, а затем раствор титровали до рН 6 раствором 30-40 мМ L-глутаминовой кислоты. Концентрация Mab2 в каждой композиции после приготовления образца показывается в Таблице 4. Исследование с замораживанием-оттаиванием осуществляли с десятью циклами замораживания при -20°С с последующим оттаиванием при комнатной температуре (медленное замораживание-оттаивание). После медленного замораживания-оттаивания количество агрегата в каждой композиции рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
|
Увеличение количества (%) агрегата для каждой композиции в исследовании с замораживанием-оттаиванием показывается на Фиг.8. Результаты продемонстрировали, что при использовании глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину устойчивость Mab2 улучшается приблизительно в два раза. Кроме того, стабилизирующий эффект глутаминовой кислоты был сравним с эффектом 50 мМ аргинин хлорида, который является традиционным стабилизатором. Таким образом, было продемонстрировано, что одна глутаминовая кислота обеспечивает высокий стабилизирующий эффект в качестве разновидности противоиона.
В то же время, считается, что отношение осмотического давления буфера предпочтительно должно быть приближенным к изотоническому 1,0 в композициях для подкожного введения из-за болезненности инъекции. Устойчивость во время замораживания-оттаивания была сравнимой для 50 мМ гистидин-хлорида/50 мМ аргинин-хлорида и 50 мМ гистидин-глутамата. Осмотическое давление буфера в последнем случае было приблизительно на 100 мосмоль ниже, чем в первом. Таким образом, как описано выше, при улучшении устойчивости путем применения аспарагиновой кислоты или глутаминовой кислоты в качестве разновидности противоиона устойчивость может быть повышена без повышения осмотического давления. Это может быть большим преимуществом в разработке композиций для подкожного введения.
В то же время, аргинин, сахара и т.п. Добавляют для улучшения устойчивости композиций во время хранения. Однако, если осмотическое давление превышает изотонический уровень, инъекция может быть болезненной при подкожном введении. Таким образом, такие стабилизаторы должны добавляться с учетом осмотического давления (Injectable Drug Development, Authors: Pramod К. Gupta (Editor), Gayle A. Brazeau, Gayle A; Challenges in the development of high protein concentration formulations, J Pharm Sci, 2004, 93(6), 1390-1402). При добавлении хлористоводородной кислоты или уксусной кислоты в качестве разновидности противоиона к гистидину или аргинина ни хлористоводородная кислота, ни уксусная кислота не обладают эффектом стабилизации Mab1. Таким образом, хлористоводородная кислота и уксусная кислота только обеспечивают эффект повышения осмотического давления. Соответственно, с точки зрения осмотического давления концентрация разновидностей ионов, не обладающих стабилизирующим эффектом, должна быть сведена в композициях до минимума. В частности, также с точки зрения осмотического давления, предпочтительным является отсутствие хлористоводородной кислоты и уксусной кислоты. Гистидин-глутамат и гистидин-аспартат превосходят в качестве буфера гистидин-хлорид и гистидин-ацетат; и аргинин-глутамат и аргинин-аспартат превосходят в качестве стабилизатора аргинин-хлорид и аргинин-ацетат.
[Пример 4] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab1 (2)
Как описано в Примерах 2 и 3, при использовании глутаминовой кислоты в качестве разновидности противоиона к гистидину и аргинину устойчивость Mab1 значительно улучшалась - приблизительно в два-три раза, в частности, во время хранения в замороженном виде. В этом контексте исследование устойчивости с хранением при -20°С проводили для оценки устойчивости Mab1 с хранением при -20°С при использовании глутаминовой кислоты в качестве разновидности противоиона к гистидину и аргинину и сахара (трегалозы) в качестве стабилизатора. Одновременно также проводили исследование с хранением в жидком состоянии и замораживанием-оттаиванием.
Каждую композицию приготавливали следующим образом: Mab1 подвергали суточному диализу с применением каждого рецептированного раствора (Таблица 5); затем растворы концентрировали и конечную концентрацию Mab1 доводили до 200 мг/мл. Способ приготовления каждого рецептированного раствора описывается ниже. L-Гистидин, L-аргинин, L-глутаминовую кислоту и трегалозу растворяли в воде MilliQ при 100 мМ, 50 мМ, 100 мМ и от 0 до 150 мМ, соответственно, а затем растворы титровали до рН 6 раствором от 30 до 40 мМ L-глутаминовой кислоты. Исследование с замораживанием-оттаиванием осуществляли с десятью циклами замораживание при -20°С с последующим оттаиванием при комнатной температуре (медленное замораживание-оттаивание). Количество агрегата в каждой композиции после замораживания-оттаивания или хранения при -20°С и 25°С рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
Увеличение количества (%) агрегата каждой композиции после храпения при -20°С, замораживания-оттаивания и хранения при 25°С показывается на Фигурах с 9 по 11. Путем добавления 50 мМ или более трегалозы получали композицию, агрегация которой практически не повышалась во время хранения при -20°С и замораживания-оттаивания, как можно видеть на Фигурах с 9 по 11. Кроме того, зависящий от концентрации трегалозы стабилизирующий эффект наблюдался при хранении в жидком состоянии при 25°С. Как описано выше, авторами настоящего изобретения были найдены простые композиции, состоящие только из аминокислот и сахара, которые способствуют стабилизации во время хранения в жидком состоянии и хранении в замороженном состоянии.
[Пример 5] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab2 (2)
Как описано в Примере 1, было обнаружено, что Mab2 стабилизируется гистидин-хлоридом лучше, чем гистидин-ацетатом, как и Mab1 (Фиг.2). Кроме того, как описано в Примере 2, устойчивость Mab1 в жидком и замороженном состояниях значительно улучшалась при использовании аспарагиновой кислоты или глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину и аргинину. В этом контексте устойчивость Mab2 во время хранения в виде жидкости (25°С) использовали для оценки хлористоводородной кислоты и глутаминовой кислоты в качестве разновидности противоиона к гистидину. Содержащие аргинин композиции обладающие высоким стабилизирующим эффектом также оценивали в то же время и использовали в качестве контроля для сравнения стабилизирующего эффекта, наблюдаемого при использовании глутаминовой кислоты в качестве разновидности противоиона к гистидину.
Каждую композицию приготавливали одним способом, как описано в Примере 1. Mab2 подвергали суточному диализу с применением каждого рецептированного раствора (Таблица 3). Затем растворы концентрировали и конечную концентрацию Mab2 доводили приблизительно до 40-230 мг/мл. Способ приготовления рецептированных растворов был таким, как описано в Примере 3. Концентрация Mab2 в каждой композиции после приготовления образца показывается в Таблице 4. Количество агрегата в каждой композиции в течение двух-четырех недель хранения при 25°С рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
Увеличение количества (%) агрегата для каждой композиции после хранения при 25°С показано на Фиг.12. Результаты показали, что, в отличие от исследования с замораживанием-оттаиванием, устойчивость Mab2 не изменялась даже при использовании глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину. Показатели pI Mab1 и Mab2 составляют 5,8 и 9,3, соответственно. Это свидетельствует о значительности стабилизирующего влияния разновидностей противоиона на антитела с низким pI при хранение в жидком состоянии.
[Пример 6] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab1, Mab2, Mab3, Mab4 и Mab5
Mab3 является биспецифическим антителом фактора IX и фактора Х и имеет IgG4-константную область. Кроме того, его показатель pI был снижен до 6,8 путем изменения аминокислотной последовательности.
Mab4 является гуманизированным антителом против NR10 (полностью гуманизированным антителом NS22, полученным в соответствии со способом, описанным в Примере 12 документа WO 2009/072604) и относится к классу антител IgG2. Его показатель pI был снижен до 5,6 путем изменения аминокислотной последовательности.
Mab5 является гуманизированным антителом против глипикана 3 (оно было гуманизировано способом, описанным в Примере 24 документа WO 2006/006693, и его L-цепь была изменена способом в соответствии с Примером 25). Относится к классу антител IgG1.
Как описано в Примерах 2 и 3, было продемонстрировано, что устойчивость Mab1 в жидком и замороженном состояниях и Mab2 значительно улучшается при использовании аспарагиновой кислоты или глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину и аргинину. Затем Mab1 и Mab2, а также Mab3, Mab4 и Mab5, которые являются антителами, модифицированными для обеспечения изоэлектрической точки от 5 до 8, использовали для оценки устойчивости раствора и устойчивости при замораживании-оттаивании при использовании хлористоводородной кислоты и аспарагиновой кислоты в качестве разновидности противоиона к гистидину и аргинину. Показатели pI Mab1, Mab2, Mab3, Mab4 и Mab5 представлены ниже в Таблице 6.
|
Образцы приготавливали следующим образом: Mab1, Mab2, Mab3, Mab4 и Mab5 подвергали диализу с применением каждого диализного буфера (Таблица 7) в течение суток. Затем раствор каждого антитела концентрировали и к нему добавляли маточный буфер для каждой композиции (Таблица 8), таким образом, чтобы довести конечную концентрацию антитела приблизительно до 100-190 мг/мл. Список рецептированных растворов, приготовленных, как описано выше, показан в Таблице 9. Для каждой композиции осуществляли исследовании с хранением в жидком состоянии при 25°С и замораживанием-оттаиванием. Исследование с замораживанием-оттаиванием осуществляли в десять циклов замораживания при -20°С с последующим оттаиванием при 25°С (медленное замораживание-оттаивание). После медленного замораживания-оттаивания количество агрегата в каждом образце рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
|
|
Результат увеличения количества (%) агрегата в каждой композиции после замораживания-оттаивания или хранения в жидком состоянии при 25°С показывается на Фигурах с 13 по 20. Сравнение увеличения количества агрегата во время хранения в виде жидкости при 25°С продемонстрировало, что показатели устойчивости сравнимы между композицией гистидин-аспартата и композицией гистидин-хлорида и между композицией аргинин-аспартата и композицией аргинин-хлорида (Фигуры 13, 15, 17 и 19).
Тем временем, сравнение увеличения количества агрегатов после замораживания-оттаивания выявило, что устойчивость композиции с гистидин-аспартатом в два раза или более выше показателя композиции с гистидин-хлоридом, и устойчивость композиции с аргинин-аспартатом выше показателя композиции с аргинин-хлоридом (Фигуры 14, 16, 18 и 20). Таким образом, было продемонстрировано, что устойчивость антитела в замороженном состоянии значительно улучшается при использовании аспарагиновой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к гистидину или аргинину.
[Пример 7] Оценка стабилизирующего эффекта разновидностей противоиона с использованием Mab1, Mab2, Mab3, Mab4 и Mab5
Как описано в Примерах 2, 3 и 6, было продемонстрировано, что устойчивость антитела в жидком и замороженном состояниях значительно улучшается при использовании аспарагиновой кислоты или глутаминовой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона в композиции гистидина. Затем хлористоводородную кислоту и аспарагиновую кислоту использовали в качестве разновидности противоиона в композиции трис(гидроксиметил)аминометана (Tris) и оценивали на устойчивость при хранении в жидком состоянии и устойчивость при замораживании-оттаивании с применением Mab1, Mab2, Mab3, Mab4 и Mab5.
Образцы приготавливали следующим образом: Mab1, Mab2, Mab3, Mab4 и Mab5 подвергали диализу с применением каждого диализного буфера (Таблица 10) в течение суток. Затем раствор каждого антитела концентрировали и к нему добавляли маточный буфер для каждой композиции (Таблица 11), таким образом, чтобы довести конечную концентрацию антитела приблизительно до 100-110 мг/мл. Список рецептированных растворов, приготовленных, как описано выше, показан в Таблице 12. Для каждого рецептированного раствора проводили исследование с хранением при 25°С и замораживанием-оттаиванием. Исследование с замораживанием-оттаиванием осуществляли в десять циклов замораживания при -20°С с последующим оттаиванием при 25°С (медленное замораживание-оттаивание). После медленного замораживания-оттаивания количество агрегата в каждом образце рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
|
|
|
Результат увеличения количества (%) агрегата в каждой композиции после замораживания-оттаивания или хранения в жидком состоянии при 25°С показывается на Фигурах 21 и 22. Сравнение увеличения количества агрегата во время хранения в виде жидкости при 25°С продемонстрировало, что показатели устойчивости сравнимы между композицией Tris-аспартата/аргинин-аспартата и Tris-хлорида/аргинин-хлорида (Фиг.21).
В то же время, сравнение увеличения количества агрегата после замораживания-оттаивания выявило, что устойчивость композиции Tris-аспартата/аргинин-аспартата выше показателя композиции Tris-хлорида/аргинин-хлорида (Фиг.22). Таким образом, было продемонстрировано, что устойчивость антитела в замороженном состоянии также значительно улучшается при использовании аспарагиновой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона в композиции Tris.
[Пример 8] Оценка стабилизирующего эффекта разновидностей противоиона к Tris с использованием Mab1, Mab2 и Mab3
Как описано в Примере 7, было продемонстрировано, что устойчивость антитела в замороженном состоянии значительно улучшается при использовании аспарагиновой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона в композиции Tris. Затем хлористоводородную кислоту и аспарагиновую кислоту использовали в качестве разновидности противоиона к Tris и оценивали на устойчивость при хранении в жидком состоянии и устойчивость при замораживании-оттаивании с использованием Mab1, Mab2 и Mab3.
Образцы приготавливали следующим образом: Mab1, Mab2, и Mab3 подвергали диализу с применением каждого диализного буфера (Таблица 13) в течение суток. Затем раствор каждого антитела концентрировали до 100 мг/мл или более высокой концентрации и к нему добавляли каждый диализат, таким образом, чтобы довести конечную концентрацию антитела приблизительно до 100 мг/мл. Список рецептированных растворов, приготовленных, как описано выше, показан в Таблице 14. Исследование с хранением при 25°С и исследование с замораживанием-оттаиванием осуществляли с использованием каждого рецептированного раствора. Исследование с замораживанием-оттаиванием осуществляли в десять циклов замораживания при -20°С с последующим оттаиванием при 25°С (медленное замораживание-оттаивание). После медленного замораживания-оттаивания, количество агрегата в каждом образце рассчитывали через процент от площади с применением эксклюзионной хроматографии (SEC).
|
|
Результат увеличения количества (%) агрегата после замораживания-оттаивания или хранения в жидком состоянии при 25°С в каждой композиции показывается на Фигурах 23 и 24. Сравнение увеличения количества агрегата на основе этого результата продемонстрировало, что во время хранения в жидком состоянии при 25°С и во время замораживания-оттаивания устойчивость композиции Tris-аспартата выше, чем показатель композиции Tris-хлорида, и устойчивость во время замораживания-оттаивания, в частности, больше в два или более раз. Таким образом, было продемонстрировано, что устойчивость антитела также значительно улучшается при использовании аспарагиновой кислоты вместо хлористоводородной кислоты в качестве разновидности противоиона к Tris, используемому в качестве буферного агента.