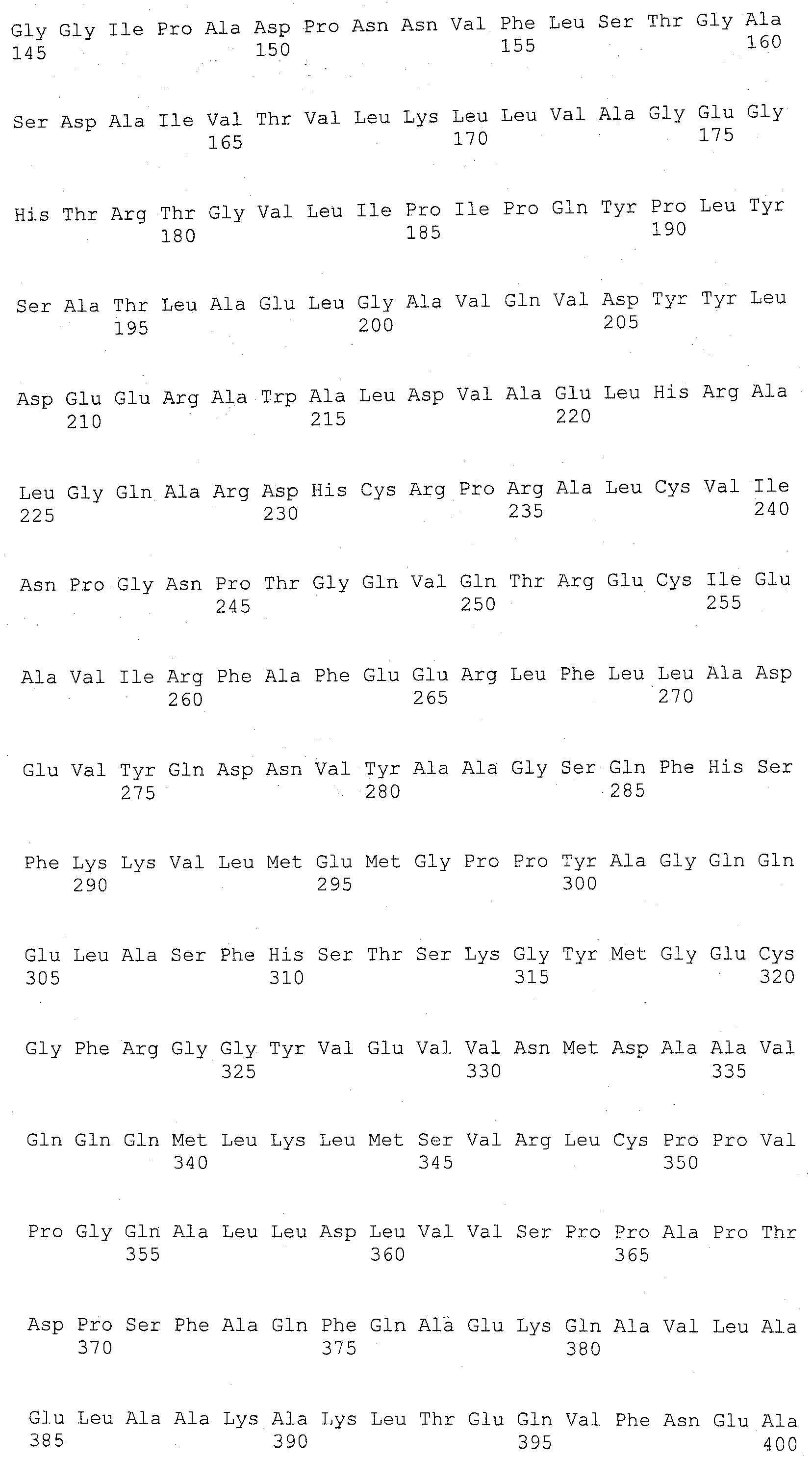Результат интеллектуальной деятельности: КЛЕТКА ДЛЯ ПОЛУЧЕНИЯ ГЕТЕРОПРОТЕИНОВ И СПОСОБ ПОЛУЧЕНИЯ НА ЕЕ ОСНОВЕ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к клетке, применяемой для получения гетеропротеинов, и к способу их получения на ее основе. Более подробно, настоящее изобретение относится к клетке, которая усиленно экспрессирует переносчик бикарбоната, и к способу получения полипептида с использованием такой клетки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В том случае, когда белки, используемые в качестве фармацевтических средств, получают в рамках технологии рекомбинантных ДНК, применение клеток животных позволяет достичь сложной пост-трансляционной модификации и укладки, которые прокариотические клетки не могут осуществить. В этой связи, клетки животных часто используют в качестве клеток-хозяев для получения рекомбинантных белков.
В последнее время было разработано большое число биофармацевтических средств, таких как антитела и физиологически активные белки. Технологии, которые позволяют достичь эффективной продукции рекомбинантных белков клетками животных, ведут к снижению стоимости биофармацевтических средств и дают возможность стабильно снабжать ими пациентов.
В этих условиях желательно иметь способ получения белка с более высокой эффективностью.
Анионообменник представляет собой переносчик, который вовлекается в антипорт внутриклеточных и внеклеточных анионов через плазматическую мембрану (транспортный белок мембраны). Семейство SLC4 представляет собой семейство переносчиков HCO3 -, и три члена, относящиеся к семейству SLC4, а именно: AE1, AE2 и АЕЗ, выполняют функцию обмена Cl-, находящегося за пределами плазматической мембраны, на HCO3 - с внутренней стороны плазматической мембраны.
В почке, AE1 обнаружен в интеркалирующих клетках а в собирающих протоках в базолатеральной мембране (непатентный документ 1). Известно, что мутации в человеческом AE1 вызывают ацидоз дистальных почечных канальцев (непатентные документы 2 и 3).
Кроме того, в почке были выявлены три изоформы AE2, а именно: AE2a, AE2b и AE2c. Считается, что AE2 регулирует гомеостаз внутриклеточного pH для сигнальной трансдукции в клетке (непатентный документ 4). Однако было обнаружено, что мышь, нокаутная по AE2, которая погибает в период отлучения от матери, не имеет фенотипических аномалий почки (непатентный документ 5).
SLC26 представляет собой относительно новое семейство анионообменников, и было высказано предположение, что множество его членов (например, SLC26A3, SLC26A4, SLC26A6 и SLC26A9) являются переносчиками бикарбоната (непатентные документы 6-11).
С другой стороны, неизвестно, можно ли за счет усиленной экспрессии аниообменника, имеющего функцию переносчика бикарбоната, захвата анионов в культивируемой клетке и экскреции анионов за пределы клетки, в которые вовлекается переносчик бикарбоната, достичь искусственного усиления, которое способствовало бы улучшению продукции желаемого рекомбинантного белка в культивируемой клетке.
Непатентный документ 1. van Adelsberg JS. et. al., J Biol Chem 1993; 268:11283-11289
Непатентный документ 2. Shayakui С.et. al., Curr Opin Nephrol Hypertens 2000; 9:541-546
Непатентный документ 3. Alper SL. etal., Annu Rev Physiol 2002; 64:899-923
Непатентный документ 4. Komlosi P. et. al.. Am J Physiol Renal Physiol 2005; 288:F380-F386
Непатентный документ 5. Gawenis LR. et. al., J Biol Chem 2004; 279:30531-30539
Непатентный документ 6. Melvin et al, J Biol Chem 1999; 274:22855-22861
Непатентный документ 7. Ко et al., EMBO J. 2002; 21:5662-5672
Непатентный документ 8. Soleimani et al., Am. J. Physiol. Renal Physiol. 2001; 280:F356-F364
Непатентный документ 9. Wang et al. Am. J. Physiol. Gastrointest. Liver Physiol. 2002; 282:G573-G579
Непатентный документ 10. Petrovic et al., Am. J. Physiol. Renal Physiol. 2004; 286:F161-F169
Непатентный документ 11. Xu et al., Am. J. Physiol. Cell Physiol. 2005; 289:C493-C505
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является разработка способа, который позволял бы эффективно получать полипептид.
ПОДХОДЫ К РЕШЕНИЮ ПРОБЛЕМЫ
В результате масштабных и интенсивных исследований в направлении решения указанной выше проблемы, авторы настоящего изобретения обнаружили, что можно повысить выход желаемого полипептида за счет использования клетки, которая усиленно экспрессирует переносчик бикарбоната. И таким образом цель настоящего изобретения была достигнута. Более того, желаемый полипептид может быть получен в еще большем количестве при использовании клеток, способных к совместной экспрессии переносчика бикарбоната и декарбоксилазы цистеин-сульфиновой кислоты (далее иногда обозначаемой как "CSAD") или аланинаминотрансферазы (далее иногда обозначаемой как "ALT").
Настоящее изобретение можно в обобщенном виде представить следующим образом.
(1) Способ получения полипептида, включающий культивирование клетки, которая усиленно экспрессирует переносчик бикарбоната и которая имеет перенесенную ДНК, кодирующую желаемый полипептид, что позволяет клетке продуцировать указанный полипептид.
(2) Способ по указанному выше пункту (1), в котором клетка, которая усиленно экспрессирует переносчик бикарбоната, представляет собой клетку, в которую была перенесена ДНК, кодирующая переносчик бикарбоната.
(3) Способ получения по указанному выше пункту (1) или (2), в котором клетка, которая усиленно экспрессирует переносчик бикарбоната, дополнительно экспрессирует декарбоксилазу цистеинсульфиновой кислоты или аланинаминотрансферазу.
(4) Способ получения по любому из указанных выше пунктов (1)-(3), в котором переносчик бикарбоната представляет собой анионообменник SLC4 или анионообменник SLC26.
(5) Способ получения по любому из указанных выше пунктов (1)-(3), в котором переносчик бикарбоната представляет собой анионообменник SLC4.
(6) Способ получения по указанному выше пункту (5), в котором анионообменник SLC4 представляет собой AE1.
(7) Способ по любому из указанных выше пунктов (1)-(6), в котором клетка представляет собой клетку яичника китайского хомячка.
(8) Способ по любому из указанных выше пунктов (1)-(7), в котором желаемый полипептид представляет собой антитело.
(9) Способ по любому из указанных выше пунктов (4)-(6), в котором ДНК, кодирующая анионообменник SLC4, представляет собой любую ДНК по пунктам (a)-(e):
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO:2;
(b) ДНК, кодирующая полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делегирования, добавления и/или инсерции одной или нескольких аминокислотных остатков и которая все еще обладает активностью анионообменника SLC4;
(c) ДНК, кодирующая полипептид, имеющий 50% или большую гомологию аминокислотной последовательности с аминокислотной последовательностью, представленной в SEQ ID NO:2, и которая все еще обладает активностью анионообменника SLC4;
(d) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ED NO:1;
(e) ДНК, которая гибридизуется в жестких условиях с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4.
(10) Способ получения фармацевтического средства, содержащего полипептид, полученный способом по любому из указанных выше пунктов (1)-(9).
(11) Клетка, которая имеет перенесенную ДНК, кодирующую переносчик бикарбоната, и перенесенную ДНК, кодирующую желаемый полипептид.
(12) Клетка по указанному выше пункту (11), которая дополнительно имеет перенесенную ДНК, кодирующую декарбоксилазу цистеин-сульфиновой кислоты или аланинаминотрансферазу.
(13) Клетка, которая имеет перенесенную ДНК, кодирующую переносчик бикарбоната, и перенесенную ДНК, кодирующую декарбоксилазу цистеин-сульфиновой кислоты или аланинаминотрансферазу.
ЭФФЕКТ, ДОСТИГАЕМЫЙ ПРИ ОСУЩЕСТВЛЕНИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением становится возможным получение желаемого полипептида с высоким выходом.
Настоящее описание охватывает информацию, раскрытую в описании и/или на рисунках заявки на патент Японии №2007-276182, на основании которой испрашивается приоритет настоящей заявки на патент.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
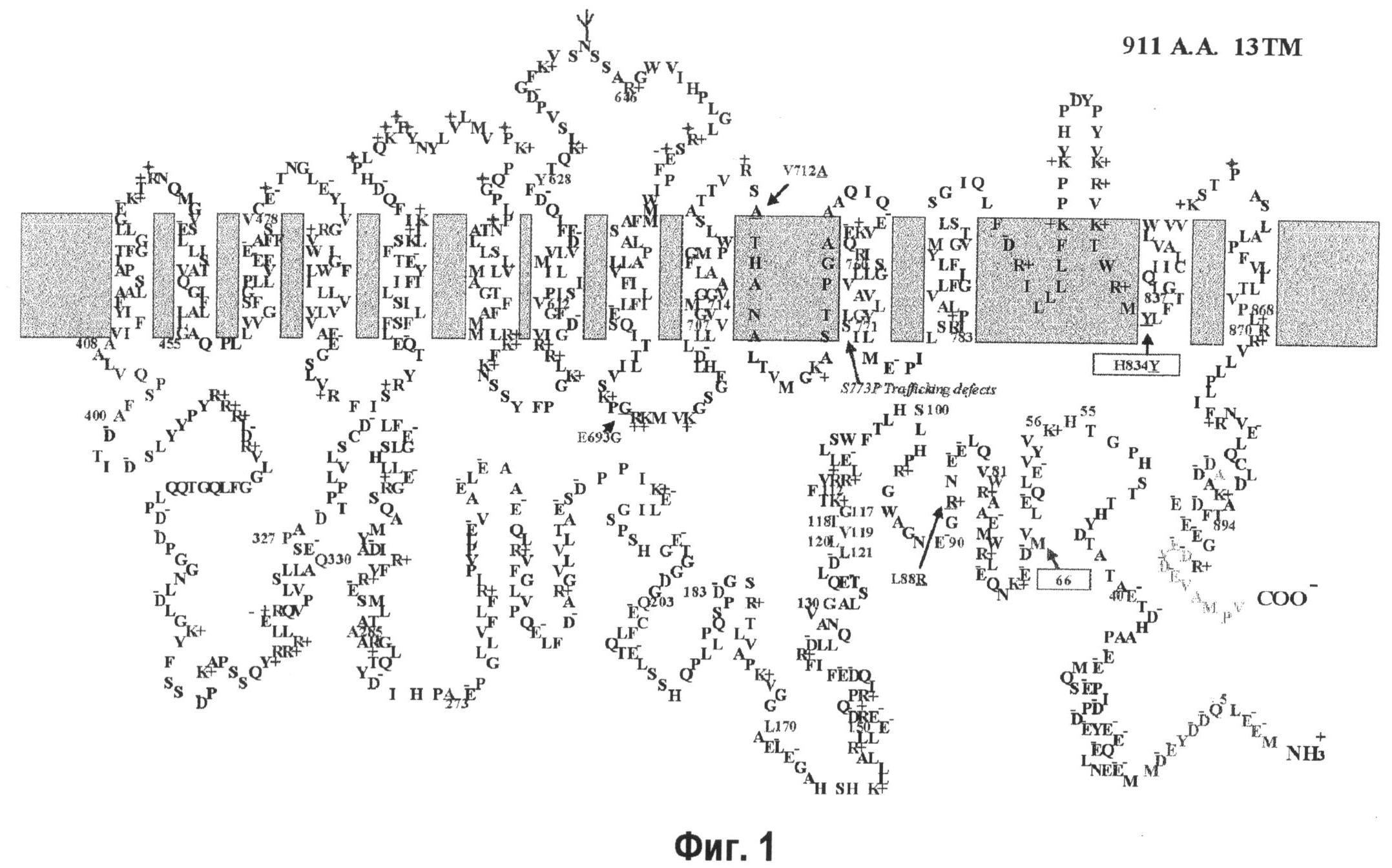
На фиг.1 показана топология мембранного AE1, полученная на основе трансмембранного домена и в направлении, прогнозируемом на основании аминокислотной последовательности человеческого AE1 из клеток печени, по данным программы TMpred, применительно к фиг.1, приведенной в Exo Physiol 91.1 pp.153-161, 2006, Seth L. Alper.
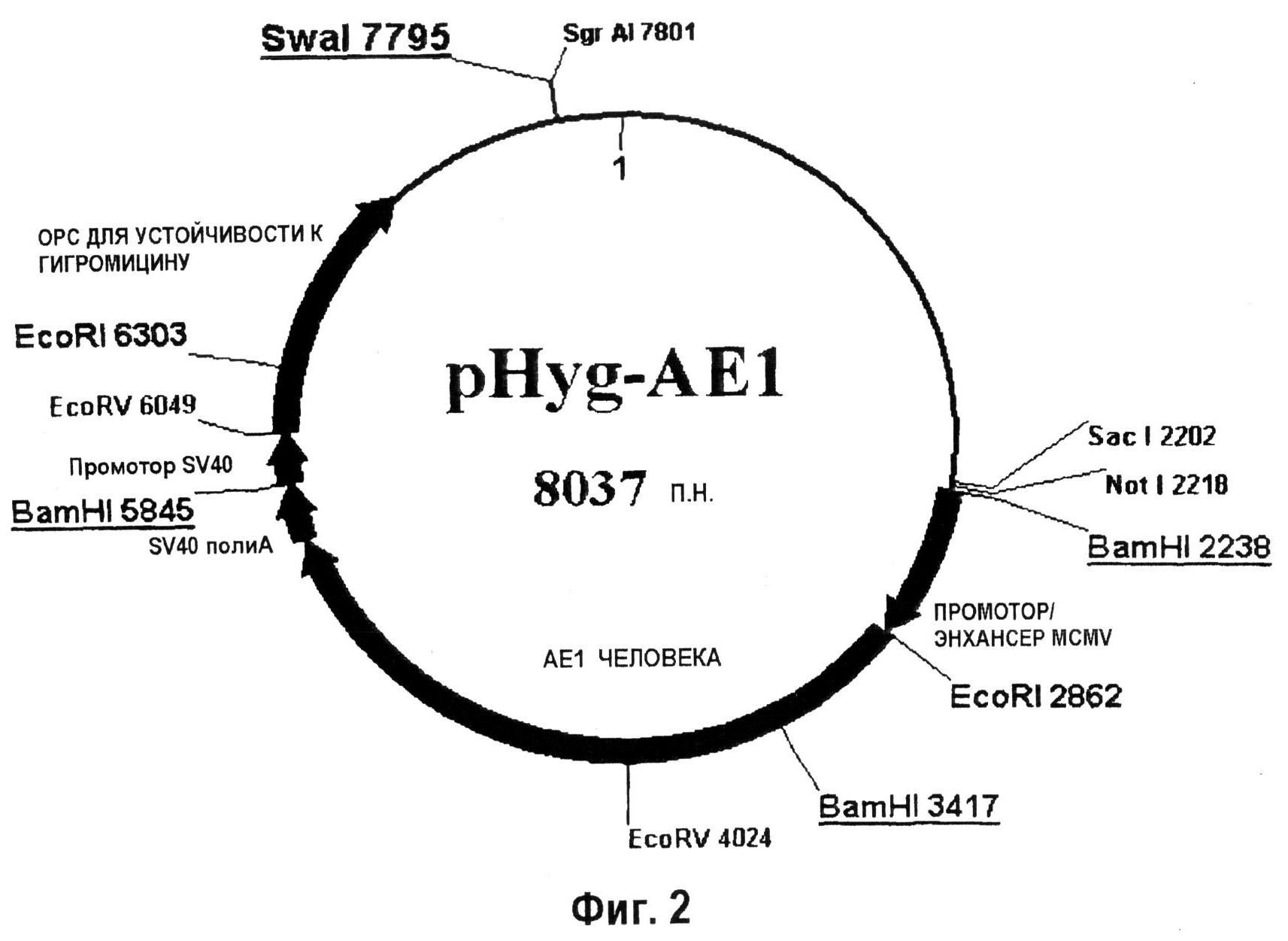
На фиг.2 показана плазмида, используемая для селекции по гигромицину, в которой экспрессировался человеческий АЕ1 (911 аминокислот).
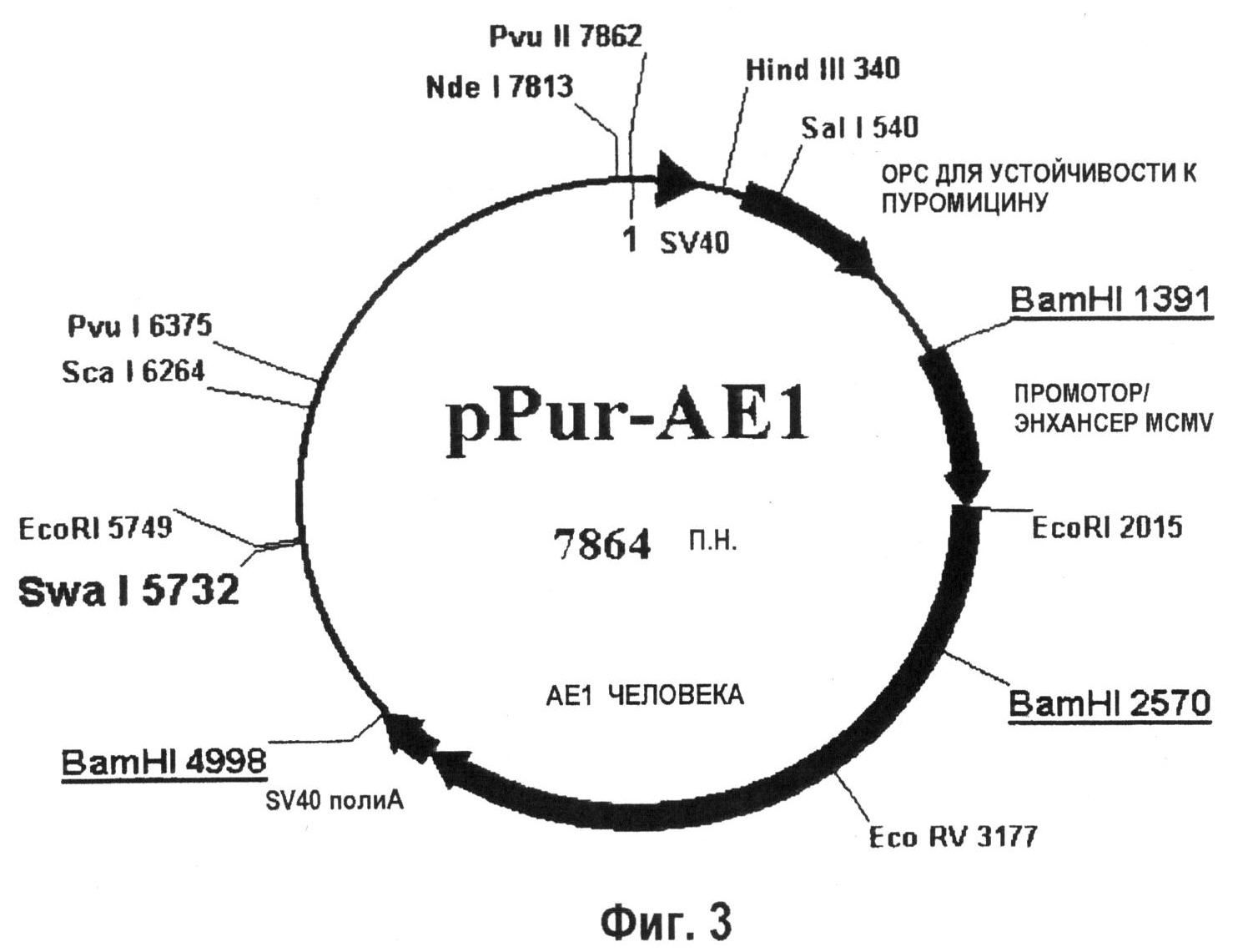
На фиг.3 показана плазмида, используемая для селекции по пуромицину, в которой экспрессировался человеческий AE1 (911 аминокислот).
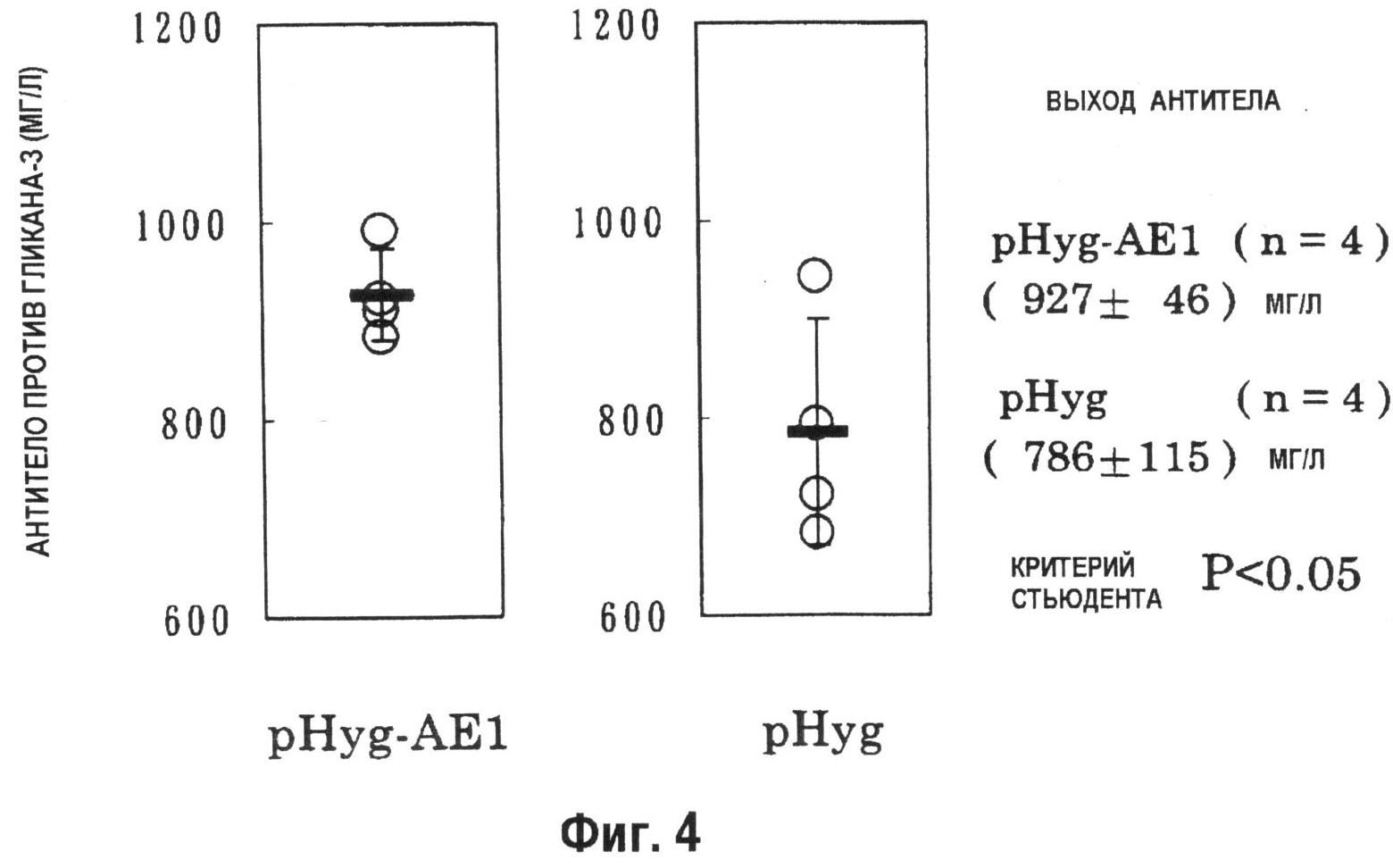
На фиг.4 показан график, демонстрирующий взаимосвязь количества антитела против гликана-3, продуцируемого на 12 день в периодической культуре с подпиткой в качалочных колбах на 50 мл. Количество анти-гликан-3 антитела, продуцируемого pHyg-AE1-трансформированными клетками (n=4), значительно превышало количество, продуцируемое pHyg-трансформированными клетками (n=4) (P<0,05).
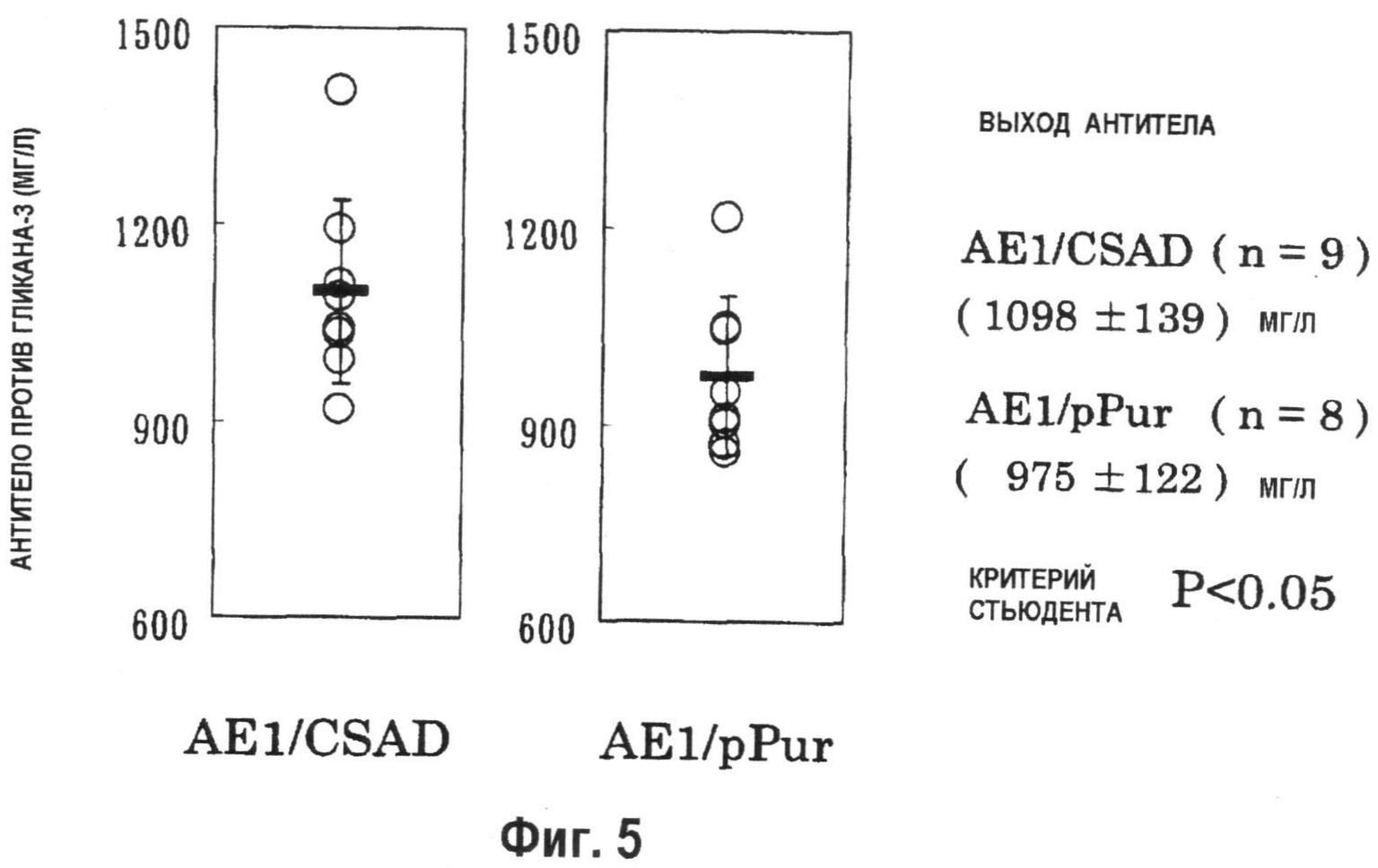
На фиг.5 показан график, демонстрирующий взаимосвязь количества антитела против гликана-3, продуцируемого на 10 день в периодической культуре с подпиткой в качалочных колбах на 50 мл. Количество анти-гликан-3 антитела, продуцируемого штаммом совместно экспрессирующих клеток AE1/CSAD (n=9), которые бьши получены при введении pPur-CSAD в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антитела с высоким выходом, было значительно выше, чем количество, которое продуцировали совместно экспрессирующие AE1/pPur клетками (n=8), которые получали при введении pPur в штамм pHyg-AE1-42 (P<0,05).
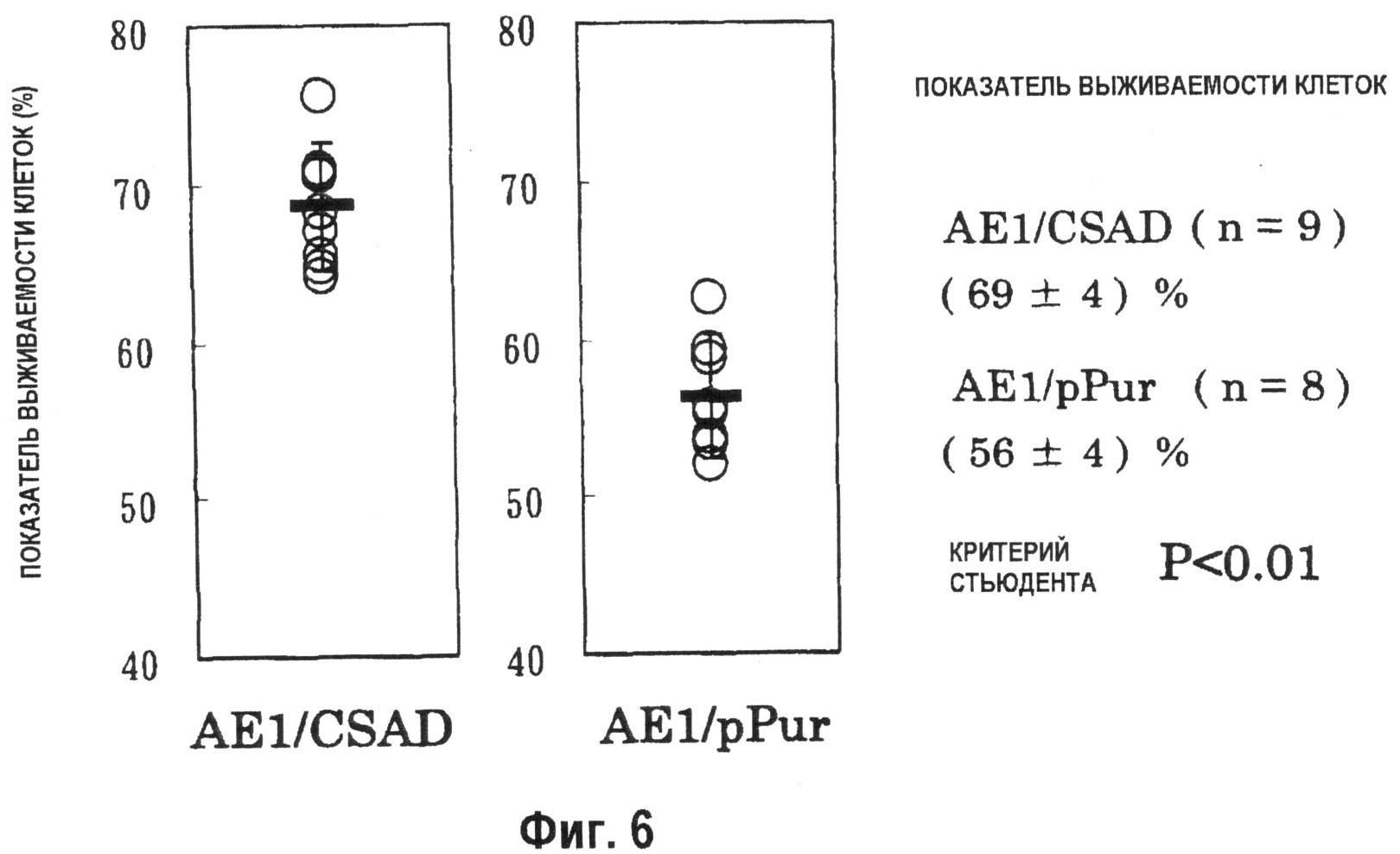
На фиг.6 показан график, демонстрирующий на 10 день зависимость уровней выживания периодической культуры с подпиткой в качалочных колбах на 50 мл. Уровень выживания штамма совместно экспрессирующих клеток AE1/CSAD (n=9), которые были получены при введении pPur-CSAD в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антител с высоким выходом, был значительно выше, чем количество, образуемое совместно экспрессирующими AE1/pPur клетками (n=8), которые были получены при введении pPur в штамм pHyg-AE1-42 (Р<0,01).
Уровень выживания на 7 день выращивания культуры также характеризовался показателем Р<0,01 (данные не приведены).
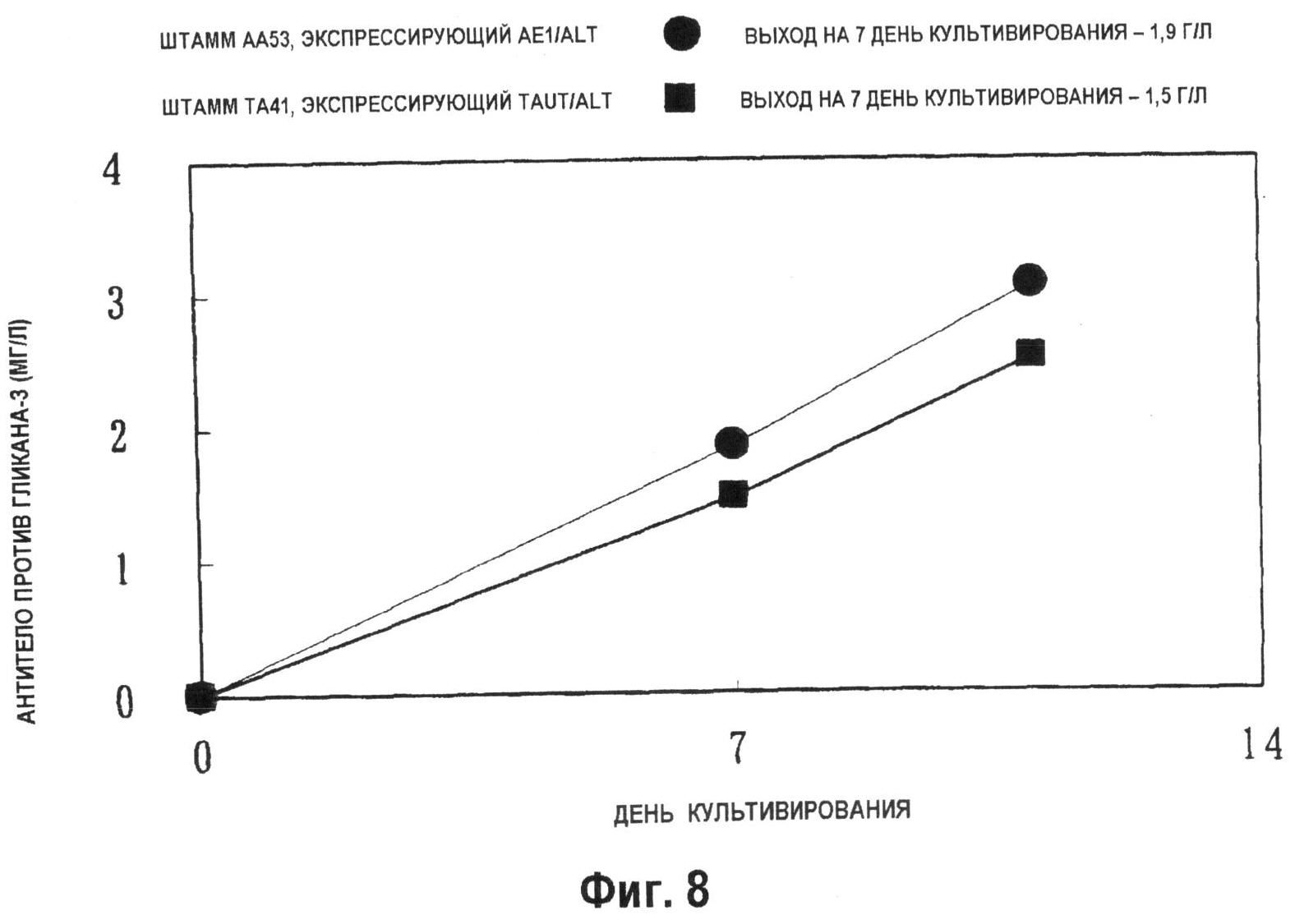
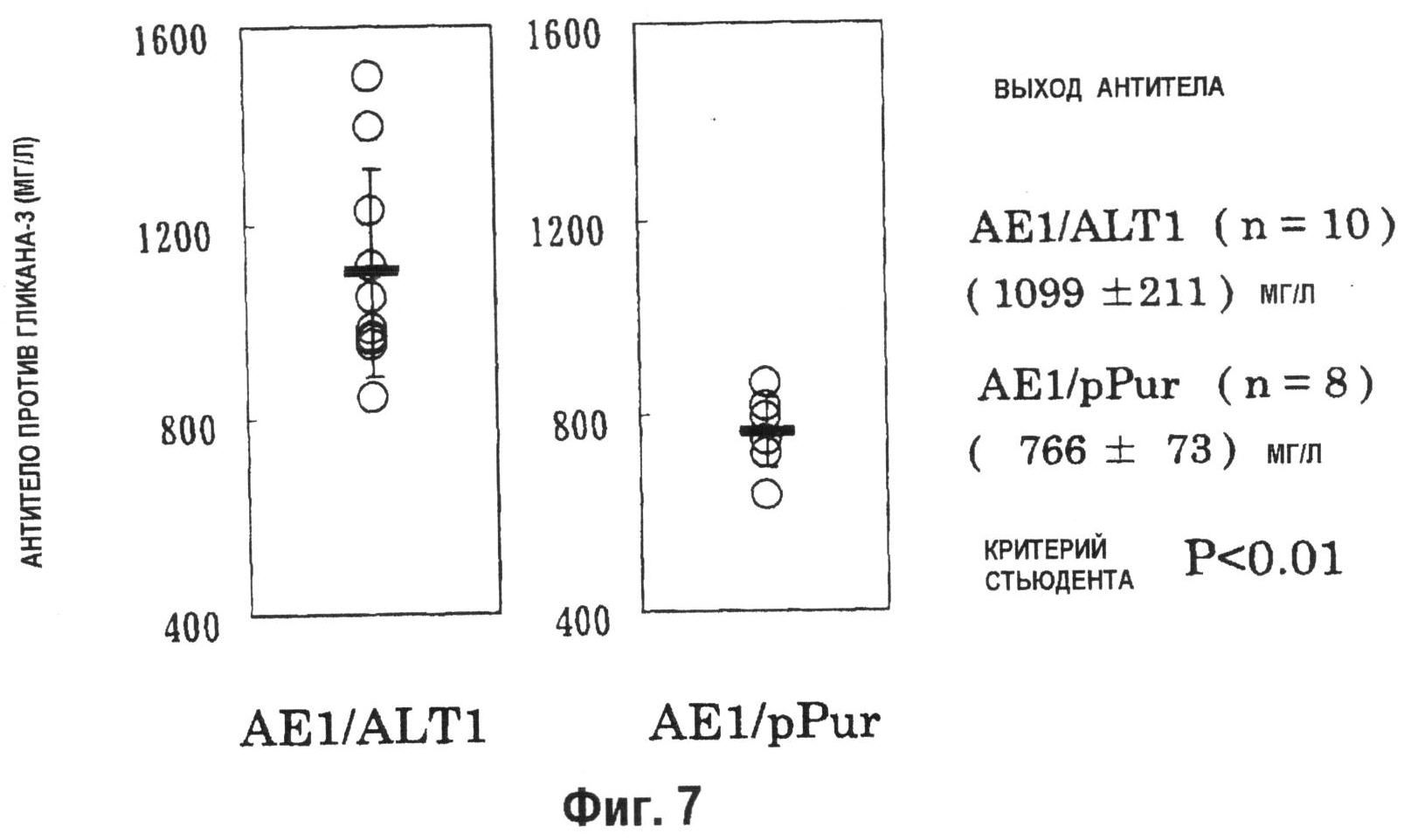
На фиг.7 показан график, демонстрирующий зависимость количества образуемого антитела против гликана-3 на 8 день выращивания периодической культуры с подпиткой в качалочной колбе на 50 мл. Количество антитела против гликана-3, продуцируемого штаммом совместно экспрессирующих AE1/ALT клеток (n=10), который был получен при введении pPur-ALT1 в штамм pHyg-AE1-42, или pHyg-AE1-трансформированными клетками, способными к образованию антитела с высоким выходом, было выше, чем количество, продуцируемое штаммом AE1/CSAD (n=9) и, кроме того, количество антитела против гликана-3, продуцируемое штаммом совместно экспрессирующих AE1/ALT клеток, было значительно выше, чем количество, образуемое совместно экспрессирующими AE1/pPur клетками (n=8), которые были получены при введении pPur в штамм pHyg-AE1-42 (P<0,01).
На фиг.8 показан график, демонстрирующий взаимосвязь количества антитела, продуцируемого штаммом АА53, или штаммом совместно экспрессирующих AE1/ALT1 клеток, в ходе выращивания периодической культуры в сосуде на 1 л. Количество антитела против гликана-3, образованного на 7 день культивирования, составляло 1,9 г/л.
На фиг.9 показана нуклеотидная последовательность заново клонированного гена CSAD, полученного из CHO клеток хомячка, и рассчитанная на ее основе аминокислотная последовательность.
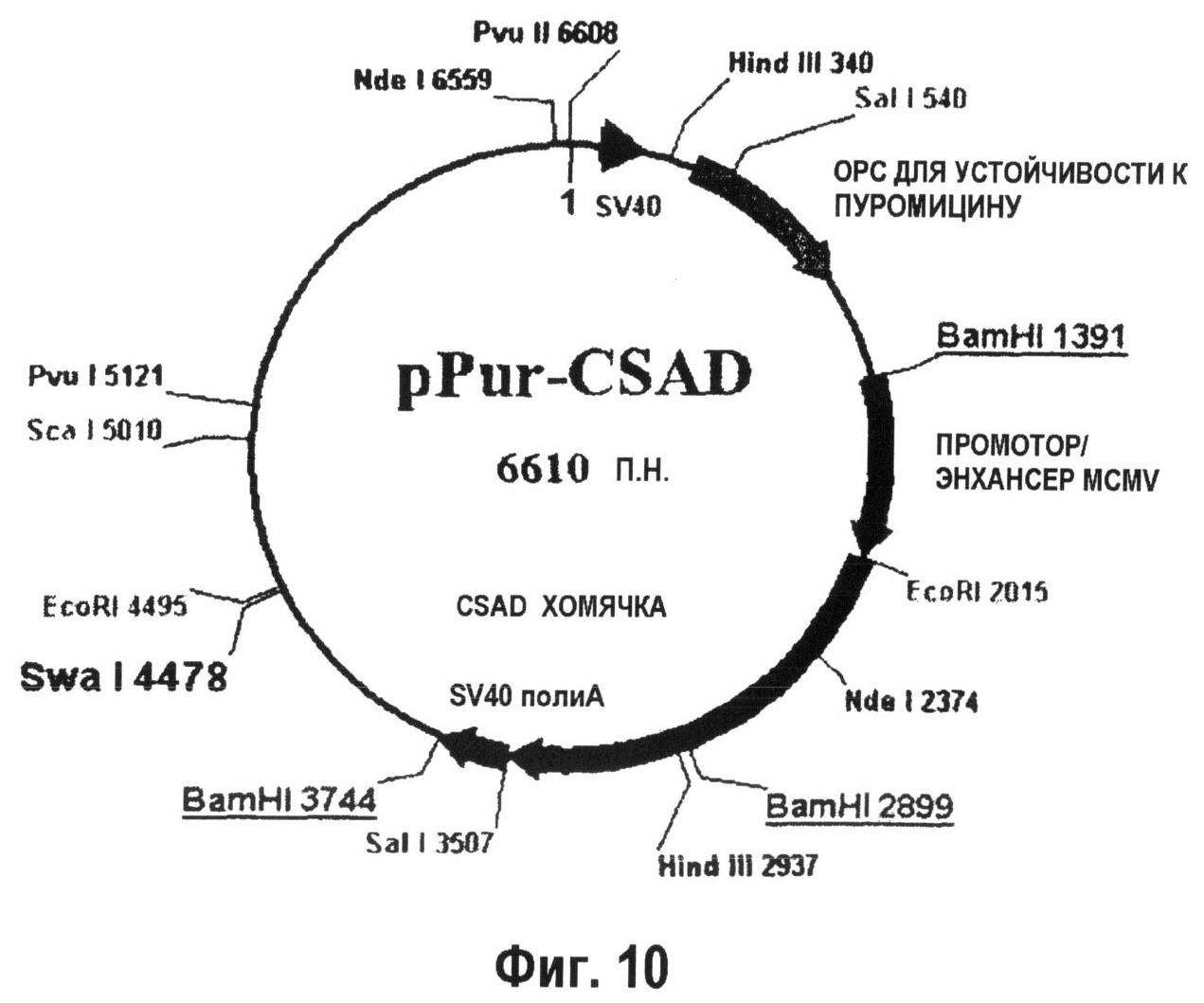
На фиг.10 показана плазмида, используемая для селекции по пуромицину, которую использовали для экспрессии CSAD хомячка (493 аминокислоты).
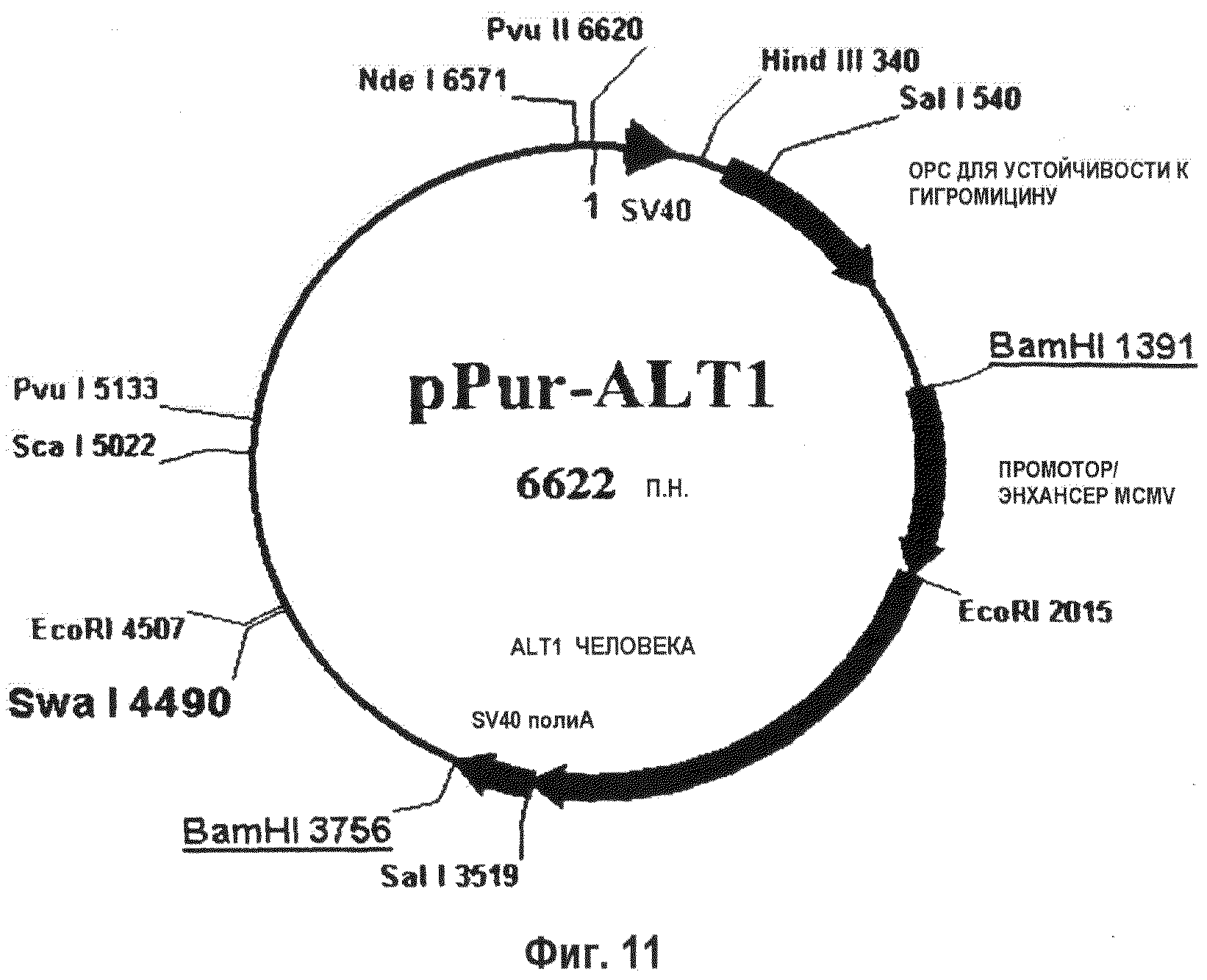
На фиг.11 показана плазмида, используемая для селекции по пуромицину, которую использовали для экспрессии ALT1 человека (496 аминокислот).
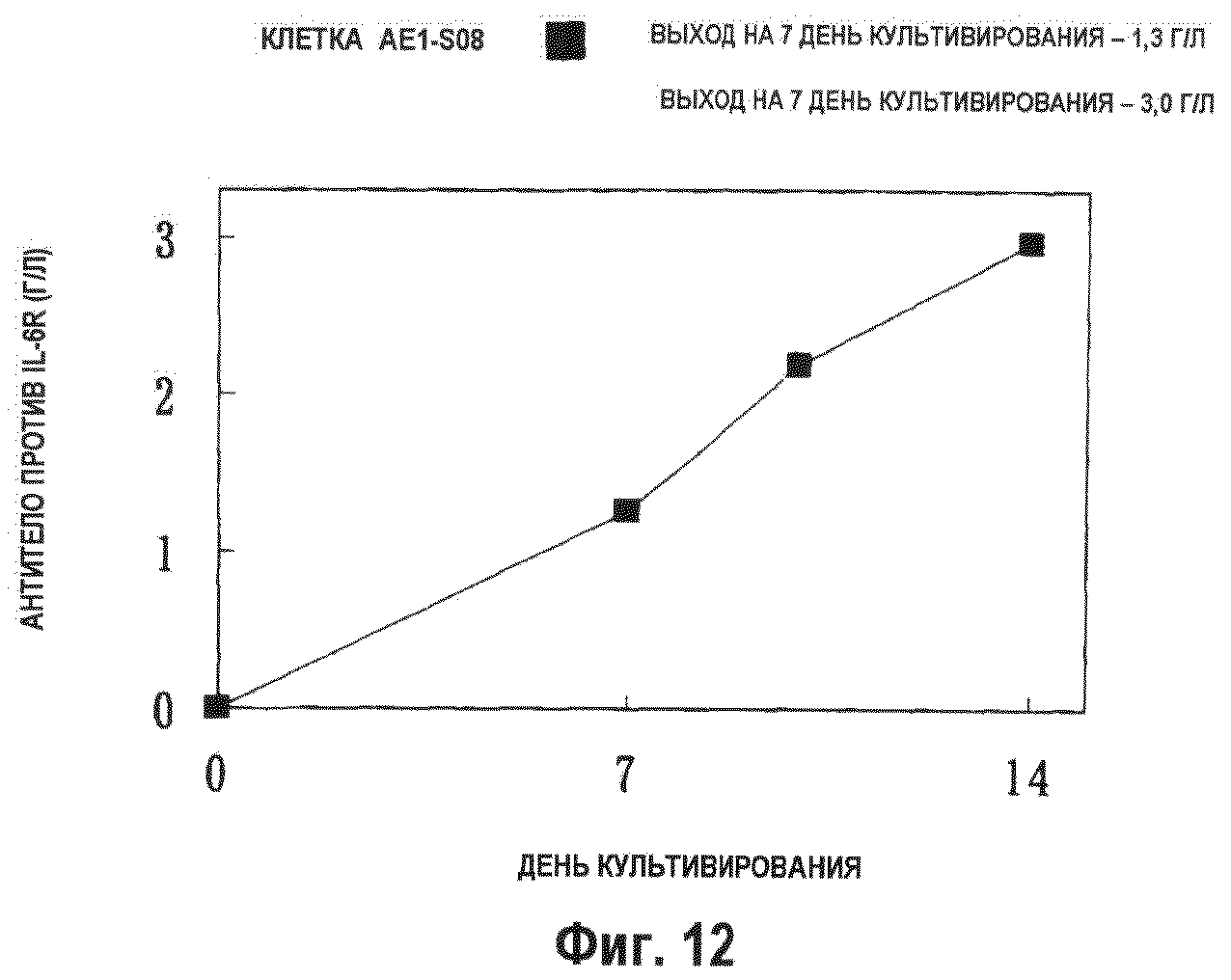
На фиг.12 показан график, демонстрирующий взаимосвязь количества антитела, образуемого клетками AE1-S08, продуцирующими антитело против IL-6R, полученными из клетки-хозяина, усиленно экспрессирующей АЕ1, в ходе периодического культивирования с подпиткой в сосуде на 1 л. Количество антитела против IL-6R, продуцируемого на 14 день культивирования, составляло 3,0 г/л.
На фиг.13 приведена нуклеотидная последовательность заново клонированного гена переносчика таурина, полученного из CHO клеток хомячка, и вычисленная на ее основе аминокислотная последовательность.
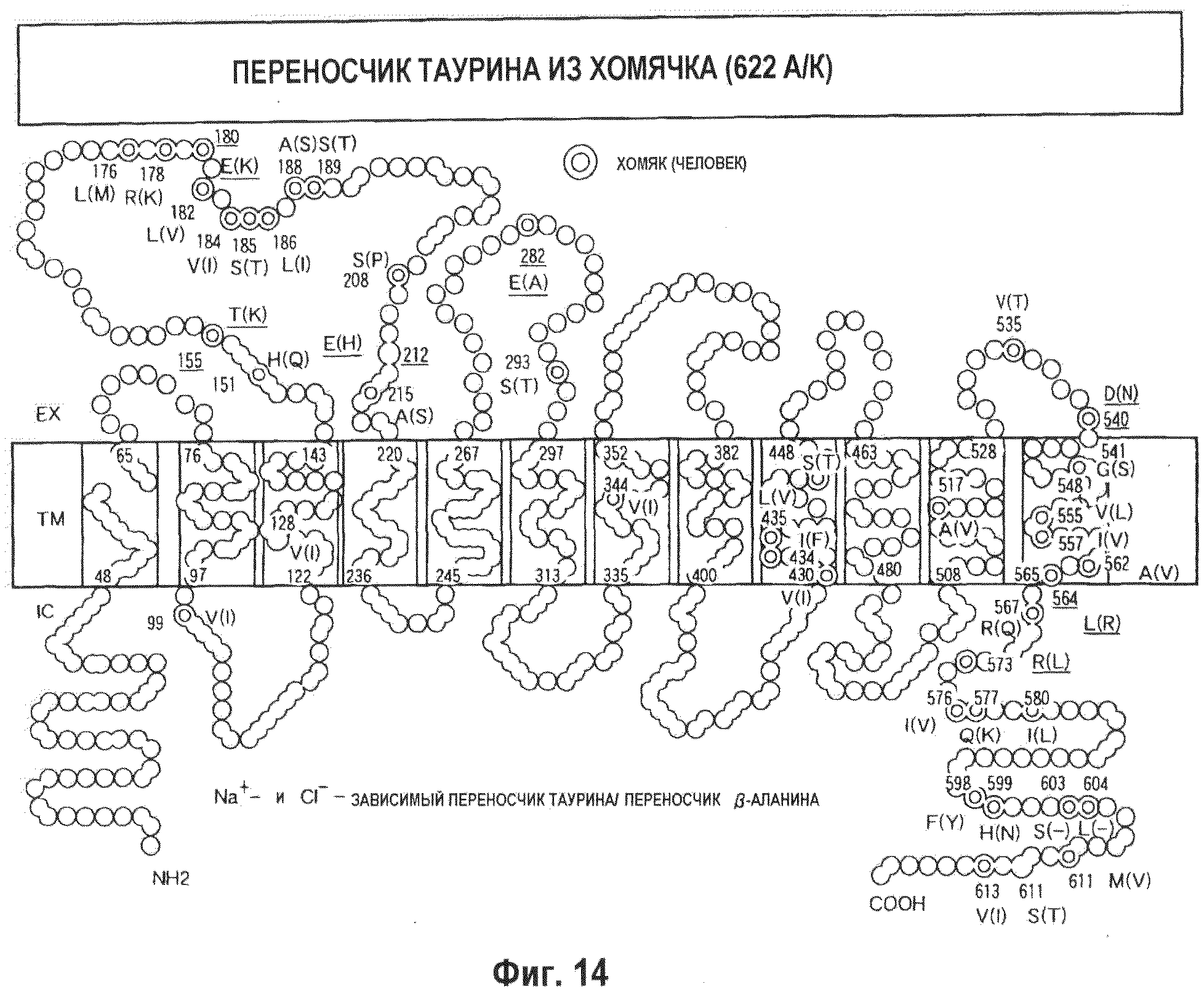
На фиг.14 показана топология мембраны переносчика таурина, которая была создана на основе информации о трансмембранных участках и в ориентации, полученной на основе прогноза с использованием программы TMpred, применительно к аминокислотной последовательности заново клонированного ТаиТ из СНО клеток хомячка, как показано на фиг.5 в работе Shinichi Uchida et al., Proc. Natl. Acad. Sci. USA Vol.89, pp.8230-8234, сентябрь 1992 г. Знак  указывает на специфические для TauT хомячка аминокислотные остатки. Большое число аминокислотных остатков, отличных от остатков, имеющихся в TauT человека, присутствует во второй петле (EX: внеклеточный мембранный участок), на 12 трансмембранном участке (TM) и на C-концевом участке (IC: внутриклеточный участок).
указывает на специфические для TauT хомячка аминокислотные остатки. Большое число аминокислотных остатков, отличных от остатков, имеющихся в TauT человека, присутствует во второй петле (EX: внеклеточный мембранный участок), на 12 трансмембранном участке (TM) и на C-концевом участке (IC: внутриклеточный участок).
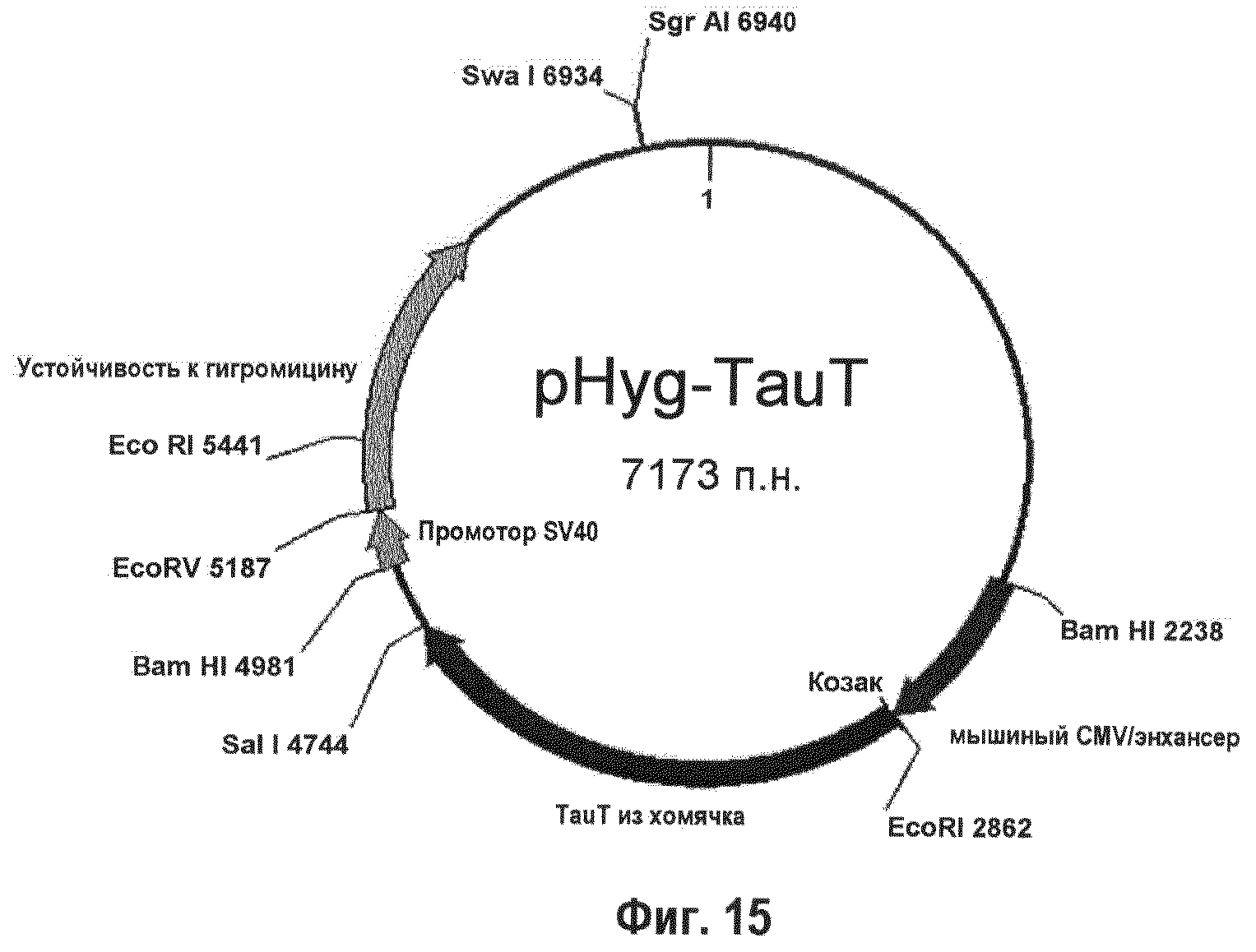
На фиг.15 показана плазмида для селекции по гигромицину, которая была использована для экспрессии ТаиТ из хомячка (622 аминокислоты).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже описаны более подробно варианты осуществления настоящего изобретения.
Настоящее изобретение относится к способу получения полипептида, включающему культивирование клетки, которая усиленно экспрессирует переносчик бикарбоната и имеет перенесенную ДНК, кодирующую желаемый полипептид, что позволяет клетке продуцировать нужный полипептид.
Клетка, используемая в способе по настоящему изобретению, может представлять собой либо природную клетку, способную к продукции желаемого полипептида, либо трансформированную клетку, в которую была перенесена ДНК, кодирующая желаемый полипептид. Предпочтительный способ включает трансформированную клетку, в которую была перенесена ДНК, кодирующая желаемый полипептид.
В способе по настоящему изобретению, желаемый полипептид каким-либо образом не ограничен. Указанный.полипептид может представлять собой любой полипептид, такой как антитело (например, антитело против рецептора IL-6, антитело против гликана-3, антитело против CD-3, антитело против CD-20, антитело против GPIIb/IIIa, антитело против TNF, антитело против CD-25, антитело против EGFR, антитело против Her2/neu, антитело против RSV, антитело против CD-33, антитело против CD-52, антитело против IgE, антитело против CD11a, антитело против VEGF, антитело против VLA4 и т.п.) или физиологически активный белок (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, интерферон, интерлейкин, такой как IL-1 или IL-6, t-PA, урокиназа, сывороточный альбумин, фактор свертывания крови, PTH и т.п.). Особенно предпочтительным является антитело, и может использоваться любое антитело, как природное тело, низкомолекулярное антитело (например, Fab, scFv, sc(Fv)2), химерное антитело, гуманизированное антитело и т.п.
При использовании клеток, усиленно экспрессирующих переносчик бикарбоната, количество продуцируемого клетками полипептида может быть повышено.
Переносчик бикарбонатаа представляет собой мембранный белок, который обладает функцией антипорта, с помощью которого бикарбонатные анионы (HCO3 -) или карбонатные анионы (CO3 2-) экскретируются, тогда как хлоридные анионы и сульфатные анионы захватываются. Примером переносчика бикарбоната может служить анионообменник SLC4 и анионообменник SLC26.
Анионообменник SLC4 представляет собой мембранный белок, который регулирует гомеостаз внутриклеточного pH и клеточный объем. В настоящее время в семействе SLC4 известно 10 видов (SLC4A1 (AE1), SLC4A2 (АЕ2), SLC4A3 (АЕ3), SLC4A4 (NBCel), SLC4A5 (NBCe2), SLC4A7 (NBCn1), SLC4A8 (kNBC3), SLC4A9 (NBCn2), SLC4A10 (NBCn3) и SLC4A11 (NaBC1)) и существует, по меньшей мере, один вид изоформы. Указанные анионообменники SLC4 имеют разные функции; например, SLC4A1 (АЕ1), SLC4A2 (АЕ2), SLC4A3 (АЕ3) и SLC4A9 (NBCn2 или АЕ4) являются независимыми от Na+, электрически нейтральными обменниками для Cl- и HCO3 -, SLC4A4 (NBCe1) и SLC4A5 (NBCe2) имеют электрогенный характер, SLC4A7 (NBCn1) представляет собой электрически-нейтральный переносчик для Na+ и HCO3 -, SLC4A8 (kNBC3) и SLC4A10 (NBCn3) представляют собой Na+-зависимые, электрически нейтральные обменники для Cl- и HCO3, и SLC4A11 (NaBC1) представляет собой электрогенный преносчик для Na+ и бората. Указанные выше анионообменники SLC4 демонстрируют сайт-специфическое действие. Так, например, в случае АЕ1, АЕ1, присутствующий в полярных эпителиальных клетках, способствует трансэпителиальной секреции и всасыванию кислот и оснований, тогда как АЕ1, присутствующий в эритроцитах форели, способствует транспорту растворенных веществ. Примерами анионообменника SLC4 являются SLC4A1 (АЕ1), SLC4A2 (АЕ2), SLC4A3 (AE3), SLC4A4 (NBCe1), SLC4A5 (NBCe2), SLC4A7 (NBCn1), SLC4A8 (kNBC3), SLC4A9 (NBCn2), SLC4A10 (NBCn3) и SLC4A11 (NaBC1), в числе которых предпочтительным является AE1.
Анионообменник SLC26 представляет собой многофункциональный мембранный белок, который действует почти во всех системах органов. В случае анионообменника SLC26 известен анионообменник, который опосредует антипорт сульфатных анионов, анионов иодида, анионов формиата, анионов оксалата, хлоридных анионов, гидроксильных анионов, бикарбонатных анионов и т.п., а также участвует в канале переноса ионов хлорида или в системе анион-независимого молекулярного переноса. Считается, что анионообменник SLC26 вовлечен в поддержание гомеостаза различных анионов, и известно 10 видов (SLC26A1, SLC26A2, SLC26A3, SLC26A4, SLC26A5, SLC26A6, SLC26A7, SLC26A8, SLC26A9 и SLC26A11) семейств анионообменников. Так, например, SLC26A3, SLC26A4, SLC26A6 и SLC26A9, которые являются переносчиками для гидроксильных анионов и анионов бикарбоната, регулируют pH внутри мембраны, а также с наружной стороны мембраны, примерно схожим, как и в случае анионообменника SLC4. SLC26A1, SLC26A2, SLC26A4, SLC26A6, SLC26A9 и SLC26A11 экспрессируются в почке. SLC26A1 переносит сульфатные анионы и оксалатные анионы, тогда как SLC26A6 вовлечен в функцию антипорта различных анионов, с тем чтобы захватывать хлорид натрия. SLC26A1, SLC26A4 и SLC26A6 и SLC26A5 являются факторами, вызывающими развитие почечнокаменной болезни, гипертензии и потери слуха, соответственно. SLC26A7 вовлечен в поддержание кислотно-щелочного равновесия и контроля давления крови, таким же образом, как это известно для SLC26A4. Примерами анионообменника SLC26 являются SLC26A1, SLC26A2, SLC26A3, SLC26A4, SLC26A5, SLC26A6, SLC26A7, SLC26A8, SLC26A9 и SLC26A11.
Клетка, которая усиленно экспрессирует переносчика бикарбоната, конкретно не ограничена, главное, чтобы эта клетка имела повышенный уровень экспрессии переносчика бикарбоната в сравнении с соответствующей природной клеткой. Природная клетка конкретным образом не ограничена. Может использоваться клетка, которая используется в качестве клетки-хозяина при получении рекомбинантного белка (например, клетки CHO).
Переносчик бикарбоната, который используется для усиленной экспрессии в клетке, может быть получен из любого организма, и на него не накладываются какие-то особые ограничения. Конкретно, переносчик бикарбоната может быть получен из таких организмов, которые включают человека, грызунов, таких как мышь, крыса и хомяк, млекопитающих, таких как шимпанзе, корова, лошадь, собака и волк, птиц, таких как курица, рыб, таких как данио и угорь, а также насекомых, таких как дрозофила; предпочтительно, переносчик бикарбоната получают из организма человека, грызунов или из организма того же вида, к которому относится клетка-хозяин. Так, например, в том случае, когда клетка, в которой нужно на усиленном уровне экспрессировать переносчик бикарбоната, представляет собой клетку яичника китайского хомячка (клетка CHO), то переносчик бикарбоната предпочтительно получают из организма человека или хомячка.
Клетка, в которой усиленно экспрессируется переносчик бикарбоната, может представлять собой любую клетку, например, эукариотическую клетку, такую как клетки животных, растений и дрожжей, прокариотическую клетку, такую как Е. coli и В. subfcilis и т.п. Предпочтительно используют клетки животных, такие как клетки СНО и COS; особенно предпочтительными являются клетки CHO. Для целей получения желаемого полипептида, предпочтительными являются клетки, подходящие для переноса гена, кодирующего жела-емый-полипептид, такие как CHO-dhfr-клетки.
В качестве клетки, которая усиленно экспрессирует переносчик бикарбоната, может быть взята клетка, в которую искусственно был перенесен ген переносчика бикарбоната (например, ген анионообменника SLC4, ген анионообменника SLC26 и т.п.). Клетка, в которую искусственно был перенесен ген переносчика бикарбоната, может быть получена с помощью способов, известным специалистам в данной области. Например, такая клетка может быть получена путем встраивания переносчика бикарбоната в вектор с последующей трансформацией вектора в клетку. Кроме того, такое понятие, как «клетки, в которые был искусственно перенесен ген переносчика бикарбоната», включает в контексте настоящего описания клетки, в которых эндогенный ген переносчика бикарбоната был активирован с использованием технологии активации гена (см., например, публикацию по международному патенту WO 94/12650), так что переносчик бикарбоната в этом случае будет экспрессироваться на высоком уровне.
В качестве гена анионообменника SLC4, подлежащего переносу в клетку, может использоваться любая из указанных ниже в пунктах от (a) до (e) ДНК, кодирующая анионообменник SLC4.
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO:2;
(b) ДНК, кодирующая полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делеции, добавления и/или инсерции одного или нескольких аминокислотных остатков, так что при этом анионообменник SLC4 сохраняет активность;
(c) ДНК, кодирующая полипептид, имеющий 50% или большую степень гомологии аминокислотной последовательности с аминокислотной последовательностью, представленной в SEQ ID NO:2, и которая сохраняет активность анионообменника SLC4;
(d) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO:1;
(e) ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, в жестких условиях и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4.
Понятие «активность анионообменника SLC4» включает активность, направленную на захват Cl- и SO4 2-, присутствующих в среде, и экскрецию внутриклеточного HCO3 - и бората с целью поддержания гомеостаза по внутриклеточному pH и клеточному объему.
Активность анионообменника SLC4 может быть определена следующим образом.
Клетки, в которых происходит функциональная экспрессия SLC4, обрабатывают BCECF-AM, представляющим собой pH-чувствительный краситель. Затем сравнивают интенсивность флуоресценции между клетками, которые перфузировали средой, содержащей Cl- и Na+, и клетками, которые подвергали перфузии без Cl- и Na+, и в этом случае могут быть определены изменения во внутриклеточном pH (pHi) (Dahl NK. etal., J Biol Chem 2003; 278:44949-44958; Fujinaga J. et. al., J Biol Chem 1999; 274:6626-6633).
В настоящем изобретении с успехом используется ДНК, кодирующая полипептид, имеющий аминокислотную последовательность SEQ ID NO:2, в качестве ДНК, кодирующей анионообменник SLC4. Кроме того, может использоваться ДНК, кодирующая полипептид, имеющий аминокислотную последовательность SEQ ID NO:2, где одна или множество (например, несколько) аминокислот были замещены, делегированы, добавлены и/или встроены, и который также обладает активностью анионообменника SLC4. Аминокислотная последовательность SEQ ID NO:2 представляет собой аминокислотную последовательность АЕ1 человека. Кроме информации о последовательности АЕ1 человека, была зарегистрирована аналогичная информация о соответствующей последовательности для мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы, данио и т.п.; для мыши - GenBank NM_011403; для крысы - GenBank NM 012651; для шимпанзе - GenBank XM 001151353; для коровы -GenBank NM_181036; для лошади - GenBank NM_001081788; для собаки - GenBank AB242566; для волка - GenBank NM_001048031; для курицы - GenBank NM_205522; и для данио - GenBank NM_198338. Таким образом, указанные выше АЕ1 также могут использоваться. Другие анионообменники SLC4 также могут использоваться, если информация об их последовательностях была зарегистрирована в каких-либо базах данных.
Полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности, представленной в SEQ ID NO:2, путем замещения, делеции, добавления и/или инсерции одного или нескольких аминокислотных остатков, и который все еще обладают активностью аниоонообменника SLC4, функционально эквивалентен анионообменнику SLC4, полученному из организма человека, мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы или данио (далее иногда называемому как «анионообменник SLC4, полученный из организма человека или т.п.»). Такой полипептид включает, например, мутанты анионообменника SLC4, полученного из организма человека или т.п. В описанном ниже примере использован мутант, в котором четыре из 911 аминокислот были замещены (L88R, E693Q V712A и H834Y).
В качестве соответствующих методов могут быть использованы хорошо известные специалистам в данной области способы получения полипептидов, которые функционально эквивалентны специфическому полипептиду, включающие введение мутаций в полипептиды. Так, например, специалисты в данной области могут получить полипептиды, функционально эквивалентные анионообменнику SLC4, полученному из организма человека или т.п., путем соответствующего встраивания мутаций в аминокислоты анионообменника SLC4, полученного из организма человека или т.п., путем сайт-направленного мутагенеза (Hashimoto-Gotoh, Т. et al. (1995) Gene 152, 271-275; ZoUer, MJ, and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, ТА (1985) Proc Nati Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). Мутации в аминокислотах также могут происходить в природе.
Конкретные примеры полипептидов, функционально эквивалентных анионообменнику SLC4, полученному из организма человека или т.п., включают, без ограничения, полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности (например, SEQ ID NO:2) из анионообменника SLC4, полученного из организма человека или т.п., путем делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности анионообменника SLC4, полученного из организма человека или т.п., путем добавления одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности анионообменника SLC4, полученного из организма человека или т.п., путем замещения одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, другими аминокислотами.
Аминокислотные остатки, в которые можно вносить мутации, конкретно не ограничены. Предпочтительно, аминокислотные остатки подвергают мутации до других аминокислот, в которых сохраняется природа боковой цепи исходной аминокислоты. Конкретные примеры аминокислот с боковой цепью соответствующей природы включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, С, E, Q, G, Н, К, S и Т), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидроксильную группу (S, Т и Y), аминокислоты с боковой цепью, содержащей атом серы (С и M), аминокислоты с боковой цепью, содержащей карбоновую кислоту и амид (D, N, Е и Q), аминокислоты с боковой цепью, содержащей основание (R, К и H), и аминокислоты с боковой цепью, содержащей ароматическое кольцо (H, F, Y и W) (в скобках приведены однобуквенные сокращения названий аминокислот).
Сообщалось, что полипептид, имеющий аминокислотную последовательность, полученную из исходной аминокислотной последовательности путем модификации (такой как делеция, добавление и/или замещение одной или нескольких аминокислот), сохраняет биологическую активность исходного полипептида (Mark, D.F. et al, Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, M.J. & Smith, M. Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al., Science 224, 1431-1433; Dalbadie-McFarland, G et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
В качестве одного из примеров можно отметить полипептид, в котором один или несколько аминокислотных остатков добавлены, к анионообменнику SLC4, полученному из организма человека или т.п., слитый полипептид, включающий анионообменник SLC4, полученный из организма человека или т.п. Такой слитый полипептид состоит из анионообменника SLC4, полученного из организма человека или т.п., и другого, соединенного с ним полипептида. Такой слитый полипептид может быть получен путем объединения гена, кодирующего анионообменник SLC4, полученный из организма человека или т.п., в рамке считывания с геном, кодирующим другой полипептид, с последующим переносом полученной ДНК в вектор экспрессии и последующей экспрессией ДНК в клетке-хозяине. Для этого могут быть использованы методики, известные специалистам в данной области. При этом отсутствуют какие-либо ограничения, относящиеся к пептиду, подлежащему слиянию с анионообменником SLC4, полученным из организма человека или т.п.
Примеры полипептидов, подходящих для слияния с анионообменником SLC4, полученным из организма человека или т.п., включают, без ограничения, FLAG (Норр, Т.Р. et al, BioTechnology (1988) 6, 1204-1210), 6xHis, включающий шесть гистидиновых (His) остатков, 10xHis, гемагглютинин гриппа (HA), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, Т7-tag, HSV-tag, E-tag, фрагмент антигена SV40T, lck tag, фрагмент а-тубулина, B-tag, фрагмент белка С, глютатион-S-трансферазу (GST), гемагглютинин гриппа (HA), константный участок иммуноглобулина, β-галактозидазу и мальтозо-связывающий белок (МВР).
Коммерчески доступный ген, кодирующий такой полипептид, подвергают слиянию с геном, кодирующим анионообменник SLC4, полученным из организма человека или т.п. Полученный таким образом слитый ген экспрессируют с образованием слитого полипептида.
Альтернативный способ, известный специалистам в данной области как подходящий для целей получения полипептидов, функционально эквивалентных конкретному полипептиду, представляет собой способ, в котором используется методика гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. Press, 1989). Специалисты в данной области могут достаточно легко выделить ДНК, высокогомологичную данной последовательности ДНК (например, с последовательностью SEQ ID NO:1) для анионообменника SLC4, полученного из организма человека или т.п., на основе последовательности ДНК или ее части, и затем выделить полипептиды, функционально эквивалентные анионообменнику SLC4, полученному из организма человека или т.п., согласно данной ДНК.
Условия гибридизации для выделения ДНК, кодирующей полипептид, функционально эквивалентный анионообменнику SLC4, полученному из организма человека или т.п., могут быть соответствующим образом выбраны специалистами в данной области. Так, например, могут быть использованы условия гибридизации низкой жесткости. Условия гибридизации низкой жесткости включают, например, использование температуры 42°C, концентраций солей 2×SSC и 0,1% ДСН, предпочтительно температуры 50°C, концентрации солей 2×SSC и 0,1% ДСН. Более предпочтительно, используются условия высокой жесткости. Так, например, условия высокой жесткости включают температуру 65°C, концентрации солей 2×SSC и 0,1% ДСН. В тех условиях, когда температуру гибридизации снижают, могут быть получены не только ДНК с высокой гомологией, но также ДНК только лишь с низкой гомологией. И, наоборот, ожидается, что при повышении температуры гибридизации будут получены только ДНК с высокой гомологией. Однако, не только температура, но также множество других факторов (такие как концентрация солей) влияют на жесткость условий гибридизации. Специалисты в данной области могут соответствующим образом выбрать те факторы, которые определяют соответствующий уровень жесткости.
Полипептид, кодируемый ДНК, выделенной с помощью указанных методик гибридизации, может характеризоваться 70% или большей степенью гомологии, и обычно имеют высокую степень гомологии с анионообменником SLC4, полученным из организма человека или т.п., по аминокислотной последовательности. Термин «высокая гомология» относится обычно к гомологии на уровне 97% или выше, предпочтительно к гомологии на уровне 98% или выше, более предпочтительно на уровне 99% гомологии или выше. Для определения степени гомологии полипептидов может быть использован алгоритм, описанный в работе Wilbur, W.J. and Lipman, D.J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Рассматриваемый полипептид может варьировать по аминокислотной последовательности, молекулярной массе, изоэлектрической точке, наличию или отсутствию сахарных цепей, по морфологии и т.п., в зависимости от клетки или клетки-хозяина, который продуцирует полипептид или, в зависимости от способа очистки, который будет описан позже. Однако, если полученный полипептид имеет функции, эквивалентные функциям анионообменника SLC4, полученного из организма человека или т.п., то в рамках настоящего изобретения может использоваться ДНК, кодирующая данный полипептид. Так, например, в том случае, когда полипептид по настоящему изобретению экспрессируют в прокариотическом организме (например, в Escherichia coli), добавляют метиониновый остаток к N-концу исходной аминокислотной последовательности полипептида. В том случае, когда полипептид экспрессируют в эукариотическом организме (например, в клетке млекопитающего), N-концевую последовательность удаляют. Указанные полипептиды могут использоваться в рамках настоящего изобретения.
В настоящем изобретении может использоваться ДНК, кодирующая анионообменник SLC4, ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO:1. Альтернативно, может использоваться ДНК, которая гибридизуется с ДНК, комплементраной к ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, в условиях соответствующей жесткости и которая все еще кодирует полипептид, обладающий активностью анионообменника SLC4. Последовательность SEQ ID NO:1 относится к нуклеотидной последовательности АЕ1 человека. Кроме информации о последовательности АЕ1 человека, была зарегистрирована аналогичная информация по соответствующим последовательностям для мыши, крысы, шимпанзе, коровы, лошади, собаки, волка, курицы, данио и т.п.; для мыши - GenBank NM_011403; для крысы - GeneBank NM_012651; для шимпанзе GenBank ХМ_001151353; для коровы - GeneBank NM_181036; для лошади - GeneBank NM_001081788; для собаки - GenBank AB242566; для волка - GeneBank NM_001048031; для курицы - GenBank NM_205522, и для данио - GenBank NM_198338. Таким образом, может также использоваться АЕ1, описанный выше. Другие анионообменники SLC4 также могут использоваться, если информация об их последовательности зарегистрирована в каких-либо базах данных.
ДНК, кодирующая анионообменник SLC4, может использоваться для получения in vivo или in vitro желаемого полипептида, описанного выше. Кроме того, ДНК, кодирующая анионообменник SLC4, может использоваться при создании клетки, которая экспрессирует на высоком уровне анионообменник SLC4. ДНК, кодирующая анионообменник SLC4, может иметь любую форму, главное, чтобы она была способна кодировать анионообменник SLC4. При этом указанная ДНК может представлять собой кДНК синтезированную на основе мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что если ДНК способна кодировать анионообменник SLC4, то ДНК может иметь любую нуклеотидную последовательность, основанную на вырожденности генетического кода.
ДНК, кодирующая анионообменник SLC4, может быть получена согласно способам, известным специалистам в данной области. Так, например, ДНК может быть получена путем получения библиотеки кДНК из клетки, экспрессирующей анионообменник SLC4, и проведения гибридизации с использованием части последовательности ДНК для анионообменника SLC4 (например, SEQ ID NO:1) в качестве зонда. Библиотека кДНК может быть получена, например, по способу, описанному в Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно, может использоваться коммерчески доступная библиотека кДНК. Возможно также получить ДНК, кодирующую анионообменник SLC4, путем получения РНК из клетки, экспрессирующей анионообменник SLC4, синтеза молекул олиго-ДНК на основе данных о последовательности ДНК для анионообменника SLC4 (например, SEQ ID NO:1) и проведения ПЦР с использованием олиго-ДНК в качестве праймеров для амплификации кДНК, кодирующей анионообменник SLC4.
Кроме того, при определении нуклеотидной последовательности полученной кДНК, можно определить участок трансляции, кодирующий анионообменник SLC4, и получить аминокислотную последовательность анионообменника SLC4. Кроме того, путем скрининга геномной библиотеки с использованием в качестве зонда полученной кДНК, возможно выделить геномную ДНК.
Конкретно, могут использоваться следующие процедуры. Во-первых, мРНК выделяют из клеток, ткани или подобных структур, экспрессирующих анионообменник SLC4. Для выделения мРНК, получают по известным способам суммарную РНК, например, по методу ультрацентрифугирования в гуанидине (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299), по методу AGPC (Chomczynski, P. and Sacchi, N, Anal. Biochem. (1987) 162, 156-159) или по другим методам, и затем мРНК выделяют и очищают из суммарной РНК с использованием набора для очистки мРНК (Pharmacia) и др. Альтернативно, мРНК может быть получена непосредственно с использованием набора для очистки мРНК QuickPrep (Pharmacia).
На основе полученной мРНК, синтезируют кДНК с использованием обратной транскриптазы. Альтернативно, кДНК может быть синтезирована с использованием набора, такого как набор для синтеза одноцепочечной кДНК с обратной транскриптазой AMV (SEIKAGAKU CORPORATION). Возможно также синтезировать и амплифицировать кДНК по методу 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932), с использованием набора 5'-Ampli FINDER RACE (Clontech), и проведения полимеразно-цепной реакции (ПЦР) с праймерами.
Интересующий фрагмент ДНК получают из полученного продукта ПЦР и проводят его лигирование с векторной ДНК с образованием рекомбинантного вектора. Указанный вектор встраивают в клетку-хозяина (например, в Е. coli) с проведением впоследствии селекции образовавшихся колоний и с получением желаемого рекомбинантного вектора. Нуклеотидная последовательность интересующей ДНК может быть подтверждена с помощью известного способа, такого как дидезоксинуклеотидный метод терминации синтеза цепи ДНК.
Кроме того, может быть создана нуклеотидная последовательность для ДНК, кодирующей анионообменник SLC4, с более высокой эффективностью экспрессии путем учета частоты использования кодонов клетки-хозяина, используемой для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p.43-74). Кроме того, ДНК, кодирующая анионообменник SLC4, может быть модифицирована с использованием коммерчески доступных наборов или известных способов. Примеры таких модификаций включают, без ограничения, расщепление рестрикционными ферментами, встраивание синтетических олигонуклеотидов или подходящих фрагментов ДНК, добавление линкеров и встраивание кодона инициации (ATG) и/или кодона терминации (ТАА, TGA или TAG).
ДНК, кодирующая анионообменник SLC4, также включает ДНК, которая гибридизируется с ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:1, в жестких условиях и которая кодирует полипептид, функционально эквивалентный анионообменнику SLC4.
Жесткие условия могут быть соответствующим образом выбраны специалистами в данной области и могут включать, например, условия низкой жесткости. Условия низкой жесткости относятся, например, к температуре 42°C, концентрации солей 2×SSC и 0,1% ДСН, предпочтительно включают температуру 50°C, концентрации солей 2×SSC и 0,1% ДСН. Более предпочтительно, могут быть выбраны условия высокой жесткости. Условия высокой жесткости относятся, например, к температуре 65°C, концентрации солей 2×SSC и 0,1% ДСН. В этих условиях, поскольку температура гибридизации повышается, получают ДНК с высокой степенью гомологии. Указанная выше ДНК, которая гибридизируется, представляет собой предпочтительно ДНК, полученную из природного источника, например, кДНК или хромосомную ДНК.
Указанные ДНК, которые выделяют методами гибридизации, обычно имеют высокую идентичность по нуклеотидной последовательности с ДНК, кодирующей анионообменник SLC4, полученный из организма человека или т.п. ДНК, кодирующая анионообменник SLC4, также включает ДНК, которая кодирует полипептид, функционально эквивалентный анионообменнику SLC4, полученному из организма человека или т.п., и которая имеет высокую степень идентичности с ДНК, кодирующей анионообменник SLC4, полученный из организма человека или т.п. Термин «высокая идентичность» относится обычно, к гомологии на уровне 96% или выше, предпочтительно на уровне гомологии 98% или выше и более предпочтительно на уровне 99% или выше. Степень идентичности нуклеотидных последовательностей может быть определена по алгоритму BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны такие программы, как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). Когда нуклеотидные последовательности анализируют с использованием программы BLASTN, полученной на основе BLAST, могут быть, например, установлены следующие параметры: количество очков = 100 и длина слова = 12. Конкретные процедуры для проведения методик анализа описаны (http://www.ncbi.nim.nih.gov.).
Ген переносчика бикарбоната, подлежащий включению в клетку, может представлять собой ген анионообменника SLC26. Информация о нуклеотидной последовательности гена анионообменника SLC26 и аминокислотной последовательности, кодируемой данным геном, была зарегистрирована со следующими номерами в GenBank AF331525 (предположительно SLC26A9 человека), GenBank NM_052934 (SLC26A9 человека, вариант 1), GenBank NM_134325 (SLC26A9 человека, вариант 2), GenBank NM_134420 (SLC26A6 мыши), GenBank NM_177243 (SLC26A9 мыши), GenBank AY240025 (Slc26d9702 дрозофилы (Drosophila)), GenBank AY240023 (Slc26d6928 дрозофилы (Drosophila)), GenBank AY240022 (Slc26d6125 дрозофилы (Drosophila)), GenBank AY240021 (Slc26d5002 дрозофилы (Drosophila)) и GenBank AB084425 (Slc26A6 угря). Таким образом, может использоваться указанный выше ген анионообменника SLC26.
ДНК, кодирующая анионообменник SLC4, может быть встроена в вектор.
В том случае, когда в качестве клетки-хозяина используется Е. coli, предпочтительно, чтобы вектор имел ориджин репликации ("ori"), с тем чтобы указанный вектор мог подвергаться значимой амплификации в Е. coli (например, JM109, DH5α, HB101 и XL1-Blue), и его можно было получать в крупных количествах, а также, чтобы он содержал гены, позволяющие проводить селекцию трансформированных Е. coli (например, гены лекарственной резистентности, которые позволяют отделять трансформант при использовании некоторых лекарственных средств, таких как ампициллин, тетрациклин, канамицин или хлорамфеникол). Примеры предпочтительных векторов включают, без ограничения, векторы М13, векторы pUC, pBR322, pBluescript и pCR-Script. Кроме этих векторов, такие векторы, как pGEM-T, pDIRECT, pT7 и др., можно отметить как приемлемые для случая, когда вектор используется для субклонирования кДНК и последующего вырезания такой субклонированной кДНК. В том случае, когда вектор используют для получения полипептида по настоящему изобретению, особенно полезным является вектор экспрессии. Если нужно провести экспрессию в клетках Е. coli, используемый вектор экспрессии предпочтительно имеет указанные выше особенности, позволяющие ему амплифицироваться в Е coli, а также включает промотор для достижения эффективной экспрессии в Е. coli, такой как JM109, DH5a, HB101 или XLl-Blue, например, промотор lacZ (Ward et al, Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), промотор araB (Better et al. Science (1988) 240, 1041-1043) или промотор Т7. Конкретные примеры такого вектора включают, в дополнение к указанным выше, pGEX-5X-1 (Pharmacia), систему QIAexpress (Qiagen), pEGFP или рЕТ (предпочтительно использование BL21, экспрессирующей РНК-полимеразу Т7 для соответствующей клетки-хозяина).
Указанный вектор может включать сигнальные последовательности для секреции полипептида. Если нужно достичь продукции полипептида в периплазме Е. coli, в качестве сигнальной последовательности для секреции полипептида может использоваться pelB (Lei, S. P. et al., J. Bacteriol. (1987) 169, 4379). Встраивание вектора в клетку-хозяина может быть проведено, например, по методике, включающей использование хлорида кальция, или путем электропорации.
В тех случаях, когда в качестве клетки-хозяина используют клетки, отличные от Е. coli, векторы, подходящие для получения желаемого полипептида, включают, без ограничения, векторы экспрессии млекопитающих [например, pcDNA3 от компании Invitrogen; pEGF-BOS (Nucleic Acids. Res. 1990, 18(17), p.5322); pEF, pCDM8], векторы экспрессии в клетках насекомых (например, система экспрессии Bac-to-BAC бакуловируса от компании GIBCO BRL; рВасРАК8), векторы экспрессии из растений (например, pMH1, pMH2), векторы экспрессии из вирусов животных (например, pHSV, pMV, pAdexLcw), векторы экспрессии из ретровирусов (например, pZIpneo), векторы экспрессии из дрожжей (например, набор для экспрессии в Pichia от компании Invitrogen; pNV11; SP-Q01), и векторы экспрессии из Bacillus subtilis (например, pPL608, pKTH50).
Если экспрессию полипептида проводят в клетках животных, таких как клетки CHO, клетки COS, клетки NIH3T3 и т.п.), то предпочтительно, используемый при этом вектор содержит промотор, необходимый для экспрессии целевого полипептида в данных клетках. Примеры такого промотора включают, без ограничения, промотор SV40 (Mulligan et al. Nature (1979) 277, 108), промотор MMLV-LTR, промотор EF1α (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322) и промотор CMV. Более предпочтительно такой вектор также включает гены для селекции трансформированных клеток (например, гены лекарственной резистентности, которые позволяют отличать трансформированные клетки с использованием лекарственных средств, таких как неомицин или G418). Примеры векторов, обладающих такими свойствами, включают, без ограничения, рМАМ, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Дополнительно, когда стоит задача осуществить стабильную экспрессию нужного гена, и осуществить внутриклеточную амплификацию данного гена с получением множества его копий, может быть использован описанный ниже способ. В общих чертах он состоит в том, что в клетки CHO, утратившие путь синтеза нуклеиновой кислоты, вводят вектор, содержащий ген DHFR, который восполняет этот недостаток (например, pCHOI), и затем проводят амплификацию с использованием метотрексата (МТХ). С другой стороны, когда планируется провести экспрессию целевого гена, может быть использован метод, в котором клетки COS, содержащие в своей хромосоме ген для экспрессии антигена SV40T, трансформируют вектором, содержащим ориджин репликации SV40 (например, pcD). В качестве ориджина репликации может быть также использован ориджин репликации из полиомавируса, аденовируса или бычьего папилломавируса (BPV). Кроме того, указанный вектор экспрессии может содержать селектируемые маркеры для амплификации с получением множества копий данного гена в системе клетки-хозяина. Примеры таких селектируемых маркеров включают, без ограничения, ген аминогликозидфосфотрансферазы (АРН), ген тимидинкиназы (ТК), ген ксантин-гуанинфосфорибозилтрансферазы из Е. coli (Ecogpt) и ген дигидрофолатредуктазы (dhfr).
Клетка-хозяин, в которую может быть перенесена ДНК, кодирующая переносчик бикарбоната (которая может быть включена в вектор), особо не ограничена. Так, например, могут использоваться клетки Е. coli или различные клетки животных. Если ДНК, кодирующая желаемый полипептид, вводится в клетку-хозяина, куда была перенесена ДНК, кодирующая переносчик бикарбоната, то такая клетка-хозяин сможет экспрессировать переносчик бикарбоната на высоком уровне, что приведет к росту продукции желаемого полипептида. В клетку-хозяина, куда была перенесена ДНК, кодирующая переносчик бикарбоната, может быть также введена ДНК, кодирующая CSAD или ALT (которая может быть включена в вектор). За счет переноса ДНК, кодирующей желаемый полипептид, и ДНК, кодирующей CSAD или ALT, в клетку-хозяина, куда вводят ДНК, кодирующую переносчик бикарбоната, выход желаемого полипептида может быть повышен. Для целей получения полипептида имеются системы продукции in vivo и in vitro. Примеры систем продукции in vitro включают системы, включающие использование систем эукариот, и системы, включающие использование прокариот.
В том случае, когда желаемый полипептид получают с использованием клетки, в которую уже был искусственно введен ген переносчика бикарбоната, особо не ограничивается порядок, в котором переносят ген, кодирующий переносчик бикарбоната, и ген, кодирующий желаемый полипептид. Ген, кодирующий желаемый полипептид, может быть перенесен после переноса гена переносчика бикарбоната. Альтернативно, ген переносчика бикарбоната может быть перенесен после переноса гена, кодирующего желаемый полипептид. Возможно также провести перенос гена переносчика бикарбоната и гена, кодирующего желаемый полипептид, одновременно.
Ген переносчика бикарбоната и ген, кодирующий желаемый полипептид, могут быть перенесены одновременно в составе одного вектора. Альтернативно, они могут быть перенесены по отдельности с использованием множества векторов.
Предпочтительно, клетка, которая на достаточно высоком уровне экспрессирует переносчик бикарбоната, также на достаточном уровне экспрессирует декарбоксилазу цистеин-сульфиновой кислоты (CSAD) или аланинаминотрансферазу (ALT) для целей получения желаемого полипептида. При переносе гена, кодирующего желаемый полипептид, в клетку и культивировании полученной клетки в среде, желаемый полипептид может быть получен в большем количестве.
CSAD ранее был известен как.фермент, который превращает аланин-3-сульфиновую кислоту в гипотаурин. Если декарбоксилаза цистеин-сульфиновой кислоты экспрессируется на достаточно высоком уровне в клетке CHO, указанная клетка синтезирует избыточное количество β-аланина.
Клетка, которая экспрессирует на достаточно высоком уровне CSAD, конкретно не ограничена, главное, чтобы она характеризовалась повышенным уровнем экспрессии в сравнении с соответствующей природной клеткой. При этом природная клетка конкретно не ограничена. Может использоваться клетка, которая используется в качестве клетки-хозяина при получении рекомбинантного белка (например, клетки СНО).
В качестве CSAD, экспрессируемой на достаточно высоком уровне, может использоваться CSAD, полученная из любого организма. В частности, может использоваться CSAD, полученная из клеток человека, грызуна (такого как мышь, крыса или хомяк), иглобрюха (такого как тигровый иглобрюх) или асцидий (таких как Ciona intestnalis). Предпочтительно, может использоваться CSAD, полученная из клеток человека, грызуна или того же вида, что и клетка-хозяин. Так, например, в том случае, когда клетка, которая может экспрессировать CSAD на достаточно высоком уровне, представляет собой клетки яичника китайского хомячка (клетки СНО), то CSAD предпочтительно получают из клеток человека или хомячка.
В качестве клетки, которая экспрессирует на достаточно высоком уровне CSAD, может быть взята клетка, в которую был искусственно перенесен ген CSAD. Клетка, в которую был искусственно перенесен ген CSAD, может быть получена по процедурам, известным специалистам в данной.области. Например, такая клетка может быть получена путем включения гена CSAD в вектор, с последующей трансформацией вектора в клетку. Кроме того, выражение "клетки, в которые был искусственно перенесен ген CSAD" обозначает, в контексте настоящего описания, такие клетки, в которых был активирован эндогенный ген CSAD с использованием метода генной активации (см., например, публикацию по международному патенту WO 94/12650), так что достигается высокая экспрессия CSAD.
В качестве гена CSAD, подлежащего переносу в клетку, может использоваться любая ДНК из числа указанных ниже в пунктах (a1)-(a1):
(a1) ДНК, кодирующая полипептид с аминокислотной последовательностью SEQ ID NO:4, или с аминокислотной последовательностью, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD крысы (Q64611), CSAD_(Q9DBE0) мыши или CSAD_(Q9Y600) человека;
(b1) ДНК, кодирующая полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности SEQ ID NO:4 или аминокислотной последовательности, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD (Q64611) крысы, CSAD_(Q9DBEO) мыши или CSAD_(Q9Y600) человека путем замещения, делеции, добавления и/или вставки одного или нескольких аминокислотных остатков, сохраняющий при этом активность CSAD;
(c1) ДНК, кодирующая полипептид, характеризующийся 70% или большей гомологией по аминокислотной последовательности с аминокислотной последовательностью SEQ ID NO:4 или аминокислотной последовательностью, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD (Q64611) крысы, CSAD_(Q9DBE0) мыши или CSAD_(Q9Y600) человека, и где указанный полипептид все еще обладает активностью CSAD;
(d1) ДНК, имеющая нуклеотидную последовательность SEQ ID NO:3 или нуклеотидную последовательность, зарегистрированную в GenBank, CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека;
(e1) ДНК, которая гибридизуется с ДНК, комплементарной к ДНК, имеющей нуклеотидную последовательность SEQ ID NO:3 или нуклеотидную последовательность, зарегистрированную в GenBank CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека в условиях гибридизации соответствующей жесткости и которая все еще кодирует полипептид, обладающий активностью CSAD.
Выражение «активность CSAD» обозначает активность, направленную на катализ реакции декарбоксилирования 3-сульфино-L-аланина с образованием гипотаурина+СС>2. Оно также относится к активности, направленной на декарбоксилирование L-цистеиновой кислоты (EC 4.1.1.29).
Активность CSAD может быть определена следующим образом.
Согласно методу Davis К. Et al., J Biomed Sci 2001; 8:359-364, определяют количество 14CO2, образованного из L-[1-14C]цистеиновой кислоты под действием декарбоксилазной активности CSAD.
В настоящем изобретении, ДНК, кодирующая полипептид с аминокислотной последовательностью SEQ ID NO:4 или аминокислотной последовательностью, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD (Q64611) крысы, CSAD_(Q9DBEO) мыши или CSAD_(Q9Y600) человека, может быть использована в качестве ДНК, кодирующей CSAD. Кроме того, может быть использована ДНК, кодирующая полипептид с аминокислотной активностью SEQ ID NO:4 или аминокислотной последовательностью, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD (Q64611) крысы, CSAD_(Q9DBEO) мыши или CSAD_(Q9Y600) человека, где одна или множество аминокислот замещены, делегированы, добавлены и/или встроены, и где указанный полипептид также обладает активностью CSAD.
Полипептид с аминокислотной последовательностью SEQ ID NO:4 или аминокислотной последовательностью, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), CSAD (Q64611) крысы, CSAD_(Q9DBEO) мыши или CSAD_(Q9Y600) человека, где одна или множество аминокислотных остатков замещены, делегированы, добавлены и/или вставлены, и который также обладает активностью CSAD, функционально эквивалентен CSAD, полученной из клеток хомячка, крысы, мыши или человека (которая далее иногда обозначается как «CSAD, полученная из хомячка и т.п.»). Такой полипептид относится, например, к мутантам CSAD, полученной из хомячка и т.п.
В качестве хорошо известных специалистам в данной области способов получения полипептидов, функционально эквивалентных данному конкретному полипептиду, можно отметить способы, основанные на введении мутаций в полипептиды. Так, например, специалисты могут получить полипептиды, функционально эквивалентные CSAD, полученной из хомячка или т.п., путем соответствующего введения мутаций в аминокислоты CSAD, полученной из хомячка или других, по процедуре сайт-направленного мутагенеза (Hashimoto-Gotoh, Т et al. (1995) Gene 152, 271-275; Zoller, MJ, and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, ТА (1985) Proc Nati Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). Мутации в аминокислотах могут также встречаться в природе.
Конкретные примеры полипептидов, функционально эквивалентных CSAD, полученной из хомячка или т.п., включают, без ограничения, полипептид с аминокислотной последовательностью CSAD, полученной из хомячка или т.п. (например, с аминокислотной последовательностью SEQ ID NO:4 или аминокислотной последовательность, согласно информации в базе данных UniProt Knowledgebase (Swiss-Prot and TrEMBL), крысы CSAD (Q64611), мышиной CSAD_(Q9DBEO) или человеческой CSAD_(Q9Y600)), путем делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности CSAD, полученной из хомячка или т.п. путем добавления одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; и полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности CSAD, полученной из хомячка или т.п. путем замещения одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, при сохранении других аминокислот.
Подлежащие мутированию аминокислотные остатки конкретно не ограничены. Предпочтительно, аминокислотные остатки подвергают мутации до других аминокислот, в которых сохраняется природа боковой цепи исходной аминокислоты. Конкретные примеры природы боковой цепи аминокислоты включают гидрофобные аминокислоты (А, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидроксильную группу (S, T и Y), аминокислоты с боковой цепью, содержащей атом серы (C и M), аминокислоты с боковой цепью, содержащей карбоксильную группу и амид (D, N, E и Q), аминокислоты с основной боковой цепью (R, K и H) и аминокислоты с боковой цепью, содержащей ароматическую группу (H, F, Y и W) (в скобках приведены однобуквенные обозначения аминокислот).
Сообщалось, что полипептид с аминокислотной последовательностью, полученной из исходной аминокислотной последовательности за счет модификации (такой как делеция, добавление и/или замещение одной или нескольких аминокислот), сохраняет биологическую активность исходного полипептида (Mark, D.F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, M.J. & Smith, M Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al., Science 224, 1431-1433; Dalbadie-McFarland, G et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
Одним из примеров полипептида, в котором один или несколько аминокислотных остатков добавлены к CSAD, полученной из хомячка или т.п., может быть слитый полипептид, включающий CSAD, полученную из хомячка или т.п. Такой слитый полипептид состоит из CSAD, полученной из хомячка или т.п., и другого полипептида, слитого с ним. Такой слитый полипептид может быть получен путем объединения гена, кодирующего CSAD, полученную из хомячка или т.п., в рамке считывания с геном, кодирующим другой полипептид, переноса полученной ДНК в вектор экспрессии и последующей экспрессии ДНК в клетке-хозяине. Могут быть использованы методы, известные специалистам в данной области. При этом отсутствуют какие-либо ограничения по полипептиду, который подлежит слиянию с CSAD, полученной из хомячка или т.п.
Примеры полипептидов, сливаемых с CSAD, полученной из хомячка или т.п., включают, без ограничения, FLAG (Hopp, Т.Р. et al., BioTechnology (1988) 6, 1204-1210), 6×His, содержащий шесть гистидиновых остатков (His), 10×His, гемагглютинин вируса гриппа (HA), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, T7-tag, HSV-tag, E-tag, фрагмент антигена SV40T, lck tag, фрагмент α-тубулина, B-tag, фрагмент белка C, глютатион-S-трансферазу (GST), гемагглютинин вируса гриппа (HA), константную область иммуноглобулина, β-галактозидазу и мальтозо-связывающий белок (МВР).
Коммерчески доступный ген, кодирующий такой полипептид, объединяют с геном, кодирующим CSAD, полученную из хомячка или т.п. Созданный таким образом гибридный, или. слитый, ген далее экспрессируют с получением слитого полипептида.
Известный специалистам в данной области альтернативный способ получения полипептидов, функционально эквивалентных конкретному полипептиду, представляет собой способ, основанный на использовании метода гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. Press, 1989). Так, любой специалист со средним уровнем знаний в данной области может стандартным образом выделить ДНК, которая характеризуется высокой степенью гомологии с последовательностью ДНК для CSAD, полученной из хомячка или т.п. (например, ДНК с последовательностью SEQ ID NO:3 или ДНК с последовательностью депонированных под соответствующими номерами в GenBank CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека), основанную на такой последовательности ДНК или ее части, и затем выделить полипептиды, функционально эквивалентные CSAD, полученной из хомячка или т.п., соответствующие данной ДНК.
Условия гибридизации, подходящие для выделения ДНК, кодирующей полипептид, функционально эквивалентный CSAD, полученной из хомячка или т.п., могут быть соответствующим образом выбраны любым специалистом со средним уровнем знаний в данной области. Так, например, могут использоваться условия гибридизации низкой жесткости. Условия гибридизации низкой жесткости включают, например, температуру 42°C, концентрации солей 2×SSC и 0,1% ДСН, предпочтительно, 50°C, 2×SSC и 0,1% ДСН. Более предпочтительно, используются условия гибридизации высокой жесткости. Так, например, условия гибридизации высокой жесткости включают следующие: температура 65°C, концентрации солей 2×SSC и 0,1% ДСН. В этих условиях, когда температуру гибридизации понижают, образуются не только ДНК с высокой степенью гомологии, но также ДНК всего лишь с низкой степенью гомологии. И, наоборот, как ожидается, при повышении температуры гибридизации будет получена только ДНК с высокой степенью гомологии. Однако, жесткость условий гибридизации определяется не только температурой, но также множеством других факторов (таких как концентрации солей). Специалисты со средним уровнем знаний в данной области могут соответствующим образом отобрать такие факторы, которые позволяют создать нужные условия жесткости.
Полипептид, кодируемый ДНК, выделенной с использованием указанных методов гибридизации, может характеризоваться 70% или большей степенью гомологии и обычно имеет высокую степень гомологии с CSAD, полученной из хомячка или т.п., по аминокислотной последовательности. Термин "высокая степень гомологии" относится обычно к 97% или более высокой степени гомологии, предпочтительно на уровне 98% или большей гомологии и более предпочтительно на уровне 99% или большей гомологии. Для определения степени гомологии полипептидов можно использовать алгоритм, описанный в работе Wilbur, W.J. and Lipman, D.J, Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Рассматриваемый полипептид может варьировать по аминокислотной последовательности, молекулярной массе, изоэлектрической точке, наличию или отсутствию сахарных цепей, морфологии и т.п., что зависит от клетки или клетки-хозяина, которая продуцирует данный полипептид, или от способа очистки, который будет описан ниже. Однако, если полученный полипептид имеет функции, эквивалентные функциям CSAD, полученной из хомячка или т.п., то в настоящем изобретении может использоваться ДНК, кодирующая данный полипептид. Например, когда рассматриваемый полипептид экспрессируют в прокариотическом организме (например, в Escherichia coli), добавляют метиониновый остаток к N-концу аминокислотной последовательности исходного полипептида. А когда полипептид экспрессируют в эукариотическом организме (например, в клетке млекопитающего), то удаляют N-концевую сигнальную последовательность. ДНК, кодирующая такой полипептид, может использоваться в настоящем изобретении.
Согласно настоящему изобретению, в качестве ДНК, которая кодирует CSAD, может использоваться ДНК с нуклеотидной последовательностью SEQ ID NO:3, или такая ДНК может иметь нуклеотидные последовательности, соответствующие депонированным в GenBank, с присвоенными им номерами, CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека. Кроме того, может использоваться ДНК, кодирующая полипептид, которая гибридизуется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность SEQ ID NO:3 или нуклеотидные последовательности, соответствующие депонированным в GenBank, с присвоенными им номерами, CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека, в условиях гибридизации соответствующей жесткости, с сохранением активности CSAD.
ДНК, кодирующую CSAD, используют для получения клетки, которая усиленно экспрессирует CSAD и которая затем может быть использована для продукции желаемого полипептида в системах in vivo или in vitro, как это было описано выше. ДНК, кодирующая CSAD, может быть представлена в любой форме, главное, чтобы она была способна кодировать CSAD. Иными словами, такая ДНК может представлять собой, например, кДНК, синтезированную на основе мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что, при условии, что указанная ДНК способна кодировать CSAD, такая ДНК может иметь любую нуклеотидную последовательность, определяемую вырожденностью генетического кода.
ДНК, кодирующая CSAD, может быть получена в рамках способов, известных специалистам в данной области. Так, например, указанная ДНК может быть получена путем создания библиотеки кДНК из клетки, экспрессирующей CSAD, и проведения далее гибридизации с использованием части последовательности ДНК для CSAD (например, нуклеотидной последовательности SEQ ID NO:3 или нуклеотидной последовательности, соответствующей депонированным в GenBank CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека) в качестве зонда. Библиотека кДНК может быть получена по методу, описанному Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно, может использоваться коммерчески доступная библиотека кДНК. Возможно также получить ДНК, кодирующую CSAD, при выделении РНК из клетки, экспрессирующей CSAD, с последующим синтезом молекул олиго-ДНК на основе последовательности ДНК для CSAD (например, нуклеотидной последовательности SEQ ID NO:3 или нуклеотидной последовательности, соответствующей депонированным в GenBank CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека) и проведением ПЦР с использованием молекул олиго-ДНК в качестве праймеров для амплификации кДНК, кодирующей CSAD.
Далее, при определении нуклеотидной последовательности полученной кДНК, можно определить участок трансляции, кодирующий данный полипептид, и получить аминокислотную последовательность CSAD. Кроме того, при скрининге геномной библиотеки с использованием полученной кДНК в качестве зонда, можно выделить геномную ДНК.
В частности, могут использоваться следующие процедуры. Вначале, из клеток, тканей или аналогичных структур, экспрессирующих CSAD, выделяют мРНК. Для выделения мРНК, получают суммарную РНК по хорошо известным методикам, например, с использованием ультрацентрифугирования в гунидине (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299), метода AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) или подобных методик, и затем мРНК выделяют и очищают из суммарной РНК с использованием набора для очистки (Pharmacia), и т.п. Альтернативно, мРНК можно получить непосредственно с использованием набора для очистки мРНК QuickPrep mRNA Purification Kit (Pharmacia).
На основе полученной мРНК, синтезируют кДНК с использованием обратной транскриптазы. Альтернативно, кДНК может быть синтезирована с использованием набора, такого как набор AMV с обратной транскриптазой для синтеза одноцепочечной кДНК (AMV Reverse Transcriptase First-Strand cDNA Synthesis Kit (SEKAGAKU CORPORATION)). Возможно также провести синтез и амплификацию кДНК по методу 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932)) с использованием набора 5'-Ampli FINDER RACE Kit (Clontech) и полимеразно-цепной реакции (ПЦР) с праймерами.
Представляющий интерес фрагмент ДНК выделяют из продукта ПЦР и лигируют с векторной ДНК с образованием рекомбинантного вектора. Указанный вектор вводят в клетку-хозяина (например, Е. coli) и затем проводят отбор колоний с получением рекомбинантного вектора. Проводят проверку и подтверждение нуклеотидной последовательности нужной ДНК в рамках известной процедуры, такой как метод терминации цепи с использованием дидезоксинуклеотида.
Дополнительно, может быть создана нуклеотидная последовательность с более высокой эффективностью экспрессии для ДНК, кодирующей CSAD, с учетом частоты использования кодонов в хозяине, используемом для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p.43-74). Кроме того, ДНК, кодирующая CSAD, может быть модифицирована с использованием коммерчески доступных наборов или известных методов. Примеры таких модификаций включают, без ограничения, расщепление рестриктазами, встраивание синтетических олигонуклеотидов или подходящих фрагментов ДНК, добавление линкеров и встраивание кодона инициации (ATG) и/или кодона терминации (ТАА, TGA или TAG).
ДНК, кодирующая CSAD, также включает ДНК, которая гибридизуется с ДНК, комплементарной к ДНК, имеющей нуклеотидную последовательность SEQ ID NO:3 или нуклеотидную последовательность, соответствующую депонированным в GenBank CSAD NM_021750 крысы, CSAD NM_144942 мыши или CSAD NM_015989 человека, в условиях гибридизации соответствующей жесткости, и которая кодирует полипептид, функционально эквивалентный CSAD.
Жесткость условий гибридизации может быть соответствующим образом выбрана любым специалистом со средним уровнем знаний в данной области, которая включает, например, условия низкой жесткости. Условия низкой жесткости относятся, например, к следующим: температура 42°C, концентрации солей 2×SSC и 0,1% ДСН, предпочтительно, 50°C, 2×SSC и 0,1% ДСН. Более предпочтительно, могут быть выбраны условия высокой жесткости. Условия высокой жесткости включают, например, температуру 65°C и концентрации солей 2×SSC и 0,1% ДСН. В этих условиях, поскольку повышается температура гибридизации, могут быть получены ДНК с более высокой степенью гомологии. Указанная выше ДНК, которая гибридизуется, представляет собой предпочтительно ДНК природного происхождения, например, кДНК или хромосомную ДНК.
Указанные ДНК, выделяемые с помощью методов гибридизации, обычно характеризуются высоким показателем идентичности по нуклеотидной последовательности с ДНК, кодирующей CSAD, полученную из хомячка или т.п. ДНК, кодирующая CSAD, также включает ДНК, которая кодирует полипептид, функционально эквивалентный CSAD, которая была получена из хомячка или т.п. и которая характеризуется высокой идентичностью с ДНК, кодирующей CSAD, полученную из хомячка или т.п. Термин "высокая идентичность" относится обычно к 96% или большей степени гомологии, предпочтительно к 98% или большей степени гомологии, более предпочтительно к 99% или большей идентичности. Идентичность нуклеотидных последовательностей может быть определена с помощью алгоритма BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны программы, такие как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). В том случае, когда нуклеотидные последовательности анализируют с помощью программы BLASTN, построенной на основе BLAST, параметры устанавливают, например, следующим образом: баллы = 100 и длина слова = 12. Конкретные процедуры проведения таких анализов хорошо известны и описаны (http://www.ncbi.nlm.nih.gov.).
Хорошо известно, что ALT является ферментом, который образует глютамат при переносе аминогруппы от аланина к 2-оксоглутарату. Если реакция биосинтеза пирувата и глютамата из аланина может быть ускорена за счет сильной экспрессии ALT в клетках-хозяевах, таких как клетки СНО, то ее продукты могут метаболизироваться в цикле ТКК и образования глюкозы в ходе глюкогенеза, что позволит улучшить характеристики клеточной культуры и приведет в итоге к повышению выхода желаемого полипептида.
Клетки, в значительной мере экспрессирующие ALT, конкретно не ограничены, главное, чтобы они были способны к экспрессии ALT на более высоких уровнях, чем природные клетки. Природные клетки включают, без особого ограничения, такие клетки, которые используются в качестве клеток-хозяев при получении рекомбинантных белков, примером которых могут служить клетки СНО.
В качестве клетки, которая в значительной степени экспрессирует ALT, может быть взята клетка, в которую был искусственно перенесен ген ALT. Клетка, в которую был искусственно перенесен ген ALT, может быть получена по методам, известным специалистам в данной области. Например, такая клетка может быть получена путем встраивания гена ALT в вектор и последующего переноса вектора в клетку. Кроме того, выражение "клетки, в которые был искусственно перенесен ген ALT" обозначает в контексте настоящего описания клетки, в которых был активирован эндогенный ген ALT по методу генной активации (см., например, публикацию по международному патенту WO 94/12650), так что ALT подвергается усиленной экспрессии.
При условии усиленной экспрессии ALT в клетке, может использоваться ALT, полученная из любого организма. Конкретно, известно наличие подходящих ALT, которые могут быть получены из организма человека, мыши, крысы, собаки, африканской шпорцевой лягушки, дрозофилы, нематоды, японского риса, Cyanidioschyzon merolae, Saccharomyces cerevisiae, Ashbya gossypii, Candida albicans, Schizosaccharomyces pombe, Aspergillus nidulans, Aspergillus fumigatus, Aspergillus oryzae, Cryptococcus neoformans, Dictyostelium discoideum, Trypanosoma brucei, Leishmania major, Entamoeba histolytica и Trypanosoma cruzi и которые, соответственно, могут использоваться. Предпочтительно, может быть использована ALT, полученная из клеток человека, грызуна или представителя любого другого вида, взятых в качестве клетки-хозяина. Например, в том случае, когда клетка, которая стала в значительной мере экспрессировать ALT, относится к клеткам яичника китайского хомячка (клетки СНО), то такую ALT предпочтительно получают из организма человека или хомячка. Для ALT человека, мыши и дрожжей показано наличие вариантов (ALT1 и ALT2). ALT2 характеризуется 80% или большей степенью гомологии с ALT1 по аминокислотному составу. Как будет описано ниже в примерах и стандартных примерах, были созданы условия для усиленной экспрессии ALT1.
При условии сильной экспрессии гена ALT в клетке, может использоваться любая ДНК из числа указанных ниже, в пунктах (а2)-(е2), которая кодирует ALT.
(а2) ДНК, кодирующая полипептид с аминокислотной последовательностью KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: A0090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjFl2.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140;
(b2) ДНК, кодирующая полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: A0090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140 путем замещения, делеции, добавления и/или встраивания одного или более (например, нескольких) аминокислотных остатков, с сохранением при этом активности ALT;
(c2) ДНК, кодирующая полипептид с 70% или большей степенью гомологии по аминокислотной последовательности с аминокислотной последовательностью KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: CaO19_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ. 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140 и сохраняющая при этом активность ALT;
(d2) ДНК, имеющая нуклеотидную последовательность KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (African clawed frog): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.1:00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.100016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140;
(e2) ДНК, которавя гибридизуется с ДНК, комплементарной к ДНК, имеющей нуклеотидную последовательность KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus. oryzae: A0090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.1:00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140 в условиях соответствующей жесткости и которая все еще кодирует полипептид, обладающий активностью ALT.
Выражение «активность ALT» обозначает ферментативную активность, направленную на катализ переноса аминогруппы между аминокислотой и α-кетокислотой.
Активность ALT может быть определена по указанной ниже методике.
Уровень активности ALT определяют с использованием реактива для автоматического анализатора, используемого в процедуре анализа аланин-аминотрансферазы (Runpia liquid S-ALT, разрешение, номер 20900AMZ00597000), а также метода, описанного в работе Rajamohan F. et. al., Protein Expression and Purification (2006) 48, 81-89.
В настоящем изобретении в качестве гена, кодирующего ALT, может быть использована ДНК, кодирующая полипептид с аминокислотной последовательностью KEGG/ФЕРМЕНТ: 2.6.1.2/Ното sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosomacruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140. Альтернативно, может быть использована ДНК, кодирующая полипептид с аминокислотной последовательностью, полученной из описанной выше аминокислотной последовательности путем замещения, делеции, добавления и/или встраивания одного или более аминоктислотных остатков, с сохранением при этом активности ALT.
Полипептид, который имеет аминокислотную последовательность, полученную из аминокислотной последовательности KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2 6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140 путем замещения, делеции, добавления и/или встраивания одного или нескольких аминоксилотных остатков, с сохраненим при этом активности ALT, функционально эквивалентен ALT, полученной из клеток человека, мыши, крысы, собаки, африканской шпорцевой лягушки, дрозофилы, нематоды, японского риса, Cyanidioschyzon merolae, Saccharomyces cerevisiae, Ashbya gossypii, Candida albicans, Schizosaccharomyces pombe, Aspergillus nidulans, Aspergillus fumigatus, Aspergillus oryzae, Cryptococcus neoformans, Dictyostelium discoideum, Trypanosoma brucei, Leishmania major, Entamoeba histolytica или Trypanosoma cruzi (далее иногда называемая как "ALT, полученная из человека или т.п."). Такой полипептид включает, например, мутанты ALT, полученной из человека или т.п. В описанных ниже примерах и стандартных примерах используют мутант, в котором замещены четыре из 496 аминокислот (R53S, Q72R, F286S и М332К).
В качестве известных специалистам методов получения полипептидов, функционально эквивалентных конкретному, данному полипептиду, можно отметить методы введения мутаций в полипептиды. Например, любой специалист со средним уровнем знаний в данной области может получить полипептиды, функционально эквивалентные ALT, полученной из человека или т.п., путем соответствующего введения мутаций в аминокислоты ALT, полученной из человека или т.п., путем сайт-направленного мутагенеза (Hashimoto-Gotoh, Т. et al. (1995) Gene 152, 271-275; Zoller, MJ, and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, ТА (1985) Proc Nati Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). В аминокислотах могут также встречаться мутации, имеющие природное происхождение.
Конкретные примеры полипептидов, функционально эквивалентных ALT, полученной из человека или т.п., включают, без ограничения, полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности (например, аминокислотной последовательности KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (яеловеческий): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: CaO19_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: A0090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: 115927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2 5/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140) ALT, которая была выделена из клеток человека или т.п., путем делеции одной или более аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид с аминокислотной последовательностью, полученной из ALT, которая была выделена из клеток человека или т.п., путем добавления одной или более аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; и полипептид с аминокислотной последовательностью, полученной из аминокислотной последовательности ALT, которая была выделена из клеток человека или т.п., путем замещения одной или более аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот другими аминокислотами.
Аминокислотные остатки, которые могут быть мутированы, конкретно не ограничены. Предпочтительно, осуществляют мутацию аминокислотных остатков до других аминокислот, так чтобы сохранялась природа боковой цепи исходной аминокислоты. Конкретные примеры аминокислот с определенной природой боковой цепи включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидроксильную группу (S, T и Y), аминокислоты с боковой цепью, содержащей атом серы (С и М), аминокислоты с боковой цепью, содержащей карбоксильную группу и амидную группу (D, N, E и Q), аминокислоты с боковой цепью, содержащей основание (R, K и H), аминокислоты с боковой цепью, содержащей ароматическую группу (H, F, Y и W) (в скобках приведены однобуквенные обозначения аминокислот).
Сообщалось, что полипептид с аминокислотной последовательностью, полученной из исходной аминокислотной последовательности путем модификации (такой как делеция, добавление и/или замещение одной или более аминокислот), сохраняет биологическую активность, свойственную исходному полипептиду (Mark, D.F. et al, Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, М.J. & Smith, М. Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al. Science 224, 1431-1433; Dalbadie-McFarland, G et al, Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
В качестве одного из примеров полипептида, в котором один или несколько аминокислотных остатков были добавлены к ALT, полученной из клеток человека или т.п., можно отметить гибридный, или слитый, полиппетид, включающий ALT, которая была выделена из клеток человека или т.п. Такой слитый полипептид состоит из ALT, полученной из клеток человека или т.п., и другого полипептида, объединенного с ним. Такой слитый полипептид может быть получен путем присоединения гена, кодирующего ALT, полученной из клеток человека или т.п., в рамке считывания с геном, кодирующим другой полипептид, с последующим переносом полученной ДНК в вектор экспрессии и экспрессией ДНК в клетке-хозяине. Для этого могут быть использованы методики, известные специалистам в данной области. И при этом отсутствуют какие-либо ограничения применительно к полипептиду, объединяемому с ALT, полученной из клеток человека или т.п.
Примеры полипептидов, которые могут быть объединены с ALT, полученной из клеток человека или т.п., включают, без ограничения, FLAG (Норр, Т Р. et al., BioTechnology (1988) 6, 1204-1210), 6xHis, включающий шесть гистидиновых (His) остатков, 10xHis, гемагглютинин вируса гриппа (НА), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, T7-tag, HSV-tag, E-tag, антигенный фрагмент из SV40T, lck tag, фрагмент α-тубулина, B-tag, фрагмент белка С, глютатион-3-трансферазу (GST), гемагглютинин вируса гриппа (НА), константный участок иммуноглобулина, β-галактозидазу и белок, связывающий мальтозу (МБР).
Коммерчески доступный ген, кодирующий такой полипептид, объединяют с геном, кодирующим ген ALT, полученной из клеток человека или т.п.Полученный при таком объединении слитый ген подвергают экспрессии для получения слитого полипептида.
Альтернативный способ, известный специалистам в данной области, как позволяющий получать полипептиды, функционально эквивалентные конкретному полипептиду, включает процедуру гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring HarborLab. Press, 1989). Любой специалист со средним уровнем знаний в данной области может стандартным образом выделить ДНК, высоко гомологичную к последовательности ДНК (например, к ДНК с последовательностью KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fiimigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140) для ALT, полученной из клеток человека или т.п., на основании такой последовательности ДНК или ее части, а затем выделить полипептиды, функционально эквивалентые ALT, полученной из клеток человека или т.п., с использованием этой ДНК.
Условия гибридизации, подходящие для выделения ДНК, кодирующей полиппетид, который функционально эквивалентен ALT, полученной из клеток человека или т.п., могут быть соответствующим образом выбраны любым специалистом со средним уровнем знаний в данной области. Например, для гибридизации могут использоваться условия низкой жесткости. Условия низкой жесткости гибридизации включают, в частности, следующие: температура 42°C, концентрации солей 2×SSC и 0,1% ДСН, предпочтительно 50°C, 2×SSC и 0,1% ДСН. Более предпочтительно, для гибридизации могут использоваться условия высокой жесткости. Условия высокой жесткости гибридизации включают, например, следующие: температура 65°C, концентрации солей 2×SSC и 0,1% ДСН. В этих условиях, когда температура гибридизации снижается, образуются не только ДНК с высокой степенью гомологии, но также ДНК с очень низкой степенью гомологии. И, наоборот, следует ожидать, что при повышении температуры гибридизации образуются только ДНК с высокой степенью гомологии. Однако, на жесткость условий гибридизации влияет не только температура, но множество других факторов (такие как концентрации солей). При этом любой специалист со средним уровнем знаний в данной области может соответствующим образом выбрать такие факторы, которые позволяют реализовать нужные условия жесткости.
Полипептид, кодируемый ДНК, выделенной с использованием такого рода рекомбинатной методики, может обладать 70% или большей степенью гомологии и обычно характеризуется высокой гомологией по аминокислотной последовательности с ALT, полученной из клеток человека или т.п. Термин "высокая гомология/высокая степень гомологии" относится обычно к 97% или большей степени гомологии, предпочтительно к 98% или большей степени гомологии и более предпочтительно к 99% или большей степени гомологии. Для определения гомологии полипептидов может быть использован алгоритм, описанный в работе Wilbur, W J. and Lipman, D.J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Полипептид может варьировать по аминокислотной последовательности, молекулярной массе, величине изоэлектрической точки, наличию или отсутствию сахарных цепей, морфологии и т.п., что зависит от клетки или клетки-хозяина, продуцирующей данный полипептид, или от использованного способа очистки, который будет описан ниже. Однако, если полученный полипептид имеет функции, эквивалентные функциям ALT, полученной из клеток человека или т.п., то ДНК, кодирующая данный полипептид, может использоваться в настоящем изобретении. Так, например, когда полипептид по настоящему изобретению экспрессируется в прокариотическом организме (например, в Escherichia coli), добавляют метиониновый остаток к N-концу исходной аминокислотной последовательности полипептида. А когда полипептид экспрессируется в эукариотах (например, в клетке млекопитающего), то удаляют N-концевую сигнальную последовательность. ДНК, кодирующая такой полипептид, может использоваться в настоящем изобретении.
В настоящем изобретении, в качестве ДНК, кодирующей ALT, может использоваться ДНК, имеющая нуклеотидную последовательность KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Cards familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140. Альтернативно, может использоваться ДНК, которая гибридизуется с ДНК, комплементарной к ДНК, имеющей описанную выше нуклеотидную последовательность, в условиях соответствующей жесткости и которая при этом сохраняет способность кодировать полипептид, обладающий активностью ALT.
ДНК, кодирующая ALT, может использоваться в системах in vivo или in vitro продукции желаемого полипептида, описанного выше. Кроме того, ДНК, кодирующая ALT, может использоваться для получения клетки, которая будет в значительной мере экспрессировать ALT. ДНК, кодирующая ALT, может быть представлена в любой форме, главное, чтобы она обладала способностью кодировать ALT. Это значит, что такая ДНК может представлять собой, например, кДНК, синтезированную на основе мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что если ДНК обладает способностью кодировать ALT, то такая ДНК может иметь любую нуклеотидную последовательность, определяемую вырожденностью генетического кода.
ДНК, кодирующая ALT, может быть получена в рамках способов, известных специалистам в данной области. Так, например, ДНК может быть получена путем создания библиотеки кДНК из клетки, экспорессирующей ALT, и проведения далее гибридизации с использованием в качестве зонда части последовательности ДНК для ALT (например, ДНК KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ; 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: CaO19_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140). Бибилиотека кДНК может быть создана, например, по способу, описанному в работе Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно, может быть использована коммерчески доступная библиотека кДНК. Возможно также получить ДНК, кодирующую ALT, путем выделения РНК из клетки, экспрессирующей ALT, синтеза молекул олиго-ДНК на основе последовательности ДНК для ALT (например, такой последовательности ДНК, как KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO 090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.1:00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.100016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140) и затем проведения ПЦР с использованием молекул олиго-ДНК в качестве праймеров, что приводит к амплификации кДНК, кодирующей ALT.
Далее, при определении нуклеотидной последовательности полученной кДНК, становится возможным определить участок трансляции кодируемой ALT и получить соответствующую аминокислотную последовательность ALT. Кроме того, при проведении скрининга геномной библиотеки с использованием полученной кДНК в качестве зонда, можно выделить геномную ДНК.
Конкретно, могут быть использованы следующие процедуры. Вначале, выделяют мРНК из клеток, тканей или других структур, экспрессирующих ALT. Для выделения мРНК, получают суммарную РНК в соответствии с известными процедурами, например, при использовании метода ультрацентрифугирования в градиенте гуанидина (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), метода AGPC (Chomczynski, P. and Sacchi, N, Anal. Biochem. (1987) 162, 156-159) или т.п., и затем выделяют и очищают мРНК из суммарной РНК с использованием набора для очистки мРНК (Pharmacia) и т.п. Альтернативно, мРНК может быть получена непосредственно с использованием набора для очистки мРНК (QuickPrep mRNA Purification Kit (Pharmacia)).
На основе полученной мРНК, синтезируют кДНК с использованием обратной транскриптазы. Альтернативно, кДНК может быть синтезирована с использованием набора, такого как набор для синтеза одноцепочечной кДНК с обратной транскриптазой (AMV Reverse Transcriptase First-Strand cDNA Synthesis Kit ((SEDCAGAKU CORPORATION)). Возможно также провести синтез и амплификацию кДНК по методу 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора 5-Ampli FINDER RACE Kit (Clontech) и полимеразно-цепной реакции (ПЦР) с праймерами.
Нужный фрагмент ДНК получают из продуктов ПЦР и далее лигируют с векторной ДНК, получая в результате рекомбинантный вектор. Далее, указанный вектор вводят в клетку-хозяина (например, в Е. coli), после чего проводят селекцию образовавшихся колоний с получением желаемого рекомбинантного вектора. Нуклеотидная последовательной целевой ДНК может быть проанализирована, с целью ее подтверждения, согласно известным методикам, таким как дидезоксинуклеотидный метод терминации цепи.
Дополнительно, может быть создана нуклеотидная последовательность с более высокой эффективностью экспрессии, применительно к ДНК, кодирующей ALT, с учетом частоты использования кодонов в клетке-хозяине, используемой для экспрессии (Grantham, R et al., Nucleic Acids Research (1981) 9, p.43-74). Кроме того, ДНК, кодирующая ALT, может быть модифицирована с использованием наборов или уже известных методик. Примеры таких модификаций включают, без ограничения, расщепление ферментами рестрикции, встраивание в качестве вставок синтетических олигонуклеотидов или соответствующих фрагментов ДНК, добавление линкеров или введение кодона инициации (ATG) и/или кодона терминации (ТАА, TGA или TAG).
ДНК, кодирующая ALT, также включает ДНК, которая гибридизуется с ДНК, комплементарной к ДНК, имеющей нуклеотидную последовательность KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875, KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282, KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682, KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670, KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510, KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533, KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (дрозофила): Dmel_CG1640, KEGG/ФЕРМЕНТ: 2. 6.1.2/Caenorhabditis elegans (нематода): C32F10.8, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210, KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524, KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C, KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C, KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W, KEGG/ФЕРМЕНТ: 2.6.1.2 5/Candida albicans: Ca019_346, KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fiimigatus: AFUA_6G07770, KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: A0090003000164, KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490, KEGG/ФЕРМЕНТ: 2. 6.1.2/Dictyostelium discoideum: DDB_0232139, KEGG/ФЕРМЕНТ: 2. 6.1.2/Trypanosomabrucei: Tb927.1.3950, KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 233.t00009, KEGG/ФЕРМЕНТ: 2.6.1.2/Entamoeba histolytica: 24.t00016, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420, KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430, KEGG/ФЕРМЕНТ. 2.6.1.2/Trypanosoma cruzi: 510889.120 или KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140 в условиях определенной жесткости и кодирует полипептид, функционально эквивалентный ALT.
Жесткость условий гибридизации может быть соответствующим образом выбрана любым специалистом со средним уровнем знаний в данной области, включая, например, условия низкой жесткости. Условия низкой жесткости относятся, например, к следующим: температура 42°C, концентрации солей 2×SSC и 0,1% ДСН, предпочтительно 50°C, 2×SSC и 0,1% ДСН. Более предпочтительно, могут быть выбраны условия высокой жесткости для гибридизации. Условия высокой жесткости включают, например, температуру 65°C, концентрации солей 2xSSC и 0,1% ДСН. В этих условиях, когда повышают температуру гибридизации, могут быть получены ДНК с более высокой степенью гомологии. Указанная выше гибридизующаяся ДНК представляет собой предпочтительно ДНК природного происхождения, например, кДНК или хромосомную ДНК.
Указанные выше ДНК, которые выделяют в рамках методик гибридизации, обычно характеризуются высокой идентичностью по последовательности с ДНК, кодирующей ALT, полученную из клеток человека или т.п. ДНК, кодирующая ALT, также включает ДНК, которая кодирует полипептид, функционально эквивалентный ALT, полученной из клеток человека или т.п., и характеризуется высокой идентичностью с ДНК, кодирующей ALT, полученную из клеток человека или т.п. Термин "высокая идентичность" относится обычно к 96% или большей степени гомологии, предпочтительно к 98% или большей степени гомологии и более предпочтительно к 99% или большей степени гомологии. Идентичность нуклеотидных последовательностей может быть определена с помощью алгоритма BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны программы, такие как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). Когда нуклеотидные последовательности анализируют по программе BLASTN, созданной на основе BLAST, то используют следующие, установленные в ней параметры: баллы = 100 и длина слова = 12. Конкретные процедуры анализа на основе указанных программ известны и широко доступны (http://www.ncbi.nlm.nih.gov.).
Желаемый полипептид может быть получен по процедуре, включающей перенос гена, кодирующего указанный желаемый полипептид, в клетку, которая способна усиленно экспрессировать переносчик бикарбоната и CSAD или ALT, и культивирование полученной клетки в среде.
Когда желаемый полипептид получают с использованием клетки, в которую были искусственно перенесены ген переносчика бикарбоната и ген CSAD или ALT, конкретно не ограничивается порядок переноса гена переносчика бикарбоната, переноса гена CSAD или ALT и переноса гена, кодирующего желаемый полипептид. Ген, кодирующий желаемый полипептид, может быть перенесен после переноса гена переносчика бикарбоната и гена CSAD или ALT. Альтернативно, ген переносчика бикарбоната и ген CSAD или ALT может быть перенесен после переноса гена, кодирующего желаемый полипептид. Возможно также провести перенос гена переносчика бикарбоната, гена CSAD или ALT и гена, кодирующего желаемый полипептид, одновременно.
Ген переносчика бикарбоната, ген CSAD или ALT и ген, кодирующий желаемый полипептид, могут быть перенесены одновременно в составе одного вектора. Альтернативно, они могут быть перенесены по отдельности с использованием множества векторов.
Для культивирования клетки, которая способна усиленно экспрессировать переносчик бикарбоната (и которая может усиленно экспрессировать CSAD или ALT), могут быть использованы стандартные среды, которые обычно применяются при культивировании клеток (предпочтительно, культуры клеток животных). Указанные среды обычно содержат аминокислоты, витамины, факторы липидной природы, энергетические источники, осмотические регуляторы, источники железа и регуляторы pH. Эти компоненты обычно содержатся в следующих количествах: аминокислоты - 0,05-1500 мг/л, витамины 0,001-10 мг/л, факторы липидной природы - 0-200 мг/л, энергетические источники - 1-20 г/л, осмотические регуляторы - 0,1-10000 мг/л, источники железа - 0,1-500 мг/л, регуляторы pH - 1-10000 мг/л, металлы-микроэлементы - 0,00001-200 мг/л, поверхностно-активные вещества - 0-5000 мг/л, ростовые кофакторы - 0,05-10000 мкг/л и нуклеозиды - 0,001-50 мг/л. Однако, их фактическое содержание не ограничивается приведенным перечнем и может быть соответствующим образом выбрано с учетом типа культивируемой клетки, типа желаемого полипептида и т.п.
В дополнение к указанным выше компонентам, могут также включаться другие металлы-микроэлементы, поверхностно-активные вещества, ростовые кофакторы, нуклеозиды и т.п.
Конкретные примеры таких компонентов включают аминокислоты, такие как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-цистеин, L-цистин, L-глютамин, L-глютаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-орнитин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин, предпочтительно, L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-цистин, L-глютамин, L-глютаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин; витамины, такие как изоинозитол, биотин, фолиевая кислота, липоевая кислота, никотинамид, никотиновая кислота, п-аминобензойная кислота, пантотенат кальция, пиридоксаль-гидрохлорид, пиридоксин-гидрохлорид, рибофлавин, тиамина гидрохлорид, витамин B12 и аскорбиновая кислота, и предпочтительно включают биотин, фолиевую кислоту, липоевую кислоту, никотинамид, пантотенат кальция, пиридоксаль-гидрохлорид, рибофлавин, тиамина гидрохлорид, витамин B12 и аскорбиновую кислоту; факторы липидной природы, такие как холинхлорид, холинтартрат, линолевая кислота, олеиновая кислота и холестерин, предпочтительно холинхлорид; энергетические источники, такие как глюкоза, галактоза, манноза и фруктоза, предпочтительно глюкоза; осмотические регуляторы, такие как хлорид натрия, хлорид калия и нитрат калия, предпочтительно, хлорид натрия; источники железа, железо-ЭДТА, цитрат железа трехвалентного, хлорид железа трехвалентного, хлорид железа двухвалентного, сульфат железа двухвалентного, сульфат железа трехвалентного и нитрат железа трехвалентного, предпочтительно, хлорид железа трехвалентного, железо-ЭДТА и цитрат железа трехвалентного; а также регуляторы pH, такие как гидрокарбонат натрия, хлорид кальция, дигидрофосфат натрия, HEPES и MOPS, предпочтительно, гидрокарбонат натрия. Культуральные среды, содержащие любой из указанных выше компонентов, могут быть приведены ниже, в качестве примеров.
Кроме указанных выше компонентов, могут быть добавлены металлы - микроэлементы, такие как сульфат меди, сульфат марганца, сульфат цинка, сульфат магния, хлорид никеля, хлорид олова, хлорид магния и субсиликат натрия, предпочтительно, сульфат меди, сульфат цинка и сульфат магния; поверхностно-активные вещества, такие как Твин 80 и Плуроник F68; ростовые кофакторы, такие как рекомбинантный инсулин, рекомбинантный IGF-1, рекомбинантный EGF, рекомбинантный FGF, рекомбинантный PDGF, рекомбинантный TGF-α, этаноламина гидрохлорид, селенит натрия, ретиноевая кислота и дигидрохлорид путресцина, предпочтительно, селенит натрия, этаноламина гидрохлорид, рекомбинантный IGF-1 и дигидрохлорид путресцина, а также нуклеозиды, такие как дезоксиаденозин, дезоксицитидин, дезоксигуанозин, аденозин, цитидин, гуанозин и уридин. В приведенных примерах, предпочтительные варианты указанных выше сред содержат антибиотики, такие как стрептомицин, калий-пенициллин-G и гентамицин, а также индикаторы pH, такие как феноловый красный.
Величина pH среды варьирует в зависимости от типа культивируемых клеток. В основном, используют среды с pH 6,8-7,6. Во многих случаях может быть приемлем pH 7,0-7,4.
Возможно также использование коммерчески доступной среды, подходящей для культивирования клеток животных, например, D-MEM (среда Игла в модификации Дульбекко), D-MEM/F-12, смесь 1:1 (среда Игла в модификации Дульбекко: питательная смесь F-12), RPMI1640, CHO-S-SFMII (Invitrogen), CHO-SF (Sigma-Aldrich), EX-CELL 301 (JRH Biosciences), CD-CHO (Invitrogen), IS CHO-V (Irvine Scientific), PF-ACF-CHO (Sigiria Aldrich) или т.п.
Альтернативно, данная среда может представлять собой бессывороточную среду.
В том случае, когда клетка, которая усиленно экспрессирует переносчик бикарбоната (и которая может усиленно экспрессировать CSAD или ALT), относится к клеткам CHO, то указанные клетки CHO культивируют согласно известным способам. Например, клетки CHO обычно. культивируют в атмосфере CO2, где его концентрация в газовой фазе составляет от 0 до 40%, предпочтительно, от 2 до 10%; при температуре от 30 до 39°C, предпочтительно, при 37°C.
Подходящая длительность культивирования для целей продукции желаемого полипептида с использованием клетки, которая усиленно экспрессирует переносчик бикарбоната (и которая может усиленно экспрессировать CSAD или ALT), составляет обычно от 1 дня до 3 месяцев, предпочтительно от 1 дня до 2 месяцев и более предпочтительно от 1 дня до 1 месяца.
Что касается различных устройств для культивирования клеток животных, то может использоваться установка для культивирования типа бродильного чана, установка для культивирования типа эрлифтного ферментера, установка для культивирования в виде бутыли с культуральной средой, установка для культивирования типа роллерной колбы, установка для культивирования с использованием микроносителя, установка для культивирования в псевдоожиженном слое, установка для культивирования с использованием полых волокон, установка для культивирования с использованием роллерных флаконов, установка для культивирования с использованием плотного слоя или т.п.
Культивирование может проводиться с использованием любого метода культивирования, такого как периодическое культивирование с подпиткой и непрерывное культивирование. Предпочтительно, используют периодическое культивирование с подпиткой или непрерывное культивирование. Более предпочтительным является периодическое культивирование с подпиткой.
В том случае, когда полипептид, получаемый в соответствии со способом по настоящему изобретению, обладает активностью, позволяющей использовать его в качестве фармацевтического средства, то возможно получать фармацевтическое средство при смешивании данного полипептида с фармацевтически приемлемыми носителями или добавками и последующем их формировании в препарат.
Конкретные примеры фармацевтически приемлемых носителей и добавок включают воду, органические растворители, которые являются фармацевтически приемлемыми, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, натрий-карбоксиметилцеллюлозу, полиакрилат натрия, альгинат натрия, водорастворимый декстран, натрий-карбоксиметилкрахмал, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую камедь, аравийскую камедь, казеин, агар-агар, полиэтиленгликоль, диглицерин, глицерин, пропиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, человеческий сывороточный альбумин (HSA), маннит, сорбит, лактозу и поверхностно-активные вещества, которые приемлемы для использования в качестве фармацевтических добавок.
Фактически используемые добавки могут быть выбраны из указанного перечня и применяться по отдельности или в сочетании, с учетом дозированной формы лекарственного средства по настоящему изобретению, но они не будут ограничены приведенным выше списком. Например, в том случае, когда полипептид используют в виде инъецируемой композиции, очищенный полипептид может быть растворен в растворителе, таком как физиологический раствор, буфер или раствор глюкозы, и затем к раствору может быть добавлен ингибитор адсорбции, такой как Твин 80, Твин 20, желатин или человеческий сывороточный альбумин. Альтернативно, может использоваться лиофильно высушенный агент для получения дозированной формы, которую растворяют и восстанавливают перед использованием. Примеры эксципиента, используемого для лиофилизации, включают сахарные спирты и сахариды, такие как маннит и глюкоза.
Эффективные дозы полипептида могут быть соответствующим образом выбраны с учетом типа данного полипептида, типа заболевания, подлежащего лечению или профилактике, возраста пациента, тяжести заболевания и т.п. Например, в том случае, когда рассматриваемый полипептид представляет собой антигликановое антитело, то эффективную дозу выбирают в диапазоне от 0,001 мг до 1000 мг на кг веса тела на введение. Альтернативно, может быть выбрана доза в диапазоне 0,01-100000 мг/тело, при расчете на пациента. Однако, эффективная доза не ограничивается указанными диапазонами.
Указанный полипептид может вводиться перорально или парентерально, но парентеральное введение является предпочтительным. Конкретно, могут быть использованы инъекция (например, системное или локальное введение путем внутривенной инъекции, внутримышечная инъекция, внутрибрюшинная инъекция, подкожная инъекция и т.п.), трансназальное введение, транспульмонарное введение, трансдермальное введение и т.п.
Настоящее изобретение относится к клетке, которая содержит перенесенную в нее ДНК, кодирующую переносчик бикарбоната, и перенесенную ДНК, кодирующую декарбоксилазу цистеинсульфиновой кислоты или аланинаминотрансферазу, причем обе или одна из них может быть включена в вектор.
В том случае, когда используют эукариоты, то в качестве клетки-хозяина применимы клетки животных, клетки растений, клетки грибов и т.п. Конкретные примеры клеток животных включают клетки млекопитающих, такие как клетки СНО (J. Exp.Med. (1995) 108, 945), клетки COS, клетки ЗТЗ, миеломные клетки, ВНК (клетки почки детенышей хомячка) клетки, клетки HeLa и клетки Vero; клетки земноводных, такие как ооциты Xenopus laevis (Valle et al., Nature (1981) 291, 358-340); или клетки насекомых, такие как клетки sf9, sf21 и Tn5. Среди клеток CHO, с особым успехом используют dhfr-CHO, не содержащие ген DHFR (Proc. Natl. Acad. Sci, USA (1980) 77, 4216-4420) и СНО K-1 (Proc. Natl. Acad. Sci. USA (1968) 60, 1275). В том случае, когда нужно получить высокую экспрессию в клетках животных, клетки CHO являются особенно предпочтительными. Введение ДНК, которая может быть включена в вектор для клетки-хозяина, может быть достигнуто в рамках таких методов, как метод с использованием фосфата кальция, метод, включающий использование ДЭАЭ-декстрана, метод с использованием катионной рибосомной DOTAP (Boehringer-Mannheim), методы электропорации, липофекции и т.п.
В качестве клеток растений, подходящих для продукции полипептида, могут использоваться клетки. Nicotiana tabacum как известная система для получения полипептидов, и на их основе может быть получена каллюсная культура. Что касается использования грибных клеток для получения полипептида, то конкретные примеры включают дрожжи, относящиеся к роду Saccharomyces, например, Saccharomyces cerevisiae, и нитевидные грибы, относящиеся к роду Aspergillus, например, Aspergillus niger.
Для случая использования прокариотов известны системы продукции с использованием бактериальных клеток. Конкретные примеры таких клеток включают Е. coli (такую как JM109, DH5α, НВ101) и Bacillus subtilis.
Полипептид, кодируемый интересующим геном, может быть получен при трансформации этих клеток геном, представляющим интерес, и последующем культивировании трансформированных клеток in vitro. Культивирование может проводиться по известным методикам. Например, в качестве культурального бульона для выращивания клеток животных может использоваться среда, такая как DMEM, MEM, RPMI1640 или IMDM. Может быть также введена сывороточная добавка, такая как фетальная сыворотка теленка (ФСТ). Альтернативно, может проводиться культивирование в бессывороточной среде. Поддерживаемый при культивировании pH среды составляет от 6 до 8. Культивирование обычно проводят при температуре 30-40°C в течение примерно 15-20 часов. При необходимости проводят замену среды, аэрацию и перемешивание.
С другой стороны, имеются системы продукции in vivo, которые включают системы на основе животных или растений. Представляющий интерес ген переносят в таких животных или в такие растения для продукции полипептида в организме животного или в растениях. Затем собирают нужный полипептид. Термин «хозяин» в контексте настоящего описания обозначает таких животных или такие растения.
В том случае, когда для указанной цели используют животных, подходящие системы продукции включают системы млекопитающих или насекомых. В качестве млекопитающих могут использоваться коза, свинья, овца, мышь и корова (Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). При использовании млекопитающих могут быть получены трансгенные животные.
Вначале, ген, представляющий интерес, объединяют с геном, кодирующим полипептид, который образуется в молоке (такой как козий β-казеин) с получением слитого гена. Фрагмент ДНК, содержащий этот слитый ген, инъецируют в козий эмбрион, который затем имплантируют в матку козы. Нужный полипептид может быть получен из молока трансгенных коз, которые родились от козы, которой ввели указанный эмбрион, или от потомства трансгенных коз. Для повышения выхода молока, содержащего полипептид, от трансгенных коз, указанным трансгенным козам могут вводиться соответствующие гормоны (Ebert, K.M. et al., Bio/Technology (1994) 12, 699-702).
Примеры насекомых, которые могут использоваться, включают шелковичных червей. В этом случае, шелковичного червя инфицируют бакуловирусом, который содержит ген, кодирующий нужный полипептид. При этом указанный полипептид может быть получен из жидкостей тела шелковичного червя (Susumu, M. et al., Nature (1985) 315, 592-594).
Дополнительно, в случае использования растений применяется табак. В случае использования растений табака, ген, кодирующий нужный полипептид, встраивают в вектор экспрессии для растений (например, pMON 530), который затем переносят в бактерию, такую как Agrobacterium tumefaciens. Растение табака (например, Nicotiana tabacum) инфицируют полученной бактерией. Представляющий интерес полипептид может быть получен из листьев этого растения (Julian, К.-С. Ма et al., Eur. J. Immunol. (1994) 24, 131-138).
Полученные таким образом полипептиды могут быть выделены из клетки-хозяина, из ее внутренней или наружной части (например, из среды для культивирования) и очищают до состояния по существу чистого гомогенного полипептида. Выделение и очистка полипептидов может быть проведена с использованием традиционных способов выделения и очистки полипептидов и никоим образом не ограничены. Например, полипептиды могут быть выделены и очищены при соответствующем выборе и объединении разных инструментов и методик, таких как хроматография на колонках, использование фильтров, ультрафильтрация, высаливание, осаждение растворителем, экстракция растворителем, отгонка, иммунопреципитация, электрофорез в ДСН-полиакриламидном геле, изоэлектрофокусирование, диализ, рекристаллизация и т.п.
Примеры хроматографических методов включают аффинную хроматографию, ионообменную хроматографию, гель-фильтрацию, хроматографию с обращением фазы, адсорбционную хроматографию (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed. Daniel R. Marshak et al.. Cold Spring Harbor Laboratory Press, 1996). Указанные хроматографические методики могут быть выполнены в рамках использования хроматографии в жидкой фазе, например, ВЭЖХ, ЖХБР (FPLC) и т.п. Настоящее изобретение также включает в свои рамки высокоочищенные полипептиды, полученные в результате использования указанных выше процедур очистки.
До или после очистки можно также ввести необязательные модификации в полипептид или удалить из него частичный пептид в ходе реакции данного полипептида с ферментом, осуществляющим соответствующую модификацию полипептида. Примеры таких ферментов включают, без ограничения, трипсин, химотрипсин, лизил-эндопептидазу, протеинкиназу и глюкозидазу.
В контексте настоящего описания выражение «клетки, в которые была перенесена ДНК» обозначает не только клетки, в которые была включена экзогенная ДНК по методам генетической рекомбинации, но также клетки, в которых была активирована эндогенная ДНК по технологии генной активации (см., например, International Publication WO 94/12650), так что при этом инициируется или повышается уровень экспрессии белка, соответствующего данной эндогенной ДНК, или транскрипция ДНК.
ПРИМЕРЫ
Ниже приводится подробное описание настоящего изобретения со ссылкой на соответствующие примеры. Следует отметить, что эти примеры даются лишь с целью иллюстрации настоящего изобретения и не следует их трактовать как ограничивающие область настоящего изобретения.
Пример 1
Клонирование гена анионообменника из клетки печени человека (анионообменик 1, полоса 3)
С использованием коммерчески доступного Quick - клона кДНК из печени человека (Clontech Laboratories, Inc.) в качестве матрицы, получают по методу ПЦР ген анионообменника (АЕ1), выделенный из печени человека. Клонированный ген далее секвенируют для подтверждения того, что он кодирует АЕ1, с точки зрения его гомологии с опубликованными данными для человеческого АЕ1. Было показано, что полученный таким образом ген АЕ1 содержит мутации в восьми сайтах последовательности из 2733 оснований (t263g, t357g, a645t, a672c, c951t, a2078g, t2195c, c2500t) и кодирует 911 аминокислот (L88R, E693G, V712A, H834Y). Однако, поскольку, как было подсчитано, продукт данного гена является переносчиком, содержащим 13 трансмембранных доменов (фиг.1), то данный ген был использован для модуляции клеток в качестве гена АЕ1, полученного из печени человека.
Пример 2
Повышение уровня продукции антитела путем введения гена анионообменника из клеток человека
Путем добавления последовательности Козака к человеческому гену АЕ1, полученному за счет ПЦР-клонирования, как было описано в примере 1 (который далее будет называться как АЕ1), были сконструированы pHyg-AE1 (фиг.2) и pPur-AE1 (фиг.3) в качестве плазмид экспрессии CMV промотора. Плазмиды экспрессии pHyg-AE1 или pHyg, которые не содержали гена AE1 (каждая из которых была получена при введении вначале единиц экспрессии гена резистентности к гигромицину, полученных из рТК5, предоставленного Clontech Laboratories, Inc., в плазмиды pSV2-dhfr (ATCC №37146), с последующим удалением единиц экспрессии dhfr из сконструированных плазмид), были введены в клетки CHO, продуцирующие анти-гликан-3-антитело, взятые в качестве родительского штамма (см. публикацию по международному патенту WO 2006/006693), путем электропорации. Затем были отобраны штаммы, которые демонстрировали высокую пролиферацию в стадии стационарной культуры в присутствии гигромицина (200 мкг/мл). После амплификации была получена суммарная РНК из штаммов pHyg-AE1, и были выбраны пять штаммов, экспрессирующих AE1 на высоких уровнях, с использованием метода TaqMan. Далее, сравнили уровень продукции антитела между pHyg-трансформированными клетками, взятыми в качестве контроля (четыре штамма), и четырьмя штаммами клеток, трансформированных человеческим AE1, которые пролиферировали на уровне, эквивалентном уровню, который наблюдался в контроле при культивировании на качалке. При периодическом культивировании с подпиткой в качалочных колбах на 50 мл в условиях, когда 2×105 клеток/мл находилось на начальной стадии, количество антитела против гликана-3, продуцированного pHyg-AE1-трансформированными клетками (четыре штамма) на 12 день после начала культивирования на качалке, значительно превышало количество продуцированного pHyg-трансформированными клетками (четыре штамма) (критерий Стьюдента: Р<0,05, фиг.4).
Затем, с использованием в качестве родительского штамма AE1-экспрессирующего штамма, который продуцировал наибольшее количество антитела среди четырех pHyg-AE1-трансформированных штаммов, вводят методом электропорации pPur-CSAD или плазмиду экспрессии декарбоксилазы цистеинсульфиновой кислоты (CSAD), содержащую ген резистентности к пуромицину (фиг.10, см. стандартный пример 2, описанный ниже), pPur-ALTl или плазмиду экспрессии аланинаминотрансферазы (ALT1), содержащую ген резистентности к пуромицину (фиг.11, см. стандартный пример 4, описанный ниже) и контрольную плазмиду pPur (pPUR, вектор экспрессии резистентности к пуромицину, предоставленный Clontech Laboratories, Inc.). Затем были отобраны штаммы, которые демонстрируют высокую пролиферацию на стадии стационарной культуры в присутствии пуромицина (6 мкг/мл). После амплификации получают суммарную РНК из отобранных таким образом штаммов. Затем были отобраны AE1/CSAD-соэкспрессирующие штаммы (девять штаммов), AE1/ALT1-соэкспрессирующие штаммы (10 штаммов) и AE1/pPur-экспрессирующие штаммы (восемь штаммов) (в каждом случае подразумевается способность к совместной экспрессии указанных продуктов), которые экспрессировали введенные в них новые гены на высоком уровне, после чего сравнивали уровни продукции антитела и длительность выживания. AE1/CSAD-экспрессирующие штаммы (девять штаммов) при проведении периодического культивирования в 50-мл качалочных колбах с подпиткой на стадии начальной культуры, содержащей 2×105 клеток/мл, демонстрировали более высокие уровни продукции антитела против гликана-3 (критерий Стьюдента Р<0,05, фиг.5) и значительно более длительный период выживания (критерий Стьюдента Р<0,01, фиг.6), чем контрольный AE1/pPur-экспрессирующий штамм (восемь штаммов) на 10 день на поздней стадии роста качалочной культуры. Среди трех видов исследованных совместно экспрессирующих штаммов, AE1/ALT1-соэкспрессирующие штаммы (10 штаммов) продуцировали наибольшее количество антитела против гликана-3, которое значительно превышало соответствующее количество, образуемое контрольными штаммами, совместно экспрессирущими AE1/pPur (восемь штаммов) на 8 день культивирования на качалке в периодическом режиме с подпиткой (критерий Стьюдента P<0,01, фиг.7). Далее, АА53, который продуцировал наибольшее количество антитела (1497 мг/л/8 дней) и экспрессировал мРНК для ALT1 на наивысшем уровне среди всех AE1/ALT1-соэкспрессирующих штаммов (10 штаммов), при оценке в эксперименте по культивированию на качалке в периодическом режиме с подпиткой в сосуде объемом 1 л (на стадии начальной культуры с содержанием 10×105 клеток/мл), количество антитела, продуцируемого штаммом АА53 на 7 день культивирования составляло 1,9 г/л/7 дней, указывая на то, что АА53 способен к высокой продукции антитела при краткосрочном культивировании (фиг.8). С учетом того, что ТА41 представлял собой TauT/ALT1-соэкспрессирущий штамм, который продуцировал 5,3 г/л антитела на 21 день культивирования (см. стандартный пример 4, описанный ниже), и продуцировал 1,5 г/л антитела на 7 день культивирования, был сделан вывод, что штамм АА53 обладает способностью продуцировать большие количества антитела при краткосрочном культивировании, чем ТА41 и, соответственно, был расценен как более перспективный для практического применения.
Приведенные выше результаты показывают, что клетки, способные к высокой продукции антитела, могут быть получены путем достижения искусственной усиленной экспрессии анионообменника (АЕ1), а также за счет усиленной одновременной экспрессии АЕ1 и CSAD или ALT1.
Кроме того, эффект усиленной экспрессии АЕ1 был продемонстрирован при конструировании штамма, способного к продукции анти-IL-6R антитела с использованием для этого клетки-хозяина, усиленно экспрессирующей AE1. В обычно используемые в качестве хозяина клетки DXB11, ввели путем электропорации pHyg-AE1 (фиг.2). Затем были отобраны штаммы, которые демонстрировали высокую пролиферацию на стадии стационарной культуры в присутствии гигромицина (200 мкг/мл). После амплификации, клетки, экспрессирующие на высоком уровне AE1, были установлены в качестве клеток-хозяев AE1/DXB11 по методу TaqMan. Плазмиды экспрессии анти-IL-6R антитела были введены в клетки-хозяева AE1/DXB11 и далее при клонировании одной клетки получили АЕ1-S08. Полученный таким образом AE1-S08 был способен к высокой продукции анти-IL-6R антитела, и уровень его образования на 14 день культивирования в периодическом режиме с подпиткой в сосуде на 1 л (7×105 клеток/мл на стадии начальной культуры) составлял 3,0 г/л, как показано на фиг.12. Таким образом, было подтверждено, что AE1-S08 способен к высокой продукции антитела, и клетки-хозяева AE1/DXB11 были стабильными, по данным теста на стабильность, проведенного при субкультивировании, и сохраняли способность к экспрессии АЕ1 на высоком уровне.
Приведенные выше результаты дают основание полагать, что эффект введения гена AE1 имеет положительный характер, как в случае его введения до, так и после введения гена антитела.
Настоящее изобретение может быть применено для всех типов клеток, способных к продукции полипептида (предпочтительно, антитела).
Стандартный пример 1
Клонирование генов декарбоксилазы цистеинсульфиновой кислоты (CSAD) и цистеиндиоксигеназы, тип 1 (CDO1) из клеток хомячка CHO
Экстрагировали суммарную РНК из клеток, продуцирующих антитело против IL-6 рецептора (клеточная линия СНО DXB11, в которую был перенесен ген, кодирующий антитело против IL-6 рецептора) (публикация по нерассмотренной заявке на патент Японии № Hei 8-99902), и затем синтезировали на ее основе кДНК в поли(А)-зависимом формате. Гены для CSAD и CDO1 из клеток хомячка были получены в результате ПЦР, проведенной с использованием в качестве матрицы кДНК, фрагментированной тремя ферментами рестрикции. SalI, XhoI и EcoRI. Для проведения ПЦР были созданы праймеры, содержащие 5'-концевую и 3'-концевую консервативную последовательность, характерную для крысиных и мышиных CSAD или CDO1. Далее определяли нуклеотидные последовательности клонированных генов. На основе гомологии с другими генами CSAD или CDO1 из известных видов, было подтверждено, что данный клонированный ген кодирует CSAD хомячка (фиг.9). Аминокислотная последовательность CSAD хомячка высоко гомологична аминокислотным последовательностям мышиной CSAD (96% идентичность), крысиной CSAD (96% идентичность) и человеческой CSAD (91% идентичность); и, в этой связи, предположили, что CSAD хомячка представляет собой фермент с такой же активностью. Нуклеотидная последовательность CSAD хомячка показана в виде SEQ ID NO:3. Аминокислотная последовательность CSAD хомячка показана в виде SEQ ID NO:4.
Стандартный пример 2
Конструирование плазмиды экспрессии CSAD хомячка для селекции на пуромицине
При добавлении последовательности Козака к гену CSAD из хомячка (далее называемый CSAD), полученному при ПЦР-клонировании, в рамках стандартного примера 1, создали плазмиду экспрессии CMV промотора pPur/CSAD (фиг.10).
Стандартный пример 3
Клонирование гена аланинаминотрансферазы из клеток печени человека
С использованием клона кДНК из печени человека (QUICK-Clone cDNA (Clontech Laboratories, Inc.)) в качестве матрицы, получали по методу ПЦР ген аланинаминотранферазы (ALT1) из печени человека. Далее проводили секвенирование клонированного таким образом гена, подтвердив, что он кодирует ALT1, что следовало из его гомологии с известными последовательностями ALT1 человека. Полученный таким образом ген ALT1 содержал мутации в пяти сайгах последовательности из 1488 оснований (с157а, а215д, c765t, t857c, t995a) и кодировал 496 аминокислот, включая четыре других, отличных аминокислоты (R53S, Q72R, F286S, M332K), и был использован в качестве ПЦР клона для ALT1 из печени человека для целей модуляции клеток.
Стандартный пример 4
Повышение продукции антитела путем переноса аланинаминотрансферазы человека
При добавлении последовательности Козака к последовательности ALT1, полученной при клонировании, в соответствии с процедурой стандартного примера 3 (далее называемой ALT1), получали pPur-ALT1, представляющую собой плазмиду экспрессии CMV промотора (фиг.11). Плазмиды экспрессии pPur-ALT1 или pPur, которые не содержали гена ALT1, были введены путем электропорации в клетки CHO, продуцирующие антитело против гликана-3, взятые в качестве родительских штаммов (см. публикацию по международному патенту WO 2006/006693), и далее были отобраны штаммы клеток, которые демонстрировали высокую пролиферацию в стадии стационарной культуры в присутствии пуромицина (6 мкг/мл) (pPur-ALT1: семь штаммов, pPur: три штамма). После размножения клеток была получена суммарная РНК из клеточных штаммов pPur-ALTl, и, по результатам метода TaqMan, были отобраны шесть штаммов, экспрессирующих на высоком уровне ALT1. Далее, сравнивали уровни продукции антитела между клетками с перенесенной в них pPur, взятыми в качестве контроля (три штамма), и четырьмя штаммами клеток с перенесенной в них человеческой ALT1, пролиферация которых была эквивалентна таковой для случая pPur-трансфертных клеток в ходе качалочного культивирования. В процессе периодического культивирования с подпиткой в качалочных колбах на 50 мл с исходной плотностью клеток 2×105 клеток/мл, уровень продукции антитела против гликана-3 в клетках с перенесенной pPur-ALT1 (четыре штамма, 1236±149 мг/л) на 17 день на поздней стадии выращивания качалочной культуры, значительно превышал уровень в клетках с перенесенной pPur (три штамма, 871±119 мг/л) (t-тест: p<0,01). Было показано, что штамм А72, экспрессирующий pPur-ALT1, и штамм Р41, экспрессирующий pPur, каждый из них, образует наибольшее количество антитела при периодическом культивировании на качалке с подпиткой, по данным проведенного исследования, и далее проводили культивирование, также в периодическом режиме с подпиткой в сосудах на 1 л (при исходной плотности культуры 10×105 клеток/мл). В результате, показали, что выход антитела в штамме А72 составлял 2,9 г/л на 19 день культивирования, что превышало уровень образования антитела в штамме Р41 (2,2 г/л). Поскольку не отмечалось повышения уровня продукции антитела в штамме P41 на 14 день или в последующие дни после начала культивирования, был сделан вывод, что высокий уровень образования антитела в штамме А72 был связан с эффектом усиления показателя жизнеспособности культуры (показатель жизнеспособности штамма А72, экспрессирующего pPur-ALT1, и штамма Р41, экспрессирующего pPur, составляли 60% и 23%, соответственно, на 14 день культивирования).
Затем проводили сотрансфекцию pPur-ALT1 или pPur в штамм Т10, который представлял собой pHyg-TauT-трансфертные клетки, используемый в качестве родительского штамма (см. описанный ниже стандартный пример 6). Были отобраны клетки из числа осуществлявших совместную экспрессию TauT/ALT1, которые демонстрировали высокую пролиферативную активность и экспрессировали ALT1 на высоком уровне (шесть штаммов), а также клетки с совместной экспрессией TauT/pPur и также демонстрировавшие высокий уровень пролиферации (восемь штаммов), и далее проводили периодическое культивирование с подпиткой в качалочных колбах на 50 мл (с исходной плотностью 10×105 клеток/мл). Уровень продукции антитела против гликана-3 (745±87 мг/л) в клетках с совместной экспрессией TauT/ALTl, которые представляли собой ALT-экспрессирующие клетки, на 4 день выращивания качалочной культуры значительно превышал таковой в TauT/pPur клетках (616±29 мг/л) (t-тест: p<0,01).
Штамм ТА41 с совместной экспрессией TauT/ALTl, который продуцировал наибольшее количество антитела (881 мг/л/4 день) и который по результатам оценки в эксперименте по периодическому культивированию с подпиткой на качалке экспрессировал мРНК для ALT1 на наивысшем уровне, подвергали далее периодическому культивированию с подпиткой в сосуде на 1 л (исходная плотность клеток 10×105 клеток/мл). Уровень продукции антитела достигал 1,3 г/л на 7 день культивирования, 3,0 г/л на 10 день культивирования, 3,5 г/л на 12 день культивирования, 4,6 г/л на 17 день культивирования и 5,3 г/л на 21 день культивирования, что явно превышало соответствующие показатели для ТР08 (656 мг/л/4 день), взятого в качестве контрольного штамма, который продуцировал наибольшее количество антитела среди TauT/pPur-экспрессирующих штаммов (2,4 г/л на 10 день культивирования).
Стандартный пример 5
Клонирование гена переносчика таурина из клеток хомячка СНО
Экстрагировали суммарную РНК из клеток, продуцирующих антитело против рецептора IL-6 (линия клеток СНО DXB11, в которые был перенесен ген антитела против рецептора IL-6) (публикация по нерассмотренной заявке на патент Японии № Hei 8-99902), и затем на ее основе синтезировали кДНК в полиА-независимом формате. Ген переносчика таурина из хомячка (TauT) был получен по методу ПЦР с использованием в качестве матрицы кДНК, фрагментированной с использованием трех ферментов рестрикции, Sail, XhoI и EcoRI. В качестве праймеров для проведения ПЦР были созданы праймеры, содержащие консервативные 5'-концевую и 3'-концевую последовательности, содержащиеся в крысином и мышином TauT. Далее определяли нуклеотидную последовательность клонированного гена. На основании его гомологии с другими генами Taut в известных видах, было подтверждено, что клонированный ген кодирует Taut из хомячка (фиг.13). Аминокислотная последовательность Taut из хомячка характеризовалась высоким уровнем гомологии с мышиным TauT (96% идентичность), крысиным TauT (96% идентичность) и человеческим TauT (93% идентичность); в этой связи предположили, что TauT представляет собой переносчик с 12 трансмембранными участками (фиг.14).
Стандартный пример 6
Повышение плотности жизнеспособных клеток, ингибирование продукции лактата и повышение уровня образования антитела, вызванные переносом переносчика таурина из хомячка
Конструируют плазмиду экспрессии CMV промотора pHyg/TauT (фиг.15) при добавлении последовательности Козака к гену TauT из хомячка (далее называемый TauT), полученному при клонировании, согласно процедуре стандартного примера 5. Контрольную плазмиду рНуд без pHyg/TauT или гена TauT вводят электропорацией в родительский штамм клеток СНО, продуцирующих антитело против гликана-3 (см. WO 2006/006693). После отбора клеток, содержащих перенесенную в них плазмиду экспрессии, в присутствии гигромицина (400 мкг/мл), размножали все стабильно растущие штаммы клеток (pHyg/TauT: 8 штаммов; pHyg: 7 штаммов). Получали мРНК для TauT. Далее, показали, по методу TaqMan, что 7 штаммов экспрессируют TauT более усиленно, чем родительский штамм; и эти штаммы были отобраны в качестве клеток, содержащих перенесенную в них pHyg/TauT. Средний уровень экспрессии мРНК в этих трансфертных клетках (7 штаммов) был почти в 40 раз выше, чем в контроле (7 штаммов). Клетки из всех 14 штаммов подвергали культивированию в периодическом режиме с подпиткой в качалочных колбах на 50 мл, при исходной плотности клеток 2×105 клеток/мл. На 7 день культивирования (поздняя фаза) определяли и сравнивали показатели плотности жизнеспособных клеток, выход лактата и уровень продукции антитела против гликана-3 в этих штаммах. В периодической культуре, рост-ингибирующие вещества, такие как лактат, которые накапливались в культуральном бульоне по мере роста клеток, ингибировались. Однако, плотность жизнеспособных клеток (9,28±3,27×105 клеток/мл) и количество образуемого лактата (1,54±0,20 г/л) в pHyg/TauT-трансфертных клетках были выше, чем в клетках, в которые была перенесена только pHyg (плотность жизнеспособных клеток: 5,69±2,09×105 клеток/мл, выход лактата: 1,54±0,20 г/л) (критерий Стьюдента; p<0,05). Что касается уровня антитела против гликана-3, то 4 из 1 штаммов pHyg/TauT-трансфертных клеток демонстрировали более высокий выход антитела (среднее значение количества образованных антител: 440,6 мг/л), чем в это наблюдалось в максимальном по выходу варианте pHyg-трансфертных клеток (389,6 мг/л). Кроме того, поскольку преимущества pHyg/TauT-трансфертных клеток по уровню антитела против гликана-3 становились более выраженными (критерий Стьюдента: P<0,01) при периодическом культивировании с подпиткой, провели культивирование Т10 штамма pHyg/TauT-трансфертных клеток (которые демонстрировали наивысший ростовой потенциал среди 4 указанных выше штаммов) и исходного родительского штамма в периодическом режиме с подпиткой в сосуде на 1 л. В результате, показатель жизнеспособности штамма Т10 поддерживался на 80% или еще больше на 32 день культивирования, при сопутствующем ингибировании образования лактата. Соответственно, уровень образования антитела против гликана-3 в этих клетках достигал 2,9 г/л на 35 день культивирования. При проведении анализа методом проточной цитометрии было показано, что TauT-трансфертные клетки штамма Т10 экспрессировали TauT молекулы на клеточной мембране. Эти результаты дают основание полагать, что при проведении искусственной экспрессии TauT хомячка, возможно усилить антителопродуцирующий потенциал клеток и создать штаммы, способные к повышенной продукции антитела.
Все публикации, патенты и патентные заявки, приведенные в настоящем описании, прилагаются, в качестве ссылок, полностью.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Настоящее изобретение применимо для целей получения полипептидов.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 показывает нуклеотидную последовательность гена, кодирующего AE1 человека (GenBank M27819).
SEQ ID NO:2 показывает аминокислотную последовательность AE1 человека (UniProtKB/Swiss-Prot P02730).
SEQ ID NO:3 показывает нуклеотидную последовательность гена, кодирующего CSAD хомячка.
SEQ ID NO:4 показывает аминокислотную последовательность CSAD хомячка.
SEQ ID NO:5 показывает нуклеотидную последовательность гена, кодирующего ALT1 человека (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875).
SEQ ID NO:6 показывает аминокислотную последовательность ALT1 человека (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875).
SEQ ID NO:7 показывает нуклеотидную последовательность гена, кодирующего переносчик таурина из хомячка.
SEQ ID NO:8 показывает аминокислотную последовательность переносчика таурина из хомячка.