Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ИЗ ТРАВЫ ГОРОШКА ОБРУБЛЕННОГО, ПРИМЕНЯЕМАЯ В КАЧЕСТВЕ ЭНДОТЕЛИОПРОТЕКТОРНОГО СРЕДСТВА
Вид РИД
Изобретение
Изобретение относится к медицине и касается фармацевтической композиции, улучшающей вазодиалатирующую, антитромбическую, противовоспалительную функции эндотелия при сахарном диабете в форме таблеток, капсул, микрокапсул, гранул, сиропа, суспензии, суппозиториев, мази или геля. Приемлемая для каждой лекарственной формы композиция содержит действующее вещество - сухой экстракт из горошка обрубленного (Vicia truncatula Fich. ex Bibl.), называемый в дальнейшем Vicatula или Викатула, а также консистентнообразующую основу.
При сахарном диабете избыток сахара приводит к развитию ангиопатии, т.е. повреждению стенок сосудов, как крупных, так и мелких, нарушению системы свертывания крови и замедлению кровотока. Консервативное лечение ангиопатии проводится статинами, препаратами для снижения вязкости крови, биогенными стимуляторами, метаболическими препаратами, препаратами с эндотелиопротекторным действием (Сулодексид в разных лекарственных формах и под разными названиями: Сулодексид, Вессел Дуэ Ф, Ангиофлюкс [режим доступа: http://www.vidal.ru]).
Известен препарат Сулодексид или Вессел Дуэ Ф [http://www.vidal.ru/drugs/molecule/1491 - Сулодексид], который в настоящее время является единственным препаратом с доказанным эндотелиальным действием. Он представляет собой естественную смесь гликозаминогликанов, получаемых из слизистых оболочек тонкого кишечника свиньи [US 3936351]: быстродвижущейся гепариноподобной фракции (80%) и дерматан-сульфата (20%). Препарат обладает сильным антитромботическим действием, которое реализуется через: 1) подавление активированного фактора X; 2) усиление синтеза и секреции простациклина (простагладина 12); 3) снижение уровня фибриногена в крови. Фибринолитическое действие сулодексида реализуется через: 1) повышение уровня тканевого активатора плазминогена (ТАП) в крови; 2) снижение содержания в крови ингибитора тканевого активатора плазминогена (ИТАП). Механизм действия сулодексида определяется влиянием обеих фракций. Таким образом, сулодексид эффективен как в целях профилактики тромбообразования в артериях и венах, так и в отношении лизиса уже сформировавшегося тромба.
Сулодексид обладает ангиопротекторным действием, которое реализуется через: 1) восстановление структурной и функциональной целостности клеток эндотелия сосудов; 2) восстановление нормальной плотности отрицательного электрического заряда пор базальной мембраны сосудов. Кроме того, препарат сулодексид оказывает положительное влияние на реологические свойства крови за счет уменьшения вязкости крови. Сулодексид высокоэффективен при диабетической нефропатии. Механизм действия препарата, кроме вышеперечисленных, определяется: уменьшением толщины базальной мембраны вплоть до нормальной; а также уменьшением продукции матрикса за счет уменьшения пролиферации клеток мезангиума. Сулодексид проявляет слабое антикоагуляционное действие за счет ингибирования гепарин кофактора II, которое проявляется при внутривенном введении больших доз препарата и сводится к минимальному при внутримышечном и пероральном применении [Харенберг Дж. Обзор фармакодинамических, фармакокинетических и терапевтических свойств препарата сулодексид; режим доступа http://www.cscrussia.ru/rus/publications/sulodexidl.shtml].
Недостатками сулодексида или Вессел Дуэ Ф являются следующие: 1) он является препаратом животного происхождения с трудоемким, многостадийным хроматографическим процессом получения, эффективность которого зависит от строгого соблюдения рН реакционной среды, 2) имеется дефицит исходного сырья (ткани кишечника свиней), которое к тому же является скоропортящимся; 3) препарат является импортным и дорогостоящим [режим доступа: http://www.pharmindex.ru/vessel_due_f.html]; 4) сулодексид по химическому составу относится к группе биологически активных веществ - глюкозаминогликанов и имеет иной механизм биологического действия в отличие от заявляемого препарата викатулы, относящегося к группе флавоноидов; 5) сулодексид лишь незначительно влияет на имеющиеся при сахарном диабете выраженную гипергликемию, нарушение основных показателей липидного обмена, что требует применения при сахарном диабете дополнительных терапевтических средств [Препараты для профилактики и лечения осложнений сахарного диабета; режим доступа: http://www.aif.ru/health/leksprav/1154205; Медикаментозное лечение пациентов с поражением сосудов при СД; режим доступа: http://diabetic.com.ua/?page_id=260; Колединцев М.Н., Бородовицына О.А. Современные возможности медикаментозного лечения диабетической ретинопатии //РМЖ; режим доступа: http://www.rmj.ru/articles_8135.htm].
Поскольку заявляемый объект Викатула состоит из 7-биозидов диосметина, то в качестве прототипов нами выбраны гесперидин (гесперидин-7-О-рутинозид) и диосмин (диосметин-7-О-рутинозид). Смеси диосмина и гесперидина широко используются во всех известных лекарственных препаратах, регулирующих процессы венозного кровообращения (Детралекс, Дафлон, Диосмин, Диовенор, Вазокет, Флебодия и др.) [Регистр лекарственных средств России - М.: "РЛС", 2000; Controlled stadies of Daflon 500 mg in chronic venous in sufficiency/Geroulakos G., Nicolaides A. // Antilogy. - 1994. - №45. - P. 549-553]. Основным активным действующим началом этих препаратов является диосмин.
Диосмин оказывает венопротекторное действие, уменьшает проницаемость венозных сосудов, повышает тонус их стенок (в том числе за счет более длительного периода сокращения гладкомышечных волокон венозных стенок в ответ на действие норадреналина). Улучшая отток крови из сосудистого русла нижних конечностей, диосмин снижает в них гидростатическое давление и препятствует развитию застоя крови, а также тормозит патологическую активацию и адгезию лейкоцитов в капиллярах, понижает вязкость крови. Он также: оказывает противовоспалительное действие вследствие торможения выделения противовоспалительных медиаторов (простагландинов, свободных радикалов), улучшает лимфоотток, повышает онкотическое давление лимфы [Антигипоксические эффекты диосмина и гесперидина / В.В. Гончарова, О.М. Шаренко, А.В. Карочинский, Г.С. Гаранян и др. // Человек и лекарство: Тез. докл. 13 Рос. нац. конгр. 3-7 апр. 2006 г. - М.: «ООФ и здоровья человека», 2006. - С.779; Моисеев, СВ. Хроническая венозная недостаточность - эффективны ли венотропные средства? / СВ. Моисеев // Клиническая фармакология и терапия. - 1998, №7. - С. 75-79; Регистр лекарственных средств России - М.: "РЛС", 2000].
Процесс получения гесперидина и диосмина сложен и многостадиен. На первом этапе из кожуры плодов цитрусовых, мандаринов или апельсинов, щелочной экстракцией получают неочищенный гесперидин. Затем его окисляют йодом в щелочной среде с последующей нейтрализацией кислотой до выделения целевого продукта, диосмина, в виде осадка [Хачава М.Р. Химико-технологическое обоснование создания флавоноидных препаратов с использованием отходов цитрусовых: Автореф. канд. дис. - 2001. - 145 с.]. При этом неочищенный целевой продукт содержит различные примеси: исходный продукт гесперидин (до 5%), сопутствующие ему, структурно близкие к гесперидину изорхойфолин или линарин, в незначительных количествах агликон диосметин, образующийся по ходу реакции за счет гидролиза исходного биозида, а также йод и органические растворители в свободном или связанном состоянии.
Недостатками этих композиций являются: 1) дефицит сырья для получения гесперидина - кожуры цитрусовых культур, мандаринов и апельсинов, которые в естественных природных условиях Российской Федерации не произрастают; 2) диосмин - продукт окисления гесперидина, поэтому также отсутствует естественная природная база сырья для его получения; 3) процесс изготовления диосмина трудоемок и многостадиен; 4) очистка диосмина требует дополнительных технологических стадий, что удорожает производство; 5) известные композиции, содержащие диосмин, не оказывают направленного комплексного воздействия на весь организм в целом с целью обеспечения активации процессов саморегуляции и самовосстановления [RU 2481353].
Целью данного изобретения является разработка способов получения средства из растительного сырья - травы горошка обрубленного (Vicia truncatula Fish. ex Bieb.), улучшающего вазодиалатирующую, антитромбическую, противовоспалительную функции эндотелия при сахарном диабете и характеризующихся более простым способом получения. Ресурсная база лекарственного сырья, травы горошка обрубленного, достаточна, т.к она широко распространена в природе, легко заготавливается и обрабатывается [Флора СССР / Под общей ред. В.Л. Комарова: В 30 т. - М. - Л.: Изд-во АН СССР, 1948 (1967). - Т. XIII. - С. 406-439; Флора Северного Кавказа и вопросы ее истории / Под ред. А.И. Галушко. - Ставрополь, 1976. - 202 с.]. Схема получения сухого экстракта, композиции Викатула, проста, так как предусматривает только экстрагирование сырья водно-спиртовыми растворами с последующим удалением экстрагента выпариванием и сушку целевого продукта.
Кроме того, по выраженности эндотелиопротективного действия Vicatula сопоставима с сулодексидом, но более эффективно снижает уровень глюкозы и индекс атерогенности, а также оказывает гораздо более выраженное противовоспалительное действие по сравнению с сулодексидом и диосмином.
Горошек обрубленный содержит структурные аналоги диосмина (7-O-рутинозид диосмина), отличающиеся от последнего только природой сахарных остатков в биозе: у одного из них биоза состоит из остатков глюкозы и арабинозы, а у другого - глюкозы и ксилозы. Следует отметить, что с агликоном в обоих случаях биоза связана через остаток глюкозы [Андреева, О.А. Фенольные соединения некоторых видов рода Вика и их встречный синтез: Автореф. дис. … канд. хим. наук / О.А. Андреева. - Ташкент, 1986. - 19 с.]. В отличие от диосмина оба биозида значительно лучше растворяются в водном этаноле [Сумма гликозидов диосметина из вики обрубленной: выделение и изучение биологического действия / О.А. Андреева, Н.И. Ивашев, И.И. Озимина, Г.В. Масликова // Хим.-фармац. журн. - 1998. - Т. 32, №11. - С. 28-30].
Помимо флавононов, в сухом экстракте вики обрубленной обнаружены в следовых количествах флавонолы, свободные аминокислоты (аланин, аспарагин, аспарагиновая и глутаминовые кислоты, гистидин, глицин, лизин, пролин, серии, треонин, триптофан, фенилаланин) [Аминокислотный состав вики четырехсеменной (в. обрубленной) (Vicia tetrasperma (1.) Schred.) / О.А. Андреева, И.П. Кодониди, О.М. Шаренко // Регион, конф. по фармации, фармакологии и подготовке кадров (56; 2001; Пятигорск): Материалы… - Пятигорск, 2001. - С. 10-11; Шаренко, О.М. Аминокислотный и микроэлементый анализ горошка изменчивого (Vicia tenuifolia Roth.) и горошка обрубленного (Vicia truncatula Fich. ex Bibl.) / О.М. Шаренко // Разработка, исследование и маркетинг новой фармацевтической продукции: Сб. науч. тр. - Пятигорск, 2004. - С. 63-64; Химико-фармакологическое изучение дикорастущей флоры и отходов фармацевтического производства / А.Ю. Пархоменко, О.М. Шаренко, Л.А. Зинченко, А.Ю. Терехов и др. // Человек и лекарство: Тез. докл. 10 Рос. нац. конгр. 7-11 апр. 2003 г. - М.: «ООФ и здоровья человека», 2003. - С. 645], а также моносахариды глюкоза и мальтоза. Полиолы представлены инозитом, дульцитом и маннитом. Установлено также наличие аскорбиновой кислоты - 0,07% [О биологически активных веществах некоторых представителей рода Vicia /Э.Т. Оганесян, Е.Г. Доркина, О.А. Андреева, О.М. Шаренко и др. // Современные наукоемкие технологии: Сб. науч. тр. - М., 2004. - №6. - С. 108-109]. Качественный и количественный состав макро- и микроэлементов сухого экстракта вики обрубленной представлен 22 элементами, среди которых преобладающими по содержанию (в % масс) являются калий и кальций (20%); отмечено высокое содержание фосфора (1%) и магния (3%). Найдены также важнейшие эссенциальные микроэлементы: Fe, K, Са, Mg, Mn, Cu, Mo, Na, Р, Cr, Zn; условно эссенциальные: Ва, Ni.
Изобретение позволит восполнить дефицит эндотелиопротекторных средств растительного происхождения российского производства на фармацевтическом рынке.
Для достижения указанного технического результата фармацевтическая композиция эндотелиопротекторного действия в форме сиропа, суспензии, гранул, таблеток, капсул, микрокапсул, суппозиториев, мази или геля, содержит в качестве действующей субстанции сухой экстракт горошка обрубленного, при соотношении компонентов в г на 1 г лекарственной формы:
- для сиропа, суспензии, гранул, таблеток, капсул, микрокапсул, суппозиториев: сухой экстракт горошка обрубленного от 0,020 г до 0,900 г, консистентнообразующая основа - остальное;
- для мазей, геля: сухой экстракт горошка обрубленного от 0,010 г до 0,100 г, консистентнообразующая основа - остальное.
Настоящее изобретение поясняется конкретными примерами исполнения, которые, однако, не являются единственно возможными, но наглядно демонстрируют возможность достижения назначения и технического результата.
Vicatula в виде сухого экстракта представляет собой мелкодисперсный, водорастворимый порошок желто-коричневого цвета, с характерным запахом, горьким вкусом. Она может служить основой для приготовления лекарственных средств, как для внутреннего, так и наружного применения. Vicatula может быть использована для получения капсул, микрокапсул, таблеток, гранул. Для производства мазей, гелей, суппозиториев Vicatula может быть смешана с основами для приготовления мазей, гелей, суппозиториев. Она хорошо смешивается с сиропами, приготовленными на основе сахарозаменителей. Таким образом, Vicatula может быть использована в смесях с фармацевтически пригодными наполнителями, обычными в составе лекарственных средств или пищевых добавок.
Дополнительным объектом по настоящему изобретению является фитокомплекс Vicatula, предпочтительно в форме сухого экстракта, полученный из травы горошка обрубленного согласно способу по изобретению.
Авторы настоящего изобретения в дополнение к вышеизложенному, что также является составной частью объекта изобретения, установили, что фитокомплекс можно использовать в клинической практике и/или в качестве пищевой добавки, поскольку он содержит достаточное количество как питательных веществ (аминокислот, витаминов, сахаров и т.д.), так и антиоксидантов (в частности, флавоноидов), которые позволяют применять его в качестве антидислипидемического и антиатерогенного средства. Объектами по настоящему изобретению также являются композиции сухого экстракта горошка обрубленного, которые, в зависимости от назначения, содержат Викатулу преимущественно в виде сухого экстракта, совместно с добавками и/или наполнителями, широко применяемыми в фармацевтической промышленности.
Композиции можно применять как в жидких, так и в других формах - лиофилизат, гранулы, порошок, таблетки, сиропы. Было показано, что фитокомплекс оказывает свое лечебное воздействие после системного введения экспериментальным животным и проявляет вазодиалатирующую, антитромбическую, противовоспалительную функции. Предлагаются дозировки в диапазоне от 20 до 900 мг, преимущественно 100 мг/кг массы тела.
Дополнительными объектами по настоящему изобретению являются лечебные пищевые добавки с вазодиалатирующей, антитромбической, противовоспалительной функциями для защиты сосудов.
Заявляемый объект по настоящему изобретению представляет собой продукт натурального происхождения для пищевой добавки или фармацевтического препарата, демонстрирующего способность к вазодиалатирующей, антитромбической, противовоспалительной функциями для защиты сосудов. Викатула повышает антитромботическую функцию эндотелия и положительно влияет на сосудисто-тромбоцитарный (антиагрегантное действие, антитромботическое за счет снижения агрегации тромбоцитов, увеличении времени тромбообразования, снижении уровня фактора Виллебранда) и коагуляционный гемостаз (увеличение активированного частичного тромбопластинового времени (АЧТВ), протромбинового, тромбинового времени, снижение уровня фибриногена), снижает вязкость крови при различных скоростях сдвига. Также он оказывает противовоспалительное действие (снижает уровень С-реактивного белка, уменьшает морфологические признаки воспаления), антипролиферативное (уменьшает соотношение интима/медиа, пролиферацию и проницаемость сосудистой стенки), восстанавливает структуру эндотелиоцитов (увеличивает ядерно-цитоплазматическое отношение эндотелиоцитов (ЯЦО) и размер ядер) и уменьшает их десквамацию, некроз.
Кроме того, при изучении эффектов Викатулы в экспериментах на животных с целью доказательства отсутствия токсических эффектов было установлено полное сохранение в пределах нормы основных биохимических показателей крови (общий анализ крови, уровень печеночной трансаминазы, азотемия и гиперкреатинемия). Эти данные были подтверждены микроскопией аутопсийного материала получавших лечение животных, выявившей отсутствие жировой дистрофии или некротических явлений в печени и почках. Кроме того, патогистологическое исследование ткани мозга и периферических нервов подтвердило отсутствие индуцированных аксонопатий или миелинопатий. Изучение токсичности фитокомплекса показало следующий результат: «токсикологический анализ не выявил факторов токсичности согласно действующей нормативной базе». В частности, было также установлено отсутствие патологических концентраций или, по меньшей мере, значений, выходящих за пределы нормальных показателей, в отношении тяжелых металлов, пестицидов, полихлорированных дифенилов, нитритов и нитратов, красителей, плесени, наряду с отсутствием охранотоксинов, бактериальных эндотоксинов, анаэробных возбудителей и плесневых грибов. При исследовании органов морских свинок (печень, почки) после перорального введения количества вещества, равного 100 мг/кг массы тела/день, не обнаружили никакого токсического эффекта.
Пример 1. Исходное сырье - высушенную траву вики обрубленной, разделенное на три порции по 10 г, экстрагируют спиртом этиловым 40% (колбы I, II, III). Сначала тремя порциями экстрагента, спирта этилового 40%, последовательно, три раза экстрагируют сырье в колбе I. Соотношение фаз сырье-экстрагент: 1:40, 1:35, 1:30, соответственно. В процессе экстрагирования колбы подсоединяют к обратному холодильнику и смесь настаивают на кипящей водяной бане 30 мин. Получают извлечение 1.1, 1.2, 1.3.
Затем извлечениями 1.1, 1.2, 1.3, полученными в результате экстрагирования сырья в колбе I, последовательно, три раза экстрагируют сырье в колбе II. Соотношение фаз сырье-экстрагент: 1:35, 1:30, 1:25, соответственно. В процессе экстрагирования колбы подсоединяют к обратному холодильнику и смесь настаивают на кипящей водяной бане 30 мин. Получают извлечения 2.1, 2.2, 2.3.
Извлечениями, полученными в результате экстрагирования сырья в колбе II, 2.1, 2.2, 2.3, последовательно, три раза экстрагируют сырье в колбе III. Соотношение фаз сырье-экстрагент: 1:30, 1:25, 1:25, соответственно. В процессе экстрагирования колбы подсоединяют к обратному холодильнику и смесь настаивают на кипящей водяной бане 30 мин. Получают извлечения 3.1, 3.2,3.3.
Все три порции готового жидкого извлечения 3.1, 3.2, 3.3 смешивают и получают 750 мл. Выход флавоноидов - 64%. Жидкое извлечение сгущают при температуре 40°С и разрежении 0,4 ат. Извлечение досушивают при температуре 40-50°С и разрежении 0,2-0.3 ат в вакуум-сушильном шкафу до остаточной влажности не более 5%.
Пример 2. То же, что и в примере 1. Экстрагент 30% этиловый спирт. Выход флавоноидов - 32%.
Пример 3. То же, что и в примере 1. Экстрагент 50% этиловый спирт. Выход флавоноидов - 42%.
Пример 4. То же, что и в примере 1. Экстрагент 60% этиловый спирт. Выход флавоноидов - 45%.
Пример 5. То же, что и в примере 1. Экстрагент 70% этиловый спирт. Выход флавоноидов - 83%.
Пример 6. То же, что и в примере 1. Экстрагент 80% этиловый спирт. Выход флавоноидов - 45%.
Пример 7. То же, что и в примере 1. Экстрагент 90% этиловый спирт. Выход флавоноидов - 39%.
Пример 8. То же, что и в примере 1. Экстрагент 96% этиловый спирт. Выход флавоноидов - 25%.
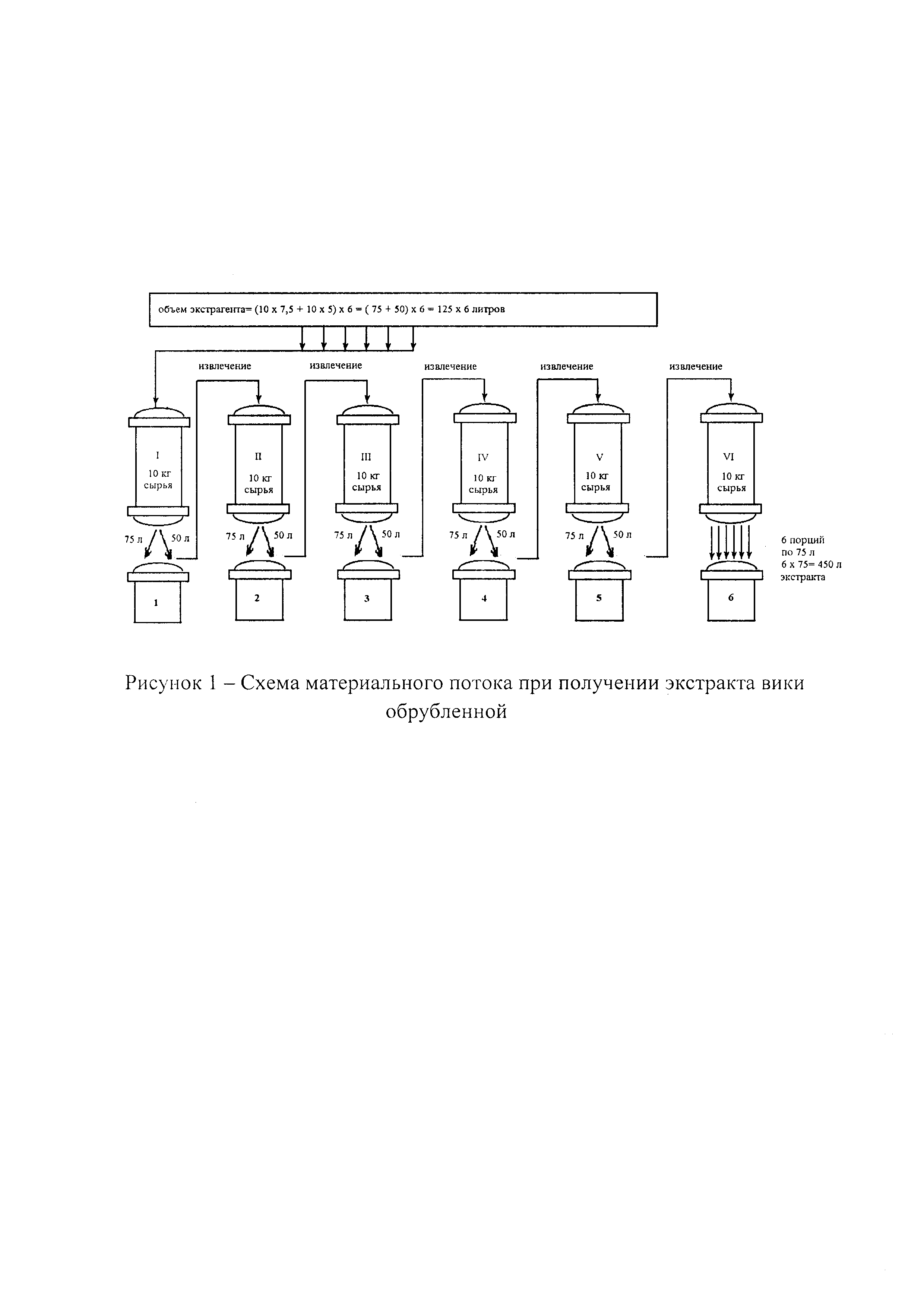
Пример 9. Приготовление извлечения из травы вики обрубленной проводят в шести самозагружающихся перколяторах (I-VI), на ложное дно которых помещают двойной слой марли, при температуре 18-20°С. Извлечения собирают в сборники 1-6. В шесть перколяторов загружают измельченную траву до 7 мм вики обрубленной в равных количествах по 10 кг (всего 60 кг сырья). Технологический процесс получения извлечения в батарее из 6 диффузоров приводится по дням. Общее время экстрагирования составляет 144 часа (6 дней ⋅ (8 часов + 16 часов) = 144 часа). Экстрагент 30% спирт этиловый. Соотношение фаз сырье - экстрагент составляет 1:7,5, коэффициент поглощения сырья 5. Схема материального потока при получении экстракта вики обрубленной представлена на рисунке 1.
День первый. В работу вводят диффузоры I и II. В диффузор I вводят первую дозу экстрагента - 125 л настаивают 8 часов. В конце смены открывают кран и сливают извлечение в сборник 1. В диффузор I вводят вторую дозу экстрагента - 125 л и продолжают сливать жидкую фазу из диффузора I до ее накопления в сборнике 1 объемом, равным 125 л. После этого кран диффузора I закрывают, а извлечение из сборника 1 перекачивают в диффузор II. Диффузоры I и II оставляют настаиваться до начала 1-й смены следующего дня (около 16 часов).
День второй. В работу вводят диффузоры III и IV. В начале смены открывают краны диффузоров I и II и проводят слив извлечения. В диффузор I вводят третью дозу экстрагента и продолжают слив извлечения до его накопления в сборнике 1 объемом 125 л, после чего кран диффузора 1 закрывают. Извлечение из сборника 1 перекачивают в диффузор II и накапливают в сборнике 2 извлечения объемом 125 л. После чего закрывают кран диффузора II. Извлечение из сборника 2 перекачивают в диффузор III и оставляют до конца смены. Через 8 часов открывают краны диффузоров I-III и проводят слив извлечений. В диффузор I вводят четвертую дозу экстрагента и после накопления в сборнике 1 жидкой фазы объемом 125 л, кран диффузора I закрывают. Извлечение из сборника 1 перекачивают в диффузор II. Слив извлечения из сборника 2 объемом 125 л перекачивают в диффузор III, а слив извлечения из сборника 3 объемом 125 л перекачивают в диффузор IV. Диффузоры I-IV оставляют настаиваться на 16 часов.
День третий. В работу вводят диффузоры V и VI. Через 16 часов открывают краны диффузоров I-IV и производят слив извлечений. В диффузор I вводят пятую дозу экстрагента. Слив из сборника 1 объемом 125 л перекачивают в диффузор II, слив из сборника 2 перекачивают в диффузор III, слив из сборника 3 перекачивают в диффузор IV объемом 125 л перекачивают в диффузор V. Диффузоры I-V оставляют настаиваться до конца смены (около 8 часов). Через 8 часов открывают краны диффузоров I-V и проводят слив извлечений. В диффузор I вводят шестую дозу экстрагента. Извлечение из сборника 1 объемом 125 л перекачивают в диффузор II, извлечение из сборника 2 перекачивают в диффузор III объемом 125 л, извлечение из сборника 3 объемом 125 л перекачивают в диффузор IV, извлечение из сборника 4 объемом 125 л перекачивают в диффузор V. Извлечение из сборника 5 объемом 125 л перекачивают в диффузор VI. Диффузоры I - VI оставляют настаиваться 16 часов.
День четвертый. Производят съем 1 и 2 порции экстракта, выводят из работы диффузоры I и II. В начале 1-й смены открывают краны диффузоров I-VI и производят слив извлечений. Объем каждого извлечения должен составить 75 л. Извлечение из сборника VI объемом 75 л перекачивают в отстойник. Диффузор I выводят из работы и ставят на отгонку спирта из отработанного сырья. Извлечения из сборников 1-5, объемом каждое 75 л, перекачивают на очередную ступень экстракции в диффузоры 2-6 и оставляют настаиваться примерно на 8 часов. В конце смены открывают краны диффузоров II-VI и производят слив извлечений. Извлечение из сборника 6 перекачивают в отстойник. Диффузор II выводят из работы и ставят на отгонку спирта. Извлечения из сборников 2-5 перекачивают на очередную ступень экстракции в диффузоры III-VI и оставляют настаиваться на 16 часов до начала 1-й смены следующего дня.
День пятый. Производят съем 3 и 4 порций экстракта, выводит из работы диффузоры III и IV. В начале 1-й смены открывают краны диффузоров III-VI и производят слив извлечений. Извлечение из сборника 6 объемом 75 л перекачивают в отстойник. Диффузор III выводят из работы и ставят на отгонку спирта. Извлечение из сборников 3-5 объемом каждое 75 л перекачивают на очередную ступень экстракции в диффузоры IV-VI и оставляют настаиваться на 8 часов.
Примерно через 8 часов открывают краны диффузоров IV-VI и производят слив. Извлечение из сборника 6 объемом 75 л перекачивают в отстойник. Диффузор IV выводят из работы и ставят на отгонку спирта. Извлечения из сборников 4-5 объемом каждое 75 л перекачивают на очередную ступень экстракции в диффузоры V и VI и оставляют настаиваться на 16 часов.
День шестой. Производят съем V и VI порции экстракта, выводят из работы диффузоры V и VI. Через 16 часов открывают краны диффузоров V и VI и производят слив извлечений. Извлечение из сборника 6 объемом 75 л перекачивают в отстойник. Диффузор V выводят из работы и ставят на отгонку спирта. Извлечение из сборника 5 объемом 75 л перекачивают в диффузор VI и оставляют настаиваться до конца смены.
Через 8 часов открывают кран диффузора VI и проводят слив извлечения. Извлечение объемом 75 л из сборника 6 перекачивают в отстойник. Диффузор VI ставят на отгонку спирта. Процесс экстракции завершен.
Всего в батарее из шести диффузоров получено 6 порций извлечений - общий объем экстракта должен составить 6×75=450 л. Все шесть порций готового жидкого извлечения смешивают и получают - 650 л. Выход флавоноидов - 30%. Жидкое извлечение сгущают при температуре 40°С и разрежении 0,4 ат. Извлечение досушивают при температуре 40-50°С и разрежении 0,2-0,3 ат в вакуум-сушильном шкафу до остаточной влажности не более 5%.
Пример 10. То же, что и в примере 9. Экстрагент 40% этиловый спирт. Выход флавоноидов - 59%.
Пример 11. То же, что и в примере 9. Экстрагент 50% этиловый спирт. Выход флавоноидов - 40%.
Пример 12. То же, что и в примере 9. Экстрагент 60% этиловый спирт. Выход флавоноидов - 45%.
Пример 13. То же, что и в примере 9. Экстрагент 70% этиловый спирт. Выход флавоноидов - 89%.
Пример 14. То же, что и в примере 9. Экстрагент 80% этиловый спирт. Выход флавоноидов - 43%.
Пример 15. То же, что и в примере 9. Экстрагент 90% этиловый спирт. Выход флавоноидов - 36%.
Пример 16. То же, что и в примере 9. Экстрагент 96% этиловый спирт. Выход флавоноидов - 24%.
Пример 17. Получение таблетированной формы. Сухой экстракт горошка обрубленного смешивают с приемлемой для этой формы консистентнообразующей основой и таблетируют смесь известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 18. Получение гранулированной формы. Сухой экстракт горошка обрубленного смешивают с приемлемой для этой формы консистентнообразующей основой и гранулируют смесь известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 19. Получение капсулированной формы. Сухой экстракт горошка обрубленного смешивают с наполнителями, приемлемыми для этой формы и капсулируют смесь известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 20. Получение микрокапсулированной формы. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы, и микрокапсулируют смесь известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 21. Получение сиропа. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы и приготавливают сироп на основе сахарозаменителей известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 22. Получение суспензии. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы и приготавливают суспензию известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 23. Получение суппозиториев. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы, и приготавливают суппозитории известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,020 до 0,900 г;
- консистентнообразующая основа до 1 г.
Пример 24. Получение мазей. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы, и приготавливают мази известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,010 до 0,100 г;
- консистентнообразующая основа до 1 г.
Пример 25. Получение гелей. Сухой экстракт горошка обрубленного смешивают с консистентнообразующими веществами, приемлемыми для этой формы, и приготавливают гели известным способом.
При этом указанные компоненты берут в следующем соотношении компонентов в г на 1 г смеси:
- сухой экстракт горошка обрубленного от 0,010 до 0,100 г;
- консистентнообразующая основа до 1 г.
Исследование композиции было проведено с помощью комплексного морфо-функционального подхода, используемого для оценки эндотелиопротективного действия (ЭПД) веществ после их курсового введения (4 недели), включающего в себя определение вазодилатирующей, антитромботической, противовоспалительной и антипролиферативной функций эндотелия [Методический подход к оценке эндотелиальной дисфункции / И.Н. Тюренков, А.В. Воронков // Экспериментальная и клиническая фармакология. - 2008. - Т. 71, №1. - С. 49-51].
Дополнительно оценивались метаболические эффекты исследуемых соединений (влияние на углеводный и липидный обмены).
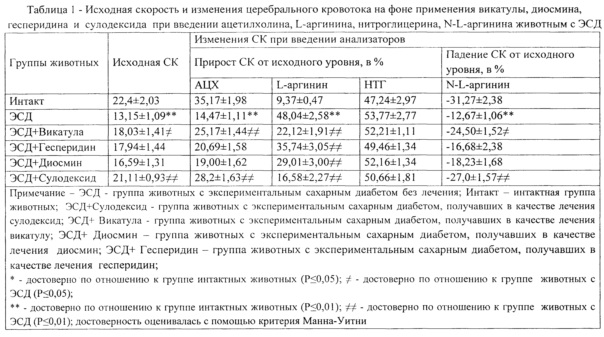
У животных с ЭСД отмечается меньший исходный мозговой кровоток, повышение жесткости (индекс Гослинга) и сопротивления сосудистой стенки (индекса Пурселло) по сравнению с контрольной группой животных, что свидетельствует о нарушении ЭЗВД у животных с ЭСД (таблица 1).
Оценка вазодилатирующей функции эндотелия осуществлялась путем регистрации изменений скорости кровотока (СК) при модификации синтеза эндогенного оксида азота введением ацетилхолина (АЦХ) (0,01 мг/кг), L-аргинина (300 мг/кг), нитро-L-аргинина («Acrosorganics», США) (10 мг/кг). Для оценки эндотелионезависимой вазодилатации (ЭНЗВД) в/в вводили нитроглицерин (НТГ) (МТХ, Москва) (0,007 мг/кг). Для оценки мощности и стабильности NO-синтазной системы был использован метод многократного (10-кратного) введения ацетилхолина (АЦХ) в фиксированной дозе (0,01 мг/кг). СК регистрировали с помощью ультразвукового допплерографа, датчика УЗОП-010-01 (рабочая частота 25МГц, диаметром 0,3 см) и компьютерной программы ММ-Д-KMinimaxDopplerv. 1.7. (Санкт-Петербург, Россия) в теменной области мозга крыс, в проекции среднемозговой артерии [Методический подход к оценке эндотелиальной дисфункции / И.Н. Тюренков, А.В. Воронков // Экспериментальная и клиническая фармакология. - 2008. - Т. 71, №1. - С. 49-51]. Дополнительно проводилась оценка периферического сопротивления (индекса Пурселло) и эластичности мозговых сосудов (индекса Гослинга) [Сравнительная оценка вазодилатирующей функции эндотелия при патологиях различного генезеса / И.Н. Тюренков и соавт.// Региональное кровообращение и микроциркуляция. - 2011. - Т. 10, №4. - С. 87-90; Новая медицинская технология: использование высокочастотной ультразвуковой допплерографии для изучения влияния фармакологических веществ на региональное кровообращение и эндотелиальную функцию / И.Н. Тюренков, А.В. Воронков // уч. изд. - Волгоград, 2010. - 30 с].
Пример 1. При применении композиции Vicatula (Викатула) у животных с ЭСД наблюдается: 1) повышение скорости церебрального кровотока (СК): на фоне введения ацетилхолинана 25,17%±1,44, на фоне введения L-аргинина на 22,12%±1,91; на фоне введения нитроглицерина на 52,21%±1,11 от исходного уровня (таблица 1); 2) падение СК на фоне введения нитро-L-аргинина на 24,5%±1,52 от исходного уровня (таблица 1).
Пример 2. При применении диосмина у животных с ЭСД наблюдается: 1) повышение скорости церебрального кровотока (СК):на фоне введения ацетилхолинана 19,00%±1,62; на фоне введения L-аргинина на 29,01%±3,00; на фоне введения нитроглицерина на 52,16%±1,34 от исходного уровня (таблица 1); 2) падение СК на фоне введения нитро-L-аргинина на 18,23%±1,68 от исходного уровня (таблица 1).
Пример 3. При применении сулодексида у животных с ЭСД наблюдается: 1) повышение скорости церебрального кровотока (СК): на фоне введения ацетилхолина на 28,2%±1,63; на фоне введения L-аргинина на 16,58%±2,27; на фоне введения нитроглицерина на 50,66%±1,81 от исходного уровня.(таблица 1); 2) падение СК на фоне введения нитрон-аргинина на 27,0%±1,57 от исходного уровня (таблица 1).
Пример 4. При применении гесперидина у животных с ЭСД наблюдается: 1) повышение скорости церебрального кровотока (СК): на фоне введения ацетилхолина на 20,69%±1,58; на фоне введения L-аргинина на 35,74%±3,05; на фоне введения нитроглицерина на 49,46±1,34 от исходного уровня (таблица 1); 2) падение СК на фоне введения нитро-L-аргинина на -16,68%±2,38 от исходного уровня (таблица 1).
Пример 5. При применении композиции Vicatula (Викатула) на фоне многократного (10-кратного) введения АЦХ в фиксированной дозе (0,01 мг/кг) у животных с ЭСД наблюдается прирост скорости кровотока на 22% на момент 10-го введения (см. рисунок 2).
Пример 6. При применении диосмина на фоне многократного (10-кратного) введения АЦХ в фиксированной дозе (0,01 мг/кг) у животных с ЭСД наблюдается прирост скорости кровотока на 13% на момент 10-го введения (см. рисунок 2).
Пример 7. При применении сулодексида на фоне многократного (10-кратного) введения АЦХ в фиксированной дозе (0,01 мг/кг) у животных с ЭСД наблюдается прирост скорости кровотока на 26% на момент 10-го введения (см. рисунок 2).
Пример 8. При применении гесперидина на фоне многократного (10-кратного) введения АЦХ в фиксированной дозе (0,01 мг/кг) у животных с ЭСД наблюдается прирост скорости кровотока на 17,5% на момент 10-го введения (см. рисунок 2).
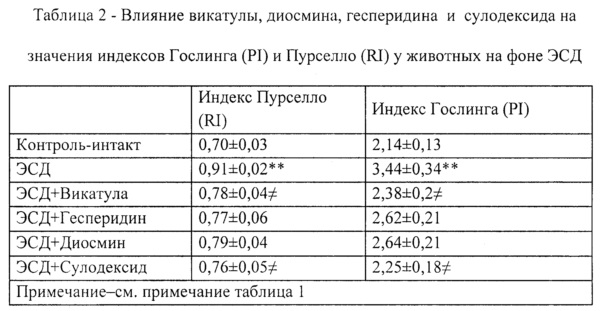
Пример 9. В результате применения композиции Vicatula (Викатула) у животных с ЭСД происходило снижение индекса Пурселло до величины 0,78±0,04 и индекса Гослинга до величины 2,38±0,2 по сравнению с контролем (таблица 2).
Пример 10. В результате применения диосмина у животных с ЭСД происходило снижение индекса Пурселло до величины 0,76±0,05 и индекса Гослинга до величины 2,25±0,18 по сравнению с контролем (таблица 2).
Пример 11. В результате применения сулодексида у животных с ЭСД происходило снижение индекса Пурселло до величины 0,79±0,04 и индекса Гослинга до величины 2,64±0,21 по сравнению с контролем (таблица 2).
Пример 12. В результате применения гесперидина у животных с ЭСД происходило снижение индекса Пурселло до величины 0,77±0,06 и индекса Гослинга до величины 2,62±0,21 по сравнению с контролем (таблица 2).
У животных с ЭСД отмечается выраженное (статистически значимое) повышение агрегации тромбоцитов и снижение тромборезистентности сосудистой стенки. При ЭСД происходит повышение уровня фактора Виллебранда в крови, что также свидетельствует о нарушениях в системе гемостаза.
Оценка антитромботической функции исследуемых соединений осуществлялась с помощью комплексного подхода для оценки как сосудисто-тромбоцитарного, так и плазменного (коагуляционного) гемостаза. Артериальный тромбоз вызывался по методике Angelillo-ScherrerA., 2004.
Показатели вязкости крови изучались на анализаторе крови реологическом АКР-2 (Россия), на двухканальном лазерном анализаторе агрегации тромбоцитов фирмы "Биола" (г.Москва) по методу Born G. (1962) в модификации Габбасова З.А. (1989). Тромбиновое время (ТВ), протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ) и содержание фибриногена определяли хронометрически на анализаторе показателей гемостаза АПТ2-01 "МИНИЛАБ 701" с использованием наборов НПО «Репам» (Россия). Определение фактора Виллебранда проводилось на двухканальном лазерном анализаторе агрегации тромбоцитов "Биола" (наборы "Ренам" для определения фактора Виллебранда).
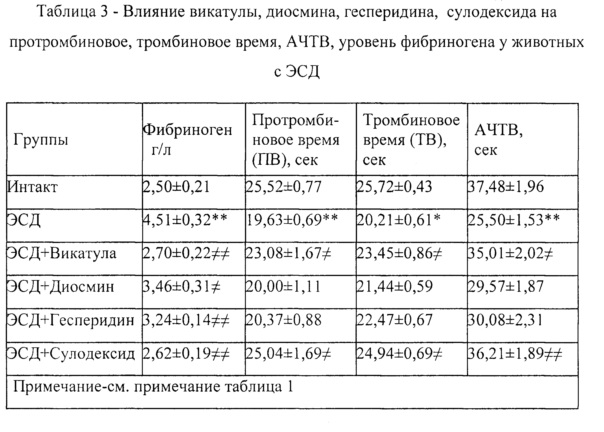
Пример 13. При применении композиции Vicatula (Викатула) у животных с ЭСД концентрация фибриногена, протромбиновое время (ПВ), тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ) составили: 2,7±0,22 г/л, 23,08±1,67 сек, 23,45±0,86 сек, 35,01±2,02 сек, соответственно (см. таблица 3).
Пример 14. При применении диосмина у животных с ЭСД концентрация фибриногена, протромбиновое время (ПВ), тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ) составили: 3,46±0,31 г/л, 20,0±1,11 сек, 21,44±0,59 сек, 29,57±1,87 сек, соответственно (см. таблица 3).
Пример 15. При применении сулодексида у животных с ЭСД концентрация фибриногена, протромбиновое время (ПВ), тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ) составили: 2,62±0,19 г/л, 25,04±1,69 сек, 24,94±0,69 сек, 36,21±1,89 сек, соответственно (см. таблица 3).
Пример 16. При применении гесперидина у животных с ЭСД концентрация фибриногена, протромбиновое время (ПВ), тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ) составили: 3,24±0,14 г/л, 20,37±0,88 сек, 22,47±0,67 сек, 30,08±2,31 сек, соответственно (см. таблица 3).
Пример 17. При курсовом применении композиции Vicatula (Викатула) у животных с ЭСД фактор Виллебранда снижался до 98% (см. рисунок 3).
Пример 18. При курсовом применении диосмина у животных с ЭСД фактор Виллебранда снижался до 125% (см. рисунок 3).
Пример 19. При курсовом применении сулодексида у животных с ЭСД фактор Виллебранда снижался до 80% (см. рисунок 3).
Пример 20. При курсовом применении гесперидина у животных с ЭСД фактор Виллебранда снижался до 120% (см. рисунок 3).
Пример 21. При курсовом применении композиции Vicatula (Викатула) у животных с ЭСД наблюдалось улучшение показателей АДФ-индуцированной агрегации тромбоцитов (рисунок 4). Индекс агрегации тромбоцитов составил 11 усл. ед., индекс дезагрегации тромбоцитов составил 0,68 усл. ед. Пример 22. При курсовом применении диосмина у животных с ЭСД наблюдалось улучшение показателей АДФ-индуцированной агрегации тромбоцитов (рисунок 4). Индекс агрегации тромбоцитов составил 13 усл. ед., индекс дезагрегации тромбоцитов составил 0,5 усл. ед.
Пример 23. При курсовом применении сулодексида у животных с ЭСД наблюдалось улучшение показателей АДФ-индуцированной агрегации тромбоцитов (рисунок 4). Индекс агрегации тромбоцитов составил 10 усл. ед., индекс дезагрегации тромбоцитов составил 0,7 усл. ед.
Пример 24. При курсовом применении гесперидина у животных с ЭСД наблюдалось улучшение показателей АДФ-индуцированной агрегации тромбоцитов (рисунок 4). Индекс агрегации тромбоцитов составил 14 усл. ед., индекс дезагрегации тромбоцитов составил 0,6 усл. ед.
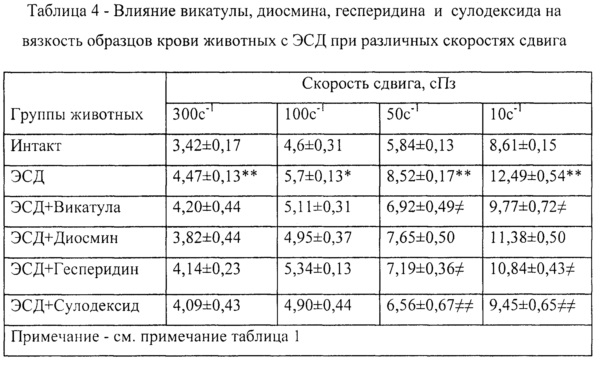
Пример 25. При курсовом применении композиция Vicatula (Викатула) вызывала снижение вязкости образцов крови животных с ЭСД при различных скоростях сдвига в интервале 300 с-1 - 10 с-1 от 4,20±0,44 сПз до 9,77±0,72 сПз, соответственно (таблица 4).
Пример 26. При курсовом применении диосмин вызывал снижение вязкости образцов крови животных с ЭСД при различных скоростях сдвига в интервале 300 с-1 - 10 с-1 от 3,82±0,44 сПз до 11,38±0,50 сПз, соответственно (таблица 4).
Пример 27. При курсовом применении сулодексид вызывал снижение вязкости образцов крови животных с ЭСД при различных скоростях сдвига в интервале 300 с-1 - 10 с-1 от 4,09±0,43 сПз до 9,45±0,65 сПз, соответственно (таблица 4).
Пример 28. При курсовом применении гесперидина вызывал снижение вязкости образцов крови животных с ЭСД при различных скоростях сдвига в интервале 300 с-1 - 10 с-1 от 4,14±0,23 сПз до 10,84±0,43 сПз, соответственно (таблица 4).
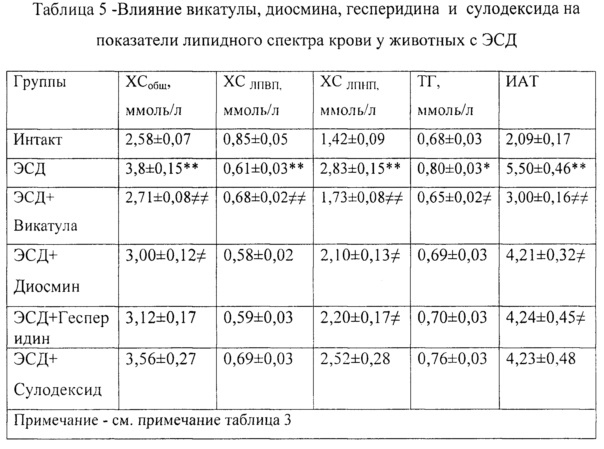
ЭСД приводит к нарушению основных показателей липидного обмена, что проявляется в повышении индекса атерогенности (ИАТ), уровней общего холестерина (ХСобщ), триглицеридов (ТГ) и липопротеидов низкой плотности ХСЛПНП, снижении уровня липопротеидов высокой плотности ХСЛПвп.
Оценка липидного профиля (ХСобщ, ХСЛПВП, ХСЛПНП, ТГ) осуществлялась с использованием ферментативных колориметрических тестов "Ольвекс Диагностикум", значение концентрации ХСЛПнп вычисляли по формуле Фридвальда (1972), индекс атерогенности (ИАТ) по А.Н. Климову (1999).
Пример 29. При курсовом применении композиция Vicatula (Викатула) улучшала показатели липидного спектра крови у животных с ЭСД: ХСобщ, - 2,71±0,08 ммоль/л, ХСЛПВП - 0,68±0,02 ммоль/л, ХСЛПНП - 1,73±0,08 ммоль/л, ТГ - 0,65±0,02 ммоль/л, ИАТ - 3,00±0,16 (таблица 5).
Пример 30. При курсовом применении диосмин улучшал показатели липидного спектра крови у животных с ЭСД: ХСобщ, - 3,00±0,12 ммоль/л, ХСЛПВП - 0,58±0,02 ммоль/л, ХСЛПНП - 2,10±0,13 ммоль/л, ТГ - 0,69±0,03 ммоль/л, ИАТ - 4,21±0,32 (таблица 5).
Пример 31. При курсовом применении сулодексид практически не улучшал показатели липидного спектра крови у животных с ЭСД: ХСобщ, - 3,56±0,27 ммоль/л, ХС лпвп - 0,69±0,03 ммоль/л, ХСЛПНП - 2,52±0,28 ммоль/л, ТГ - 0,76±0,03 ммоль/л, ИАТ - 4,23±0,48 (таблица 5).
Пример 32. При курсовом применении гесперидин улучшал показатели липидного спектра крови у животных с ЭСД: ХСобщ, - 3,12±0,17 ммоль/л, ХСЛПВП - 0,59±0,03 ммоль/л, ХСЛПНП - 2,2±0,17 ммоль/л, ТГ - 0,70±0,03 ммоль/л, ИАТ - 4,24±0,45 (таблица 5).
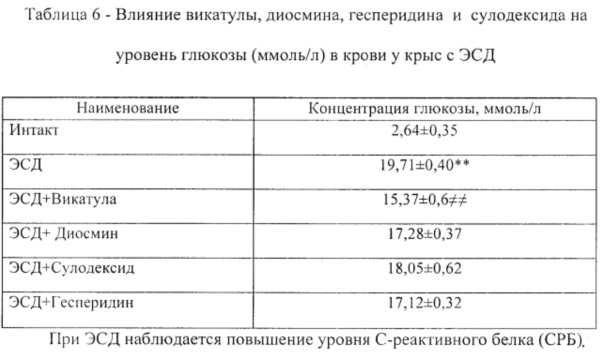
ЭСД приводит к выраженной гипергликемии. Уровень гликемии определялся в плазме крови крыс глюкозооксидантным способом с использованием набора «Глюкоза-ФКД» (Россия) [Инструкция на Глюкозу ФКД - режим доступа: http://www.fl-cd.ru/instruktsiya-na-glyukozu-fkd].
Пример 33. При курсовом применении композиция Vicatula (Викатула) снижала уровень глюкозы (ммоль/л) в крови у крыс с ЭСД до 15,37±0,6 ммоль/л (таблица 6).
Пример 34. При курсовом применении диосмин снижал уровень глюкозы (ммоль/л) в крови у крыс с ЭСД до 17,28±0,37 ммоль/л (таблица 6).
Пример 35. При курсовом применении сулодексид практически не снижал уровень глюкозы (ммоль/л) в крови у крыс с ЭСД (таблица 6).
Пример 36. При курсовом применении гесперидин снижал уровень глюкозы (ммоль/л) в крови у крыс с ЭСД (таблица 6).
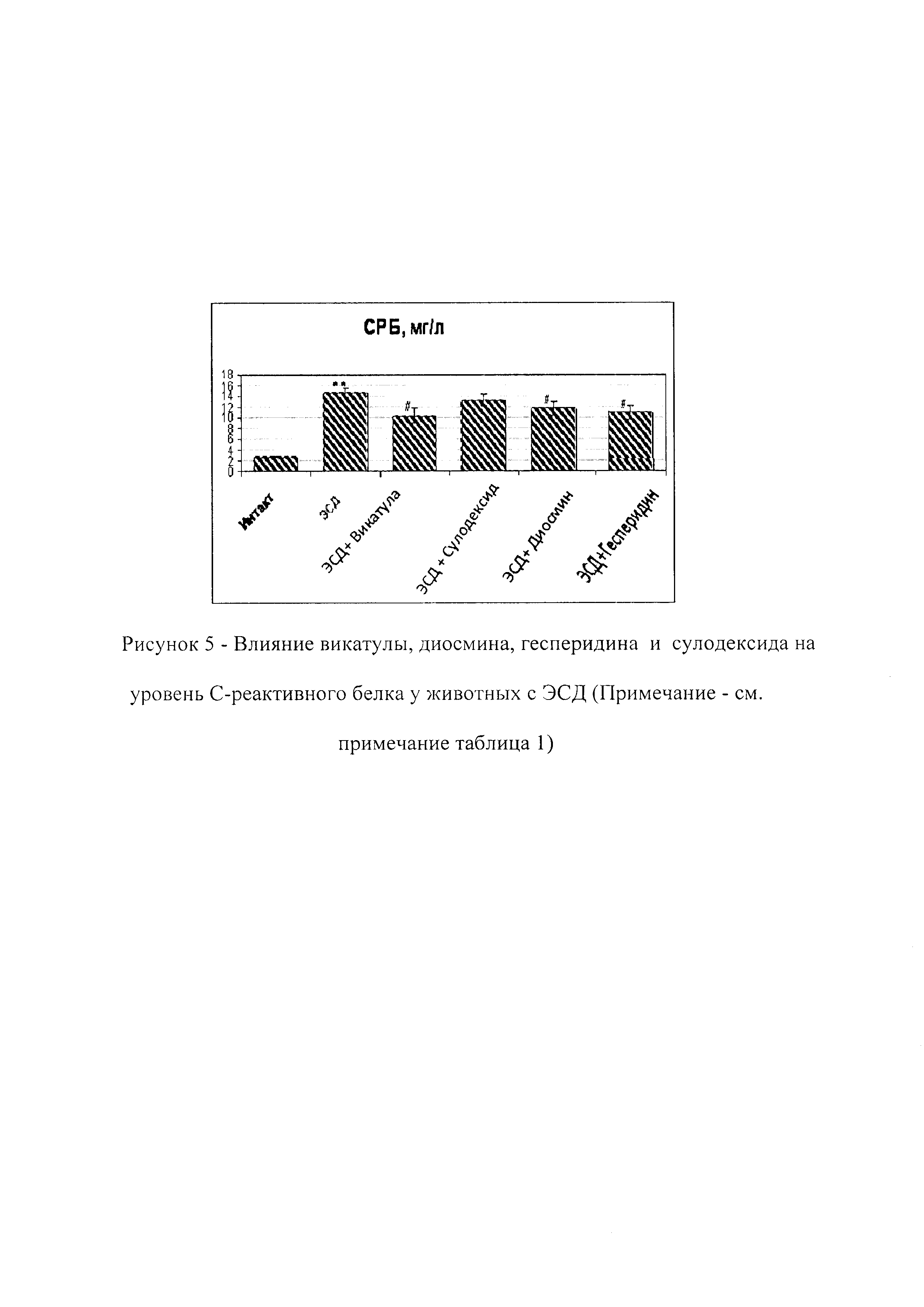
При ЭСД наблюдается повышение уровня С-реактивного белка (СРБ) в плазме по сравнению с интактной группой, что свидетельствует о повышении противовоспалительного потенциала эндотелия при ЭСД. Противовоспалительная функция эндотелия оценивалась по уровню СРБ с помощью набора реагентов для качественного и полуколичественного определения СРБ в сыворотке крови методом латекс-агглютинации ("Ольвекс Диагностикум").
Пример 30. При курсовом применении композиция Vicatula (Викатула) снижала уровень СРБ в крови у крыс с ЭСД до 10 мг/л (рисунок 5).
Пример 31. При курсовом применении диосмин снижал уровень СРБ в крови у крыс с ЭСД до 12 мг/л (рисунок 5).
Пример 32. При курсовом применении сулодексид уровень СРБ в крови у крыс с ЭСД до 13 мг/л (рисунок 5).
ЭСД приводит к морфологически подтвержденным признакам нарушений в сосудах головного мозга, расцененных нами как признаки эндотелиальной дисфункции. Под влиянием викатулы было выявлено снижение признаков воспаления (снижение проницаемости, инфильтрации сосудистой стенки, отека, плазморрагии, уровня СРБ), повышенной тромбогенности (стаза, тромбоза), пролиферации (снижение соотношения комплекса интима/медиа), десквамации эндотелиальных клеток и нарушения их структуры.