Результат интеллектуальной деятельности: Способ получения рН-чувствительных разветвленных узлов ДНК-наноконструкций
Вид РИД
Изобретение
Изобретение относится к области наноконструирования, биоорганической химии, фармакологии и молекулярной биологии. Оно может быть использовано для получения новых систем доставки терапевтических и терагностических средств, для создания диагностикумов, рН-чувствительных биогелей, 3D элементов биоэлектроники.
Уровень технического состояния
Известно, что С-богатые олигонуклеотиды способны формировать четырехцепочечные внутри- и межмолекулярные структуры - так называемые I-мотивы.
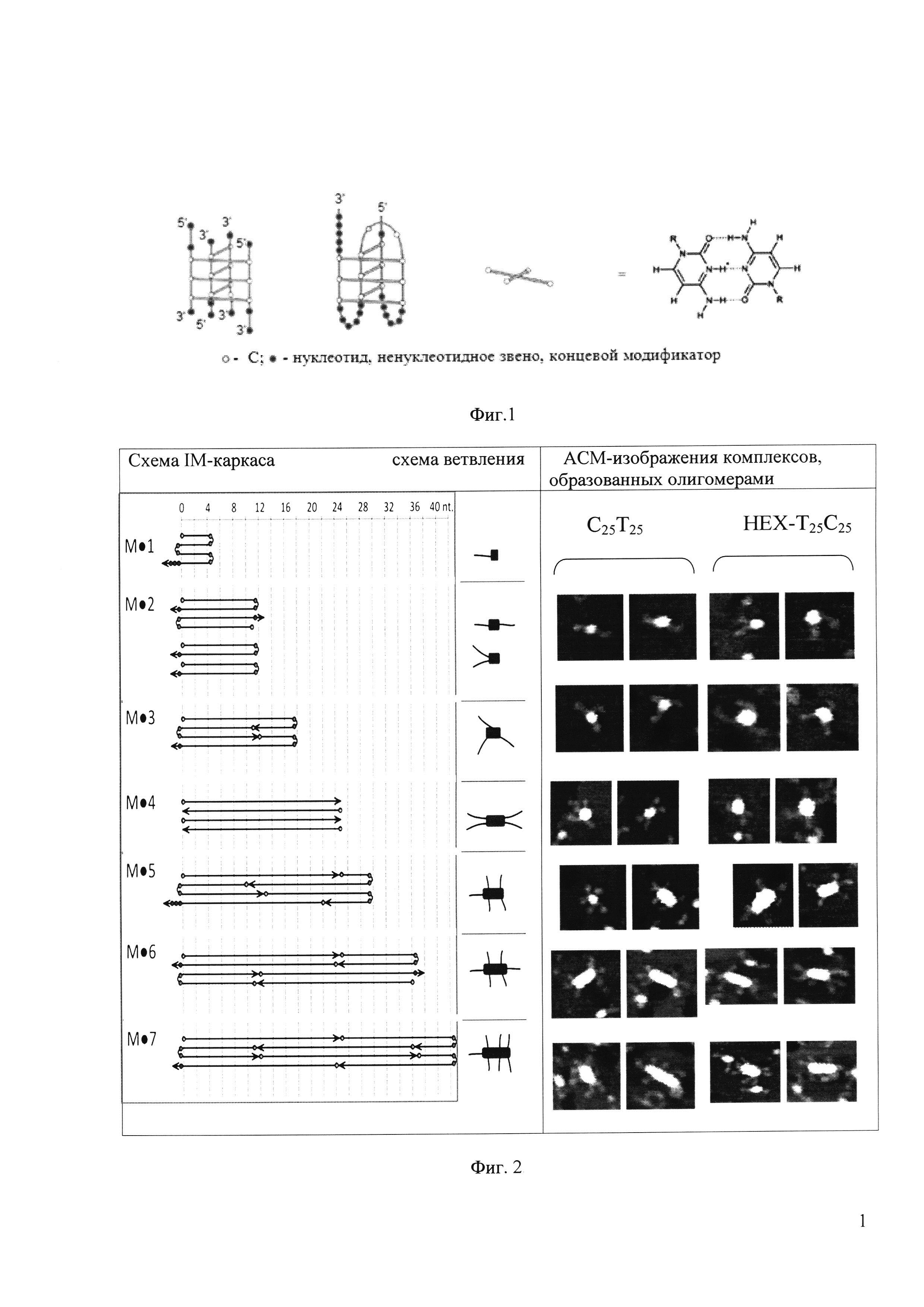
I-мотив, IM (Intercalated motif) - структура, состоящая из двух параллельных дуплексов с интеркалированными гемипротонированными цитозин+-цитозин парами оснований (Фиг. 1).
В настоящем изобретении описан новый принцип формирования мультимерных комплексов на основе ДНК IM с образованием стабильных разветвленных структур - необходимых узловых соединений для создания сложных наноконструкций [1].
Известно, что структура IM формируется из 1-4 молекул олигонуклеотида [2-3]. Важно отметить, что увеличение длины петель IM обычно приводит к понижению их стабильности [4]. В настоящее время наиболее перспективными для создания наноприборов на основе ДНК-оригами считаются узловые конструкции IM, отличающиеся высокой стабильностью в слабокислых условиях (при рН 5-6) и способные изменить конформацию при повышении рН [5-6]. Однако используемые ранее IM-структуры, например, описанные в работе [3] (прототип 1), позволяли получать лишь крестообразные конструкции, но не узловые соединения с большим числом ветвлений.
ДНК-наноконструирование каркасных объектов невозможно без использования разветвляющих узлов. В работе [7] был получен широкий ряд 3D ДНК-структур на основе дуплексных разветвлений (прототип 2). Для формирования узловых конструкций авторы использовали сложные композиции нескольких различных олигомеров. Последовательность каждого из них рассчитывалась с помощью специальной программы. В настоящей работе самосборка разветвленного узла происходит из раствора одного олигомера. Кроме того, очевидным преимуществом настоящего изобретения является возможность простого управления конформацией структур (рН чувствительность), несущих предложенные ветвящие IM узлы.
Раскрытие изобретения и технический результат
Технический результат настоящего изобретения достигается тем, что в водных слабокислых растворах олигонуклеотидов (фрагментов дезоксирибонуклеиновых кислот) XCn или CnX, где С - остаток дезоксицитидина; n≥5 - число остатков дезоксицитидина; Х-заместитель различной химической природы, самопроизвольно формируется стабильная при рН 4÷6,5 мультимерная структура интеркалированного мотива (IM), несущая 2-7 и более Х-фрагментов. Фрагмент молекулы X может содержать остатки флуоресцентных меток или гасителей флуоресценции, аффинных молекул, олигонуклеотидную последовательность различной длины и состава, в том числе несущую якорные группы для ковалентного, комплементарного, хелатного или аффинного присоединения молекулярных блоков, а также для конъюгации с поверхностями, наночастицами и проч.
Мы впервые предложили термодинамически обоснованную схему расположения олигонуклеотидов в мультимерах IM. Схема предполагает минимальное количество не задействованных в образовании водородных связей IM-каркаса цитидинов Cn-фрагментов олигонуклеотидов, при этом Х-фрагменты ответвляются от IM-каркаса. Количество ответвлений, равное количеству олигонуклеотидов в комплексе, зависит от длины С-блока (n) и условий формирования структуры (Фиг. 2).
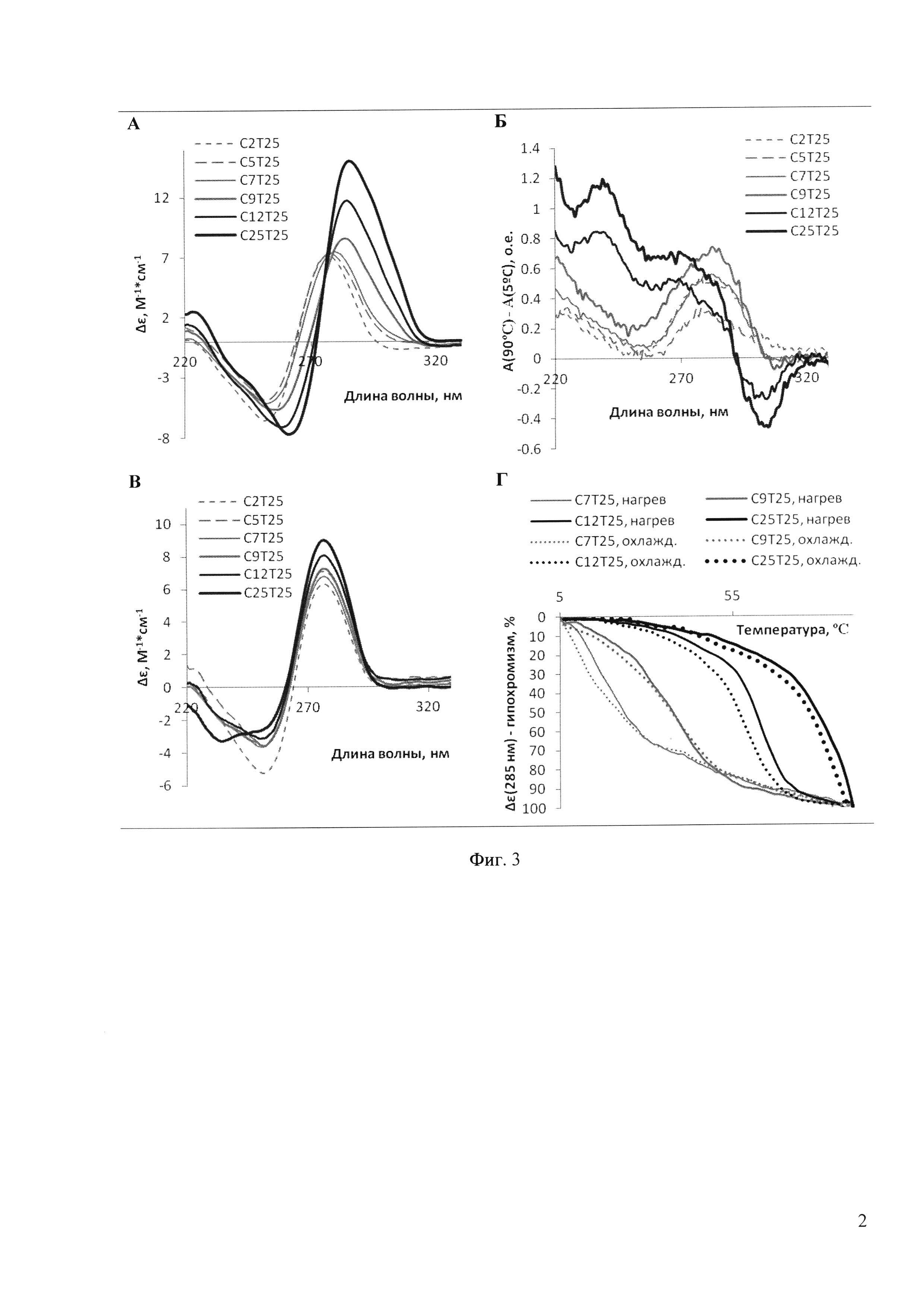
Формирование IM и рН-зависимость доказывали на примере серии дезоксирибоолигонуклеотидов CnT25 (n=2, 5, 7, 9, 12, 25) с помощью оптических методов (спектроскопия кругового дихроизма (КД) и абсорбционная УФ-спектроскопия, Фиг. 3). Характерные для IM сигналы - положительная полоса около 285 нм и небольшая отрицательная полоса около 260 нм в КД-спектрах (Фиг. 3,А), а также отрицательная полоса около 295-305 нм в дифференциальных спектрах УФ-абсорбции (Фиг. 3,Б), наблюдались для олигонуклеотидов с n>7 (в случае n=7 признаки IM присутствуют, но выражены достаточно слабо). При повышении рН до 8,5 (Фиг. 3,В) наблюдается исчезновение характерного КД-пика при 285 нм, что свидетельствует о разрушении IM. Профили термической диссоциации (Фиг. 3,Г) характеризуют стабильность IM-структур.
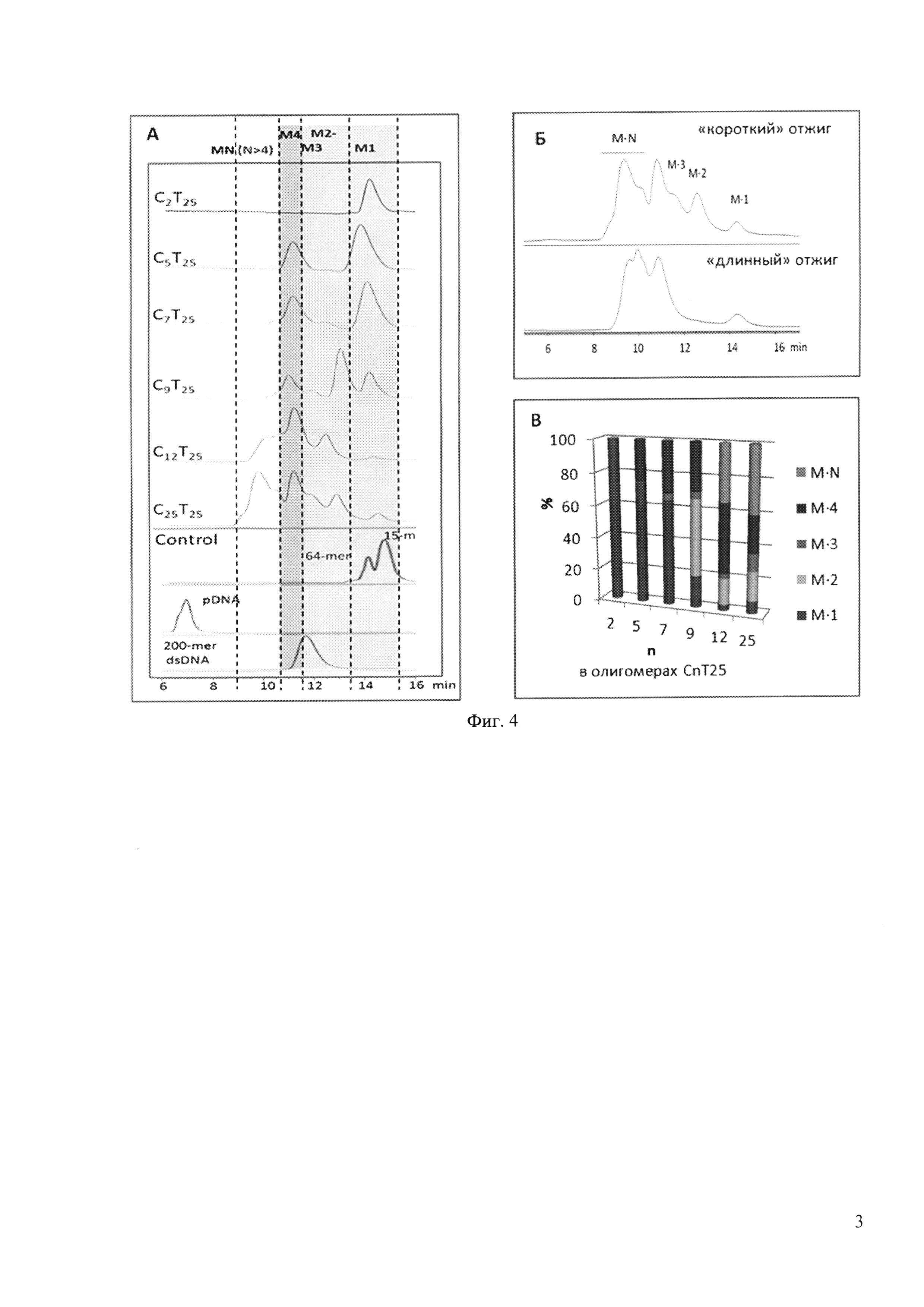
Состав комплексов подтвержден анализом АСМ-сканирования высокого разрешения (Фиг. 2) и методом гель-фильтрационной хроматографии (Фиг. 4). Оказалось, что С2Т25 в рассмотренных условиях не образует межмолекулярных структур. С5Т25 способен формировать только тетрамеры; С7Т25 - тетрамеры и некоторое количество тримеров. Увеличение длины С-домена до 12-25 нуклеотидов приводит к большему полиморфизму структур, образованию многомерных конструктов (см. Фиг. 2 и гистограмму на Фиг. 4,В).
Зависимость содержания и состава IM-комплексов от температурного режима и продолжительности отжига наблюдалась только для олигнуклеотидов C12-25Т25. Продолжительный отжиг приводил, как видно по хроматограммам на Фиг. 4,Б, к перераспределению 2М- и 3М-комплексов в пользу тетра- и мультимеров.
В качестве модели, несущей ненуклеотидную модификацию в Х-домен, было исследовано флуоресцентное производное НЕХ-Т25С25 (НЕХ - гексахлорфлуоресцеиновый остаток). Как видно из АСМ-сканов на Фиг. 2, заместитель не повлиял на способность олигонуклеотида формировать разветвленные узловые структуры, что доказывает возможность вводить в состав Х-домена группы различной химической природы, в том числе несущие якорные группы для ковалентного, комплементарного, хелатного и/или аффинного присоединения двух и более молекулярных блоков.
Описание примеров реализации изобретения
В примере 1 описаны синтез, хроматографическое выделение и масс-спектрометрический анализ олигонуклеотидов состава CnX (X=Т25; n=5-25), способных формировать рН-чувствительные узловые конструкции.
В примере 2 описана сборка мономерных и мультимерных (узловых) конструкций из олигонуклеотидов CnX, а также подтверждение формирования IM-каркаса оптическими методами.
В примере 3 описано разделение мультимеров методом гель-хроматографии.
В примере 4 представлена методика подтверждения структуры узловых конструкций (типа ветвления) методом ACM.
Ниже приведены примеры реализации изобретения.
Пример 1. Синтез и хроматографическая очистка олигонуклеотидов CnT25
Олигонуклеотиды синтезировали на ДНК-синтезаторе Biosset ASM-800 DNA по стандартному фосфорамидитному протоколу. Очистку проводили методом ВЭЖХ на колонке Hypersil С18 (250 мм ×4,0 мм) с УФ-детекцией при 260 нм в системе 5-17,5% CH3CN (линейный градиент) в 0,1 М аммоний-ацетатном буфере при 55°С. Диметокситритильную защитную группу удаляли, обрабатывая олигонуклеотид 80%-ной уксусной кислотой (20 мин), детритилированные олигонуклеотиды дополнительно очищали в той же системе. Чистота всех полученных олигонуклеотидов по данных ВЭЖХ составляла не менее 95%. MALDI TOF масс-спектры регистрировали на спектрометре Bruker Microflex в линейном режиме регистрации ионов . В качестве матрицы использовали раствор 3-гидроксипиколиновой кислоты (35 г/мл) с двухосновным аммоний-цитратом. Данные масс-спектрометрии дополнительно подтвердили структуру и чистоту олигонуклеотидов.
. В качестве матрицы использовали раствор 3-гидроксипиколиновой кислоты (35 г/мл) с двухосновным аммоний-цитратом. Данные масс-спектрометрии дополнительно подтвердили структуру и чистоту олигонуклеотидов.
Пример 2. Сборка мультимеров и подтверждение их вторичных структур оптическими методами
Олигонуклеотиды растворяли в 10 мМ Tris-HCl буфере (рН 5,5 или 8,5), содержащем 10 мМ KCl. Концентрации олигонуклеотидов рассчитывали по УФ-поглощению при 90°С и коэффициентам молярной экстинкции нуклеотидов. Образцы выдерживали 5 мин при температуре 90°С, затем охлаждали на льду («быстрый» отжиг) или со скоростью 0,5°С/мин («медленный» отжиг) непосредственно перед экспериментами для обеспечения мономолекулярного или межмолекулярного фолдинга соответственно. УФ-спектры, КД-спектры и КД-профили термической денатурации/ренатурации регистрировали на спектрофотометре Chirascan (Applied Photophysics, Великобритания), оборудованном термостатируемой ячейкой. Температуры плавления IM определяли по максимуму первой производной профилей термической денатруации/ренатурации. Эллиптичность регистрировали с шагом 1°С в диапазоне 5-90°С (скорость нагрева/охлаждения составляла 0,5°С/мин).
Пример 3. Гель хроматография мультимеров CnT25
Лиофилизированные олигонуклеотиды CnT25 (100 mkM) растворяли в буфере А и отжигали в «медленном» и «быстром» режиме, как описано в Примере 2.
ВЭЖХ-анализ проводили на гель-фильтрационной колонке Zorbax GF-250 (250×4,6 мм) в изократического режиме (буфер А: 10 mM KCl, 25 mM Tris-HCl, 5% MeOH, рН 5,5) при 10°С со скоростью потока 0,3 мл/мин. Объем инжекции образцов равнялся 5 мкл. Хроматограф - Agilent 1100, УФ-детектор, длина волны регистрации - 260 нм. Для идентификации пиков использовали калибровочную кривую, полученную с использованием синтетических олигонуклеотидов среднего состава (15-мер, 50-мер, 64-мер), ДНК-ампликонов (180-210 пар нуклеотов) и плазмидной ДНК (2300-4800 пар нуклеотов).
Пример 4. Получение АСМ-сканов для подтверждения структуры мультимеров (типа ветвления)
В АСМ-экспериментах использовали ВОПГ, поверхность которого обрабатывали для повышения гидрофильности модификатором графита (МГ) (CH2)n(NCH2CO)m-NH2 (Nanotuning, Россия). Модификацию осуществляли по опубликованному протоколу [8]: на свежий скол ВОПГ наносили каплю водного раствора МГ (0.01 мг/мл), выдерживали 5-7 мин, затем излишек жидкости удаляли в потоке азота.
Образы, предварительно отожженные в «медленном» режиме, как описано в примере 2, разбавляли до концентрации около 0.2 мкМ, каплю раствора образца наносили на поверхность МГ-ВОПГ на 1-2 с, затем удаляли с поверхности в потоке азота. Данная технология пробоподготовки позволяет элиминировать избыток солей, минимизировать влияние агрегации, а также артефактов, возникающих при адсорбции и высушивании. АСМ-сканирование осуществляли на приборе ИНТЕГРА Прима (NT-Mdt, Россия) в полуконтактном режиме при скорости сканирования 1 Гц; амплитуда колебаний зонда составляла несколько нм. Все измерения проводили с использованием сверхтонких кантилеверов (диаметр острия около 1 нм).
Источники информации
1. Seeman N.C. Nucleic acid junctions and lattices // J Theor Biol. - 1982; 99 (2): 237-247.
2. Amato J., Iaccarino N., Randazzo A., Novellino E. Pagano B. Noncanonical DNA secondary structures as drug targets: the prospect of the i-motif // ChemMedChem. - 2014; 9 (9): 2026-2030.
3. Laisne A., Pompon D.Leroy J.L. [C7GC4]4 association into supra molecular i-motif structures // Nucleic Acids Res. - 2010; 38 (11): 3817-3826.
4. Reilly S.M., Morgan R.K., Brooks T.A., Wadkins R.M. Effect of interior loop length on the thermal stability and pK(a) of i-motif DNA // Biochemistry. - 2015; 54 (6): 1364-1370.
5. Yang Y., Zhou C., Zhang Т., Cheng E., Yang Z.Liu D. DNA pillars constructed from an i-motif stem and duplex branches // Small. - 2012; 8 (4): 552-556.
6. Dong Y., Yang Z.Liu D. DNA nanotechnology based on i-motif structures // Acc Chem Res. - 2014; 47 (6): 1853-1860.
7. Zhang F., Jiang S., Wu S., Li Y., Mao C., Liu Y. Yan H. Complex wireframe DNA origami nanostructures with multi-arm junction vertices // Nat Nanotechnol. - 2015; 10 (9): 779-784.
8. Klinov D., Dwir В., Kapon E., Borovok N., Molotsky Т., Kotlyar A. High-resolution atomic force microscopy of duplex and triplex DNA molecules // Nanotechnology - 2007; 18:225102.
Список сокращений
ACM - атомно-силовая микроскопия
ВОПГ - высокоориентированный пиролитический графит
ДНК - дезоксирибонуклеиновая кислота
ВЭЖХ - высокоэффективная жидкостная хроматография
КД-спектроскопия - спектроскопия кругового дихроизма
МГ - модификатор графита
С - цитидин (остаток дезоксицитидина в дезоксирибоолигонуклеотидах)
Т - тимидин
УФ - ультрафиолет
КД-спектроскопия - спектроскопия кругового дихроизма
IM - I-мотив (Intercalated motif)
HEX - 4,7,2',4',5',7'-гексахлорфлуоресцеин
MALDI-TOF-масс-спектрометрия - матричная десорбционно-ионизационная времяпролетная масс-спектрометрия
Описание чертежей
На фиг. 1 представлена схема строения межмолекулярного и внутримолекулярного I-мотивов ДНК.
На фиг. 2 представлена схема строения и соответствующие фрагменты АСМ-сканов 2-7-мерных узловых конструкций (комплексов олигонуклеотидов С25Т25 и его аналогов с заместителями на примере НЕХ-Т25С25).
На фиг. 3 представлены физико-химические данные, подтверждающие формирование IM олигонуклеотидами серии CnT25. А: КД-спектры олигонуклеотидов. Молярная эллиптичность приведена в расчете на 1 нуклеотид. Условия: 10 мМ Tris-HCl, 10 мМ KCl (буфер 1), рН 5,5, температура - 5°С. Б: Дифференциальные спектры УФ-абсорбции (разность абсорбции при 90°С и 5°С). Условия: буфер 1 (рН 5,5). В: КД-спектры олигонуклеотидов. Условия: буфер 1 (рН 8,5), температура - 5°С. Г: Температурная зависимость молярной эллиптичности. Условия: буфер 1 (рН 5,5), скорость нагрева/охлаждения – 0,5°С/мин. Концентрация олигонуклеотидов во всех экспериментах составляла 20 мкМ. Д: АСМ-визуализация наноструктур, полученных из олигомера С12Т25 при рН 5,5 (структуры стабильны) и рН 8,5 (образование наносборок не наблюдается).
На фиг. 4 представлены результаты разделения мономеров и мультимеров CnT25 методом гель-хроматографии. А: ВЭЖХ-анализ содержания ГМ-комплексов в препаратах олигомеров CnT25 (концентрация олигонуклеотидов 100 мкМ, буфер 1). Б: Анализ влияния режима и продолжительности отжига на состав и соотношение IM-комплексов, формирующихся в 100 мкМ растворе олигонуклеотида С25Т25. В: Гистограмма зависимости содержания мультимерных структур олигонуклеотидов общей формулы CnT25 от длины С-блока (n=2÷25).
Способ получения рН-чувствительных разветвленных узловых наноконструкций из фрагментов дезоксирибонуклеиновых кислот, стабильных при рН 4÷6,5, путем самосборки синтетических олигонуклеотидов XCn или CnX за счет образования структур интеркалированного мотива, где С - остаток дезоксицитидина; n=5÷25 - число остатков дезоксицитидина; X - заместитель, выбранный из Т25 или НЕХ-Т25, Т - тимидин, причем олигонуклеотиды растворяют в 10 мМ Tris-HCl буфере при рН 5,5, содержащем 10 мМ KCl, образцы выдерживают 5 мин при 90°С, затем охлаждают на льду или со скоростью 0,5°С/мин.