Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ УДАЛЯЕМЫХ ВОДОНЕРАСТВОРИМЫХ ИОНООБМЕННЫХ ПОКРЫТИЙ НА МАЛДИ МИШЕНЯХ И ИХ ПРИМЕНЕНИЕ ДЛЯ МАСС-СПЕКТРОМЕТРИЧЕСКОГО АНАЛИЗА
Вид РИД
Изобретение
Настоящее изобретение относится к области масс-спектрометрии, молекулярной биологии, медицине, медицинской диагностике и генетике, в частности к генотипированию. В настоящем изобретении предложен новый способ подготовки олигонуклеотидных проб для МАЛДИ МС анализа, сочетающий операции концентрирования образца и его обессоливания в одном шаге, выполняемом на стандартной МАЛДИ мишени.
Уровень технического состояния.
Матрично-ассистированная лазерно-десорбционная масс-спектроскопия (МАЛДИ МС) широко используется для анализа коротких ДНК-проб, олигонуклеотидов, как синтетического происхождения, так и продуктов ферментативных превращений (с использованием ДНК-зависимых полимераз, обратных транскриптаз, эндо- и экзонуклеаз, различных рестриктаз и т.д.) [1]. Практические приложения МАЛДИ МС в мини-сиквенсе, генотипировании, анализе тандемных повторов стали неотъемлемой частью современных методов лабораторного биохимического анализа [2]. Метод отличает высокая производительность, скорость и возможность мультиплексного анализа (т.е. одновременного анализа многих образцов), удобство автоматизации.
Одновременно имеются и ограничения, сдерживающие более широкое его применение. Прежде всего это высокая чувствительность МАЛДИ МС к присутствию в анализируемом образце солей металлов, в особенности щелочных - натрия и калия [3]. Это резко ухудшает качество получаемых спектров, приводит к появлению в них дополнительных, интерферирующих сигналов аддуктов металлов и ухудшает чувствительность. При загрязнении образца такими солями МАЛДИ анализ может оказаться существенно затруднен или просто невозможен.
Другой проблемой являются ограничения, связанные с чувствительностью масс-спектрометрической детекции, требующей концентрации пробы перед масс-спектрометром для быстрого автоматического анализа без длительного времени накопления полезного сигнала. Таким образом, удаление примесей ионов металлов и методы концентрирования образов являются актуальными задачами, поиски решения которых активно ведутся разными группами [4, 5].
Существует ряд подходов, предлагающих решение этих проблем. К самым простым можно отнести переосаждение олигонуклеотидов из аммонийацетатного буфера и микродиализ [6, 7], а также гель-фильтрацию [8]. Все эти методы отличает высокая трудоемкость, при этом их практически невозможно автоматизировать. В более эффективных вариантах, совместимых с автоматизацией, используются биотинилированные ДНК-пробы и стрептавидиновые твердофазные носители для их выделения [9, 10]. Однако это требует введения меток, а главное, специализированных магнитных шариков или микроплашек, покрытых стрептавидином, что существенно удорожает метод выделения. Альтернативным вариантом является концентрация и обессоливание ДНК-проб на обращенно-фазовых сорбентах, что реализовано как в виде индивидуальных микроколонок, так и микроплашек, позволяющих одновременно работать с 96 образцами. Примерами могут быть решения лабораторные, использующие обычные наконечники для 20 мкл пипеток [11], также промышленно выпускаемые Zip-Tip С-18, С-8, С-4 (Millipore Corp., USA). Существует 96-канальный вариант в формате стандартной микроплашки с сорбентом Oasis HLB (Waters, USA) [12, 13]. Усовершенствованная разновидность такого способа - появившиеся недавно специальные 96-канальные микроплашки, MALDI Mass-PREP PROtarget (Waters Corp., USA), содержащие С-18 фазу и поставляемые со специальным адаптером, позволяющим элюировать целевую фракцию непосредственно на МАЛДИ пластинки. Опять же, недостатками предлагаемых методов являются их дороговизна в реализации (при использовании микроплашечного формата цена анализа возрастает на добавочные 100-200$ за 96-ячеечную плашку), введение дополнительных шагов и операций, требование специализированного оборудования, а также то обстоятельство, что они занимают достаточно много времени.
Описанные прототипы изобретения, основанные на обращенно-фазовых методах очистки и концентрации, также плохо переносят присутствие поверхностно-активных веществ, являющихся добавками во многих ферментативных буферах, а также требуют переноса образцов с помощью пипеток из емкости в емкость на различных этапах пробоподготовки. Попытки регенерации такого рода плашек требуют существенных усилий, а при их использовании для ДНК-типирования, в клинической и медицинской диагностике такого рода регенерация запрещена в соответствии с требованиями СОП (стандартных операционных процедур), поскольку не обновляется сорбент, который может нести следы предыдущих образцов (см., например, методические указания Минздрава РФ и главврача РФ (МУ 1.3.1794-03, МУ 1.3.1888-04, МУ 2.3.2.1830-04, МУ 3.5.5.1034-01, MУ N 2001/4, утв. МЗ РФ 25.01.2001)).
Ближайшим прототипом предлагаемого изобретения является недавно появившийся метод, использующий специальные подложки, связывающие ДНК из ферментативной реакционной среды. Этот подход был реализован на специальных вставках в МАЛДИ мишени, состоявщих из собственно подложки и ковалентно присоединенного к ней слоя линейного или разветвленного полимера, связывающего ДНК. Для этой цели в прототипе использовались линейный и разветвленный полиэтиленимин (PEI), поливинилпирролидон (PVP), этоксилированный полиэтиленимин. В качестве подложки выступали как покровные микроскопные стекла, так и различные пластиковые и керамические вставки, поверхности которых были химически модифицированы таком образом, что это позволяло ковалентно пришивать ДНК-связывающие полимеры к их поверхности [14]. К сожалению, такие подложки являются одноразовыми и применение коммерческих образцов значительно увеличивает стоимость анализа. В тоже время, производство модифицированных поверхностей с воспроизводимыми свойствами в лабораторных условиях весьма сложно, а зачатую и вовсе не возможно.
Сходный прототип был реализован с использованием полиэтилениминового дендримера 4-го поколения (РАМАМ G4), ковалентно пришитого к поверхности позолоченного предметного стекла микроскопа [15-17] и использованного впоследствии как вставка в специальный МАЛДИ адаптер. Ранее РАМАМ, ковалентно связанный с поверхностью чипа, был использован для иммобилизации ДНК-зондов [18]. В последнем случае молекулы дендримера, так же как и в работе [15], закреплялись на поверхности чипа ковалентной пришивкой через амино- либо эпоксигруппы, содержащиеся на поверхности химически модифицированной позолоченной стеклянной пластинки. В случае модификации эпоксигруппами пластинка с нанесенным на нее дендримером инкубировалась при 90°С 15 минут. К недостаткам описанного прототипа относится необходимость специальных манипуляций по химической пришивке полимера к поверхности вставки, что требует предварительной химической модификации-активации поверхности, а также проведения собственно химической реакции пришивки полимера. Кроме того, химическая пришивка является необратимой и такого рода вставки становятся одноразовыми. Еще одним недостатком такого прототипа является невозможность проведения таких модификаций непосредственно на стальных поверхностях стандартных МАЛДИ мишеней. Недостатком также является невозможность многоразового использования такого рода вставок, что существенно увеличивает цену анализа. Еще одним осложнением является необходимость модификации стеклянной поверхности с тем, чтобы придать ей проводящие свойства, необходимые для корректной работы масс-спектрометра. В последнем случае [15] были использованы позолоченные поверхности, полученные нанесением золота в на специальной установке в тлеющем вакуумном разряде. Такого рода техника в подавляющем большинстве аналитических лабораторий отсутствует.
Раскрытие изобретения и технический результат.
Техническим результатом настоящего изобретения является способ получения ДНК-связывающих поверхностей, отличающихся тем, что на стальной МАЛДИ мишени, без предварительной подготовки и химической обработки, получают легко удаляемую водонерастворимую поверхностную пленку путем непосредственного покрытия МАЛДИ мишени специальным ДНК-связывающим полимерным составом, которое после испарения растворителя образует сравнительно тонкий слой, позволяющий иммобилизовать ДНК-фрагменты из различных растворов. После проведения шага отмывки поверхности, удаляющей основные примеси солей металлов, адсорбированная ДНК элюируется в наносимый на эту же точку раствор МАЛДИ матрицы. Элюированная ДНК сокристаллизуется с МАЛДИ матрицей и после высушивания подвергается МАЛДИ МС анализу.
Отличительной чертой данного изобретения является возможность легко удалить использованное покрытие-пленку с поверхности мишени и наносить свежее покрытие на ту же самую мишень, т.е. возможность повторного многократного использования мишени.
Сравнение с ранее использованными решениями.
Известно использование нитроцеллюлозы в МАЛДИ ДНК-анализе для получения более однородной кристаллизации матрицы и улучшения воспроизводимости детекции больших ПЦР-продуктов. Однако, в отличие от предлагаемых катионных пленок, она не способна сорбировать ДНК из водных растворов и не может использоваться для выделения и обессаливания олигонуклеотидов. Для успешного МАЛДИ анализа с использованием такой нитроцеллюлозной пленки перед нанесением образца на МАЛДИ мишень требовалась трудоемкая и тщательная предварительная очистка и концентрация анализируемой ДНК.
Известно также использование ионогенных покрытий для иммобилизации и обессаливания ДНК для последующего МАЛДИ анализа. Однако для этой цели требовалось проведение химической модификации поверхности, при которой ионогенный полимер через ковалентную связь закреплялся на поверхности. Это невозможно выполнить на стандартных стальных МАЛДИ мишенях и требует применения специальных одноразовых подложек с химически активированной поверхностью и дорогостоящего дополнительного оборудования для их использования в МАЛДИ МС анализе. При этом такие подложки могут быть использованы только один раз и не подлежат регенерации, т.е. являются одноразовыми, что существенно увеличивает стоимость анализа. Помимо этого, использованные ранее стеклянные и полимерные подложки в случае серийных анализов требуют применения специальных технологических решений для удаления накапливающегося статического заряда с их поверхности, способного значительно исказить сигналы масс-спектров.
Преимущество предлагаемого способа состоит в возможности многократного использования стандартного оборудования и стандартных условий серийного анализа, что значительно упрощает и удешевляет его проведение.
В предлагаемом изобретении ДНК-связывающее покрытие является временным, легко удаляемым и наносится на стандартную стальную МАЛДИ мишень без предварительной подготовки, поскольку не требует химической подготовки и обработки поверхности. В состав покрытия входит ионогенный ДНК-связывающий полимер, обеспечивающий основную функциональность - иммобилизацию ДНК из раствора, и нитроцеллюлоза, обеспечивающая формирование на МАЛДИ мишени временной пленки с указанными свойствами. После использования такой МАЛДИ мишени она может быть легко очищена и повторно использована в дальнейшем либо в качестве стандартной МАЛДИ мишени, либо повторно покрыта указанной ДНК-связывающей пленкой.
В предложенном способе ДНК-связывающее покрытие наносится на стандартную МАЛДИ мишень в виде раствора ионогенного ДНК-связывающего полимера и нитроцеллюлозы, а после его высыхания на поверхности образуется водонерастворимая пленка, удерживающаяся на поверхности МАЛДИ мишени силами адгезии. После использования ее удаление осуществляется простой отмывкой поверхности водно-органическими смесями растворителей.
Описание чертежей.
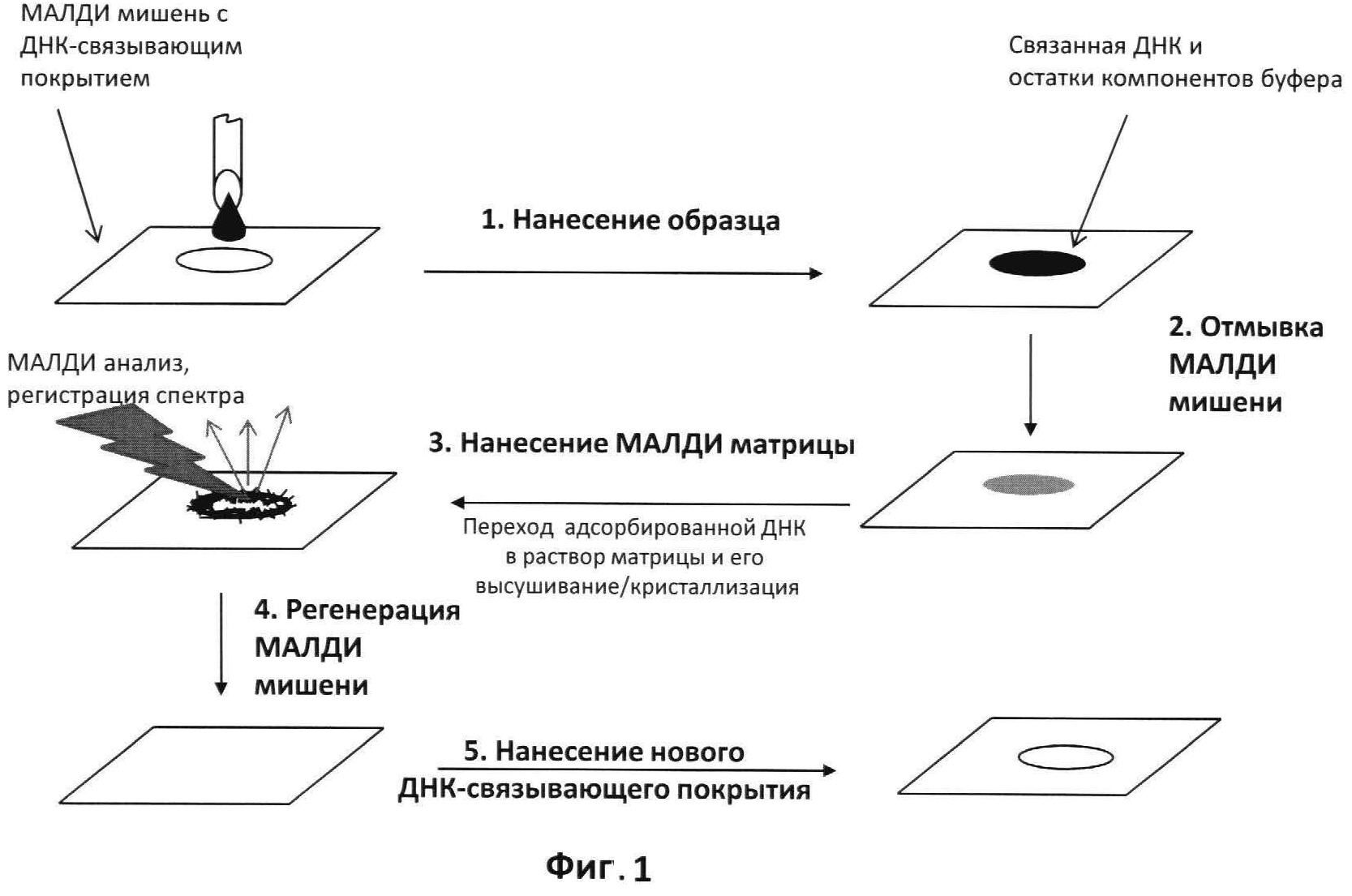
На фиг.1 приведена общая схема проведения подготовки пробы анализируемого образца с использованием МАЛДИ мишени, содержащей ДНК-связывающее покрытие. Операции выполняется в следующей последовательности. На первом шаге, нанесении образца, водный раствор анализируемого олигонуклеотида либо ферментативные смеси, содержащие ДНК-зонды, и т.п. непосредственно наносятся на заранее подготовленную МАЛДИ мишень, покрытую ДНК-связывающим полимером. На втором шаге, отмывке МАЛДИ мишени, точки нанесения образца промываются дистиллированной водой либо, если их много, то МАЛДИ пластинка целиком погружается на несколько секунд в емкость с дистиллированной водой, в которой весь не связавшийся отмывается от подложки, оставляя лишь иммобилизованную ДНК. На третьем шаге, нанесении МАЛДИ матрицы, на эти же точки наносится раствор МАЛДИ матрицы и после его высыхания выполняется МАЛДИ анализ. На четвертом шаге, регенерации МАЛДИ мишени, использованная пленка-покрытие удаляется с помощью смеси смесью водно-органических растворителей. На пятом шаге МАЛДИ мишень может быть вновь покрыта свежей ДНК-связывающей пленкой и цикл МАЛДИ анализа с использованием той же мишени таким образом может быть повторен. Количество циклов использования-регенерации неограниченно.
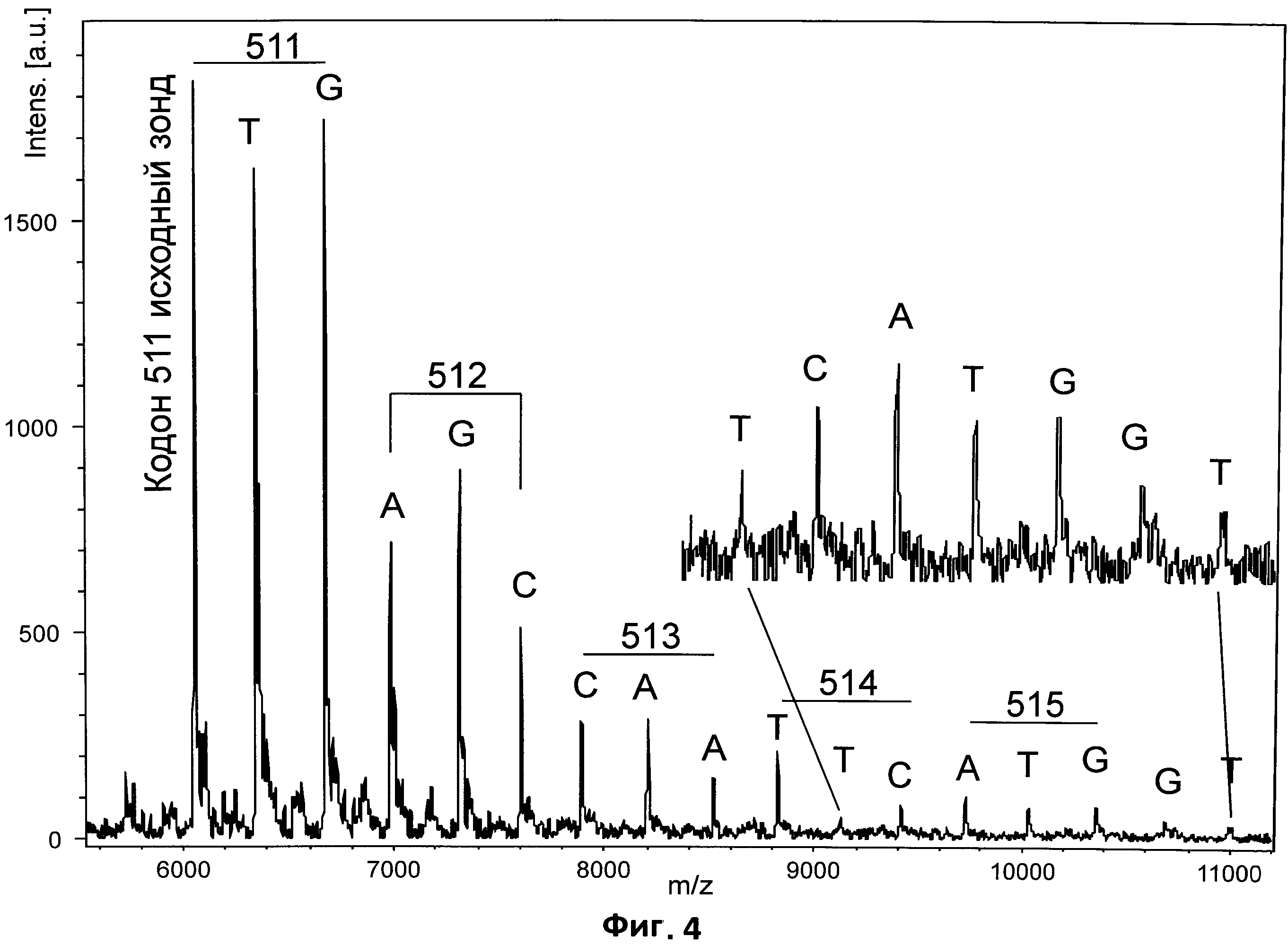
На фиг.2 приведены МАЛДИ МС раствора в 0.2 М водном хлориде натрия 25-мерного олигонуклеотида смешанного состава Н33571 (5'-GTG TAA CTT AGA ACT CCA ТСТ TGA G), полученного без дополнительных шагов обработки исходного раствора (фиг.2А); после обработки раствора олигонуклеотида катионообменной смолой в аммониевой форме (фиг.2Б); спектр, полученный на МАЛДИ мишени, покрытой пленкой на основе полиаллиламина (фиг.2В).
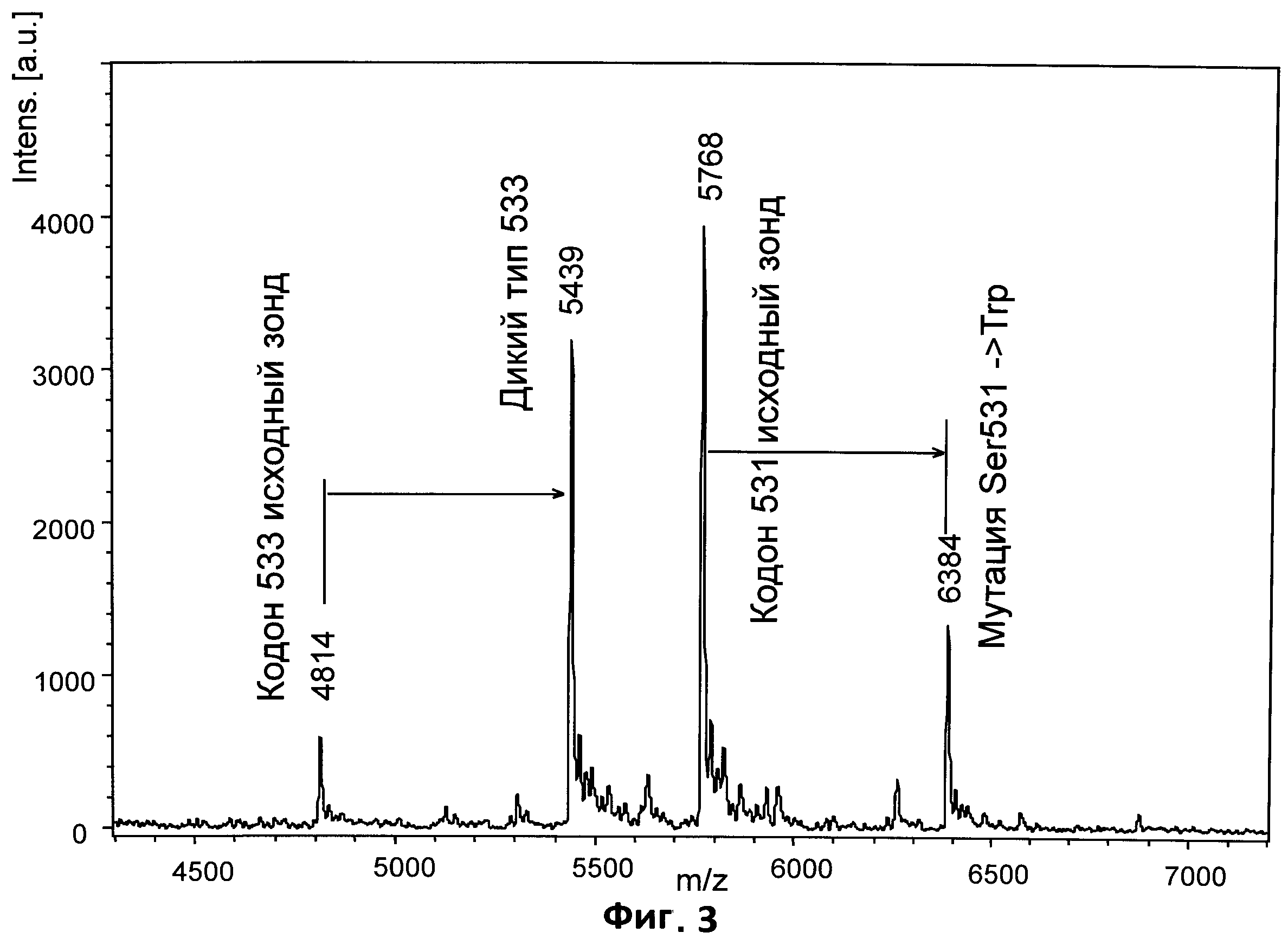
На фиг.3 приведен характерный спектр продуктов реакции генотипирования кодонов 531 и 533 гена Mycobacterium tuberculosis rроB, полученный с использованием МАЛДИ мишени, покрытой пленкой на основе полиэтиленимина.
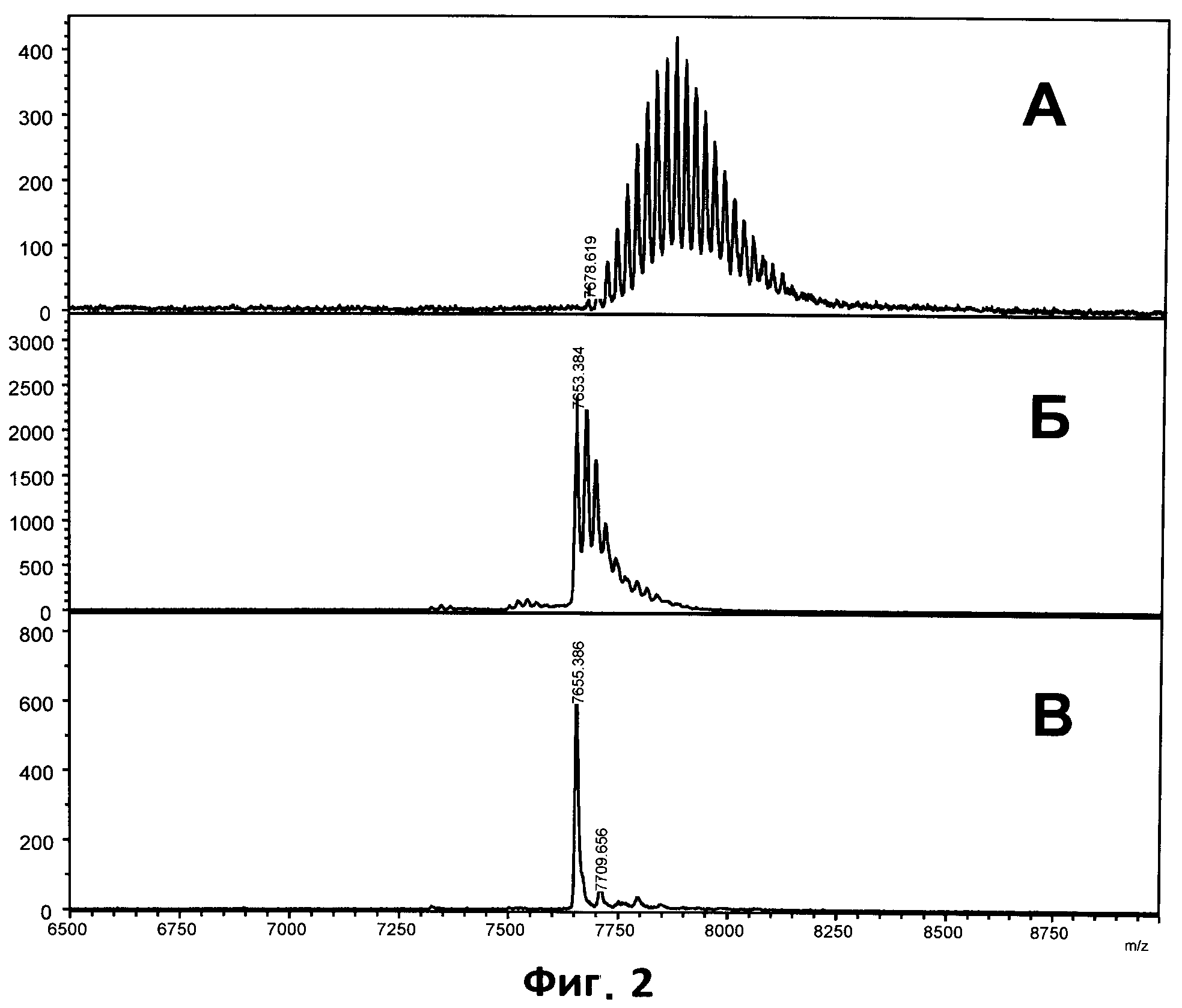
На фиг.4 приведен характерный спектр продуктов реакции мини-сиквенса кодонов 511-515 гена Mycobacterium tuberculosis rpoB, полученный с использованием МАЛДИ мишени, покрытой пленкой на основе полиэтиленимина.
Описание примеров реализации изобретения
Пример 1 описывает получение полиэтилениминовой ДНК-связывающей пленки на стальной пластинке, используемой в качестве МАЛДИ мишени, и дальнейшие операции пробоподготовки.
ДНК-связывающий полимер наносится в составе специальной смеси, состоящей из собственно полимера: линейный и разветвленный полиэтиленимин (PEI), полиаллиламин (PAAm), этоксилированный полиэтиленимин (EtOPEI), дендримеры полиамидоамина (РАМАМ), поливинилпирролидон (PVP), водно-органической смеси растворителей и фиксатора (нитроцеллюлозы), непосредственно на стальную стандартную МАЛДИ мишень или вставку в нее, не модифицированную и не обработанную никаким образом. После испарения растворителя на поверхности остается пленка, состоящая из полимера и фиксатора, выполняющего роль клея, не дающего полимеру перейти в раствор при добавлении воды или водного буфера. После чего пластинка (вставка) готова к работе.
Процедура нанесения проста и не требует специальных химических реактивов, полученное покрытие легко удаляется последовательной отмывкой пластинки органическими растворителями и затем водой. После чего пластинка может быть использована заново.
Водные растворы анализируемого олигонуклеотида, ферментативные смеси, содержащие ДНК-зонды, и т.п. наносятся непосредственно перед масс-спектрометрическим анализом на такую подготовленную МАЛДИ мишень, минуя все промежуточные стадии пробоподготовки. Смесь выдерживается в течение нескольких секунд на пластинке, в течение которых ДНК переходит из раствора на ионообменное пленочное покрытие МАЛДИ мишени. После этого точки нанесения образца промываются дистиллированной водой либо, если их много, то МАЛДИ пластинка целиком погружается на несколько секунд в емкость с дистиллированной водой, в которой весь несвязавшийся с полимерным покрытием материал (соли буферов, поверхностно-активные вещества, белки и пептиды) отмывается от подложки, оставляя лишь иммобилизованную ДНК. После нанесения на эти же точки раствора МАЛДИ матрицы при ее кристаллизации ДНК переходит из приповерхностного слоя в раствор МАЛДИ матрицы, что делает возможным последующий МАЛДИ анализ. При этом достигается две цели. Первая - при удалении супернатанта и на стадии отмывки поверхности происходит удаление солевых примесей и поверхностно-активных веществ (ПАВ), затрудняющих МАЛДИ анализ. Вторая - на стадии элюирования ДНК вся ДНК, адсорбированная из начального раствора, переходит в небольшое количество матрицы, чем достигается эффект концентрирования ДНК и повышение чувствительности детекции. В качестве МАЛДИ матриц используются самые обычные рецептуры, широко применяемые в рутинном МАЛДИ анализе олигонуклеотидов, такие как 3-гидроксипиколиновая кислота, 2,3,4- и 2,4,6-тригидроксиацетофеноны, 6-аза-2-тиотимидин, смесь антраниловой и никотиновой кислот, 2,5-дигидроксибензойная кислота и другие (более полный перечень см., например, в обзоре [4]).
В качестве подложек для нанесения покрытий могут использоваться токопроводящие керамические, кремниевые, алюминиевые и иные твердотельные планарные подложки, помещающиеся в любой доступный МАЛДИ адаптер.
Пример 2 иллюстрирует условия регенерации-очистки стальной МАЛДИ пластинки после ее использования по примеру 1. Полученная после этой процедуры пластинка может быть использована либо как стандартная МАЛДИ мишень, либо может быть повторно покрыта катионной пленкой по примеру 1.
Пример 3 иллюстрирует зависимость чувствительности МАЛДИ анализа синтетического 25-мерного олигонуклеотида смешанного состава Н33571 (5'-GTG TAA CTT AGA ACT ССА ТСТ TGA G) от содержания в растворе соли (NaCl).
МАЛДИ МС анализ олигонуклеотидов из солевых растворов практически невозможен без предварительных шагов, связанных с необходимостью их предварительного выделения из исходных смесей. Чаще всего для это используется обращенно-фазовая хроматография, резко усложняющая и существенно удорожающая такой анализ.
На Фиг.2А приведен МАЛДИ спектр олигонуклеотида Н33571 (5'-GTG TAA CTT AGA ACT ССА ТСТ TGA G), полученный при попытке анализа его раствора в 0.2 М NaCl без дополнительной обработки. Молекулярный ион искомого олигонуклеотида Н33571 (7655 Да, [М+Н]+) не наблюдается вообще, а спектр состоит из сложного набора сигналов, распределенных в широком диапазоне (7680-8200 Да) и соответствующих молекулярным ионам его натриевых солей, различающихся степенью замещения водородов на натрий в полифосфатном остатке. Таким образом, непосредственное наблюдение сигнала молекулярного иона олигонуклеотида Н33571 из 0.2 М раствора NaCl оказывается невозможным.
На профиле Б представлен МАЛДИ спектр той же смеси, полученной после обработки исходного раствора катионообменной смолой в аммониевой форме. Из него видно, что такая обработка (занимающая несколько минут на каждый образец) улучшает качество спектра, но не позволяет избавиться от набора интерферирующих пиков натриевых солей, что существенно затрудняет, а при недостаточном разрешении прибора делает невозможным наблюдение пика молекулярного иона.
На профиле В представлен МАЛДИ спектр с использованием стальной МАЛДИ мишени, покрытой пленкой на основе полиаллиламина с молекулярным весом 65кДа. Методика ее получения была полностью аналогична описанной для полиэтиленимина и приведена в примере 1. Важно отметить, что невзирая на наличие на поверхности МАЛДИ мишени тонкой пленки, проблем, вызванных недостаточной проводимостью поверхности, не наблюдалось. Необходимости изменения и дополнительной настройки параметров прибора, а также его перекалибровки не требовалось. Как видно из приведенного спектра, наблюдается практически исключительно пик молекулярного иона олигонуклеотида Н33571 (7655 Да) при отсутствии интерферирующих сигналов.
Пример 4 иллюстрирует использование МАЛДИ мишени, покрытой пленкой на основе полиэтиленимина, для анализа продуктов реакции генотипирования кодонов 531 и 533 гена Mycobacterium tuberculosis rpoB. Масс-спектр, приведенный на Фиг.3, демонстрирует возможности параллельного генотипирования двух кодонов (531 и 533) с высоким разрешением и скоростью. В сравнении с ранее опубликованной методикой [19], где шаг выдержки над ионообменной смолой занимал более одного часа, в приведенном протоколе весь цикл иммобилизации, отмывки и концентрации образца занимает не более 30 секунд.
Пример 5 иллюстрирует использование мишени, покрытой пленкой на основе полиэтиленимина, для анализа продуктов реакции мини-сиквенса по Сэнгеру Mycobacterium tuberculosis rpoB с использованием немеченых трифосфатов (Фиг.4). Применение ДНК-связывающих пленок и перенос (элюция) сорбированной ДНК в небольшое количество матрицы позволило увеличить общую чувствительность метода и сделало возможным чтение 16 оснований за один раз (кодоны 511-515), в сравнении с ранее зарегистрированной максимальной длиной чтения в 12 оснований [20].
Примеры реализации изобретения
Пример 1. Получение PEI-покрытой поверхности МАЛДИ мишени и общая методика применения к МАЛДИ анализу.
10 мкл раствора нитроцеллюлозы в метаноле смешивали с 10%-ным раствором полиэтиленимина со средней молекулярной массой 25000 Да. После интенсивного перемешивания в течение 10 секунд раствор оставляли отстаиваться в течение 5 минут, позволяя избытку полимера осесть в осадок. В дальнейшем использовали супернатант этого раствора. Для формирования рабочего покрытия (пленки) на чистую поверхность стальной МАЛДИ мишени вдоль размеченных точек наносили по 0.5 мкл этого супернатанта, позволяя ему свободно растечься в виде пятна с диаметром около 1-2 мм, и оставляли высыхать на воздухе при комнатной температуре в течение 5 минут, после чего помещали в сухую баню, где выдерживали еще 5 минут при температуре 50°С, и затем помещали в ванночку с деионизованной водой таким образом, что она на 2-3 мм покрывала всю пластинку, и помещали на шейкер, перемешивая на 10 качаниях в минуту в течение 3 минут. После отсушки на воздухе промытая МАЛДИ мишень была готова к работе. Для этого на нее в промаркированные места, содержащие высохшую пленку, наносили 1-2 мкл ферментативной реакционной смеси, имеющей в своем составе короткие, до 40 оснований фрагменты ДНК-продуктов ферментативной реакции. Через 2-3 секунды супернатант удаляли либо той же пипеткой, либо наконечником для нее, присоединенным к небольшому вакууму мембранного или водоструйного насоса. После этого на то же место наносили 1.5-2 мкл деионизованной воды, которая через несколько секунд таким же образом удалялась, и на это же место наносился раствор (0.5 мкл) МАЛДИ матрицы, представляющий собой 0.25 М водный раствор 3-оксипиколиновой кислоты, содержащий 0.02 М диаммонийцитрата. Пластинка высушивалась на воздухе при комнатной температуре, после чего с каждой из этих точек записывались МАЛДИ масс-спектры. Каждый спектр представлял собой накопление с 20 импульсов лазера, при этом накопление спектра велось в случайных местах пятна образца.
Пример 2. Регенерация-очистка использованной МАЛДИ пластинки по примеру 1.
Для регенерации и одновременной очистки пластинки после проведения анализа по примеру 1 пластинку помещают в 100 мл емкость, приливают 50 мл 80% ацетонитрила и обрабатывают ультразвуком (например, в ультразвуковой бане Coul-Palmer 8851, США) в течение 5 минут, раствор удаляют, пластинку протирают безворсовой салфеткой (например, Kimwipes EX-L, США), добавляют 50 мл ацетона, повторяют обработку и высушивают на воздухе. В дальнейшем регенерированная стальная пластинка может быть использована как стандартная МАЛДИ мишень, в соответствии с протоколами производителя, или быть повторно покрыта катионной пленкой по примеру 1.
Пример 3. Анализ 25-мерного олигонуклеотида (Н33571) из 0.2М раствора NaCl.
МАЛДИ спектр с использованием стальной МАЛДИ мишени, покрытой пленкой на основе полиаллиламина с молекулярным весом 65 кДа. Методика ее формирования была полностью аналогична описанной в примере 1. На выбранную точку на МАЛДИ мишени наносили 1 микролитр исходного раствора олигонуклеотида (Н33571, 5'-GTG ТАА СТТ AGA ACT ССА ТСТ TGA G) в 0.2 М NaCl. После удаления через 2 секунды супернатанта раствора исходного олигонуклеотида точка нанесения образца отмывалась в течение одной секунды еще 2 микролитрами воды, после чего на нее наносилась МАЛДИ матрица, состоящая из 0.3 М 3-гидроксипиколиновой кислоты и 20 мМ диаммонийцитрата. Масс-спектрометрический анализ олигонуклеотида Н33571 проводился после полного высыхания МАЛДИ мишени со стандартными значениями параметров прибора, оптимизированными для МАЛДИ МС олигонуклеотидов.
Пример 4. Подготовка ДНК для генотипирования гена антибиотикорезистентности Mycobacterium tuberculosis rpoB и проведение МАЛДИ анализа с использованием МАЛДИ мишени, покрытой полиэтиленимином.
Амплификация ДНК проводилась, как описано в [19]. Вкратце, ПЦР выполнялся в объеме 10 мкл, используя буфер, состоящий из 66 мМ TrisHCl (pH 9.0), 16.6 мМ (NH4)2SO4, 2.5 мМ MgCl2, 250 мM каждого дезокситрифосфата, 1 U Taq DNA полимеразы) и 10 пмоль каждого из двух праймеров для амплификации участка гена Mycobacterium tuberculosis rpoB (для сиквенса см. [19]). Амплификация велась по программе 94°С 2 мин - 30×(94°С, 30 сек - 61°С, 15 сек - 72°С, 20 сек) - 72°С, 5 мин. Полученную реакционную смесь обрабатывали 0.5 ед. щелочной фосфатазы арктической креветки при 37°С и 20 мин с последующей инактивацией фермента при 85°С /10 мин.
Для генотипирования доменов 531 и 533 гена Mycobacterium tuberculosis rpoB к реакционной смеси добавляли 2 ед. ДНК-полимеразы TermiPol, 20 пмоль каждого из двух олигонуклеотидных зондов (Mt531f, 5'-GAC ССА САА GCG CCG ACT G и Mt533r, 5'-AGA CCG CCG GGC CCC), а также эквимолярную смесь ddGTP, dATP, dTTP и dCTP (пo 0.2 мМ каждого), после чего зонды элонгировались по программе 70×(94°С, 20 сек - 59°С, 20 сек - 72°С 15 сек). После окончания элонгации 2 мкл смеси наносились на подготовленную МАЛДИ мишень, предварительно покрытую пленкой полиэтиленимина по примеру 1. После чего через 2 секунды супернатант удаляли либо той же пипеткой, либо носиком для нее, присоединенным к небольшому вакууму мембранного или водоструйного насоса. После этого на то же место наносили 1.5-2 мкл деионизованной воды, которая через несколко секунд таким же образом удалялась, и на это же место наносился раствор (0.5 мкл) МАЛДИ матрицы, представляющий собой 0.25 М водный раствор 3-гидроксипиколиновой кислоты, содержащий 0.02 М двухосновного цитрата аммония. Пластинка отсушивалась на воздухе при комнатной температуре, после чего с каждой из этих точек записывались МАЛДИ масс-спектры так же, как в примере 1. Регенерация пластинки проводилась, как описано в примере 2.
Пример 5. Мини-сиквенс ДНК-доменов 511-515 Mycobacterium tuberculosis rpoB с использованием РЕI покрытой МАЛДИ мишени. Для мини-сиквенса высокополиморфного участка доменов 511-515 гена Mycobacterium tuberculosis rpoB к полученному ПЦР-продукту добавлялось 10 пмоль праймера MT511f (cм. [19]) и смесь дидезокси и дезокси-трифосфатов в молярном соотношении 1:4. Элонгацию зонда проводили по протоколу, описанном в работе [20]. Выделение, концентрацию, удаление солей, последующий МАЛДИ анализ и регенерацию пластинки осуществляли, как описано в примере 4.