Результат интеллектуальной деятельности: ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ
Вид РИД
Изобретение
Родственные заявки
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США № 61/547637, поданной 14 октября 2011 года, и предварительной заявкой на выдачу патента США № 61/638990, поданной 26 апреля 2012 года. Раскрытия каждой из указанных выше заявок включены во всей их полноте в настоящий документ посредством ссылки.
Область техники, к которой относится изобретение
В настоящем документе представлены гетероциклические соединения, включая бензотиазолиловые, бензоксазолиловые и хиназолиловые соединения. Согласно определенным вариантам осуществления, соединения являются модуляторами семейства рецепторных тирозинкиназ III типа. Согласно другим вариантам осуществления, соединения являются модуляторами киназ CSF1R, FLT3, KIT и/или PDGFRβ. Также представлены композиции, содержащие соединения, и способы их использования. Представленные соединения применимы при лечении, профилактике или уменьшении интенсивности заболевания или нарушения, связанного с активностью киназ CSF1R, FLT3, KIT и/или PDGFRβ, или одного или нескольких симптомов, ассоциированных с такими заболеваниями или нарушениями.
Предпосылки создания настоящего изобретения
Протеинкиназы (PK) представляют собой ферменты, катализирующие фосфорилирование гидроксигрупп тирозиновых, сериновых и треониновых остатков белков. Рецепторные тирозинкиназы (RTK) представляют собой подсемейство протеинкиназ, которые играют ключевую роль в передаче сигналов клетками и вовлечены в процесс онкогенеза, включая пролиферацию, выживание, ангиогенез, прорастание и метастазирование клеток. Группа RTK, известная как семейство рецепторных тирозинкиназ III типа, которое включает в себя рецепторы PDGFRα, PDGFRβ, FLT3, KIT, VEGFR и CSF1R, вовлечена в различные пролиферативные и воспалительные заболевания.
CSF1R (также известный, как рецептор к макрофагальному колониестимулирующему фактору (M-CSFR), или fms) представляет собой рецептор к макрофагальному колониестимулирующему фактору (M-CSF, или CSF-1). Связывание лиганда CSF-1 с его рецептором вызывает димеризацию и аутофосфорилирование рецептора и приводит к активации каскадов передачи нисходящего сигнала, включая каскады PI3K/Akt и митоген-активируемой протеинкиназы. Активация CSF1R приводит к пролиферации, выживанию, подвижности и дифференцировке клеток моноцитарного/макрофагального происхождения, и, следовательно, играет роль в развитии нормальной ткани и иммунной защите. Активация CSF1R также приводит к пролиферации и дифференцировке предшественников остеокластов, а потому опосредует процесс резорбции кости.
Вследствие своей роли в биологии остеокластов, считается, что CSF1R является важной терапевтической мишенью при остеопорозе и воспалительном артрите. Например, повышенная передача сигналов M-CFS приводит к повышенной активности остеокластов, что приводит к потере костной массы, сопровождающей артрит, и другим видам воспалительной эрозии кости (см. Scott et al. Rheumatology 2000, 39: 122-132, Ritchlin et al. J. Clin. Invest. 2003, 111: 821-831). Поэтому ингибирование CSF1R является перспективным терапевтическим подходом к лечению артрита и других видов воспалительной эрозии кости, что дополнительно подтверждается данными об эффективности известных ингибиторов CSF1R, таких как Ki-20227 и GW2580, в моделях артрита на животных (см. Conwat et al. JPET 2008, 326:41-50 и Ohno et al. Eur. J. Immunol. 2008, 38:283-291). Дисрегуляцию развития остеокластов и нарушение баланса резорбции и формирования кости, лежащие в основе остеопороза, также могут подвергаться лечению модулятором CSF1R.
Повышенная экспрессия или активация CSF1R и/или его лигандов была обнаружена у пациентов с острым миелолейкозом, злокачественной опухолью предстательной железы, молочной железы, яичников, эндометрия, злокачественной опухолью ободочной и прямой кишки, злокачественной опухолью поджелудочной железы и целым рядом других видов злокачественных опухолей, и повышенное содержание M-CSF ассоциировано с неблагоприятным прогнозом при определенных видах злокачественных опухолей (см. Muller-Tidow et al. Clin Cancer Res, 2004, 10:1241-1249, Bauknecht et al. Cancer Detect. Prev., 1994, 18: 231-239; Baiocchi G et al. Cancer 1991, 67:990-996; Kirma et al Cancer Res. 2007; Sapi et al. Exp. Biol. Med., 2004, 229:1-11; Kluger et al. Clin. Canc. Res. 2004 10:173-177; Mroczko et al., Clin. Chem. Lab. Med. 2005 43:146-50 и Mroczko et al., Clin. Chim. Acta 2007, 380:208-212). Данные предполагают, что CSF1R может являться важной терапевтической мишенью для указанных солидных опухолей.
Ранние исследования связали повышенную экспрессию M-CSF с повышенной инфильтрацией лейкоцитами солидных опухолей при злокачественной опухоли молочной железы и яичников (Scholl et al. J. Natl. Cancer Inst. 1994, 86:120-126, Tang et al. J. Cell. Biochem. 1990, 44:189-198). Дальнейшие исследования показали, что M-CSF является одним из нескольких цитокинов, вовлеченных в рекрутинг ассоциированных с опухолью макрофагов (TAM), которые способствуют ангиогенезу опухоли и прогрессированию опухоли с метастазированием, и совсем недавно было показано, что находящийся на доклинических исследованиях ингибитор GW2580 ингибирует метастазирование опухоли и ангиогенез в экспериментах на мышах с ксенотрансплантатом опухоли (Priceman et al. Blood 2010 115(7):1461-1471). Также считается, что стимулированная активность остеокластов лежит в основе патофизиологии метастазирования в кости (Lipton, J. Support. Oncol. 2004 2:205-220). Метастатические поражения кости вызывают значительную локализованную потерю костной массы и приводят к скелетным осложнениям, симптомам, которые включают в себя боль в кости, переломы кости и гиперкальциемию. Поэтому, ингибирование CSF1R может обеспечивать терапию солидных опухолей и метастазирующей злокачественной опухоли, включая метастазирование в кость.
Другой представитель семейства PDGFR, FLT3 (также называемый Flk2), играет важную роль в пролиферации и дифференцировке стволовых гемопоэтических клеток, а активирующая мутация или сверхэкспрессия указанного рецептора обнаруживается при AML (см. Heinrich Mini-Reviews in Medicinal Chemistry 2004, 4(3):255-271, Kiyoi et al. Int J Hematol, 2005 82:85-92). Разрабатывается более дюжины известных ингибиторов FLT3, и некоторые из них обнаружили клинический эффект при AML (см. Levis et al. Int J Hematol. 2005 82:100-107). Рецептор FLT3 также экспрессируется у значительной части предшественников дендритных клеток, и стимулирование рецептора является причиной пролиферации и дифференцировки указанных предшественников в дендритные клетки (DC). Поскольку дендритные клетки являются основными инициаторами опосредованного Т-клетками иммунного ответа, включая аутореактивный иммунный ответ, ингибирование FLT3 представляет собой механизм подавления опосредованного DC воспалительного и аутоиммунного ответов. В одном исследовании было показано, что ингибитор FLT3 CEP-701 эффективно уменьшает потерю миелина при экспериментальном аутоиммунном энцефаломиелите (EAE), модели рассеянного склероза на мышах (см. Whartenby et al. PNAS 2005 102: 16741-16746). Высокое содержание лиганда FLT3 обнаруживается в сыворотке пациентов с лангергансоклеточным гистиоцитозом и системной красной волчанкой, что дополнительно вовлекает передачу сигналов FLT3 в дисрегуляцию предшественников дендритных клеток при указанных аутоиммунных заболеваниях (см. Rolland et al. J. Immunol. 2005 174:3067-3071).
KIT (или рецептор фактора стволовых клеток, или SCFR) является другим представителем семейства RTK, и наличие мутаций KIT является важным диагностическим маркером при желудочно-кишечных стромальных опухолях (GIST) (Duensing et al. Cancer Investigation 2004, 22(1):106-116). Gleevec® (иматиниба мезилат, или STI571), первый одобренный FDA ингибитор RTK, первоначально одобренный для лечения c-Abl-опосредованного хронического миелолейкоза, получил в 2002 г. одобрение FDA для лечения KIT-опосредованного GIST и подтвердил правильность молекулярного подхода к ингибированию KIT при лечении GIST (Giorgi and Verweij, Mol. Cancer Ther. 2005 4(3):495-501). Мутации рецептора KIT c приобретением патологических функций также ассоциированы с тучноклеточным/миелоидным лейкозом и семиномами/дисгерминомами (Blume-Jensen Nature 2001 411(17): 355-365). Мутации KIT также были идентифицированы при определенных меланомах, и KIT признается в качестве потенциальной терапевтической мишени при меланоме (Curtain et al. J Clin. Oncol. 2006 24(26):4340-4346).
По-прежнему существует потребность в идентификации малых молекул, которые ингибируют RTK, в частности, соединений, применимых для лечения CSF1R-, FLT3-, PDGFRβ- и/или KIT-опосредованных заболеваний.
Краткое описание сущности изобретения
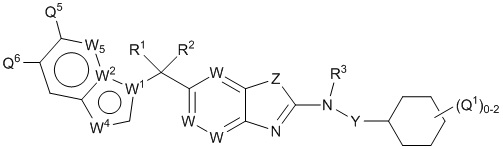
В настоящем документе описаны соединения формулы (I) или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров. Согласно определенным вариантам осуществления, соединения обладают активностью в качестве модуляторов киназ CSF1R, FLT3, KIT и/или PDGFRβ. Соединения применимы при терапевтическом лечении, в фармацевтических композициях и способах модуляции активности киназ CSF1R, FLT3, KIT и/или PDGFRβ, включая киназы CSF1R, FLT3, KIT и/или PDGFRβ дикого типа и/или мутантные формы. Согласно определенным вариантам осуществления, соединения, представленные в настоящем документе, обладают активностью в качестве модуляторов киназ CSF1R, FLT3, KIT и/или PDGFRβ. Согласно одному варианту осуществления, соединения для применения в композициях и способах, представленных в настоящем документе, характеризуются формулой (I).
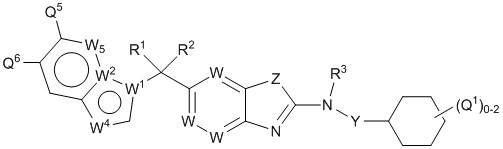
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I:
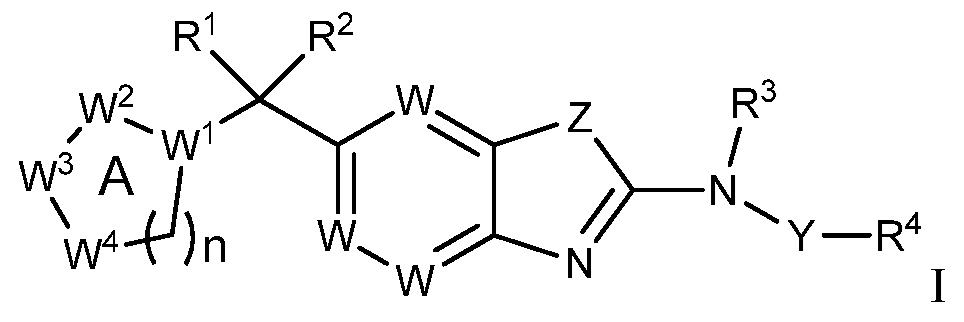
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, дейтерия, галогена, гидроксила и алкокси или R1 и R2 образуют вместе =O;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, дейтерий, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород, дейтерий или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, дейтерий, галоген, галогеналкил или алкил;
кольцо A представляет собой бициклический или трициклический арил, гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород, дейтерий или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9a и R10b, R9a и R10a, R9b и R10b, R9b и R10a, R10a и R11a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a или R11a представляет собой водород, дейтерий или алкил; и оставшаяся часть R9b или R11b представляет собой водород или Q2; или
iii) R9a и R10b, R9a и R10a, R9b и R10b, R9b и R10a, R10a и R11a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно конденсированное с фенильным кольцом, необязательно замещенным одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a или R11a представляет собой водород, дейтерий или алкил, и оставшаяся часть R9b или R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx,-RuORuN(Ry)(Rz), RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4,
где соединения выбирают таким образом, что: i) если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин; ii) если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин; iii) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой пиридинил, то кольцо A не представляет собой фенил, iv) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой пирролидин, и v) если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой пиперидин, 1,2,3,4-тетрагидроизохинолин или изоиндолин.
Согласно одному варианту осуществления, соединение, представленное в настоящем документе, характеризуется формулой (I). Согласно одному варианту осуществления, соединение, представленное в настоящем документе, представляет собой фармацевтически приемлемую соль соединения формулы (I). Согласно одному варианту осуществления, соединение, представленное в настоящем документе, представляет собой сольват соединения формулы (I). Согласно одному варианту осуществления, соединение, представленное в настоящем документе, представляет собой гидрат соединения формулы (I). Согласно одному варианту осуществления, соединение, представленное в настоящем документе, представляет собой пролекарство соединения формулы (I). Согласно одному варианту осуществления, соединение, представленное в настоящем документе, представляет собой клатрат соединения формулы (I).
Также представлены фармацевтические композиции, составленные для введения некоторым подходящим путем, и средства, содержащие эффективные концентрации одного или нескольких соединений, представленных в настоящем документе, или их фармацевтически приемлемых солей, сольватов, гидратов и пролекарств, и необязательно содержащие, по меньшей мере, один фармацевтический носитель.
Согласно одному варианту осуществления, фармацевтические композиции доставляют количества, эффективные для лечения, профилактики или уменьшения интенсивности заболеваний или нарушений, которые модулируются киназами CSF1R, FLT3, KIT и/или PDGFRβ или иным способом отвечают на их воздействие, или одного или нескольких их симптомов или причинных факторов. Такие заболевания или нарушения включают в себя без ограничения злокачественные опухоли, незлокачественные пролиферативные заболевания, атеросклероз, рестеноз после сосудистой ангиопластики, фибропролиферативные нарушения, воспалительные заболевания или заболевания, связанные с иммунной дисфункцией, инфекционные заболевания и/или заболевания или нарушения, поддающиеся лечению, профилактике или ведению заболевания путем модулирования активности, связывания или внутриклеточного распределения киназ, причем такие способы включают в себя введение субъекту, например, человеку, нуждающемуся в таком лечении, профилактике или ведении заболевания, терапевтически и профилактически эффективного количества соединения, представленного в настоящем документе. Такие заболевания или нарушения дополнительно описаны в настоящем документе.
В настоящем документе также представлены виды комбинированной терапии с использованием одного или нескольких соединений или композиций, представленных в настоящем документе, или их фармацевтически приемлемых производных в сочетании с другими фармацевтически активными средствами для лечения заболеваний и нарушений, описанных в настоящем документе.
Согласно одному варианту осуществления, такие дополнительные фармацевтические средства включают в себя одно или несколько из химиотерапевтических средств, анти-пролиферативных средств, противовоспалительных средств, иммуномодулирующих средств или иммуносупрессирующих средств.
Соединения или композиции, представленные в настоящем документе, или их фармацевтически приемлемые производные могут вводиться одновременно с введением, перед введением или после введения одного или нескольких из представленных выше средств. Также представлены фармацевтические композиции, содержащие соединение, представленное в настоящем документе, и одно или несколько из представленных выше средств.
Согласно определенным вариантам осуществления, в настоящем документе представлены способы лечения, профилактики или уменьшения интенсивности заболевания или нарушения, которое модулируется киназами CSF1R, FLT3, KIT и/или PDGFRβ, такими как киназы CSF1R, FLT3, KIT и/или PDGFRβ дикого типа и/или мутантные формы, или иным способом отвечает на их воздействие, или одного или нескольких их симптомов или причинных факторов.
При применении способов на практике, эффективные количества соединений или композиций, содержащих терапевтически эффективные концентрации соединения, которые включены в состав для системного введения, включая парентеральное, пероральное или внутривенное введение, или для локального или местного нанесения, вводят субъекту, проявляющему симптомы подлежащего лечению заболевания или нарушения. Количества являются эффективными для уменьшения интенсивности или устранения одного или нескольких симптомов заболевания или нарушения.
Дополнительно представлена фармацевтическая упаковка или набор, содержащие один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций. К такому(им) контейнеру(ам) может необязательно прилагаться памятка в форме, предписанной государственным органом, контролирующим производство, применение или продажу фармацевтических препаратов или биологических продуктов, в которой отражено одобрение органа на производство, применение или продажу для введения человеку. Упаковка или набор может быть снабжена информацией, относящейся к способу введения, последовательности введения лекарственного средства (например, раздельно, последовательно или параллельно) и т.п.
Указанные и другие аспекты объекта изобретения, описанного в настоящем документе, станут очевидны исходя из последующего подробного описания.
Краткое описание чертежей
На фиг. 1 отражено ингибирование in vivo CSF-1-зависимой пролиферации опухолевых клеток линии M-NFS-60 в брюшной полости бестимусных nu/nu мышей после введения одного из соединений, представленных в настоящем документе, характеризующихся формулой (I) (соединение А).
На фиг. 2 отражено ингибирование in vivo CSF-1-зависимой пролиферации опухолевых клеток линии M-NFS-60 в брюшной полости бестимусных nu/nu мышей после введения одного из соединений, представленных в настоящем документе, характеризующихся формулой I (соединение B).
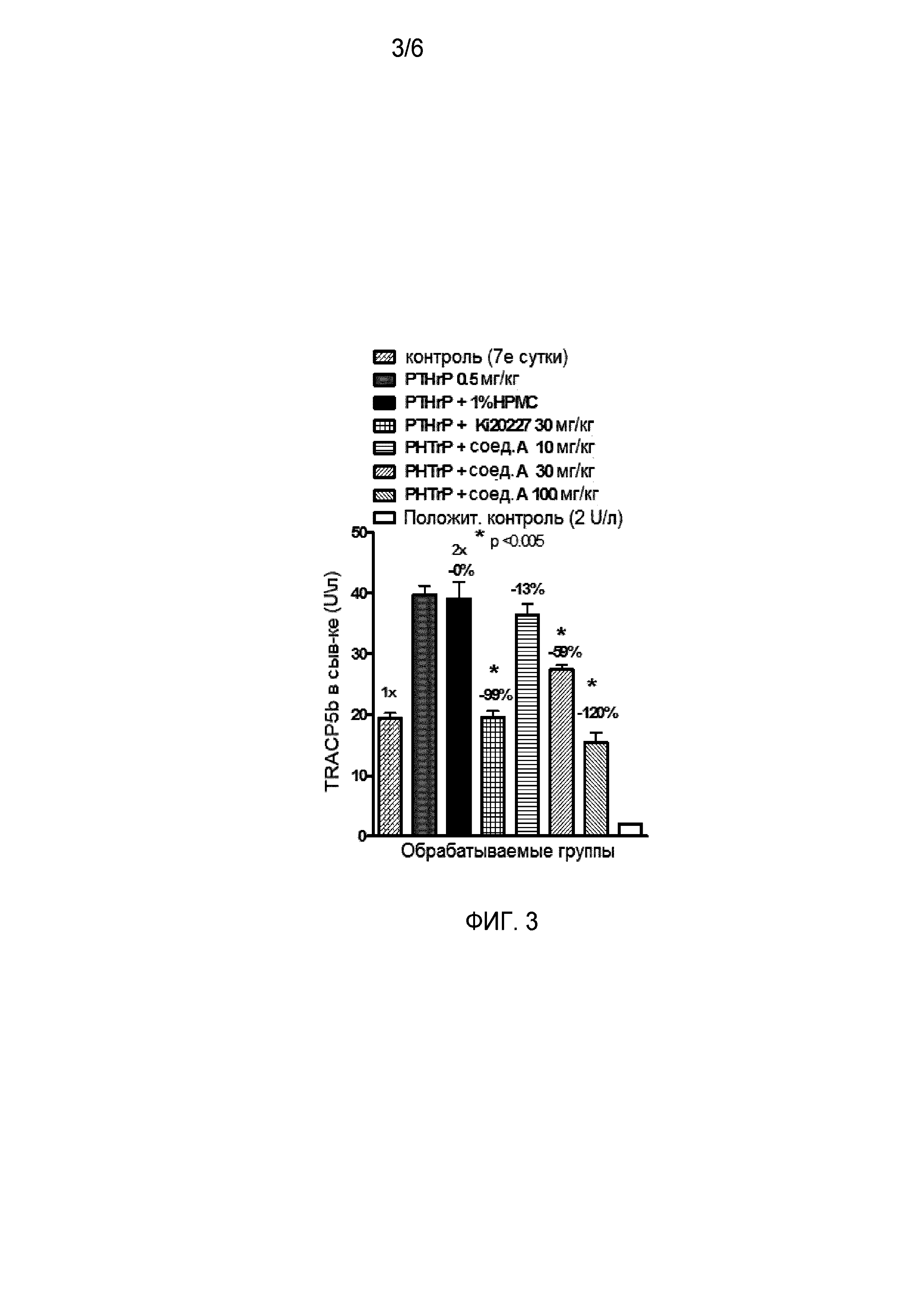
На фиг. 3 отражено ингибирование in vivo PTHrP-индуцированной гиперкальциемии после введения соединения A, характеризующегося формулой I, мышам линии BDF1, стимулированным 0,5 мг/кг рекомбинантного PTHrP дважды в сутки в течение семи суток, измеренное по содержанию в сыворотке маркера резорбции кости TRAPC5B.
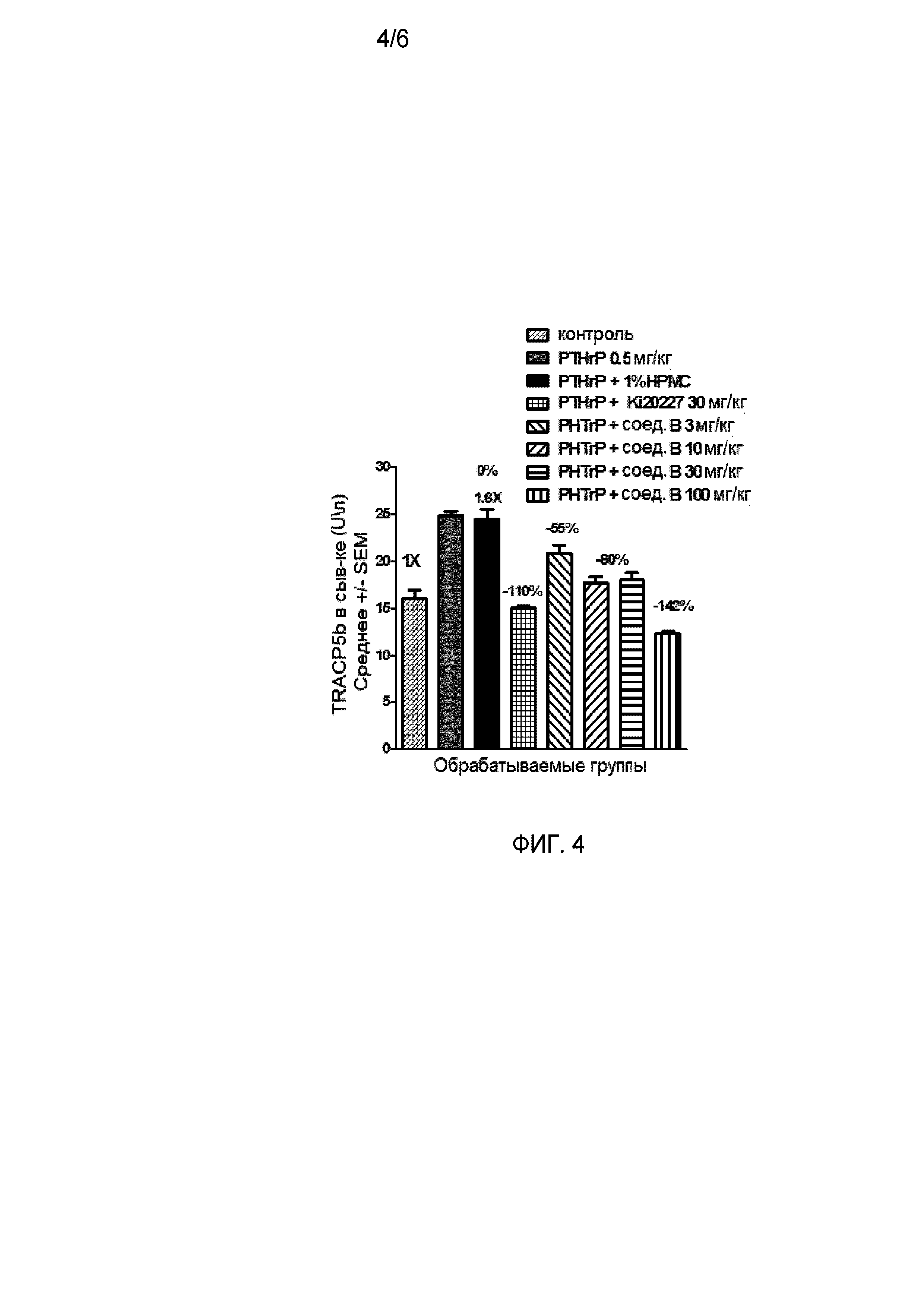
На фиг. 4 отражено ингибирование in vivo PTHrP-индуцированной гиперкальциемии после введения соединения B, характеризующегося формулой I, мышам линии BDF1, стимулированным 0,5 мг/кг рекомбинантного PTHrP дважды в сутки в течение семи суток, измеренное по содержанию в сыворотке маркера резорбции кости TRAPC5B.
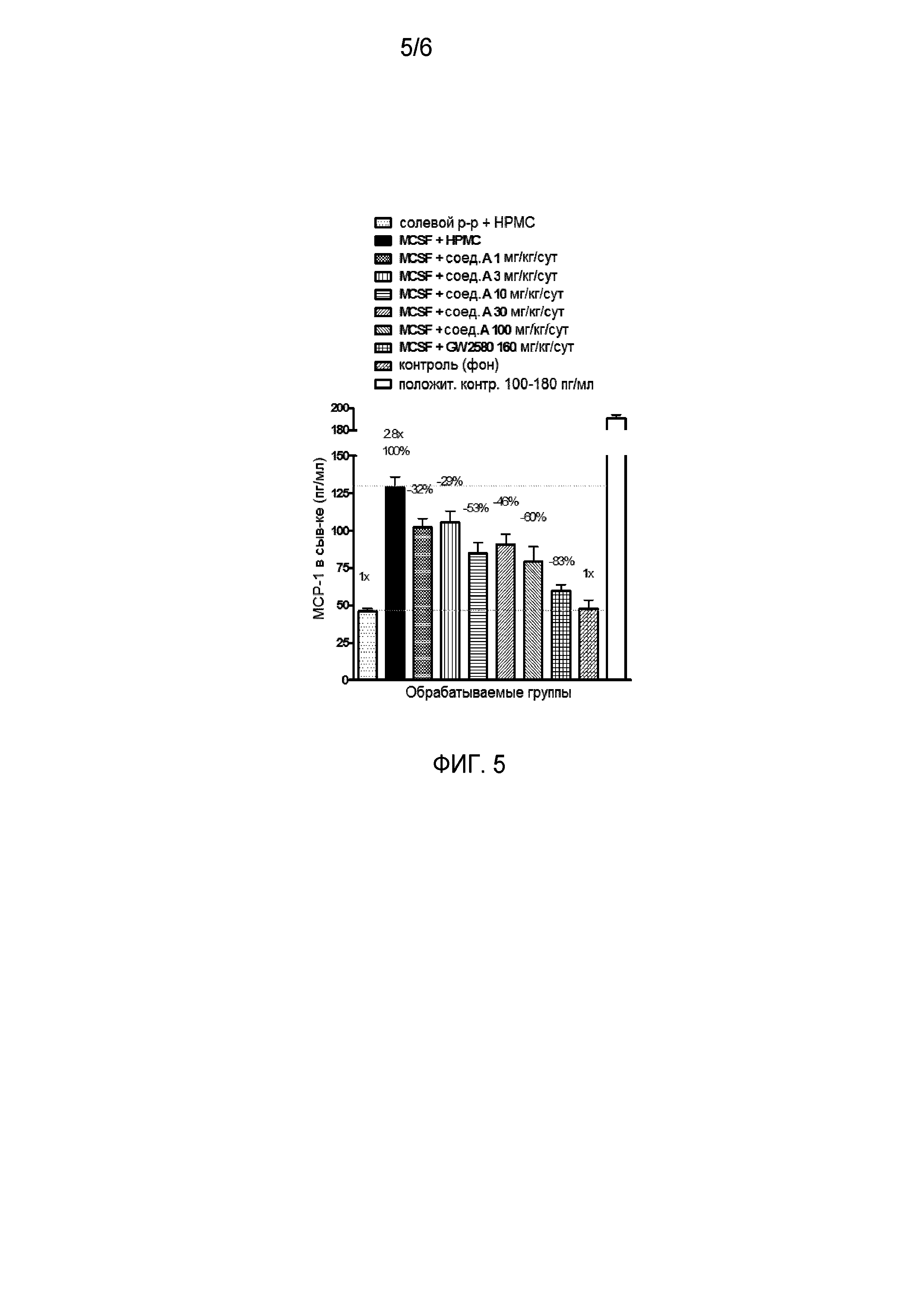
На фиг. 5 отражено ингибирование индукции MCP-1 in vivo у мышей линии Balb/c, получавших лечение соединением A, характеризующимся формулой I, до стимуляции M-CSF.
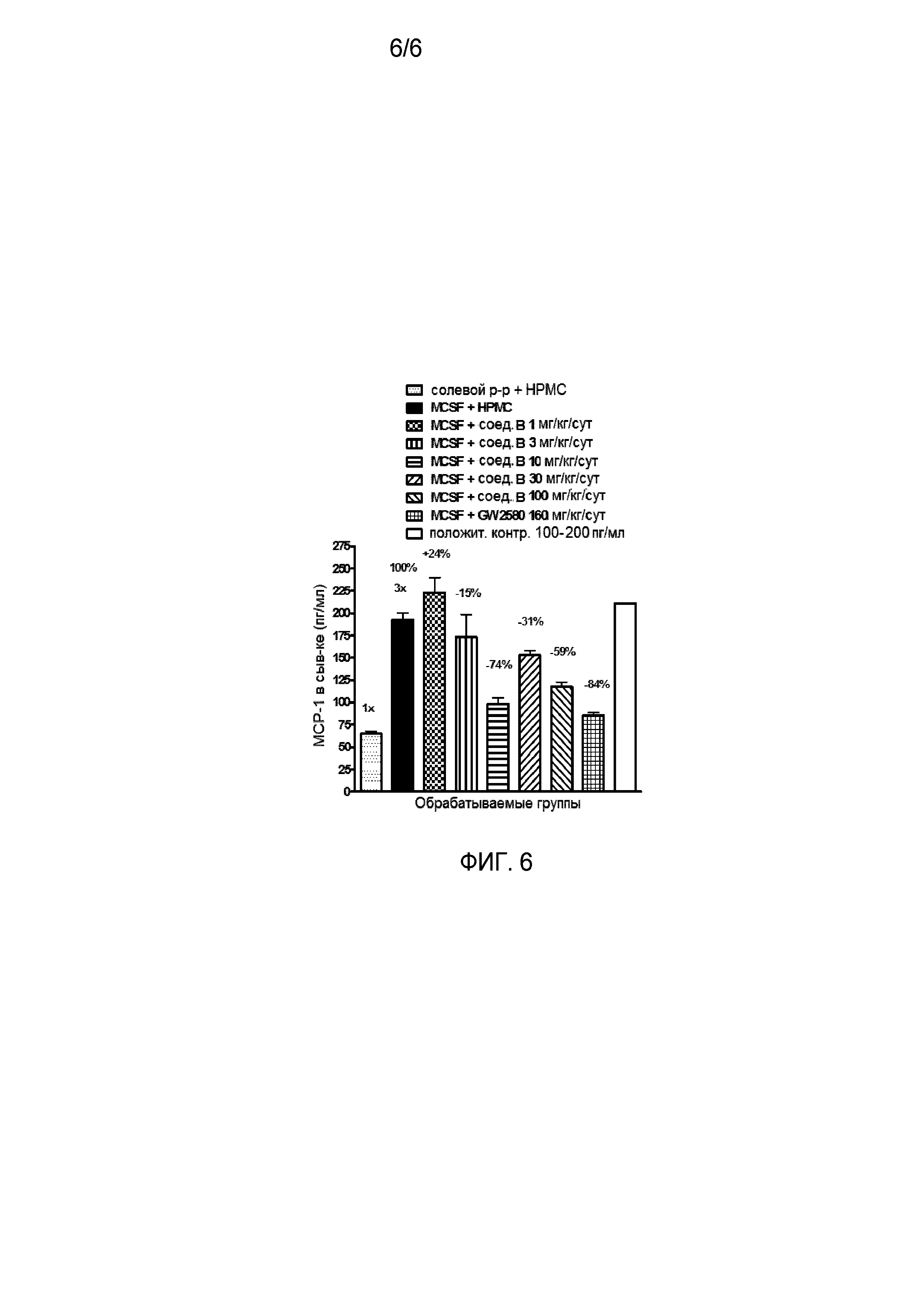
На фиг. 6 отражено ингибирование индукции MCP-1 in vivo у мышей линии Balb/c, получавших лечение соединением B, характеризующимся формулой I, до стимуляции M-CSF.
Подробное описание
В настоящем документе представлены соединения формулы (I), которые обладают активностью в качестве модуляторов киназ CSF1R, FLT3, KIT и/или PDGFRβ. Дополнительно представлены способы лечения, профилактики или уменьшения интенсивности заболеваний, которые модулируются киназами CSF1R, FLT3, KIT и/или PDGFRβ, и фармацевтические композиции и лекарственные формы, применимые в таких способах. Методы и композиции подробно описаны в представленных ниже разделах.
A. ОПРЕДЕЛЕНИЯ
Если не определено иное, то все технические и научные термины, используемые в настоящем документе, имеют то же значение, что и обычно понимаемое средним специалистом в данной области техники. Все патенты, заявки, опубликованные заявки и другие публикации включены во всей их полноте посредством ссылки. В том случае, когда для представленного в настоящем документе термина существует несколько определений, преимуществом обладают определения, представленные в этом разделе, если не указано иное.
«Алкил» относится к углеводородной группе с неразветвленной или разветвленной цепью, состоящей только из атомов углерода и водорода, не содержащей ненасыщенных связей, содержащей от одного до десяти, от одного до восьми, от одного до шести или от одного до четырех атомов углерода, и которая присоединена к остатку молекулы простой связью, например, метил, этил, н-пропил, 1-метилэтил (изо-пропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил) и т.п.
«Алкенил» относится к углеводородной группе с неразветвленной или разветвленной цепью, состоящей только из атомов углерода и водорода, содержащей, по меньшей мере, одну двойную связь, содержащую от двух до десяти атомов углерода, и которая присоединена к остатку молекулы простой связью или двойной связью, например, этенил, проп-1-енил, бут-1-енил, пент-1-енил, пента-1,4-диенил и т.п.
«Алкинил» относится к углеводородной группе с неразветвленной или разветвленной цепью, состоящей только из атомов углерода и водорода, содержащей, по меньшей мере, одну тройную связь, содержащую от двух до десяти атомов углерода, и которая присоединена к остатку молекулы простой связью или тройной связью, например, этинил, проп-1-инил, бут-1-инил, пент-1-инил, пент-3-инил и т.п.
«Алкилен» и «алкиленовая связь» относится к неразветвленной или разветвленной двухвалентной углеводородной цепи, состоящей только из углерода и водорода, не содержащей ненасыщенных связей, и содержащей от одного до восьми атомов углерода, например, метилен, этилен, пропилен, н-бутилен и т.п. Алкиленовая связь может быть присоединена к остатку молекулы через любые два атома углерода, находящихся в структуре цепи.
«Алкенилен» или «алкениленовая связь» относится к неразветвленной или разветвленной цепи ненасыщенного двухвалентного радикала, состоящей только из атомов углерода и водорода, содержащей от двух до восьми атомов углерода, где ненасыщенные связи присутствует только в виде двойных связей, и где двойная связь может существовать между любыми двумя атомами углерода в цепи, например, этенилен, проп-1-енилен, бут-2-енилен и т.п. Алкениленовая цепь может быть присоединена к остатку молекулы через любые два атома углерода, находящихся в структуре цепи.
«Алкинилен» или «алкиниленовая связь» относится к неразветвленной или разветвленной цепи ненасыщенного двухвалентного радикала, состоящей только из атомов углерода и водорода, содержащей от двух до восьми атомов углерода, где ненасыщенные связи присутствует только в виде тройных связей, и где тройная связь может существовать между любыми двумя атомами углерода в цепи, например, этинилен, проп-1-инилен, бут-2-инилен, пент-1-инилен, пент-3-инилен и т.п. Алкиниленовая цепь может быть присоединена к остатку молекулы через любые два атома углерода, находящихся в структуре цепи.
«Алкокси» относится к группе, содержащей формулу -OR, где R представляет собой алкил или галогеналкил. «Необязательно замещенный алкокси» относится к группе, содержащей формулу -OR, где R представляет собой необязательно замещенный алкил, определенный в настоящем документе.
«Амино» относится к радикалу, содержащему формулу -NR’R’’, где каждый из R’ и R’’ независимо представляет собой водород, алкил или галогеналкил. «Необязательно замещенный амино» относится к радикалу, содержащему формулу -NR’R’’, где один или оба из R’ и R’’ представляют собой необязательно замещенный алкил, определенный в настоящем документе.
«Арил» относится к группе карбоциклической кольцевой системы, включая моноциклические, бициклические, трициклические, тетрациклические C6-C18 кольцевые системы, где, по меньшей мере, одно из колец является ароматическим. Арил может быть полностью ароматическим, примерами которого являются фенил, нафтил, антраценил, аценафтиленил, азуленил, флуоренил, инденил и пиренил. Арил также может содержать ароматическое кольцо в комбинации с неароматическим кольцом, примерами которого являются аценафен, инден и флуоренил.
«Циклоалкил» относится к стабильной одновалентной моноциклической или бициклической углеводородной группе, состоящей только из атомов углерода и водорода, содержащей от трех до десяти атомов углерода, которая является насыщенной, например, циклопропил, циклобутил, циклопентил, циклогексил, декалинил, норборнан, норборнен, адамантил, бицикло[2.2.2]октан и т.п.
«Циклоалкенил» относится к стабильной одновалентной моноциклической или бициклической углеводородной группе, состоящей только из атомов углерода и водорода, содержащей от трех до десяти атомов углерода, которая является частично насыщенной. Примеры циклоалкенила включают в себя циклопропен, циклобутилен, циклопентен и циклогексен.
«Гало», «галоген» или «галид» относится к F, Cl, Br или I.
«Галогеналкил» относится к алкильной группе, согласно определенным вариантам осуществления, C1-6алкильной группе, в которой один или несколько атомов водорода заменены галогеном. Такие группы включают в себя без ограничения хлорметил, трифторметил 1-хлор-2-фторэтил, 2,2-дифторэтил, 2-фторпропил, 2-фторпропан-2-ил, 2,2,2-трифторэтил, 1,1-дифторэтил, 1,3-дифтор-2-метилпропил, 2,2-дифторциклопропил, (трифторметил)циклопропил, 4,4-дифторциклогексил и 2,2,2-трифтор-1,1-диметилэтил.
«Гетероцикл» или «гетероциклил» относится к стабильному 3-15-членному неароматическому кольцевому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. Согласно одному варианту осуществления, содержащий систему гетероциклических колец радикал может характеризоваться моноциклической, бициклической или трициклической кольцевой или тетрациклической кольцевой системой, которая может включать в себя конденсированные или соединенные мостиковой связью кольцевые системы; и атомы азота или серы в содержащем систему гетероциклических колец радикале могут быть необязательно окислены; атом азота необязательно может быть кватернизованным; и гетероциклильный радикал может быть частично или полностью насыщенным. Гетероциклическая кольцевая система может быть присоединена к основной структуре по любому гетероатому или атому углерода, что приводит к образованию стабильного соединения. Типичные гетероциклические радикалы включают в себя морфолинил, пиперидинил, пиперазинил, пиранил, пирролидинил, оксетанил, азетидинил, хинуклидинил, октагидрохинолизинил, декагидрохинолизинил, диметилцикло[3.2.1]октанил, азабицикло[2.2.2]октанил и т.д.
«Гетероарил» относится к гетероциклильной группе, как определено выше, которая является ароматической. Гетероарильная группа может быть присоединена к основной структуре по любому гетероатому или атому углерода, что приводит к образованию стабильного соединения. Примеры таких гетероарильных групп включают в себя без ограничения: фуранил, имидазолил, оксазолил, изоксазолил, пиримидинил, пиридинил, пиридазинил, тиазолил, тиенил и т.д.
«Гетероциклилалкил» относится к группе формулы -RaRe, где Ra представляет собой алкильную группу, определенную выше, и Re представляет собой гетероциклильную группу, определенную выше, где алкильная группа Ra может быть присоединена либо по атому углерода, либо по гетероатому гетероциклильной группы Re. Алкильная группа и гетероциклильная группа необязательно может быть замещена, как определено в настоящем документе.
«IC50» относится к количеству, концентрации или дозировке конкретного тестируемого соединения, при котором достигается 50% ингибирование максимального ответа, например, рост клеток или пролиферация, измеренное любым описанным в настоящем документе методом анализа in vitro или клеточным методом анализа.
«Оксо» относится к группе =O, присоединенной к атому углерода.
Фармацевтически приемлемые соли включают в себя без ограничения соли аминов, таких как без ограничения N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглукамин, прокаин, N-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин и трис(гидроксиметил)аминометан; соли щелочных металлов, таких как без ограничения литий, калий и натрий; соли щелочноземельных металлов, таких как без ограничения барий, кальций и магний; соли переходных металлов, таких как без ограничения цинк; и другие соли металлов, такие как без ограничения гидрофосфат натрия и динатрийфосфат; и также включают в себя без ограничения соли неорганических кислот, такие как без ограничения гидрохлориды и сульфаты; и соли органических кислот, такие как без ограничения ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты, фумараты и органические сульфонаты.
Если не указано иное, то используемый в настоящем документе термин «гидрат» означает предусмотренное настоящим документом соединение или его соль, которое дополнительно содержит стехиометрическое или нестехиометрическое количество воды, связанное нековалентными межмолекулярными силами.
Если не указано иное, то используемый в настоящем документе термин «сольват» означает сольват, образованный путем объединения одной или нескольких молекул растворителя с предусмотренным настоящим документом соединением. Термин «сольват» включает в себя гидраты (например, моногидрат, дигидрат, тригидрат, тетрагидрат и т.п.).
Используемый в настоящем документе «по существу чистый» означает достаточно однородный, чтобы не содержать легко определимых примесей, определяемых стандартными способами анализа, такими как тонкослойная хроматография (TLC), электрофорез в геле, высокоэффективная жидкостная хроматография (HPLC) и масс-спектрометрия (MS), используемыми специалистами в данной области техники для определения такой чистоты, или достаточно чистый, чтобы дальнейшая очистка явно не изменила физические и химические свойства вещества, такие как ферментативная и биологическая активность. Способы очистки соединений с получением по существу химически чистых соединений известны специалистам в данной области техники. Тем не менее по существу химически чистое соединение может быть смесью стереоизомеров. В таких случаях дальнейшая очистка может усиливать специфическую активность соединения.
Если в настоящем документе конкретно не отмечено иное, то следует понимать, что замещение может происходить по любому атому алкильной, алкенильной, алкинильной, циклоалкильной, гетероциклильной, арильной или гетероарильной группы.
Если конкретно не отмечено иное, то в случае, когда соединение может допускать альтернативные таутомерные, региоизомерные и/или стереоизомерные формы, подразумевается, что все альтернативные изомеры охватываются объемом заявленного объекта изобретения. Например, если соединение описано как содержащее одну из двух таутомерных форм, то подразумевается, что будут охвачены оба таутомера.
Таким образом, представленные в настоящем документе соединения могут быть энантиомерно чистыми, или представлять собой стереоизомерныеи или диастереоизомерные смеси.
Следует понимать, что представленные в настоящем документе соединения могут содержать хиральные центры. Такие хиральные центры могут принимать либо (R)-, либо (S)-конфигурацию, или могут представлять собой их смеси. Следует понимать, что хиральные центры предусмотренных настоящем документом соединений могут подвергаться эпимеризации in vivo. В этой связи, специалисту в данной области техники следует понимать, что для соединений, которые подвергаются эпимеризации in vivo, введение соединения в его (R)-форме эквивалентно введению соединения в его (S)-форме.
Оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)-изомеры могут быть получены с применением хиральных синтонов или хиральных реагентов, или расщеплены с применением традиционных технологий, таких как хроматография на хиральной неподвижной фазе.
Используемый в настоящем документе термин «изотопная композиция» относится к количеству каждого изотопа данного атома, и «природная изотопная композиция» относится к изотопной композиции или составу природного происхождения для данного атома. Атомы, характеризующиеся своей нейтральной изотопной композицией, в настоящем документе также могут называться «необогащенными» атомами. Если не указано иное, то подразумевается, что атомы перечисленных в настоящем документе соединений представляют любой стабильный изотоп такого атома. Например, если не отмечено иное, и если положение конкретно обозначено как «H» или «водород», то следует понимать, что положение включает в себя водород в его природной изотопной композиции.
Используемый в настоящем документе термин «изотопно обогащенный» относится к атому, содержащему изотопную композицию, отличную от природной изотопной композиции такого атома. «Изотопно обогащенный» также может относиться к соединению, включающему в себя, по меньшей мере, один атом, содержащий изотопную композицию, отличную от природной изотопной композиции такого атома.
Используемый в настоящем документе термин «изотопное обогащение» относится к процентному содержанию включенного в молекулу количества конкретного изотопа данного атома вместо природного изотопного состава такого атома. Например, обогащение дейтерием 1% в данном положении означает, что 1% молекул в данном образце содержит дейтерий при заданном положении. Поскольку распространение дейтерия природного происхождения равно приблизительно 0,0156%, обогащение дейтерием по любому положению соединения, синтезированного с использованием необогащенных исходных материалов, равно приблизительно 0,0156%. Изотопное обогащение предусмотренных в настоящем документе соединений может быть определено с использованием традиционных аналитических способов, известных среднему специалисту в данной области техники, включая масс-спектрометрию и ядерную магнитно-резонансную спектроскопию.
Если число любого конкретного заместителя не указано (например, галогеналкил), то может присутствовать один или несколько заместителей. Например, «галогеналкил» может включать в себя один или несколько одинаковых или разных атомов галогена.
В представленном описании, если существует любое различие между химическим названием и химической структурой, то структура имеет преимущественную силу.
Термин «противораковые средства» относится к антиметаболитам (например, 5-фторурацил, меотрексат, флударабин), антимикротубулиновым средствам (например, алкалоиды барвинка, такие как винкристин, винбластин; таксаны, такие как паклитасксел и доцетаксел), алкилирующим средствам (например, циклофосфамид, мелфалан, кармустин, нитрозомочевины, такие как бисхлорэтилнитрозомочевина и гидроксимочевина), средствам, содержащим платину (например, цисплатин, карбоплатин, оксалиплатин, JM-216 илисатраплатин, CI-973), антрациклинам (например, доксорубицин и даунорубицин), противоопухолевым антибиотикам (например, митомицин, идарубицин, адриамицин и дауномицин), ингибиторам топоизомеразы (например, этопозид и камптотецины), средствам антиангиогенеза (например, Сутент® и Бевацизумаб) или любым другим цитотоксическим средствам (например, фосфат эстрамустина, преднимустин), гормонам или агонистам гормонов, антагонистам, частичным агонистам или частичным антагонистам, ингибиторам киназ и радиационной терапии.
Термин «противовоспалительные средства» относится к ингибиторам матриксных металлопротеиназ, ингибиторам провоспалительных цитокинов (например, анти-TNF молекулы, растворимые рецепторы TNF и IL-1), нестероидным противовоспалительным лекарствам (NSAID), таким как ингибиторы синтазы простагландинов (например, салицилат холина магния и салициловая кислота), ингибиторам COX-1 или COX-2, агонистам глюкокортикоидных рецепторов, таким как кортикостероиды, метилпреднизон, преднизон и кортизон.
Если не указано иное, то используемые в настоящем документе аббревиатуры для защитных групп, аминокислот и других соединений, соответствуют своему обычному повсеместному использованию, общепризнанным аббревиатурам или IUPAC-IUB Commission on Biochemical Nomenclature (см., Biochem. 1972, 11:942-944).
В. СОЕДИНЕНИЯ
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I:
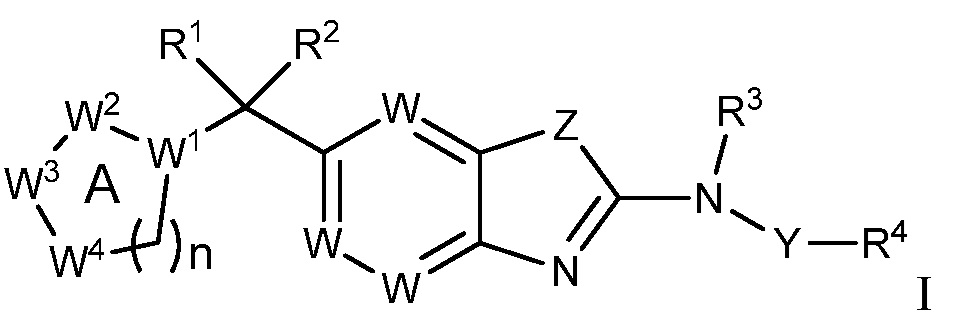
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, дейтерия, галогена, гидроксила и алкокси, или R1 и R2 образуют вместе =O;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, дейтерий, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород, дейтерий или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, дейтерий, галоген или алкил;
кольцо A представляет собой моноциклический, бициклический или трициклический арил, гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, дейтерий, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a, R10a и R11a независимо представляет собой водород, дейтерий или алкил; и каждая оставшаяся часть R9b, R10b и R11b независимо представляет собой водород, дейтерий, галоген или алкил; или
iii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно конденсированное с фенильным кольцом, необязательно замещенным одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a и R9b или оставшаяся часть R11a и R11b независимо представляет собой водород, дейтерий или алкил;
каждая Q2 независимо представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx,-RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4,
где соединения выбирают таким образом, что: i) если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил, и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин; ii) если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин; iii) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой пиридинил, то кольцо A не представляет собой фенил, iv) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой пирролидин, и v) если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой пиперидин, 1,2,3,4-тетрагидроизохинолин или изоиндолин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, гидроксила и алкокси, или R1 и R2 образуют вместе =O;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a, R10a и R11a независимо представляет собой водород или алкил; и каждая оставшаяся часть R9b, R10b и R11b независимо представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4,
где соединения выбирают таким образом, что если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил, и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I, где кольцо A представляет собой гетероарил, n равно 1, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I, где кольцо A представляет собой гетероарил, W1 представляет собой N, n равно 1 или 2, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I, где кольцо A представляет собой гетероарил, W1 представляет собой C или N, n равно 1 или 2, при условии, что если W1 представляет собой C, n равно 1, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I, где кольцо A представляет собой бициклический или трициклический гетероарил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, гидроксила и алкокси;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a, R10a и R11a независимо представляет собой водород или алкил; и каждая оставшаяся часть R9b R10b и R11b независимо представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4,
где соединения выбирают таким образом, что если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил, и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин.
Согласно определенным вариантам осуществления, соединения формулы I выбирают таким образом, что если W представляет собой CH, W1 представляет собой C, Z представляет собой NH, R1 и R2 образуют вместе =O и q равно 0, то кольцо A не представляет собой фенил. Согласно определенным вариантам осуществления, соединения формулы I выбирают таким образом, что если i) W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин и ii) если W представляет собой CH, W1 представляет собой C, Z представляет собой NH, R1 и R2 образуют вместе =O и q равно 0, то кольцо A не представляет собой фенил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения, выбирают таким образом, что если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой 6-членное гетероарильное кольцо.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения, выбирают таким образом, что если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A представляет собой конденсированное бициклическое кольцо.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения, выбирают таким образом, что если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой 5-членный гетероциклил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой пиридинил, то кольцо A не представляет собой фенил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой азотсодержащий гетероарил, то кольцо A не представляет собой фенил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой моноциклический гетероарил, то кольцо A не представляет собой фенил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой пирролидин.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой азотсодержащий гетероциклил.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой пиперидин, 1,2,3,4-тетрагидроизохинолин или изоиндолин.
Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой азотсодержащий гетероциклил. Согласно определенным вариантам осуществления, представленные в настоящем документе соединения выбирают таким образом, что если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой гетероциклил.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I, где каждый из R1 и R2 независимо выбирают из водорода и галогена. Согласно определенным вариантам осуществления, каждый из R1 и R2 представляет собой водород. Согласно определенным вариантам осуществления, R1 представляет собой водород, и R2 представляет собой галоген. Согласно определенным вариантам осуществления, каждый из R1 и R2 представляет собой галоген. Согласно определенным вариантам осуществления, каждый из R1 и R2 независимо выбирают из водорода и фтора. Согласно определенным вариантам осуществления, R1 представляет собой алкокси, и R2 представляет собой водород. Согласно определенным вариантам осуществления, R1 представляет собой гидрокси, и R2 представляет собой водород.
Согласно определенным вариантам осуществления, R3 представляет собой водород или алкил. Согласно определенным вариантам осуществления, R3 представляет собой водород или метил. Согласно определенным вариантам осуществления, R3 представляет собой водород.
Согласно определенным вариантам осуществления, R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь и каждый Rx независимо представляет собой водород или алкил. Согласно определенным вариантам осуществления, R4 представляет собой циклоалкил или гетероциклил, где R4 необязательно замещен одной или несколькими Q1.
Согласно определенным вариантам осуществления, R4 представляет собой циклогексил, тетрагидрофурил, пиридинил, фенил, морфолинил, циклопентил, пиперидинил, тетрагидро-2H-пиранил или 2,3-дигидро-1H-инденил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь; и каждый Rx независимо представляет собой водород или алкил.
Согласно определенным вариантам осуществления, R4 представляет собой циклоалкил, необязательно замещенный одной, двумя или тремя группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, и каждый Rx независимо представляет собой водород или алкил.
Согласно определенным вариантам осуществления, R4 представляет собой циклогексил, необязательно замещенный гидроксилом.
Согласно определенным вариантам осуществления, Y представляет собой прямую связь или -(CR5R6)q-; каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил. Согласно определенным вариантам осуществления, Y представляет собой прямую связь или -(CR5R6)q-; каждый из R5 и R6 независимо представляет собой водород, алкил или гидроксиалкил. Согласно определенным вариантам осуществления, Y представляет собой прямую связь, -CH2-, -CH(CH3)- или -CH(CH2OH)-.
Согласно определенным вариантам осуществления, Z представляет собой O, S или NH. Согласно определенным вариантам осуществления, Z представляет собой O или S.
Согласно определенным вариантам осуществления, каждый W независимо представляет собой CR8 или N, и R8 представляет собой водород, галоген или алкил. Согласно определенным вариантам осуществления, каждый W представляет собой CR8, и R8 представляет собой водород или алкил. Согласно определенным вариантам осуществления, каждый W представляет собой CH.
Согласно определенным вариантам осуществления, кольцо A представляет собой арил или гетероарил, необязательно замещенный одним или двумя заместителями, выбранными из Q2, где Q2 представляет собой гетероарил, -RuC(J)N(Ry)(Rz) или -RuN(Rx)C(J)Rx, причем если Q2 представляет собой гетероарил, он необязательно замещен одним или несколькими алкилами;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил; и
J представляет собой O, NRx или S.
Согласно определенным вариантам осуществления, кольцо A представляет собой гетероарил, необязательно замещенный одним или двумя заместителями, выбранными из Q2, где Q2 представляет собой гетероарил, -RuC(J)N(Ry)(Rz) или -RuN(Rx)C(J)Rx, причем если Q2 гетероарил, он необязательно замещен одним или несколькими алкилами;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил; и
J представляет собой O, NRx или S.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I:
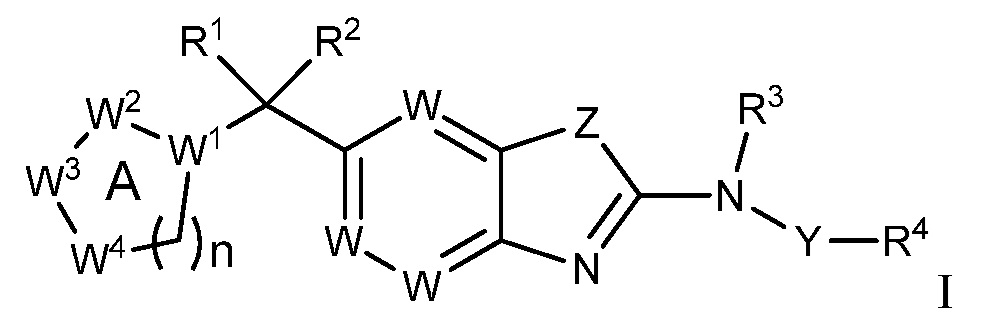
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, гидроксила и алкокси, или R1 и R2 образуют вместе =O;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой бициклический или трициклический гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a, R10a и R11a независимо представляет собой водород или алкил; и каждая оставшаяся часть R9b, R10b и R11b независимо представляет собой водород, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно конденсированное с фенильным кольцом, необязательно замещенным одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a и R9b или оставшаяся часть R11a и R11b независимо представляет собой водород или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4,
причем соединение выбрано таким образом, что если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой 1,2,3,4-тетрагидроизохинолин или изоиндолин.
Согласно определенным вариантам осуществления, W1 представляет собой N. Согласно определенным вариантам осуществления, W1 представляет собой C.
Согласно определенным вариантам осуществления, W2 представляет собой N или CR9b, где R9b представляет собой водород оксо, гидроксил или алкил. Согласно определенным вариантам осуществления, W3 представляет собой N или CR10b, где R10b представляет собой водород или алкил. Согласно определенным вариантам осуществления, W4 представляет собой N или CR11b, где R11b представляет собой водород или алкил.
Согласно определенным вариантам осуществления, W2 представляет собой CR9b, W3 представляет собой CR10b, W4 представляет собой N или CR11b, где R9b и R10b вместе с атомами углерода, по которым они замещены, образуют арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2, R11b представляет собой водород или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S; и
каждый t независимо представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, W2 представляет собой CR9b, W3 представляет собой CR10b, W4 представляет собой N, если R9b и R10b вместе с атомами углерода, по которым они замещены, образуют арильное или гетероарильное кольцо, необязательно замещенное одной или двумя группами, выбранными из Q2, где значение Q2 определено по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая Q2 независимо представляет собой галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероциклил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S; и
каждый t независимо представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, n равно 1 или 2. Согласно определенным вариантам осуществления, n равно 1. Согласно определенным вариантам осуществления, n равно 2.
Согласно определенным вариантам осуществления, q представляет собой целое число от 0 до 4. Согласно определенным вариантам осуществления, q равно 0-3. Согласно определенным вариантам осуществления, q равно 0-2. Согласно определенным вариантам осуществления, q равно 0, 1 или 2. Согласно определенным вариантам осуществления, q равно 0. Согласно определенным вариантам осуществления, q равно 1. Согласно определенным вариантам осуществления, q равно 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы I или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, алкокси и галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой прямую связь или -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; каждый остаток R9a, R10a и R11a независимо представляет собой водород или алкил; каждый остаток R9b R10b и R11b независимо представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II
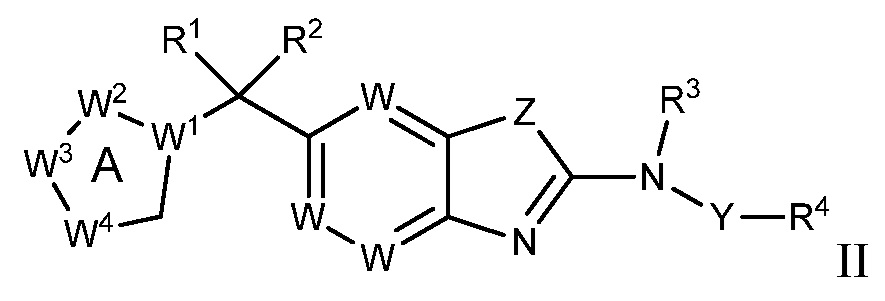
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, алкокси и галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; остаток R9a или R11a представляет собой водород или алкил; и оставшаяся часть R9b или R11b независимо представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2;
где соединения выбирают таким образом, что если i) W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин и ii) если W представляет собой CH, W1 представляет собой C, Z представляет собой NH, R1 и R2 образуют вместе =O и q равно 0, то кольцо A не представляет собой фенил.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2, n равно 1, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II
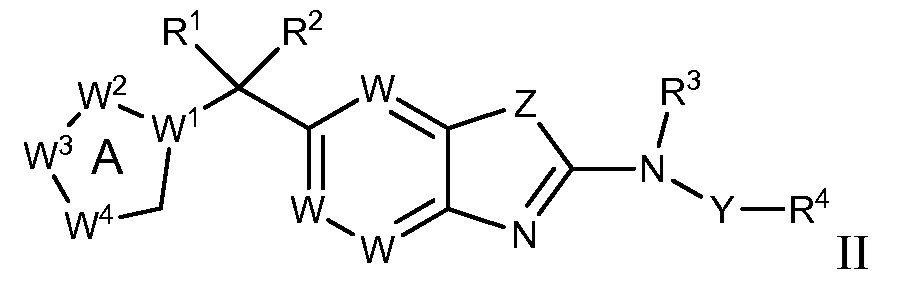
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, алкокси и галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; каждый остаток R9a, R10a и R11a независимо представляет собой водород или алкил; каждый остаток R9b R10b и R11b независимо представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, соединение формулы II выбрано таким образом, что: i) если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин; ii) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой пирролидин, и iii) если Z представляет собой N, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой изоиндолин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где кольцо A представляет собой бициклический или трициклический гетероарил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, алкокси и галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой моноциклический, бициклический или трициклический гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; каждый остаток R9a, R10a и R11a независимо представляет собой водород или алкил, каждый остаток R9b R10b и R11b независимо представляет собой водород, галоген или алкил; или
iii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно конденсированное с фенильным кольцом, необязательно замещенным одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2, и каждая оставшаяся часть R9a и R9b или оставшаяся часть R11a и R11b независимо представляет собой водород или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2;
где соединения выбирают таким образом, что если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, алкокси и галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NR7;
R7 представляет собой водород или алкил;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой бициклический гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой CR10b;
W4 представляет собой N;
R9a, R9b, и R10b выбирают следующим образом:
R9a и R10b или R9b и R10b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; остаток R9a и R10b представляет собой водород или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz),-RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где W4 представляет собой N, W2 представляет собой N, NR9a или CR9b, W3 представляет собой CR10b и R9a и R10b или R9b и R10b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы II, где R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx; Y представляет собой -(CR5R6)q-;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; и
q равно 0, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III
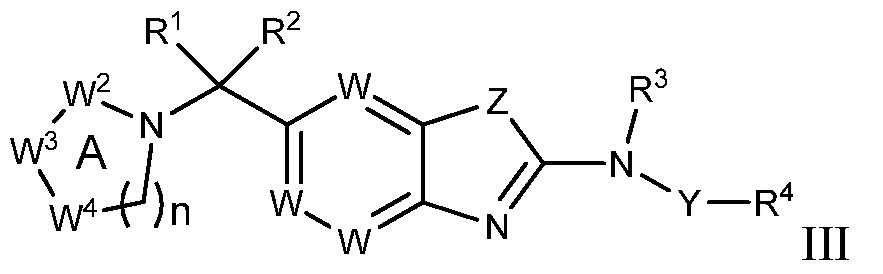
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, алкокси и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III
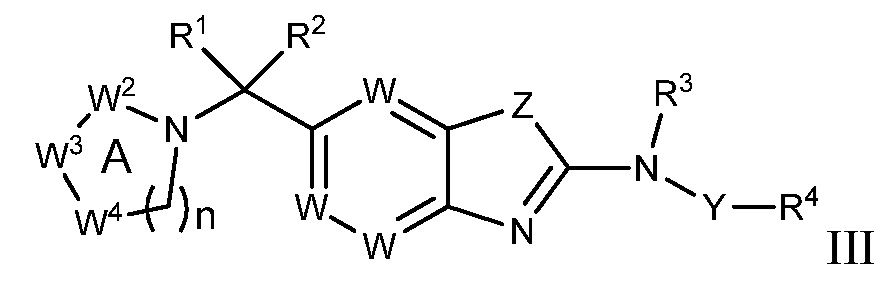
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, алкокси и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, соединение формулы III выбрано таким образом, что: i) если W представляет собой CH, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин; ii) если W представляет собой CH, Z представляет собой NH, R1 и R2 образуют вместе =O, q равно 0, и R4 представляет собой фенил, то кольцо A не представляет собой пирролидин; и iii) если Z представляет собой NH, один из R1 и R2 представляет собой метил, а другой из R1 и R2 представляет собой H, q равно 0, и R3 представляет собой пиридин, и W1 представляет собой N, то кольцо A не может представлять собой пиперидин, 1,2,3,4-тетрагидроизохинолин или изоиндолин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где кольцо A представляет собой гетероарил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где кольцо A представляет собой бициклический или трициклический гетероарил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, алкокси и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой моноциклический, бициклический или трициклический гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx,-RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена, алкокси и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой моноциклический, бициклический или трициклический гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4;
где соединения выбирают таким образом, что i) если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин и ii) W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где n равно 1, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил; n равно 1, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9b, R10b и R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b и R10b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или двумя группами, выбранными из Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
R11b представляет собой водород;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b и R10b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или двумя группами, выбранными из Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
R11b представляет собой водород;
n равно 1 или 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b и R10b, вместе с атомами углерода, к которым они присоединены, образуют арильное или гетероарильное кольцо, необязательно замещенное одной или двумя группами Q2; каждая Q2 независимо представляет собой галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероциклил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где циклоалкил, гетероарил, гетероциклил необязательно замещены одним или несколькими алкилами;
R11b представляет собой водород или Q2;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b и R10b, вместе с атомами углерода, к которым они присоединены, образуют арильное или гетероарильное кольцо, необязательно замещенное одной или двумя группами Q2; каждая Q2 независимо представляет собой галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероциклил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где циклоалкил, гетероарил, гетероциклил необязательно замещены одним или несколькими алкилами;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 2.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9b и R10b или R10b и R11b, образуют вместе с атомами, которые ими замещены, арильное, гетероарильное кольцо, необязательно замещенное одной или двумя группами, выбранными из Q2; и оставшаяся часть R9b или R11b представляет собой водород или Q2;
каждая Q2 представляет собой водород, галоген, алкокси, тетразол или пиразол, где тетразольные и пиразольные кольца необязательно замещены одним или несколькими алкилами;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода, галогена и гидроксила;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W2 представляет собой N или CR9b;
W3 представляет собой N или CR10b;
W4 представляет собой N или CR11b;
R9b, R10b и R11b выбирают следующим образом:
i) каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9b и R10b или R10b и R11b, образуют вместе с атомами, которые ими замещены, арильное, гетероарильное кольцо, необязательно замещенное одной или двумя группами, выбранными из Q2; и оставшаяся часть R9b, R10b или R11b представляет собой водород или алкил;
каждая Q2 представляет собой водород, галоген, алкокси, тетразол или пиразол, где тетразольные и пиразольные кольца необязательно замещены одним или несколькими алкилами;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы III, где W4 представляет собой N, W2 представляет собой CR9b, W3 представляет собой CR10b, R9b и R10b образуют вместе с атомами, к которым они присоединены, арильное или гетероарильное кольцо, необязательно замещенное одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV
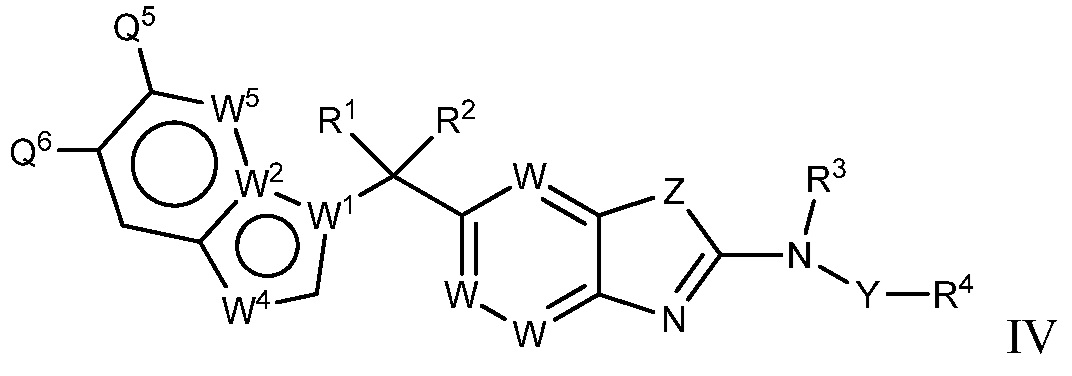
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где значения переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W1 представляет собой N или C;
W2 представляет собой N или CR9b;
R9b представляет собой водород или Q2;
W4 представляет собой N или CR11b;
W5 представляет собой N или CR13;
каждый из R11b и R13 независимо представляет собой водород или Q2;
Q2 представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где и R1, и R2 представляет собой водород. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждый из R9b и R11b независимо представляет собой водород, алкил или галогеналкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, каждый из R11b и R13 независимо представляет собой водород, галоген или алкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где R4 представляет собой циклоалкил.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждый из R9b и R11b независимо представляет собой водород, галоген или алкил и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx; каждый Ru независимо представляет собой алкилен или прямую связь; каждый Rx независимо представляет собой водород или алкил; и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь; каждый Rx независимо представляет собой водород или алкил, каждый из R11b и R13 независимо представляет собой водород, галоген или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W1 представляет собой N или C;
W2 представляет собой N или CR9b;
R9b представляет собой водород или алкил;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W1 представляет собой N или C;
W2 представляет собой N или CR9b;
R9b представляет собой водород или алкил;
W4 представляет собой N или CR11b;
R11b представляет собой водород или Q2;
Q2 представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, циклоалкенил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W1 представляет собой N или C;
W2 представляет собой N или CR9b;
R9b представляет собой водород или алкил;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J) RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx) Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где и R1, и R2 представляет собой водород и другие переменные описаны здесь далее.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, где R11b и R13 каждый независимо представляет собой водород, галоген или алкил и другие переменные описаны здесь далее.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V
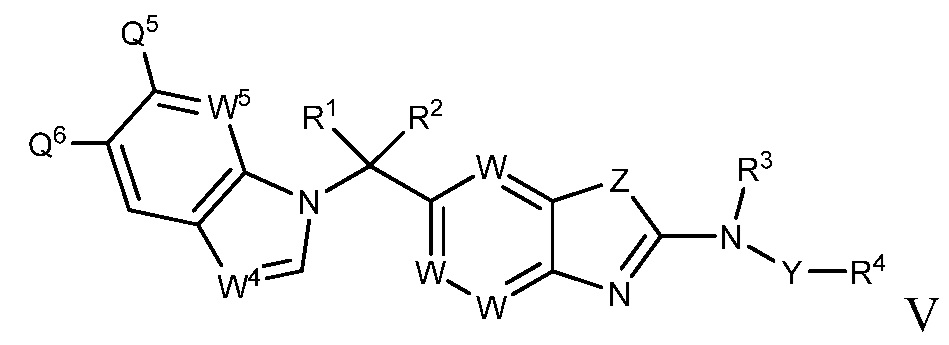
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где другие переменные описаны здесь далее.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляют собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где W4 представляет собой N и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где W4 представляет собой N; W5 представляет собой N; каждая из Q5 и Q6 независимо представляет собой водород, галоген или алкокси; R4 представляет собой циклоалкил, независимо замещенный одной или двумя группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx; и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где W4 представляет собой N; W5 представляет собой CR11b; R11b представляет собой водород; каждая из Q5 и Q6 независимо представляет собой водород, галоген или алкокси; R4 представляет собой циклоалкил, независимо замещенный одной или двумя группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx; и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx; каждая Ru независимо представляет собой алкилен или прямую связь; каждая Rx независимо представляет собой водород или алкил; и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где W4 представляет собой N; W5 представляет собой CH или N; каждая из Q5 и Q6 независимо представляет собой водород, галоген или алкокси; R4 представляет собой циклоалкил, независимо замещенный одной или двумя гидрокси группами; и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где W представляет собой С; Z представляет собой S; W4 представляет собой N; W5 представляет собой CH или N; каждая из Q5 и Q6 независимо представляет собой водород, галоген, алкил или алкокси; R3 представляет собой водород или алкил; Y представляет собой –(CR5R6)q-; q равно 0; и R4 представляет собой циклоалкил, независимо замещенный одной или двумя гидрокси группами.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V, где где W представляет собой С; Z представляет собой S; W4 представляет собой N; W5 представляет собой CH или N; каждая из Q5 и Q6 независимо представляет собой водород, галоген, алкил или алкокси; R3 представляет собой водород или алкил; Y представляет собой –(CR5R6)q-; q равно 0; и R4 представляет собой циклогексил, независимо замещенный одной или двумя гидрокси группами.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы V или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(О)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
Каждый из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuORuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI
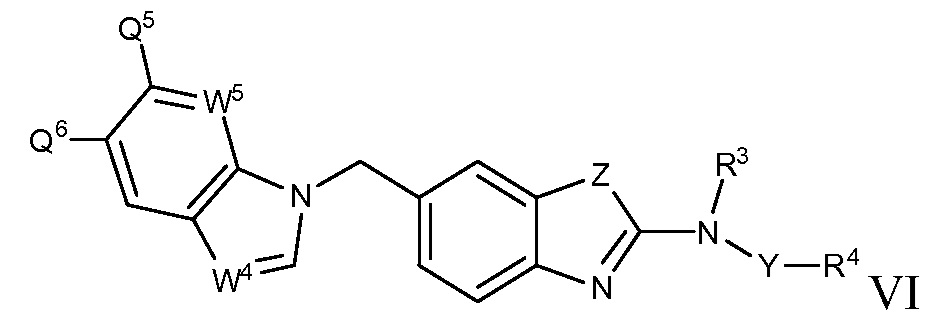
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W5 представляет собой N или CH;
W4 представляет собой N или CR11b;
R11b представляет собой водород или Q2;
Q2 представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI, где W4 представляет собой N, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлено соединение формулы VI, где Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W5 представляет собой N или CH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W5 представляет собой N или CH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuORuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -C(=NORx) Rx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W5 представляет собой N или CH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VI или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W5 представляет собой N или CH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuORuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -C(=NORx) Rx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формул IV, V или VI, где W4 представляет собой N, W5 представляет собой N или CR13; R13 представляет собой водород, галоген или алкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формул IV, V или VI, где W4 представляет собой N, W5 представляет собой N или CH, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формул IV, V или VI, где каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, хлор, фтор, бром, циано, алкил, алкенил, алкинил, циклоалкил, метокси или алкилкарбонил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, V или VI, где каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, циклоалкил, алкокси, тетразол или пиразол, где тетразольные и пиразольные кольца необязательно замещены одним или несколькими алкилами, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, V или VI, где каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, алкокси, тетразол или пиразол, где тетразольные и пиразольные кольца необязательно замещены одним или несколькими алкилами, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, хлор, фтор, бром, циано, алкил, алкенил, алкинил, циклоалкил, метокси или алкилкарбонил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, хлор, фтор, бром, циано, алкил, алкенил, алкинил, циклоалкил или метокси, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, хлор, фтор, бром, циано, циклоалкил или метокси, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, хлор, фтор, бром или метокси, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IV, V или VI, где
R3 представляет собой водород;
R4 представляет собой циклогексил, тетрагидрофурил, пиридинил, фенил, морфолинил, циклопентил, пиперидинил, тетрагидро-2H-пиранил или 2,3-дигидро-1H-инденил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1; каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa
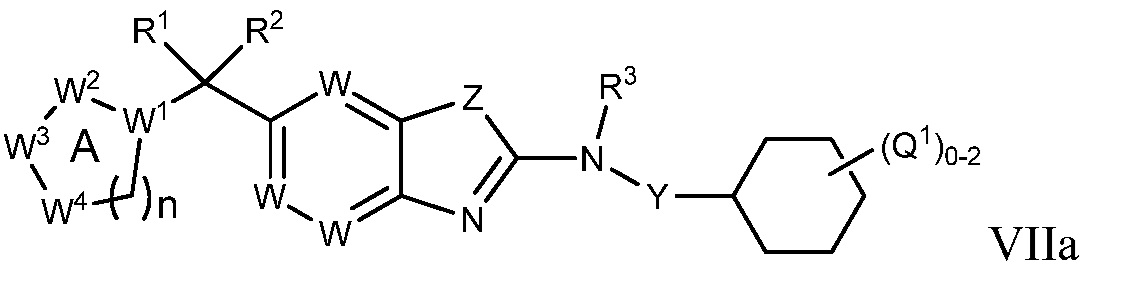
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, где арильное, гетероарильное или гетероциклильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a или R11a представляет собой водород или алкил, и оставшаяся часть R9b или R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, где арильное, гетероарильное или гетероциклильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a, R10a или R11a представляет собой водород или алкил, и оставшаяся часть R9b, R10b или R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)N(Ry)ORx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой моноциклический, бициклический или трициклический арил, гетероарил или гетероциклил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, где арильное, гетероарильное или гетероциклильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a, R10a или R11a представляет собой водород или алкил, и оставшаяся часть R9b, R10b или R11b представляет собой водород, галоген или алкил; или
iii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, необязательно конденсированное с фенильным кольцом, необязательно замещенным одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и каждая оставшаяся часть R9a и R9b или оставшаяся часть R11a и R11b независимо представляет собой водород или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4;
причем соединения выбирают таким образом, что: i) если W представляет собой CH, W1 представляет собой C, Z представляет собой S, R1 представляет собой водород или гидроксил и R2 представляет собой водород, или R1 и R2 образуют вместе =O, то кольцо A не представляет собой пиридин и ii) если W представляет собой CH, W1 представляет собой N, Z представляет собой S, R1 и R2 представляют собой водород, то кольцо A не представляет собой пирролидин.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb
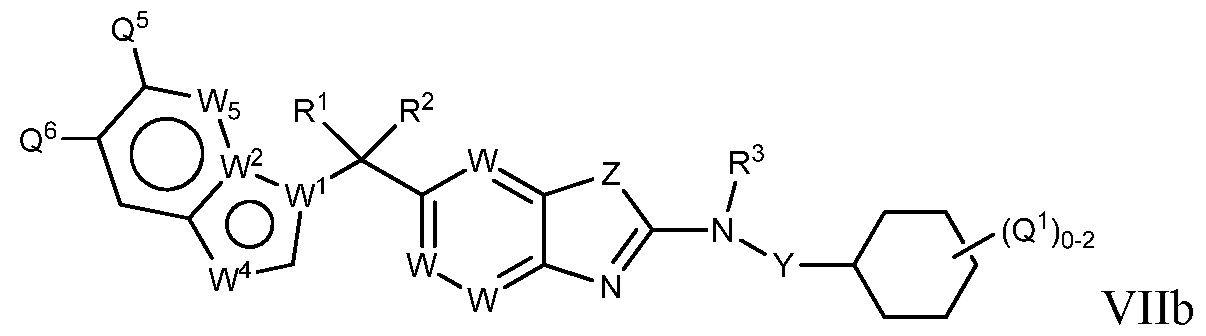
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
W1 представляет собой N или C;
W2 представляет собой N или CR9b;
R9b представляет собой водород или алкил;
W4 представляет собой N или CR11b;
W5 представляет собой N или CR13;
каждый из R11b и R13 независимо представляет собой водород или Q2;
Q2 представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенному варианту осуществления в настоящем документе представлены соединения формулы VIIb, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где и R1, и R2 представляет собой водород. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где каждая из Q5 и Q6 независимо представляет собой водород, дейтерий, галоген, циано, алкил, алкенил, алкинил, циклоалкил, алкокси или алкилкарбонил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где Q5 представляет собой водород, и Q6 представляет собой галоген, дейтерий, циано, алкил, алкенил, алкинил, циклоалкил, алкокси или алкилкарбонил. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где Q5 представляет собой водород, и Q6 представляет собой галоген, алкил, алкенил, алкинил, циклоалкил, алкокси или алкилкарбонил. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где Q5 представляет собой водород, и Q6 представляет собой галоген, циано, циклоалкил, алкокси или алкилкарбонил. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIb, где Q5 представляет собой водород, и Q6 представляет собой бром, хлор, фтор, циано, циклопропил, метокси или метилкарбонил.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIII
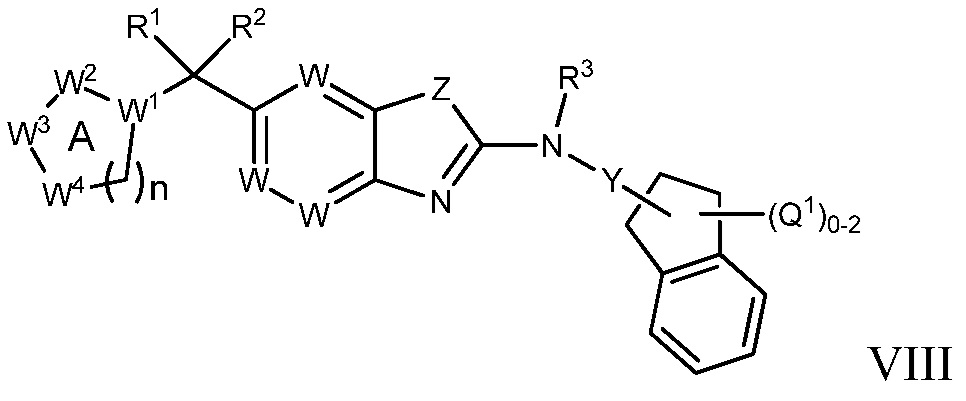
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a,R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород или Q2; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное кольцо, где арильное, гетероарильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a или R11a представляет собой водород или алкил, и оставшаяся часть R9b или R11b представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, галогеналкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa, VIIb или VIII, где:
каждый из R1 и R2 представляет собой водород;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, гидроксил, алкокси, галогеналкил, гидроксиалкил, циклоалкил, =NOH или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W представляет собой CH;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, где арильное, гетероарильное или гетероциклильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a, R10a или R11a представляет собой водород или алкил, или оставшаяся часть R9b, R10b или R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIII

или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
каждый из R1 и R2 независимо выбирают из водорода или галогена;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W независимо представляет собой CR8 или N;
R8 представляет собой водород, галоген, галогеналкил или алкил;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное кольцо, где арильное, гетероарильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a, R10a или R11a представляет собой водород или алкил, или оставшаяся часть R9b, R10b или R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIIa, VIIb или VIII, где:
каждый из R1 и R2 представляет собой водород;
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, гидроксил, алкокси, галогеналкил, гидроксиалкил, циклоалкил, =NOH или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
каждый W представляет собой CH;
кольцо A представляет собой арил или гетероарил, необязательно замещенный одним - четырьмя заместителями, выбранными из Q2;
W1 представляет собой N или C;
W2 представляет собой N, NR9a или CR9b;
W3 представляет собой N, NR10a или CR10b;
W4 представляет собой N, NR11a или CR11b;
R9a, R9b, R10a, R10b, R11a и R11b выбирают следующим образом:
i) каждый из R9a, R10a и R11a независимо представляет собой водород или алкил, и каждый из R9b, R10b и R11b независимо представляет собой водород, оксо, гидроксил, галоген или алкил; или
ii) R9a и R10b, R9b и R10b, R9b и R10a, R10b и R11a, R10a и R11b или R10b и R11b образуют вместе с атомами, к которым они присоединены, арильное, гетероарильное или гетероциклильное кольцо, где арильное, гетероарильное или гетероциклильное кольцо необязательно замещено одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q2; и оставшаяся часть R9a, R10a или R11a представляет собой водород или алкил, или оставшаяся часть R9b, R10b или R11b представляет собой водород, галоген или алкил;
каждая Q2 независимо представляет собой галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4; каждую Q4 независимо выбирают из галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы VIII, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IX
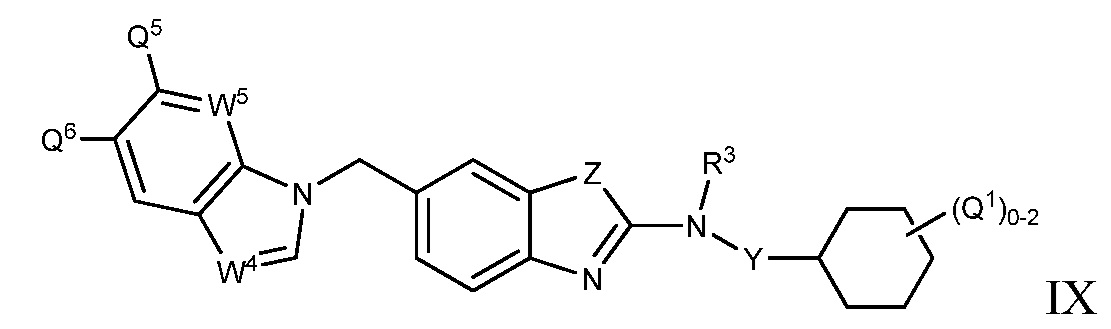
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
W5 представляет собой N или CR13;
каждый из R11b и R13 независимо представляет собой водород или Q2;
каждая Q2 независимо представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждая из Q5 и Q6 независимо представляет собой водород, галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
Rd представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IX или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил;
каждая из Q5 и Q6 независимо представляет собой водород, галоген, циано, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q8; каждую Q8 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Ru независимо представляет собой алкилен или прямую связь;
Rw представляет собой алкил;
каждый Rx независимо представляет собой водород или алкил;
каждый из Ry и Rz независимо представляет собой водород или алкил;
J представляет собой O, NRx или S;
каждый t независимо представляет собой целое число от 0 до 2;
n равно 1 или 2; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IX, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, каждый из R11b и R13 независимо представляет собой водород, галоген или алкил, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы IX, где каждая из Q5 и Q6 независимо представляет собой водород, галоген, алкокси, тетразол или пиразол, где тетразольные и пиразольные кольца необязательно замещены одним или несколькими алкилами, и значения других переменных таковы, как описано по тексту настоящего документа. Согласно определенным вариантам осуществления, каждая из Q5 и Q6 независимо представляет собой водород, хлор, фтор, бром или метокси, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы X
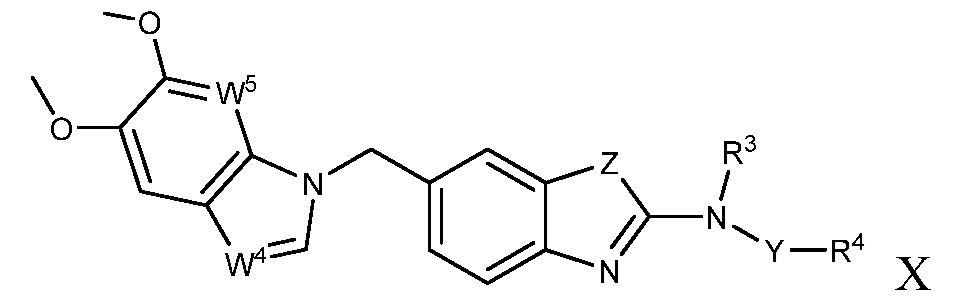
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой дейтерий, галоген, циано, оксо, тиоксо, алкил, галогеналкил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw, =NORd, или -C(=NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q3, согласно одному варианту осуществления, одной - тремя группами Q3; каждую Q3 независимо выбирают из дейтерия, галогена, гидроксила, алкила, галогеналкила и гидроксиалкила;
каждый Rd независимо представляет собой водород или алкил;
каждый Ru независимо представляет собой алкилен, алкенилен или прямую связь;
Rw представляет собой алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, цианоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый из Ry и Rz независимо выбирают из (i) или (ii), представленных ниже:
(i) каждый из Ry и Rz независимо представляет собой водород, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил; или
(ii) Ry и Rz образуют вместе с атомом азота, к которому они присоединены, гетероциклил или гетероарил, необязательно замещенный одной или несколькими, согласно одному варианту осуществления, одной, двумя или тремя, группами Q7; каждую Q7 независимо выбирают из галогена, дейтерия, оксо, тиоксо, гидрокси, алкокси, алкила, галогеналкила, гидроксиалкила, аминоалкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкилалкила, циклоалкенилалкила, арила, аралкила, гетероарила, гетероаралкила, гетероциклила и гетероциклилалкила;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
R11b представляет собой водород или Q2;
Q2 представляет собой галоген, дейтерий, циано, оксо, тиоксо, алкил, галогеналкил, галогеналкенил, аминоалкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкилалкил, циклоалкенилалкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, гетероциклилалкил, -RuORx, -RuORuORx, -RuORuN(Ry)(Rz), -RuN(Ry)(Rz), -RuSRx, -RuC(J)Rx, -RuC(J)ORx, -RuC(J)N(Ry)(Rz), -RuC(J)RuN(Ry)(Rz), -RuC(J)N(Ry)ORx, -C(=NORx)Rx, -RuS(O)tRw, -RuN(Rx)C(J)Rx, -RuN(Rx)C(J)ORx, -RuN(Rx)S(O)tRw или -C=(NRy)N(Ry)ORx, где алкильные, галогеналкильные, аминоалкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные, гетероарильные и гетероциклильные группы необязательно замещены одной или несколькими группами Q4, согласно одному варианту осуществления, одной - тремя группами Q4; каждую Q4 независимо выбирают из галогена, дейтерия, гидроксила, алкила, галогеналкила и гидроксиалкила;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы X, где каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx, каждый Ru независимо представляет собой алкилен или прямую связь, каждый Rx независимо представляет собой водород или алкил, и значения других переменных таковы, как описано по тексту настоящего документа.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы X или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы XI
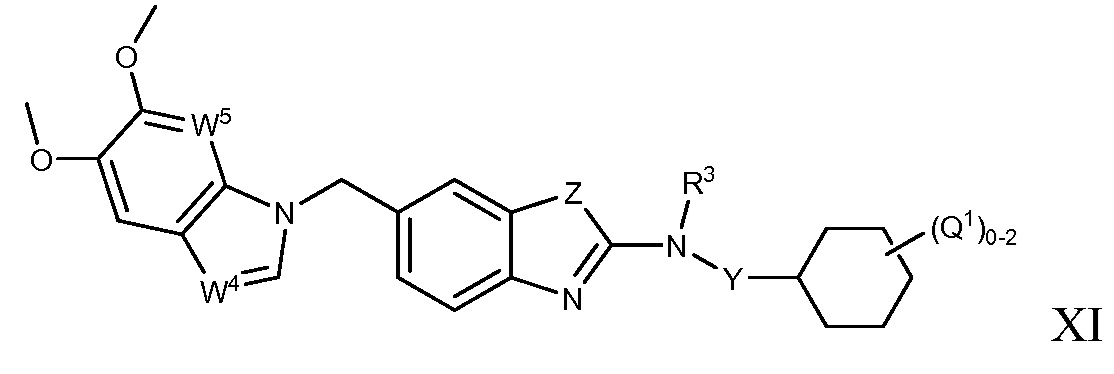
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы XI или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
W4 представляет собой N или CR11b;
R11b представляет собой водород, галоген или алкил;
W5 представляет собой N или CR13;
R13 представляет собой водород, галоген или алкил; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы XII
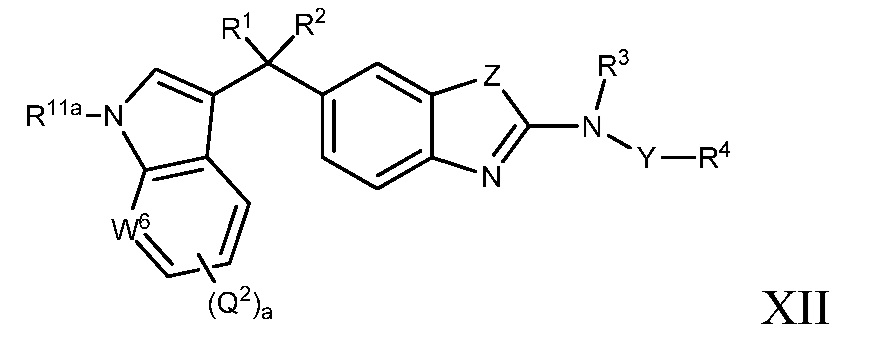
или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, арил, гетероциклил или гетероарил, где R4 необязательно замещен одной или несколькими, согласно одному варианту осуществления, одной - тремя, согласно другому варианту осуществления, одной, двумя или тремя, группами, выбранными из Q1;
каждая Q1 независимо представляет собой галоген, оксо, алкил, галогеналкил, гидроксиалкил, циклоалкил, =NOH, -RuORx или -RuC(O)Rx;
каждый Ru независимо представляет собой алкилен или прямую связь;
каждый Rx независимо представляет собой водород или алкил;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
R11a представляет собой водород или алкил;
W6 представляет собой N или CR14;
R14 представляет собой водород или алкил;
a равно 0-4; и
q представляет собой целое число от 0 до 4.
Согласно определенным вариантам осуществления, в настоящем документе представлены соединения формулы XII или их фармацевтически приемлемые соли, сольваты, гидраты, клатраты, отдельные стереоизомеры, смесь стереоизомеров или рацемическая смесь стереоизомеров, где:
R3 представляет собой водород или алкил;
R4 представляет собой циклоалкил, где R4 представляет собой необязательно замещенный гидрокси;
Y представляет собой -(CR5R6)q-;
каждый из R5 и R6 независимо представляет собой водород, галоген, алкил, галогеналкил или гидроксиалкил;
Z представляет собой O, S или NH;
R11a представляет собой водород или алкил;
W6 представляет собой N или CR14;
R14 представляет собой водород или алкил;
a равно 0-2; и
q представляет собой целое число от 0 до 2.
Согласно одному варианту осуществления, соединение, представленное в настоящем документе, выбирают из:
2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолметансульфоновой кислоты,
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((1H-имидазо[4,5-b]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((1H-имидазо[4,5-b]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((1H-имидазо[4,5-b]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1S,2S)-2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(R)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-((тетрагидрофуран-2-ил)метил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-((тетрагидрофуран-2-ил)метил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-2-илметил)бензо[d]тиазол-2-амина,
(1R,2S)-1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(S)-N-(2,3-дигидро-1H-инден-1-ил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
N-(2,3-дигидро-1H-инден-1-ил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
(1R,2R)-2-((6-(метокси(1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-(метокси(1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
N-бензил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-морфолиноэтил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидро-2H-пиран-4-ил)бензо[d]тиазол-2-амина,
N-циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-метилбензо[d]тиазол-2-амина,
(1R,2R)-2-((6-((1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
N-циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
(1R,2R)-1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклопентанола,
2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклопентанола,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-4-илметил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-фенилбензо[d]тиазол-2-амина,
(1R,2R)-2-((6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-(4-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)пиперидин-1-ил)этанонуксусной кислоты,
1-(4-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)пиперидин-1-ил)этанона,
(R,S)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидрофуран-3-ил)бензо[d]тиазол-2-аминоуксусной кислоты,
(R,S)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидрофуран-3-ил)бензо[d]тиазол-2-амина,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидрофуран-3-ил)бензо[d]тиазол-2-амина,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-2-аминия ацетата,
(1R,2R)-2-((6-((2-амино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((2-амино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-этоксифенил)бензо[d]тиазол-2-амина,
N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
(1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амина,
2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)фенола,
(1R,2R)-1-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(1R,2R)-1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(S)-N-(1-циклогексилэтил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
N-(1-циклогексилэтил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина,
(1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-амина,
(1R,2R)-2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-имидазол-4-карбоксамида,
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-имидазол-4-карбоксамида,
(1R,2R)-2-((6-(имидазо[1,2-a]пиридин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-(имидазо[1,2-a]пиридин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила,
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила,
(1R,2R)-2-((6-((7-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((7-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-циклопропил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-циклопропил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(±)-(1R,2R)(1S,2S)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогептанола,
2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогептанола,
(1R,2R)-2-((6-((6-метокси-5-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-метокси-5-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5-метокси-6-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-метокси-6-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-1H-бензо[d]имидазол-6-карбонитрила,
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-1H-бензо[d]имидазол-6-карбонитрила,
(R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанона,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанона,
(1R,2R)-2-((6-((6-хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексаноноксима,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексаноноксима,
(1S,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола,
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола,
(1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(S)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола,
(R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола,
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-6-метокси-1H-бензо[d]имидазол-5-карбонитрила,
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-6-метокси-1H-бензо[d]имидазол-5-карбонитрила,
((1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола,
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола,
(1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((3H-имидазо[4,5-c]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((3H-имидазо[4,5-c]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((1H-имидазо[4,5-c]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((1H-имидазо[4,5-c]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона,
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона,
(1R,2R)-2-((6-((6-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексанола,
(1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексил)метанола,
(1R,2R)-2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
метил-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата,
метил-3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата,
(1R,2R)-1-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты,
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты,
(1R,2R)-2-((6-((6-(морфолинометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(морфолинометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(гидроксиметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(гидроксиметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(метилтио)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(метилтио)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-((метилтио)метил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-((метилтио)метил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-карбонитрила,
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-карбонитрила,
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-ил)этанона,
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-ил)этанона,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-карбоксамида,
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-карбоксамида,
N-гидрокси-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксимидамида,
(1R,2R)-2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолуксусной кислоты,
(1R,2R)-2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-карбоксамида,
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-карбоксамида,
(1R,2R)-2-((6-((6-(2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(2-метил-2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(2-метил-2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-(1-метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-(1-метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-1-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
1-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола,
(1R,2R)-2-((6-((6-этинил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-этинил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-морфолино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-морфолино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
(1R,2R)-2-((6-((6-винил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-винил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
N-((3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метил)ацетамида,
N-((3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метил)ацетамида,
(1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
N-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамида,
N-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамида,
(1R,2R)-2-((6-((6-этил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
2-((6-((6-этил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола,
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-она и
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-она.
Согласно одному варианту осуществления, представленное в настоящем документе соединение выбирают из:
(1R,2R)-2-((6-((6-(3-гидрокси-3-метилбут-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(3-гидрокси-3-метилбут-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((2-(трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((2-(трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
(1R,2R)-2-((6-((6-(2-гидроксипропан-2-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(2-гидроксипропан-2-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)этанона;
1-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)этанона;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-карбонитрила;
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-карбонитрила;
(1R,2R)-2-((6-((5-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)тиазоло[4,5-b]пиридин-2-ил)амино)циклогексанола;
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)тиазоло[4,5-b]пиридин-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-((R,S)-1-гидроксиэтил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(1-гидроксиэтил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-(диметиламино)-1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанонацетата;
2-(диметиламино)-1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона;
2-(диметиламино)-1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила;
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила;
(1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
2-((6-((9H-пурин-9-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-ил)этанона;
1-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-ил)этанона;
(1R,2R)-2-((6-((5-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
3-((2-((2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
(1R,2R)-2-((6-(имидазо[1,2-a]пиразин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-(имидазо[1,2-a]пиразин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
(1R,2R)-2-((6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
((1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
(1R,2R)-2-((6-((6-(1-метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(1-метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(2-гидроксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(2-гидроксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
((1S,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
(1R,2R)-2-((6-((5,6-дихлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5,6-дихлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-этокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-этокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5,6-дикарбонитрила;
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5,6-дикарбонитрила;
3-((2-(((1R,2R)-2-(гидроксиметил)циклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
3-((2-((2-(гидроксиметил)циклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила;
(1R,2R)-2-((6-((6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]оксазол-2-ил)амино)циклогексанола;
2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]оксазол-2-ил)амино)циклогексанола;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метилимидазо[1,2-b]пиридазин-6-карбоксамида;
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метилимидазо[1,2-b]пиридазин-6-карбоксамида;
(1R,2R)-2-((6-((6-(гидроксиметил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(гидроксиметил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола;
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола;
(1R,2R)-2-((6-((5,7-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5,7-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(2-метоксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(2-метоксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-5-фторбензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-5-фторбензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((4-хлор-6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((4-хлор-6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-(имидазо[2,1-b]тиазол-5-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-(имидазо[2,1-b]тиазол-5-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(1H-пиразол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1H-пиразол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(1H-1,2,4-триазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1H-1,2,4-триазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
транс-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-7-фторбензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-7-фторбензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бромбензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бромбензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифторбензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифторбензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(1H-1,2,4-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(1H-1,2,4-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
1-((2-((2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
(1R,2R)-2-((6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(2-гидроксиэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(2-гидроксиэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-бензо[d]имидазол-5-карбоксамида;
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-бензо[d]имидазол-5-карбоксамида;
(1R,2R)-2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(3,3,3-трифторпроп-1-ен-2-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(3,3,3-трифторпроп-1-ен-2-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(R)-N-(циклогекс-2-ен-1-ил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
N-(циклогекс-2-ен-1-ил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
(1R,2R)-2-((6-((6-бромимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-бромимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-(4-метилпиперазин-1-ил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(4-метилпиперазин-1-ил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(транс-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
(цис-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-((1R,2R)-2-(метилтио)циклогексил)бензо[d]тиазол-2-амина;
6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-(2-(метилтио)циклогексил)бензо[d]тиазол-2-амина;
(1R,2R)-2-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(циклогекс-1-ен-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(циклогекс-1-ен-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(1-метил-3-(трифторметил)-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1-метил-3-(трифторметил)-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-фторимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-фторимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-морфолиноимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-морфолиноимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(4-метилпиперазин-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(4-метилпиперазин-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
((1R,2R)-2-((6-((5,7-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5,7-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-фенилбензо[d]тиазол-2-амина;
((1R,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
(1R,2S,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
((1S,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола;
6-хлор-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
6-хлор-1-((2-((2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
2-((1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрила;
2-((1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрила;
6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амина;
N-((1R,2R)-2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
N-(2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ола;
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ола;
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанона;
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанона;
(1R,2R)-2-((6-((7-(1-гидроксиэтил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(1-гидроксиэтил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этаноноксима;
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этаноноксима;
(1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанон-O-метилоксима;
1-(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанон-O-метилоксима;
(1R,2R)-2-((6-((9H-бензо[d]имидазо[1,2-a]имидазол-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((9H-бензо[d]имидазо[1,2-a]имидазол-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
7-фтор-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
7-фтор-1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила;
(1R,2R)-2-((6-((7-фтор-5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-фтор-5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)пиперидин-2-она;
1-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)пиперидин-2-она;
(1R,2R)-2-((6-((5-(1H-пиразол-3-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1H-пиразол-3-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1S,2S)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(1H-имидазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(1H-имидазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-винилимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-винилимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(аллилокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(аллилокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((7-(1H-1,2,3-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((7-(1H-1,2,3-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
N-((1R,2S)-2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
N-(2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина;
3-амино-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-онацетата;
3-амино-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-она;
3-амино-1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-она;
3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила;
3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила;
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она;
1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она;
(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)(пирролидин-1-ил)метанона;
(3-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)(пирролидин-1-ил)метанона;
(E)-3-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акриловой кислоты;
(E)-3-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акриловой кислоты;
3-(1-((2-((2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акриловой кислоты;
(1R,2R)-2-((6-((5-(1,2,3,6-тетрагидропиридин-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1,2,3,6-тетрагидропиридин-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(1H-имидазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(1H-имидазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1R,2R)-2-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
2-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола;
(1S,2R,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
3-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола;
(1R,2S,3R)-3-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола; и
3-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола.
В настоящем документе также представлены обогащенные изотопами аналоги соединений, представленных в настоящем документе. Обогащение изотопом (например, дейтерирование) фармацевтических средств для улучшения фармакокинетики (PK), фармакодинамики (PD) и профилей токсичности было продемонстрировано ранее для некоторых классов лекарственных средств (см., например, Lijinsky et al., Food Cosmet. Toxicol., 20: 393 (1982); Lijinsky et al., J. Nat. Cancer Inst., 69: 1127 (1982); Mangold et al., Mutation Res. 308: 33 (1994); Gordon et al., Drug Metab. Dispos., 15: 589 (1987); Zello et al., Metabolism, 43: 487 (1994); Gately et al., J. Nucl. Med., 27: 388 (1986); Wade D, Chem. Biol. Interact. 117: 191 (1999)).
Обогащение изотопом лекарственного средства может быть использовано, например, для (1) уменьшения количества или устранения нежелательных метаболитов, (2) увеличения времени полувыведения исходного лекарства, (3) уменьшения числа доз, необходимых для достижения желаемого эффекта, (4) уменьшения размера дозы, необходимой для достижения желаемого эффекта, (5) увеличения образования активных метаболитов (если таковые образуются) и/или (6) снижения продукции вредоносных метаболитов в конкретных тканях и/или образования более эффективного лекарства и/или более безопасного лекарства для комбинированной терапии, предполагается ли комбинированная терапия или нет.
Замена атома на один из его изотопов обычно приводит к изменению скорости химической реакции. Этот феномен известен как «кинетический изотопный эффект» (KIE). Например, если в процессе химической реакции связь C-H разрывается на стадии, определяющей скорость реакции (т.е. на стадии с наивысшей энергией переходного состояния), то замена дейтерием этого водорода будет обуславливать снижение скорости реакции, и процесс будет замедляться. Этот феномен известен как «кинетический изотопный эффект дейтерия» (DKIE) (см., например, Foster et al., Adv. Drug Res., vol. 14, pp. 1-36 (1985); Kushner et al., Can. J. Physiol. Pharmacol., vol. 77, pp. 79-88 (1999)).
Тритий (T) представляет собой радиоактивный изотоп водорода, используемый в исследованиях, термоядерных реакторах, генераторах нейтронов и радиофармпрепаратах. Тритий представляет собой атом водорода, который содержит 2 нейтрона в ядре и имеет атомную массу, близкую к 3. В естественных условиях он содержится в окружающей среде в очень малых концентрациях, наиболее часто обнаруживаемый в виде T2O. Тритий медленно (период полураспада = 12,3 года) распадается и испускает бета-частицу с низкой энергией, которая не может проникнуть через внешний слой кожи человека. Внутреннее облучение является основной опасностью, связанной с данным изотопом, хотя для значительного риска здоровью он должен быть поглощен в больших количествах. По сравнению с дейтерием, меньшее количество трития должно быть поглощено, прежде чем он достигнет опасного уровня. Замещение тритием (T) водорода приводит к образованию еще более сильной связи, чем с дейтерием, и обеспечивает численно большие эффекты изотопа. По аналогии, замена изотопами других элементов, включая без ограничения замену углерода на 13C или 14C, 33S, серы на 34S или 36S, азота на 15N и кислорода на 17O или 18O, будет обеспечивать сходные кинетические изотопные эффекты.
Согласно другому варианту осуществления, в настоящем документе представлены способы использования раскрытых соединений и композиций или их фармацевтически приемлемых солей, сольватов, гидратов, клатратов, отдельных стереоизомеров, смеси стереоизомеров или рацемической смеси стереоизомеров, для местного или системного лечения или профилактики заболеваний, нарушений или состояний человека и животных, модулируемых или иным образом опосредуемых через активность CSF1R, FLT3, KIT, и/или PDGFRβ киназы.
C. СОСТАВЛЕНИЕ ЛЕКАРСТВЕННЫХ КОМПОЗИЦИЙ
Фармацевтические композиции, представленные в настоящем документе, содержат терапевтически эффективные количества одного или нескольких соединений, представленных в настоящем документе, которые применимы для профилактики, лечения или уменьшения интенсивности заболеваний, опосредованных киназой CSF1R, FLT3, KIT и/или PDGFRβ, или одного или нескольких симптомов таких заболеваний.
Такие композиции содержат одно или несколько соединений, представленных в настоящем документе. Соединения могут быть включены в состав подходящих фармацевтических препаратов, таких как растворы, суспензии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, лекарственные формы замедленного высвобождения или эликсиры, для перорального введения или в виде стерильных растворов или суспензий для парентерального введения, а также препараты в виде чрескожных пластырей и ингаляторов сухого порошка. Описанные выше соединения, как правило, включают в состав фармацевтических композиций с использованием методик и процедур, хорошо известных в данной области техники.
В композициях эффективные концентрации одного или нескольких соединений или их фармацевтически приемлемых солей, сольватов, гидратов, клатратов, отдельных стереоизомеров, смеси стереоизомеров или рацемической смеси стереоизомеров или пролекарств смешаны с подходящим фармацевтическим носителем или растворителем. Концентрации соединений в композициях являются эффективными для доставки после введения количества, которое оказывает лечение, предупреждает или уменьшает интенсивность одного или нескольких симптомов заболеваний, опосредованных киназой CSF1R, FLT3, KIT и/или PDGFRβ.
Как правило, приготавливают композиции для введения однократной дозы. Для приготовления композиции, весовую долю соединения растворяют, суспендируют, диспергируют или иным образом смешивают с выбранной основой в эффективной концентрации, так что подвергаемое лечению состояние смягчается или уменьшается его интенсивность. Фармацевтические носители или основы, подходящие для введения соединений, представленных в настоящем документе, включают в себя любые такие носители, известные специалистам в данной области техники в качестве подходящих для конкретного пути введения.
Кроме того, такие соединения могут быть включены в состав композиции в виде отдельного фармацевтически активного ингредиента или могут быть сочетаны с другими активными ингредиентами. Липосомальные суспензии, включая тканеспецифичные липосомы, такие как направленные на опухоли липосомы, также могут быть подходящими в качестве фармацевтически приемлемых носителей. Суспензии могут быть приготовлены в соответствии со способами, известными специалистам в данной области техники. Например, в соответствии с известным в данной области техники могут быть приготовлены липосомальные лекарственные формы. Вкратце, липосомы, такие как мультиламеллярные везикулы (MLV) могут быть образованы путем высушивания яичного фосфатидилхолина и фосфатидилсерина головного мозга (молярное соотношение 7/3) на внутренней поверхности флакона. Затем добавляют раствор соединения, представленного в настоящем документе, в фосфатном буферном солевом растворе без двухвалентных катионов (PBS), и флакон встряхивают до тех пор, пока липидная пленка не диспергируется. Конечные везикулы промывают для удаления неинкапсулированного соединения, осаждают путем центрифугирования и затем ресуспендируют в PBS.
Активное соединение вносят в фармацевтически приемлемый носитель в количестве, достаточном для получения терапевтически полезного эффекта в отсутствие нежелательных побочных эффектов у получающего лечение пациента. Терапевтически эффективная концентрация может быть определена эмпирически путем тестирования соединений в системах in vitro и in vivo, описанных в настоящем документе, с последующим экстраполированием дозировок для людей.
Концентрация активного соединения в фармацевтической композиции будет зависеть от скоростей всасывания, инактивации и выведения активного соединения, физико-химических характеристик соединения, режима дозирования и вводимого количества, а также от других факторов, известных специалистам в данной области техники. Например, доставляемое количество является достаточным для облегчения одного или нескольких симптомов заболеваний, опосредованных киназой CSF1R, FLT3, KIT и/или PDGFRβ.
Обычно терапевтически эффективная дозировка должна обеспечивать концентрацию активного ингредиента в сыворотке крови, составляющую приблизительно от 1 нг/мл приблизительно до 50-100 мкг/мл. Фармацевтические композиции обычно должны обеспечивать дозировку приблизительно от 10 мг приблизительно до 4000 мг соединения на килограмм веса тела в сутки. Фармацевтические стандартные лекарственные формы приготавливают так, чтобы обеспечивать приблизительно от 10 мг приблизительно до 1000 мг, и, согласно определенным вариантам осуществления, приблизительно от 10 мг приблизительно до 500 мг, приблизительно от 20 мг приблизительно до 250 мг или приблизительно от 25 мг приблизительно до 100 мг, основного активного ингредиента или сочетания основных ингредиентов на стандартную лекарственную форму. Согласно определенным вариантам осуществления, фармацевтические стандартные лекарственные формы приготавливают так, чтобы обеспечивать приблизительно 10 мг, 20 мг, 25 мг, 50 мг, 100 мг, 250 мг, 500 мг, 1000 мг или 2000 мг основного активного ингредиента.
Активный ингредиент может быть введен сразу или может быть разделен на некоторое число меньших доз для введения с интервалами во времени. Следует понимать, что точная дозировка и длительность лечения зависят от подлежащего лечению заболевания, и могут быть определены эмпирически с использованием известных протоколов тестирования или путем экстраполяции данных тестирования in vivo или in vitro. Следует указать, что значения концентраций и дозировки также могут варьировать от тяжести подлежащего облегчению состояния. Также следует понимать, что для каждого конкретного субъекта с течением времени должны быть подобраны конкретные режимы дозирования в соответствии с индивидуальными потребностями и профессиональным суждением субъекта, производящего введение или контролирующего введение композиций, и что пределы концентраций, изложенные в настоящем документе, являются лишь типичными и не предназначены для ограничения объема или практики применения заявленных композиций.
Фармацевтически приемлемые производные включают в себя кислоты, основания, простые енольные эфиры и сложные енольные эфиры, соли, сложные эфиры, гидраты, сольваты и пролекарственные формы. Производное выбирают так, чтобы его фармакокинетические свойства были лучшими по сравнению с соответствующим нейтральным соединением.
Поэтому для получения фармацевтической композиции эффективные концентрации или количества одного или нескольких соединений, описанных в настоящем документе, или их фармацевтически приемлемых производных, смешивают с походящим фармацевтическим носителем или основой для системного, местного или локального введения. Соединения включают в состав в количестве, эффективном для уменьшения интенсивности одного или нескольких симптомов или для лечения или профилактики заболеваний, опосредованных киназой CSF1R, FLT3, KIT и/или PDGFRβ. Концентрация активного соединения в композиции будет зависеть от скоростей всасывания, инактивации, выведения активного соединения, схемы дозирования, вводимого количества, конкретной лекарственной формы, а также от других факторов, известных специалистам в данной области техники.
Такие композиции предназначены для введения посредством подходящего пути, включая без ограничения пероральный, парентеральный, ректальный, местный и локальный путь. Для перорального введения могут быть приготовлены капсулы и таблетки. Композиции находятся в жидкой, полужидкой или твердой формах, и их приготавливают способом, подходящим для каждого пути введения.
Растворы или суспензии, используемые для парентерального, внутрикожного, подкожного или местного применения могут включать в себя любой из следующих компонентов: стерильный разбавитель, такой как вода для инъекций, солевой раствор, жирное масло, полиэтиленгликоль, глицерин, пропиленгликоль, диметилацетамид, или другой синтетический растворитель; противомикробные средства, такие как бензиловый спирт и метилпарабены; антиоксиданты, такие как аскорбиновая кислота и бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты и фосфаты; и средства для регулирования тоничности, такие как хлорид натрия или декстроза. Парентеральные препараты могут быть заключены в ампулы, шприцы одноразового применения или флаконы с одной или несколькими дозами, сделанные из стекла, пластика или другого подходящего материала.
В тех случаях, когда соединения обладают недостаточной растворимостью, могут использоваться способы солюбилизации соединений. Такие способы известны специалистам в данной области техники и включают в себя без ограничения использование сорастворителей, таких как диметилсульфоксид (DMSO), применение поверхностно-активных веществ, таких как TWEEN®, или растворение в водном растворе бикарбоната натрия.
После смешивания или добавления соединения(ий), конечная смесь может представлять собой раствор, суспензию, эмульсию или т.п. Форма конечной смеси зависит от ряда факторов, включая предполагаемый путь введения и растворимость соединения в выбранном носителе или основе. Согласно одному варианту осуществления, эффективная концентрация является достаточной для уменьшения интенсивности симптомов подлежащего лечению заболевания, нарушения или состояния, и может быть определена эмпирически.
Фармацевтические композиции предоставляются для введения людям и животным в стандартных лекарственных формах, таких как таблетки, капсулы, пилюли, порошки, гранулы, стерильные парентеральные растворы или суспензии, и пероральные растворы или суспензии, и водно-масляные эмульсии, содержащие подходящие количества соединений или их фармацевтически приемлемых производных. Фармацевтически терапевтически активные соединения и их производные обычно приготавливают и вводят в стандартных лекарственных формах или дозированных лекарственных формах. Используемое в настоящем документе выражение «стандартные лекарственные формы» относится к физически дискретным единицам, подходящим для введения субъектам-людям и животным и индивидуально упакованным, как принято в данной в области техники. Каждая однократная доза содержит предварительно определенное количество терапевтически активного соединения, достаточное для получения желаемого терапевтического эффекта, совместно с необходимым фармацевтическим носителем, основой или разбавителем. Примеры стандартных лекарственных форм включают в себя ампулы и шприцы и индивидуально упакованные таблетки или капсулы. Стандартные лекарственные формы могут быть введены дробно или многократно. Дозированная лекарственная форма представляет собой множество одинаковых стандартных лекарственных форм, упакованных в одном контейнере и подлежащих введению в виде отдельных стандартных лекарственных форм. Примеры дозированных лекарственных форм включают в себя флаконы, бутыли с таблетками или капсулами или бутыли, измеряемые пинтами или галлонами. Следовательно, многократная дозированная форма представляет собой множество однократных доз, которые не разделены в упаковке.
Также могут быть приготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие представленное в настоящем документе соединение, причем матрицы принимают форму изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают в себя сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды, сополимеры L-глутаминовой кислоты и этил-L-глутамина, неразлагающийся этиленвинилацетат, разлагающиеся сополимеры молочной кислоты/гликолевой кислоты, такие как LUPRON DEPOT™ (инъекционные микросферы, приготовленные из сополимеров молочной кислоты/гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляную кислоту. Хотя полимеры, такие как этилен-винилацетат и молочная кислота/гликолевая кислота, делают возможным высвобождение молекул в течение более 100 суток, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Если инкапсулированное соединение остается в организме в течение длительного времени, то оно может денатурировать или агрегировать в результате воздействия влаги при температуре 37°C, приводя к потере биологической активности и возможным изменениям его структуры. Могут быть разработаны рациональные стратегии для стабилизации в зависимости от конкретного механизма действия. Например, если обнаруженный механизм агрегации представляет собой формирование межмолекулярной S-S связи посредством тиодисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, контроля влагосодержания, применения подходящих добавок и разработки специфических полимерных матричных композиций.
Могут быть приготовлены лекарственные формы или композиции, содержащие активный ингредиент в диапазоне от 0,005% до 100% с остальной частью в виде нетоксичного носителя. Для перорального введения, фармацевтически приемлемую нетоксичную композицию формируют путем включения в состав любого из обычно используемых наполнителей, например, таких как фармацевтические виды маннита, лактозы, крахмала, стеарата магния, талька, производных целлюлозы, кросскармелозы натрия, глюкозы, сахарозы, карбоната магния и сахарина натрия. Такие композиции включают в себя растворы, суспензии, таблетки, капсулы, порошки и лекарственные формы с замедленным высвобождением, такие как без ограничения импланты и микроинкапсулированные системы доставки, и биоразлагаемые биосовместимые полимеры, такие как коллаген, этиленвинилацетат, полиангидриды, полигликолевая кислота, сложные полиортоэфиры, полимолочная кислота и другие. Способы приготовления таких композиций известны специалистам в данной области техники. Предполагаемые композиции могут содержать приблизительно 0,001%-100% активного ингредиента, согласно определенным вариантам осуществления, приблизительно 0,1-85%, обычно приблизительно 75-95%.
Активные соединения или фармацевтически приемлемые производные могут быть приготовлены с носителями, которые защищают такое соединение от быстрого выведения из организма, такие как лекарственные формы с замедленным высвобождением или покрытия.
Композиции могут включать в себя другие активные соединения для получения желаемых сочетаний свойств. Соединения, представленные в настоящем документе, или их фармацевтически приемлемые производные, описанные в настоящем документе, также могут быть успешно введены с терапевтической или профилактической целью вместе с другим известным в данной области техники фармакологическим средством, представляющим ценность для лечения одного или нескольких заболеваний или медицинских состояний, относящихся к вышеперечисленным в настоящем документе, таких как заболевания, опосредованные киназой CSF1R, FLT3, KIT и/или PDGFRβ. Следует понимать, что такая комбинированная терапия представляет собой дополнительный аспект композиций и способов лечения, представленных в настоящем документе.
1. Композиции для перорального введения
Пероральные фармацевтические лекарственные формы могут быть твердыми, гелеобразными или жидкими. Твердые лекарственные формы представляют собой таблетки, капсулы, гранулы и порошкообразные вещества. Типы пероральных таблеток включают в себя спрессованные, жевательные леденцы и таблетки, которые могут быть покрыты кишечнорастворимой оболочкой, сахарной оболочкой или пленочной оболочкой. Капсулы могут представлять собой твердые или мягкие желатиновые капсулы, тогда как гранулы и порошки могут предоставляться в нешипучей или шипучей форме в сочетании с другими ингредиентами, известными специалистам в данной области техники.
Согласно определенным вариантам осуществления, лекарственные формы представляют собой твердые лекарственные формы, такие как капсулы или таблетки. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединений сходной природы: связующее вещество; разбавитель; разрыхлитель; смазка; глидант; подсластитель; и вкусоароматизатор.
Примеры связующих веществ включают в себя микрокристаллическую целлюлозу, трагакантовую камедь, раствор глюкозы, камедь акации, раствор желатина, сахарозу и крахмальную пасту. Смазки включают в себя тальк, крахмал, стеарат магния или кальция, ликоподий и стеаровую кислоту. Разбавители включают в себя, например, лактозу, сахарозу, крахмал, каолин, соль, маннит и дикальция фосфат. Глиданты включают в себя без ограничения коллоидный диоксид кремния. Разрыхлители включают в себя кросскармелозу натрия, крахмалгликолят натрия, альгиновую кислоту, кукурузный крахмал, картофельный крахмал, бентонит, метилцеллюлозу, агар и карбоксиметилцеллюлозу. Красители включают в себя, например, любой из одобренных сертифицированных водорастворимых FD и C красителей, их смесей; и нерастворимых в воде FD и C красителей, суспендированных на гидрате алюминия. Подсластители включают в себя сахарозу, лактозу, маннит и искусственные средства подсластители, такие как сахарин и любое число высушенных распылением отдушек. Вкусоароматизаторы включают в себя естественные вкусоароматизаторы, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые придают приятные ощущения, такие как без ограничения мята и метилсалицилат. Увлажнители включают в себя моностеарат пропиленгликоля, моноолеат сорбитана, монолаурат диэтиленгликоля и простой полиоксиэтиленлауралэфир. Emetic-coatings включают в себя жирные кислоты, жиры, воски, шеллак, аммонизированный шеллак и ацетатфталаты целлюлозы. Пленочные покрытия включают в себя гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу натрия, полиэтиленгликоль 4000 и ацетатфталат целлюлозы.
Если пероральное введение желательно, то соединение может предоставляться в композиции, которая защищает его от кислого содержимого желудка. Например, композиция может быть снабжена кишечнорастворимым покрытием, которое сохраняет ее целостность в желудке и высвобождает активное соединение в кишечнике. Такая композиция также может быть включена в состав вместе с антацидом или другим подобным ингредиентом.
Если стандартная лекарственная форма представляет собой капсулу, то в дополнение к веществам вышеперечисленных типов она может содержать жидкий носитель, такой как жирное масло. Кроме того, стандартные лекарственные формы могут содержать различные другие вещества, которые модифицируют физическую форму лекарственной формы, например, покрытия из сахара и других кишечнорастворимых средств. Соединения также могут быть введены в виде компонента эликсира, суспензии, сиропа, облатки, опрыскивания, жевательной резинки или т.п. В дополнение к активным соединениям сироп может содержать сахарозу в качестве подсластителя, и некоторые консерванты, пигменты и красители и вкусоароматизаторы.
Активные вещества также могут быть смешаны с другими активными веществами, которые не уменьшают желаемое воздействие, или с веществами, которые дополняют желаемое воздействие, такими как антациды, H2-блокаторы и диуретики. Активный ингредиент представляет собой соединение или его фармацевтически приемлемое производное, описанное в настоящем документе. Могут быть включены более высокие концентрации активного ингредиента, приблизительно до 98 масс.%.
Фармацевтически приемлемые носители, входящие в состав таблеток, представляют собой связующие вещества, смазки, разбавители, разрыхлители, красители, вкусоароматизаторы и увлажнители. Снабженные кишечнорастворимым покрытием таблетки, вследствие наличия такого покрытия, противостоят действию желудочной кислоты и растворяются или распадаются в нейтральной или щелочной среде кишечника. Таблетки, покрытые сахаром, представляют собой спрессованные таблетки, в которых используют различные слои фармацевтически приемлемых веществ. Таблетки с пленочной оболочкой представляют собой спрессованные таблетки, которые покрывают полимером или другим подходящим покрытием. Таблетки многократного прессования представляют собой спрессованные таблетки, которые изготавливают посредством более чем одного цикла компрессии с использованием упомянутых ранее фармацевтически приемлемых веществ. В представленных выше лекарственных формах также могут быть использованы красители. Вкусоароматизаторы и подсластители применяются в прессованных таблетках, таблетках с сахарным покрытием, таблетках многократного прессования и жевательных таблетках. Вкусоароматизаторы и подсластители особенно применимы при приготовлении жевательных таблеток и леденцов.
Жидкие пероральные лекарственные формы включают в себя водные растворы, эмульсии, суспензии, растворы и/или суспензии, получаемые разведением из нешипучих гранул, и шипучие препараты, получаемые разведением из шипучих гранул. Водные растворы включают в себя, например, эликсиры и сиропы. Эмульсии относятся либо к типу «масло в воде», либо к типу «вода в масле».
Эликсиры представляют собой чистые подслащенные водно-спиртовые препараты. Фармацевтически приемлемые носители, используемые в эликсирах, включают в себя растворители. Сиропы представляют собой концентрированные водные растворы сахара, например, сахарозы, и могут содержать консервант. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в виде маленьких сфер в другой жидкости. Фармацевтически приемлемые носители, используемые в эмульсиях, представляют собой неводные жидкости, эмульгаторы и консерванты. В суспензиях используют фармацевтически приемлемые средства, способствующие суспендированию, и консерванты. Фармацевтически приемлемые вещества, используемые в нешипучих гранулах, которые разбавляют до жидкой пероральной лекарственной формы, включают в себя разбавители, подсластители и увлажнители. Фармацевтически приемлемые вещества, используемые в шипучих гранулах, которые разбавляют до жидкой пероральной лекарственной формы, включают в себя органические кислоты и источники диоксида углерода. Красители и вкусоароматизаторы используют во всех вышеперечисленных лекарственных формах.
Растворители включают в себя глицерин, сорбит, этиловый спирт и сироп. Примеры консервантов включают в себя глицерин, метил и пропилпарабен, бензойную кислоту, бензоат натрия и спирт. Примеры неводных жидкостей, используемых в эмульсиях, включают в себя минеральное масло и хлопковое масло. Примеры эмульгаторов включают в себя желатин, акацию, трагакант, бентонит и поверхностно-активные вещества, такие как моноолеат полиоксиэтиленсорбитана. Средства, способствующие суспендированию, включают в себя карбоксиметилцеллюлозу натрия, пектин, трагакант, Вигум и камедь. Разбавители включают в себя лактозу и сахарозу. Подсластители включают в себя сахарозу, сиропы, глицерин и искусственные подсластители, такие как сахарин. Увлажнители включают в себя моностеарат пропиленгликоля, моноолеат сорбитана, монолаурат диэтиленгликоля и простой полиоксиэтиленлаурилэфир. Органические добавки включают в себя лимонную и винную кислоту. Источники диоксида углерода включают в себя бикарбонат натрия и карбонат натрия. Красители включают в себя любой из одобренных сертифицированных водорастворимых FD и C красителей, их смесей. Вкусоароматизаторы включают в себя естественные вкусоароматизаторы, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые придают приятные вкусовые ощущения.
Для получения твердой лекарственной формы, раствор или суспензию, например в пропиленкарбонате, растительных маслах или триглицеридах, капсулируют в желатиновую капсулу. Для получения жидкой лекарственной формы, раствор, например, в полиэтиленгликоле, может быть разбавлен достаточным количеством фармацевтически приемлемого жидкого носителя, например, воды, для легкого измерения для введения.
В качестве альтернативы, жидкие и полутвердые пероральные лекарственные формы могут быть приготовлены путем растворения или диспергирования активного соединения или соли в растительных маслах, гликолях, триглицеридах, сложных эфирах пропиленгликоля (например, пропиленкарбонате) и других таких носителях, и капсулирования указанных растворов или суспензий в желатиновых капсулах с твердыми или мягкими оболочками. Другие применимые лекарственные формы включают в себя без ограничения формы, которые содержат соединение, представленное в настоящем документе, диалкилированный моно- или полиалкиленгликоль, включая без ограничения 1,2-диметоксиметан, диглим, триглим, тетраглим, простой полиэтиленгликоль-350-диметилэфир, простой полиэтиленгликоль-550-диметилэфир, простой полиэтиленгликоль-750-диметилэфир, в которых 350, 550 и 750 относятся к приблизительной средней молекулярной массе полиэтиленгликоля, и один или несколько антиоксидантов, таких как бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA), пропилгаллат, витамин E, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, тиодипропионовая кислота и ее сложные эфиры, и дитиокарбаматы.
Другие лекарственные формы включают в себя без ограничения водно-спиртовые растворы, включая фармацевтически приемлемый ацеталь. Спирты, используемые в таких лекарственных формах, представляют собой любые фармацевтически приемлемые растворимые в воде растворители, содержащие одну или несколько гидроксильных групп, включая без ограничения пропиленгликоль и этанол. Ацетали включают в себя без ограничения ди(низший алкил)ацетали низших алкильных альдегидов, такие как диэтилацеталь ацетальдегида.
Согласно всем вариантам осуществления, лекарственные формы в виде таблеток и капсул могут быть снабжены покрытием, известным специалистам в данной области техники, для модификации или замедления растворения активного ингредиента. Так, например, они могут быть покрыты стандартным кишечнорастворимым покрытием, таким как фенилсалицилат, воски и ацетатфталат целлюлозы.
2. Инъекционные препараты, растворы и эмульсии
Настоящим документом также предполагается парентеральное введение, обычно осуществляемое путем инъекции, подкожной, внутримышечной или внутривенной. Инъекционные препараты могут быть приготовлены в стандартных формах, таких как жидкие растворы или суспензии, твердые формы, подходящие для растворения или суспендирования в жидкости перед инъекцией, или в виде эмульсий. Подходящие наполнители представляют собой, например, воду, солевой раствор, декстрозу, глицерин или этанол. Кроме того, при желании, фармацевтические композиции, подлежащие введению, также могут содержать небольшие количества нетоксичных вспомогательных веществ, таких как увлажнители или эмульгаторы, рН буферные средства, стабилизаторы, усилители растворимости и другие подобные средства, такие как, например, ацетат натрия, монолаурат сорбитана, олеат триэтаноламина и циклодекстрины. Согласно одному варианту осуществления, такую композицию вводят в виде водного раствора с гидроксипропил-бета-циклодекстрином (HPBCD) в качестве наполнителя. Согласно одному варианту осуществления, водный раствор содержит приблизительно от 1% приблизительно до 50% HPBCD. Согласно одному варианту осуществления, водный раствор содержит приблизительно 1%, 3%, 5%, 10% или приблизительно 20% HPBCD.
Настоящим документом также предполагается имплантация систем медленного высвобождения или замедленного высвобождения, так что сохраняется постоянный уровень дозировки. Вкратце, соединение, представленное настоящим документом, диспергируют в твердом инертном матриксе, например, полиметилметакрилате, полибутилметакрилате, пластифицированном или непластифицированном поливинилхлориде, пластифицированном нейлоне, пластифицированном полиэтилентерефталате, природном каучуке, полиизопрене, полиизобутилене, полибутадиене, полиэтилене, сополимерах этилен-винилацетат, силиконовых каучуках, полидиметилсилоксанах, сополимерах силиконкарбоната, гидрофильных полимерах, таких как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, поперечно-сшитый поливиниловый спирт и поперечно-сшитый частично гидролизованный поливинилацетат, которые окружены наружной полимерной мембраной, например, полиэтиленом, полипропиленом, сополимерами этилен/пропилен, сополимерами этилен/этилакрилат, сополимерами этилен/винилацетат, силиконовыми каучуками, полидиметилсилоксанами, неопреновым каучуком, хлорированным полиэтиленом, поливинилхлоридом, сополимерами винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, иономерным полиэтилентерефталатом, бутилкаучук эпихлоргидриновыми каучуками, сополимерами этилен/виниловый спирт, терполимером этилен/винилацетат/виниловый спирт и сополимером этилен/винилоксиэтанол, которые не растворимы в жидкостях организма. Соединение диффундирует через наружную полимерную мембрану на стадии регулируемой скорости высвобождения. Процентное содержание активного соединения в таких парентеральных композициях сильно зависит от его специфической природы, а также от активности такого соединения и нужд субъекта.
Парентеральное введение композиций включает в себя внутривенное, подкожное и внутримышечное введение. Препараты для парентерального введения включают в себя стерильные растворы, готовые для инъекции, стерильные сухие растворимые продукты, такие как лиофилизированные порошки, готовые для смешивания с растворителем непосредственно перед применением, включая подкожные таблетки, стерильные суспензии, готовые для инъекции, стерильные сухие нерастворимые продукты, готовые для смешивания с основой непосредственно перед применением и стерильные эмульсии. Растворы могут быть как водными, так и неводными.
При внутривенном введении, подходящие носители включают в себя физиологический солевой раствор или фосфатный буферный солевой раствор (PBS) и растворы, содержащие загустители и солюбилизаторы, такие как глюкоза, полиэтиленгликоль и пропиленгликоль и их смеси.
Фармацевтически приемлемые носители, используемые в парентеральных препаратах, включают в себя водные основы, неводные основы, противомикробные средства, изотонические средства, буферы, антиоксиданты, местные анестетики, средства, способствующие суспендированию и диспергированию, эмульгаторы, секвестрирующие или хелатирующие средства и другие фармацевтически приемлемые вещества.
Примеры водных основ включают в себя инъекционный препарат хлорида натрия, инъекционный препарат Рингера, инъекционный препарат изотонической декстрозы, инъекционный препарат стерильной воды, инъекционный препарат декстрозы и лактата Рингера. Неводные парентеральные основы включают в себя жирные масла растительного происхождения, хлопковое масло, кукурузное масло, кунжутное масло и арахисовое масло. В парентеральные препараты, упакованные в контейнеры для многократного приема, должны быть добавлены противомикробные средства в бактериостатических или фунгистатических концентрациях, которые включают в себя фенолы или крезолы, ртутьсодержащие вещества, бензиловый спирт, хлорбутанол, сложные эфиры метил- и пропилпарагидроксибензойной кислоты, тимерозал, хлорид бензалкония и хлорид бензетония. Изотонические средства включают в себя хлорид натрия и декстрозу. Буферы включают в себя фосфат и цитрат. Антиоксиданты включают в себя бисульфат натрия. Местные анестетики включают в себя гидрохлорид прокаина. Средства, способствующие суспендированию и диспергированию, включают в себя карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Эмульгаторы включают в себя Полисорбат 80 (TWEEN® 80). Секвестрирующие или хелатирующие ионы металлов средства включают в себя EDTA. Фармацевтические носители также включают в себя этиловый спирт, полиэтиленгликоль и пропиленгликоль для водорастворимых основ и гидроксид натрия, соляную кислоту, лимонную кислоту или молочную кислоту для регулирования рН.
Концентрация фармацевтически активного соединения регулируется так, чтобы инъекционный препарат предоставлял количество, эффективное для получения желаемого фармакологического эффекта. Точная доза зависит от возраста, веса и общего состояния пациента или животного, известного в данной области техники.
Однократную дозу парентеральных препаратов упаковывают в ампулу, флакон или шприц с иглой. Все препараты для парентерального введения должны быть стерильны, что известно и применяется на практике в данной области техники.
В качестве иллюстрации, эффективным способом введения является внутривенная или внутриартериальная инфузия стерильного водного раствора, содержащего активное соединение. Другой вариант осуществления представляет собой стерильный водный или масляный раствор или суспензия, содержащие активное вещество, инъецируемые при необходимости для получения желаемого фармакологического эффекта.
Инъекционные препараты разрабатывают для местного и системного введения. Обычно терапевтически эффективная дозировка составляется так, чтобы она содержит концентрацию, по меньшей мере, приблизительно от 0,1 масс.% приблизительно до 90 масс.% или более, как например, более 1 масс.% активного соединения в ткани(ях), подвергающейся(ихся) обработке. Активный ингредиент может быть введен сразу целиком или может быть разделен на некоторое число меньших доз для введения с интервалами во времени. Следует понимать, что точная дозировка и длительность лечения зависят от подлежащей обработке ткани и могут быть определены эмпирически с использованием известных протоколов тестирования или путем экстраполирования данных тестирования in vivo или in vitro. Следует упомянуть, что значения концентраций и дозировки также могут варьировать от возраста подлежащего лечению субъекта. Также следует понимать, что для каждого конкретного субъекта с течением времени должны быть подобраны специфические режимы дозирования в соответствии с индивидуальными потребностями и профессиональным суждением субъекта, производящего введение или контролирующего введение композиций, и что диапазон концентраций, изложенных в настоящем документе, являются лишь типичным и не предназначен для ограничения объема или практического применения заявленных композиций.
Для обеспечения лучшей растворимости активного продукта или для получения пролекарства соединение может быть суспендировано в микронизированной или другой подходящей форме или дериватизовано. Форма конечной смеси зависит от целого ряда факторов, включая предполагаемый способ введения и растворимость соединения в выбранном носителе или основе. Эффективная концентрация достаточна для уменьшения интенсивности симптомов состояния и может быть определена эмпирически.
3. Лиофилизированные порошки
Объектом исследования согласно настоящему документу также являются лиофилизированные порошки, которые могут быть восстановлены для введения в виде растворов, эмульсий и других смесей. Они также могут быть восстановлены и приготовлены в виде твердых препаратов или гелей.
Стерильный лиофилизированный порошок приготавливают путем растворения соединения, представленного в настоящем документе, или его фармацевтически приемлемого производного, в подходящем растворителе. Такой растворитель может содержать наполнитель, который улучшает стабильность, или другой фармакологический компонент порошка или восстановленного раствора, приготовленного из порошка. Наполнители, возможные к использованию, включают в себя без ограничения декстрозу, сорбитан, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу, гидроксипропил-бета-циклодекстрин (HPBCD) или другое подходящее средство. Растворитель также может содержать буфер, такой как цитрат, фосфат натрия или калия, или другой буфер, известный специалистам в данной области техники, как правило, приблизительно с нейтральным рН. Путем стерильной фильтрации раствора с последующей лиофилизацией при стандартных условиях, известных специалистам в данной области техники, получают желаемую лекарственную форму. Обычно, конечный раствор распределяют по флаконам для лиофилизации. Каждый флакон будет содержать однократную дозировку (10-1000 мг, 100-500 мг, 10-500 мг, 50-250 мг или 25-100 мг) или многократные дозировки соединения. Лиофилизированный порошок можно хранить в подходящих условиях, таких как приблизительно от 4°C до комнатной температуры.
Восстановление такого лиофилизированного порошка водой для инъекций получают лекарственную форму для применения при парентеральном введении. Для восстановления, из расчета на 1 мл стерильной воды или другого подходящего носителя добавляют приблизительно 1-50 мг, приблизительно 5-35 мг или приблизительно 9-30 мг лиофилизированного порошка. Точное количество зависит от выбранного соединения. Такое количество может быть определено эмпирически.
4. Местное введение
Смеси для местного введения приготавливают, как описано, для местного и системного введения. Конечная смесь может представлять собой раствор, суспензию, эмульсии или т.п. и приготавливается в виде кремов, гелей, мазей, эмульсий, растворов, эликсиров, лосьонов, суспензий, настоек, паст, пен, аэрозолей, орошений, спреев, суппозиториев, бандажей, кожных пластырей или любых других лекарственных форм, подходящих для местного введения.
Соединения или их фармацевтически приемлемые производные могут быть приготовлены в виде аэрозолей для местного применения, такого как посредством ингаляции. Такие лекарственные формы для введения в дыхательные пути могут находиться в форме аэрозоля или раствора для небулайзера, или в виде мелкодисперсного порошка для инсуфляции, отдельно или в сочетании с инертным носителем, таким как лактоза. В таком случае, частицы лекарственной формы обычно имеют диаметр менее 50 микрон или менее 10 микрон.
Соединения могут быть приготовлены для локального или местного применения, например, для местного применения на коже и слизистых оболочках, например на глазах, в форме гелей, кремов и лосьонов и для применения на глазах или для интрацистернального или интраспинального применения. Местное введение предполагается для чрескожной доставки, а также для введения в глаза или слизистые, или для ингаляционной терапии. Также могут быть введены назальные растворы активного соединения, отдельно или в сочетании с другими фармацевтически приемлемыми наполнителями.
Такие растворы, особенно растворы, предназначенные для офтальмологического применения, могут быть приготовлены в виде 0,01%-10% изотонических растворов с рН приблизительно 5-7 с подходящими солями.
5. Композиции для других путей введения
Настоящим документом также предполагаются другие пути введения, такие как местное введение, чрескожные пластыри и ректальное введение.
Например, фармацевтические лекарственные формы для ректального введения представляют собой ректальные суппозитории, капсулы и таблетки для получения системного эффекта. Используемый в настоящем документе термин «ректальные суппозитории» означает твердые тела для введения в прямую кишку, которые разжижаются или размягчаются при температуре тела, высвобождая один или несколько фармакологически или терапевтически активных ингредиентов. Фармацевтически приемлемые вещества, используемые в ректальных суппозиториях, представляют собой основания или основы и средства для увеличения температуры плавления. Примеры оснований включают в себя масло какао (какао-масло), глицерин/желатин, карбовакс (полиоксиэтиленгликоль) и подходящие смеси моно-, ди- и триглицеридов жирных кислот. Могут быть использованы сочетания различных оснований. Средства для увеличения температуры плавления суппозиториев включают в себя спермацет и воск. Ректальные суппозитории могут быть приготовлены как посредством компрессионного способа, так и посредством молдинга. Стандартная масса ректального суппозитория составляет приблизительно от 2 до 3 г.
Таблетки и капсулы для ректального введения изготавливают с использованием таких же фармацевтически приемлемых веществ и теми же способами, что и лекарственные формы для перорального введения.
6. Композиции замедленного высвобождения
Активные ингредиенты, представленные в настоящем документе, могут быть введены с помощью средств регулируемого высвобождения или посредством устройств доставки, которые хорошо известны средним специалистам в данной области техники. Примеры включают в себя без ограничения таковые, описанные в патентах США №№ 3845770, 3916899, 3536809, 3598123, 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556, 5639480, 5733566, 5739108, 5891474, 5922356, 5972891, 5980945, 5993855, 6045830, 6087324, 6113943, 6197350, 6248363, 6264970, 6267981, 6376461, 6419961, 6589548, 6613358, 6699500 и 6740634, каждый из которых включен в настоящий документ посредством ссылки. Такие лекарственные формы могут быть использованы для обеспечения медленного или регулируемого высвобождения одного или нескольких активных ингредиентов, с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их сочетаний, для обеспечения желаемого профиля высвобождения в различных пропорциях. Для использования с активными ингредиентами, представленными в настоящем документе, могут быть легко выбраны подходящие лекарственные формы с регулируемым высвобождением, известные средним специалистам в данной области техники, включая формы, описанные в настоящем документе.
Все фармацевтические продукты с регулируемым высвобождением имеют своей общей целью улучшить лекарственную терапию по сравнению с терапией, достигаемой с их нерегулируемыми аналогами. В идеале, использование для медицинского лечения оптимально разработанного препарата с регулируемым высвобождением характеризуется минимальным количеством используемого лекарственного вещества для лечения или контроля состояния в течение минимального промежутка времени. Преимущества лекарственных форм с регулируемым высвобождением включают в себя повышенную активность лекарства, сниженную частоту дозирования и повышенную комплаентность пациента. Кроме того, лекарственные формы с регулируемым высвобождением могут быть использованы для влияния на время наступления действия или других характеристик, таких как уровни лекарства в крови, а потому могут влиять на возникновение побочных (например, нежелательных) эффектов.
Большинство лекарственных форм с регулируемым высвобождением разрабатывают так, чтобы изначально высвобождать количество лекарства (активного ингредиента), которое немедленно дает желаемый терапевтический эффект, с постепенным и непрерывным высвобождением других количеств лекарства для поддержания такого уровня терапевтического или профилактического эффекта в течение длительного периода времени. С целью сохранения такого постоянного уровня лекарства в организме, такое лекарство должно высвобождаться из лекарственной формы со скоростью, которая будет замещать количество лекарства, метаболизируемое и выводимое из организма. Регулируемое высвобождение активного ингредиента может стимулироваться различными состояниями, включая без ограничения рН, температуру, ферменты, воду или другие физиологические состояния или соединения.
Согласно определенным вариантам осуществления, средство может быть введено с использованием внутривенной инфузии, имплантируемой осмотической помпы, чрескожного пластыря, липосом или других способов введения. Согласно одному варианту осуществления, может быть использована помпа. Согласно другому варианту осуществления, могут быть использованы полимерные материалы. Согласно еще одному варианту осуществления, система регулируемого высвобождения может быть помещена вблизи от терапевтической мишени, т.е. требуя тем самым лишь части системной дозы. Согласно определенным вариантам осуществления, устройство регулируемого высвобождения помещают у субъекта вблизи от места аномальной иммунной активации или опухоли. Активный ингредиент может быть диспергирован в твердом инертном матриксе, например, в полиметилметакрилате, полибутилметакрилате, пластифицированном или непластифицированном поливинилхлориде, пластифицированном нейлоне, пластифицированном полиэтилентерефталате, природном каучуке, полиизопрене, полиизобутилене, полибутадиене, полиэтилене, сополимерах этилена/винилацетата, силиконовых каучуках, полидиметилсилоксанах, сополимерах силиконкарбоната, гидрофильных полимерах, таких как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, поперечно-сшитый поливиниловый спирт и поперечно-сшитый частично гидролизованный поливинилацетат, который окружен наружной полимерной мембраной, например, полиэтиленом, полипропиленом, сополимерами этилена/пропилена, сополимерами этилена/этилакрилата, сополимерами этилена/винилацетата, силиконовыми каучуками, полидиметилсилоксанами, неопреновым каучуком, хлорированным полиэтиленом, поливинилхлоридом, сополимерами винилхлорида/винилацетата, винилиденхлоридом, этиленом и пропиленом, иономерным полиэтилентерефталатом, бутилкаучуком, эпихлоргидриновыми каучуками, сополимерами этилена/винилового спирта, терполимером этилена/винилацетата/винилового спирта и сополимером этилена/винилоксиэтанола, которые нерастворимы в жидкостях организма. Затем, на этапе регуляции скорости высвобождения, активный ингредиент диффундирует через наружную полимерную мембрану. Процент активного соединения, содержащийся в таких парентеральных композициях, сильно зависит от его специфической природы, а также от нужд субъекта.
7. Лекарственные формы направленного действия
Соединения, представленные в настоящем документе, или их фармацевтически приемлемые производные, также могут быть приготовлены так, чтобы быть направленными на конкретную ткань, рецептор или другую область организма субъекта, подлежащего лечению. Множество таких способов направленного действия хорошо известны специалистам в данной области техники. Все такие способы направленного действия подразумеваются в настоящем документе для использования в настоящих композициях. Для неограничивающих примеров способов направленного действия см., например, патенты США №№ 6316652, 6274552, 6271359, 6253872, 6139865, 6131570, 6120751, 6071495, 6060082, 6048736, 6039975, 6004534, 5985307, 5972366, 5900252, 5840674, 5759542 и 5709874.
Согласно одному варианту осуществления, липосомальные суспензии, включая тканеспецифичные липосомы, такие как направленные на опухоли липосомы, также могут быть подходящими в качестве фармацевтически приемлемых носителей. Такие суспензии могут быть приготовлены в соответствии со способами, известными специалистам в данной области техники. Вкратце, липосомы, такие как мультиламеллярные везикулы (MLV) могут быть сформированы путем высушивания яичного фосфатидилхолина и фосфатидилсерина из головного мозга (молярное соотношение 7/3) на внутренней поверхности флакона. Затем добавляют раствор соединения, представленного в настоящем документе, в фосфатном буферном солевом растворе (PBS) без двухвалентных катионов, и встряхивают флакон до тех пор, пока не диспергируется липидная пленка. Полученные везикулы промывают для удаления неинкапсулированного соединения, осаждают путем центрифугирования, а затем ресуспендируют в PBS.
D. ОЦЕНКА АКТИВНОСТИ СОЕДИНЕНИЙ
Для тестирования соединений с целью определения соединений, которые обладают биологическими эффектами модулирования активности киназы CSF1R, FLT3, KIT и/или PDGFRβ, доступны стандартные физиологические, фармакологические и биохимические процедуры.
Такие методы анализа включают в себя, например, биохимические методы анализа, такие как методы анализа связывания, методы включения радиоактивных веществ, а также ряд клеточных методов анализа.
Согласно определенным вариантам осуществления, соединения, раскрытые в настоящем документе, тестировали методом анализа пролиферации клеток M-NFS-60 для определения их активности в отношении CSF1R клеток. M-NFS-60 представляют собой моноцитарные клетки мышей, пролиферация которых зависит от связывания лиганда M-CSF с его рецептором CSF1R. Ингибирование CSF1R киназной активности будет обуславливать замедленный рост и/или гибель клетки. Этот метод анализа оценивает активность соединений в качестве ингибиторов CSF1R посредством измерения восстановления реагента Аламарового Синего жизнеспособными клетками. Типичный пример метод анализа описан в разделе «Примеры».
Согласно определенным вариантам осуществления, анализ на конкурентное связывание осуществляют, как описано в Fabian et al., Nature Biotechnology 2005, 23, 329-336.
Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении FLT3 киназы, приблизительно равными или меньшими чем 150 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении FLT3 киназы, приблизительно равными 1 нМ или менее, 3 нМ или менее, 5 нМ или менее, 0,1-2 нМ, 2-5 нМ, 5-10 нМ, 10-25 нМ, 25-50 нМ или 50-150 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении FLT3 киназы, составляющими приблизительно менее чем 50, 25, 10, 5, 4, 3, 2 или 1 нМ. Согласно другому варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении FLT3 киназы, приблизительно равными или меньшими чем 5 нМ, 3 нМ или 1 нМ.
Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении KIT киназы, приблизительно равными или меньшими чем 50 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении KIT киназы, приблизительно равными 1 нМ или менее, 3 нМ или менее, 0,1-2 нМ, 2-5 нМ, 5-10 нМ или 10-25 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении KIT киназы, составляющими приблизительно менее чем 10, 5, 4, 3, 2 или 1 нМ. Согласно другому варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении KIT киназы, приблизительно равными или меньшими чем 5 нМ, 3 нМ или 1 нМ.
Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении PDGFRβ киназы, приблизительно равными или меньшими чем 100 нМ или 50 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении PDGFRβ киназы, приблизительно равными 1 нМ или менее, 3 нМ или менее, 0,1-2 нМ, 2-5 нМ, 5-10 нМ или 10-25 нМ. Согласно одному варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении PDGFRβ киназы, составляющими приблизительно менее чем 10, 5, 4, 3, 2 или 1 нМ. Согласно другому варианту осуществления, соединения, представленные в настоящем документе, обладают значениями Kd в отношении PDGFRβ киназы, приблизительно равными или меньшими чем 5 нМ, 3 нМ или 1 нМ.
Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении CSF1R киназы, приблизительно равными или меньшими чем 1 мкМ. Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении CSF1R киназы, составляющими приблизительно менее чем 1, 0,5, 0,1 или 0,01 мкМ. Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении CSF1R киназы, составляющими приблизительно менее чем 300, 200, 100, 50, 10, 5, 4, 3, 2 или 1 нМ. Согласно другому варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями Kd в отношении CSF1R киназы, приблизительно равными или меньшими чем 5 нМ, 3 нМ или 1 нМ.
Е. СПОСОБЫ ИСПОЛЬЗОВАНИЯ СОЕДИНЕНИЙ И КОМПОЗИЦИЙ
В настоящем документе также представлены способы использования раскрытых соединений и композиций, или их фармацевтически приемлемых солей, сольватов, гидратов, клатратов, отдельных стереоизомеров, смеси стереоизомеров, рацемической смеси стереоизомеров или пролекарств, для лечения, профилактики или уменьшения интенсивности заболевания или нарушения, которое опосредовано или иным образом вовлечено посредством протеинкиназной активности, или одного или нескольких симптомов заболеваний или нарушений, которые опосредованы или иным образом вовлечены посредством протеинкиназной активности (см., Krause and Van Etten, N Engl J Med (2005) 353(2):172-187, Blume-Jensen and Hunter, Nature (2001) 411(17): 355-365 и Plowman et al., DN&P, 7:334-339 (1994)).
Согласно определенным вариантам осуществления, в настоящем документе представлены способы лечения следующих заболеваний или нарушений:
1) карцином, включая Kit-опосредованные и/или CSF1R-опосредованные карциномы, аденокарциному, сквамозноклеточную карциному, аденосквамозную карциному, тератокарциному, злокачественную опухоль головы и шеи, злокачественную опухоль головного мозга, интракраниальную карциному, глиобластому, включая PDGFR-опосредованную глиобластому, глиобластому мультиформную, включая PDGFR-опосредованную глиобластому мультиформную, нейробластому, злокачественную опухоль гортани, множественные эндокринные неоплазии 2A и 2B (MENS 2A и MENS 2B), включая RET-опосредованные MENS, злокачественную опухоль щитовидной железы, включая спорадическую и семейную медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, карциному паращитовидной железы, включая любую RET-опосредованную карциному щитовидной железы, фолликулярную злокачественную опухоль щитовидной железы, анапластическую злокачественную опухоль щитовидной железы, бронхиальный карциноид, мелкоклеточную карциному, злокачественную опухоль легких, мелкоклеточный рак легких, включая flt-3 и/или Kit-опосредованный мелкоклеточный рак легких, злокачественную опухоль желудка, злокачественную опухоль желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта (GIST), включая, Kit-опосредованные GIST и PDGFRα-опосредованные GIST, злокачественную опухоль толстого кишечника, злокачественную опухоль ободочной и прямой кишки, злокачественную опухоль поджелудочной железы, карциному островков Лангерганса, злокачественную опухоль печени, метастазы в печень, злокачественную опухоль мочевого пузыря, почечно-клеточный рак, включая PDGFR-опосредованный почечно-клеточный рак, злокачественные опухоли урогенитального тракта, злокачественную опухоль яичников, включая Kit-опосредованную и/или PDGFR-опосредованную и/или CSF1R-опосредованную злокачественную опухоль яичников, злокачественную опухоль эндометрия, включая CSF1R-опосредованную злокачественную опухоль эндометрия, злокачественную опухоль эндометрия шейки матки, злокачественную опухоль молочных желез, включая Flt-3-опосредованную и/или PDGFR-опосредованную и/или CSF1R-опосредованную злокачественную опухоль молочных желез, злокачественную опухоль предстательной железы, включая Kit-опосредованную опухоль предстательной железы, злокачественные опухоли стволовых клеток, включая Kit-опосредованные злокачественные опухоли стволовых клеток, семиномы, включая Kit-опосредованные семиномы, дисгерминомы, включая Kit-опосредованные дисгерминомы, меланому, включая PDGFR-опосредованную меланому, метастазы в кости, включая CSF1R-опосредованные костные метастазы, метастатические опухоли, включая VEGFR-опосредованные и/или CSF1R-опосредованные метастатические опухоли, стромальные опухоли, нейроэндокринные опухоли, опухоли ангиогенеза, включая VEGFR-опосредованные и/или CSF1R-опосредованные опухоли ангиогенеза, смешанные мезодермальные опухоли;
2) сарком, включая PDGFR-опосредованные саркомы, остеосаркому, остеогенную саркому, злокачественную опухоль кости, глиому, включая PDGFR-опосредованную и/или CSF1R-опосредованную глиому, астроцитому, сосудистые опухоли, включая VEGFR-опосредованные сосудистые опухоли, саркому Капоши, карциносаркому, гемангиосаркомы, включая VEGFR3-опосредованные гемангиосаркомы, лимфангиосаркому, включая VEGFR3-опосредованную лимфангиосаркому;
3) «жидких» опухолей, миелом, множественных миелом, лейкоза миелопролиферативных заболеваний (MPD), острого миелоидного лейкоза (AML), включая flt-3-опосредованный и/или KIT-опосредованный и/или CSF1R-опосредованный острый миелоидный лейкоз, хронический миелоидный лейкоз (CML), включая flt-3-опосредованный и/или PDGFR-опосредованный хронический миелоидный лейкоз, миелодиспластических лейкозов, включая Flt-3-опосредованный миелодиспластический лейкоз, острого мегакариобластного лейкоза, включая CSF1R-опосредованный острый мегакариобластный лейкоз, миелодиспластического синдрома, включая Flt-3-опосредованный и/или Kit-опосредованный миелодиспластический синдром (MDS), идиопатического гиперэозинофильного синдрома (HES), включая PDGFR-опосредованный HES, хронического эозинофильного лейкоза (CEL), включая PDGFR-опосредованный CEL, хронического миеломоноцитарного лейкоза (CMML), тучноклеточного лейкоза, включая Kit-опосредованный тучноклеточный лейкоз, или системного мастоцитоза, включая Kit-опосредованный системный мастоцитоз; и
4) лимфом, лимфом Ходжкина, лимфопролиферативных заболеваний, острого лимфобластного лейкоза (ALL), В-клеточного острого лимфобластного лейкоза, Т-клеточного острого лимфобластного лейкоза, лейкоза естественных клеток-киллеров (NK), В-клеточной лимфомы, Т-клеточной лимфомы и лимфомы естественных клеток-киллеров (NK), каждая из которых может быть Flt-3-опосредованной и/или PDGFR-опосредованной, гистиоцитоза клеток Лангерганса, включая CSF1R-опосредованный и flt-3-опосредованный гистиоцитоз клеток Лангерганса, опухолей тучных клеток и мастоцитоза;
2) незлокачественных пролиферативных заболеваний, атеросклероза, включая CSF1R-опосредованный атеросклероз или PDGFR-опосредованный атеросклероз, рестеноза после сосудистой ангиопластики, включая PDGFR-опосредованный рестеноз, и фибропролиферативных нарушений, таких как облитерирующий бронхиолит и идиопатический миелофиброз, каждый из которых может быть PDGFR-опосредованным, легочного фиброза, а также ожирения и резистентности к инсулину, индуцированной ожирением, каждое из которых может быть CSF1R-опосредованным;
5) воспалительных заболеваний или иммунных нарушений, включая аутоиммунные заболевания, которые включают в себя без ограничения отторжение тканевого трансплантата, реакцию трансплантат-против-хозяина, заживление ран, заболевание почек, рассеянный склероз, тиреоидит, сахарный диабет 1 типа, саркоидоз, аллергический ринит, нефрит, болезнь Альцгеймера, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит (UC), системную красную волчанку (SLE), артрит, остеоартрит, ревматоидный артрит, псориатический артрит, воспалительный артрит, остеопороз, бронхиальную астму и хроническую обструктивную болезнь легких (COPD), включая любое из вышеупомянутых заболеваний, которое является flt-3-опосредованным и/или CSF1R-опосредованным и/или KIT-опосредованным;
6) заболеваний костей, включая нарушения, связанные с минерализацией, образованием и резорбцией кости, включая без ограничения остеопороз, остеопороз индуцированный глюкокортикоидами, периодонтит, разрежение кости в связи с противораковой терапией, перипростатический остеолизис, болезнь Паджета, гиперкальцемию, остеомиелит и костную боль; и
7) инфекционных заболеваний, опосредованных как вирусными, так и бактериальными патогенами, и сепсиса, включая KIT-опосредованный и/или CSF1R-опосредованный сепсис.
В настоящем документе также представлены способы модулирования активности или внутриклеточного распределения киназ в клетке, ткани или целом организме, с использованием соединений и композиций, представленных в настоящем документе, или их фармацевтически приемлемых производных. Согласно одному варианту осуществления, в настоящем документе представлены способы модулирования активности FLT3 в клетке, ткани или целом организме с использованием соединений и композиций, представленных в настоящем документе, или их фармацевтически приемлемых производных. Согласно одному варианту осуществления, настоящим документом предоставляются способы модулирования активности CSF1R в клетке, ткани или целом организме с использованием соединений и композиций, представленных в настоящем документе, или их фармацевтически приемлемых производных. Согласно одному варианту осуществления, настоящим документом предоставляются способы модулирования активности KIT в клетке, ткани или целом организме с использованием соединений и композиций, представленных в настоящем документе, или их фармацевтически приемлемых производных.
Согласно одному варианту осуществления, в настоящем документе представлены способы лечения остеолизиса, ассоциированного с опухолями, остеопороза, включая разрежение кости, индуцированное овариэктомией, ортопедической несостоятельности трансплантата, почечного воспаления и гломерулонефрита, отторжения трансплантата, включая почечные и костномозговые аллотрансплантаты и кожные ксенотрансплантаты, ожирения, болезни Альцгеймера и гистиоцитоза клеток Лангерганса. Согласно одному варианту осуществления, в настоящем документе представлены способы лечения хронических кожных нарушений, включая псориаз.
Согласно другому варианту осуществления, в настоящем документе представлен способ лечения периодонтита, гистиоцитоза клеток Лангерганса, остеопороза, болезни костей Паджета (PDB), разрежения кости в связи с противораковой терапией, перипростатического остеолизиса, остеопороза, индуцированного глюкокортикоидами, ревматоидного артрита, псориатического артрита, остеоартрита и/или воспалительного артрита.
Согласно одному варианту осуществления, в настоящем документе представлены способы лечения заболеваний костей, включая нарушения связанные с минерализацией, образованием и резорбцией кости, включая без ограничения остеопороз, болезнь Паджета, гиперкальциемию, остеолизис, остеомиелит и костную боль.
Согласно одному варианту осуществления, в настоящем документе представлены способы лечения злокачественных опухолей, включая без ограничения злокачественную опухоль головы и шеи (возникающую на губе, в ротовой полости, ротоглотке, гортаноглотке, глотке, носоглотке, носовой полости и параназальных синусах или слюнных железах); злокачественную опухоль легких, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого; злокачественные опухоли желудочно-кишечного тракта, включая злокачественную опухоль пищевода, злокачественную опухоль желудка, злокачественную опухоль ободочной и прямой кишки, злокачественную опухоль ануса, злокачественную опухоль поджелудочной железы, злокачественную опухоль печени, злокачественную опухоль желчного пузыря, злокачественную опухоль внепеченочных желчевыводящих путей, злокачественную опухоль фатеровой ампулы; злокачественную опухоль молочной железы; гинекологические злокачественные опухоли, включая злокачественную опухоль шейки матки, злокачественную опухоль тела матки, злокачественную опухоль вагины, злокачественную опухоль наружных женских половых органов, злокачественную опухоль яичников, гестационную трофобластическую раковую неоплазию; злокачественную опухоль яичек; злокачественные опухоли мочевыводящих путей, включая злокачественную опухоль почки, злокачественную опухоль мочевого пузыря, злокачественную опухоль предстательной железы, злокачественную опухоль полового члена, уретральную злокачественную опухоль; неврологические опухоли; эндокринные новообразования, включая карциноид и опухоли островков Лангерганса, феохромоцитому, злокачественную опухоль коры надпочечников, карциному паращитовидной железы и метастазы в эндокринные железы. Согласно другому варианту осуществления, в настоящем документе представлены способы лечения карциномы, злокачественной опухоли молочных желез, злокачественной опухоли яичников, метастазов в кости, остеопороза, болезни Паджета, гиперкальциемии, остеолизиса, остеомиелита, костной боли, воспалительного заболевания кишечника (IBD), болезни Крона, язвенного колита (UC), системной красной волчанки (SLE), артрита, остеоартрита, ревматоидного артрита, остеопороза, бронхиальной астмы, хронической обструктивной болезни легких (COPD), псориаза и рассеянного склероза. Согласно другому варианту осуществления, в настоящем документе представлены способы лечения воспалительных заболеваний глаза, включая конъюнктивит, увеит, ирит, склерит, блефарит, мейбомит и неврит зрительного нерва. Согласно еще одному варианту осуществления, в настоящем документе представлены способы лечения глаукомы, диабетической ретинопатии и макулярной дегенерации.
Другие примеры злокачественных опухолей представляют собой базально-клеточную карциному; сквамозно-клеточную карциному; хондросаркому (злокачественная опухоль, возникающая в клетках хрящей); мезенхимальную хондросаркому; саркомы мягких тканей, включая злокачественные опухоли, которые могут возникать в любой мезодермальной ткани (мышцах, сухожилиях, сосудах, которые переносят кровь или лимфу, суставах и жировой ткани); саркомы мягких тканей включают в себя альвеолярную саркому мягких тканей, ангиосаркому, фибросаркому, лейомиосаркому, липосаркому, злокачественную фиброзную гистиоцитому, гемангиоперицитому, мезенхимому, шванному, периферические нейроэктодермальные опухоли, рабдомиосаркому, синовиальную саркому; гестационную трофобластическую опухоль (злокачественное образование, при котором ткани, образующиеся в матке после зачатия, становятся злокачественными); лимфому Ходжкина и злокачественную опухоль гортани.
Согласно одному варианту осуществления, злокачественная опухоль представляет собой лейкоз. Согласно одному варианту осуществления, лейкоз представляет собой хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелоидный лейкоз и острый миелобластный лейкоз.
Согласно другому варианту осуществления, лейкоз представляет собой острый лейкоз. Согласно одному варианту осуществления, острый лейкоз представляет собой острый миелоидный лейкоз (AML). Согласно одному варианту осуществления, острый миелоидный лейкоз представляет собой недифференцированный AML (M0), миелобластный лейкоз (M1), миелобластный лейкоз (M2), промиелоцитарный лейкоз (M3 или M3 вариант [M3V]), миеломоноцитарный лейкоз (M4 или M4 вариант с эозинофилией [M4E]), моноцитарный лейкоз (M5), эритролейкоз (M6) или мегакариобластный лейкоз (M7). Согласно другому варианту осуществления, острый миелоидный лейкоз представляет собой недифференцированный AML (M0). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой миелобластный лейкоз (M1). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой миелобластный лейкоз (M2). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой промиелоцитарный лейкоз (M3 или M3 вариант [M3V]). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой миеломоноцитарный лейкоз (M4 или M4 вариант с эозинофилией [M4E]). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой моноцитарный лейкоз (M5). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой эритролейкоз (M6). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой мегакариобластный лейкоз (M7). Согласно еще одному варианту осуществления, острый миелоидный лейкоз представляет собой промиелоцитарный лейкоз.
Согласно другому варианту осуществления, острый лейкоз представляет собой острый лимфоцитарный лейкоз (ALL). Согласно одному варианту осуществления, острый лимфоцитарный лейкоз представляет собой лейкоз, который возникает в бластных клетках костного мозга (В-клетках), тимуса (Т-клетки) или лимфатических узлов. Острый лимфоцитарный лейкоз классифицируют согласно фрацузско-американско-британской (FAB) морфологической классификационной схемой как L1 - созревающие лимфобласты (Т-клетки или пре-В-клетки), L2 - незрелые и плеоморфные (с разными формами) лимфобласты (Т-клетки или пре-В-клетки) и L3 - лимфобласты (В-клетки; клетки Беркитта). Согласно другому варианту осуществления, острый лимфоцитарный лейкоз возникает в бластных клетках костного мозга (В-клетках). Согласно еще одному варианту осуществления, острый лимфоцитарный лейкоз возникает в тимусе (Т-клетки). Согласно еще одному варианту осуществления, острый лимфоцитарный лейкоз представляет собой L1 тип, характеризующийся созревающими лимфобластами (Т-клетки или пре-В-клетки). Согласно еще одному варианту осуществления, острый лимфоцитарный лейкоз представляет собой L2 тип, характеризующийся незрелыми и плеоморфными (с разными формами) лимфобластами (Т-клетки или пре-В-клетки). Согласно еще одному варианту осуществления, острый лимфоцитарный лейкоз представляет собой L3 тип, характеризующийся лимфобластами (В-клетки; клетки Беркитта).
Согласно еще одному варианту осуществления, лейкоз представляет собой Т-клеточный лейкоз. Согласно одному варианту осуществления, Т-клеточный лейкоз представляет собой периферический Т-клеточный лейкоз, Т-клеточный лимфобластный лейкоз, кожный Т-клеточный лейкоз и Т-клеточный лейкоз взрослых. Согласно другому варианту осуществления, Т-клеточный лейкоз представляет собой периферический Т-клеточный лейкоз. Согласно еще одному варианту осуществления, Т-клеточный лейкоз представляет собой Т-клеточный лимфобластный лейкоз. Согласно еще одному варианту осуществления, Т-клеточный лейкоз представляет собой кожный Т-клеточный лейкоз. Согласно еще одному варианту осуществления, Т-клеточный лейкоз представляет собой Т-клеточный лейкоз взрослых.
Согласно еще одному варианту осуществления, лейкоз представляет собой лейкоз с филадельфийской хромосомой. Согласно одному варианту осуществления, лейкоз с филадельфийской хромосомой представляет собой AML с филадельфийской хромосомой, включая без ограничения недифференцированный AML (M0), миелобластный лейкоз (M1), миелобластный лейкоз (M2), промиелоцитарный лейкоз (M3 или M3 вариант [M3V]), миеломоноцитарный лейкоз (M4 или M4 вариант с эозинофилией [M4E]), моноцитарный лейкоз (M5), эритролейкоз (M6) или мегакариобластный лейкоз (M7). Согласно другому варианту осуществления, лейкоз с филадельфийской хромосомой представляет собой ALL с филадельфийской хромосомой.
Согласно еще одному варианту осуществления, лейкоз представляет собой лейкоз, устойчивый к лекарствам. Согласно еще одному варианту осуществления, желудочно-кишечная стромальная опухоль (GIST) представляет собой опухоль, устойчивую к лекарствам. Согласно еще одному варианту осуществления, меланома представляет собой опухоль, устойчивую к лекарствам. Согласно одному варианту осуществления, субъект характеризуется развитием лекарственной устойчивости к противораковой терапии.
Злокачественные опухоли, подлежащие лечению согласно настоящему документу, могут быть первичными или метастатическими. Согласно одному варианту осуществления, злокачественная опухоль представляет собой солидную метастатическую опухоль или метастатическую опухоль крови. Согласно другому варианту осуществления, злокачественная опухоль представляет собой метастатическую злокачественную опухоль кости.
В настоящем документе также представлены способы модулирования активности или внутриклеточного распределения CSF1R киназы в клетке, ткани или целом организме, с использованием соединений или композиций, представленных в настоящем документе, или их фармацевтически приемлемых солей, сольватов, гидратов, клатратов, отдельных стереоизомеров, смеси стереоизомеров или рацемической смеси стереоизомеров.
Согласно одному варианту осуществления, активный(ые) ингредиент(ы) вводят в количестве, достаточном для доставки пациенту терапевтически эффективного количества активного соединения, например, с целью лечения заболеваний, описанных в настоящем документе, без индукции у подвергающегося лечению субъекта серьезных токсичных эффектов.
Обычная доза соединения может находиться в пределах приблизительно от 1 приблизительно до 50 мг/кг, приблизительно от 1 приблизительно до 20 мг/кг, приблизительно от 0,1 приблизительно до 10 мг/кг, приблизительно от 0,5 мг/кг приблизительно до 10 мг/кг массы тела в сутки, более предпочтительно приблизительно от 0,1 приблизительно до 100 мг/кг массы реципиента в сутки. В качестве альтернативы, обычная доза соединения может находиться в пределах приблизительно от 50 приблизительно до 500 мг. Могут быть использованы более низкие дозировки, например, дозы, составляющие приблизительно 0,5-100 мг, 0,5-10 мг или 0,5-5 мг на килограмм массы тела в сутки. Могут быть применимы даже более низкие дозы, а потому пределы могут включать приблизительно от 0,1-0,5 мг/кг массы тела реципиента в сутки. Эффективный диапазон доз фармацевтически приемлемых производных вычисляют, основываясь на массе исходного соединения, подлежащей доставке. Если само производное демонстрирует активность, то эффективная доза может быть оценена, как указано выше, с использованием массы производного, или посредством других способов, известных специалистам в данной области техники.
Соединения подходящим образом вводят в единицах дозирования любой подходящей лекарственной формы, включая без ограничения таковую, содержащую приблизительно от 1 до 2000 мг, приблизительно от 10 до 1000 мг или приблизительно от 25 до 700 мг активного ингредиента на стандартную лекарственную форму. Согласно одному варианту осуществления, стандартную дозу выбирают из 12, 18, 25, 27, 40, 50, 60, 90, 100, 135, 200, 250, 300, 400, 450, 500, 600, 675, 700, 800, 900 и 1000 мг. Например, подходящая пероральная дозировка обычно составляет приблизительно от 25 до 1000 мг, включая в виде однократной или многократной лекарственной формы по 10, 12, 18, 25, 27, 40, 50, 60, 90, 100, 135, 200, 250, 300, 400, 450, 500, 600, 675, 700, 800, 900 или 1000 мг. Согласно определенным вариантам осуществления, могут быть использованы более низкие дозировки, например, приблизительно 10-100 или 1-50 мг. Также предусмотрены дозы, составляющие 0,1-50 мг, 0,1-20 мг или 0,1-10 мг. Кроме того, в случае введения путем, отличным от перорального, как например, путем инъекции или ингаляции, могут быть использованы более низкие дозы.
Активный ингредиент может быть введен сразу или может быть разделен на некоторое число меньших доз для введения с интервалами во времени. Следует понимать, что точная дозировка и длительность лечения зависят от подлежащего лечению заболевания, и могут быть определены эмпирически с использованием известных протоколов тестирования или путем экстраполирования данных тестирования in vivo или in vitro. Следует указать, что значения концентраций и дозировки также могут варьировать от тяжести состояния, интенсивность которого подлежит уменьшению. Также следует понимать, что для каждого конкретного субъекта с течением времени должны быть подобраны специфические режимы дозирования в соответствии с индивидуальными потребностями и профессиональным суждением субъекта, производящего введение или контролирующего введение композиций, и диапазоны концентраций, изложенные в настоящем документе, являются лишь типичными и не предназначены для ограничения объема или практического применения композиций, представленных в настоящем документе.
Согласно определенным вариантам осуществления, соединение или композиция, представленные в настоящем документе, могут быть введены в виде однократной ежесуточной дозы (QD) или в виде отдельных доз в течение суток. Согласно определенным вариантам осуществления, соединение или композицию вводят четыре раза в сутки (QID). Согласно определенным вариантам осуществления, соединение или композицию вводят три раза в сутки (TID). Согласно определенным вариантам осуществления, соединение или композицию вводят два раза в сутки (BID). Согласно определенным вариантам осуществления, соединение или композицию вводят один раз в сутки (QD).
Введение также может быть непрерывным (т.е. ежесуточно в течение последовательных дней или каждый день) или периодическим. Используемый в настоящем документе термин «периодический» или «периодически» предназначен для обозначения остановки и начала как с регулярными, так и с нерегулярными интервалами. Например, периодическое введение соединения Формулы I может представлять собой введение в течение от одних до шести суток в неделю или введение через сутки.
Согласно одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят периодически. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят периодически один раз в неделю, два раза в неделю или три раза в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят один раз в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят два раза в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят три раза в неделю. Согласно одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят QD периодически один раз в неделю, два раза в неделю или три раза в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят QD один раз в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят QD два раза в неделю. Согласно еще одному варианту осуществления, соединение или композицию, представленную в настоящем документе, вводят QD три раза в неделю.
Согласно одному варианту осуществления, активный ингредиент вводят для достижения пика концентрации активного соединения в плазме крови, составляющего приблизительно от 0,02 до 20 мкМ, приблизительно от 0,2 приблизительно до 5 мкМ или приблизительно от 0,5 до 10 мкМ. Например, это может быть достигнуто путем внутривенной инъекции 0,1-5% раствора активного ингредиента, необязательно в солевом растворе, или введено в виде болюса с активным ингредиентом. Следует понимать, что для каждого конкретного субъекта с течением времени должны быть подобраны специфические режимы дозирования в соответствии с индивидуальными потребностями, которые будут варьировать в зависимости от скоростей всасывания, инактивации и выведения лекарства. Концентрации, изложенные в настоящем документе, были лишь типичными и не предназначены для ограничения объема или практического применения заявленных композиций. Активный ингредиент может быть введен весь сразу или может быть разделен на некоторое число меньших доз для введения через различные интервалы времени.
Объект настоящего изобретения был описан иллюстративно, и следует понимать, что использованная терминология подразумевает скорее описательный характер, а не ограничительный. Поэтому специалистам в данной области техники следует понимать, что условия, такие как выбор растворителя, температуры реакции, объемов, реакционного времени, могут варьировать, но при этом желаемые соединения все еще будет производиться. Кроме того, специалистам в данной области техники также следует понимать, что многие из реагентов, представленные в примерах, могут быть заменены другими подходящими реагентами (см., например, Smith & March, Advanced Organic Chemistry, 5th ed. (2001)).
F. КОМБИНИРОВАННАЯ ТЕРАПИЯ
Кроме того, специалистам в данной области техники следует понимать, что соединения, изомеры и фармацевтически приемлемые соли, гидраты, сольваты, представленные в настоящем документе, включая фармацевтические композиции и составы, содержащие указанные соединения, могут быть использованы для широкого ряда комбинированных видов терапии для лечения описанных выше состояний и заболеваний. Поэтому настоящий документ также предполагает использование соединений и фармацевтически приемлемых солей, представленных в настоящем документе, в сочетании с другими активными фармацевтическими средствам для лечения заболевания/состояний, описанных в настоящем документе.
Согласно одному варианту осуществления, дополнительные фармацевтические средства включают в себя без ограничения противораковые средства (включая химиотерапевтические средства и антипролиферативные средства), противовоспалительные средства, иммуномодулирующие средства или иммуносупрессорные средства.
Согласно определенным вариантам осуществления, такие противораковые средства включают в себя антиметаболиты (например, 5-фторурацил, цитарабин, клофарабин, метотрексат, флударабин и другие), антимикротубулиновые средства (например, алкалоиды барвинка, такие как винкристин, винбластин; таксаны, такие как паклитасксел и доцетаксел), алкилирующие средства (например, циклофосфамид, мелфалан, кармустин, нитрозомочевины, такие как бисхлорэтилнитрозомочевина и гидроксимочевина), средства, содержащие платину (например, цисплатин, карбоплатин, оксалиплатин, сатраплатин и CI-973), антрациклины (например, доксорубицин и даунорубицин), противоопухолевые антибиотики (например, митомицин, идарубицин, адриамицин и дауномицин), ингибиторы топоизомеразы (например, этопозид и камптотецины), средства антиангиогенеза (например, Сутент®, сорафениб и Бевацизумаб) или любые другие цитотоксические средства (например, фосфат эстрамустина, преднимустин), гормоны или агонисты гормонов, антагонисты, частичные агонисты или частичные антагонисты, ингибиторы киназ (такие как иматиниб) и радиационную терапию.
Согласно определенным вариантам осуществления, такие противовоспалительные средства включают в себя ингибиторы матриксных металлопротеиназ, ингибиторы провоспалительных цитокинов (например, анти-TNF молекулы, растворимые рецепторы TNF и IL-1) нестероидные противовоспалительные лекарства (NSAID), такие как ингибиторы синтазы простагландинов (например, салицилат холина магния и салициловая кислота), ингибиторы COX-1 или COX-2, агонисты глюкокортикоидных рецепторов (например, кортикостероиды, метилпреднизон, преднизон и кортизон) или антифолаты, такие как метотрексат.
Соединение или композиция, представленные в настоящем документе, или фармацевтически приемлемая соль соединения, могут вводиться одновременно с одним или несколькими вышеупомянутыми средствами, перед их введением или после их введения.
Также предоставлены фармацевтические композиции, содержащие соединение, представленное в настоящем документе, или его фармацевтически приемлемую соль, и одно или несколько из вышеупомянутых средств.
Согласно одному варианту осуществления, также предоставлена комбинированная терапия, которая оказывает лечение или предупреждает возникновение симптомов или ассоциированных со злокачественной опухолью осложнений и связанных с ней заболеваний или нарушений, причем упомянутая терапия включает в себя введение субъекту, нуждающемуся в этом, одного из соединений или композиций, раскрытых в настоящем документе, или его фармацевтически приемлемых солей, вместе с одним или несколькими противораковыми средствами. Согласно другому варианту осуществления, также предоставлена комбинированная терапия, которая оказывает лечение или предупреждает возникновение симптомов остеопороза и связанных с ним заболеваний или нарушений, причем упомянутая терапия включает в себя введение субъекту, нуждающемуся в этом, одного из соединений или композиций, раскрытых в настоящем документе, или его фармацевтически приемлемых солей, вместе с одним или несколькими противовоспалительными или иммуномодулирующими средствами. Согласно еще одному варианту осуществления, также предоставлена комбинированная терапия, которая оказывает лечение или предупреждает возникновение симптомов ревматоидного артрита и связанных с ним заболеваний или нарушений, причем упомянутая терапия включает в себя введение субъекту, нуждающемуся в этом, одного из соединений или композиций, раскрытых в настоящем документе, или его фармацевтически приемлемых солей, вместе с одним или несколькими противовоспалительными или иммуномодулирующими средствами.
G. ПОЛУЧЕНИЕ СОЕДИНЕНИЙ
Исходные вещества в примерах синтеза, представленных в настоящем документе, являются доступными либо из коммерческих источников, или при помощи известных из литературы методик (например, March Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, (1992) 4th Ed.; Wiley Interscience, New York). Если не указано иное, то все коммерчески доступные соединения использовали без дополнительной очистки. Спектры протонного (1H) ядерного магнитного резонанса (ЯМР) с частотой 300 МГц регистрировали на ЯМР-спектрометре Bruker Avance 300. Значимые пики классифицируют и обычно включают: число протонов и мультиплетность (с, синглет; д, дублет; т, триплет; кв, квартет; м, мультиплет; уш.с, уширенный синглет). Химические сдвиги приведены в миллионных долях (δ) относительно тетраметилсилана. Масс-спектры низкого разрешения (MS) получали в виде масс-спектров с ионизацией электрораспылением (ESI), которые регистрировали на приборе Shimadzu HPLC/MS с использованием условий с обращенной фазой (ацетонитрил/вода, 0,05% уксусная кислота). Препаративную HPLC с обращенной фазой обычно проводили с использованием системы Varian HPLC, оборудованной колонкой Phenomenex с фенилгексилом, колонкой Phenomenex Luna C18 или колонкой с обращенной фазой Varian Pursuit с дифенилом; обычные условия элюирования предполагали использование градиента с постепенно растущим соотношением содержания от органического сорастворителя (0,05% HOAc/CH3CN или 0,05% HOAc/MeOH) до водного сорастворителя (0,05% водн. HOAc). Хроматографию на силикагеле проводили либо с ручным управлением, обычно следуя методике, опубликованной для флэш-хроматографии (Still et al. (1978) J. Org. Chem. 43:2923), или на автоматизированной системе (например, Biotage SP instrument) с использованием предварительно заполненных силикагелем колонок.
Следует понимать, что в последующем описании комбинации заместителей и/или переменных в изображенных формулах допустимы, только, если такие комбинации приводят к образованию стабильных в стандартных условиях соединений.
Специалистами в данной области техники также следует понимать, что в описанном ниже способе может потребоваться защита функциональных групп промежуточных соединений подходящими защитными группами. Такие функциональные группы включают в себя гидрокси, амино, меркапто и карбоновую кислоту. Подходящие защитные группы для гидрокси включают в себя триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и т.п. Подходящие защитные группы для амино, амидино и гуанидино включают в себя трет-бутоксикарбонил, бензилоксикарбонил и т.п. Подходящие защитные группы для меркапто включают в себя -C(O)-R (где R представляет собой алкил, арил или аралкил), пара-метоксибензил, тритил и т.п. Подходящие защитные группы для карбоновой кислоты включают в себя алкильные, сложные арильные или аралкильные эфиры.
Защитные группы могут быть введены или удалены в соответствии со стандартными методиками, которые хорошо известны специалистам в данной области техники и которые описаны в настоящем документе. Использование защитных групп подробно описано в Green, T.W. and P.G.M. Wutz, Protective Groups in Organic Synthesis (1991), 2nd Ed., Wiley-Interscience.
Средний специалист в данной области техники может легко установить, каков возможен выбор для каждого заместителя в реакционных условиях, представленных для каждой схемы. Более того, заместители выбирают из компонентов, указанных выше в настоящем описании, и они могут быть присоединены к исходным веществам, промежуточным соединениям и/или конечным продуктам согласно схемам, известным средним специалистам в данной области техники.
Также очевидно, что представленные в настоящем документе соединения могут существовать в виде одного или нескольких изомеров, а именно E/Z-изомеров, энантиомеров и/или диастереомеров.
Если не отмечено иное, то соединения формулы (I), как правило, могут быть получены, как представлено на последующих схемах; значения различных заместителей определены в другом месте настоящего документа.
В настоящем документе используются стандартные аббревиатуры и акронимы, определенные в J. Org. Chem. 2007 72(1): 23A-24A. Другие используемые в настоящем изобретении аббревиатуры и акронимы являются следующими:
|
|
Схема 1: Общий синтез соединений формулы (I)
Согласно иллюстративному способу, определенные соединения формулы (I) могут быть получены стандартным способом синтеза, представленным на схеме 1. Легкодоступные 2-аминозамещенные азольные соединения 1 являются либо коммерчески доступными, либо могут быть получены из соответствующих 4-аминоарилкарбоксилатов или 4-аминогетероариларбоксилатов с использованием методик, аналогичных описанным Molinos-Gomez, et al. Tetrahedron 61, 9075 (2005). Амины 1 могут быть преобразованы в бромиды 2 в условиях Зандмейера источником брома, таким как без ограничения бромид меди, с использованием органического нитрита, такого как без ограничения трет-бутилнитрит или изо-амилнитрит. Реакция может быть проведена в растворителе, таком как без ограничения MeCN. Карбоксилаты соединения 2 могут быть восстановлены с получением спиртов 3 восстановителем, такого как без ограничения DIBAL-H или LiBH4, в растворителе, таком как без ограничения DCM или THF. Спирты 3 могут быть преобразованы в сульфонаты 4 с использованием агента сульфонирования, такого как без ограничения метансульфонилхлорид или пара-толуолсульфонилхлорид. Реакция может быть проведена в растворителе, таком как без ограничения DCM или THF, и ускорена основанием, таким как без ограничения TEA или пиридин. Алкилирование гетероарилов/гетероциклилов 5 сульфонатом 4 с получением соединений 6 может быть выполнено в присутствии основания, такого как без ограничения NaH или t-BuOK. Алкилирование может быть проведено в растворителе, таком как без ограничения DMF или THF, при повышенной температуре, если это необходимо. Региохимия алкилирования может быть определена посредством тщательного рассмотрения двумерного ядерного эффекта Оверхаузера (NOE) в ЯМР-спектрах продуктов. Бромиды 6 могут быть обработаны амином 7 в условиях нуклеофильного замещения при повышенной температуре в растворителе, таком как без ограничения DMA или DMF, и реакция может быть ускорена основанием, таким как без ограничения DIEA или TEA, с получением соединений 8.
Схема 2: Общий синтез соединений формулы (I)
Согласно иллюстративному способу определенные соединения формулы (I) могут быть получены стандартным способом синтеза, представленным на схеме 2. Легкодоступные аминоарильные/гетероарильные соединения 9 могут быть преобразованы в бромиды 10 агентом бромирования, таким как без ограничения N-бромсукцимид или бром. Реакция может быть проведена в растворителе, таком как без ограничения MeCN или DCM. Конденсированием бромидов 10 O-этилкарбонодитиоатом калия в растворителе, таком как без ограничения DMF, в условиях нагревания с обратным холодильником могут быть получены меркаптановые соединения 11, которые могут быть алкилированы йодметаном с получением метилсульфидов 12. Реакция может быть проведена в растворителе, таком как без ограничения DMF или DMA, и ускорена основанием, таким как без ограничения K2CO3 или Cs2CO3, при повышенной температуре, если это необходимо. В качестве альтернативы, метилсульфиды 12 могут быть получены, используя в качестве исходных веществ бромиды 2, путем обработки тиометоксидом натрия в растворителе, таком как без ограничения THF или MeCN. Карбоксилатная группа соединения 12 может быть восстановлена с получением спиртов 13 восстановителем, такого как без ограничения DIBAL-H или LiBH4, в растворителе, таком как без ограничения DCM или THF. Спирты 13 могут быть преобразованы в хлориды 14 с использованием агента, такого как без ограничения тионилхлорид или оксалилхлорид, в растворителе, таком как без ограничения DCM. Реакция может быть катализирована путем добавления небольшого количества DMF. Алкилирование гетероарилов/гетероциклилов 5 хлоридами 14 с получением соединений 15 может быть выполнено основанием, таким как без ограничения NaH или t-BuOK. Алкилирование может быть проведено в растворителе, таком как без ограничения DMF или THF, при повышенной температуре, если это необходимо. Сульфидный фрагмент соединения 15 может быть окислен до соответствующего сульфоксида окислителем, таким как без ограничения m-CPBA или перуксусная кислота. Окисление может быть проведено в растворителе, таком как без ограничения DCM или AcOH. Сульфинильная группа соединения 16 может быть вытеснена амином 7 в условиях нуклеофильного замещения при повышенной температуре с получением соединений 8. Реакция может быть проведена в растворителе, таком как без ограничения DMA или DMF, и ускорена основанием, таким как без ограничения DIEA или TEA.
Схема 3: Общий синтез соединений формулы (I)
Согласно другому иллюстративному способу соединения формулы (I) также могут быть получены способом синтеза, представленным на схеме 3. Гетероарилбромиды 3 могут взаимодействовать с аминами 7, как описано ранее, с получением продуктов 17, которые могут быть окислены до соответствующих альдегидов 18 окислителем, таким как без ограничения перийодат Десса-Мартина или MnO2, в растворителе, таком как без ограничения DCM или MeCN. Конденсация альдегидов 18 и гетероарилов 19 может обеспечивать карбинольные соединения 20 (R=H). Конденсация может быть ускорена основанием, таким как без ограничения KOH или NaOH, в растворителе, таком как без ограничения MeOH или EtOH. Если реакцию проводят в спиртовом растворителе, то также могут быть выделены продукты 20 (R = алкил). Восстановление соединений 20 силаном, таким как без ограничения Et3SiH, ускоренное добавлением кислоты, такой как без ограничения трифторуксусная кислота или метансульфоновая кислота, будет обеспечивать соединения 21. Реакция восстановления может быть проведена в растворителе, таком как без ограничения DCM или MeCN.
Схема 4: Общий синтез соединений формулы (I)
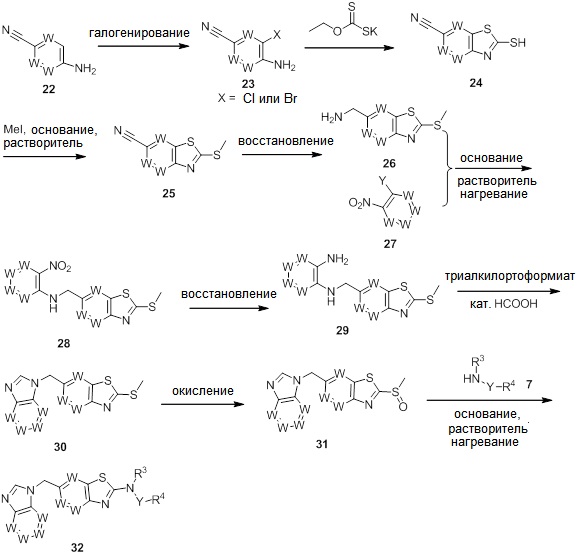
Согласно другому иллюстративному способу определенные соединения формулы (I) могут быть получены стандартным способом синтеза, представленным на схеме 4. Легкодоступные аминоарильные/гетероарильные нитрилы 22 могут быть обработаны галогенирующим агентом, таким как без ограничения N-хлорсукцимид или N-бромсукцимид, с получением галогенированных продуктов 23. Реакция может быть проведена в растворителе, таком как без ограничения MeCN или DCM. Конденсация соединений 23 O-этилкарбонодитиоатом калия в растворителе, таком как без ограничения DMF, в условиях нагревания с обратным холодильником могут быть получены меркаптановые соединения 24, которые могут быть алкилированы йодметаном с получением метилсульфидов 25. Реакция метилирования может быть проведена в растворителе, таком как без ограничения DMF или DMA, и ускорена основанием, таким как без ограничения K2CO3 или Cs2CO3, при повышенных температурах, если это необходимо. Нитрильная группа соединения 25 может быть восстановлена до аминометильных соединений 26 восстановителем, таким как без ограничения LiAlH4 или борид никеля, в растворителе, таком как без ограничения THF или диэтиловый эфир. Арильные/гетероарильные соединения 27, соответствующим образом замещенные галогеновыми и нитрогруппами, могут взаимодействовать с аминами 26 с получением соответствующих амино- и нитрозамещенных арильных/гетероарильных соединений 28, реакция может быть ускорена основанием, таким как без ограничения K2CO3 или DIEA, в растворителе, таком как без ограничения DMF или DMA. Реакция может быть дополнительно ускорена повышением температур, если это необходимо. Нитрогруппа соединения 28 может быть восстановлена до аминогруппы восстановителем, таким как без ограничения Zn или Fe, в присутствии кислоты, такой как без ограничения AcOH или HCl, в растворителе, таком как без ограничения DCM или EtOH. Диаминогетероарилы 29 могут взаимодействовать с триалкилортоформиатом, таким как без ограничения триметилортоформиат или триэтилортоформиат, с образованием бициклических гетероарильных соединений 30. Реакция циклизации может быть ускорена кислым катализатором, таким как без ограничения HCOOH или AcOH, при повышенной температуре. Сульфиды 30 могут быть преобразованы в сульфоксиды 31, а затем в конечные соединения 32, как описано для схемы 2.
Схема 5: Общий синтез соединений формулы (I)
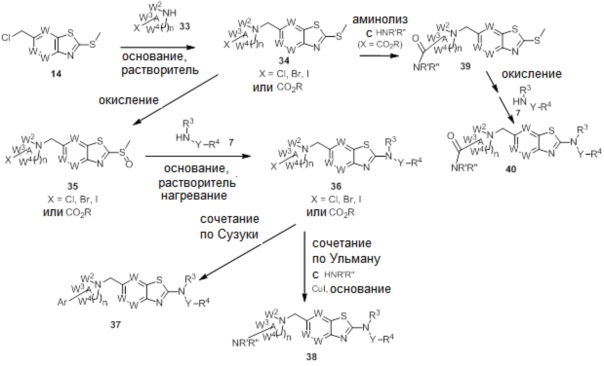
Согласно другому иллюстративному способу соединения формулы (I) также могут быть получены способом синтеза, представленным на схеме 5. Алкилирование гетероарилов/гетероциклилов 33 хлоридами 14 с получением соединений 34 может быть выполнено основанием, таким как без ограничения NaH или t-BuOK. Алкилирование может быть проведено в растворителе, таком как без ограничения DMF или THF, при повышенных температурах, если это необходимо. После двустадийной последовательности окисления и нуклеофильного замещения, описанной на схеме 2, сульфиды 34 сначала могут быть преобразованы в сульфоксиды 35, а затем в соединения 36. Сочетание по Сузуки соединения 36 с арильным или гетероарильными бороновыми кислотами или сложными боронатными эфирами, катализированное палладиевым катализатором, таким как без ограничения Pd(dppf)Cl2 или PdCl2(PPh3)2, в растворителе, таком как без ограничения MeCN или 1,4-диоксан, может обеспечивать арилгетероарильные/бигетероарильные соединения 37. Реакция по Сузуки может быть ускорена основанием, таким как без ограничения Na2CO3 или KOAc, при повышенных температурах, если это необходимо. Соединения 36 также могут подвергаться сочетанию по Ульману NH-содержащим нуклеофилом, таким как без ограничения амин или карбоксимид, с получением соединений 38. Реакция может быть катализирована катализатором, таким как без ограничения йодид меди(I) или медь, ускорена основанием, таким как без ограничения K2CO3 или Cs2CO3, и проведена в растворителе, таком как без ограничения DMF или NMP, при повышенной температуре. В качестве альтернативы, соединения 34 (X=CO2R) могут подвергаться аминолизу любым из различных аминов с получением карбоксамидов 39. Реакция может быть ускорена реагентом, таким как без ограничения триметилалюминий или триэтилалюминий, и проведена в растворителе, таком как без ограничения DCE или DCM. После двустадийной последовательности окисления и нуклеофильного замещения, описанной на схеме 2, соединения 39 могут быть преобразованы в конечные соединения 40.
Схема 6: Общий синтез соединений формулы (I)
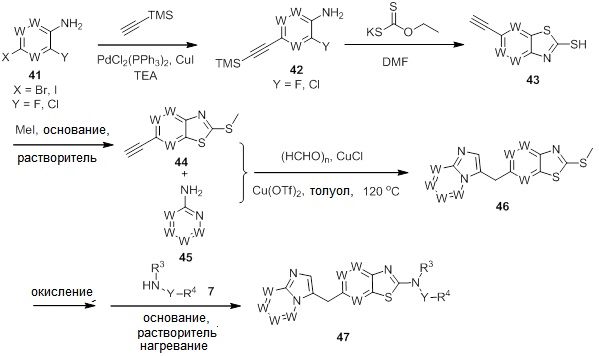
Согласно другому иллюстративному способу соединения формулы (I) также могут быть получены способом синтеза, представленным на схеме 6. Используя в качестве исходных веществ соответствующие аминоарильные/гетероарильные дигалогениды 41, сочетанием по Соногашира с этинилтриметилсиланом, катализируемым катализатором, таким как PdCl2(PPh3)2 или PdCl2(dppf), могут быть получены ацетилены 42. Реакция сочетания может быть ускорена основанием, таким как без ограничения DIEA или TEA, и проведена в растворителе, таком как без ограничения DMF или MeCN, при повышенных температурах, если это необходимо. Конденсированием соединения 42 O-этилкарбонодитиоатом калия в растворителе, таком как без ограничения DMF, при нагревании могут быть получены меркаптановые соединения 43, которые могут быть алкилированы йодметаном с получением метилсульфидов 44. Реакция может быть проведена в растворителе, таком как без ограничения DMF или DMA, и ускорена основаниями, такими как без ограничения K2CO3 или Cs2CO3, при повышенных температурах, если это необходимо. Трехкомпонентной циклизацией с использованием ацетиленов 44, аминоарильных/гетероарильных соединений 45 и параформальдегида в растворителе, таком как без ограничения толуол, при повышенной температуре, получают соединения 46. Циклизация может быть ускорена катализатором, таким как без ограничения хлорид меди(I) и трифталат меди(II). После двустадийной последовательности окисления и нуклеофильного замещения, описанной на схеме 2, соединения 46 могут быть преобразованы в конечные соединения 47.
Схема 7: Общий синтез соединений формулы (I)
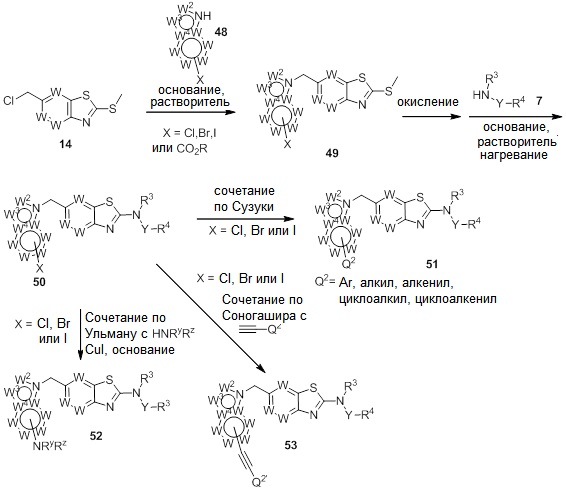
Согласно другому иллюстративному способу соединения формулы (I) также могут быть получены способом синтеза, представленным на схеме 7. Алкилированием гетероарилов 48 (где X соединен с W = углерод) хлоридами 14 согласно схеме 2 в условиях, описанных на схеме 2, могут быть получены соединения 49. После двустадийной последовательности окисления и нуклеофильного замещения, описанной на схеме 2, соединения 49 могут быть преобразованы в традиционные промежуточные соединения 50. Как описано на схеме 5, сочетанием по Сузуки соединения 50 с агентами сочетания, такими как без ограничения бороновые кислоты, сложные боронатные эфиры или трифторбораты Моландера, могут быть получены соединения 51. Сочетанием Ульмана соединения 50 с NH-содержащими нуклеофилами, такими как без ограничения амины или карбоксамиды, в условиях, описанных для схемы 5, могут быть получены соединения 52. Сочетанием по Соногашира соединения 50 с ацетиленами в условиях, описанных для схемы 6, могут быть получены соединения 53.
Схема 8: Общий синтез соединений формулы (I)
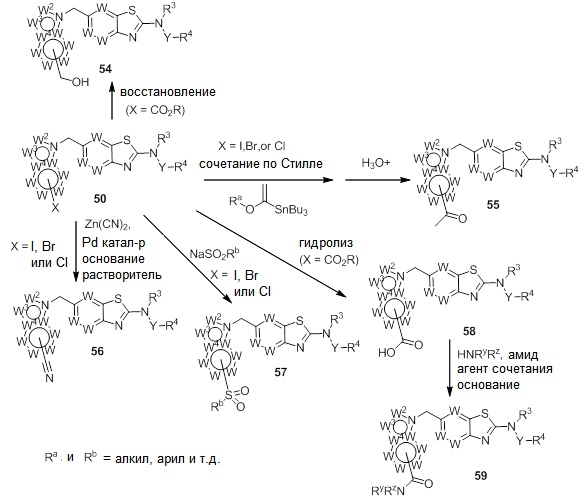
Согласно другому иллюстративному способу соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 8. Используя в качестве исходных веществ традиционные промежуточные соединения 50, описанные на схеме 7, восстановлением карбоксилатов соединения 50 (X=CO2R) восстановителем, таким как без ограничения DIBAL-H или LiBH4, в растворителе, таком как без ограничения DCM или THF, могут быть получены спирты 54. Сочетанием по Стилле соединения 50 (X=I, Br или Cl) с соответствующим трибутилалкоксивинилстаннаном, с последующим гидролизом кислотой могут быть получены ацетильные соединения 55. Реакцию обычно катализируют катализатором, таким как Pd(PPh3)4, и проводят в растворителе, таком как без ограничения DMF или DMA. По аналогии, опосредованное палладием цианирование соединения 50 (X=I, Br или Cl) реагентом, таким как без ограничения Zn(CN)2, может обеспечивать цианосоединения 56. Реакцию катализируют катализатором, таким как PdCl2(PPh3)2 или PdCl2(dppf), ускоряют основаниями, такими как без ограничения DIEA или TEA, и проводят в растворителях, таких как без ограничения DMF или MeCN, при повышенной температуре. По аналогии, опосредованное палладием сульфонилирование соединения 50 (X=I, Br или Cl) реагентом, таким как без ограничения метансульфинат натрия, может формировать сульфонильные соединения 57. Реакцию катализируют катализатором, таким как без ограничения трифторметансульфонатбензольный комплекс меди(I), ускоряют амином, таким как без ограничения несимметричный N,N-диметилэтилендиамин, и проводят в растворителе, таком как без ограничения DMF или DMSO, при повышенной температуре. Карбоксилат традиционных промежуточных соединений 50 (X=CO2R) может быть гидролизован основанием, таким как без ограничения NaOH или KOH, в растворителе, таком как без ограничения MeOH или THF, с получением карбоновых кислот 58. Сочетанием кислот 58 с любым из различных аминов с использованием пептидных агентов сочетания, таких как без ограничения EDCI или HATU, могут быть получены карбоксамиды 59. Реакция может быть ускорена основанием, таким как без ограничения DIEA или TEA, и проведена в растворителе, таком как без ограничения DMF или THF.
Схема 9: Общий синтез соединений формулы (I)
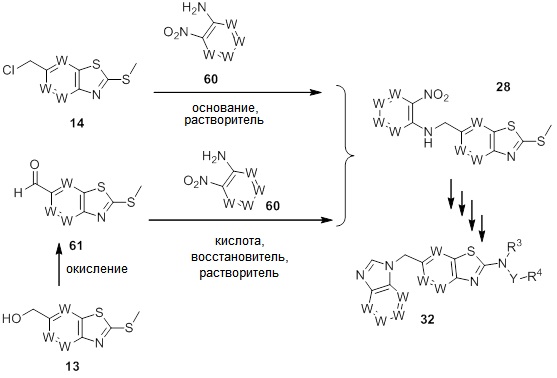
Согласно другому иллюстративному способу соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 9. Алкилирование аминонитроарилов/гетероарилов 60 хлоридами 14 может быть проведено основанием, таким как без ограничения NaH или t-BuOK, с получением соединений 28. Алкилирование может быть проведено в растворителе, таком как без ограничения DMF или THF. В качестве альтернативы, спирты 13 могут быть окислены до альдегидов 61 окислителем, таким как без ограничения перийодат Десса-Мартина или MnO2, в растворителе, таком как без ограничения DCM или MeCN. Восстановительное алкилирование аминонитроарилов/гетероарилов 60 альдегидами 61 может быть проведено восстановителем, таким как без ограничения NaCNBH3 или Na(OAc)3BH, обычно в присутствии кислоты, такой как без ограничения TFA или AcOH, с получением соединений 28. Реакция восстановительного алкилирования может быть проведена в растворителе, таком как без ограничения DCM или DCE. Соединения 28 могут быть преобразованы в конечные соединения 32, как описано на схеме 4.
Схема 10: Общий синтез соединений формулы (I)
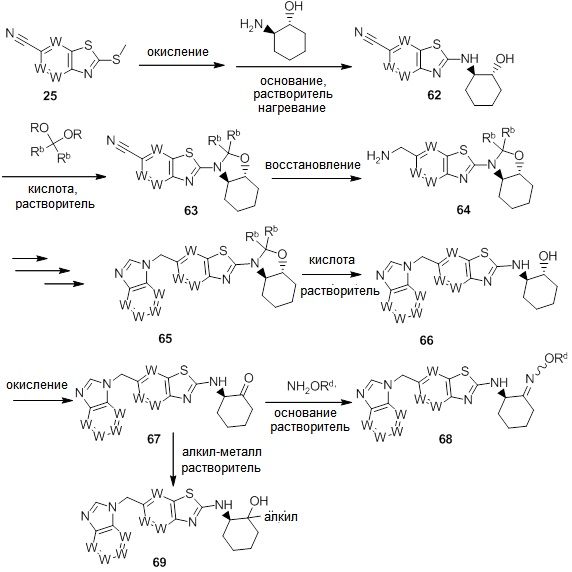
Согласно другому иллюстративному способу соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 10. Используя в качестве исходных веществ нитрилы 25 из схемы 4, окисление сульфидного фрагмента и нуклеофильное замещение аминовыми спиртами, такими как без ограничения простой стереоизомер 2-аминоциклогексанола, может обеспечивать соединения 62. Одновременной защитой NH и OH групп соединения 62 обработкой кеталем, таким как без ограничения 2,2-диметоксипропан, в присутствии кислого катализатора, такого как без ограничения пара-толуолсульфоновая кислота или камфорсульфокислота, в растворителе, таком как без ограничения толуол или 1,4-диоксан, с нагреванием (при необходимости) могут быть получены соединения 63. Восстановление нитрильной группы соединения 63 может быть выполнено гидридом металла, таким как без ограничения LiAlH4 или борид никеля, в растворителе, таком как THF или диэтиловый эфир, с получением аминов 64. С применением процедур, аналогичных описанным в схеме 4 для превращения соединений 26 в соединения 30, в трехстадийной последовательности соединения 64 могут быть преобразованы в соединения 65, после чего защитная группа может быть удалена с использованием кислоты, такой как без ограничения TFA в DCM или HCl в 1,4-диоксане, с получением соединений согласно настоящему изобретению 66. Кроме того, соединения 66 могут быть окислены до кетонов 67 окислителем, таким как без ограничения перийодат Десса-Мартина или 2-йодоксибензойная кислота, в растворителе, таком как без ограничения DCM или MeCN. Обработкой кетонов 67 гидроксиламином или алкоксиламином при повышенной температуре в растворителе, таком как без ограничения EtOH или MeOH, могут быть образованы оксимы 68. Реакция может быть ускорена основанием, таким как без ограничения пиридин. С другой стороны, кетоны 67 могут взаимодействовать с металлорганическими агентами, такими как без ограничения реактивы Гриньяра или литийорганические агенты, в растворителе, таком как без ограничения THF или диэтиловый эфир, с получением соединений 69, которые могут быть образованы в виде смеси диастереоизомеров.
Схема 11: Общий синтез соединений формулы (I)
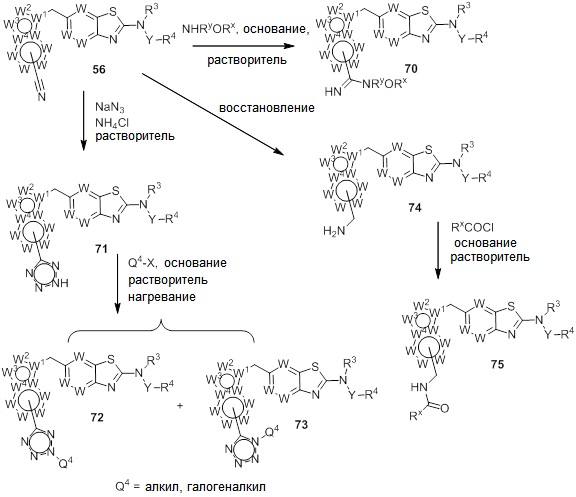
Согласно другому иллюстративному способу соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 11. Путем осуществления взаимодействия нитрилов 56 из схемы 8 с производными гидроксиламина при повышенной температуре в растворителе, таком как без ограничения EtOH или MeOH, могут быть получены гидроксиламидины или алкоксиламидины 70. Реакция может быть ускорена основанием, таким как без ограничения пиридин. Путем осуществления взаимодействия нитрилов 56 с азидом, например, NaN3 и NH4Cl, в растворителе, таком как без ограничения DMF или DMA, могут быть получены тетразольные соединения 71. Алкилированием тетразолов алкильными или галогеналкильными галогенидами с использованием оснований, таких как без ограничения K2CO3 или Cs2CO3, в растворителях, таких как без ограничения DMF или DMA, при повышенной температуре могут быть получены тетразольные производные 72 и 73. Восстановление нитрильной группы соединения 56 может быть осуществлено гидридами металла, такими как без ограничения LiAlH4 или борид никеля, в растворителе, таком как THF или диэтиловый эфир, с получением аминосоединений 74. Ацилированием аминогруппы соединения 74 ацилирующей группой в присутствии основания, такого как без ограничения пиридин или DIEA, в растворителе, таком как DCM или DCE, могут быть получены амиды 75; соответствующие карбаматы или мочевины могут быть получены подобным образом, с использованием в качестве ацилирующего агента хлорформиата или изоцианата, соответственно.
Схема 12: Общий синтез оксазольных соединений
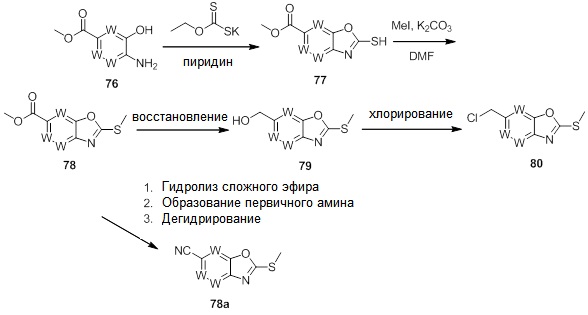
Согласно иллюстративному способу, используемые в настоящем документе оксазольные производные могут быть получены стандартным способом синтеза, представленным на схеме 12. Нагреванием аминофенолов 76 с O-этилкарбонодитиоатом калия в растворителе, таком как без ограничения пиридин, могут быть получены соединения 77. Как описано на схеме 2, посредством трехстадийной последовательности, состоящей из алкилирования, восстановления и хлорирования могут быть образованы хлоридные производные 80. Промежуточное соединение 78 из вышеуказанной последовательности может быть альтернативно преобразовано в нитрил 78a посредством стандартной трехстадийной последовательности, состоящей из гидролиза сложного эфира, образования первичного амида и дегидратации. Конечные оксазольные соединения согласно настоящему изобретению могут быть получены путем замены оксазолами 79 тиазолов 13 на схеме 9, и проведением оставшейся части последовательности синтеза с использованием методик, аналогичных описанным на схеме 9; дополнительные конечные оксазольные соединения согласно настоящему изобретению могут быть получены путем замены оксазолами 80 тиазолов 14 на схемах 2, 5, 7 и 9, и проведением оставшейся части соответствующих последовательностей синтеза с использованием методик, аналогичных описанным на схемах 2, 5, 7 или 9; и дополнительные конечные оксазольные соединения согласно настоящему изобретению могут быть также получены путем замены оксазолами 78a тиазолов 25 на схемах 4 и 10, и проведением оставшейся части соответствующих последовательностей синтеза с использованием методик, аналогичных описанным на схемах 4 или 10.
Схема 13: Общий синтез бициклических имидазольных производных (примеры гетероарилов 48)
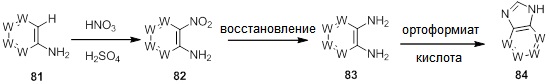
Согласно иллюстративному способу, используемые в настоящем документе бициклические имидазольные производные могут быть получены стандартным способом синтеза, представленным на схеме 13. Нитрование аминоарильных/гетероарильных соединений 81 может быть выполнено с использованием реагентов, таких как без ограничения смесь концентрированной серной кислоты и азотной кислоты, с получением аминонитросоединений 82. Восстановлением соединений 82 восстановителем, таким как без ограничения Zn или Fe, в присутствии кислоты, такой как без ограничения AcOH или HCl, в растворителе, таком как без ограничения DCM или EtOH, могут быть получены диаминосоединения 83. Соединения 83 могут быть преобразованы в бициклические имидазольные производные 84 путем осуществления взаимодействия с ортоформиатом, таким как без ограничения триметилортоформиат или триэтилортоформиат. Реакция может быть ускорена кислотным катализатором, таким как без ограничения HCOOH или AcOH, при повышенной температуре.
Схема 14: Общий синтез аминоспиртовых производных (примеры аминов 7)
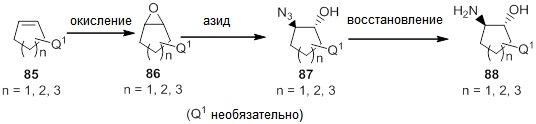
Согласно иллюстративному способу, используемые в настоящем документе аминоспиртовые производные могут быть получены стандартным способом синтеза, представленным на схеме 14. Циклоалкены 85 могут быть окислены реагентами, такими как без ограничения m-CPBA или NaOCl, с получением эпоксидов 86, которые могут взаимодействовать с азидом, таким как без ограничения TMSN3 или н-Bu4NN3, в растворителе, таком как без ограничения THF или DCM, с получением азидоспиртов 87. Азидогруппа соединения 87 может быть восстановлена до аминогруппы гидрированием или в условиях восстановления Штаудингера с получением аминоспиртов 88.
Схема 15: Общий синтез аминоспиртовых производных (примеры аминов 7)
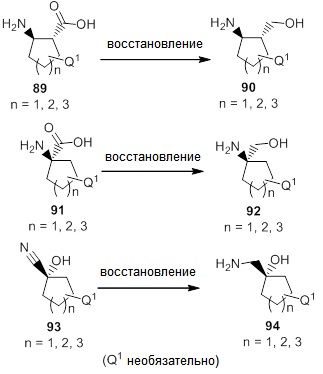
Согласно другому иллюстративному способу, используемые в настоящем документе аминоспиртовые производные могут быть также получены способом синтеза, представленным на схеме 15. Аминокислоты 89 и 91 могут быть восстановлены до аминоспиртов 90 и 92, соответственно, с использованием реагента, такого как без ограничения LiAlH4 или диборан, в растворителе, таком как THF или диэтиловый эфир. По аналогии, цианогидрины 93 могут быть восстановлены до аминоспиртов 94 гидридом металла, таким как без ограничения LiAlH4 или борид никеля, в растворителе, таком как THF или диэтиловый эфир.
Схема 16: Общий синтез 5-членных гетероарильных производных (примеры гетероциклильных соединений 5)
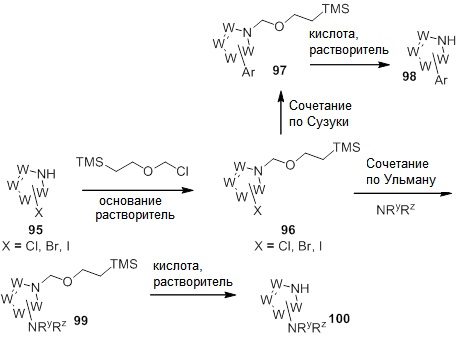
Согласно иллюстративному способу, определенные используемые в настоящем документе 5-членные гетероарильные производные могут быть получены стандартным способом синтеза, представленным на схеме 16. Гетероарилы 95, содержащие соответствующий галогеновый заместитель, могут быть защищены защитной группой, такой как без ограничения триметилсилилэтоксиметиленовая группа, с получением соединений 96. Защита может быть выполнена основанием, таким как без ограничения NaH или t-BuOK, и проведена в растворителе, таком как без ограничения DMF или THF, при повышенной температуре, если это необходимо. Галогенгетероарильные соединения 96 могут подвергаться сочетанию по Сузуки, как описано на схеме 5, с агентами сочетания, такими как без ограничения бороновые кислоты, боронатные сложные эфиры или трифторбораты Моландера, с получением соединений 97. Последующим удалением защитной группы с использованием реагента, такого как без ограничения TFA в DCM или HCl в 1,4-диоксане, могут быть получены гетероарильные производные 98. По аналогии, сочетанием по Ульману соединения 96 с NH-содержащими нуклеофилами, такими как без ограничения амин или карбоксамиды, можно получать соединения 99, с которых может быть удалена защитная группа, как описано выше, с получением гетероарильных производных 100.
Схема 17: Общий синтез 6-членных гетероарильных/гетероциклильных производных (примеры гетероарильных/гетероциклильных соединений 5)
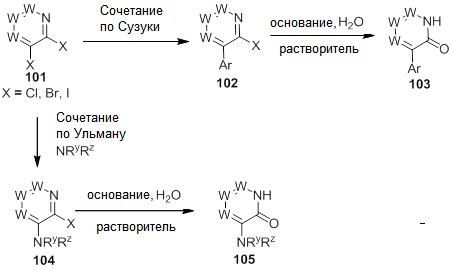
Согласно иллюстративному способу, определенные используемые в настоящем документе 6-членные гетероарильные/гетероциклильные производные могут быть получены стандартным способом синтеза, представленным на схеме 17. Галогенированные гетероарильные/гетероциклильные соединения 101 могут подвергаться сочетанию по Сузуки, как описано на схеме 5, с агентами сочетания, такими как без ограничения бороновые кислоты, боронатные сложные эфиры или трифторбораты Моландера, с получением соединений 102. Последующим щелочным гидролизом, например, KOH или NaOH, в растворителе, таком как без ограничения DMSO или THF, могут быть получены гетероциклильные производные 103. По аналогии, сочетанием по Ульману галогенидов 101 с NH-содержащим нуклеофилом, таким как без ограничения амин или карбоксамид, можно получать соединения 104, последующий гидролиз которых может приводить к гетероарильным/гетероциклильным производным 105.
Схема 18: Общий синтез соединений формулы (I)
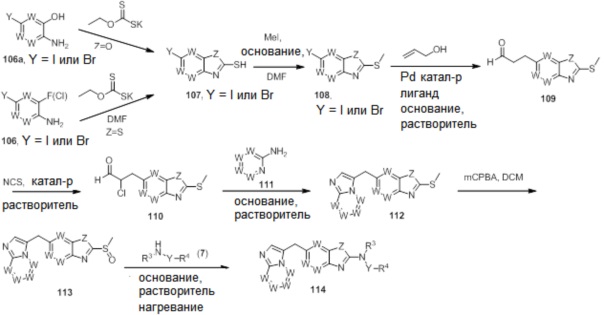
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 18. Легкодоступные аминоарильные/гетероарильные производные 106 и 106a могут взаимодействовать с O-этилкарбонодитиоатом калия в растворителе, таком как без ограничения DMF или пиридин, с нагреванием с получением конденсированных меркаптановых производных 107. Метилирование соединений 107 может быть выполнено с использованием MeI, ускорено основанием, таким как без ограничения K2CO3 или Cs2CO3, в растворителе, таком как без ограничения DMF или DMA, с получением соединений 108. Сочетанием по Хеку галогенидов 108 с аллиловым спиртом, катализируемым катализатором на основе палладия, таким как без ограничения Pd(OAc)2 или Pd(dba)2, получают пропанали 109. Реакция может быть ускорена палладиевым лигандом, таким как без ограничения P(орто-толил)3 или As(PPh3)3, и форсирована основанием, таким как без ограничения NaHCO3 или KHCO3. Реакция может быть проведена в растворителе, таком как без ограничения MeCN или DMF. Хлорирование пропаналей 109 может быть осуществлено хлорирующим агентом, таким как без ограничения N-хлорсукцинимид, и катализировано амином, таким как без ограничения L-пролин или пиперидин, с получением хлоридов 110. Бициклические гетероарилы 112 получают конденсацией соединений 110 с шестичленными 2-аминогетероарильными производными 111 при повышенной температуре с ускорением основанием, таким как без ограничения NaHCO3 или триэтиламин, в растворителе, таком как без ограничения н-BuOH или DMF. Сульфиды соединения 112 могут быть окислены до сульфоксидов окислителем, таким как без ограничения m-CPBA или перуксусная кислота. Окисление может быть проведено в растворителе, таком как без ограничения DCM или AcOH. Сульфоксиды 113 могут взаимодействовать с аминами 7 в условиях нуклеофильного замещения при повышенной температуре с получением соединений 114. Реакция может быть проведена в растворителе, таком как без ограничения DMA или NMP, и ускорена основанием, таким как без ограничения DIEA или TEA.
Схема 19: Общий синтез соединений формулы (I)
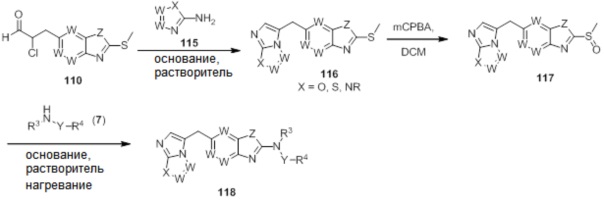
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 19. Конденсацией соединений 110 из схемы 18 c 5-членными аминогетероарильными производными 115 при повышенной температуре c ускорением основанием, таким как без ограничения NaHCO3 или триэтиламин, в растворителе, таком как без ограничения н-BuOH или DMF, получают бициклические гетероарилы 116. С использованием методик, аналогичных описанным в схеме 18, соединения 116 окисляют с получением сульфоксидов 117, а затем путем осуществления взаимодействия с аминами 7 получают соединения 118.
Схема 20: Общий синтез соединений формулы (I)
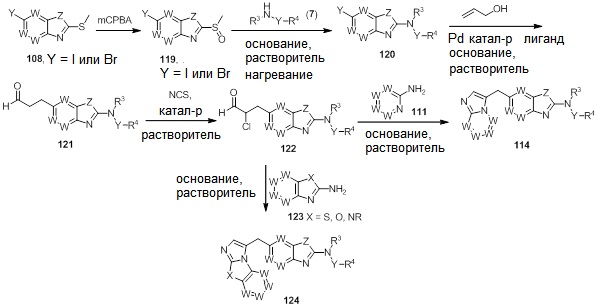
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 20. Сульфиды 108 из схемы 18 могут быть окислены до сульфоксидов 119 окислителем, таким как без ограничения m-CPBA или перуксусная кислота, как описано на схеме 18. Путем осуществления взаимодействия сульфоксидов 119 с аминами 7 получают соединения 120 с использованием методики, аналогичной описанной на схеме 18. Сочетанием по Хеку галогенидов 120 с аллиловым спиртом получают пропанали 121 с использованием методики, аналогичной описанной на схеме 18. Хлорированием соединения 121 с использованием NCS получают соединения 122. Конденсацией соединений 122 с шестичленными аминогетероарильными производными 111 получают соединения 114 с использованием методик, аналогичных описанным в схеме 18. В качестве альтернативы, конденсацией хлоральдегидов 122 с бициклическими аминогетероарилами 123 получают трициклические соединения 124.
Схема 21: Общий синтез соединений формулы (I)
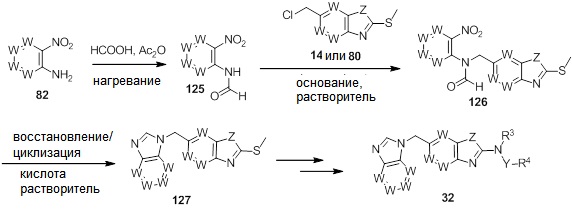
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 21. Аминонитроарилы/гетероарилы 82 из схемы 13 могут быть преобразованы в формамиды 125 при нагревании в смешанном ангидриде уксусной и муравьиной кислоты. Алкилированием формамидов 125 хлоридами 14 или 80 получают соединения 126. Реакцию алкилирования ускоряют основанием, таким как без ограничения NaH или t-BuOK, в растворителе, таком как без ограничения DMF или THF. Восстановление нитрогруппы до аминогруппы, сопровождаемое циклизацией до соединений 127, может быть выполнено восстановителем, таким как без ограничения железо или цинк, в присутствии кислоты, такой как без ограничения AcOH или трифторуксусная кислота. Реакцию проводят в растворителе, таком как без ограничения EtOH или MeOH, и реакция может быть ускорена нагреванием при повышенной температуре. Соединение 127 может быть преобразовано в необходимое соединение 32 с использованием методик, аналогичных описанным в схеме 18 для превращения соединения 112 в соединение 114.
Схема 22: Общий синтез соединений формулы (I)
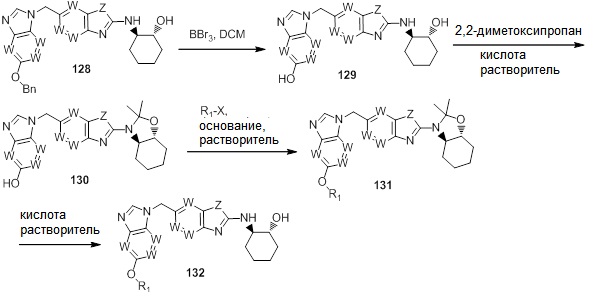
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 22. Бензильные группы соединений 128, которые получают описанными выше способами, удаляют с использованием реагента, такого как без ограничения BBr3 или TMSI, в растворителе, таком как без ограничения DCM или CH3CN, с получением гидроксильных соединений 129. Вицинальную функциональную группу аминового спирта соединения 129 защищают, например, в виде ацетонида, путем осуществления взаимодействия с реагентом, таким как без ограничения 2,2-диметоксипропан, с получением соединений 130. Реакцию катализируют кислотой, такой как без ограничения пара-толуолсульфоновая кислота или камфорсульфокислота, в растворителе, таком как без ограничения 1,4-диоксан или толуол. Алкилирование гидроксильной группы соединения 130 алкилгалогенидами ускоряют основанием, таким как без ограничения Cs2CO3 или NaH, в растворителе, таком как без ограничения NMP или THF, с получением эфиров 131. Снятием защиты с соединения 131 кислотой, такой как без ограничения HCl или трифторуксусная кислота, в растворителе, таком как без ограничения DCM или CH3CN, получают соединения 132.
Схема 23: Общий синтез соединений формулы (I)
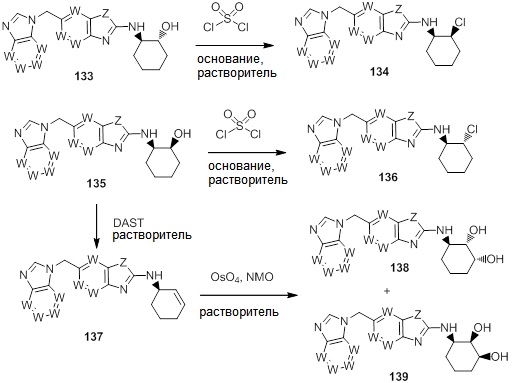
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 23. Соединения 133, полученные как описано выше, могут быть преобразованы в хлориды 134 обработкой сульфурилхлоридом в растворителе, таком как без ограничения DCM или CH3CN. По аналогии, соединения 135 могут быть преобразованы в хлориды 136 в сходных условиях. Более того, обработкой соединений 135 агентом, таким как без ограничения трифторид диэтиламиносеры (DAST) или деоксофтор, в растворителе, таком как без ограничения DCM, могут быть получены циклогексены 137. Дигидроксилированием при изолированной двойной связи соединения 137 при помощи OsO4 и N-метилморфолиноксида (NMO) в растворителе, таком как без ограничения H2O/ацетон/трет-BuOH, получают диоловые соединения 138 и 139.
Схема 24: Общий синтез соединений формулы (I)
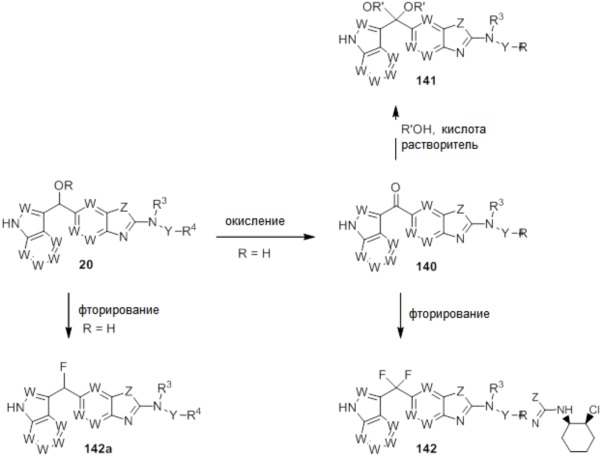
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 24. Соединения 20 (R=H) из схемы 3 могут быть окислены до кетонов 140 реагентом, таким как без ограничения перийодат Десса-Мартина или реагент Джонса, в растворителе, таком как без ограничения CH3CN или ацетон. Кетали 141 могут быть получены путем нагревания кетонов 140 со спиртом или диолом в растворителе, таком как без ограничения толуол или бензол. Реакция может быть катализирована кислотой, такой как без ограничения пара-толуолсульфоновая кислота или камфорсульфокислота. Кетоны 140 могут быть также бис-фторированы фторирующим реагентом, таким как без ограничения диэтиламиносеры трифторид (DAST) или деоксофтор, с получением соединений 142. Спирты 20 могут быть также преобразованы во фториды 142a фторирующим реагентом, таким как без ограничения диэтиламиносеры трифторид (DAST) или деоксофтор.
Схема 25: Общий синтез соединений формулы (I)
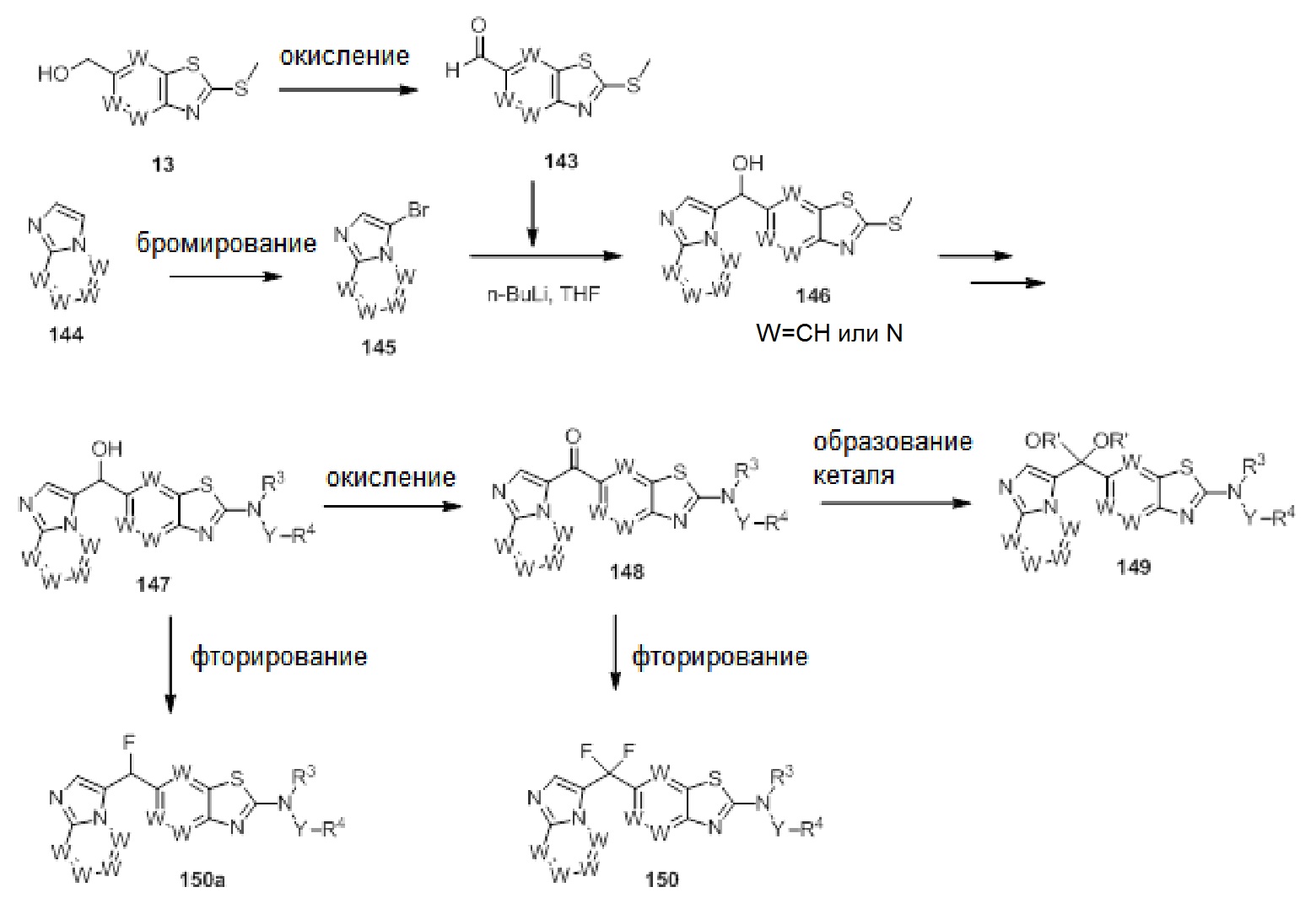
Согласно иллюстративному способу, соединения формулы (I) могут быть также получены способом синтеза, представленным на схеме 25. Соединения 13 из схемы 2 могут быть окислены до альдегидов 143 реагентом, таким как без ограничения перийодат Десса-Мартина, в растворителе, таком как без ограничения CH3CN или DCM. При этом, легкодоступные соединения 144 могут быть бромированы реагентом, таким как без ограничения бром или N-бромсукцимид, с получением соединений 145. Транс-металлированием соединения 145 реагентом, таким как без ограничения н-бутиллитий, с последующей обработкой альдегидами 143 могут быть получены спирты 146, которые могут быть преобразованы в соединения 147 с использованием методик, аналогичных описанным в схеме 4 для превращения соединения 30 в соединение 32. Спирты 147 могут быть затем преобразованы в кетоны 148, фториды 150a, кетали 149 и дифтористые соединения 150 с использованием методик, аналогичных описанным в схеме 24.
Объект настоящего изобретения был описан иллюстративно, и следует понимать, что использованная терминология подразумевает скорее описательный характер, а не ограничительный. Поэтому специалистам в данной области техники следует понимать, что условия, такие как выбор растворителя, температуры реакции, объемов, реакционного времени, могут варьировать, но при этом желаемые соединения все еще будет производиться. Кроме того, специалистам в данной области техники также следует понимать, что многие из реагентов, представленные в примерах, могут быть заменены другими подходящими реагентами (см., например, Smith & March, Advanced Organic Chemistry, 5th ed. (2001)). Такие изменения и модификации, включая без ограничения такие, которые относятся к представленным в настоящем документе химическим структурам, заместителям, производным, промежуточным соединениям, способам синтеза, составам и/или способам получения, могут быть сделаны без отклонения от его сущности и объема. Упоминаемые в настоящем документе патенты США и публикации включены в настоящий документ посредством ссылки.
ПРИМЕРЫ
Пример 1
Получение 2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
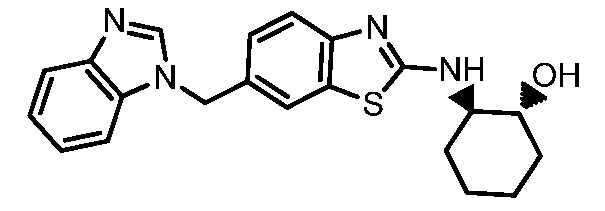
Стадия 1: 6-((1H-Бензо[d]имидазол-1-ил)метил)-2-бромбензо[d]тиазол (150 мг, 44%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 5,6-диметокси-1H-бензо[d]имидазол, использованный в примере 2, 1H-бензо[d]имидазолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1H), 8,06 (с, 1H), 7,97 (д, J=8,5 Гц, 1H), 7,62-7,72 (м, 1H), 7,45-7,58 (м, 2H), 7,13-7,28 (м, 2H), 5,65 (с, 2H). ЖХМС (ИЭР) m/z 344, 346 (M+H)+.
Стадия 2: 2-((6-((1H-Бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол получали в виде белого твердого вещества (12 мг, 22%) с использованием методики, аналогичной описанной на стадии 4 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол 6-((1H-бензо[d]имидазол-1-ил)метил)-2-бромбензо[d]тиазолом, полученным на стадии 1 этого примера, и (1R,2R)-2-аминоциклогексанол, использованный в примере 2, рацемическим транс-2-аминоциклогексанолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 7,98 (д, J=7,5 Гц, 1H), 7,61-7,69 (м, 2H), 7,49-7,59 (м, 1H), 7,25-7,34 (м, 1H), 7,13-7,24 (м, 3H), 5,46 (с, 2H), 4,75 (шир. с, 1H), 3,47-3,59 (м, 2H), 2,02 (д, J=10,9 Гц, 1H), 1,87 (д, J=9,2 Гц, 1H), 1,61 (шир. с, 2H), 1,04-1,36 (м, 4H). ЖХМС (ИЭР) m/z 379 (M+H)+.
Пример 2
Получение (1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
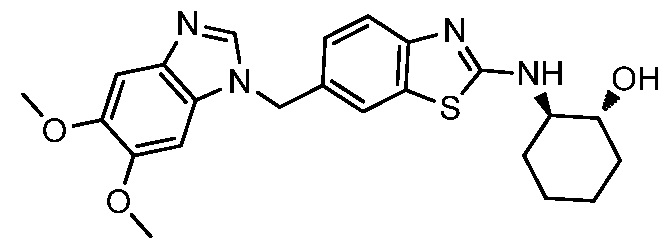
Стадия 1: К раствору трет-бутилнитрила (4,5 мл, 37,5 ммоль) и бромида меди(II) (6,0 г, 27 ммоль) в CH3CN (100 мл) при к.т. добавляли смесь этил-2-аминобензо[d]тиазол-6-карбоксилата (5,0 г, 22,5 ммоль) в CH3CN (50 мл). Реакционную суспензию перемешивали при к.т. в течение 1 ч. Полученную реакционную смесь гасили добавлением 300 мл 1н водного раствора HCl и экстрагировали CH2Cl2 (3×200 мл). Объединенные органические слои сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси CH2Cl2/гексаны (4/1, об./об.) в качестве элюента с получением этил-2-бромбензо[d]тиазол-6-карбоксилата в виде белого твердого вещества (6,2 г, 96%). 1H ЯМР (300 МГц, CDCl3) δ 8,54 (д, J=1,1 Гц, 1H), 8,16 (дд, J=1,5, 8,7 Гц, 1H), 8,02 (д, J=8,7 Гц, 1H), 4,43 (кв., J=7,2 Гц, 2H), 1,43 (т, J=7,2 Гц, 3H). ЖХМС (ИЭР) m/z 288, 286 (M+H)+.
Стадия 2: К раствору этил-2-бромбензо[d]тиазол-6- карбоксилата (5,0 г, 17,5 ммоль), полученного на стадии 1 этого примера, в безводном CH2Cl2 при -78°C медленно добавляли DIBAL-H (1,0 M в CH2Cl2, 36,7 мл, 36,7 ммоль). Раствор перемешивали при -78°C в течение 2 ч. Полученную смесь гасили добавлением 10 мл насыщенного водн. тартрата калия-натрия при -78°C. После медленного нагревания до 0°C, смесь дополнительно обрабатывали 50 мл насыщенного водн. тартрата калия-натрия и перемешивали при к.т. в течение 2 ч. Водный слой отделяли и экстрагировали CH2Cl2 (3×100 мл). Объединенные органические слои промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси EtOAc/гексаны (2/3, об./об.) в качестве элюента с получением (2-бромбензо[d]тиазол-6-ил)метанола в виде белого твердого вещества (3,4 г, 80%). 1H ЯМР (300 МГц, CDCl3) δ 7,96 (д, J=8,3 Гц, 1H), 7,85 (с, 1H), 7,45 (дд, J=1,4, 8,4 Гц, 1H), 4,83 (с, 2H), 1,86 (шир. с, 1H). ЖХМС (ИЭР) m/z 244, 246 (M+H)+.
Стадия 3: К раствору (2-бромбензо[d]тиазол-6-ил)метанола (205 мг, 0,83 ммоль), полученного на стадии 2 этого примера, и DIEA (118 мг, 0,92 ммоль) в CH2Cl2 (20 мл), охлажденному на бане с этиленгликолем/водой (4/1, об./об.) и сухим льдом, медленно добавляли метансульфонилхлорид (105 мг, 0,92 ммоль). Реакционный раствор нагревали до к.т. и перемешивали при к.т. в течение 1 ч. Полученную смесь гасили добавлением 20 мл воды. Разделенный водный слой экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях пониженного давления с получением (2-бромбензо[d]тиазол-6-ил)метилметансульфоната в виде светло-желтого твердого вещества (267 мг, 100%). ЖХМС (ИЭР) m/z 322, 324 (M+H)+.
Стадия 4: К раствору (2-бромбензо[d]тиазол-6-ил)метилметансульфоната (460 мг, 1,4 ммоль), полученного на стадии 3 этого примера, в DMF (5 мл) порциями при к.т. добавляли 5,6-диметокси-1H-бензо[d]имидазол (560 мг, 3,14 ммоль). Смесь перемешивали при к.т. в течение ночи. Полученный раствор разбавляли 40 мл EtOAc и промывали водой, солевым раствором. Разделенный органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси MeOH/CH2Cl2 (1/20, об./об.) в качестве элюента с получением 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола в виде светло-желтого твердого вещества (427 мг, 75%). ЖХМС (ИЭР) m/z 404, 406 (M+H)+.
Стадия 5: К суспензии 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (202 мг, 0,5 ммоль), полученного на стадии 4 этого примера, в DMA (4 мл) при к.т. добавляли DIEA (129 мг, 1,0 ммоль) и (1R,2R)-2-аминоциклогексанол (69 мг, 0,6 ммоль). Смесь перемешивали в герметизированной пробирке при 120°C в течение ночи. После охлаждения до к.т. смесь концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде белого твердого вещества (127 мг, 58%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,14 (с, 1H), 7,99 (д, J=7,5 Гц, 1H), 7,62 (с, 1H), 7,04-7,34 (м, 4H), 5,40 (с, 2H), 4,77 (шир. с, 1H), 3,76 (с, 6H), 3,51 (шир. с, 1H), 1,77-2,14 (м, 3H), 1,61 (шир., 2H), 1,04-1,38 (м, 4H). ЖХМС (ИЭР) m/z 439 (M+H)+.
Пример 3
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолметансульфоновой кислоты
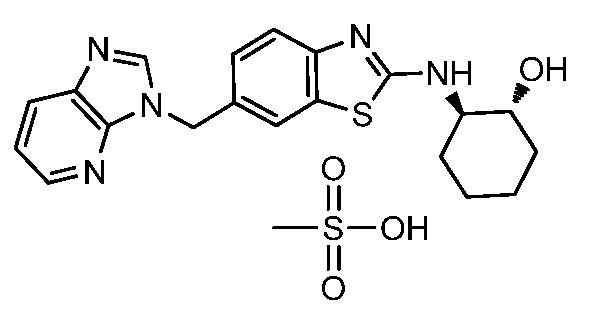
Стадия 1: К раствору этил-2-бромбензо[d]тиазол-6-карбоксилата (4,8 г, 16,8 ммоль), полученного на стадии 1 примера 2, в THF (100 мл) при 0°C медленно добавляли тиометоксид натрия (1,74 г, 25,2 ммоль). Реакционную смесь перемешивали при к.т. в течение ночи. Смесь разбавляли Et2O (200 мл) и промывали насыщенным водн. NaHCO3 и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления с получением этил-2-(метилтио)бензо[d]тиазол-6-карбоксилата в виде белого твердого вещества (4,18 г, 98%). 1H ЯМР (300 МГц, CDCl3) δ 8,48 (д, J=1,5 Гц, 1H), 8,11 (дд, J=1,6, 8,6 Гц, 1H), 7,87 (д, J=8,5 Гц, 1H), 4,41 (кв., J=7,1 Гц, 2H), 2,82 (с, 3H), 1,42 (т, J=7,1 Гц, 3H). ЖХМС (ИЭР) m/z 254 (M+H)+.
Стадия 2: (2-(Метилтио)бензо[d]тиазол-6-ил)метанол (4,1 г, 88%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 2, заменяя этил-2-бромбензо[d]тиазол-6-карбоксилат, использованный в примере 2, этил-2-(метилтио)бензо[d]тиазол-6-карбоксилатом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 212 (M+H)+.
Стадия 3: К раствору (2-(метилтио)бензо[d]тиазол-6-ил)метанола (4,1 г, 19,4 ммоль), полученного на стадии 2 этого примера, и DIEA (3,26 г, 25,3 ммоль) в CH2Cl2 (200 мл) при 0°C медленно добавляли метансульфонилхлорид (2,88 г, 25,3 ммоль). Смесь затем обрабатывали 2 каплями DMF и перемешивали при к.т. в течение ночи. Смесь гасили добавлением 300 мл насыщенного водн. NaHCO3. Разделенный водный слой экстрагировали CH2Cl2 (2×250 мл). Объединенные органические слои промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях пониженного давления с получением 6-(хлорметил)-2-(метилтио)бензо[d]тиазола в виде светло-коричневого твердого вещества (4,4 г, 99%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,10 (д, J=1,5 Гц, 1H), 7,84 (д, J=8,5 Гц, 1H), 7,53 (дд, J=1,6, 8,4 Гц, 1H), 4,89 (с, 2H), 2,80 (с, 3H). ЖХМС (ИЭР) m/z 231 (M+H)+.
Стадия 4: К раствору 3H-имидазо[4,5-b]пиридина (2,99 г, 25 ммоль) в DMF (100 мл) при 0°C медленно добавляли гидрид натрия (60% в минеральном масле, 1,0 г, 25 ммоль). После перемешивания реакционной смеси при к.т. в течение 20 мин, ее обрабатывали раствором 6-(хлорметил)-2-(метилтио)бензо[d]тиазола, полученного на стадии 3 этого примера (4,8 г, 21 ммоль), в DMF (20 мл) при 0°C. Реакционную смесь затем перемешивали при к.т. в течение ночи. Смесь гасили добавлением 3 мл насыщенного водн. NH4Cl и концентрировали в условиях пониженного давления. Остаток разбавляли 600 мл EtOAc и промывали водой и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси MeOH/CH2Cl2 (1/30, об./об.) в качестве элюента с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола в виде рыжеватого твердого вещества (2,5 г, 38%). Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,38 (дд, J=1,2, 4,8 Гц, 1H), 8,11 (дд, J=1,3, 8,1 Гц, 1H), 8,00 (д, J=1,1 Гц, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,46 (дд, J=1,6, 8,4 Гц, 1H), 7,30 (дд, J=4,8, 8,0 Гц, 1H), 5,62 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 5: К раствору 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (2,5 г, 8 ммоль) в CH2Cl2 (150 мл) при 0°C медленно добавляли m-CPBA (70%, 2,36 г, 9,6 ммоль). Смесь перемешивали при к.т. в течение ночи. Полученный раствор разбавляли 150 мл CH2Cl2 и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола в виде белого твердого вещества (2,6 г, 99%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,37 (дд, J=1,3, 4,7 Гц, 1H), 8,23 (д, J=0,9 Гц, 1H), 7,99-8,18 (м, 2H), 7,63 (дд, J=1,7, 8,5 Гц, 1H), 7,30 (дд, J=4,7, 8,1 Гц, 1H), 5,70 (с, 2H), 3,06 (с, 3H). ЖХМС (ИЭР) m/z 339 (M+H)+.
Стадия 6: К суспензии 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,3 г, 3,96 ммоль), полученного на стадии 5 этого примера, в DMA (6 мл) при к.т. добавляли DIEA (511 мг, 3,96 ммоль) и (1R,2R)-2-аминоциклогексанола (1,36 г, 11,9 ммоль). Реакционную смесь перемешивали в герметизированной пробирке при 120°C в течение 6 ч. После охлаждения до к.т. смесь разбавляли 120 мл EtOAc и промывали 120 мл воды. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси ацетон/EtOAc (1/12, об./об.) в качестве элюента с получением (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде не совсем белого твердого вещества (864 мг, 58%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,38 (дд, J=1,3, 4,7 Гц, 1H), 8,09 (дд, J=1,2, 8,0 Гц, 1H), 7,95 (д, J=7,5 Гц, 1H), 7,67 (с, 1H), 7,17-7,35 (м, 3H), 5,49 (с, 2H), 4,73 (д, J=5,3 Гц, 1H), 3,52 (д, J=8,5 Гц, 1H), 3,32 (шир. с, 1H), 1,76-2,12 (м, 2H), 1,61 (шир. с, 2H), 1,07-1,38 (м, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Стадия 7: К суспензии (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (1,84 г, 4,88 ммоль) в EtOH (100 мл) при к.т. добавляли метансульфоновую кислоту (478 мг, 4,98 ммоль). Реакционную смесь перемешивали при 55°C в течение 2 ч. После охлаждения до к.т. смесь концентрировали в условиях пониженного давления. Остаток разбавляли 15 мл воды и лиофилизовали в течение ночи с получением (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолметансульфоната в виде рыжеватого твердого вещества (2,32 г, 100%). 1H ЯМР (300 МГц, MeOH-d4) δ 8,80 (с, 1H), 8,50 (дд, J=1,1, 4,7 Гц, 1H), 8,15 (дд, J=1,1, 8,1 Гц, 1H), 7,82 (с, 1H), 7,36-7,59 (м, 3H), 5,68 (с, 2H), 3,40-3,65 (м, 2H), 2,71 (с, 3H), 2,06 (д, J=12,2 Гц, 2H), 1,79 (д, J=6,6 Гц, 2H), 1,24-1,55 (м, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 4
Получение смеси (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола и (1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
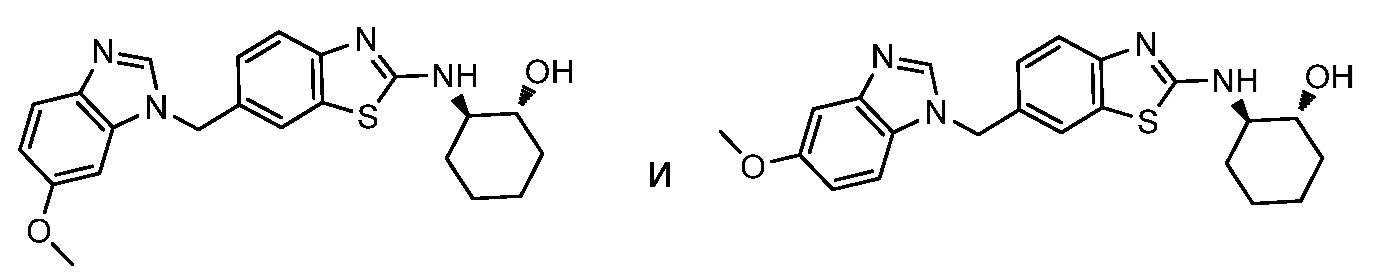
Стадия 1: Смесь 2-бром-6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола и 2-бром-6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (846 мг, 81%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 2, заменяя 5,6-диметокси-1H-бензо[d]имидазол, использованный в примере 2, 6-метокси-1H-бензо[d]имидазолом. ЖХМС (ИЭР) m/z 374, 376 (M+H)+.
Стадия 2: Смесь (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола и (1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (119 мг, 51%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, смесью 2-бром-6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола и 2-бром-6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола, полученной на стадии 1 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,31 (с, 1H), 8,24 (с, 1H), 7,98 (д, J=7,3 Гц, 2H), 7,58-7,69 (м, 2H), 7,52 (д, J=8,7 Гц, 1H), 7,35-7,46 (м, 1H), 7,25-7,34 (м, 2H), 7,06-7,24 (м, 4H), 6,82 (ддд, J=2,3, 6,8, 8,8 Гц, 2H), 5,42 (с, 4H), 4,78 (шир. с, 2H), 3,76 (д, J=2,3 Гц, 6H), 3,51 (шир. с, 3H), 3,27-3,40 (м, 2H), 1,77-2,18 (м, 4H), 1,62 (д, J=5,1 Гц, 4H), 1,04-1,42 (м, 7H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 5
Получение (1R,2R)-2-((6-((1H-имидазо[4,5-b]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
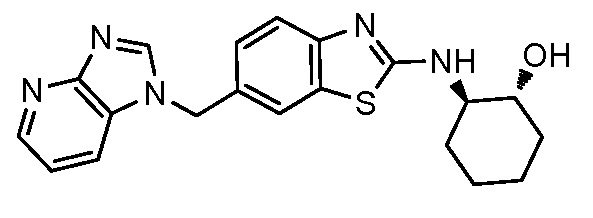
Стадия 1: К раствору (2-бромбензо[d]тиазол-6- ил)метилметансульфоната (900 мг, 2,79 ммоль), полученного на стадии 3 примера 2, и 1H-имидазо[4,5-b]пиридина (365 мг, 3,07 ммоль) в DMF (8 мл) при к.т. добавляли карбонат калия (560 мг, 3,14 ммоль). Реакционную смесь перемешивали при к.т. в течение ночи. Затем ее разбавляли 80 мл EtOAc и промывали полученную смесь водой и солевым раствором. Органический слой отделяли и сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси MeOH/CH2Cl2 (1/20, об./об.) в качестве элюента с получением трех изомеров:
Изомер 1: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-2-бромбензо[d]тиазол
1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,37 (дд, J=1,3, 4,7 Гц, 1H), 8,12 (дд, J=1,2, 8,0 Гц, 1H), 8,06 (д, J=0,9 Гц, 1H), 7,93-8,00 (м, 1H), 7,55 (дд, J=1,5, 8,5 Гц, 1H), 7,31 (дд, J=4,8, 8,0 Гц, 1H), 5,67 (с, 2H). NOESY: a-b, a-c, a-d. ЖХМС (ИЭР) m/z 345, 347 (M+H)+.
Изомер 2: 6-((1H-Имидазо[4,5-b]пиридин-1-ил)метил)-2-бромбензо[d]тиазол
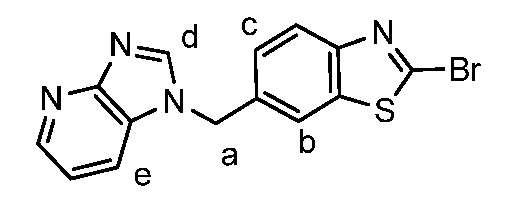
1H ЯМР (300 МГц, ДМСО-d6) δ 8,72 (с, 1H), 8,42 (дд, J=1,5, 4,7 Гц, 1H), 8,08 (д, J=0,9 Гц, 1H), 7,99 (тд, J=1,7, 8,1 Гц, 2H), 7,50-7,60 (м, 1H), 7,25 (дд, J=4,7, 8,1 Гц, 1H), 5,70 (с, 2H). NOESY: a-b, a-c, a-d, a-e. ЖХМС (ИЭР) m/z 345, 347 (M+H)+.
Изомер 3: 6-((4H-Имидазо[4,5-b]пиридин-4-ил)метил)-2-бромбензо[d]тиазол
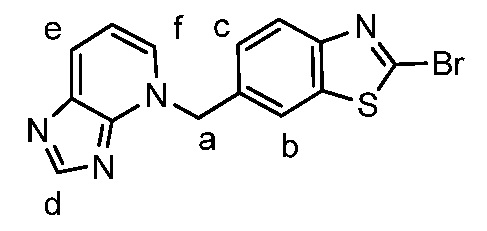
1H ЯМР (300 МГц, ДМСО-d6) δ 8,42-8,51 (м, 1H), 8,28-8,40 (м, 2H), 8,20 (д, J=0,9 Гц, 1H), 7,99 (д, J=8,5 Гц, 1H), 7,68 (дд, J=1,6, 8,4 Гц, 1H), 7,21-7,35 (м, 1H), 6,04 (с, 2H). NOESY: a-b, a-c, a-f. ЖХМС (ИЭР) m/z 345, 347 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((1H-Имидазо[4,5-b]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (41 мг, 42%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, 6-((1H-имидазо[4,5-b]пиридин-1-ил)метил)-2-бромбензо[d]тиазолом (Изомер 2), полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,35-8,44 (м, 1H), 8,00 (д, J=7,0 Гц, 2H), 7,69 (с, 1H), 7,12-7,36 (м, 3H), 5,50 (с, 2H), 4,77 (шир. с, 1H), 3,24-3,40 (м, 2H), 2,02 (д, J=10,2 Гц, 1H), 1,87 (д, J=9,4 Гц, 1H), 1,62 (д, J=4,9 Гц, 2H), 1,22 (д, J=6,0 Гц, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 6
Получение (1R,2R)-2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
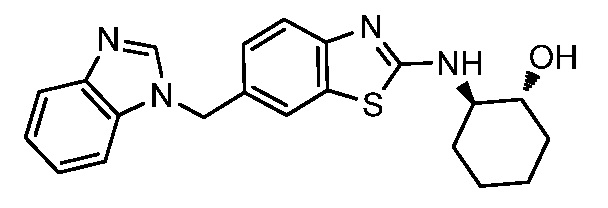
К суспензии 6-((1H-бензо[d]имидазол-1-ил)метил)-2-бромбензо[d]тиазола (34,4 мг, 0,1 ммоль), полученного на стадии 1 примера 1, в DMA (3 мл) при к.т. добавляли DIEA (15 мг, 0,12 ммоль) и (1R,2R)-2-аминоциклогексанол (13,8 мг, 0,12 ммоль). Реакционную смесь перемешивали в герметизированной пробирке при 120°C в течение ночи. После охлаждения до к.т. смесь концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом препаративной HPLC с использованием смеси воды (содержащей 5% CH3CN, 0,05% HCOOH) и CH3CN (содержащего 0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (22 мг, 58%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 7,99 (д, J=7,3 Гц, 1H), 7,60-7,72 (м, 2H), 7,55 (дд, J=2,6, 6,0 Гц, 1H), 7,26-7,34 (м, 1H), 7,12-7,25 (м, 3H), 5,47 (с, 2H), 4,76 (шир. с, 1H), 3,26-3,39 (м, 2H), 2,03 (д, J=10,0 Гц, 1H), 1,87 (д, J=9,4 Гц, 1H), 1,62 (д, J=4,7 Гц, 2H), 1,03-1,39 (м, 4H). ЖХМС (ИЭР) m/z 379 (M+H)+.
Пример 7
Получение (1S,2S)-2-((6-((1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
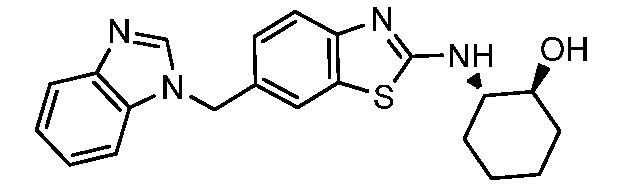
(1S,2S)-2-((6-((1H-Бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (27 мг, 71%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 6, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 6, (1S,2S)-2-аминоциклогексанолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 8,03 (д, J=7,3 Гц, 1H), 7,60-7,72 (м, 2H), 7,55 (дд, J=2,6, 6,0 Гц, 1H), 7,25-7,34 (м, 1H), 7,11-7,24 (м, 3H), 5,46 (с, 2H), 4,82 (шир. с, 1H), 3,50 (шир. с, 2H), 1,82-2,15 (м, 2H), 1,61 (шир. с, 2H), 1,02-1,41 (м, 4H). ЖХМС (ИЭР) m/z 379 (M+H)+.
Пример 8
Получение (R)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-((тетрагидрофуран-2-ил)метил)бензо[d]тиазол-2-амина
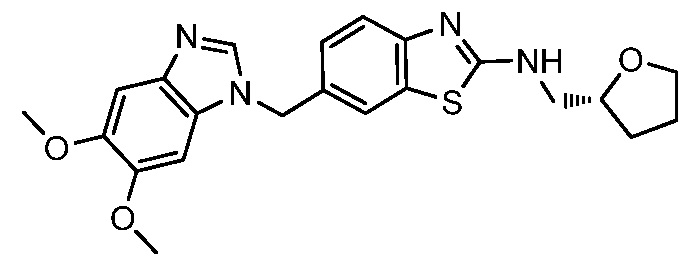
(R)-6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-((тетрагидрофуран-2-ил)метил)бензо[d]тиазол-2-амин (33 мг, 65%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, (R)-(тетрагидрофуран-2-ил)метанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,05-8,22 (м, 2H), 7,64 (д, J=1,1 Гц, 1H), 7,27-7,37 (м, 1H), 7,11-7,25 (м, 3H), 5,41 (с, 2H), 3,95-4,07 (м, 1H), 3,70-3,83 (м, 7H), 3,57-3,68 (м, 2H), 3,43-3,52 (м, 1H), 1,72-2,00 (м, 3H), 1,48-1,64 (м, 1H). ЖХМС (ИЭР) m/z 425 (M+H)+.
Пример 9
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-2-илметил)бензо[d]тиазол-2-амина
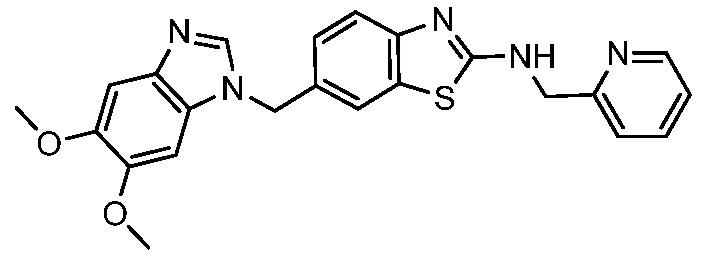
6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-2-илметил)бензо[d]тиазол-2-амин (31 мг, 60%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, пиридин-2-илметанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (т, J=5,5 Гц, 1H), 8,52 (д, J=4,3 Гц, 1H), 8,15 (с, 1H), 7,56-7,85 (м, 2H), 7,05-7,46 (м, 6H), 5,42 (с, 2H), 4,67 (д, J=5,3 Гц, 2H), 3,76 (с, 6H). ЖХМС (ИЭР) m/z 432 (M+H)+.
Пример 10
Получение (1R,2S)-1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
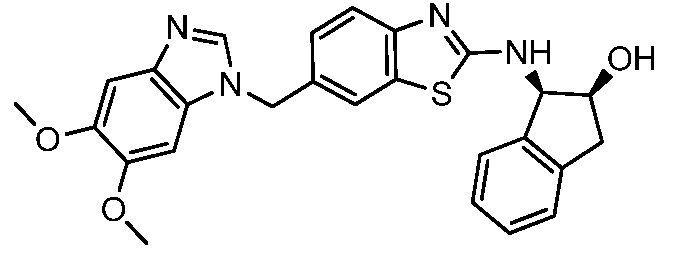
(1R,2S)-1-((6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол (27 мг, 39%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, (1R,2S)-1-амино-2,3-дигидро-1H-инден-2-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,33 (д, J=8,5 Гц, 1H), 8,16 (с, 1H), 7,69 (с, 1H), 7,31-7,39 (м, 1H), 7,10-7,29 (м, 7H), 5,35-5,50 (м, 3H), 4,53-4,63 (м, 1H), 3,77 (д, J=3,2 Гц, 6H), 3,08 (дд, J=4,8, 16,1 Гц, 2H), 2,83 (д, J=16,0 Гц, 1H). ЖХМС (ИЭР) m/z 473 (M+H)+.
Пример 11
Получение (S)-N-(2,3-дигидро-1H-инден-1-ил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина
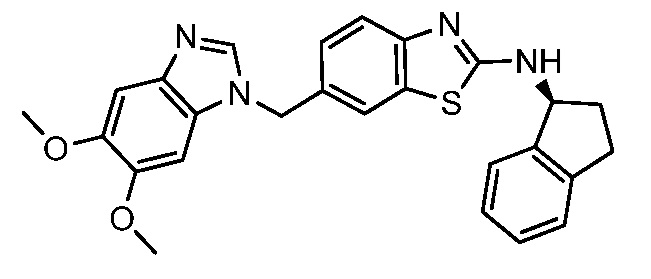
(S)-N-(2,3-дигидро-1H-инден-1-ил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амин (22 мг, 33%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, (S)-2,3-дигидро-1H-инден-1-амином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (д, J=7,9 Гц, 1H), 8,17 (с, 1H), 7,68 (д, J=0,9 Гц, 1H), 7,05-7,46 (м, 7H), 5,35-5,53 (м, 3H), 3,77 (д, J=2,6 Гц, 2H), 3,36 (с, 6H), 2,74-3,08 (м, 2H), 1,79-2,02 (м, 1H). ЖХМС (ИЭР) m/z 457 (M+H)+.
Пример 12
Получение (1R,2R)-2-((6-(метокси(1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
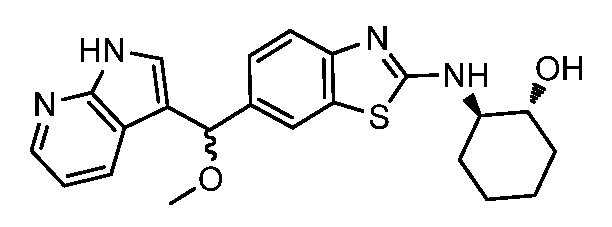
Стадия 1: К суспензии (2-бромбензо[d]тиазол-6-ил)метанола (400 мг, 1,6 ммоль), полученного на стадии 2 примера 2, в DMA (6 мл) при к.т. добавляли DIEA (258 мг, 2,0 ммоль) и (1R,2R)-2-аминоциклогексанол (226 мг, 2,0 ммоль). Реакционную смесь перемешивали в герметизированной пробирке при 120°C в течение ночи. После охлаждения до к.т. смесь концентрировали в условиях пониженного давления с получением неочищенного (1R,2R)-2-((6-(гидроксиметил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде коричневого масла (445 мг, 100%), которое использовали на следующей стадии без какой-либо дополнительной очистки. ЖХМС (ИЭР) m/z 279 (M+H)+.
Стадия 2: К раствору (1R,2R)-2-((6-(гидроксиметил)бензо[d]тиазол-2-ил)амино)циклогексанола (445 мг, 1,6 ммоль), полученного на стадии 1 этого примера, в CH2Cl2 (40 мл) при к.т. добавляли оксид марганца(IV) (696 мг, 8,0 ммоль). Реакционную суспензию нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до к.т. реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного 2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-карбальдегида в виде коричневого масла (440 мг, 99%), которое использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 277 (M+H)+.
Стадия 3: К раствору 1H-пирроло[2,3-b]пиридина (205 мг, 1,74 ммоль) в MeOH (20 мл) при к.т. последовательно добавляли гидроксид калия (162 мг, 2,9 ммоль) и 2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-карбальдегид (400 мг, 1,45 ммоль), полученный на стадии 2 этого примера. Реакционную смесь перемешивали при к.т. в течение 14 суток. Полученную смесь разбавляли EtOAc (80 мл) и промывали водой, солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом HPLC с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-(метокси(1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде белого твердого вещества (32 мг, 5,4%). 1H ЯМР (300 МГц, CDCl3) δ 9,70 (шир. с, 1H), 8,26 (дд, J=1,4, 4,8 Гц, 1H), 7,85 (дд, J=1,3, 7,7 Гц, 1H), 7,64 (д, J=1,3 Гц, 1H), 7,44-7,54 (м, 1H), 7,34 (д, J=8,3 Гц, 1H), 6,97-7,11 (м, 2H), 5,64 (шир. с, 1H), 5,56 (с, 1H), 3,44-3,67 (м, 3H), 3,42 (с, 3H), 2,06-2,27 (м, 2H), 1,65-1,87 (м, 2H), 1,14-1,53 (м, 4H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 13
Получение N-бензил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина
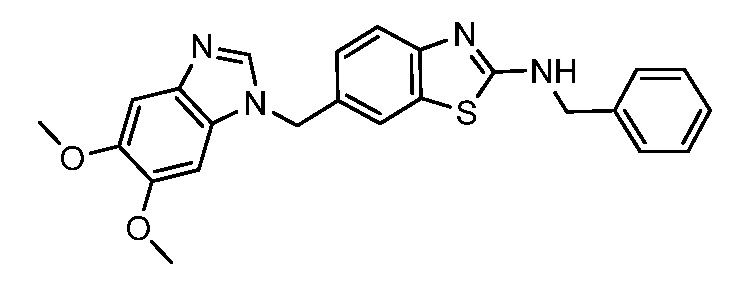
N-Бензил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амин (21 мг, 33%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, фенилметанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,54 (т, J=5,7 Гц, 1H), 8,15 (с, 1H), 7,66 (д, J=1,3 Гц, 1H), 7,07-7,47 (м, 9H), 5,41 (с, 2H), 4,57 (д, J=5,7 Гц, 2H), 3,76 (с, 6H). ЖХМС (ИЭР) m/z 431 (M+H)+.
Пример 14
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-морфолиноэтил)бензо[d]тиазол-2-амина
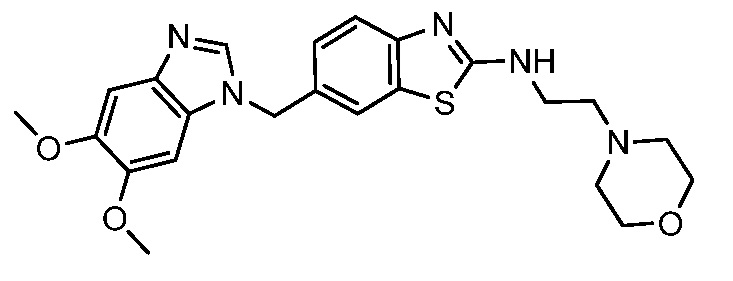
6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-морфолиноэтил)бензо[d]тиазол-2-амин (14 мг, 21%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, 2-морфолиноэтанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (с, 1H), 7,99 (т, J=5,0 Гц, 1H), 7,64 (с, 1H), 7,27-7,36 (м, 1H), 7,11-7,26 (м, 3H), 5,41 (с, 2H), 3,76 (с, 6H), 3,52-3,66 (м, 4H), 3,38-3,51 (м, 4H), 2,33-2,45 (м, 4H). ЖХМС (ИЭР) m/z 454 (M+H)+.
Пример 15
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидро-2H-пиран-4-ил)бензо[d]тиазол-2-амина
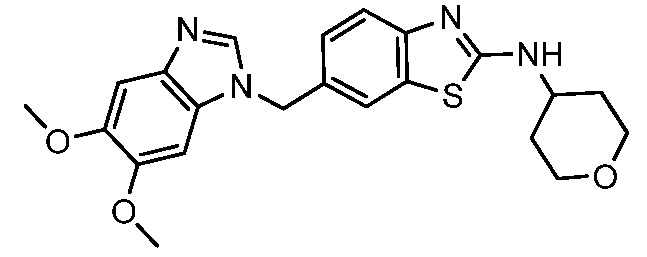
6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидро-2H-пиран-4-ил)бензо[d]тиазол-2-амин (34 мг, 54%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, тетрагидро-2H-пиран-4-амином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (с, 1H), 8,09 (д, J=7,2 Гц, 1H), 7,65 (д, J=1,1 Гц, 1H), 7,30-7,37 (м, 1H), 7,13-7,25 (м, 3H), 5,41 (с, 2H), 3,81-4,00 (м, 2H), 3,76 (с, 6H), 3,37-3,51 (м, 3H), 1,93 (д, J=10,5 Гц, 2H), 1,37-1,56 (м, 2H). ЖХМС (ИЭР) m/z 425 (M+H)+.
Пример 16
Получение N-циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-метилбензо[d]тиазол-2-амина
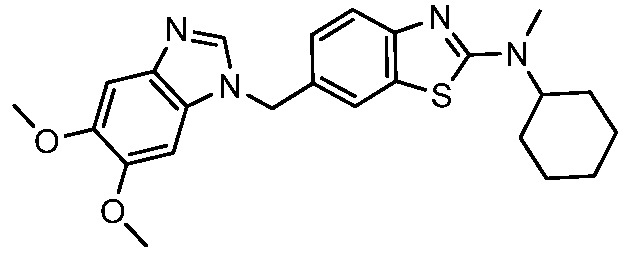
N-Циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-метилбензо[d]тиазол-2-амин (47 мг, 73%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, N-метилциклогексанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,16 (с, 1H), 7,75 (д, J=1,1 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H), 7,24 (дд, J=1,5, 8,3 Гц, 1H), 7,18 (д, J=3,0 Гц, 2H), 5,43 (с, 2H), 3,88 (шир. с, 1H), 3,76 (с, 6H), 2,98 (с, 3H), 1,47-1,90 (м, 7H), 1,35 (кв., J=12,5 Гц, 2H), 1,03-1,22 (м, 1H). ЖХМС (ИЭР) m/z 437 (M+H)+.
Пример 17
Получение (1R,2R)-2-((6-((1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
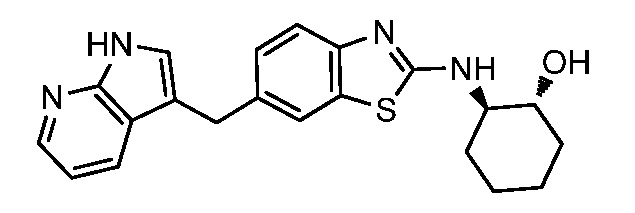
К раствору (1R,2R)-2-((6-(метокси(1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (20 мг, 0,049 ммоль), полученного на стадии 3 примера 12, в CH3CN (10 мл) при к.т. добавляли триэтилсилан (11,4 мг, 0,092 ммоль) и TFA (10,4 мг, 0,092 ммоль). Смесь перемешивали при 60°C в течение ночи. После охлаждения до к.т. реакционную смесь концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((1H-пирроло[2,3-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (5,7 мг, 31%) в виде коричневого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 11,71 (шир. с, 1H), 9,56 (шир. с, 1H), 8,23 (д, J=4,1 Гц, 1H), 7,93 (д, J=7,0 Гц, 1H), 7,70 (с, 1H), 7,26-7,42 (м, 3H), 7,07 (дд, J=4,9, 7,9 Гц, 1H), 4,11 (с, 2H), 3,53 (шир. с, 1H), 3,27-3,43 (м, 2H), 1,83-2,12 (м, 2H), 1,66 (шир. с, 2H), 1,27 (шир. с, 4H). ЖХМС (ИЭР) m/z 379 (M+H)+.
Пример 18
Получение N-циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина
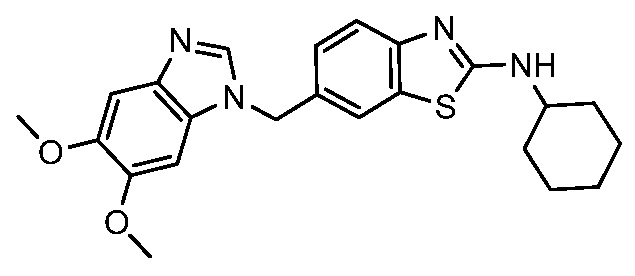
N-Циклогексил-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амин (41 мг, 66%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, циклогексанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (с, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,63 (с, 1H), 7,27-7,36 (м, 1H), 7,08-7,25 (м, 3H), 5,40 (с, 2H), 3,76 (с, 6H), 3,60-3,71 (м, 1H), 1,95 (д, J=10,4 Гц, 2H), 1,49-1,80 (м, 3H), 1,06-1,46 (м, 5H). ЖХМС (ИЭР) m/z 423 (M+H)+.
Пример 19
Получение (1R,2R)-1-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
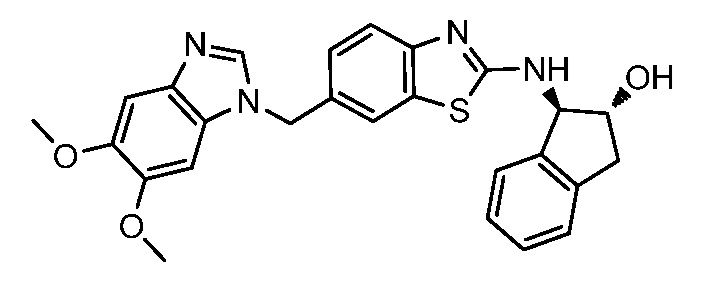
(1R,2R)-1-((6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол (41 мг, 66%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, (1R,2R)-1-амино-2,3-дигидро-1H-инден-2-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (д, J=7,9 Гц, 1H), 8,17 (с, 1H), 7,69 (с, 1H), 7,32-7,43 (м, 1H), 7,05-7,31 (м, 7H), 5,44 (с, 2H), 5,18 (т, J=6,9 Гц, 1H), 4,30 (кв., J=6,9 Гц, 1H), 3,77 (д, J=3,0 Гц, 6H), 3,38 (шир. с, 1H), 3,16 (дд, J=7,0, 15,4 Гц, 1H), 2,75 (дд, J=7,2, 15,4 Гц, 1H). ЖХМС (ИЭР) m/z 473 (M+H)+.
Пример 20
Получение (1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклопентанола
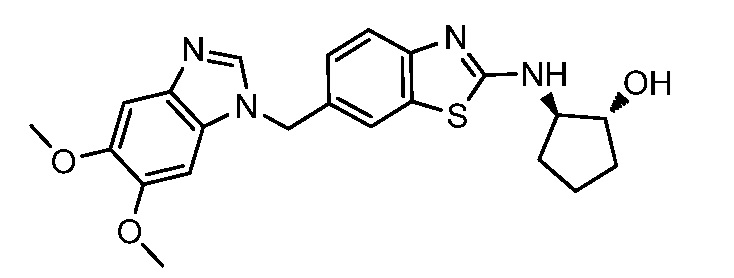
(1R,2R)-2-((6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклопентанол (31 мг, 49%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, (1R,2R)-2-аминоциклопентанолом. 1H ЯМР (300МГц, ДМСО-d6) δ 8,15 (с, 1 H), 8,05 (д, J=6,6 Гц, 1 H), 7,64 (д, J=1,1 Гц, 1 H), 7,28-7,37 (м, 1 H), 7,11-7,26 (м, 3 H), 5,41 (с, 2 H), 4,95 (шир. с, 1 H), 3,91-4,03 (м, 1 H), 3,81-3,91 (м, 1 H), 3,76 (с, 6 H), 1,75-1,94 (м, 2 H), 1,56-1,74 (м, 2 H), 1,39-1,55 (м, 2 H). ЖХМС (ИЭР) m/z 425 (M+H)+.
Пример 21
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-4-илметил)бензо[d]тиазол-2-амина
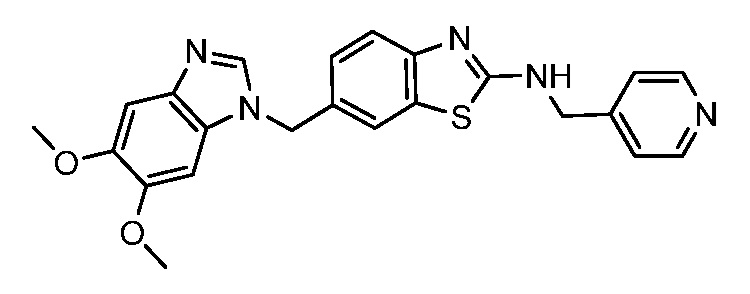
6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(пиридин-4-илметил)бензо[d]тиазол-2-амин (29 мг, 45%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 2, пиридин-4-илметанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (т, J=5,8 Гц, 1H), 8,50 (д, J=5,7 Гц, 2H), 8,15 (с, 1H), 7,68 (д, J=0,9 Гц, 1H), 7,06-7,42 (м, 6H), 5,42 (с, 2H), 4,62 (д, J=5,5 Гц, 2H), 3,76 (с, 6H). ЖХМС (ИЭР) m/z 432 (M+H)+.
Пример 22
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-фенилбензо[d]тиазол-2-амина
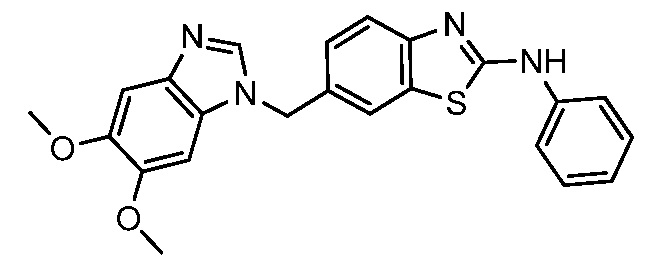
К суспензии 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (60 мг, 0,148 ммоль), полученного на стадии 4 примера 2, в анилине (0,6 мл) при к.т. добавляли DIEA (23 мг, 0,178 ммоль). Реакционную смесь перемешивали в герметизированной пробирке при 120°C в течение 48 ч. После охлаждения до к.т. реакционную смесь концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом HPLC с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-фенилбензо[d]тиазол-2-амина (31 мг, 50%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 10,53 (шир. с, 1H), 8,18 (с, 1H), 7,71-7,82 (м, 3H), 7,56 (д, J=8,3 Гц, 1H), 7,26-7,42 (м, 3H), 7,19 (д, J=3,2 Гц, 2H), 7,01 (т, J=7,3 Гц, 1H), 5,48 (с, 2H), 3,77 (с, 6H). ЖХМС (ИЭР) m/z 417 (M+H)+.
Пример 23
Получение (1R,2R)-2-((6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
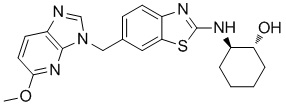
Стадия 1: К перемешиваемому раствору 4-аминобензонитрила (10,0 г, 84,7 ммоль) в MeCN (100 мл) при 90°C медленно добавляли N-хлорсукцинимид (12,4 г, 93 ммоль). После добавления N-хлорсукцинимида, реакционную смесь перемешивали при 90°C в течение 2 ч. Реакционную смесь затем охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток растворяли в 500 мл CH2Cl2 и промывали 5% водн. NaOH. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления с получением 4-амино-3-хлорбензонитрила в виде рыжеватого твердого вещества (12,2 г, 95%). 1H ЯМР (300 МГц, CDCl3) δ 7,54 (д, J=1,7 Гц, 1H), 7,35 (дд, J=1,8, 8,4 Гц, 1H), 6,77 (д, J=8,5 Гц, 1H), 4,63 (шир. с, 2H).
Стадия 2: К раствору 4-амино-3-хлорбензонитрила (12,2 г, 80,2 ммоль), полученного на стадии 1 этого примера, в DMF (60 мл) при к.т. добавляли O-этилкарбонодитиоат калия (28,9 г, 180,7 ммоль). Смесь кипятили с обратным холодильником в течение 4 ч. После охлаждения до к.т. реакционную смесь вливали в воду со льдом и подкисляли добавлением 2н водн. HCl. Рыжеватые твердые вещества собирали и сушили в вакуумной печи в течение ночи. Затем, твердые вещества кипятили с обратным холодильником с 500 мл CHCl3 в течение 10 мин. После охлаждения до к.т. смесь растирали с 200 мл гексанов и обрабатывали ультразвуком в течение 20 мин. Бледно-коричневое твердое вещество собирали путем фильтрования с получением 2-меркаптобензо[d]тиазол-6-карбонитрила (12,9 г, 84%). 1H ЯМР (300 МГц, ДМСО-d6) δ 14,16 (шир. с, 1H), 8,23 (д, J=0,9 Гц, 1H), 7,83 (дд, J=1,3, 8,5 Гц, 1H), 7,31-7,51 (м, 1H).
Стадия 3: Гидрид натрия (60% в минеральном масле, 1,92 г, 48 ммоль) суспендировали в DMF (60 мл) при 0°C, и медленно добавляли 2-меркаптобензо[d]тиазол-6-карбонитрил (5,76 г, 30 ммоль), полученный на стадии 2 этого примера. После завершения выделения газа, добавляли йодметан (8,4 мл, 135 ммоль), и перемешивали реакционную смесь при к.т. в течение ночи. К реакционной смеси добавляли 300 мл воды, и собирали осадок путем фильтрования с получением 2-(метилтио)бензо[d]тиазол-6-карбонитрила в виде светло-желтого твердого вещества (5,47 г, 89%). 1H ЯМР (300 МГц, CDCl3) δ 8,08 (д, J=1,1 Гц, 1H), 7,91 (д, J=8,3 Гц, 1H), 7,67 (дд, J=1,5, 8,5 Гц, 1H), 2,83 (с, 3H).
Стадия 4: К раствору 2-(метилтио)бензо[d]тиазол-6-карбонитрила (10,0 г, 48,5 ммоль), полученного на стадии 3 этого примера, в THF (150 мл) при -78°C медленно добавляли раствор алюмогидрида лития (2,0 M в THF, 50,9 мл, 101,9 ммоль). Реакционную смесь медленно нагревали до 0°C, перемешивали при 0°C в течение 3 ч и обрабатывали 4 мл воды, 4 мл 10% водн. NaOH и 12 мл воды. Полученную реакционную смесь перемешивали при к.т. в течение 1 ч, после чего ее фильтровали через слой целита, и промывали выпавшие в осадок вещества 100 мл EtOAc. Объединенные фильтраты концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси MeOH/CH2Cl2 (1/2, об./об.) в качестве элюента с получением (2-(метилтио)бензо[d]тиазол-6-ил)метанамина в виде желтого масла (3,5 г, 34%). 1H ЯМР (300 МГц, CDCl3) δ 7,82 (д, J=8,3 Гц, 1H), 7,73 (с, 1H), 7,35 (дд, J=1,4, 8,4 Гц, 1H), 3,97 (с, 2H), 2,79 (с, 3H), 1,55 (с, 2H). ЖХМС (ИЭР) m/z 211 (M+H)+.
Стадия 5: К раствору 2-хлор-6-метокси-3-нитропиридина (430 мг, 2,3 ммоль) в DMF (6 мл) при 0°C медленно добавляли (2-(метилтио)бензо[d]тиазол-6-ил)метанамин (437 мг, 2,1 ммоль), полученный на стадии 4 этого примера. Реакционную смесь перемешивали при к.т. в течение ночи. Полученную реакционную смесь разбавляли 60 мл EtOAc и промывали насыщенным водн. NaHCO3 и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием CH2Cl2 в качестве элюента с получением 6-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амина в виде желтого твердого вещества (431 мг, 57%). ЖХМС (ИЭР) m/z 363 (M+H)+.
Стадия 6: К смеси 6-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амина (431 мг, 1,19 ммоль), полученного на стадии 5 этого примера, в уксусной кислоте (6 мл) при 0°C медленно добавляли цинковый порошок (235 мг, 3,57 ммоль). Реакционную смесь перемешивали при 0°C в течение 20 мин, а затем перемешивали при к.т. в течение 4 ч. Полученную реакционную смесь разбавляли 30 мл EtOAc и фильтровали через слой целита. Фильтрат нейтрализовывали насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси EtOAc/CH2Cl2 (1/3, об./об.) в качестве элюента с получением 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамина в виде коричневого масла (389 мг, 98%). ЖХМС (ИЭР) m/z 333 (M+H)+.
Стадия 7: К раствору триэтоксиметана (5 мл) при к.т. добавляли 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин (332 мг, 1,0 ммоль), полученный на стадии 6 этого примера. Реакционную смесь нагревали с обратным холодильником в течение ночи. После охлаждения до к.т. смесь концентрировали в условиях пониженного давления. Неочищенный продукт очищали на колонке с силикагелем с использованием смеси EtOAc/CH2Cl2 (0→100%, об./об.) в качестве элюента с получением 6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола в виде коричневого твердого вещества (180 мг, 53%). 1H ЯМР (300 МГц, CDCl3) δ 7,95 (д, J=8,7 Гц, 1H), 7,87 (с, 1H), 7,82 (д, J=8,5 Гц, 1H), 7,70 (д, J=1,1 Гц, 1H), 7,41 (дд, J=1,7, 8,3 Гц, 1H), 6,71 (д, J=8,7 Гц, 1H), 5,47 (с, 2H), 3,99 (с, 3H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 343 (M+H)+.
Стадия 8: (6-((5-Метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (180 мг, 100%) получали в виде не совсем белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 3, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 7 этого примера. ЖХМС (ИЭР) m/z 359 (M+H)+.
Стадия 9: (1R,2R)-2-((6-((5-Метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]]тиазол-2-ил)амино)циклогексанол (36 мг, 35%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, 6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 8 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,34 (с, 1H), 7,90-8,08 (м, 2H), 7,73 (с, 1H), 7,29 (с, 2H), 6,69 (д, J=8,5 Гц, 1H), 5,39 (с, 2H), 4,76 (шир. с, 1H), 3,94 (с, 3H), 3,51 (шир. с, 2H), 1,76-2,17 (м, 2H), 1,61 (шир. с, 2H), 1,04-1,42 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 24
Получение 1-(4-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)пиперидин-1-ил)этанонуксусной кислоты
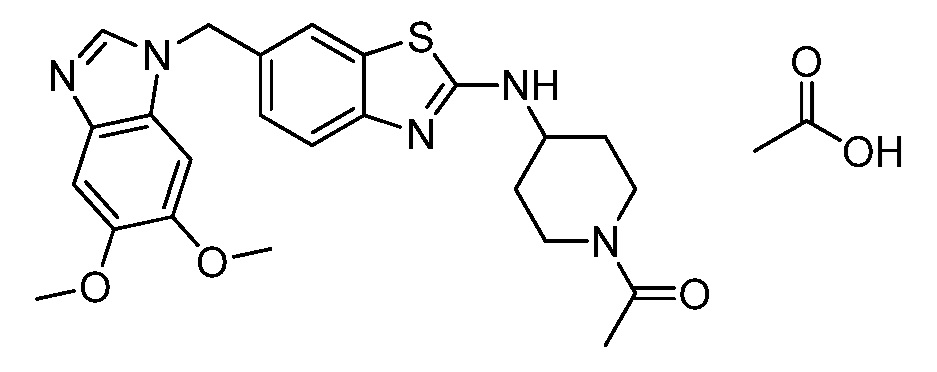
Перемешиваемую смесь 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (80 мг, 0,198 ммоль), полученного в примере 2, 1-(4-аминопиперидин-1-ил)этанона (56 мг, 0,396 ммоль) и DIEA (77 мг, 0,594 ммоль) в безводном DMA (1 мл) нагревали при 120°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением 1-(4-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)пиперидин-1-ил)этанонацетата (7 мг, 7%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (с, 1H), 8,08 (д, J=7,2 Гц, 1H), 7,65 (с, 1H), 7,30-7,37 (м, 1H), 7,14-7,25 (м, 3H), 5,41 (с, 2H), 4,18 (м, 1H), 3,94 (м, 1H), 3,75-3,77 (м, 7H), 3,11-3,24 (м, 2H), 2,78-2,85 (м, 1H), 1,95-2,05 (м, 4H), 1,89 (с, 3H), 1,19-1,48 (м, 2H). ЖХМС (ИЭР) m/z 466 (M+H)+.
Пример 25
Получение (R,S)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидрофуран-3-ил)бензо[d]тиазол-2-аминуксусной кислоты
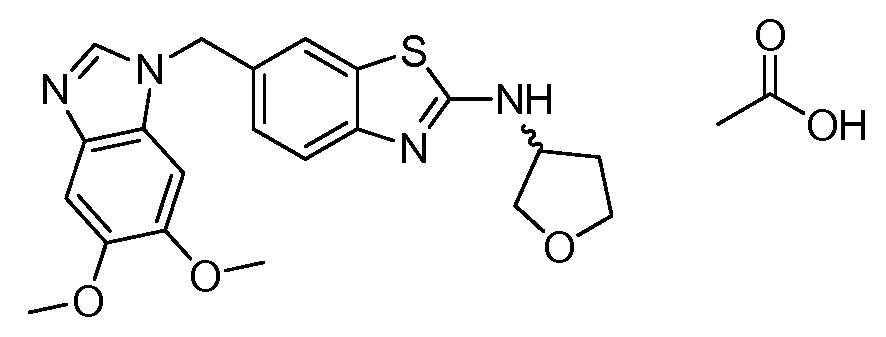
Перемешиваемую смесь 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (80 мг, 0,198 ммоль), полученного в примере 2, (R,S)-тетрагидрофуран-3-амина (34 мг, 0,396 ммоль) и DIEA (77 мг, 0,594 ммоль) в безводном DMA (1 мл) нагревали при 120°C в течение 3 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (R,S)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(тетрагидрофуран-3-ил)бензо[d]тиазол-2-аминацетата (15 мг, 16%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,28 (д, J=6,0 Гц, 1H), 8,15 (с, 1H), 7,66 (д, J=1,1 Гц, 1H), 7,36 (д, J=8,1 Гц, 1H), 7,14-7,26 (м, 3H), 5,42 (с, 2H), 4,39 (шир. с, 1H), 3,59-3,88 (м, 11H), 2,12-2,26 (м, 1H), 1,88 (с, 3H). ЖХМС (ИЭР) m/z 411 (M+H)+.
Пример 26
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-2-аминия ацетата
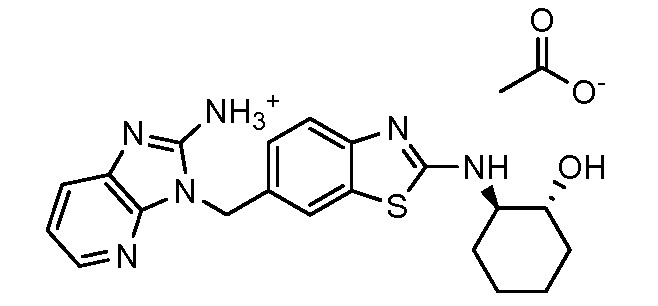
Стадия 1: 3-((2-Бромбензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-2-амин (34 мг, 20%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 2, заменяя 5,6-диметокси-1H-бензо[d]имидазол, использованный в примере 2, 3H-имидазо[4,5-b]пиридин-2-амином. 1H ЯМР (300 МГц, CDCl3): δ 7,97 (д, J=8,5 Гц, 1 H), 7,51 (д, J=5,5 Гц, 2 H), 7,35 (дд, J=8,3, 1,5 Гц, 1 H), 7,14-7,23 (м, 1 H), 7,05-7,14 (м, 3 H), 5,28 (с, 2 H).
Стадия 2: (1R,2R)-2-((6-((2-Амино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (14 мг, 36%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, 3-((2-бромбензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-2-амином, полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,95 (д, J=7,5 Гц, 1 H), 7,48 (д, J=1,1 Гц, 1 H), 7,27 (д, J=8,3 Гц, 1 H), 7,02-7,19 (м, 3 H), 6,91 (т, J=7,1 Гц, 1 H), 6,76-6,85 (м, 1 H), 6,54 (с, 2 H), 5,22 (с, 2 H), 4,77 (шир. с, 1 H), 3,11 (шир. с, 2 H), 1,95-2,16 (м, 2 H), 1,87 (с, 3 H), 1,62 (д, J=4,5 Гц, 2 H), 1,01-1,41 (м, 4 H). ЖХМС (ИЭР) m/z 395 (M+H)+.
Пример 27
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-этоксифенил)бензо[d]тиазол-2-амина
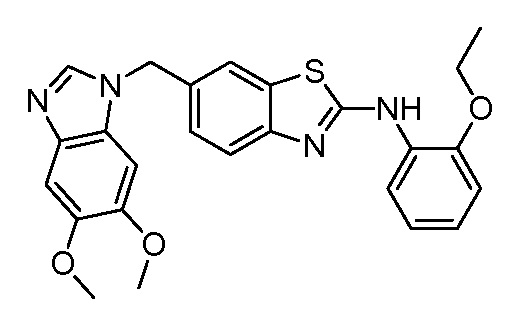
К суспензии 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (60 мг, 0,15 ммоль), полученного в примере 2, и 2-этоксианилина (61 мг, 0,46 ммоль) в безводном DMA (600 мкл) при к.т. добавляли DIEA (155 мкл, 0,90 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 72 ч. После охлаждения до к.т. полученный реакционный раствор очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-этоксифенил)бензо[d]тиазол-2-амина (15,2 мг, 22%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,69 (с, 1H), 8,31-8,44 (м, 1H), 8,18 (с, 1H), 7,76 (д, J=1,1 Гц, 1H), 7,51 (д, J=8,1 Гц, 1H), 7,29 (дд, J=1,5, 8,3 Гц, 1H), 7,19 (д, J=2,4 Гц, 2H), 6,91-7,07 (м, 3H), 5,47 (с, 2H), 4,12 (кв., J=6,8 Гц, 2H), 3,76 (с, 6H), 1,37 (т, J=7,0 Гц, 3H). ЖХМС (ИЭР) m/z 461 (M+H)+.
Пример 28
Получение N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина
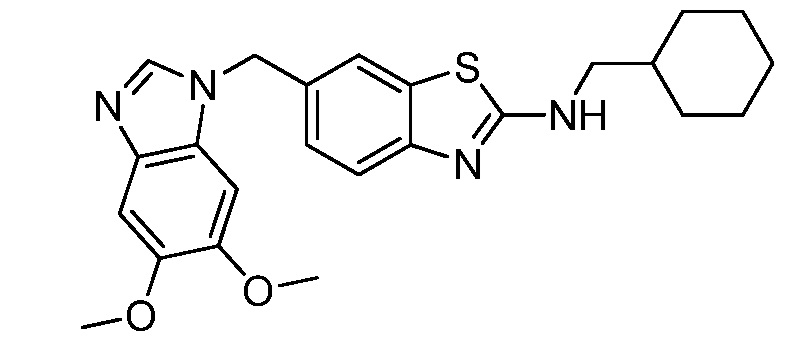
Перемешиваемую смесь 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (70 мг, 0,173 ммоль), полученного в примере 2, циклогексанметиламина (39 мг, 0,346 ммоль) и DIEA (67 мг, 0,519 ммоль) в безводном DMA (1,5 мл) нагревали при 100°C в течение 2,5 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина (25 мг, 33%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (шир. с, 1H), 8,04 (т, J=5,4 Гц, 1H), 7,63 (с, 1H), 7,31 (м, 1H), 7,12-7,24 (м, 3H), 5,40 (с, 2H), 3,76 (с, 6H), 3,17 (т, J=6,1 Гц, 2H), 1,49-1,78 (м, 6H), 1,07-1,27 (м, 3H), 0,84-1,02 (м, 2H). ЖХМС (ИЭР) m/z 437 (M+H)+.
Пример 29
Получение (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
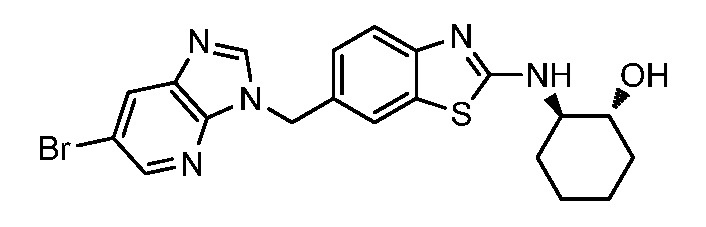
Стадия 1: 5-Бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин (605 мг, 44%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 23, заменяя 2-хлор-6-метокси-3-нитропиридин, использованный в примере 23, 5-бром-2-хлор-3-нитропиридином. ЖХМС (ИЭР) m/z 409, 411 (M+H)+.
Стадия 2: 5-Бром-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин (170 мг, 30%) получали в виде желтого масла с использованием методики, аналогичной описанной на стадии 6 примера 23, заменяя 6-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин, использованный в примере 23, 5-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 381, 383 (M+H)+.
Стадия 3: 6-((6-Бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол (71 мг, 40%) получали в виде не совсем белого твердого вещества с использованием методики, аналогичной описанной на стадии 7 примера 23, заменяя 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин, использованный в примере 23, 5-бром-N2-((2- (метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамином, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 391, 393 (M+H)+.
Стадия 4: 6-((6-Бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (73 мг, 100%) получали в виде не совсем белого твердого вещества с использованием методики, аналогичной описанной на стадии 8 примера 23, заменяя 6-((5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 23, 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. ЖХМС (ИЭР) m/z 407, 409 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((6-Бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (22 мг, 27%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 2, заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,48 (д, J=2,1 Гц, 1H), 8,40 (д, J=2,1 Гц, 1H), 8,00 (д, J=7,5 Гц, 1H), 7,65 (с, 1H), 7,15-7,36 (м, 2H), 5,48 (с, 2H), 4,78 (шир. с, 1H), 3,51 (шир. с, 1H), 1,96-2,13 (м, 1H), 1,87 (д, J=9,6 Гц, 1H), 1,61 (шир. с, 2H), 1,01-1,40 (м, 4H). ЖХМС (ИЭР) m/z 458, 460 (M+H)+.
Пример 30
Получение 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амина
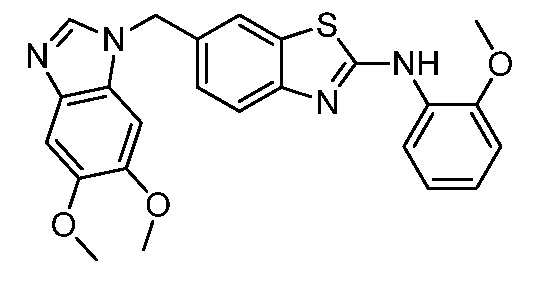
К суспензии 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (26 мг, 0,063 ммоль), полученного в примере 2, и 2-метоксианилина (15,5 мг, 0,13 ммоль) в безводном 1,4-диоксане (0,30 мл) при к.т. добавляли Cs2CO3 (41 мг, 0,13 ммоль). Смесь барботировали аргоном в течение 5 мин, после чего добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (3,0 мг, 0,005 ммоль) и трис(дибензилиденацетон)дипалладий(0) (2,3 мг, 0,003 ммоль). Смесь барботировали аргоном еще в течение 5 мин, а затем нагревали смесь в герметизированной пробирке при 100°C в течение 4 ч. После охлаждения до к.т. реакционную смесь фильтровали через слой целита, и очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амина (9,4 мг, 33%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,85 (с, 1H), 8,42 (д, J=7,3 Гц, 1H), 8,18 (с, 1H), 7,76 (д, J=1,1 Гц, 1H), 7,51 (д, J=8,1 Гц, 1H), 7,28 (дд, J=1,5, 8,3 Гц, 1H), 7,19 (д, J=2,1 Гц, 2H), 6,92-7,09 (м, 3H), 5,46 (с, 2H), 3,86 (с, 3H), 3,76 (д, J=0,8 Гц, 6H). ЖХМС (ИЭР) m/z 447 (M+H)+.
Пример 31
Получение 2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)фенола
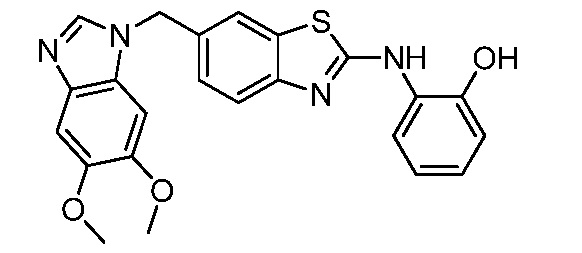
К суспензии 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (70 мг, 0,17 ммоль), полученного в примере 2, и 2-аминофенола (95 мг, 0,87 ммоль) в безводном DMA (300 мкл) при к.т. добавляли DIEA (90 мкл, 0,52 ммоль). Смесь перемешивали и нагревали в герметизированной пробирке при 110°C в течение 96 ч. После охлаждения до к.т. смесь очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)фенола (12 мг, 16%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,77 (шир. с, 1H), 8,14-8,26 (м, 2H), 7,75 (с, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,24-7,29 (м, 1H), 7,16-7,22 (m , 2H), 6,79-6,92 (м, 3H), 5,46 (с, 2H), 3,76 (с, 6H). ЖХМС (ИЭР) m/z 461 (M+H)+.
Пример 32
Получение (1R,2R)-1-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола или (1R,2R)-1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H- имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (альтернатива примеру 83)
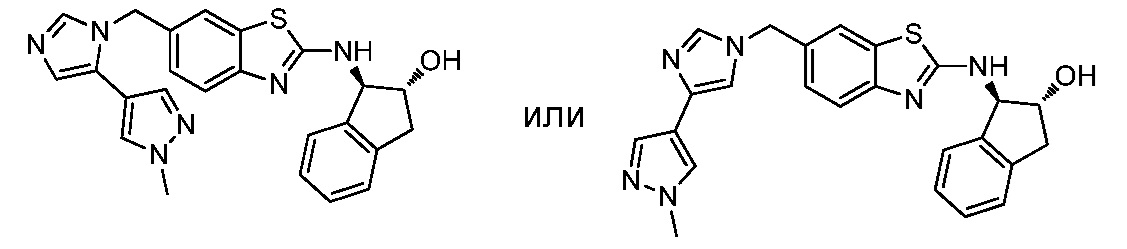
Стадия 1: К перемешиваемой смеси DMF (15 мл) и NaH (60% дисперсия в минеральном масле, 539 мг, 21 ммоль) при 0°C в атмосфере аргона одной порцией добавляли 4-бром-1H-имидазол (3 г, 20 ммоль). Смесь перемешивали в течение 5 мин при 0°C. По каплям добавляли раствор 2-(триметилсилил)этоксиметилхлорида (4,3 мл, 24 ммоль) в DMF (3 мл). После перемешивания при 0°C в течение 1 ч, смесь медленно нагревали до к.т. и перемешивали в течение 6 ч. Затем смесь распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли и промывали солевым раствором, сушили над Na2SO4, фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле (элюируя градиентом 100% гексаны→100% EtOAc) с получением региоизомерной смеси 4-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола и 5-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола в виде масла (2,9 г, 53%). ЖХМС (ИЭР) m/z 277 и 279 (M+H)+.
Стадия 2: К смеси 4-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола и 5-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (345 мг, 1,3 ммоль), полученной на стадии 1 этого примера, и пинаколовому эфиру 1-метилпиразол-4-бороновой кислоты (390 мг, 1,9 ммоль) в DME (3 мл) добавляли K2CO3 (691, 5 ммоль). Смесь барботировали аргоном в течение 5 мин, после чего добавляли Pd(PPh3)2Cl2 (44 мг, 0,06 ммоль). Смесь барботировали аргоном еще в течение 5 мин. Затем реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 15 ч. Смесь охлаждали до к.т., а затем распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли и промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% CH2Cl2→10% MeOH в CH2Cl2, с получением региоизомерной смеси 1-метил-4-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-4-ил)-1H-пиразола и 1-метил-4-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-5-ил)-1H-пиразола в виде масла (280 мг, 82%). ЖХМС (ИЭР) m/z 280 (M+H)+.
Стадия 3: Смесь 1-метил-4-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-4-ил)-1H-пиразола и 1-метил-4-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-5-ил)-1H-пиразола (170 мг, 0,7 ммоль), полученную на стадии 2 этого примера, перемешивали в смеси TFA и CH2Cl2 (1/1, 5 мл) в течение 15 ч. Затем смесь концентрировали в условиях пониженного давления с получением 4-(1H-имидазол-4-ил)-1-метил-1H-пиразола (248 мг) в виде масла, которое использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 149 (M+H)+.
Стадия 4: К перемешиваемой смеси 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (209 мг, 0,9 ммоль), полученного на стадии 4 примера 36, и 4-(1H-имидазол-4-ил)-1-метил-1H-пиразола (248 мг, 1,0 ммоль), полученного на стадии 3 этого примера, в безводном DMF (3,0 мл) добавляли K2CO3 (700 мг, 5 ммоль). После перемешивания в течение 3 ч при 80°C, реакционную смесь охлаждали до к.т. и распределяли между EtOAc (150 мл) и водой (50 мл). EtOAc слой отделяли, промывали солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле (изократически элюируя 1% MeOH в CH2Cl2) с раздельным получением 6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола и 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола в виде белых твердых веществ. Элюируемый первым региоизомер называли региоизомером 1 (55 мг, 16%), а элюируемый вторым региоизомер называли региоизомером 2 (142 мг, 42%). Региохимию алкилирования изучали методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE), но данные были неубедительными. Региоизомер 1: 1H ЯМР (300 МГц, CDCl3) δ 7,81 (д, J=8,3 Гц, 1H), 7,60 (с, 1H), 7,37 (с, 1H), 7,31 (с, 1H), 7,19 (с, 1H), 7,08-7,14 (м, 2H), 5,23 (с, 2H), 3,85 (с, 3H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 342 (M+H)+. Региоизомер 2: 1H ЯМР (300 МГц, CDCl3) δ 7,81 (д, J=8,3 Гц, 1H), 7,60-7,71 (м, 2H), 7,47-7,56 (м, 2H), 7,22 (дд, J=1,6, 8,4 Гц, 1H), 6,94 (с, 1H), 5,15 (с, 2H), 3,87 (с, 3H), 2,76 (с, 3H). ЖХМС (ИЭР) m/z 342 (M+H)+.
Стадия 5: К перемешиваемой смеси региоизомера 1 (55 мг, 0,2 ммоль), полученного на стадии 4 этого примера, в CH2Cl2 (15 мл) при 0°C добавляли 70-75% 3-хлорпербензойную кислоту (40 мг, 0,2 ммоль). После перемешивания смеси при 0°C в течение 2 ч, добавляли насыщенный водн. NaHCO3 (10 мл). Смесь перемешивали в течение 10 мин, CH2Cl2 слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением либо 6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола либо 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (55 мг) в виде белой пены. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 356 (M+H)+.
Стадия 6: К смеси либо 6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола либо 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (55 мг, 0,2 ммоль), полученной на стадии 5 этого примера, и (1R,2R)-1-амино-2,3-дигидро-1H-инден-2-ола (48 мг, 0,4 ммоль) в NMP (1,5 мл) добавляли DIEA (112 мкл, 0,8 ммоль). Реакционный сосуд герметизировали и нагревали при 150°C в микроволновом реакторе Biotage в течение 2 ч. Смесь сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением единственного соединения, идентифицированного либо как (1R,2R)-1-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол, либо как (1R,2R)-1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол (альтернатива примеру 83) (6 мг, 7%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (д, J=7,9 Гц, 1H), 7,72-7,86 (м, 2H), 7,49 (с, 1H), 7,28-7,39 (м, 2H), 7,12-7,26 (м, 4H), 7,01 (с, 1H), 6,92 (дд, J=1,7, 8,3 Гц, 1H), 5,52 (м, 1H), 5,28 (с, 2H), 5,17 (т, J=7,1 Гц, 1H), 4,30 (м, 1H), 3,82 (с, 3H), 3,16 (м, 1H), 2,74 (м, 1H). ЖХМС (ИЭР) m/z 443 (M+H)+.
Пример 33
Получение (S)-N-(1-циклогексилэтил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина
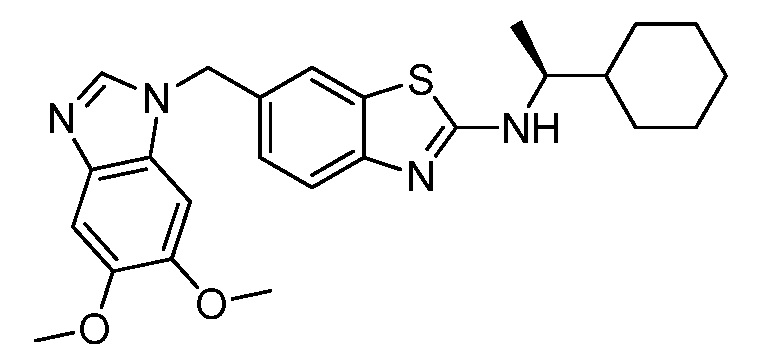
Перемешиваемую смесь 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (80 мг, 0,198 ммоль), полученного в примере 2, (S)-(+)-1-циклогексилэтиламина (50 мг, 0,396 ммоль) и DIEA (77 мг, 0,594 ммоль) в безводном DMA (2 мл) нагревали при 100°C в течение 72 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (S)-N-(1-циклогексилэтил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-амина (48 мг, 54%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,14 (с, 1H), 7,89 (д, J=8,3 Гц, 1H), 7,62 (с, 1H), 7,29 (м, 1H), 7,12-7,23 (м, 3H), 5,40 (с, 2H), 3,76 (2 × s, 6H), 1,55-1,79 (м, 6H), 1,32 (м, 1H), 0,93-1,22 (м, 8H). ЖХМС (ИЭР) m/z 451 (M+H)+.
Пример 34
Получение (1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
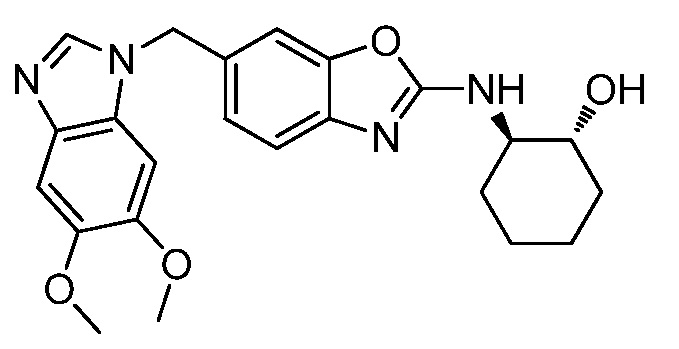
Стадия 1: К перемешиваемому раствору (2-(метилтио)бензо[d]оксазол-6-ил)метанола (1,2 г, 6,15 ммоль), полученного в примере 56, и DIEA (1,19 г, 9,23 ммоль) в безводном DCM (40 мл) при 0°C по каплям добавляли метансульфонилхлорид (771 мг, 6,77 ммоль). Смесь оставляли нагреваться до к.т. и перемешивали еще в течение 2 ч. Смесь распределяли между насыщенным водн. NaHCO3 и DCM. Органический слой отделяли и промывали 2 M водн. HCl. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением смеси (2-(метилтио)бензо[d]оксазол-6-ил)метилметансульфоната и 6-(хлорметил)-2-(метилтио)бензо[d]оксазола (9/1, 1,45 г) в виде светло-розового твердого вещества, которое дополнительно не очищали. (2-(Метилтио)бензо[d]оксазол-6-ил)метилметансульфонат: 1H ЯМР (300 МГц, ДМСО-d6) δ 7,78 (м, 1H), 7,68 (д, J=8,1 Гц, 1H), 7,45 (м, 1H), 5,36 (с, 2H), 3,25 (с, 3H), 2,78 (с, 3H); 6-(хлорметил)-2-(метилтио)бензо[d]оксазол: 1H ЯМР (300 МГц, ДМСО-d6) δ 7,75 (д, J=1,3 Гц, 1H), 7,63 (д, J=8,1 Гц, 1H), 7,43 (дд, J=1,3, 8,1 Гц, 1H), 4,89 (с, 2H), 2,77 (с, 3H).
Стадия 2: К перемешиваемому раствору смеси (2- (метилтио)бензо[d]оксазол-6-ил)метилметансульфоната и 6-(хлорметил)-2-(метилтио)бензо[d]оксазола (9/1, 1,45 г), полученной на стадии 1 этого примера, и 5,6-диметоксибензимидазола (945 мг, 5,31 ммоль) в безводном DMF (10 мл) при к.т. добавляли твердый K2CO3 (1,47 г, 10,62 ммоль). Смесь перемешивали при к.т. в течение 3 ч. Смесь распределяли между водой и DCM. Органический слой отделяли и промывали водой. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→10% MeOH в DCM, с получением 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (430 мг) в виде твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,20 (с, 1H), 7,66 (м, 1H), 7,60 (д, J=9,0 Гц, 1H), 7,32 (дд, J=9,0, 3,0 Гц, 1H), 7,19 (с, 2H), 5,53 (с, 2H), 3,76 (с, 6H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 356 (M+H)+.
Стадия 3: К перемешиваемому раствору 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (160 мг, 0,451 ммоль), полученного на стадии 2 этого примера, в DCM (2 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (114 мг, 0,496 ммоль), смесь оставляли нагреваться до к.т. и перемешивали еще в течение 2,5 ч. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением твердого вещества (121 мг). Твердое вещество растворяли в безводном DMA (2 мл), а затем добавляли (1R,2R)-(-)-2-аминоциклогексанол (38 мг, 0,324 ммоль) и DIEA (63 мг, 0,486 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при 90°C в течение 15 ч. После охлаждения до к.т. реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (35 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,16 (с, 1H), 7,81 (м, 1H), 7,35 (с, 1H), 7,11-7,21 (м, 4H), 5,41 (с, 2H), 4,70 (шир. с, 1H), 3,76 (с, 6H), 1,80-2,00 (м, 2H), 1,55-1,67 (м, 2H), 1,15-1,30 (м, 4H). ЖХМС (ИЭР) m/z 423 (M+H)+.
Пример 35
Получение N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-амина
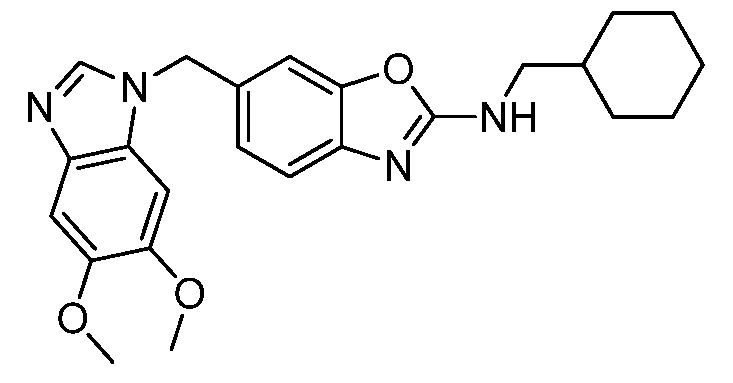
Стадия 1: К перемешиваемому раствору 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (270 мг, 0,761 ммоль), полученного на стадии 2 примера 34, в DCM (5 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (262 мг, 1,14 ммоль), смесь оставляли нагреваться до к.т. и перемешивали еще в течение 4,5 ч. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→10% MeOH в DCM, с получением 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (127 мг, 45%) в виде твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,24 (с, 1H), 7,85-7,92 (м, 2H), 7,48 (д, J=8,3 Гц, 1H), 7,21 (с, 1H), 7,20 (с, 1H), 5,62 (с, 2H), 3,76 (с, 6H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 372 (M+H)+.
Стадия 2: Перемешиваемую смесь 6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (60 мг, 0,162 ммоль), циклогексилметиламина (36 мг, 0,323 ммоль) и DIEA (63 мг, 0,485 ммоль) в безводном DMA (2 мл) нагревали при 90°C в течение 15 ч. После охлаждения до к.т. реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением N-(циклогексилметил)-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-амина (20 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,17 (с, 1H), 7,99 (т, J=5,7 Гц, 1H), 7,37 (с, 1H), 7,11-7,24 (м, 4H), 5,42 (с, 2H), 3,77 (с, 3H), 3,76 (с, 3H), 3,11 (т, J=6,2 Гц, 2H), 1,50-1,79 (м, 7H), 1,07-1,26 (м, 2H), 0,81-1,00 (м, 2H). ЖХМС (ИЭР) m/z 421 (M+H)+.
Пример 36
Получение (1R,2R)-2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
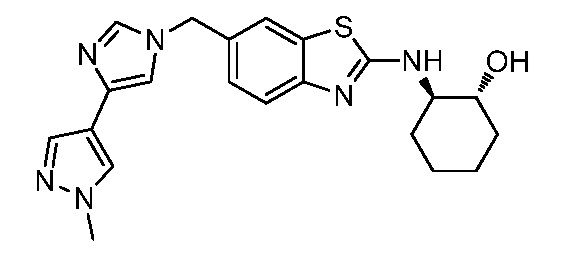
Стадия 1: К перемешиваемой смеси CuBr2 (6,5 г, 0,03 моль) и трет-бутилнитрила (3,9 г, 0,04 моль) в CH3CN (100 мл) при 0°C в атмосфере аргона порциями добавляли этил-2-аминобензо[d]тиазол-6-карбоксилат (5,0 г, 0,02 моль). После перемешивания при 0°C в течение 15 мин, смесь оставляли нагреваться до к.т. и перемешивали в атмосфере аргона в течение 2 ч. Добавляли 2н HCl (300 мл), и полученный раствор экстрагировали EtOAc (2×200 мл). Объединенные EtOAc слои промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→50% EtOAc в гексанах, с получением этил-2-бромбензо[d]тиазол-6-карбоксилата (3,94 г, 61%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,81 (с, 1H), 8,05-8,12 (м, 2H), 4,37 (кв., J=7,2 Гц, 2H), 1,36 (т, J=7,1 Гц, 3H). ЖХМС (ИЭР) m/z 286 и 288 (M+H)+.
Стадия 2: К перемешиваемой смеси 2-бромбензо[d]тиазол-6-карбоксилата (2,3 г, 7,9 ммоль), полученного на стадии 1 этого примера, в THF (15 мл) при 0°C одной порцией добавляли тиометоксид натрия (607 мг, 8,7 ммоль). Смесь оставляли нагреваться до к.т. и перемешивали в течение 20 ч. Смесь распределяли между EtOAc (150 мл) и водой (100 мл). EtOAc слой отделяли и промывали водой (100 мл) и солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением этил-2-(метилтио)бензо[d]тиазол-6-карбоксилата (1,7 г, 83%) в виде желтого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (д, J=1,3 Гц, 1H), 8,02 (м, 1H), 7,92 (м, 1H), 4,35 (кв., J=7,0 Гц, 2H), 2,83 (с, 3H), 1,35 (т, J=7,1 Гц, 3H). ЖХМС (ИЭР) m/z 254 (M+H)+.
Стадия 3: К перемешиваемой смеси этил-2-(метилтио)бензо[d]тиазол-6-карбоксилата (1,7 г, 6,6 ммоль), полученного на стадии 2 этого примера, в CH2Cl2 (50 мл) при -78°C в атмосфере аргона по каплям добавляли 1 M диизобутилалюмогидрид в CH2Cl2 (13,8 мл, 13,8 ммоль). После перемешивания смеси при -78°C в атмосфере аргона в течение 3 ч, ее оставляли медленно нагреваться до 0°C. К смеси при перемешивании добавляли насыщенный водн. тартрат калия-натрия (50 мл), и оставляли смесь медленно нагреваться до к.т. После перемешивания смеси в течение 12 ч органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением (2-(метилтио)бензо[d]тиазол-6-ил)метанола (1,05 г, 76%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,93 (м, 1H), 7,79 (д, J=8,3 Гц, 1H), 7,40 (дд, J=1,3, 8,3 Гц, 1H), 5,32 (т, J=5,7 Гц, 1H), 4,60 (д, J=5,8 Гц, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 212 (M+H)+.
Стадия 4: К перемешиваемой смеси (2-(метилтио)бензо[d]тиазол-6-ил)метанола (1,05 г, 5 ммоль), полученного на стадии 3 этого примера, и DIEA (1,3 мл, 7,5 ммоль) в безводном CH2Cl2 (20 мл) в атмосфере аргона при -10°C по каплям добавляли раствор метансульфонилхлорида (0,6 г, 5,5 ммоль) в CH2Cl2 (10 мл). Смесь оставляли нагреваться до к.т. и перемешивали в течение 3 ч. Дополнительно добавляли метансульфонилхлорид (190 мг, 1,7 ммоль), и перемешивали смесь еще в течение 2 ч. Добавляли воду (50 мл), и перемешивали смесь в течение 10 мин. Полученную смесь затем экстрагировали CH2Cl2 (200 мл). CH2Cl2 слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (1,0 г, 88%) в виде светло-красного твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 230 (M+H)+.
Стадия 5: К перемешиваемой смеси 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (0,2 г, 0,9 ммоль), полученного на стадии 4 этого примера, и 4-бром-1H-имидазола (0,2 г, 1,3 ммоль) в безводном DMF (3,0 мл) добавляли K2CO3 (0,37 г, 2,7 ммоль). После перемешивания в течение 3 ч при к.т. реакционную смесь распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли, промывали солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 30% EtOAc в гексанах→100% EtOAc, с получением 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (160 мг, 54%) в виде желтого масла. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, CDCl3) δ 7,85 (д, J=8,3 Гц, 1H), 7,54 (д, J=1,1 Гц, 1H), 7,45 (д, J=1,3 Гц, 1H), 7,24 (дд, J=1,7, 8,5 Гц, 1H), 6,88 (д, J=1,5 Гц, 1H), 5,17 (с, 2H), 2,80 (с, 3H), ЖХМС (ИЭР) m/z 340 и 342 (M+H)+.
Стадия 6: К перемешиваемой смеси 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (105 мг, 0,3 ммоль), полученного на стадии 5 этого примера, в CH2Cl2 (15 мл) при 0°C добавляли 70-75% 3-хлорпербензойную кислоту (91 мг, 0,4 ммоль). После перемешивания смеси при 0°C в течение 2 ч, добавляли насыщенный водн. NaHCO3 (10 мл). Смесь перемешивали в течение 10 мин, CH2Cl2 слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (130 мг) в виде белой пены. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 356 и 358 (M+H)+.
Стадия 7: К суспензии 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (130 мг, 0,37 ммоль), полученного на стадии 6 этого примера, и (1R,2R)-2-аминоциклогексанола (126 мг, 1 ммоль) в безводном DMA (1,0 мл) добавляли DIEA (320 мкл, 1,8 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 7 ч. Смесь охлаждали до к.т., и при перемешивании медленно добавляли воду с получением осадка. Смесь перемешивали в течение 10 мин, и собирали твердое вещество путем фильтрования с получением (1R,2R)-2-((6-((4-бром-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 68%) в виде рыжеватого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 407 и 409 (M+H)+.
Стадия 8: К суспензии (1R,2R)-2-((6-((4-бром-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (50 мг, 0,12 ммоль), полученного на стадии 7 этого примера, и пинаколового эфира 1-метилпиразол-4-бороновой кислоты (51 мг, 0,25 ммоль) в смеси DME (0,7 мл) и H2O (0,3 мл) добавляли K2CO3 (68 мг, 0,5 ммоль). Смесь барботировали аргоном в течение 5 мин. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (14 мг, 0,01 ммоль). Смесь барботировали аргоном в течение 5 мин. Реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 16 ч. К смеси добавляли дополнительные порции пинаколового эфира 1-метилпиразол-4-бороновой кислоты (51 мг, 0,25 ммоль) и тетракис(трифенилфосфин)палладий(0) (14 мг, 0,01 ммоль), и барботировали смесь аргоном в течение 5 мин. Реакционный сосуд герметизировали, и нагревали смесь при 110°C в течение 4 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (100 мл) и водн. 1н K2CO3 (50 мл). EtOAc слой отделяли и промывали водой (50 мл) и солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((4-(1- метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (10,3 мг, 20%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,97 (д, J=7,5 Гц, 1H), 7,80 (с, 1H), 7,71 (с, 1H), 7,54-7,62 (м, 2H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (с, 1H), 7,16 (дд, J=1,3, 8,3 Гц, 1H), 5,13 (с, 2H), 4,75 (шир. м, 1H), 3,80 (с, 3H), 3,52 (шир. с, 1H), 3,34 (шир. с, 1H), 2,04 (д, J=10,2 Гц, 1H), 1,88 (д, J=9,4 Гц, 1H), 1,55-1,66 (м, 2H), 1,10-1,33 (м, 4H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 37
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-имидазол-4-карбоксамида
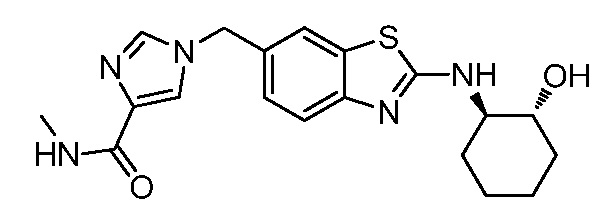
Стадия 1: К перемешиваемой смеси 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (500 мг, 2,2 ммоль), полученного в примере 36, и метил-4-имидазолкарбоксилата (400 мг, 3,3 ммоль) в DMF (15 мл) добавляли K2CO3 (0,9 г, 6,5 ммоль). После перемешивания смеси в течение 3 ч при к.т. ее распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли и промывали водой (50 мл) и солевым раствором (50 мл), а затем сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2% MeOH в CH2Cl2, с получением метил-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4- карбоксилата (130 мг, 19%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,01 (д, J=0,9 Гц, 1H), 7,98 (д, J=1,1 Гц, 1H), 7,93 (д, J=0,9 Гц, 1H), 7,84 (д, J=8,3 Гц, 1H), 7,43 (дд, J=1,7, 8,3 Гц, 1H), 5,35 (с, 2H), 3,72 (с, 3H), 2,78 (с, 3Н). ЖХМС (ИЭР) m/z 322 (M+H)+.
Стадия 2: К перемешиваемомому раствору метиламина (623 мкл 2 M раствора в THF, 1,3 ммоль) при 0°C добавляли триметилалюминий (623 мкл 2 M раствора в толуоле, 1,2 ммоль). Смесь перемешивали в течение 2 мин, а затем по каплям добавляли раствор 1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксилата (80 мг, 0,25 ммоль), полученного на стадии 1 этого примера, в DCE (1 мл). Реакционный сосуд герметизировали, и нагревали смесь при 70°C в течение 20 ч. Затем смесь концентрировали в условиях пониженного давления, и очищали остаток методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в EtOAc, с получением N-метил-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамида (46 мг, 58%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,98 (д, J=1,3 Гц, 1H), 7,81-7,94 (м, 3H), 7,71 (д, J=1,1 Гц, 1H), 7,42 (дд, J=1,6, 8,4 Гц, 1H), 5,33 (с, 2H), 2,78 (с, 3H), 2,70 (д, J=4,9 Гц, 3H). ЖХМС (ИЭР) m/z 319 (M+H)+.
Стадия 3: N-Метил-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамид синтезировали в виде белой пены (76 мг, 100%) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, N-метил-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамидом, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 335 (M+H)+).
Стадия 4: 1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-имидазол-4-карбоксамид синтезировали в виде белого порошка (26 мг, 46%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, N-метил-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамидом, полученным на стадии 3 этого примера, и подвергая неочищенный остаток очистке методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,01 (д, J=7,5 Гц, 1H), 7,84-7,92 (м, 1H), 7,80 (д, J=1,1 Гц, 1H), 7,62-7,67 (м, 2H), 7,31 (д, 1H), 7,18 (дд, J=1,7, 8,3 Гц, 1H), 5,18 (с, 2H), 4,77 (шир. м, 1H), 3,55 (шир. м, 1H), 3,35 (шир. м, 1H), 2,69 (шир. м, 3H), 2,04 (шир. М, 1H), 1,86 (шир. м, 1H), 1,61 (шир. м, 2H), 1,10-1,35 (шир. м, 4H). ЖХМС (ИЭР) m/z 386 (M+H)+.
Пример 38
Получение (1R,2R)-2-((6-(имидазо[1,2-a]пиридин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола
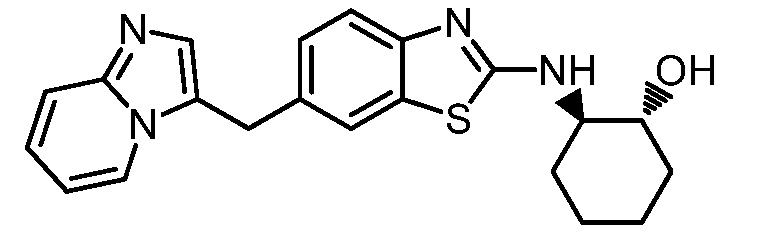
Стадия 1: Перемешиваемую смесь 2-фтор-4-йоданилина (5,0 г, 21,1 ммоль), CuI (90 мг, 0,42 ммоль) и PdCl2(PPh3)2 (300 мг, 0,42 ммоль) в толстостенной пробирке продували аргоном. Добавляли этинилтриметилсилан (2,28 г, 23,2 ммоль) в TEA (20 мл), и перемешивали полученную смесь при к.т. в течение ночи. Реакционную смесь затем разбавляли Et2O и фильтровали через слой целита. Фильтрат концентрировали в условиях пониженного давления, и очищали остаток методом хроматографии на силикагеле, элюируя 5% EtOAc в гексанах, с получением 2-фтор-4-((триметилсилил)этинил)анилина (4,4 г, 100%) в виде коричневого твердого вещества. ЖХМС (ИЭР) m/z 208 (M+H)+.
Стадия 2: К раствору 2-фтор-4-((триметилсилил)этинил)анилина (4,4 г, 21,2 ммоль), полученного на стадии 1 этого примера, в 20 мл DMF добавляли O-этилкарбонодитиоат калия (7,48 г, 46,8 ммоль). Полученную смесь нагревали с обратным холодильником в течение 4 ч. После охлаждения до к.т. реакционную смесь обрабатывали водой (30 мл) и 1н HCl (100 мл). Смесь перемешивали при к.т. в течение 2 ч, после чего выпавшие в осадок вещества собирали путем фильтрования и промывали водой с получением неочищенного 6-этинилбензо[d]тиазол-2-тиола (4,0 г, 99%) в виде темно-коричневого твердого вещества. ЖХМС (ИЭР) m/z 192 (M+H)+.
Стадия 3: К перемешиваемому раствору 6-этинилбензо[d]тиазол-2-тиола (4,0 г, 21 ммоль), полученного на стадии 2 этого примера, в 20 мл DMF при 0°C добавляли K2CO3 (7,25 г, 5,25 ммоль) и MeI (5 мл). Смесь перемешивали при к.т. в течение 2 ч, после чего ее распределяли между EtOAc и водой, органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/гексанами (3/1), с получением 6-этинил-2-(метилтио)бензо[d]тиазола (1,5 г, 35%) в виде не совсем белого твердого вещества. ЖХМС (ИЭР) m/z 206 (M+H)+.
Стадия 4: Перемешиваемую смесь 2-аминопиридина (100 мг, 1,1 ммоль), параформальдегида (34 мг, 1,1 ммоль), CuCl (5 мг, 0,06 ммоль) и Cu(OTf)2 (19 мг, 0,06 ммоль) в 3 мл толуола в толстостенной пробирке продували аргоном. Добавляли 6-этинил-2-(метилтио)бензо[d]тиазол (327 мг, 1,6 ммоль), полученный на стадии 3 этого примера. Реакционный сосуд герметизировали, и нагревали смесь на масляной бане при 120°C в течение 6 ч. Анализ методом LCMS обнаруживал почти полное завершение реакции. Реакционную смесь распределяли между EtOAc и насыщенным водн. NaHCO3. Органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя 0-100% EtOAc в гексанах, с получением 6-(имидазо[1,2-a]пиридин-3-илметил)-2-(метилтио)бензо[d]тиазола (127 мг, 38%) в виде коричневого масла. ЖХМС (ИЭР) m/z 312 (M+H)+.
Стадия 5: (1R,2R)-2-((6-(Имидазо[1,2-a]пиридин-3- илметил)бензо[d]тиазол-2-ил)амино)циклогексанол (28 мг, 18%) получали в виде желтого порошка с последовательным использованием методик, аналогичных описанным на стадии 5 примера 3 и стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-(имидазо[1,2-a]пиридин-3-илметил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,20 (д, J=6,4 Гц, 1H), 7,89 (д, J=7,5 Гц, 1H), 7,48-7,62 (м, 2H), 7,43 (шир. с, 1H), 7,27 (д, J=8,1 Гц, 1H), 7,14-7,23 (м, 1H), 7,09 (дд, J=1,2, 8,2 Гц, 1H), 6,86 (т, J=6,7 Гц, 1H), 4,75 (шир. с, 1H), 4,29 (с, 2H), 3,47-3,59 (м, 1H), 2,03 (д, J=10,4 Гц, 1H), 1,88 (шир. с, 2H), 1,61 (шир. с, 2H), 1,23 (д, J=5,5 Гц, 4H). ЖХМС (ИЭР) m/z 379 (M+H)+.
Пример 39
Получение (1R, 2R)-2-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
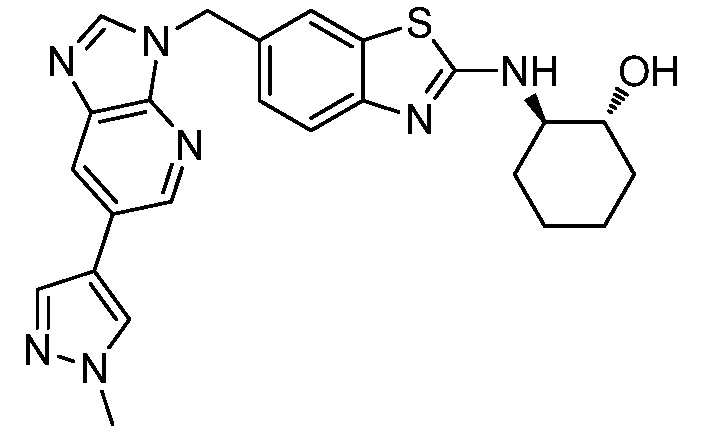
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (80 мг, 0,175 ммоль), полученного в примере 29, пинаколового эфира 1-метилпиразол-4-бороновой кислоты (73 мг, 0,351 ммоль), 2M водн. Na2CO3 (400 мкл, 0,40 ммоль) и безводного DME (1,5 мл) дегазировали в атмосфере аргона в течение 15 мин. Добавляли дихлорид бис(трифенилфосфин)палладия(II) (12 мг, 0,0171 ммоль), реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R, 2R)-2-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (33 мг, 41%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,64 (д, J=1,9 Гц, 1H), 8,56 (с, 1H), 8,26 (д, J=1,9 Гц, 1H), 8,23 (с, 1H), 7,95-8,01 (м, 2H), 7,67 (д, J=1,1 Гц, 1H), 7,20-7,32 (м, 2H), 5,47 (с, 2H), 4,76 (шир. с, 1H), 3,88 (с, 3H), 3,51 (м, 1H), 3,35 (м, 1H), 2,03 (м, 1H), 1,90 (м, 1H), 1,62 (д, J=4,7 Гц, 2H), 1,10-1,33 (м, 4H). ЖХМС (ИЭР) m/z 460 (M+H)+.
Пример 40
Получение (1R,2R)-2-((6-((6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
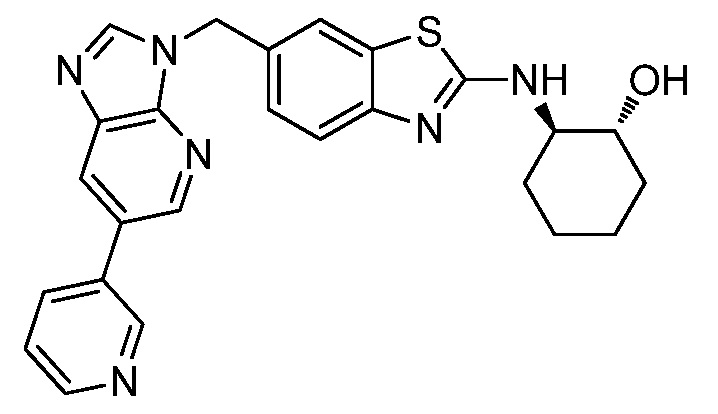
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (80 мг, 0,175 ммоль), полученного в примере 29, пиридин-3-илбороновой кислоты (43 мг, 0,350 ммоль), 2M водн. Na2CO3 (400 мкл, 0,40 ммоль) и безводного DME (1,5 мл) дегазировали в атмосфере аргона в течение 15 мин. Добавляли дихлорид бис(трифенилфосфин)палладия(II) (12 мг, 0,0171 ммоль), реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (25 мг, 31%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,99 (шир. с, 1H), 8,66-8,77 (м, 2H), 8,60 (шир. с, 1H), 8,46 (с, 1H), 8,19 (д, J=7,9 Гц, 1H), 8,00 (д, J=7,3 Гц, 1H), 7,69 (с, 1H), 7,52 (дд, J=4,7, 7,7 Гц, 1H), 7,21-7,34 (м, 2H), 5,53 (с, 2H), 4,77 (шир. с, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,66 (м, 2H), 1,11-1,34 (м, 4H). ЖХМС (ИЭР) m/z 457 (M+H)+.
Пример 41
Получение (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
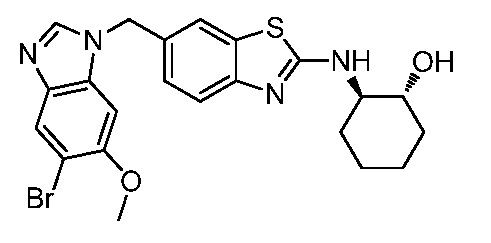
Стадия 1: К перемешиваемой смеси DMF (15 мл) и NaH (60% в минеральном масле,75 мг,, 1,9 ммоль) при -10°C в атмосфере аргона одной порцией добавляли 4-бром-5-метокси-2-нитроанилин (490 мг, 2,2 ммоль). Смесь перемешивали в течение 5 мин при -10°C. По каплям добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (500 мг, 2,2 ммоль), полученного в примере 36, в DMF (5 мл). После перемешивания при -10°C в течение 1 ч, смесь оставляли медленно нагреваться до к.т. Смесь перемешивали при к.т. в течение 58 ч, а затем распределяли между EtOAc (150 мл) и 1 M водн. Na2CO3 (50 мл). EtOAc слой отделяли и промывали водой (50 мл) и солевым раствором, сушили над Na2SO4, фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (239 мг, 25%) в виде оранжевого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,02 (т, J=5,8 Гц, 1H), 8,23 (с, 1H), 8,06 (с, 1H), 7,83 (д, J=8,5 Гц, 1H), 7,53 (д, J=8,3 Гц, 1H), 6,40 (с, 1H), 4,80 (д, J=5,8 Гц, 2H), 3,77 (с, 3H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 440 и 442 (M+H)+.
Стадия 2: К перемешиваемой суспензии 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (212 мг, 0,5 ммоль), полученного на стадии 1 этого примера, в EtOH (4 мл) и HOAc (2 мл) при 0°C в атмосфере аргона одной порцией добавляли цинковый порошок (160 мг, 2,4 ммоль). Спустя 1,5 ч при 0°C добавляли MeOH (5 мл), еще HOAc (2 мл) и цинковый порошок (160 мг, 2,4 ммоль). Смесь оставляли нагреваться до к.т. и перемешивали в течение 18 ч. Смесь фильтровали, и охлаждали фильтрат до 0°C. Значение pH фильтрата корректировали до pH~9 добавлением твердого Na2CO3. Затем, смесь распределяли между EtOAc (150 мл) и водой (100 мл). EtOAc слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (120 мг, 61%). ЖХМС (ИЭР) m/z 410 и 412 (M+H)+.
Стадия 3: К перемешиваемой смеси 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (120 мг, 0,3 ммоль), полученного на стадии 2 этого примера, и триэтилортоформиата (20 мл) добавляли муравьиную кислоту (1 мл). Смесь нагревали при кипячении с обратным холодильником в течение 2 ч, а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% EtOAc, с получением 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (50 мг, 40%) в виде масла. 1H ЯМР (300 МГц, CDCl3) δ 8,01 (с, 1H), 7,78-7,91 (м, 2H), 7,46 (с, 1H), 7,25 (м, 1H), 6,69 (с, 1H), 5,42 (с, 2H), 3,81 (с, 3H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 420 и 422 (M+H)+.
Стадия 4: 6-((5-Бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (75 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. ЖХМС (ИЭР) m/z 436 и 438 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((5-Бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (15 мг, 26%) с использованием методики, аналогичной описанной на стадии 4 примера 37, заменяя N-метил-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамид, использованный в примере 37, 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,29 (с, 1H), 7,98 (д, J=7,5 Гц, 1H), 7,85 (с, 1H), 7,66 (д, J=1,1 Гц, 1H), 7,37 (с, 1H), 7,27-7,33 (м, 1H), 7,22 (дд, J=9, 1,5 Гц, 1H), 5,46 (с, 2H), 4,75 (д, J=4,9 Гц, 1H), 3,85 (с, 3H), 3,52 (шир. м, 1H), 3,33 (шир. м, 1H), 2,02 (шир. м, 1H), 1,85 (шир. м, 1H), 1,55-1,68 (шир. м, 2H), 1,10-1,34 (шир. м, 4H). ЖХМС (ИЭР) m/z 487 и 489 (M+H)+.
Пример 42
Получение (1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
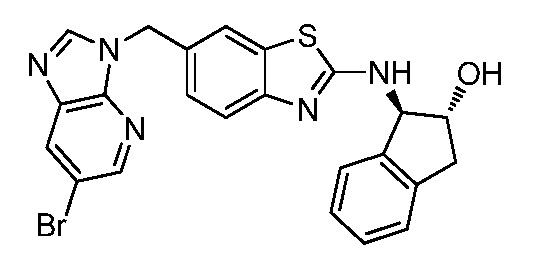
Перемешиваемую смесь 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (210 мг, 0,3 ммоль), полученного в примере 29, (1R,2R)-1-амино-2,3-дигидро-1H-инден-2-ола (92 мг, 0,6 ммоль) и DIEA (267 мкл, 1,5 ммоль) в DMA (3 мл) нагревали при 130°C в течение 120 ч в герметизированной пробирке. Смесь охлаждали до к.т. и подвергали очистке методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (5,4 мг, 4%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,36-8,54 (м, 3H), 7,71 (с, 1H), 7,35 (м, 1H), 7,11-7,30 (м, 5H), 5,51 (с, 2H), 5,18 (т, J=7,0 Гц, 1H), 4,30 (м, 1H), 3,16 (дд, J=7,2, 15,8 Гц, 1H), 2,74 (дд, J=7,3, 15,4 Гц, 1H). ЖХМС (ИЭР) m/z 492 и 494 (M+H)+.
Пример 43
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила
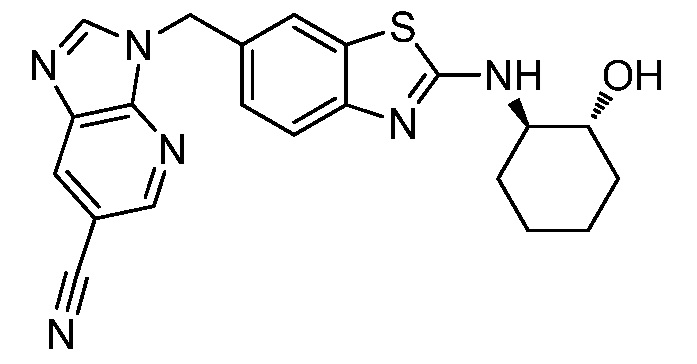
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (170 мг, 0,372 ммоль), полученного в примере 29, цианида цинка (131 мг, 1,12 ммоль), 1,1’-бис(дифенилфосфино)ферроцена (31 мг, 0,0558 ммоль) и безводного DMF (2 мл) дегазировали в атмосфере аргона в течение 15 мин. Добавляли трис(дибензилиденацетон)дипалладий(0) (34 мг, 0,0372 ммоль). Реакционный сосуд герметизировали и нагревали смесь при 100°C в течение 6 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением ((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила (51 мг, 34%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,80-8,91 (м, 2H), 8,72 (д, J=1,5 Гц, 1H), 7,99 (д, J=7,3 Гц, 1H), 7,68 (с, 1H), 7,20-7,34 (м, 2H), 5,53 (с, 2H), 4,74 (шир. с, 1H), 3,29-3,38 (м, 2H), 2,04 (м, 1H), 1,88 (м, 1H), 1,55-1,70 (м, 2H), 1,10-1,35 (м, 4H). ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 44
Получение (1R,2R)-2-((6-((7-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
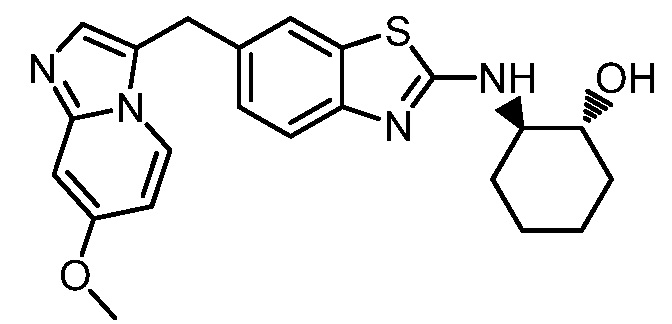
(1R,2R)-2-((6-((7-Метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (25 мг) получали в виде желтого порошка с использованием методик, аналогичных описанным на стадиях 4-5 примера 38, заменяя 2-аминопиридин, использованный в примере 38, 4-метоксипиридин-2- амином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,03 (д, J=7,3 Гц, 1H), 7,87 (д, J=7,5 Гц, 1H), 7,49 (с, 1H), 7,17-7,33 (м, 2H), 7,07 (дд, J=1,2, 8,2 Гц, 1H), 6,92 (д, J=2,3 Гц, 1H), 6,59 (дд, J=2,4, 7,4 Гц, 1H), 4,73 (шир. с, 1H), 4,22 (с, 2H), 3,80 (с, 3H), 3,41-3,63 (м, 2H), 2,03 (д, J=10,2 Гц, 1H), 1,88 (д, J=9,6 Гц, 1H), 1,61 (шир. с, 2H), 1,23 (д, J=5,3 Гц, 4H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 45
Получение (1R,2R)-2-((6-((6-циклопропил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
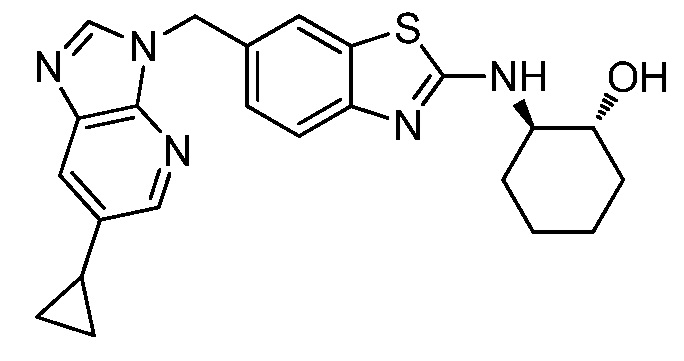
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (30 мг, 0,0656 ммоль), полученного в примере 29, циклопропилбороновой кислоты (11 мг, 0,131 ммоль), K2CO3 (36 мг, 0,262 ммоль), 2-дициклофенилфосфино-2’,4’,6’-триизопропилбифенила (16 мг, 0,0328 ммоль) и безводного толуола (1 мл) дегазировали в атмосфере аргона в течение 15 мин. Добавляли трис(дибензилиденацетон)дипалладий(0) (6 мг, 0,0066 ммоль). Реакционный сосуд герметизировали и нагревали смесь при 100°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Phenomenex Luna C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-циклопропил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (1 мг, 4%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (с, 1H), 8,24 (д, J=1,5 Гц, 1H), 8,03 (д, J=7,3 Гц, 1H), 7,70 (д, J=1,5 Гц, 1H), 7,63 (с, 1H), 7,28 (м, 1H), 7,19 (м, 1H), 5,44 (с, 2H), 4,82 (шир. с, 1H), 1,97-2,13 (м, 2H), 1,85 (м, 1H), 1,54-1,74 (м, 3H), 1,09-1,34 (м, 4H), 0,92-1,02 (м, 2H), 0,70-0,80 (м, 2H). ЖХМС (ИЭР) m/z 420 (M+H)+.
Пример 46
Получение (1R,2R)-1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
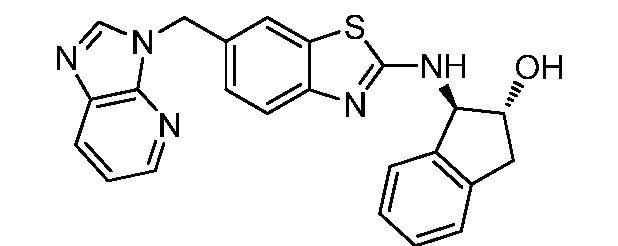
(1R,2R)-1-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол синтезировали в виде белого порошка (8 мг, 6%) с использованием методики, аналогичной описанной в примере 42, заменяя 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 42, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным в примере 3. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,46 (д, J=8,1 Гц, 1H), 8,39 (дд, J=1,3, 4,7 Гц, 1H), 8,10 (дд, J=1,3, 8,1 Гц, 1H), 7,73 (д, J=1,1 Гц, 1H), 7,10-7,40 (м, 7H), 5,51 (с, 2H), 5,17 (т, J=7,2 Гц, 1H), 4,29 (м, 1H), 3,16 (дд, J=7,0, 15,6 Гц, 1H), 2,74 (м, 1H). ЖХМС (ИЭР) m/z 414 (M+H)+.
Пример 47
Получение (1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
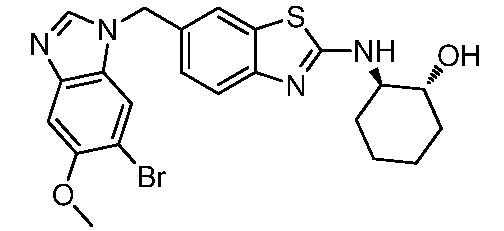
Стадия 1: К перемешиваемой смеси 4-бром-5-метокси-2-нитроанилина (5 г, 20 ммоль) в MeOH (50 мл) и HOAc (20 мл) при 0°C в атмосфере аргона порциями добавляли цинковый порошок (5,3 г, 80 ммоль). Смесь перемешивали в течение 2 ч, а затем фильтровали, и охлаждали фильтрат до 0°C. Значение pH фильтрата корректировали до pH~9 добавлением твердого Na2CO3. Затем, смесь распределяли между EtOAc (250 мл) и водой (200 мл). EtOAc слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-бром-5-метоксибензол-1,2-диамина (3,8 г, 88%) в виде темно-пурпурного твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 6,66 (с, 1H), 6,34 (с, 1H), 4,08-4,83 (м, 4H), 3,63 (с, 3H). ЖХМС (ИЭР) m/z 217 и 219 (M+H)+.
Стадия 2: К перемешиваемой смеси 4-бром-5-метоксибензол-1,2-диамина (3,8 г, 18 ммоль), полученного на стадии 1 этого примера, и триэтилортоформиата (50 мл) добавляли муравьиную кислоту (1 мл). Смесь нагревали при кипячении с обратным холодильником в течение 3 ч, а затем концентрировали в условиях пониженного давления. Остаток распределяли между EtOAc (200 мл) и 1н водн. Na2CO3 (100 мл). EtOAc слой отделяли, промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 5-бром-6-метокси-1H-бензо[d]имидазола (4,0 г) в виде коричневого масла. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 228 и 230 (M+H)+.
Стадия 3: К перемешиваемой смеси DMF (3 мл) и NaH (60% в минеральном масле, 67 мг, 1,6 ммоль) при 0°C в атмосфере аргона одной порцией добавляли 5-бром-6-метокси-1H-бензо[d]имидазол (346 мг, 1,5 ммоль), полученный на стадии 2 этого примера. Смесь перемешивали в течение 5 мин при 0°C. По каплям добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (500 мг, 2,2 ммоль), полученного на стадии 4 примера 36, в DMF (3 мл). Смесь перемешивали при 0°C в течение 1 ч, а затем оставляли медленно нагреваться до к.т. и перемешивали в течение 6 ч. Затем, смесь распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли и промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% EtOAc, с получением двух региоизомеров: Региоизомер 1; 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (127 мг, 20%). Структуру подтверждали путем сравнения с данными ЯМР, полученным при региоспецифичном синтезе этого же соединения, описанном на стадии 3 примера 41. 1H ЯМР (300 МГц, CDCl3) δ 8,02 (с, 1H), 7,78-7,91 (м, 2H), 7,47 (с, 1H), 7,25 (м, 1H), 6,70 (с, 1H), 5,43 (с, 2H), 3,82 (с, 3H), 2,79 (с, 3H). ЖХМС (ИЭР) m/z 420 и 422 (M+H)+. Региоизомер 2; 6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (81 мг, 13%). 1H ЯМР (300 МГц, CDCl3) δ 7,92 (с, 1H), 7,84 (д, J=8,5 Гц, 1H), 7,48 (м, 2H), 7,34 (с, 1H), 7,25 (м, 1H), 5,40 (с, 2H), 3,94 (с, 3H), 2,79 (с, 3H). ЖХМС (ИЭР) m/z 420 и 422 (M+H)+.
Стадия 4: 6-((6-Бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (115 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом (региоизомер 2 на стадии 3 этого примера). ЖХМС (ИЭР) m/z 436 и 438 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((6-Бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (15 мг, 19%) с использованием методики, аналогичной описанной на стадии 4 примера 37, заменяя N-метил-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-карбоксамид, использованный в примере 37, 6-((5-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,37 (с, 1H), 7,98 (д, J=7,5 Гц, 1H), 7,79-7,91 (м, 2H), 7,63 (с, 1H), 7,35 (с, 1H), 7,17 (дд, J=1,6, 8,2 Гц, 1H), 5,43 (с, 2H), 4,75 (шир. с, 1H), 3,84 (с, 3H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,13-1,35 (шир. м, 2H), 1,09-1,35 (м, 4H). ЖХМС (ИЭР) m/z 487 и 489 (M+H)+.
Пример 48
Получение (1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
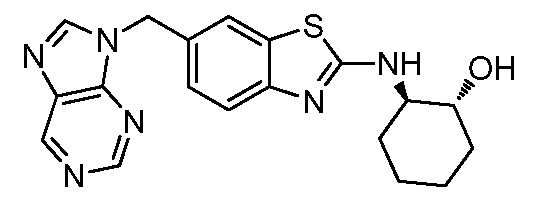
Стадия 1: 2-(Метилсульфинил)бензо[d]тиазол-6-карбонитрил синтезировали в виде рыжеватого твердого вещества (6,0 г) с использованием методики, аналогичной описанной на стадии 5 примера 3, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 2-(метилтио)бензо[d]тиазол-6-карбонитрилом, полученным на стадии 3 примера 23. ЖХМС (ИЭР) m/z 223 (M+H)+.
Стадия 2: 2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-карбонитрил синтезировали в виде белого твердого вещества (1,8 г, 69%) с использованием методики, аналогичной описанной на стадии 6 примера 3, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 3, 2-(метилсульфинил)бензо[d]тиазол-6-карбонитрилом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 274 (M+H)+.
Стадия 3: К перемешиваемой смеси 2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-карбонитрила (1,2 г, 4,5 ммоль), полученного на стадии 2 этого примера, и 2,2-диметоксипропана (4,7 г, 45 ммоль) в 1,4-диоксане (30 мл) добавляли пара-толуолсульфоновую кислоту (89 мг, 0,5 ммоль) и молекулярные сита (4Å), и нагревали смесь при кипячении с обратным холодильником в течение 15 ч. Смесь охлаждали до к.т., фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле с получением 2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-карбонитрила (700 мг, 50%) в виде белого твердого вещества. ЖХМС (ИЭР) m/z 314 (M+H)+.
Стадия 4: К перемешиваемой смеси 2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-карбонитрила (260 мг, 0,8 ммоль), полученного на стадии 3 этого примера, в THF (10 мл) при 0°C добавляли LAH (3,3 мл 1M раствора в THF, 3,3 ммоль). Смесь оставляли медленно нагреваться до к.т. и перемешивали в течение 15 ч. Смесь снова охлаждали до 0°C и медленно добавляли Na2SO4·10H2O. Смесь перемешивали в течение 2 ч, фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением (2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метанамина (237 мг). Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 318 (M+H)+.
Стадия 5: К перемешиваемой смеси (2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метанамина (236 мг, 0,7 ммоль), полученного на стадии 4 этого примера, и DIEA (388 мкл, 2,2 ммоль) при 0°C в атмосфере аргона одной порцией добавляли 4,6-дихлор-5-нитропиримидин (159 мг, 0,8 ммоль). Смесь перемешивали в течение 4 ч, а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле (элюируя градиентом 100% гексаны→50% EtOAc в гексанах) с получением 6-хлор-N-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-5-нитропиримидин-4-амина (153 мг, 43%) в виде масла. 1H ЯМР (300 МГц, CDCl3) δ 8,45 (с, 1H), 7,81 (шир. с, 1H), 7,57-7,63 (м, 2H), 7,22-7,31 (м, 1H), 4,85 (д, J=5,7 Гц, 2H), 3,11 (м, 1H), 2,82 (м, 1H), 2,11-2,16 (м, 1H), 1,90 (м, 1H), 1,80 (с, 3H), 1,51-1,69 (м, 5H), 1,19-1,49 (м, 4H). ЖХМС (ИЭР) m/z 475 (M+H)+.
Стадия 6: К перемешиваемой смеси 6-хлор-N-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-5-нитропиримидин-4-амина (153 мг, 0,3 ммоль), полученного на стадии 5 этого примера, в MeOH (5 мл) и EtOAc (5 мл) добавляли 10 масс.% палладированный уголь (20 мг, 0,02 ммоль). Смесь при перемешивании барботировали водоородом в течение 2 мин, а затем продолжали перемешивание в течение 15 ч под давлением 1 атм H2. Смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением N4-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)пиримидин-4,5-диамина в виде масла (155 мг). Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 411 (M+H)+.
Стадия 7: (3aR,7aR)-3-(6-((9H-Пурин-9-ил)метил)бензо[d]тиазол-2-ил)-2,2-диметилоктагидробензо[d]оксазол синтезировали в виде масла (220 мг) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, N4-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)пиримидин-4,5-диамином, полученным на стадии 6 этого примера. ЖХМС (ИЭР) m/z 421 (M+H)+.
Стадия 8: Раствор (3aR,7aR)-3-(6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)-2,2-диметилоктагидробензо[d]оксазола (220 мг, 0,5 ммоль), полученного на стадии 7 этого примера, в TFA (5 мл) и CH2Cl2 (5 мл) перемешивали в течение 2 ч при к.т. Смесь концентрировали в условиях пониженного давления, и очищали остаток методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (7 мг, 4%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,17 (с, 1H), 8,96 (с, 1H), 8,74 (с, 1H), 8,01 (д, J=7,5 Гц, 1H), 7,68 (д, J=1,1 Гц, 1H), 7,17-7,36 (м, 2H), 5,50 (с, 2H), 4,78 (д, J=4,5 Гц, 1H), 3,52 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,57-1,67 (м, 2H), 1,11-1,34 (м, 4H). ЖХМС (ИЭР) m/z 381 (M+H)+.
Пример 49
Получение (1R,2R)-1-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
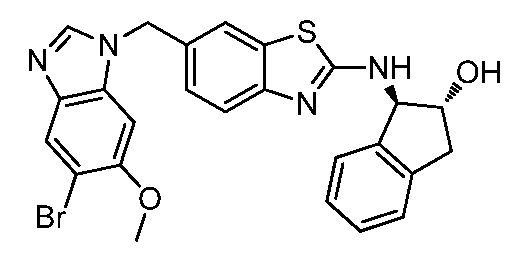
Стадия 1: 6-((5-Бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (200 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, региоизомером 1 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола, полученным на стадии 3 примера 47. ЖХМС (ИЭР) m/z 436 и 438 (M+H)+.
Стадия 2: К суспензии 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (279 мг, 0,07 ммоль) и (1R,2R)-1-амино-2,3-дигидро-1H-инден-2-ола (30 мг, 0,2 ммоль) добавляли DIEA (60 мкл, 0,3 ммоль). Смесь нагревали в микроволновом реакторе Biotage при 160°C в герметизированной пробирке в течение 30 мин. Затем, смесь подвергали очистке методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1- ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (7 мг, 20%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,48 (д, J=7,9 Гц, 1H), 8,31 (с, 1H), 7,86 (с, 1H), 7,72 (с, 1H), 7,33-7,41 (м, 2H), 7,28 (м, 1H), 7,12-7,24 (м, 4H), 5,49 (с, 2H), 5,17 (т, J=7,1 Гц, 1H), 4,29 (шир. с, 1H), 3,87 (с, 3H), 3,16 (дд, J=7,0, 15,6 Гц, 1H), 2,74 (дд, J=7,3, 15,5 Гц, 1H). ЖХМС (ИЭР) m/z 522 и 524 (M+H)+.
Пример 50
Получение (±)-2-((6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогептанола
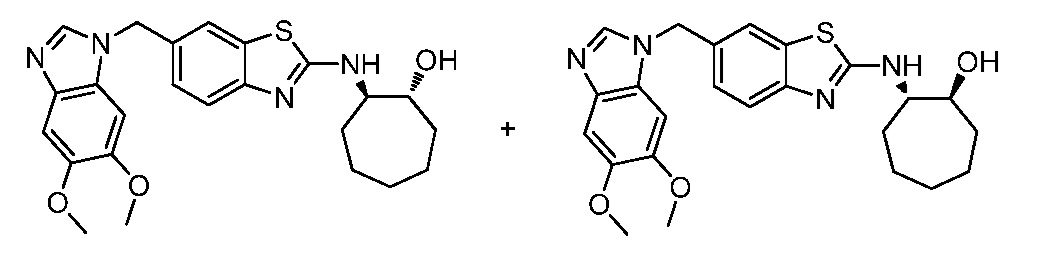
Стадия 1: К перемешиваемой смеси (±)-2-азидоциклогептанола (190 мг, 1,2 ммоль) в THF (1 мл) и H2O (100 мкл) добавляли PPh3 (321 мг, 1,2 ммоль). Смесь перемешивали при к.т. в течение 15 ч, а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя CH2Cl2/MeOH/TEA (100/15/1), с получением (±)-2-аминоциклогептанола (103 мг, 50%) в виде белого твердого вещества. ЖХМС(ELSD) (ИЭР) m/z 130 (M+H)+.
Стадия 2: (±)-2-((6-((5,6-Диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогептанол синтезировали в виде белого порошка (39 мг, 16%) с использованием методики, аналогичной описанной в примере 27, заменяя 2-этоксианилин, использованный в примере 27, (±)-2-аминоциклогептанолом, полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15 (с, 1H), 8,05 (д, J=7,3 Гц, 1H), 7,63 (д, J=1,1 Гц, 1H), 7,30 (м, 1H), 7,13-7,24 (м, 3H), 5,41 (с, 2H), 4,80 (д, J=4,1 Гц, 1H), 3,64-3,81 (м, 8H), 3,58 (шир. с, 1H), 1,23-1,99 (м, 9H). ЖХМС (ИЭР) m/z 453 (M+H)+.
Пример 51
Получение (1R,2R)-2-((6-((6-метокси-5-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
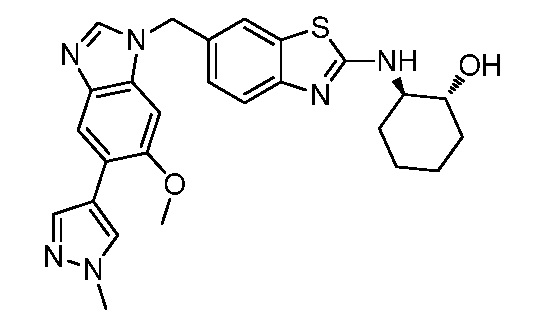
Стадия 1: К суспензии 6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (502 мг, 1 ммоль), полученного на стадии 1 примера 49, и (1R,2R)-2-аминоциклогексанола в DMA (4 мл) добавляли DIEA (1 мл, 6 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 16 ч. Смесь охлаждали до к.т. и при перемешивании по каплям добавляли к H2O (200 мл). После перемешивания смеси в течение 30 мин, твердое вещество собирали путем фильтрования с получением (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (443 мг, 80%) в виде рыжеватого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,99 (д, J=7,5 Гц, 1H), 7,86 (с, 1H), 7,66 (д, J=1,1 Гц, 1H), 7,37 (с, 1H), 7,30 (м, 1H), 7,22 (м, 1H), 5,46 (с, 2H), 4,76 (д, J=5,1 Гц, 1H), 3,86 (с, 3H), 3,53 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,88 (м 1H), 1,55-1,69 (м 2H), 1,11-1,33 (м, 4H). ЖХМС (ИЭР) m/z 486 и 488 (M+H)+.
Стадия 2: К суспензии (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (30 мг, 0,06 ммоль), полученного на стадии 1 этого примера, и пинаколового эфира 1-метилпиразол-4-бороновой кислоты (26 мг, 0,1 ммоль) в DME (300 мкл) добавляли водн. 2M K2CO3 (150 мкл, 0,2 ммоль). Смесь барботировали аргоном в течение 5 мин, после чего добавляли дихлорид бис(трифенилфосфин)палладия(II) (4 мг, 0,006 ммоль). Смесь барботировали аргоном еще в течение 5 мин, а затем нагревали смесь в герметизированной пробирке в течение 15 ч. Смесь охлаждали до к.т., а затем распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-метокси-5-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (16 мг, 53%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,21 (с, 1H), 7,97-8,06 (м, 2H), 7,87 (с, 1H), 7,80 (с, 1H), 7,66 (д, J=1,1 Гц, 1H), 7,27-7,33 (м, 1H), 7,19-7,25 (м, 2H), 5,44 (с, 2H), 4,78 (д, J=4,3 Гц, 1H), 3,85 (с, 6H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,66 (м, 2H), 1,12-1,32 (м, 4H). ЖХМС (ИЭР) m/z 489 (M+H)+.
Пример 52
Получение (1R,2R)-2-((6-((5-метокси-6-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
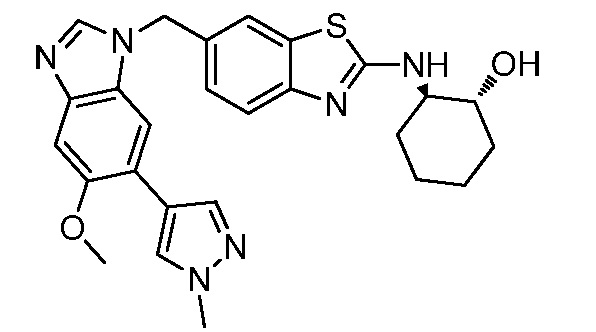
(1R,2R)-2-((6-((5-Метокси-6-(1-метил-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (19 мг, 55%) синтезировали в виде белого порошка с использованием методики, аналогичной описанной на стадии 2 примера 51, заменяя (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 51, (1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 5 примера 47. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,27 (с, 1H), 8,06 (с, 1H), 7,99 (д, J=7,3 Гц, 1H), 7,88 (с, 1H), 7,77 (с, 1H), 7,68 (д, J=1,1 Гц, 1H), 7,18-7,33 (м, 3H), 5,44 (с, 2H), 4,77 (д, J=4,5 Гц, 1H), 3,86 (с, 6H), 3,50 (м, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,86 (м, 1Н), 1,55-1,65 (м, 2Н), 1,10-1,31 (м, 4Н). ЖХМС (ИЭР) m/z 489 (M+H)+.
Пример 53
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-1H-бензо[d]имидазол-6-карбонитрила
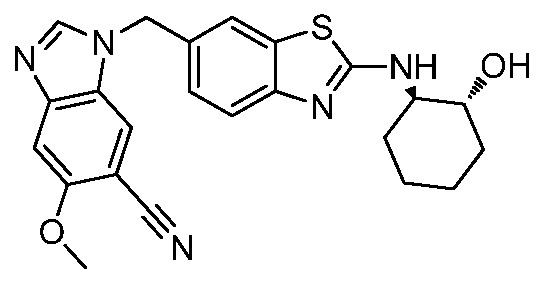
К суспензии (1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (50 мг, 0,1 ммоль), полученного на стадии 5 примера 47, в DMF (1,5 мл) добавляли цианид цинка (24 мг, 0,2 ммоль). Смесь барботировали аргоном в течение 5 мин, после чего добавляли 1,1'-бис(дифенилфосфино)ферроцен (9 мг, 0,02 ммоль) и трис(дибензилиденацетон)дипалладий (9 мг, 0,01 ммоль). Смесь барботировали аргоном еще в течение 5 мин. Реакционный сосуд герметизировали, и нагревали смесь при 110°C в течение 15 ч. Смесь охлаждали до к.т., и снова барботировали смесь аргоном в течение 5 мин. К смеси дополнительно добавляли цианид цинка (24 мг, 0,2 ммоль), 1,1'-бис(дифенилфосфино)ферроцен (9 мг, 0,02 ммоль) и трис(дибензилиденацетон)дипалладий (9 мг, 0,01 ммоль), реакционный сосуд повторно герметизировали и нагревали в течение 5 ч. Смесь охлаждали до к.т., фильтровали, и очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 1-((2-(((1R,2R)-2- гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-1H-бензо[d]имидазол-6-карбонитрила (18 мг, 41%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,12 (с, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,70 (д, J=0,9 Гц, 1H), 7,43 (с, 1H), 7,20-7,34 (м, 2H), 5,46 (с, 2H), 4,76 (д, J=4,9 Гц, 1H), 3,90 (с, 3H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,57-1,67 (м, 2H), 1,15-1,34 (м, 4H). ЖХМС (ИЭР) m/z 434 (M+H)+.
Пример 54
Получение (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанона
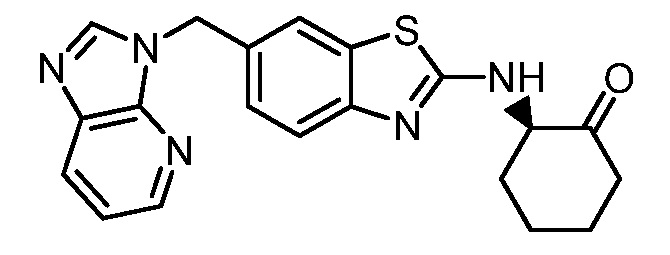
(1R,2R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (188 мг, 0,50 ммоль), полученный в примере 3, перемешивали в смеси DCM/MeCN/DMA (4/4/2, об./об./об.), при к.т. добавляли перйодинан Десс-Мартина (254 мг, 0,60 ммоль), и перемешивали смесь при к.т. в течение 30 мин, после чего добавляли другую порцию перйодинана (254 мг, 0,60 ммоль). Полученную смесь нагревали при 55°C в течение 4 ч, затем добавляли другую порцию перйодинана (254 мг, 0,60 ммоль), и нагревали реакционную смесь при 60°C в течение 6 ч. Анализ методом LCMS обнаруживал почти полное завершение реакции. Смесь затем охлаждали до к.т. и распределяли между DCM и 3% водн. NaOH, а затем органический слой промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя 0-100% EtOAc в гексанах, с получением (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанона (150 мг, 80%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,38 (дд, J=1,2, 4,8 Гц, 1H), 8,22 (д, J=7,3 Гц, 1H), 8,09 (дд, J=1,3, 8,1 Гц, 1H), 7,70 (д, J=1,1 Гц, 1H), 7,26-7,35 (м, 2H), 7,19-7,26 (м, 1H), 5,49 (с, 2H), 4,68 (тд, J=6,5, 12,8 Гц, 1H), 2,53-2,67 (м, 1H), 2,42 (ддд, J=2,7, 5,9, 12,3 Гц, 1H), 2,30 (д, J=13,4 Гц, 1H), 1,94-2,12 (м, 1H), 1,82 (шир. с, 2H), 1,38-1,66 (м, 2H). ЖХМС (ИЭР) m/z 378 (M+H)+.
Пример 55
Получение (1R,2R)-2-((6-((6-хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
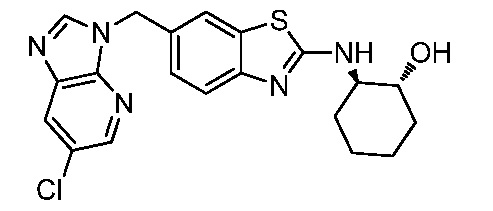
Стадия 1: 5-Хлор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин синтезировали в виде желтой пены (126 мг, 29%) с использованием методики, аналогичной описанной на стадии 1 примера 41, заменяя 4-бром-5-метокси-2-нитроанилин, использованный в примере 41, 5-хлор-3-нитропиридин-2-амином. ЖХМС (ИЭР) m/z 367 (M+H)+.
Стадия 2: Неочищенный 5-хлор-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин синтезировали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2- нитроанилин, использованный в примере 41, 5-хлор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на стадии 1 этого примера. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc с получением 5-хлор-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамина (75 мг, 65%). ЖХМС (ИЭР) m/z 337 (M+H)+.
Стадия 3: 6-((6-Хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол синтезировали в виде белой пены (62 мг, 80%) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, 5-хлор-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамином, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 4: 6-((6-Хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (111 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((6-хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. ЖХМС (ИЭР) m/z 363 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((6-Хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (35 мг, 47%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4- бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((6-хлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,42 (д, J=2,1 Гц, 1H), 8,28 (д, J=2,3 Гц, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,66 (д, J=1,3 Гц, 1H), 7,29 (м, 1H), 7,21 (м, 1H), 5,48 (с, 2H), 4,74 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,12-1,31 (м, 4H). ЖХМС (ИЭР) m/z 414 (M+H)+.
Пример 56
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
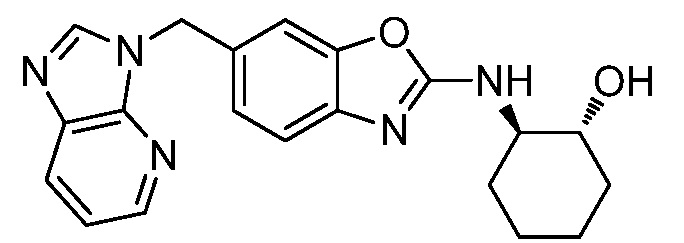
Стадия 1: К перемешиваемой смеси метил-2-меркаптобензо[d]оксазол-6-карбоксилата (5 г, 23,92 ммоль) и твердого K2CO3 (9,9 г, 71,76 ммоль) в безводном DMF (50 мл) при к.т. добавляли метилйодид (10,2 г, 71,76 ммоль). Смесь перемешивали при к.т. в течение 15 ч. Реакционную смесь разбавляли водой, а затем экстрагировали DCM (×3). Объединенные органические слои промывали водой и 2 M водн. HCl. Органический слой отделяли и сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением метил-2-(метилтио)бензо[d]оксазол-6-карбоксилата (4,24 г, 80%) в виде светло-розового твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, CDCl3) δ 8,12 (д, J=1,1 Гц, 1H), 8,04 (дд, J=1,1, 8,3 Гц, 1H), 7,61 (д, J=8,3 Гц, 1H), 3,95 (с, 3H), 2,79 (с, 3H). ЖХМС (ИЭР) m/z 224 (M+H)+.
Стадия 2: К перемешиваемому раствору метил-2-(метилтио)бензо[d]оксазол-6-карбоксилата (4,24 г, 19 ммоль), полученного на стадии 1 этого примера, в безводном DCM (100 мл) в атмосфере аргона при -78°C по каплям добавляли диизобутилалюмогидрид (1,0 M раствор в DCM, 40 мл, 40 ммоль). Смесь оставляли нагреваться до -30°C в течение 2 ч. Реакционную смесь гасили добавлением насыщенного водн. тартрата калия-натрия, и перемешивали полученную смесь при к.т. еще в течение 15 ч. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством DCM (× 2). Объединенные органические слои промывали водой, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением (2-(метилтио)бензо[d]оксазол-6-ил)метанола (2 г, 54%) в виде рыжеватого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,51-7,61 (м, 2H), 7,28 (д, J=8,3 Гц, 1H), 5,34 (т, J=5,7 Гц, 1H), 4,59 (д, J=5,7 Гц, 2H), 2,76 (с, 3H). ЖХМС (ИЭР) m/z 196 (M+H)+.
Стадия 3: К перемешиваемому раствору (2-(метилтио)бензо[d]оксазол-6-ил)метанола (2 г, 10,26 ммоль), полученного на стадии 2 этого примера, в смеси безводного DMF (0,5 мл) и безводного DCM (100 мл) при 0°C по каплям добавляли тионилхлорид (4 мл, 55 ммоль). Смесь оставляли нагреваться до к.т. и перемешивали еще в течение 40 мин. Смесь концентрировали в условиях пониженного давления, и распределяли остаток между насыщенным водн. NaHCO3 и смесью DCM/MeOH (10/1). Органический слой отделяли и сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-(хлорметил)-2-(метилтио)бензо[d]оксазола (2 г, 92%) в виде светло-розового твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ ppm 7,75 (д, J=1,3 Гц, 1H), 7,63 (д, J=8,1 Гц, 1H), 7,43 (дд, J=1,3, 8,1 Гц, 1H), 4,89 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 214 (M+H)+.
Стадия 4: К перемешиваемому раствору 4-азабензимидазола (304 мг, 2,55 ммоль) в безводном DMF (10 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 107 мг, 2,68 ммоль), и перемешивали смесь при 0°C в течение 20 мин. Смесь оставляли нагреваться до к.т. и перемешивали еще в течение 20 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]оксазола (600 мг, 2,81 ммоль), полученного на стадии 3 этого примера, в DMF (5 мл). Смесь перемешивали при к.т. в течение 15 ч. К реакционной смеси добавляли воду, и экстрагировали смесь DCM. Объединенные органические слои промывали солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали, и концентрировали фильтрат в условиях пониженного давления. Неочищенное вещество очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM, а затем 1% MeOH в DCM, с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (290 мг, 38%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,64 (с, 1H), 8,38 (дд, J=1,2, 4,6 Гц, 1H), 8,10 (дд, J=1,2, 8,0 Гц, 1H), 7,69 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,25-7,41 (м, 2H), 5,61 (с, 2H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 297 (M+H)+.
Стадия 5: К перемешиваемому раствору 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (290 мг, 0,979 ммоль), полученного на стадии 4 этого примера, в DCM (25 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (582 мг, 2,36 ммоль), и перемешивали смесь при 0°C в течение 2,5 ч. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (305 мг, 100%) в виде твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,38 (д, J=4,5 Гц, 1H), 8,11 (д, J=7,2 Гц, 1H), 7,84-7,94 (м, 2H), 7,52 (д, J=8,3 Гц, 1H), 7,30 (дд, J=4,8, 8,0 Гц, 1H), 5,69 (с, 2H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 6: Перемешиваемую смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (165 мг, 0,53 ммоль), полученного на стадии 5 этого примера, (1R,2R)-(-)-2-аминоциклогексанола (122 мг, 1,06 ммоль) и DIEA (137 мг, 1,06 ммоль) в безводном DMA (3 мл) герметизировали и нагревали при 100°C в течение 15 ч. Реакционную смесь охлаждали до к.т. и сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (44 мг, 23%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,39 (дд, J=1,1, 4,7 Гц, 1H), 8,08 (дд, J=1,2, 8,0 Гц, 1H), 7,81 (д, J=7,5 Гц, 1H), 7,40 (с, 1H), 7,29 (дд, J=4,7, 8,1 Гц, 1H), 7,10-7,19 (м, 2H), 5,50 (с, 2H), 4,70 (шир. с, 1H), 3,25-3,45 (м, 2H), 1,83-1,97 (м, 2H), 1,57-1,67 (м, 2H), 1,14-1,32 (м, 4H). ЖХМС (ИЭР) m/z 364 (M+H)+.
Пример 57
Получение (1R,2R)-1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
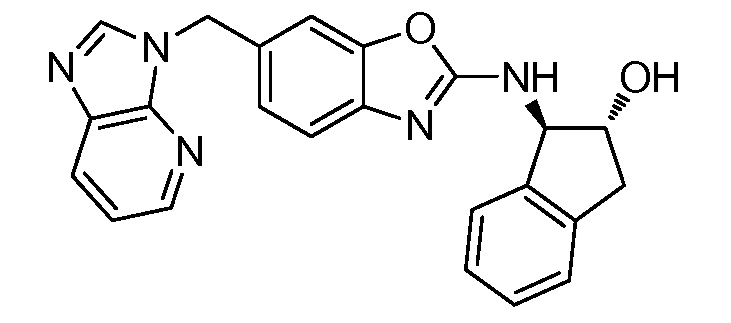
Перемешиваемую смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (108 мг, 0,346 ммоль), полученного на стадии 5 примера 56, (1R,2R)-(-)-транс-1-амино-2-инданола (104 мг, 0,698 ммоль) и DIEA (90 мг, 0,698 ммоль) в безводном DMA (1,5 мл) герметизировали и нагревали в микроволновом реакторе Biotage при 120°C в течение 30 мин. Реакционную смесь охлаждали до к.т. и сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (35 мг, 26%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,36-8,45 (м, 2H), 8,09 (дд, J=1,3, 8,1 Гц, 1H), 7,47 (с, 1H), 7,29 (дд, J=4,7, 8,1 Гц, 1H), 7,12-7,25 (м, 6H), 5,52 (с, 2H), 5,47 (д, J=5,1 Гц, 1H), 5,02 (м, 1H), 4,34 (м, 1H), 3,15 (дд, J=7,2, 15,6 Гц, 1H), 2,73 (дд, J=7,6, 15,4 Гц, 1H). ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 58
Получение (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексаноноксима
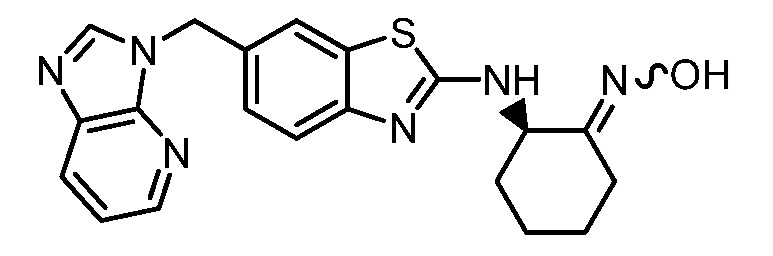
(R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанон (70 мг, 0,19 ммоль), полученный в примере 54, перемешивали в EtOH. Добавляли пиридин (100 мкл, избыток) и NH2OH·HCl (100 мг, избыток), и нагревали полученную смесь при 88°C в течение 1 ч. Анализ методом LCMS обнаруживал завершение реакции. Смесь затем охлаждали до к.т. и очищали методом HPLC с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексаноноксима (53 мг, 73%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 10,57 (с, 1H), 8,60 (с, 1H), 8,38 (д, J=4,0 Гц, 1H), 8,13-8,27 (м, 1H), 8,09 (дд, J=0,8, 7,9 Гц, 1H), 7,58-7,76 (м, 1H), 7,10-7,39 (м, 3H), 5,49 (с, 2H), 4,33-4,77 (м, 1H), 2,69-2,95 (м, 1H), 1,92-2,38 (м, 2H), 1,26-1,86 (м, 5H). ЖХМС (ИЭР) m/z 393 (M+H)+.
Пример 59
Получение либо (1S,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола, либо (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола
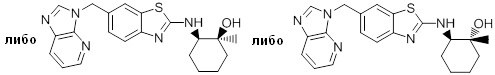
(R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанон (60 мг, 0,16 ммоль), полученный в примере 54, перемешивали в 5 мл THF при 0°C в атмосфере аргона. Медленно по каплям добавляли метиллитий в THF (1,6 M, 99 мкл, 0,16 ммоль). Полученную смесь перемешивали при к.т. в течение 30 мин, после чего добавляли еще метиллитий в THF (495 мкл, 0,80 ммоль). Спустя 90 мин, реакционную смесь гасили добавлением нас. NH4Cl (20 мл), и экстрагировали полученную смесь DCM (2×50 мл). Объединенные органические слои промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях пониженного давления. Остаток очищали методорм препаративной TLC на силикагеле, элюируя 2N NH3 в MeOH/EtOAc (5/95), а затем методом HPLC с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением двух отдельных диастереоизомеров:
Изомер, элюируемый первым при проведении HPLC с обращенной фазой, представляет собой один из (1S,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола или (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола (5 мг, 8%) в виде белого порошка. 1H ЯМР (300 МГц, MeOH-d4) δ 8,40-8,51 (м, 2H), 8,10 (дд, J=0,9, 8,1 Гц, 1H), 7,64 (с, 1H), 7,23-7,43 (м, 3H), 5,57 (с, 2H), 3,78-3,92 (м, 1H), 1,56-1,84 (м, 4H), 1,31-1,55 (м, 4H), 1,22 (с, 3H). ЖХМС (ИЭР) m/z 394 (M+H)+.
Пример 60
Получение либо (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола, либо (1S,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола
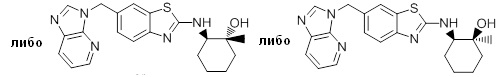
Для двух диастереоизомеров, полученных в примере 59, изомер, элюируемый вторым при проведении HPLC с обращенной фазой, представляет собой один из (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола или (1S,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-1-метилциклогексанола и является альтернативой примеру 59; полученный в виде белого порошка (4 мг, 6%). 1H ЯМР (300 МГц, MeOH-d4) δ 8,28-8,40 (м, 2H), 7,99 (дд, J=1,1, 8,1 Гц, 1H), 7,52 (д, J=0,9 Гц, 1H), 7,13-7,35 (м, 3H), 5,45 (с, 2H), 3,58 (дд, J=3,9, 11,2 Гц, 1H), 1,17-1,74 (м, 8H), 1,12 (с, 3H). ЖХМС (ИЭР) m/z 394 (M+H)+.
Пример 61
Получение (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
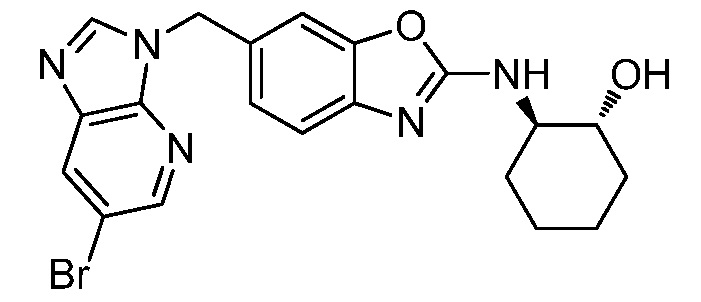
Стадия 1: Перемешиваемую смесь 5-бромпиридин-2,3-диамина (5 г, 26,6 ммоль), муравьиной кислоты (2,5 мл) и триэтилортоформиата (70 мл) нагревали при 100°C в течение 2,5 ч. Реакционную смесь охлаждали до к.т., выпавшее в осадок твердое вещество собирали путем фильтрования, промывали Et2O и сушили с получением 6-бром-3H-имидазо[4,5-b]пиридина в виде твердого вещества (3,22 г, 61%), которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 13,14 (шир.с, 1H), 8,50 (с, 1H), 8,44 (д, J=2,1 Гц, 1H), 8,31 (д, J=1,9 Гц, 1H). ЖХМС (ИЭР) m/z 198 и 200 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-бром-3H-имидазо[4,5-b]пиридина (506 мг, 2,55 ммоль), полученного на стадии 1 этого примера, в безводном DMF (10 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 107 мг, 2,68 ммоль), и перемешивали смесь при 0°C в течение 30 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2- (метилтио)бензо[d]оксазола (600 мг, 2,81 ммоль), полученного на стадии 3 примера 56, в DMF (2 мл). Смесь оставляли нагреваться до к.т., а затем перемешивали еще в течение 15 ч. К реакционной смеси добавляли воду, и экстрагировали смесь EtOAc. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством EtOAc. Объединенные органические слои промывали водой, а затем солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM, а затем 1% MeOH в DCM, с получением 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (460 мг, 48%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,48 (д, J=1,9 Гц, 1H), 8,40 (д, J=1,9 Гц, 1H), 7,68 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,34 (д, J=8,1 Гц, 1H), 5,59 (с, 2H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 375 и 377 (M+H)+.
Стадия 3: К перемешиваемому раствору 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (460 мг, 1,23 ммоль), полученного на стадии 2 этого примера, в DCM (25 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (333 мг, 1,35 ммоль), смесь оставляли нагреваться до к.т. и перемешивали еще в течение 30 мин. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой повторно экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (481 мг, 100%) в виде кремового твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,73 (с, 1H), 8,40-8,50 (м, 2H), 7,84-7,95 (м, 2H), 7,50 (д, J=8,3 Гц, 1H), 5,68 (с, 2H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 391 и 393 (M+H)+.
Стадия 4: Перемешиваемую смесь 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (150 мг, 0,384 ммоль), полученного на стадии 3 этого примера, (1R,2R)-(-)-2-аминоциклогексанола (88 мг, 0,768 ммоль) и DIEA (99 мг, 0,768 ммоль) в безводном DMA (3 мл) в герметизированной пробирке нагревали в микроволновом реакторе Biotage при 120°C в течение 30 мин. После охлаждения реакционной смеси до к.т. ее сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (64 мг, 38%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,49 (д, J=2,0 Гц, 1H), 8,38 (д, J=1,7 Гц, 1H), 7,81 (д, J=7,6 Гц, 1H), 7,39 (с, 1H), 7,10-7,16 (м, 2H), 5,48 (с, 2H), 4,69 (д, J=4,2 Гц, 1H), 3,30-3,40 (м, 2H), 1,83-1,97 (м, 2H), 1,57-1,67 (м, 2H), 1,15-1,30 (м, 4H). ЖХМС (ИЭР) m/z 442 и 444 (M+H)+.
Пример 62
Получение (1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
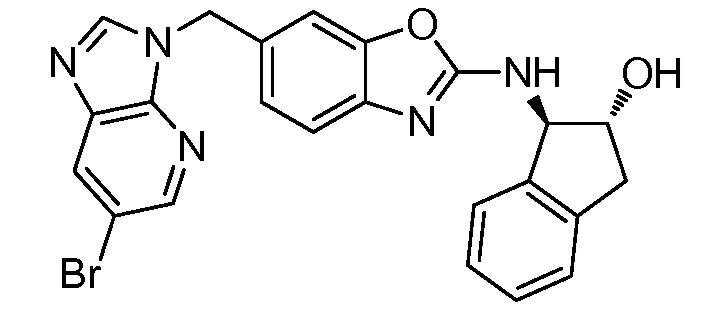
Перемешиваемую смесь 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (150 мг, 0,384 ммоль), полученного на стадии 3 примера 61, (1R,2R)-(-)-транс-1-амино-2-инданола (114 мг, 0,768 ммоль) и DIEA (99 мг, 0,768 ммоль) в безводном DMA (3 мл) в герметизированной пробирке нагревали в микроволновом реакторе Biotage при 120°C в течение 30 мин. После охлаждения реакционной смеси до к.т. ее сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (40 мг, 22%) в виде белого твердого вещества. 1H ЯМР (499 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,49 (д, J=2,0 Гц, 1H), 8,36-8,44 (м, 2H), 7,45 (с, 1H), 7,12-7,24 (м, 6H), 5,51 (с, 2H), 5,47 (д, J=5,2 Гц, 1H), 5,01 (т, J=7,6 Гц, 1H), 4,34 (м, 1H), 3,15 (дд, J=7,1, 15,5 Гц, 1H), 2,73 (дд, J=7,6, 15,5 Гц, 1H). ЖХМС (ИЭР) m/z 476 и 478 (M+H)+.
Пример 63
Получение (S)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола
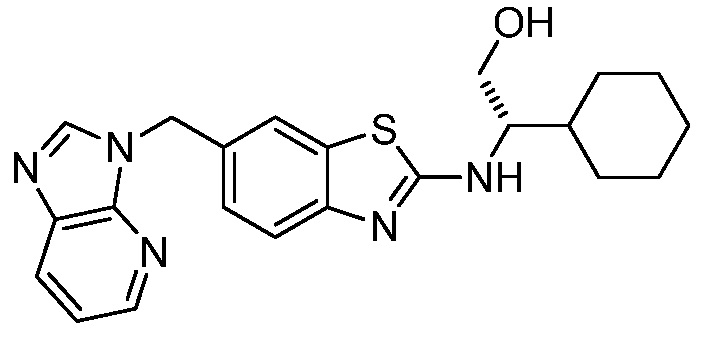
Стадия 1: К перемешиваемому раствору 4-азабензимидазола (613 мг, 5,15 ммоль) в безводном DMF (20 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 216 мг, 5,41 ммоль) и перемешивали смесь при 0°C в течение 20 мин. Смесь оставляли нагреваться до к.т. и перемешивали еще в течение 20 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (1,3 г, 5,66 ммоль), полученного на стадии 4 примера 36, в DMF (5 мл). Смесь перемешивали при к.т. в течение 15 ч. К реакционной смеси добавляли воду (300 мл), и экстрагировали смесь DCM (3×50 мл). Объединенные органические слои промывали солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле (элюируя 100% DCM, а затем 1% MeOH в DCM) с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (670 мг, 41%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,38 (дд, J=1,3, 4,7 Гц, 1H), 8,11 (дд, J=1,2, 8,0 Гц, 1H), 8,00 (д, J=1,1 Гц, 1H), 7,81 (д, J=8,5 Гц, 1H), 7,46 (дд, J=1,6, 8,4 Гц, 1H), 7,30 (дд, J=4,7, 8,1 Гц, 1H), 5,62 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (670 мг, 2,15 ммоль) в DCM (25 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (582 мг, 2,36 ммоль), и перемешивали смесь при 0°C в течение 1 ч. К смеси добавляли насыщенный водный NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и в условиях пониженного давления получали 670 мг смеси (4/1) 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола в виде твердого вещества, которое дополнительно не очищали. LCMS (ESI) m/z 329 (M+H)+ (соответствует 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолу) и m/z 345 (M+H)+ (соответствует 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазолу).
Стадия 3: К перемешиваемой смеси LiAlH4 (724 мг, 19,08 ммоль) в безводном THF (20 мл) при к.т. порциями добавляли L-(+)-2-циклогексилглицин (1 г, 6,36 ммоль). Смесь нагревали при 80°C в течение 4 ч. Смесь охлаждали до 0°C, а затем последовательно добавляли воду (1 мл), 1M водн. NaOH (1 мл) и воду (3 мл). Смесь фильтровали, и распределяли фильтрат между смесью DCM, 1M водн. NaOH и насыщенного водн. тартрата калия-натрия. Органический слой отделяли и дополнительно промывали 1M водн. NaOH. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением (S)-2-амино-2-циклогексилэтанола (500 мг), который дополнительно не очищали. ЖХМС (ИЭР) m/z 144 (M+H)+.
Стадия 4: Смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола (4/1, 60 мг), полученную на стадии 2 этого примера, растворяли в безводном DMA (1,5 мл), и к этому раствору добавляли (S)-2-амино-2-циклогексилэтанол (52 мг, 0,366 ммоль), полученный на стадии 3 этого примера, и DIEA (94 мг, 0,732 ммоль). Реакционный сосуд герметизировали, и нагревали смесь в микроволновом реакторе Biotage при 150°C в течение 30 мин. Анализ методом LCMS обнаруживал незавершение реакции. К реакционной смеси дополнительно добавляли (S)-2-амино-2-циклогексилэтанол (52 мг, 0,366 ммоль). Реакционный сосуд герметизировали, и нагревали смесь в микроволновом реакторе Biotage при 150°C в течение 40 мин. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (S)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола (4 мг) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,58 (с, 1H), 8,37 (м, 1H), 8,08 (м, 1H), 7,84 (д, J=8,9 Гц, 1H), 7,66 (с, 1H), 7,18-7,31 (м, 3H), 5,48 (с, 2H), 3,71 (м, 1H), 3,50 (м, 1H), 1,54-1,77 (м, 7H), 0,95-1,24 (м, 6H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Пример 64
Получение (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола
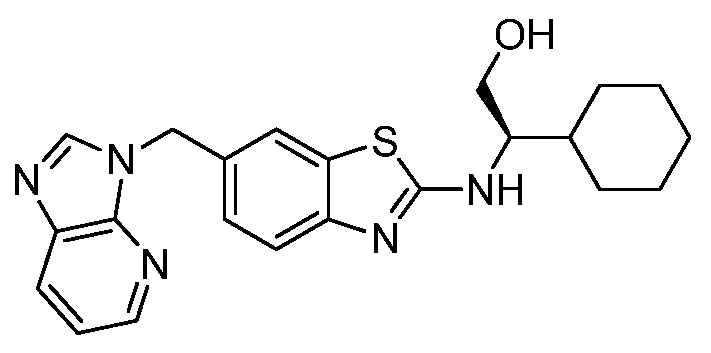
Стадия 1: К перемешиваемой смеси LiAlH4 (724 мг, 19,08 ммоль) в безводном THF (20 мл) при к.т. порциями добавляли 2-циклогексил-D-глицин (1 г, 6,36 ммоль). Смесь нагревали при 80°C в течение 4 ч. Смесь охлаждали до 0°C, а затем последовательно добавляли воду (1 мл), 1M водн. NaOH (1 мл) и воду (3 мл). Смесь фильтровали, и распределяли фильтрат между смесью DCM, 1M водн. NaOH и насыщенного водн. тартрата калия-натрия. Органический слой отделяли и дополнительно промывали 1M водн. NaOH. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением (R)-2-амино-2-циклогексилэтанола (400 мг), который дополнительно не очищали. ЖХМС (ИЭР) m/z 144 (M+H)+.
Стадия 2: Смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола (4/1, 120 мг), полученную на стадии 2 примера 63, растворяли в безводном DMA (2 мл), а затем добавляли (R)-2-амино-2-циклогексилэтанол (209 мг, 1,46 ммоль), полученный на стадии 1 этого примера, и DIEA (188 мг, 1,46 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 120°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2-циклогексилэтанола (18 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,38 (м, 1H), 8,09 (дд, J=1,0, 8,0 Гц, 1H), 7,85 (д, J=8,9 Гц, 1H), 7,66 (с, 1H), 7,18-7,32 (м, 3H), 5,48 (с, 2H), 4,70 (шир. с, 1H), 3,72 (м, 1H), 3,50 (м, 2H), 1,54-1,77 (м, 6H), 0,94-1,23 (м, 5H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Пример 65
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-6-метокси-1H-бензо[d]имидазол-5-карбонитрила
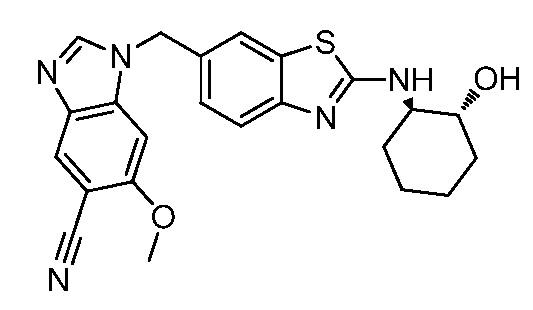
1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-6-метокси-1H-бензо[d]имидазол-5-карбонитрил синтезировали в виде белого порошка (20 мг, 45%) с использованием методики, аналогичной описанной в примере 53, заменяя (1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 53, (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2- ил)амино)циклогексанолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,12 (с, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,70 (д, J=0,9 Гц, 1H), 7,43 (с, 1H), 7,20-7,34 (м, 2H), 5,46 (с, 2H), 4,76 (д, J=4,9 Гц, 1H), 3,90 (с, 3H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,57-1,67 (м, 2H), 1,15-1,34 (м, 4H). ЖХМС (ИЭР) m/z 434 (M+H)+.
Пример 66
Получение ((1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
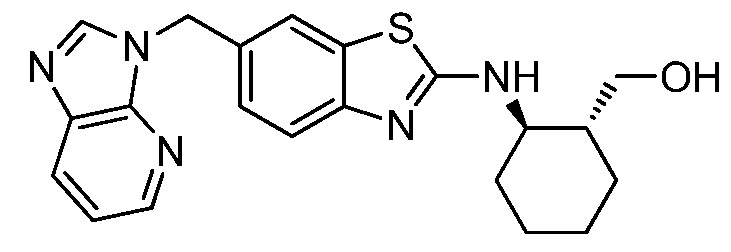
Стадия 1: К перемешиваемой смеси LiAlH4 (796 мг, 20,97 ммоль) в безводном THF (20 мл) при к.т. порциями добавляли (1R,2R)-2-аминоциклогексанкарбоновую кислоту (1 г, 6,99 ммоль). Смесь нагревали при 80°C в течение 4 ч, после чего ее охлаждали до 0°C. Последовательно добавляли воду (1 мл), 1M водн. NaOH (1 мл) и воду (3 мл). Смесь фильтровали, и распределяли фильтрат между смесью DCM, 1M водн. NaOH и насыщенного водн. тартрата калия-натрия. Органический слой отделяли и промывали 1M водн. NaOH. Органический слой отделяли, сушили над MgSO4, фильтровали, и в условиях пониженного давления получали ((1R,2R)-2-аминоциклогексил)метанол (180 мг), который дополнительно не очищали. ЖХМС (ИЭР) m/z 130 (M+H)+.
Стадия 2: Смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола (4/1, 120 мг), полученную на стадии 2 примера 63, растворяли в безводном DMA (2 мл), а затем добавляли ((1R,2R)-2-аминоциклогексил)метанол (180 мг, 1,40 ммоль), полученный на стадии 1 этого примера, и DIEA (188 мг, 1,46 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 120°C в течение 4,5 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением ((1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола (41 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,38 (дд, J=1,1, 4,7 Гц, 1H), 8,09 (дд, J=1,2, 8,0 Гц, 1H), 8,00 (д, J=8,3 Гц, 1H), 7,67 (с, 1H), 7,20-7,32 (м, 3H), 5,49 (с, 2H), 4,48 (шир. с, 1H), 3,55 (м, 2H), 1,99 (м, 1H), 1,82 (м, 1H), 1,60-1,75 (м, 2H), 1,10-1,43 (м, 6H). ЖХМС (ИЭР) m/z 394 (M+H)+.
Пример 67
Получение (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
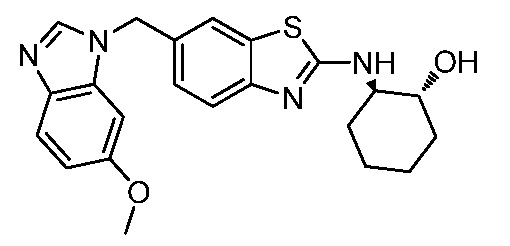
К смеси (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,2 ммоль), полученного на стадии 1 примера 51, в 1,4-диоксане (1,4 мл) и водн. 1н NaOH (300 мкл) добавляли цинковый порошок (134 мг, 2 ммоль). Смесь нагревали при 80°C в течение 55 ч. Смесь охлаждали до к.т., фильтровали, и очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (45 мг, 56%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,23 (с, 1H), 7,98 (д, J=7,6 Гц, 1H), 7,64 (д, J=1,0 Гц, 1H), 7,51 (д, J=8,6 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,20 (дд, J=1,4, 8,2 Гц, 1H), 7,12 (д, J=2,2 Гц, 1H), 6,80 (дд, J=2,3, 8,7 Гц, 1H), 5,41 (с, 2H), 4,76 (м, 1H), 3,76 (с, 3H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,66 (м, 2H), 1,14-1,29 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 68
Получение (1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
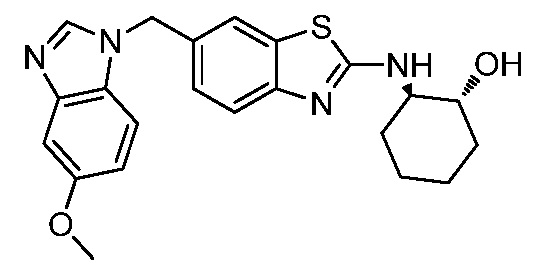
(1R,2R)-2-((6-((5-Метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (39 мг, 53%) с использованием методики, аналогичной описанной в примере 67, заменяя (1R,2R)-2-((6-((5-бром-6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 67, (1R,2R)-2- ((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 5 примера 47. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,99 (д, J=7,6 Гц, 1H), 7,62 (с, 1H), 7,40 (д, J=8,9 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,13-7,19 (м, 2H), 6,82 (дд, J=2,2, 8,9 Гц, 1H), 5,41 (с, 2H), 4,78 (м, 1H), 3,75 (с, 3H), 3,50 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,66 (м, 2H), 1,13-1,29 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 69
Получение (1R,2R)-1-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
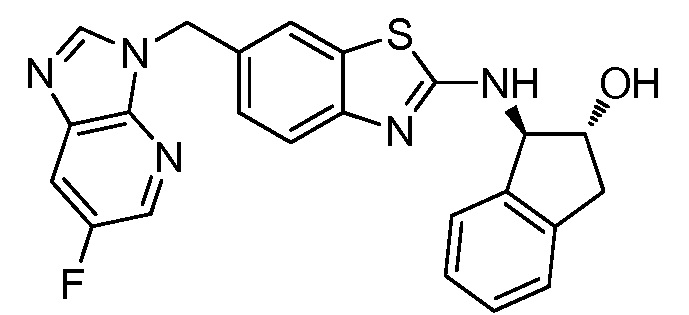
Перемешиваемую смесь 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (120 мг, 0,346 ммоль), полученного на стадии 4 примера 70, (1R,2R)-(-)-транс-1-амино-2-инданола (103 мг, 0,692 ммоль) и DIEA (89 мг, 0,692 ммоль) в безводном DMA (2,5 мл) нагревали в микроволновом реакторе Biotage при 150°C в течение 30 мин. Анализ методом LCMS обнаруживал незавершение реакции. Допонительно добавляли (1R,2R)-(-)-транс-1-амино-2-инданол (103 мг, 0,692 ммоль) и DIEA (89 мг, 0,692 ммоль), и дополнительно нагревали смесь в микроволновом реакторе Biotage при 150°C в течение 2 ч. После охлаждения реакционной смеси до к.т. ее сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (24 мг, 16%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,40-8,50 (м, 2H), 8,09 (дд, J=2,6, 9,4 Гц, 1H), 7,73 (д, J=1,1 Гц, 1H), 7,32-7,39 (м, 1H), 7,10-7,31 (м, 5H), 5,47-6,00 (м, 3H), 5,18 (т, J=7,1 Гц, 1H), 4,30 (д, J=3,6 Гц, 1H), 3,16 (дд, J=7,0, 15,6 Гц, 1H), 2,74 (дд, J=7,1, 15,5 Гц, 1H). ЖХМС (ИЭР) m/z 432 (M+H)+.
Пример 70
Получение (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
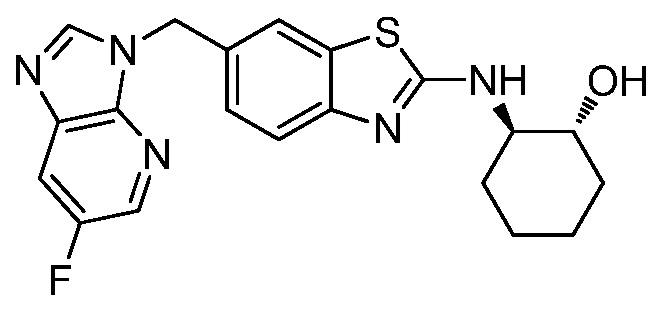
Стадия 1: К перемешиваемой смеси 2-амино-5-фтор-3-нитропиридина (2,46 г, 15,66 ммоль) в смеси ледяной HOAc (10 мл) и MeOH (20 мл) при 0°C порциями добавляли цинковую пыль (5,09 г, 78,3 ммоль), и оставляли смесь медленно нагреваться до к.т. После перемешивания при к.т. в течение 15 ч смесь фильтровали через целит, и концентрировали фильтрат в условиях пониженного давления. Остаток распределяли между EtOAc и насыщенным водн. NaHCO3. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 5-фторпиридин-2,3-диамина (1,13 г) в виде твердого вещества, которое дополнительно не очищали. ЖХМС (ИЭР) m/z 128 (M+H)+.
Стадия 2: Перемешиваемую смесь 5-фторпиридин-2,3-диамина (1,13 г), полученного на стадии 1 этого примера, муравьиной кислоты (0,5 мл) и триэтилортоформиата (15 мл) нагревали при 100°C в течение 1 ч. Реакционную смесь охлаждали до к.т., фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→10% MeOH в DCM, с получением 6-фтор-3H-имидазо[4,5-b]пиридина (760 мг, 36% в два этапа) в виде желтого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,09 (шир. с, 1H), 8,49 (с, 1H), 8,37 (с, 1H), 7,97 (д, J=7,9 Гц, 1H). ЖХМС (ИЭР) m/z 138 (M+H)+.
Стадия 3: К перемешиваемому раствору 6-фтор-3H-имидазо[4,5-b]пиридина (325 мг, 2,37 ммоль), полученного на стадии 2 этого примера, в безводном DMF (10 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 100 мг, 2,49 ммоль), и перемешивали смесь при 0°C в течение 30 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (600 мг, 2,61 ммоль), полученного на стадии 4 примера 36, в DMF (2 мл). Смесь оставляли нагреваться до к.т., а затем перемешивали еще в течение 15 ч. К реакционной смеси добавляли воду (250 мл), и экстрагировали смесь DCM (3×100 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM, а затем 1% MeOH в DCM, с получением 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (356 мг, 45%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,73 (с, 1H), 8,41 (т, J=2,0 Гц, 1H), 8,10 (дд, J=2,6, 9,4 Гц, 1H), 7,99 (с, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,46 (дд, J=1,3, 8,3 Гц, 1H), 5,62 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 331 (M+H)+.
Стадия 4: К перемешиваемому раствору 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (350 мг, 1,06 ммоль), полученного на стадии 3 этого примера, в DCM (15 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (287 мг, 1,17 ммоль), оставляли смесь нагреваться до к.т. и перемешивали еще в течение 2 ч. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением твердого вещества. Твердое вещество растирали с Et2O, фильтровали, а затем сушили с получением 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (336 мг, 92%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,76 (с, 1H), 8,41 (шир. с, 1H), 8,22 (с, 1H), 8,04-8,15 (м, 2H), 7,63 (д, J=8,3 Гц, 1H), 5,70 (с, 2H), 3,06 (с, 3H). ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (90 мг, 0,260 ммоль), полученного на стадии 4 этого примера, (1R,2R)-(-)-2-аминоциклогексанола (120 мг, 1,03 ммоль) и DIEA (133 мг, 1,03 ммоль) в безводном DMA (3 мл) нагревали при 125°C в течение 15 ч. После охлаждения реакционной смеси до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (41 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,42 (с, 1H), 8,08 (дд, J=2,4, 9,4 Гц, 1H), 7,98 (д, J=7,5 Гц, 1H), 7,66 (с, 1H), 7,17-7,33 (м, 2H), 5,48 (с, 2H), 4,76 (шир. с, 1H), 3,45-3,55 (м, 2H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,10-1,33 (м, 4H). ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 71
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-c]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
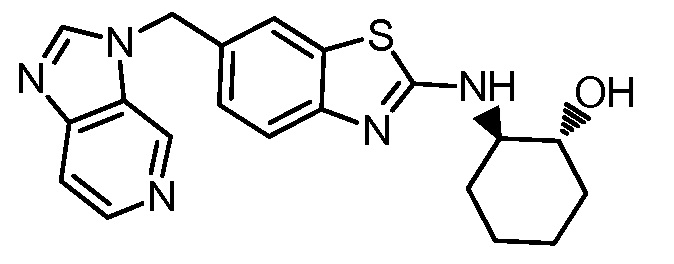
Стадия 1: 6-((3H-Имидазо[4,5-c]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол (162 мг, 21%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 3, заменяя 3H-имидазо[4,5-b]пиридин, использованный в примере 3, 1H-имидазо[4,5-c]пиридином. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, MeOH-d4) δ 8,82 (д, J=0,8 Гц, 1H), 8,62 (с, 1H), 8,37 (д, J=5,8 Гц, 1H), 7,92 (д, J=1,1 Гц, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,75 (дд, J=0,8, 5,7 Гц, 1H), 7,46 (дд, J=1,7, 8,3 Гц, 1H), 5,74 (с, 2H), 2,79 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((3H-Имидазо[4,5-c]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (30 мг, 15% в два этапа) получали в виде желтого порошка с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем методик, аналогичных описанным на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-((3H-имидазо[4,5-c]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 1 этого примера, и заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, продуктом этой реакции. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,94 (с, 1H), 8,63 (с, 1H), 8,30 (д, J=5,7 Гц, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,74 (с, 1H), 7,65 (д, J=5,1 Гц, 1H), 7,18-7,36 (м, 2H), 5,56 (с, 2H), 4,76 (шир. с, 1H), 3,53 (д, J=14,5 Гц, 2H), 2,02 (д, J=10,2 Гц, 1H), 1,86 (с, 1H), 1,61 (шир. с, 2H), 1,03-1,37 (м, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 72
Получение (1R,2R)-2-((6-((1H-имидазо[4,5-c]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
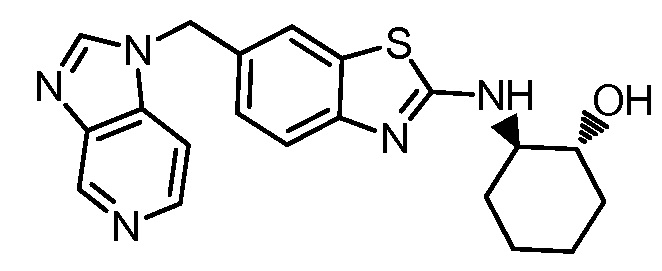
Стадия 1: 6-((1H-Имидазо[4,5-c]пиридин-1-ил)метил)-2-(метилтио)бензо[d]тиазол (206 мг, 26%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 3, заменяя 3H-имидазо[4,5-b]пиридин, использованный в примере 3, 1H-имидазо[4,5-c]пиридином. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, MeOH-d4) δ 8,95 (с, 1H), 8,53 (с, 1H), 8,31 (д, J=5,8 Гц, 1H), 7,84 (с, 1H), 7,77 (д, J=8,3 Гц, 1H), 7,59 (д, J=5,3 Гц, 1H), 7,41 (дд, J=1,4, 8,4 Гц, 1H), 5,65 (с, 2H), 2,76 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((1H-Имидазо[4,5-c]пиридин-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (85 мг, 42% в два этапа) получали в виде желтого порошка с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем методик, аналогичных описанным на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-((1H-имидазо[4,5-c]пиридин-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 1 этого примера, и заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, продуктом этой реакции. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,95 (шир. с, 1H), 8,56 (с, 1H), 8,31 (д, J=4,9 Гц, 1H), 8,00 (д, J=7,2 Гц, 1H), 7,69 (д, J=1,1 Гц, 1H), 7,64 (д, J=5,5 Гц, 1H), 7,26-7,37 (м, 1H), 7,11-7,26 (м, 1H), 5,51 (с, 2H), 4,74 (шир. с, 1H), 3,34 (д, J=4,1 Гц, 2H), 2,02 (д, J=10,2 Гц, 1H), 1,86 (шир. с, 1H), 1,60 (д, J=4,0 Гц, 2H), 0,90-1,37 (м, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 73
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона
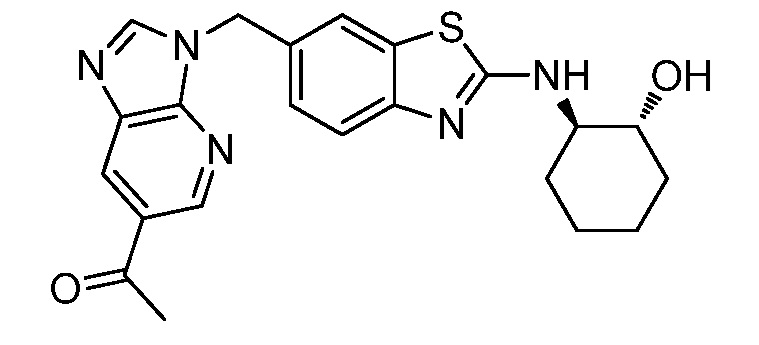
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (50 мг, 0,109 ммоль), полученного в примере 29, трибутил(1-этоксивинил)олова (79 мг, 0,218 ммоль) и TEA (22 мг, 0,218 ммоль) в безводном DMF (1 мл) при к.т. продували струей аргона в течение 15 мин. К полученной смеси добавляли тетракис(трифенилфосфин)палладий(0) (19 мг, 0,0165 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 110°C в течение 1,5 ч. После охлаждения до к.т. добавляли 2 M водн. HCl (500 мкл), и перемешивали смесь в течение 1 ч. Реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона (8 мг, 17%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,00 (д, J=1,5 Гц, 1H), 8,76 (с, 1H), 8,64 (с, 1H), 7,99 (д, J=7,5 Гц, 1H), 7,68 (с, 1H), 7,20-7,32 (м, 2H), 5,53 (с, 2H), 4,76 (шир. с, 1H), 3,50 (м, 1H), 3,30 (м, 1H), 2,68 (с, 3H), 2,04 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 422 (M+H)+.
Пример 74
Получение (1R,2R)-2-((6-((6-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
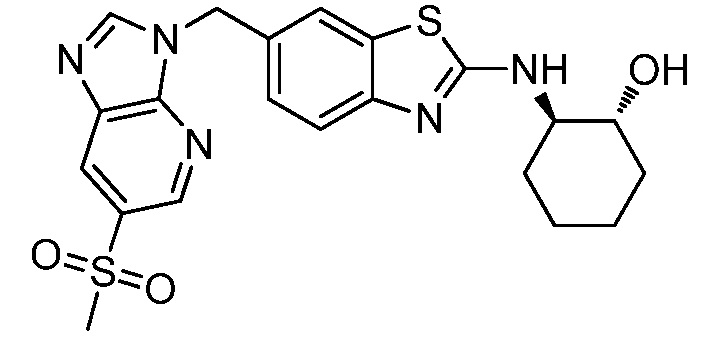
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,218 ммоль), полученного в примере 29, метансульфината натрия (90 мг, 0,436 ммоль) и асимметрического N,N-диметилэтилендиамина (6 мг, 0,066 ммоль) в безводном DMSO (1 мл) при к.т. продували струей аргона в течение 15 мин. К полученной смеси добавляли комплекс трифторметансульфоната меди(I) и бензола (20 мг, 0,0328 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 125°C в течение 5 ч. После охлаждения до к.т. реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (12 мг, 12%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,85-8,95 (шир. м, 2H), 8,61 (с, 1H), 8,02 (д, J=7,3 Гц, 1H), 7,69 (с, 1H), 7,18-7,35 (м, 2H), 5,56 (с, 2H), 4,79 (шир. с, 1H), 3,25-3,60 (м, 5H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,70 (м, 2H), 1,08-1,36 (м, 4H). ЖХМС (ИЭР) m/z 458 (M+H)+.
Пример 75
Получение 1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексанола
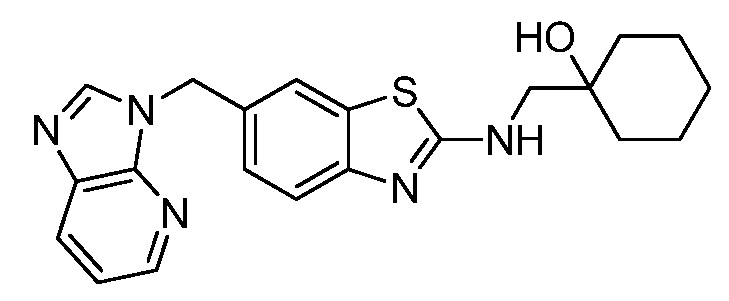
Стадия 1: К перемешиваемому раствору циангидрина циклогексанона (2 г, 15,98 ммоль) в безводном THF (40 мл) при к.т. добавляли порциями LiAlH4 (1,82 г, 47,94 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при 80°C в течение 5 ч. Смесь охлаждали до 0°C, и последовательно добавляли воду (1 мл), 1M водн. NaOH (1 мл) и воду (3 мл). К полученной смеси добавляли DCM и насыщенный водн. тартрат калия-натрия, и перемешивали смесь в течение 3 ч. Органический слой отделяли и дополнительно промывали солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 1-(аминометил)циклогексанола (1,3 г), который дополнительно не очищали. ЖХМС (ИЭР) m/z 130 (M+H)+.
Стадия 2: Смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола (4/1, 50 мг), полученную на стадии 2 примера 63, растворяли в безводном DMA (1,5 мл), а затем добавляли 1-(аминометил)циклогексанол (79 мг, 0,608 ммоль), полученный на стадии 1 этого примера, и DIEA (98 мг, 0,760 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 125°C в течение 15 ч. Анализ методом LCMS обнаруживал незавершение реакции. Добавляли дополнительные количества 1-(аминометил)циклогексанола (79 мг, 0,608 ммоль), полученного на стадии 1 этого примера, и DIEA (98 мг, 0,760 ммоль), и перемешивали смесь при 125°C еще в течение 5 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексанола (10 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,38 (дд, J=1,1, 4,7 Гц, 1H), 8,09 (дд, J=1,2, 8,0 Гц, 1H), 7,96 (т, J=5,6 Гц, 1H), 7,67 (с, 1H), 7,19-7,33 (м, 3H), 5,48 (с, 2H), 4,42 (шир. с, 1H), 1,12-1,62 (м, 12H). ЖХМС (ИЭР) m/z 394 (M+H)+.
Пример 76
Получение (1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексил)метанола
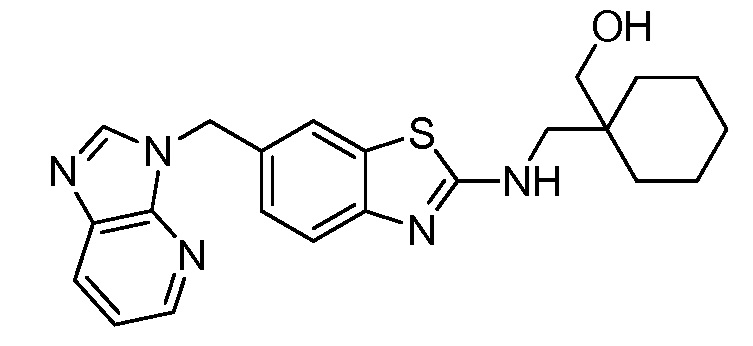
Стадия 1: К перемешиваемому раствору метил-1-цианциклогексанкарбоксилата (2 г, 11,96 ммоль) в безводном THF (40 мл) при к.т. порциями добавляли LiAlH4 (1,36 г, 35,88 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при 80°C в течение 5 ч. Смесь охлаждали до 0°C, и последовательно добавляли воду (1 мл), 1M водн. NaOH (1 мл) и воду (3 мл). К полученной смеси добавляли DCM и насыщенный водн. тартрат калия-натрия, и перемешивали смесь в течение 3 ч. Органический слой отделяли и дополнительно промывали солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением (1-(аминометил)циклогексил)метанола (1 г), который дополнительно не очищали. ЖХМС (ИЭР) m/z 144 (M+H)+.
Стадия 2: Смесь 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола и 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфонил)бензо[d]тиазола (4/1, 80 мг), полученную на стадии 2 примера 63, растворяли в безводном DMA (2 мл), и добавляли (1-(аминометил)циклогексил)метанол (175 мг, 1,22 ммоль), полученный на стадии 1 этого примера, и DIEA (157 мг, 1,22 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 125°C в течение 15 ч. После охлаждения до к.т. смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 1-(((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)метил)циклогексанола (22 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,38 (дд, J=1,1, 4,7 Гц, 1H), 8,09 (дд, J=1,3, 7,9 Гц, 1H), 7,99 (т, J=5,7 Гц, 1H), 7,68 (с, 1H), 7,20-7,33 (м, 3H), 5,49 (с, 2H), 3,33 (д, J=5,8 Гц, 2H), 3,21 (с, 1H), 1,21-1,49 (м, 12H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Пример 77
Получение (1R,2R)-2-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
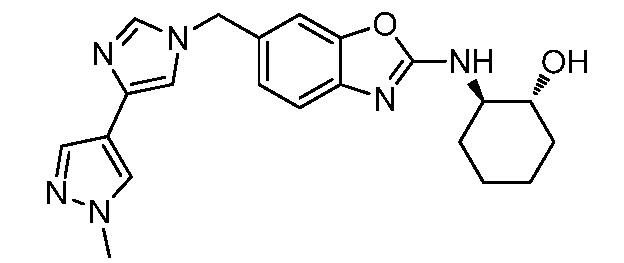
Стадия 1: 6-((4-Бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазол синтезировали в виде масла (241 мг, 79%) с использованием методики, аналогичной описанной на стадии 5 примера 36, заменяя 6-(хлорметил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, смесью (9/1) (2-(метилтио)бензо[d]оксазол-6-ил)метилметансульфоната и 6-(хлорметил)-2-(метилтио)бензо[d]оксазолом, полученной на стадии 1 примера 34. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,81 (д, J=1,3 Гц, 1H), 7,65 (м, 2H), 7,41 (д, J=1,3 Гц, 1H), 7,32 (дд, J=1,3, 8,1 Гц, 1H), 5,27 (с, 2H), 2,76 (с, 3H). ЖХМС (ИЭР) m/z 324 и 326 (M+H)+.
Стадия 2: 6-((4-Бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазол синтезировали в виде белой пены (443 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазолом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 340 и 342 (M+H)+.
Стадия 3: (1R,2R)-2-((6-((4-Бром-1H-имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанол синтезировали в виде оранжевого твердого вещества (280 мг, 96%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазолом, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 392 и 394 (M+H)+.
Стадия 4: (1R,2R)-2-((6-((4-(1-Метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (27 мг, 10%) с использованием методики, аналогичной описанной на стадии 8 примера 36, заменяя (1R,2R)-2-((6-((4-бром-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 36, (1R,2R)-2-((6-((4-бром-1H-имидазол-1- ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанолом, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,78-7,86 (м, 2H), 7,75 (с, 1H), 7,57 (с, 1H), 7,32 (с, 1H), 7,26 (с, 1H), 7,17 (м, 1H), 7,09 (м, 1H), 5,15 (с, 2H), 4,71 (д, J=4,3 Гц, 1H), 3,80 (с, 3H), 3,27-3,42 (м, 2H), 1,81-2,03 (м, 2H), 1,55-1,70 (м, 2H), 1,10-1,34 (м, 4H). ЖХМС (ИЭР) m/z 393 (M+H)+.
Пример 78
Получение (1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
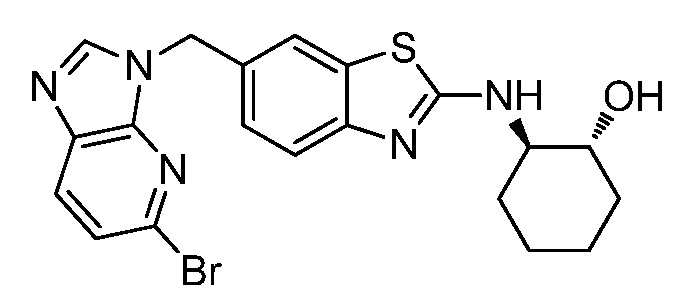
Стадия 1: К перемешиваемой смеси 6-бром-3-нитро-2-пиридинамина (2,5 г, 11,47 ммоль) в смеси ледяной HOAc (10 мл), MeOH (10 мл) и EtOH (10 мл) при 0°C порциями добавляли цинковую пыль (3,73 г, 57,35 ммоль). Смесь перемешивали при к.т. в течение 15 ч. Смесь фильтровали через целит, и концентрировали фильтрат в условиях пониженного давления. Остаток распределяли между насыщенным водн. NaHCO3 и EtOAc. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством EtOAc. Объединенные органические слои промывали солевым раствором, разделяли и сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-бромпиридин-2,3-диамина (1,30 г, 60%) в виде твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 6,61 (д, J=7,7 Гц, 1H), 6,47 (д, J=7,7 Гц, 1H), 5,82 (с, 2H), 4,79 (с, 2H). ЖХМС (ИЭР) m/z 188 и 190 (M+H)+.
Стадия 2: Перемешиваемую смесь 6-бромпиридин-2,3-диамина (1,30 г, 6,91 ммоль), полученного на стадии 1 этого примера, муравьиной кислоты (0,7 мл) и триэтилортоформиата (28 мл) нагревали при 100°C в течение 1,5 ч. После охлаждения реакционной смеси до к.т. смесь концентрировали в условиях пониженного давления. Остаток растирали с 5% MeOH в DCM. Твердое вещество собирали путем фильтрования и сушили с получением 5-бром-3H-имидазо[4,5-b]пиридина (245 мг, 18%) в виде рыжеватого твердого вещества, которое не требовало дополнительной очистки. Фильтрат концентрировали в условиях пониженного давления, и очищали остаток методом флэш-хроматографии на силикагеле (элюируя 100% DCM→10% MeOH в DCM) с получением доплнительного количества 5-бром-3H-имидазо[4,5-b]пиридина (756 мг, 55%) в виде рыжеватого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 13,08 (шир. с, 1H), 8,50 (с, 1H), 8,00 (д, J=8,3 Гц, 1H), 7,43 (д, J=8,3 Гц, 1H). ЖХМС (ИЭР) m/z 198 и 200 (M+H)+.
Стадия 3: К перемешиваемому раствору 5-бром-3H-имидазо[4,5-b]пиридина (1 г, 5,05 ммоль), полученного на стадии 2 этого примера, в безводном DMF (25 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 222 мг, 5,56 ммоль), и перемешивали смесь при 0°C в течение 30 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (1,39 г, 6,06 ммоль), полученного на стадии 4 примера 36, в DMF (5 мл). Смесь оставляли нагреваться до к.т. и перемешивали еще в течение 15 ч. К реакционной смеси добавляли воду (300 мл), и экстрагировали смесь EtOAc (3×50 мл). Объединенные органические слои промывали водой, а затем солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM, а затем 1% MeOH в DCM, с получением 6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (1,02 г, 52%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,09 (д, J=8,3 Гц, 1H), 7,96 (д, J=0,9 Гц, 1H), 7,83 (д, J=8,3 Гц, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,43 (дд, J=1,5, 8,3 Гц, 1H), 5,60 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 391 и 393 (M+H)+.
Стадия 4: К перемешиваемому раствору 6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (1,02 г, 2,61 ммоль), полученного на стадии 3 этого примера, в DCM (50 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (707 мг, 2,87 ммоль), смесь оставляли нагреваться до к.т. и перемешивали еще в течение 45 мин. К смеси добавляли насыщенный водн. NaHCO3, и отделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением 6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,06 г, 100%) в виде кремового твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,18 (с, 1H), 8,08-8,12 (м, 2H), 7,61 (м, 1H), 7,50 (д, J=9 Гц, 1H), 5,68 (с, 2H), 3,07 (с, 3H); ЖХМС (ИЭР) m/z 407 и 409 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (50 мг, 0,123 ммоль), полученного на стадии 4 этого примера, (1R,2R)-(-)-2-аминоциклогексанола (42 мг, 0,369 ммоль) и DIEA (46 мг, 0,369 ммоль) в безводном DMA (1 мл) нагревали в герметизированном сосуде при 100°C в течение 15 ч. Реакционную смесь оставляли охлаждаться до к.т., а затем сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (12 мг, 21%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 7,98-8,10 (м, 2H), 7,64 (д, J=1,1 Гц, 1H), 7,48 (д, J=8,5 Гц, 1H), 7,31 (м, 1H), 7,18 (дд, J=1,6, 8,2 Гц, 1H), 5,46 (с, 2H), 4,79 (шир. с, 1H), 3,50 (м, 1H), 3,30 (м, 1H), 2,04 (м, 1H), 1,87 (м, 1H), 1,65-1,67 (м, 2H), 1,12-1,34 (м, 4H). ЖХМС (ИЭР) m/z 458 и 460 (M+H)+.
Пример 79
Получение метил-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата
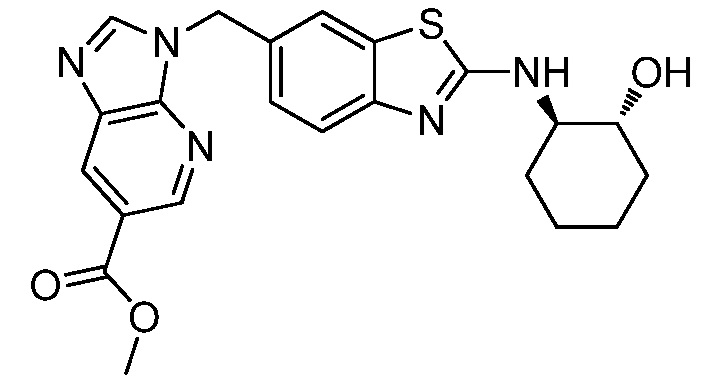
Стадия 1: К перемешиваемой смеси метил-6-амино-5-нитроникотината (2 г, 10,15 ммоль) в смеси THF (30 мл) и MeOH (10 мл) при к.т. добавляли палладий (10 масс.% на активированном угле, 100 мг), и перемешивали смесь в атмосфере водорода (1 атм) в течение 15 ч. Смесь фильтровали через целит, и концентрировали фильтрат в условиях пониженного давления с получением метил-5,6-диаминоникотината (1,69 г, 100%) в виде желтого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,94 (д, J=2,1 Гц, 1H), 7,16 (д, J=2,1 Гц, 1H), 6,27 (шир. с, 2H), 4,92 (шир. с, 2H), 3,74 (с, 3H). ЖХМС (ИЭР) m/z 168 (M+H)+.
Стадия 2: Перемешиваемую смесь метил-5,6-диаминоникотината (1,69 г, 10,12 ммоль), полученного на стадии 1 этого примера, муравьиной кислоты (0,5 мл) и триэтилортоформиата (25 мл) нагревали при 90°C в течение 2,5 ч. Реакционную смесь охлаждали до к.т., затем выпавшее в осадок твердое вещество собирали путем фильтрования и сушили с получением метил-3H-имидазо[4,5-b]пиридин-6-карбоксилата (588 мг, 33%) в виде кремового твердого вещества, которое не требовало дополнительной очистки. Фильтрат концентрировали в условиях пониженного давления, и очищали остаток методом флэш-хроматографии на силикагеле, элюируя 100% DCM→10% MeOH в DCM, с получением дополнительного количества метил-3H-имидазо[4,5-b]пиридин-6-карбоксилата (550 мг, 31%) в виде кремового твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 13,33 (шир. с, 1H), 8,95 (д, J=1,5 Гц, 1H), 8,64 (с, 1H), 8,50 (д, J=1,5 Гц, 1H), 3,91 (с, 3H). ЖХМС (ИЭР) m/z 178 (M+H)+.
Стадия 3: К перемешиваемому раствору метил-3H-имидазо[4,5-b]пиридин-6-карбоксилата (1,34 г, 7,56 ммоль), полученного на стадии 2 этого примера, в безводном DMF (25 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 333 мг, 8,32 ммоль), и перемешивали смесь при 0°C в течение 30 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (1,3 г, 5,66 ммоль), полученного на стадии 4 примера 36, в DMF (5 мл). Смесь оставляли нагреваться до к.т., а затем перемешивали еще в течение 15 ч. К реакционной смеси добавляли воду (300 мл), и экстрагировали смесь EtOAc (3×50 мл). Объединенные органические слои промывали водой, а затем солевым раствором, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM, а затем 1% MeOH в DCM, с получением метил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (1,3 г, 46%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,95 (д, J=1,9 Гц, 1H), 8,81 (с, 1H), 8,56 (д, J=1,7 Гц, 1H), 8,00 (д, J=1,1 Гц, 1H), 7,80 (д, J=8,5 Гц, 1H), 7,47 (дд, J=1,6, 8,4 Гц, 1H), 5,66 (с, 2H), 3,90 (с, 3H), 2,76 (с, 3H). ЖХМС (ИЭР) m/z 371 (M+H)+.
Стадия 4: К перемешиваемому раствору метил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (300 мг, 0,811 ммоль), полученного на стадии 3 этого примера, в DCM (10 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (154 мг, 0,892 ммоль), смесь оставляли нагреваться до к.т. и перемешивали еще в течение 4 ч. К смеси добавляли насыщенный водн. NaHCO3, и разделяли органический слой. Водный слой экстрагировали DCM, и промывали объединенные органические слои насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 370 мг смеси (2/1) метил-3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата и метил-3-((2-(метилсульфонил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата в виде масла, которое дополнительно не очищали. LCMS (ESI) m/z 387 (M+H)+ (соответствует метил-3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилату) и m/z 403 (M+H)+ (соответствует метил-3-((2-(метилсульфонил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилату).
Стадия 5: Смесь метил-3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата и метил-3-((2-(метилсульфонил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5- b]пиридин-6-карбоксилата (2/1, 360 мг), полученную на стадии 4 этого примера, растворяли в безводном DMA (10 мл), и добавляли (1R,2R)-(-)-2-аминоциклогексанол (322 мг, 2,79 ммоль) и DIEA (360 мг, 2,79 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при перемешивании при 100°C в течение 19 ч. Анализ методом LCMS обнаруживал незавершение реакции. К реакционной смеси добавляли дополнительное количество (1R,2R)-(-)-2-аминоциклогексанола (100 мг, 0,870 ммоль), реакционный сосуд герметизировали, и нагревали смесь при 100°C еще в течение 15 ч. После охлаждения реакционной смеси до к.т. половину реакционной смеси сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением метил-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (19 мг) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,96 (д, J=7,3 Гц, 1H), 8,76 (м, 1H), 8,54 (м, 1H), 7,99 (шир. с, 1H), 7,66 (д, J=7,2 Гц, 1H), 7,16-7,33 (м, 2H), 5,51 (шир. с, 2H), 4,76 (шир. с, 1H), 3,89 (с, 3H), 3,30-3,50 (м, 2H), 2,02 (м, 1H), 1,86 (м, 1H), 1,50-1,70 (м, 2H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 438 (M+H)+.
Пример 80
Получение (1R,2R)-1-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
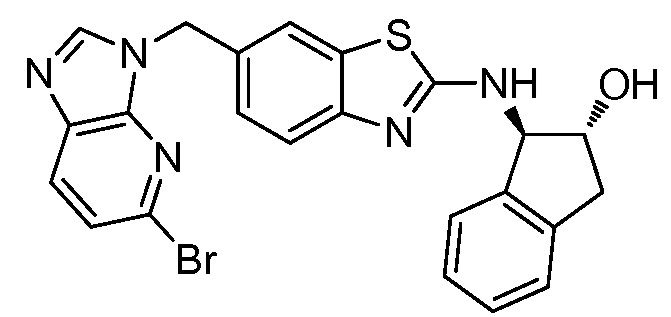
Перемешиваемую смесь 6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (130 мг, 0,332 ммоль), полученного на стадии 4 примера 78, (1R,2R)-(-)-транс-1-амино-2-инданола (198 мг, 1,33 ммоль) и DIEA (214 мг, 1,66 ммоль) в безводном DMA (2 мл) в герметизированном реакционном сосуде нагревали в микроволновом реакторе Biotage при 140°C в течение 1,5 ч. Анализ методом LCMS обнаруживал незавершение реакции. Добавляли дополнительное количество (1R,2R)-(-)-транс-1-амино-2-инданола (50 мг, 0,335 ммоль), и нагревали смесь в микроволновом реакторе Biotage при 140°C еще в течение 45 мин. Реакционную смесь охлаждали до к.т. и сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-1-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (24 мг, 15%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,47 (д, J=7,9 Гц, 1H), 8,08 (д, J=8,3 Гц, 1H), 7,69 (с, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,37 (д, J=8,3 Гц, 1H), 7,11-7,28 (м, 5H), 5,45-5,54 (м, 3H), 5,18 (т, J=7,1 Гц, 1H), 4,24-4,35 (м, 1H), 3,16 (дд, J=6,9, 15,5 Гц, 1H), 2,74 (дд, J=7,1, 15,5 Гц, 1H). ЖХМС (ИЭР) m/z 492 и 494 (M+H)+.
Пример 81
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты
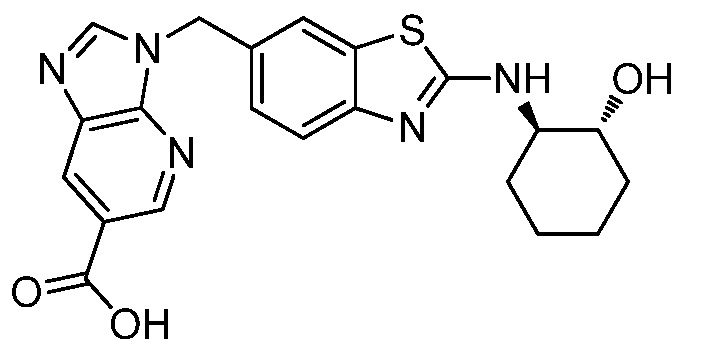
Смесь метил-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (210 мг, 0,48 ммоль), полученного в примере 79, в THF (5 мл) и 1 M водн. LiOH (5 мл) перемешивали при к.т. в течение 3 ч. Реакционную смесь подкисляли до pH~1,0 добавлением 2 M водн. HCl, и сразу очищали смесь методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты (37 мг, 18%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 13,15 (шир. с, 1H), 8,96 (д, J=1,7 Гц, 1H), 8,74 (с, 1H), 8,52 (д, J=1,9 Гц, 1H), 7,98 (д, J=7,3 Гц, 1H), 7,67 (д, J=1,1 Гц, 1H), 7,19-7,33 (м, 2H), 5,53 (с, 2H), 4,75 (шир. с, 1H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,68 (м, 2H), 1,09-1,35 (м, 4H). ЖХМС (ИЭР) m/z 424 (M+H)+.
Пример 82
Получение (1R,2R)-2-((6-((6-(морфолинометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
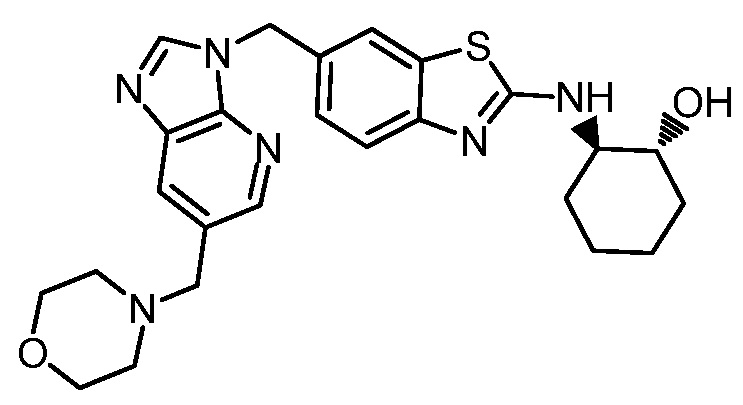
Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,22 ммоль), полученного в примере 29, (морфолин-4-ил)метилтрифторбората калия (59 мг, 0,28 ммоль), Pd(OAc)2 (1,5 мг, 0,007 ммоль), 2-дициклофенилфосфино-2′,4′,6′-триизопропилбифенила (6,2 мг, 0,013 ммоль) и Cs2CO3 (213 мг, 0,66 ммоль) в THF/H2O (1,5 мл, 4/1, об./об.) продували аргоном в течение 10 мин. Смесь затем нагревали при 85°C в герметизированном реакционном сосуде в течение ночи. Анализ методом LCMS обнаруживал завершение реакции. После охлаждения до к.т. реакционную смесь фильтровали через слой целита, и очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(морфолинометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде белого порошка (36 мг, 35%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,57 (с, 1H), 8,31 (д, J=1,5 Гц, 1H), 7,88-8,04 (м, 2H), 7,67 (д, J=0,9 Гц, 1H), 7,26-7,33 (м, 1H), 7,17-7,26 (м, 1H), 5,46 (с, 2H), 4,75 (шир. с, 1H), 3,60 (с, 2H), 3,45-3,58 (м, 5H), 2,36 (шир. с, 4H), 2,03 (д, J=10,4 Гц, 1H), 1,79-1,89 (м, 1H), 1,62 (д, J=5,1 Гц, 2H), 1,05-1,37 (м, 4H). ЖХМС (ИЭР) m/z 479 (M+H)+.
Пример 83
Получение либо (1R,2R)-1-((6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола, либо (1R,2R)-1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (альтернатива продукту примера 32)
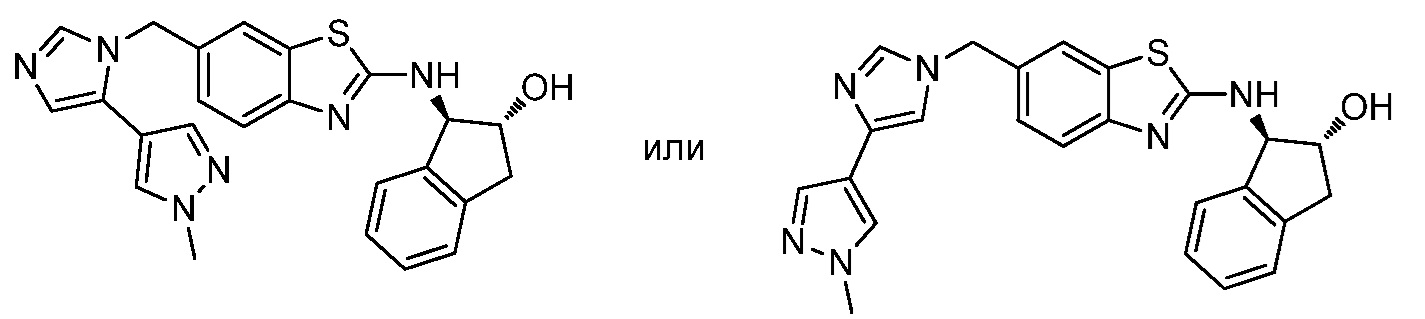
Стадия 1: 6-((5-(1-Метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол или 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (140 мг) с использованием методики, аналогичной описанной на стадии 5 примера 32, заменяя региоизомер 1, использованный в примере 32, региоизомером 2, полученным на стадии 4 примера 32 (либо 6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, либо 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол). ЖХМС (ИЭР) m/z 356 (M+H)+.
Стадия 2: (1R,2R)-1-((6-((4-(1-Метил-1H-пиразол-4-ил)-1H- имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол или (1R,2R)-1-((6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ол (альтернатива исходному веществу на стадии 6 примера 32) синтезировали в виде белого порошка (10 мг, 8%) с использованием методики, аналогичной описанной на стадии 6 примера 32, заменяя 6-((5-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол или 6-((4-(1-метил-1H-пиразол-4-ил)-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 32, продуктом, полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,50 (д, J=7,9 Гц, 1H), 7,81 (с, 1H), 7,73 (д, J=0,9 Гц, 1H), 7,66 (с, 1H), 7,58 (с, 1H), 7,38 (д, J=8,3 Гц, 1H), 7,11-7,30 (м, 6H), 5,54 (м, 1H), 5,11-5,25 (м, 3H), 4,31 (м, 1H), 3,81 (с, 3H), 3,17 (м, 1H), 2,75 (м, 1H). ЖХМС (ИЭР) m/z 443 (M+H)+.
Пример 84
Получение (1R,2R)-2-((6-((6-(гидроксиметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
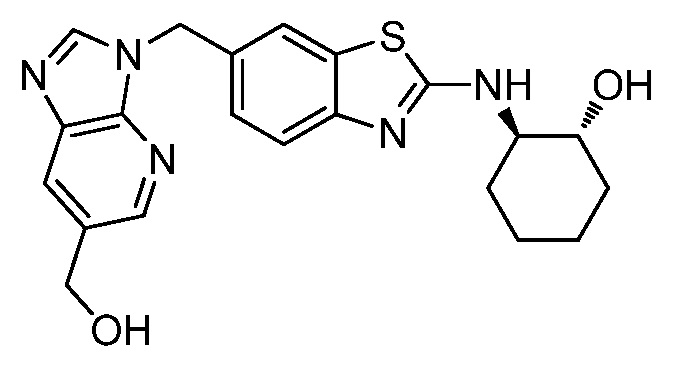
К перемешиваемой смеси метил-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (76 мг, 0,174 ммоль), полученного в примере 79, в безводном DCM (1 мл) при -50°C в атмосфере аргона по каплям добавляли диизобутилалюмогидрид (1 M раствор в DCM, 0,696 мкл, 696 ммоль). Смесь оставляли нагреваться до -20°C и перемешивали в течение 10 мин. Реакционную смесь подкисляли до pH~1,0 добавлением 2 M водн. HCl, и сразу очищали смесь методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(гидроксиметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (20 мг, 28%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,56 (с, 1H), 8,35 (д, J=1,3 Гц, 1H), 7,93-8,01 (м, 2H), 7,65 (с, 1H), 7,28 (м, 1H), 7,20 (м, 1H), 5,47 (с, 2H), 5,29 (шир. с, 1H), 4,75 (д, J=4,0 Гц, 1H), 4,62 (шир. с, 2H), 3,50 (м, 1H), 3,30 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,10-1,35 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 85
Получение (1R,2R)-2-((6-((6-(метилтио)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
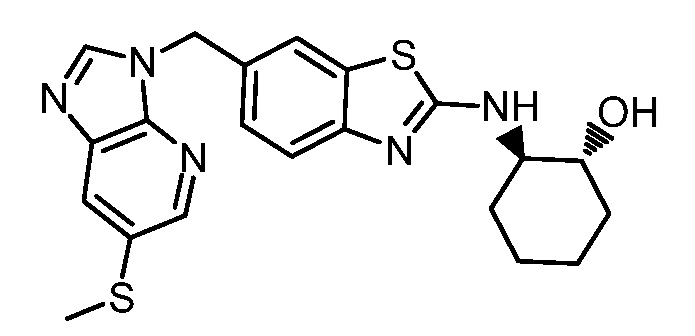
(1R,2R)-2-((6-((6-(Метилтио)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (25 мг, 18%) получали в виде рыжеватого порошка с использованием методики, аналогичной описанной в примере 82, заменяя (морфолин-4- ил)метилтрифторборат калия (тиометил)метилтрифторборатом калия, заменяя THF/H2O, использованные в примере 82, на диоксан/H2O, и осуществляя взаимодействие при 100°C вместо 85°C. 1H ЯМР (300 МГц, MeOH-d4) δ 8,37-8,50 (м, 2H), 8,07 (д, J=1,7 Гц, 1H), 7,64 (с, 1H), 7,34-7,40 (м, 1H), 7,25-7,34 (м, 1H), 5,53 (с, 2H), 3,58 (дд, J=3,4, 9,8 Гц, 1H), 3,39-3,51 (м, 1H), 2,56 (с, 3H), 2,10-2,24 (м, 1H), 2,03 (д, J=10,9 Гц, 1H), 1,64-1,85 (м, 2H), 1,13-1,51 (м, 4H). ЖХМС (ИЭР) m/z 426 (M+H)+.
Пример 86
Получение (1R,2R)-2-((6-((6-((метилтио)метил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
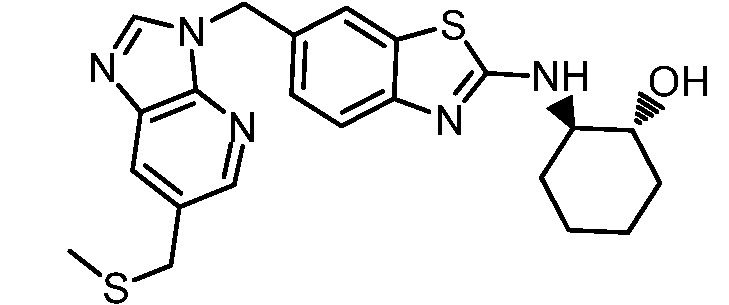
(1R,2R)-2-((6-((6-((метилтио)метил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (5 мг, 4%) получали в виде рыжеватого порошка с использованием методики, аналогичной описанной в примере 82, заменяя (морфолин-4-ил)метилтрифторборат калия, использованный в примере 82, (тиометил)метилтрифторборатом калия, заменяя THF/H2O, использованные в примере 82, на диоксан/H2O, и осуществляя взаимодействие при 100°C вместо 85°C. 1H ЯМР (300 МГц, MeOH-d4) δ 8,29 (с, 2H), 7,95 (шир. с, 1H), 7,52 (с, 1H), 7,22-7,30 (м, 1H), 7,13-7,22 (м, 1H), 5,43 (с, 2H), 3,76 (с, 2H), 3,47 (дд, J=3,4, 9,8 Гц, 1H), 3,27-3,40 (м, 1H), 2,04 (д, J=11,7 Гц, 1H), 1,93 (шир. с, 1H), 1,90 (с, 3H), 1,52-1,74 (м, 2H), 1,01-1,40 (м, 4H). ЖХМС (ИЭР) m/z 440 (M+H)+.
Пример 87
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-карбонитрила
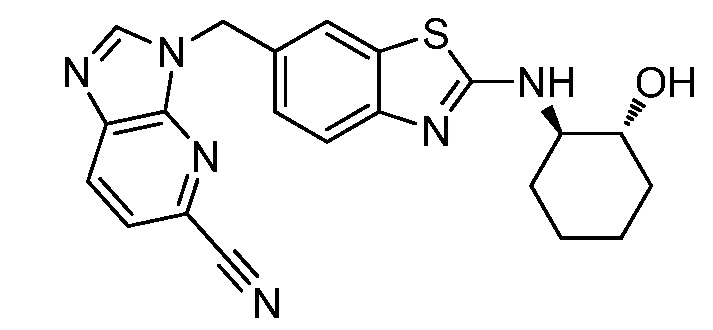
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,218 ммоль), полученного в примере 78, цианида цинка (77 мг, 0,654 ммоль) и 1,1’-бис(дифенилфосфино)ферроцена (18 мг, 0,0327 ммоль) в безводном DMF (2 мл) при к.т. продували струей аргона в течение 15 мин. К полученной смеси добавляли трис(дибензилиденацетон)дипалладий (18 мг, 0,0218 ммоль). Реакционный сосуд герметизировали, и перемешивали смесь при 100°C в течение 2 ч. После охлаждения до к.т. реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-карбонитрила (34 мг, 39%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,91 (с, 1H), 8,34 (д, J=8,3 Гц, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,92 (д, J=8,1 Гц, 1H), 7,67 (д, J=1,1 Гц, 1H), 7,32 (м, 1H), 7,22 (м, 1H), 5,53 (с, 2H), 4,77 (шир. с, 1H), 3,51 (м, 1H), 3,30 (м, 1H), 2,03 (м, 1H), 1,85 (м, 1H), 1,65-1,67 (м, 2H), 1,08-1,37 (м, 4H). ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 88
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-ил)этанона
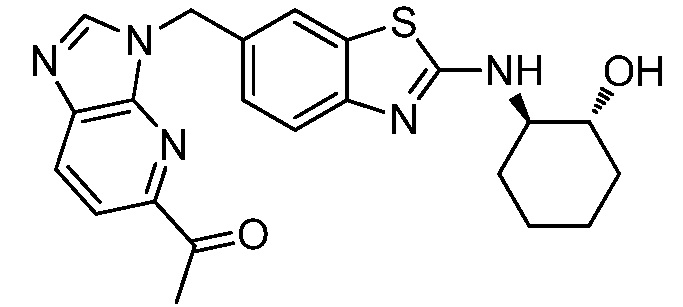
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,218 ммоль), полученного в примере 78, трибутил(1-этоксивинил)олова (157 мг, 0,436 ммоль) в безводном DMF (2 мл) при к.т. продували струей аргона в течение 15 мин. К полученной смеси добавляли тетракис(трифенилфосфин)палладий(0) (38 мг, 0,0327 ммоль). Реакционный сосуд герметизировали, и перемешивали смесь при 110°C в течение 2 ч. После охлаждения до к.т. добавляли 2 M водн. HCl (0,5 мл), и перемешивали смесь при к.т. в течение 1,5 ч. Смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением неочищенного 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5-ил)этанона. Неочищенный продукт растирали с Et2O, твердое вещество собирали путем фильтрования и сушили с получением 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H- имидазо[4,5-b]пиридин-5-ил)этанона (19 мг, 21%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,84 (с, 1H), 8,22 (д, J=8,5 Гц, 1H), 8,00 (д, J=7,5 Гц, 1H), 7,92 (д, J=8,3 Гц, 1H), 7,80 (с, 1H), 7,26-7,39 (м, 2H), 5,55 (с, 2H), 4,77 (д, J=4,9 Гц, 1H), 3,50 (м, 1H), 3,30 (м, 1H), 2,74 (с, 3H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,12-1,32 (м, 4H). ЖХМС (ИЭР) m/z 422 (M+H)+.
Пример 89
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-карбоксамида
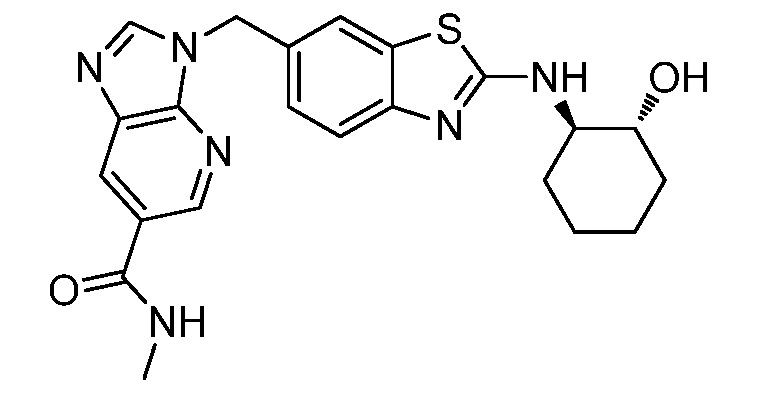
К перемешиваемой смеси 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты (70 мг, 0,165 ммоль), полученной в примере 81, и TEA (67 мг, 0,660 ммоль) в безводном THF (2,5 мл) при к.т. добавляли метиламин (2 M раствор в THF, 413 мкл, 0,825 ммоль), а затем гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (109 мг, 0,248 ммоль). Смесь перемешивали при к.т. в течение 4,5 ч. Смесь очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-карбоксамида (26 мг, 36%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,86 (д, J=1,88 Гц, 1H), 8,69 (с, 1H), 8,59 (д, J=4,52 Гц, 1H), 8,49 (д, J=1,88 Гц, 1H), 7,97 (д, J=7,54 Гц, 1H), 7,67 (д, J=1,13 Гц, 1H), 7,19-7,32 (м, 2H), 5,51 (с, 2H), 4,73 (шир. с, 1H), 3,51 (м, 1H), 3,30 (м, 1H), 2,82 (д, J=4,33 Гц, 3H), 2,02 (м, 1H), 1,88 (м, 1H), 1,55-1,65 (m 2H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 437 (M+H)+.
Пример 90
Получение N-гидрокси-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксимидамида
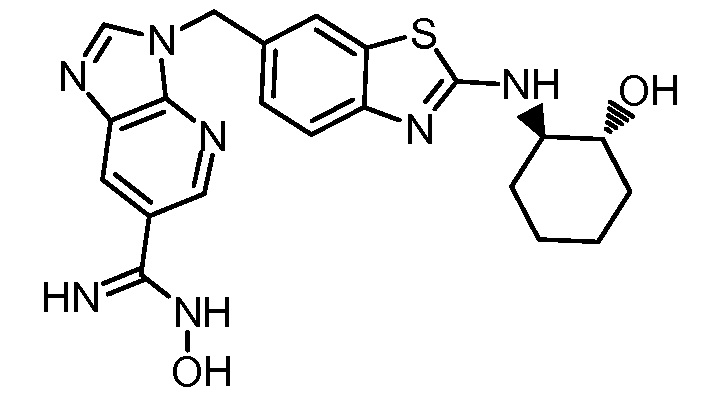
Перемешиваемую смесь 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила (55 мг, 0,14 ммоль), полученного в примере 43, и избытка 50% NH2OH в H2O (300 мкл) в EtOH (3 мл) нагревали при 80°C в течение 1 ч. Анализ методом LCMS обнаруживал завершение реакции. Неочищенный продукт очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением N-гидрокси-3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксимидамида (8 мг, 13%) в виде рыжеватого порошка. 1H ЯМР (300 МГц, MeOH-d4) δ 8,73 (д, J=1,7 Гц, 1H), 8,50 (с, 1H), 8,29 (д, J=1,7 Гц, 1H), 7,63 (с, 1H), 7,32-7,39 (м, 1H), 7,25-7,32 (м, 1H), 5,55 (с, 2H), 3,50-3,65 (м, 1H), 3,37-3,49 (м, 1H), 2,13 (д, J=12,1 Гц, 1H), 2,02 (д, J=10,4 Гц, 1H), 1,62-1,82 (м, 2H), 1,15-1,49 (м, 4H). ЖХМС (ИЭР) m/z 438 (M+H)+.
Пример 91
Получение (1R,2R)-2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолацетата
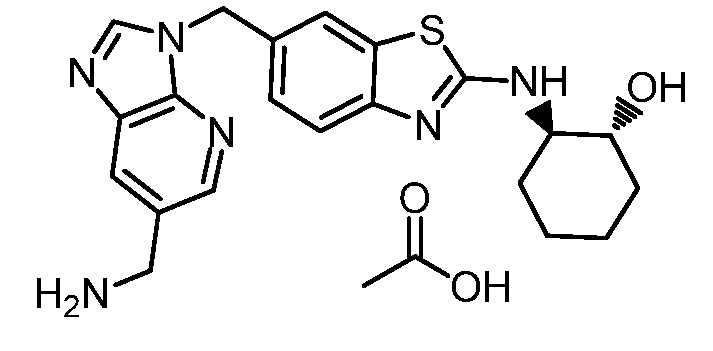
К перемешиваемой смеси 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила (85 мг, 0,21 ммоль), полученного в примере 43, в THF (3 мл) при 0°C по каплям добавляли LAH в диэтиловом эфире (2,0 M, 0,4 мл, 0,4 ммоль). Полученную смесь перемешивали при к.т. в течение 1 ч, после чего добавляли еще 0,4 мл 2,0 M LAH в диэтиловом эфире. После перемешивания при к.т. в течение ночи, реакционную смесь растирали при последовательом добавлении 61 мкл H2O, 61 мкл 10% NaOH и 183 мкл H2O. Полученную смесь фильтровали через слой целита и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолацетата (4 мг, 5%) в виде рыжеватого порошка. 1H ЯМР (300 МГц, MeOH-d4) δ 8,54 (д, J=9,2 Гц, 2H), 8,19 (с, 1H), 7,63 (с, 1H), 7,19-7,42 (м, 2H), 5,56 (с, 2H), 4,27 (с, 2H), 3,57 (д, J=9,6 Гц, 1H), 3,37-3,50 (м, 1H), 2,13 (д, J=11,3 Гц, 1H), 2,01 (шир. с, 1H), 1,92 (с, 3H), 1,62-1,81 (м, 2H), 1,17-1,49 (м, 4H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 92
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-карбоксамида
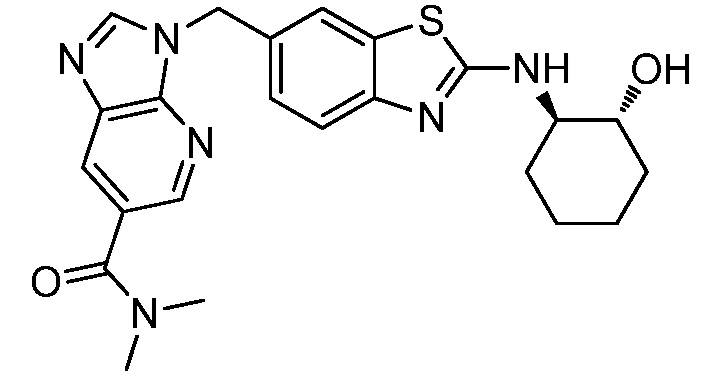
К перемешиваемой смеси 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты (65 мг, 0,153 ммоль), полученной в примере 81, and TEA (77 мг, 0,767 ммоль) в смеси безводного THF (1,5 мл) и безводного DMF (0,5 мл) при к.т. добавляли диметиламин (2 M раствор в MeOH, 383 мкл, 0,767 ммоль), а затем гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (102 мг, 0,230 ммоль). Полученную смесь перемешивали при к.т. в течение 2 ч. Смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-карбоксамида (33 мг, 48%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,45 (с, 1H), 8,16 (с, 1H), 7,96 (д, J=7,54 Гц, 1H), 7,68 (с, 1H), 7,20-7,33 (м, 2H), 5,50 (с, 2H), 4,73 (д, J=4,90 Гц, 1H), 3,51 (м, 1H), 3,30 (м, 1H), 2,99 (шир. с, 6H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 451 (M+H)+.
Пример 93
Получение (1R,2R)-2-((6-((6-(2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
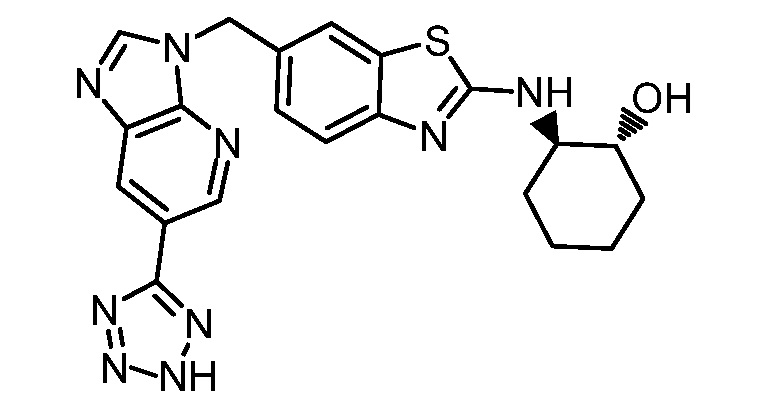
Перемешиваемую смесь 3-((2-(((1R,2R)-2- гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила (120 мг, 0,30 ммоль), полученного в примере 43, NaN3 (29 мг, 0,45 ммоль) и NH4Cl (24 мг, 0,45 ммоль) в DMF (1,5 мл) нагревали при 100°C в течение ночи. Анализ методом LCMS обнаруживал почти полное завершение реакции. Порцию реакционной смеси (~1/3) охлаждали до к.т. и очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (4 мг, 9%) в виде белого порошка. 1H ЯМР (300 МГц, MeOH-d4) δ 9,13 (с, 1H), 8,67 (с, 1H), 8,60 (с, 1H), 7,76 (дд, J=7,5, 10,9 Гц, 2H), 7,69 (с, 1H), 5,60 (с, 2H), 3,56 (д, J=9,6 Гц, 1H), 3,37-3,50 (м, 1H), 1,92-2,21 (м, 2H), 1,72 (д, J=8,9 Гц, 2H), 1,17-1,49 (м, 4H). ЖХМС (ИЭР) m/z 448 (M+H)+.
Пример 94
Получение (1R,2R)-2-((6-((6-(2-метил-2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
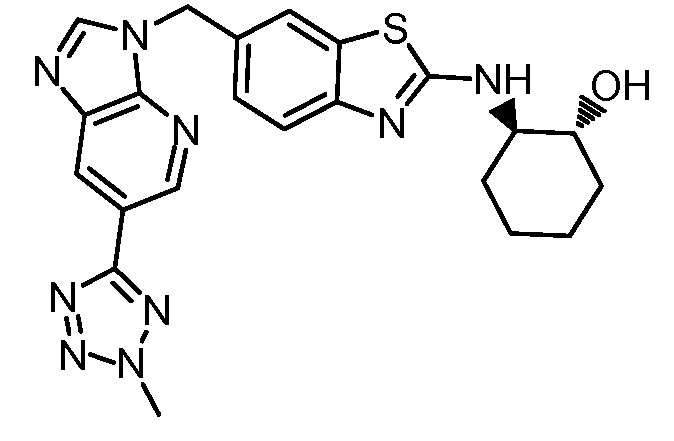
К оставшейся части реакционной смеси, полученной в примере 93, добавляли избыток Cs2CO3 (300 мг) и избыток MeI (200 мкл). Полученную смесь нагревали при 90°C в течение 4 ч. Анализ методом LCMS обнаруживал почти полное завершение реакции. После охлаждения до к.т. смесь очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(2-метил-2H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (8 мг) в виде белого порошка. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, MeOH-d4) δ 9,17 (с, 1H), 8,69 (с, 1H), 8,55 (с, 1H), 7,67 (с, 1H), 7,25-7,41 (м, 2H), 5,58 (с, 2H), 4,36-4,51 (м, 3H), 3,57 (д, J=9,6 Гц, 1H), 3,36-3,49 (м, 1H), 2,13 (д, J=11,3 Гц, 1H), 2,01 (шир. с, 1H), 1,71 (д, J=10,0 Гц, 2H), 1,12-1,48 (м, 4H). ЖХМС (ИЭР) m/z 462 (M+H)+.
Пример 95
Получение (1R,2R)-1-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола
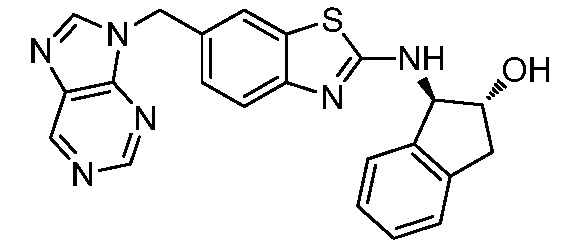
Стадия 1: 6-((9H-Пурин-9-ил)метил)-2-(метилтио)бензо[d]тиазол синтезировали в виде белого твердого вещества (690 мг, 30%) с использованием методики, аналогичной описанной на стадии 3 примера 47, заменяя 5-бром-6-метокси-1H-бензо[d]имидазол, использованный в примере 47, 9H-пурином. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,19 (с, 1H), 8,96 (с, 1H), 8,80 (с, 1H), 8,01 (д, J=0,9 Гц, 1H), 7,82 (д, J=8,3 Гц, 1H), 7,49 (дд, J=1,5, 8,5 Гц, 1H), 5,64 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 314 (M+H)+.
Стадия 2: 6-((9H-Пурин-9-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (473 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((9H-пурин-9-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 330 (M+H)+.
Стадия 3: К смеси 6-((9H-пурин-9-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (270 мг, 0,8 ммоль), полученного на стадии 2 этого примера, и (1R,2R)-1-амино-2,3-дигидро-1H-инден-2-ола (246 мг, 1,6 ммоль) в NMP (1,5 мл) добавляли DIEA (570 мкл, 3,3 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при 150°C в микроволновом реакторе Biotage в течение 1,5 ч. Смесь очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-1-((6-((9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)-2,3-дигидро-1H-инден-2-ола (71 мг, 21%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,18 (с, 1H), 8,97 (с, 1H), 8,77 (с, 1H), 8,47 (д, J=8,1 Гц, 1H), 7,74 (д, J=1,3 Гц, 1H), 7,37 (м, 1H), 7,30 (м, 1H), 7,11-7,25 (м, 4H), 5,45-5,57 (м, 3H), 5,18 (т, J=7,1 Гц, 1H), 4,28 (м, 1H), 3,16 (дд, J=6,9, 15,5 Гц, 1H), 2,74 (м, 1H). ЖХМС (ИЭР) m/z 415 (M+H)+.
Пример 96
Получение (1R,2R)-2-((6-((6-этинил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
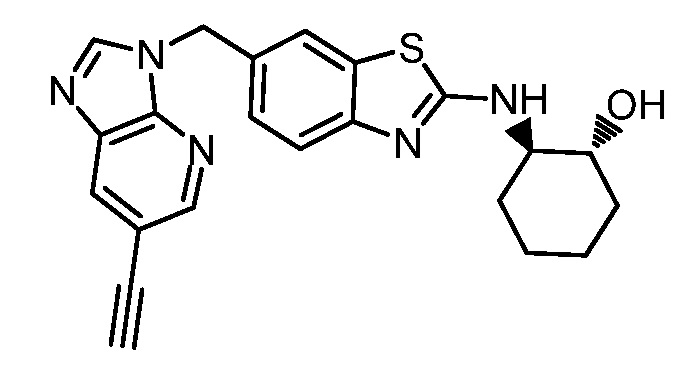
Стадия 1: 6-Йод-3H-имидазо[4,5-b]пиридин (3,78 г) получали с использованием методики, аналогичной описанной на стадии 7 примера 23, заменяя 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин, использованный в примере 23, 5-йодпиридин-2,3-диамином. ЖХМС (ИЭР) m/z 246 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((6-Йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол получали в виде не совсем белого твердого вещества с последовательным использованием методик, аналогичных описанным на стадиях 4-5 примера 3 и на стадии 5 примера 2, заменяя 3H-имидазо[4,5-b]пиридин, использованный на стадии 4 примера 3, 6-йод-3H-имидазо[4,5-b]пиридином, полученным на стадии 1 этого примера, с последующим проведением аналогичных замен исходных веществ, использованных на стадии 5 примера 3 и на стадии 5 примера 2. ЖХМС (ИЭР) m/z 506 (M+H)+.
Стадия 3: К перемешиваемой суспензии (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (152 мг, 0,30 ммоль), полученного на стадии 2 этого примера, в DMF (3 мл) добавляли CuI (6 мг, 0,032 ммоль) и PdCl2(PPh3)2 (11 мг, 0,015 ммоль). Смесь продували аргоном в процессе последовательного добавления этинилтриметилсилана (85 мкл, 0,60 ммоль) и TEA (127 мкл, 0,90 ммоль). Полученную смесь перемешивали при к.т. в течение 1 ч. Анализ методом LCMS обнаруживал завершение реакции. Добавляли воду (30 мл), полученное темно-коричневое твердое вещество собирали путем фильтрования и сушили с получением неочищенного (1R,2R)-2-((6-((6-((триметилсилил)этинил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 70%). ЖХМС (ИЭР) m/z 476 (M+H)+.
Стадия 4: К перемешиваемому раствору (1R,2R)-2-((6-((6-((триметилсилил)этинил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,21 ммоль), полученного на стадии 3 этого примера, в MeOH (5 мл) добавляли избыток K2CO3 (150 мг). Полученную смесь перемешивали при к.т. в течение 30 мин. Анализ методом LCMS обнаруживал завершение реакции. Реакционную смесь фильтровали через слой целита, и очищали фильтрат методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-этинил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде рыжеватого порошка (40 мг, 47%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,50 (д, J=1,5 Гц, 1H), 8,23 (д, J=1,7 Гц, 1H), 8,02 (д, J=6,6 Гц, 1H), 7,66 (с, 1H), 7,26-7,34 (м, 1H), 7,15-7,26 (м, 1H), 5,49 (с, 2H), 4,29 (с, 1H), 3,26-3,38 (м, 2H), 2,03 (д, J=10,4 Гц, 1H), 1,85 (шир. с, 1H), 1,62 (д, J=4,7 Гц, 2H), 1,00-1,38 (м, 4H). ЖХМС (ИЭР) m/z 404 (M+H)+.
Пример 97
Получение (1R,2R)-2-((6-((6-морфолино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
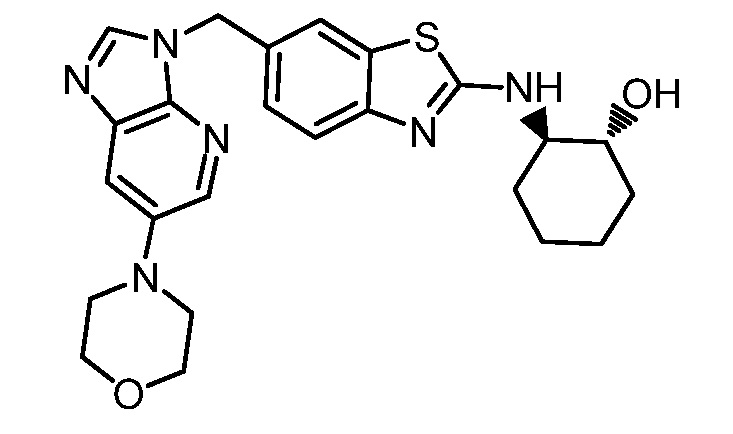
К перемешиваемому раствору (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,30 ммоль), полученного на стадии 2 примера 96, в DMSO (3 мл) добавляли морфолин (156 мкл, 1,78 ммоль), CuI (23 мг, 0,12 ммоль), L-пролин (14 мг, 0,12 ммоль) и K2CO3 (123 мг, 0,89 ммоль). Полученную смесь продували аргоном, реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 2 ч, а затем при 110°C в течение 2 ч. Анализ методом LCMS обнаруживал завершение реакции. Реакционную смесь охлаждали до к.т., фильтровали через слой целита, и очищали фильтрат методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-морфолино-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (15 мг, 11%) в виде рыжеватого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,22 (д, J=2,3 Гц, 1H), 8,03 (д, J=7,2 Гц, 1H), 7,63 (шир. с, 2H), 7,24-7,34 (м, 1H), 7,14-7,22 (м, 1H), 5,42 (с, 2H), 3,70-3,83 (м, 4H), 3,48-3,55 (м, 2H), 3,07-3,15 (м, 4H), 2,03 (д, J=10,2 Гц, 1H), 1,87 (д, J=9,6 Гц, 1H), 1,61 (шир. с, 2H), 1,22 (д, J=7,3 Гц, 4H). ЖХМС (ИЭР) m/z 465 (M+H)+.
Пример 98
Получение (1R,2R)-2-((6-((6-винил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
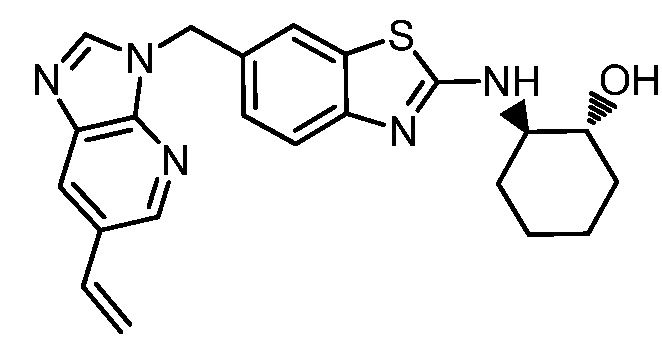
К перемешиваемой смеси (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (200 мг, 0,44 ммоль), полученного в примере 29, в n-PrOH добавляли винилтрифторборат калия (117 мг, 0,88 ммоль), PdCl2(dppf)·DCM (18 мг, 0,022 ммоль) и TEA (122 мкл, 0,88 ммоль). Полученную смесь продували аргоном в течение 5 мин, реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение ночи. Анализ методом LCMS обнаруживал завершение реакции. Реакционную смесь охлаждали до к.т. и очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-винил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2- ил)амино)циклогексанола в виде рыжеватого порошка (40 мг, 23%). 1H ЯМР (300 МГц, MeOH-d4) δ 8,50 (д, J=1,7 Гц, 1H), 8,43 (с, 1H), 8,15 (д, J=1,7 Гц, 1H), 7,63 (с, 1H), 7,32-7,41 (м, 1H), 7,25-7,32 (м, 1H), 6,91 (дд, J=10,9, 17,7 Гц, 1H), 5,91 (д, J=17,5 Гц, 1H), 5,53 (с, 2H), 5,35 (д, J=11,1 Гц, 1H), 3,50-3,66 (м, 1H), 3,37-3,49 (м, 1H), 2,14 (д, J=12,1 Гц, 1H), 2,01 (шир. с, 1H), 1,63-1,82 (м, 2H), 1,13-1,50 (м, 4H). ЖХМС (ИЭР) m/z 406 (M+H)+.
Пример 99
Получение N-((3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метил)ацетамида
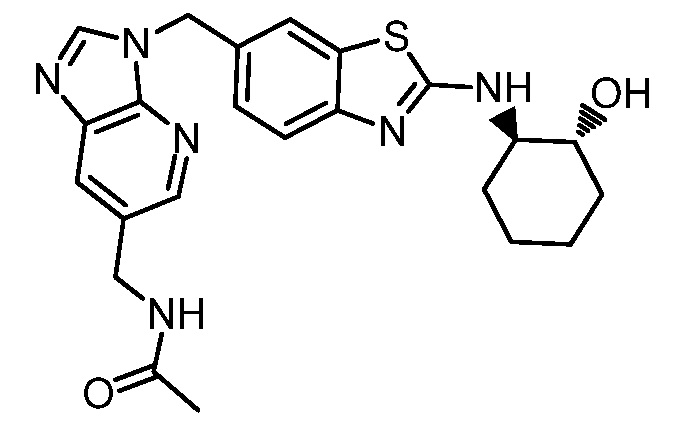
К перемешиваемому раствору (1R,2R)-2-((6-((6-(аминометил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (50 мг, 0,12 ммоль), полученного в примере 91, в DCM (2 мл) добавляли пиридин (40 мкл, 0,48 ммоль) и AcCl (27 мкл, 0,36 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч, после чего ее концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением N-((3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метил)ацетамида (45 мг, 82%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,58 (с, 1H), 8,40 (шир. с, 1H), 8,31 (с, 1H), 7,84-8,10 (м, 2H), 7,65 (с, 1H), 7,24-7,41 (м, 1H), 7,10-7,24 (м, 1H), 5,47 (с, 2H), 4,37 (д, J=5,5 Гц, 2H), 3,34 (д, J=8,7 Гц, 2H), 1,97-2,16 (м, 1H), 1,89 (шир. с, 1H), 1,86 (с, 3H), 1,61 (шир. с, 2H), 0,99-1,39 (м, 4H). ЖХМС (ИЭР) m/z 451 (M+H)+.
Пример 100
Получение (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
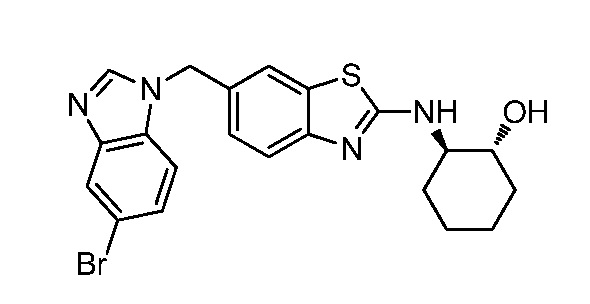
Стадия 1: К перемешиваемой смеси (2-(метилтио)бензо[d]тиазол-6-ил)метанола (958 мг, 4,5 ммоль), полученного на стадии 3 примера 36, в CH2Cl2 (20 мл) при 0°C в атмосфере аргона порциями добавляли перйодинан Десс-Мартина (2,0 г, 5,0 ммоль). Смесь перемешивали в течение 1 ч, а затем разбавляли CH2Cl2 (100 мл). К этой смеси добавляли смесь насыщенного водн. сульфита натрия и насыщенного водн. бикарбоната натрия (50/50, 40 мл). Эту смесь перемешивали в течение 10 мин, затем CH2Cl2 слой отделяли, промывали насыщенным водн. бикарбонатом натрия (50 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 2-(метилтио)бензо[d]тиазол-6-карбальдегида (937 мг, 99%) в виде белого твердого вещества. ЖХМС (ИЭР) m/z 210 (M+H)+.
Стадия 2: К перемешиваемой смеси 4-бром-2-нитроанилина (694 мг, 3,2 ммоль) в TFA (5 мл) при -15°C в атмосфере аргона порциями добавляли NaBH(OAc)3 (1,1 г, 5,3 ммоль). Смесь перемешивали в течение 10 мин. К перемешиваемой смеси по каплям добавляли 2-(метилтио)бензо[d]тиазол-6-карбальдегид (735 мг, 3,5 ммоль), полученный на стадии 1 этого примера, в CH2Cl2 (3 мл). Смесь перемешивали в течение 1 ч, а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением 4-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (1,0 г, 77%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,84 (т, J=6,0 Гц, 1H), 8,19 (д, J=2,4 Гц, 1H), 7,98 (с, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,56 (дд, J=2,4, 9,3 Гц, 1H), 7,46 (д, J=8,3 Гц, 1H), 6,88 (д, J=9,2 Гц, 1H), 4,75 (д, J=6,0 Гц, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 410 и 412 (M+H)+.
Стадия 3: 4-Бром-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин синтезировали в виде масла (1 г) с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, 4-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилином, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 379 и 381 (M+H)+.
Стадия 4: 6-((5-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол синтезировали в виде белого твердого вещества (630 мг, 57%) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси -N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, 4-бром-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамином, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (с, 1H), 8,00 (с, 1H), 7,75-7,91 (м, 2H), 7,54 (д, J=8,5 Гц, 1H), 7,33-7,45 (м, 2H), 5,62 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 389 и 391 (M+H)+.
Стадия 5: 6-((5-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (1,0 г) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 4 этого примера. ЖХМС (ИЭР) m/z 405 и 407 (M+H)+.
Стадия 6: (1R,2R)-2-((6-((5-Бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (36 мг, 36%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 5 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,00 (д, J=7,5 Гц, 1H), 7,85 (д, J=1,7 Гц, 1H), 7,64 (д, J=1,3 Гц, 1H), 7,54 (д, J=8,7 Гц, 1H), 7,25-7,39 (м, 2H), 7,18 (дд, J=1,5, 8,3 Гц, 1H), 5,47 (с, 2H), 4,76 (м, 1H), 3,50 (м, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,12-1,32 (м, 4H). ЖХМС (ИЭР) m/z 456 и 458 (M+H)+.
Пример 101
Получение N-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамида
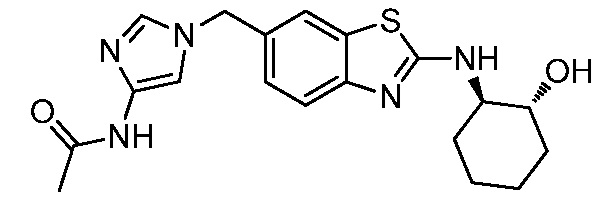
Стадия 1: К смеси региоизомеров 4-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола и 5-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (643 мг, 2,3 ммоль), полученных на стадии 1 примера 32, ацетамида (275 мг, 5,0 ммоль) и Cs2CO3 (1,5 г, 5 ммоль) в 1,4-диоксане (7 мл) добавляли N,N'-диметилэтилендиамин (500 мкл, 5 ммоль). Смесь барботировали аргоном в течение 5 мин, после чего добавляли CuI (221 мг, 1,1 ммоль). Смесь барботировали аргоном еще в течение 5 мин. Затем реакционный сосуд герметизировали, и нагревали смесь при 100°C в течение 15 ч. Смесь охлаждали до к.т., а затем распределяли между EtOAc (100 мл) и водой (50 мл). EtOAc слой отделяли, промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением смеси региоизомеров N-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-4-ил)ацетамида и N-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-5-ил)ацетамида (170 мг, 29%) в виде масла. ЖХМС (ИЭР) m/z 256 (M+H)+.
Стадия 2: Смесь региоизомеров N-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-4-ил)ацетамида и N-(1-((2-(триметилсилил)этокси)метил)-1H-имидазол-5-ил)ацетамида (170 мг, 0,7 ммоль), полученную на стадии 1 этого примера, перемешивали в 70% TFA в CH2Cl2 (10 мл) при к.т. в течение 4 ч. Смесь концентрировали в условиях пониженного давления с получением N-(1H-имидазол-4-ил)ацетамида (147 мг) в виде желтой пленки, которую использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 126 (M+H)+.
Стадия 3: N-(1-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамид синтезировали в виде белого твердого вещества (58 мг, 15%) с использованием методики, аналогичной описанной на стадии 5 примера 36, заменяя 4-бром-1H-имидазол, использованный в примере 36, N-(1H-имидазол-4-ил)ацетамидом, полученным на стадии 2 этого примера. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 10,27 (с, 1H), 7,94 (с, 1H), 7,83 (д, J=8,5 Гц, 1H), 7,60 (с, 1H), 7,38 (д, J=8,5 Гц, 1H), 7,20 (с, 1H), 5,24 (с, 2H), 2,78 (с, 3H), 1,94 (с, 3H). ЖХМС (ИЭР) m/z 319 (M+H)+.
Стадия 4: N-(1-((2-(Метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамид синтезировали в виде белой пены (106 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, N-(1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4- ил)ацетамидом, полученным на стадии 3 этого примера. ЖХМС (ИЭР) m/z 351 (M+H)+.
Стадия 5: N-(1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамид синтезировали в виде белого порошка (4 мг) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, N-(1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамидом, полученным на стадии 4 этого примера. Порошок затем очищали методом препаративной TLC, элюируя 10% MeOH в CH2Cl2, с получением N-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-имидазол-4-ил)ацетамида (2 мг, 2%) в виде белого твердого вещества. 1H ЯМР (300 МГц, MeOH-d4) δ 7,50 (с, 2H), 7,35 (д, J=8,1 Гц, 1H), 7,12-7,25 (м, 2H), 5,13 (с, 2H), 3,60 (м, 1H), 3,43 (м, 1H), 1,96-2,20 (м, 5H), 1,67-1,80 (м, 2H), 1,20-1,47 (м, 4H). ЖХМС (ИЭР) m/z 386 (M+H)+.
Пример 102
Получение (1R,2R)-2-((6-((6-этил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
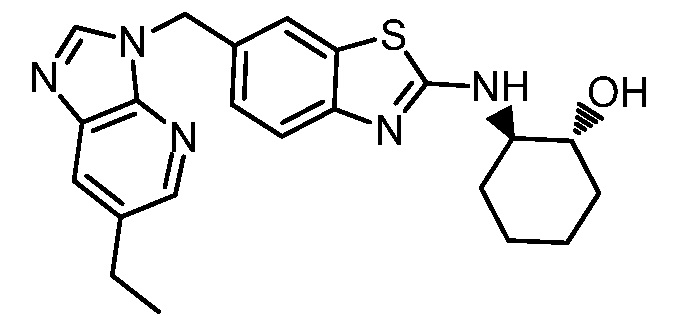
К перемешиваемому раствору (1R,2R)-2-((6-((6-винил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2- ил)амино)циклогексанола (20 мг, 0,049 ммоль), полученного в примере 98, в MeOH/THF (1/1, 2 мл) добавляли никель Ренея (10 мг). Полученную смесь перемешивали в атмосфере подаваемого из баллона H2 при к.т. в течение 4 ч. Анализ методом LCMS обнаруживал завершение реакции. Реакционную смесь фильтровали через слой целита, и очищали фильтрат методом препаративной TLC с получением (1R,2R)-2-((6-((6-этил-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (6 мг, 30%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,53 (шир. с, 1H), 8,26 (шир. с, 1H), 7,95 (д, J=12,4 Гц, 2H), 7,66 (шир. с, 1H), 7,25-7,42 (м, 1H), 7,06-7,25 (м, 1H), 5,45 (шир. с, 2H), 4,74 (д, J=4,5 Гц, 1H), 3,51 (шир. с, 1H), 2,73 (д, J=7,2 Гц, 2H), 2,04 (шир. с, 1H), 1,86 (шир. с, 1H), 1,62 (шир. с, 2H), 1,23 (т, J=6,8 Гц, 7H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Пример 103
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-она
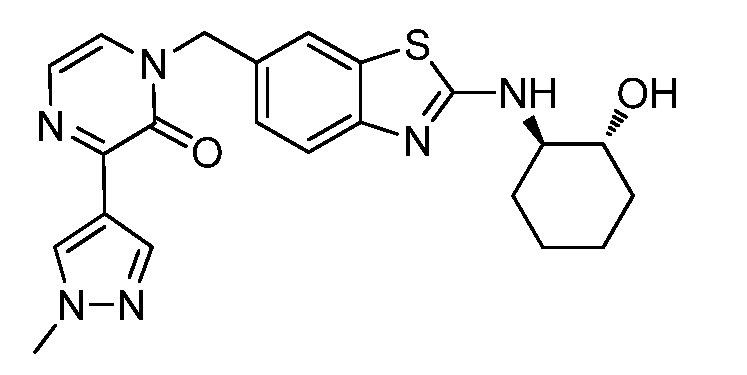
Стадия 1: К 2,3-дихлорпиразину (1,12 г, 7,52 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразолу (1,56 г, 7,52 ммоль), дихлориду бис(трифенилфосфин)палладия(II) (270 мг, 0,38 ммоль) и Na2CO3 (2,4 г, 22,56 ммоль) в толстостенной пробирке добавляли 1,2- диметоксиэтан (15 мл) и воду (2 мл). Из колбы откачивали воздух, продували ее аргоном (3×), а затем герметизировали и нагревали при 90°C в течение ночи. Смесь концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя 20-100% EtOAc в гексанах, с получением 2-хлор-3-(1-метил-1H-пиразол-4-ил)пиразина (780 мг, 53%). ЖХМС (ИЭР) m/z 195 (M+H)+.
Стадия 2: К 2-хлор-3-(1-метил-1H-пиразол-4-ил)пиразину (200 мг, 1,03 ммоль), полученному на стадии 1 этого примера, в DMSO (1,5 мл) и воде (1,5 мл) добавляли KOH (890 мг, 15,4 ммоль), и нагревали смесь при 80°C в течение 3 ч. Смесь охлаждали и распределяли между EtOAc и 4н HCl. Водный слой концентрировали в условиях пониженного давления, затем добавляли смесь MeOH и EtOH, и фильтровали суспензию через целит. Фильтрат концентрировали в условиях пониженного давления, а затем добавляли Et2O, и снова концентрировали смесь в условиях пониженного давления. Остаток растирали с DCM и фильтровали с получением неочищенного 3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-она (300 мг, колич.) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1 H), 8,18 (с, 1 H), 7,24-7,39 (м, 2 H), 3,91 (с, 3 H).
Стадия 3: К 3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-ону (139 мг, 0,78 ммоль), полученному на стадии 2 этого примера, в DMF (3 мл) добавляли NaH (60% в минеральном масле, 32 мг, 0,78 ммоль), и перемешивали смесь при к.т. в течение 10 мин. Затем добавляли 6-(хлорметил)-2-(метилтио)бензо[d]тиазол (180 мг, 0,78 ммоль), полученный на стадии 4 примера 36. Смесь перемешивали при к.т. в течение ночи, а затем концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя 0-15% MeOH/DCM, с получением содержащего примеси 3-(1-метил-1H-пиразол-4-ил)-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-она (80 мг, 27%), который использовали без дополнительной очистки. ЖХМС (ИЭР) m/z 370 (M+H)+.
Стадия 4: К 3-(1-Метил-1H-пиразол-4-ил)-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-ону (80 мг, 0,21 ммоль), полученному на стадии 3 этого примера, в DCM (5 мл) при 0°C добавляли 3-хлорпербензойную кислоту (70%, 75 мг, 0,3 ммоль), и перемешивали смесь в течение 20 мин. Смесь разбавляли DCM, а затем промывали водн. тиосульфатом натрия и насыщенным водн. бикарбонатом натрия. Органический слой сушили над сульфатом натрия и концентрировали в условиях пониженного давления. К остатку добавляли N,N-диметилацетамид (4 мл), DIEA (0,075 мл, 0,43 ммоль) и (1R,2R)-2-аминоциклогексанол (50 мг, 0,43 ммоль). Смесь нагревали при 100°C в течение 3 суток, а затем очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-(1-метил-1H-пиразол-4-ил)пиразин-2(1H)-она (7 мг, 8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,55 (с, 1 H), 8,09 (с, 1 H), 8,00 (д, J=7,54 Гц, 1 H), 7,66-7,71 (м, 2 H), 7,35 (д, J=4,33 Гц, 1 H), 7,29-7,33 (м, 1 H), 7,22-7,27 (м, 1 H), 5,14 (с, 2 H), 4,77 (шир. с, 1 H), 3,89 (с, 3 H) 3,52 (шир. с, 1 H), 2,04 (д, J=10,36 Гц, 1 H), 1,89 (шир. с, 1 H), 1,63 (шир. с, 2 H), 1,23 (д, J=5,84 Гц, 4 H). ЖХМС (ИЭР) m/z 437 (M+H)+.
Пример 104
Получение (1R,2R)-2-((6-((6-(3-гидрокси-3-метилбут-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
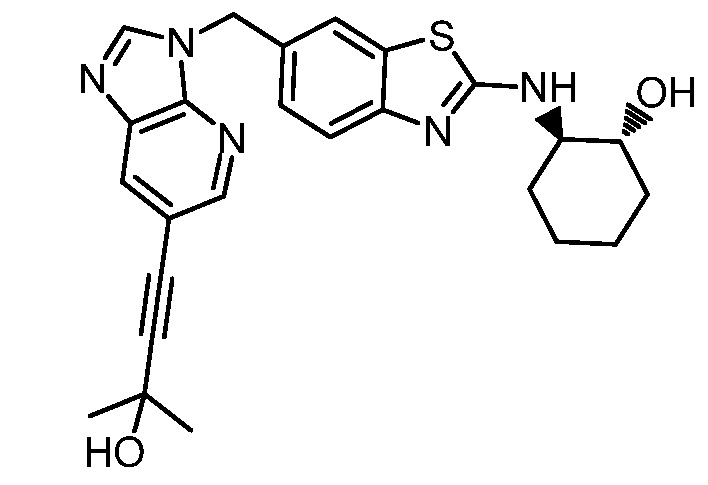
(1R,2R)-2-((6-((6-(3-Гидрокси-3-метилбут-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (125 мг, 91%) получали в виде белого порошка с использованием методики, аналогичной описанной на стадии 3 примера 96, заменяя этинилтриметилсилан, использованный в примере 96, 2-метилбут-3-ин-2-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (шир. с, 1H), 8,41 (с, 1H), 8,10 (шир. с, 1H), 7,99 (д, J=7,3 Гц, 1H), 7,66 (с, 1H), 7,26-7,36 (м, 1H), 7,17-7,26 (м, 1H), 5,48 (с, 2H), 4,77 (шир. с, 1H), 3,48-3,61 (м, 2H), 2,03 (д, J=10,2 Гц, 1H), 1,88 (д, J=10,0 Гц, 1H), 1,62 (д, J=4,5 Гц, 2H), 1,49 (с, 6H), 1,22 (д, J=5,8 Гц, 4H). ЖХМС (ИЭР) m/z 462 (M+H)+.
Пример 105
Получение (1R,2R)-2-((6-((2-(трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
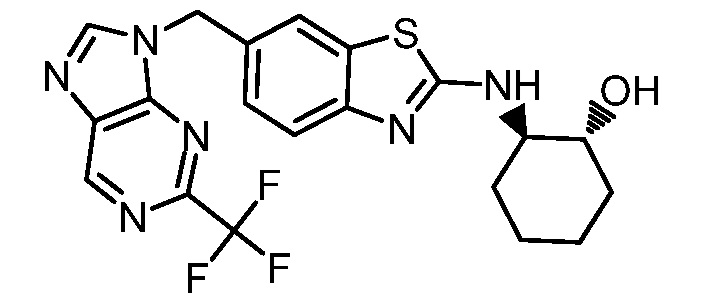
Стадия 1: 2-(Трифторметил)-9H-пурин (940 мг, 94%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 7 примера 23, заменяя 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин, использованный в примере 23, 2-(трифторметил)пиримидин-4,5-диамином. ЖХМС (ИЭР) m/z 189 (M+H)+.
Стадия 2: 2-(Метилтио)-6-((2-(трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазол (480 мг, 47%) получали в виде масла с использованием методики, аналогичной описанной на стадии 1 примера 63, заменяя 4-азабензимидазол, использованный в примере 63, 2-(трифторметил)-9H-пурином, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 382 (M+H)+.
Стадия 3: (1R,2R)-2-((6-((2-(Трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол получали в виде светло-коричневого твердого вещества с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем методик, аналогичных использованным на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 2-(метилтио)-6-((2-(трифторметил)-9H-пурин-9-ил)метил)бензо[d]тиазолом, полученным на стадии 2 этого примера, и заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, продуктом этой реакции. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,39 (с, 1H), 8,97 (с, 1H), 8,05 (д, J=7,5 Гц, 1H), 7,69 (с, 1H), 7,29-7,39 (м, 1H), 7,14-7,28 (м, 1H), 5,56 (с, 2H), 4,81 (шир. с, 1H), 3,50 (д, J=7,7 Гц, 2H), 1,96-2,17 (м, 1H), 1,88 (д, J=9,6 Гц, 1H), 1,62 (шир. с, 2H), 0,93-1,41 (м, 4H). ЖХМС (ИЭР) m/z 449 (M+H)+.
Пример 106
Получение (1R,2R)-2-((6-((5-(метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
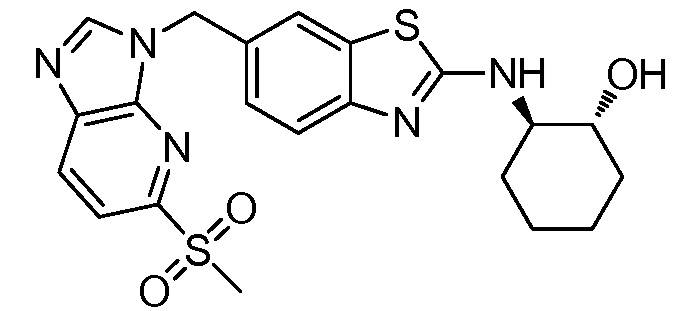
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (89 мг, 0,194 ммоль), полученного в примере 78, метансульфината натрия (80 мг, 0,777 ммоль) и N,N-диметилэтилендиамина (7 мг, 0,078 ммоль) в безводном DMSO (2 мл) при к.т. продували струей аргона в течение 15 мин. К полученной смеси добавляли комплекс трифторметансульфоната меди(I) и бензола (20 мг, 0,038 ммоль). Реакционный сосуд герметизировали, и перемешивали смесь при 125°C в течение 5 ч. После охлаждения до к.т. реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5- (метилсульфонил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (33 мг, 37%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,91 (с, 1H), 8,39 (д, J=8,3 Гц, 1H), 7,90-8,02 (м, 2H), 7,78 (с, 1H), 7,25-7,36 (м, 2H), 5,54 (с, 2H), 4,74 (шир. с, 1H), 3,50 (шир. с, 1H), 3,33-3,34 (м, 4H), 2,02 (m , 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,15-1,30 (м, 4H); ЖХМС (ИЭР) m/z 458 (M+H)+.
Пример 107
Получение (1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
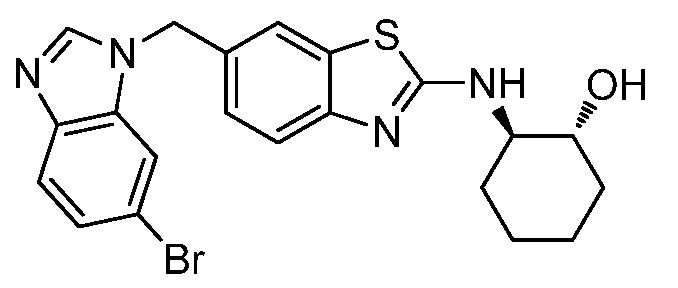
Стадия 1: К перемешиваемой смеси (2-(метилтио)бензо[d]тиазол-6-ил)метанола (958 мг, 4,5 ммоль), полученного на стадии 3 примера 36, в CH2Cl2 (20 мл) при 0°C в атмосфере аргона малыми порциями добавляли перйодинан Десс-Мартина (2,1 г, 5,0 ммоль). После перемешивания смеси в течение 1 ч при 0°C, ее разбавляли CH2Cl2 (100 мл), после чего добавляли смесь насыщенного водн. Na2SO3 и насыщенного водн. NaHCO3 (1/1, 40 мл). Смесь перемешивали в течение 10 мин. Слои разделяли, CH2Cl2 слой последовательно промывали насыщенным водн. NaHCO3 (50 мл) и солевым раствором (50 мл). Органический слой отделяли и сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 2-(метилтио)бензо[d]тиазол-6-карбальдегида (937 мг, 99%) в виде не совсем белого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 10,06 (с, 1H), 8,62 (с, 1H), 7,99 (с, 2H), 2,84 (с, 3H). ЖХМС (ИЭР) m/z 210 (M+H)+.
Стадия 2: К перемешиваемой смеси 5-бром-2-нитроанилина (714 мг, 4,0 ммоль) в TFA (7 мл) при -15°C в атмосфере аргона малыми порциями добавляли NaBH(OAc)3 (1,2 г, 5,4 ммоль). Смесь перемешивали в течение 15 мин, а затем по каплям добавляли раствор 2-(метилтио)бензо[d]тиазол-6-карбальдегида в CH2Cl2 (2 мл). Смесь перемешивали в течение 30 мин, а затем концентрировали в условиях пониженного давления с получением красного масла. Масло распределяли между EtOAc (200 мл) и насыщенным водн. NaHCO3 (100 мл). Органический слой отделяли и промывали солевым раствором (100 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→50% гексаны в EtOAc, с получением 5-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (1,1 г, 73%) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z 409, 411 (M+H)+.
Стадия 3: 5-Бром-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин синтезировали в виде коричневого твердого вещества (920 мг) с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, 5-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 379, 381 (M+H)+.
Стадия 4: 6-((6-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол синтезировали в виде желтого твердого вещества (701 мг, 70%) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, 5-бром-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 389, 391 (M+H)+).
Стадия 5: 6-((6-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде желтой пены (811 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 405, 407 (M+H)+.
Стадия 6: (1R,2R)-2-((6-((6-Бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. Порцию неочищенного продукта очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде белого порошка (33 мг). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 1H), 8,00 (д, J=7,5 Гц, 1H), 7,85 (д, J=1,5 Гц, 1H), 7,56-7,68 (м, 2H), 7,26-7,36 (м, 2H), 7,15-7,24 (м, 1H), 5,47 (с, 2H), 4,76 (д, J=4,5 Гц, 1H), 3,52 (м, 1H), 3,32 (м, 1H), 1,99 (м, 1H), 1,88 (м, 1H), 1,55-1,67 (м, 2H), 1,12-1,30 (м, 4H); ЖХМС (ИЭР) m/z 456, 458 (M+H)+.
Пример 108
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила
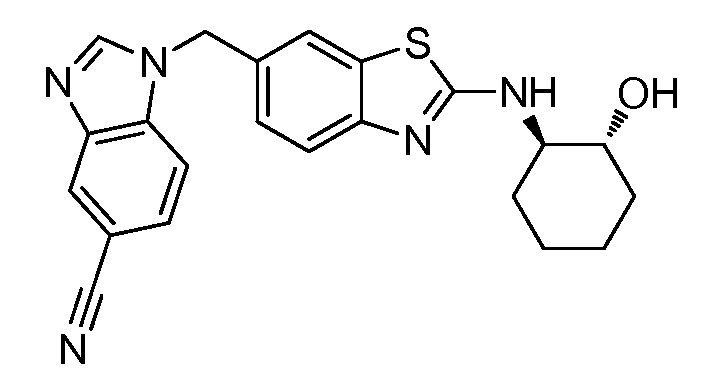
Стадия 1: 4-Бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин синтезировали в виде желтого твердого вещества (1,08 г, 77%) с использованием методики, аналогичной описанной на стадии 2 примера 107, заменяя 5-бром-2-нитроанилин, использованный в примере 107, 4-бром-2-нитроанилином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,84 (т, J=6,0 Гц, 1H), 8,19 (д, J=2,4 Гц, 1H), 7,98 (с, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,56 (дд, J=2,4, 9,3 Гц, 1H), 7,46 (д, J=8,3 Гц, 1H), 6,88 (д, J=9,2 Гц, 1H), 4,75 (д, J=6,0 Гц, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 410, 412 (M+H)+.
Стадия 2: 4-Бром-N1-((2-(метилтио)бензо[d]тиазол-6- ил)метил)бензол-1,2-диамин синтезировали в виде красного масла с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, 4-бром-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 380, 382 (M+H)+.
Стадия 3: 6-((5-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол синтезировали в виде белого твердого вещества (630 мг, 62% в два этапа) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, 4-бром-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-амином, полученным на предшествующей стадии. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (с, 1H), 8,00 (с, 1H), 7,87 (д, J=1,7 Гц, 1H), 7,81 (д, J=8,5 Гц, 1H), 7,54 (д, J=8,5 Гц, 1H), 7,33-7,45 (м, 2H), 5,62 (с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 390, 392 (M+H)+.
Стадия 4: 6-((5-Бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (830 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 405, 407 (M+H)+.
Стадия 5: К суспензии 6-((5-бром-1H-бензо[d]имидазол-1- ил)метил)-2-(метилсульфинил)бензо[d]тиазола (655 мг, 1,6 ммоль) и (1R,2R)-2-аминоциклогексанола (558 мг, 4,8 ммоль) в безводном DMA (3,0 мл) добавляли DIEA (842 мкл, 4,8 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 18 ч. Смесь охлаждали до к.т. и по каплям добавляли к перемешиваемому раствору воду, вызывая образование осадка. После перемешивания в течение 10 мин, твердое вещество собирали путем фильтрования с получением (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (837 мг) в виде рыжеватого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,85 (д, J=1,7 Гц, 1H), 7,65 (с, 1H), 7,54 (д, J=8,5 Гц, 1H), 7,26-7,39 (м, 2H), 7,19 (м, 1H), 5,47 (с, 2H), 4,74 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,32 (м, 1H), 2,01 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,13-1,32 (м, 4H); ЖХМС (ИЭР) m/z 457, 459 (M+H)+.
Стадия 6: 1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрил синтезировали в виде белого порошка (32 мг, 6%) с использованием методики, аналогичной описанной на стадии 1 примера 53, заменяя (1R,2R)-2-((6-((6-бром-5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 53, (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на предшествующей стадии. Затем, продукт очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в CH2Cl2. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,22 (с, 1H), 7,98 (д, J=7,5 Гц, 1H), 7,79 (д, J=8,5 Гц, 1H), 7,68 (с, 1H), 7,62 (м, 1H), 7,29 (м, 1H), 7,21 (м, 1H), 5,54 (с, 2H), 4,73 (д, J=5,3 Гц, 1H), 3,51 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,88 (м, 1H), 1,56-1,67 (м, 2H), 1,10-1,35 (м, 4H); ЖХМС (ИЭР) m/z 404 (M+H)+.
Пример 109
Получение (1R,2R)-2-((6-((6-(2-гидроксипропан-2-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
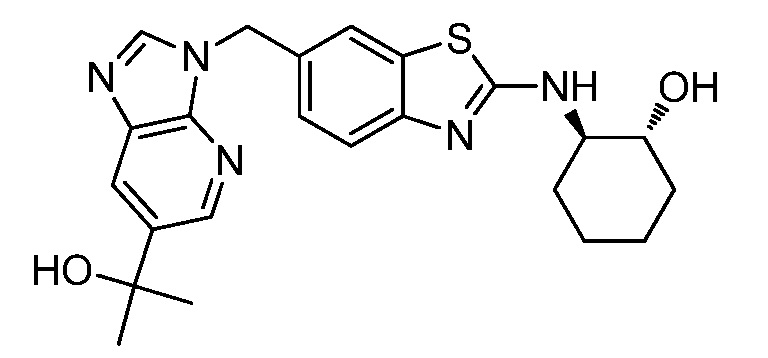
Стадия 1: К перемешиваемому раствору метил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (253 мг, 0,684 ммоль), полученного на стадии 3 примера 79, в смеси безводного DCM (2,5 мл) и безводного THF (6,4 мл) при 0°C в условиях инертной атмосферы по каплям добавляли метилмагнийбромид (3M раствор в диэтиловом эфире, 0,49 мл, 1,47 ммоль). Смесь оставляли медленно нагреваться до к.т. и перемешиваться в течение 1,5 ч. Добавляли дополнительное количество метилмагний бромида (3M раствор в диэтиловом эфире, 0,49 мл, 1,47 ммоль), и перемешивали смесь при к.т. еще в течение 48 ч. Добавляли дополнительное количество метилмагний бромида (3M раствор в диэтиловом эфире, 0,25 мл, 0,74 ммоль), и перемешивали смесь при к.т. еще в течение 4 ч. Реакционную смесь распределяли между EtOAc и смесью (1/1) насыщенного водн. NH4Cl и насыщенного водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→15% MeOH в DCM, с получением 2-(3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)пропан-2-ола (191 мг, 75%) в виде твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,52 (д, J=3,0 Гц, 1H), 8,12 (д, J=3,0 Гц, 1H), 8,00 (м, 1H), 7,81 (д, J=9,0 Гц, 1H), 7,45 (дд, J=9,0, 3,0 Гц, 1H), 5,59 (с, 2H), 5,20 (с, 1H), 2,77 (с, 3H), 1,51 (с, 6H); ЖХМС (ИЭР) m/z 371 (M+H)+.
Стадия 2: 2-(3-((2-(Метилсульфинил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)пропан-2-ол (140 мг, 70%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 3, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 2-(3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)пропан-2-олом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 387 (M+H)+.
Стадия 3: (1R,2R)-2-((6-((6-(2-Гидроксипропан-2-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (17 мг, 11%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 70, заменяя 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 70, 2-(3-((2- (метилсульфинил)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)пропан-2-олом, полученным на стадии 2 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,54 (с, 1H), 8,53 (д, J=3,0 Гц, 1H), 8,10 (д, J=3,0 Гц, 1H), 7,97 (д, J=6,0 Гц, 1H), 7,66 (м, 1H), 7,19-7,30 (м, 2H), 5,46 (с, 2H), 5,22 (шир. с, 1H), 4,76 (шир. д, J=3,0 Гц, 1H), 3,50 (м, 1H), 3,30 (м, 1H), 2,03 (м, 1H), 1,86 (м, 1H), 1,60-1,70 (м, 2H), 1,51 (с, 6H), 1,15-1,30 (м, 4H); ЖХМС (ИЭР) m/z 438 (M+H)+.
Пример 110
Получение 1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)этанона
Перемешиваемую суспензию (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,33 ммоль), полученного на стадии 5 примера 108, и трибутил(1-этоксивинил)олова (177 мг, 0,5 ммоль) в DMA (1,5 мл) продували струей аргона в течение 5 мин. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (57 мг, 0,05 ммоль), и барботировали смесь аргоном еще в течение 5 мин. Реакционный сосуд герметизировали, и нагревали смесь при 110°C в течение 3 ч. Смесь охлаждали до к.т. К смеси добавляли 0,5 M водн. HCl (500 мкл), а затем перемешивали при к.т. в течение 12 ч. Смесь фильтровали, и сразу очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы. Затем продукт очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в CH2Cl2, с получением 1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)этанона (11 мг, 8%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,57 (с, 1H), 8,32 (с, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,85 (д, J=8,5 Гц, 1H), 7,,64-7,72 (м, 2H), 7,30 (м, 1H), 7,20 (м, 1H), 5,52 (с, 2H), 4,73 (д, J=5,1 Гц, 1H), 3,52 (м, 1H), 3,34 (м, 1H), 2,62 (с, 3H), 2,02 (м, 1H), 1,90 (м, 1H), 1,55-1,69 (м, 2H), 1,10-1,35 (м, 4H); ЖХМС (ИЭР) m/z 421 (M+H)+.
Пример 111
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-карбонитрила
1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-карбонитрил синтезировали в виде белого порошка (23 мг, 13%) с использованием методики, аналогичной описанной на стадии 6 примера 108, заменяя (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2- ил)амино)циклогексанол, использованный в примере 108, (1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 6 примера 107. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,27 (с, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,83 (д, J=8,3 Гц, 1H), 7,73 (с, 1H), 7,58 (д, J=8,5 Гц, 1H), 7,23-7,35 (м, 2H), 5,53 (с, 2H), 4,76 (д, J=4,5 Гц, 1H), 3,51 (м, 1H), 2,50 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,13-1,31 (м, 4H); ЖХМС (ИЭР) m/z 404 (M+H)+.
Пример 112
Получение (1R,2R)-2-((6-((5-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
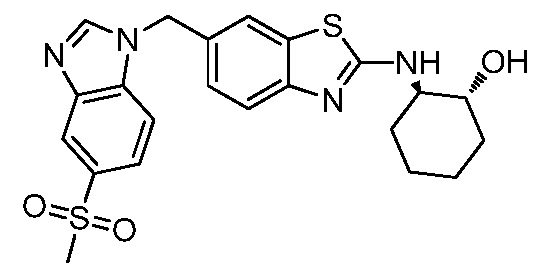
Перемешиваемую суспензию (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,22 ммоль) (полученного, как описано в примере 108, стадии 1-6), метансульфината натрия (89 мг, 0,9 ммоль) и N,N-диметилэтилендиамина (9,6 мкл, 0,9 ммоль) дегазировали под струей аргона в течение 5 мин. Добавляли комплекс трифторметансульфоната меди(I) и бензола (22 мг, 0,04 ммоль), смесь герметизировали и нагревали при 125°C в течение 7 ч. Смесь охлаждали до к.т., фильтровали, и подвергали фильтрат очистке методом препаративной HPLC с обращенной фазой, используя смесь воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонку Varian Diphenyl в качестве неподвижной фазы, с получением (1R,2R)-2-((6-((5-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (30 мг, 30%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,20 (с, 1H), 8,06 (д, J=7,5 Гц, 1H), 7,84 (м, 1H), 7,76 (м, 1H), 7,69 (с, 1H), 7,30 (м, 1H), 7,21 (м, 1H), 5,56 (с, 2H), 4,82 (м, 1H), 3,50 (м, 1H), 3,36 (м, 1H), 3,19 (с, 3H), 2,01 (м, 1H), 1,87 (м, 1H), 1,56-1,67 (м, 2H), 1,11-1,31 (м, 4H); ЖХМС (ИЭР) m/z 457 (M+H)+.
Пример 113
Получение (1R,2R)-2-((6-((6-(метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
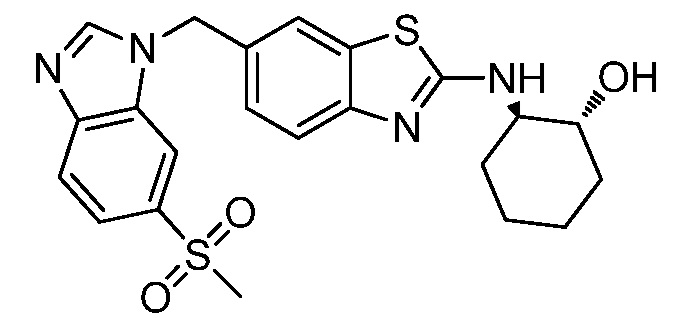
(1R,2R)-2-((6-((6-(Метилсульфонил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (22 мг, 26%) с использованием методики, аналогичной описанной в примере 112, заменяя (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 112, (1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом (полученным, как описано в примере 107, стадии 1-6). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,21 (с, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,89 (д, J=8,5 Гц, 1H), 7,75 (м, 1H), 7,67 (д, J=1,1 Гц, 1H), 7,32 (м, 1H), 7,20 (м, 1H), 5,60 (с, 2H), 4,76 (д, J=4,3 Гц, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 3,21 (с, 3H), 2,02 (м, 1H), 1,88 (м, 1H), 1,55-1,67 (м, 2H), 1,13-1,34 (м, 4H); ЖХМС (ИЭР) m/z 457 (M+H)+.
Пример 114
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)тиазоло[4,5-b]пиридин-2-ил)амино)циклогексанола
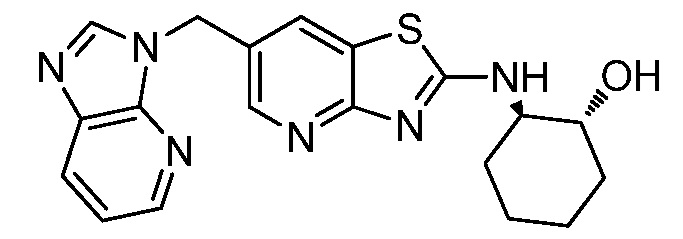
Стадия 1: Смесь этил-6-амино-5-бромникотината (1,0 г, 4 ммоль) и калиевой соли O-этилксантогеновой кислоты (785 мг, 4,2 ммоль) в DMF (15 мл) нагревали с обратным холодильником в течение 6 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (200 мл) и 1 M водн. Na2CO3 (150 мл). Твердое вещество, образованное между двумя слоями, собирали путем фильтрования. Слои разделяли, и концентрировали органический слой в условиях пониженного давления до вспенивания суспензии. Смесь охлаждали до 0°C, и собирали полученное твердое вещество путем фильтрования. Две партии твердого вещества объединяли с получением этил-2-меркаптотиазоло[4,5-b]пиридин-6-карбоксилата калия (871 мг, 89%), который не требовал дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (д, J=2,1 Гц, 1H), 8,19 (д, J=2,1 Гц, 1H), 4,29 (кв., J=7,0 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H); ЖХМС (ИЭР) m/z 241 (M+H)+.
Стадия 2: К перемешиваемой смеси этил-2-меркаптотиазоло[4,5-b]пиридин-6-карбоксилата калия (1,7 г, 6,6 ммоль), полученного на предшествующей стадии, в DMF (10 мл) при 0°C добавляли йодметан (226 мкл, 3,6 ммоль). После перемешивания смеси при 0°C в течение 2 ч, ее оставляли медленно нагреваться до к.т. Смесь распределяли между EtOAc (100 мл) и 0,5 M водн. Na2CO3 (50 мл). Органический слой отделяли и промывали солевым раствором (50 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением этил-2-(метилтио)тиазоло[4,5-b]пиридин-6-карбоксилата (724 мг, 82%) в виде желтого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,07 (с, 2H), 4,38 (кв., J=7,0 Гц, 2H), 2,86 (с, 3H), 1,36 (т, J=7,1 Гц, 3H); ЖХМС (ИЭР) m/z 255 (M+H)+.
Стадия 3: (2-(Метилтио)тиазоло[4,5-b]пиридин-6-ил)метанол синтезировали в виде белого твердого вещества (404 мг, 67%) с использованием методики, аналогичной описанной на стадии 3 примера 36, заменяя этил-2-(метилтио)бензо[d]тиазол-6-карбоксилат, использованный в примере 36, этил-2-(метилтио)тиазоло[4,5-b]пиридин-6-карбоксилатом, полученным на предшествующей стадии. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (д, J=1,9 Гц, 1H), 8,42 (д, J=1,9 Гц, 1H), 5,44 (т, J=5,7 Гц, 1H), 4,63 (д, J=5,7 Гц, 2H), 2,82 (с, 3H); ЖХМС (ИЭР) m/z 213 (M+H)+.
Стадия 4: К перемешиваемой смеси (2-(метилтио)тиазоло[4,5-b]пиридин-6-ил)метанола (404 мг, 2 ммоль) в безводном CH2Cl2 (20 мл) при к.т. добавляли SOCl2 (166 мкл, 2,4 ммоль). Спустя 3 ч, смесь концентрировали в условиях пониженного давления с получением 6-(хлорметил)-2-(метилтио)тиазоло[4,5-b]пиридина (497 мг) в виде белого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,65 (д, J=1,9 Гц, 1H), 8,60 (д, J=1,9 Гц, 1H), 4,95 (с, 2H), 2,83 (с, 3H); ЖХМС (ИЭР) m/z 231 (M+H)+.
Стадия 5: К перемешиваемой смеси DMF (5 мл) и гидрида натрия (60% в минеральном масле, 64 мг, 1,6 ммоль) при 0°C в атмосфере аргона одной порцией добавляли 4-азабензимидазол (204 мг, 1,1 ммоль). Смесь перемешивали в течение 5 мин при 0°C, а затем по каплям добавляли раствор 6-(хлорметил)-2-(метилтио)тиазоло[4,5-b]пиридина (497 мг, 2,2 ммоль) в DMF (2 мл). Смесь медленно нагревали до к.т., а затем нагревали при 70°C в течение 18 ч. Смесь охлаждали до к.т., а затем распределяли между EtOAc (150 мл) и 0,5 M водн. Na2CO3 (50 мл). Органический слой отделяли и промывали водой (50 мл), а затем солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% CH2Cl2→5% MeOH в DCM, с получением 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)тиазоло[4,5-b]пиридина (126 мг, 35%) в виде желтого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,64-8,74 (м, 2H), 8,46 (д, J=2,1 Гц, 1H), 8,38 (дд, J=1,1, 4,7 Гц, 1H), 8,12 (дд, J=1,3, 8,1 Гц, 1H), 7,31 (дд, J=4,7, 8,1 Гц, 1H), 5,67 (с, 2H), 2,80 (с, 3H); ЖХМС (ИЭР) m/z 314 (M+H)+.
Стадия 6: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)тиазоло[4,5-b]пиридин синтезировали в виде белой пены (135 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)тиазоло[4,5-b]пиридином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 330 (M+H)+.
Стадия 7: (1R,2R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)тиазоло[4,5-b]пиридин-2-ил)амино)циклогексанол синтезировали в виде белого порошка (80 мг, 53%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)тиазоло[4,5-b]пиридином, полученным на предшествующей стадии. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,46 (д, J=7,5 Гц, 1H), 8,39 (дд, J=1,2, 4,8 Гц, 1H), 8,33 (д, J=2,1 Гц, 1H), 8,09 (дд, J=1,3, 8,1 Гц, 1H), 8,05 (д, J=2,1 Гц, 1H), 7,30 (м, 1H), 5,50 (с, 2H), 4,82 (д, J=5,3 Гц, 1H), 3,61 (м, 1H), 3,35 (м, 1H), 2,03 (м, 1H), 1,88 (м, 1H), 1,55-1,70 (м, 2H), 1,15-1,33 (м, 4H); ЖХМС (ИЭР) m/z 381 (M+H)+.
Пример 115
Получение (1R,2R)-2-((6-((6-((R,S)-1-гидроксиэтил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
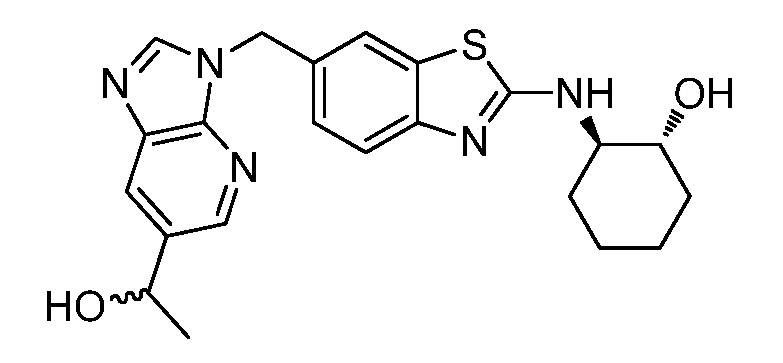
К перемешиваемому раствору 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанона (92 мг, 0,22 ммоль), полученного в примере 73, MeOH (5 мл) и DMF (3 мл) при к.т. добавляли боргидрид натрия (17 мг, 0,44 ммоль). Смесь перемешивали при к.т. в течение 15 мин. Реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-((R,S)-1-гидроксиэтил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (38 мг, 41%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,55 (с, 1H), 8,37 (д, J=1,5 Гц, 1H), 7,97-8,00 (м, 2H), 7,66 (м, 1H), 7,28 (д, J=6,0 Гц, 1H), 7,20 (дд, J=6,0, 3,0 Гц, 1H), 5,46 (с, 2H), 5,30 (шир. м, 1H), 4,90 (м, 1H), 4,76 (шир. м, 1H), 3,50 (м, 1H), 3,30 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,65 (м, 2H), 1,40 (д, J=6,0 Гц, 3H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 424 (M+H)+.
Пример 116
Получение 2-(диметиламино)-1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанонацетата
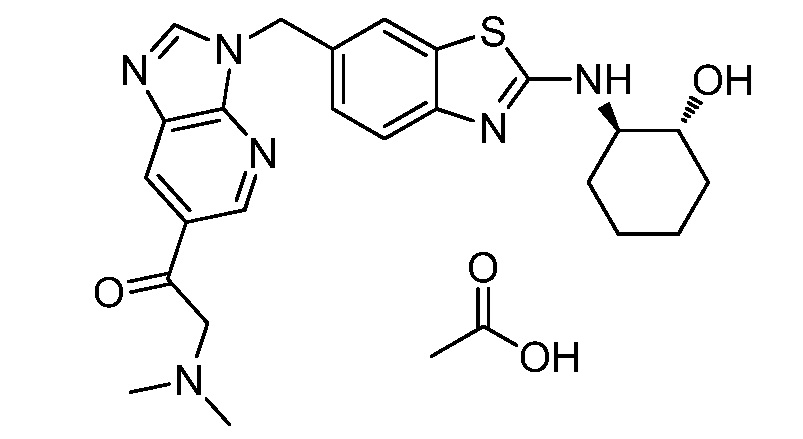
Стадия 1: Перемешиваемую смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (693 мг, 1,51 ммоль), полученного в примере 29, трибутил(1-этоксивинил)олова (1,10 г, 3,03 ммоль) и DMF (10 мл) продували аргоном. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (262 мг, 0,23 ммоль). Реакционный сосуд герметизировали, и нагревали смесь при 110°C в течение 2 ч. Смесь оставляли охлаждаться до к.т. Смесь распределяли между водой и DCM, и отделяли органический слой. Водный слой экстрагировали дополнительным количеством DCM. Объединенные органические слои промывали водой, а затем солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→15% MeOH в DCM, с получением (1R,2R)-2-((6-((6-(1-этоксивинил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (320 мг, 47%) в виде твердого вещества. ЖХМС (ИЭР) m/z 450 (M+H)+.
Стадия 2: К перемешиваемому раствору (1R,2R)-2-((6-((6-(1-этоксивинил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (90 мг, 0,20 ммоль), полученного на предшествующей стадии, в DMF (2 мл) при 0°C добавляли N-бромсукцинимид (36 мг, 0,20 ммоль), и перемешивали смесь в течение 15 мин. К смеси добавляли диметиламин (2M в THF, 0,90 мл, 1,80 ммоль), и продолжали перемешивание при 0°C в течение 5 мин. Реакционную смесь сразу очищали методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 2-(диметиламино)-1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)этанонацетата (5 мг, 5%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,01 (д, J=1,7 Гц, 1H), 8,75 (с, 1H), 8,67 (д, J=1,7 Гц, 1H), 8,03 (д, J=7,5 Гц, 1H), 7,68 (с, 1H), 7,20-7,32 (м, 2H), 5,52 (с, 2H), 4,80 (шир. с, 1H), 3,78 (с, 2H), 3,51 (шир. м, 1H), 3,30 (шир. м, 1H), 2,25 (с, 6H), 2,04 (шир. м, 1H), 1,82-1,86 (м, 4H), 1,59-1,65 (шир. м, 2H), 1,10-1,60 (м, 4H); ЖХМС (ИЭР) m/z 465 (M+H)+.
Пример 117
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила
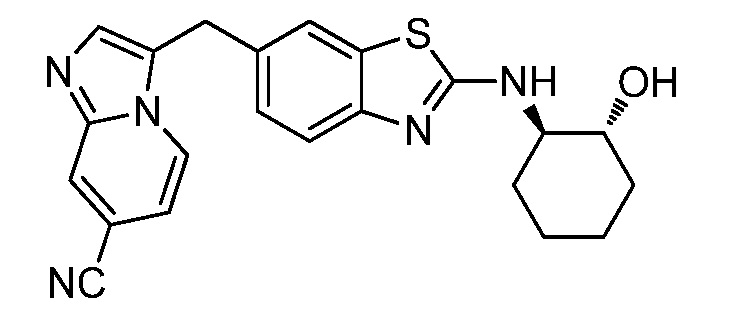
Стадия 1: Смесь 2-фтор-4-йоданилина (2,4 г, 10 ммоль) и O-этилкарбонодитиоата натрия (3,2 г, 20 ммоль) в DMF (8 мл) перемешивали при 95°C в течение 5 ч. Реакционную смесь охлаждали до к.т., а затем разбавляли водой (25 мл) и 1н водной HCl (20 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Полученный осадок собирали путем фильтрования и промывали водой. Твердое вещество сушили с получением 6-йодбензо[d]тиазол-2-тиола в виде светло-желтого твердого вещества (3,3 г, 100%). 1H ЯМР (300 МГц, CD3OD) δ 7,89 (д, J=1,2 Гц, 1H), 7,67 (дд, J=1,8, 8,7 Гц, 1H), 7,05 (д, J=8,4 Гц, 1H). ЖХМС (ИЭР) m/z 294 (M+H)+.
Стадия 2: К перемешиваемой смеси 6-йодбензо[d]тиазол-2-тиола (0,5 г, 1,7 ммоль) и карбоната калия (0,23 г, 1,7 ммоль) в THF (10 мл) добавляли метилйодид (0,12 мл, 1,1 ммоль). После перемешивания при к.т. в течение ночи смесь концентрировали в условиях пониженного давления с получением твердого вещества. Твердое вещество распределяли между насыщенным водн. карбонатом натрия и DCM. Органический слой сушили над Na2SO4 и фильтровали и концентрировали в условиях пониженного давления с получением 6-йод-2-(метилтио)бензо[d]тиазола в виде не совсем белого твердого вещества (0,4 г, 76%). 1H ЯМР (300 МГц, CDCl3) δ 8,07 (д, J=1,2 Гц, 1H), 7,69 (дд, J=1,8, 8,4 Гц, 1H), 7,58 (д, J=8,4 Гц, 1H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 308 (M+H)+.
Стадия 3: Смесь 6-йод-2-(метилтио)бензо[d]тиазола (5,0 г, 16,3 ммоль), аллилового спирта (2,2 мл, 32,6 ммоль), Pd(OAc)2 (0,36 г, 1,63 ммоль), трис(орто-толил)фосфина (1,0 г, 3,3 ммоль) и NaHCO3 (2,8 г, 32,6 ммоль) в DMF (75 мл) перемешивали при 100°C в атмосфере азота в течение 4 ч. Затем смесь охлаждали до к.т., и добавляли воду (300 мл). Смесь экстрагировали EtOAc (3×200 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (10/1→5/1), с получением 3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя в виде темно-желтого масла (2,0 г, 52%). 1H ЯМР (300 МГц, CDCl3) δ 9,83 (т, J=1,2 Гц, 1H), 7,78 (д, J=8,4 Гц, 1H), 7,58 (д, J=1,2 Гц, 1H), 7,23 (дд, J=1,8, 8,4 Гц, 1H), 3,05 (т, J=7,5 Гц, 2H), 2,85 (т, J=7,5 Гц, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 238 (M+H)+.
Стадия 4: К раствору 3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (2,3 г, 9,7 ммоль) в DCM (40 мл) при 0°C добавляли L-пролин (0,22 г, 1,9 ммоль), а затем добавляли N-хлорсукцинимид (1,4 г, 10 ммоль). Реакционную смесь медленно нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (10/1→2/1), с получением 2-хлор-3-(2- (метилтио)бензо[d]тиазол-6-ил)пропаналя в виде желтого масла (2,1 г, 79%). 1H ЯМР (300 МГц, CDCl3) δ 9,56 (дд, J=1,2, 2,1 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,63 (д, J=0,6 Гц, 1H), 7,28 (д, J=1,5 Гц, 1H), 4,44-4,39 (м, 1H), 3,51-3,44 (м, 1H), 3,20-3,13 (м, 1H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 290 (M+18+H)+.
Стадия 5: Смесь 4-бромпиридин-2-амина (4,9 г, 28,5 ммоль), Zn(CN)2 (5,0 г, 42,5 ммоль), Pd2(dba)3 (1,3 г, 1,4 ммоль) и dppf (1,6 г, 2,8 ммоль) в DMF (150 мл) перемешивали при 100°C в атмосфере азота в течение 1,5 ч. Смесь охлаждали до к.т., и добавляли воду (500 мл). Смесь экстрагировали EtOAc (33×00 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (10/1→2/1), с получением 2-аминоизоникотинонитрила в виде светло-желтого твердого вещества (2,7 г, 80%). 1H ЯМР (300 МГц, CDCl3) δ 8,19 (д, J=5,1 Гц, 1H), 6,82 (д, J=4,8 Гц, 1H), 6,69 (д, J=0,9 Гц, 1H), 4,72 (шир. с, 2H). ЖХМС (ИЭР) m/z 120 (M+H)+.
Стадия 6: Смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (0,35 г, 1,3 ммоль) и 2-аминоизоникотинонитрила (0,30 г, 2,6 ммоль) в 1-бутаноле (15 мл) нагревали с обратным холодильником в течение ночи. После охлаждения до к.т. образовавшееся твердое вещество собирали и промывали водой, а затем сушили с получением 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила в виде белого твердого вещества (0,27 г, 62%). 1H ЯМР (300 МГц, CDCl3) δ 8,45 (д, J=7,2 Гц, 1H), 8,34 (с, 1H), 7,90 (с, 1H), 7,78 (д, J=8,7 Гц, 1H), 7,75 (с, 1H), 7,37 (дд, J=1,2, 7,8 Гц, 1H), 7,20 (дд, J=1,8, 7,2 Гц, 1H), 4,49 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 337 (M+H)+.
Стадия 7: К раствору 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила (0,27 г, 0,8 ммоль) в DCM (15 мл) добавляли m-CPBA (0,17 г, 0,9 ммоль) при 0°C. Реакционную смесь перемешивали в течение 2 ч при 0°C, затем добавляли водн. Na2SO3 (15 мл), и перемешивали смесь в течение 0,5 ч. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила в виде желтого твердого вещества (0,28 г, 99%). 1H ЯМР (300 МГц, CDCl3) δ 8,46 (д, J=7,2 Гц, 1H), 8,36 (с, 1H), 8,15 (д, J=1,2 Гц, 1H), 8,04 (д, J=8,7 Гц, 1H), 7,78 (с, 1H), 7,55 (дд, J=1,5, 8,4 Гц, 1H), 7,21 (дд, J=1,8, 7,2 Гц, 1H), 4,57 (с, 2H), 3,06 (с, 3H). ЖХМС (ИЭР) m/z 353 (M+H)+.
Стадия 8: Смесь 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила (0,20 г, 0,56 ммоль), (1R,2R)-2-аминоциклогексанола (97 мг, 0,84 ммоль) и DIEA (0,18 г, 1,4 ммоль) в DMA (10 мл) перемешивали в течение 2 суток при 140°C. Смесь охлаждали до к.т., и добавляли воду (50 мл). Смесь экстрагировали EtOAc (33×0 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→10/1), с получением твердого вещества, которое перекристаллизовывали в DCM/MeOH (10/1, 10 мл) с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрила в виде белого твердого вещества (75 мг, 33%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (д, J=6,9 Гц, 1H), 8,32 (с, 1H), 7,88 (д, J=6,9 Гц, 1H), 7,72 (с, 1H), 7,53 (с, 1H), 7,27 (д, J=8,1 Гц, 1H), 7,19 (д, J=6,9 Гц, 1H), 7,09 (д, J=7,5 Гц, 1H), 4,73 (д, J=4,2 Гц, 1H), 4,36 (с, 2H), 3,54-3,50 (м, 1H), 3,37-3,34 (м, 1H), 2,05-2,01 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,30-1,16 (м, 4H). ЖХМС (ИЭР) m/z 404 (M+H)+.
Пример 118
Получение (1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
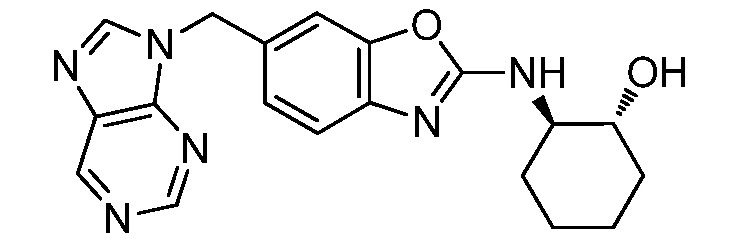
Стадия 1: Раствор пиримидин-4,5-диамина (718 мг, 6,53 ммоль) и HCOOH (0,36 мл) в триэтоксиметане (19 мл) перемешивали при 90°C в течение 3,5 ч. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (40/1), с получением 9H-пурина в виде коричневого твердого вещества (784 мг, 100%). 1H ЯМР (300 МГц, ДМСО-d6) δ 13,40 (шир. с, 1H), 9,12 (с, 1H), 8,92 (с, 1H), 8,60 (с, 1H). ЖХМС (ИЭР) m/z 121 (M+H)+.
Стадия 2: К перемешиваемому раствору 9H-пурина (784 мг, 6,53 ммоль) в DMF (16 мл) при 0°C порциями добавляли NaH (60% дисперсия в минеральном масле, 373 мг, 9,33 ммоль). После перемешивания в течение 30 мин, к смеси добавляли 6-(хлорметил)-2-(метилтио)бензо[d]оксазол (1,3 г, 6,22 ммоль). Реакционную смесь оставляли нагреваться до к.т. и перемешиваться в течение 3 ч. Реакционную смесь вливали в воду (150 мл) и экстрагировали этилацетатом (4×150 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (40/1), с получением 6-((9H-пурин-9-ил)метил)-2-(метилтио)бензо[d]оксазола в виде светло-желтого твердого вещества (569 мг, 32,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,14 (с, 1H), 8,92 (с, 1H), 8,77 (с, 1H), 7,69 (с, 1H), 7,56 (д, J=7,8 Гц, 1H), 7,35 (д, J=9,0 Гц,1H), 5,59 (с, 2H), 2,70 (с, 3H). ЖХМС (ИЭР) m/z 298 (M+H)+.
Стадия 3: Смесь 6-((9H-пурин-9-ил)метил)-2-(метилтио)бензо[d]оксазола (400 мг, 1,35 ммоль) и m-CPBA (289 мг, 1,69 ммоль) в DCM (25 мл) перемешивали при 0°C в течение 6 ч. Реакционную смесь промывали водн. Na2S2O3 и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/5), с получением 6-((9H-пурин-9-ил)метил)-2-(метилсульфинил)бензо[d]оксазола в виде светло-желтого твердого вещества (143 мг, 33,89%). 1H ЯМР (300 МГц, CDCl3) δ 9,18 (с, 1H), 9,03 (с, 1H), 8,13 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,66 (с, 1H), 7,44 (д, J=9,9 Гц, 1H), 5,62 (с, 2H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 314 (M+H)+.
Стадия 4: Смесь 6-((9H-пурин-9-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (106 мг, 0,34 ммоль), (1R,2R)-2-аминоциклогексанола (77 мг, 0,51 мг) и DIEA (132 мг, 1,02 ммоль) в DMA (3 мл) перемешивали при 135°C в течение 2 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/6), с получением неочищенного продукта, который промывали петролейным эфиром/этилацетатом (10/1) с получением (1R,2R)-2-((6-((9H-пурин-9-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола в виде светло-желтого твердого вещества (68 мг, 48,57%). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,16 (с, 1H), 8,96 (с, 1H), 8,73 (с, 1H), 7,79 (д, J=7,8 Гц, 1H), 7,42 (с, 1H), 7,16 (д, J=1,2 Гц, 1H), 7,14 (д, J=8,1 Гц, 1H) 5,51 (с, 2H), 4,66 (д, J=4,2 Гц, 1H), 3,34 (шир. с, 2H), 1,90 (шир. с, 2H), 1,60 (шир. с, 2H), 1,22 (шир. с, 4H). ЖХМС (ИЭР) m/z 365 (M+H)+.
Пример 119
Получение (1R,2R)-2-((6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
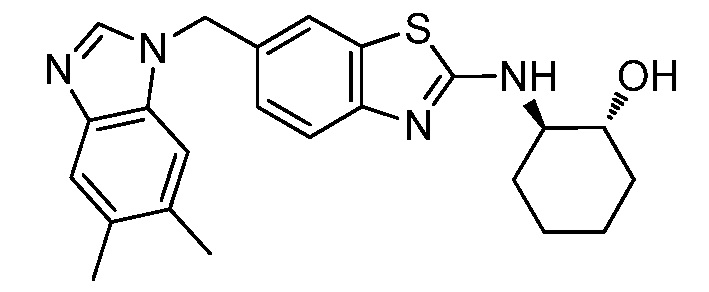
Стадия 1: К перемешиваемой смеси безводного DMF (15 мл) и гидрида натрия (60% дисперсия в минеральном масле, 105 мг, 2,63 ммоль) при 0°C в атмосфере азота порциями добавляли 5,6-диметил-1H-бензо[d]имидазол (215 мг, 1,4 ммоль). Реакционную смесь перемешивали в течение 5 мин. добавляли по каплям раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (320 мг, 1,4 ммоль), полученного на стадии 4 примера 36, в безводном DMF (2 мл). Реакционную смесь оставляли нагреваться до к.т. и перемешиваться в течение 1 ч. Реакционный раствор выливали в воду со льдом и экстрагировали EtOAc (3×50 мл). Объединенные органические слои дополнительно промывали водой (20 мл), а затем солевым раствором (20 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (450 мг, 96%) в виде желтого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 7,86 (с, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,59 (с, 1H), 7,46 (с, 1H), 7,24-7,26 (м, 1H), 7,03 (с, 1H), 5,40 (с, 2H), 2,77 (с, 3H), 2,37 (с, 3H), 2,32 (с, 3H); ЖХМС (ИЭР) m/z 340 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (450 мг, 1,32 ммоль), полученного на предшествующей стадии, в DCM (20 мл) при 0°C добавляли раствор мета-хлорпербензойной кислоты (270 мг, 1,32 ммоль) в DCM (3 мл). После перемешивания в течение 2 ч при 0°C реакционный раствор разбавляли EtOAc (100 мл) и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (460 мг, 98%) в виде бесцветного твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 8,01 (д, J=8,4 Гц, 1H), 7,90 (с, 1H), 7,72 (с, 1H), 7,60 (с, 1H), 7,37 (м, 1H), 7,02 (с, 1H), 5,48 (с, 2H), 3,06 (с, 3H), 2,37 (с, 3H), 2,32 (с, 3H); ЖХМС (ИЭР) m/z 356 (M+H)+.
Стадия 3: Перемешиваемую смесь 6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (150 мг, 0,42 ммоль), полученного на предшествующей стадии, (1R,2R)-2-аминоциклогексанола (140 мг, 1,2 ммоль), DIEA (540 мг, 4,2 ммоль) и NMP (2 мл) нагревали при 130°C в течение 12 ч. Реакционную смесь охлаждали до к.т., разбавляли EtOAc (30 мл) и промывали водой (2×10 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением (1R,2R)-2-((6-((5,6-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (80 мг, 47%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,22 (с, 1H), 7,92 (д, J=6,0 Гц, 1H), 7,58 (м, 1H), 7,41 (с, 1H), 7,26-7,31 (м, 2H), 7,14 (м, 1H), 5,40 (с, 2H), 4,71 (д, J=3,0 Гц, 1H), 3,50 (м, 1H), 3,35 (м, 1H), 2,30 (с, 6H), 2,02 (м, 1H), 1,88 (м, 1H), 1,86-1,90 (м, 2H), 1,12-1,27 (м, 4H); ЖХМС (ИЭР) m/z 407 (M+H)+.
Пример 120
Получение 1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-ил)этанона
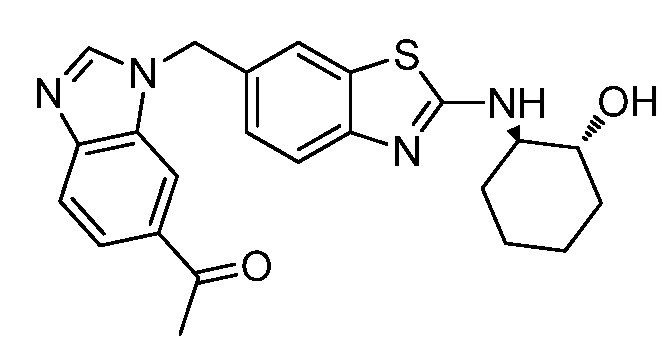
1-(1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-6-ил)этанон синтезировали в виде белого порошка (8 мг, 6%) с использованием методики, аналогичной описанной в примере 110, заменяя (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 110, (1R,2R)-2-((6-((6-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 6 примера 107. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,24 (с, 1H), 7,99 (д, J=7,5 Гц, 1H), 7,82 (м, 1H), 7,74 (м, 1H), 7,68 (с, 1H), 7,31 (м, 1H), 7,21 (м, 1H), 5,58 (с, 2H), 4,75 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,61 (с, 3H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,10-1,34 (м, 4H); ЖХМС (ИЭР) m/z 421 (M+H)+.
Пример 121
Получение (1R,2R)-2-((6-((5-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
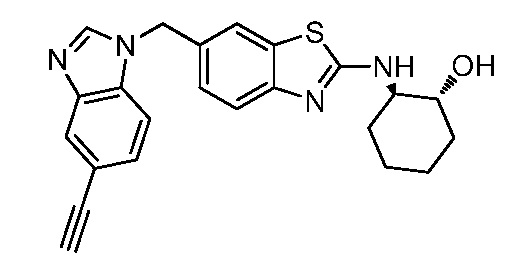
Стадия 1: Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (109 мг, 0,24 ммоль), полученного на стадии 6 примера 108, (триметилсилил)ацетилена (68 мкл, 0,48 ммоль) и DIEA (62 мкл, 0,36 ммоль) в CH3CN (2 мл) продували струей аргона в течение 5 мин. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (57 мг, 0,05 ммоль), и барботировали смесь аргоном еще в течение 5 мин. Реакционный сосуд герметизировали, и нагревали смесь при 80°C в течение 5 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (100 мл) и 1 M водн. NaHCO3 (50 мл). Органический слой промывали солевым раствором (50 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в DCM, с получением (1R,2R)-2-((6-((5-((триметилсилил)этинил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (61 мг, 54%) в виде янтарного масла. ЖХМС (ИЭР) m/z 476 (M+H)+.
Стадия 2: Смесь (1R,2R)-2-((6-((5-((триметилсилил)этинил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (61 мг, 0,13 ммоль) и Na2CO3 (177 мг, 1,3 ммоль) в MeOH (2 мл) перемешивали при к.т. в течение 2 ч. Смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (8 мг, 17%) в виде белого порошка. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,76 (с, 1H), 7,65 (с, 1H), 7,57 (д, J=8,3 Гц, 1H), 7,27-7,33 (м, 2H), 7,19 (м, 1H), 5,48 (с, 2H), 4,78 (д, J=4,9 Гц, 1H), 4,03 (с, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,69 (м, 2H), 1,11-1,31 (м, 4H); ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 122
Получение (1R,2R)-2-((6-((6-этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
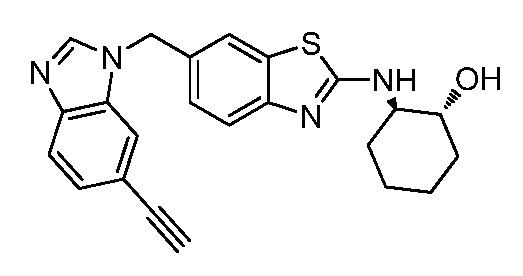
Стадия 1: (1R,2R)-2-((6-((6-((Триметилсилил)этинил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде масла (46 мг, 41%) с использованием методики, аналогичной описанной на стадии 1 примера 121, заменяя (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 121, (1R,2R)-2-((6-((6-бром-1H- бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 6 примера 107. ЖХМС (ИЭР) m/z 476 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((6-Этинил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде порошка (7 мг, 18%) с использованием методики, аналогичной описанной на стадии 2 примера 121, заменяя (1R,2R)-2-((6-((5-((триметилсилил)этинил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 121, (1R,2R)-2-((6-((6-((триметилсилил)этинил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на предшествующей стадии. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,50 (с, 1H), 8,03 (д, J=7,2 Гц, 1H), 7,74 (с, 1H), 7,60-7,68 (м, 2H), 7,16-7,34 (м, 3H), 5,48 (с, 2H), 4,80 (д, J=4,0 Гц, 1H), 4,10 (с, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,56-1,67 (м, 2H), 1,11-1,34 (м, 4H); ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 123
Получение (1R,2R)-2-((6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
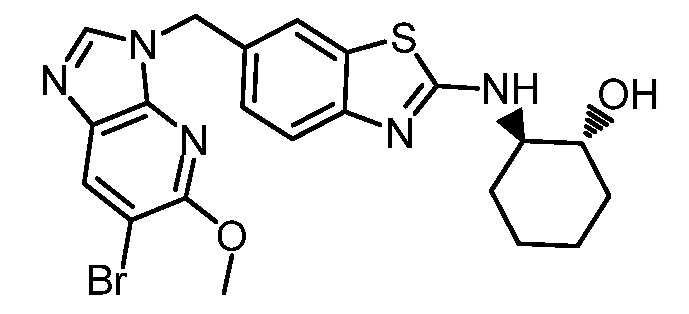
Стадия 1: К перемешиваемому раствору 6-метокси-3-нитропиридин-2-амина (1,56 г, 9,2 ммоль) в 15 мл DMF при к.т. порциями добавляли N-бромсукцинимид (1,81 г, 10,1 ммоль). Полученную смесь перемешивали при к.т. в течение 1 ч. Анализ методом TLC обнаруживал завершение реакции. Реакционную смесь гасили добавлением воды, красно-коричневое твердое вещество собирали путем фильтрования, промывали водой, и сушили в вакуумной печи с получением 5-бром-6-метокси-3-нитропиридин-2-амина (2,1 г, 92%). ЖХМС (ИЭР) m/z 248, 250 (M+H)+.
Стадия 2: Смесь уксусного ангидрида (15,9 мл, 168,7 ммоль) и муравьиной кислоты (6,4 мл, 168,7 ммоль) нагревали при 60°C в течение 3 ч. После охлаждения до к.т. порциями добавляли 5-бром-6-метокси-3-нитропиридин-2-амин (2,1 г, 8,4 ммоль), полученный на стадии 1 этого примера. Полученную смесь нагревали при 60°C в течение 1 ч, а затем при 70°C в течение 1 ч. Анализ методом LCMS обнаруживал завершение реакции. Объем сокращали в условиях пониженного давления, и собирали выпавшее в осадок твердое вещество путем фильтрования с получением N-(5-бром-6-метокси-3-нитропиридин-2-ил)формамида в виде светло-желтого твердого вещества (2,2 г, 94%). ЖХМС (ИЭР) m/z 276, 278 (M+H)+.
Стадия 3: Неочищенный N-(5-бром-6-метокси-3-нитропиридин-2-ил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид (950 мг) получали в виде светло-желтого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 3, заменяя 3H-имидазо[4,5-b]пиридин, использованный в примере 3, N-(5-бром-6-метокси-3-нитропиридин-2-ил)формамидом, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 469,471 (M+H)+.
Стадия 4: К перемешиваемому раствору неочищенного N-(5-бром-6-метокси-3-нитропиридин-2-ил)-N-((2-(метилтио)бензо[d]тиазол-6- ил)метил)формамида (950 мг, 2,0 ммоль) в EtOH (8 мл) добавляли AcOH (2 мл) и железо (169 мг, 3,0 ммоль). Полученную смесь нагревали с обратным холодильником в течение 1 ч. Добавляли еще одну порцию железа (169 мг, 3,0 ммоль), и продолжали нагревание в течение 1 ч при 105°C. Анализ методом LCMS обнаруживал завершение реакции. Смесь оставляли охлаждаться до к.т., а затем добавляли воду. Неочищенный 6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол собирали путем фильтрования в виде коричневато-зеленого твердого вещества (1,01 г). ЖХМС (ИЭР) m/z 421, 423 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((6-Бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (115 мг, 23%) получали в виде светло-желтого твердого вещества с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 4 этого примера, и заменяя 2-бром-6-((5,6-диметокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 2, продуктом этой реакции. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1H), 8,35 (с, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,73 (с, 1H), 7,29 (с, 2H), 5,39 (с, 2H), 4,75 (шир. с, 1H), 4,01 (с, 3H), 3,50 (шир. с, 2H), 2,04 (шир. с, 1H), 1,80-1,88 (м, 1H), 1,60 (шир. с, 2H), 1,22 (д, J=5,8 Гц, 4H). ЖХМС (ИЭР) m/z 488, 490 (M+H).
Пример 124
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила
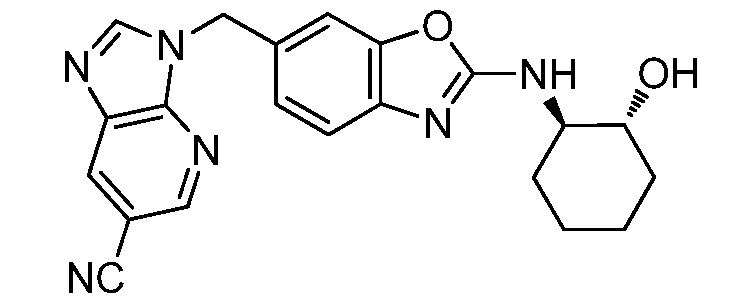
Стадия 1: Раствор 5-бромпиридин-2,3-диамина (3,0 г, 15,96 ммоль) и HCOOH (1,1 мл) в триэтоксиметане (48 мл) перемешивали при 90°C в течение 3 ч. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (40/1), с получением 6-бром-3H-имидазо[4,5-b]пиридина в виде светло-коричневого твердого вещества (2,74 г, 86,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1H), 8,44 (с, 1H), 8,30 (шир. с, 1H). ЖХМС (ИЭР) m/z 198 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-бром-3H-имидазо[4,5-b]пиридина (200 мг, 1,01 ммоль) в DMF (16 мл) при 0°C порциями добавляли NaH (60% дисперсия в минеральном масле, 581 мг, 1,44 ммоль). После перемешивания смеси в течение 30 мин, добавляли 6-(хлорметил)-2-(метилтио)бензо[d]оксазол (203 мг, 0,96 ммоль). Реакционную смесь оставляли нагреваться до к.т. и перемешиваться в течение 2 ч. Реакционную смесь вливали в воду (40 мл) и экстрагировали этилацетатом (4×60 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной TLC, элюируя DCM/MeOH (15/1), с получением 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (156 мг, 43,2%) в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1H), 8,22 (с, 1H), 8,04 (с, 1H), 7,56 (д, J=8,4 Гц, 1H), 7,40 (с, 1H), 7,26 (д, J=6,6 Гц, 1H), 5,53 (с, 2H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 374 (M+H)+.
Стадия 3: Смесь 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (522 мг, 1,39 ммоль) и m-CPBA (282 мг, 1,39 ммоль) в DCM (20 мл) перемешивали при 0°C в течение 5 ч. Реакционную смесь промывали водн. Na2S2O3 и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/1→1/5), с получением 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола в виде светло-желтого твердого вещества (400 мг, 73,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,48 (с, 1H), 8,40 (с, 1H), 7,68 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,34 (д, J=9,3 Гц, 1H), 5,60 (с, 2H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 390 (M+H)+.
Стадия 4: Смесь 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метил-сульфинил)бензо[d]оксазола (330 мг, 0,84 ммоль), (1R,2R)-2-аминоциклогексанола (192 мг, 1,27 мг) и DIEA (327 мг, 2,54 ммоль) в DMA (15 мл) перемешивали при 135°C в течение 1 ч. Реакционную смесь охлаждали до к.т., вливали в воду (100 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/6), с получением (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола в виде светло-желтого твердого вещества (373 мг, 100%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,48 (с, 1H), 8,38 (с, 1H), 7,79 (д, J=7,5 Гц, 1H), 7,38 (с, 1H), 7,13 (с, 1H), 5,48 (с, 2H), 4,68 (с, 3H), 3,37 (шир. с, 2H), 1,92 (шир. с, 2H), 1,62 (шир. с, 2H), 1,23 (шир. с, 4H). ЖХМС (ИЭР) m/z 441 (M+H)+.
Стадия 5: Смесь (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (276 мг, 0,62 ммоль), Zn(CN)2 (110 мг, 0,94 ммоль), Pd2(dba)3 (57 мг, 0,062 ммоль) и dppf (68,8 мг, 0,124 ммоль) в DMF (6 мл) перемешивали при 100°C в течение 2 ч. Реакционную смесь охлаждали до к.т., вливали в воду (100 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (15/1), с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила в виде светло-желтого твердого вещества (62 мг, 25,8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,85 (с, 1H), 8,83 (д, J=1,5 Гц, 1H), 8,70 (с, 1H), 7,81 (д, J=7,8 Гц, 1H), 7,41(с, 1H), 7,14 (м, 2H), 5,54 (с, 2H), 4,68 (д, J=4,8 Гц, 1H), 3,34 (шир. с, 2H), 1,91 (шир. с, 2H), 1,62 (шир. с, 2H), 1,22 (шир., 4H). ЖХМС (ИЭР) m/z 389 (M+H)+.
Пример 125
Получение (1R,2R)-2-((6-(имидазо[1,2-a]пиразин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола
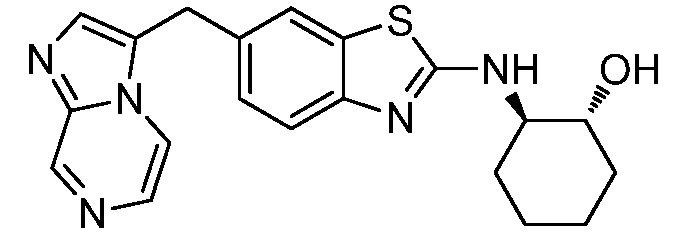
Стадия 1: Перемешиваемую смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (300 мг, 1,1 ммоль), полученного на стадии 4 примера 117, и пиразин-2-амина (210 мг, 2,2 ммоль) в 1-бутаноле (10 мл) нагревали с обратным холодильником в течение ночи. Смесь охлаждали до к.т., и добавляли воду (20 мл). Смесь экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-(имидазо[1,2-a]пиразин-3-илметил)-2-(метилтио)бензо[d]]тиазола в виде желтого твердого вещества (120 мг, 35%). 1H ЯМР (300 МГц, CDCl3) δ 9,10 (д, J=1,2 Гц, 1H), 7,83-7,80 (м, 2H), 7,72-7,68 (м, 2H), 7,50 (д, J=9,0 Гц, 1H), 7,23 (д, J=1,8 Гц, 1H), 4,38 (с, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 2: К раствору 6-(имидазо[1,2-a]пиразин-3-илметил)-2-(метилтио)бензо[d]тиазола (230 мг, 0,74 ммоль), полученного на предшествующей стадии, в DCM (14 мл) при 0°C добавляли m-CPBA (160 мг, 0,93 ммоль). Реакционную смесь перемешивали в течение 2 ч при 0°C, затем добавляли водн. Na2S2O3 (15 мл), и перемешивали смесь в течение 0,5 ч. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-(имидазо[1,2-a]пиразин-3-илметил)-2-(метилсульфинил)бензо[d]тиазола в виде желтого твердого вещества (200 мг, 83%). 1H ЯМР (300 МГц, CDCl3) δ 9,13 (д, J=1,5 Гц, 1H), 8,02 (д, J=8,7 Гц, 1H), 7,85-7,79 (м, 2H), 7,74-7,70 (м, 2H), 7,40 (дд, J=1,5, 8,4 Гц, 1H), 4,46 (с, 2H), 3,07 (с, 3H). ЖХМС (ИЭР) m/z 329 (M+H)+.
Стадия 3: Смесь 6-(имидазо[1,2-a]пиразин-3-илметил)-2-(метилсульфинил)бензо[d]тиазола (350 мг, 1,07 ммоль), (1R,2R)-2-аминоциклогексанола (324 мг, 2,14 ммоль) и DIEA (414 мг, 3,21 ммоль) в NMP (14 мл) перемешивали в течение 2 суток при 140°C. Смесь охлаждали до к.т., и добавляли воду (50 мл). Смесь экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→10/1), с получением 100 мг твердого вещества. Твердое вещество перекристаллизовывали из DCM/MeOH (10/1) с получением (1R,2R)-2-((6-(имидазо[1,2-a]пиразин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде белого твердого вещества (70 мг, 17%). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,03 (д, J=1,2 Гц, 1H), 8,33 (дд, J=1,8, 4,5 Гц, 1H), 7,88-7,85 (м, 2H), 7,68 (с, 1H), 7,54 (с, 1H), 7,27 (д, J=7,8 Гц, 1H), 7,11 (дд, J=1,5, 7,8 Гц, 1H), 4,71 (д, J=4,8 Гц, 1H), 4,35 (с, 2H), 3,52-3,49 (м, 1H), 3,39-3,36 (м, 1H), 2,05-2,01 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,30-1,16 (м, 4H). ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 126
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-3H-имидазо[4,5-b]пиридин-6-карбонитрила
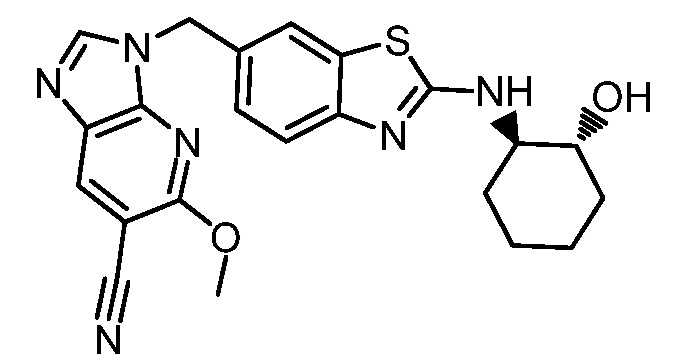
3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-5-метокси-3H-имидазо[4,5-b]пиридин-6-карбонитрил (55 мг, 69%) получали в виде светло-желтого твердого вещества с использованием методик, аналогичных описанным в примере 43, заменяя (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 43, (1R,2R)-2-((6-((6-бром-5-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным в примере 123. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,60 (д, J=6,6 Гц, 2H), 7,99 (д, J=7,3 Гц, 1H), 7,74 (с, 1H), 7,30 (с, 2H), 5,42 (с, 2H), 4,76 (шир. с, 1H), 4,07 (с, 3H), 3,51-3,70 (м, 2H), 1,97-2,14 (м, 1H), 1,86 (шир. с, 1H), 1,62 (д, J=4,5 Гц, 2H), 1,22 (д, J=5,5 Гц, 4H). ЖХМС (ИЭР) m/z 435 (M+H)+.
Пример 127
Получение (1R,2R)-2-((6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
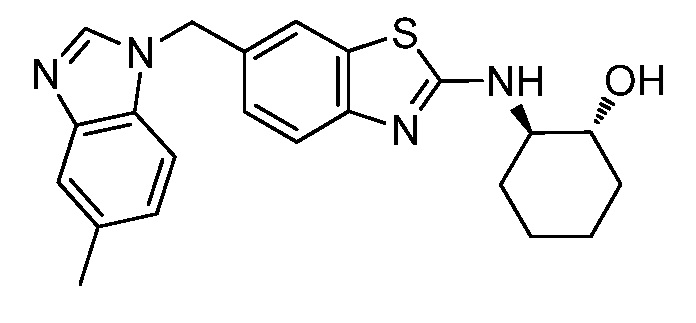
Стадия 1: К перемешиваемой смеси 4-метил-2-нитроанилина (1 г, 6,5 ммоль) в TFA (15 мл) при 0-5°C порциями добавляли триацетоксиборгидрид натрия (2,78 г, 13,2 ммоль) и перемешивали смесь в течение 10 мин. К реакционной смеси порциями добавляли 2-(метилтио)бензо[d]тиазол-6-карбальдегид (1,44 г, 6,9 ммоль), полученный на стадии 1 примера 100. После перемешивания при к.т. в течение 4 ч смесь вливали в воду со льдом и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали насыщенным водн. NaHCO3 (2×100 мл) и солевым раствором (100 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% EtOAc в петролейном эфире, с получением 4-метил-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (0,93 г, 41%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,37 (шир. с, 1H), 8,01 (с, 1H), 7,83 (д, J=8,4 Гц, 1H), 7,71 (с, 1H), 7,38 (дд, J=8,4, 2,4 Гц, 1H), 7,19 (дд, J=8,7, 2,1 Гц, 1H), 8,71 (д, J=8,7 Гц, 1H), 4,83 (д, J=6,0 Гц, 2H), 2,83 (с, 3H), 2,25 (с, 3H); ЖХМС (ИЭР) m/z 346 (M+H)+.
Стадия 2: Смесь 4-метил-N-((2-(метилтио)бензо[d]тиазол-6- ил)метил)-2-нитроанилина (0,93 г, 2,7 ммоль), полученного на предшествующей стадии, MeOH (50 мл) и палладия на активированном угле (100 мг) перемешивали под давлением водорода 1 атм при к.т. в течение 12 ч. Смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением 4-метил-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (0,70 г, 85%) в виде коричневого твердого вещества, которое дополнительно не очищали. ЖХМС (ИЭР) m/z 316 (M+H)+.
Стадия 3: Перемешиваемую смесь неочищенного 4-метил-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (0,7 г, 2,3 ммоль), муравьиной кислоты (0,5 мл) и триэтилортоформиата (5 мл) нагревали при 100°C в течение 1 ч. Реакционную смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением 6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,61 г, 85%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,94 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,62 (с, 1H), 7,49 (с, 1H), 7,26 (м, 1H), 7,14 (д, J=8,1 Гц, 1H), 7,07 (д, J=8,1 Гц, 1H), 5,43 (с, 2H), 2,77 (с, 3H), 2,47 (с, 3H); ЖХМС (ИЭР) m/z 326 (M+H)+.
Стадия 4: К перемешиваемому раствору 6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,61 г, 1,8 ммоль), полученного на предшествующей стадии, в DCM (20 мл) при 0°C добавляли раствор мета-хлорпербензойной кислоты (0,40 г, 1,57 ммоль) в DCM (3 мл). После перемешивания в течение 2 ч при 0°C, раствор разбавляли EtOAc (100 мл) и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (0,57 г, 89%) в виде желтого твердого вещества, которое дополнительно не очищали.
Стадия 5: Перемешиваемую смесь 6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (0,26 г, 0,76 ммоль), полученного на предшествующей стадии, (1R,2R)-2-аминоциклогексанола (0,26 г, 2,2 ммоль), DIEA (0,98 г, 7,6 ммоль) и NMP (2 мл) нагревали при 130°C в течение 12 ч. Реакционную смесь охлаждали до к.т., разбавляли EtOAc (30 мл) и промывали водой (2×10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением (1R,2R)-2-((6-((5-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (79 мг, 89%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,91 (д, J=7,5 Гц, 1H), 7,61 (д, J=2,0 Гц, 1H), 7,39-7,42 (м, 2H), 7,28 (д, J=8,1 Гц, 1H), 7,16 (дд, J=8,4, 1,8 Гц, 1H), 7,02 (д, J=7,2 Гц, 1H), 5,42 (с, 2H), 4,69 (д, J=5,1 Гц, 1H), 3,39 (м, 1H), 3,33 (м, 1H), 2,38 (с, 3H), 2,03 (м, 1H), 1,86 (м, 1H), 1,59-1,63 (м, 2H), 1,21-1,23 (м, 4H); ЖХМС (ИЭР) m/z 393 (M+H)+.
Пример 128
Получение (1R,2R)-2-((6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
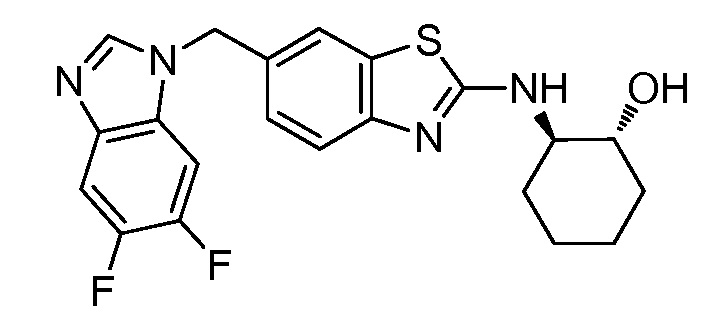
Стадия 1: Смесь 4,5-дифтор-2-нитроанилина (1,73 г, 10 ммоль), палладия на активированном угле (200 мг) и MeOH (50 мл) перемешивали в атмосфере водорода (1 атм) при к.т. в течение 12 ч. Смесь фильтровали для удаления катализатора, и концентрировали фильтрат в условиях пониженного давления с получением 4,5-дифторбензол-1,2-диамина (1,42 г, 97%) в виде коричневого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 6,50 (м, 2H), 2,75-3,48 (шир. с, 4H).
Стадия 2: Перемешиваемую смесь 4,5-дифторбензол-1,2-диамина (1,40 г, 9,7 ммоль), полученного на предшествующей стадии, муравьиной кислоты (2,0 мл) и триэтилортоформиата (20 мл) нагревали при 100°C в течение 1 ч. Реакционную смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в DCM, с получением 5,6-дифтор-1H-бензо[d]имидазола (1,12 г, 75%) в виде белого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,07 (с, 1H), 7,44 (м, 2H); ЖХМС (ИЭР) m/z 155 (M+H)+.
Стадия 3: К перемешиваемой смеси гидрида натрия (60% дисперсия в минеральном масле, 0,144 г, 3,0 ммоль) в безводном DMF (10 мл) при 0°C в атмосфере азота порциями добавляли 6- дифтор-1H-бензо[d]имидазол (0,475 г, 2,0 ммоль), полученный на предшествующей стадии. Смесь перемешивали при 0°C в течение 5 мин. К смеси по каплям добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (0,32 г, 2,0 ммоль), полученного на стадии 4 примера 36, в безводном DMF (2 мл). Реакционную смесь оставляли нагреваться до к.т. и перемешиваться в течение 1 ч. Смесь вливали в воду со льдом и экстрагировали EtOAc (2×100 мл). Объединенные органические слои дополнительно промывали водой (20 мл), а затем солевым раствором (20 мл). Органический слой отделяли и сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,55 г, 76%) в виде желтого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 7,97 (с, 1H), 7,84 (д, J=8,4 Гц, 1H), 7,59 (м, 1H), 7,50 (с, 1H), 7,24 (м, 1H), 7,02 (м, 1H), 5,40 (с, 2H), 2,78 (с, 3H); ЖХМС (ИЭР) m/z 348 (M+H)+.
Стадия 4: К перемешиваемому раствору 6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,55 г, 1,58 ммоль), полученного на предшествующей стадии, в DCM (20 мл) при 0°C добавляли раствор мета-хлорпербензойной кислоты (0,32 г, 1,58 ммоль) в DCM (3 мл). После перемешивания в течение 2 ч при 0°C, смесь разбавляли EtOAc (100 мл) и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2- (метилсульфинил)бензо[d]тиазола (0,50 г, 88%) в виде белого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 8,02-8,06 (м, 2H), 7,77 (с, 1H), 7,61 (м, 1H), 7,37 (дд, J=8,4, 1,5 Гц, 1H), 7,01 (м, 1H), 5,48 (с, 2H), 3,07 (с, 3H); ЖХМС (ИЭР) m/z 364 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (0,20 г, 0,55 ммоль), (1R,2R)-2-аминоциклогексанола (0,19 г, 1,6 ммоль), DIEA (0,71 г, 5,5 ммоль) и NMP (2 мл) нагревали при 130°C в течение 12 ч. Реакционную смесь охлаждали до к.т., разбавляли EtOAc (30 мл) и промывали водой (2×10 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением (1R,2R)-2-((6-((5,6-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (65 мг, 30%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,48 (с, 1H), 7,97 (д, J=7,5 Гц, 1H), 7,69-7,78 (м, 3H), 7,30 (д, J=8,1 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 5,44 (с, 2H), 4,74 (д, J=4,8 Гц, 1H), 3,51 (м, 1H), 3,42 (м, 1H), 2,00 (м, 1H), 1,87 (м, 1H), 1,58-1,60 (м, 2H), 1,15-1,25 (м, 4H); ЖХМС (ИЭР) m/z 415 (M+H)+.
Пример 129
(1R,2R)-2-((6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
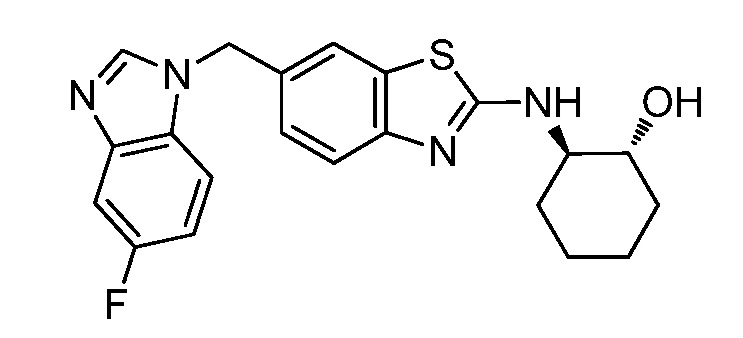
Стадия 1: 4-Фтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин (0,88 г, 66%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 4-фтор-2-нитроанилином. 1H ЯМР (300 МГц, CDCl3) δ 8,37 (шир. с, 1H), 8,01 (с, 1H), 7,92 (дд, J=9,0, 3,0 Гц, 1H), 7,85 (д, J=9,0 Гц, 1H), 7,37 (дд, J=8,4, 1,5 Гц, 1H), 7,17 (м, 1H), 6,75 (дд, J=9,6, 4,8 Гц, 1H), 4,64 (д, J=5,7 Гц, 2H), 3,78 (с, 3H); ЖХМС (ИЭР) m/z 350 (M+H)+.
Стадия 2: К перемешиваемой смеси 4-фтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (1,18 г, 3,3 ммоль), полученного на предшествующей стадии, уксусной кислоты (3 мл), MeOH (3 мл) и DCM (20 мл) при -10°C порциями добавляли цинковую пыль (1,7 г, 26 ммоль). Реакционную смесь перемешивали при -10°C в течение 0,5 ч. Смесь вливали в воду со льдом и экстрагировали EtOAc (3×100 мл). Объединенные органические слои последовательно промывали водой, насыщенным водн. NaHCO3 (2×100 мл) и солевым раствором (100 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-фтор-N1-((2- (метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (0,93 г, выход 87%) в виде желтого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 7,82 (д, J=8,4 Гц, 1H), 7,76 (с, 1H), 7,42 (дд, J=8,4, 1,8 Гц, 1H), 6,42-6,56 (м, 3H), 4,35 (с, 2H), 3,60 (шир. с, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 320 (M+H)+.
Стадия 3: Перемешиваемую смесь 4-фтор-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (0,93 г, 2,93 ммоль), полученного на предшествующей стадии, муравьиной кислоты (0,5 мл) и триэтилортоформиата (5 мл) нагревали при 100°C в течение 1 ч. Реакционную смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением 6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,64 г, 67%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,99 (с, 1H), 7,83 (д, J=8,1 Гц, 1H), 7,47-7,51 (м, 2H), 7,26 (м, 1H), 7,17 (м, 1H), 7,00 (дт, J=9,3, 2,4 Гц, 1H), 5,44 (с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 330 (M+H)+.
Стадия 4: К перемешиваемому раствору 6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (0,64 г, 1,9 ммоль), полученного на предшествующей стадии, в DCM (20 мл) при 0°C добавляли раствор мета-хлорпербензойной кислоты (0,472 г, 2,3 ммоль) в DCM (3 мл). Смесь перемешивали при 0°C в течение 2 ч. Раствор разбавляли EtOAc (100 мл) и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (0,63 г, 94%) в виде желтого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 8,02-8,05 (м, 2H), 7,78 (с, 1H), 7,51 (дд, J=9,6, 2,4 Гц, 1H), 7,38 (дд, J=8,4, 1,8 Гц, 1H), 7,20 (м, 1H), 7,00 (дт, J=9,0, 2,4 Гц, 1H), 5,52 (с, 2H), 3,07 (с, 3H); ЖХМС (ИЭР) m/z 346 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (0,20 г, 0,57 ммоль), полученного на предшествующей стадии, (1R,2R)-2-аминоциклогексанола (0,20 г, 1,7 ммоль), DIEA (0,73 г, 5,7 ммоль) и NMP (2 мл) нагревали при 130°C в течение 12 ч. Реакционную смесь охлаждали до к.т., разбавляли EtOAc (30 мл) и промывали водой (2×10 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением (1R,2R)-2-((6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (75 мг, 33%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1H), 7,93 (д, J=7,2 Гц, 1H), 7,65 (д, J=1,5 Гц, 1H), 7,56 (м, 1H), 7,43 (дд, J=9,6, 2,4 Гц, 1H), 7,28 (м, 1H), 7,19 (дд, J=8,4, 1,8 Гц, 1H), 7,08 (дт, J=9,6, 3,0 Гц, 1H), 5,46 (с, 2H), 4,69 (д, J=5,4 Гц, 1H), 3,51 (м, 1H), 3,37 (м, 1H), 2,01 (м, 1H), 1,87 (м, 1H), 1,59-1,63 (м, 2H), 1,15-1,23 (м, 4H); ЖХМС (ИЭР) m/z 397 (M+H)+.
Пример 130
Получение (1R,2R)-2-((6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
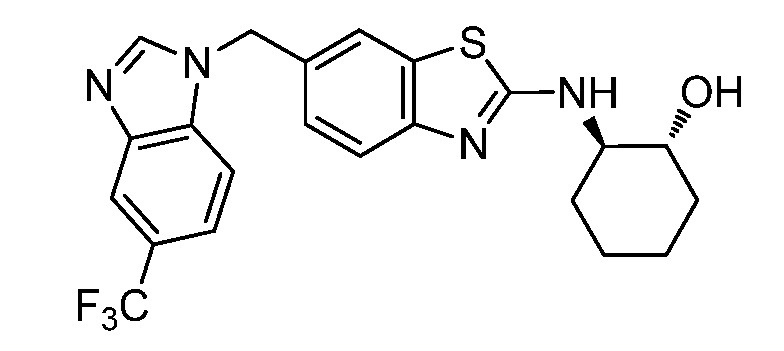
Стадия 1: N-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-(трифторметил)анилин (0,38 г, 49%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 2-нитро-4-(трифторметил)анилином. 1H ЯМР (300 МГц, CDCl3) δ 8,64 (шир. с, 1H), 8,50 (с, 1H), 7,87 (д, J=8,4 Гц, 1H), 7,71 (с, 1H), 7,56 (дд, J=9,0, 2,1 Гц, 1H), 7,38 (дд, J=8,4, 1,8 Гц, 1H), 6,90 (д, J=9,0 Гц, 1H), 4,69 (д, J=5,7 Гц, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 400 (M+H)+.
Стадия 2: Смесь N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-трифторметил)анилина (0,38 г, 2,0 ммоль), полученного на предшествующей стадии, MeOH (30 мл) и палладия на активированном угле (50 мг) перемешивали в атмосфере водорода (1 атм) при к.т. в течение 12 ч. Смесь фильтровали для удаления катализотора, и концентрировали фильтрат в условиях пониженного давления с получением N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамина (0,32 г, 91%) в виде коричневого твердого вещества, которое дополнительно не очищали. ЖХМС (ИЭР) m/z 370 (M+H)+.
Стадия 3: Перемешиваемую смесь N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамина (0,32 г, 0,86 ммоль), полученного на предшествующей стадии, муравьиной кислоты (0,5 мл) и триэтилортоформиата (5 мл) нагревали при 100°C в течение 1 ч. Реакционную смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (0,22 г, 69%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,12 (с, 1H), 8,08 (с, 1H), 7,84 (д, J=8,4 Гц, 1H), 7,48-7,54 (м, 2H), 7,36 (д, J=8,4 Гц, 1H), 7,26 (м, 1H), 5,49 (с, 2H), 2,78 (с, 3H); ЖХМС (ИЭР) m/z 380 (M+H)+.
Стадия 4: К перемешиваемому раствору 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (0,22 г, 0,58 ммоль), полученного на предшествующей стадии, в DCM (20 мл) при 0°C добавляли раствор мета-хлорпербензойной кислоты (0,30 г, 1,5 ммоль) в DCM (3 мл). Смесь перемешивали при 0°C в течение 2 ч. Смесь разбавляли EtOAc (100 мл) и последовательно промывали насыщенным водн. Na2S2O3, насыщенным водн. NaHCO3 и солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (0,22 г, 96%) в виде желтого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 8,12-8,14 (м, 2H), 8,05 (д, J=8,4 Гц, 1H), 7,79 (с, 1H), 7,50 (дд, J=8,7, 1,2 Гц, 1H), 7,37 (т, J=8,4 Гц, 2H), 5,57 (с, 2H), 3,06 (с, 3H); ЖХМС (ИЭР) m/z 396 (M+H)+.
Стадия 5: Перемешиваемую смесь 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазола (0,20 г, 0,50 ммоль), полученного на предшествующей стадии, (1R,2R)-2-аминоциклогексанола (0,17 г, 1,5 ммоль), DIEA (0,59 г, 4,6 ммоль) и NMP (2 мл) нагревали при 130°C в течение 12 ч. Реакционную смесь охлаждали до к.т., разбавляли EtOAc (30 мл) и промывали водой (2×10 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 3% MeOH в DCM, с получением (1R,2R)-2-((6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (54 мг, 23%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,02 (с, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,79 (д, J=8,7 Гц, 1H), 7,67 (д, J=1,2 Гц, 1H), 7,54 (д, J=8,7 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 5,54 (с, 2H), 4,71 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,39 (м, 1H), 2,01 (м, 1H), 1,80 (м, 1H), 1,59-1,62 (м, 2H), 1,17-1,23 (м, 4H); ЖХМС (ИЭР) m/z 447 (M+H)+.
Пример 131
Получение (1R,2R)-2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола
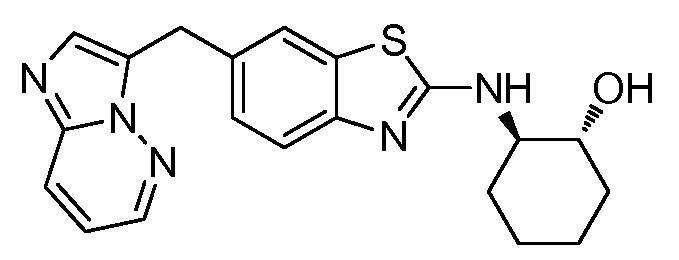
Стадия 1: Перемешиваемую смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (500 мг, 1,8 ммоль), полученного на стадии 4 примера 117, и пиридазин-3-амина (350 мг, 3,6 ммоль) в 1-бутаноле (20 мл) нагревали при кипячении с обратным холодильником в течение 15 ч. Смесь охлаждали до к.т., и добавляли воду (40 мл). Смесь экстрагировали EtOAc (3×20 мл), и промывали объединенные органические слои солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2→5% MeOH в DCM, с получением 6-(имидазо[1,2-b]пиридазин-3-илметил)-2-(метилтио)бензо[d]тиазола (460 мг, 80%) в виде светло-коричневого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,32 (дд, J=4,5, 1,5 Гц, 1H), 7,94 (дд, J=9,3, 1,5 Гц, 1H), 7,79 (д, J=8,7 Гц, 1H), 7,66 (с, 1H), 7,58 (с, 1H), 7,36 (дд, J=8,4, 1,8 Гц, 1H), 7,02 (м, 1H), 4,45 (с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 313 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-(имидазо[1,2-b]пиридазин-3-илметил)-2-(метилтио)бензо[d]тиазола (350 мг, 1,1 ммоль), полученного на предшествующей стадии, в DCM (30 мл) при 0°C добавляли мета-хлорпербензойную кислоту (194 мг, 1,1 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч. К смеси добавляли насыщенный водн. Na2S2O3 (15 мл) и перемешивали смесь еще в течение 0,5 ч. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2→5% MeOH в DCM, с получением 6-(имидазо[1,2-b]пиридазин-3-илметил)-2-(метилсульфинил)бензо[d]тиазола (320 мг, 87%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,33 (дд, J=4,5, 1,5 Гц, 1H), 7,91-8,00 (м, 3H), 7,62 (с, 1H), 7,54 (дд, J=8,4, 1,8 Гц, 1H), 7,03 (м, 1H), 4,52 (с, 2H), 3,05 (с, 3H); ЖХМС (ИЭР) m/z 329 (M+H)+.
Стадия 3: Перемешиваемую смесь 6-(имидазо[1,2-b]пиридазин-3-илметил)-2-(метилсульфинил)бензо[d]тиазола (260 мг, 0,79 ммоль), полученного на предшествующей стадии, гидрохлорида (1R,2R)-2-аминоциклогексанола (360 мг, 2,38 ммоль), DIEA (408 мг, 3,16 ммоль) и NMP (10 мл) нагревали при 140°C в течение 48 ч. Смесь охлаждали до к.т. и добавляли воду (50 мл). Смесь экстрагировали EtOAc (3×30 мл) и промывали объединенные органические слои солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2→10% MeOH в DCM, с получением твердого вещества. Твердое вещество дополнительно очищали путем перекристаллизации из смси DCM/MeOH (10/1) с получением (1R,2R)-2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола (80 мг, 27%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,53 (дд, J=4,5, 1,5 Гц, 1H), 8,10 (дд, J=9,3, 1,5 Гц, 1H), 7,83 (д, J=7,8 Гц, 1H), 7,60 (с, 1H), 7,53 (с, 1H), 7,25 (д, J=8,7 Гц, 1H), 7,19 (м, 1H), 7,12 (дд, J=8,4, 1,8 Гц, 1H), 4,71 (д, J=4,8 Гц, 1H), 4,32 (с, 2H), 3,51 (м, 1H), 3,38 (м, 1H), 2,04 (м, 1H), 1,88 (м, 1H), 1,59-1,65 (м, 2H), 1,16-1,30 (м, 4H); ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 132
Получение (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
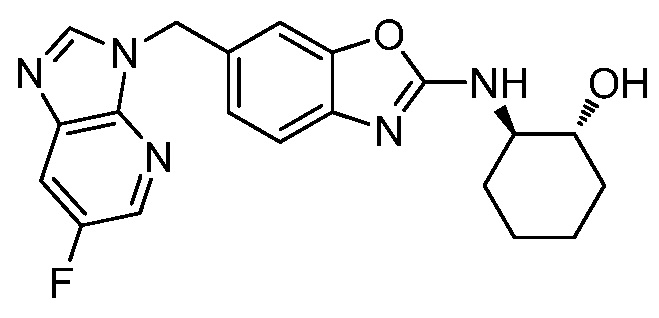
Стадия 1: К перемешиваемому раствору 6-фтор-3H-имидазо[4,5-b]пиридина (502 мг, 3,66 ммоль), полученного на стадии 2 примера 70, в безводном DMF (10 мл) при 0°C одной порцией добавляли гидрид натрия (60% дисперсия в минеральном масле, 220 мг, 5,49 ммоль), и перемешивали смесь при 0°C в течение 30 мин. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]оксазола (858 мг, 4,03 ммоль), полученного на стадии 3 примера 56, в DMF (2 мл). Смесь оставляли нагреваться до к.т. и перемешиваться еще в течение 3 ч. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом (3×100 мл). Объединенные органические слои последовательно промывали водой и солевым раствором, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 30→50% этилацетатом в петролейном эфире, с получением 6-((6-фтор-3H- имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (698 мг, 61%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (300 МГц, ДМСО-d6): δ 8,71 (с, 1H), 8,41 (с, 1H), 8,07 (д, J=6, 9 Гц, 1H), 7,68 (с, 1H), 7,58 (д, J=7,8 Гц, 1H), 7,35 (д, J=6,3 Гц, 1H), 5,59 (с, 2H), 2,73 (с, 3H); ЖХМС (ИЭР) m/z 315 (M+H)+.
Стадия 2: К перемешиваемому раствору 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]оксазола (595 мг, 1,89 ммоль), полученного на предшествующей стадии, в DCM (10 мл) при 0°C добавляли 70% мета-хлорпербензойную кислоту (425 мг, 2,46 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч. Реакционную смесь последовательно промывали водн. сульфитом натрия и солевым раствором. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 50% этилацетатом в петролейном эфире, с получением 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (509 мг, 82%). 1H ЯМР (300 МГц, ДМСО-d6): δ 8,73 (с, 1H), 8,40 (с, 2H), 7,53 (д, J=7,2 Гц, 1H), 7,37 (с, 1H), 7,15 (д, J=4,5 Гц, 1H), 5,69 (с, 2H), 3,18 (с, 3H); ЖХМС (ИЭР) m/z 331 (M+H)+.
Стадия 3: Перемешиваемую смесь 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (220 мг, 0,67 ммоль), полученного на предшествующей стадии, (1R,2R)- 2-аминоциклогексанола (152 мг, 1 ммоль) и DIEA (259 мг, 2,01 ммоль) в DMA (5 мл) нагревали при 135°C в течение 2 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои последовательно промывали водой и солевым раствором. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали в условиях пониженного давления. Остаток сразу очищали методом препаративной HPLC с обращенной фазой с получением (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (68 мг, 27%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6): δ 8,67 (с, 1H), 8,41 (м, 1H), 8,06 (м, 1H), 7,79 (м, 1H), 7,39 (с, 1H), 7,13-7,15 (м, 2H), 5,48 (с, 2H), 4,67 (д, J=3,9 Гц, 1H), 3,30-3,35 (м, 2H), 1,86-1,95 (м, 2H), 1,60-1,65 (м, 2H), 1,15-1,35 (м, 4H); ЖХМС (ИЭР) m/z 382 (M+H)+.
Пример 133
Получение ((1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
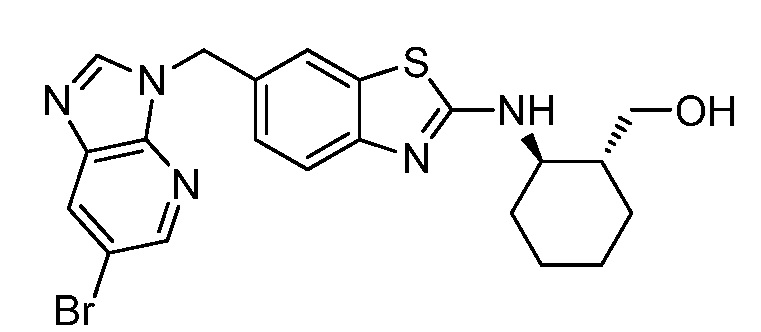
Стадия 1: К перемешиваемому раствору (1R,2R)-2-аминоциклогексанкарбоновой кислоты (500 мг, 3,49 ммоль) в безводном THF (3 мл) при 0°C по каплям добавляли раствор LAH (2M раствор в THF, 7 мл, 13,99 ммоль). Реакционный сосуд герметизировали и перемешивали смесь при 85°C в течение 24 ч. Смесь охлаждали до 0°C и разбавляли THF (6 мл). К реакционной смеси последовательно добавляли воду (0,5 мл), 1M водн. NaOH (0,5 мл) и воду (1,5 мл). К смеси добавляли MgSO4 и перемешивали смесь при к.т. в течение 10 мин. Смесь затем разбавляли THF (10 мл) и фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением ((1R,2R)-2-аминоциклогексил)метанола (326 мг, 70%) в виде масла. 1H ЯМР (300 МГц, ДМСО-d6) δ 3,27-3,52 (м, 3H), 2,29 (дт, J=10,1, 4,0Гц, 1H), 1,53-1,78 (м, 4H), 0,98-1,21 (м, 4H), 0,87 (м, 1H).
Стадия 2: ((1R,2R)-2-((6-((6-Бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол (18 мг, 18%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 70, заменяя 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 70, 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 примера 29, и заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 70, ((1R,2R)-2-аминоциклогексил)метанолом, полученным на стадии 1 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,39 (д, J=2,0 Гц, 1H), 8,00 (д, J=8,4 Гц, 1H), 7,65 (д, J=1,0 Гц, 1H), 7,28 (м, 1H), 7,22 (м, 1H), 5,47 (с, 2H), 4,46 (т, J=5,4 Гц, 1H), 3,55 (шир. м, 1H), 3,41 (м, 1H), 3,30 (м, 1H), 1,98 (д, J=8,9 Гц, 1H), 1,83 (д, J=10,8 Гц, 1H), 1,62-1,73 (м, 2H), 1,37 (м, 1H), 1,12-1,29 (м, 4H). ЖХМС (ИЭР) m/z 472, 474 (M+H)+.
Пример 134
Получение (1R,2R)-2-((6-((6-(1-метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
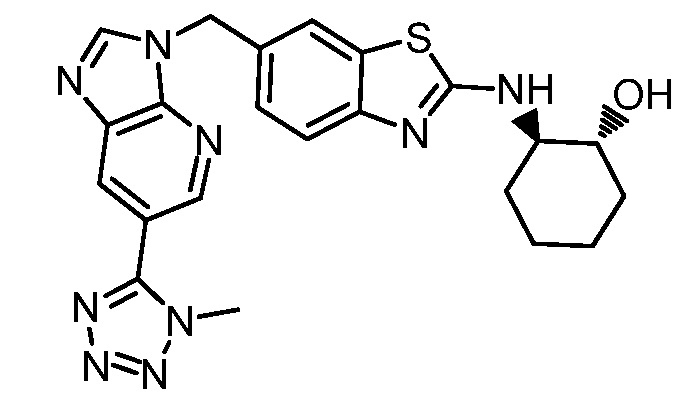
(1R,2R)-2-((6-((6-(1-Метил-1H-тетразол-5-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (30 мг, 10%) получали в виде минорного продукта реакции, описанной в примере 94. Региохимическое расположение соответствовало данным ЯМР-спектроскопии ядрного эффекта Оверхаузера (NOE). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,76-8,84 (м, 2H), 8,60 (д, J=2,0 Гц, 1H), 8,00 (д, J=7,4 Гц, 1H), 7,71 (с, 1H), 7,67 (д, J=19,7 Гц, 1H), 7,28-7,35 (м, 2H), 7,20-7,28 (м, 2H), 5,56 (с, 3H), 4,77 (шир. с, 1H), 3,50 (шир. с, 2H), 2,03 (д, J=11,8 Гц, 1H), 1,87 (д, J=11,3 Гц, 1H), 1,52-1,69 (м, 2H), 1,08-1,34 (м, 4H). ЖХМС (ИЭР) m/z 462 (M+H)+.
Пример 135
Получение (1R,2R)-2-((6-((7-(2-гидроксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
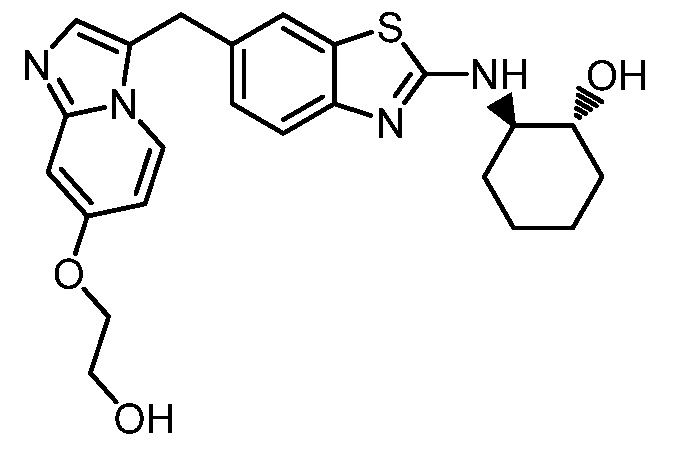
К перемешиваемому раствору (1R,2R)-2-((6-((7-(2-метоксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (45 мг, 0,099 ммоль), полученного в примере 153, в 2 мл DCM при -10°C добавляли BBr3 в DCM (1,0 M, 110 мкл, 0,11 ммоль). Полученную смесь перемешивали при к.т. в течение 30 мин, после чего ее охлаждали до -10°C и добавляли дополнительное количество BBr3 в DCM (1,0 M, 100 мкл, 0,10 ммоль). После перемешивания при к.т. в течение ночи, добавляли BBr3 в DCM (1,0 M, 100 мкл, 0,10 ммоль) и продолжали перемешивание в течение 1 суток. Полученную смесь гасили добавлением MeOH и очищали смесь методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((7-(2-гидроксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (16 мг, 37%). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,00 (д, J=7,9 Гц, 1H), 7,91 (д, J=7,4 Гц, 1H), 7,49 (с, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,22 (с, 1H), 7,06 (д, J=8,4 Гц, 1H), 6,90 (д, J=2,0 Гц, 1H), 6,57 (дд, J=2,5, 7,4 Гц, 1H), 4,79 (шир. с, 1H), 4,22 (с, 2H), 4,02 (т, J=4,7 Гц, 2H), 3,72 (т, J=4,7 Гц, 2H), 3,50 (шир. с, 2H), 2,04 (д, J=12,8 Гц, 1H), 1,87 (д, J=11,3 Гц, 1H), 1,54-1,68 (м, 2H), 1,10-1,37 (м, 4H). ЖХМС (ИЭР) m/z 439 (M+H)+.
Пример 136
Получение ((1S,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
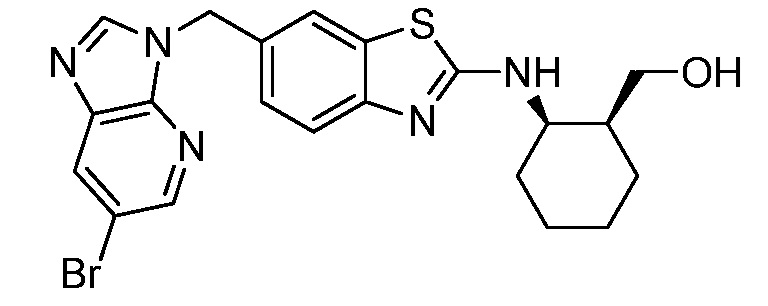
Стадия 1: ((1S,2R)-2-Аминоциклогексил)метанол (460 мг, 64%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 133, заменяя (1R,2R)-2-аминоциклогексанкарбоновую кислоту, использованную в примере 133, гидрохлоридом (1S,2R)-2-аминоциклогексанкарбоновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ 3,40 (м, 1H), 3,28 (дд, J=10,6, 6,2 Гц, 1H), 3,04 (кв., J=3,4 Гц, 1H), 1,44-1,58 (м, 5H), 1,23-1,43 (м, 6H), 1,17 (м, 1H).
Стадия 2: ((1S,2R)-2-((6-((6-Бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол (7 мг, 19%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 70, заменяя 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 70, 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 примера 29, и заменяя (1R,2R)-2-аминоциклогексанол, использованный в примере 70, ((1S,2R)-2-аминоциклогексил)метанолом, полученным на стадии 1 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,39 (д, J=2,0 Гц, 1H), 7,92 (д, J=8,4 Гц, 1H), 7,65 (д, J=1,0 Гц, 1H), 7,28 (м, 1H), 7,23 (м, 1H), 5,48 (с, 2H), 4,61 (шир. с, 1H), 4,23 (шир. с, 1H), 3,27 (м, 1H), 3,21 (м, 1H), 1,81 (м, 1H), 1,74 (м, 1H), 1,63 (м, 1H), 1,39-1,52 (м, 4H), 1,21-1,37 (м, 2H); ЖХМС (ИЭР) m/z 472, 474 (M+H)+.
Пример 137
Получение (1R,2R)-2-((6-((5,6-дихлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
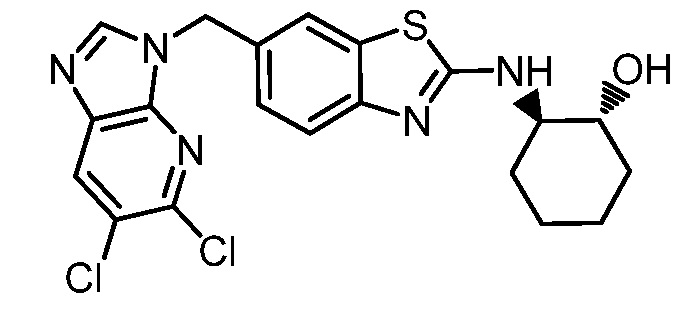
Стадия 1: 5,6-Дихлор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин (105 мг) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 23, заменяя 2-хлор-6-метокси-3-нитропиридин, использованный в примере 23, 2,3,6-трихлор-5-нитропиридином. ЖХМС (ИЭР) m/z 401, 403, 405 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((5,6-Дихлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (35 мг, 31%) получали с использованием методик, аналогичных описанным на стадии 6-9 примера 23, заменяя 6-метокси-N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин, использованный на стадии 6 примера 23, 5,6-дихлор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на стадии 1 этого примера, и проводя аналогичные замены на последующих стадиях. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,69 (с, 1H), 8,52 (с, 1H), 7,98 (д, J=7,9 Гц, 1H), 7,63 (с, 1H), 7,30 (д, J=8,4 Гц, 1H), 7,19 (д, J=7,9 Гц, 1H), 5,45 (с, 2H), 4,74 (шир. с, 1H), 3,51 (шир. с, 1H), 2,03 (д, J=11,8 Гц, 1H), 1,86 (шир. с, 1H), 1,52-1,69 (м, 2H), 1,06-1,34 (м, 4H). ЖХМС (ИЭР) m/z 448, 450, 452 (M+H)+.
Пример 138
Получение (1R,2R)-2-((6-((5-этокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
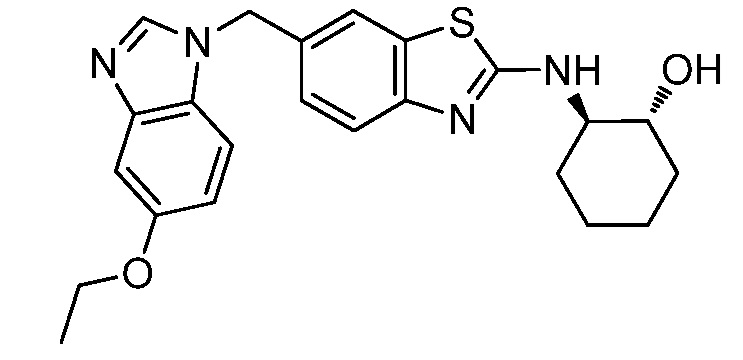
Смесь 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (80 мг, 0,20 ммоль), полученного в примере 147, йодэтана (47 мг, 0,30 ммоль) и Cs2CO3 (196 мг, 0,6 ммоль) в NMP (3,5 мл) перемешивали при к.т. в течение 5 ч. Смесь добавляли к воде и экстрагировали DCM. Органический слой отделяли, последовательно промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с получением (1R,2R)-2-((6-((5-этокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (35 мг, 42%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,96 (д, J=7,5 Гц, 1H), 7,62 (с, 1H), 7,39 (д, J=9,0 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,14-7,19 (м, 2H), 6,82 (д, J=9,0 Гц, 1H), 5,41 (с, 2H), 4,72 (д, J=4,8 Гц, 1H), 3,97-4,04 (м, 2H), 3,43-3,54 (м, 2H), 2,03 (м, 1H), 1,87 (м, 1H), 1,60-1,65 (шир. м, 2H), 1,32 (т, J=13,8 Гц, 3H), 1,15-1,24 (м, 4H). ЖХМС (ИЭР) m/z 423 (M+H)+.
Пример 139
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5,6-дикарбонитрила
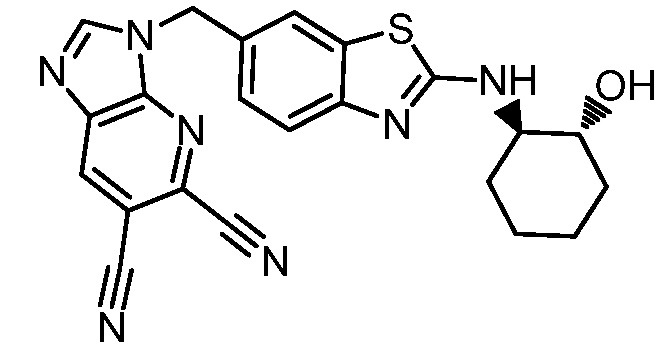
3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-5,6-дикарбонитрил получали в виде белого порошка (7 мг, 21%) с использованием методик, аналогичных описанным в примере 43, заменяя (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 43, (1R,2R)-2-((6-((5,6-дихлор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным в примере 137. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,10 (с, 1H), 9,03 (с, 1H), 8,08 (д, J=7,4 Гц, 1H), 7,66 (с, 1H), 7,27-7,36 (м, 1H), 7,24 (д, J=8,4 Гц, 1H), 5,56 (с, 2H), 4,84 (шир. с, 1H), 3,46-3,64 (м, 2H), 2,03 (д, J=11,8 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,51-1,70 (м, 2H), 1,08-1,39 (м, 4H). ЖХМС (ИЭР) m/z 430 (M+H)+.
Пример 140
Получение 3-((2-(((1R,2R)-2-(гидроксиметил)циклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила
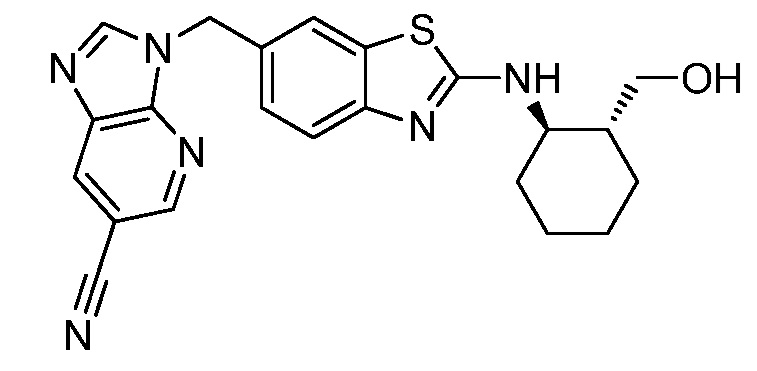
3-((2-(((1R,2R)-2-(Гидроксиметил)циклогексил)амино)бензо[d]тиазол-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрил получали в виде твердого вещества (18 мг, 19%) с использованием методики, аналогичной описанной в примере 43, заменяя (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 43, ((1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанолом, полученным в примере 133. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,84 (с, 1H), 8,82 (д, J=1,5 Гц, 1H), 8,72 (д, J=1,5 Гц, 1H), 8,01 (д, J=8,4 Гц, 1H), 7,67 (с, 1H), 7,28 (м, 1H), 7,24 (м, 1H), 5,53 (с, 2H), 4,46 (шир. м, 1H), 3,55 (шир. м, 1H), 3,41 (д, J=9,8 Гц, 1H), 3,30 (м, 1H), 1,98 (м, 1H), 1,83 (д, J=10,8 Гц, 1H), 1,62-1,73 (м, 2H), 1,37 (м, 1H), 1,17-1,27 (м, 4H); ЖХМС (ИЭР) m/z 419 (M+H)+.
Пример 141
Получение (1R,2R)-2-((6-((6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
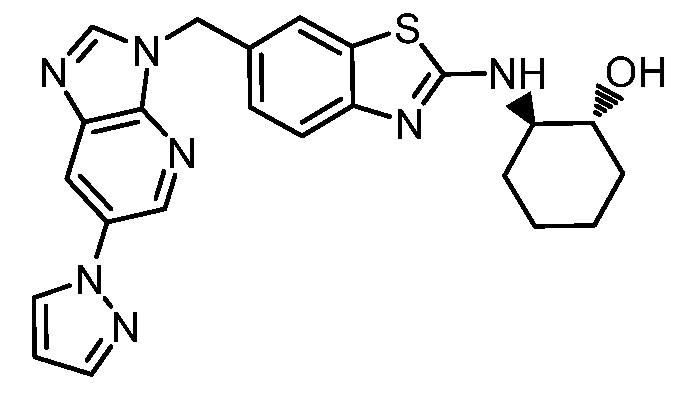
К перемешиваемому раствору CuI (14 мг, 0,0053 ммоль), K2CO3 (102 мг, 0,74 ммоль) и пиразола (30 мг, 0,44 ммоль) в 2 мл DMF в атмосфере аргона добавляли (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (150 мг, 0,30 ммоль), полученный на стадии 2 примера 96, и транс-N1,N2-диметилциклогексан-1,2-диамин (21 мг, 0,15 ммоль). Реакционную смесь затем нагревали при 110°C в течение ночи. Смесь охлаждали до к.т., разбавляли MeOH и очищали методом препаративной HPLC с использованием смеси воды (5% CH3CN, 0,05% AcOH) и CH3CN (0,05% AcOH) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (85 мг, 64%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,92 (д, J=2,0 Гц, 1H), 8,69 (с, 1H), 8,57 (д, J=2,5 Гц, 1H), 8,50 (д, J=2,5 Гц, 1H), 7,96 (д, J=7,4 Гц, 1H), 7,79 (с, 1H), 7,68 (с, 1H), 7,29 (с, 1H), 7,20-7,27 (м, 1H), 6,58 (с, 1H), 5,52 (с, 2H), 4,74 (шир. с, 1H), 3,51 (шир. с, 1H), 2,03 (д, J=12,3 Гц, 1H), 1,80-1,95 (м, 1H), 1,52-1,72 (м, 2H), 1,08- 1,33 (м, 4H). ЖХМС (ИЭР) m/z 446 (M+H)+.
Пример 142
Получение (1R,2R)-2-((6-(имидазо[1,2-b]пиридазин-3-илметил)бензо[d]оксазол-2-ил)амино)циклогексанола
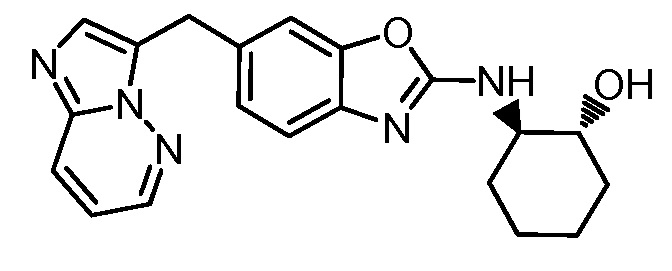
Стадия 1: Смесь 6-йодбензо[d]оксазол-2(3H)-она (3,2 г, 12,3 ммоль) в 30 мл толуола нагревали с реагентом Лавессона (2,7 г, 6,7 ммоль) при 100°C в течение 4 ч. Затем растворитель удаляли в условиях пониженного давления, остаток охлаждали до к.т. и растворяли в 20 мл DMF. К смеси добавляли K2CO3 (8,4 г, 61,2 ммоль) и йодметан (2,27 мл, 36,7 ммоль). Полученную смесь перемешивали при к.т. в течение ночи и нагревали при 55°C в течение 1 ч. После охлаждения до к.т. реакционную смесь распределяли между EtOAc и водой, органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле, элюируя 0-25% EtOAc в гексанах, с получением 6-йод-2-(метилтио)бензо[d]оксазола в виде белого твердого вещества (1,5 г, 42%). ЖХМС (ИЭР) m/z 292 (M+H)+.
Стадия 2: Неочищенный 2-хлор-3-(2-(метилтио)бензо[d]оксазол-6-ил)пропаналь (120 мг) получали с использованием методик, аналогичных описанным на стадиях 3-4 примера 117, заменяя 6-йод-2-(метилтио)бензо[d]тиазол, использованный на стадии 3 примера 117, 6-йод-2-(метилтио)бензо[d]оксазолом, полученным на стадии 1 этого примера, и проводя аналогичную замену на стадии 4 примера 117. ЖХМС (ИЭР) m/z 256, 258 (M+H)+.
Стадия 3: (1R,2R)-2-((6-(Имидазо[1,2-b]пиридазин-3-илметил)бензо[d]оксазол-2-ил)амино)циклогексанол (20 мг) получали в виде рыжеватого твердого вещества с использованием методик, аналогичных описанным на стадиях 1 - 3 примера 131, заменяя 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный на стадии 1 примера 131, 2-хлор-3-(2-(метилтио)бензо[d]оксазол-6-ил)пропаналем, полученным на стадии 2 этого примера, и проводя аналогичные замены на стадиях 2 и 3 примера 131. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,53 (д, J=3,0 Гц, 1H), 8,09 (д, J=9,4 Гц, 1H), 7,74 (д, J=7,4 Гц, 1H), 7,58 (с, 1H), 7,25 (с, 1H), 7,19 (дд, J=4,4, 8,9 Гц, 1H), 7,06-7,13 (м, 1H), 7,03 (д, J=7,9 Гц, 1H), 4,74 (шир. с, 1H), 4,33 (с, 2H), 1,96 (д, J=9,4 Гц, 1H), 1,88 (д, J=10,3 Гц, 1H), 1,63 (шир. с, 2H), 1,23 (д, J=6,4 Гц, 4H). ЖХМС (ИЭР) m/z 364 (M+H)+.
Пример 143
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метилимидазо[1,2-b]пиридазин-6-карбоксамида
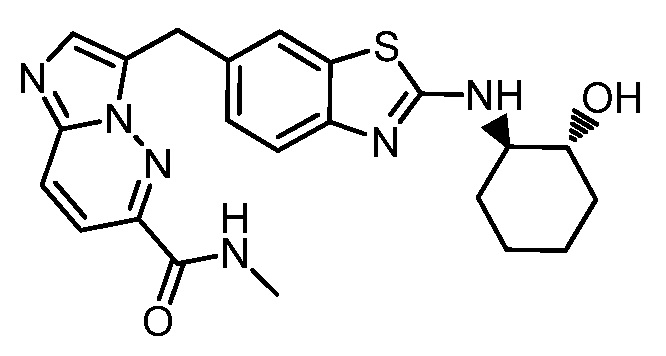
Стадия 1: Этил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбоксилат (272 мг, 54%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил, использованный в примере 117, этил-6-аминопиридазин-3-карбоксилатом. ЖХМС (ИЭР) m/z 385 (M+H)+.
Стадия 2: Этил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбоксилат (115 мг, 0,3 ммоль) нагревали с 2 мл 2,0 M NH2Me в THF при 85°C в герметизированной пробирке в течение 1 ч, при 100°C в течение 1 ч, а затем при 110°C в течение ночи. Анализ методом LCMS обнаруживал завершение реакции. Растворитель выпаривали в условиях пониженного давления и сушили остаток в вакуумной печи с получением N-метил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбоксамида, который использовали непосредственно на следующей стадии. ЖХМС (ИЭР) m/z 370 (M+H)+.
Стадия 3: 3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метилимидазо[1,2-b]пиридазин-6-карбоксамид (55 мг, 42%) получали в виде рыжеватого твердого вещества с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, N-метил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбоксамидом, полученным на стадии 2 этого примера, и проводя аналогичную замену на стадии 5 примера 2. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,83 (д, J=4,9 Гц, 1H), 8,20 (д, J=9,4 Гц, 2H), 7,88 (д, J=7,9 Гц, 1H), 7,60-7,71 (м, 3H), 7,24-7,32 (м, 1H), 7,15-7,24 (м, 1H), 4,76 (шир. с, 1H), 4,44 (с, 2H), 3,51 (шир. с, 1H), 2,89 (д, J=4,4 Гц, 3H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=11,3 Гц, 1H), 1,53-1,72 (м, 2H), 1,09-1,40 (м, 4H). ЖХМС (ИЭР) m/z 437 (M+H)+.
Пример 144
Получение (1R,2R)-2-((6-((6-(гидроксиметил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
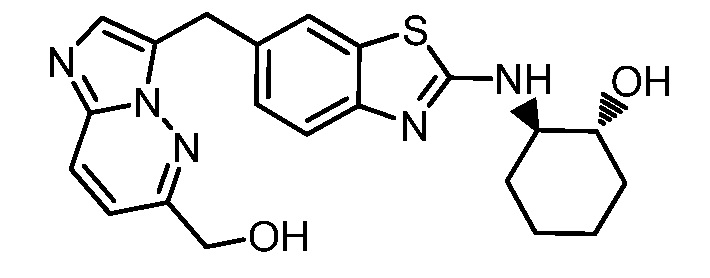
Стадия 1: (3-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-ил)метанол (48 мг, 34%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 2, заменяя этил-2-бромбензо[d]тиазол-6-карбоксилат, использованный в примере 2, этил-3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбоксилатом, полученным на стадии 1 примера 143. ЖХМС (ИЭР) m/z 343 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((6-(Гидроксиметил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (15 мг, 26%) получали в виде желтого порошка с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, (3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-ил)метанолом, полученным на стадии 1 этого примера, и проводя аналогичную замену на стадии 5 примера 2. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,07 (д, J=9,4 Гц, 1H), 7,91 (д, J=7,4 Гц, 1H), 7,55 (с, 1H), 7,50 (с, 1H), 7,21-7,30 (м, 2H), 7,13 (д, J=8,4 Гц, 1H), 4,79 (шир. с, 1H), 4,60 (с, 2H), 4,28 (с, 2H), 3,50 (шир. с, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,52-1,70 (м, 2H), 1,06-1,36 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 145
Получение (1R,2R)-2-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
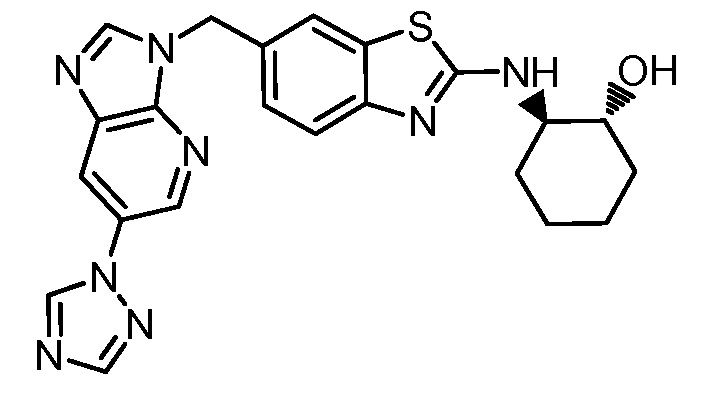
(1R,2R)-2-((6-((6-(1H-1,2,4-Триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (48 мг, 45%) получали в виде желтого порошка с использованием методики, аналогичной описанной в примере 141, заменяя пиразол, использованный в примере 141, 1,2,4-триазолом. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,30 (с, 1H), 8,89 (д, J=2,0 Гц, 1H), 8,76 (с, 1H), 8,56 (д, J=2,0 Гц, 1H), 8,29 (с, 1H), 7,99 (д, J=7,4 Гц, 1H), 7,69 (с, 1H), 7,28-7,34 (м, 1H), 7,17-7,26 (м, 1H), 5,54 (с, 2H), 4,76 (шир. с, 1H), 3,47-3,60 (м, 2H), 2,03 (д, J=11,8 Гц, 1H), 1,86 (м, 1H), 1,52-1,70 (м, 2H), 1,10-1,34 (м, 4H). ЖХМС (ИЭР) m/z 447 (M+H)+.
Пример 146
Получение (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
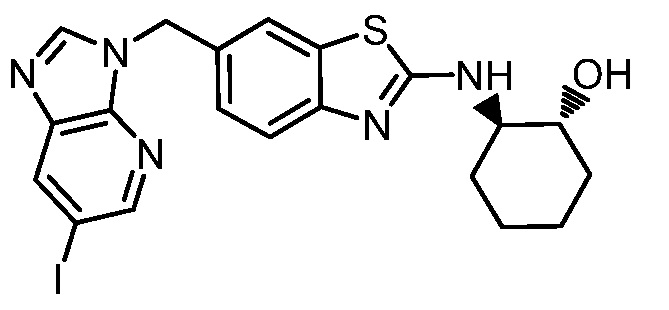
(1R,2R)-2-((6-((6-Йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол получали в виде не совсем белого твердого вещества с использованием методик, аналогичных описанным на стадиях 4-5 примера 3, а затем на стадии 5 примера 2, заменяя 3H-имидазо[4,5-b]пиридин, использованный на стадии 4 примера 3, 6-йод-3H-имидазо[4,5-b]пиридином, полученным на стадии 1 примера 96, и проводя аналогичные замены на стадии 5 примера 3 и на стадии 5 примера 2. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,56 (с, 1H), 8,49 (с, 1H), 8,06 (д, J=7,4 Гц, 1H), 7,64 (с, 1H), 7,23-7,32 (м, 1H), 7,19 (д, J=8,4 Гц, 1H), 5,46 (с, 2H), 4,84 (шир. с, 1H), 3,50 (шир. с, 2H), 2,03 (д, J=11,8 Гц, 1H), 1,86 (д, J=10,8 Гц, 1H), 1,53-1,67 (м, 2H), 1,09-1,36 (м, 4H). ЖХМС (ИЭР) m/z 506 (M+H)+.
Пример 147
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола
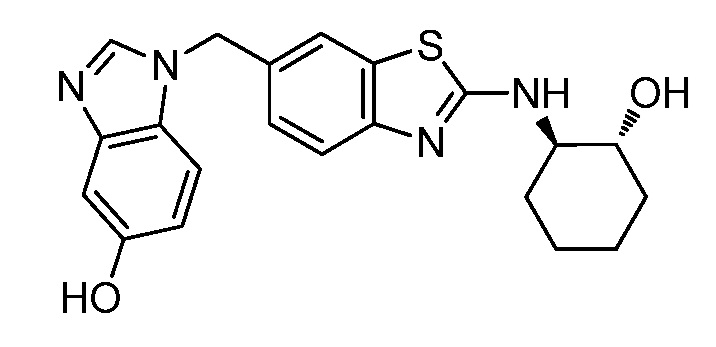
Стадия 1: К перемешиваемой смеси 4-(бензилокси)-2-нитроанилина (2,0 г, 8,2 ммоль) в TFA (14 мл) при -15°C добавляли триацетоксиборгидрид натрия (2,84 г, 12 ммоль). Затем по каплям добавляли раствор 2-(метилтио)бензо[d]тиазол-6-карбальдегида (1,9 г, 9,0 ммоль), полученного на стадии 1 примера 100, в DCM (10 мл). Реакционную смесь оставляли нагреваться до 0°C и перемешиваться в течение 2 ч. Смесь распределяли между DCM и водой. Органический слой отделяли и последовательно промывали насыщенным водн. NaHCO3 и солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом от 10% EtOAc в петролейном эфире до 100% EtOAc, с получением 4-(бензилокси)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (2,3 г, 64%) в виде красновато-коричневого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,34 (с, 1H), 7,84 (д, J=8,4 Гц, 1H), 7,72-7,77 (м, 2H), 7,33-7,43 (м, 6H), 7,14 (м, 1H), 6,76 (д, J=9,6 Гц, 1H), 5,02 (с, 2H), 4,64 (д, J=5,7 Гц, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 438 (M+H)+.
Стадия 2: К смеси 4-(бензилокси)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилина (2,8 г, 6,42 ммоль), полученного на предшествующей стадии, HOAc (7,5 мл), MeOH (7,5 мл) и DCM (50 мл) при 0°C порциями добавляли цинковую пыль (4,25 г, 65,4 ммоль). Реакционную смесь перемешивали при 5°C в течение 1 ч. Смесь фильтровали, фильтрат разбавляли DCM и последовательно промывали водой и насыщенным водн. NaHCO3. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-(бензилокси)-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (2,49 г, 95%) в виде светло-оранжевого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 7,83 (д, J=8,4 Гц, 1H), 7,77 (с, 1H), 7,26-7,44 (м, 7H), 6,59 (д, J=8,4 Гц, 1H), 6,46 (с, 1H), 6,38 (м, 1H), 4,97 (с, 2H), 4,34 (с, 2H), 3,54 (шир. с, 2H), 2,80 (с, 3H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Стадия 3: Смесь 4-(бензилокси)-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамина (2,49 г, 6,1 ммоль), полученного на предшествующей стадии, триэтилортоформиата (60 мл) и муравьиной кислоты (1,22 г) перемешивали при 90°C в течение 2 ч. Реакционную смесь охлаждали до к.т., а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом от 50% EtOAc в петролейном эфире до 100% EtOAc, с получением 6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (1,6 г, 62%) в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,93 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,50 (с, 1H), 7,44-7,49 (м, 2H), 7,30-7,40 (м, 4H), 7,26 (м, 1H), 7,13 (д, J=9,0 Гц, 1H), 6,98 (м, 1H), 5,41 (с, 2H), 5,10 (с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 418 (M+H)+.
Стадия 4: Смесь 6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (1,6 г, 3,8 ммоль), полученного на предшествующей стадии, и мета-хлорпербензойной кислоты (0,82 г, 4,75 ммоль) в DCM (38 мл) перемешивали при 0°C в течение 2 ч. Смесь разбавляли DCM и последовательно промывали водн. Na2S2O3, насыщенным водн. NaHCO3 и водой. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,58 г, 96%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 8,02 (д, J=8,4 Гц, 1H), 7,96 (с, 1H), 7,76 (с, 1H), 7,44-7,47 (м, 2H), 7,31-7,40 (м, 5H), 7,12 (д, J=8,7 Гц, 1H), 6,97 (м, 1H), 5,49 (с, 2H), 5,11 (с, 2H), 3,08 (с, 3H); ЖХМС (ИЭР) m/z 434 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,48 г, 3,4 ммоль), полученного на предшествующей стадии, гидрохлорида (1R,2R)-2-аминоциклогексанола (1,29 г, 8,5 ммоль) и DIEA (2,19 г, 17 ммоль) в DMA (44 мл) нагревали при 138°C в течение 15 ч. Реакционную смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2-6% MeOH в DCM, с получением (1R,2R)-2-((6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (0,98 г, 59%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,88 (с, 1H), 7,43-7,46 (м, 3H), 7,29-7,39 (м, 4H), 7,25 (с, 1H), 7,13-7,16 (м, 2H), 6,96 (м, 1H), 5,75 (шир. с, 1H), 5,31 (с, 2H), 5,09 (с, 2H), 3,46-3,56 (м, 2H), 2,07-2,18 (м, 2H), 1,71-1,77 (м, 2H), 1,26-1,40 (м, 4H); ЖХМС (ИЭР) m/z 485 (M+H)+.
Стадия 6: К перемешиваемой смеси (1R,2R)-2-((6-((5-(бензилокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (3,4 г, 7,02 ммоль) в DCM (40 мл) при -30°C добавляли трибромид бора (3,4 мл, 35,4 ммоль). Реакционную смесь перемешивали при -30°C в течение 2 ч. К смеси добавляли воду и корректировали значение pH до 8 добавлением водн. NH4OH. Осадок собирали путем фильтрования с получением светло-желтого твердого вещества (2,45 г). Часть этого твердого вещества (150 мг) сразу очищали методом препаративной HPLC с обращенной фазой с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола в виде белого твердого вещества (54 мг). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,98 (с, 1H), 8,22 (с, 1H), 7,93 (д, J=7,5 Гц, 1H), 7,61 (с, 1H), 7,30 (с, 1H), 7,27 (с, 1H), 7,17 (м, 1H), 6,94 (с, 1H), 6,69 (м, 1H), 5,37 (с, 2H), 4,71 (д, J=5,4 Гц, 1H), 3,53 (м, 1H), 3,36 (м, 1H), 2,03 (м, 1H), 1,88 (м, 1H), 1,60-1,63 (м, 2H), 1,15-1,29 (м, 4H). ЖХМС (ИЭР) m/z 395 (M+H)+.
Пример 148
Получение (1R,2R)-2-((6-((5,7-дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
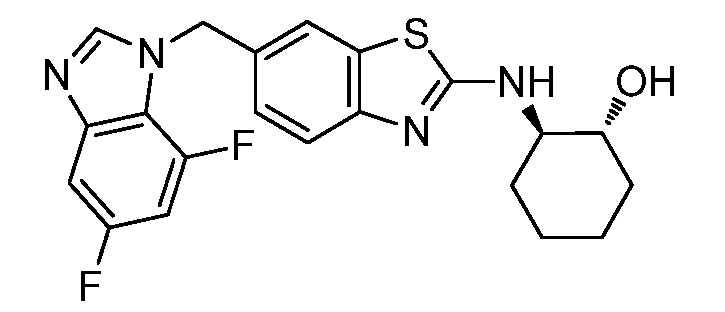
Стадия 1: 2,4-Дифтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-6-нитроанилин (0,8 г, 73%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 2,4-дифтор-6-нитроанилином. 1H ЯМР (300 МГц, CDCl3) δ 7,84 (д, J=8,1 Гц, 1H), 7,70-7,74 (м, 2H), 7,36 (дд, J=8,4, 1,8 Гц, 1H), 7,05 (м, 1H), 4,78 (д, J=3,6 Гц, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 368 (M+H)+.
Стадия 2: 4,6-Дифтор-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин (0,29 г, 91%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 130, заменяя N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-трифторметил)анилин, использованный в примере 130, 2,4-дифтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-6-нитроанилином, полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 7,79 (д, J=8,4 Гц, 1H), 7,70 (с, 1H), 7,35 (дд, J=8,7, 1,8 Гц, 1H), 6,18-6,24 (м, 2H), 4,20 (шир. с, 2H), 4,13 (с, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 338 (M+H)+.
Стадия 3: 6-((5,7-Дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (0,18 г, 59%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 130, заменяя N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамин, использованный в примере 130, 4,6-дифтор-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамином, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 348 (M+H)+.
Стадия 4: 6-((5,7-Дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (0,17 г, 90%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 6-((5,7-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,01-8,05 (м, 2H), 7,81 (с, 1H), 7,41 (дд, J=8,7, 1,8 Гц, 1H), 7,32 (дд, J=9,0, 2,1 Гц, 1H), 6,80 (т, J=9,6 Гц, 1H), 5,64 (с, 2H), 3,06 (с, 3H); ЖХМС (ИЭР) m/z 364 (M+H)+.
Стадия 5: ((1R,2R)-2-((6-((5,7-Дифтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (65 мг, 34,5%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 130, заменяя 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 6-((5,7-дифтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (с, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,54 (с, 1H), 7,36 (дд, J=9,3, 1,5 Гц, 1H), 7,30 (д, J=8,1 Гц, 1H), 7,06-7,15 (м, 2H), 5,51 (с, 2H), 4,71 (д, J=5,1 Гц, 1H), 3,53 (м, 1H), 3,33 (м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,59-1,63 (м, 2H), 1,14-1,29 (м, 4H); ЖХМС (ИЭР) m/z 415 (M+H)+.
Пример 149
Получение (1R,2R)-2-((6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
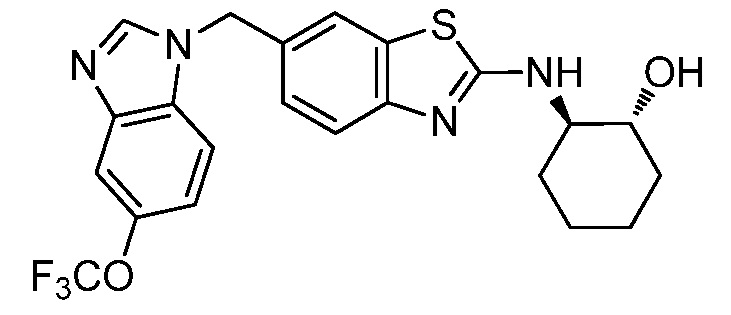
Стадия 1: N-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-(трифторметокси)анилин (0,85 г, 51%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 2-нитро-4-(трифторметокси)анилином. 1H ЯМР (300 МГц, CDCl3) δ 8,49 (шир. с, 1H), 8,28 (д, J=0,6 Гц, 1H), 7,94 (д, J=3,0 Гц, 1H), 7,84 (с, 1H), 7,38 (дд, J=8,4, 1,5 Гц, 1H), 7,29 (м, 1H), 6,83 (д, J=9,0 Гц, 1H), 4,66 (д, J=5,7 Гц, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 416 (M+H)+.
Стадия 2: N1-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметокси)бензол-1,2-диамин (0,69 г, 88%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 130, заменяя N-((2- (метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-трифторметил)анилин, использованный в примере 130, N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитро-4-(трифторметокси)анилином, полученным на стадии 1 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 7,83 (д, J=8,4 Гц, 1H), 7,75 (с, 1H), 7,41 (дд, J=8,4, 1,5 Гц, 1H), 6,54-6,65 (м, 4H), 4,35 (с, 2H), 3,48 (шир. с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 386 (M+H)+.
Стадия 3: 2-(Метилтио)-6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол (0,55 г, 79%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 130, заменяя N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамин, использованный в примере 130, N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметокси)бензол-1,2-диамином, полученным на стадии 2 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,03 (с, 1H), 7,83 (д, J=8,4 Гц, 1H), 7,70 (с, 1H), 7,52 (с, 1H), 7,22-7,28 (м, 2H), 7,13 (м, 1H), 5,45 (с, 2H), 2,78 (с, 3H); ЖХМС (ИЭР) m/z 396 (M+H)+.
Стадия 4: 2-(Метилсульфинил)-6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол (0,55 г, 96%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 2-(метилтио)-6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазолом, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,08 (с, 1H), 7,04 (д, J=8,4 Гц, 1H), 7,79 (с, 1H), 7,71 (с, 1H), 7,38 (дд, J=8,4, 1,8 Гц, 1H), 7,24 (м, 1H), 7,13 (м, 1H), 5,52 (с, 2H), 3,06 (с, 3H); ЖХМС (ИЭР) m/z 412 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((5-(Трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (65 мг, 35%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 130, заменяя 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 2-(метилсульфинил)-6-((5-(трифторметокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,54 (с, 1H), 7,93 (д, J=6,6 Гц, 1H), 7,65-7,75 (м, 3H), 7,30 (д, J=8,1 Гц, 1H), 7,21-7,26 (м, 2H), 5,50 (с, 2H), 4,69 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,40 (м, 1H), 2,01 (м, 1H), 1,85 (м, 1H), 1,57-1,60 (м, 2H), 1,20-1,23 (м, 4H); ЖХМС (ИЭР) m/z 463 (M+H)+.
Пример 150
Получение (1R,2R)-2-((6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
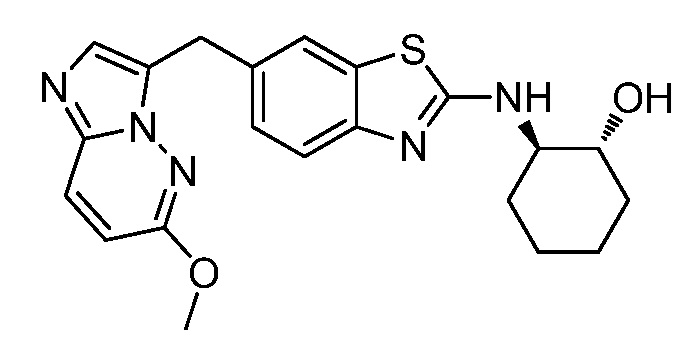
Стадия 1: Перемешиваемую смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (600 мг, 2,2 ммоль), полученного на стадии 4 примера 117, и 6-метоксипиридазин-3-амина (550 мг, 4,4 ммоль) в 1-бутаноле (20 мл) нагревали с обратным холодильником в течение ночи. Смесь охлаждали до к.т., и добавляли воду (40 мл). Смесь экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилтио)бензо[d]тиазола в виде светло-коричневого твердого вещества (500 мг, 66%). 1H ЯМР (300 МГц, CDCl3) δ 7,79-7,73 (м, 2H), 7,67 (д, J=1,2 Гц, 1H), 7,43 (с, 1H), 7,38 (дд, J=1,5, 8,4 Гц, 1H), 6,64 (д, J=9,6 Гц, 1H), 4,33 (с, 2H), 3,94 (с, 3H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 343 (M+H)+.
Стадия 2: К раствору 6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (500 мг, 1,46 ммоль) в DCM (30 мл) при 0°C добавляли m-CPBA (314 мг, 1,82 ммоль). Реакционную смесь перемешивали в течение 2 ч при 0°C, затем добавляли водн. Na2SO3 (15 мл) и перемешивали смесь в течение 0,5 ч. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола в виде желтого твердого вещества (500 мг, 95%). 1H ЯМР (300 МГц, CDCl3) δ 7,99-7,93 (м, 2H), 7,76 (д, J=9,6 Гц, 1H), 7,53 (дд, J=1,5, 8,4 Гц, 1H), 7,46 (с, 1H), 6,65 (д, J=9,3 Гц, 1H), 4,42 (с, 2H), 3,94 (с, 3H), 3,06 (с, 3H). ЖХМС (ИЭР) m/z 359 (M+H)+.
Стадия 3: Смесь 6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (320 мг, 0,89 ммоль), (1R,2R)-2-аминоциклогексанола (308 мг, 2,68 ммоль) и DIEA (231 мг, 1,79 ммоль) в NMP (11 мл) перемешивали в течение 1 суток при 140°C. Смесь охлаждали до к.т. и добавляли воду (50 мл). Смесь экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→10/1), а затем дополнительно очищая методом препаративной HPLC, с получением (1R,2R)-2-((6-((6-метоксиимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде коричневого твердого вещества (120 мг, 33%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,97 (д, J=9,6 Гц, 1H), 7,83 (д, J=7,5 Гц, 1H), 7,61 (с, 1H), 7,44 (с, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,18 (д, J=9,9 Гц, 1H), 6,82 (д, J=9,6 Гц, 1H), 4,72 (д, J=5,4 Гц, 1H), 4,23 (с, 2H), 3,95 (с, 3H), 3,52-3,49 (м, 1H), 3,39-3,36 (м, 1H), 2,05-2,01 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,28-1,14 (м, 4H). ЖХМС (ИЭР) m/z 410 (M+H)+.
Пример 151
Получение (1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
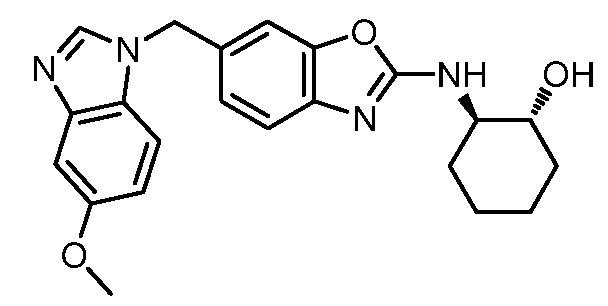
Стадия 1: К раствору 4-метокси-2-нитроанилина (500 мг, 2,99 ммоль) и TFA (3,07 мл) в DCM (15 мл) при 5°C добавляли NaBH(OAc)3 (1,9 г, 8,97 ммоль). К полученной смеси при 0°C добавляли раствор 2-(метилтио)бензо[d]оксазол-6-карбальдегида (630 мг, 3,29 ммоль) в DCM (10 мл) и перемешивали смесь при 0°C в течение 2 ч. Реакционную смесь разбавляли DCM и последовательно промывали H2O, водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением 4-метокси-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина в виде светло-коричневого твердого вещества (1,08 г, колич.). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,62 (т, 1H), 7,64 (с, 1H), 7,58 (д, J=8,4 Гц, 1H), 7,52 (с, 1H), 7,37 (д, J=9,3 Гц, 1H), 7,18 (д, J=6,0 Гц, 1H), 6,93 (д, J=9,3 Гц, 1H), 4,71 (д, J=5,7 Гц, 1H), 3,72 (с, 3H), 2,75 (с, 3H). ЖХМС (ИЭР) m/z 346 (M+H)+.
Стадия 2: К перемешиваемому раствору 4-метокси-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина (1,07 г, 3,11 ммоль), HOAc (3,7 мл) и MeOH (3,7 мл) в DCM (40 мл) при 0°C порциями добавляли цинковую пыль (2,02 г, 31,1 ммоль). После перемешивания в течение 2 ч, смесь фильтровали. Фильтрат промывали водн. NaHCO3 и солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением 4-метокси-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (775 мг, 79,1%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,60 (с, 1H), 7,55 (д, J=8,4 Гц, 1H), 7,35 (д, J=9,6 Гц, 1H), 6,26 (д, J=8,1Гц, 1H), 6,21 (с, 1H), 5,97 (д, J=9,0 Гц, 2H), 4,74 (т, 1H), 4,68 (с, 1H), 4,31 (д, J=5,7 Гц, 1H), 3,55 (с, 3H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 316 (M+H)+.
Стадия 3: Раствор 4-метокси-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (755 мг, 2,40 ммоль) в триэтоксиметане (8 мл) и HCOOH (0,2 мл) перемешивали при 90°C в течение 40 мин. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/2), с получением 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола в виде светло-коричневого твердого вещества (683 мг, 87,6%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,36 (с, 1H), 7,66 (с, 1H), 7,58 (д, J=7,8 Гц, 1H), 7,43 (д, J=9,0 Гц, 1H), 7,30 (д, J=6,6 Гц, 1H), 7,16 (с, 1H), 6,82 (д, J=6,6 Гц, 1H), 5,54 (с, 2H), 3,75 (с, 3H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 326 (M+H)+.
Стадия 4: Раствор 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метиотио)бензо[d]оксазола (683 мг, 2,1 ммоль) и m-CPBA (471 мг, 2,7 ммоль) в DCM (10 мл) перемешивали при 0°C в течение 3,5 ч. Реакционную смесь промывали водн. Na2S2O3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/1), с получением 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (455 мг, 63,6%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 7,88 (м, 2H), 7,4 4 (м, 2H), 7,18 (с, 1H), 6,83 (с, 1H), 5,63 (с, 2H), 3,75 (с, 3H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 342 (M+H)+.
Стадия 5: Смесь 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (450 мг, 1,32 ммоль), (1R,2R)-2-аминоциклогексанола (228 мг, 1,98 ммоль) и DIEA (341 мг, 2,64 ммоль) в DMA (10 мл) перемешивали при 120°C в течение 1,5 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали полученную смесь этилацетатом (3×30 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением (1R,2R)-2-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола в виде белого твердого вещества (155 мг, 29,9%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,32 (с, 1H), 7,80 (д, J=7,8 Гц, 1H), 7,41 (д, J=8,7 Гц, 1H), 7,33 (с, 1H), 7,16-7,08 (м, 3H), 6,82 (дд, J=2,4, 8,7 Гц, 1H), 5,42 (с, 2H), 4,68 (д, J=4,5 Гц, 1H), 3,75 (с, 3H), 3,35 (шир. с, 2H), 1,90 (м, 2H), 1,62 (шир. с, 2H), 1,22 (шир. с, 4H). ЖХМС (ИЭР) m/z 393 (M+H)+.
Пример 152
Получение (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола
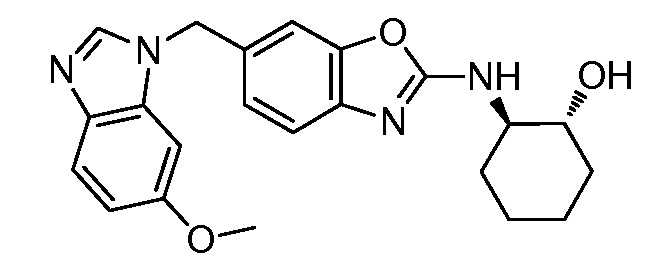
Стадия 1: К раствору 5-метокси-2-нитроанилина (500 мг, 2,99 ммоль) и TFA (3,07 мл) в DCM (15 мл) при 5°C добавляли NaBH(OAc)3 (1,9 г, 8,97 ммоль). К полученной смеси при 0°C по каплям добавляли раствор 2-(метилтио)бензо[d]оксазол-6-карбальдегида (630 мг, 3,29 ммоль) в DCM (10 мл) и перемешивали смесь при 0°C в течение 2 ч. Реакционную смесь разбавляли DCM и промывали H2O, водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением 5-метокси-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина в виде светло-коричневого твердого вещества (1,06 г, 100%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,90 (т, 1H), 8,04 (д, J=8,7 Гц, 1H), 7,68 (с, 1H), 7,60 (д, J=8,4 Гц, 1H), 7,41 (д, J=7,5 Гц, 1H), 6,28-6,32 (м, 2H), 4,73 (д, J=6 Гц, 2H), 3,72 (с, 3H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 345 (M+H)+.
Стадия 2: К перемешиваемому раствору 5-метокси-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина (1,05 г, 3,05 ммоль), HOAc (3,6 мл) и метанола (3,6 мл) в DCM (40 мл) при 0°C порциями добавляли цинковую пыль (1,98 г, 30,5 ммоль). После перемешивания в течение 2 ч, смесь фильтровали. Фильтрат промывали водн. NaHCO3 и солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением 5-метокси-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина в виде светло-желтого твердого вещества (920 мг, 95,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,55-7,60 (м, 2H), 7,35 (д, J=7,8 Гц, 1H), 6,47 (д, J=8,1 Гц, 1H), 5,93-5,99 (м, 2H), 5,32 (т, 1H), 4,38 (д, J=5,7 Гц, 2H), 4,13 (с, 2H), 3,50 (с, 3H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 316 (M+H)+.
Стадия 3: Смесь 5-метокси-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (920 мг, 2,92 ммоль), триэтоксиметана (8,8 мл) и HCOOH (0,2 мл) перемешивали при 90°C в течение 40 мин. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/2), с получением 6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола в виде светло-коричневого твердого вещества (799 мг, 84,1%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,28 (с, 1H), 7,68 (с, 1H), 7,59 (д, J=8,1 Гц, 1H), 7,52 (д, J=9,0 Гц, 1H), 7,33 (д, J=6,6 Гц, 1H), 7,15 (с, 1H), 6,80 (д, J=6,6 Гц, 1H), 5,54 (с, 2H), 3,75 (с, 3H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 326 (M+H)+.
Стадия 4: Раствор 6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (799 мг, 2,46 ммоль) и m-CPBA (551 мг, 3,20 ммоль) в DCM (18 мл) перемешивали при 0°C в течение 3,5 ч. Реакционную смесь промывали водным Na2S2O3 и солевым раствором. Органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/1), с получением 6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола в виде светло-желтого твердого вещества (697 мг, 74,9%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,34 (с, 1H), 7,87-7,92 (м, 2H), 7,47-7,55 (м, 2H), 7,16 (с, 1H), 6,82 (д, J=5,4 Гц, 1H), 5,63 (с, 2H), 3,75 (с, 3H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 342 (M+H)+.
Стадия 5: Смесь 6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метил-сульфинил)бензо[d]оксазола (595 мг, 1,74 ммоль), (1R,2R)-2-аминоциклогексанола (301 мг, 2,6 ммоль) и DIEA (449 мг, 3,48 ммоль) в DMA (12 мл) перемешивали при 120°C в течение 1,5 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением (1R,2R)-2-((6-((6-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола в виде белого твердого вещества (198 мг, 29,0%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,24 (с, 1H), 7,80 (д, J=6,9 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,36 (с, 1H), 7,14 (с, 3H), 6,80 (дд, J=2,4, 9,0 Гц, 1H), 5,42 (с, 2H), 4,68 (д, J=3,3 Гц, 1H), 3,76 (с, 3H), 3,33 (шир. с, 2H), 1,89 (шир. с, 2H), 1,62 (шир. с, 2H), 1,22 (шир. с, 4H). ЖХМС (ИЭР) m/z 393 (M+H)+.
Пример 153
Получение (1R,2R)-2-((6-((7-(2-метоксиэтокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
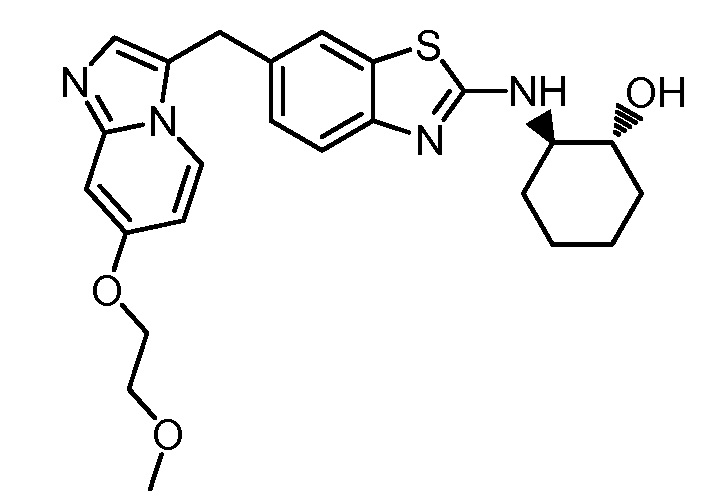
Стадия 1: (1R,2R)-2-((6-Йодбензо[d]тиазол-2-ил)амино)циклогексанол (1,9 г, 81%) получали в виде желтого твердого вещества с использованием методик, аналогичных описанным на стадии 5 примера 3, а затем на стадии 5 примера 2, заменяя 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 3, 6-йод-2-(метилтио)бензо[d]тиазолом (см. US 2009/163464 A1, 2009), и проводя затем аналогичную замену на стадии 5 примера 2. ЖХМС (ИЭР) m/z 375 (M+H)+.
Стадия 2: Неочищенный 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналь (180 мг) получали в виде желтого масла с использованием методик, аналогичных описанным на стадиях 3-4 примера 117, заменяя 6-йод-2-(метилтио)бензо[d]тиазол, использованный на стадии 3 примера 117, (1R,2R)-2-((6-йодбензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 этого примера, и проводя аналогичную замену на стадии 4 примера 117. ЖХМС (ИЭР) m/z 339, 341 (M+H)+. В этой же реакционной смеси, в качестве минорного продукта также также присутствовал 2-хлор-3-(4-хлор-2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналь.
Стадия 3: (1R,2R)-2-((6-((7-(2-Метоксиэтокси)имидазо[1,2- a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (28 мг, 18%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил 4-(2-метоксиэтокси)пиридин-2-амином (см. WO 2008/121687 A2, 2008), и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,00 (д, J=7,4 Гц, 1H), 7,89 (д, J=7,4 Гц, 1H), 7,49 (с, 1H), 7,25 (д, J=8,4 Гц, 1H), 7,23 (с, 1H), 7,06 (д, J=7,9 Гц, 1H), 6,92 (д, J=2,5 Гц, 1H), 6,58 (дд, J=2,5, 7,4 Гц, 1H), 4,77 (д, J=5,9 Гц, 1H), 4,22 (с, 2H), 4,07-4,16 (м, 2H), 3,60-3,72 (м, 2H), 3,50 (шир. с, 2H), 3,30 (с, 3H), 2,04 (д, J=12,3 Гц, 1H), 1,87 (д, J=11,8 Гц, 1H), 1,53-1,71 (м, 2H), 1,06-1,36 (м, 4H) , ЖХМС (ИЭР) m/z 453 (M+H)+.
Пример 154
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-5-фторбензо[d]тиазол-2-ил)амино)циклогексанола
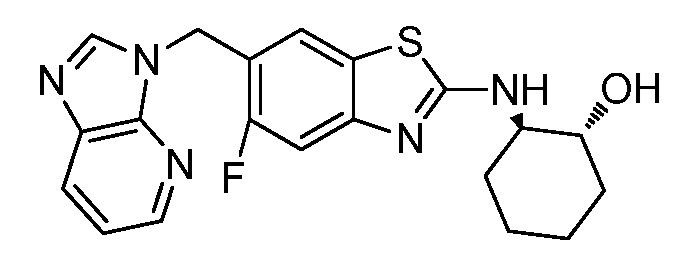
Стадия 1: Смесь 4-амино-2,5-дифторбензонитрила (1,0 г, 6,5 ммоль) и калиевой соли O-этилксантогеновой кислоты (1,2 г, 7,8 ммоль) в DMF (15 мл) нагревали с обратным холодильником в течение 6 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (200 мл) и 1 M водн. Na2CO3 (100 мл). Органический слой отделяли и экстрагировали водный слой дополнительным количеством EtOAc (2×200 мл). Объединенные органические слои промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2% MeOH в DCM, с получением 6-циан-5-фторбензо[d]тиазол-2-тиолята калия (1,94 г) в виде оранжевого твердого вещества. ЖХМС (ИЭР) m/z 211 (M+H)+.
Стадия 2: 5-Фтор-2-(метилтио)бензо[d]тиазол-6-карбонитрил синтезировали в виде оранжевого твердого вещества (1,2 г, 86%) с использованием методики, аналогичной описанной на стадии 2 примера 114, заменяя этил-2-меркаптотиазоло[4,5-b]пиридин-6-карбоксилат калия, использованный в примере 114, 6-циан-5-фторбензо[d]тиазол-2-тиолатом калия, полученным на предшествующей стадии. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (д, J=6,4 Гц, 1H), 8,01 (д, J=10,5 Гц, 1H), 2,84 (с, 3H); ЖХМС (ИЭР) m/z 225 (M+H)+.
Стадия 3: К перемешиваемой смеси 5-фтор-2-(метилтио)бензо[d]тиазол-6-карбонитрила в безводном THF (20 мл) при -20°C в атмосфере аргона по каплям добавляли алюмогидрид лития (2 M раствор в THF, 11,7 мл, 5,9 ммоль). Спустя 1 ч, к реакционной смеси медленно добавляли воду (500 мкл) и 1 M водн. NaOH (500 мкл). Спустя 5 минут, добавляли дополнительное количество воды (2 мл) и перемешивали смесь при к.т. в течение 30 минут. Смесь фильтровали и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в CH2Cl2, с получением (5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамина (128 мг, 29%) в виде бесцветного масла. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,07 (д, J=7,1 Гц, 1H), 7,64 (д, J=11,1 Гц, 1H), 3,83 (с, 2H), 2,78 (с, 3H), 1,80-2,06 (м, 2H); ЖХМС (ИЭР) m/z 229 (M+H)+.
Стадия 4: К перемешиваемой смеси (5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамина (128 мг, 0,6 ммоль) и DIEA (195 мкл, 1,2 ммоль) при 0°C в атмосфере аргона одной порцией добавляли 2-хлор-3-нитропиридин (98 мг, 0,7 ммоль). Смесь перемешивали при к.т. в течение 18 ч, а затем концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→50% EtOAc в гексанах, с получением N-((5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амина (165 мг, 84%) в виде желтого масла. ЖХМС (ИЭР) m/z 351 (M+H)+.
Стадия 5: N2-((5-Фтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин синтезировали в виде желтого твердого вещества (200 мг) с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, N-((5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 321 (M+H)+.
Стадия 6: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-5-фтор-2-(метилтио)бензо[d]тиазол синтезировали в виде рыжеватого твердого вещества (180 мг) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5- метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, N2-((5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 331 (M+H)+.
Стадия 7: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-5-фтор-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (314 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-5-фтор-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 8: (1R,2R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-5-фторбензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (42 мг, 19%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-5-фтор-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,50 (с, 1H), 8,36 (дд, J=1,2, 4,7 Гц, 1H), 8,15 (д, J=7,6 Гц, 1H), 8,09 (дд, J=1,1, 8,0 Гц, 1H), 7,60 (д, J=7,4 Гц, 1H), 7,29 (м, 1H), 7,18 (д, J=11,6 Гц, 1H), 5,52 (с, 2H), 4,75 (д, J=5,2 Гц, 1H), 3,51 (м, 1H), 3,32 (м, 1H), 2,01 (м, 1H), 1,89 (м, 1H), 1,56-1,65 (м, 2H), 1,12-1,31 (м, 4H); ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 155
Получение (1R,2R)-2-((6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
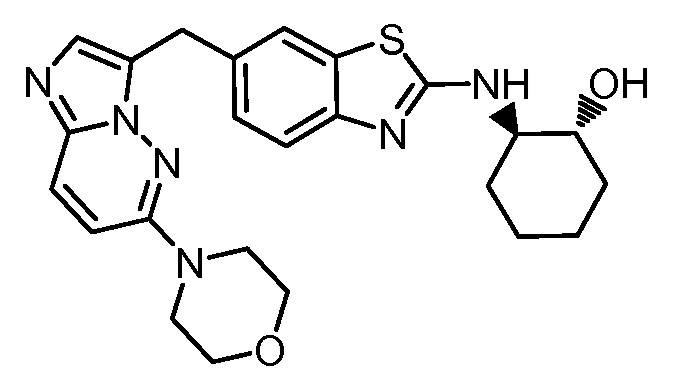
(1R,2R)-2-((6-((6-Морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (55 мг, 13%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 6-морфолинопиридазин-3-амином (см. US 4104385 A1, 1978) и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,87 (д, J=7,8 Гц, 1H), 7,81 (д, J=9,9 Гц, 1H), 7,58 (с, 1H), 7,35 (с, 1H), 7,24 (д, J=8,3 Гц, 1H), 7,13 (д, J=8,3 Гц, 1H), 7,09 (д, J=9,9 Гц, 1H), 4,78 (шир. с, 1H), 4,17 (с, 2H), 3,72 (д, J=4,7 Гц, 4H), 3,50 (шир. с, 2H), 3,42-3,49 (м, 4H), 2,04 (д, J=11,9 Гц, 1H), 1,87 (д, J=10,4 Гц, 1H), 1,53-1,71 (м, 2H), 1,10-1,37 (м, 4H). ЖХМС (ИЭР) m/z 465 (M+H)+.
Пример 156
Получение (1R,2R)-2-((4-хлор-6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
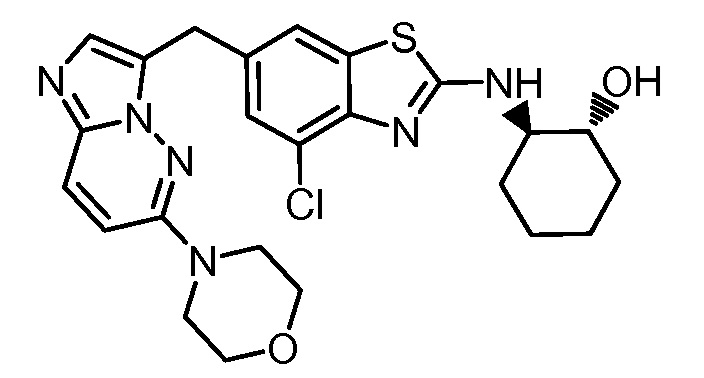
(1R,2R)-2-((4-Хлор-6-((6-морфолиноимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (25 мг, 6%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 6-морфолинопиридазин-3-амином (см. US 4104385 A1, 1978) и 2-хлор-3-(4-хлор-2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем (минорный продукт на стадии 2 примера 153), соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,20 (д, J=7,3 Гц, 1H), 7,82 (д, J=9,9 Гц, 1H), 7,56 (с, 1H), 7,40 (с, 1H), 7,27 (с, 1H), 7,10 (д, J=9,9 Гц, 1H), 4,83 (шир. с, 1H), 4,17 (с, 2H), 3,66-3,80 (м, 4H), 3,44 (д, J=4,7 Гц, 4H), 2,02 (д, J=7,8 Гц, 1H), 1,88 (д, J=11,4 Гц, 1H), 1,63 (шир. с, 2H), 1,10-1,37 (м, 4H). ЖХМС (ИЭР) m/z 499, 501 (M+H)+.
Пример 157
Получение (1R,2R)-2-((6-(имидазо[2,1-b]тиазол-5-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола
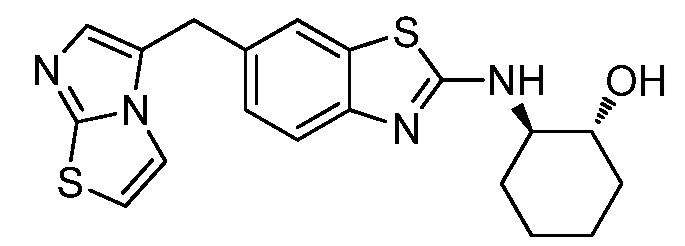
Стадия 1: Перемешиваемую смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (500 мг, 1,84 ммоль), полученного на стадии 4 примера 117, и тиазол-2-амина (370 мг, 3,68 ммоль) в 1-бутаноле (22 мл) нагревали с обратным холодильником в течение ночи. Смесь охлаждали до к.т., и добавляли воду (120 мл). Смесь экстрагировали EtOAc (3×60 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-(имидазо[2,1-b]тиазол-5-илметил)-2-(метилтио)бензо[d]тиазола в виде желтого твердого вещества (350 мг, 60%). 1H ЯМР (300 МГц, CDCl3) δ 7,80 (д, J=8,4 Гц, 1H), 7,55 (д, J=1,2 Гц, 1H), 7,29 (д, J=1,8 Гц, 1H), 7,16 (д, J=0,9 Гц, 1H), 6,99 (д, J=4,5 Гц, 1H), 6,71 (дд, J=0,9 Гц, J=4,5 Гц, 1H), 4,24 (с, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 318 (M+H)+.
Стадия 2: К раствору 6-(имидазо[2,1-b]тиазол-5-илметил)-2-(метилтио)бензо[d]тиазола (350 мг, 1,1 ммоль) в DCM (20 мл) при 0°C добавляли m-CPBA (240 мг, 1,4 ммоль). Реакционную смесь перемешивали в течение 2 ч при 0°C, затем добавляли водн. Na2S2O3 (20 мл), и перемешивали смесь в течение 0,5 ч. Органический слой отделяли и сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-(имидазо[2,1-b]тиазол-5-илметил)-2-(метилсульфинил)бензо[d]тиазола в виде желтого твердого вещества (310 мг, 85%). 1H ЯМР (300 МГц, CDCl3) δ 8,00 (д, J=8,4 Гц, 1H), 7,82 (д, J=0,9 Гц, 1H), 7,43 (дд, J=1,5, 8,4 Гц, 1H), 7,18 (с, 1H), 7,03 (д, J=4,5 Гц, 1H), 6,75 (дд, J=0,9, 4,5 Гц, 1H), 4,32 (с, 2H), 3,07 (с, 3H). ЖХМС (ИЭР) m/z 334 (M+H)+.
Стадия 3: Смесь 6-(имидазо[2,1-b]тиазол-5-илметил)-2-(метилсульфинил)бензо[d]тиазола (310 мг, 0,93 ммоль), (1R,2R)-2-аминоциклогексанола (321 мг, 2,79 ммоль) и DIEA (240 мг, 1,86 ммоль) в NMP (10 мл) перемешивали при 130°C в течение 1 суток. Смесь охлаждали до к.т., и добавляли воду (50 мл). Смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeO (50/1→10/1) H, и дополнительно очищали продукт методом препаративной HPLC с получением (1R,2R)-2-((6-(имидазо[2,1-b]тиазол-5-илметил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде коричневого твердого вещества (100 мг, 28%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,84 (д, J=7,2 Гц, 1H), 7,68 (д, J=4,5 Гц, 1H), 7,54 (д, J=1,8 Гц, 1H), 7,27 (д, J=8,1 Гц, 1H), 7,20 (дд, J=0,9, 4,2 Гц, 1H), 7,10 (дд, J=1,8, 8,4 Гц, 1H), 7,02 (с, 1H), 4,71 (д, J=4,8 Гц, 1H), 4,15 (с, 2H), 3,52-3,49 (м, 1H), 3,39-3,36 (м, 1H), 2,05-2,01 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,30-1,16 (м, 4H). ЖХМС (ИЭР) m/z 385 (M+H)+.
Пример 158
Получение (1R,2R)-2-((6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
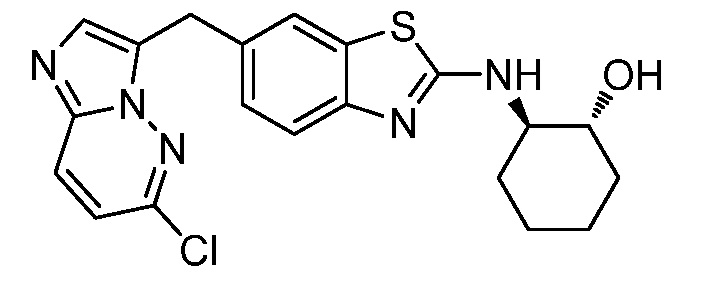
Стадия 1: Смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (1,5 г, 5,5 ммоль), полученного на стадии 4 примера 117, и 6-хлорпиридазин-3-амина (1,4 г, 11 ммоль) в 1-бутаноле (60 мл) нагревали с обратным холодильником в течение ночи. Затем смесь охлаждали до к.т., и добавляли воду (120 мл). Смесь экстрагировали EtOAc (3×60 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилтио)бензо[d]тиазола в виде желтого твердого вещества (1,6 г, 84%). 1H ЯМР (300 МГц, CDCl3) δ 7,89 (д, J=9,6 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,68 (дд, J=0,6 , 1,2 Гц, 1H), 7,53 (с, 1H), 7,37 (дд, J=1,8, 8,4 Гц, 1H), 7,03 (д, J=9,3 Гц, 1H), 4,40 (с, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 2: К раствору 6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (1,6 г, 4,6 ммоль) в DCM (90 мл) при 0°C добавляли m-CPBA (1,0 г, 5,8 ммоль). Реакционную смесь перемешивали в течение 2 ч при 0°C, затем добавляли водн. Na2S2O3 (45 мл), и перемешивали смесь в течение 0,5 ч. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола в виде желтого твердого вещества (1,68 г, 100%). 1H ЯМР (300 МГц, CDCl3) δ 8,00 (д, J=8,4 Гц, 1H), 7,92 (д, J=3,6 Гц, 1H), 7,89 (с, 1H), 7,58 (с, 1H), 7,53 (дд, J=2,1, 8,7 Гц, 1H), 7,05 (д, J=9,3 Гц, 1H), 4,48 (с, 2H), 3,07 (с, 3H). ЖХМС (ИЭР) m/z 363 (M+H)+.
Стадия 3: Смесь 6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,0 г, 2,7 ммоль), (1R,2R)-2-аминоциклогексанола (0,93 г, 8,1 ммоль) и DIEA (697 мг, 5,4 ммоль) в NMP (40 мл) перемешивали при 140°C в течение 2 суток. Смесь охлаждали до к.т., и добавляли воду (150 мл). Смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→10/1), с получением (1R,2R)-2-((6-((6-хлоримидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде коричневого твердого вещества (530 мг, 46%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,20 (д, J=9,6 Гц, 1H), 7,86 (д, J=7,2 Гц, 1H), 7,63 (с, 1H), 7,54 (д, J=1,8 Гц, 1H), 7,32 (д, J=9,9 Гц, 1H), 7,27 (д, J=1,8 Гц, 1H), 7,12 (дд, J=1,5, 8,4 Гц, 1H), 4,73 (д, J=5,1 Гц, 1H), 4,29 (с, 2H), 3,52-3,49 (м, 1H), 3,39-3,36 (м, 1H), 2,05-2,01 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,30-1,16 (м, 4H). ЖХМС (ИЭР) m/z 414 (M+H)+.
Пример 159
Получение (1R,2R)-2-((6-((6-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
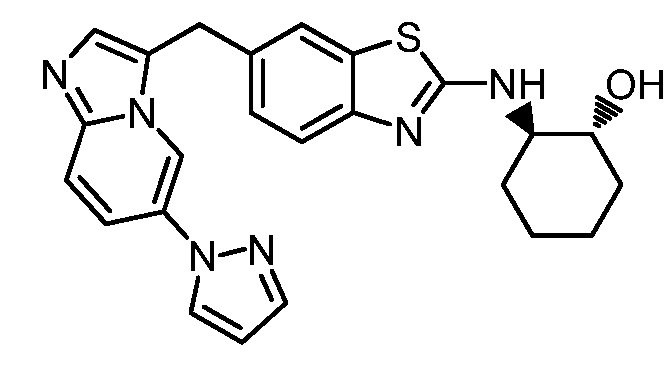
Стадия 1: (1R,2R)-2-((6-((6-Йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (50 мг, 13%) получали в виде светло-коричневого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 5-йодпиридин-2-амином и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. ЖХМС (ИЭР) m/z 505 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((6-(1H-Пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (7 мг, 16%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 141, (1R,2R)-2-((6-((6-йодимидазо[1,2-a]пиридин-3- ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,70 (шир. с, 1H), 8,48 (д, J=2,1 Гц, 1H), 7,92 (д, J=7,3 Гц, 1H), 7,76 (шир. с, 2H), 7,73 (шир. с, 1H), 7,54 (с, 1H), 7,28 (д, J=8,3 Гц, 1H), 7,12 (д, J=8,3 Гц, 1H), 6,57 (с, 1H), 4,79 (шир. с, 1H), 4,36 (с, 2H), 3,49 (д, J=6,7 Гц, 2H), 2,04 (д, J=11,4 Гц, 1H), 1,87 (д, J=10,4 Гц, 1H), 1,53-1,71 (м, 2H), 1,08-1,36 (м, 4H). ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 160
Получение (1R,2R)-2-((6-((5-(1H-пиразол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
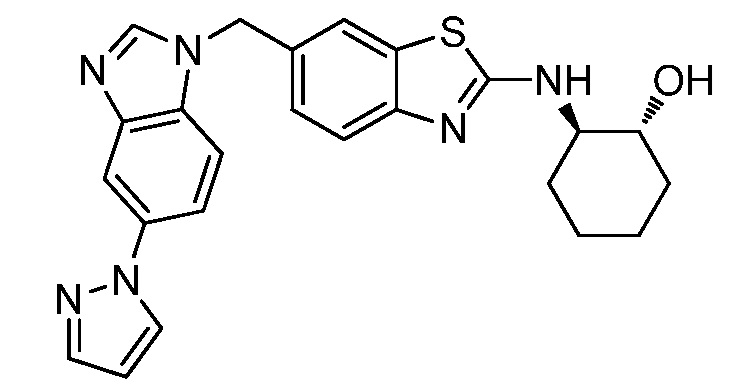
(1R,2R)-2-((6-((5-(1H-пиразол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (18 мг, 20%) получали в виде твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 141, (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 5 примера 183. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,43-8,53 (м, 2H), 8,06 (д, J=1,6 Гц, 1H), 7,99 (д, J=7,8 Гц, 1H), 7,69-7,75 (м, 2H), 7,64-7,68 (м, 2H), 7,30 (д, J=8,3 Гц, 1H), 7,22 (д, J=8,3 Гц, 1H), 6,51 (д, J=2,1 Гц, 1H), 5,50 (с, 2H), 4,76 (шир. м, 1H), 3,48-3,56 (шир. м, 2H), 2,02 (м, 1H), 1,87 (м, 1H), 1,52-1,68 (м, 2H), 1,09-1,35 (м, 4H); ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 161
Получение (1R,2R)-2-((6-((5-(1H-1,2,4-триазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
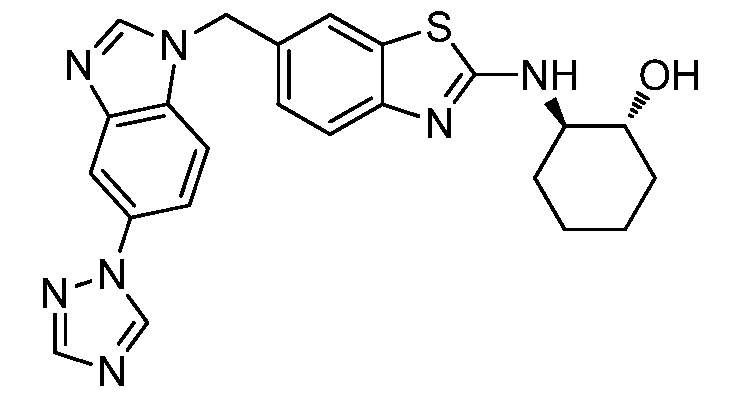
(1R,2R)-2-((6-((5-(1H-1,2,4-Триазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (10 мг, 8%) получали в виде твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и 1H-пиразол, использованные в примере 141, (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 5 примера 183, и 1H-1,2,4-триазолом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,23 (с, 1H), 8,54 (с, 1H), 8,20 (с, 1H), 8,12 (с, 1H), 7,97 (д, J=7,3 Гц, 1H), 7,71-7,74 (м, 2H), 7,68 (с, 1H), 7,30 (д, J=8,3 Гц, 1H), 7,22 (д, J=8,3 Гц, 1H), 5,52 (с, 2H), 4,74 (шир. с, 1H), 3,48-3,56 (шир. м, 2H), 2,02 (м, 1H), 1,87 (шир. с, 1H), 1,52-1,72 (м, 2H), 1,10-1,33 (м, 4H); ЖХМС (ИЭР) m/z 446 (M+H)+.
Пример 162
Получение (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
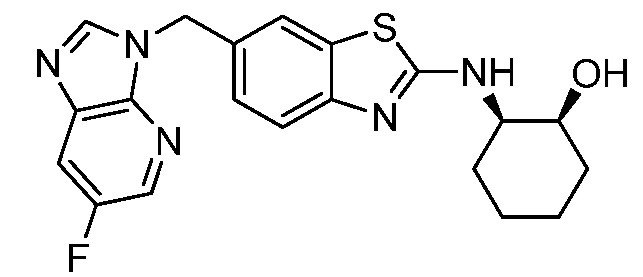
Стадия 1: Смесь уксусного ангидрида (49 мл, 0,5 моль) и муравьиной кислоты (19 мл, 0,5 моль) нагревали при 60°C в течение 3 ч. Добавляли 5-фтор-3-нитропиридин-2-амин, и перемешивали смесь при 60°C в течение 1 ч. Смесь концентрировали в условиях пониженного давления, и энергично перемешивали остаток в диэтиловом эфире (200 мл) в течение 30 минут. Твердое вещество собирали путем фильтрования с получением N-(5-фтор-3-нитропиридин-2-ил)формамида (4,5 г, 96%) в виде оранжевого твердого вещества, которое не требовало дополнительной очистки. ЖХМС (ИЭР) m/z 186 (M+H)+.
Стадия 2: N-(5-Фтор-3-нитропиридин-2-ил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид синтезировали в виде желтого твердого вещества (4 г, 82%) с использованием методики, аналогичной описанной на стадии 3 примера 47, заменяя 5-бром-6-метокси-1H-бензо[d]имидазол, использованный в примере 47, N-(5-фтор-3-нитропиридин-2-ил)формамидом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 379 (M+H)+.
Стадия 3: Перемешиваемую смесь N-(5-фтор-3-нитропиридин-2-ил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамида и железного порошка (6 г, 108 ммоль) в EtOH (70 мл) и HOAc (30 мл) нагревали с обратным холодильником в течение 2 ч. Смесь охлаждали до к.т., фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазола (1 г, 28%) в виде белой пены. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,72 (с, 1H), 8,40 (т, J=2,0 Гц, 1H), 8,09 (дд, J=2,6, 9,5 Гц, 1H), 7,99 (с, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,45 (дд, J=1,5, 8,4 Гц, 1H), 5,61 (с, 2H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 331 (M+H)+.
Стадия 4: 6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (1,8 г) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 5: К суспензии 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,0 г, 3,0 ммоль) и (1S,2R)-2-аминоциклогексанола гидрохлорида (916 мг, 6 ммоль) в безводном DMA (12 мл) добавляли DIEA (1,6 мл, 9,0 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 12 ч. Смесь охлаждали до к.т., и добавляли дополнительное количество (1S,2R)-2-аминоциклогексанола гидрохлорида (458 мг, 3 ммоль) и DIEA (530 мкл, 3 ммоль). Смесь дополнительно нагревали в герметизированной пробирке при 120°C в течение 12 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (200 мл) и 0,5 M водн. K2CO3 (100 мл). Органический слой отделяли, промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в CH2Cl2, а затем методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы, с получением (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (89 мг, 7%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,41 (с, 1H), 8,06 (дд, J=2,5, 9,5 Гц, 1H), 7,85 (д, J=7,5 Гц, 1H), 7,66 (с, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,21 (дд, J=1,3, 8,3 Гц, 1H), 5,47 (с, 2H), 4,67 (м, 1H), 3,90 (м, 1H), 3,84 (м, 1H), 1,64-1,74 (м, 2H), 1,43-1,63 (м, 4H), 1,25-1,34 (м, 2H); ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 163
Получение транс-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
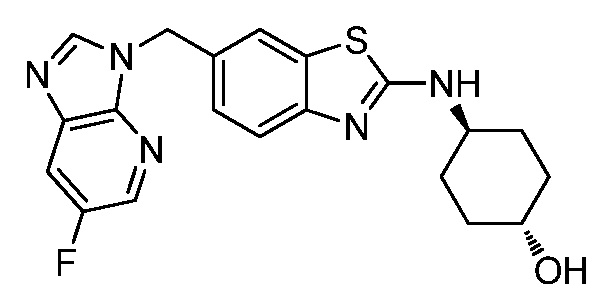
К перемешиваемой суспензии 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (119 г, 0,3 ммоль), полученного на стадии 4 примера 162, и транс-4-аминоциклогексанола (119 мг, 1,0 ммоль) в безводном DMA (1 мл) добавляли DIEA (180 мкл, 1,0 ммоль). Смесь нагревали в герметизированной пробирке при 110°C в течение 15 ч. Смесь охлаждали до к.т. и очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением транс-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (50 мг, 37%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,41 (с, 1H), 8,06 (дд, J=2,6, 9,3 Гц, 1H), 7,92 (д, J=7,3 Гц, 1H), 7,66 (с, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 5,48 (с, 2H), 4,55 (м, 1H), 3,60 (м, 1H), 3,40 (м, 1H), 1,93-2,03 (м, 2H), 1,78-1,87 (м, 2H), 1,19-1,30 (м, 4H); ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 164
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-7-фторбензо[d]тиазол-2-ил)амино)циклогексанола
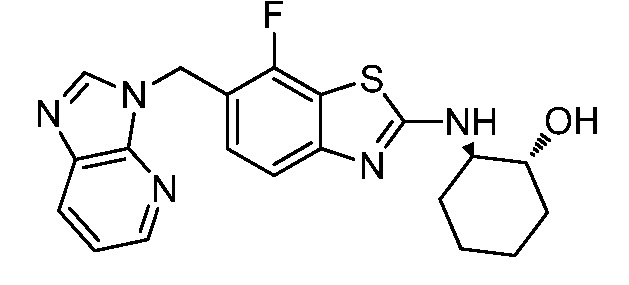
Стадия 1: 6-(Метоксикарбонил)-7-фторбензо[d]тиазол-2-тиолят калия синтезировали в виде коричневого масла (1,2 г) с использованием методики, аналогичной описанной на стадии 1 примера 114, заменяя этил-6-амино-5-бромникотинат, использованный в примере 114, метил-4-амино-2,3-дифторбензоатом. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС (ИЭР) m/z 243 (M+H)+.
Стадия 2: Метил-7-фтор-2-(метилтио)бензо[d]тиазол-6- карбоксилат синтезировали в виде прозрачного масла (400 мг, 29%) с использованием методики, аналогичной описанной на стадии 2 примера 114, заменяя этил-2-меркаптотиазоло[4,5-b]пиридин-6-карбоксилат калия, использованный в примере 114, 6-(метоксикарбонил)-7-фторбензо[d]тиазол-2-тиолятом калия, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,96 (м, 1H), 7,77 (д, J=8,6 Гц, 1H), 3,89 (с, 3H), 2,85 (с, 3H); ЖХМС (ИЭР) m/z 258 (M+H)+.
Стадия 3: (7-Фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанол синтезировали в виде белого твердого вещества (249 мг, 69%) с использованием методики, аналогичной описанной на стадии 3 примера 36, заменяя этил-2-(метилтио)бензо[d]тиазол-6-карбоксилат, использованный в примере 36, метил-7-фтор-2-(метилтио)бензо[d]тиазол-6-карбоксилатом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,70 (д, J=8,4 Гц, 1H), 7,56 (т, J=7,8 Гц, 1H), 5,39 (т, J=5,8 Гц, 1H), 4,64 (д, J=5,7 Гц, 2H), 2,81 (с, 3H); ЖХМС (ИЭР) m/z 230 (M+H)+.
Стадия 4: 6-(Хлорметил)-7-фтор-2-(метилтио)бензо[d]тиазол синтезировали в виде белого твердого вещества (258 мг) с использованием методики, аналогичной описанной на стадии 4 примера 114, заменяя (2-(метилтио)тиазоло[4,5-b]пиридин-6-ил)метанол, использованный в примере 114, метил-(7-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 248 (M+H)+.
Стадия 5: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-7-фтор-2-(метилтио)бензо[d]тиазол синтезировали в виде желтого твердого вещества (200 мг, 61%) с использованием методики, аналогичной описанной на стадии 5 примера 114, заменяя 6-(хлорметил)-2-(метилтио)тиазоло[4,5-b]пиридин, использованный в примере 114, 6-(хлорметил)-7-фтор-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,60 (с, 1H), 8,36 (дд, J=1,0, 4,7 Гц, 1H), 8,10 (дд, J=1,1, 8,0 Гц, 1H), 7,67 (д, J=8,4 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 7,29 (дд, J=4,8, 8,0 Гц, 1H), 5,68 (с, 2H), 2,80 (с, 3H); ЖХМС (ИЭР) m/z 331 (M+H)+.
Стадия 6: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-7-фтор-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде желтого твердого вещества (350 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-7-фтор-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 347 (M+H)+.
Стадия 7: (1R,2R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-7-фторбензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (75 мг, 31%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-7-фтор-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,53 (с, 1H), 8,37 (дд, J=1,2, 4,7 Гц, 1H), 8,26 (д, J=7,6 Гц, 1H), 8,09 (дд, J=1,2, 8,1 Гц, 1H), 7,29 (дд, J=4,8, 8,0 Гц, 1H), 7,11-7,23 (м, 2H), 5,56 (с, 2H), 4,77 (д, J=4,9 Гц, 1H), 3,50 (м, 1H), 3,32 (м, 1H), 2,03 (м, 1H), 1,88 (м, 1H), 1,56-1,68 (м, 2H), 1,12-1,32 (м, 4H); ЖХМС (ИЭР) m/z 398 (M+H)+.
Пример 165
Получение (1R,2R)-2-((6-((6-метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
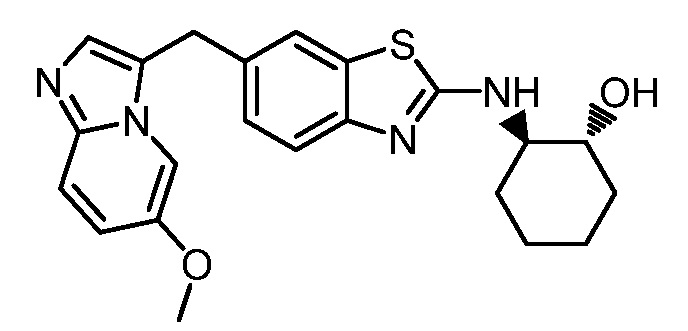
(1R,2R)-2-((6-((6-Метоксиимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (58 мг, 6%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 5-метоксипиридин-2-амином и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,88 (д, J=7,4 Гц, 1H), 7,78 (с, 1H), 7,55 (с, 1H), 7,47 (д, J=9,8 Гц, 1H), 7,30 (с, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,13 (д, J=8,4 Гц, 1H), 7,00 (дд, J=2,0, 9,8 Гц, 1H), 4,76 (шир. с, 1H), 4,26 (с, 2H), 3,74 (с, 3H), 3,51 (шир. с, 2H), 2,04 (д, J=12,8 Гц, 1H), 1,87-1,92 (м, 1H), 1,55-1,71 (м, 2H), 1,11-1,35 (м, 4H). ЖХМС (ИЭР) m/z 409 (M+H)+.
Пример 166
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бромбензо[d]тиазол-2-ил)амино)циклогексанола
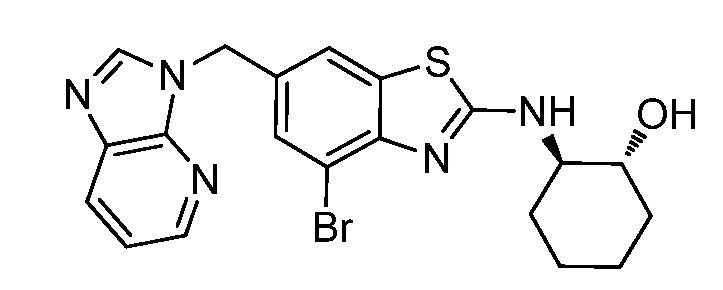
Стадия 1: К перемешиваемой смеси 4-амино-3-фторбензонитрила (5 г, 37 ммоль) в безводном CH2Cl2 (40 мл) в атмосфере Ar при к.т. по каплям добавляли N-бромсукцинимид (6,5 г, 37 ммоль). Спустя 15 ч, смесь концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→50% EtOAc в гексанах, с получением 4-амино-3-бром-5-фторбензонитрила (6,4 г, 81%) в виде рыжеватого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,76 (с, 1H), 7,62 (дд, J=1,5, 11,1 Гц, 1H), 6,44 (с, 2H); ЖХМС (ИЭР) m/z 214, 216 (M+H)+.
Стадия 2: 4-Бром-6-цианбензо[d]тиазол-2-тиолят калия синтезировали в виде коричневого масла (9,3 г) с использованием методики, аналогичной описанной на стадии 1 примера 154, заменяя 4-амино-2,5-дифторбензонитрил, использованный в примере 154, 4-амино-3-бром-5-фторбензонитрилом, полученным на предшествующей стадии, и исключая хроматографию, использованную на стадии 1 примера 154. ЖХМС (ИЭР) m/z 269, 271 (M+H)+.
Стадия 3: 4-Бром-2-(метилтио)бензо[d]тиазол-6-карбонитрил синтезировали в виде желтого твердого вещества (1,0 г, 12%) с использованием методики, аналогичной описанной на стадии 2 примера 114, заменяя этил-2-меркаптотиазоло[4,5-b]пиридин-6- карбоксилат калия, использованный в примере 114, 4-бром-6-цианбензо[d]тиазол-2-тиолятом калия, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 284, 286 (M+H)+.
Стадия 4: (4-Бром-2-(метилтио)бензо[d]тиазол-6-ил)метанамин синтезировали в виде прозрачного масла (794 мг, 79%) с использованием методики, аналогичной описанной на стадии 3 примера 154, заменяя 5-фтор-2-(метилтио)бензо[d]тиазол-6-карбонитрил, использованный в примере 154, 4-бром-2-(метилтио)бензо[d]тиазол-6-карбонитрилом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 288, 290 (M+H)+.
Стадия 5: N-((4-Бром-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин синтезировали в виде желтого твердого вещества (115 мг, 39%) с использованием методики, аналогичной описанной на стадии 4 примера 154, заменяя (5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамин, использованный в примере 154, (4-бром-2-(метилтио)бензо[d]тиазол-6-ил)метанамином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 410, 412(M+H)+.
Стадия 6: N2-((4-Бром-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин синтезировали в виде красного твердого вещества (120 мг) с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, N-((4-бром-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 380, 382 (M+H)+.
Стадия 7: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-4-бром-2-(метилтио)бензо[d]тиазол синтезировали в виде оранжевого твердого вещества (180 мг) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, N2-((4-бром-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 390, 392 (M+H)+.
Стадия 8: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-4-бром-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде желтой пены (211 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бром-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 406, 408 (M+H)+.
Стадия 9: (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бромбензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (9 мг, 7%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-бром-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,61 (с, 1H), 8,29-8,41 (м, 2H), 8,09 (дд, J=1,2, 8,1 Гц, 1H), 7,68 (с, 1H), 7,49 (д, J=1,2 Гц, 1H), 7,30 (м, 1H), 5,47 (с, 2H), 4,85 (м, 1H), 3,35 (м, 1H), 1,99 (м, 1H), 1,88 (м, 1H), 1,60-1,66 (м, 2H), 1,13-1,33 (м, 5H); ЖХМС (ИЭР) m/z 457, 459 (M+H)+.
Пример 167
Получение (1R,2R)-2-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
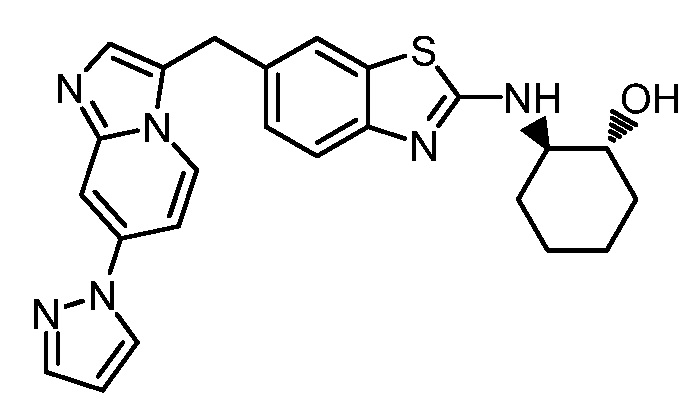
Стадия 1: (1R,2R)-2-((6-((7-Йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (50 мг, 13%) получали в виде светло-коричневого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-йодпиридин-2-амином и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. ЖХМС (ИЭР) m/z 505 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((7-(1H-Пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (7 мг, 16%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 141, (1R,2R)-2-((6-((7-йодимидазо[1,2-a]пиридин-3- ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,64 (д, J=2,6 Гц, 1H), 8,32 (д, J=6,7 Гц, 1H), 7,98 (шир. с, 1H), 7,87 (д, J=7,3 Гц, 1H), 7,79 (с, 1H), 7,54 (с, 2H), 7,44 (шир. с, 1H), 7,28 (д, J=8,3 Гц, 1H), 7,12 (д, J=7,3 Гц, 1H), 6,59 (с, 1H), 4,74 (шир. с, 1H), 4,31 (с, 2H), 3,48-3,57 (м, 2H), 2,03 (д, J=10,9 Гц, 1H), 1,87 (д, J=10,4 Гц, 1H), 1,54-1,71 (м, 2H), 1,09-1,38 (м, 4H), ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 168
Получение (1R,2R)-2-((6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифторбензо[d]тиазол-2-ил)амино)циклогексанола
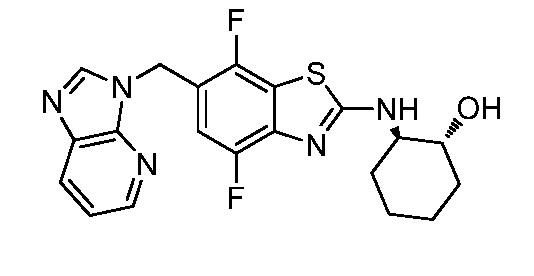
Стадия 1: 4-Амино-3-бром-2,5-дифторбензонитрил синтезировали в виде желтого твердого вещества (2,4 г, 73%) с использованием методики, аналогичной описанной на стадии 1 примера 166, заменяя 4-амино-3-фторбензонитрил, использованный в примере 166, 4-амино-2,5-дифторбензонитрилом. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,71 (дд, J=5,9, 11,1 Гц, 1H), 6,89 (шир. с, 2H); ЖХМС (ИЭР) m/z 232, 234 (M+H)+.
Стадия 2: 6-Циан-4,7-дифторбензо[d]тиазол-2-тиолят калия синтезировали в виде коричневого масла (3,93 г) с использованием методики, аналогичной описанной на стадии 1 примера 154, заменяя 4-амино-2,5-дифторбензонитрил, использованный в примере 154, 4-амино-3-бром-2,5-дифторбензонитрилом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 228 (M+H)+.
Стадия 3: 4,7-Дифтор-2-(метилтио)бензо[d]тиазол-6-карбонитрил синтезировали в виде желтого твердого вещества (1,0 г, 37%) с использованием методики, аналогичной описанной на стадии 2 примера 114, заменяя этил-2-меркаптотиазоло[4,5-b]пиридин-6-карбоксилат калия, использованный в примере 114, 6-циан-4,7-дифторбензо[d]тиазол-2-тиолятом калия, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,04 (м, 1H), 2,88 (с, 3H). ЖХМС (ИЭР) m/z 243 (M+H)+.
Стадия 4: (4,7-Дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамин синтезировали в виде прозрачного масла (646 мг, 64%) с использованием методики, аналогичной описанной на стадии 3 примера 154, заменяя 5-фтор-2-(метилтио)бензо[d]тиазол-6-карбонитрил, использованный в примере 154, 4,7-дифтор-2-(метилтио)бензо[d]тиазол-6-карбонитрилом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 247 (M+H)+.
Стадия 5: N-((4,7-Дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амин синтезировали в виде желтого масла (187 мг, 39%) с использованием методики, аналогичной описанной на стадии 4 примера 154, заменяя (5-фтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамин, использованный в примере 154, (4,7-дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метанамином, полученным на предшествующей стадии. 1H ЯМР (500 МГц, CDCl3) δ 8,99 (т, J=6,0 Гц, 1H), 8,40-8,48 (м, 2H), 7,36 (дд, J=5,5, 11,0 Гц, 1H), 6,80 (дд, J=4,4, 8,4 Гц, 1H), 4,91 (д, J=6,2 Гц, 2H), 2,82 (с, 3H); ЖХМС (ИЭР) m/z 369 (M+H)+.
Стадия 6: N2-((4,7-Дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-диамин синтезировали в виде желтого твердого вещества (190 мг) с использованием методики, аналогичной описанной на стадии 2 примера 41, заменяя 4-бром-5-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 41, N-((4,7-дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитропиридин-2-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 339 (M+H)+.
Стадия 7: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифтор-2-(метилтио)бензо[d]тиазол синтезировали в виде оранжевого твердого вещества (220 мг) с использованием методики, аналогичной описанной на стадии 3 примера 41, заменяя 4-бром-5-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 41, N2-((4,7-дифтор-2-(метилтио)бензо[d]тиазол-6-ил)метил)пиридин-2,3-амином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 349 (M+H)+.
Стадия 8: 6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифтор-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде желтой пены (200 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифтор-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 364 (M+H)+.
Стадия 9: (1R,2R)-2-((6-((3H-Имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифторбензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (58 мг, 25%) с использованием методики, аналогичной описанной на стадии 7 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2- (метилсульфинил)бензо[d]тиазол, использованный в примере 36, 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4,7-дифтор-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,45-8,58 (м, 2H), 8,38 (д, J=4,7 Гц, 1H), 8,09 (д, J=8,0 Гц, 1H), 7,29 (дд, J=4,7, 8,0 Гц, 1H), 7,16 (дд, J=5,8, 10,8 Гц, 1H), 5,54 (с, 2H), 4,80 (д, J=5,2 Гц, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,02 (м, 1H), 1,88 (м, 1H), 1,57-1,67 (м, 2H), 1,17-1,32 (м, 4H). ЖХМС (ИЭР) m/z 416 (M+H)+.
Пример 169
Получение (1R,2R)-2-((6-((7-(1H-1,2,4-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
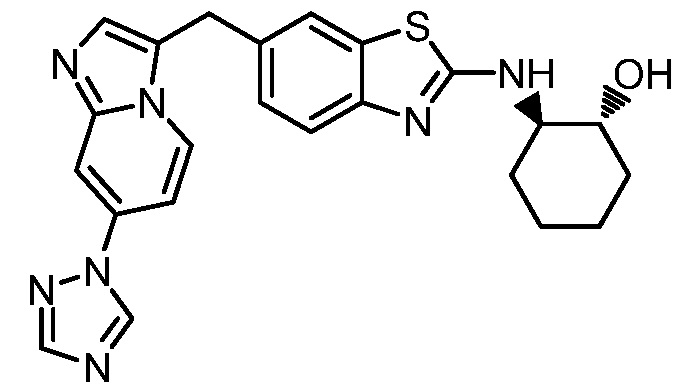
(1R,2R)-2-((6-((7-(1H-1,2,4-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (50 мг, 57%) получали в виде светло-желтого порошка с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованный в примере 141, (1R,2R)-2-((6-((7-йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 примера 167, и 1H-1,2,4-триазолом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,41 (с, 1H), 8,40 (д, J=7,3 Гц, 1H), 8,28 (с, 1H), 8,08 (с, 1H), 7,90 (д, J=7,3 Гц, 1H), 7,54 (с, 1H), 7,50 (с, 1H), 7,48 (д, J=5,7 Гц, 1H), 7,28 (д, J=8,3 Гц, 1H), 7,11 (д, J=8,3 Гц, 1H), 4,76 (шир. с, 1H), 4,34 (с, 2H), 3,48-3,56 (м, 2H), 2,04 (д, J=11,4 Гц, 1H), 1,88-1,93 (м, 1H), 1,53-1,70 (м, 2H), 1,08-1,36 (м, 4H). ЖХМС (ИЭР) m/z 446 (M+H)+.
Пример 170
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила
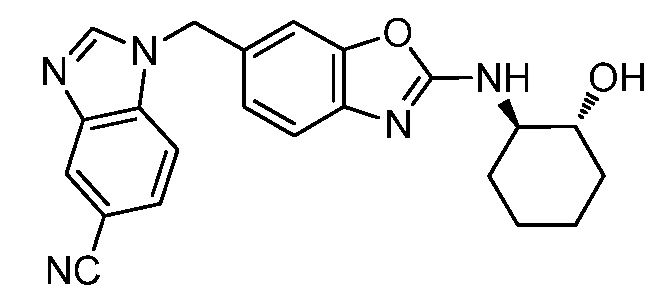
Стадия 1: К раствору 4-бром-2-нитроанилина (400 мг, 1,84 ммоль) и TFA (1,89 мл) в DCM (8 мл) при -5°C добавляли NaBH(OAc)3 (1,17 г, 5,52 ммоль). Затем, при 0°C к смеси добавляли раствор 2-(метилтио)бензо[d]оксазол-6-карбальдегида (391 мг, 2,03 ммоль) в DCM (7 мл), и перемешивали смесь при 0°C в течение 2 ч. Смесь разбавляли DCM и промывали H2O, водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (20/1→10/1), с получением 4-бром-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина в виде желтого твердого вещества (704 мг, 97,4%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,80 (т, 1H), 8,15 (с, 1H), 7,64 (с, 1H), 7,50-7,60 (м, 2H), 7,35 (д, J=8,4 Гц, 1H), 6,90 (д, J=9,3 Гц, 1H), 4,72 (д, J=6,6 Гц, 1H), 2,73 (с,3H). ЖХМС (ИЭР) m/z 394 (M+H)+.
Стадия 2: К перемешиваемому раствору 4-бром-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина (704 мг, 1,79 ммоль), HOAc (2,1 мл) и метанола (2,1 мл) в DCM (18 мл) при 0°C порциями добавляли цинковую пыль (1,16 г, 17,9 ммоль). После перемешивания в течение 2 ч, смесь фильтровали. Фильтрат промывали водн. NaHCO3 и солевым раствором. Органический слой сушили над NaSO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-бром-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (469 мг, 71,9%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,72-7,60 (м, 2H), 7,53 (д, J=5,4 Гц, 1H), 6,68 (с, 1H), 6,49 (д, J=1,8 Гц, 1H), 6,23 (д, J=8,1 Гц, 1H), 5,36 (т, 1H), 4,90 (с, 2H), 4,38 (д, J=6,0 Гц, 2H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 365 (M+H)+.
Стадия 3: Смесь 4-бром-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (465 мг, 2,40 ммоль), триэтилортоформиата (3,8 мл) и HCOOH (0,06 мл) перемешивали при 90°C в течение 40 мин. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/1), с получением 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола в виде светло-коричневого твердого вещества (327 мг, 68,3%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,50 (с, 1H), 7,85 (с, 1H), 7,68 (с, 1H), 7,55-7,60 (м, 2H), 7,30-7,37 (м, 2H), 5,60 (с, 2H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 375 (M+H)+.
Стадия 4: Раствор 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (327 мг, 0,87 ммоль) и m-CPBA (226 мг, 1,31 ммоль) в DCM (6 мл) перемешивали при 0°C в течение 3,5 ч. Смесь промывали водн. Na2S2O3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/5), с получением 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (256 мг, 75,52%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,54 (с, 1H), 7,97 (с, 1H), 7,87-7,89 (м, 2H), 7,57 (д, J=9,0 Гц, 1H), 7,46 (д, J=9,6 Гц, 1H), 7,36 (д, J=6,6 Гц, 1H), 5,68 (с, 2H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 391 (M+H)+.
Стадия 5: Смесь 6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)-2-(метил-сульфинил)бензо[d]оксазола (206 мг, 0,53 ммоль), (1R,2R)-2-аминоциклогексанола (91 мг, 0,79 ммоль) и DIEA (136 мг, 1,06 ммоль) в DMA (4 мл) перемешивали при 120°C в течение 2 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанол в виде светло-желтого твердого вещества (175 мг, 74,8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1H), 7,81- 7,84 (м, 2H), 7,56 (д, J=8,7 Гц, 1H), 7,33-7,36 (с, 1H), 7,12 (с, 2H), 5,48 (с, 1H), 4,68 (д, J=4,2 Гц, 1H) , 3,35 (шир. с, 2H), 1,90 (шир. с, 2H), 1,62 (шир. с, 2H), 1,22 (шир. с, 4H). ЖХМС (ИЭР) m/z 442 (M+H)+.
Стадия 6: Смесь (1R,2R)-2-((6-((5-бром-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (126 мг, 0,29 ммоль), Zn(CN)2 (134 мг, 1,14 ммоль), Pd2(dba)3 (53 мг, 0,06 ммоль) и dppf (63 мг, 0,12 ммоль) в DMF (4 мл) перемешивали при 130°C в течение 6 ч. Реакционную смесь охлаждали до к.т., вливали в воду (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила в виде белого твердого вещества (40 мг, 35,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,20 (с, 1H), 7,83-7,78 (м, 2H), 7,61 (д, J=6,9 Гц, 1H), 7,41 (с, 1H), 7,14 (с, 1H), 5,54 (с, 2H), 4,68 (д, 1H), 3,32 (шир. с, 2H), 1,91 (шир. с, 2H), 1,62 (шир. с, 2H), 1,22 (шир. с, 4H). ЖХМС (ИЭР) m/z 388 (M+H)+.
Пример 171
Получение (1R,2R)-2-((6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
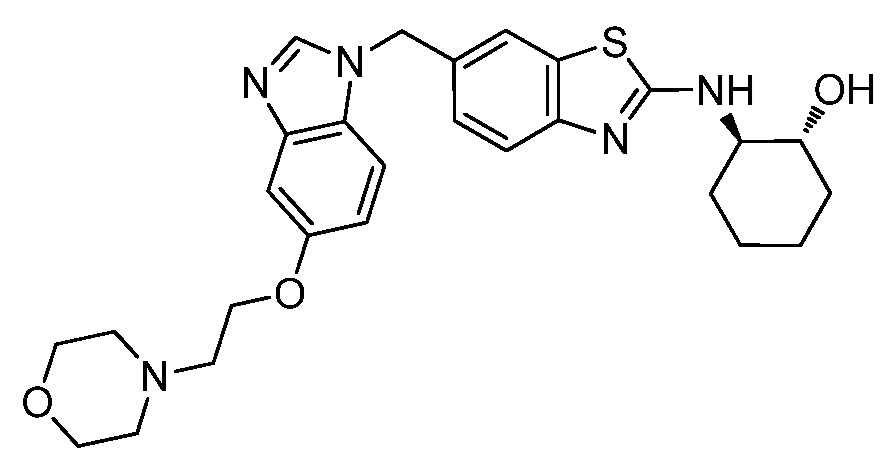
Стадия 1: К смеси 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (2,4 г, 6,07 ммоль), полученного в примере 147, и 2,2-диметоксипропана (8 г, 76,81 ммоль) в 1,4-диоксане (200 мл) добавляли пара-толуолсульфоновую кислоту (0,15 г, 0,8 ммоль). Реакционную смесь нагревали при 100°C в течение 15 ч. Смесь распределяли между насыщенным водн. NaHCO3 и DCM. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2→10% MeOH в DCM, с получением 1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (0,9 г, 34%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,99 (с, 1H), 8,24 (с, 1H), 7,79 (с, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,24-7,30 (м, 2H), 6,94 (с, 1H), 6,68 (м, 1H), 5,43 (с, 2H), 3,68 (м, 1H), 3,05 (м, 1H), 2,67 (м, 1H), 2,04 (м, 1H), 1,76-1,78 (м, 2H), 1,70 (с, 3H), 1,53 (с, 3H), 1,26-1,39 (м, 4H); ЖХМС (ИЭР) m/z 435 (M+H)+.
Стадия 2: Перемешиваемую смесь 4-(2-хлорэтил)морфолина (1 г, 5,4 ммоль) и KI (4,5 г, 26,8 ммоль) в ацетоне (15 мл) нагревали при 75°C в течение 24 ч. Смесь разбавляли насыщенным водн. NaHCO3 и экстрагировали DCM. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-(2-йодэтил)морфолина (0,8 г, 62%) в виде бледно-желтого масла, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 3,71 (т, J=9,0 Гц, 4H), 3,20 (т, J=7,8 Гц, 2H), 2,72 (т, J=7,8 Гц, 2H), 2,49 (т, J=9,3 Гц, 4H). ЖХМС (ИЭР) m/z 242 (M+H)+.
Стадия 3: Смесь 1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (100 мг, 0,23 ммоль), полученного на стадии 1 этого примера, 4-(2-йодэтил)морфолина (111 мг, 0,46 ммоль), полученного на стадии 2 этого примера, Cs2CO3 (250 мг, 0,69 ммоль) и NMP (2 мл) перемешивали при к.т. в течение 3 ч. Смесь разбавляли EtOAc и промывали солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 33% DCM в THF→100% THF, с получением (3aR,7aR)-2,2-диметил-3-(6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)октагидробензо[d]оксазола (84 мг, 67%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,90 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,40 (с, 1H), 7,29 (с, 1H), 7,14-7,19 (м, 2H), 6,90 (м, 1H), 5,35 (с, 2H), 4,11-4,17 (м, 2H), 3,70-3,75 (м, 4H), 3,65 (м, 1H), 3,08 (м, 1H), 2,76-2,84 (м, 3H), 2,57-2,60 (м, 4H), 2,17 (м, 1H), 1,82-1,92 (м, 2H), 1,78 (с, 3H), 1,46 (с, 3H), 1,33-1,39 (м, 4H); ЖХМС (ИЭР) m/z 548 (M+H)+.
Стадия 4: К перемешиваемой смеси (3aR,7aR)-2,2-диметил-3-(6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)октагидробензо[d]оксазола (85 мг, 0,15 ммоль), полученного на предшествующей стадии, в DCM (10 мл) при 0°C добавляли раствор HCl в метаноле (3 капли). Реакционную смесь перемешивали при 0°C в течение 10 мин. Значение pH смеси корректировали до pH~7 добавлением триэтиламина, а затем концентрировали в условиях пониженного давления. Остаток сразу очищали методом препаративной HPLC с обращенной фазой с получением (1R,2R)-2-((6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (20 мг, 25%) в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,97 (м, 1H), 7,62 (с, 1H), 7,39 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,17 (д, J=6,9 Гц, 2H), 6,83 (м, 1H), 5,41 (с, 2H), 4,73 (д, J=5,4 Гц, 1H), 4,08 (т, J=11,7 Гц, 2H), 3,57 (т, J=9,1 Гц, 4H), 3,47-3,52 (м, 2H), 2,68 (т, J=11,7 Гц, 2H), 2,46 (т, J=9,3 Гц, 4H), 2,02 (м, 1H), 1,87 (м, 1H), 1,59-1,63 (шир. с, 2H), 1,16-1,28 (м, 4H). ЖХМС (ИЭР) m/z 508 (M+H)+.
Пример 172
Получение (1R,2R)-2-((6-((5-(2-гидроксиэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
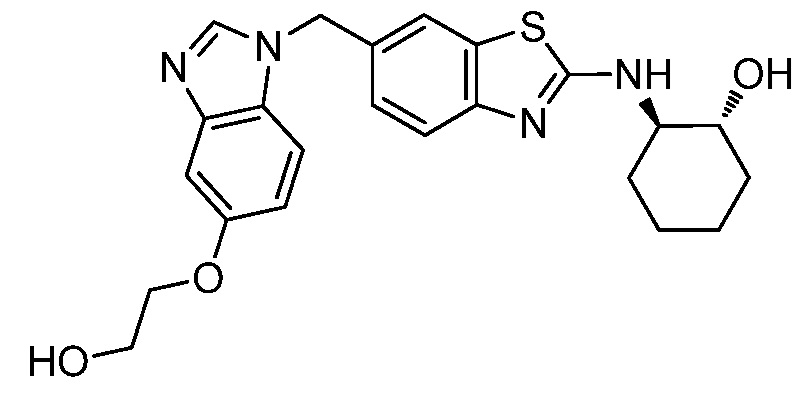
Стадия 1: Перемешиваемую смесь 1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (60 мг, 0,14 ммоль), полученного на стадии 1 примера 171, 2-йодэтанола (60 мг, 0,35 ммоль), Cs2CO3 (137 мг, 0,42 ммоль) и NMP (2 мл) нагревали при 100°C в течение 24 ч. Смесь разбавляли EtOAc и промывали солевым раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной TLC с получением 2-((1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)этанола (26 мг, 39%) в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,93 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,40 (с, 1H), 7,32 (с, 1H), 7,16-7,19 (м, 2H), 6,91 (м, 1H), 5,36 (с, 2H), 4,13 (т, J=9,0 Гц, 2H), 3,98 (т, J=9,0 Гц, 2H), 3,65 (м, 1H), 3,08 (м, 1H), 2,80 (м, 1H), 2,14 (м, 1H), 1,84-1,92 (м, 2H), 1,78 (с, 3H), 1,63 (с, 3H), 1,28-1,40 (м, 4H); ЖХМС (ИЭР) m/z 479 (M+H)+.
Стадия 2: К перемешиваемой смеси 2-((1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6- ил)метил)-1H-бензо[d]имидазол-5-ил)окси)этанола (70 мг, 0,15 ммоль), полученного на предшествующей стадии, в DCM (5 мл) при 0°C добавляли раствор HCl в метаноле (3 капли). Реакционную смесь перемешивали при 0°C в течение 10 мин. Значение pH смеси корректировали до pH~7 добавлением триэтиламина, и концентрировали в условиях пониженного давления. Остаток сразу очищали методом препаративной HPLC с обращенной фазой с получением ((1R,2R)-2-((6-((5-(2-гидроксиэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (30 мг, 47%) в виде светло-желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,95 (д, J=7,2 Гц, 1H), 7,62 (с, 1H), 7,40 (д, J=9,0 Гц, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,16-7,18 (м, 2H), 6,84 (м, 1H), 5,41 (с, 2H), 4,83 (шир. с, 1H), 4,72 (д, J=4,5 Гц, 1H), 3,98 (т, J=9,6 Гц, 2H), 3,71 (д, J=4,5 Гц, 2H), 3,52 (м, 1H), 3,33 (шир. с, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,61-1,63 (м, 2H), 1,22-1,28 (м, 4H); ЖХМС (ИЭР) m/z 439 (M+H)+.
Пример 173
1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-бензо[d]имидазол-5-карбоксамида
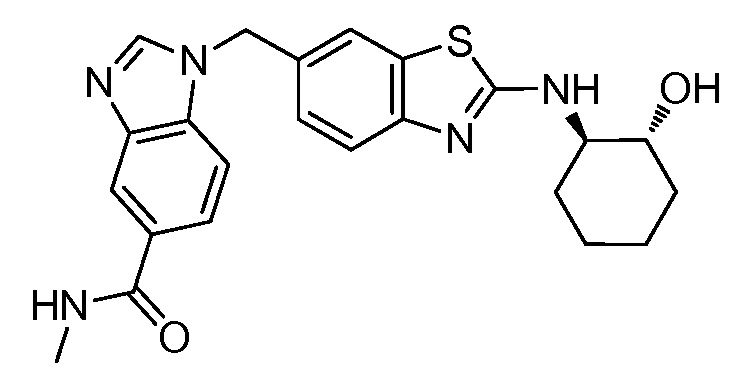
Стадия 1: Метил-4-(((2-(метилтио)бензо[d]тиазол-6-ил)метил)амино)-3-нитробензоат (1,80 г, 91%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, метил-4-амино-3-нитробензоатом. 1H ЯМР (300 МГц, CDCl3) δ 9,15 (шир. с, 1H), 8,63 (с, 1H), 7,98 (с, 1H), 7,88 (дд, J=9,0, 2,4 Гц, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,47 (дд, J=8,7, 1,8 Гц, 1H), 7,02 (д, J=9,0 Гц, 1H), 4,81 (д, J=5,7 Гц, 2H), 3,80 (с, 3H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 391 (M+H)+.
Стадия 2: Метил-3-амино-4-(((2-(метилтио)бензо[d]тиазол-6-ил)метил)амино)бензоат (1,01 г, 62%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 129, заменяя 4-фтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 129, 4-(((2-(метилтио)бензо[d]тиазол-6-ил)метил)амино)-3-нитробензоатом, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 360 (M+H)+.
Стадия 3: Метил-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H бензо[d]имидазол-5-карбоксилат (0,42 г, 42%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 130, заменяя N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамин, использованный в примере 130, метил-3-амино-4-(((2-(метилтио)бензо[d]тиазол-6-ил)метил)амино)бензоатом, полученным на стадии 2 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,05 (с, 1H), 7,98 (дд, J=8,7, 1,5 Гц, 1H), 7,83 (д, J=8,4 Гц, 1H), 7,51 (с, 1H), 7,26-7,32 (м, 2H), 5,48 (с, 2H), 3,94 (с, 3H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 370 (M+H)+.
Стадия 4: Метил-1-((2-(метилсульфинил)бензо[d]тиазол-6- ил)метил)-1H-бензо[d]имидазол-5-карбоксилат (0,40 г, 93%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, метил-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбоксилатом, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,56 (с, 1H), 8,09 (с, 1H), 7,91-8,05 (м, 2H), 7,79 (с, 1H), 7,39 (дд, J=8,7, 1,6 Гц, 1H), 7,29 (д, J=8,7 Гц, 1H), 5,56 (с, 2H), 3,94 (с, 3H), 3,06 (с, 3H); ЖХМС (ИЭР) m/z 386 (M+H)+.
Стадия 5: Метил-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)этил)-1H-бензо[d]имидазол-5-карбоксилат (0,27 г, 60%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 130, заменяя 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, метил-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбоксилатом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,51 (с, 1H), 8,01 (с, 1H), 9,76 (дд, J=8,4, 1,5 Гц, 1H), 7,46 (д, J=8,1 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 7,13 (дд, J=8,1, 1,2 Гц, 1H), 7,27 (с, 1H), 5,35 (с, 2H), 3,92 (с, 3H), 3,48-3,51 (м, 2H), 2,01-2,03 (м, 2H), 1,70 (шир. м, 2H), 1,25-1,32 (м, 4H); ЖХМС (ИЭР) m/z 438 (M+H)+.
Стадия 6: Смесь метил-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)этил)-1H- бензо[d]имидазол-5-карбоксилата (0,27 г, 0,61 ммоль), полученного на предшествующей стадии, гидроксида лития (84 мг, 3,05 ммоль), THF (20 мл) и воды (4 мл) перемешивали при к.т. в течение 3 ч. Смесь концентрировали в условиях пониженного давления, и корректировали значение pH до 4-5. Смесь экстрагировали EtOAc (3×30 мл), объединенные органические слои промывали водой (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбоновой кислоты (0,15 г, 58%) в виде белого твердого вещества, которое дополнительно не очищали. 1H ЯМР (300 МГц, CDCl3) δ 8,25 (с, 1H), 7,94 (с, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,27 (м, 1H), 7,18-7,21 (м, 2H), 7,06 (м, 1H), 5,25 (с, 2H), 3,30-3,39 (м, 2H), 1,98 (м, 1H), 1,86 (м, 1H), 1,53-1,56 (м, 2H), 1,06-1,16 (м, 4H); ЖХМС (ИЭР) m/z 424 (M+H)+.
Стадия 7: Смесь 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбоновой кислоты (100 мг, 0,24 ммоль), полученной на предшествующей стадии, метиламина (1 мл, 22,5 ммоль), DIEA (91 мг, 0,35 ммоль) и DMF (5 мл) перемешивали при к.т. в течение 15 мин. Добавляли HATU (180 мг, 0,23 ммоль), и перемешивали смесь при к.т. в течение 15 ч. Реакционную смесь разбавляли EtOAc (50 мл) и последовательно промывали водой (10 мл) и солевым раствором (10 мл). Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток сразу очищали методом препаративной HPLC с обращенной фазой с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-N-метил-1H-бензо[d]имидазол-5-карбоксамида (26 мг, 25%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1H), 8,37 (шир. с, 1H), 8,16 (с, 1H), 7,95 (д, J=7,5 Гц, 1H), 7,58-7,75 (м, 3H), 7,29 (м, 1H), 7,20 (м, 1H), 5,49 (с, 2H), 4,72 (д, J=5,1 Гц, 1H), 3,50 (м, 1H), 3,35 (м, 1H), 2,50 (с, 3H), 2,04 (м, 1H), 1,88 (м, 1H), 1,60-1,62 (м, 2H), 1,18-1,21 (м, 4H). ЖХМС (ИЭР) m/z 436 (M+H)+.
Пример 174
Получение (1R, 2R)-2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
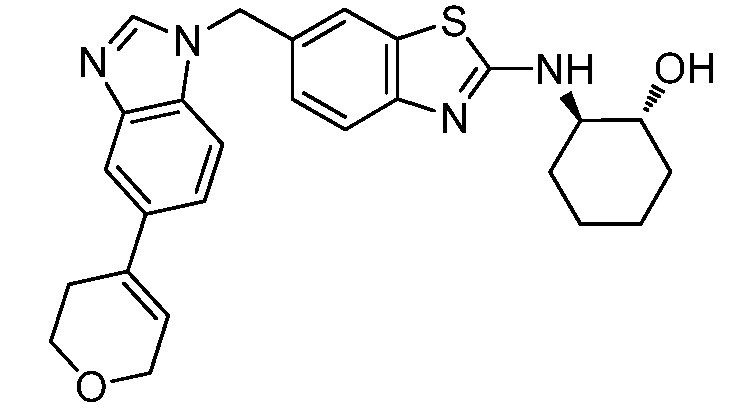
Перемешиваемую смесь (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (300 мг, 0,59 ммоль), полученного на стадии 5 примера 183, 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (188 мг, 0,89 ммоль), Na2CO3 (126 мг, 1,19 ммоль), 1,4-диоксана (3 мл) и воды (0,5 мл) продували струей азота в течение 10 мин. Добавляли дихлор[1,1′-бис(дифенилфосфино)ферроцен]палладий(II) (44 мг, 0,59 ммоль) и нагревали смесь при 100°C в течение 2 ч. Реакционную смесь охлаждали до к.т. и распределяли между EtOAc и водой. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя DCM/MeOH (30/1), а затем методом препаративной HPLC с обращенной фазой с получением (1R,2R)-2-((6-((5-(3, 6-дигидро-2H-пиран-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (54 мг, 20%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,38 (с, 1H), 7,94 (д, J=7,8 Гц, 1H), 7,67 (д, J=1,5 Гц, 1H), 7,63 (д, J=1,8 Гц, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,35 (м, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,18 (м, 1H), 6,19 (с, 1H), 5,46 (с, 2H), 4,71 (д, J=5,1 Гц, 1H), 4,22 (д, J=2,7 Гц, 2H), 3,81-3,84 (м, 2H), 3,51 (м, 1H), 3,38 (м, 1H), 2,02 (м, 1H), 2,00 (м, 1H), 1,61 (шир. с, 2H), 1,14-1,29 (м, 4H); ЖХМС (ИЭР) m/z 460 (M+H)+.
Пример 175
Получение (1R,2R)-2-((6-((5-(3,3,3-трифторпроп-1-ен-2-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
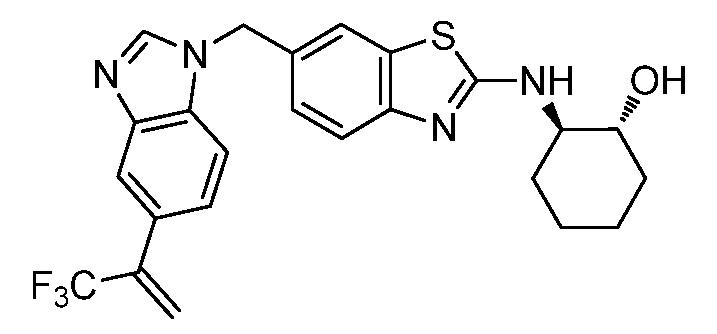
(1R,2R)-2-((6-((5-(3,3,3-Трифторпроп-1-ен-2-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (71 мг, 25%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 174, заменяя 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, использованный в примере 174, 4,4,5,5-тетраметил-2-(3,3,3-трифторпроп-1-ен-2-ил)-1,3,2-диоксабороланом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,75 (с, 1H), 7,67 (д, J=1,2 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 7,35 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 7,20 (м, 1H), 6,04 (т, J=1,8 Гц, 2H), 5,49 (с, 2H), 4,17 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,35 (м, 1H), 2,03 (м, 1H), 1,88 (м, 1H), 1,60-1,64 (м, 2H), 1,18-1,25 (м, 4H); ЖХМС (ИЭР) m/z 473 (M+H)+.
Пример 176
Получение (R)-N-(циклогекс-2-ен-1-ил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина
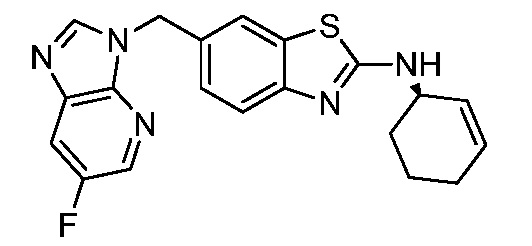
К перемешиваемой смеси (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (156 мг, 0,4 ммоль), полученного в примере 162, в CH2Cl2 (10 мл) при -78°C в атмосфере аргона добавляли трифторид диэтиламиносеры (63 мкл, 0,5 ммоль). После перемешивания смеси в течение 3 ч, добавляли дополнительное количество трифторида диэтиламиносеры (63 мкл, 0,5 ммоль). После перемешивания смеси еще в течение 3 ч, ее выливали на лед. Добавляли дополнительное количество CH2Cl2 (50 мл), и перемешивали смесь до тех пор, пока лед на растаял. Слои разделяли, органический слой промывали солевым раствором (50 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (R)-N-(циклогекс-2-ен-1-ил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина (5 мг, 3%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,41 (с, 1H), 8,03-8,13 (м, 2H), 7,68 (с, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (дд, J=1,3, 8,3 Гц, 1H), 5,83 (м, 1H), 5,72 (м, 1H), 5,48 (с, 2H), 4,40 (шир. с, 1H), 1,95-2,03 (м, 2H), 1,90 (м, 1H), 1,70 (м, 1H), 1,54-1,62 (м, 2H); ЖХМС (ИЭР) m/z 380 (M+H)+.
Пример 177
Получение (1R,2R)-2-((6-((6-бромимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
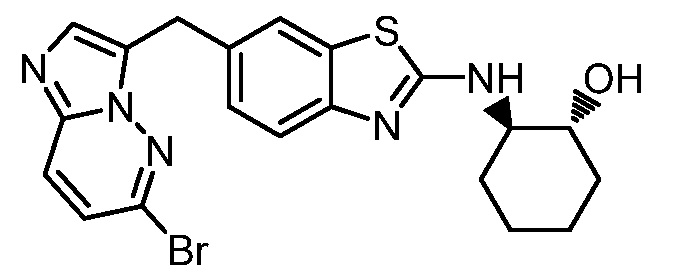
(1R,2R)-2-((6-((6-Бромимидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (25 мг, 28%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 6-бромпиридазин-3-амином и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученного на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,09 (д, J=9,8 Гц, 1H), 7,89 (д, J=7,4 Гц, 1H), 7,59 (с, 1H), 7,54 (с, 1H), 7,39 (д, J=9,4 Гц, 1H), 7,27 (д, J=7,9 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 4,76 (шир. с, 1H), 4,29 (с, 2H), 3,47-3,59 (м, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,86-1,92 (м, 1H), 1,55-1,69 (м, 2H), 1,11-1,34 (м, 4H). ЖХМС (ИЭР) m/z 458, 460 (M+H)+.
Пример 178
Получение (1R,2R)-2-((6-((6-(4-метилпиперазин-1-ил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
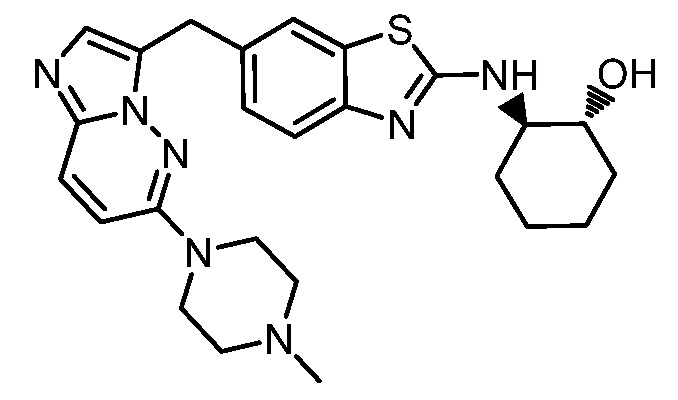
(1R,2R)-2-((6-((6-(4-Метилпиперазин-1-ил)имидазо[1,2-b]пиридазин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (40 мг, 28%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 6-(1-метилпиперидин-4-ил)пиридазин-3-амином (см. US 4104385 A1, 1978) и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученного на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,88 (д, J=7,4 Гц, 1H), 7,78 (д, J=9,8 Гц, 1H), 7,58 (с, 1H), 7,33 (шир. с, 1H), 7,24 (д, J=7,9 Гц, 1H), 7,13 (д, J=8,4 Гц, 1H), 7,10 (д, J=9,8 Гц, 1H), 4,77 (шир. с, 1H), 4,16 (с, 2H), 3,44-3,51 (м, 4H), 3,34 (тд, J=4,6, 9,0 Гц, 2H), 2,37-2,46 (м, 4H), 2,21 (с, 3H), 1,98-2,08 (м, 1H), 1,87-1,94 (м, 1H), 1,53-1,70 (м, 2H), 1,09-1,35 (м, 4H). ЖХМС (ИЭР) m/z 478 (M+H)+.
Пример 179
Получение (транс-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
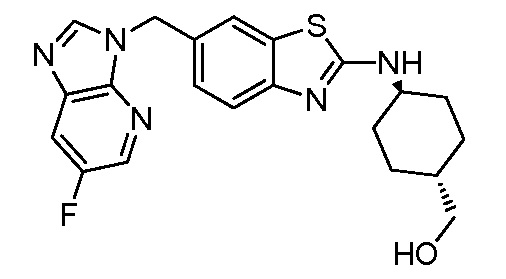
Стадия 1: К перемешиваемой суспензии гидрохлорида транс-4-аминоциклогексанкарбоновой кислоты (0,5 г, 2,8 ммоль) в безводном THF (10 мл) при 0°C в атмосфере аргона по каплям добавляли алюмогидрид лития (2 M раствор в THF, 5,6 мл, 11 ммоль). Смесь перемешивали в течение 1 ч при 0°C, а затем оставляли нагреваться до к.т. и перемешиваться еще в течение 1 ч. Затем, смесь нагревали в герметизированной пробирке при 85°C в течение 12 ч. Смесь охлаждали до 0°C, медленно добавляли H2O (600 мкл), а затем 1 M водн. NaOH (1,2 мл) и H2O (1,8 мл). Смесь разбавляли CH2Cl2 (50 мл) и перемешивали в течение 30 мин при к.т. Смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением (транс-4-аминоциклогексил)метанола (323 мг, 90%) в виде белого твердого вещества, которое не требовало дополнительной очистки.
Стадия 2: (транс-4-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3- ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол синтезировали в виде белого порошка (43 мг, 36%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола использованный в примере 162, (транс-4-аминоциклогексил)метанолом. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,41 (т, J=2,0 Гц, 1H), 8,07 (дд, J=2,6, 9,5 Гц, 1H), 7,95 (д, J=7,4 Гц, 1H), 7,66 (д, J=1,2 Гц, 1H), 7,31 (м, 1H), 7,22 (дд, J=1,6, 8,2 Гц, 1H), 5,47 (с, 2H), 4,40 (т, J=5,2 Гц, 1H), 3,58 (м, 1H), 3,22 (м, 2H), 2,00-2,07 (м, 2H), 1,73-1,80 (м, 2H), 1,32 (м, 1H), 1,13-1,25 (м, 2H), 0,92-1,03 (м, 2H); ЖХМС (ИЭР) m/z 412 (M+H)+.
Пример 180
Получение (цис-4-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
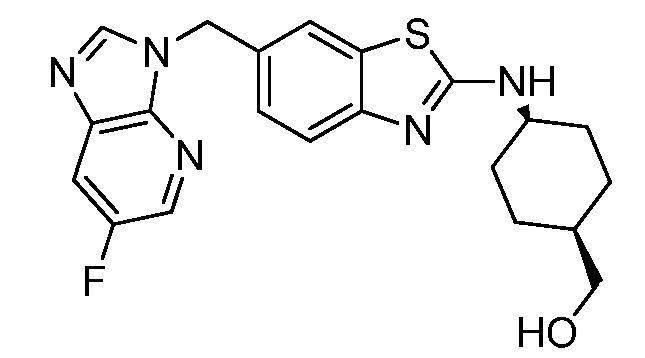
Стадия 1: (цис-4-Аминоциклогексил)метанол синтезировали в виде белого порошка (301 мг, 86%) с использованием методики, аналогичной описанной на стадии 1 примера 179, заменяя гидрохлорид транс-4-аминоциклогексанкарбоновой кислоты использованный в примере 179, цис-4-аминоциклогексанкарбоновой кислотой.
Стадия 2: (цис-4-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол синтезировали в виде белого порошка (26 мг, 21%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола, использованный в примере 162, (цис-4-аминоциклогексил)метанолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,41 (т, J=2,0 Гц, 1H), 8,07 (дд, J=2,5, 9,4 Гц, 1H), 7,98 (д, J=7,1 Гц, 1H), 7,66 (д, J=1,0 Гц, 1H), 7,30 (м, 1H), 7,23 (дд, J=1,4, 8,2 Гц, 1H), 5,48 (с, 2H), 4,41 (т, J=4,9 Гц, 1H), 3,96 (м, 1H), 3,26 (т, J=5,4 Гц, 2H), 1,70-1,78 (м, 2H), 1,4-1,60 (м, 5H), 1,28-1,38 (м, 2H); ЖХМС (ИЭР) m/z 412 (M+H)+.
Пример 181
Получение 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-((1R,2R)-2-(метилтио)циклогексил)бензо[d]тиазол-2-амина
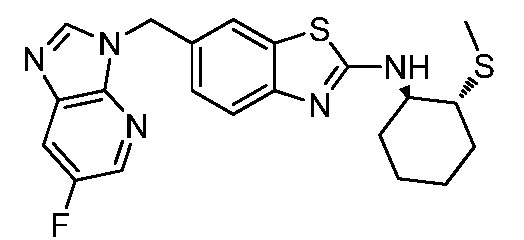
Стадия 1: К перемешиваемой смеси (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (517 мг, 1,3 ммоль), полученного в примере 162, TEA (194 мкл, 1,4 ммоль) и CH2Cl2 (15 мл) при к.т. в атмосфере аргона добавляли метансульфонилхлорид (152 мкл, 2,0 ммоль). После перемешивания смеси в течение 15 ч, добавляли доплнительное колчиество TEA (194 мкл, 1,4 ммоль) и метансульфонилхлорида (152 мкл, 2,0 ммоль). После перемешивания еще в течение 18 ч, смесь разбавляли CH2Cl2 и перемешивали насыщенным водн. NaHCO3 (50 мл) в течение 30 мин. Слои разделяли, органический слой промывали солевым раствором (50 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% гексаны→100% EtOAc, с получением (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексилметансульфоната (274 мг, 44%) в виде прозрачного масла. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,66 (с, 1H), 8,39 (т, J=1,8 Гц, 1H), 8,16 (д, J=7,4 Гц, 1H), 8,04 (дд, J=2,6, 9,5 Гц, 1H), 7,66 (д, J=1,0 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 7,22 (дд, J=1,4, 8,2 Гц, 1H), 5,46 (с, 2H), 4,98 (м, 1H), 4,06 (м, 1H), 2,99 (с, 3H), 2,01 (м, 1H), 1,54-1,72 (м, 4H), 1,34-1,50 (м, 3H); ЖХМС (ИЭР) m/z 476 (M+H)+.
Стадия 2: Смесь (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексилметансульфоната (100 мг, 0,2 ммоль) и тиометоксида натрия (74 мг, 1,0 ммоль) в DMF (1,0 мл) перемешивали при к.т. в течение 2 ч. Смесь сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-((1R,2R)-2-(метилтио)циклогексил)бензо[d]тиазол-2-амина (5 мг, 4%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,41 (т, J=1,8 Гц, 1H), 8,04-8,11 (м, 2H), 7,67 (с, 1H), 7,30 (м, 1H), 7,23 (м, 1H), 5,48 (с, 2H), 3,72 (м, 1H), 2,56 (м, 1H), 1,99-2,08 (м, 5H), 1,63-1,71 (м, 2H), 1,41-1,51 (м, 1H), 1,21- 1,36 (м, 3H); ЖХМС (ИЭР) m/z 428 (M+H)+.
Пример 182
Получение (1R,2R)-2-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
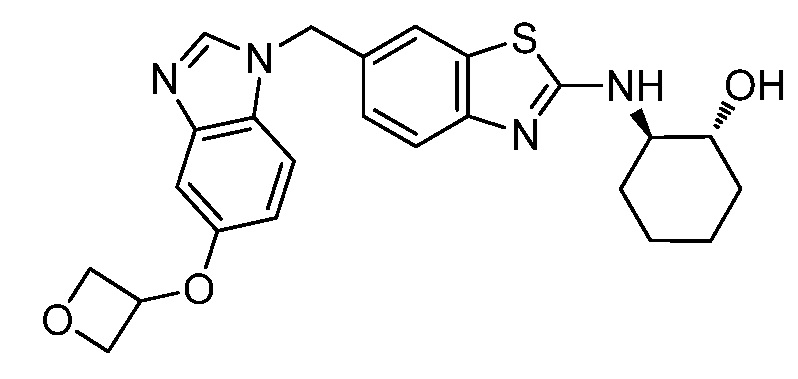
Стадия 1: К перемешиваемой смеси оксетан-3-ола (0,85 г, 11,5 ммоль) в DCM (38 мл) добавляли TEA (3,3 мл, 23 ммоль) и 4-метилбензол-1-сульфонилхлорид (2,7 г, 13,8 ммоль). Реакционную смесь перемешивали при к.т. в течение 15 ч. Смесь распределяли между водой и DCM. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 30% DCM в петролейном эфире→100% DCM, с получением оксетан-3-ил-4-метилбензолсульфоната (1,3 г, 50%) в виде белого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,77 (д, J=8,4 Гц, 2H), 7,35 (д, J=8,7 Гц, 2H), 5,30 (м, 1H), 4,66-4,74 (м, 4H), 2,46 (с, 3H); ЖХМС (ИЭР) m/z 229 (M+H)+.
Стадия 2: Перемешиваемую смесь 1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ола (100 мг, 0,23 ммоль), полученного на стадии 1 примера 171, оксетан-3-ил-4-метилбензолсульфоната (420 мг, 1,84 ммоль), полученного на предшествующей стадии, Cs2CO3 (225 мг, 0,69 ммоль), йодида натрия 276 мг, 0,69 ммоль) и NMP (4 мл) нагревали при 145°C в течение 15 ч. Смесь разбавляли EtOAc и промывали солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя DCM/MeOH (40/1), с получением (3aR,7aR)-2,2-диметил-3-(6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)октагидробензо[d]оксазола (35 мг, 31%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,90 (с, 1H), 7,58 (д, J=8,4 Гц, 1H), 7,40 (с, 1H), 7,17-7,20 (м, 2H), 6,94 (с, 1H), 6,84 (м, 1H), 5,35 (с, 2H), 5,24 (м, 1H), 5,00 (м, 2H), 4,79 (м, 2H), 3,66 (м, 1H), 3,08 (м, 1H), 2,81 (м, 1H), 2,15 (м, 1H), 1,84-1,92 (м, 2H), 1,78 (с, 3H), 1,63 (с, 3H), 1,30-1,45 (м, 4H); ЖХМС (ИЭР) m/z 491 (M+H)+.
Стадия 3: (1R,2R)-2-((6-((5-(Оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (20 мг, 50%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 172, заменяя 2-((1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)этанол, использованный в примере 172, (3aR,7aR)-2,2-диметил-3-(6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)октагидробензо[d]оксазолом, полученным на стадии 2 этого примера. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,21 (с, 1H), 7,49 (с, 1H), 7,34-7,37 (м, 2H), 7,19 (м, 1H), 6,82-6,89 (м, 2H), 5,44 (с, 2H), 5,28 (т, J=8,4 Гц, 1H), 5,00-5,04 (м, 2H), 4,67-4,71 (м, 2H), 3,57 (м, 1H), 3,44 (м, 1H), 2,08 (м, 1H), 2,00 (м, 1H), 1,70-1,77 (м, 2H), 1,29-1,41 (м, 4H); ЖХМС (ИЭР) m/z 451 (M+H)+.
Пример 183
Получение (1R,2R)-2-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)benzo[d]тиазол-2-ил)амино)циклогексанола
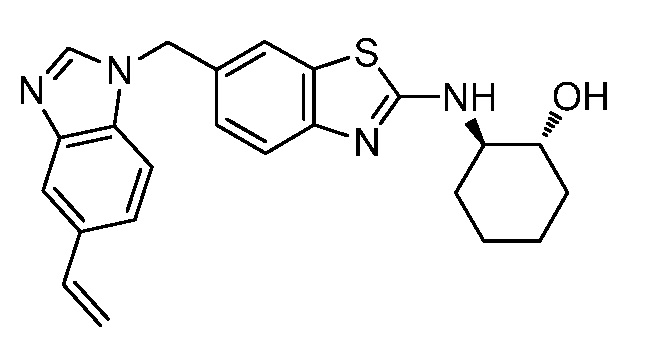
Стадия 1: 4-Йод-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин (5,7 г, 66%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 4-йод-2-нитроанилином. 1H ЯМР (300 МГц, CDCl3) δ 8,50 (д, J=2,1 Гц, 1H), 8,46 (шир. с, 1H), 7,85 (д, J=8,7 Гц, 1H), 7,70 (с, 1H), 7,57 (д, J=9,0 Гц, 1H), 7,36 (д, J=8,4 Гц, 1H), 6,58 (д, J=9,0 Гц, 1H), 4,63 (д, J=5,7 Гц, 2H), 2,79 (с, 3H); ЖХМС (ИЭР) m/z 458 (M+H)2+.
Стадия 2: 4-Йод-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин (4,89 г, 92%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 129, заменяя 4-фтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 129, 4-йод-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилином, полученным на стадии 1 этого примера. ЖХМС (ИЭР) m/z 428 (M+H)+.
Стадия 3: 6-((5-Йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (3 г, 60%) получали в виде оранжевого твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 130, заменяя N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-4-(трифторметил)бензол-1,2-диамин, использованный в примере 130, 4-йод-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамином, полученным на стадии 2 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,18 (с, 1H), 7,91 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,48-7,53 (м, 2H), 7,24 (д, J=9,0 Гц, 1H), 7,04 (д, J=8,4 Гц, 1H), 5,43 (с, 2H), 2,78 (с, 3H); ЖХМС (ИЭР) m/z 438 (M+H)+.
Стадия 4: 6-((5-Йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (2,79 г, 90%) получали в виде рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,20 (с, 1H), 8,03 (д, J=8,4 Гц, 1H), 7,96 (с, 1H), 7,76 (с, 1H), 7,52 (д, J=8,4 Гц, 1H), 7,36 (д, J=8,4 Гц, 1H), 7,03 (д, J=8,4 Гц, 1H), 5,51 (с, 2H), 3,07 (с, 3H); ЖХМС (ИЭР) m/z 454 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((5-Йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (1,78 г, 57%) получали в виде коричневого твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 130, заменяя 2-(метилсульфинил)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 этого примера. 1H ЯМР (300 МГц, CDCl3) δ 8,13 (с, 1H), 7,87 (с, 1H), 7,46 (д, J=8,45 Гц, 1H), 7,44 (д, J=9,9 Гц, 1H), 7,19 (с, 1H), 7,08 (д, J=8,4 Гц, 1H), 7,03 (д, J=8,4Гц, 1H), 5,28 (с, 2H), 3,52 (м, 1H), 3,44 (м, 1H), 2,04-2,16 (м, 2H), 1,68-2,73 (м, 2H), 1,18-1,42 (м, 4H); ЖХМС (ИЭР) m/z 505 (M+H)+.
Стадия 6: (1R,2R)-2-((6-((5-Винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (64 мг, 20%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 174, заменяя 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан использованный в примере 174, 4,4,5,5-тетраметил-2-винил-1,3,2-диоксабороланом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,39 (с, 1H), 7,95 (д, J=7,5 Гц, 1H), 7,72 (с, 1H), 7,64 (с, 1H), 7,51 (д, J=8,4 Гц, 1H), 7,38 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,19 (д, J=8,4 Гц, 1H), 6,81 (м, 1H), 5,77 (д, J=18,0 Гц, 1H), 5,45 (с, 2H), 5,16 (д, J=11,1 Гц, 1H), 4,73 (д, J=8,4 Гц, 1H), 3,53 (м, 1H), 3,27 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,60-1,62 (м, 2H), 1,20-1,24 (м, 4H); ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 184
Получение (1R,2R)-2-((6-((5-(циклогекс-1-ен-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
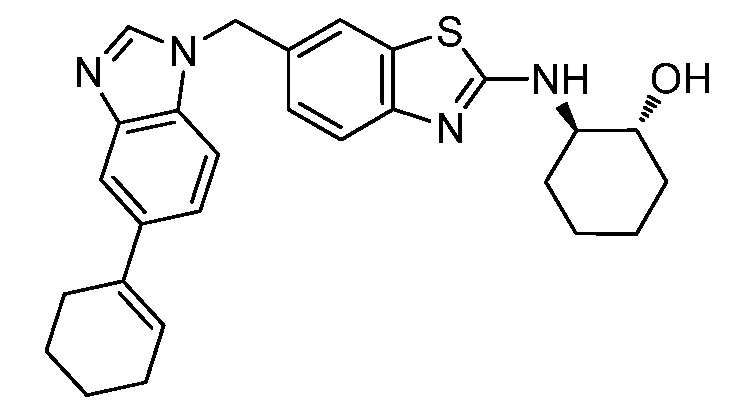
(1R,2R)-2-((6-((5-(Циклогекс-1-ен-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (80 мг, 30%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 174, заменяя 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан использованный в примере 174, 2-(циклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксабороланом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,35 (с, 1H), 7,94 (д, J=8,1 Гц, 1H), 7,60 (д, J=8,7 Гц, 2H), 7,45 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,1 Гц, 2H), 7,18 (м, 1H), 6,08 (д, J=4,5 Гц, 1H), 5,44 (с, 2H), 4,72 (д, J=5,4 Гц, 1H), 3,51 (м, 1H), 3,37 (м, 1H), 2,39-2,45 (м, 2H), 2,13-2,20 (м, 2H), 2,04 (м, 1H), 1,89 (м, 1H), 1,80-1,83 (м, 2H), 1,56-1,66 (м, 4H), 1,11-1,36 (м, 4H); ЖХМС (ИЭР) m/z 459 (M+H)+.
Пример 185
Получение (1R,2R)-2-((6-((5-(1-метил-3-(трифторметил)-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
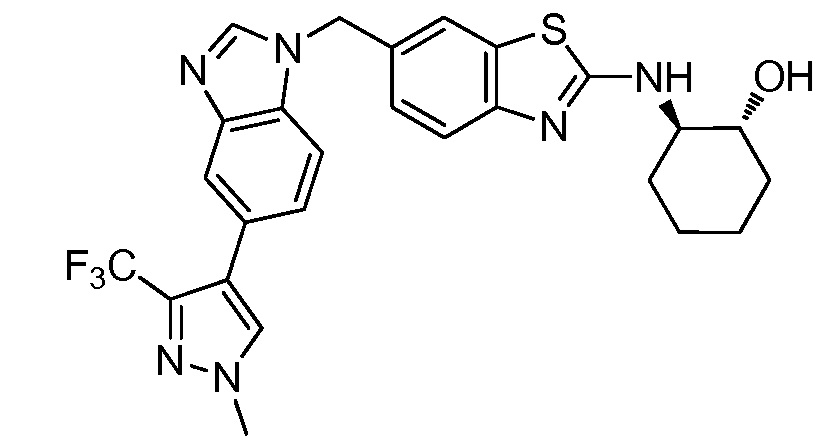
(1R,2R)-2-((6-((5-(1-Метил-3-(трифторметил)-1H-пиразол-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (71 мг, 25%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 174, заменяя 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, использованный в примере 174, (1-метил-3-(трифторметил)-1H-пиразол-4-ил)бороновой кислотой. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 1H), 8,10 (с, 1H), 7,95 (м, 1H), 7,69 (с, 1H), 7,63 (с, 1H), 7,60 (д, J=8,7 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 7,23-7,75 (м, 2 H), 5,48 (с, 2H), 4,70 (м, 1H), 3,96 (с, 3H), 3,51 (м, 1H), 3,32 (м, 1H), 2,03 (м, 1H), 1,84 (м, 1H), 1,59-1,62 (м, 2H), 1,15-1,29 (м, 4H); ЖХМС (ИЭР) m/z 527 (M+H)+.
Пример 186
Получение (1R,2R)-2-((6-((5-фторимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
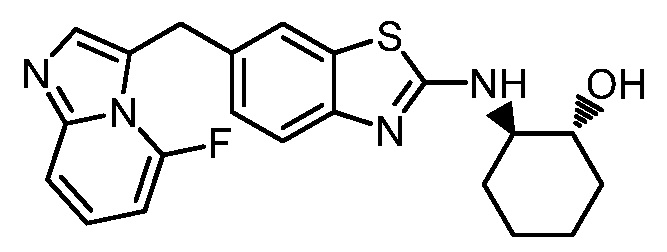
(1R,2R)-2-((6-((5-Фторимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (5 мг, 10%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 6-фторпиридин-2-амином и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,92 (д, J=7,4 Гц, 1H), 7,42 (д, J=3,9 Гц, 1H), 7,35-7,40 (м, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,22 (дд, J=7,1, 15,5 Гц, 1H), 6,99 (д, J=7,9 Гц, 1H), 6,66 (т, J=7,1 Гц, 1H), 4,80 (шир. с, 1H), 4,39 (шир. с, 2H), 3,50 (шир. с, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,54-1,70 (м, 2H), 1,10-1,37 (м, 4H). ЖХМС (ИЭР) m/z 397 (M+H)+.
Пример 187
Получение (1R,2R)-2-((6-((7-морфолиноимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
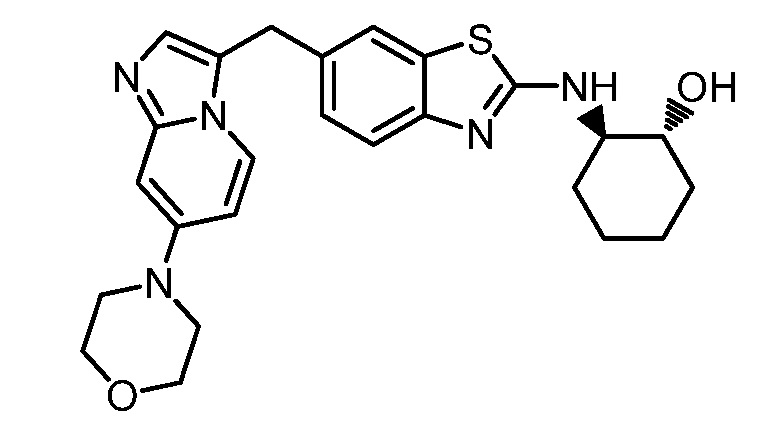
Стадия 1: Смесь 4-хлорпиридин-2-амина (400 мг, 3,1 ммоль) и морфолина (2 мл) в 2 мл DMA нагревали при 200°C в течение 5 мин в микроволновом реакторе. Методом LCMS-анализа обнаруживали завершение реакции. Смесь распределяли между EtOAc и солевым раствором, органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением неочищенного 4-морфолинопиридин-2-амина в виде желтого твердого вещества (350 мг). ЖХМС (ИЭР) m/z 180 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((7-Морфолиноимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (50 мг, 31%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-морфолинопиридин-2-амином, полученным на стадии 1 этого примера, и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,94 (д, J=7,9 Гц, 1H), 7,88 (д, J=7,4 Гц, 1H), 7,48 (с, 1H), 7,25 (д, J=7,9 Гц, 1H), 7,18 (с, 1H), 7,06 (д, J=8,4 Гц, 1H), 6,79 (дд, J=2,2, 7,6 Гц, 1H), 6,67 (д, J=2,0 Гц, 1H), 4,75 (шир. с, 1H), 4,20 (с, 2H), 3,67-3,79 (м, 4H), 3,50 (шир. с, 2H), 3,09-3,16 (м, 4H), 2,03 (д, J=11,8 Гц, 1H), 1,86 (шир. с, 1H), 1,55-1,71 (м, 2H), 1,12-1,38 (м, 4H). ЖХМС (ИЭР) m/z 464 (M+H)+.
Пример 188
Получение (1R,2R)-2-((6-((7-(4-метилпиперазин-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
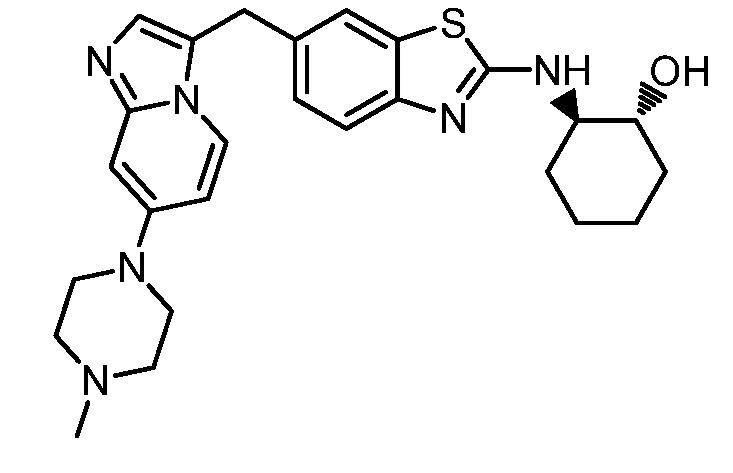
Стадия 1: Смесь 4-хлорпиридин-2-амина (400 мг, 3,1 ммоль) и N-метилпиперазина (2 мл) в DMA (2 мл) нагревали при 200°C в течение 5 мин в микроволновом реакторе. Методом LCMS-анализа обнаруживали завершение реакции. Реакционную смесь распределяли между EtOAc и солевым раствором, органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением неочищенного 4-(4-метилпиперазин-1-ил)пиридин-2-амина в виде коричневого твердого вещества (350 мг). ЖХМС (ИЭР) m/z 193 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((7-(4-Метилпиперазин-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (17 мг, 9%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-(4-метилпиперазин-1-ил)пиридин-2-амином, полученным на стадии 1 этого примера, и 2-хлор-3-(2-(((1R,2R)-2- гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,90 (д, J=7,4 Гц, 1H), 7,87 (д, J=7,4 Гц, 1H), 7,47 (с, 1H), 7,25 (д, J=8,4 Гц, 1H), 7,17 (с, 1H), 7,06 (д, J=6,9 Гц, 1H), 6,72-6,81 (м, 2H), 6,64 (с, 1H), 4,19 (с, 2H), 3,51 (шир. с, 1H), 3,31-3,37 (м, 2H), 3,16 (д, J=4,4 Гц, 4H), 2,42 (д, J=4,4 Гц, 4H), 2,21 (с, 3H), 2,03 (д, J=11,8 Гц, 1H), 1,83-1,87 (м, 1H), 1,55-1,70 (м, 2H), 1,10-1,35 (м, 4H). ЖХМС (ИЭР) m/z 477 (M+H)+.
Пример 189
Получение ((1R,2R)-2-((6-((5,7-диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
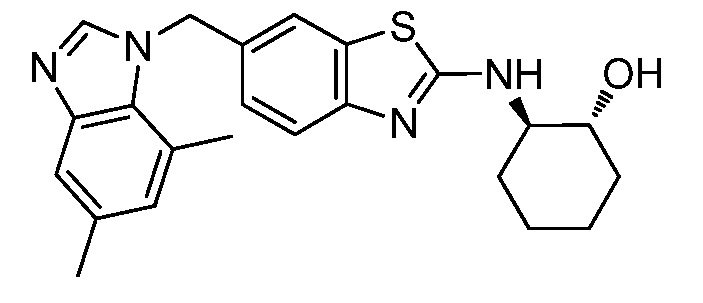
Стадия 1: N-(2,4-Диметил-6-нитрофенил)формамид (746 мг, 64%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 203, заменяя 4-бром-2-фтор-6-нитроанилин, использованный в примере 203, 4,6-диметил-2-нитроанилином. ЖХМС (ИЭР) m/z 195 (M+H)+.
Стадия 2: N-(2,4-Диметил-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид (1,29 г, 87%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)формамид, использованный в примере 203, N-(2,4-диметил-6-нитрофенил)формамидом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 388 (M+H)+.
Стадия 3: 6-((5,7-Диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (696 мг, 62%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид, использованный в примере 203, N-(2,4-диметил-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамидом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,25 (с, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,60 (д, J=0,8 Гц, 1H), 7,29 (с, 1H), 7,08 (дд, J=8,4, 1,6 Гц, 1H), 6,74 (с, 1H), 5,75 (с, 2H), 2,75 (с, 3H), 2,33 (с, 3H), 2,33 (с, 3H); ЖХМС (ИЭР) m/z 340 (M+H)+.
Стадия 4: 6-((5,7-Диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (600 мг, 83%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 203, заменяя 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 203, 6-((5,7-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,28 (с, 1H), 8,07 (д, J=8,5 Гц, 1H), 7,83 (м, 1H), 7,31 (м, 1H), 7,28 (дд, J=8,6, 1,6 Гц, 1H), 6,74 (м, 1H), 5,83 (с, 2H), 3,05 (с, 3H), 2,33 (с, 3H), 2,33 (с, 3H); ЖХМС (ИЭР) m/z 356 (M+H)+.
Стадия 5: ((1R,2R)-2-((6-((5,7-Диметил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (50 мг, 29%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 203, заменяя 6-((5- бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 203, 6-((5,7-диметил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,21 (с, 1H), 7,96 (д, J=7,6 Гц, 1H), 7,22-7,30 (м, 3H), 6,81 (дд, J=1,2, 8,4 Гц, 1H), 6,73 (с, 1H), 5,62 (с, 2H), 4,75 (шир. м, 1H), 3,51 (шир. м, 1H), 3,30 (шир. м, 1H), 2,38 (с, 3H), 2,33 (с, 3H), 2,02 (м, 1H), 1,85 (м, 1H), 1,56-1,66 (м, 2H), 1,13-1,30 (м, 4H); ЖХМС (ИЭР) m/z 407 (M+H)+.
Пример 190
Получение (1R,2R)-2-((6-((5-бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
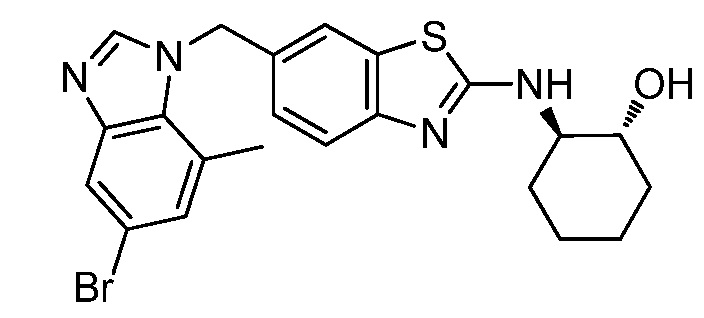
Стадия 1: N-(4-бром-2-метил-6-нитрофенил)формамид (227 мг, 33%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 203, заменяя 4-бром-2-фтор-6-нитроанилин, использованный в примере 203, 4-бром-2-метил-6-нитроанилином. ЖХМС (ИЭР) m/z 259 и 260 (M+H)+.
Стадия 2: N-(4-Бром-2-метил-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид (377 мг, 95%) получали в виде масла с использованием методики, аналогичной описанной на стадии 2 примера 203, заменяя N-(4-бром-2-фтор-6- нитрофенил)формамид, использованный в примере 203, N-(4-бром-2-метил-6-нитрофенил)формамидом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 452 и 454 (M+H)+.
Стадия 3: 6-((5-Бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (100 мг, 30%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид, использованный в примере 203, N-(4-бром-2-метил-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамидом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,38 (с, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,72 (м, 1H), 7,62 (м, 1H), 7,10-7,11 (м, 2H), 5,79 (с, 2H), 2,76 (с, 3H), 2,37 (с, 3H); ЖХМС (ИЭР) m/z 404 и 406 (M+H)+.
Стадия 4: 6-((5-Бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (60 мг, 58%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 203, заменяя 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 203, 6-((5-бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,42 (с, 1H), 8,09 (д, J=8,5 Гц, 1H), 7,85 (м, 1H), 7,73 (м, 1H), 7,31 (дд, J=8,6, 1,6 Гц, 1H), 7,12 (м, 1H), 5,87 (с, 2H), 3,05 (с, 3H), 2,37 (с, 3H); ЖХМС (ИЭР) m/z 420 и 422 (M+H)+.
Стадия 5: (1R,2R)-2-((6-((5-Бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2- ил)амино)циклогексанол (9 мг, 13%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 203, заменяя 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 203, 6-((5-бром-7-метил-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,34 (с, 1H), 7,98 (д, J=7,6 Гц, 1H), 7,70 (д, J=1,0 Гц, 1H), 7,25-7,31 (м, 2H), 7,10 (с, 1H), 6,83 (дд, J=1,2, 8,1 Гц, 1H), 5,66 (с, 2H), 4,76 (шир. м, 1H), 3,51 (шир. м, 1H), 3,30 (шир. м, 1H), 2,42 (с, 3H), 2,03 (м, 1H), 1,87 (м, 1H), 1,56-1,66 (м, 2H), 1,13-1,32 (м, 4H); ЖХМС (ИЭР) m/z 471 и 473 (M+H)+.
Пример 191
Получение 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-фенилбензо[d]тиазол-2-амина
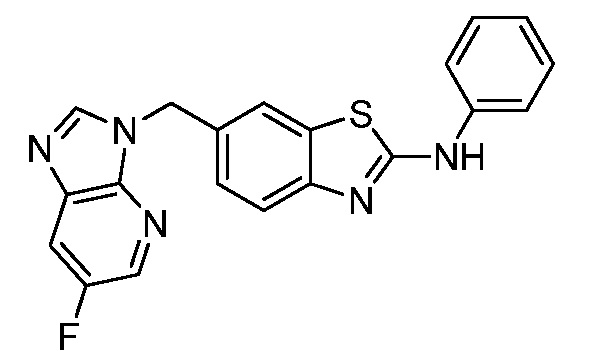
6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-фенилбензо[d]тиазол-2-амин синтезировали в виде белого порошка (38 мг, 23%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола, использованный в примере 162, анилином и повышая темпеартуру реакции до 130°C. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,50 (шир. с, 1H), 8,71 (с, 1H), 8,42 (м, 1H), 8,09 (дд, J=2,5, 9,4 Гц, 1H), 7,80 (с, 1H), 7,73-7,77 (м, 2H), 7,55 (д, J=8,4 Гц, 1H), 7,32-7,37 (м, 3H), 7,01 (т, J=7,4 Гц, 1H), 5,55 (с, 2H); ЖХМС (ИЭР) m/z 376 (M+H)+.
Пример 192
Получение ((1R,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
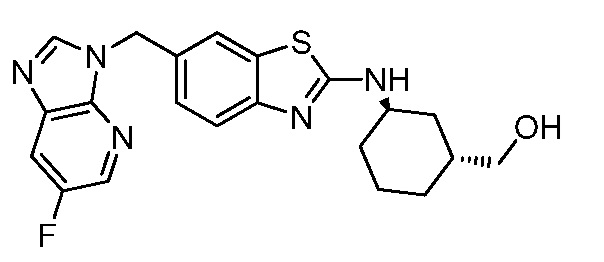
Стадия 1: Смесь (1R,3R)-3-((трет-бутоксикарбонил)амино)циклогексанкарбоновой кислоты в смеси TFA/CH2Cl2 (1/1, 6 мл) перемешивали при к.т. в течение 3 ч. Смесь концентрировали в условиях пониженного давления. Остаток растирали с этиловым эфиром (50 мл), и собирали полученное твердое вещество путем фильтрования с получением трифторацетата (1R,3R)-3-аминоциклогексанкарбоновой кислоты (253 мг, 86%) в виде белого твердого вещества, которое не требовало дополнительной очистки.
Стадия 2: ((1R,3R)-3-Аминоциклогексил)метанол синтезировали в виде белого порошка (213 мг, 75%) с использованием методики, аналогичной описанной на стадии 1 примера 179, заменяя гидрохлорид транс-4-аминоциклогексанкарбоновой кислоты использованный в примере 179, трифторацетатом (1R,3R)-3-аминоциклогексанкарбоновой кислоты, полученным на предшествующей стадии.
Стадия 3: ((1R,3R)-3-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол синтезировали в виде белого порошка (17 мг, 10%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола, использованный в примере 162, ((1R,3R)-3-аминоциклогексил)метанолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,41 (т, J=1,8 Гц, 1H), 8,07 (дд, J=2,5, 9,4 Гц, 1H), 7,96 (д, J=7,6 Гц, 1H), 7,66 (с, 1H), 7,31 (м, 1H), 7,23 (дд, J=1,5, 8,4 Гц, 1H), 5,48 (с, 2H), 4,43 (m 1H), 3,65 (м, 1H), 3,17-3,28 (м, 2H), 1,95-2,10 (м, 2H), 1,61-1,79 (м, 2H), 1,49 (м, 1H), 1,31 (м, 1H), 1,08 (м, 1H), 0,75-0,90 (м, 2H); ЖХМС (ИЭР) m/z 412 (M+H)+.
Пример 193
Получение (1R,2S,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
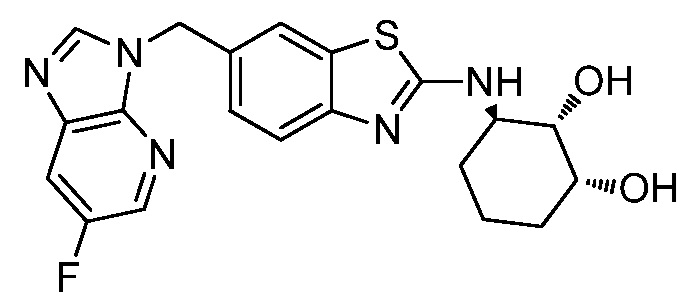
(1R,2S,3R)-3-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол синтезировали в виде белого порошка (15 мг, 14%) с использованием методики, аналогичной описанной на стадии 5 примера 232, заменяя 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 232, 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 4 примера 70. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,41 (т, J=2,0 Гц, 1H), 8,07 (дд, J=2,5, 9,4 Гц, 1H), 7,94 (д, J=7,9 Гц, 1H), 7,66 (д, J=1,0 Гц, 1H), 7,29 (м, 1H), 7,22 (дд, J=1,4, 8,2 Гц, 1H), 5,48 (с, 2H), 4,54 (шир. с, 1H), 4,44 (шир. с, 1H), 3,93 (м, 1H), 3,79 (м, 1H), 3,39 (м, 1H), 1,91 (м, 1H), 1,52-1,69 (м, 2H), 1,33-1,43 (м, 2H), 1,19 (м, 1H); ЖХМС (ИЭР) m/z 414 (M+H)+.
Пример 194
Получение ((1S,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанола
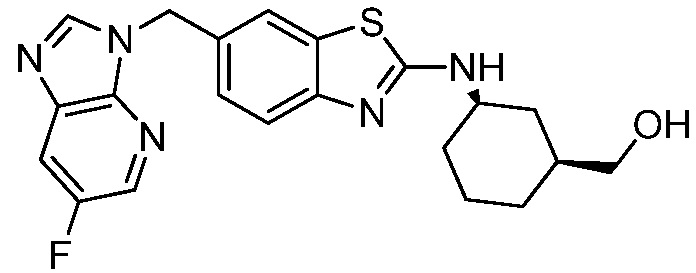
Стадия 1: Трифторацетат (1S,3R)-3-аминоциклогексанкарбоновой кислоты синтезировали в виде белого порошка (275 мг, 94%) с использованием методики, аналогичной описанной на стадии 1 примера 192, заменяя (1R,3R)-3-((трет-бутоксикарбонил)амино)циклогексанкарбоновую кислоту, использованный в примере 192, (1S,3R)-3-((трет-бутоксикарбонил)амино)циклогексанкарбоновой кислотой.
Стадия 2: ((1S,3R)-3-Аминоциклогексил)метанол синтезировали в виде белого порошка (157 мг, 59%) с использованием методики, аналогичной описанной на стадии 1 примера 179, заменяя гидрохлорид транс-4-аминоциклогексанкарбоновой кислоты, использованный в примере 179, трифторацетатом (1S,3R)-3-аминоциклогексанкарбоновой кислоты, полученным на предшествующей стадии.
Стадия 3: ((1S,3R)-3-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексил)метанол синтезировали в виде белого порошка (15 мг, 8%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола, использованный в примере 162, ((1S,3R)-3-аминоциклогексил)метанолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (с, 1H), 8,41 (т, J=1,8 Гц, 1H), 8,07 (дд, J=2,5, 9,4 Гц, 1H), 7,96 (д, J=7,6 Гц, 1H), 7,66 (с, 1H), 7,31 (м, 1H), 7,23 (дд, J=1,5, 8,4 Гц, 1H), 5,48 (с, 2H), 4,43 (m 1H), 3,65 (м, 1H), 3,17-3,28 (м, 2H), 1,95-2,10 (м, 2H), 1,61-1,79 (м, 2H), 1,49 (м, 1H), 1,31 (м, 1H), 1,08 (м, 1H), 0,75-0,90 (м, 2H); ЖХМС (ИЭР) m/z 412 (M+H)+.
Пример 195
Получение 6-хлор-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила
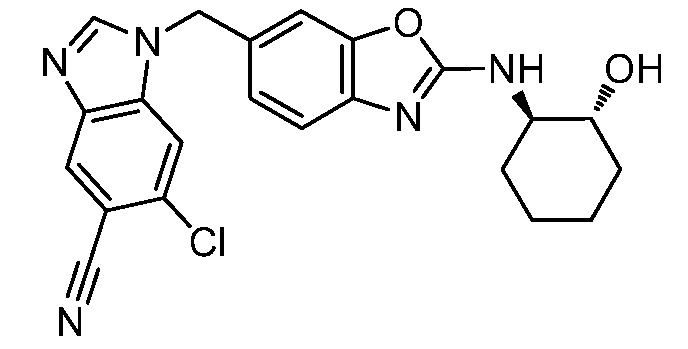
Стадия 1: Смесь 5-хлор-2-нитроанилина (6,0 г, 34,88 ммоль) и NBS (6,06 г, 34,0 ммоль) в HOAc (240 мл) перемешивали при 130°C в течение 1 ч. Реакционную смесь вливали в воду. Осадок собирали путем фильтрования и промывали петролейным эфиром с получением 4-бром-5-хлор-2-нитроанилина в виде светло-коричневого твердого вещества (8,25 г, 96,5%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,24 (с, 1H), 7,62 (шир. с, 2H), 7,29 (с, 1H). ЖХМС (ИЭР) m/z 251 (M+H)+.
Стадия 2: К раствору 4-бром-5-хлор-2-нитроанилина (550 мг, 2,19 ммоль), полученного на предшествующей стадии, и TFA (2,26 мл) в DCM (10 мл) при -15°C добавляли NaBH(OAc)3 (1,39 г, 5,37 ммоль). Затем к смеси добавляли раствор 2-(метилтио)бензо[d]оксазол-6-карбальдегида (465 мг, 2,41 ммоль) в DCM (6 мл). После завершения добавления, смесь перемешивали при -10°C-0°C в течение 2 ч. Реакционную смесь разбавляли DCM и последовательно промывали H2O, водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/DCM (5/1→2/1) с получением 4-бром-5-хлор-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина в виде желтого твердого вещества (451 мг, 48,2%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,81 (т, 1H), 8,34 (с, 1H), 7,66 (с, 1H), 7,60 (д, J=8,1 Гц, 1H), 7,37 (д, J=6,9 Гц, 1H), 7,19 (с, 1H), 4,76 (д, J=6,3 Гц, 2H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 428 (M+H)+.
Стадия 3: К перемешиваемому раствору 4-бром-5-хлор-N-((2-(метилтио)бензо[d]оксазол-6-ил)метил)-2-нитроанилина (451 мг, 1,06 ммоль) в метаноле (80 мл) и DCM (80 мл) добавляли палладий на активированном угле (100 мг). Смесь перемешивали в атмосфере водорода в течение 2 ч, фильтровали и концентрировали в условиях пониженного давления с получением 4-бром-5-хлор-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина в виде светло-желтого твердого вещества (415 мг, 98,6%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,57-7,60 (м, 2H), 7,35 (д, J=8,1 Гц, 1H), 6,81 (с, 1H), 6,41 (с, 1H), 5,64 (т, 1H), 5,03 (с, 2H), 4,40 (д, J=6,0 Гц, 2H), 2,74 (с, 3H). ЖХМС (ИЭР) m/z 399 (M+H)+.
Стадия 4: Смесь 4-бром-5-хлор-N1-((2-(метилтио)бензо[d]оксазол-6-ил)метил)бензол-1,2-диамина (622 мг, 2,40 ммоль), триэтоксиметана (5 мл) и HCOOH (0,08 мл) перемешивали при 90°C в течение 2 ч. Реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/1), с получением 6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола в виде светло-коричневого твердого вещества (607 мг, 84,5%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,56 (с, 1H), 8,07 (с, 1H), 8,02 (с, 1H), 7,72 (с, 1H), 7,60 (д, J=8,4 Гц, 1H), 7,34 (д, J=6,6 Гц, 1H), 5,60 (с, 2H), 2,73 (с, 3H). ЖХМС (ИЭР) m/z 408 (M+H)+.
Стадия 5: Раствор 6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]оксазола (554 мг, 1,80 ммоль) и m-CPBA (403 мг, 2,34 ммоль) в DCM (18 мл) перемешивали при 0°C в течение 3 ч. Реакционную смесь промывали водным Na2S2O3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/5), с получением 6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (510 мг, 87,5%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,08 (с, 1H), 8,04 (с, 1H), 7,97 (с, 1H), 7,90 (д, J=8,7 Гц, 1H), 7,50 (д, J=9,3 Гц, 1H), 5,69 (с, 2H), 3,18 (с, 3H). ЖХМС (ИЭР) m/z 424 (M+H)+.
Стадия 6: Смесь 6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]оксазола (460 мг, 1,08 ммоль), (1R,2R)-2-аминоциклогексанола (245 мг, 2,13 ммоль) и DIEA (366 мг, 2,84 ммоль) в DMA (10 мл) перемешивали при 120°C в течение 1 ч. Реакционную смесь охлаждали до к.т., вливали в воду (30 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/5), с получением (1R,2R)-2-((6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола в виде светло-желтого твердого вещества (470 мг, 82,3%). 1H ЯМР (300 МГц, CDCl3) δ 8,52 (с, 1H), 8,06 (с, 1H), 8,00 (с, 1H), 7,82(д, J=7,8 Гц, 1H), 7,41(с, 1H), 7,14 (с, 1H), 5,48 (с, 2H), 4,68 (д, J=4,2 Гц, 1H), 3,33 (шир. с, 2H), 1,91 (шир. с, 2H), 1,63 (шир. с, 2H), 1,25 (шир. с, 4H). ЖХМС (ИЭР) m/z 477 (M+H)+.
Стадия 7: Смесь (1R,2R)-2-((6-((5-бром-6-хлор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]оксазол-2-ил)амино)циклогексанола (215 мг, 0,45 ммоль), Zn(CN)2 (327 мг, 2,71 ммоль), Pd2(dba)3 (82 мг, 0,09 ммоль) и dppf (100 мг, 0,18 ммоль) в DMA (10 мл) перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в воду (20 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением 6-хлор-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]оксазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила в виде белого твердого вещества (25 мг, 13,5%). 1H ЯМР (300 МГц, ДМСО-d6): δ 8,69 (с, 1H), 8,36 (с, 1H), 8,13 (с, 1H), 7,82 (д, J=7,8 Гц, 1H), 7,45 (с, 1H), 7,16 (с, 1H), 5,53 (с, 2H), 4,68 (д, J=4,5 Гц, 1H), 3,38-3,31 (м, 2H), 1,92-1,86 (м, 2H), 1,65-1,60 (м, 2H), 1,27-1,19 (м, 4H). ЖХМС (ИЭР) m/z 422 (M+H)+.
Пример 196
Получение 2-((1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрила
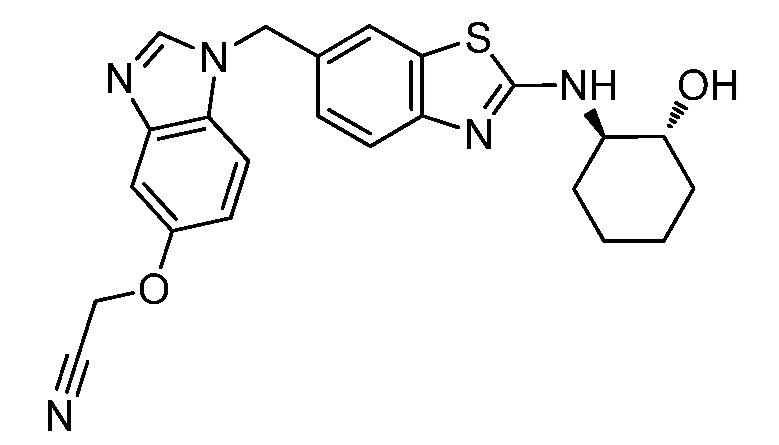
Стадия 1: 2-((1-((2-((3aR,7aR)-2,2-Диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрил (42 мг, 25%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 171, заменяя 4-(2-йодэтил)морфолин, использованный в примере 171, йодацетонитрилом. 1H ЯМР (300 МГц, CDCl3) δ 7,99 (с, 1H), 7,58 (д, J=8,1 Гц, 1H), 7,30-7,40 (м, 2H), 7,16-7,26 (м, 2H), 6,95 (м, 1H), 5,38 (с, 2H), 4,79 (с, 2H), 3,65 (м, 1H), 3,08 (м, 1H), 2,80 (м, 1H), 2,17 (м, 1H), 1,82-1,92 (м, 2H), 1,78 (с, 3H), 1,64 (с, 3H), 1,33-1,39 (м, 4H).
Стадия 2: 2-((1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрил (31 мг, 68%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 171, заменяя (3aR,7aR)-2,2-диметил-3-(6-((5-(2-морфолиноэтокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)октагидробензо[d]оксазол, использованный в примере 171, 2-((1-((2-((3aR,7aR)-2,2-диметилгексагидробензо[d]оксазол-3(2H)-ил)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)окси)ацетонитрилом. 1H ЯМР (300 МГц, CDCl3) δ 7,95 (с, 1H), 7,48 (д, J=8,4 Гц, 1H), 7,40 (д, J=2,1 Гц, 1H), 7,29 (м, 1H), 7,20 (д, J=8,1 Гц, 1H), 7,16 (дд, J=8,1, 1,5 Гц, 1H), 6,96 (дд, J=8,7, 2,4 Гц, 1H), 5,36 (с, 2H), 5,21 (м, 1H), 4,80 (с, 2H), 3,83 (шир. м, 1H), 3,61 (шир. м, 1H), 3,47 (м, 1H), 2,08-2,18 (м, 2H), 1,75-1,79 (м, 2H), 1,24-1,44 (м, 4H). ЖХМС (ИЭР) m/z 434 (M+H)+.
Пример 197
Получение 6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амина
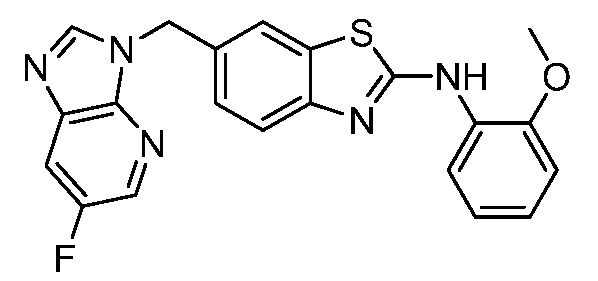
6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)-N-(2-метоксифенил)бензо[d]тиазол-2-амин синтезировали в виде белого порошка (45 мг, 15%) с использованием методики, аналогичной описанной в примере 191, заменяя анилин, использованный в примере 191, 2-метоксианилином. 1H ЯМР (500 МГц, CDCl3) δ 9,84 (с, 1H), 8,71 (с, 1H), 8,35-8,46 (м, 2H), 8,08 (дд, J=2,6, 9,5 Гц, 1H), 7,78 (с, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,31 (дд, J=1,5, 8,4 Гц, 1H), 6,91-7,10 (м, 3H), 5,53 (с, 2H), 3,85 (с, 3H); ЖХМС (ИЭР) m/z 407 (M+H)+.
Пример 198
Получение N-((1R,2R)-2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина
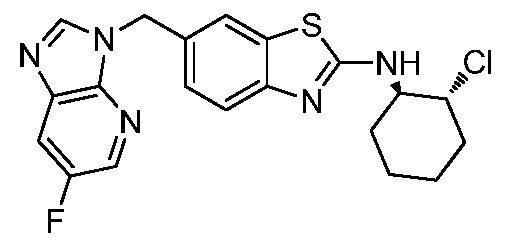
К перемешиваемой смеси (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (282 мг, 0,7 ммоль), полученного в примере 162, DIEA (247 мкл, 1,4 ммоль) и CH2Cl2 (15 мл) при 0°C в атмосфере аргона добавляли сульфурилхлорид (142 мг, 2,0 ммоль). Смесь нагревали до к.т. и перемешивали в течение 15 ч, а затем перемешивали при 60°C в течение 15 ч. Смесь охлаждали до к.т. и сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы. Продукт дополнительно очищали путем растирания в CH2Cl2 (5 мл) с получением N-((1R,2R)-2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина (29 мг, 10%) в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 8,68 (с, 1H), 8,41 (с, 1H), 8,24 (д, J=8,4 Гц, 1H), 8,07 (дд, J=2,6, 9,5 Гц, 1H), 7,68 (с, 1H), 7,33 (д, J=8,4 Гц, 1H), 7,24 (дд, J=1,4, 8,2 Гц, 1H), 5,48 (с, 2H), 4,02 (м, 1H), 3,87 (м, 1H), 2,20 (м, 1H), 2,07 (м, 1H), 1,63-1,75 (м, 3H), 1,29-1,41 (м, 3H); ЖХМС (ИЭР) m/z 416 (M+H)+.
Пример 199
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ола
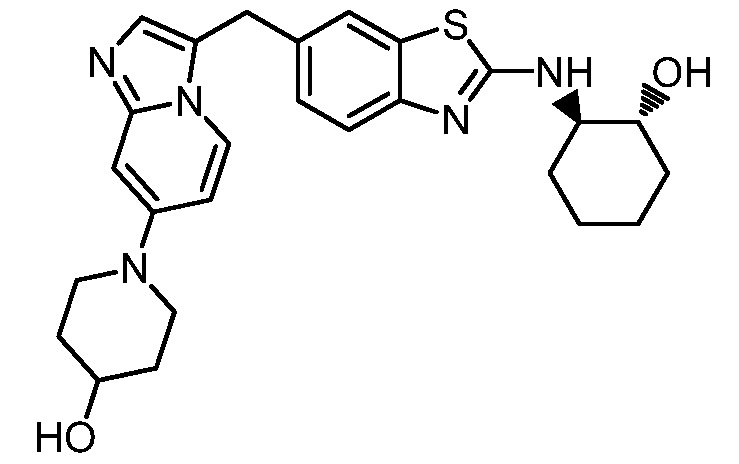
1-(3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)пиперидин-4-ол (30 мг, 22%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-(2-аминопиридин-4-ил)циклогексанолом и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,88 (д, J=7,4 Гц, 2H), 7,47 (с, 1H), 7,25 (д, J=8,4 Гц, 1H), 7,15 (с, 1H), 7,06 (д, J=8,4 Гц, 1H), 6,76 (дд, J=2,2, 7,6 Гц, 1H), 6,63 (с, 1H), 4,74 (шир. с, 1H), 4,18 (с, 2H), 3,63 (дд, J=4,2, 8,6 Гц, 1H), 3,54 (д, J=12,8 Гц, 2H), 3,31-3,37 (м, 4H), 2,80-2,93 (м, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,88-1,92 (м, 1H), 1,74-1,83 (м, 2H), 1,56-1,70 (м, 2H), 1,38-1,50 (м, 2H), 1,10-1,37 (м, 4H). ЖХМС (ИЭР) m/z 478 (M+H)+.
Пример 200
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанона
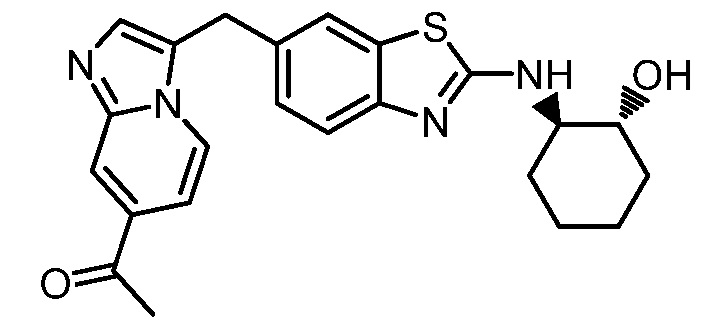
Стадия 1: 1-(2-Аминопиридин-4-ил)этанон получали в виде желтого твердого вещества (398 мг, 64%) с использованием методики, аналогичной описанной в примере 73, заменяя (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 73, 4-йодпиридин-2-амином. ЖХМС (ИЭР) m/z 137 (M+H)+.
Стадия 2: 1-(3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанон (80 мг, 35%) получали в виде желтого порошка с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 1-(2-аминопиридин-4-ил)этаноном, полученным на стадии 1 этого примера, и 2-хлор-3-(2-(((1R,2R)-2- гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,32 (с, 1H), 8,29 (д, J=6,9 Гц, 1H), 7,87 (д, J=7,4 Гц, 1H), 7,67 (с, 1H), 7,53 (с, 1H), 7,28 (шир. с, 1H), 7,27 (д, J=7,9 Гц, 1H), 7,09 (д, J=8,4 Гц, 1H), 4,72 (д, J=4,9 Гц, 1H), 4,35 (с, 2H), 3,51 (шир. с, 1H), 2,62 (с, 3H), 2,03 (д, J=11,3 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,55-1,70 (м, 2H), 1,09-1,35 (м, 4H). ЖХМС (ИЭР) m/z 421 (M+H)+.
Пример 201
Получение (1R,2R)-2-((6-((7-(1-гидроксиэтил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
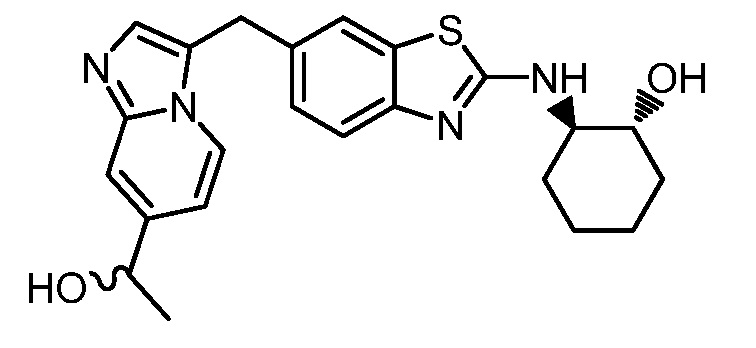
К перемешиваемому раствору 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанона (40 мг, 0,095 ммоль), полученного в примере 200, в MeOH при к.т. добавляли NaBH4. Спустя 30 мин, добавляли 3н HCl, и очищали смесь методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((7-(1-гидроксиэтил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (23 мг, 58%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,11 (д, J=7,4 Гц, 1H), 7,87 (д, J=7,9 Гц, 1H), 7,50 (с, 1H), 7,41 (с, 1H), 7,37 (с, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,07 (д, J=7,9 Гц, 1H), 6,84 (д, J=7,4 Гц, 1H), 5,30 (шир. с, 1H), 4,72 (кв., J=6,4 Гц, 2H), 4,26 (с, 2H), 3,50 (шир. с, 1H), 2,03 (д, J=11,8 Гц, 1H), 1,82-1,87 (м, 1H), 1,55-1,69 (м, 2H), 1,32 (д, J=6,9 Гц, 3H), 1,10-1,30 (м, 4H). ЖХМС (ИЭР) m/z 423 (M+H)+.
Пример 202
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этаноноксима
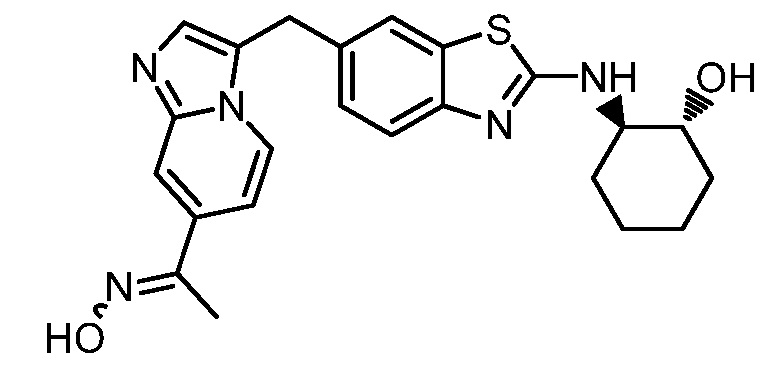
К перемешиваемому раствору 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанона (40 мг, 0,095 ммоль), полученного в примере 200, в EtOH (2 мл) при к.т. добавляли гидрохлорид гидроксиламина (120 мг, избыток) и пиридин (200 мкл, избыток). Смесь нагревали при 90°C в течение 1 ч, а затем охлаждали до к.т. Путем очистки методом HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH), CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы получали 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этаноноксим (23 мг, 61%) в виде желтого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,46 (шир. с, 1H), 8,13 (д, J=7,4 Гц, 1H), 7,90 (д, J=7,4 Гц, 1H), 7,72 (с, 1H), 7,51 (с, 1H), 7,45 (с, 1H), 7,08 (д, J=8,4 Гц, 1H), 6,44-6,58 (м, 1H), 5,89 (с, 1H), 4,78 (д, J=2,5 Гц, 1H), 4,29 (с, 2H), 3,50 (шир. с, 1H), 2,18 (с, 3H), 2,04 (д, J=12,3 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,56-1,67 (м, 2H), 1,15-1,32 (м, 4H). ЖХМС (ИЭР) m/z 436 (M+H)+.
Пример 203
Получение (1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
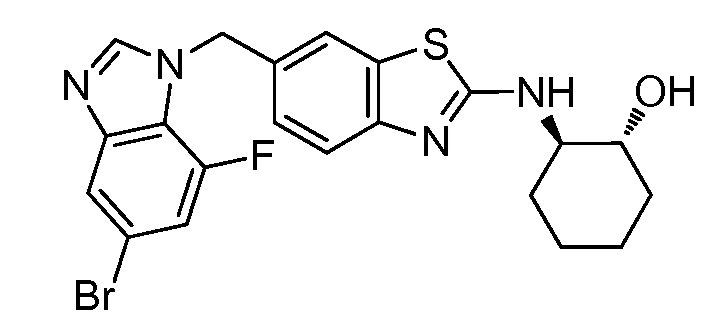
Стадия 1: Перемешиваемую смесь уксусного ангидрида (20 мл, 213 ммоль) и муравьиной кислоты (8 мл, 213 ммоль) нагревали при 60°C в течение 3 ч. Смесь охлаждали до к.т., и добавляли -бром-2-фтор-6-нитроанилин (2,5 г, 10,64 ммоль). Смесь нагревали при 60°C в течение 15 ч, охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток распределяли между насыщенным водн. NaHCO3 и DCM. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением N-(4-бром-2-фтор-6-нитрофенил)формамида (2,79 г, 100%) в виде коричневого твердого вещества, которое дополнительно не очищали. ЖХМС (ИЭР) m/z 285 и 287 (M+H+Na)+.
Стадия 2: К перемешиваемому раствору N-(4-бром-2-фтор-6-нитрофенил)формамида (2,79 г, 10,61 ммоль), полученного на предшествующей стадии, в безводном DMF (40 мл) при 0°C добавляли гидрид натрия (60% дисперсия в минеральном масле, 485 мг, 12,13 ммоль). Смесь перемешивали при 0°C в течение 15 мин, а затем оставляли нагреваться до к.т. К реакционной смеси добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (3,04 г, 13,24 ммоль), полученного на стадии 3 примера 3, в DMF (10 мл), и перемешивали смесь при к.т. в течение 15 ч. Смесь распределяли между водой и DCM, органический слой отделяли и последовательно промывали водой и солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением N-(4-бром-2-фтор-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамида (4,8 г, 98%) в виде масла, которое дополнительно не очищали. ЖХМС (ИЭР) m/z 456 и 458 (M+H)+.
Стадия 3: К перемешиваемой смеси N-(4-бром-2-фтор-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамида (4,8 г, 10,55 ммоль), полученного на предшествующей стадии, HOAc (15 мл) и EtOH (50 мл) при к.т. порциями добавляли железный порошок (1,77 г, 31,65 ммоль). Смесь нагревали при 80°C в течение 2,5 ч. После охлаждения до к.т. смесь распределяли между насыщенным водн. NaHCO3 и смесью EtOAc и MeOH (10/1). Двухфазную смесь фильтровали через целит, и разделяли слои в фильтрате. Водный слой экстрагировали смесью EtOAc и MeOH (10/1). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Оставшееся твердое вещество очищали путем растирания с диэтиловым эфиром с получением 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (1,39 мг, 39%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,56 (с, 1H), 7,87 (м, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,75 (м, 1H), 7,30-7,34 (м, 2H), 5,66 (с, 2H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 408 и 410 (M+H)+.
Стадия 4: 6-((5-Бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (1,33 г, 92%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 3 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,58 (с, 1H), 8,10 (м, 1H), 8,07 (д, J=10,6 Гц, 1H), 7,76 (м, 1H), 7,48 (дд, J=8,5, 1,7 Гц, 1H), 7,32 (дд, J=10,6, 1,7 Гц, 1H), 5,75 (с, 2H), 3,05 (с, 3H); ЖХМС (ИЭР) m/z 424 и 426 (M+H)+.
Стадия 5: Перемешиваемую смесь 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (1,33 г, 3,14 ммоль), (1R,2R)-2-аминоциклогексанола (1,09 г, 9,43 ммоль), DIEA (1,62 г, 12,58 ммоль) и DMA (40 мл) нагревали в герметизированной пробирке при 110°C в течение 15 ч. Смесь охлаждали до к.т., а затем распределяли между водой и EtOAc. Органический слой отделяли и последовательно промывали водой и солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Оставшееся твердое вещество очищали путем растирания со смесью диэтилового эфира и DCM (6/1) с получением (1R,2R)-2-((6-((5- бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (952 мг, 64%) в виде рыжеватого твердого вещества. Порцию массой 90 мг дополнительно очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (15 мг) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,52 (с, 1H), 7,98 (д, J=10,0 Гц, 1H), 7,74 (д, J=5,0 Гц, 1H), 7,54 (м, 1H), 7,33 (м, 1H), 7,29 (д, J=10,0 Гц, 1H), 7,08 (м, 1H), 5,52 (с, 2H), 4,75 (д, J=5,0 Гц, 1H), 3,51 (м, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,59-1,64 (м, 2H), 1,16-1,30 (м, 4H); ЖХМС (ИЭР) m/z 475 и 477 (M+H)+.
Пример 204
Получение 1-(3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанон-O-метилоксима
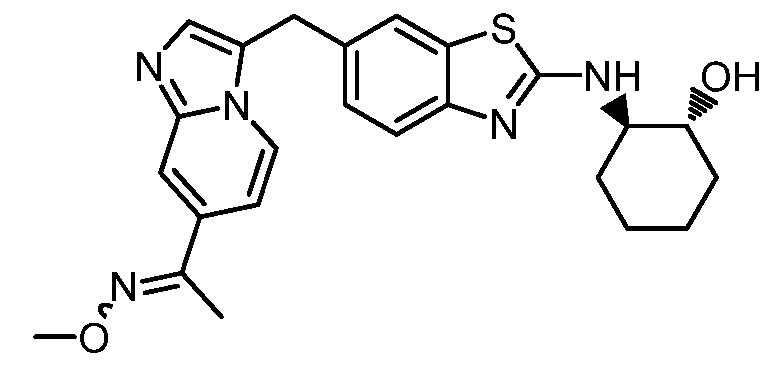
1-(3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)этанон-O-метилоксим получали в виде желтого порошка (23 мг, 59%) с использованием методики, аналогичной описанной в примере 202, заменяя гидрохлорид гидроксиламина, использованный в примере 202, гидрохлоридом O-метилгидроксиламина. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,17 (д, J=7,4 Гц, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,79 (с, 1H), 7,51 (с, 1H), 7,46 (с, 1H), 7,27 (д, J=8,4 Гц, 2H), 7,08 (д, J=7,9 Гц, 1H), 4,78 (шир. с, 1H), 4,30 (с, 2H), 3,94 (с, 3H), 3,50 (шир. с, 1H), 2,21 (с, 3H), 2,04 (д, J=11,8 Гц, 1H), 1,85-1,93 (м, 1H), 1,54-1,69 (м, 2H), 1,09-1,35 (м, 4H). ЖХМС (ИЭР) m/z 450 (M+H)+.
Пример 205
Получение (1R,2R)-2-((6-((9H-бензо[d]имидазо[1,2-a]имидазол-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
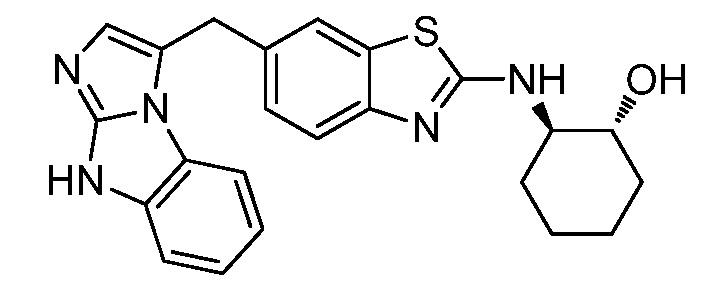
(1R,2R)-2-((6-((9H-Бензо[d]имидазо[1,2-a]имидазол-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (17 мг, 7%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 3 Пример 153, с использованием 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналя, полученного на стадии 2 примера 153, и заменяя 4-(2-метоксиэтокси)пиридин-2-амин, использованный на стадии 3 примера 153, 1H-бензо[d]имидазол-2-амином. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,66 (шир. с, 1H), 7,87 (д, J=7,4 Гц, 1H), 7,54 (с, 1H), 7,35 (дд, J=3,4, 7,9 Гц, 2H), 7,28 (д, J=8,4 Гц, 1H), 7,08-7,17 (м, 2H), 6,84-6,95 (м, 2H), 4,74 (шир. с, 1H), 4,32 (с, 2H), 3,50 (шир. с, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,54-1,67 (м, 2H), 1,12-1,33 (м, 4H); ЖХМС (ИЭР) m/z 418 (M+H)+.
Пример 206
Получение 7-фтор-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила
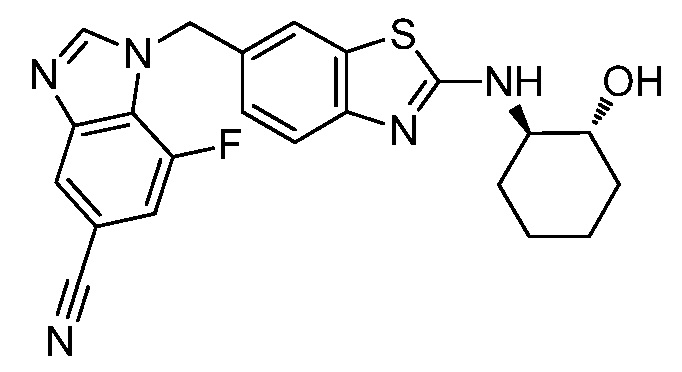
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,316 ммоль), полученного в примере 203, цианида цинка (111 мг, 0,948 ммоль), 1,1’-бис(дифенилфосфино)ферроцена (35 мг, 0,0632 ммоль) и безводного DMF (2 мл) продували струей аргона. К смеси добавляли трис(дибензилиденацетон)палладий(0) (29 мг, 0,0316 ммоль), и нагревали смесь в герметизированной пробирке 100°C в течение 6 ч. Смесь охлаждали, добавляли дополнительное количество цианида цинка (111 мг, 0,948 ммоль), 1,1’-бис(дифенилфосфино)ферроцена (35 мг, 0,0632 ммоль) и трис(дибензилиденацетон)палладия(0) (29 мг, 0,0316 ммоль), и продолжали нагревание в герметизированной пробирке при 100°C в течение 15 ч. Смесь охлаждали до к.т. и сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (7-фтор-1-((2- (((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила (2,6 мг, 2%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,13 (с, 1H), 8,02 (д, J=7,6 Гц, 1H), 7,63 (д, J=11,1 Гц, 1H), 7,57 (с, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,10 (д, J=8,1 Гц, 1H), 5,58 (с, 2H), 4,77 (шир. с, 1H), 3,50 (шир. м, 1H), 3,30 (шир. м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,12-1,32 (м, 4H); ЖХМС (ИЭР) m/z 422 (M+H)+.
Пример 207
Получение (1R,2R)-2-((6-((7-фтор-5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
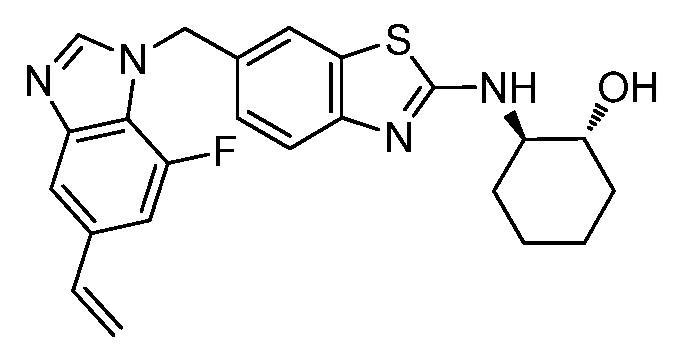
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,316 ммоль), полученного в примере 203, пинаколового эфира винилбороновой кислоты (97 мг, 0,632 ммоль), карбоната натрия (67 мг, 0,0632 ммоль), 1,4-диоксана (2 мл) и воды (0,5 мл) продували струей аргона. К смеси добавляли аддукт дихлор[1,1’-бис(дифенилфосфино)ферроцен]палладия(II) и DCM (35 мг, 0,0474 ммоль), и нагревали смесь в герметизированном реакционном сосуде при 100°C в течение 2,5 ч. Смесь охлаждали до к.т. и сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((7-фтор-5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (23 мг, 17%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,44 (с, 1H), 7,98 (д, J=7,6 Гц, 1H), 7,55 (д, J=6,9 Гц, 2H), 7,23-7,31 (м, 2H), 7,09 (м, 1H), 6,79 (дд, J=11,0, 17,6 Гц, 1H), 5,83 (д, J=17,5 Гц, 1H), 5,51 (с, 2H), 5,22 (д, J=11,1 Гц, 1H), 4,74 (д, J=4,4 Гц, 1H), 3,51 (шир. м, 1H), 3,30 (шир. м, 1H), 2,03 (м, 1H), 1,87 (м, 1H), 1,55-1,67 (м, 2H), 1,14-1,32 (м, 4H); ЖХМС (ИЭР) m/z 423 (M+H)+.
Пример 208
Получение (1R,2R)-2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
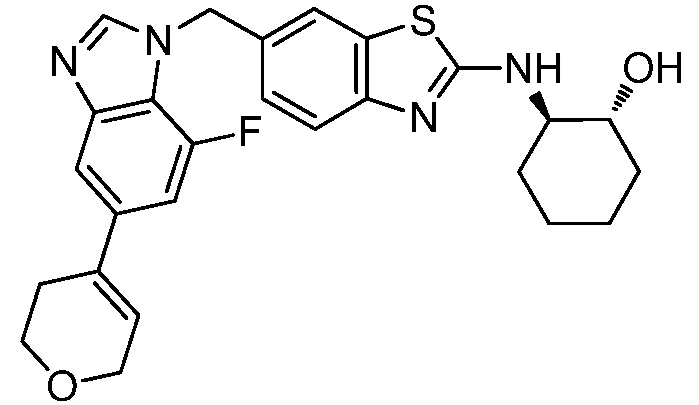
Перемешиваемую смесь (1R,2R)-2-((6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,316 ммоль), полученного в примере 203, пинаколового эфира 3,6-дигидро-2H-пиран-4-бороновой кислоты (133 мг, 0,632 ммоль), карбоната натрия (67 мг, 0,0632 ммоль), 1,4-диоксана (2 мл) и воды (0,5 мл) продували струей аргона. К смеси добавляли аддукт дихлор[1,1’- бис(дифенилфосфино)ферроцен]палладия(II) и DCM (35 мг, 0,0474 ммоль), и нагревали смесь в герметизированном сосуде при 100°C в течение 3 ч. Смесь охлаждали до к.т. и сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5-(3,6-дигидро-2H-пиран-4-ил)-7-фтор-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (55 мг, 36%) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,43 (с, 1H), 7,95 (д, J=7,6 Гц, 1H), 7,49-7,56 (м, 2H), 7,29 (д, J=8,1 Гц, 1H), 7,21 (д, J=13,0 Гц, 1H), 7,09 (м, 1H), 6,27 (шир. м, 1H), 5,51 (с, 2H), 4,72 (д, J=5,2 Гц, 1H), 4,21 (д, J=2,5 Гц, 2H), 4,06 (м, 1H), 3,81 (т, J=5,4 Гц, 2H), 3,61 (м, 1H), 3,51 (шир. м, 1H), 3,30 (шир. м, 1H), 2,00 (м, 1H), 1,88 (м, 1H), 1,55-1,67 (м, 2H), 1,11-1,32 (м, 4H); ЖХМС (ИЭР) m/z 479 (M+H)+.
Пример 209
Получение (1R,2R)-2-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
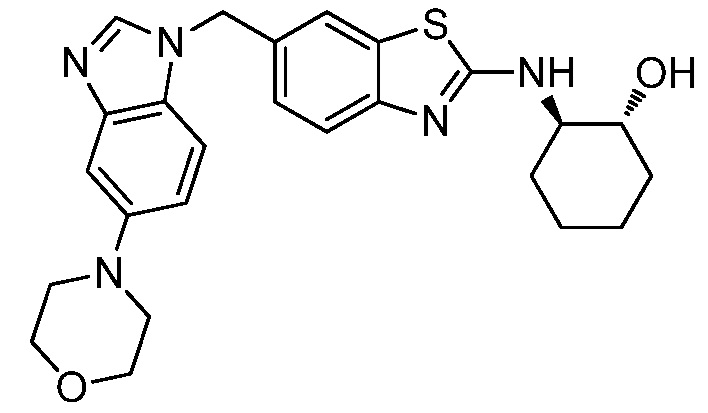
(1R,2R)-2-((6-((5-Морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (10 мг, 7%) получали в виде твердого вещества с использованием методики, аналогичной описанной в примере 97, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, полученный в примере 97, (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 5 примера 183. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,42 (шир. с, 1H), 7,62 (шир. с, 1H), 7,57 (с, 1H), 7,47 (шир. с, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,15 (д, J=7,9 Гц, 2H), 6,94 (д, J=8,9 Гц, 1H), 5,40 (с, 2H), 4,42 (шир. с, 1H), 3,70-3,81 (м, 4H), 3,52 (м, 1H), 3,41 (шир. с, 1H), 3,06-3,11 (м, 4H), 2,07 (м, 1H), 1,90 (м, 1H), 1,60-1,70 (м, 2H), 1,20-1,36 (м, 4H); ЖХМС (ИЭР) m/z 464 (M+H)+.
Пример 210
Получение 1-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)пиперидин-2-она
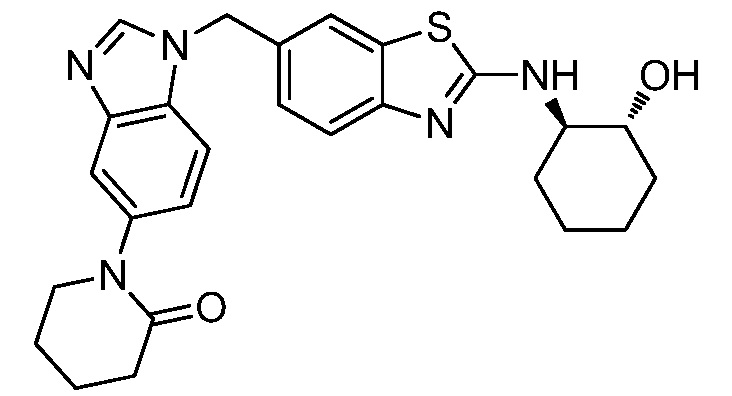
К перемешиваемой смеси йодида меди (23 мг, 0,12 ммоль) и трикалийфосфата (190 мг, 0,90 ммоль) в DMSO (3 мл) добавляли (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (150 мг, 0,30 ммоль), полученный на стадии 5 примера 183, и пиперидин-2-он (200 мг, 2,02 ммоль). Смесь продували аргоном и нагревали в герметизированном реакционном сосуде при 125°C в течение 15 ч. Реакционную смесь охлаждали до к.т. и фильтровали, и сразу очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением 1-(1-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)пиперидин-2-она (3 мг, 7%) в виде твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,31 (шир. с, 1H), 7,69 (шир. с, 1H), 7,62 (с, 1H), 7,44-7,53 (м, 2H), 7,30 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 7,08 (д, J=8,9 Гц, 1H), 5,45 (с, 2H), 3,62 (т, J=5,4 Гц, 2H), 3,51 (шир. с, 1H), 3,37-3,46 (м, 2H), 2,36-2,43 (м, 2H), 2,06 (м, 1H), 1,82-1,93 (м, 5H), 1,61-1,70 (м, 2H), 1,20-1,36 (м, 4H); ЖХМС (ИЭР) m/z 476 (M+H)+.
Пример 211
Получение (1R,2R)-2-((6-((5-(1H-пиразол-3-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
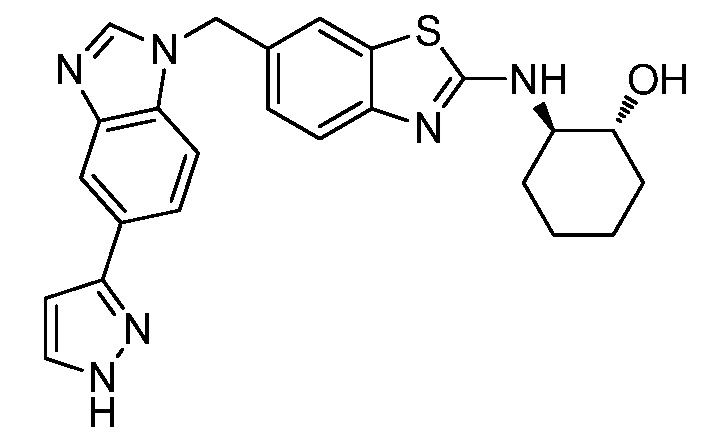
К перемешиваемому раствору (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,20 ммоль), полученного на стадии 5 примера 183, в DMF (2 мл) добавляли (1H-пиразол-3-ил)бороновую кислоту (90 мг, 0,80 ммоль), NaHCO3 (100 мг, 1,2 ммоль), дихлорид бис(трифенилфосфин)палладия(II) (28 мг, 0,04 ммоль) и воду (0,4 мл). Смесь продували аргоном и нагревали в герметизированном сосуде при 90°C в течение 15 ч. Реакционную смесь охлаждали до к.т. и распределяли между DCM и водой. Водный слой дважды экстрагировали DCM, объединенные органические фазы трижды промывали смесью воды и солевого раствора (1/1). Затем органические фазы сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 100% DCM→10% MeOH/DCM, с получением (1R,2R)-2-((6-((5-(1H-пиразол-3-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (4 мг, 5%) в виде твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,92 (шир. с, 1H), 12,53 (шир. с, 1H), 8,29 (шир. с, 1H), 8,03 (м, 1H), 7,58-7,74 (м, 3H), 7,53 (д, J=7,9 Гц, 1H), 7,31 (д, J=7,9 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 6,63 (шир. с, 1H), 5,47 (с, 2H), 4,42 (д, J=4,4 Гц, 1H), 3,51 (шир. с, 1H), 3,41 (тт, J=4,5, 8,8 Гц, 1H), 2,06 (м, 1H), 1,90 (д, J=11,8 Гц, 1H), 1,57-1,71 (м, 2H), 1,19-1,36 (м, 4H); ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 212
Получение (1R,2R)-2-((6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
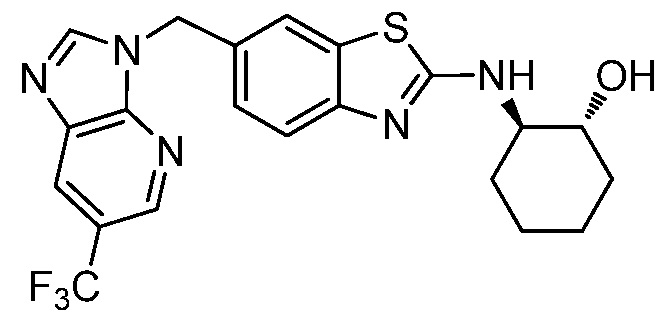
Стадия 1: Смесь 2-хлор-3-нитро-5-(трифторметил)пиридина (500 мг, 2,21 ммоль), (2-(метилтио)бензо[d]тиазол-6-ил)метанамина (583 мг, 2,76 ммоль), полученного на стадии 4 примера 23, и триэтиламина (837 мг, 8,29 ммоль) в DMF (10 мл) перемешивали при к.т. в течение ночи. Реакционную смесь разбавляли EtOAc и промывали водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (1/0→10/1), с получением N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитро-5-(трифторметил)пиридин-2-амина в виде желтого твердого вещества (150 мг, 84,7%). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,46 (т, J=1,8 Гц,1H), 8,78 (д, J=2,1 Гц, 1H), 8,66 (д, J=2,4 Гц, 1H), 7,97 (с, 1H), 7,78 (д, J=8,4 Гц, 1H), 7,49-7,45 (м, 1H), 4,95 (д, J=6,6 Гц, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 401 (M+H)+.
Стадия 2: К смеси N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-нитро-5-(трифторметил)пиридин-2-амина (0,97 г, 2,42 ммоль), HOAc (4 мл) и MeOH (4 мл) в DCM (30 мл), охлажденной на бане со льдом/водой, медленно добавляли цинковую пыль (1,6 г, 24,2 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч. Смесь фильтровали, фильтрат разбавляли DCM, а затем промывали водой и водн. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-5-(трифторметил)пиридин-2,3-диамина (0,89 г, 100%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,05 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,77 (с, 1H), 7,44-7,41 (м, 1H), 7,03 (д, J=1,8 Гц, 1H), 4,84 (шир. с, 1H), 4,78 (д, J=5,1 Гц, 2H), 3,29 (шир. с, 2H), 2,79 (с, 3H). ЖХМС (ИЭР) m/z 371 (M+H)+.
Стадия 3: Смесь N2-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-5-(трифторметил)пиридин-2,3-диамина (0,89 г, 2,39 ммоль), триэтоксиметана (30 мл) и HCOOH (0,6 г) перемешивали при 90°C в течение 2 ч. Смесь концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (2/1→0/1), с получением 2-(метилтио)-6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазола в виде светло-желтого твердого вещества (0,77 г, 79,3%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,88 (с, 1H), 8,77 (д, J=1,2 Гц, 1H), 8,57 (д, J=1,8 Гц, 1H), 8,00 (д, J=1,2 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,49-7,46 (м, 1H), 5,68 (с, 2H), 2,77 (с, 3H). ЖХМС (ИЭР) m/z 381 (M+H)+.
Стадия 4: Смесь 2-(метилтио)-6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазола (200 мг, 0,53 ммоль) и m-CPBA (114 мг, 0,66 ммоль) в DCM (5 мл) перемешивали на бане со льдом/водой в течение 2 ч. Смесь разбавляли DCM и промывали водн. Na2S2O3, водн. NaHCO3 и водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 2-(метилсульфинил)-6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазола в виде желтого твердого вещества (180 мг, 87,8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,91 (с, 1H), 8,77 (с, 1H), 8,59 (с, 1H), 8,23 (с, 1H), 8,08 (д, J=8,1 Гц, 1H), 7,66-7,62 (м, 1H), 5,77 (с, 2H), 3,06 (с, 3H). ЖХМС (ИЭР) m/z 397 (M+H)+.
Стадия 5: Смесь 2-(метилсульфинил)-6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазола (180 мг, 0,45 ммоль), (1R,2R)-2-аминоциклогексанола (112 мг, 0,97 ммоль) и DIEA (261 мг, 2 ммоль) в DMA (2 мл) перемешивали при 130°C в течение ночи. Реакционную смесь разбавляли EtOAc и промывали солевым раствором. Органический слой сушили над NaSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с получением (1R,2R)-2-((6-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде желтого твердого вещества (64 мг, 31,8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,84 (с, 1H), 8,78 (д, J=1,2 Гц, 1H), 8,55 (д, J=1,5 Гц, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,68 (д, J=1,5 Гц, 1H), 7,29 (д, J=7,8 Гц, 1H), 7,25-7,22 (м, 1H), 5,55 (с, 2H), 4,71 (д, J=5,1 Гц, 1H), 3,52-3,50 (м, 1H), 3,37-3,33 (м, 1H), 2,08-2,01 (м, 1H), 1,87-1,85 (м, 1H), 1,64-1,60 (м, 2H), 1,29-1,19 (м, 4H). ЖХМС (ИЭР) m/z 448 (M+H)+.
Пример 213
Получение (1S,2S)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
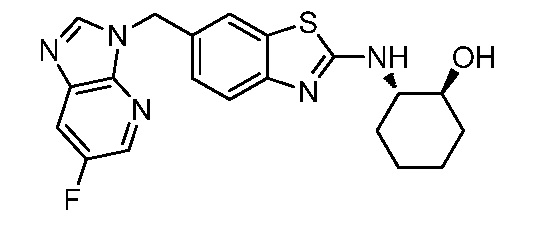
(1S,2S)-2-((6-((6-Фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол синтезировали в виде белого порошка (48 мг, 42%) с использованием методики, аналогичной описанной на стадии 5 примера 162, заменяя гидрохлорид (1S,2R)-2-аминоциклогексанола, использованный в примере 162, (1S,2S)-2-аминоциклогексанолом. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,41 (т, J=2,0 Гц, 1H), 8,07 (дд, J=2,6, 9,5 Гц, 1H), 7,95 (д, J=7,6 Гц, 1H), 7,66 (д, J=1,2 Гц, 1H), 7,28 (м, 1H), 7,22 (дд, J=1,5, 8,4 Гц, 1H), 5,48 (с, 2H), 4,72 (д, J=5,2 Гц, 1H), 3,51 (м, 1H), 3,33 (м, 1H), 2,02 (м, 1H), 1,87 (м, 1H), 1,57-1,65 (м, 2H), 1,15-1,29 (м, 4H); ЖХМС (ИЭР) m/z 399 (M+H)+.
Пример 214
Получение (1R,2R)-2-((6-((7-(1H-имидазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
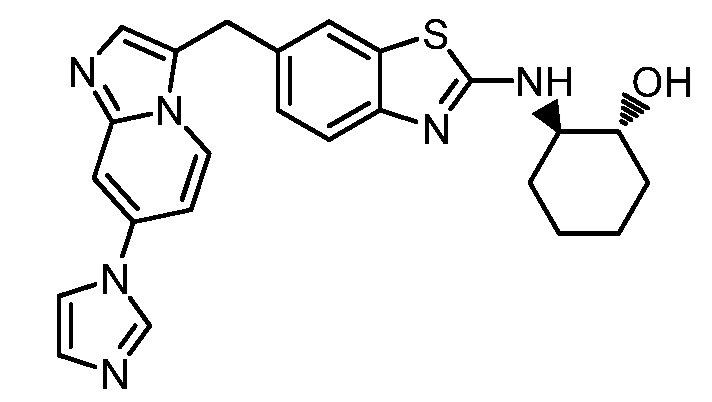
(1R,2R)-2-((6-((7-(1H-Имидазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (27 мг, 47%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованный в примере 141, (1R,2R)-2-((6-((7-йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 примера 167, и имидазолом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,42 (шир. с, 1H), 8,34 (д, J=6,9 Гц, 1H), 7,93 (шир. с, 1H), 7,90 (д, J=7,4 Гц, 2H), 7,54 (с, 1H), 7,49 (шир. с, 1H), 7,33 (д, J=7,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 7,01-7,19 (м, 2H), 4,77 (шир. с, 1H), 4,33 (с, 2H), 3,51 (шир. с, 1H), 3,31-3,34 (м, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,53-1,70 (м, 2H), 1,06-1,36 (м, 4H). ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 215
Получение (1R,2R)-2-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
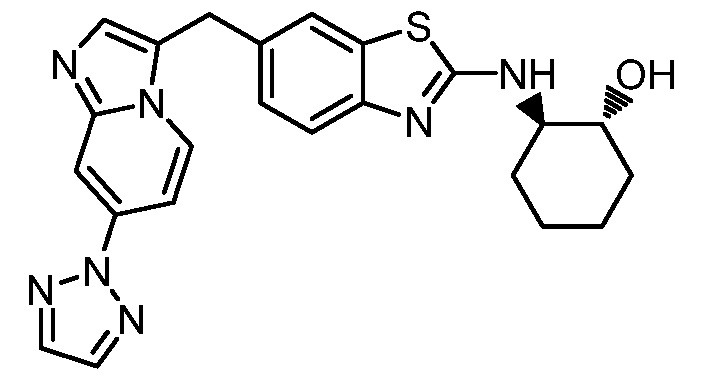
(1R,2R)-2-((6-((7-(2H-1,2,3-Триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (13 мг, 23%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованный в примере 141, (1R,2R)-2-((6-((7-йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 примера 167, и 1,2,3-триазолом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,40 (д, J=7,4 Гц, 1H), 8,18 (с, 2H), 8,04 (с, 1H), 7,90 (д, J=7,9 Гц, 1H), 7,63 (дд, J=2,0, 7,4 Гц, 1H), 7,54 (с, 1H), 7,51 (с, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,11 (д, J=6,9 Гц, 1H), 4,77 (шир. с, 1H), 4,34 (с, 2H), 3,51 (шир. с, 3H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=11,3 Гц, 1H), 1,55-1,69 (м, 2H), 1,10-1,36 (м, 4H). ЖХМС (ИЭР) m/z 446 (M+H)+.
Пример 216
Получение (1R,2R)-2-((6-((7-винилимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
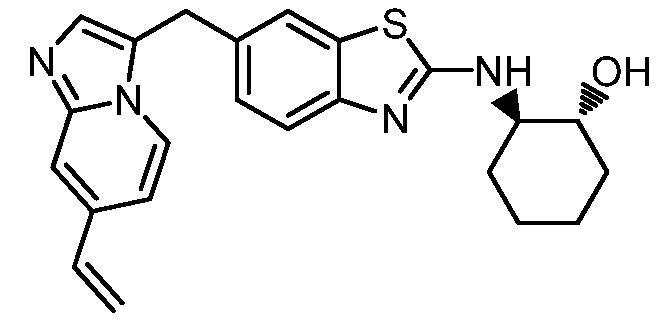
Стадия 1: Неочищенный 4-винилпиридин-2-амин (200 мг) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 98, заменяя (1R,2R)-2-((6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 98, 4-йодпиридин-2-амином. ЖХМС (ИЭР) m/z 121 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((7-Винилимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (13 мг, 8%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-винилпиридин-2-амином, полученным на стадии 1 этого примера, и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,14 (д, J=6,9 Гц, 1H), 7,86 (д, J=7,4 Гц, 1H), 7,52 (д, J=3,4 Гц, 2H), 7,40 (с, 1H), 7,26 (д, J=7,9 Гц, 1H), 7,13 (д, J=5,9 Гц, 1H), 7,09 (д, J=6,9 Гц, 1H), 6,77 (дд, J=10,8, 17,7 Гц, 1H), 5,91 (д, J=17,7 Гц, 1H), 5,34 (д, J=11,3 Гц, 1H), 4,72 (д, J=3,4 Гц, 1H), 4,28 (с, 2H), 3,52 (д, J=8,4 Гц, 2H), 2,03 (д, J=10,8 Гц, 1H), 1,87 (д, J=11,3 Гц, 1H), 1,54-1,70 (м, 2H), 1,11-1,36 (м, 4H). ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 217
Получение (1R,2R)-2-((6-((7-(аллилокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
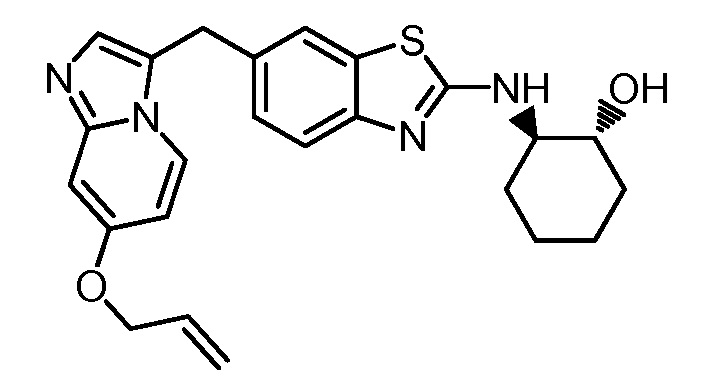
Стадия 1: К перемешиваемому раствору 2-аминопиридин-4-ола (500 мг, 4,5 ммоль) в DMF (5 мл) при к.т. добавляли K2CO3 (940 мг, 6,8 ммоль). Полученную смесь перемешивали при к.т. в течение 20 мин, после чего добавляли аллилбромид (393 мкл, 4,5 ммоль). Смесь затем перемешивали при к.т. в течение ночи и нагревали при 60°C в течение 2 ч. После охлаждения до к.т. смесь распределяли между EtOAc и водой, органический слой промывали солевым раствором, сушили над Na2SO4 и упаривали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя EtOAc в гексанах, с получением 4-(аллилокси)пиридин-2-амина (110 мг, 16%) в виде белого твердого вещества. ЖХМС (ИЭР) m/z 151 (M+H)+.
Стадия 2: (1R,2R)-2-((6-((7-(Аллилокси)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (56 мг, 34%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованный в примере 117, 4-(аллилокси)пиридин-2-амином, полученным на стадии 1 этого примера, и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученным на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,02 (д, J=7,4 Гц, 1H), 7,88 (д, J=7,9 Гц, 1H), 7,49 (с, 1H), 7,26 (д, J=7,9 Гц, 1H), 7,23 (с, 1H), 7,07 (д, J=8,4 Гц, 1H), 6,92 (д, J=2,5 Гц, 1H), 6,60 (дд, J=2,5, 7,4 Гц, 1H), 5,96-6,10 (м, 1H), 5,42 (д, J=17,2 Гц, 1H), 5,28 (д, J=10,3 Гц, 1H), 4,75 (шир. с, 1H), 4,61 (д, J=5,4 Гц, 2H), 4,22 (с, 2H), 3,51 (шир. с, 2H), 2,04 (д, J=11,8 Гц, 1H), 1,87-1,94 (м, 1H), 1,55-1,69 (м, 2H), 1,11-1,36 (м, 4H). ЖХМС (ИЭР) m/z 435 (M+H)+.
Пример 218
Получение (1R,2R)-2-((6-((7-(1H-1,2,3-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
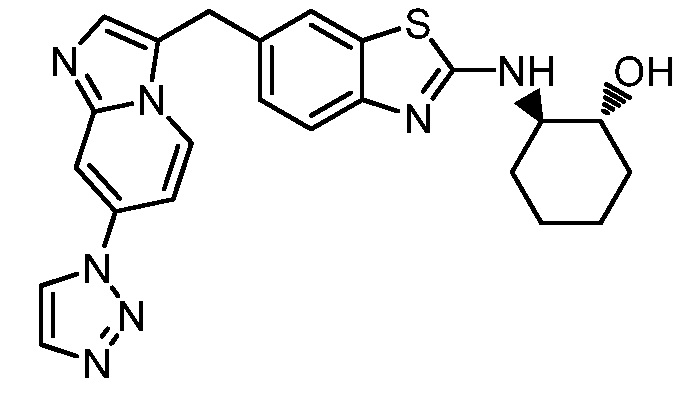
(1R,2R)-2-((6-((7-(1H-1,2,3-триазол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (6 мг, 11%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованный в примере 141, (1R,2R)-2-((6-((7-йодимидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом, полученным на стадии 1 примера 167, и 1,2,3-триазолом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,98 (с, 1H), 8,44 (д, J=7,4 Гц, 1H), 8,17 (с, 1H), 8,01 (с, 1H), 7,96 (д, J=7,4 Гц, 1H), 7,58 (д, J=7,4 Гц, 1H), 7,55 (шир. с, 2H), 7,28 (д, J=8,4 Гц, 1H), 7,11 (д, J=8,4 Гц, 1H), 4,83 (шир. с, 1H), 4,35 (с, 2H), 3,50 (шир. с, 3H), 2,04 (д, J=11,8 Гц, 1H), 1,87 (д, J=10,8 Гц, 1H), 1,54-1,67 (м, 2H), 1,08-1,33 (м, 4H). ЖХМС (ИЭР) m/z 446 (M+H)+.
Пример 219
Получение N-((1R,2S)-2-хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амина
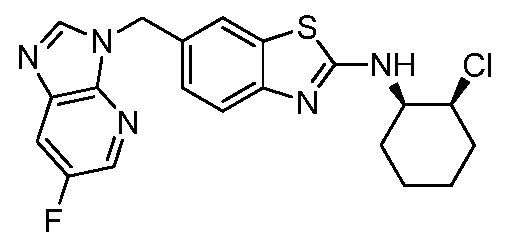
N-((1R,2S)-2-Хлорциклогексил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амин синтезировали в виде белого порошка (6 мг, 2%) с использованием методики, аналогичной описанной в примере 198, заменяя (1S,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол, использованный в примере 198, (1R,2R)-2-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанолом. 1H ЯМР (500 МГц, CDCl3) δ 8,68 (с, 1H), 8,41 (с, 1H), 8,24 (д, J=8,4 Гц, 1H), 8,07 (дд, J=2,6, 9,5 Гц, 1H), 7,68 (с, 1H), 7,33 (д, J=8,4 Гц, 1H), 7,24 (дд, J=1,4, 8,2 Гц, 1H), 5,48 (с, 2H), 4,02 (м, 1H), 3,87 (м, 1H), 2,20 (м, 1H), 2,07 (м, 1H), 1,63-1,75 (м, 3H), 1,29-1,41 (м, 3H); ЖХМС (ИЭР) m/z 416 (M+H)+.
Пример 220
Получение 3-амино-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-онацетата
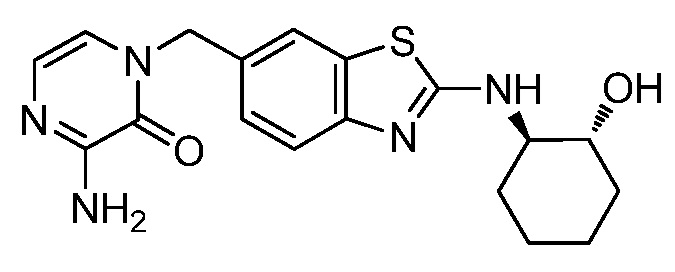
Стадия 1: К перемешиваемой смеси йодида натрия (4,89 г, 32,67 ммоль) и 2-йод-3-метоксипиразина (2,57 г, 10,89 ммоль) в ацетонитриле (30 мл) при к.т. добавляли триметилсилилхлорид (3,55 г, 32,67 ммоль). Смесь нагревали при 70°C в течение 1,5 ч. Смесь охлаждали до к.т. и распределяли между смесью DCM, MeOH и 2 M водн. HCl. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством смеси DCM/MeOH. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 3-йодпиразин-2(1H)-она (1,21 г, 50%) в виде коричневого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,54 (шир. с, 1H), 7,42 (д, J=3,7 Гц, 1H), 7,17 (д, J=3,7 Гц, 1H); ЖХМС (ИЭР) m/z 223 (M+H)+.
Стадия 2: 3-Йод-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-он (1 г) получали в виде коричневого твердого вещества с использованием методики, аналогичной описанной на стадии 2 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)формамид, использованный в примере 203, 3-йодпиразин-2(1H)-оном, полученным на стадии 1 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,98 (с, 1H), 7,81-7,85 (м, 2H), 7,45 (м, 1H), 7,23 (м, 1H), 5,19 (с, 2H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 416 (M+H)+.
Стадия 3: Перемешиваемую смесь 3-йод-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-она (750 мг, 1,81 ммоль), аммиака (7 M раствор в MeOH, 2 мл, 14 ммоль) и DMSO (1,5 мл) нагревали микроволновом реакторе Biotage при 150°C в течение 15 мин. Смесь охлаждали до и распределяли между EtOAc и смесью воды и солевого раствора (1/1). Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 100% DCM→2% MeOH в DCM, с получением 3-амино-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-она (149 мг) в виде желтого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,96 (с, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,43 (дд, J=1,5, 8,4 Гц, 1H), 6,92 (д, J=4,7 Гц, 1H), 6,65-6,67 (шир. м, 3H), 5,11 (с, 2H), 2,78 (с, 3H); ЖХМС (ИЭР) m/z 305 (M+H)+.
Стадия 4: 3-Амино-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-он (84 мг, 54%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 3-амино-1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-оном, полученным на стадии 3 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,20 (с, 1H), 8,08 (д, J=8,6 Гц, 1H), 7,59 (дд, J=1,5, 8,4 Гц, 1H), 6,94 (д, J=4,7 Гц, 1H), 6,69 (д, J=4,4 Гц, 3H), 5,19 (с, 2H), 3,07 (с, 3H); ЖХМС (ИЭР) m/z 321 (M+H)+.
Стадия 5: 3-Амино-1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-онацетат (19 мг, 17%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 203, заменяя 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 130, 3-амино-1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)пиразин-2(1H)-оном, полученным на стадии 4 этого примера. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,99 (д, J=7,4 Гц, 1H), 7,62 (с, 1H), 7,30 (д, J=8,1 Гц, 1H), 7,19 (дд, J=1,5, 8,1 Гц, 1H), 6,87 (д, J=4,7 Гц, 1H), 6,60-6,80 (м, 3H), 4,99 (с, 2H), 3,20-3,60 (м, 4H), 2,04 (м, 1H), 1,88 (с, 3H), 1,57-1,67 (м, 2H), 1,12-1,33 (м, 4H); ЖХМС (ИЭР) m/z 372 (M+H)+.
Пример 221
Получение 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила
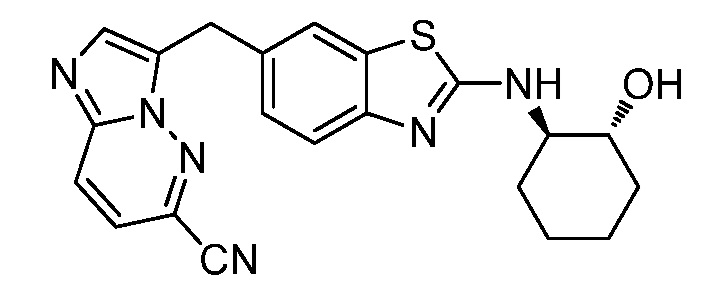
Стадия 1: Перемешиваемую смесь 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналя (1,3 г, 4,8 ммоль), полученного на стадии 4 примера 117, и 6-аминопиридазин-3-карбонитрила (0,8 г, 7,2 ммоль) в 1-бутаноле (48 мл) нагревали с обратным холодильником в течение ночи. Смесь охлаждали до к.т., и добавляли воду (100 мл). Смесь экстрагировали EtOAc (3×60 мл), объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1) с получением 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила в виде желтого твердого вещества (0,7 г, 44%). 1H ЯМР (300 МГц, CDCl3) δ 8,09 (д, J=9,0 Гц, 1H), 7,83-7,78 (м, 2H), 7,69 (с, 1H), 7,36 (д, J=8,4 Гц, 1H), 7,29 (д, J=9,3 Гц, 1H), 4,46 (с, 2H), 2,78 (с, 3H). ЖХМС (ИЭР) m/z 338 (M+H)+.
Стадия 2: К раствору 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила (0,7 г, 2,1 ммоль) в DCM (30 мл) при 0°C медленно добавляли m-CPBA (0,4 г, 2,1 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч, затем добавляли водн. Na2SO3 (25 мл), и перемешивали смесь в течение 0,5 ч. Органический слой отделяли и сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила в виде желтого твердого вещества (0,7 г, 96%). 1H ЯМР (300 МГц, CDCl3) δ 8,11 (д, J=9,3 Гц, 1H), 8,02 (д, J=8,4 Гц, 1H), 7,92 (с, 1H), 7,82 (с, 1H), 7,51 (д, J=8,4 Гц, 1H), 7,31 (д, J=9,3 Гц, 1H), 4,54 (с, 2H), 3,07 (с, 3H). ЖХМС (ИЭР) m/z 354 (M+H)+.
Стадия 3: Смесь 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила (300 мг, 0,9 ммоль), (1R,2R)-2-аминоциклогексанола (293 мг, 2,5 ммоль) и DIEA (219 мг, 1,7 ммоль) в NMP (16 мл) перемешивали при 135°C в течение ночи. Смесь охлаждали до к.т., и добавляли воду (40 мл). Смесь экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя DCM/MeOH (50/1→20/1), с получением 3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-b]пиридазин-6-карбонитрила в виде коричневого твердого вещества (100 мг, 30%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (д, J=9,3 Гц, 1H), 7,87-7,84 (м, 2H), 7,70 (д, J=9,3 Гц, 1H), 7,55 (д, J=1,5 Гц, 1H), 7,28 (д, J=8,1 Гц, 1H), 7,13 (дд, J=1,5, 8,1 Гц, 1H), 4,72 (д, J=5,1 Гц, 1H), 4,36 (с, 2H), 3,54-3,51 (м, 1H), 3,39-3,36 (м, 1H), 2,06-2,02 (м, 1H), 1,90-1,86 (м, 1H), 1,65-1,59 (м, 2H), 1,31-1,17 (м, 4H). ЖХМС (ИЭР) m/z 405 (M+H)+.
Пример 222
Получение 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она
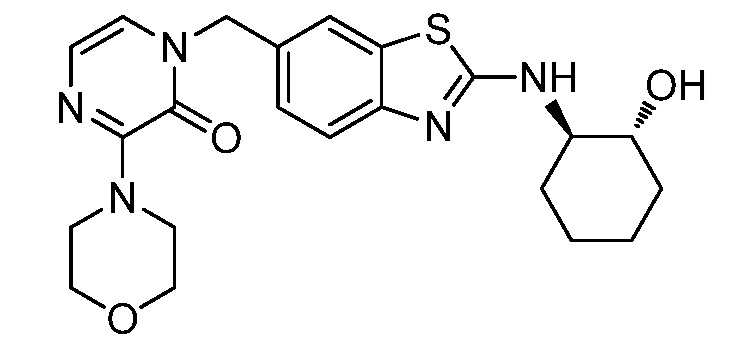
Стадия 1: Смесь 2,3-дихлорпиразина (894 мг, 6 ммоль), морфолина (523 мг, 6 ммоль) и DIEA (1,55 г, 12 ммоль) в DMSO (8 мл) перемешивали при 70°C в течение 2 ч. Реакционную смесь вливали в воду (30 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали 2н водн. HCl (30 мл), водой (2×30 мл) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 4-(3-хлорпиразин-2-ил)морфолина в виде светло-желтого твердого вещества (1,01 г, 92,8%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,11 (д, J=2,4 Гц, 1H), 7,90 (д, J=2,7 Гц, 1H), 3,86 (т, J=9,3 Гц, 4H), 3,45 (т, J=9,6 Гц, 4H). ЖХМС (ИЭР) m/z 200 (M+H)+.
Стадия 2: Смесь 4-(3-хлорпиразин-2-ил)морфолина (894 мг, 6 ммоль) и водн. NaOH (13 мл, 52 ммоль) в DMSO (18 мл) перемешивали при 80°C в течение 2 ч. Реакционную смесь вливали в воду (30 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 3-морфолинопиразин-2(1H)-она в виде светло-желтого твердого вещества (807 мг, 92,9%). 1H ЯМР (300 МГц, CDCl3) δ 11,80 (шир. с, 1H), 7,05 (д, J=4,2 Гц, 1H), 6,73 (д, J=4,2 Гц, 1H), 3,84 (с, 8H). ЖХМС (ИЭР) m/z 182 (M+H)+.
Стадия 3: К перемешиваемому раствору 3-морфолинопиразин-2(1H)-она (317 мг, 1,75 ммоль) в DMF (8 мл) при 0°C добавляли NaH (60% в минеральном масле, 105 мг, 2,63 ммоль). После перемешивания в течение 20 мин, по каплям добавляли раствор 6-(хлорметил)-2-(метилтио)бензо[d]тиазола (400 мг, 1,75 ммоль) в DMF (2 мл), и перемешивали смесь при к.т. в течение 2 ч. Смесь вливали в воду и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением 1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она в виде светло-желтого твердого вещества (625 мг, 95,4%). 1H ЯМР (300 МГц, CDCl3) δ 7,82 (д, J=8,4 Гц,1H), 7,71 (с, 1H), 7,36 (д, J=6,6 Гц, 1H), 6,92 (д, J=4,2 Гц, 1H), 6,71 (д, J=4,2 Гц, 1H), 5,10 (с, 2H), 3,81 (с, 8H), 2,80 (с, 3H). ЖХМС (ИЭР) m/z 375 (M+H)+.
Стадия 4: Раствор 1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она (752 мг, 2,0 ммоль) и m-CPBA (449 мг, 2,6 ммоль) в DCM (20 мл) перемешивали при 0°C в течение 4 ч. Реакционную смесь промывали водным Na2S2O3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/3), с получением 1-((2- (метилсульфинил)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она в виде светло-желтого твердого вещества (430 мг, 55,1%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,20 (с, 1H), 8,08 (д, J=8,4 Гц, 1H), 7,59 (д, J=6,9 Гц, 1H), 7,29 (д, J=4,5 Гц, 1H), 6,96 (д, J=4,2 Гц, 1H), 5,20 (с, 2H), 3,65 (с, 8H), 3,07 (с, 3H). ЖХМС (ИЭР) m/z 391 (M+H)+.
Стадия 5: Смесь 1-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она (250 мг, 0,64 ммоль), (1R,2R)-2-аминоциклогексанола (221 мг, 1,92 ммоль) и DIEA (248 мг, 1,92 ммоль) в DMA (6,6 мл) перемешивали при 130°C в течение 16 ч. Реакционную смесь охлаждали до к.т. и вливали в воду (30 мл). Смесь экстрагировали этилацетатом (3×100 мл), объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле, элюируя петролейным эфиром/этилацетатом (1/5), с получением 1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-3-морфолинопиразин-2(1H)-она в виде светло-желтого твердого вещества (120 мг, 26,5%). 1H ЯМР (300 МГц, ДМСО-d6) δ 7,96 (д, J=7,2 Гц, 1H), 7,63 (с, 1H), 7,30 (д, J=8,4 Гц,1H), 7,18-7,22 (м, 2H), 6,90 (д, J=4,8 Гц,1H), 5,01 (с, 2H), 4,72 (д, J=5,1 Гц, 1H), 3,65 (с, 8H), 3,55-3,52 (м, 1H), 3,36-3,31 (м, 1H), 2,07-2,02 (м, 1H), 1,90-1,86 (м, 1H), 1,63-1,62 (м, 2H), 1,30-1,22 (м, 4H). ЖХМС (ИЭР) m/z 442 (M+H)+.
Пример 223
Получение (3-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)(пирролидин-1-ил)метанона
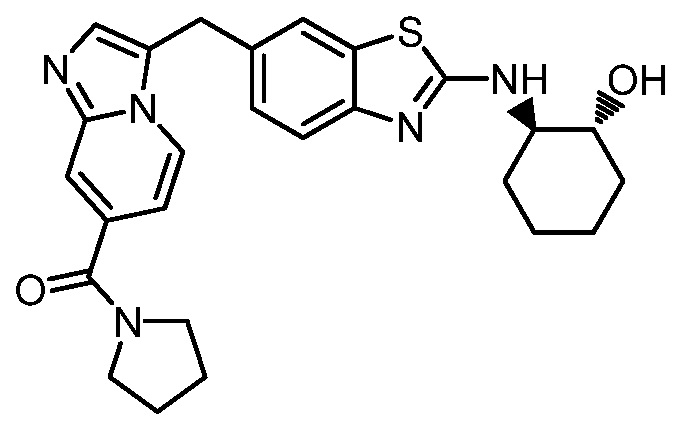
(3-((2-(((1R,2R)-2-Гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-ил)(пирролидин-1-ил)метанон (65 мг, 46%) получали в виде светло-рыжеватого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил и 2-хлор-3-(2-(метилтио)бензо[d]тиазол-6-ил)пропаналь, использованные в примере 117, (2-аминопиридин-4-ил)(пирролидин-1-ил)метаноном и 2-хлор-3-(2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)пропаналем, полученнем на стадии 2 примера 153, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,24 (д, J=6,9 Гц, 1H), 8,01 (д, J=7,4 Гц, 1H), 7,72 (с, 1H), 7,53 (с, 2H), 7,31 (шир. с, 1H), 7,27 (д, J=7,9 Гц, 1H), 7,10 (д, J=8,4 Гц, 1H), 6,99 (д, J=6,9 Гц, 1H), 6,78 (шир. с, 1H), 4,88 (шир. с, 1H), 4,31 (с, 2H), 3,43-3,58 (м, 6H), 2,04 (д, J=12,3 Гц, 1H), 1,76-1,94 (м, 5H), 1,57-1,68 (м, 2H), 1,10-1,27 (м, 4H). ЖХМС (ИЭР) m/z 476 (M+H)+.
Пример 224
Получение (E)-3-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акриловой кислоты
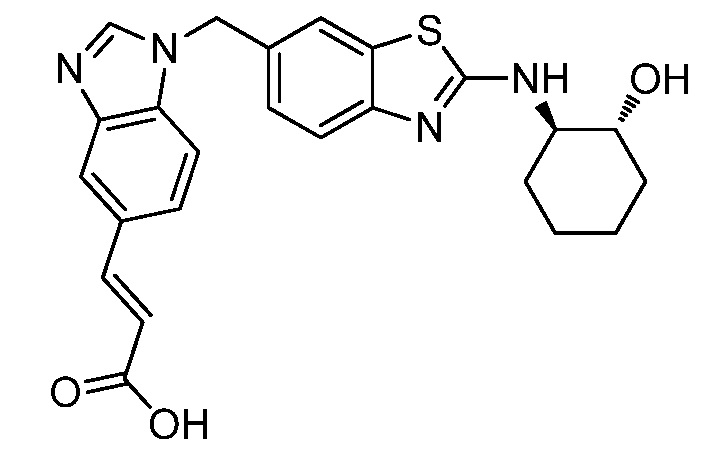
Стадия 1: К перемешиваемому раствору (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (150 мг, 0,30 ммоль), полученного на стадии 5 примера 183, в DMF (2 мл) добавляли этилакрилат (0,036 мл, 0,33 ммоль), ацетат палладия(II) (7 мг, 0,03 ммоль) и триэтиламин (0,088 мл, 0,63 ммоль). Смесь продували аргоном и нагревали в герметизированном сосуде при 120°C в течение 3 ч. Смесь охлаждали до к.т. и распределяли между EtOAc и водой. Разделенный водный слой дважды экстрагировали EtOAc, объединенные органические фазы трижды промывали смесью воды и солевого раствора (1/1), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением (E)-этил-3-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акрилата (187 мг) в виде твердого вещества. Этот продукт использовали непосредственно на следующей стадии. ЖХМС (ИЭР) m/z 477 (M+H)+.
Стадия 2: К перемешиваемому раствору (E)-этил-3-(1-((2- (((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акрилата, полученного на предшествующей стадии, в THF (2 мл) добавляли 1M водн. LiOH (2 мл), и перемешивали смесь при к.т. в течение 48 ч. Смесь затем подкисляли и концентрировали в условиях пониженного давления. Остаток сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением (E)-3-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)акриловой кислоты в виде твердого вещества (22 мг, 16%). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,46 (с, 1H), 7,90-8,01 (м, 2H), 7,68 (д, J=15,8 Гц, 1H), 7,66 (д, J=1,0 Гц, 1H), 7,58 (с, 2H), 7,29 (д, J=10 Гц, 1H), 7,20 (дд, J=1,2, 8,1 Гц, 1H), 6,48 (д, J=15,8 Гц, 1H), 5,48 (с, 2H), 4,73 (шир. с, 1H), 3,47-3,57 (шир. м, 2H), 2,02 (м, 1H), 1,86 (м, 1H), 1,55-1,67 (м, 2H), 1,12-1,32 (м, 4H). ЖХМС (ИЭР) m/z 449 (M+H)+.
Пример 225
Получение (1R,2R)-2-((6-((5-(1,2,3,6-тетрагидропиридин-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
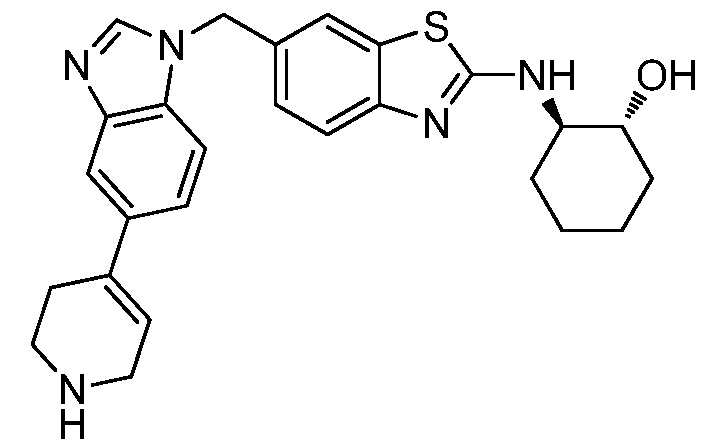
Стадия 1: К перемешиваемому раствору (1R,2R)-2-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (100 мг, 0,20 ммоль), полученного на стадии 5 примера 183, в DMF (2 мл) добавляли пинаколовый эфир N-Boc-1,2,5,6-тетрагидропиридин-4-бороновой кислоты (93 мг, 0,30 ммоль), карбонат калия (55 мг, 0,40 ммоль), хлорид бис(трифенилфосфин)паладия (II) (6,3 мг, 0,009 ммоль) и 1,1’-бис(дифенилфосфино)ферроцен (5 мг, 0,009 ммоль). Смесь продували аргоном и нагревали в герметизированном сосуде при 80°C в течение 15 ч. Реакционную смесь сразу очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Varian Pursuit XRs Diphenyl в качестве неподвижной фазы с получением трет-бутил-4-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)-5,6-дигидропиридин-1(2H)-карбоксилата в виде твердого вещества (35 мг, 31%). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,38 (с, 1H), 7,97 (д, J=7,9 Гц, 1H), 7,66 (с, 1H), 7,63 (с, 1H), 7,49 (д, J=8,4 Гц, 1H), 7,33 (м, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,18 (дд, J=1,2, 8,1 Гц, 1H), 6,09 (шир. с, 1H), 5,45 (с, 2H), 4,75 (д, J=3,9 Гц, 1H), 3,98 (шир. с, 2H), 3,46-3,59 (м, 4H), 3,36-3,42 (м, 2H), 2,02 (м, 1H), 1,87 (м, 1H), 1,56-1,67 (м, 2H), 1,38-1,48 (м, 9H), 1,13-1,32 (м, 4H); ЖХМС (ИЭР) m/z 560 (M+H)+.
Стадия 2: К перемешиваемому раствору трет-бутил-4-(1-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-ил)-5,6-дигидропиридин-1(2H)- карбоксилата (30 мг, 0,05 ммоль), полученного на предшествующей стадии, в DCM (3 мл) при 0°C добавляли 4M HCl в 1,4-диоксане (0,3 мл), и перемешивали смесь при 0°C в течение 5 мин. Смесь концентрировали в условиях пониженного давления, и очищали остаток методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HOAc) и CH3CN (0,05% HOAc) в качестве подвижной фазы и колонки Phenomenex Luna C-18 в качестве неподвижной фазы с получением (1R,2R)-2-((6-((5-(1,2,3,6-тетрагидропиридин-4-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола в виде твердого вещества (1,38 мг, 5%). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,36 (с, 1H), 8,00 (д, J=7,4 Гц, 1H), 7,62 (д, J=5,9 Гц, 2H), 7,47 (д, J=8,9 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 7,18 (дд, J=1,2, 8,1 Гц, 1H), 6,14 (шир. с, 1H), 5,44 (с, 2H), 3,47-3,57 (шир. м, 2H), 2,94 (т, J=5,4 Гц, 2H), 2,40 (шир. с, 2H), 2,02 (д, J=11,8 Гц, 1H), 1,85-1,87 (м, 6H), 1,57-1,66 (м, 2H), 1,12-1,30 (м, 4H); ЖХМС (ИЭР) m/z 460 (M+H)+.
Пример 226
Получение (1R,2R)-2-((6-((5-(1H-имидазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
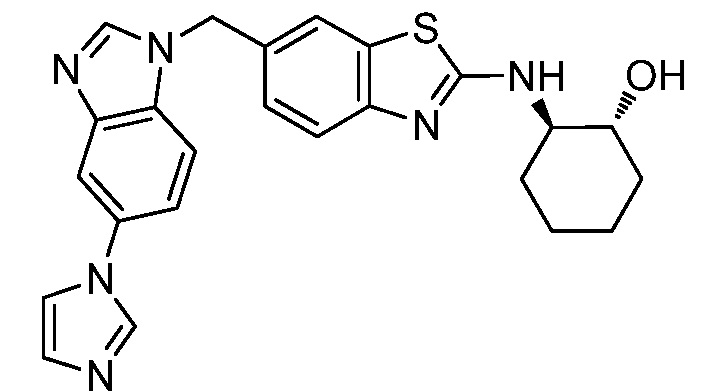
Перемешиваемую смесь (1R,2R)-2-((6-((5-йод-1H- бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (250 мг, 0,50 ммоль), полученного на стадии 5 примера 183, имидазола (80 мг, 1,18 ммоль), карбоната калия (82 мг, 0,59 ммоль), транс-N,N-диметилциклогексан-1,2-диамина (9 мг, 0,063 ммоль), йодида меди(I) (30 мг, 0,158 ммоль) и DMF (2 мл) нагревали при 120°C в течение 3 ч. Реакционную смесь охлаждали до к.т. и распределяли между EtOAc и водой. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя DCM/MeOH (20/1), с получением (1R,2R)-2-((6-((5-(1H-имидазол-1-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола (78 мг, 35%) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,52 (с, 1H), 8,18 (с, 1H), 7,91-7,96 (м, 2H), 7,72-7,86 (м, 3H), 7,47 (дд, J=8,4, 1,8 Гц, 1H), 7,30 (д, J=8,1 Гц, 1H), 7,21 (дд, J=8,1, 1,5 Гц, 1H), 7,07 (д, J=1,2 Гц, 1H), 5,52 (с, 2H), 4,71 (д, J=5,1 Гц, 1H), 3,51 (м, 1H), 3,38 (м, 1H), 2,02 (м, 1H), 1,88 (м, 1H), 1,60-1,80 (м, 2H), 1,15-1,28 (м, 4H); ЖХМС (ИЭР) m/z 445 (M+H)+.
Пример 227
Получение (1R,2R)-2-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанола
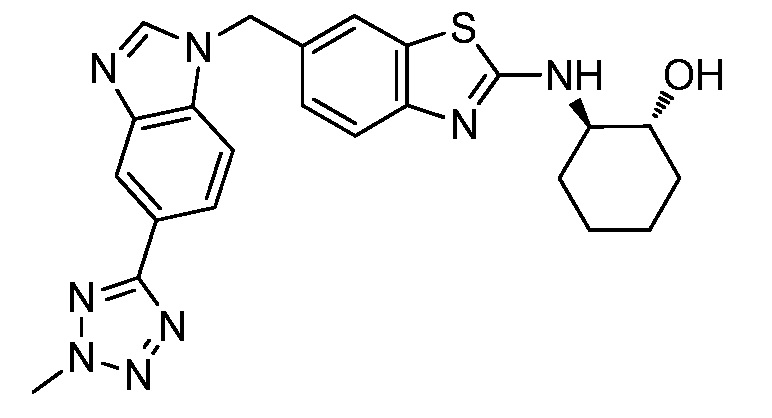
(1R,2R)-2-((6-((5-(2-Метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол (18 мг, 18%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 203, заменяя 6-((5-бром-7-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 203, 6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на стадии 6 примера 236. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,53 (с, 1H), 8,29 (с, 1H), 7,91-7,97 (м, 2H), 7,68-7,76 (м, 2H), 7,21-7,32 (м, 2H), 5,52 (с, 2H), 4,72 (д, J=5,1 Гц, 1H), 4,42 (с, 3H), 3,51 (м, 1H), 3,38 (м, 1H), 2,02 (м, 1H), 1,88 (м, 1H), 1,60-1,80 (м, 2H), 1,15-1,28 (м, 4H); ЖХМС (ИЭР) m/z 461 (M+H)+.
Пример 228
Получение (1S,2R,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
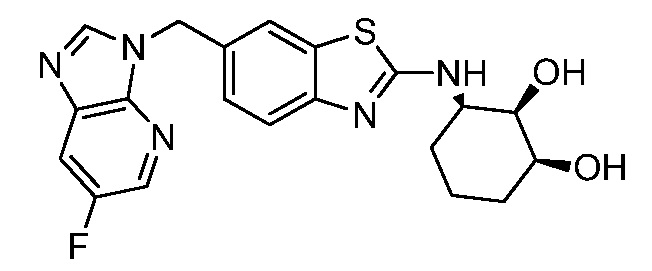
К перемешиваемой смеси NMO в трет-бутаноле (5 мл), THF (1,5 мл), H2O (0,5 мл), и 4 масс.% раствора OsO4 в H2O (10 мкл, 0,3 ммоль) при к.т. порциями добавляли (R)-N-(циклогекс-2-ен-1-ил)-6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-амин (142 мг, 0,4 ммоль), полученный в примере 176. После перемешивания смеси при к.т. в течение 18 ч, ее распределяли между EtOAc (200 мл) и 0,5 M водн. K2CO3 (100 мл). Органический слой отделяли, промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток дважды очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1S,2R,3R)-3-((6-((6-фтор-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (7 мг, 2%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,67 (с, 1H), 8,40 (м, 1H), 8,07 (дд, J=2,6, 9,5 Гц, 1H), 7,95 (д, J=7,9 Гц, 1H), 7,66 (д, J=1,2 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,21 (дд, J=1,6, 8,2 Гц, 1H), 5,47 (с, 2H), 4,45-4,70 (м, 2H), 3,88 (шир. с, 1H), 3,76 (м, 1H), 3,43 (м, 1H), 1,40-1,62 (м, 5H), 1,25 (м, 1H); ЖХМС (ИЭР) m/z 414 (M+H)+.
Пример 229
Получение (1R,2S,3R)-3-((6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
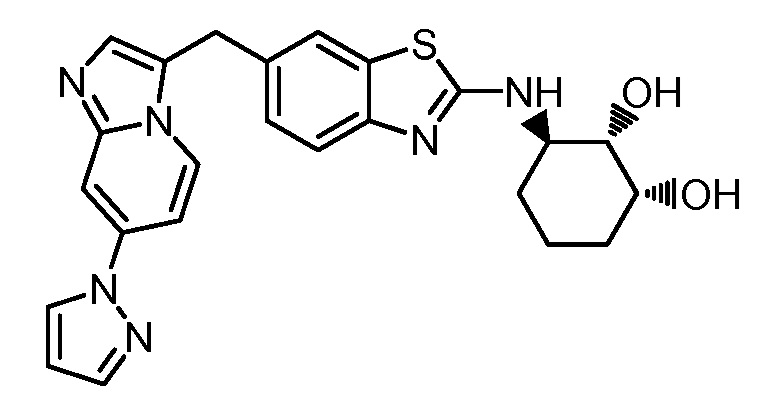
Стадия 1: В реакционный сосуд емкостью 20 мл загружали 4-йодпиридин-2-амин (1,5 г, 6,8 ммоль) и 1H-пиразол (4,0 г, 58,9 ммоль). Добавляли концентрированную соляную кислоту (1,5 мл) и 1,4-диоксан (1,5 мл) и герметизировали реакционный сосуд. Смесь облучали в микроволновой печи при 120°C в течение 45 мин, а затем при 130°C в течение 60 мин. Смесь охлаждали до к.т., а затем добавляли диэтиловый эфир (6 мл) и этанол (3 мл). Смесь обрабатывали ультразвуком в течение 10 мин, твердое вещество собирали путем фильтрования и промывали диэтиловым эфиром и н-гексаном с получением гидрохлорида 4-(1H-пиразол-1-ил)пиридин-2-амина (1,2 г, 90%) в виде белого твердого вещества. ЖХМС (ИЭР) m/z 161 (M+H)+.
Стадия 2: 6-((7-(1H-Пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол (176 мг, 63%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил, использованный в примере 117, гидрохлоридом 4-(1H-пиразол-1-ил)пиридин-2-амина, полученным на стадии 1 этого примера, и добавляя NaHCO3 к реакционной смеси. ЖХМС (ИЭР) m/z 378 (M+H)+.
Стадия 3: (1R,2S,3R)-3-((6-((7-(1H-Пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол (25 мг, 12%) получали в виде светло-рыжеватого твердого вещества с использованием методик, аналогичных описанным на стадиях 7-8 примера 117, заменяя 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил, использованный на стадии 7 примера 117, 6-((7-(1H-пиразол-1-ил)имидазо[1,2-a]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, и заменяя 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил и (1R,2R)-2-аминоциклогексанол использованный на стадии 8 примера 117, продуктом этой реакции и гидрохлоридом (1R,2S,3R)-3-аминоциклогексан-1,2-диола, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,66 (д, J=2,5 Гц, 1H), 8,32 (д, J=7,4 Гц, 1H), 7,99 (с, 1H), 7,85 (д, J=7,9 Гц, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,53 (д, J=2,0 Гц, 1H), 7,43 (с, 1H), 7,28 (д, J=7,9 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 6,59 (с, 1H), 4,53 (д, J=5,9 Гц, 1H), 4,43 (д, J=3,9 Гц, 1H), 4,31 (с, 2H), 3,93 (д, J=3,9 Гц, 1H), 3,80 (шир. с, 1H), 3,37-3,45 (м, 1H), 1,92 (дд, J=3,4, 11,8 Гц, 1H), 1,65 (дд, J=5,2, 16,5 Гц, 1H), 1,51-1,61 (м, 1H), 1,32-1,48 (м, 2H), 1,14-1,29 (м, 1H). ЖХМС (ИЭР) m/z 461 (M+H)+.
Пример 230
Получение (1R,2S,3R)-3-((6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
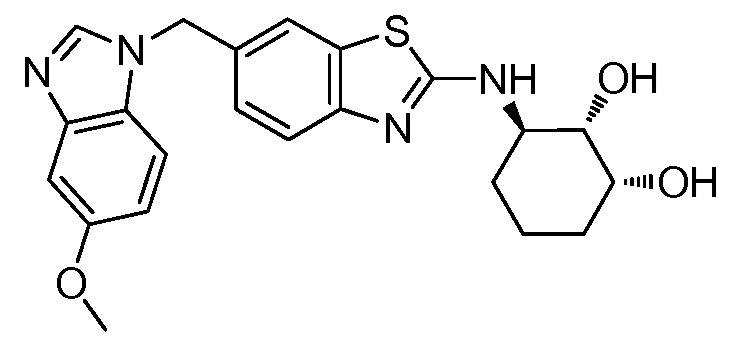
Стадия 1: 4-Метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин (5,2 г, 92%) получали в виде красного твердого вещества с использованием методики, аналогичной описанной на стадии 1 примера 127, заменяя 4-метил-2-нитроанилин, использованный в примере 127, 4-метокси-2-нитроанилином. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,64 (т, J=6,1 Гц, 1H), 7,98 (м, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,52 (д, J=3,1 Гц, 1H), 7,45 (дд, J=8,4, 1,5 Гц, 1H), 7,18 (дд, J=9,4, 3,1 Гц, 1H), 6,91 (д, J=9,5 Гц, 1H), 4,72 (д, J=6,1 Гц, 2H), 3,72 (с, 3H), 2,77 (с, 3H); ЖХМС (ИЭР) m/z 362 (M+H)+.
Стадия 2: 4-Метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин (4 г, 84%) получали в виде масла с использованием методики, аналогичной описанной на стадии 2 примера 129, заменяя 4-фтор-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилин, использованный в примере 129, 4-метокси-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-2-нитроанилином, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 332 (M+H)+.
Стадия 3: 6-((5-Метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол (1,12 г, 27%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 129, заменяя 4-фтор-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-диамин, использованный в примере 129, 4-метокси-N1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)бензол-1,2-амином, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,35 (с, 1H), 7,97 (д, J=1,2 Гц, 1H), 7,79 (д, J=8,4 Гц, 1H), 7,38-7,41 (м, 2H), 7,18 (д, J=2,3 Гц, 1H), 6,82 (дд, J=8,8, 2,3 Гц, 1H), 5,55 (с, 2H), 3,75 (с, 3H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 342 (M+H)+.
Стадия 4: 6-((5-Метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол (986 мг, 84%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 129, заменяя 6-((5-фтор-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 129, 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,38 (с, 1H), 8,21 (д, J=1,2 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,55 (дд, J=8,5, 1,6 Гц, 1H), 7,38 (д, J=8,8 Гц, 1H), 7,19 (д, J=2,3 Гц, 1H), 6,83 (дд, J=8,8, 2,3 Гц, 1H), 5,64 (с, 2H), 3,75 (с, 3H), 3,05 (с, 3H); ЖХМС (ИЭР) m/z 358 (M+H)+.
Стадия 5: (1R,2S,3R)-3-((6-((5-Метокси-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол (53 мг, 15%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 232, заменяя 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2- (метилсульфинил)бензо[d]тиазол, полученный в примере 232, 6-((5-метокси-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,92 (д, J=7,9 Гц, 1H), 7,62 (с, 1H), 7,40 (д, J=8,9 Гц, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,13-7,20 (м, 2H), 6,82 (дд, J=2,1, 8,7 Гц, 1H), 5,41 (с, 2H), 4,52 (д, J=5,9 Гц, 1H), 4,43 (д, J=3,7 Гц, 1H), 3,93 (д, J=4,4 Гц, 1H), 3,79 (м, 1H), 3,75 (с, 3H), 3,40 (м, 1H), 1,91 (дд, J=3,8, 12,4 Гц, 1H), 1,51-1,70 (м, 2H), 1,32-1,45 (м, 2H), 1,20 (м, 1H); ЖХМС (ИЭР) m/z 425 (M+H)+.
Пример 231
Получение (1R,2S,3R)-3-((6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
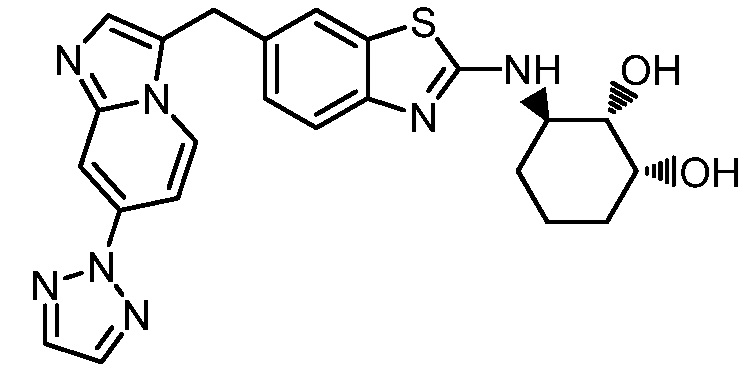
Стадия 1: 4-(2H-1,2,3-триазол-2-ил)пиридин-2-амин (370 мг, 39%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованные в примере 141, 4-йодпиридин-2-амином и 1,2,3-триазолом, соответственно. ЖХМС (ИЭР) m/z 162 (M+H)+.
Стадия 2: 6-((7-(2H-1,2,3-Триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол (87 мг, 31%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной на стадии 6 примера 117, заменяя 2-аминоизоникотинонитрил, использованный в примере 117, 4-(2H-1,2,3-триазол-2-ил)пиридин-2-амином, полученным на стадии 1 этого примера, и добавляя NaHCO3 к реакционной смеси. ЖХМС (ИЭР) m/z 379 (M+H)+.
Стадия 3: (1R,2S,3R)-3-((6-((7-(2H-1,2,3-Триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол (35 мг, 33%) получали в виде светло-рыжеватого твердого вещества с использованием методик, аналогичных описанным на стадиях 7-8 примера 117, заменяя 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил, использованный на стадии 7 примера 117, 6-((7-(2H-1,2,3-триазол-2-ил)имидазо[1,2-a]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 2 этого примера, и заменяя 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил и (1R,2R)-2-аминоциклогексанол, использованные на стадии 8 примера 117, продуктом этой реакции и (1R,2S,3R)-3-аминоциклогексан-1,2-диола гидрохлоридом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,40 (д, J=7,4 Гц, 1H), 8,19 (с, 2H), 8,04 (с, 1H), 7,85 (д, J=7,9 Гц, 1H), 7,63 (дд, J=2,0, 7,4 Гц, 1H), 7,54 (с, 1H), 7,51 (с, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 4,49-4,69 (м, 1H), 4,43 (шир. с, 1H), 4,34 (с, 2H), 3,93 (д, J=3,9 Гц, 1H), 3,80 (шир. с, 1H), 3,40 (д, J=8,4 Гц, 2H), 1,92 (дд, J=3,9, 12,3 Гц, 1H), 1,66 (дд, J=5,4, 10,8 Гц, 1H), 1,51-1,61 (м, 1H), 1,31-1,48 (м, 2H), 1,12-1,29 (м, 1H). ЖХМС (ИЭР) m/z 461 (M+H)+.
Пример 232
Получение (1R,2S,3R)-3-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
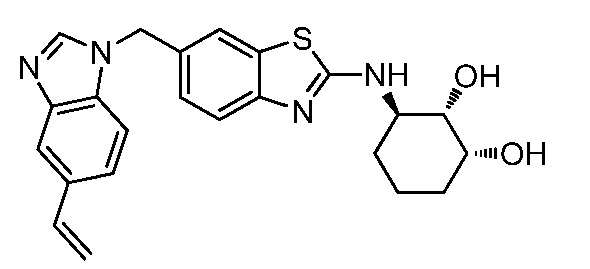
Стадия 1: N-(4-Йод-2-нитрофенил)формамид синтезировали в виде черного твердого вещества (7,4 г, 71%) с использованием методики, аналогичной описанной на стадии 1 примера 162, заменяя 5-фтор-3-нитропиридин-2-амин, использованный в примере 162, 4-йод-2-нитроанилином. ЖХМС (ИЭР) m/z 293 (M+H)+.
Стадия 2: N-(4-Йод-2-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид синтезировали в виде коричневого твердого вещества (9,7 г, 82%) с использованием методики, аналогичной описанной на стадии 3 примера 47, заменяя 5-бром-6-метокси-1H-бензо[d]имидазол, использованный в примере 47, N-(4-Йод-2-нитрофенил)формамидом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 486 (M+H)+.
Стадия 3: Перемешиваемую смесь N-(4-йод-2-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамида и железного порошка (16,7 г, 20 ммоль) в EtOH (140 мл) и HOAc (60 мл) нагревали с обратным холодильником в течение 1 ч. Смесь охлаждали до к.т. и фильтровали, и концентрировали фильтрат в условиях пониженного давления. Остаток распределяли между EtOAc (200 мл) и 0,5 M водн. Na2CO3 (100 мл). Органический слой отделяли и дополнительно промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (5,9 г, 68%) в виде желтого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,44 (с, 1H), 8,03 (д, J=1,0 Гц, 1H), 7,97 (с, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,49 (дд, J=1,4, 8,5 Гц, 1H), 7,37-7,43 (м, 2H), 5,60 (с, 2H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 438 (M+H)+.
Стадия 4: 6-((5-Йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (2,9 г, 94%) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,47 (с, 1H), 8,21 (с, 1H), 8,02-8,10 (м, 2H), 7,56 (дд, J=1,4, 8,5 Гц, 1H), 7,50 (дд, J=1,2, 8,4 Гц, 1H), 7,40 (д, J=8,6 Гц, 1H), 5,69 (с, 2H), 3,05 (с, 3H); ЖХМС (ИЭР) m/z 454 (M+H)+.
Стадия 5: К суспензии 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (350 мг, 0,8 ммоль) и гидрохлорида (1R,2S,3R)-3-аминоциклогексан-1,2-диола (258 мг, 1,6 ммоль), полученного, как описано в Gauthier Errasti, et al.≤, Org. Lett. 2009, 13, 2912-2915, в безводном DMA (1,5 мл) добавляли DIEA (402 мкл, 2,4 ммоль). Смесь нагревали в герметизированной пробирке при 120°C в течение 15 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (150 мл) и 0,5 M водн. K2CO3 (100 мл). Органический слой отделяли и промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в DCM, с получением (1R,2S,3R)-3-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (127 мг, 32%) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z 521 (M+H)+.
Стадия 6: Суспензию (1R,2S,3R)-3-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (120 мг, 0,2 ммоль), пинаколового эфира винилбороновой кислоты (71 мг, 0,5 ммоль) и K2CO3 (64 мг, 0,5 ммоль) в смеси диоксан/вода (6/1, 3,5 мл) продували аргоном в течение 5 мин. К смеси добавляли дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) (19 мг, 0,02 ммоль), смесь продували аргоном еще в течение 5 мин, а затем нагревали в герметизированной пробирке при 100°C в течение 6 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (150 мл) и 0,5 M водн. K2CO3 (100 мл). Органический слой отделяли и промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением почти чистого соединения. Затем, это соединение очищали методом флэш-хроматографии на силикагеле, изократически элюируя 5% MeOH в CH2Cl2, с получением (1R,2S,3R)-3-((6-((5-винил-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (5 мг, 5%) в виде белого порошка. 1H ЯМР (500 МГц, MeOH-d4) δ 8,28 (шир. с, 1H), 7,69 (с, 1H), 7,54 (м, 1H), 7,41-7,43 (м, 2H), 7,37 (д, J=8,1 Гц, 1H), 7,22 (м, 1H), 6,81-6,86 (м, 2H), 5,76 (д, J=17,7 Гц, 1H), 5,49 (с, 2H), 5,19 (д, J=11,1 Гц, 1H), 3,99-4,02 (м, 2H), 3,50 (м, 1H), 2,08 (м, 1H), 1,72-1,85 (м, 2H), 1,48-1,55 (м, 2H), 1,28-1,39 (м, 2H); ЖХМС (ИЭР) m/z 421 (M+H)+.
Пример 233
Получение (1R,2S,3R)-3-((6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
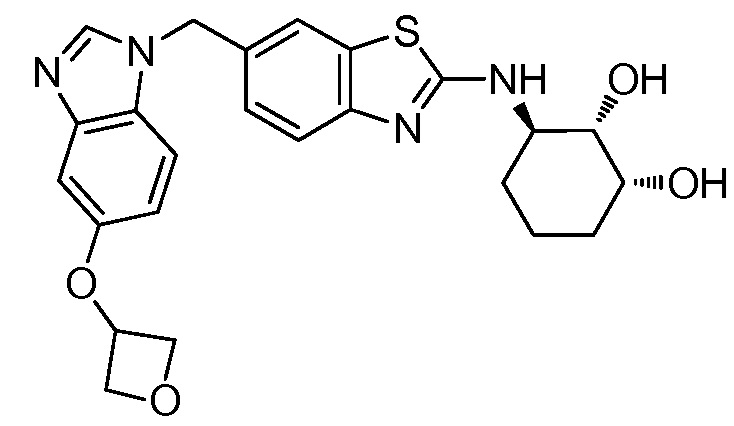
Стадия 1: К перемешиваемому раствору 4-амино-3-нитрофенола (1,37 г, 8,91 ммоль) в DMF (15 мл) при к.т. добавляли карбонат цезия (5,79 г, 17,82 ммоль), и перемешивали смесь в течение 30 мин. Добавляли оксетан-3-ил-4-метилбензолсульфонат (3,05 г, 13,36 ммоль) и нагревали смесь при 80°C в течение 6 ч. Смесь охлаждали до к.т. и распределяли между EtOAc и водой. Органический слой отделяли, и экстрагировали водный слой дополнительным количеством EtOAc. Объединенные органические слои промывали солевым раствором. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Твердый остаток очищали путем растирания с диэтиловым эфиром с получением 2-нитро-4-(оксетан-3-илокси)анилина (1,33 г, 71%) в виде коричневого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,29 (шир. с, 2H), 7,15 (дд, J=9,2, 3,0 Гц, 1H), 7,10 (д, J=3,0 Гц, 1H), 7,02 (д, J=9,2 Гц, 1H), 5,24 (пентет, J=4,9 Гц, 1H), 4,87-4,93 (м, 2H), 4,51-4,53 (м, 2H); ЖХМС (ИЭР) m/z 211 (M+H)+.
Стадия 2: Перемешиваемую смесь уксусного ангидрида (15 мл, 161 ммоль) и муравьиной кислоты (6 мл, 161 ммоль) нагревали при 60°C в течение 5 ч. Смесь охлаждали до к.т., затем добавляли 2-нитро-4-(оксетан-3-илокси)анилин (1,69 г, 8,02 ммоль), и нагревали смесь при 70°C в течение 15 ч. Смесь охлаждали до к.т. и концентрировали в условиях пониженного давления. Остаток распределяли между EtOAc и насыщенным водн. NaHCO3. Органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя градиентом 20% EtOAc в гексанах→100% EtOAc, с получением N-(2-нитро-4-(оксетан-3-илокси)фенил)формамида (967 мг, 51%) в виде желтого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,36 (шир. с, 1H), 8,29 (м, 1H), 7,85 (д, J=8,9 Гц, 1H), 7,36 (д, J=1,8 Гц, 1H), 7,24 (дд, J=9,0, 3,0 Гц, 1H), 5,38 (пентет, J=4,9 Гц, 1H), 4,92-4,94 (м, 2H), 4,53-4,56 (м, 2H).
Стадия 3: N-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-N-(2-нитро-4-(оксетан-3-илокси)фенил)формамид (1,71 г) получали в виде масла с использованием методики, аналогичной описанной на стадии 2 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)формамид, использованный в примере 203, N-(2-нитро-4-(оксетан-3-илокси)фенил)формамидом, полученным на стадии 2 этого примера. ЖХМС (ИЭР) m/z 432 (M+H)+.
Стадия 4: 2-(Метилтио)-6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол (640 мг, 41% из N-(2-нитро-4-(оксетан-3-илокси)фенил)формамида) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 3 примера 203, заменяя N-(4-бром-2-фтор-6-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид, использованный в примере 203, N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-N-(2-нитро-4-(оксетан-3-илокси)фенил)формамидом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,38 (с, 1H), 7,98 (д, J=1,4 Гц, 1H), 7,79 (д, J=8,4 Гц, 1H), 7,43 (д, J=8,8 Гц, 1H), 7,40 (дд, J=8,4, 1,8 Гц, 1H), 6,93 (д, J=2,3 Гц, 1H), 6,79 (дд, J=8,8, 2,3 Гц, 1H), 5,55 (с, 2H), 5,27 (пентет, J=5,6 Гц, 1H), 4,91-4,94 (м, 2H), 4,53-4,55 (м, 2H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 384 (M+H)+.
Стадия 5: 2-(Метилсульфинил)-6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол (496 мг, 74%) получали в виде белого твердого вещества с использованием методики, аналогичной описанной на стадии 4 примера 130, заменяя 2-(метилтио)-6-((5-(трифторметил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол, использованный в примере 130, 2-(метилтио)-6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,41 (с, 1H), 8,22 (м, 1H), 8,07 (д, J=10,0 Гц, 1H), 7,56 (м, 1H), 7,42 (д, J=10,0 Гц, 1H), 6,95 (д, J=5,0 Гц, 1H), 6,80 (м, 1H), 5,64 (с, 2H), 5,27 (пентет, J=5,0 Гц, 1H), 4,92-4,95 (м, 2H), 4,52-4,55 (м, 2H), 3,05 (с, 3H); ЖХМС (ИЭР) m/z 400 (M+H)+.
Стадия 6: (1R,2S,3R)-3-((6-((5-(Оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол (68 мг, 12%) получали в виде твердого вещества с использованием методики, аналогичной описанной на стадии 5 примера 232, заменяя 6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол, использованный в примере 232, 2-(метилсульфинил)-6-((5-(оксетан-3-илокси)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазолом, полученным на предшествующей стадии. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,34 (с, 1H), 7,92 (д, J=7,9 Гц, 1H), 7,63 (д, J=1,5 Гц, 1H), 7,43 (д, J=8,8 Гц, 1H), 7,28 (д, J=8,2 Гц, 1H), 7,18 (дд, J=8,2, 1,6 Гц, 1H), 6,91 (д, J=2,3 Гц, 1H), 6,79 (дд, J=8,8, 2,4 Гц, 1H), 5,41 (с, 2H), 5,27 (пентет, J=5,2 Гц, 1H), 4,91-4,94 (м, 2H), 4,51-4,54 (м, 2H), 4,43 (д, J=3,8 Гц, 1H), 3,92 (шир. м, 1H), 3,79 (м, 1H), 3,38 (м, 1H), 3,31 (м, 1H), 1,91 (м, 1H), 1,54-1,67 (м, 2H), 1,34-1,42 (м, 2H), 1,21 (м, 1H); ЖХМС (ИЭР) m/z 467 (M+H)+.
Пример 234
Получение (1R,2S,3R)-3-((6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
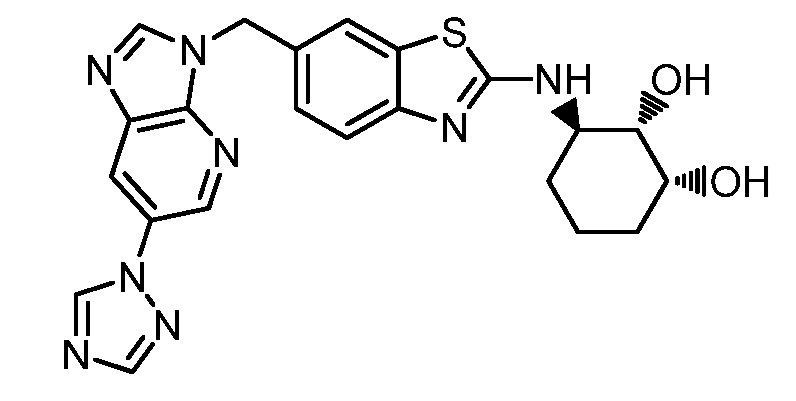
Стадия 1: 6-((6-(1H-1,2,4-Триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазол (108 мг, 19%) получали в виде желтого твердого вещества с использованием методики, аналогичной описанной в примере 141, заменяя (1R,2R)-2-((6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексанол и пиразол, использованные в примере 141, 6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным в качестве промежуточного продукта на стадии 2 примера 96, и 1,2,4-триазолом, соответственно. ЖХМС (ИЭР) m/z 380 (M+H)+.
Стадия 2: (1R,2S,3R)-3-((6-((6-(1H-1,2,4-Триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диол (53 мг, 41%) получали в виде желтого твердого вещества с использованием методик, аналогичных описанным на стадиях 7-8 примера 117, заменяя 3-((2-(метилтио)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил, использованный на стадии 7 примера 117, 6-((6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на стадии 1 этого примера, и заменяя 3-((2-(метилсульфинил)бензо[d]тиазол-6-ил)метил)имидазо[1,2-a]пиридин-7-карбонитрил и (1R,2R)-2-аминоциклогексанол, использованные на стадии 8 примера 117, продуктом этой реакции и (1R,2S,3R)-3-аминоциклогексан-1,2-диола гидрохлоридом, соответственно. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,30 (с, 1H), 8,89 (д, J=2,0 Гц, 1H), 8,76 (с, 1H), 8,56 (д, J=2,0 Гц, 1H), 8,29 (с, 1H), 8,21 (с, 1H), 7,93 (д, J=7,9 Гц, 1H), 7,69 (с, 1H), 7,27-7,32 (м, 1H), 7,20-7,27 (м, 1H), 5,54 (с, 2H), 4,44 (д, J=4,9 Гц, 2H), 3,93 (д, J=4,4 Гц, 1H), 3,79 (шир. с, 1H), 3,39 (д, J=8,4 Гц, 2H), 1,92 (дд, J=3,4, 12,8 Гц, 1H), 1,61-1,71 (м, 1H), 1,50-1,61 (м, 1H), 1,30-1,47 (м, 2H), 1,12-1,29 (м, 1H), ЖХМС (ИЭР) m/z 463 (M+H)+.
Пример 235
Получение (1R,2S,3R)-3-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
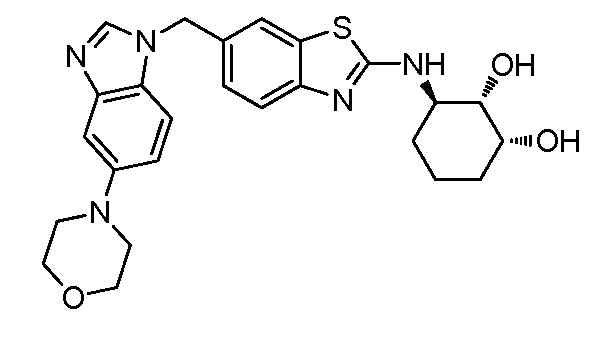
Суспензию (1R,2S,3R)-3-((6-((5-йод-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (262 мг, 0,5 ммоль), полученного на стадии 5 примера 232, морфолина (264 мкл, 3,0 ммоль), L-пролина (23 мг, 0,2 ммоль) и K2CO3 (209 мг, 1,5 ммоль) в DMSO (2,0 мл) продували аргоном в течение 5 мин. Добавляли йодид меди(I) (19 мг, 0,02 ммоль), смесь еще раз продували аргоном в течение 5 мин, а затем нагревали в герметизированной пробирке при 110°C в течение 2 ч. Смесь охлаждали до к.т. и фильтровали через целит, и очищали фильтрат методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы, а затем методом флэш-хроматографии на силикагеле, элюируя 5% MeOH в CH2Cl2, с получением (1R,2S,3R)-3-((6-((5-морфолино-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (2 мг, 1%) в виде белого порошка. 1H ЯМР (500 МГц, MeOH-d4) δ 8,19 (с, 1H), 7,50 (с, 1H), 7,31-7,39 (м, 2H), 7,16-7,23 (м, 2H), 7,05 (дд, J=2,0, 8,9 Гц, 1H), 5,44 (с, 2H), 3,95-4,06 (м, 2H), 3,80-3,88 (м, 4H), 3,50 (дд, J=2,6, 9,2 Гц, 1H), 3,06-3,14 (м, 4H), 2,09 (м, 1H), 1,77-1,86 (м, 2H), 1,48-1,53 (м, 2H), 1,33 (м, 1H); ЖХМС (ИЭР) m/z 480 (M+H)+.
Пример 236
Получение (1R,2S,3R)-3-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола
Стадия 1: N-(4-Циан-2-нитрофенил)формамид синтезировали в виде белого твердого вещества (4,8 г, 100%) с использованием методики, аналогичной описанной на стадии 1 примера 162, заменяя 5-фтор-3-нитропиридин-2-амин, использованный в примере 162, 4- циан-2-нитроанилином. ЖХМС (ИЭР) m/z 192 (M+H)+.
Стадия 2: N-(4-Циан-2-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид синтезировали в виде желтой пены (920 мг, 92%) с использованием методики, аналогичной описанной на стадии 3 примера 47, заменяя 5-бром-6-метокси-1H-бензо[d]имидазол, использованный в примере 47, N-(4-циан-2-нитрофенил)формамидом полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 385 (M+H)+.
Стадия 3: 1-((2-(Метилтио)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрил синтезировали в виде белого твердого вещества (694 мг, 86%) с использованием методики, аналогичной описанной на стадии 3 примера 232, заменяя N-(4-йод-2-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамид, использованный в примере 232, N-(4-циан-2-нитрофенил)-N-((2-(метилтио)бензо[d]тиазол-6-ил)метил)формамидом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 337 (M+H)+.
Стадия 4: Суспензию 1-((2-(метилтио)бензо[d]тиазол-6-ил)метил)-1H-бензо[d]имидазол-5-карбонитрила (694 мг, 2,1 ммоль), азида натрия (403 мг, 6,3 ммоль) и хлорида аммония (331 мг, 6,3 ммоль) в DMF (3 мл) нагревали в герметизированной пробирке при 125°C в течение 15 ч. Смесь охлаждали до к.т., и формировался осадок. Твердое вещество собирали путем фильтрования с получением 6-((5-(2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (796 мг, 100%) в виде желтого твердого вещества, которое не требовало дополнительной очистки. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,41 (с, 1H), 8,19 (с, 1H), 8,02 (с, 1H), 7,88 (дд, J=1,0, 8,4 Гц, 1H), 7,81 (д, J=8,6 Гц, 1H), 7,52 (д, J=8,4 Гц, 1H), 7,45 (дд, J=1,4, 8,5 Гц, 1H), 7,15-7,30 (шир. с, 2H), 5,60 (с, 2H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 380 (M+H)+.
Стадия 5: К перемешиваемой смеси 6-((5-(2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (796 мг, 2,1 ммоль), Cs2CO3 (673 мг, 2,1 ммоль) и DMF (10 мл) добавляли йодметан (129 мкл, 2,1 ммоль). Смесь нагревали при 60°C в течение 6 ч. Добавляли дополнительное количество йодметана (30 мкл, 0,5 ммоль), и перемешивали смесь при 60°C еще в течение 4 ч. Смесь охлаждали до к.т. и распределяли между EtOAc (200 мл) и 0,5 M водн. Na2CO3 (100 мл). Органический слой отделяли и промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя 2% MeOH в CH2Cl2, с получением 6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазола (318 мг, 39%) в виде белого твердого вещества. Региохимию алкилирования определяли методом двумерной спектроскопии ядерного эффекта Оверхаузера (NOE). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,58 (с, 1H), 8,31 (с, 1H), 8,03 (с, 1H), 7,93 (дд, J=1,0, 8,4 Гц, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,73 (д, J=8,6 Гц, 1H), 7,46 (дд, J=1,2, 8,4 Гц, 1H), 5,66 (с, 2H), 4,41 (с, 3H), 2,76 (с, 3H); ЖХМС (ИЭР) m/z 394 (M+H)+.
Стадия 6: 6-((5-(2-Метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазол синтезировали в виде белой пены (390 мг) с использованием методики, аналогичной описанной на стадии 6 примера 36, заменяя 6-((4-бром-1H-имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазол, использованный в примере 36, 6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилтио)бензо[d]тиазолом, полученным на предшествующей стадии. ЖХМС (ИЭР) m/z 410 (M+H)+.
Стадия 7: К суспензии 6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)-2-(метилсульфинил)бензо[d]тиазола (330 мг, 0,8 ммоль) и (1R,2S,3R)-3-аминоциклогексан-1,2-диола гидрохлорида (391 мг, 2,4 ммоль), полученного как описано в Gauthier Errasti, et al, Org. Lett. 2009, 13, 2912-2915, в безводном NMP (3,0 мл) добавляли DIEA (703 мкл, 4,0 ммоль). Смесь нагревали в герметизированной пробирке при 120°C в течение 15 ч. Добавляли дополнительное количество (1R,2S,3R)-3-аминоциклогексан-1,2-диола гидрохлорида (258 мг, 1,6 ммоль) и DIEA (703 мкл, 4,0 ммоль), и нагревали смесь при 140°C еще в течение 15 ч. Смесь охлаждали до к.т. и очищали методом препаративной HPLC с обращенной фазой с использованием смеси воды (5% CH3CN, 0,05% HCOOH) и CH3CN (0,05% HCOOH) в качестве подвижной фазы и колонки Varian Pursuit XRs C18 в качестве неподвижной фазы с получением (1R,2S,3R)-3-((6-((5-(2-метил-2H-тетразол-5-ил)-1H-бензо[d]имидазол-1-ил)метил)бензо[d]тиазол-2-ил)амино)циклогексан-1,2-диола (37 мг, 10%) в виде белого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,53 (с, 1H), 8,29 (с, 1H), 7,90-7,98 (м, 2H), 7,74 (д, J=8,4 Гц, 1H), 7,69 (с, 1H), 7,31 (м, 1H), 7,23 (дд, J=1,5, 8,4 Гц, 1H), 5,52 (с, 2H), 4,41 (с, 3H), 3,93 (м, 1H), 3,79 (м, 1H), 3,25 (м, 1H), 1,91 (м, 1H), 1,52-1,69 (м, 3H), 1,32-1,44 (м, 2H), 1,15-1,25 (м, 2H); ЖХМС (ИЭР) m/z 477 (M+H)+.
Пример 237
Анализ пролиферации клеток линии M-NFS-60
Соединения, раскрытые в настоящем документе, тестировали с использованием анализа пролиферации клеток линии M-NFS-60 для определения их активности в отношении CSF1R. Клетки линии M-NFS-60 представляют собой мышиные моноцитарные клетки, пролиферация которых зависит от связывания лиганда M-CSF с его рецептором CSF1R. Ингибирование активности киназы CSF1R приводит к уменьшению роста и/или гибели клеток. В указанном методе анализа активность соединений в качестве ингибиторов CSF1R оценивается по восстановлению реагента Аламар синий жизнеспособными клетками.
На первые сутки эксперимента клетки линии M-NFS-60 поддерживают в полной среде RPMI (Omega Scientific) с 10% FBS с добавлением 20 нг/мл M-CSF (R&D Systems). В 96-луночные плоскодонные планшеты, обработанные TC, вносили 10000 клеток на лунку в объеме 100 мкл. Клетки культивировали в течение ночи при 37°C и 5% CO2.
На вторые сутки к клеткам добавляли соединения в 9 различных концентрациях в полулогарифмических интервалах параллельно с контрольным эталонным соединением, выступающим в качестве положительного контроля. Конечную концентрацию DMSO поддерживали на уровне 0,5% для конечного объема 200 мкл. Соединения инкубировали с клетками в течение 72 часов при 37°C и 5% CO2.
На пятые сутки эксперимента в каждую лунку добавляли 40 мкл реагента Аламар синий и инкубировали в течение 3 часов. Флуоресценцию Аламара синего считывали с использованием программного обеспечения SoftMax Pro при 560 нм (возбуждение) и 590 нм (испускание). Значения IC50 получали как среднее из двух повторов, и они представляют собой концентрацию тестируемого соединения, при которой достигается 50% ингибирование пролиферации клеток по сравнению с контролем.
Согласно одному варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями IC50, приблизительно равными или меньшими, чем приблизительно 5, 4, 3, 2, 1, 0,5, 0,1, 0,05 или 0,01 мкМ. Согласно другому варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями IC50, приблизительно равными или меньшими, чем приблизительно 2000, 1000, 500, 300, 100, 50, 40, 30 или 20 нМ. Согласно другому варианту осуществления, было обнаружено, что соединения, представленные в настоящем документе, обладают значениями IC50, меньшими, чем приблизительно 200 или 100 нМ.
Пример 238
MSD анализ фосфорилирования CSF1R клеток линии HEK293
Соединения, раскрытые в настоящем документе, тестировали на фосфорилирование CSF1R для определения их клеточной активности в отношении CSF1R. Создавали клеточную линию HEK293, экспрессирующую CSF1R, слитый с FK506-связывающим белком (FKBP) в качестве молекулярной метки. Ингибирование активности киназы CSF1R будет предотвращать в интактных клетках стимулированное лигандом аутофосфорилирование CSF1R-FKBP. В последующем, клеточные лизаты подвергали анализу методом сэндвич-ELISA с использованием электрохемилюминесцентной технологии Meso Scale Discovery (MSD) для обнаружения фосфорилированного (p)CSF1R-FKBP. Указанный метод определяет активность соединений в качестве ингибиторов CSF1R путем измерения уменьшения количества pCSF1R при увеличении доз соединений, добавленных к клеткам до стимуляции M-CSF.
На первые сутки эксперимента клетки линии HEK293-CSF1R-FKPB, поддерживаемые в среде DMEM с L-глютамином (Mediatech), 10% FBS и 100 единиц/мл пенициллина/стрептомицина, высевали в 96-луночные планшеты Cell Bind (Costar) в количестве 50000 клеток на лунку в объеме 100 мкл. Клетки культивировали в течение ночи при 37°C и 5% CO2. Для подготовки планшетов, применяемых при MSD анализе, к покрытым стрептавидином 96-луночным планшетам (MSD) добавляли 330 нМ раствор биотин-FK506 (в TBS, pH 7,2) в объеме 30 мкл на лунку, и инкубировали при комнатной температуре в течение ночи со встряхиванием (500 об/мин) на орбитальном шейкере.
На вторые сутки к клеткам добавляли разбавленные DMSO соединения в двух повторах в 9 различных концентрациях в полулогарифмических интервалах, контроль с добавлением только DMSO, параллельно с контрольным эталонным соединением, выступающим в качестве положительного контроля. Конечную концентрацию DMSO поддерживали на уровне 0,5% для конечного объема 200 мкл. Соединения инкубировали с клетками в течение 2 часов при 37°C и 5% CO2. После завершения инкубации на 5 мин добавляли человеческий M-CSF (R&D Systems) до конечной концентрации 50 нг/мл для стимулирования фосфорилирования CSF1R. Клетки лизировали в течение 20 мин, и добавляли лизаты к промытым, покрытым FK506 планшетам для MSD, и инкубировали в течение ночи при 4°C и встряхивании (500 об/мин).
На третьи сутки планшеты MSD промывали, и последовательно анализировали захваченный CSF1R-FKBP на фосфорилирование с использованием мышиного анти-фосфотирозин-антитела (Millipore) и Sulfo-TAG козлиного антитела против мышиного IgG (MSD), и детектировали на приборе Sector Imager 6000 (MSD).
Для каждого соединения определяли единственное значение IC50 путем усреднения значений IC50 в двух повторах, рассчитанных с использованием программного обеспечения Igor Pro 6, и значение IC50 представляет собой концентрацию тестируемого соединения, при которой достигается 50% ингибирование индуцированного лигандом фосфорилирования CSF1R по сравнению с контролем с добавлением DMSO.
Пример 239
Анализ конкурентного связывания для определения баллов селективности и констант связывания (Kd) соединений в отношении набора киназ
Используемые в настоящем документе методы анализа конкурентного связывания разрабатывали, валидизировали и проводили, как описано в Fabian et al., Nature Biotechnology 2005, 23, 329-336. Киназы получали в виде слитых с Т7-фагом белков (см. Fabian et al. или WO 04/015142) или, в качестве альтернативы, экспрессировали киназы в клетках HEK-293 с последующим мечением ДНК для детектирования методом ПЦР (см. WO 08/005310). Для анализа связывания, покрытые стрептавидином магнитные шарики обрабатывали биотинилированными аффинными лигандами в течение 30 мин при комнатной температуре с получением аффинных смол. Покрытые лигандами шарики блокировали избытком биотина и промывали блокирующим буфером (SeaBlock (Pierce), 1% BSA, 0,05% Tween 20, 1 мМ DTT) для удаления несвязанных лигандов и уменьшения неспецифического связывания. Реакции связывания инициировали путем объединения киназы, покрытых лигандами шариков и тестируемого соединения в 1× связующем буферном растворе (20% SeaBlock, 0,17×PBS, 0,05% Tween 20, 6 мМ DTT). Тестируемые соединения приготавливали в виде 100× маточных растворов в DMSO и разбавляли введением в водную среду. Значение Kd определяли по одиннадцати точкам с использованием трехкратных последовательных разведений. В контрольные группы без тестируемого соединения добавляли DMSO или контрольные соединения. Первичный скрининг проводили в полипропиленовых 384-луночных планшетах в конечном объеме 20-40 мкл, при этом определение Kd проводили в полистирольных 96-луночных планшетах в конечном объеме 135 мкл. Аналитические планшеты инкубировали при комнатной температуре при встряхивании в течение 1 часа для уравновешивания реакций связывания, и обильно промывали шарики связывания промывочным буфером (1× PBS, 0,05% Tween 20) для удаления несвязанного белка. Затем шарики ресуспендировали в элюирующем буфере (1× PBS, 0,05% Tween 20, 0,5 мкМ небиотинилированного лиганда связывания) и инкубировали при комнатной температуре при встряхивании в течение 30 мин. Концентрацию киназы в элюатах измеряли количественно с помощью количественной ПЦР.
Балл селективности (S10) представляет собой количественную меру селективности соединения в отношении набора киназ. Значение S10 рассчитывали для соединения путем деления числа киназ, для которых обнаруженный процент регуляции (DMSO) был меньше 10, на общее число протестированных отдельных киназ (исключая мутантные варианты). Процент регуляции (POC) рассчитывали путем вычитания из сигнала тестируемого соединения сигнала контрольного соединения (POC=0), и деления результата на сигнал DMSO (POC=100) за вычетом сигнала контрольного соединения. Для представленных в настоящем документе соединений баллы S10 получали путем тестирования соединений в концентрации 10 мкМ на наборе киназ, содержащем 386 либо 392 отдельных киназ.
Согласно одному варианту осуществления, было обнаружено, что представленные в настоящем документе соединения характеризуются баллом S10, приблизительно равным или меньшим чем приблизительно 0,1, 0,08, 0,06, 0,04, 0,03, или 0,02.
Было обнаружено, что соединения, представленные в настоящем документе, характеризуются следующей активностью, представленной в таблице 1.
|
|
|
|
Было обнаружено, что дополнительные соединения, представленные в настоящем документе, характеризуются следующей активностью, представленной в таблице 2.
|
|
|
|
Пример 240
Ингибирование in vivo роста и выживания опухолевых клеток M-NFS-60 у мышей
На 0 сутки 1×107 клеток линии M-NFS-60, суспендированных в PBS, вводили в брюшную полость бестимусных nu/nu мышей (Harlan Research Labs) во всех экспериментальных группах, за исключением интактной группы. На 1-3 сутки в экспериментальной группе перорально вводили соединение A, характеризующееся формулой I, суспендированное в 0,5% гидроксипропилметилцеллюлозе (HPMC), в дозе 100, 30, и 10 и 3 мг/кг один раз в сутки (QD), а в группе положительного контроля перорально вводили соединение Ki20227, суспендированное в Pharmatek#6, в дозе 30 мг/кг один раз в сутки (QD). В контрольной группе с введением растворителя вводили Pharmatek#6 один раз в сутки (QD), а группу интактных мышей оставляли без обработки. На 4 сутки брюшную полость промывали 5 мл стерильного PBS, содержащего 40 ед/мл гепарина натрия, и подсчитывали перитонеальные клетки с помощью счетчика клеток Vi-cell. На фигуре 1 представлено уменьшение числа опухолевых клеток в группах с введением соединения А.
Такое же исследование проводили с использованием соединения B, характеризующегося формулой I, которое вводили в том же составе в той же дозе и по той же схеме. На фигуре 2 представлено уменьшение числа опухолевых клеток в группах с введением соединения В.
Пример 241
Ингибирование PTHrP-индуцированной гиперкальцемии in vivo
Гиперкальциемия злокачественной опухоли представляет собой серьезное осложнение на поздней стадии злокачественной опухоли молочной железы и легких и множественной миеломы. Продукция гуморальных факторов первичной опухолью является механизмом, ответственным за 80% случаев злокачественной опухоли. Подавляющее большинство HHM обусловлены продуцируемым опухолью родственным паратиреоидному гормону белком, который посредством рецепторов PTH/PTHrP в кости и почках приводит к стимуляции остеокластной резорбции кости и резорбции кальция. Трансформирующий фактор роста-β (TGF-β), который запасен в костном матриксе и высвобождается посредством резорбции кости остеокластами, вызывает усиленную продукцию PTHrP опухолевыми клетками в кости. Повышенная продукция PTHrP дополнительно ускоряет резорбцию кости и обеспечивает больше пространства для пролиферации опухолевых клеток. Поэтому, подавление опосредованной остеокластами резорбции кости может быть эффективно против метастазов в кость. Было показано, что M-CSF индуцирует выработку остеокластов и резорбцию кости, а потому ингибирование CSF1R может являться эффективным механизмом против метастазов в кость.
В данной модели гуморальной гиперкальцемии злокачественной опухоли мышей линии BDF1 (Charles River Laboratories) в возрасте 32 суток во всех группах, за исключением интактной, в течение семи суток проводили стимулирование 0,5 мг/кг рекомбинантного PTHrP (Bachem, Torrance, CA) дважды в сутки (утром и вечером, путем подкожного введения). В экспериментальной группе в течение семи суток вводили соединение A, характеризующееся формулой I, суспендированное в 0,5% гидроксипропилметилцеллюлозе (HPMC), в дозе 100, 30, и 10 и 3 мг/кг перорально один раз в сутки (QD). На 1 сутки непосредственно перед введением соединения A или контроля с введением растворителя вводили rPTHrP. В группе положительного контроля перорально в течение семи суток вводили соединение Ki20227, суспендированное в Pharmatek#6, в дозе 30 мг/кг один раз в сутки (QD), при этом в контрольной группе с введением растворителя вводили 1% гидроксипропилметилцеллюлозу перорально один раз в сутки (QD). Сведения по экспериментальным группам изложены в представленной ниже таблице 3. Для наблюдения за изменениями содержания в крови ионизированного кальция и TRAPC5b (маркера резорбции кости) ровно через 3 ч после последнего введения из нижней челюсти отбирали кровь. Содержание ионизированного кальция в крови определяли с использованием QuantiChrom Calcium Assay Kit (DICA-500) для количественного колориметрического определения содержания кальция при 612 нм. Содержание TRAPC5b определяли путем анализа мышиного TRAP (Immunodiagnostic systems Inc. # SB-TR103). Мышей умерщвляли на 8 сутки, и извлекали большеберцовую кость для окрашивания TRAP5b кости и гематоксилином/эозином.
|
Результаты демонстрируют, что ингибиторы CSF1R могут быть эффективными в данной модели HHM. На фигуре 3 представлено, что соединение A дозозависимым образом снижает содержание TRAP5b в сыворотке, и в максимальной дозе снижает содержание TRAP5b ниже значения у интактных животных.
Такое же исследование проводили с использованием соединения B, характеризующегося формулой I, которое вводили в том же составе в той же дозе и по той же схеме. На фигуре 4 представлено, что соединение B дозозависимым образом снижает содержание TRAP5b в сыворотке, и в максимальной дозе снижает содержание TRAP5b ниже значения у интактных животных.
Пример 242
Ингибирование индукции MCP-1 in vivo
MCP-1 (моноцитарный хемоаттрактантный белок 1) представляет собой хемокин, который регулирует миграцию и инфильтрацию моноцитов/макрофагов, и вовлечен в развитие метастазов опухоли. В предшествующих экспериментах было показано, что стимулирование моноцитов, мононуклеарных клеток периферической крови или цельной крови человека M-CSF индуцирует увеличение содержания MCP-1. Данный эксперимент проводили для оценки возможности получения таких же результатов in vivo.
В данном исследовании мышей линии Balb/c (Harlan Laboratories) в возрасте 55 дней делили на группы в соответствии с таблицей 4. За один час до стимуляции M-CSF мышам перорально вводили соединение A, либо GW-2580 или растворитель. Через один час после введения животным внутривенно вводили по 0,8 мкг M-CSF, ресуспендированного в 200 мкл стерильного солевого раствора. Через два часа после введения M-CSF, кровь отбирали через верхнечелюстную вену и подвергали обработке для проведения MCP-1 ELISA (R&D Systems # MJE00) в соответствии с инструкциями производителя.
|
На фигуре 5 представлено, что в/в введение M-CSF мышам индуцирует увеличение содержания MCP-1 приблизительно в три раза. Наибольшее снижение MCP-1 на 60% наблюдали в дозе 100 мг/кг, и активность была снижена, но сопоставима, при предварительной обработке соединением A в дозах 30 и 10 мг/кг (46 и 53%, соответственно). Такое же исследование проводили с использованием соединения B, характеризующегося формулой I, которое вводили в таком же составе в такой же дозе и по той же схеме. На фигуре 6 представлено, что в/в введение M-CSF мышам индуцирует увеличение содержания MCP-1 приблизительно в три раза. Эффект дозы был менее очевидным, но максимальная активность также наблюдалась в дозе 100 мг/кг, а % снижения (59%) был практически идентичен таковому, измеренному для соединения А.
Описанные выше варианты осуществления приводятся исключительно в качестве примеров, и специалисты в данной области техники смогут выявить или установить с использованием не более чем общепринятой экспериментальной работы многочисленные эквиваленты конкретных соединений, веществ и методик. Предполагается, что все такие эквиваленты подпадают под объем заявленного объекта изобретения и охватываются прилагаемой формулой изобретения.
Поскольку модификации будут очевидны специалистам в данной области техники, то предполагается, что заявленный объект изобретения будет ограничиваться лишь объемом прилагаемой формулы изобретения.