Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ПУТЕМ ПРИМЕНЕНИЯ КОМБИНИРОВАННОЙ ТЕРАПИИ
Вид РИД
Изобретение
СПОСОБ ЛЕЧЕНИЯ ПУТЕМ ПРИМЕНЕНИЯ КОМБИНИРОВАННОЙ ТЕРАПИИ
Родственные заявки
Настоящая заявка заявляет приоритет предварительных заявок США: заявки № 61/202647, поданной 23 марта 2009 года; № 61/173803, поданной 29 апреля 2009 года; и № 61/266989, поданной 4 декабря 2009 года. Раскрытия вышеупомянутых заявок включены в настоящее изобретение посредством ссылки во всей их полноте.
Область изобретения
Настоящее изобретение относится к комбинированной терапии для лечения пролиферативного заболевания. Дополнительно в изобретении рассмотрены способы введения N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины или ее фармацевтически приемлемой соли, гидрата, сольвата или пролекарства, в комбинации с химиотерапевтическим агентом, таким как нуклеозидный аналог, антрациклин, ингибитор топоизомеразы или с их комбинацией. В конкретных вариантах осуществления способы предназначены для лечения рака.
Уровень изобретения
В последнее время во всем мире рак является одной из десяти ведущих причин смерти. Например, в 2007 году смертность от рака составила 7,9 миллионов случаев (примерно 13% всех случаев смерти). Согласно отчету за 2008 год Международного агентства исследования рака (IARC), являющегося подразделением Всемирной организации здравоохранения (ВОЗ), уровень заболеваемости раком в мире в период от 1975 года до 2000 года удвоился, и предполагается, что рак станет ведущей причиной смерти в мире к 2010 году.
Гематологические злокачественные заболевания, такие как лейкоз, лимфома, множественная миелома и другие раковые заболевания, связанные с кровью и органами кроветворения, занимают пятое место среди наиболее частых случаев рака и являются второй основной причиной смерти среди смертности от рака. Несмотря на последние разработки новых противораковых агентов, в существующих способах терапии гематологических злокачественных заболеваний по прежнему доминирует применение лекарств для лечения солидных опухолей.
Известно противораковое действие N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины или AC220. Опубликованы предложения по лечению ряда раковых заболеваний с помощью AC220. Описаны разные схемы введения, например, в опубликованных патентных заявках США № US 2007/0232604, US 2009/0123418, US 2009/0131426, которые включены в изобретение посредством ссылки во всей их полноте.
В настоящее время существует потребность в разработке лечения пролиферативных заболеваний, включающих рак.
Сущность раскрытия
В одном варианте осуществления в изобретении рассматривается способ лечения пролиферативного заболевания, содержащий совместное введение нуждающемуся в этом пациенту терапевтически эффективного количества (a) нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) соединения, имеющего структурную формулу (I) или его соль, сольват, гидрат, сложный эфир и/или пролекарство. В одном варианте осуществления нуклеозидный аналог представляет собой антиметаболит неопластической клетки. В одном варианте осуществления изобретение относится к способу лечения гематологического неопластического заболевания, при этом указанный способ содержит совместное введение нуждающемуся в этом пациенту терапевтически эффективного количества (a) нуклеозидного аналога, и указанный нуклеозидный аналог представляет собой антиметаболит неопластической клетки; антрациклин; ингибитор топоизомеразы; или их комбинацию; и (b) соединения, имеющего структурную формулу (I) или его соли, сольвати, гидрати, сложного эфира и/или пролекарства.
Соединение формулы (I) представляет собой:
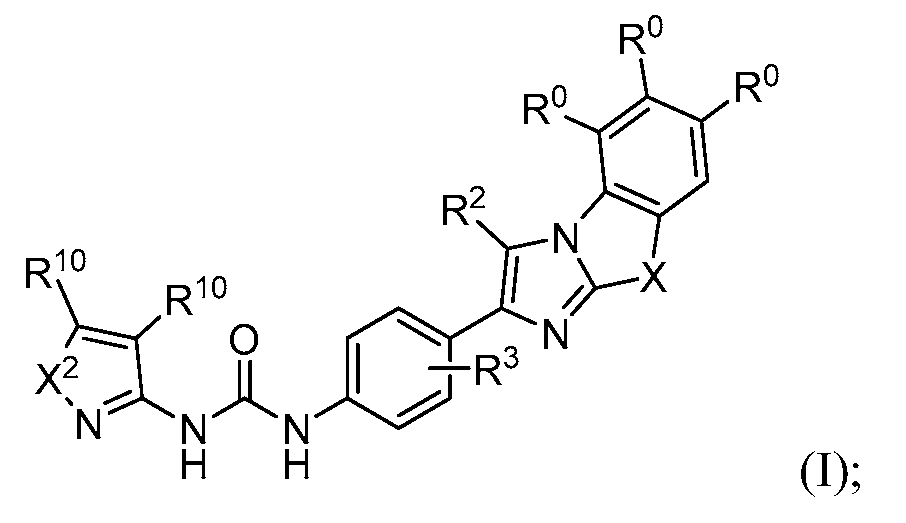
в которой
X2 представляет собой -О- или -S-;
X представляет собой -S-, -N(R5)- или -O-;
два из трех R0 представляют собой водород; и другой R0 представляет собой галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, или 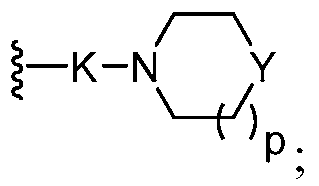
Y представляет собой -О-, -S-, -N(R14)- или -C(H)R15-;
K представляет собой -O(CH2)q-, -C(O), -C(O)NH(CH2)q-, -(CH2)qO-, или -(CH2)qO(CH2)q-;
p является целым числом от 0 до 2;
каждый q независимо является целым числом от 1 до 4;
R2 представляет собой водород, галоген, нитро, циано, необязательно замещенный алкил, -OR12, -SR12, -N(R12)2, -S(O)tR13, -C(O)R12, -C(O)OR12, -C(O)N(R12)2, -C(O)SR12 или -N(R12)S(O)tR13;
R3 представляет собой водород, галоген, нитро, циано, необязательно замещенный алкил, -OR12, -SR12, -N(R12)2, -S(O)tR13, -C(O)R12, -C(O)OR12, -C(O)N(R12)2, -C(O)SR12 или -N(R12)S(O)tR13;
R5 представляет собой водород или необязательно замещенный алкил;
каждый R10 независимо выбирают из водорода, галогена, необязательно замещенного алкила, необязательно замещенного циклоалкила или необязательно замещенного арила;
каждый R12 независимо выбирают из группы, состоящей из водорода, необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного циклоалкилалкила, необязательно замещенного арила, необязательно замещенного аралкила, необязательно замещенного гетероциклила, необязательно замещенного гетероциклилалкила, необязательно замещенного гетероарила и необязательно замещенного гетероаралкила;
R13 представляет собой необязательно замещенный алкил;
R14 представляет собой водород, необязательно замещенный алкил, -C(O)OR12, -C(O)SR12, -C(O)NR12 или -S(O)tR13;
R15 представляет собой водород или необязательно замещенный алкил; и
t равен 1 или 2.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу нуклеозидного аналога, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки, и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к упаковке комбинации, содержащей:
(a) по меньшей мере одну отдельную дозу антрациклина, ингибитора топоизомеразы или их комбинации; и (b) по меньшей мере одну отдельную дозу соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации; и (b) соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) нуклеозидного аналога, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки; и (b) соединения со структурной формулой (I), как описано выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество (a) антрациклина, ингибитора топоизомеразы, или их комбинации; и (b) соединения со структурной формулой (I), как описано выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, предупреждения или контроля пролиферативного заболевания. В конкретных вариантах осуществления способы содержат введение субъекту терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата в комбинации со вторым противораковым агентом. В одном варианте осуществления вторым агентом является нуклеозидный аналог, антрациклин, ингибитор топоизомеразы или их комбинации. В одном варианте осуществления вторым агентом является нуклеозидный аналог, при этом нуклеозидный аналог представляет собой антиметаболит неопластической клетки. В одном варианте осуществления вторым агентом является антрациклин, ингибитор топоизомеразы или их комбинация. В одном варианте осуществления ингибитор топоизомеразы выбирают из амсакрина, этопозида, этопозида фосфата и тенипозида. В одном варианте осуществления ингибитором топоизомеразы является этопозид. В одном варианте осуществления антрациклин выбирают из даунорубицина, доксорубицина, эпирубицина, идарубицина, митоксантрона, амрубицина и валрубицина. В одном варианте осуществления антрациклином является даунорубицин. В одном варианте осуществления второй агент представляет собой цитарабин, даунорубицин, этопозид или их комбинацию.
В одном варианте осуществления рассматриваемые способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с цитарабином, который вводят интратекально в дозе от около 5 мг/м2 до около 75 мг/м2 один раз в день или один раз каждые четыре дня, или около 30 мг/м2 каждые четыре дня, в другом варианте осуществления цитарабин вводят внутривенно от около 5 мг/м2/день до около 3 г/м2/день или от около 100 мг/м2/день до около 200 мг/м2/день. В одном варианте осуществления AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. Введение цитарабина можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, с помощью болюсного вливания или подкожной инъекции. В одном варианте осуществления введение цитарабина проводят в течение 5 дней. В одном варианте осуществления введение цитарабина проводят в течение 7 дней. В одном варианте осуществления введение цитарабина проводят в дни от 1 до 5. В одном варианте осуществления введение цитарабина проводят в дни от 1 до 7.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с этопозидом в количестве от около 10 мг/м2 до около 150 мг/м2. Например, один вариант осуществления включает введение этопозида в дозе от около 30 до около 120 мг/м2. Один вариант осуществления включает введение этопозида в дозе около 35, 50 или 100 мг/м2. Введение этопозида можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции. В одном варианте осуществления введение этопозида выполняют один раз в день в течение 5 дней, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение этопозида выполняют один раз в день в дни 1, 3 и 5, при этом введение AC220 выполняют один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с даунорубицином в количестве от около 10 мг/м2 до около 50 мг/м2. Например, один вариант осуществления включает введение даунорубицина в дозе от около 20 до около 50 мг/м2. Один вариант осуществления включает введение даунорубицина в дозе около 25, 30 или 45 мг/м2. Введение даунорубицина можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции. В одном варианте осуществления введение даунорубицина выполняют один раз в день в 1, 2 и 3 дни, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина выполняют один раз в день на 1 и 2 день, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина выполняют один раз в день в 1 день, при этом AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель.
В одном варианте осуществления представленные способы включают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с цитарабином и даунорубицином.
В конкретных вариантах осуществления недельным циклом считается введение через неделю AC220 и вторых агентов, выбираемых из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы и их комбинации, как указано выше. Предполагается, что способы осуществляют в виде одного недельного цикла, необязательно с периодом выжидания от одного дня до нескольких дней или от одной недели до нескольких недель, во время которых не вводят ни второй агент, ни AC220, и затем повторяют недельный цикл. Указанные способы также предполагают постоянное повторение недельных циклов, например, в течение 2-5 недель. Дополнительно, эти способы предполагают повторение цикла в виде нескольких циклов, с периодом выжидания от одного дня до нескольких дней или от одной недели до нескольких недель, во время которых не вводят ни AC220, ни второй агент, и затем повторяют один или больше циклов. Наконец, способы по изобретению рассматривают введение AC220/второго агента в виде недельного цикла, с последующим циклом введения второго агента или AC220 единственных.
Также изобретение рассматривает способ ингибирования клеточного роста, который содержит контакт клетки с эффективным количеством AC220 или его фармацевтически приемлемым пролекарством, солью, сольватом или гидратом в комбинации со вторым противораковым агентом, выбранным из антрациклина, ингибитора топоизомеразы и их комбинаций.
Краткое описание фигур
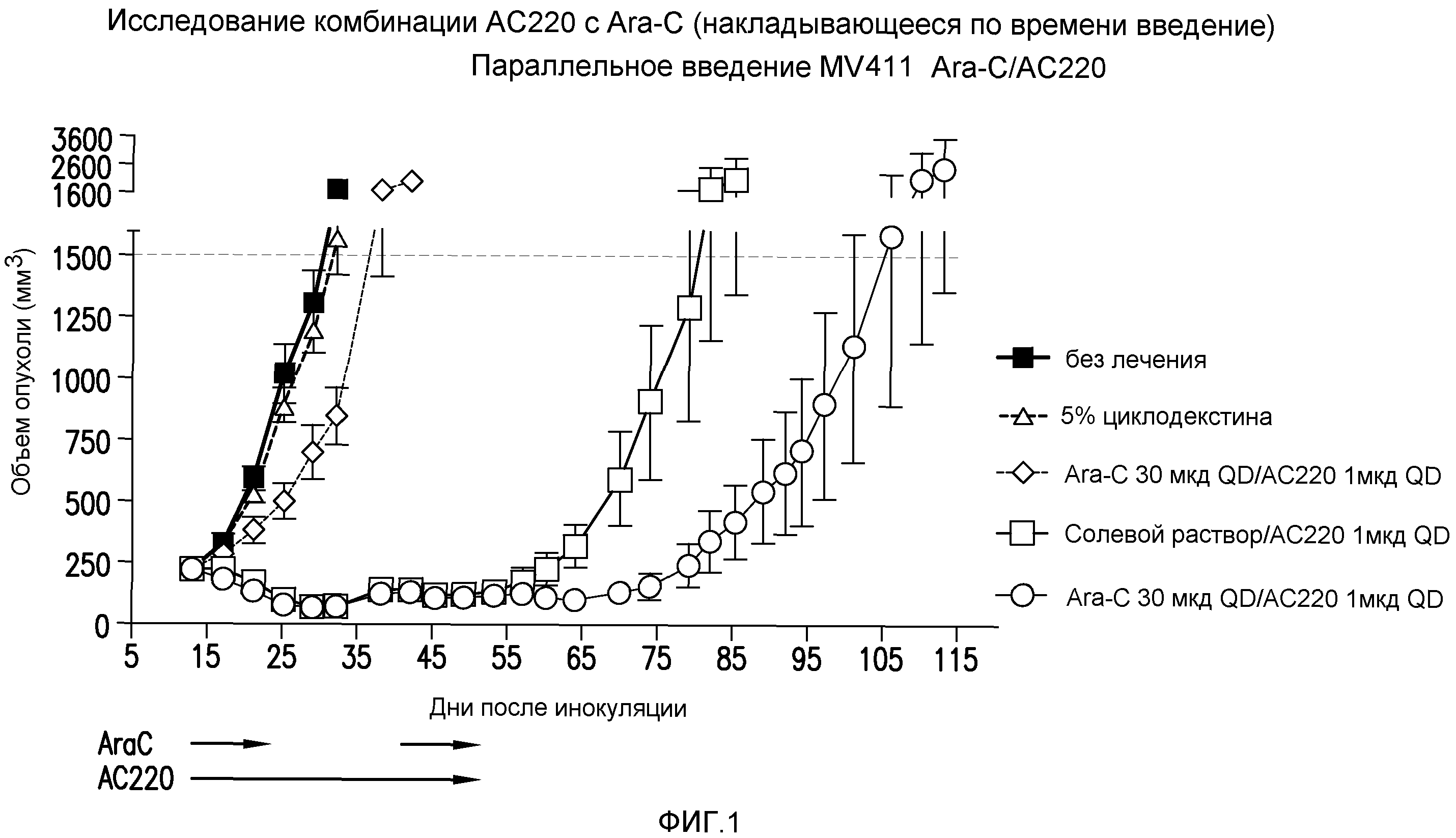
Фигура 1 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс цитарабин (с совпадающим по времени введением) при сравнении с введением контроля, AC220 единственного и цитарабина единственного.
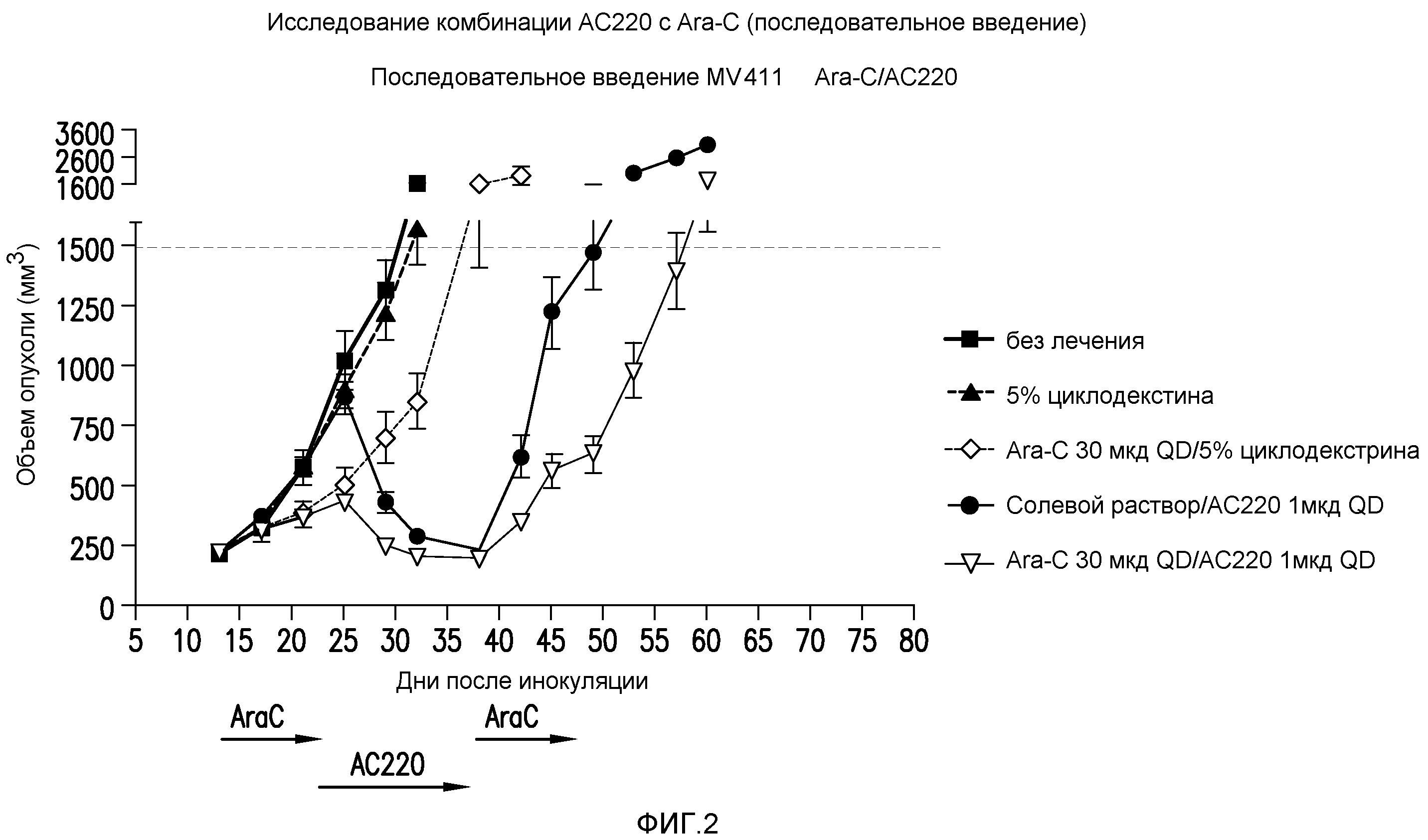
Фигура 2 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс цитарабин (при последовательном введении) при сравнении с введением контроля, AC220 единственного и цитарабина единственного.
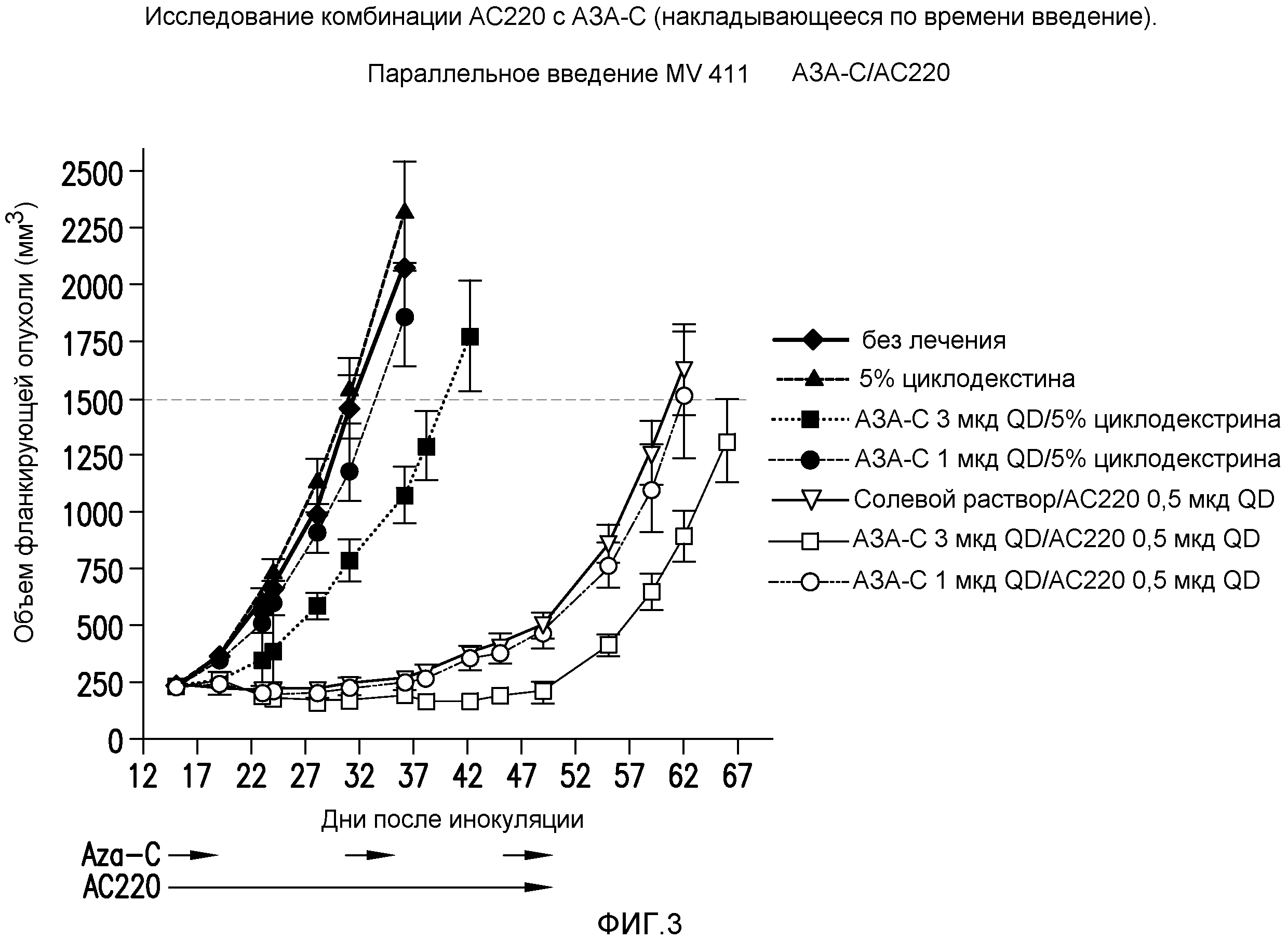
Фигура 3 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс азацитидин (с совпадающим по времени введением) при сравнении с введением контроля, AC220 единственного и азацитидина единственного.
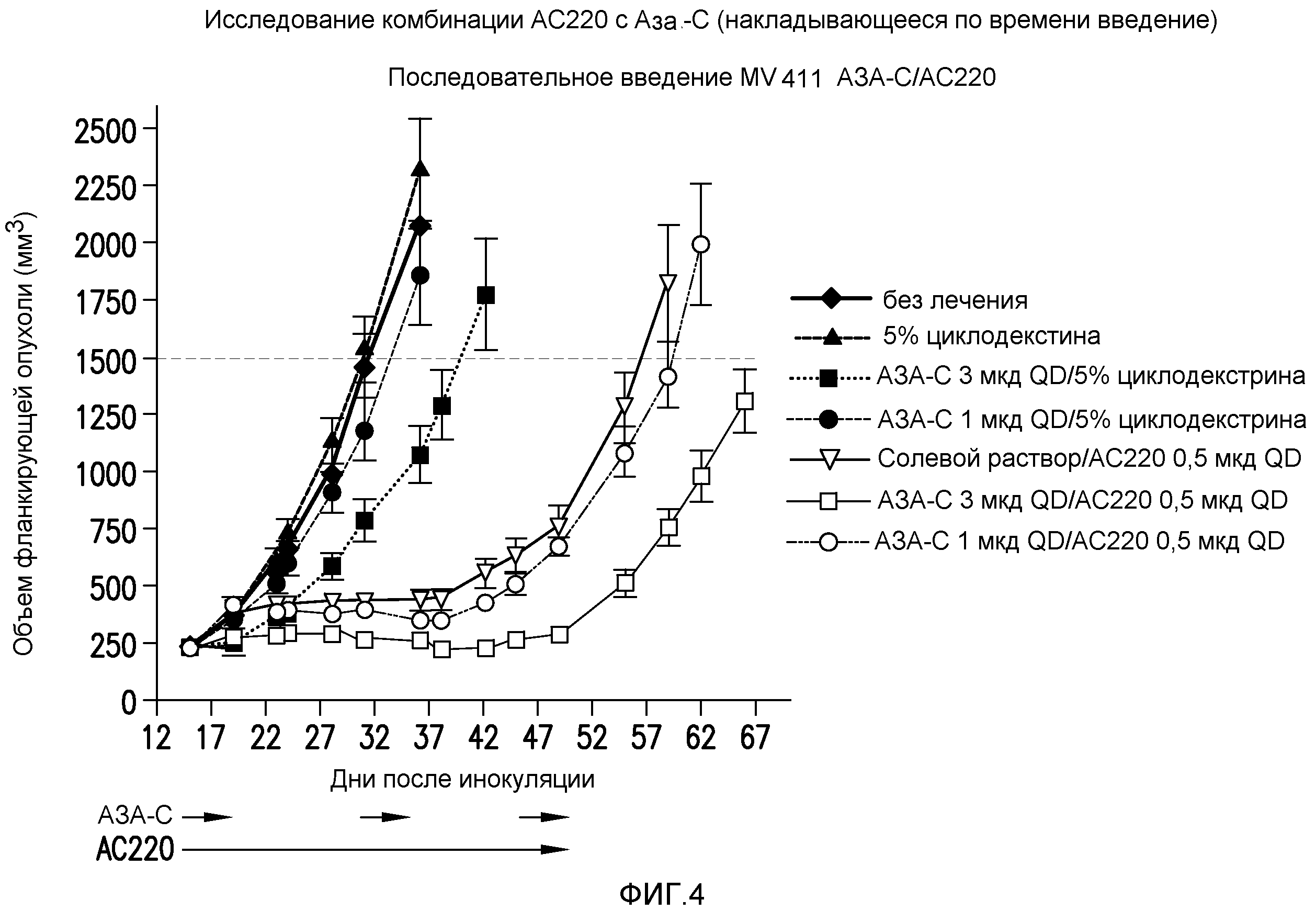
Фигура 4 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс азацитидин (при последовательном введении) при сравнении с введением контроля, AC220 единственного и азацитидина единственного.
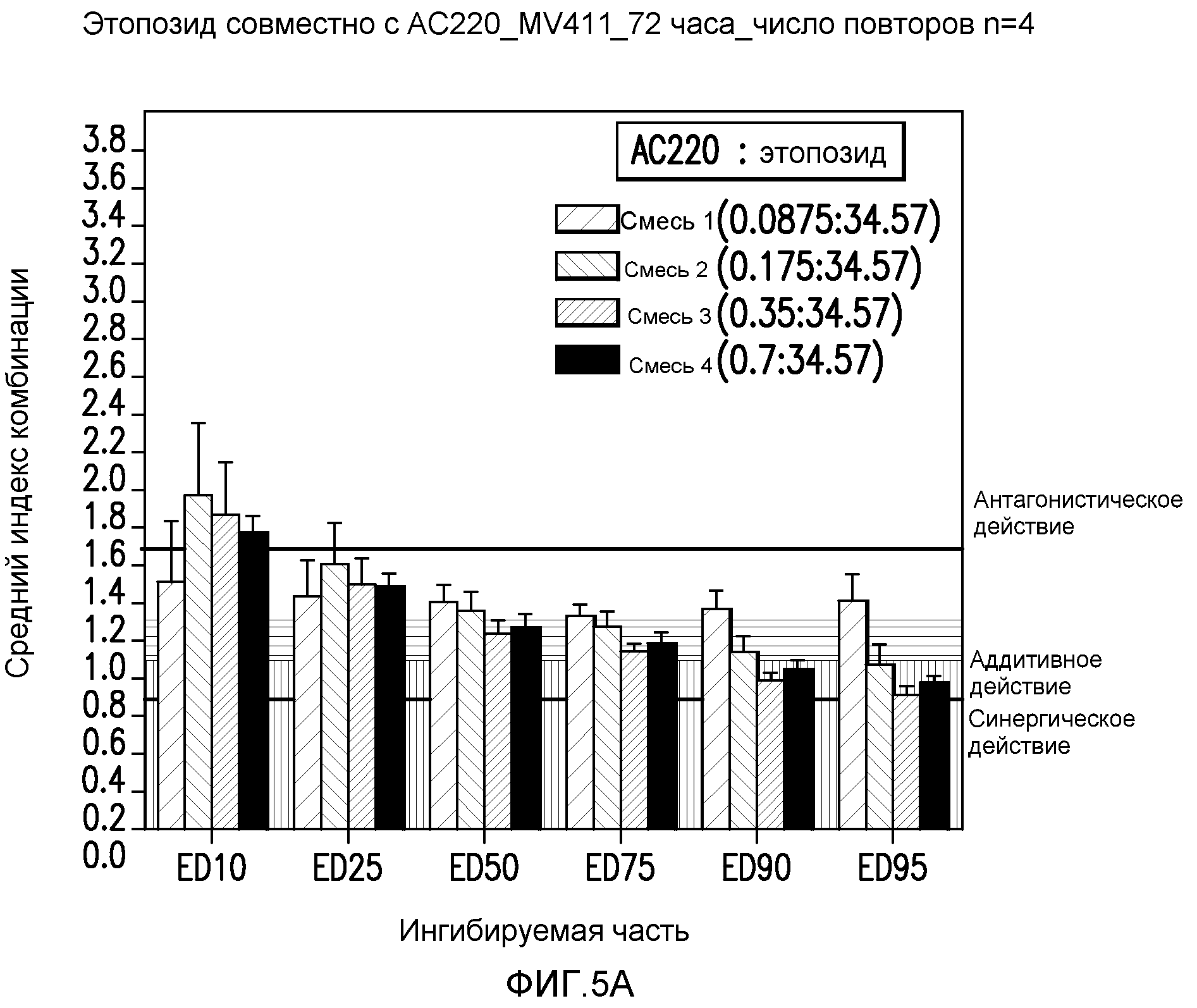
Фигура 5А показывает эффект введения AC220 в комбинации с этопозидом, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при сопутствующем введении.
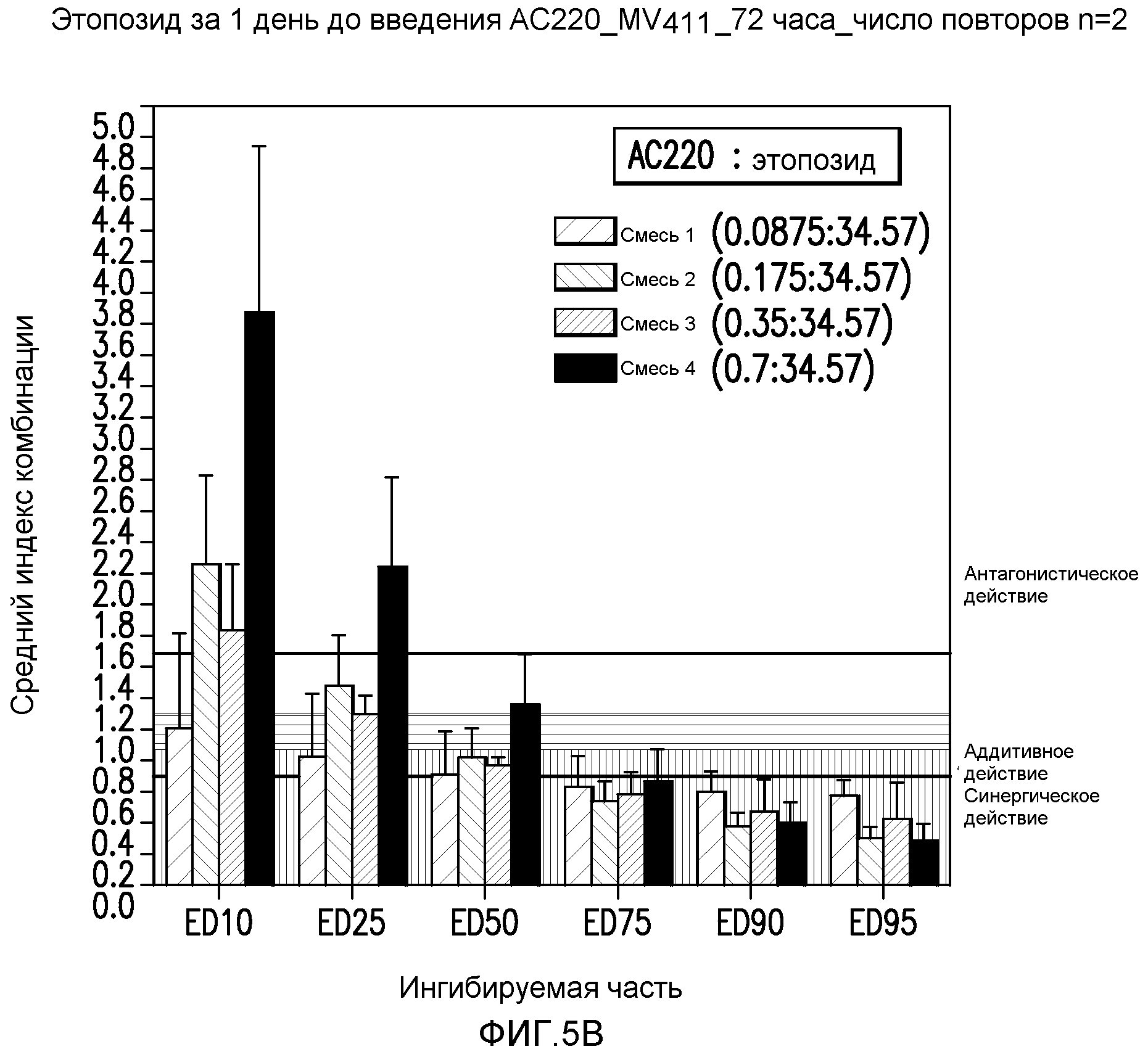
Фигура 5B показывает эффект введения AC220 в комбинации с этопозидом, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ному ингибированию роста клеток MV4-11 при введении этопозида за 1 день до введения AC220.
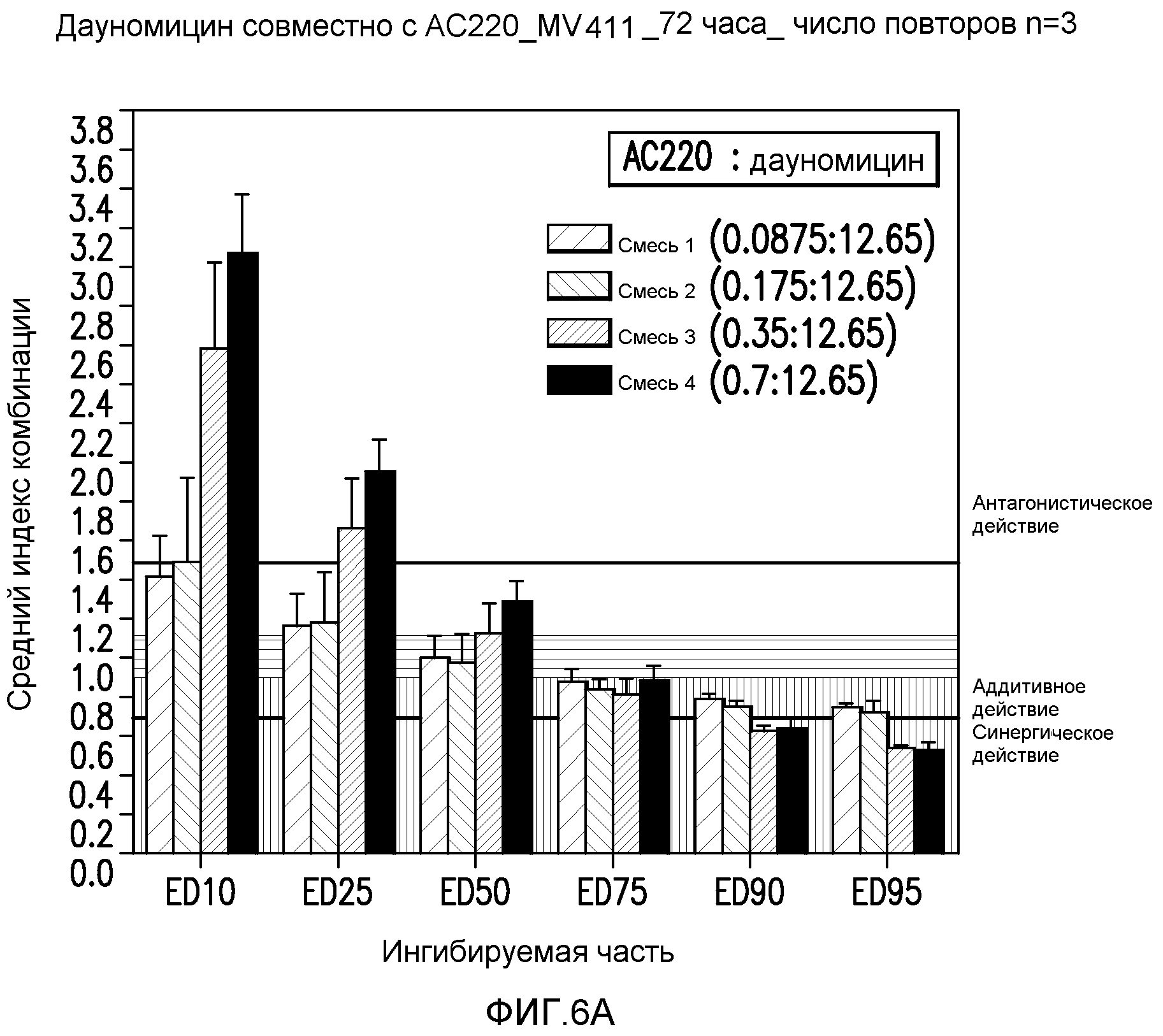
Фигура 6A показывает эффект AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при сопутствующем введении.
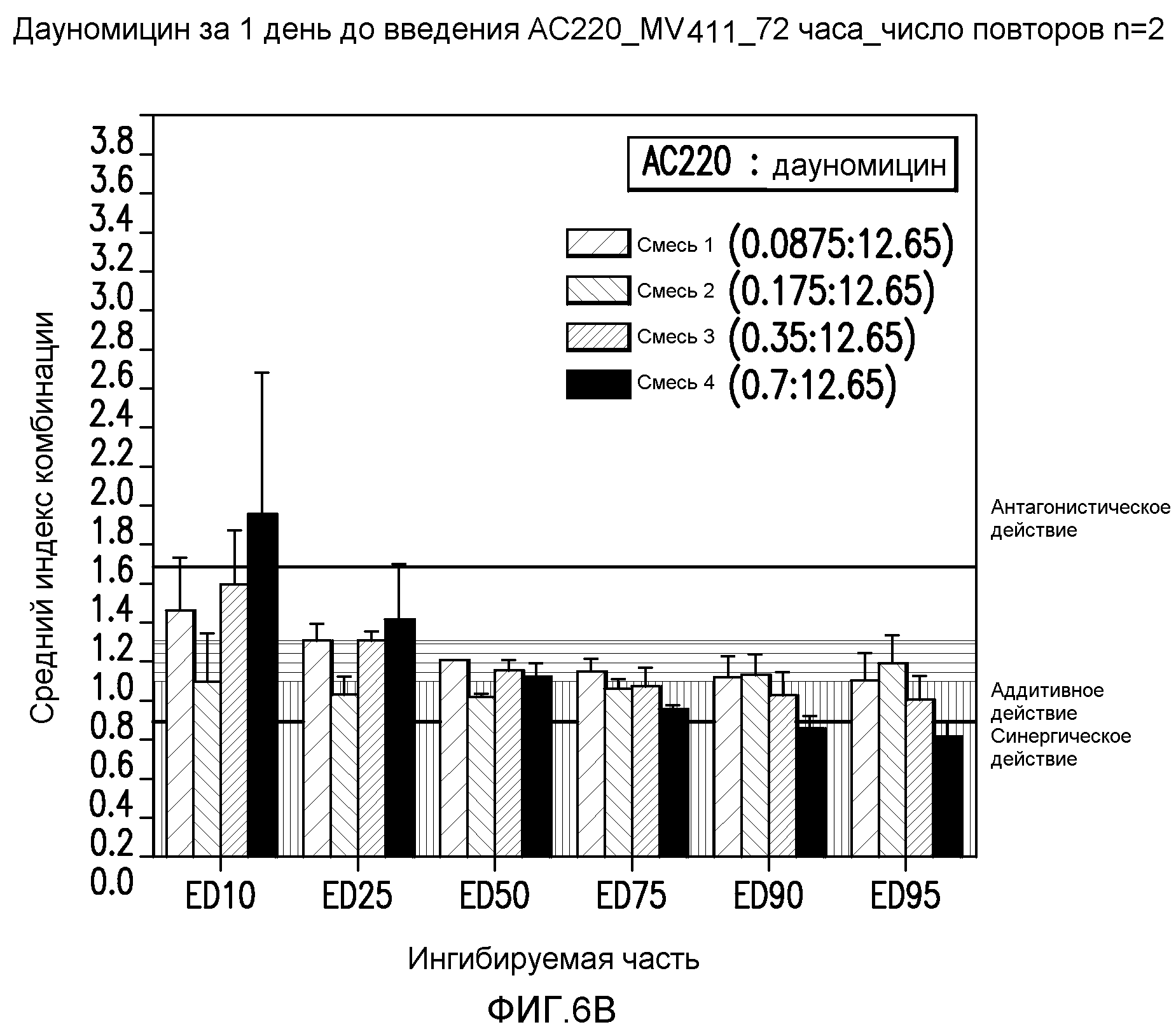
Фигура 6B показывает эффект введения AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при введении даунорубицина за 1 день до введения AC220.
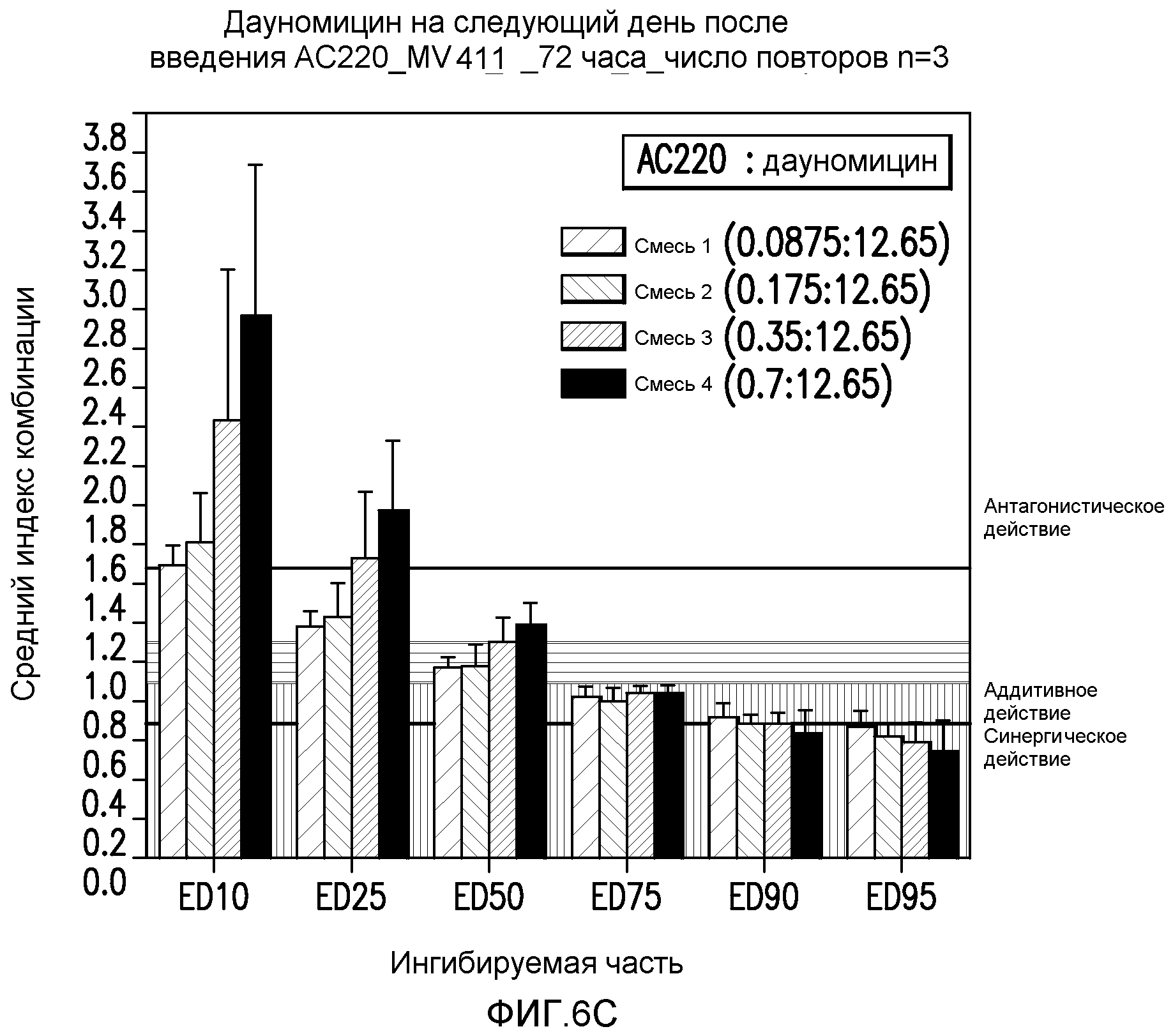
Фигура 6C показывает эффект введения AC220 в комбинации с даунорубицином, который определяют по 10%, 25%, 50%, 75%, 90% и 95%-ому ингибированию роста клеток MV4-11 при введении даунорубицина через 1 день после введения AC220.
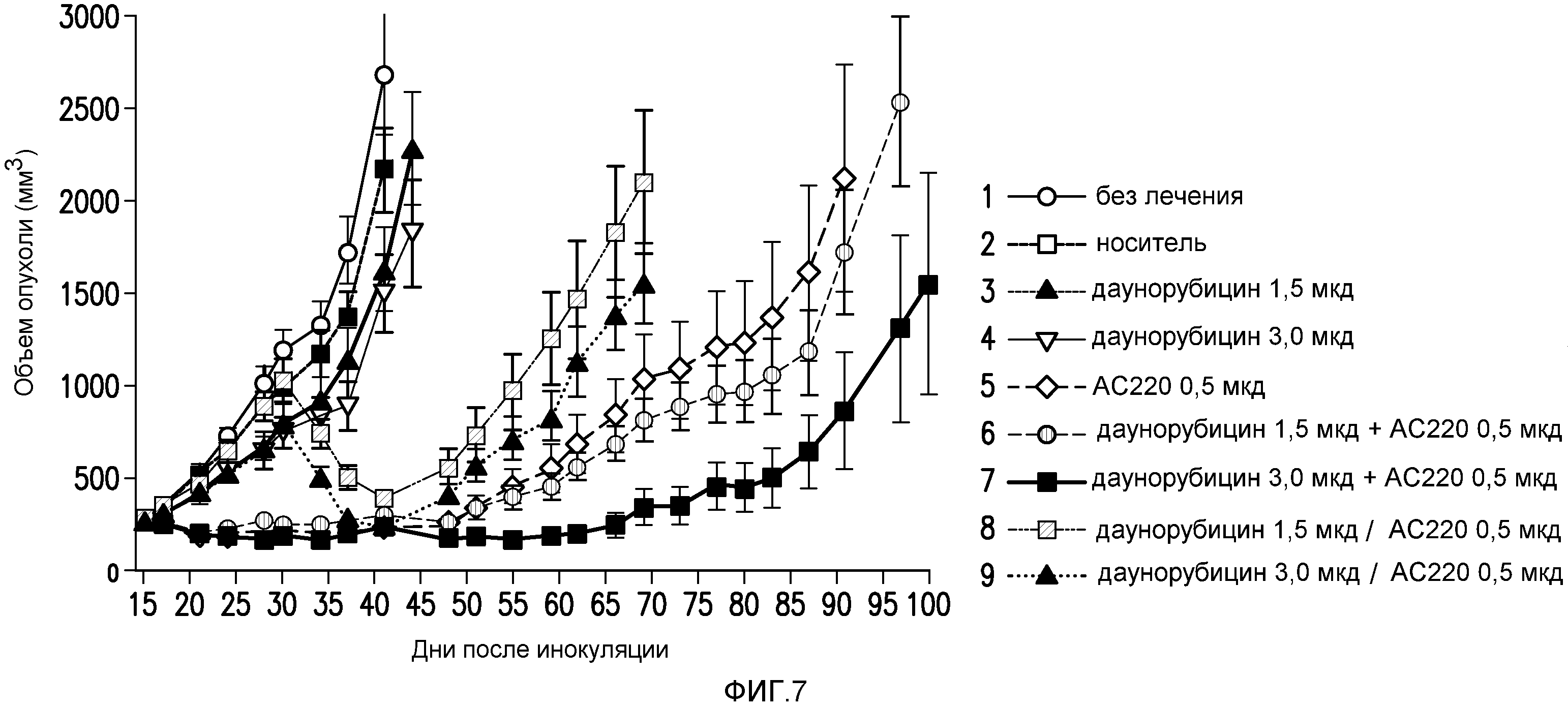
Фигура 7 представляет собой график эффективности контроля опухолевого роста с помощью введения AC220 плюс даунорубицин на модели солидной опухоли MV4-11 при сравнении с введением контроля, AC220 единственного и даунорубицина единственного.
Подробное описание
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, и указанные способы включают введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, менеджменте или предупреждении, терапевтически или профилактически эффективного количества соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства, в комбинации со вторым агентом, выбранным из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, которые содержат введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, контроле или предупреждении, терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата, в комбинации со вторым агентом, выбранным из нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации.
В конкретных вариантах осуществления изобретение рассматривает способы лечения, контроля или предупреждения пролиферативных заболеваний, которые включают введение субъекту, такому как млекопитающее, нуждающемуся в таком лечении, контроле или предупреждении, терапевтически или профилактически эффективного количества AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата, в комбинации со вторым агентом, выбранным из антрациклина и ингибитора топоизомеразы.
В конкретных вариантах осуществления изобретение относится к способам и композициям для лечения гематологического неопластического заболевания путем комбинированного применения нуклеозидного аналога, антрациклина, ингибитора топоизомеразы или их комбинации, и соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В конкретных вариантах осуществления изобретение относится к способам и композициям для лечения гематологического неопластического заболевания путем комбинированного применения нуклеозидного аналога и соединения со структурной формулой (I), описанного выше, или его соли, сольвата, сложного эфира и/или пролекарства.
В одном варианте осуществления способы охватывают лечение, предупреждение или контроль ряда раковых заболеваний, выбираемых из рака мочевого пузыря, рака молочной железы, рака шейки матки, рака ЦНС, рака толстой кишки, рака пищевода, рака головы и шеи, рака печени, рака легкого, рака носоглотки, нейроэндокринного рака, рака яичника, рака поджелудочной железы, рака предстательной железы, рака почки, рака слюнной железы, мелкоклеточного рака легкого, рака кожи, рака желудка, рака яичка, рака щитовидной железы, рака матки или гематологического злокачественного заболевания. Рак может быть рецидивирующим, рефрактерным или резистентным к общепринятой терапии.
В конкретных вариантах осуществления рассматриваемые в изобретении способы предусматривают введение AC220 или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации со вторым активным агентом, выбранным из клофарабина, цитарабина, даунорубицина и этопозида, или их комбинацией. В конкретных вариантах осуществления в рассматриваемых в изобретении способах вводят AC220 или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат в комбинации со вторым активным агентом, выбранным из даунорубицина и этопозида. Ниже представлены конкретные дозы и схемы введения указанных комбинаций.
A. Определения
Для облегчения понимания раскрытия настоящего изобретения ниже приведены определения ряда терминов.
Используемая в изобретении номенклатура и лабораторные методики органической химии, лекарственной химии, биохимии, биологии, фармакологии и другие методики, описанные в изобретении, в целом являются общеизвестными и широко применяемыми в данной области техники. Если не указано иначе, все используемые в изобретении технические и научные термины обычно имеют то же значение, как общепринято рядовыми специалистами в области техники, к которому относится настоящее раскрытие.
Термины "опухоль", "новообразование" и "неопластическая патология или заболевание" используются в изобретении взаимозаменяемо и предназначены для обозначения нежелательной клеточной пролиферации одной или больше субпопуляций клеток в многоклеточном организме, которая приводит к повреждению (то есть, к нарушению самочувствия или уменьшению продолжительности жизни) у многоклеточных организмов. В конкретных вариантах осуществления опухоль может быть доброкачественной (неинвазивной) или злокачественной (инвазивной).
Термин "рак" относится к злокачественному новообразованию, характеризующемуся нерегулируемой клеточной пролиферацией, при которой клетки теряют нормальные механизмы регуляторного контроля, которые в других случаях регулируют скорость клеточного роста. Такие нерегулируемые делящиеся клетки в процессе, называемом "метастазированием", могут распространяться во всем организме и инвазировать нормальные ткани.
Понятие "натуральный" или "нативный", используемое по отношению к биологическим материалам, таким как молекулы нуклеиновой кислоты, полипептиды, клетки-хозяева и т.п., относится к материалам, которые встречаются в природе и не обработаны человеком. Аналогично, понятия "неприродное происхождение" или "ненативный" относятся к материалу, который не встречается в природе, или подвергался структурной модификации, или синтезирован человеком.
Термины "FLT3", который обозначает FMS-связанную тирозинкиназу 3, "FLK-2", который обозначает киназу эмбриональной печени 2, "STK1", который обозначает киназу стволовой клетки 1 и кластер дифференцировки 135 (CD-135), используются в изобретении взаимозаменяемо и относятся к белку рецептора FLT3 или его варианту, описанному, например, авторами Small et al. (1994) Proc. Natl. Acad. Sci. USA 91:459-463. Варианты FLT3 включают белки, по существу гомологичные нативному FLT3, то есть, белки, имеющие одну или больше аминокислотных делеций, вставок или замен природного или неприродного происхождения (например, производные, гомологи и фрагменты FLT3), по сравнению с аминокислотной последовательностью нативного FLT3. Аминокислотная последовательность варианта FLT3 по меньшей мере примерно на 80% идентична, по меньшей мере примерно на 90% идентична, или по меньшей мере на около 95% идентична нативному FLT3. Примеры мутантных форм нативного FLT3 природного происхождения включают мутацию FLT3 ITD (внутреннюю тандемную дупликацию), то есть мутацию вставки внутренней тандемной дупликации, также описанную авторами Nakao et al. (1996) Leukemia 10:1911-1918, и мутацию домена тирозинкиназы FLT3, то есть бессмысленную мутацию, такую как FLT3 D835, которая также описана авторами Yamamoto et al. (2001) Blood 97 (8):2434-2439.
Термины "пролиферативная патология или заболевание" относится к нежелательной клеточной пролиферации одной или больше субпопуляций клеток в многоклеточном организме, которая приводит к повреждению (то есть, к нарушению самочувствия или уменьшению продолжительности жизни) у многоклеточных организмов. Пролиферативная патология или заболевание может возникать у разных типов животных и людей. Например, используемые в изобретении термины "пролиферативная патология или заболевание" включают неопластические патологии и другие пролиферативные патологии.
Термин "неопластическая патология или заболевание" или "рак" относится к опухоли, обусловленной патологическим или нерегулируемым клеточным ростом. Примеры неопластических патологий включают без ограничения гематопоэтические болезни, такие как миелопролиферативные болезни, тромбоцитемию, эссенциальный тромбоцитоз (ЭТ), ангиогенную миелоидную метаплазию, миелофиброз (МФ), миелофиброз с миелоидной метаплазией (МММ), хронический идиопатический миелофиброз (ХИМ), истинную полицитемию (ИП), цитопении и предзлокачественные миелодиспластические синдромы; раковые заболевания, такие как злокачественные глиомы, раковые болезни легкого, рак молочной железы, раковые болезни толстой и прямой кишки, раковые болезни предстательной железы, раковые болезни желудка, раковые болезни пищевода, раковые болезни толстой кишки, раковые болезни поджелудочной железы, раковые болезни яичника и гематологические злокачественные заболевания.
Понятие "гематологическое злокачественное заболевание" относится к раку кровеобразующей и иммунной системы организма, а именно, костного мозга и лимфатической ткани.
Примеры гематологических злокачественных заболеваний включают, например, миелодисплазию, лимфомы, лейкозы, лимфомы (неходжкинкую лимфому), болезнь Ходжкина (также называемую ходжкинской лимфомой) и миеломы, такие как острый лимфоцитарный лейкоз (ОЛЛ), острый миелоцитарный лейкоз (ОМЛ), острый промиелоцитарный лейкоз (ОПЛ), хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелоцитарный лейкоз (ХМЛ), хронический нейтрофильный лейкоз (ХНЛ), острый недифференцированный лейкоз (ОНДЛ), анапластическую крупноклеточную лимфому (АККЛ), пролимфоцитарный лейкоз (ПЛЛ), ювенилный миеломоноцитарный лейкоз (ЮММЛ), T-клеточный ОЛЛ взрослых, ОМЛ с трехлинейной миелодисплазией (ОМЛ/TMDS), недифференцированный лейкоз (НЛ), миелодиспластические синдромы (МДС), миелопролиферативные болезни (МПБ) и множественную миелому (ММ).
Термин "лейкоз" относится к злокачественным новообразованиям кровеобразующих тканей и включает без ограничения хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз. Лейкоз может быть рецидивирующим, рефрактерным или резистентным к общепринятой терапии.
Термин "рецидивирующий" относится к ситуации, когда у субъекта или млекопитающего в состоянии ремиссии рака после лечения обнаруживают возвращение раковых клеток.
Термин "рефрактерный или резистентный" относится к ситуации, когда в организме субъекта или млекопитающего даже после интенсивного лечения имеются остаточные раковые клетки.
Термин "лекарственная резистентность" относится к состоянию, когда при болезни отсутствует реакция на лечение лекарством или лекарствами. Лекарственная резистентность может быть как врожденной, что означает, что при болезни никогда не было реакции на лекарство или лекарства, или она может быть приобретенной, что означает, что болезнь прекратила реагировать на лекарство или лекарства, на которые ранее была реакция при болезни. В конкретных вариантах осуществления лекарственная резистентность является врожденной. В конкретных вариантах осуществления лекарственная резистентность является приобретенной. Предполагается, что используемый в изобретении термин "лекарственная резистентность" включает резистентность к иматинибу, резистентность к дасатинибу и/или резистентность к нилотинибу.
Термин "сверхэкспрессирует" или "сверхэкспрессия" означает, что клетка, связанная с заболеванием, нарушением или состоянием, содержит определяемый более высокий уровень белка, такого как FLT3 или FLT3, чем идентичная клетка в другой ситуации, которая не связана с заболеванием, нарушением или состоянием.
Термин "субъект" относится к животному, включающему без ограничения примата (например, человека), корову, свинью, овцу, козу, лошадь, собаку, кошку, кролика, крысу или мышь. Термины "субъект" и "пациент" использованы в изобретении взаимозаменяемо по отношению, например, к млекопитающему субъекту, такому как человек, в одном варианте осуществления, по отношению к человеку.
Понятия "лечить", "осуществлять лечение" и "лечение" включают облегчение или прекращение нарушения, заболевания или состояния, или одного или больше симптомов, связанных с нарушением, заболеванием или состоянием; или облегчение или уничтожение непосредственно причины (причин) нарушения, заболевания или состояния.
Понятия "предупреждать", "предупреждение" включают подавление симптома конкретного заболевания или нарушения. В некоторых вариантах осуществления пациенты с семейным анамнезом рака или лейкоза являются кандидатами для профилактических схем. В общем, термин "предупреждение" относится к введению препарата до начала симптомов, в частности, пациента с риском ракового заболевания.
Как используется в изобретении и если не указано иначе, понятия "контролировать", "контролирующий" и "контроль" охватывают предупреждение рецидива конкретного заболевания или нарушения у пациента, страдавшего этим заболеванием, удлинение времени ремиссии у пациента, который страдает этим заболеванием или нарушением, уменьшение смертности больных, и/или поддержание уменьшения тяжести или отсутствия симптома, связанного с контролируемым заболеванием или состоянием.
Термин "контактировать" или "контакт" относятся к совместному сближению терапевтического агента и клетки или ткани таким образом, что в результате такого контакта возникает физиологический и/или химический эффект. Контакт может иметь место in vitro, ex vivo или in vivo. В одном варианте осуществления терапевтический агент контактирует с клеткой в клеточной культуре (in vitro) для определения эффекта терапевтического агента в клетке. В другом варианте осуществления контакт терапевтического агента с клеткой или тканью включает введение терапевтического агента субъекту, имеющему клетку или ткань для контакта.
Термин "терапевтически эффективное количество" включает количество соединения, которое при введении является достаточным для предупреждения развития или для некоторого облегчения одного или больше симптомов нарушения, заболевания или состояния, которое лечат. Термин "терапевтически эффективное количество" также относится к количеству соединения, которое является достаточным для проявления биологического или клинического ответа биологической молекулы (например, белка, фермента, РНК или ДНК), клетки, ткани, системы, животного или человека, к которому стремится исследователь, ветеринар, врач или клиницист.
Понятия "совместное введение" и "в комбинации с" включают введение двух терапевтических агентов (например, AC220 и второго противоракового агента, такого как даунорубицин или этопозид) или одновременно, или в качестве сопутствующего агента, или последовательно без конкретных ограничений времени. В одном варианте осуществления оба агента присутствуют в клетке или в организме пациента в одно и то же время или проявляют свой биологический или терапевтический эффект в одно и то же время. В одном варианте осуществления два терапевтических агента находятся в одной композиции или в стандартной лекарственной форме. В другом варианте осуществления два терапевтических агента находятся в отдельных композициях или в стандартных лекарственных формах.
Используемый в изобретении термин "нуклеозидный аналог" обозначает органическое соединение, содержащее нуклеооснование, связанное с углеводным кольцом посредством атома азота нуклеооснования. В одном варианте осуществления нуклеооснование представляет собой азотистое основание. В другом варианте осуществления углеводным кольцом является сахарное кольцо. Нуклеозидный аналог необязательно содержит фосфатную группу. Примеры азотистых оснований включают без ограничения пурин и его производные, такие как аденин, гуанин и гипоксантин, и пиримидин и его производные, такие как цитозин, урацил, тимин и 4-амино-триазин-2-(1Н)-он (аза-производное цитозина). Нуклеозидный аналог, предназначенный для использования в изобретении, представляет собой антиметаболит неопластической клетки, то есть, соединение, которое нарушает биологические функции неопластических клеток. Например, нуклеозидный аналог может нарушать метилирование ДНК, синтез ДНК и другие функции, связанные с делением клетки.
Используемый в изобретении термин "антрациклин" относится к типу противоопухолевых антибиотиков, которые получают из конкретных типов бактерий Streptomyces или являются их производными.
Используемый в изобретении термин "ингибитор топоизомеразы" относится к веществу, которое блокирует ферменты топоизомеразы.
Используемое в изобретении понятие "не пропущенный день" предназначено для обозначения дня, когда вводят по меньшей мере одно из соединений формулы (I) или его соль, сольват, сложный эфир и/или пролекарство, или второй агент, такой как нуклеозидный аналог, антрациклин или ингибитор топоизомеразы.
"Одновременное введение" означает, что нуклеозидный аналог, антрациклин или ингибитор топоизомеразы и соединение со структурной формулой (I) или его соль, сольват, сложный эфир и/или пролекарство вводят в один день. Для одновременного введения нуклеозидный аналог, антрациклин или ингибитор топоизомеразы, и соединение со структурной формулой (I) или его соль, сольват, сложный эфир и/или пролекарство можно вводить в одно и то же время или по одному.
"Последовательное введение" означает, что в течение двух или больше дней постоянного совместного введения без какого-либо пропущенного дня, в любой данный день вводят только что-либо одно из нуклеозидного аналога, антрациклина или ингибитора топоизомеразы и соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства.
"Накладывающееся по времени введение" означает, что в течение двух или больше дней постоянного совместного введения без какого-либо пропущенного дня имеется по меньшей мере один день одновременного введения и по меньшей мере один день, когда вводят только одно из нуклеозидного аналога, антрациклина или ингибитора топоизомеразы и соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства.
"Введение с интервалами" означает период совместного введения по меньшей мере с одним пропущенным днем. "Непрерывное введение" означает период совместного введения без какого-либо пропущенного дня. Непрерывное введение может быть одновременным, последовательным или накладывающимся по времени, как описано выше.
Термин "фармацевтически приемлемый носитель", "фармацевтически приемлемый наполнитель", "физиологически приемлемый носитель" или "физиологически приемлемый наполнитель" относятся к фармацевтически приемлемому материалу, композиции или носителю, такому как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал. В одном варианте осуществления каждый компонент является "фармацевтически приемлемым" в том смысле, что он совместим с другими компонентами фармацевтической рецептуры и подходит для использования в контакте с тканью или органом людей и животных без чрезмерной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений, соизмеримых с приемлемым соотношением пользы/риска. См. публикации: Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition, Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; и Handbook of Pharmaceutical Additives, 3rd Edition, Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, 2nd Edition, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2009.
Понятие "примерно" или "около" означает приемлемую погрешность в конкретном значении, определяемую рядовым специалистом в данной области техники, которая частично зависит от методики измерения или определения значения. В конкретных вариантах осуществления понятия "примерно" или "около" находятся в пределах 1, 2, 3 или 4 значений стандартного отклонения. В конкретных вариантах осуществления понятия "примерно" или "около" находятся в пределах 50%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% или 0,05% данного значения или диапазона.
Термины "активный компонент" и "активное вещество" относятся к соединению, которое вводят субъекту единственным или в комбинации с одним или больше фармацевтически приемлемыми наполнителями, для лечения, предупреждения или улучшения одного или более симптомов состояния, нарушения или заболевания. Используемые в изобретении понятия "активный компонент" и "активное вещество" могут представлять собой оптически активный изомер соединения, описанного в изобретении.
Термины "лекарство", "терапевтический агент" и "химиотерапевтический агент" относятся к соединению или фармацевтической композиции, которую вводят субъекту для лечения, предупреждения или улучшения одного или больше симптомов состояния, нарушения или заболевания.
Используемый в изобретении термин "гидрат", если не указано иначе, означает соединение согласно изобретению или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными связями.
Используемый в изобретении термин "сольват", если не указано иначе, означает сольват, образованный ассоциацией одной или больше молекул растворителя и соединения согласно изобретению. Термин "сольват" включает гидраты (например, его моногидрат, дигидрат, тригидрат, тетрагидрат и т.п.).
Термин "алкил" относится к прямой или разветвленной углеводородной цепи, состоящей исключительно из атомов углерода и водорода, не содержащей ненасыщенности, и имеющей от одного до десяти атомов углерода, которая присоединена к остальной части молекулы посредством одинарной связи, например, метил, этил, н-пропил, 1-метилэтил (изо-пропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил) и тому подобное.
Термин "алкенил" относится к прямой или разветвленной углеводородной цепи, состоящей исключительно из атомов углерода и водорода, содержащей по меньшей мере одну двойную связь, имеющей от двух до десяти атомов углерода, которая присоединена к остальной части молекулы посредством одинарной связи или двойной связи, например, этенил, проп-1-енил, бут-1-енил, пент-1-енил, пента-1,4-диенил и тому подобное.
Термин "алкинил" относится к прямой или разветвленной углеводородной цепи, состоящей исключительно из атомов углерода и водорода, содержащей по меньшей мере одну тройную связь, имеющей от двух до десяти атомов углерода, которая присоединена к остальной части молекулы посредством одинарной связи или тройной связи, например, этинил, проп-1-инил, бут-1-инил, пент-1-инил, пент-3-инил и тому подобное.
Термины "алкилен" и "алкиленовая цепь" относятся к прямой или разветвленной двухвалентной углеводородной цепи, состоящей исключительно из углерода и водорода, не содержащей ненасыщенности и имеющей от одного до восьми атомов углерода, например, метилен, этилен, пропилен, n-бутилен и тому подобное. Алкиленовая цепь может быть присоединена к остальной части молекулы посредством любых двух атомов углерода в пределах цепи.
Термин "алкокси" относится к группе, имеющей формулу -OR-, в которой R является алкилом или галогеналкилом. "Необязательно замещенный алкокси" относится к группе, имеющей формулу -OR-, в которой R представляет собой необязательно замещенный алкил, как указано в изобретении.
Термин "амино" относится к группе, имеющей формулу -NR'R", в которой каждый R' и R" независимо являются водородом, алкилом или галогеналкилом. "Необязательно замещенный амино" относится к группе, имеющей формулу -NR'R", в которой один или оба из R' и R" являются необязательно замещенными алкилами, как указано в изобретении.
Термин "арил" относится к группе карбоциклической кольцевой системы, в которой по меньшей мере одно из колец является ароматическим. Арил может быть полностью ароматическим, примерами чего являются фенил, нафтил, антраценил, аценафтиленил, азуленил, флуоренил, инденил и пиренил. Арил также может содержать ароматическое кольцо в комбинации с неароматическим кольцом, такими примерами являются аценафен, инден и флуорен.
Термин "аралкил" относится к группе формулы -RaRb, в которой Ra представляет собой алкильную группу, как упомянуто выше, замещенную Rb, арильной группой, упомянутой выше, например, бензилом. И алкильные, и арильные группы могут быть необязательно замещенными, как указано в изобретении.
Термин "циклоалкил" относится к устойчивой одновалентной моноциклической или бициклической углеводородной группе, состоящей исключительно из атомов углерода и водорода, имеющей от трех до десяти атомов углерода, которая является насыщенной и присоединяется к остальной части молекулы посредством одинарной связи, например, циклопропил, циклобутил, циклопентил, циклогексил, декалинил, норбоман, норбомен, адамантил, бицикло[2.2.2]октан и тому подобное.
Термин "циклоалкилалкил" относится к группе формулы -RaRd, в которой Ra представляет собой алкильную группу согласно определению выше, и Rd является циклоалкилной группой согласно определению выше. Алкильная группа и циклоалкильная группа могут быть необязательно замещенными согласно изобретению.
Термины "галоген" относится к F, Cl, Br или I.
"Галогеналкил" относится к алкильной группе, в которой один или больше атомов водорода замещены галогеном. Такие группы включают без ограничения хлорметил, трифторметил и 1-хлор-2-фторэтил.
"Галогеналкенил" относится к алкенильной группе, в которой один или больше атомов водорода замещены галогеном. Такие группы включают без ограничения 1-хлор-2-фторэтенил.
Термин "гетероциклил" относится к устойчивому кольцу с количеством членов от 3 до 15, которое состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. В одном варианте осуществления гетероциклическая кольцевая система может представлять собой моноциклическое, бициклическое или трициклическое кольцо или тетрациклическую кольцевую систему, которая может включать слитые или соединенные кольцевые системы; и азот или атомы серы в гетероциклической кольцевой системе необязательно могут быть окисленными; атом азота может быть необязательно кватернизированным; и гетероциклильная группа может быть частично или полностью насыщенной или ароматической. Гетероциклическая кольцевая система может быть присоединена к основной структуре в любом гетероатоме или атоме углерода, что приводит к образованию устойчивого соединения. Примеры гетероциклических радикалов включают морфолинилил, пиперидинил, пиперазинил, пиранил, пирролидинил и другие.
"Гетероаралкил" относится к группе формулы -RaRf, в которой Ra представляет собой алкильную группу, определение которой приведено выше, и Rf является гетероарильной группой, упомянутой в изобретении. Алкильная группа и гетероарильная группа могут необязательно замещаться, как указано в изобретении.
"Гетероарил" относится к гетероциклильной группе, определение которой приведено выше, которая является ароматической. Гетероарильная группа может быть присоединена к основной структуре в любом гетероатоме или атоме углерода, что приводит к образованию устойчивого соединения. Примеры таких гетероарильных групп включают в себе без ограничения: акридинил, бензимидазолил, бензиндолил, бензизоксазинил, бензо[4,6]имидазо[1,2-α]пиридинил, бензофуранил, бензонафтофуранил, бензотиадиазолил, бензотиазолил, бензотиофенил, бензотриазолил, бензотиопиранил, бензоксазинил, бензоксазолил, бензотиазолил, β-карболинил, карбазолил, циннолинил, дибензофуранил, фуранил, имидазолил, имидазопиридинил, имидазотиазолил, индазолил, индолизинил, индолил, изобензотиенил, изоиндолинил, изохинолинил, изотиазолидинил, изотиазолил, нафтиридинил, октагидроиндолил, октагидроизоиндолил, оксазолидинонил, оксазолидинил, оксазолопиридинил, оксазолил, оксиранил, перимидинил, фенантридинил, фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пиразинил, пиразолил, пиридазинил, пиридинил, пиридопиридинил, пиримидинил, пирролил; хиназолинил, хинолинил, хиноксалинил, тетразолил, тиадиазолил, тиазолил, тиофенил, триазинил и триазолил.
"Гетероциклилалкил" относится к группе формулы -RaRe, в которой Ra представляет собой алкильную группу, определение которой дано выше, и Re является гетероциклильной группой по изобретению. Алкильная группа и гетероциклильная группа могут необязательно замещаться, как указано в изобретении.
"Гетероциклилалкокси" относится к группе формулы -ORaRe, в которой -RaRe является гетероциклилалкильной группой, как определено выше. Алкильная группа и гетероциклильная группа могут необязательно замещаться, как указано в изобретении.
"Необязательно замещенный алкил", "необязательно замещенный алкенил" и "необязательно замещенный алкинил" относятся, соответственно, к алкильным группам, алкенильным группам и алкинильным группам, которые могут необязательно замещаться одним или больше заместителями, независимо выбранными из группы, состоящей из нитро, галоген, азидо, циано, циклоалкила, гетероарила, гетероциклила, -ORX, -N(Ry)(Rz), -SRX, -C(J)RX, -C(J)ORX, -C(J)N(Ry)(Rz), -C(J)SRX, -S(O)tRw (где t равен 1 или 2), -OC(J)RX, -OC(J)ORX, -OC(J)N(Ry)(Rz), -OC(J)SRX, -N(RX)C(J)RX, N(RX)C(J)RX, -N(Rx)C(J)N(Ry)(Rz), -N(RX)C(J)SRX, -Si(Rw)3, -N(RX)S(O)2RW, -N(Rx)S(O)2N(Ry)(Rz), -S(O)2N(Ry)(Rz), -P(O)(RV)2, -OP(O)(RV)2, -C(J)N(RX)S(O)2RW, -C(J)N(RX)N(RX)S(O)2RW, -C(RX)=N(ORX) и -C(Rx)=NN(Ry)(Rz), в которых:
Rx представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Ry и Rz независимо представляют собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил; аралкил, гетероарил или гетероаралкил; или
Ry и Rz вместе с атомом азота, к которому они присоединены, образуют гетероциклил или гетероарил;
Rw представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
Rv представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил, гетероаралкил, гидрокси, -ORx или -N(Ry)(Rz); и J представляет собой O, NRX или S.
Если конкретно в настоящем описании не указано иначе, подразумевается, что замещение может происходить в любом атоме углерода алкильной, алкенильной или алкинильной группы.
Термины "необязательно замещенный арил", "необязательно замещенный циклоалкил", "необязательно замещенный гетероарил" и "необязательно замещенный гетероциклил" относятся к арильной, циклоалкильной, гетероарильной и гетероциклильной группам, соответственно, которые необязательно замещаются одним или больше заместителями, выбранными из группы, состоящей из нитро, галогена, галогеналкила, галогеналкенила, азидо, циано, оксо, тиоксо, имино, алкила, алкенила, алкинила, циклоалкила, циклоалкилалкила, гетероциклила, гетероциклилалкила, гетероарила, гетероаралкила, -RυORx, -RυN(Ry(R2), -RυSRx, -RυC(J)Rx, -RυC(J)ORx, -RυC(J)N(Ry)(Rz), -RυC(J)SRx, -RυS(O)tRw (где t равен 1 или 2), -RυOC(J)Rx, -RυOC(J)ORx, -RυOC(J)N(Ry)(Rz), -RυOC(J)SRx, -RυN(Rx)C(J)Rx, -RυN(Rx)C(J)ORx, -Rυ(Rx)C(J)N(Ry)(Rz), -RυN(Rx)C(J)SRx, -RυSi(Rw)3, -RυN(Rx)S(O)2Rw, -RυN(Rx)S(O)2N(Ry)(Rz), -RυS(O)2N(Ry)(Rz), -RυP(O)(Rv)2, -RυOP(O)(Rv)2, -RυC(J)N(Rx)S(O)2Rw, -RυC(J)N(Rx)N(Rx)S(O)2Rw, -RυC(Rx)=N(ORx) и -RυC(Rx)=NN(Ry)(Rz), в которых:
каждый Rυ независимо представляет собой алкилен или прямую связь;
каждый Rv независимо представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил, гетероаралкил, гидрокси, -ORx или -N(Ry)(Rz);
Rw представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Rx независимо представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
каждый Ry и Rz независимо представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил, аралкил, гетероарил или гетероаралкил;
Ry и Rz вместе с атомом азота, к которому они присоединены, образуют гетероцикл или гетероарил; и
J является O, NRX или S.
Если конкретно в настоящем описании не указано иначе, подразумевается, что замещение может происходить в любом атоме группы циклоалкила, гетероциклила, арила или гетероарила.
"Оксо" обозначает =О.
Соединения для использования в изобретении, а именно, нуклеозидные аналоги, а также соединения формулы (I) и его подтипы и конкретные варианты осуществления, включают с себя указанные соединения и их фармацевтически приемлемые производные. Используемый в изобретении термин "фармацевтически приемлемые производные" соединения включают соли, сложные эфиры, энольные эфиры, энольные сложные эфиры, ацетали, кетали, ортоэфиры, гемиацетали, гемикетали, кислоты, основания, сольваты, и/или их пролекарства. Такие производные могут быть легко изготовлены специалистами в данной области техники с помощью известных способов дериватизации. Полученные соединения можно вводить животным или людям без значительных токсических эффектов, или они являются фармацевтически активными, или представляют собой пролекарства.
Термин "соли" означает, что любая кислотная и/или основная аддитивная соль соединения по изобретению является его фармацевтически приемлемой солью. Фармацевтически приемлемой солью называют соль соединения согласно изобретению, которая по результатам тщательной медицинской оценки подходит для применения в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции, и т.п., что соизмеримо с приемлемым соотношением пользы/риска, в целом является растворимой или диспергируемой в воде или масле и эффективной для предназначенного применения. В случае возможности применения и совместимости с химическими свойствами никотинового десенсибилизатора, указанный термин включает фармацевтически приемлемые кислотно-аддитивные соли и фармацевтически приемлемые основные аддитивные соли. Перечень подходящих солей можно найти, например, в издании S. M. Birge et al., J. Pharm. Sci., 1911, 66, стр 1-19. Фармацевтически приемлемые соли включают без ограничения соли аминов, например, без ограничения, соли следующих соединений: N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммоний, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглукамин, прокаин, N-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-ил-метил-бензимидазол, диэтиламин и другие алкиламины, пиперазин и трис(гидроксиметил)аминометан; соли щелочных металлов, например, без ограничения, соли лития, калия и натрия; соли щелочноземельных металлов, например, без ограничения, соли бария, кальция и магния; соли переходных металлов, например, без ограничения, соли цинка; и другие соли металлов, например, без ограничения, натрия гидрофосфат и динатрия фосфат; и также включают без ограничения соли минеральных кислот, например, без ограничения, гидрохлориды и сульфаты; и соли органических кислот, например, без ограничения, ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты.
Термин "сложный эфир" подразумевает любой сложный эфир соединения настоящего изобретения, в молекуле которого любая из функциональных групп -COOH замещена функциональной группой -COOR, в которой функциональный остаток сложного эфира R представляет собой любую углерод-содержащую группу, которая образует устойчивую эфирную группу, включающую без ограничения алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероциклил, гетероциклилалкил и их замещенные производные. Термин "сложный эфир" включает без ограничения его фармацевтически приемлемые сложные эфиры. Фармацевтически приемлемые сложные эфиры включают без ограничения сложные эфиры кислых групп алкила, алкенила, алкинила, арила, гетероарила, аралкила, гетероаралкила, циклоалкила и гетероциклила, включающие без ограничения карбоновые кислоты, фосфорные кислоты, фосфиновые кислоты, сульфоновые кислоты, сульфиновые кислоты и бороновые кислоты.
Фармацевтически приемлемые энольные эфиры включают без ограничения производные формулы C=C(OR), в которой R представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил. Фармацевтически приемлемые энольные сложные эфиры включают без ограничения производные формулы C=C(OC(O)R), в которой R представляет собой водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, циклоалкил или гетероциклил.
"Пролекарство" представляет собой соединение, которое при введении in vivo метаболизируется путем одного или больше этапов или механизмов, или иным образом превращается в биологически, фармацевтически или терапевтически активную форму соединения. Для изготовления пролекарства модифицируют фармацевтически активное соединение таким образом, что активное соединение будет регенерировано посредством метаболических процессов. Можно разрабатывать пролекарства для изменения метаболической стабильности или параметров транспорта препарата, для маскировки побочных эффектов или токсичности, для улучшения вкуса препарата или изменения других характеристик или свойства препарата. Основываясь на знании фармакодинамических процессов и метаболизма лекарств in vivo, специалисты в данной области техники, при известном фармацевтически активном соединении, могут разрабатывать пролекарства для этого соединения (см., например, Nogrady (2005) Medicinal Chemistry A Biochemical Approach, Oxford University Press, New York).
Используемое в изобретении понятие "по существу чистое" означает достаточную степень гомогенности с предполагаемым отсутствием легко обнаружимых примесей, что определяют стандартными аналитическими способами, такими как тонкослойная хроматография (ТСХ), гель-электрофорез, высокоэффективная жидкостная хроматография (ВЭЖХ) и масс-спектрометрия (МС), применяемые специалистами в данной области техники для оценки степени чистоты, или означает такую достаточную степень чистоты, что дополнительная очистка не будет определяемо изменять физические и химические свойства вещества, например, ферментативную и биологическую активность. Способы очистки соединений для получения по существу химически чистых соединений известны специалистам в данной области. Вместе с тем, по существу химически чистое соединение может быть смесью стереоизомеров. В таких случаях дополнительная очистка может увеличивать конкретное действие соединения.
Если соединение может принимать альтернативные таутомерные, региоизомерные и/или стереоизомерные формы, предполагается, что все альтернативные изомеры входят в объем формулы настоящего изобретения, если конкретно не указано иначе. Например, если в описании соединения упомянуто наличие одной из двух таутомерных форм, предполагается, что оба таутомера входят в объем изобретения.
Таким образом, соединения, рассматриваемые в изобретении, могут быть энантиомерно чистыми, или представлять собой стереоизомерные или диастереомерные смеси.
Подразумевается, что соединения, описанные в изобретении, могут содержать хиральные центры. Такие хиральные центры могут иметь или (R) или (S) конфигурацию, или могут представлять собой их смесь. Подразумевается, что хиральные центры соединений по изобретению могут подвергаться эпимеризации in vivo. Также специалистам в данной области техники известно, что для соединений, которые подвергаются эпимеризации in vivo, введение соединения в его (R) форме эквивалентно введению соединения в (S) форме.
Можно изготовлять оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)-изомеры с помощью хиральных синтонов или хиральных реактивов, или растворять с использованием общепринятых способов, таких как обращенно-фазовая ВЭЖХ.
Используемый в изобретении термин "энантиомерно чистый" или "чистый энантиомер" обозначает, что соединение содержит энантиомер в количестве более 75% веса, более 80% веса, более 85% веса, более 90% веса, более 91% веса, более 92% веса, более 93% веса, более 94% веса, более 95% веса, более 96% веса, более 97% веса, более 98% веса, более 98,5% веса, более 99% веса, более 99,2% веса, более 99,5% веса, более 99,6% веса, более 99,7% веса, более 99,8% веса или более 99,9% веса.
Если не указано количество любого данного заместителя (например, галогеналкила), может присутствовать один или больше заместителей. Например, "галогеналкил" может включать один или больше одинаковых или разных галогенов.
Если в описании изобретения имеется какое-либо несоответствие между химическим названием и химической структурой, структура предпочтительно является контролем.
Используемые в изобретении сокращения для любых защитных групп, аминокислот и других соединений, если не обозначено иначе, указаны согласно их общепринятым применениям, признанными сокращениями, или в соответствии с Комиссией IUPAC-IUB по биохимической номенклатуре (см. Biochem. 1972, 77:942-944).
Вышеописанные имидазолтиазольные соединения формулы (I) можно синтезировать с помощью известных специалисту в данной области способов. Определенные конкретные методики получения имидазолтиазольных соединений описаны в международной патентной заявке № PCT/US2007/006613 под названием "Имидазолтиазольные соединения для лечения заболевания" ("Imidazolothiazole Compounds for the Treatment of Disease") и опубликованы под номером WO 2007/109120, содержание указанной заявки включено в изобретение со ссылкой полностью во всех целях.
B. Соединения формулы (I)
В конкретных вариантах осуществления изобретение относится к имидазолтиазольным соединениям формулы (I) или его солям, сольватам, сложным эфирам и/или пролекарствам, которые можно применять в комбинации с нуклеозидным аналогом, антрациклином или ингибитором топоизомеразы согласно изобретению, для лечения пролиферативных заболеваний. В конкретных вариантах осуществления изобретение относится к имидазолтиазольным соединениям формулы (I) или к его солям, сольватам, сложным эфирам и/или пролекарствам, которые можно применять в комбинации с нуклеозидными аналогами согласно изобретению для лечения гематологических неопластических заболеваний.
В одном варианте осуществления формулы (I) X2 представляет собой -O-.
В другом варианте осуществления формулы (I) X представляет собой -S-.
В другом варианте осуществления формулы (I) два из трех R0 являются водородом; и другой R0 представляет собой 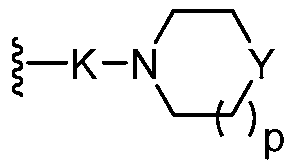 . В одном варианте осуществления Y представляет собой -О-. В другом варианте осуществления K представляет собой -O(CH2)q-, в котором атом кислорода присоединен к фенильному кольцу конденсированного трициклического ядра. В другом варианте осуществления p является целым числом 1. В другом варианте осуществления q является целым числом 2.
. В одном варианте осуществления Y представляет собой -О-. В другом варианте осуществления K представляет собой -O(CH2)q-, в котором атом кислорода присоединен к фенильному кольцу конденсированного трициклического ядра. В другом варианте осуществления p является целым числом 1. В другом варианте осуществления q является целым числом 2.
В другом варианте осуществления формулы (I) R2 является водородом.
В другом варианте осуществления формулы (I) R3 представляет собой водород.
В другом варианте осуществления формулы (I) один из R10 представляет собой водород, и другой R10 является необязательно замещенным алкилом.
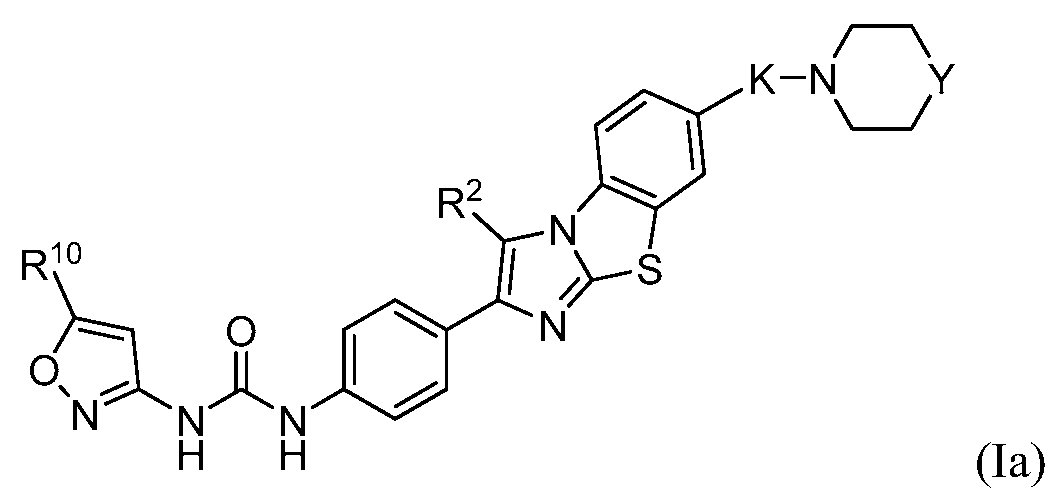
В одном варианте осуществления формулы (I) соединение может быть представлено структурной формулой (Ia):
 ,
,
в которой
K представляет собой -O(CH2)q-, -(CH2)qO-, -(CH2)q или -(CH2)qO(CH2)q-;
каждый q независимо равен от 1 до 4;
Y представляет собой -О-, -S-, или -N(R14)-;
R2 независимо представляет собой водород, галоген, необязательно замещенный алкил или -OR12;
R10 представляет собой водород, галоген, необязательно замещенный алкил или необязательно замещенный циклоалкил; и
R12 является водородом или необязательно замещенным алкилом.
В другом варианте осуществления формулы (I) R3 является водородом.
В конкретных вариантах осуществления соединение со структурной формулой (I) выбирают из группы, состоящей из следующих соединений:
3-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-морфолин-4-ил-этил)-пропионамид;
3-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-пиперидин-1-ил-этил)-пропионамид;
3-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-пирролидин-1-ил-этил)-пропионамид;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(4-метил-пиперазин-1-ил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-(4-{7-[2-(4-метил-пиперазин-1-ил)-этокси]-бензо[d]имидазо[2,1-b]тиазол-2-ил}-фенил)-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(2-пиперидин-1-ил-этокси)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(3-морфолин-4-ил-пропокси)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-(4-{7-[3-(4-метил-пиперазин-1-ил)-пропокси]-бензо[d]имидазо[2,1-b]тиазол-2-ил}-фенил)-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-(4-{7-[3-(4-метансульфонил-пиперазин-1-ил)-пропокси]-бензо[d]имидазо[2,1-b]тиазол-2-ил}-фенил)-мочевина;
N-(5-трет-бутил-изоксазол-3-ил)-N'-(4-{7-[3-(4-этил-пиперазин-1-ил)пропил]имидазо[2,1-b][1,3]бензотиазол-2-ил}фенил)мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(3-морфолин-4-ил-3-оксо-пропил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
3-(5-трет-бутил-изоксазол-3-ил)-1-метил-1-{4-[7-(3-морфолин-4-ил-пропил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(3-морфолин-4-ил-пропил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-[4-(7-морфолин-4-ил-бензо[d]имидазо[2,1-b]тиазол-2-ил)-фенил]-мочевина;
N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(3-пиперидин-1-ил-пропил)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевина;
N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[5-(2-морфолин-4-ил-этокси)имидазо[2,1-6][1,3]бензотиазол-2-ил]фенил}мочевина;
2-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-морфолин-4-ил-этил)-ацетамид;
2-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-пиперидин-1-ил-этил)-ацетамид;
2-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-пирролидин-1-ил-этил)-ацетамид;
1-(5-трет-бутил-изоксазол-3-ил)-3-(4-{7-[2-(4-этил-пиперазин-1-ил)-2-оксо-этил]-бензо[d]имидазо[2,1-b]тиазол-2-ил}-фенил)-мочевина и
1-(5-трет-бутил-изоксазол-3-ил)-3-[4-(7-морфолин-4-илметил-имидазо[2,1-b][1,3]бензотиазол-2-ил)-фенил]-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(4-этил-пиперазин-1-илметил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-[4-(7-пиперидин-1-илметил-бензо[d]имидазо[2,1-b]тиазол-2-ил)-фенил]-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(2-морфолин-4-ил-2-оксо-этил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(2-морфолин-4-ил-этил)-имидазо[2,1-b][1,3]бензотиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(2-пиперидин-1-ил-этил)-имидазо[2,1-b][1,3]бензотиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-(4-{7-[2-(4-этил-пиперазин-1-ил)-этил]-имидазо[2,1-b][1,3]бензотиазол-2-ил}-фенил)-мочевина;
N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[6-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевина;
(2-морфолин-4-ил-этил)-амид 2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновой кислоты;
(2-пиперидин-1-ил-этил)-амид 2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновой кислоты;
(2-пирролидин-1-ил-этил)-амид 2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновой кислоты;
(2-диэтиламино-этил)-амид 2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновой кислоты;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(4-этил-пиперазин-1-карбонил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-пиперазин-1-карбонил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина; и
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(4-метил-пиперазин-1-карбонил)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина.
1-(5-трет-бутил-изоксазол-3-ил)-3-[4-(7-гидрокси-бензо[d]имидазо[2,1-b]тиазол-2-ил)-фенил]-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-[4-(7-метокси-бензо[d]имидазо[2,1-b]тиазол-2-ил)-фенил]-мочевина;
1-(5-трет-бутил-изоксазол-3-ил)-3-{4-[7-(2-диэтиламино-этокси)-бензо[d]имидазо[2,1-b]тиазол-2-ил]-фенил}-мочевина;
этил{2-[4-({[(5-трет-бутилизоксазол-3-ил)амино]карбонил}амино)фенил]имидазо[2,1-b][1,3]бензотиазол-7-ил}ацетат;
3-{2-[4-({[(5-трет-бутилизоксазол-3-ил)амино]карбонил}амино)фенил]имидазо[2,1-b][1,3]бензотиазол-7-ил}уксусная кислота;
2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил сложный эфир пирролидин-2-карбоновой кислоты;
этил-3-{2-[4-({[(5-трет-бутилизоксазол-3-ил)амино]карбонил}амино)фенил]имидазо[2,1-b][1,3]бензотиазол-7-ил}пропаноат;
3-{2-[4-({[(5-трет-бутилизоксазол-3-ил)амино]карбонил}амино)фенил]имидазо[2,1-b][1,3]бензотиазол-7-ил}пропановая кислота
3-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N,N-диэтил-пропионамид;
2-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-диэтиламино-этил)-ацетамид;
3-(2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил)-N-(2-диэтиламино-этил)-пропионамид;
2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-ил сложный эфир 2-амино-3-метил масляной кислоты;
этилэфир 2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновой кислоты; и
2-{4-[3-(5-трет-бутил-изоксазол-3-ил)-уреидо]-фенил}-бензо[d]имидазо[2,1-b]тиазол-7-карбоновая кислота.
В конкретных вариантах осуществления соединение, подходящее для использования в способах по изобретению, представляет собой N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевину, также известное как соединение AC220, имеещее структуру формулы A:
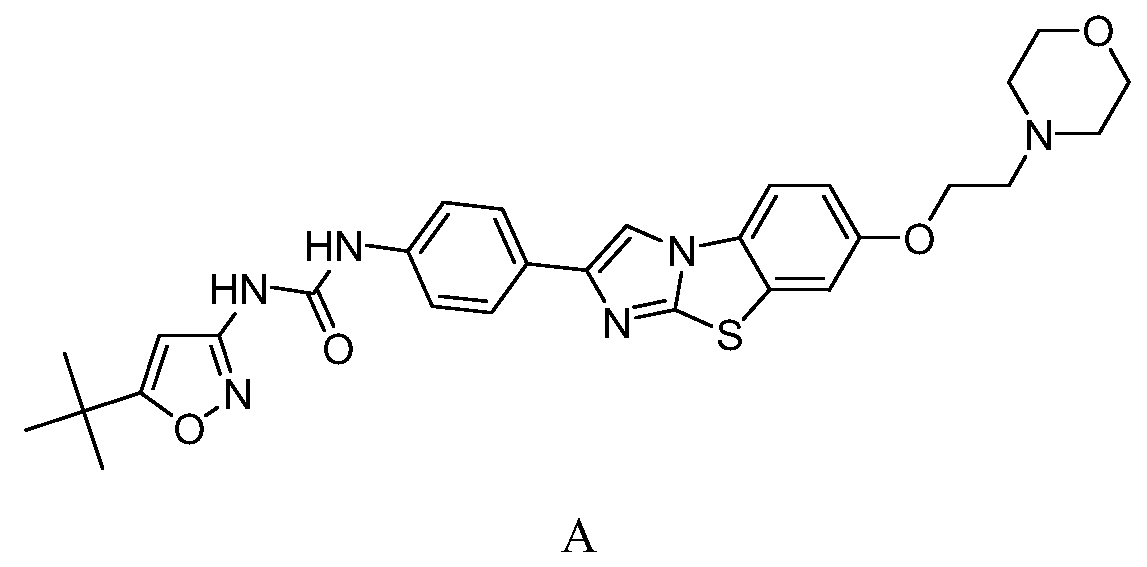
или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат.
В конкретных вариантах осуществления AC220 можно изготовлять согласно способам, описанным в патенте США, № публикации 2007/0232604, который включен в изобретении со ссылкой во всей полноте. В конкретных вариантах осуществления AC220 можно изготовлять согласно способам, описанным в предварительной патентной заявке № 61/258,550, которая включена в изобретение со ссылкой во всей полноте. Указанное соединение также можно синтезировать с помощью других способов, очевидных для специалистов в данной области техники, на основании идеи настоящего изобретения.
В одном варианте осуществления соединение, подходящее для использования в способах по изобретению, представляет собой свободное основание AC220 или его фармацевтически приемлемый сольват. В одном варианте осуществления свободное основание представляет собой твердую форму. В другом варианте осуществления свободное основание является твердым в аморфной форме. Еще в одном варианте осуществления свободное основание является твердым в кристаллической форме. Твердые формы AC220 можно изготовлять согласно способу, описанному в патенте США, № публикации 2009/0123418, который включен в изобретение со ссылкой во всей полноте; или с помощью других способов, известных в данной области техники.
В другом варианте осуществления свободное основание представляет собой фармацевтически приемлемый сольват. В одном варианте осуществления свободное основание является гидратом. В другом варианте осуществления фармацевтически приемлемый растворитель представляет собой метанольный сольват. Метанольный сольват AC220 можно изготовлять согласно способу, описанному в патенте США, № публикации 2009/0123418; или с помощью других способов, известных в данной области техники.
Еще в одном варианте осуществления соединение, используемое в способах по изобретению, представляет собой фармацевтически приемлемую соль AC220, которая включает без ограничения соли следующих соединений: ацетат, адипат, альгинат, аспартат, бензоат, бензенсульфонат (безилат), бисульфат, бутират, цитрат, камфорат, камфоросульфонат, циклопентанпропионат, диглюконат, додецилсульфат, 1,2-этандисульфонат (эдизилат), этансульфонат (эзилат), формиат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат (мезилат), 2-нафталинсульфонат (напзилат), никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат или ундеканоат.
В одном варианте осуществления фармацевтически приемлемая соль представляет собой соли гидрохлорида, гидробромида, сульфата, мезилата, эзилата, эдизилата, безилата, тозилата или напзилата AC220. В другом варианте осуществления фармацевтически приемлемой солью является хлористоводородная соль AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является гидробромид AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является сульфат AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является мезилат AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является эзилат AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является эдизилат AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является безилат AC220. Еще в одном варианте осуществления фармацевтически приемлемой солью является тозилат AC220. Также в другом варианте осуществления фармацевтически приемлемой солью является напзилат AC220. Фармацевтически приемлемую соль AC220 можно изготовить согласно способу, описанному в патенте США № публикации 2009/0123418; который включен в изобретение со ссылкой во всей полноте. Фармацевтически приемлемую соль AC220 также можно изготовить с помощью других способов, известных в данной области техники.
Если не указана конкретная стереохимия, предполагается, что используемое в изобретении соединение AC220 охватывает все возможные стереоизомеры. Если структурные изомеры AC220 являются взаимозаменяемыми, что обусловлено низкоэнергетическим барьером, AC220 может существовать в виде единственного таутомера или смеси таутомеров. Это может происходить в виде протонного таутомеризма в соединении, которое содержит, например, группу мочевины; или так называемого валентного таутомеризма в соединении, которые содержат ароматическую функциональную группу.
Соединение согласно изобретению также может быть представлено в виде пролекарства, которое представляет собой функциональное производное соединения формулы (I) и легко превращается в исходное соединение in vivo. Часто пролекарства имеют пользу, поскольку в некоторых ситуациях их введение может осуществляться легче, чем введение исходного соединения. Например, в отличие от исходного соединения, они могут обладать биодоступностью при пероральном введении. Пролекарства также могут иметь повышенную растворимость в фармацевтических композициях по сравнению с исходным соединением. Пролекарства могут превращаться в исходный препарат посредством разных механизмов, включающих ферментативные процессы и метаболический гидролиз. См. ссылки: Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. in "Design of Biopharmaceutical Properties through Prodrugs and Analogs," Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application," Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs," Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265-287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech. 1998, 11, 345-365; Gaignault et al., Pract. Med. Chem. 1996, 671-696; Asgharnejad in "Transport Processes in Pharmaceutical Systems," Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. Drug Metab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev. 1992, 8, 1-38; Fleisher et al., Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher et al., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc., Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 49-59; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148-155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; and Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507.
C. Вторые агенты
В способах и соединениях, рассмотренных в изобретении, соединение формулы (I), AC220 или их фармацевтически приемлемая соль, пролекарство, сольват или гидрат можно применять вместе с одним или больше вторыми активными агентами, или объединять с ними указанные соединения. Без связи с какой-либо теорией предполагается, что некоторые комбинации для лечения раковых заболеваний работают синергически. Способы также охватывают применение соединения формулы (I), AC220 или их фармацевтически приемлемой соли, пролекарства, сольвата или гидрата таким образом, чтобы облегчить, уменьшить или избежать отрицательных эффектов, связанных с конкретными вторыми активными агентами. Также рассматриваются способы, в которых вторые активные вещества используются с целью облегчения, уменьшения или избегания неблагоприятных или нежелательных эффектов, связанных с соединением формулы (I), AC220 или их фармацевтически приемлемой солью, пролекарством, сольватом или гидратом.
В способах и соединениях по изобретению можно применять один или больше вторых активных компонентов или агентов вместе с соединением формулы (I), или с AC220, или с их фармацевтически приемлемым пролекарством, солью, сольватом или гидратом.
В конкретных вариантах осуществления второй агент представляет собой нуклеозид или его аналог. Термин "нуклеозидный аналог" обозначает органическое соединение, содержащее нуклеооснование, связанное с углеводным кольцом посредством атома азота нуклеооснования. В одном варианте осуществления нуклеооснование представляет собой азотистое основание. В другом варианте осуществления углеводным кольцом является сахарное кольцо. Нуклеозидный аналог необязательно содержит фосфатную группу.
Примеры азотистых оснований включают без ограничения пурин и его производные, такие как аденин, гуанин и гипоксантин, и пиримидин и его производные, такие как цитозин, урацил, тимин и 4-амино-триазин-2-(1Н)-он (аза-производное цитозина). В некоторых вариантах осуществления нуклеозидный аналог представляет собой антиметаболит неопластической клетки, то есть соединение, которое нарушает биологические функции неопластических клеток. Например, нуклеозидный аналог может нарушать метилирование ДНК, синтез ДНК и другие функции, связанные с делением клетки.
В конкретных вариантах осуществления нуклеозидный аналог представляет собой соединение, имеющее формулу (II):
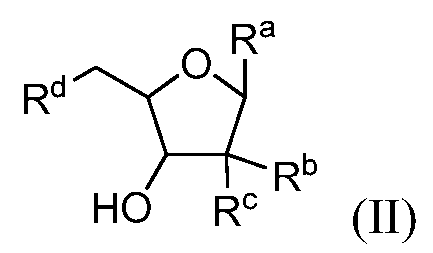
в которой Ra, Rb, Rc и Rd выбирают из (i), (ii) и (iii) следующим образом:
(i) Ra представляет собой:
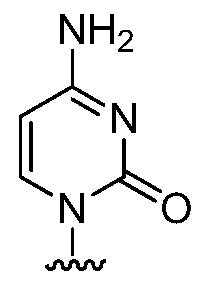
Rb является гидрокси, и Rc и Rd являются фтором;
(ii) Ra представляет собой:
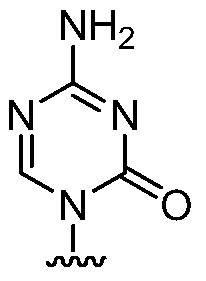
Rb является гидрокси, один из Rc и Rd представляет собой водород, и другой из Rc и Rd представляет собой водород или гидрокси; и
Ra представляет собой:
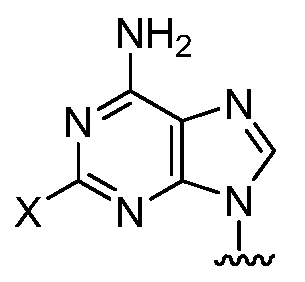
в которой X является фтором или хлором,
Rb представляет собой -OP(O)(OH)2 или гидрокси, один из Rc и Rd представляет собой водород и другой из Rc и Rd представляет собой водород, фтор или гидрокси.
В одном варианте осуществления нуклеозидный аналог является ингибитором синтеза ДНК. В другом варианте осуществления нуклеозидный аналог, также называемый деметилирующим агентом, является ингибитором метилирования ДНК. В одном варианте осуществления нуклеозидный аналог содержит фосфатную группу. Например, нуклеозидный аналог может представлять собой флударабин фосфат. В другом варианте осуществления нуклеозидный аналог не содержит фосфатной группы. Например, нуклеозидный аналог можно выбирать из группы, состоящей из следующих препаратов: децитабин, азацитидин (также называемый 5-аза-цитидин, АЗА-C, 5-АЗА-C, и ВИДАЗА®), клофарабин (также называемый Клолар®), кладрибин (также называемый 2CdA и Леустатин®), цитарабин (также известный как цитозин арабинозид, АраC, Цитозар-U®, Тарабин PFS и Депоцит®), децитабин, флударабин, гемцитабин (также известный как Гемзар®) и их комбинации.
В одном варианте осуществления нуклеозидный аналог представляет собой эпигенетический агент. Термин "эпигенетический агент" обозначает соединение, которое может регулировать ключевые гены, контролирующие клеточный цикл и гены опухолевой супрессии. Например, эпигенетический агент может подавлять ключевые гены контроля клеточного цикла и гены опухолевой супрессии посредством метилирования ДНК и/или деацетилирования гистона, и эти оба механизма представляют собой эпигенетическую регуляцию экспрессии генов. Пример эпигенетического агента включает без ограничения азацитидин.
Вышеописанный нуклеозидный аналог можно синтезировать с помощью способов, известных специалисту в данной области техники, или получать из коммерческих источников.
В конкретных вариантах осуществления второй активный агент выбирают из антрациклина и ингибитора топоизомеразы. В одном варианте осуществления ингибитор топоизомеразы выбирают из амсакрина, этопозида, этопозида фосфата и тенипозида. В одном варианте осуществления ингибитором топоизомеразы является этопозид.
Вышеописанные ингибиторы топоизомеразы можно синтезировать с помощью способов, известных специалисту в данной области техники, или получать из коммерческих источников.
В одном варианте осуществления антрациклин выбирают из даунорубицина, доксорубицина, эпирубицина, идарубицина, митоксантрона, амрубицина и валрубицина. В одном варианте осуществления антрациклин является даунорубицином. В конкретных вариантах осуществления соединение формулы (I), или AC220, или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат вводят в комбинации с цитарабином и даунорубицином.
Вышеописанные антрациклины можно синтезировать с помощью способов, известных специалисту в данной области техники, или получать из коммерческих источников.
Комбинированная терапия согласно изобретению предполагает возможность введения AC220 и второго агента одновременно или последовательно с AC220. В конкретных вариантах осуществления AC220 и второй агент, выбираемый из нуклеозидного аналога, антрациклина и ингибитора топоизомеразы, применяют в комбинированных схемах, которые могут также включать применение одного или больше других способов лечения, включающих без ограничения лечение терапевтическим антителом, которое специфично связывается с раковым антигеном, лечение гематопоэтическим фактором роста, цитокином, другим противораковым агентом, антибиотиком, ингибиторами циклооксигеназы-2, иммуномодулирующим агентом, иммуносупрессивным агентом, кортикостероидом или их фармакологически активным мутантом или производным, противораковыми агентами, лучевой терапией, противорвотными средствами и тому подобным.
В конкретных вариантах осуществления применение второго активного агента в комбинации с соединением формулы (I) можно модифицировать, или откладывать по времени, или осуществлять сразу после введения соединения формулы (I), как будет считаться подходящим практикующим специалистом в данной области техники. В конкретных вариантах осуществления при введении соединения формулы (I) в комбинации со вторыми агентами субъекты могут получать поддерживающую терапию, включающую соответствующие противорвотные средства.
В конкретных вариантах осуществления применение второго активного агента в комбинации с AC220 можно изменять или откладывать по времени или осуществлять сразу после введения AC220, как будет считаться подходящим практикующим специалистом в данной области техники. В конкретных вариантах осуществления при введении AC220 в комбинации со вторыми агентами субъекты могут получать поддерживающую терапию, включающую соответствующие противорвотные средства.
D. Способы лечения и предупреждения
В одном варианте осуществления изобретение относится к способу лечения пролиферативного заболевания у млекопитающего, при этом указанный способ содержит введение млекопитающему, страдающему пролиферативным заболеванием, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата в комбинации с терапевтически эффективным количеством второго активного агента, выбираемого из нуклеозидного аналога, антрациклина и ингибитора топоизомеразы, или их комбинации.
В одном варианте осуществления соединение, имеющее структурную формулу (I), или его соль, сольват, сложный эфир и/или пролекарство, вводят в дозе от около 12 мг/день до около 500 мг/день. В одном варианте осуществления соединение со структурной формулой (I) или его соль, сольват, сложный эфир и/или пролекарство вводят в дозе от около 30 мг/день до около 500 мг/день. В одном варианте осуществления нуклеозидный аналог вводят в дозе от около от 5 мг/м2 до около 3 г/м2. В одном варианте осуществления нуклеозидный аналог вводят в дозе от около 5 мг/м2 до около 150 мг/м2. Например, азацитидин можно вводить в дозе от около 50 мг/м2/день до около 100 мг/м2/день, или около 75 мг/м2/день; клофарабин можно вводить в дозе от около 11,25 мг/м2/день до около 70 мг/м2/день, или от около 40 мг/м2/день до около 52 мг/м2/день; цитарабин можно вводить интратекально в дозе от около 5 мг/м2 до около 75 мг/м2 один раз в день или один раз каждые четыре дня в дозе около 30 мг/м2 каждые четыре дня, или внутривенно от около 5 мг/м2/день до около 3 г/м2/день в дозе от около 100 мг/м2/день до около 200 мг/м2/день; децитабин можно вводить в дозе от около 33 мг/м2/день до около 45 мг/м2/день или около 45 мг/м2/день; и флударабин можно вводить в дозе от около 15 мг/м2/день до около 40 мг/м2/день, или около 25 мг/м2/день.
Вводимую дозу можно обозначать в единицах мг/м2/день, для этого можно вычислять площадь поверхности тела пациента (ППТ) в м2 с помощью различных доступных формул, используя показатели роста и веса пациента. Вводимую дозу можно альтернативно выражать в единицах мг/день, которые не учитывают ППТ пациента. Специалисты в данной области техники могут делать преобразование одной единицы в другую, учитывая рост и вес пациента.
В конкретных вариантах осуществления терапевтически эффективное количество AC220 находится в диапазоне от около 12 до около 1000 мг в день, от около 12 до около 500 мг в день, от около 12 до около 450 мг в день, от около 12 до около 300 мг в день, от около 12 до около 200 мг в день, от около 12 до около 100 мг в день, от около 12 до около 90 мг в день, от около 12 до около 80 мг в день, от около 12 до около 70 мг в день, от около 15 до около 65 мг в день, или от около 20 до около 60 мг в день. В одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 1000 мг в день. В другом варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 500 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 450 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 400 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 300 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 200 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 150 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 100 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 90 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 80 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 12 до около 70 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 15 до около 65 мг в день. И в другом варианте осуществления терапевтически эффективное количество AC220 составляет от около 20 до около 60 мг в день.
В конкретных вариантах осуществления терапевтически эффективное количество AC220 составляет около 12, около 18, около 20, около 25, около 27, около 30, около 35, около 40, около 45, около 50, около 55, около 60, около 90, около 100, около 135, около 150, около 200, около 300 или около 450 мг в день. В конкретных вариантах осуществления терапевтически эффективное количество AC220 в комбинированной схеме составляет около 12, около 18, около 20, около 25, около 27, около 30, около 35, около 40, около 45, около 50, около 55, около 60, около 75, около 90, около 100, около 125, около 135, около 150, около 175, около 200, около 225, около 250, около 300, около 450 или около 500 мг в день. В одном варианте осуществления терапевтически эффективное количество AC220 составляет около 12 мг в день. В другом варианте осуществления терапевтически эффективное количество AC220 составляет около 18 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 20 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 25 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 27 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 30 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 35 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 40 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 45 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 50 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 55 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 60 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 75 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 90 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 100 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 125 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 135 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 150 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 175 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 200 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 225 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 250 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 275 мг в день. Также в другом варианте осуществления терапевтически эффективное количество AC220 составляет около 300 мг в день. Еще в одном варианте осуществления терапевтически эффективное количество AC220 составляет около 350 мг в день. И в другом варианте осуществления терапевтически эффективное количество AC220 составляет около 450 мг в день.
В конкретных вариантах осуществления терапевтически эффективное количество AC220 находится в диапазоне от около 0,2 до около 20 мг/кг/день, от около 0,2 до около 15 мг/кг/день, от около 0,2 до около 10 мг/кг/день, от около 0,2 до около 9 мг/кг/день, от около 0,2 до около 8 мг/кг/день, от около 0,2 до около 7 мг/кг/день, от около 0,2 до около 6 мг/кг/день, от около 0,2 до около 5 мг/кг/день, от около 0,2 до около 5 мг/кг/день, от около 0,2 до около 5 мг/кг/день, от около 0,2 до около 4 мг/кг/день, от около 0,2 до около 3 мг/кг/день, от около 0,2 до около 2 мг/кг/день, от около 0,2 до около 1 мг/кг/день или от около 0,24 мг/кг/день до около 9 мг/кг/день.
В одном варианте осуществления терапевтически эффективное количество AC220 составляет от около 0,2 до около 20 мг/кг/день. В другом варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 15 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 10 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 9 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 8 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 7 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 6 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 5 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 5 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 4 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 3 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 2 мг/кг/день. Еще в одном варианте осуществления терапевтически эффективное количество составляет от около 0,2 до около 1 мг/кг/день. И в другом варианте осуществления терапевтически эффективное количество составляет от около 0,24 до около 9 мг/кг/день.
Вводимая доза также может быть обозначена в других единицах, кроме мг/кг/день. Например, дозы для парентерального введения можно обозначать в мг/м2/день. Специалистам в данной области техники известно, как преобразовать дозу из мг/кг/день в мг/м2/день по заданным показателям или роста или веса субъекта, или по обоим показателям (см. www.fda.gov/cder/cancer/animalframe.htm). Например, для человека весом 65 кг доза 1 мг/кг/день равна примерно 38 мг/м2/день.
В конкретных вариантах осуществления соединение I вводят в количестве, достаточном, чтобы обеспечить устойчивое состояние концентрации соединения в плазме, в пределах от около 0,0,02 до около 100 мкМ, от около 0,1 до около 10 мкМ, от около 0,3 до около 10 мкМ, от около 0,9 до около 5 мкМ, от около 1 до около 4 мкМ, от около 1 до около 3 мкМ или от около 1,5 до около 3 мкМ. В одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,02 до около 100 мкМ. В другом варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,1 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,3 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,9 до около 5 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1 до около 4 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1 до около 3 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1,5 до около 3 мкМ. Используемый в изобретении термин "устойчивое состояние концентрации в плазме" обозначает концентрацию, достигаемую после периода введения соединения. При достижении устойчивого состояния на кривой концентрации соединения в плазме в зависимости от времени имеются незначительные подъемы и понижения.
Еще в одном варианте осуществления соединение I вводят в количестве, достаточном, чтобы обеспечить максимальную концентрацию соединения в плазме (пиковую концентрацию) в диапазоне от около 0,0,02 до около 100 мкМ, от около 0,1 до около 10 мкМ, от около 0,3 до около 10 мкМ, от около 0,9 до около 5 мкМ, от около 1 до около 4 мкМ, от около 1 до около 3 мкМ или от около 1,5 до около 3 мкМ. В одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,02 до около 100 мкМ. В другом варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,1 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,3 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 0,9 до около 5 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1 до около 4 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1 до около 3 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от около 1,5 до около 3 мкМ.
Еще в одном варианте осуществления соединение I вводят в количестве, достаточном, чтобы обеспечить минимальную концентрацию соединения в плазме (низшую концентрацию) в диапазоне от около 0,02 до около 10 мкМ, от около 0,1 до около 10 мкМ, от около 0,3 до около 10 мкМ, от около 0,6 до около 5 мкМ, от около 0,6 до около 3 мкМ, от около 0,9 до около 3 мкМ или от около 1,5 до около 3 мкМ при введении больше, чем одной дозы. В одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,02 до около 10 мкМ. В другом варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,1 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,3 до около 10 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,6 до около 5 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,6 до около 3 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 0,9 до около 3 мкМ. Еще в одном варианте осуществления количество вводимого соединения является достаточным для обеспечения минимальной концентрации соединения в плазме от около 1,5 до около 3 мкМ.
Также в другом варианте осуществления соединение I вводят в количестве, достаточном для достижения значения области под кривой (AUC) соединения в диапазоне от около 100 до около 50000 нг*час/мл, от около 1000 до около 50000 нг*час/мл, от около 1500 до около 40000 нг*час/мл, от около 2000 до около 35000 нг*час/мл, от около 2000 до около 35000 нг*час/мл, от около 9000 до около 35000 нг*час/мл или от около 10000 до около 25000 нг*час/мл.
В зависимости от заболевания, которое предполагают лечить, и от состояния субъекта, можно вводить AC220 или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство пероральным путем, парентеральным путем (например, внутримышечной, внутрибрюшинной, внутривенной, непрерывной внутривенной (CIV), внутрисистемной инъекцией или инфузией, подкожной инъекцией или имплантацией), ингаляционным, назальным, влагалищным, ректальным, сублингвальным или местным путем (например, трансдермальным или локальным). Можно создавать рецептуру подходящей лекарственной формы AC220 или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства единственным или совместно с фармацевтически приемлемыми наполнителями, носителями, адъювантами и средствами транспорта, подходящими для каждого пути введения.
В одном варианте осуществления AC220 или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство можно доставлять в виде однократной дозы, такой как, например, однократное болюсное вливание или пероральные таблетки или пилюли; или в виде дозы для введения в течение времени, такой как, например, непрерывное продолжительное вливание или отдельные болюсные дозы, вводимые на протяжении времени.
В одном варианте осуществления AC220 или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство можно вводить однократно ежедневно (QD), или разделять на многократные ежедневные дозы, например, два раза в день (BID), три раза в день (TID) и четыре раза в день (QID). Дополнительно, введение может быть непрерывным, то есть, каждый день, или периодическим. Термин "периодический" или "периодически", используемый в изобретении, предназначен для обозначения прекращения и начала, или регулярных или нерегулярных интервалов. Например, периодическое введение соединения представляет собой введение в течение от одного до шести дней в неделю, введение циклами (например, ежедневное введение в течение от двух до восьми последовательных недель с последующим периодом покоя без введения в течение одной недели), или введение через день.
В конкретных вариантах осуществления частота введения AC220 находится в диапазоне от около ежедневной дозы до около ежемесячной дозы. В конкретных вариантах осуществления введение AC220 осуществляют один раз в день, два раза в день, три раза в день, четыре раза в день, однократно через день, два раза в неделю, однократно каждую неделю, однократно через две недели, однократно через три недели или однократно через четыре недели. В одном варианте осуществления AC220 согласно изобретению вводят один раз в день. В другом варианте осуществления AC220 согласно изобретению вводят два раза в день. Еще в одном варианте осуществления AC220 согласно изобретению вводят три раза в день. Еще в другом варианте осуществления AC220 согласно изобретению вводят четыре раза в день.
В конкретных вариантах осуществления AC220 вводят в течение 7 дней по схеме 21-дневного цикла. В конкретных вариантах осуществления AC220 вводят в течение 7 дней в 28-дневном цикле. В конкретных вариантах осуществления AC220 вводят в течение 14 дней в 28-дневном цикле. В конкретных вариантах осуществления AC220 вводят в течение 28 дней в 28-дневном цикле.
В конкретных вариантах осуществления AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат вводят один раз в день в течение около 1 недели, 2 недель, 3 недель, около 4 недель, около 6 недель, около 9 недель, около 12 недель, около 15 недель, около 18 недель, около 21 недели, или около 26 недель. В конкретных вариантах осуществления AC220 вводят периодически. В конкретных вариантах осуществления AC220 вводят периодически в количестве от около 40 до 450 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве в диапазоне от около 12 мг до 1000 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве в диапазоне от около 12 мг до 2000 мг в день, или от около 27 мг до 1000 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве в диапазоне от около 200 мг до 1000 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве в диапазоне от около 200 мг до 675 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве в диапазоне от около 200 мг до 450 мг в день. В конкретных вариантах осуществления AC220 вводят непрерывно в течение 28 дней. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве около 200 мг. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве около 450 мг. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве около 675 мг. В конкретных вариантах осуществления AC220 вводят непрерывно в количестве около 1000 мг.
В одном варианте осуществления AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат вводят ежедневно в однократной дозе или раздельными дозами в течение одной недели, двух недель, трех недель, четырех недель, пяти недель, шести недель, восьми недель, десяти недель, пятнадцати недель или двадцати недель, с последующим периодом покоя от около 1 дня до около десяти недель. Например, способы предусматривают циклы продолжительностью в одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, восемь недель, десять недель, пятнадцать недель или двадцать недель. В другом варианте осуществления AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат вводят ежедневно в однократной дозе или раздельными дозами в течение одной недели, двух недель, трех недель, четырех недель, пяти недель или шести недель с периодом покоя 1 день, 3, 5, 7, 9, 12, 14, 16, 18, 20, 22, 24, 26, 28, 29 или 30 дней. В некоторых вариантах осуществления период покоя составляет 14 дней. В некоторых вариантах осуществления период покоя составляет 28 дней. В одном варианте осуществления период покоя является периодом, который достаточен для восстановления костного мозга. Частота, количество и продолжительность циклов введения могут быть увеличены или уменьшены.
В конкретных вариантах осуществления путь введения AC220 не зависит от пути введения второго лекарства. В одном варианте осуществления AC220 вводят перорально. В другом варианте осуществления AC220 вводят внутривенно. Таким образом, согласно указанным вариантам осуществления, AC220 вводят перорально или внутривенно, и второе лекарство можно вводить перорально, парентерально, интраперитонеально, внутривенно, внутриартериально, чрескожно, сублингвально, внутримышечно, ректально, трансбуккально, интраназально, с помощью липосом, путем ингаляции, вагинально, интраокулярно, локально посредством доставки катетером или стентом, подкожно, внутрь жировой ткани, внутрисуставно, интратекально, или в лекарственной форме с замедленным высвобождением. В одном варианте осуществления AC220 и второе лекарство вводят одинаковыми путями введения, перорально или внутривенно (в/в). В другом варианте осуществления AC220 вводят одним путем введения, например, в/в, тогда как второе вещество вводят другим путем введения, например, перорально.
В конкретных вариантах осуществления способы согласно изобретению предназначены для лечения человека.
В одном варианте осуществления пролиферативным заболеванием является опухоль. В другом варианте осуществления пролиферативным заболеванием является солидная опухоль. В другом варианте осуществления пролиферативным заболеванием является рак. В другом варианте осуществления заболевание представляет собой гематологическое неопластическое заболевание.
В конкретных вариантах осуществления раковое заболевание, которое поддается лечению способами согласно изобретению, включает без ограничения следующее: (1) лейкозы, включающие без ограничения, острый лейкоз, острый лимфоцитарный лейкоз, острые миелоцитарные лейкозы, такие как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный, эритроцитарные лейкозы и миелодиспластический синдром или их симптомы (такие как анемия, тромбоцитопения, нейтропения, бицитопения или панцитопения), рефрактерную анемию (РА), РА с кольцевидными сидеробластами (РАКС), РА с избытком бластов (RAEB), RAEB на стадии трансформации (RAEB-T), предлейкоз и хронический миеломоноцитарный лейкоз (ХММЛ), (2) хронические лейкозы, включающие без ограничения хронический миелоцитарный (гранулоцитарный) лейкоз, хронический лимфоцитарный лейкоз и волосатоклеточный лейкоз; (3) истинную полицитемию; (4) лимфомы, включающие без ограничения болезнь Ходжкина и неходжкинские лимфомы; (5) множественные миеломы, включающие без ограничения, вялотекущую множественную миелому, несекреторную миелому, остеосклеротическую миелому, плазмаклеточный лейкоз, солитарную плазмацитому и экстрамедуллярную плазмацитому; (6) макроглубулинемию Вальденстрема; (7) моноклональную гаммапатию неопределенного генеза; (8) доброкачественную моноклональную гаммапатию (9) болезнь тяжелых цепей; (10) саркомы костной и соединительной ткани, включающие без ограничения саркому кости, остеосаркому, хондросаркому, саркому Юинга, злокачественную гигантско-клеточную опухоль, фибросаркому кости, хондрому, периостальную саркому, саркомы мягких тканей, ангиосаркому (гемангиосаркому), фибросаркому, саркому Капоши, лейомиосаркому, липосаркому, лимфангиосаркому, метастатические раковые новообразования, неврилеммому, рабдомиосаркому и синовиальную саркому; (11) опухоли головного мозга, включающие без ограничения: глиому, астроцитому, глиому ствола мозга, эпендимому, олигодендроглиому, неглиальную опухоль, акустическую невриному, краниофарингиому, медуллобластому, менингиому, пинеоцитому, пинеобластому и первичную мозговую лимфому; (12) рак молочной железы, включающий без ограничения аденокарциному, лобулярную (мелкоклеточную) карциному, интрадуктальную карциному, медуллярный рак молочной железы, мукоидный рак молочной железы, трубчатый рак молочной железы, папиллярный рак молочной железы, первичные раковые образования, болезнь Педжета и воспалительный рак молочной железы; (13) рак надпочечников, включающий без ограничения феохромоцитому и адренокортикальную карциному; (14) рак щитовидной железы, включающий без ограничения папиллярный или фолликулярный рак щитовидной железы, медуллярный рак щитовидной железы и анапластический рак щитовидной железы; (15) рак поджелудочной железы, включающий без ограничения инсулиному, гастриному, глюкагоному, випому, соматостатин-секретирующую опухоль и карциноид или опухоль островковых клеток; (16) гипофизарный рак, включающий без ограничения болезнь Кушинга, пролактин-секретирующую опухоль, акромегалию и несахарный диабет; (17) рак глаза, включающий без ограничения меланому глаза, например, меланому радужной оболочки, хориоидальную меланому и меланому цилиарного тела, и ретинобластому; (18) рак влагалища, включающий без ограничения плоскоклеточную карциному, аденокарциному и меланомы; (19) рак вульвы, включающий без ограничения плоскоклеточную карциному, меланому, аденокарциному, базальноклеточную карциному, саркому и болезнь Педжета; (20) рак шейки матки, включающий без ограничения плоскоклеточную карциному и аденокарциному; (21) рак матки, включающий без ограничения карциному эндометрия и саркому матки; (22) рак яичника, включающий без ограничения эпителиальную карциному яичника, паранеоплазию, эмбриональноклеточную опухоль и стромальную опухоль; (23) рак пищевода, включающий без ограничения плоскоклеточный рак, аденокарциному, аденокистозную карциному, мукоэпидермоидную карциному, аденосквамозную карциному, саркому, меланому, плазмацитому, бородавчатый рак, и овсяно-клеточную (мелкоклеточную) карциному; (24) рак желудка, включающий без ограничения аденокарциному, грибовидные разрастания (полиповидный рак), изъязвленный рак, поверхностно распространенный и диффузно распространенный рак, злокачественную лимфому, липосаркому, фибросаркому и карциносаркому; (25) рак толстой кишки; (26) рак прямой кишки; (27) рак печени, включающий без ограничения гепатоцеллюлярную карциному и гепатобластому; (28) рак желчного пузыря, включающий без ограничения аденокарциному; (29) холангиосаркомы, включающие без ограничения папиллярные, узловые и диффузные формы; (30) рак легкого, включающий без ограничения немелкоклеточный рак легкого, плоскоклеточную карциному (эпидермоидную карциному), аденокарциному, гигантско-клеточную карциному и мелкоклеточный рак легкого; (31) рак яичка, включающий без ограничения эмбриональную опухоль, семиному, анапластический, классический (типичный), сперматоцитарный рак, несеминому, эмбриональную карциному, карциному тератому и хориокарциному (опухоль желточного мешка); (32) рак предстательной железы, включающий без ограничения аденокарциному, лейомиосаркому и рабдомиосаркому (33) рак полового члена; (34) рак полости рта, включающий без ограничения плоскоклеточную карциному; (35) базальный рак; (36) рак слюнной железы, включающий без ограничения аденокарциному, мукоэпидермоидную карциному, и аденокистозную карциному; (37) рак глотки, включающий без ограничения плоскоклеточный и бородавчатый рак; (38) рак кожи, включающий без ограничения базальноклеточную карциному, плоскоклеточную карциному и меланому, поверхностную распространенную меланому, узловую меланому, злокачественную меланому лентиго и акральную лентигонозную меланому; (39) рак почки, включающий без ограничения почечноклеточную карциному, аденокарциному, гипернефрому, фибросаркому и переходно-клеточный рак (почки, таза и/или матки); (40) опухоль Вильмса; (41) рак мочевого пузыря, включающий без ограничения переходно-клеточную карциному, плоскоклеточный рак, аденокарциному и карциносаркому; и другие виды раковых заболеваний, включающие без ограничения следующее: миксосаркому, остеогенную саркому, эндотелиосаркому, лимфангио-эндотелиосаркому, мезотелиому, синовиому, гемангиобластому, эпителиальную карциному, цистоаденокарциному, бронхогенную карциному, карциному потовой железы, сальную аденокарциному, папиллярную карциному и папиллярные аденокарциномы (См. Fishman et al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia and Murphy et al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, and Recovery, Viking Penguin, Penguin Books U.S.A., Inc., United States of America).
В конкретных вариантах осуществления раковое заболевание, которое поддается лечению способами согласно изобретению, включает без ограничения рак мочевого пузыря, рак молочной железы, рак шейки матки, рак толстой кишки (например, колоректальный рак), рак эндометрия, рак желудка, глиому (например, глиобластому), рак головы и шеи, рак печени, немелкоклеточный рак легкого, рак яичников, рак поджелудочной железы и рак предстательной железы.
В конкретных вариантах осуществления рак представляет собой метастатический рак, включающий без ограничения рак мочевого пузыря, рак молочной железы, рак шейки матки, рак толстой кишки (например, колоректальный рак), рак пищевода, рак головы и шеи, рак печени, рак легкого (например, мелкоклеточные и немелкоклеточные типы рака легкого), меланому, миелому, нейробластому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак почки, саркому (например, остеосаркому), рак кожи (например, плоскоклеточную карциному), рак желудка, рак яичка, рак щитовидной железы и рак матки. В одном варианте осуществления метастатическим раком является рак предстательной железы или молочной железы. В другом варианте осуществления метастатическим раком является рак молочной железы. Еще в одном варианте осуществления метастатический рак представляет собой рак предстательной железы.
В одном варианте осуществления лейкоз представляет собой хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз.
В другом варианте осуществления лейкозом является острый лейкоз. В одном варианте осуществления острым лейкозом является острый миелогенный лейкоз (ОМЛ). В одном варианте осуществления острый миелогенный лейкоз представляет собой недифференцированный ОМЛ (М0), миелобластный лейкоз (М1), миелобластный лейкоз (М2), промиелоцитарный лейкоз (М3 или вариант М3 [M3V]), миеломоноцитарный лейкоз (М4 или вариант М4 с эозинофилией [M4E]), моноцитарный лейкоз (М5), эритролейкоз (М6) или мегакариобластный лейкоз (М7). В другом варианте осуществления острым миелогенным лейкозом является недифференцированный ОМЛ (М0). Еще в одном варианте осуществления острым миелогенным лейкозом является миелобластный лейкоз (М1). Еще в одном варианте осуществления острым миелогенным лейкозом является миелобластный лейкоз (М2). Еще в одном варианте осуществления острым миелогенным лейкозом является промиелоцитарный лейкоз (М3 или вариант М3 [M3V]). Еще в одном варианте осуществления острым миелогенным лейкозом является миеломоноцитарный лейкоз (М4 или вариант М4 с эозинофилией [M4E]). Еще в одном варианте осуществления острым миелогенным лейкозом является моноцитарный лейкоз (М5). Еще в одном варианте осуществления острым миелогенным лейкозом является эритролейкоз (М6). Еще в одном варианте осуществления острым миелогенным лейкозом является мегакариобластный лейкоз (М7). Еще в одном варианте осуществления острым миелогенным лейкозом является промиелоцитарный лейкоз. Еще в одном варианте осуществления лейкоз обусловлен мутацией внутренней тандемной дупликации FLT3 (ITD). Еще в одном варианте осуществления лейкоз обусловлен точечной мутацией FLT3. И еще в одном варианте осуществления точечная мутация FLT3 представляет собой точечную мутацию в аминокислоте D835.
В другом варианте осуществления острым лейкозом является острый лимфоцитарный лейкоз (ОЛЛ). В одном варианте осуществления острый лимфоцитарный лейкоз представляет собой лейкоз, который возникает в бластных клетках костного мозга (B-клетки), тимуса (T-клетки) или лимфатических узлов. Классификация острого лимфоцитарного лейкоза согласно французско-американско-британской (FAB) схеме морфологической классификации построена следующим образом: L1 - зрелые лимфобласты (T-клетки или предшественники B-клеток), L2 - незрелые и плеоморфные (по-разному сформированные) лимфобласты (T-клетки или предшественники B-клеток) и L3 - лимфобласты (B-клетки; клетки Беркитта). В другом варианте осуществления острый лимфоцитарный лейкоз возникает в бластных клетках костного мозга (B-клетки). Еще в одном варианте осуществления острый лимфоцитарный лейкоз возникает в тимусе (T-клетки). Еще в одном варианте осуществления острый лимфоцитарный лейкоз возникает в лимфатических узлах. Еще в одном варианте осуществления острый лимфоцитарный лейкоз представляет собой тип L1, характеризующийся наличием зрелых лимфобластов (T-клетки или предшественники B-клеток). Еще в одном варианте осуществления острый лимфоцитарный лейкоз представляет собой тип L2, характеризующийся наличием незрелых и плеоморфных (по-разному сформированных) лимфобластов (T-клетки или предшественники В-клеток). Еще в одном варианте осуществления острый лимфоцитарный лейкоз представляет собой тип L3, характеризующийся наличием лимфобластов (B-клетки; клетки Беркитта).
Еще в одном варианте осуществления лейкозом является T-клеточный лейкоз. В одном варианте осуществления T-клеточный лейкоз представляет собой лейкоз периферических T-клеток, T-клеточный лимфобластный лейкоз, T-клеточный кожный лейкоз и T-клеточный лейкоз взрослых. В другом варианте осуществления T-клеточным лейкозом является периферический T-клеточный лейкоз. Еще в одном варианте осуществления T-клеточным лейкозом является T-клеточный лимфобластный лейкоз. Еще в одном варианте осуществления T-клеточным лейкозом является T-клеточный кожный лейкоз. Во все еще другом варианте осуществления T-клеточным лейкозом является T-клеточный лейкоз взрослых.
Еще в одном варианте осуществления лейкоз является Филадельфия-положительным. В одном варианте осуществления Филадельфия-положительный лейкоз представляет собой Филадельфия-положительный ОМЛ, включающий без ограничения недифференцированный ОМЛ (М0), миелобластный лейкоз (М1), миелобластный лейкоз (М2), промиелоцитарный лейкоз (М3 или вариант М3 [M3V]), миеломоноцитарный лейкоз (М4 или вариант М4 с эозинофилией [M4E]), моноцитарный лейкоз (М5), эритролейкоз (М6) или мегакариобластный лейкоз (М7). В другом варианте осуществления Филадельфия-положительный лейкоз представляет собой Филадельфия-положительный ОЛЛ.
Также в другом варианте осуществления лейкоз является лекарственно-резистентным. В одном варианте осуществления у субъекта развивается лекарственная резистентность к противораковой терапии. В другом варианте осуществления у субъекта развивается лекарственная резистентность к ингибитору киназы FLT3. Еще в одном варианте осуществления субъект получал лечение препаратами PKC 412, MLN 578, CEP-701, CT 53518, CT-53608, CT-52923, D-64406, D-65476, AGL-2033, AG1295, AG1296, KN-1022, PKC-412, SU5416, SU5614, SU11248, L-00021649 или CHIR-258. И еще в одном варианте осуществления субъект имеет конститутивный активирующий мутант FLT3.
В конкретных вариантах осуществления млекопитающее, которое лечат одним из способов согласно изобретению, не подвергалось противораковой терапии до введения AC220 или его фармацевтически приемлемого пролекарства, соли, гидрата или сольвата. В конкретных вариантах осуществления млекопитающее, которое лечат одним из способов согласно изобретению, уже подвергалось противораковой терапии перед введением AC220 или его фармацевтически приемлемого пролекарства, соли, гидрата или сольвата.
Способы, рассматриваемые в изобретении, охватывают лечение субъекта независимо от возраста пациента, вместе с тем ряд заболеваний или нарушений более часто встречаются в конкретных возрастных группах. Дополнительно изобретение относится к способу лечения субъекта, который подвергался хирургическому вмешательству с целью лечения рассматриваемого заболевания или состояния, а также к способу лечения субъекта, не подвергавшегося хирургическому лечению. Поскольку у субъектов с раковыми заболеваниями выявляют гетерогенные клинические симптомы и варьирующие клинические исходы, лечение, получаемое конкретным субъектом, может варьировать в зависимости от прогноза его/ее заболевания. Квалифицированный клиницист сможет легко определить без неуместного экспериментирования конкретные вторые агенты, типы хирургического вмешательства и типы нелекарственной базовой стандартной терапии, которую можно эффективно применять для лечения конкретного субъекта, страдающего раком.
В другом варианте осуществления изобретение относится к способу ингибирования клеточного роста, который содержит контакт клетки с эффективным количеством антрациклина и AC220 или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства. В одном варианте осуществления антрациклином является даунорубицин. В другом варианте осуществления изобретение относится к способу ингибирования клеточного роста клетки, который содержит контакт клетки с эффективным количеством ингибитора топоизомеразы и AC220 или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства. В одном варианте осуществления ингибитором топоизомеразы является этопозид. В другом варианте осуществления изобретение относится к способу ингибирования клеточного роста, который содержит контакт клетки с эффективным количеством нуклеозидного аналога и AC220 или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства.
В конкретных вариантах осуществления клеткой является клетка млекопитающих. В конкретных вариантах осуществления клетка млекопитающих представляет собой человеческую клетку. В конкретных вариантах осуществления клеткой является опухолевая клетка. В конкретных вариантах осуществления клеткой является опухолевая клетка млекопитающих. В конкретных вариантах осуществления клеткой является человеческая опухолевая клетка. В конкретных вариантах осуществления клеткой является раковая клетка. В конкретных вариантах осуществления клеткой является раковая клетка млекопитающих. В конкретных вариантах осуществления клеткой является человеческая раковая клетка. В конкретных вариантах осуществления опухолевая клетка экспрессирует мутацию FLT3 ITD. В конкретных вариантах осуществления опухолевая клетка проявляет сверхэкспрессию белка FLT3.
В конкретных вариантах осуществления раковая клетка, которую можно лечить способами согласно изобретению, включает без ограничения клетки рака мочевого пузыря; рака молочной железы; рака шейки матки; рака толстой кишки (например, колоректального рака); рака эндометрия; рака пищевода; рака желудка; глиомы (например, глиобластомы); рака головы и шеи; рака печени, рака легкого (например, клетки мелкоклеточного и немелкоколеточного рака легкого); меланомы, миеломы; нейробластомы; рака яичника; рака пожелудочной железы; рака предстательной железы; рака почки; саркомы (например, остеосаркомы); рака кожи (например, плоскоклеточной карциномы); рака желудка; рака яичка; рака щитовидной железы; рака матки; лейкозные клетки при лейкозе, включающем острый миелолейкоз (ОМЛ), острый промиелоцитарный лейкоз, острый миелобластный лейкоз, острый монобластный лейкоз, острый моноцитарный лейкоз, острый эритроидный лейкоз, острый мегакариобластный лейкоз, острый базофильный лейкоз, острый панмиелоз, миелоидную саркому, хронический миелолейкоз (ХМЛ), острый лимфобластный лейкоз (ОЛЛ) и миелодиспластические синдромы (МДС) и лимфомы, включающие B-клеточную лимфому, хронический лимфоцитарный лейкоз, лимфому Беркитта, B-клеточный пролимфоцитарный лейкоз, T-клеточную лимфому, T-клеточный пролимфоцитарный лейкоз, T-клеточный крупноклеточный гранулярный лимфоцитарный лейкоз, NK-клеточную лимфому (клеток-натуральных киллеров), агрессивный NK-клеточный лейкоз, ходжкинскую лимфому и неходжкинскую лимфому.
В конкретных вариантах осуществления раковой клеткой является клетка рака мочевого пузыря, рака молочной железы, рака шейки матки, рака толстой кишки (например, колоректального рака), рака эндометрия, рака желудка, глиомы (например, глиобластомы), рака головы и шеи, рака печени, клетка немелкоклеточного рака легкого, рака яичников, рака поджелудочной железы или рака предстательной железы.
В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; перед контактом клетки с ингибитором топоизомеразы или антрациклином. В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом, или пролекарством; перед контактом клетки с нуклеозидным аналогом. В конкретных вариантах осуществления клетку лечат соединением, рассматриваемым в изобретении, перед контактом указанной клетки с нуклеозидным аналогом, ингибитором топоизомеразы или антрациклином с интервалом времени около 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут или около 10 минут.
В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; с сопутствующим контактом клетки с антрациклином. В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; с сопутствующим контактом клетки с ингибитором топоизомеразы. В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; с сопутствующим контактом клетки с нуклеозидным аналогом.
В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; после контакта клетки с антрациклином. В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; после контакта клетки с нуклеозидным аналогом. В конкретных вариантах осуществления клетку лечат путем контакта клетки с AC220 или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством; после контакта клетки с ингибитором топоизомеразы. В конкретных вариантах осуществления клетку лечат соединением AC220 согласно изобретению после контакта клетки с нуклеозидным аналогом, ингибитором топоизомеразы или антрациклином с интервалом времени около 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут или около 10 минут. В одном варианте осуществления нуклеозидный аналог представляет собой АЗА, цитарабин или клофарабин. В одном варианте осуществления антрациклином является даунорубицин. В одном варианте осуществления ингибитором топоизомеразы является этопозид.
Ингибирование клеточного роста можно измерить, например, путем подсчета числа клеток, которые контактируют с рассматриваемыми соединениями, и сравнения клеточной пролиферации с идентичными клетками, которые в другой ситуации не контактируют с этими соединениями, или путем определения размера опухоли, в которой заключены эти клетки. Можно легко оценить количество клеток, а также размер клеток с помощью любого способа, известного в данной области (например, путем эксклюзионной окраски трипан-синим и подсчета клеток при измерении включения 3H-тимидина в растущей ДНК в клетке). Также можно измерить жизнеспособность клетки путем флуометрического анализа, например, с помощью CellTiter-Blue™.
E. Схемы дозирования комбинации AC220 и вторых агентов
В конкретных вариантах осуществления рассматриваемые в изобретении способы содержат введение соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства в комбинации с одним или больше вторыми активными агентами для лечения рака. В одном варианте осуществления второй агент выбирают из азацитидина (АЗА), цитарабина (Ara-C или AraC), идарубицина, митоксантрона, клофарабина, кладрибина, даунорубицина и этопозида, или их комбинации. В одном варианте осуществления вторым агентом является GDC-0941. Вторые агенты, рассматриваемые в изобретении, можно вводить или перед введением, или одновременно, или после введения соединения со структурной формулой (I) или его соли, сольвата, сложного эфира и/или пролекарства. В некоторых вариантах осуществления второй агент можно вводить подкожно или внутривенно. В конкретных вариантах осуществления второй агент вводят подкожно. В конкретных вариантах осуществления второй агент вводят внутривенно.
В конкретных вариантах осуществления способы согласно изобретению содержат введение AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с одним или больше вторыми активными агентами, выбранными из цитарабина, даунорубицина и этопозида.
В конкретных вариантах осуществления способы, рассматриваемые в изобретении, содержат введение AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с одним или больше вторыми активными агентами, выбранными из даунорубицина и этопозида. В конкретных вариантах осуществления способы, рассматриваемые в изобретении, содержат введение AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации с одним или больше вторыми активными агентами, выбранными из цитарабина и даунорубицина.
В конкретных вариантах осуществления схему введения комбинации можно осуществлять повторно в случае необходимости, например, во время стабильной фазы или регресса заболевания, наблюдаемого у пациента, или при прогрессировании заболевания у пациента, или при неприемлемой токсичности. Например, устойчивая фаза заболевания при солидных опухолях обычно означает, что перпендикулярный диаметр измеримых областей поражения не увеличился на 25% или больше от последнего измерения. Согласно Руководству по критериям оценки реакции при солидных опухолях Response Evaluation Criteria in Solid Tumors (RECIST) Guidelines, Journal of the National Cancer Institute 2000, 92, 205-216. Стабильность заболевания или ее отсутствие определяют способами, известными в данной области, такими как оценка симптоматики у больных, физикальный осмотр, визуализация опухоли с получением изображения с помощью рентгена, КТ (компьютерной томографии), ПЭТ (позитронно-эмиссионной томографии) или МРТ (магнитно-резонансной томографии) и других общепринятых методик оценки.
В конкретных вариантах осуществления комбинированную схему введения субъекту проводят с расширенными интервалами времени, в пределах от 1 дня до около 12 месяцев, от 2 дней до около 6 месяцев, от 3 дней до около 5 месяцев, от 3 дней до около 4 месяцев, от 3 дней до около 12 недель, от 3 дней до около 10 недель, от 3 дней до около 8 недель, от 3 дней до около 6 недель, от 3 дней до около 5 недель, от 3 дней до около 4 недель, от 3 дней до около 3 недель, от 3 дней до около до 2 недель или от 3 дней до около 10 дней.
В конкретных вариантах осуществления комбинированную схему введения проводят в 21-дневном цикле. В конкретных вариантах осуществления комбинированную схему введения проводят в 28-дневном цикле. В конкретных вариантах осуществления комбинированную схему введения проводят в виде ежемесячного цикла.
В конкретных вариантах осуществления введение субъекту по комбинированной схеме проводят циклами. Лечение циклами подразумевает введение по комбинированной схеме, рассматриваемой в изобретении, в течение периода времени с последующим периодом покоя, и повторение такой последовательности введения. Лечение циклами может уменьшать развитие резистентности к одному или больше лекарственным препаратам, при этом можно избежать или уменьшать побочные эффекты одного из лекарственных препаратов и/или повышать эффективность лечения.
Таким образом, в одном варианте осуществления введение по рассматриваемой в изобретении комбинированной схеме проводят ежедневно в течение одной недели, двух недель, трех недель, четырех недель, пяти недель, шести недель, восьми недель, десяти недель, пятнадцати недель или двадцати недель, с последующим периодом покоя в течение от около 1 дня до около десяти недель. Например, указанные способы предполагают применение терапевических циклов из одной недели, двух недель, трех недель, четырех недель, пяти недель, шести недель, восьми недель, десяти недель, пятнадцати недель или двадцати недель. В другом варианте осуществления введение по рассматриваемой в изобретении комбинированной схеме проводят ежедневно в течение одной недели, двух недель, трех недель, четырех недель, пяти недель или шести недель с периодом покоя продолжительностью 1, 3, 5, 7, 9, 12, 14, 16, 18, 20, 22, 24, 26, 28, 29 или 30 дней. В конкретных вариантах осуществления период покоя составляет 14 дней. В конкретных вариантах осуществления период покоя составляет 28 дней. В одном варианте осуществления период покоя представляет собой период, который является остаточным для восстановления костного мозга. Частота, количество и продолжительность циклов введения могут быть увеличены или уменьшены.
Используемый в изобретении термин "комбинированная схема" включает использование больше чем одного лекарственного препарата (например, одного или больше профилактических и/или терапевтических агентов). Вместе с тем, использование термина "комбинированная схема" не ограничивает порядок введения субъекту лекарственных препаратов (например, профилактических и/или терапевтических агентов). Первый препарат (например, AC220) можно вводить субъекту перед введением второго препарата (например, за 5 минут, 15 минут, 30 минут, 45 минут, за 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, за 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или за 12 недель до введения второго препарата), одновременно, или после введения второго препарата (например, через 5 минут, 15 минут, 30 минут, 45 минут, через 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, через 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или через 12 недель) после введения второго препарата (например, профилактического или терапевтического агента, такого как антрациклин или ингибитор топоизомеразы, описанный в изобретении). В изобретении также рассмотрена тройная лекарственная терапия (например, введение цитарабина или тиогуанина в качестве третьего препарата).
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство; вводят субъекту до введения нуклеозидного аналога. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту перед введением нуклеозидного аналога с интервалом около 7 дней, около 5 дней, около 3 дней, 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 2 дня до введения нуклеозидного аналога. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 1 день до введения нуклеозидного аналога. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту в тот же день, в который вводят нуклеозидный аналог.
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство; вводят субъекту перед введением ингибитора топоизомеразы. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту перед введением ингибитора топоизомеразы с интервалом около 7 дней, около 5 дней, около 3 дней, 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 2 дня до введения ингибитора топоизомеразы. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 1 день перед введением ингибитора топоизомеразы. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту в тот же день, в который вводят ингибитор топоизомеразы.
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство; вводят субъекту перед введением антрациклина. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту перед введением антрациклина с интервалом около 7 дней, около 5 дней, около 3 дней, около 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 2 дня до введения антрациклина. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно за 1 день до введения антрациклина.
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения нуклеозидного аналога. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения нуклеозидного аналога с интервалом около 7 дней, около 5 дней, около 3 дней, 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 2 дня после введения нуклеозидного аналога. В конкретных вариантах осуществления AC220; или фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 1 день после введения нуклеозидного аналога.
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения ингибитора топоизомеразы. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения ингибитора топоизомеразы с интервалом около 7 дней, около 5 дней, около 3 дней, 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 2 дня после введения ингибитора топоизомеразы. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 1 день после введения ингибитора топоизомеразы.
В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения антрациклина. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту после введения антрациклина с интервалом около 7 дней, около 5 дней, около 3 дней, около 2 дней, около 1 дня, около 12 часов, около 6 часов, около 4 часов, около 2 часов, около 60 минут, около 30 минут, около 10 минут. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 2 дня после введения антрациклина. В конкретных вариантах осуществления AC220; или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту примерно через 1 день после введения антрациклина.
В конкретных вариантах осуществления AC220 или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство вводят субъекту одновременно с введением нуклеозидного аналога, ингибитора топоизомеразы или антрациклина.
В каждом варианте осуществления по изобретению способ может дополнительно содержать этап диагностики для определения уровня экспрессии белка FLT3 в опухолевых клетках. В одном варианте осуществления этап диагностики проводят перед введением рассматриваемой в изобретении комбинированной схемы. При выявлении у субъекта опухоли со сверхэкспрессией FLT3 проводят введение комбинированной схемы, рассматриваемой в изобретении. В другом варианте осуществления этап диагностики проводят во время лечения.
В каждом варианте осуществления по изобретению способ может дополнительно содержать этап диагностики для определения уровня экспрессии белка FLT3 в опухолевых клетках. В одном варианте осуществления этап диагностики проводят перед введением соединений. В другом варианте осуществления этап диагностики проводят во время лечения.
В каждом варианте осуществления по изобретению способ может дополнительно содержать этап диагностики для определения уровней фосфорилированого белка FLT3 в опухолевых клетках или в бластных клетках. В одном варианте осуществления этап диагностики проводят перед введением соединений. В другом варианте осуществления этап диагностики проводят во время лечения.
В каждом варианте осуществления по изобретению способ может дополнительно содержать этап диагностики для определения наличия мутации FLT3 ITD в опухолевых клетках или в бластных клетках. В одном варианте осуществления этап диагностики проводят перед введением соединений. В другом варианте осуществления этап диагностики проводят во время лечения.
Способы согласно изобретению могут дополнительно содержать введение других терапевтических агентов, полезных для лечения и/или предупреждения заболевания, описанного в изобретении.
В конкретных вариантах осуществления каждый способ согласно изобретению может независимо дополнительно содержать этап введения дополнительного терапевтического средства. Дополнительные терапевтические средства, которые можно применять в комбинированной схеме по изобретению, включают без ограничения хирургическое вмешательство, эндокринную терапию, модификаторы биологической реакции (например, интерфероны, интерлейкины и фактор некроза опухолей (ФНО)), гипертермию и криотерапию, агенты для уменьшения какого-либо отрицательного эффекта (например, противорвотные средства), и другие одобренные химиотерапевтические лекарства, включающие без ограничения антиметаболиты (например, 5-фторурацил, метотрексат, флударабин), антимикротубулярные агенты (например, алкалоиды барвинка, такие как винкристин, винбластин; таксаны, такие как паклитаксел, доцетаксел), алкилирующие агенты (например, циклофосфамид, мелфалан, кармустин, нитрозомочевины, такие как бисхлорэтилнитрозомочевина и гидроксимочевина), платиновые агенты (например, цисплатин, карбоплатин, оксалиплатин, JM-216, CI-973), антрациклины (например, доксорубицин), противораковые антибиотики (например, митомицин, идарубицин, адриамицин, даунорубицин), ингибиторы топоизомеразы (например, этопозид, камптотецины) или любые другие цитотоксические агенты, (эстрамустин фосфат, преднимустин), гормоны или агонисты гормонов, антагонисты, частичные агонисты или частичные антагонисты, ингибиторы киназы и лучевую терапию. Более полное обсуждение современных способов лечения рака см. ссылку: http://www.nci.nih.gov/, перечень одобренных Управлением по контролю за продуктами и лекарствами США (FDA) онкологических лекарств в ссылке www.fda.gov/cder/cancer/druglistframe.htm, и в издании The Merck Manual, Seventeenth Ed. 1999, все содержание которых со ссылкой включено в изобретение.
В конкретных вариантах осуществления дополнительные терапевтические агенты, которые можно применять в комбинированной схеме по изобретению, включают без ограничения тиогуанин, гранулоцитарный колониестимулирующий фактор (G-CSF, Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, ГМ-КСФ), гемтузумаб, озогамицин, винбластин, гемцитабин, митомицин, бевацизумаб и этопозид.
Комбинированные схемы согласно изобретению также могут представлять собой изделие, в котором использованы упаковочные материалы, общеизвестные в данной области техники. См, например, патенты США №№ 5323907; 5052558; и 5033252. Примеры фармацевтических упаковочных материалов включают без ограничения блистерные упаковки, флаконы, тюбики, ингаляторы, помпы, пекетики, пробирки, контейнеры, шприцы и любой упаковочный материал, подходящий для выбранной рецептуры и предполагаемого пути введения и лечения.
i) Комбинация AC220 и АЗА
В одном варианте осуществления соединение формулы (I), AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат вводят перорально в комбинации с введением АЗА подкожным или внутривенным путем, используя любой из уровней дозы -3, -2, -1 или 0, выбираемый из одной из нижеприведенных таблиц 1A-1G:
|
|
|
|
|
|
|
|
|
|
В одном варианте осуществления введение АЗА в одном цикле лечения проводят в течение 7 последовательных дней перед введением соединения формулы (I) или AC220 в течение 14 последовательных дней. В другом варианте осуществления в одном цикле лечения соединение формулы (I) вводят в течение 14 последовательных дней перед введением АЗА в течение 7 последовательных дней. Еще в одном варианте осуществления введение АЗА в одном цикле лечения проводят в течение первых 7 последовательных дней, и соединение формулы (I) вводят в течение первых 14 последовательных дней. Еще в одном варианте осуществления введение АЗА в одном цикле лечения проводят в течение первых 7 последовательных дней, и соединение формулы (I) вводят в течение первых 28 последовательных дней. Еще в одном варианте осуществления в одном цикле лечения соединение формулы (I) вводят в течение 28 последовательных дней, и АЗА вводят в течение 7 последовательных дней, которые накладываются на введение соединения формулы (I). В другом варианте осуществления АЗА вводят в дни с 1 до 7, и соединение формулы (I) вводят в дни с 1 до 14 цикла лечения. В другом варианте осуществления АЗА вводят в дни с 1 до 7, и соединение формулы (I) вводят в дни с 1 до 28 цикла лечения. В другом варианте осуществления АЗА вводят в дни с 1 до 7, и соединение формулы (I) вводят в дни с 8 до 21 цикла лечения. Еще в одном варианте осуществления соединение формулы (I) вводят в дни с 1 до 14, и АЗА вводят в дни с 15 до 21 цикла лечения. В другом варианте осуществления цикл лечения составляет 28 дней, 29 дней, 30 дней или 31 день. В другом варианте осуществления цикл лечения представляет собой любой интервал времени продолжительностью от 4 недель до 6 недель.
В другом конкретном варианте осуществления в одном цикле лечения комбинированная терапия настоящего изобретения содержит пероральное введение соединения формулы (I) с использованием схемы, которую выбирают из группы, состоящей из:
A. 60 мг/день соединения формулы (I) или AC220 в дни с 1 до 14,
B. 60 мг/день соединения формулы (I) или AC220 в дни с 1 до 28,
C. 90 мг/день соединения формулы (I) или AC220 в дни с 1 до 14,
D. 90 мг/день соединения формулы (I) или AC220 в дни с 1 до 28,
E. 135 мг/день соединения формулы (I) или AC220 в дни с 1 до 14,
F. 135 мг/день соединения формулы (I) или AC220 в дни с 1 до 28,
G. 200 мг/день соединения формулы (I) или AC220 в дни с 1 до 14,
H. 200 мг/день соединения формулы (I) или AC220 в дни с 1 до 28,
I. 300 мг/день соединения формулы (I) или AC220 в дни с 1 до 14,
J. 300 мг/день соединения формулы (I) или AC220 в дни с 1 до 28,
K. 450 мг/день соединения формулы (I) или AC220 в дни с 1 до 14, и
L. 450 мг/день соединения формулы (I) или AC220 в дни с 1 до 28;
и подкожное или внутривенное введение АЗА с использованием схемы, которую выбирают из группы, состоящей из:
I. 100 мг/м2/день в течение 5 дней,
II. 100 мг/м2/день в дни с 1 до 5,
III. 75 мг/м2/день в течение 7 дней,
IV. 75 мг/м2/день в дни с 1 до 7
V. 75 мг/м2/день в течение 5 дней,
VI. 75 мг/м2/день в дни с 1 до 5,
VII. 75 мг/м2/день в течение 5 дней, с последующим перерывом на 2 дня, затем с последующими 2 дополнительными днями,
VIII. 75 мг/м2/день в дни с 1 по 5, с последующим перерывом на 6 и 7 день с последующим введением 75 мг/м2/день в дни 8 и 9,
IX. 50 мг/м2/день в течение 7 дней,
X. 50 мг/м2/день в дни с 1 по 7,
XI. 50 мг/м2/день ч/д (через день) в течение первых 14 дней,
XII. 50 мг/м2/день в дни 1, 3, 5, 7, 9, 11 и 13,
XIII. 50 мг/м2/день в течение 5 дней,
XIV. 50 мг/м2/день в дни с 1 по 5,
XV. 50 мг/м2/день в течение 5 дней, с последующим перерывом на 2 дня, затем с последующими 5 дополнительными днями введения 50 мг/м2/день,
XVI. 50 мг/м2/день в дни с 1 по 5, с последующим перерывом в дни 6 и 7, с последующим введением 50 мг/м2/день в дни с 8 до 13,
XVII. 50 мг/м2/день в течение 5 дней, с последующим перерывом на 2 дня, затем с последующим введением в течение 4 дополнительных дней 50 мг/м2/день,
XVIII. 50 мг/м2/день в дни с 1 по 5, с последующим перерывом в дни 6 и 7, с последующим введением 50 мг/м2/день в дни с 8 до 12,
XIX. 37,5 мг/м2/день в течение 7 дней,
XX. 37,5 мг/м2/день в дни с 1 до 7,
XXI. 8 мг/м2/день в течение 5 дней,
XXII. 8 мг/м2/день в дни с 1 до 5,
XXIII. 75 мг/м2/день в течение 5 дней,
XXIV. 75 мг/м2/день в течение первых 5 последовательных дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом конкретном варианте осуществления комбинированная схема содержит пероральное введение соединения формулы (I) или AC220 с использованием схемы, выбираемой из группы, состоящей из:
A. 60 мг/день соединения формулы (I) или AC220 в дни с 1 по 14,
B. 60 мг/день соединения формулы (I) или AC220 в дни с 1 по 28,
C. 90 мг/день соединения формулы (I) или AC220 в дни с 1 по 14,
D. 90 мг/день соединения формулы (I) или AC220 в дни с 1 по 28,
E. 135 мг/день соединения формулы (I) или AC220 в дни с 1 по 14,
F. 135 мг/день соединения формулы (I) или AC220 в дни с 1 по 28,
G. 200 мг/день соединения формулы (I) или AC220 в дни с 1 по 14,
H. 200 мг/день соединения формулы (I) или AC220 в дни с 1 по 28,
I. 300 мг/день соединения формулы (I) или AC220 в дни с 1 по 14,
J. 300 мг/день соединения формулы (I) или AC220 в дни с 1 по 28,
K. 450 мг/день соединения формулы (I) или AC220 в дни с 1 по 14, и
L. 450 мг/день соединения формулы (I) или AC220 в дни с 1 по 28;
и пероральное введение АЗА с использованием схемы, которую выбирают из группы, состоящей из:
aa. дозы, вычисленной для 100% доставки при подкожном введении (AUC) в дни с 1 по 7,
bb. 100 мг в дни с 1 по 7,
cc. 120 мг в дни с 1 по 7,
dd. 180 мг в дни с 1 по 7,
ee. 240 мг в дни с 1 по 7,
ff. 200 мг в дни с 1 по 7,
gg. 300 мг в дни с 1 по 7,
hh. 360 мг в дни с с 1 по 7,
ii. 420 мг в дни с 1 по 7,
jj. 480 мг в дни с 1 по 7,
kk. 540 мг в дни с 1 по 7,
ii. 600 мг в дни с 1 по 7,
mm. 660 мг в дни с 1 по 7,
nn. 720 мг в дни с 1 по 7,
oo. 780 мг в дни с 1 по 7,
pp. 840 мг в дни с 1 по 7,
qq. 900 мг в дни с 1 по 7,
rr. 960 мг в дни с 1 по 7,
ss. 1000 мг в дни с 1 по 7,
tt. 1020 мг в дни с 1 по 7,
uu. 1080 мг в дни с 1 по 7,
vv. 1140 мг в дни с 1 по 7, и
ww. 1200 мг в дни с 1 по 7;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В одном варианте осуществления в одном цикле лечения AC220 вводят перорально 14 дней, и АЗА вводят подкожно или внутривенно ежедневно в дозе 50 мг/м2 или 75 мг/м2 в течение первых 7 дней.
ii) Комбинация AC220 и цитарабина
В другом варианте осуществления настоящего способа соединение структурной формулы (I), описанной выше, или его соль, сольват, сложный эфир и/или пролекарство содержит AC220, или его соль, сольват, сложный эфир и/или пролекарство; и нуклеозидный аналог содержит цитарабин.
В одном варианте осуществления в одном цикле лечения комбинированная терапия содержит пероральное введение соединения формулы (I) или AC220 с использованием схемы, которую выбирают из группы, состоящей из:
A. 12 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
B. 20 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
C. 25 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
D. 50 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
E. 60 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
F. 75 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
G. 90 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
H. 100 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
I. 125 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
J. 135 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
K. 200 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
L. 225 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
М. 250 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
N. 300 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
и внутривенное или подкожное введение цитарабина по схеме, выбираемой из группы, состоящей из:
i. 5 мг/м2/день цитарабина в течение 7-25 дней,
ii. 5 мг/м2/день цитарабина в течение 10-14 дней,
iii. 10 мг/м2/день цитарабина в течение 7-14 дней,
iv. 10 мг/м2/день цитарабина в течение 7 дней,
v. 10 мг/м2/день цитарабина в течение 10 дней,
vi. 20 мг/м2/день цитарабина в течение 7-25 дней,
vii. 20 мг/м2/день цитарабина в течение 10-14 дней,
viii. 20 мг/м2/день цитарабина в течение 10 дней,
ix. 20 мг/м2/день цитарабина в течение 14 дней,
x. 20 мг/м2/день цитарабина в течение 21 дня,
xi. 5-30 мг/м2/день цитарабина в течение 1-4 недель,
xii. 100 мг/м2/день цитарабина в течение 7 дней,
xiii. 150 мг/м2/день цитарабина в течение 7 дней,
xiv. 200 мг/м2/день цитарабина в течение 7 дней,
xv. 100-200 мг/м2/день цитарабина в течение 7 дней,
xvi. 1 г/м2/день цитарабина в течение 7 дней,
xvii. 1 г/м2/день цитарабина в течение 5 дней,
xviii. 1 г/м2/день цитарабина в течение 4 дней,
xix. 1 г/м2/день цитарабина в течение 3 дней,
xx. 1 г/м2/день цитарабина в течение 7 дней,
xxi. 1,5 г/м2/день цитарабина в течение 4 дней,
xxii. 1,5 г/м2/день цитарабина в течение 3 дней,
xxiii. 2 г/м2/день цитарабина в течение 3 дней,
xxiv. 2 г/м2/день цитарабина в течение 4 дней,
xxv. 2 г/м2/день цитарабина в течение 5 дней,
xxvi. 2 г/м2/день цитарабина в течение 6 дней,
xxvii. 2 г/м2/день цитарабина на 12 доз каждые 12 часов,
xxviii. 4 г/м2/день цитарабина в течение 6 дней,
xxix. 3 г/м2/день цитарабина в течение 3 дней,
xxx. 3 г/м2/день цитарабина в течение 4 дней,
xxxi. 3 г/м2/день цитарабина в течение 5 дней,
xxxii. 3 г/м2/день цитарабина в течение 6 дней,
xxxiii. 3 г/м2 цитарабина на 12 доз каждые 12 часов,
xxxiv. 3 г/м2 цитарабина на 8 доз каждые 12 часов,
xxxv. 3 г/м2/день цитарабина на 6 доз каждые 12 часов,
xxxvi. 3 г/м2 цитарабина каждые 12 часов в течение 1, 3 и 5 дня,
xxxvii. 3 г/м2/день цитарабина на 12 доз каждые 12 часов,
xxxviii. 1 г/м2 цитарабина каждые 12 часов в течение 1, 3 и 5 дня,
xxxix. 6 г/м2/день цитарабина в течение 6 дней,
xl. 20 мг/день цитарабина в течение 10 дней, и
xli. 40 мг/день цитарабина в течение 10 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В одном варианте осуществления в одном цикле лечения комбинированная схема содержит пероральное введение соединения формулы (I) или AC220 с использованием схемы, которую выбирают из группы, состоящей из:
A. 60 мг/день соединения формулы (I) или AC220 в течение 14 дней,
B. 60 мг/день соединения формулы (I) или AC220 в течение 28 дней,
C. 60 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
D. 90 мг/день соединения формулы (I) или AC220 в течение 14 дней,
E. 90 мг/день соединения формулы (I) или AC220 в течение 28 дней,
F. 90 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
G. 135 мг/день соединения формулы (I) или AC220 в течение 14 дней,
H. 135 мг/день соединения формулы (I) или AC220 в течение 28 дней,
I. 135 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
J. 200 мг/день соединения формулы (I) или AC220 в течение 14 дней,
K. 200 мг/день соединения формулы (I) или AC220 в течение 28 дней,
L. 200 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
М. 300 мг/день соединения формулы (I) или AC220 в течение 14 дней,
N. 300 мг/день соединения формулы (I) или AC220 в течение 28 дней,
О. 300 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
P. 450 мг/день соединения формулы (I) или AC220 в течение 14 дней,
Q. 450 мг/день соединения формулы (I) или AC220 в течение 28 дней; и
R. 450 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
и внутривенное или подкожное введение цитарабина по схеме, которую выбирают из группы, состоящей из:
xlii. 5 мг/м2/день цитарабина в течение 7-25 дней,
xliii. 5 мг/м2/день цитарабина в течение 10-14 дней,
xliv. 10 мг/м2/день цитарабина в течение 7-14 дней,
xlv. 10 мг/м2/день цитарабина в течение 7 дней,
xlvi. 10 мг/м2/день цитарабина в течение 10 дней,
xlvii. 20 мг/м2/день цитарабина в течение 7-25 дней,
xlviii. 20 мг/м2/день цитарабина в течение 10-14 дней,
xlix. 20 мг/м2/день цитарабина в течение 10 дней,
l. 20 мг/м2/день цитарабина в течение 14 дней,
li. 20 мг/м2/день цитарабина в течение 21 дня,
lii. 5-30 мг/м2/день цитарабина в течение 1-4 недель,
liii. 100 мг/м2/день цитарабина в течение 7 дней,
liv. 150 мг/м2/день цитарабина в течение 7 дней,
lv. 200 мг/м2/день цитарабина в течение 7 дней,
lvi. 100-200 мг/м2/день цитарабина в течение 7 дней,
lvii. 1 г/м2/день цитарабина в течение 7 дней,
lviii. 1 г/м2/день цитарабина в течение 5 дней,
lix. 1 г/м2/день цитарабина в течение 4 дней,
Ix. 1 г/м2/день цитарабина в течение 3 дней,
lxi. 1 г/м2/день цитарабина в течение 7 дней,
lxii. 1,5 г/м2/день цитарабина в течение 4 дней,
lxiii. 1,5 г/м2/день цитарабина в течение 3 дней,
lxiv. 2 г/м2/день цитарабина в течение 3 дней,
lxv. 2 г/м2/день цитарабина в течение 4 дней,
lxvi. 2 г/м2/день цитарабина в течение 5 дней,
lxvii. 2 г/м2/день цитарабина в течение 6 дней,
lxviii. 2 г/м2/день цитарабина на 12 доз каждые 12 часов,
lxix. 4 г/м2/день цитарабина в течение 6 дней,
lxx. 3 г/м2/день цитарабина в течение 3 дней,
lxxi. 3 г/м2/день цитарабина в течение 4 дней,
lxxii. 3 г/м2/день цитарабина в течение 5 дней,
lxxiii. 3 г/м2/день цитарабина в течение 6 дней,
lxxiv. 3 г/м2 цитарабина на 12 доз каждые 12 часов,
lxxv. 3 г/м2 цитарабина на 8 доз каждые 12 часов,
lxxvi. 3 г/м2/день цитарабина на 6 доз каждые 12 часов,
lxxvii. 3 г/м2 цитарабина каждые 12 часов в течение 1, 3 и 5 дня,
lxxviii.3 г/м2/день цитарабина на 12 доз каждые 12 часов,
lxxix. 1 г/м2 цитарабина каждые 12 часов в течение 1, 3 и 5 дня,
lxxx. 6 г/м2/день цитарабина в течение 6 дней,
lxxxi. 20 мг/день цитарабина в течение 10 дней, и
lxxxii. 40 мг/день цитарабина в течение 10 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема дополнительно содержит внутривенное введение антрациклина с использованием схемы, которую выбирают из следующей группы:
ia: 45 мг/м2/день даунорубицина в течение 3 дней,
ib: 50 мг/м2/день даунорубицина в течение 3 дней,
ic: 60 мг/м2/день даунорубицина в течение 3 дней,
id: 45-60 мг/м2/день даунорубицина в течение 3 дней,
ie: 70 мг/м2/день даунорубицина в течение 3 дней,
if: 12 мг/м2/день идарубицина в течение 3 дней,
ig: 8 мг/м2/день идарубицина в течение 2 дней, и
ig: 12 мг/м2/день митоксантрона в течение 3 дней;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема введения соединения формулы (I) или AC220 и цитарабина дополнительно содержит внутривенное введение этопозида с использованием схемы, которую выбирают из следующей группы:
i. от 50 до 100 мг/м2/день этопозида в течение пяти дней;
ii. 50-100 мг/м2/день этопозида в течение дней с 1 до 5;
iii. 5-100 мг/м2/день этопозида в течение трех дней;
iv. 5-100 мг/м2/день этопозида в течение трех дней;
v. 50-100 мг/м2/день этопозида в течение дней с 1 до 5;
vi. 35 мг/м2/день этопозида в течение четырех дней;
vii. 40 мг/м2/день этопозида в течение четырех дней;
viii. 45 мг/м2/день этопозида в течение четырех дней;
ix. 50 мг/м2/день этопозида в течение четырех дней;
x. 35 мг/м2/день этопозида в течение четырех дней;
xi. 40 мг/м2/день этопозида в течение четырех дней;
xii. 45 мг/м2/день этопозида в течение четырех дней; и
xiii. 50 мг/м2/день этопозида в течение четырех дней;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме. В другом варианте осуществления комбинированная схема введения соединения формулы (I) или AC220 и цитарабина дополнительно содержит внутривенное введение этопозида с использованием схемы, которую выбирают из следующей группы:
i. 50-150 мг/м2/день этопозида в течение пяти дней;
ii. 50-150 мг/м2/день этопозида в течение дней с 1 до 5; и
iii. 150 мг/м2/день этопозида в течение пяти дней;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В одном варианте осуществления цитарабин вводят ежедневно путем непрерывного вливания в течение 24 часов. В другом варианте осуществления цитарабин вводят каждые 12 часов путем внутривенного вливания в течение от 1 до 2 часов. В другом варианте осуществления цитарабин вводят два раза в день подкожно. В другом варианте осуществления в одном цикле лечения цитарабин вводят через день в общей сложности в течение 3 дней введения. В другом варианте осуществления в одном цикле лечения цитарабин вводят через день в общей сложности в течение 4 дней введения. В другом варианте осуществления в одном цикле лечения цитарабин вводят в дни 1, 3 и 5. Еще в одном варианте осуществления в одном цикле лечения цитарабин вводят в дни 1, 3, 5 и 7.
В одном варианте осуществления в одном цикле лечения цитарабин вводят в течение первых 7 последовательных дней, антрациклин вводят в течение 3 последовательных дней, с наложением на период введения цитарабина, и соединение формулы (I) или AC220 вводят в течение 14 последовательных дней после завершения введения цитарабина и антрациклина. В другом варианте осуществления в одном цикле лечения цитарабин вводят в течение первых 7 последовательных дней, антрациклин вводят в течение 3 последовательных дней, с наложением на период введения цитарабина, и соединение формулы (I) или AC220 вводят в течение 14 последовательных дней, через одну неделю после завершения введения цитарабина и антрациклина. В другом варианте осуществления в одном цикле лечения цитарабин вводят в течение первых 7 последовательных дней, антрациклин вводят в течение 3 последовательных дней, с наложением на период введения цитарабина, и соединение формулы (I) или AC220 вводят в течение 14 последовательных в день, через две недели после завершения введения цитарабина и антрациклина. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят в течение первых 14 последовательных дней, цитарабин вводят в течение 7 последовательных дней после завершения введения соединения формулы (I) или AC220, и антрациклин вводят в течение 3 дней, с наложением на период введения цитарабина. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят в течение первых 28 последовательных дней, цитарабин вводят в течение 7 последовательных дней после завершения периода 14 дней введения соединения формулы (I) или AC220, и антрациклин вводят в течение 3 дней, с наложением на период введения цитарабина.
В другом варианте осуществления в одном цикле лечения цитарабин вводят в течение первых 7 последовательных дней, антрациклин вводят в течение 3 последовательных дней, с наложением на период введения цитарабина, и соединение формулы (I) или AC220 вводят в течение первых 28 последовательных дней. В другом варианте осуществления в одном цикле лечения цитарабин вводят в течение первых 7 последовательных дней, антрациклин вводят в течение 3 последовательных дней, с наложением на период введения цитарабина, и соединение формулы (I) или AC220 вводят в течение первых 14 последовательных дней. В другом варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 1 по 14. В другом варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 1 по 28. В одном варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 4 по 17. В одном варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 4 по 21. В другом варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 4 по 28. В одном варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3 и соединение формулы (I) или AC220 вводят в дни с 4 по 28. В одном варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят в дни с 4 по 35. В одном варианте осуществления в одном цикле лечения цитарабин вводят в дни 1, 3 и 5, и соединение формулы (I) или AC220 вводят в дни с 6 по 28.
В другом варианте осуществления в одном цикле лечения цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3 и соединение формулы (I) или AC220 вводят в дни с 8 по 21. В другом варианте осуществления цитарабин вводят в дни с 1 по 7, антрациклин вводят в дни с 1 по 3, и соединение формулы (I) или AC220 вводят с 1 до 7 дня и с 15 до 21 дня. В одном варианте осуществления цитарабин вводят внутривенно в дозе 100 мг/м2/день или 200 мг/м2/день. В одном варианте осуществления антрациклином является даунорубицин. В другом варианте осуществления даунорубицин вводят внутривенно в дозе 60 мг/м2/день. Еще в одном варианте осуществления соединение формулы (I) или AC220 перорально вводят в дозе 12 мг/м2/день, 20 мг/м2/день, 25 мг/м2/день, 40 мг/м2/день, 50 мг/м2/день, 60 мг/м2/день, 75 мг/м2/день, 90 мг/м2/день, 100 мг/м2/день, 125 мг/м2/день, 135 мг/м2/день, 150 мг/м2/день, или 200 мг/м2/день.
В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 перорально вводят в дозе 60 мг/день в дни с 1 до 14, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) вводят перорально в дозе 60 мг/день в дни с 1 до 28, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. Еще в одном варианте осуществления в одном цикле лечения соединение формулы (I) вводят перорально в дозе 60 мг/день с 1 до 7 дня и с 15 до 21 дня, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 4 до 28, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 перорально вводят в дозе 60 мг/день в дни с 8 до 21, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 4 до 35, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3.
В другом варианте осуществления в одном цикле лечения соединения формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 1 до 14, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 1 до 28, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. Еще в одном варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день с 1 до 7 дня и с 15 до 21 дня, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3 и соединение формулы (I) или AC220 перорально вводят в дозе 90 мг/день в дни с 4 до 35.
В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 1 до 14, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 1 до 28, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. Еще в одном варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день с 1 до 7 дня и с 15 до 21 дня, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 35.
В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 1 до 14, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 1 до 28, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. Еще в одном варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день с 1 до 7 дня и с 15 до 21 дня, цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, и даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3. В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3 и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 35.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 8 до 21.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 100 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3, и AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 200 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в 200 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 перорально вводят в дозе 200 мг/день в дни с 4 до 21. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 35. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 8 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 8 до 22.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 200 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3 и соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 21. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 35. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 8 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/днях в дни с 8 до 22.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 200 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3 и соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 21. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 35. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 8 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 8 до 22.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 200 мг/м2/день в дни с 1 до 7, даунорубицин вводят внутривенно в дозе 60 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 4 до 21. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 4 до 35. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 8 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 60 мг/день в дни с 8 до 22.
В одном варианте осуществления AC220 вводят в дозе 60 мг/м2/день, 90 мг/м2/день, 135 мг/м2/день или 200 мг/м2/день.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2 в течение 3 часов каждые 12 часов в дни 1, 3 и 5, и соединение формулы (I) или AC220 вводят перорально в течение от около 14 дней до около 32 дней. В одном варианте осуществления AC220 вводят в дни с 1 до 14. В одном варианте осуществления AC220 вводят в дни с 1 до 28. В одном варианте осуществления AC220 вводят в дни с 4 до 17. В одном варианте осуществления AC220 вводят в дни с 4 до 21. В одном варианте осуществления AC220 вводят в дни с 4 до 31. В одном варианте осуществления AC220 вводят в дни с 4 до 35. В одном варианте осуществления AC220 вводят в дни с 6 до 28. В одном варианте осуществления AC220 вводят в дни с 6 до 33. В одном варианте осуществления AC220 вводят в дни с 8 до 21. В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2 на протяжении 3 часов каждые 12 часов в дни 1, 3 и 5, и соединение формулы (I) или AC220 вводят перорально в дни с 8 до 21. В одном варианте осуществления AC220 вводят в дозе 60 мг/м2/день, 90 мг/м2/день, 135 мг/м2/день или 200 мг/м2/день. В одном варианте осуществления AC220 вводят в дозе 12 мг/м2/день, 20 мг/м2/день, 25 мг/м2/день, 40 мг/м2/день, 50 мг/м2/день, 60 мг/м2/день, 75 мг/м2/день, 90 мг/м2/день, 100 мг/м2/день, 125 мг/м2/день, 135 мг/м2/день, 150 мг/м2/день или 200 мг/м2/день.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2 каждые 12 часов в дни 1, 3 и 5, и AC220 вводят перорально в дозе 200 мг/день в дни с 6 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 1 г/м2 каждые 12 часов в дни 1, 3 и 5, и AC220 вводят перорально в дозе 200 мг/день в дни с 6 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2/день в течение 3 или 4 дней, и соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 6 до 28. В другом варианте осуществления цитарабин вводят в дни 1, 3 и 5. В другом варианте осуществления цитарабин вводят в дни 1, 3, 5 и 7.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2/день в течение 3 или 4 дней, и соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 6 до 28. В другом варианте осуществления цитарабин вводят в дни 1, 3 и 5.
В другом варианте осуществления цитарабин вводят в дни 1, 3, 5 и 7. В одном конкретном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2/день в течение 3 или 4 дней, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 6 до 28. В другом варианте осуществления цитарабин вводят в дни 1, 3 и 5. В другом варианте осуществления цитарабин вводят в дни 1, 3, 5 и 7.
В одном варианте осуществления в одном цикле лечения AC220 перорально вводят в течение 14 дней, идарубицин вводят внутривенно в дозе 12 мг/м2 в течение 1 часа ежедневно в дни 1, 2 и 3, цитарабин вводят внутривенно в виде непрерывного вливания в дозе 1,5 г/м2 на протяжении 24 часов ежедневно в дни с 1 до 4, и солюмедрол вводят в дозе 50 мг, или дексаметазон в дозе 10 мг вводят внутривенно ежедневно в течение 3-4 дней с цитарабином (в дни с 1 до 4). В конкретных вариантах осуществления AC220 вводят в дозе 75 мг/м2/день, 100 мг/м2/день, 125 мг/м2/день или 150 мг/м2/день.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 1,5 мг/м2/день в дни с 1 до 4, идарубицин вводят внутривенно в дозе 12 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 перорально вводят в дозе 90 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 1,5 г/м2/день в дни с 1 до 4, идарубицин вводят внутривенно в дозе мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 28.
В одном варианте осуществления в одном цикле лечения, цитарабин вводят внутривенно в дозе 1,5 г/м2/день в дни с 1 до 4, идарубицин вводят внутривенно в дозе 12 мг/м2/день в дни с 1 до 3, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 2 г/м2/день в течение 6 дней и соединения формулы (I) или AC220 вводят перорально в дозе 90 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 6 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 2 г/м2/день в течение 6 дней и соединения формулы (I) или AC220 вводят перорально в дозе 135 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/днях в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 6 до 28.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 2 г/м2/день в течение 6 дней и соединения формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 6 до 28.
В одном варианте осуществления в одном цикле лечения AC220 вводят перорально ежедневно в течение до 4 недель, идарубицин вводят внутривенно в дозе 8 мг/м2 на протяжении 1 часа ежедневно в течение 2 дней, цитарабин вводят внутривенно в дозе 1,5 г/м2 на протяжении 24 часов ежедневно в течение 3 дней, и вводят солюмедрол в дозе 50-100 мг или вводят дексаметазон в дозе 10 мг внутривенно ежедневно в течение 3 дней с цитарабином (в дни с 1 до 3). В конкретных вариантах осуществления AC220 вводят в дозе 75 мг/м2/день, 100 мг/м2/день, 125 мг/м2/день или 150 мг/м2/день.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 0,75 г/м2/день в дни с 1 до 3, идарубицин вводят внутривенно в дозе 8 г/м2/день в дни 1 и 2, и соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 90 мг/день в дни с 4 до 33.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 0,75 г/м2/день в дни с 1 до 3, идарубицин вводят внутривенно в дозе 8 мг/м2/день в дни 1 и 2, и соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 135 мг/день в дни с 4 до 33.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 0,75 г/м2/день в дни с 1 до 3, идарубицин вводят внутривенно в дозе 8 мг/м2/день в дни 1 и 2, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение от около 14 до около 32 дней. В одном варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 1 до 14. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 21. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 28. В другом варианте осуществления соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в дни с 4 до 33.
В одном варианте осуществления в одном цикле лечения идарубицин вводят внутривенно в дозе 12 мг/м2 в дни 1, 3 и 5, цитарабин вводят внутривенно в виде непрерывного вливания в дозе 100 мг/м2 с 1 до 7 дня, AC220 перорально вводят в дозе 200 мг/день с 4 до 21 дня. В одном варианте осуществления цикл лечения дополнительно содержит введение полностью транс-ретиноевой кислоты (ATRA) в дозе 45 мг/м2 в дни с 6 до 8 и в дозе 15 мг/м2 в дни с 9 до 21.
В одном варианте осуществления в одном цикле лечения цитарабин вводят внутривенно в дозе 3 г/м2 каждые 12 часов в течение дней с 1 до 3, и AC220 вводят перорально в дозе 200 мг/день в дни с 3 до 21. В одном варианте осуществления цикл лечения дополнительно содержит введение полностью транс-ретиноевой кислоты (ATRA) в дозе 15 мг/м2 в дни с 4 до 21.
В одном варианте осуществления в одном цикле лечения этопозид вводят внутривенно в дозе 150 мг/м2/день в дни с 1 до 5, цитарабин вводят внутривенно в дозе 1000 мг/м2/день с введением каждые 12 часов в дни с 1 до 5, AC220 вводят перорально ежедневно в дни с 5 до 28, и метотрексат вводят интратекально в дозе 8 мг, 10 мг, 12 мг или 15 мг в день 0. В одном варианте осуществления AC220 вводят в дозе 75 мг/м2/день, 100 мг/м2/день, 125 мг/м2/день или 150 мг/м2/день.
В одном варианте осуществления в одном цикле лечения этопозид вводят внутривенно в дозе 150 мг/м2/день в дни с 1 до 5, цитарабин вводят внутривенно в дозе 1000 мг/м2/день с введением каждые 12 часов в дни с 1 до 5, AC220 вводят перорально ежедневно в дни с 5 до 28, и цитарабин вводят интратекально в дозе 30 мг, 50 мг или 70 мг в день 0.
iii) Комбинация соединения формулы (I) или AC220 и клофарабина
В одном варианте осуществления настоящего способа соединение со структурной формулой (I), описанное выше, или его соль, сольват, сложный эфир и/или пролекарство содержит AC220; и нуклеозидный аналог содержит клофарабин.
В одном варианте осуществления в одном цикле лечения комбинированная схема содержит пероральное введение соединения формулы (I) или AC220, с использованием схемы, которую выбирают из группы, состоящей из:
A. 60 мг/день соединения формулы (I) или AC220 в течение 14 дней,
B. 60 мг/день соединения формулы (I) или AC220 в течение 28 дней,
C. 90 мг/день соединения формулы (I) или AC220 в течение 14 дней,
D. 90 мг/день соединения формулы (I) или AC220 в течение 28 дней,
E. 135 мг/день соединения формулы (I) или AC220 в течение 14 дней,
F. 135 мг/день соединения формулы (I) или AC220 в течение 28 дней,
G. 200 мг/день соединения формулы (I) или AC220 в течение 14 дней,
H. 200 мг/день соединения формулы (I) или AC220 в течение 28 дней,
I. 300 мг/день соединения формулы (I) или AC220 в течение 14 дней,
J. 300 мг/день соединения формулы (I) или AC220 в течение 28 дней,
K. 450 мг/день соединения формулы (I) или AC220 в течение 14 дней, и
L. 450 мг/день соединения формулы (I) или AC220 в течение 28 дней;
и внутривенное введение клофарабина по схеме, которую выбирают из группы, состоящей из:
ii. 10 мг/м2/день клофарабина в течение 5 дней,
iia. 15 мг/м2/день клофарабина в течение 5 дней,
iib. 20 мг/м2/день клофарабина в течение 5 дней,
iic. 22,5 мг/м2/день клофарабина в течение 5 дней,
iid. 30 мг/м2/день клофарабина в течение 5 дней,
iie. 40 мг/м2/день клофарабина в течение 5 дней, и
iif. 52 мг/м2/день клофарабина в течение 5 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема дополнительно содержит внутривенное введение цитарабина с использованием схемы, которую выбирают из следующей группы:
iiia. 1 г/м2/день цитарабина в течение 5 дней
iiib. 1 г/м2/день цитарабина в течение 7 дней,
iiic. 1,5 г/м2/день цитарабина в течение 3 дней,
iiid. 1,5 г/м2/день цитарабина в течение 5 дней,
iiie. 2 г/м2/день цитарабина в течение 3 дней,
iiif. 2 г/м2/день цитарабина в течение 4 дней,
iiig. 2 г/м2/день цитарабина в течение 5 дней,
iiih. 2 г/м2/день цитарабина в течение 6 дней,
iiii. 3 г/м2/день цитарабина в течение 3 дней,
iiij. 3 г/м2/день цитарабина в течение 4 дней,
iiik. 3 г/м2/день цитарабина в течение 5 дней,
iiil. 3 г/м2/день цитарабина в течение 6 дней,
iiim. 4 г/м2/день цитарабина в течение 3 дней,
iiin. 4 г/м2/день цитарабина в течение 4 дней,
iiio. 4 г/м2/день цитарабина в течение 5 дней,
iiip. 4 г/м2/день цитарабина в течение 6 дней,
iiiq. 6 г/м2/день цитарабина в течение 3 дней,
iiir. 6 г/м2/день цитарабина в течение 4 дней,
iiis. 6 г/м2/день цитарабина в течение 5 дней, и
iiit. 6 г/м2/день цитарабина в течение 6 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема, содержащая введение соединения формулы (I) или AC220 и клофарабина, дополнительно содержит внутривенное введение антрациклина с использованием схемы, которую выбирают из следующей группы:
ia: 45 мг/м2/день даунорубицина в течение 3 дней,
ib: 50 мг/м2/день даунорубицина в течение 3 дней,
ic: 60 мг/м2/день даунорубицина в течение 3 дней,
id: 45-60 мг/м2/день даунорубицина в течение 3 дней,
ie: 70 мг/м2/день даунорубицина в течение 3 дней,
if: 12 мг/м2/день идарубицина в течение 3 дней, и
ig: 12 мг/м2/день митоксантрона в течение 3 дней;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В одном варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 40 мг/м2/день в течение первых 5 последовательных дней, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение 14 последовательных дней после завершения введения клофарабина. В одном варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 52 мг/м2/день в течение первых 5 последовательных дней, и соединения формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение 14 последовательных дней после завершения введения клофарабина.
В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение 14 последовательных дней, и клофарабин вводят внутривенно в дозе 40 мг/м2/день в течение 5 последовательных дней после завершения введения соединения формулы (I) или AC220. В другом варианте осуществления в одном цикле лечения соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение 14 последовательных дней, и клофарабин вводят внутривенно в дозе 52 мг/м2/день в течение 5 последовательных дней после завершения введения соединения формулы (I) или AC220.
В другом варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 40 мг/м2/день в течение первых 5 последовательных дней, и соединения формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение первых 14 последовательных дней. В другом варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 40 мг/м2/день в течение первых 5 последовательных дней, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение первых 28 последовательных дней. В другом варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 52 мг/м2/день в течение первых 5 последовательных дней, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение первых 14 последовательных дней. В другом варианте осуществления в одном цикле лечения клофарабин вводят внутривенно в дозе 52 мг/м2/день в течение первых 5 последовательных дней, и соединение формулы (I) или AC220 вводят перорально в дозе 200 мг/день в течение первых 28 последовательных дней.
В одном варианте осуществления в одном цикле лечения AC220 перорально вводят в течение 14 дней, и клофарабин вводят в течение первых 5 дней ежедневно в дозе 10 мг/м2, 15 мг/м2, 20 мг/м2, 25 мг/м2 или 30 мг/м2.
iv) Комбинация AC220 и кладрибина
В одном варианте осуществления настоящего способа соединение со структурной формулой (I), описанное выше, или его соль, сольват, сложный эфир и/или пролекарство содержит AC220; и нуклеозидный аналог содержит кладрибин.
В одном варианте осуществления в одном цикле лечения комбинированная схема содержит пероральное введение соединения формулы (I) или AC220 с использованием схемы, которую выбирают из группы, состоящей из:
A. 60 мг/день соединения формулы (I) или AC220 в течение 14 дней,
B. 60 мг/день соединения формулы (I) или AC220 в течение 28 дней,
C. 90 мг/день соединения формулы (I) или AC220 в течение 14 дней,
D. 90 мг/день соединения формулы (I) или AC220 в течение 28 дней,
E. 135 мг/день соединения формулы (I) или AC220 в течение 14 дней,
F. 135 мг/день соединения формулы (I) или AC220 в течение 28 дней,
G. 200 мг/день соединения формулы (I) или AC220 в течение 14 дней,
H. 200 мг/день соединения формулы (I) или AC220 в течение 28 дней,
I. 300 мг/день соединения формулы (I) или AC220 в течение 14 дней,
J. 300 мг/день соединения формулы (I) или AC220 в течение 28 дней,
K. 450 мг/день соединения формулы (I) или AC220 в течение 14 дней, и
L. 450 мг/день соединения формулы (I) или AC220 в течение 28 дней;
и внутривенное введение кладрибина по схеме, которую выбирают из группы, состоящей из:
ii. 0,09 мг/кг/день кладрибина в течение 7 дней,
iia. 12 мг/м2/день кладрибина в течение 5 дней,
iib. 0,15 мг/кг/день кладрибина в течение 5 дней,
iic. 5,6 мг/м2/день кладрибина в течение 5 дней,
iid. 0,875 мг/кг/день кладрибина в течение 2 дней,
iie. 0,875 мг/кг/день кладрибина в течение 4 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В одном варианте осуществления кладрибин вводят путем подкожной инъекции в дозе 1,5 мг/м2 три раза в день ежедневно в течение 7 дней.
В другом варианте осуществления комбинированная схема дополнительно содержит внутривенное введение цитарабина с использованием схемы, которую выбирают из следующей группы:
iiia. 1 г/м2/день цитарабина в течение 5 дней
iiib. 1 г/м2/день цитарабина в течение 7 дней,
iiic. 1,5 г/м2/день цитарабина в течение 3 дней,
iiid. 1,5 г/м2/день цитарабина в течение 5 дней,
iiie. 2 г/м2/день цитарабина в течение 3 дней,
iiif. 2 г/м2/день цитарабина в течение 4 дней,
iiig. 2 г/м2/день цитарабина в течение 5 дней,
iiih. 2 г/м2/день цитарабина в течение 6 дней,
iiii. 3 г/м2/день цитарабина в течение 3 дней,
iiij. 3 г/м2/день цитарабина в течение 4 дней,
iiik. 3 г/м2/день цитарабина в течение 5 дней,
iiil. 3 г/м2/день цитарабина в течение 6 дней,
iiim. 4 г/м2/день цитарабина в течение 3 дней,
iiin. 4 г/м2/день цитарабина в течение 4 дней,
iiio. 4 мг/м2/день цитарабина в течение 5 дней,
iiip. 4 г/м2/день цитарабина в течение 6 дней,
iiiq. 6 г/м2/день цитарабина в течение 3 дней,
iiir. 6 г/м2/день цитарабина в течение 4 дней,
iiis. 6 г/м2/день цитарабина в течение 5 дней, и
iiit. 6 г/м2/день цитарабина в течение 6 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема, содержащая введение соединения формулы (I) или AC220 и клофарабина, дополнительно содержит введение антрациклина с использованием схемы, известной специалистам в данной области.
v) Комбинация AC220 и этопозида
В одном варианте осуществления вторым агентом является этопозид, и доза этопозида составляет от около 10 мг/м2 до около 150 мг/м2, от около 20 мг/м2 до около 120 мг/м2 или от около 30 мг/м2 до 100 мг/м2. В другом варианте осуществления доза этопозида составляет около 35 мг/м2. В другом варианте осуществления доза этопозида составляет около 50 мг/м2. В другом варианте осуществления доза этопозида составляет около 100 мг/м2. В одном варианте осуществления доза этопозида составляет примрно от 50 до 100 мг/м2 в день в течение 5 дней. В одном варианте осуществления доза этопозида составляет около 35 мг/м2 в день в течение 4 дней. В одном варианте осуществления доза этопозида составляет около 50 мг/м2 в день в течение 5 дней. В одном варианте осуществления ежедневная доза этопозида составляет около 100 мг/м2 в день в дни 1, 3 и 5. В одном варианте осуществления этопозид вводят один раз в день в течение 5 дней, тогда как AC220 вводят один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение этопозида происходит один раз в день в дни 1, 3 и 5, тогда как введение AC220 происходит один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления этопозид вводят один раз в день в течение 4 дней, тогда как введение AC220 происходит один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель.
Введение этопозида можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции.
В одном варианте осуществления в одном цикле лечения этопозид вводят в течение трех, четырех или пяти дней перед введением AC220. В другом варианте осуществления в одном цикле лечения этопозид вводят в течение трех, четырех или пяти дней, которые накладываются на период введения AC220.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе около 60 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 90 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 135 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 200 мг/день и этопозида в дозе около 35 мг/м2; или AC220 в дозе около 450 мг/день и этопозида в дозе около 35 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе около 60 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 90 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 135 мг/день и этопозида в дозе около 35 мг/м2; AC220 в дозе около 200 мг/день и этопозида в дозе около 35 мг/м2; или AC220 в дозе около 450 мг/день и этопозида около 35 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и этопозида в дозе около 50 мг/м2; AC220 в дозе около 90 мг/день и этопозида в дозе около 50 мг/м2; AC220 в дозе около 135 мг/день и этопозида в дозе около 50 мг/м2; AC220 в дозе около 200 мг/день и этопозида в дозе около 50 мг/м2; или AC220 в дозе около 450 мг/день и этопозида в дозе около 50 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и этопозида в дозе около 100 мг/м2; AC220 в дозе около 90 мг/день и этопозида в дозе около 100 мг/м2; AC220 в дозе около 135 мг/день и этопозида в дозе около 100 мг/м2; AC220 в дозе около 200 мг/день и этопозида в дозе около 100 мг/м2; или AC220 в дозе около 450 мг/день и этопозида в дозе около 100 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и этопозида в дозе около 150 мг/м2; AC220 в дозе около 90 мг/день и этопозида в дозе около 150 мг/м2; AC220 в дозе около 135 мг/день и этопозида в дозе около 150 мг/м2; AC220 в дозе около 200 мг/день и этопозида в дозе около 150 мг/м2; или AC220 в дозе около 450 мг/день и этопозида в дозе около 150 мг/м2.
В одном варианте осуществления комбинированная схема в одном цикле лечения содержит пероральное введение AC220 с использованием схемы, выбираемой из:
A. 60 мг/день соединения формулы (I) или AC220 в течение 14 дней,
B. 60 мг/день соединения формулы (I) или AC220 в течение 28 дней,
C. 90 мг/день соединения формулы (I) или AC220 в течение 14 дней,
D. 90 мг/день соединения формулы (I) или AC220 в течение 28 дней,
E. 135 мг/день соединения формулы (I) или AC220 в течение 14 дней,
F. 135 мг/день соединения формулы (I) или AC220 в течение 28 дней,
G. 200 мг/день соединения формулы (I) или AC220 в течение 14 дней,
H. 200 мг/день соединения формулы (I) или AC220 в течение 28 дней,
I. 300 мг/день соединения формулы (I) или AC220 в течение 14 дней,
J. 300 мг/день соединения формулы (I) или AC220 в течение 28 дней,
K. 450 мг/день соединения формулы (I) или AC220 в течение 14 дней, и
L. 450 мг/день соединения формулы (I) или AC220 в течение 28 дней;
и внутривенное введение этопозида с использованием схемы, которую выбирают из следующей группы:
i. 50-100 мг/м2/день этопозида в течение пяти дней;
ii. 50-100 мг/м2/день этопозида в течение дней с 1 до 5;
iii. 5-100 мг/м2/день этопозида в течение трех дней;
iv. 5-100 мг/м2/день этопозида в течение трех дней;
v. 150 мг/м2/день этопозида в течение дней с 1 до 5;
vi. 150 мг/м2/день этопозида в течение 5 дней;
vii. 35 мг/м2/день этопозида в течение четырех дней;
viii. 40 мг/м2/день этопозида в течение четырех дней;
ix. 45 мг/м2/день этопозида в течение четырех дней;
x. 50 мг/м2/день этопозида в течение четырех дней;
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
В другом варианте осуществления комбинированная схема в одном цикле лечения содержит пероральное введение AC220 с использованием схемы, которую выбирают из:
A. 25 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
B. 25 мг/день соединения формулы (I) или AC220 в течение 23 дней,
C. 50 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
D. 50 мг/день соединения формулы (I) или AC220 в течение 23 дней,
E. 75 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
F. 75 мг/день соединения формулы (I) или AC220 в течение 23 дней,
G. 100 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
H. 100 мг/день соединения формулы (I) или AC220 в течение 23 дней,
I. 125 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
J. 125 мг/день соединения формулы (I) или AC220 в течение 23 дней,
K. 150 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
L. 150 мг/день соединения формулы (I) или AC220 в течение 23 дней;
М. 200 мг/день соединения формулы (I) или AC220 в течение 14-32 дней,
N. 200 мг/день соединения формулы (I) или AC220 в течение 23 дней;
и внутривенное введение этопозида с использованием схемы, которую выбирают из следующей группы:
i. 50-150 мг/м2/день этопозида в течение пяти дней; и
ii. 150 мг/м2/день этопозида в течение пяти дней;
и внутривенное введение цитарабина с использованием схемы, которую выбирают из следующей группы:
a. 1 г/м2/день цитарабина в течение 5 дней
b. 1 г/м2/день цитарабина в течение 7 дней,
c. 1,5 г/м2/день цитарабина в течение 3 дней,
d. 1,5 г/м2/день цитарабина в течение 5 дней,
e. 2 г/м2/день цитарабина в течение 3 дней,
f. 2 г/м2/день цитарабина в течение 4 дней,
g. 2 г/м2/день цитарабина в течение 5 дней, и
h. 2 г/м2/день цитарабина в течение 6 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме. В одном варианте осуществления оба препарата цитарабин и этопозид вводят в дни с 1 до 5, и AC220 вводят в дни с 5 до 28. В одном варианте осуществления и цитарабин и этопозид вводят в дни с 1 до 5, и AC220 вводят в дни с 6 до 28. В одном варианте осуществления и цитарабин и этопозид вводят в дни с 1 до 5, и AC220 вводят в дни с 6 до 19.
vi) Комбинация AC220 и даунорубицина
В одном варианте осуществления вторым агентом является этопозид, и доза даунорубицин составляет от около 10 мг/м2 до около 100 мг/м2, от около 10 мг/м2 до около 60 мг/м2, от около 10 мг/м2 до около 50 мг/м2, от около 20 мг/м2 до около 50 мг/м2 или от около 20 мг/м2 до 45 мг/м2. В другом варианте осуществления доза даунорубицина составляет около 25 мг/м2. В другом варианте осуществления доза даунорубицина составляет около 30 мг/ м2. В другом варианте осуществления доза даунорубицина составляет около 45 мг/м2. В другом варианте осуществления доза даунорубицина составляет около 60 мг/м2. В одном варианте осуществления введение даунорубицина происходит один раз в день в дни 1, 2 и 3, при этом введение AC220 происходит один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина происходит один раз в день в дни 1 и 2, при этом введение AC220 происходит один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. В одном варианте осуществления введение даунорубицина происходит один раз в день в день 1, при этом введение AC220 происходит один раз в день в течение одной недели, двух недель, трех недель, четырех недель или пяти недель. Введение даунорубицина можно осуществлять путем внутривенного вливания, внутривенного прерывистого вливания, болюсного вливания или подкожной инъекции.
В одном варианте осуществления в одном цикле лечения антрациклин вводят в течение трех дней перед введением AC220. В другом варианте осуществления в одном цикле лечения антрациклин вводят в течение трех дней, которые накладываются на период введения AC220. В другом варианте осуществления в одном цикле лечения антрациклин вводят в течение трех дней, последующих за периодом введения AC220.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и даунорубицина в дозе около 25 мг/м2; AC220 около 90 мг/день и даунорубицина около 25 мг/м2; AC220 около 135 мг/день и даунорубицина около 25 мг/м2; AC220 около 200 мг/день и даунорубицина около 25 мг/м2; или AC220 около 450 мг/день и даунорубицина около 25 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и даунорубицина в дозе около 30 мг/м2; AC220 около 90 мг/день и даунорубицина около 30 мг/м2; AC220 около 135 мг/день и даунорубицина около 30 мг/м2; AC220 около 200 мг/день и даунорубицина около 30 мг/м2; или AC220 около 450 мг/день и даунорубицина около 30 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и даунорубицина в дозе около 45 мг/м2; AC220 около 90 мг/день и даунорубицина около 45 мг/м2; AC220 около 135 мг/день и даунорубицина около 45 мг/м2; AC220 около 200 мг/день и даунорубицина около 45 мг/м2; или AC220 около 450 мг/день и даунорубицина около 45 мг/м2.
В некоторых вариантах осуществления способы лечения рака содержат введение AC220 в дозе от около 60 мг/день и даунорубицина в дозе около 60 мг/м2; AC220 около 90 мг/день и даунорубицина около 60 мг/м2; AC220 около 135 мг/день и даунорубицина около 60 мг/м2; AC220 около 200 мг/день и даунорубицина около 45 мг/м2; или AC220 около 450 мг/день и даунорубицина около 60 мг/м2.
В одном варианте осуществления комбинированная схема в одном цикле лечения содержит пероральное введение AC220 с использованием режима, выбираемого из:
A. 60 мг/день соединения формулы (I) или AC220 в течение 14 дней,
B. 60 мг/день соединения формулы (I) или AC220 в течение 28 дней,
C. 90 мг/день соединения формулы (I) или AC220 в течение 14 дней,
D. 90 мг/день соединения формулы (I) или AC220 в течение 28 дней,
E. 135 мг/день соединения формулы (I) или AC220 в течение 14 дней,
F. 135 мг/день соединения формулы (I) или AC220 в течение 28 дней,
G. 200 мг/день соединения формулы (I) или AC220 в течение 14 дней,
H. 200 мг/день соединения формулы (I) или AC220 в течение 28 дней,
I. 300 мг/день соединения формулы (I) или AC220 в течение 14 дней,
J. 300 мг/день соединения формулы (I) или AC220 в течение 28 дней,
K. 450 мг/день соединения формулы (I) или AC220 в течение 14 дней, и
L. 450 мг/день соединения формулы (I) или AC220 в течение 28 дней;
и внутривенное введение антрациклина с использованием схемы, которую выбирают из следующей группы:
i: 45 мг/м2/день даунорубицина в течение 3 дней,
ii: 50 мг/м2/день даунорубицина в течение 3 дней,
iii: 60 мг/м2/день даунорубицина в течение 3 дней,
iv: 45-60 мг/м2/день даунорубицина в течение 3 дней,
vi: 70 мг/м2/день даунорубицина в течение 3 дней,
при этом комбинированное введение проводят по одновременной, сопутствующей, раздельной или последовательной схеме.
F. Примеры схем введения AC220 и вторых агентов
В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат, и вторые агенты, рассматриваемые в изобретении, можно вводить согласно любой схеме, которую специалист в данной области техники считает подходящей. В этом разделе представлены примеры возможных для осуществления в способах согласно изобретению схем введения AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата в комбинации со вторыми агентами.
В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат и вторые агенты вводят циклами. В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат и вторые агенты вводят по меньшей мере в одном цикле. В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат и вторые агенты вводят по меньшей мере в двух циклах. В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат и вторые агенты вводят по меньшей мере в трех циклах. В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат и вторые агенты вводят по меньшей мере в четырех циклах. В конкретных вариантах осуществления каждый цикл составляет по меньшей мере 28 дней. В одном варианте осуществления вторым агентом является этопозид. В одном варианте осуществления вторым агентом является даунорубицин. В одном варианте осуществления вторым агентом является идарубицин. В одном варианте осуществления вторым агентом является цитарабин. В одном варианте осуществления вторым агентом является АЗА. В одном варианте осуществления вторым агентом является клофарабин.
В конкретных вариантах осуществления начальную дозу AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата вводят перед введением второго агента. В конкретных вариантах осуществления начальную дозу AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата вводят непосредственно перед введением второго агента. В конкретных вариантах осуществления введение второго агента начинают через 1, 2, 3, 4, 8, 12, 16, 24 или 32 часа, или через 1, 2, 3, 4, 5, 6 или 7 дней после введения AC220, например, через 1, 2, 3, 4, 8, 12, 16, 24 или 32 часа, или через 1, 2, 3, 4, 5, 6 или 7 дней после окончания введения AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата.
В конкретных вариантах осуществления начальную дозу AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата вводят после введения второго агента. В конкретных вариантах осуществления начальную дозу AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата вводят непосредственно после введения второго агента. В конкретных вариантах осуществления введение AC220 и/или его фармацевтически приемлемой соли, пролекарства, сольвата или гидрата начинают через 1, 2, 3, 4, 8, 12, 16, 24 или 32 часа, или через 1, 2, 3, 4, 5, 6 или 7 дней после введения второго агента, например, через 1, 2, 3, 4, 8, 12, 16, 24 или 32 часа, или через 1, 2, 3, 4, 5, 6 или 7 дней после завершения введения второго агента.
G. Популяция пациентов
В конкретных вариантах осуществления AC220 и/или его фармацевтически приемлемую соль, пролекарство, сольват или гидрат согласно изобретению и вторые агенты можно вводить любому пациенту/больному раком, который, по мнению специалиста в данной области, подходит для такого лечения.
В одном варианте осуществления способы согласно изобретению предназначены для лечения пациента с рецидивом или резистентностью к предшествующей противораковой терапии. В конкретных вариантах осуществления у пациента возникает рецидив после первого, второго, третьего или последующего курса противораковой терапии.
В конкретных вариантах осуществления возраст пациента составляет 60 лет или больше, и он находится в стадии рецидива после первого курса противораковой терапии. В конкретных вариантах осуществления возраст пациента составляет 18 лет или старше, и он находится в состоянии рецидива или резистентности после второго курса противораковой терапии. В конкретных вариантах осуществления возраст пациента составляет 18 лет или старше, и он находится в состоянии рецидива или резистентности после третьего или последующего курса противораковой терапии. В конкретных вариантах осуществления пациент находится в возрасте 60 лет или старше и является резистентным к первому курсу противораковой терапии. В конкретных вариантах осуществления пациент находится в возрасте 70 лет или старше и ранее не получал лечения. В конкретных вариантах осуществления пациент находится в возрасте 70 лет или старше и не подходит для противораковой терапии, и/или ее эффект является маловероятным.
В конкретных вариантах осуществления ранее нелеченные пациенты, не подходящие для противораковой терапии и/или имеющие малую вероятностью ее эффекта, включают пациентов, имеющих по меньшей мере один из следующих неблагоприятных факторов: наличие в анамнезе МДС, диагностированные неблагоприятные цитогенетические данные, статус общего состояния по шкале ECOG (Восточной объединенной группы онкологов) 1, 2 или 3, или возраст ≥?75 лет.
В конкретных вариантах осуществления у пациента:
a) возраст 60 лет или старше и рецидив после первого курса противораковой терапии,
b) возраст 60 лет или старше и резистентность к первому курсу противораковой терапии,
c) возраст 18 лет или старше и рецидив или рефрактерность после после второго курса противораковой терапии, или
d) возраст 70 лет или старше, ранее он не получал лечение и не подходит для противораковой терапии, и/или ее эффект является маловероятным.
В конкретных вариантах осуществления у пациента возникает рецидив после третьего курса противораковой терапии или терапии спасения.
В конкретных вариантах осуществления возраст пациента составляет 60, 65, 70, 75, 80, 85 лет или старше, и у него возникает рецидив после первого курса противораковой терапии. В конкретных вариантах осуществления возраст пациента составляет 60, 65, 70, 75, 80, 85 лет или старше, и он проявляет резистентность к первому курсу противораковой терапии. В конкретных вариантах осуществления пациент находится в возрасте 18, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85 лет или старше, и у него возникает рецидив после второго курса противораковой терапии. В конкретных вариантах осуществления возраст пациента составляет 70, 75, 80, 85 лет или старше, при этом ранее он не получал лечение, и не подходит для противораковой терапии, и/или ее эффект является маловероятным.
В конкретных вариантах осуществления ранее нелеченные пациенты, которые не подходят для химиотерапии и/или с ее малой вероятностью включают пациентов, имеющих по меньшей мере один из следующих неблагоприятных факторов: наличие в анамнезе МДС (миелодиспластического синдрома), диагностированные неблагоприятные цитогенетические данные, статус общего состояния по шкале ECOG (Восточной объединенной группы онкологов) 1, 2 или 3, или возраст ≥75 лет.
В некоторых вариантах осуществления пациента лечат на основе статуса общего состояния Восточной объединенной группы онкологов (ECOG) по шкале для больных лейкозом. Статус общего состояния ECOG можно определить по шкале от 0 до 5, где 0 обозначает отсутствие симптомов; 1 обозначает наличие симптомов с возможностью амбулаторного лечения; 2 обозначает наличие симптомов и <50% времени постельного режима в течение дня; 3 обозначает наличие симптомов и >50% постельного режима, но пациент не прикован к постели; 4 обозначает состояние прикованности к постели; и 5 обозначает смерть. В некоторых вариантах осуществления пациент имеет показатель статуса общего состояния ECOG 0, 1, 2 или 3. В других вариантах осуществления пациент имеет показатель статуса общего состояния ECOG 0, 1 или 2. В других вариантах осуществления пациент имеет показатель статуса общего состояния ECOG 1 или 2. В некоторых вариантах осуществления пациент имеет показатель статуса общего состояния ECOG 2 или 3. В других вариантах осуществления пациент имеет показатель статуса общего состояния ECOG 2.
В конкретных вариантах осуществления способы согласно изобретению содержат введение соединения по меньшей мере примерно через 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов после еды. В конкретных вариантах осуществления соединение вводят примерно за 1, 2, 3, 4, 5 или 6 часов перед едой. В конкретных вариантах осуществления соединение вводят по меньшей мере примерно через 2 часа после еды и примерно за 1 час или больше перед едой.
В конкретных вариантах осуществления способы согласно изобретению охватывают лечение субъекта независимо от возраста пациента, вместе с тем некоторые заболевания или нарушения больше распространены в конкретных возрастных группах. Дополнительно в изобретении рассматривается способ лечения субъектов, подвергавшихся хирургическому вмешательству с целью лечения рассматриваемого заболевания или состояния, а также пациентов без хирургического вмешательства. Поскольку страдающие раком субъекты имеют гетерогенную клиническую симптоматику и разные клинические исходы, лечение конкретного субъекта может варьировать в зависимости от прогноза его/ее заболевания. Квалифицированный клиницист сможет легко определить без неуместного экспериментирования конкретные вторичные агенты, типы хирургического вмешательства и типы нелекарственной стандартной терапии, которую можно эффективно использовать для лечения рака у конкретного субъекта.
В конкретных вариантах осуществления способы согласно изобретению применяют для лечения пациентов, получавших интенсивное предварительное лечение. Пациентом после интенсивного предварительного лечения считается пациент, которому ранее провели лечение, например, тремя курсами противораковой терапии или большим количеством курсов. В конкретных вариантах осуществления пациенту, получавшему интенсивное предварительное лечение, провели 3, 4, 5, 6, 7, 8, 9 или 10 курсов противоракового лечения. Пациенту, получавшему интенсивную предварительную терапию, можно назначать любую схему предварительного противоракового лечения, которую считает подходящей специалист в данной области. В конкретных вариантах осуществления интенсивная предварительная терапия пациента заключалась в лечении одним или больше ингибиторами FLT3, например, препаратами CEP701, PKC412, MLN-518, сунитиниб и сорафениб.
В конкретных вариантах осуществления способы согласно изобретению применяют для лечения получавших минимальную предварительную терапию пациентов. Пациенты, ранее не лечившиеся или лечившиеся, но не интенсивно, считаются пациентами, получавшими минимальную предварительную терапию.
В конкретных вариантах осуществления пациенту 65 лет или меньше, и он страдает недавно диагностированным ОМЛ или МДС.
В конкретных вариантах осуществления пациенту 18 лет или больше, и он страдает недавно диагностированным ОМЛ с выявленной мутацией FLT3-ITD. В конкретных вариантах осуществления пациенту 18 лет или больше, и у него недавно диагностирован ОМЛ с экспрессией FLT3-ITD, разделенного мутацией NPM1.
В конкретных вариантах осуществления пациенту 18 лет или больше, и он имеет высокий риск МДС, ХММЛ или ОМЛ с неудачной предшествующей терапией. В конкретных вариантах осуществления пациенту МДС проведено неудачное предшествующее лечение гипометилирующим агентом и/или леналидомидом. В конкретных вариантах осуществления описан пациент ОМЛ с неудачно проведенной любой предшествующей индукционной терапией или с рецидивом после предшествующей терапии. В конкретных вариантах осуществления пациенту МДС проводили лечение гипометилирующим агентом и наблюдали прогрессирование ОМЛ, несмотря на какую-либо предшествующую терапию ОМЛ. В конкретных вариантах осуществления пациент не получал предшествующего лечения и не является кандидатом на проведение стандартной терапии.
В конкретных вариантах осуществления пациенту 18 лет или больше и у него недавно диагностирован CBF-ОМЛ.
В конкретных вариантах осуществления пациент соответствует следующим критериям:
1. диагностированный 1) ОМЛ (с >/=20% бластов, по определению согласно классификации ВОЗ), или 2) промежуточный 2 или высокий риск МДС (определенный по классификации международной прогностической системы IPSS);
2. возраст от 15 до 65 лет;
3. наличие в анамнезе рецидива или рефрактерного заболевания или вторичного нелеченного заболевания, в конкретных вариантах осуществления пациенту не проводили предшествующего лечения ингибитором FLT3;
4. Статус общего состояния ECOG ≤2
5. Нормальное функционирование органов
В конкретных вариантах осуществления пациент не получал химиотерапии против ОМЛ или МДС (кроме препарата гидреа). В конкретных вариантах осуществления пациенту вводили гипометилирующие агенты, гематопоэтические факторы роста или витамины и проводили трансфузии против предшествующего МДС.
В конкретных вариантах осуществления пациент соответствует следующим критериям:
1. высокий риск рецидива, критериями которого являются:
a) мутации FLT3 ITD или D835, b) сложные кариотипы (по меньшей мере 3 разных отклонения) c) полная патологическая ремиссия CRp или полная ремиссия с неполным гематологическим восстановлением CRi, (d) вторая или дальнейшая стадия CR
2). Пациент не является кандидатом на аллогенную гематопоэтическую трансплантацию стволовых клеток (HCT)
3). Пациент находится в стадии CR, CRp или CRi в течение 1 недели до начала терапии
4). Оба из показателей сывороточного билирубина и креатинина у пациента составляют <2 мг/дл
5). У пациента отсутствует прологация QTc
6). У пациента (a) отсутствуют другие заболевания, которые могут ограничивать продолжительность жизни <1 года или нарушать соблюдение предписанного лечения AC220, (b) отсутствует ВИЧ-инфекция, и (c) ранее пациент не получал AC220.
В конкретных вариантах осуществления возраст пациента составляет 18 лет или больше, и он соответствует следующим критериям:
1. Пациент МДС, ХММЛ или ОМЛ имеет в анамнезе неудачно проведенную предшествующую терапию.
a. Пациенту МДС неудачно проведена предшествующая терапия гипометилирующим агентом и/или леналидомидом.
b. Пациенту ОМЛ неудачно проведена предшествующая индукционная терапия или возник рецидив после предшествующей терапии.
c. Пациент МДС получал лечение гипометилирующим агентом, и болезнь прогрессировала в ОМЛ.
d. Пациент не получал предшествующего лечения и не является кандидатом на проведение стандартной терапии.
2. Статус общего состояния ECOG ≤2
3. Адекватная функция печени (билирубин ≤2 мг/дл) и почек (креатинин ≤2 мг/дл).
В конкретных вариантах осуществления пациент находится в возрасте от 1 до 21 года. В конкретных вариантах осуществления у пациента диагностирован рецидивирующий/рефрактерный ОМЛ, ОЛЛ или острый лейкоз неопределенного генеза, и пациент соответствует следующим критериям:
1. У пациента диагностирован ОМЛ или лейкоз неопределенного генеза и выявлено >5% бластов в костном мозге;
2. Пациент ОЛЛ имеет показатели костного мозга М3 (>25% бластов в костном мозге);
3. Пациент ОЛЛ имеет генную перестройку или гипердиплоидность MLL более чем в 50 хромосомах;
4. Пациенты после лечения ОМЛ (t-ОМЛ) являются подходящими, если они соответствуют всем другим критериям отбора.
H. Фармацевтические композиции
В способах согласно изобретению применяют фармацевтические композиции, содержащие AC220 и/или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, и фармацевтически приемлемые носители, такие как разбавители или адъюванты, или комбинации со вторым агентом. В конкретных вариантах осуществления второй агент, например, цитарабин, клофарабин, АЗА, этопозид, идарубицин или даунорубицин вводят в качестве известных в данной области фармацевтических композиций.
Примеры фармацевтических композиций AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата описаны в патентных заявках США №№ публикаций US2007/0232604, US2009/0123418, US2009/0131426 и в предварительной заявке № 61/243,977. В одном варианте осуществления фармацевтические композиции содержат по меньшей мере один наполнитель или носитель, не регулирующий высвобождение. В другом варианте осуществления фармацевтические композиции содержат по меньшей мере один наполнитель или носитель, регулирующий высвобождение, и один наполнитель или носитель, не регулирующий высвобождение. В одном варианте осуществления фармацевтические композиции согласно изобретении представляют собой высушенные распылением композиции.
В другом варианте осуществления фармацевтические композиции содержат в качестве активного компонента AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с одним или больше фармацевтически приемлемыми носителями, каждый из которых выбирают из группы, состоящей из гидроксипропил-β-циклодекстрина, маннита, натрия гликолята крахмала (EXPLOTAB®), лимонной кислоты, полиэтиленгликолей ПЭГ400, ПЭГ6000, поливинилпирролидона (ПВП), лаурил полиоксилглицеридов (GELUCIRER 44/14, Gattefosse Corp., Paramus, N.J), Плуроника® F68, диоксида кремния и воды. Плуроник® F68 (также называемый Полоксамер 188) представляет собой блоксополимер окиси этилена и окиси пропилена.
В другом варианте осуществления фармацевтические композиции содержат AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат и гидроксипропил-β-циклодекстрин (HPBCD). В конкретных вариантах осуществления рецептуру HPBCD-содержащей композиции создают в виде водного раствора, который получают путем добавления водного раствора HPBCD с желательной концентрацией к соответствующему количеству AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, с достижением желательной конечной концентрации соединения, включающей без ограничения значения конечной концентрации около 1 мг/мл, около 2, около 3, около 5, около 10, около 15, около 50 или около 100 мг/мл. В одном варианте осуществления композиция HPBCD содержит около 5% HPBCD. В другом варианте осуществления композиция HPBCD содержит около 22% HPBCD. В конкретных вариантах осуществления фармацевтическая композиция содержит 2, 3 или 5 мг/мл AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, в 5% HPBCD. В конкретных вариантах осуществления фармацевтическая композиция содержит 1, 3 или 10 мг/мл соединения AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, в 22% HPBCD. Примеры фармацевтических композиций показаны в Таблице 2.
|
Еще в одном варианте осуществления фармацевтическую композицию AC220 восстанавливают водным раствором, который содержит один или больше фармацевтически приемлемых носителей. В одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат. В другом варианте осуществления фармацевтическая композиция содержит AC220 во флаконе. Еще в одном варианте осуществления фармацевтическая композиция содержит от около 1 около до 200 мг, от около 10 около до 100 мг, или от около 10 до 60 мг, или 10 мг, 12 мг, 14 мг, 16 мг, 18 мг, 20 мг, 25 мг, 27 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг или 60 мг соединения или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата. В одном варианте осуществления используемый для востановления водный раствор содержит HPBCD. В конкретных вариантах осуществления водный раствор содержит 5% вес. HPBCD. В конкретных вариантах осуществления водный раствор содержит 22% вес. HPBCD.
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат в комбинации с ПЭГ400 и водой. В конкретных вариантах осуществления соотношение ПЭГ400 и воды составляет 3 к 1.
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с маннитом и EXPLOTAB®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в таблице 3.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с маннитом, EXPLOTABR и лимонной кислотой. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. В конкретных вариантах осуществления AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат является микронизированным, например, с помощью вихревой мельницы. Примеры фармацевтических композиций показаны в Таблице 4.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с ПЭГ6000, маннитом и EXPLOTAB®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в Таблице 5.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с поливинилпирролидоном (ПВП), маннитом и EXPLOTAB®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в Таблице 6.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с GELUCIRE®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. В конкретных вариантах осуществления фармацевтическая композиция содержит дигидрохлорид N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины и GELUCIRE® 44/14. Примеры фармацевтических композиций показаны в Таблице 7.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с GELUCIRE® и ПЭГ6000. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. В конкретных вариантах осуществления фармацевтическая композиция содержит три весовых части GELUCIRE® и одну весовую часть ПЭГ6000.
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с маннитом, EXPLOTAB® и Плуроник® F68. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в Таблице 8.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с GELUCIRE®, ПЭГ6000, диоксидом кремния, маннитом и EXPLOTAB®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в Таблице 9.
|
Еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с HPBCD, маннитом и EXPLOTAB®. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде капсулы. Примеры фармацевтических композиций показаны в Таблице 10.
|
И еще в одном варианте осуществления фармацевтическая композиция содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, в комбинации с HPBCD. В конкретных вариантах осуществления рецептуру фармацевтической композиции создают в виде лиофилизированного порошка. В конкретных вариантах осуществления AC220, применяемый в фармацевтической копмпозиции, представляет собой со-кристаллическую форму AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, и HPBCD. Используемый в изобретении термин "со-кристаллический" относится к кристаллу, содержащему два или больше разных молекулярных компонента в пределах кристаллической решетки (элементарная ячейка). Примеры фармацевтических композиций показаны в Таблице 11.
|
В одном варианте осуществления изобретение рассматривает высушенную распылением фармацевтическую композицию, которая содержит AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, и HPBCD. В конкретных вариантах осуществления высушенную распылением композицию получают путем распылительной сушки водного раствора AC220, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата.
В конкретных вариантах осуществления водный раствор получают путем добавления водного раствора HPBCD с желательной концентрацией к соответствующему количеству AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, с достижением желательной конечной концентрации соединения, включающей без ограничения значения конечной концентрации около 1, около 2, около 3, около 5, около 10, около 15, около 30, около 40, около 50, около 75 или около 100 мг/мл. В одном варианте осуществления композиции согласно изобретению содержат около 5% HPBCD. В другом варианте осуществления композиции согласно изобретению содержат около 22% HPBCD. В одном варианте осуществления композиции согласно изобретению содержат около 20% HPBCD. В одном варианте осуществления композиции согласно изобретению содержат около 40% HPBCD. В одном варианте осуществления композиции согласно изобретению содержат около 50% HPBCD.
В конкретных вариантах осуществления композиции согласно изобретению содержат 40 мг AC220, растворенного в каждом мл 40% раствора HPBCD, и в общей сложности 100 мг соединения растворено в 40% растворе HPBCD с общим объемом 2,5 мл. В конкретных вариантах осуществления композиции согласно изобретению содержат 40 мг AC220, растворенного в каждом мл 40% раствора HPBCD, и в общей сложности 200 мг соединения растворено в 40% растворе HPBCD с общим объемом 5 мл.
В конкретных вариантах осуществления композиции согласно изобретению содержат AC220 и HPBCD в весовом соотношении около 1:5, 1:7, 1:10, 1:13, 1:15 или 1:20. В конкретных вариантах осуществления композиции согласно изобретению содержат AC220 и HPBCD в весовом соотношении около 1:10. В приведенном в качестве примера варианте осуществления высушенная распылением композиция по изобретению в количестве около 1,1 г содержит около 100 мг AC220 и около 1000 мг HPBCD. В другом примере варианта осуществления около 2,2 г высушенной распылением композиции по изобретению содержат около 200 мг AC220 и около 2000 мг HPBCD.
В конкретных вариантах осуществления изобретение рассматривает высушенную распылением фармацевтическую композицию для востановления водным раствором перед введением. В одном варианте осуществления упаковка высушенной распылением фармацевтической композиции представляет собой флакон. В одном варианте осуществления рассматриваемые в изобретении высушенные распылением композиции восстанавливают водой для получения водного раствора, содержащего примерно от 1 до 10, от 2 до 10, от 3 до 10, от 2 до 8 или от 3 до 7 мг высушенной распылением композиции на мл воды. В одном варианте осуществления высушенные распылением композиции согласно изобретению восстанавливают водой, чтобы получить водный раствор, содержащий около 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг высушенной распылением композиции на мл воды.
В конкретных вариантах осуществления рецептуры фармацевтических композиций изготовляют в дозах AC220 или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, содержащих от около 1 около до 100 мг, или от около 1 около до 60 мг, или от около 10 около до 60 мг, от около 10 около до 40 мг, от около 10 около до 27 мг, или от около 10 около до 25 мг.
В конкретных вариантах осуществления в фармацевтических композициях согласно изобретению используемый AC220 находится в твердой форме. Подходящие твердые формы включают без ограничения твердые формы, содержащие свободное основание AC220, и твердые формы, содержащие соли AC220, которые включают без ограничения соли HCl, соли HBr, соли сульфата, соли мезилата, соли эзилата, соли эдизилата, соли безилата, соли тозилата и соли напзилата. В конкретных вариантах осуществления соли HCl AC220 включают соли моно-HCl и соли бис-HCl. В конкретных вариантах осуществления изобретение рассматривает твердые формы, включающие полиморфы, сольваты (включающие гидраты) и ко-кристаллы, содержащие AC220 и/или его соли. В конкретных вариантах осуществления твердая форма представляет собой ко-кристалл AC220 или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, и HPBCD. В конкретных вариантах осуществления в фармацевтических композициях согласно изобретению используют AC220, представляющий собой дигидрохлоридную соль N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины. Некоторые из этих твердых форм описаны в патенте США № 2009/0123418, включенном в изобретение со ссылкой во всей полноте.
Рецептуру фармацевтических композиций можно создавать в различных лекарственных формах для перорального, парентерального и местного введения. Рецептуру фармацевтических композиций также можно создавать в виде форм с модифицированным высвобождением, включающих формы с отсроченным, удлиненным, пролонгированным, постоянным, прерывистым, регулируемым, ускоренным и быстрым высвобождением, с направленным, программируемым высвобождением, и в виде лекарственных форм с удержанием в желудке. Эти лекарственные формы можно изготовлять с помощью общепринятых способов и методик, известных специалистам в данной области техники (см. издания Remington: The Science and Practice of Pharmacy, supra; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc.: New York, NY, 2003; Vol. 126).
В одном варианте осуществления фармацевтические композиции предоставлены в лекарственной форме для перорального введения. В другом варианте осуществления фармацевтические композиции предоставлены в лекарственной форме для парентерального введения. Еще в одном варианте осуществления фармацевтические композиции предоставлены в лекарственной форме для местного введения.
Фармацевтические композиции AC220 могут быть предоставлены в стандартной лекарственной форме или в лекарственной форме для многократного введения. Стандартная лекарственная форма, используемая в изобретении, относится к физически дискретной единице, подходящей для введения субъектам - людям и животным, и в индивидуальной упаковке, как принято в данной области техники. Каждая стандартная доза содержит заданное количество активного компонента (компонентов), достаточное, чтобы оказать желательное терапевтическое воздействие, в сочетании с необходимыми фармацевтическими носителями или наполнителями. Примеры стандартных лекарственных форм включают ампулу, шприц, таблетку и капсулу в индивидуальной упаковке. Стандартную лекарственную форму можно вводить порциями или как форму для многократного введения. Лекарственная форма для многократного введения представляет собой совокупность идентичных стандартных лекарственных форм, упакованных в единственном контейнере, для введения в отдельных стандартных лекарственных формах. Примеры форм для многократного введения включают флакон, бутылку, таблетки, или капсулы, или бутыль объемом в пинтах или галлонах.
Фармацевтические композиции с AC220 можно вводить однократно или многократно с интервалами времени. Подразумевается, что точная доза и продолжительность лечения могут варьировать в зависимости от возраста, веса и состояния пациента, получающего лечение, и их можно определять эмпирически с помощью известных тестовых протоколов, или экстраполировать от тестовых или диагностических данных, полученных in vivo или in vitro. Дополнительно подразумевается, что для любого конкретного субъекта необходимо адаптировать конкретную схему введения на протяжении времени согласно его индивидуальной потребности и профессиональному мнению человека, осуществляющего введение или контроль введения рецептур.
A. Пероральное введение
В дополнение к рассмотренным выше композициям фармацевтические композиции AC220 могут быть представлены в твердых, полутвердых или жидких лекарственных формах для перорального введения. Применяемое в изобретении пероральное введение включает также буккальное, лингвальное и сублингвальное введение. Подходящие пероральные лекарственные формы включают без ограничения таблетки, капсулы, пилюли, лепешки, таблетки для рассасывания, пастилки, саше, шарики, лекарственную жевательную резинку, гранулы, нерасфасованные порошки, шипучие или нешипучие порошки или гранулы, растворы, эмульсии, суспензии, растворы, облатки, обсыпки, эликсиры и сиропы. Фармацевтические композиции в дополнение к активному компоненту (компонентам) могут содержать один или больше фармацевтически приемлемых носителей или наполнителей, включающих без ограничения связующие вещества, наполнители, разбавители, дезинтегрирующие вещества, увляжняющие вещества, лубриканты, вещества, способствующие скольжению, красители, ингибиторы подвижности краски, подсластители и ароматизаторы.
Связующие вещества или грануляторы придают когезионные свойства таблетке, чтобы гарантировать отсутствие повреждения таблетки после прессования. Подходящие связующие вещества или грануляторы включают без ограниченния крахмалы, такие как кукурузный крахмал, картофельный крахмал и предварительно желатинизированный крахмал (например, КРАХМАЛ 1500); желатин; сахар, например, сахарозу, глюкозу, декстрозу, патоку и лактозу, камедь природного и синтетического происхождения, такую как камедь акации, альгиновую кислоту, альгинаты, экстракт каррагена, камедь панвар, камедь гхатти, клейкое вещество шелухи семян исфагула, карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон (ПВП), вигум, арабогалактан лиственницы, порошок трагаканта и гуаровую смолу; целлюлозы, такие как этилцеллюлоза, ацетат целлюлозы, кальций карбоксиметилцеллюлоза, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиэтилцеллюлоза (ГЭЦ), гидроксиприприлцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ); микрокристаллические целлюлозы, такие как Авицел-PH-101, Авицел-PH-103, Авицел-RC-581, Авицел-PH-105 (Корпорация FMC, Marcus Hook, PA); и их смеси. Подходящие наполнители включают без ограничения тальк, карбонат кальция, микрокристаллическую целлюлозу, порошковую целлюлозу, декстраны, каолин, маннит, кремниевую кислоту, сорбитол, крахмал, предварительно желатинизированный крахмал и их смеси. В фармацевтических композициях по изобретению связующее вещество или наполнитель могут присутствовать в весовом количестве от около 50 до около 99% веса.
Подходящие разбавители включают без ограничения дикальция фосфат, кальция сульфат, лактозу, сорбитол, сахарозу, инозит, целлюлозу, каолин, маннит, хлорид натрия, сухой крахмал и сахарную пудру. В случае присутствия в некоторых прессованных таблетках достаточного количества определенных разбавителей, таких как маннит, лактоза, сорбитол, сахароза и инозит, они могут придавать таблетке такие свойства, которые делают возможной дезинтергацию во рту в процессе жевания. Такие прессованные таблетки можно применять в качестве жевательных таблеток.
Подходящие дезинтегранты включают без ограничения агар; бентонит; целлюлозы, такие как метилцеллюлозу и карбоксиметилцеллюлозу; продукты из древесины; губку природного происхождения; катионобменные смолы; альгиновую кислоту; камеди, такие как гуаровая смола и вигум HV; мякоть цитрусовых; сшитые целлюлозы, такие как кроскармеллоза; сшитые полимеры, такие как кросповидон; сшитые крахмалы; карбонат кальция; микрокристаллическую целлюлозу, такую как натрия гликолят крахмала; калия полакрилин; крахмалы, такие как кукурузный крахмал, картофельный крахмал, крахмал тапиоки и предварительно желатинизированный крахмал; глины; вещества для выравнивания; и их смеси. Количество дезинтегрирующего вещества в фармацевтических композициях согласно изобретению варьирует в зависимости от типа рецептуры и легко определяется специалистом в данной области техники. Фармацевтические композиции по изобретению могут содержать от около 0,5 около до 15% или от около 1 около до 5% веса дезинтегрирующего вещества.
Подходящие лубриканты включают без ограничения стеарат кальция; стеарат магния; минеральное масло; светлое минеральное масло; глицерин; сорбит; маннит; гликоли, такие как глицерин бегенат и полиэтиленгликоль (ПЭГ) (например, ПЭГ400 и ПЭГ6000); стеариновую кислоту; сульфат лаурила натрия; тальк; гидрогенизированное растительное масло, включающее арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; стеарат цинка; этилолеат; этиллаурат; агар; крахмал; ликоподий; кремний (диоксид кремния) или силикагели, такие как AEROSIL® 200 (W.R. Grace Co., Baltimore, MD) и CAB-O-SIL® (Cabot Co. of Boston, MA); и их смеси. Фармацевтические композиции по изобретению могут содержать лубриканты в количестве от около 0,1 до около 5% веса.
Подходящие вещества для скольжения включают коллоидный диоксид кремния, CAB-O-SIL® (Cabot Co. Boston, MA), и тальк, не содержащий асбеста. Красители включают любой из одобренных, сертифицированных водорастворимых красителей FD&C и водонерастворимых красителей FD&C, суспендированных на гидрате окиси алюминия, и красочные лаки и их смеси. Красочный лак представляет собой комбинацию водорастворимой краски, адсорбированной к гидратированному оксиду тяжелого металла, что приводит к получению нерастворимой формы красителя. Ароматизирующие агенты включают ароматизаторы природного происхождения, экстрагированные из растений, например, из фруктов, и смеси синтетических соединений, которые производят приятное вкусовое ощущение, например, эфир метилсалициловой кислоты и мята. Подслащивающие агенты включают сахарозу, лактозу, маннит, сиропы, глицерин и искусственные подсластители, такие как сахарин и аспартам. Подходящие эмульгирующие агенты включают желатин, камедь акации, трагакант, бентонит и сурфактанты, такие как полиоксиэтилен сорбитан моноолеат (например, Твин® 20), полоксамеры (например, Плуроник® F68), полиоксиэтилен сорбитан моноолеат 80 (например, Твин® 80) и триэтаноламин олеат. Суспендирующие и диспергирующие агенты включают натрий карбоксиметилцеллюлозу, пектин, трагакант, вигум, камедь акации, натрия карбоксиметилцеллюлозу, гидроксипропил-метилцеллюлозу, поливинилпирролидон и лаурил-полиоксиглицериды (например, GELUCIRER 44/14). Консерванты включают глицерин, метил- и пропил-парабен, бензойную добавку, бензоат натрия и спирт. Увлажняющие агенты включают пропиленгликоль моностеарат, сорбитан моноолеат, диэтиленгликоль монолаурат и полиоксиэтилен лаурил эфир. Растворители включают глицерин, сорбит, этиловый спирт и сироп. Примеры используемых в эмульсиях неводных жидкостей включают минеральное масло и хлопковое масло. Органические кислоты включают лимонную и винную кислоту. Источники углекислого газа включают бикарбонат натрия и карбонат натрия.
Подходящие комплексобразующие агенты включают без ограничения циклодекстрины, включающие α-циклодекстрин, β-циклодекстрин, гидроксипропил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрин и сульфобутилэфир 7-β-циклодекстрин (CAPTISOL®, CyDex, Lenexa, KS).
Подразумевается, что даже в одной рецептуре ряд носителей и наполнителей могут иметь несколько функций.
Фармацевтические композиции с AC220 могут быть представлены в виде прессованных таблеток, измельченных в порошок таблеток, жевательных пастилок, быстрорастворимых таблеток, множественных прессованных таблеток или таблеток с энтеросолюбильным покрытием, с сахарным или пленочным покрытием. Таблетки с энтеросолюбильным покрытием представляют собой таблетки, покрытые веществами, которые обладают устойчивостью к действию желудочной кислоты, но растворяются или дезинтегрируются в кишечнике, таким образом защищая свои активные компоненты от кислой среды желудка. Энтеросолюбильные покрытия включают без ограничения жирные кислоты, жиры, фенилсалицилат, воски, шеллак, содержащий аммоний шеллак и ацетатфталат целлюлозы. Покрытые сахарной оболочкой таблетки представляют собой прессованные таблетки, окруженные сахарным покрытием, которое может быть полезным для маскирования нежелательных вкусов или ароматов и для защиты таблеток от окисления. Таблетки с пленочным покрытием представляют собой прессованные таблетки, которые покрыты тонким слоем или пленкой водорастворимого материала. Пленочные покрытия включают без ограничения гидроксиэтилцеллюлозу, натрий карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и ацетатфталат целлюлозы. Пленочное покрытие придает сходные общие свойства, как и сахарное покрытие. Многократно прессованные таблетки представляют собой прессованные таблетки, изготовленные с помощью более одного цикла прессования, и включают слоеные таблетки и таблетки с напрессованным покрытием или сухим покрытием.
Лекарственные формы таблетки можно изготовлять из активного компонента в порошковой, кристаллической или гранулированной формах, из единственного компонента или в комбинации с одним или больше носителями или наполнителями, описанными в изобретении, включающими связующие вещества, дезинтегрирующие вещества, регулирующие высвобождение полимеры, лубриканты, разбавители и/или красители. Для изготовления жевательных таблеток и пастилок особенно полезными являются ароматизирующие агенты и подсластители.
Фармацевтические композиции с AC220 могут быть представлены в виде мягких или твердых капсул, которые можно изготовлять из желатина, метилцеллюлозы, крахмала или альгината кальция. Твердая желатиновая капсула, также называемая капсулой сухого наполнения (DFC), состоит из двух секций, накрывающих друг друга со скольжением одной секции по другой, таким образом полностью запечатывая активный компонент. Мягкая эластичная капсула (SEC) представляет собой мягкую, шаровидную оболочку, такую как желатиновая оболочка, которой придают пластичность путем добавления глицерина, сорбита или подобных полиолов. Мягкие желатиновые оболочки могут содержать консервант для предотвращения роста микроорганизмов. Подходящими консервантами являются описанные в изобретении консерванты, включающие метил- и пропил-парабены и сорбиновую кислоту. Жидкие, полутвердые и твердые лекарственные формы по изобретению могут быть заключены в капсулу (инкапсулированы). Подходящие жидкие и полутвердые лекарственные формы включают растворы и суспензии в пропиленкарбонате, растительных маслах или триглицеридах. Капсулы, содержащие такие растворы, можно изготовлять согласно описанию в патентах США №№ 4328245; 4409239; и 4410545. На капсулы также можно наносить покрытие, как известно специалистам в данной области техники, для модификации или замедленного растворения активного компонента.
Фармацевтические композиции с AC220 могут быть представлены в жидких и полутвердых лекарственных формах, включающих эмульсии, растворы, суспензии, эликсиры и сиропы. Эмульсия представляет собой систему с двумя фазами, в которой одна жидкость диспергирована в виде маленьких капель в другой жидкости, и может быть маслом в воде или водой в масле. Эмульсии могут включать фармацевтически приемлемую неводную жидкость или растворитель, эмульгирующий агент и консервант. Суспензии могут включать фармацевтически приемлемый суспендирующий агент и консервант. Водные спиртовые растворы могут включать фармацевтически приемлемый ацеталь, такой как ди(низший алкил)ацеталь альдегида низшего алкила, например, ацетальдегида диэтилацеталь; и смешиваемый с водой растворитель, имеющий одну или больше гидроксильных групп, такой как пропиленгликоль и этанол. Эликсиры предствляют собой прозрачные, подслащенные и гидроспиртовые растворы. Сиропы являются концентрированными водными растворами сахара, например, сахарозы, и также могут содержать консервант. Например, для жидкой лекарственной формы раствор в полиэтиленгликоле можно разводить достаточным количеством фармацевтически приемлемого жидкого носителя, например, водой, для удобства измерения количества для введения.
Другие полезные жидкие и полутвердые лекарственные формы включают без ограничения формы, содержащие активный компонент (компоненты) согласно изобретению, и диалкилированный моно- или полиалкилен-гликоль, включающий 1,2-диметоксиметан, диглим, триглим, тетраглим, полиэтиленгликоль-350-диметилэфир, полиэтиленгликоль-550-диметилэфир, полиэтиленгликоль-750-диметилэфир, в которых 350, 550 и 750 относится к примерной молекулярной массе полиэтиленгликоля. Указанные рецептуры могут дополнительно содержать один или больше антиокислителей, таких как бутилированный гидрокситолуол (БГТ), бутилированный гидроксианизол (БГА), пропилгаллат, витамин Е, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, бисульфит, натрий метабисульфит, тиодипропионовая кислота и ее сложные эфиры и дитиокарбаматы.
Фармацевтические композиции с AC220 могут быть представлены в виде нешипучих или шипучих гранул и порошков для восстановления в жидкую лекарственную форму. Фармацевтически приемлемые носители и наполнители, используемые в нешипучих гранулах или порошках, могут включать разбавители, подсластители и увлажняющие агенты. Фармацевтически приемлемые носители и наполнители, используемые в шипучих гранулах или порошках, могут включать органические кислоты и источник углекислого газа.
Во всех вышеупомянутых лекартственных формах можно использовать красители и ароматизаторы.
Рецептуру фармацевтических композиций с AC220 можно создавать в виде форм с немедленным или модифицированным высвобождением, включающих формы с отсроченным, постоянным, прерывистым, регулируемым, направленным и программируемым высвобождением.
Можно создавать совместную рецептуру фармацевтических композиций с AC220 с другими активными компонентами, которые не ослабляют желательное терапевтическое действие, или с веществами, которые дополняют желательное действие.
B. Парентеральное введение
Фармацевтические композиции с AC220 можно вводить путем парентеральной инъекции, вливания или имплантации для локального или системного введения. Парентеральное введение, применяемое в изобретении, включает внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, интрауретральное, интрастернальное, внутричерепное, внутримышечное, внутрисиновиальное и подкожное введение.
Рецептуру фармацевтических композиций с AC220 можно изготовлять в любых лекарственных формах, которые подходят для парентерального введения, включающих растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, подходящие для растворов или суспензий в жидкости, приготовляемых перед инъекцией. Такие лекарственные формы можно изготовлять согласно общепринятым способам, известным специалистам в области фармацевтической науки (см. выше Remington: The Science and Practice of Pharmacy).
Фармацевтические композиции AC220, предназначенные для парентерального введения, могут включать один или больше фармацевтически приемлемых носителей и наполнителей, включающих без ограничения водные носители, смешиваемые с водой носители, неводные носители, антибактериальные агенты или консерванты, препятствующие росту микроорганизмов, стабилизаторы, агенты, усиливающие растворимость, изотонические агенты, буферные агенты, антиокислители, местные анестетики, суспендирующие и диспергирующие агенты, увлажняющие или эмульгирующие агенты, комплексообразователи, секвестрирующие или хелатирующие агенты, криопротектанты, лиопротектанты, загущающие агенты, агенты, регулирующие уровнь рН и инертные газы.
Подходящие водные носители включают без ограничения воду, солевой раствор, физиологический раствор или фосфатно-буферный раствор (PBS, ФБР), натрия хлорид для инъекций, растрор Рингера для инъекций, изотоническую декстрозу для инъекций, стерильную воду для инъекций, декстрозу и Рингер-лактат для инъекций. Неводные носители включают без ограничения фиксированные масла растительного происхождения, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, мятное масло, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированные растительные масла, гидрогенизированное соевое масло, триглицериды со средней длиной цепи кокосового масла и пальмоядровое масло. Смешиваемые с водой носители включают без ограничения этанол, 1,3-бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N-метил-2-пирролидон, N,N-диметилацетамид и диметилсульфоксид.
Подходящие антибактериальные агенты или консерванты включают без ограничения фенолы, крезолы, препараты ртути, бензиловый спирт, хлорбутанол, метил- и пропил-п-гидроксибензоаты, тимеросал, бензалконий хлорид (например, бензетоний хлорид), метил- и пропил-парабены и сорбиновую кислоту. Подходящие изотонические агенты включают без ограничения натрия хлорид, глицерин и декстрозу. Подходящие буферные агенты включают без ограничения фосфат и цитрат. Подходящими антиокислителями являются описанные в изобретении соединения, включающие бисульфит и натрий метабисульфит. Подходящие местные анестетики включают без ограничения прокаина гидрохлорид. Подходящие суспендирующие и диспергирующие агенты представляют собой агенты, описанные в изобретении, включающие натрий карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Подходящие эмульгирующие агенты включают описанные в изобретении агенты, включающие полиоксиэтилен сорбитан монолаурат, полиоксиэтилен сорбитан моноолеат 80 и триэтаноламин олеат. Подходящие секвестирующие или хелатирующие агенты включают без ограничения этилендиаминтетрауксусную кислоту (ЭДТА). Подходящие агенты, регулирующие уровень pH, включают без ограничения, гидроокись натрия, соляную кислоту, лимонную кислоту и молочную кислоту. Подходящие комплексообразователи включают без ограничения циклодекстрины, включающие α-циклодекстрин, β-циклодекстрин, гидроксипропил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрин и сульфобутилэфир-7-β-циклодекстрин (CAPTISOL®, CyDex, Lenexa, KS).
Рецептуру фармацевтических композиций с AC220 можно создавать для введения в качестве однократной или многократной дозы. Рецептуры для однократного введения дозы упакованы в ампулу, флакон или шприц. Парентеральная рецептура для многократного введения должна содержать антибактериальный агент в бактериостатической или фунгистатической концентрации. Общеизвестно, что все парентеральные рецептуры должны быть стерильными, как это и осуществляется в данной области техники.
В одном варианте осуществления фармацевтические композиции с AC220 представлены в виде готовых к применению стерильных растворов. В другом варианте осуществления фармацевтические композиции с AC220 представлены в виде стерильных сухих растворимых продуктов, включающих лиофилизированные порошки и таблетки для подкожного введения, восстанавливаемые с помощью носителя перед применением. Еще в одном варианте осуществления фармацевтические композиции с AC220 представлены в виде готовых к применению стерильных суспензий. Еще в одном варианте осуществления фармацевтические композиции с AC220 представлены в виде стерильных сухих нерастворимых продуктов, которые восстанавливают с помощью носителя перед применением. И еще в одном варианте осуществления указанные фармацевтические композиции представлены в виде готовых к применению стерильных эмульсий.
Фармацевтические композиции с AC220 могут быть в виде рецептуры лекарственной формы с немедленным или модифицированным высвобождением, включающим отсроченное, постоянное, прерывистое, регулируемое, направленное и программируемое высвобождение.
Можно создавать рецептуру фармацевтических композиций с AC220 в виде суспензии, твердой, полутвердой лекарственной формы или тиксотропной жидкости для введения в виде имплантируемого депо. В одном варианте осуществления фармацевтические композиции согласно изобретению диспергированы в твердой внутренней матрице, окруженной внешней полимерной мембраной, которая не растворяется в жидкостях организма, но позволяет активному компоненту в фармацевтических композициях диффундировать через мембрану.
Подходящие внутренние матрицы включают полиметил-метакрилат, полибутил-метакрилат, пластифицированный или непластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, природный каучук, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, сополимеры этилен-винил ацетата, силиконовые каучуки, полидиметилсилоксаны, сополимеры карбоната силикона, гидрофильные полимеры, такие как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, сшитый поливиниловый спирт и сшитый частично гидролизованный поливинилацетат.
Подходящие внешние полимерные мембраны включают полиэтилен, полипропилен, сополимеры этилена/пропилена, сополимеры этилена/этилакрилата, сополимеры, этилена/винилацетата, силиконовые резины, полидиметилсилоксаны, неопреновый каучук, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида с винилацетатом, винилиден хлорид, этилен и пропилен, иономер полиэтилентерефталата, бутилкаучук, эпихлоргидриновые каучуки, сополимер этилена/винилового спирта, терполимер этилена/винилацетата/винилового спирта и сополимер этилена/винилоксиэтанола.
C. Местное введение
Фармацевтические композиции с AC220 можно вводить ректально, уретрально, вагинально или перивагинально в форме суппозиториев, пессариев, палочек, примочек или припарок, паст, порошков, повязок, кремов, пластырей, контрацептивов, мазей, растворов, эмульсий, суспензий, тампонов, гелей, пенок, спреев или клизм. Эти лекарственные формы можно изготовлять с помощью общепринятых способов, описанных в издании Remington: The Science and Practice of Pharmacy, см. выше.
Ректальные, уретральные и влагалищные свечи представляют собой твердые лекарственные формы для вставления в отверстия организма, и эти формы являются твердыми при обычной температуре, но тают или размягчаются при температуре тела для высвобождения в отверстиях активного компонента (компонентов). Фармацевтически приемлемые носители, используемые в ректальных и влагалищных суппозиториях, включают основания или носители, такие как агенты для придания твердости, которые при изготовлении рецептуры с фармацевтическими композициями согласно изобретению создают температуру плавления, близкую к температуре тела; и антиокислители, описанные в изобретении, включающие бисульфит и натрия метабисульфит. Подходящие носители включают без ограничения масло какао (теоброминовое масло), глицериновый желатин, карбовакс (полиэтиленгликоль), спермацетовый, парафиновый, белый и желтый воск, и подходящие смеси моно-, ди- и триглицеридов жирных кислот, гидрогелей, таких как поливиниловый спирт, гидроксиэтилметакрилат, полиакриловая кислота; глицеринизированный желатин. Можно использовать комбинации разных носителей. Ректальные и влагалищные суппозитории можно изготовлять способом прессования или формования. Обычный вес ректального и влагалищного суппозитория составляет от около 2 до около 3 г.
Фармацевтические композиции с AC220 можно вводить в дыхательные пути интраназально или путем ингаляции. Фармацевтические композиции с AC220 могут быть представлены в виде аэрозоля или раствора для доставки с помощью герметичного контейнера, помпы, спрея, пульверизатора, такого как пульверизатор с использованием электрогидродинамики для создания мелкодисперсного тумана, или распылителя, единственного или в комбинации с подходящим пропеллентом, таким как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Фармацевтические композиции с AC220 также могут быть представлены в виде сухого порошка для вдувания, единственного или в комбинации с инертным носителем, таким как лактоза или фосфолипиды; и в виде капель для носа. Порошок для интраназального применения может содержать биоадгезивный агент, включающий хитозан или циклодекстрин.
Рецептуру растворов или суспензий, используемых в герметичном контейнере, помпе, спрее, пульверизаторе или распылителе, можно изготовлять с содержанием этанола, водного этанола или подходящего альтернативного агента для диспергирования, солюбилизации, или для расширения высвобождения активного компонента согласно изобретению, с содержанием пропеллента в качестве растворителя; и/или сурфактанта, такого как сорбитан триолеат, олеиновая кислота или олигомолочная кислота.
Фармацевтические композиции с AC220 по изобретению можно микронизировать до размера, подходящего для доставки ингаляционным путем, например, до около 50 микрометров или меньше, или около 10 микрометров или меньше. Частицы таких размеров можно изготовлять способом дробления, известным специалистам в данной области техники, например, с помощью спиральной струйной мельницы, струйной мельницы с кипящим слоем, сверхкритической обработкой жидкости для образования наночастиц, гомогенизацией высокого давления или путем распылительной сушки.
Капсулы, блистеры и картриджи, используемые в ингаляторе или инсуффляторе, можно изготовлять таким образом, чтобы они содержали порошкообразную смесь фармацевтических композиций по изобретению; подходящую порошковую основу, такую как лактоза или крахмал; и модификатор характеристик, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть в безводной форме или в форме моногидрата. Другие подходящие наполнители или носители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Фармацевтические композиции согласно изобретению для ингаляционного/интраназального введения могут дополнительно содержать подходящий ароматизатор, такой как ментол и левоментол, или подсласители, такие как сахарин или натрия сахарин.
Фармацевтические композиции соединения формулы (I) или AC220 для местного введения могут быть созданы в виде рецептуры с немедленным высвобождением или модифицированным высвобождением, включающим отсроченное, постоянное, прерывистое, регулируемое, направленное и программируемое высвобождение.
I. Готовые изделия и комплекты
Комбинированные схемы согласно изобретению также могут быть представлены как готовое изделие, для изготовления которого были использованы упаковочные материалы, известные специалистам в данной области техники. См., например, патенты США №№ 5323907; 5052558; и 5033252. Примеры фармацевтических упаковочных материалов включают без ограничения прозрачные упаковки, бутылки, пробирки, ингаляторы, помпы, контейнеры, флаконы, контейнеры, шприцы и любой упаковочный материал, подходящий для выбранной рецептуры и предполагаемого способа введения и лечения.
Изобретение также относится к комплектам для врачебного применения, которые могут упростить введение субъекту соответствующего количества активных компонентов. В конкретных вариантах осуществления изобретение рассматривает комплект, включающий контейнеры и лекарственные формы соединений для комбинированных схем введения по изобретению.
В конкретных вариантах осуществления комплект включает контейнер, содержащий лекарственные формы соединений для комбинированных схем введения по изобретению, в одном или больше контейнерах.
Комплекты по изобретению могут дополнительно включать устройства, которые используют для введения активных компонентов. Примеры таких устройств включают без ограничения шприцы, безыгольные инжекторы, капельницы, пластыри и ингаляторы. Комплекты по изобретению также могут включать презервативы для введения активных компонентов.
Комплекты по изобретению могут дополнительно включать фармацевтически приемлемые носители, которые можно использовать для введения одного или больше активных компонентов. Например, если активный компонент представлен в твердой лекарственной форме, которую нужно восстанавливать для парентерального введения, комплект может содержать герметичный контейнер с подходящим носителем, в котором можно растворять активный компонент для образования стерильного раствора без макрочастиц, подходящего для парентерального введения. Примеры фармацевтически приемлемых носителей включают без ограничения: водные носители, включающие без ограничения воду для инъекций USP, натрия хлорид для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и натрия хлорид для инъекций, и Рингер-лактат для инъекций; смешиваемые с водой носители, включающие без ограничения этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, включающие без ограничения кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропил миристат и бензил бензоат.
Далее в раскрытии приведены следующие примеры, не ограничивающие объем изобретения.
ПРИМЕРЫ
Пример 1. Клиническое исследование:
Цель клинического исследования состояла в определении клинического действия и определения профиля токсичности комбинаций азацитидина ("АЗА") и N-(5-трет-бутил-изоксазол-3-ил)-N'-{4-[7-(2-морфолин-4-ил-этокси)имидазо[2,1-b][1,3]бензотиазол-2-ил]фенил}мочевины ("AC220") у пациентов с рефрактерным или рецидивным ОМЛ и/или МДС. В дополнение к клиническому ответу проводили мониторинг пациентов с конкретными корреляционными исследованиями, такими как изучение индукции гипометилирования, повреждений ДНК и сигнального пути FLT-3.
Настоящее исследование представляет собой фазу I/II неконтролируемого открытого исследования, в котором пациенты в каждом 28-дневном цикле лечения получали терапию, содержащую ежедневное пероральное введение соединения формулы (I) или AC220 в течение первых 14 дней, и ежедневное подкожное или внутривенное введение АЗА в течение первых 7 дней. Циклы повторяли примерно каждые 28 дней, и терапию продолжали до прогрессирования заболевания или подтверждения недопустимой токсичности.
В исследовании принимали участие около 30 пациентов. Пациенты соответствовали следующим критериям:
1. Пациент МДС, ХММЛ или ОМЛ имеет в анамнезе неудачно проведенную предшествующую терапию.
a. Пациенту МДС неудачно проведена предшествующая терапия гипометилирующим агентом и/или леналидомидом.
b. Пациенту ОМЛ или неудачно проведена предшествующая индукционная терапия или возник рецидив после предшествующей терапии.
c. Пациент МДС, получавший лечение гипометилирующим агентом, у которого болезнь прогрессировала в ОМЛ, соответствует критериям при диагностированном ОМЛ независомо от предшествующей терапии ОМЛ.
d. Больные с любым из соответствующих критериям диагнозов, не получавшие предшествующего лечения, считаются соответствующими критериям, если они не подходят для проведения стандартной терапии.
2. Возраст 18 лет или старше.
3. Статус общего состояния ECOG ≤2
4. Адекватная функция печени (билирубин ≤2 мг/дл) и почек (креатинин ≤2 мг/дл).
Одной из задач исследования было введение АЗА и AC220 в полной дозе, начиная с уровня дозы -1 у первых шести больных (см. таблицы от A до E ниже). Исследование представляло собой клиническое испытание по Байесовской схеме с правилами раннего прекращения по причине отсутствия целесообразности и токсичности. Если недопустимая токсичность выявлена не больше, чем у 1 пациента, то все последующие больные получали лечение на уровне дозы 0. Первые 6 больных получали лечение на уровне дозы -1. Если у 2 или больше из первых 6 больных, получавших лечение на уровне дозы 0, выявлена недопустимая токсичность, то все последующие больные получали лечение на уровне дозы -1. В другом случае все больные получали лечение на уровне дозы 0. Лечение проведено в общей сложности 30 больным.
Азацитидин вводят или подкожно или внутривенно в дозе 75 мг/м2/день с 1 дня до 7 дня из 28-дневного цикла лечения. AC220 вводят на уровне дозы -1, представляющий собой уровень дозы ниже максимальной переносимой дозы (МПД). Для AC220 не была достигнута МПД, и в следующих таблицах показана возможная концентрация дозы AC220 и схема перорального введения комбинации с АЗА:
|
|
|
|
|
|
Первичная переменная эффективности представляет собой уровень полной ремиссии CR, полной патологической ремиссии CRp, частичной ремиссии PR и HI (токсичности в периоде фазы I исследования). Вторичная переменная эффективности представляет собой продолжительность ремиссии, выживаемость, токсичность и качество жизни. Токсичность оценивали согласно общим терминологическим критериям NCI CTC v3.0.
Циклы лечения повторяли примерно каждые 28 дней, и терапию продолжали до прогрессирования заболевания или подтверждения недопустимой токсичности. Ответы должны быть оценены согласно критериям для МДС, предложенным международной рабочей группой (Cheson et al. Blood 2006; 108: 419-25) и ОМЛ (Cheson et al. J Clin Oncol 2003; 21: 4642-9). Общий уровень ответов 20% считался значимым.
Пример 2
Исследование эффективности введения AC220 плюс цитарабин в модели фланковой солидной опухоли MV4-11
Исследование эффективности (in vivo) введения AC220 плюс цитарабин проводили на модели фланковой солидной опухоли MV4-11 у мышей SCID. Введение начинали на 14 день после инокуляции в группах по 10 животных на группу. Размер опухолей составлял в среднем около 222 мм3. Доставку AC220 осуществляли в рецептуре 5% водного раствора гидроксибетациклодекстрина (5 мл/кг/день, приготовляемом еженедельно) в дозе 1,0 мг/кг/день (мкд), однократно ежедневно (QD), перорально (п/о), и дозу регулировали по массе тела. Цитарабин вводили в рецептуре стерильного солевого раствора (5 мл/кг/день, приготовляемого еженедельно) в дозе около 30 или около 60 мкд, QD, внутрибрюшинно (в/б), и дозу регулировали по массе тела. Средняя исходная масса тела в группе составляла около 20 г. Клинические симптомы и массу тела измеряли два раза в неделю. Количество лейкоцитов (WBC) в крови определяли в конце периода введения цитарабина и повторно через 7 дней после лекарственной терапии. Исследование проводили в однократном цикле или многократными циклами лечения цитарабином, который вводили в течение 10 дней в каждом 24-дневном цикле. Как показано в Таблице 12 ниже, цитарабин вводили или до введения АС220 или параллельно с AC220, при этом AC220 вводили только в первом цикле лечения.
|
Фигура 1 показывает объем фланкирующей опухоли в группах, которым вводили AC220 и цитарабин с наложением по времени (группа 7) или единственный препарат и носитель (группы 3 и 5). Сравнение групп с 5 по 7 показывает отсутствие антагонистического аффекта цитарабина и AC220, и дополнительно обнаружено, что параллельное введение цитарабина с AC220 приводит к более медленной скорости восстановления опухолевого роста по сравнению с введением AC220 единственного. Фактически, в этой схеме комбинация дает показатель эффективности лечения 20% (постоянная полная регрессия), тогда как лечение только одним любым агентом не приводит к какой-либо длительной полной регрессии. Полученные данные предполагают, что параллельное введение цитарабина и AC220 может быть эффективной схемой для лечения рака.
Фигура 2 показывает объем фланкирующей опухоли в группах, которым вводили AC220 и цитарабин последовательно (группа и 6) или АС220 и носитель (группа 4). Сравнение групп с 4 по 6 показывает отсутствие антагонистического аффекта AC220 и цитарабина, и обнаружена способность к сокращению опухолевой массы у животных, получавших в течение 2 недель лечение AC220 перед вторым введением Ara-C. Полученные данные предполагают, что последовательное введение вначале цитарабина и последующее введение AC220 может быть эффективной схемой для лечения рака.
Пример 3
Исследование эффективности введения AC220 плюс АЗА-C in vivo в модели фланковой солидной опухоли MV4-11
Исследование эффективности введения (in vivo) AC220 плюс Аза-C проводили на модели фланковой солидной опухоли MV4-11, у мышей SCID. Введение начинали на 15 день после инокуляции в группах по 10 животных на группу. Размер опухолей составлял в среднем около 230 мм3. AC220 вводили в рецептуре 5% водного раствора гидроксибетациклодекстрина (10 мл/кг/день, приготовляемом еженедельно) в дозе 0,5 мг/кг/день (мкд), QD, п/о, и дозу регулировали по массе тела. АЗА-C вводили в рецептуре стерильного солевого раствора (10 мл/кг/день, приготовляемого порциями на 5 дней) в дозе около 3 или около 1 мкд, QD, в/б, и дозу регулировали по массе тела. Средняя исходная масса тела в группе составляла около 20,6 г. Клинические симптомы и массу тела измеряли два раза в неделю. Количество лейкоцитов (WBC) в крови определяли в конце периода введения АЗА-С и повторно через 7 дней после лекарственной терапии. Исследование проводили в однократном цикле или многократными циклами лечения АЗА-С, который вводили в течение 5 дней в каждом 15-дневном цикле. Как показано в Таблице 13 ниже, АЗА-С вводили или до введения АС220 или параллельно с AC220, при этом AC220 вводили только в первом цикле лечения.
|
Фигура 3 показывает объем фланкирующей опухоли в группах, которым вводили AC220 и АЗА-С параллельно (группа 9 и 10) или лекарство единственное и носитель (группы 3, 4 и 6). Эта фигура показывает, что введение AC220 на 15 день после инокуляции приводит к стабилизации опухоли, и что АЗА-C в дозе 3 мкг вызывает сокращение объема опухоли примерно на 50%. По данным фигуры 3 предполагается, что АЗА-C не является антогонистом действия AC220. Параллельное введение АЗА-C и AC220 было также связано с потерей веса у животных от слабо выраженной до умеренной степени, и эта потеря веса была не более явной, чем при лечении только АЗА-С единственным. Исходя из полученных данных ожидается, что терапевтическое окно может быть достигнуто при параллельном введении AC220 с АЗА-C.
Фигура 4 показывает объем фланкирующей опухоли в группах, которым последовательно вводили AC220 и АЗА-C (группы 7 и 8) или препарат единственный и носитель (группы 5 и 6). Эта фигура показывает, что введение AC220 на 20 день после инокуляции приводит к стабилизации опухоли, и что АЗА-C не является антогонистом действия AC220. Последовательное введение АЗА-C и AC220 было также связано с потерей веса у животных от слабо выраженной до умеренной степени, и эта потеря веса была не более явной, чем при лечении только АЗА-С единственным. Исходя из полученных данных ожидается, что терапевтическое окно может быть достигнуто при последовательном введении AC220 и АЗА-C.
Пример 4
AC220 в комбинации с этопозидом в исследовании жизнеспособности клеток
В этом исследовании изучали цитотоксический эффект последовательности введения AC220 и этопозида. Для тестовых схем комбинации клеточные линии MV4-11 культивировали в среде RPMI с 10% эмбриональной бычьей сывороткой и пенициллином/стрептомицином с плотностью клеток от 3e5/мл до 1e6/мл и высевали с плотностью 6e5 клеток на лунку. Клетки подвергали двойному последовательному разведению этопозидом (в рабочих концентрациях, начиная с 1/4x и до 4x с известным значением EC50 34,57 нМ) в сочетании с двойными последовательными разведениями AC220 (в рабочих концентрациях, начиная с 1/16x и до 8x и значении ЕС50 0,35 нМ), и инкубировали в атмосфере 5% CO2 при 37°C в течение 24 часов в случае одновременного введения AC220 и этопозида, и инкубировали в общей сложности в течение 72 часов в случае, когда клетки сначала обрабатывали этопозидом (в течение 24 часов) и затем дополнительно обрабатывали AC220 (в течение 48 часов). Цитотоксичность оценивали в анализе жизнеспособности с помощью CellTiter-Blue™ (#G8081 Promega). Значение индекса комбинации (CI) получали для каждого эксперимента с комбинацией, используя коммерчески доступную программу (Calcusyn; Biosoft, Манчестер, Великобритания). Взаимодействие двух указанных агентов анализировали с помощью методики оценки среднего эффекта авторов Chou and Talalay (Adv. Enyme Regul. 1984; 22:27-55). Индекс комбинации и взвешенный индекс комбинации вычисляли согласно описанию в публикации Chou, Pharmacol. Rev. 58:621-681, 2006.
Как описано Chou, см. выше, диапазоны CI показывают синергизм, совокупный эффект и антагонизм следующим образом:
CI <1 представляет собой синергизм, CI=1 представляет собой совокупный эффект и CI>1 является антагонизмом.
Таблица 14 показывает значения индекса комбинации (CI), полученных для одновременной обработки AC220 и этопозидом. Фиг.5A подчеркивает конкретные комбинации, показывающие синергизм. [Таблица 14 показывает синергетические комбинации тех клеток, которые одновременное обрабатывали AC220 и этопозидом, на основе индекса комбинации (CI), полученного для указанных комбинаций. Соответствующий график показан в фиг.5A.]
|
Таблица 15 показывает значения индекса комбинации (CI), полученных на клетках, предварительно обработанных этопозидом с последующим добавлением AC220. Фиг.5В выделяет конкретные комбинации, показывающие синергизм. [Таблица 15 показывает синергетические комбинации тех клеток, которые предварительно обрабатывали этопозидом с последующим добавлением AC220, при этом синергизм определяли по значениям индекса комбинации (CI). Соответствующий график показан в фиг.5В.]
|
Пример 5
AC220 в комбинации с даунорубицином в исследовании жизнеспособности клеток
В этом исследовании изучали цитотоксический эффект последовательности введения AC220 и даунорубицина. Для тестовых схем комбинации клеточные линии MV4-11 культивировали в среде RPMI с 10% эмбриональной бычьей сывороткой и пенициллином/стрептомицином с плотностью клеток от 3e5/мл до 1e6/мл и высевали с плотностью 6e5 клеток на лунку. Клетки подвергали двойному последовательному разведению даунорубицином (в рабочих концентрациях, начиная с 1/4x и до 4x с известным значением EC50 12,65 нМ) в сочетании с двойными последовательными разведениями AC220 (в рабочих концентрациях, начиная с 1/16x и до 8x и значении ЕС50 0,35 нМ), и инкубировали в атмосфере 5% CO2 при 37°C в течение 24 часов в случае одновременного введения AC220 и даунорубицина, и инкубировали в общей сложности в течение 72 часов в случае, когда клетки сначала обрабатывали даунорубицином (в течение 24 часов) и затем дополнительно обрабатывали AC220 (в течение 48 часов), или в случае, когда клетки сначала предварительно обрабатывали AC220 (в течение 24 часов) с последующим добавлением даунорубицина (в течение 48 часов). Цитотоксичность оценивали в анализе жизнеспособности с помощью CellTiter-Blue™ (#G8081 Promega). Значение индекса комбинации (CI) получали для каждого эксперимента с комбинацией, используя коммерчески доступную программу (Calcusyn; Biosoft, Манчестер, Великобритания). Взаимодействие двух указанных агентов анализировали с помощью методики оценки среднего эффекта авторов Chou and Talalay (Adv. Enyme Regul. 1984; 22:27-55).
Таблица 16 показывает значения индекса комбинации, полученные для одновременного воздействия на клетки AC220 и даунорубицина. Соответствующий график показан в фигуре 6A.
|
Таблица 17 показывает значения индекса комбинации (CI), полученные с клетками после предварительной обработки даунорубицином с последующим добавлением AC220. Соответствующий график показан в фигуре 6B.
|
Таблица 18 показывает значения индекса комбинации (CI), полученные с клетками после обработки AC220 с последующей обработкой даунорубицином. Соответствующий график показан в фиг.6C.
|
Пример 6
AC220 в комбинации с кладрибином в исследовании жизнеспособности клеток
В этом исследовании изучали цитотоксический эффект последовательности введения AC220 и кладрибина. Для тестовых схем комбинации клеточные линии MV4-11 культивировали в среде Iscove с 10% эмбриональной бычьей сывороткой и пенициллином/стрептомицином с плотностью клеток 3e5/мл и высевали с плотностью 6e4 клеток на лунку. Клетки подвергали двойному последовательному разведению кладрибином (в рабочих концентрациях, начиная с 1/4x и до 4x с известным значением EC50 16,2 нМ) в сочетании с двойными последовательными разведениями AC220 (в рабочих концентрациях, начиная с 1/16x и до 8x и значении ЕС50 0,35 нМ), и инкубировали в атмосфере 5% CO2 при 37°C в течение 72 часов в случае одновременной обработки AC220 и кладрибином, и инкубировали в общей сложности в течение 72 часов в случае, когда клетки сначала обрабатывали кладрибином (в течение 24 часов) и затем дополнительно обрабатывали AC220 (в течение 48 часов), или в случае, когда клетки сначала предварительно обрабатывали AC220 (в течение 24 часов) с последующей обработкой кладрибином (в течение 48 часов). Цитотоксичность оценивали в анализе жизнеспособности с помощью CellTiter-Blue™ (#G8081 Promega). Значение индекса комбинации (CI) получали для каждого эксперимента с комбинацией, используя коммерчески доступную программу (Calcusyn; Biosoft, Манчестер, Великобритания). Взаимодействие двух указанных агентов анализировали с помощью методики оценки среднего эффекта авторов Chou and Talalay (Adv. Enyme Regul. 1984; 22:27-55).
Таблица 19 показывает значения взвешенного индекса комбинации (CI), полученные при одновременной обработке клеток AC220 и кладрибином.
|
Таблица 20 показывает значения взвешенного индекса комбинации (CI), полученные с клетками, предварительно обработанными кладрибином с последующим добавлением AC220.
|
Таблица 21 показывает значения взвешенного индекса комбинации (CI), полученные с клетками, предварительно обработанными AC220 с последующим добавлением кладрибина.
|
Пример 7
AC220 в комбинации с цитарабином в исследовании жизнеспособности клеток
В этом исследовании изучали цитотоксический эффект последовательности введения AC220 и цитарабина. Для тестовых схем комбинации клеточные линии MV4-11 культивировали в среде Iscove с 10% эмбриональной бычьей сывороткой и пенициллином/стрептомицином с плотностью клеток 3e5/мл и высевали с плотностью 6e4 клеток на лунку. Клетки подвергали двойному последовательному разведению цитарабином (в рабочих концентрациях, начиная с 1/4x и до 4x с известным значением EC50 380 нМ) в сочетании с двойными последовательными разведениями AC220 (в рабочих концентрациях, начиная с 1/16x и до 8x и значении ЕС50 0,35 нМ), и инкубировали в атмосфере 5% CO2 при 37°C в течение 72 часов в случае одновременной обработки AC220 и цитарабином, и инкубировали в общей сложности в течение 72 часов в случае, когда клетки сначала обрабатывали цитарабином (в течение 24 часов) и затем дополнительно обрабатывали AC220 (в течение 72 часов), или в случае, когда клетки сначала предварительно обрабатывали AC220 (в течение 24 часов) с последующей обработкой цитарабином (в течение 72 часов). Цитотоксичность оценивали в анализе жизнеспособности с помощью CellTiter-Blue™ (#G8081 Promega). Значение индекса комбинации (CI) получали для каждого эксперимента с комбинацией, используя коммерчески доступную программу (Calcusyn; Biosoft, Манчестер, Великобритания). Взаимодействие двух указанных агентов анализировали с помощью методики оценки среднего эффекта авторов Chou and Talalay (Adv. Enyme Regul. 1984; 22:27-55).
Таблица 22 показывает значения взвешенного индекса комбинации (CI), полученные при одновременной обработке клеток AC220 и цитарабином.
|
Таблица 23 показывает значения взвешенного индекса комбинации (CI), полученные для предварительной обработки клеток цитарабином с последующим добавлением AC220.
|
Таблица 24 показывает значения взвешенного индекса комбинации (CI), полученные для предварительной обработки клеток AC220 с последующим добавлением цитарабина.
|
Пример 8
AC220 в комбинации с ингибитором PI3K GDC-0941 в исследовании жизнеспособности клеток
В этом исследовании изучали цитотоксический эффект последовательности введения AC220 и ингибитора PI3K GDC-0941. Для тестовых схем комбинации клеточные линии MV4-11 культивировали в среде RPMI с 10% эмбриональной бычьей сывороткой и пенициллином/стрептомицином с плотностью клеток от 3e5/мл до 1e6/мл и высевали с плотностью 6e4 клеток на лунку. Вначале независимо вычисляли значения EC50 для GDC-0941 и AC220 для каждой схемы лечения для каждого препарата, используемого в комбинациях. Клетки подвергали двойному последовательному разведению GDC-0941 (при рабочих концентрациях, начиная с 1/4x и до 4x с известным значением EC50 в сочетании с двойными последовательными разведениями AC220 (в рабочих концентрациях, начиная с 1/16x и до 8x с вычисленным значением ЕС50), и инкубировали в течение 4 дней в атмосфере 5% CO2 при 37°C по одной из следующих схем: (i) инкубировали с AC220 и GDC-0941 в течение четырех дней в случае одновременной обработки AC220 и GDC-0941; (ii) инкубировали с GDC-0941 единственным в течение первых 24 часов, с последующей инкубацией и с AC220 и с GDC-0941 в случае полупараллельного введения, начиная с введения GDC-0941; (iii) инкубировали с GDC-0941 в течение первых 24 часов, с последующим удалением GDC-0941 и добавлением AC220 в случае последовательного введения, начиная с GDC-0941; (iv) инкубировали с AC220 единственным в течение первых 24 часов, с последующим параллельным введением AC220 и GDC-0941 в случае полупараллельного введения, начиная с AC220; и, наконец (v) инкубировали с AC220 единственным в течение первых 24 часов, с последующим удалением AC220 и добавлением GDC-0941 в случае последовательного введения, начиная с AC220. Цитотоксичность оценивали в анализе жизнеспособности с помощью CellTiter-Blue™ (#G8081 Promega). Значение индекса комбинации (CI) получали для каждого эксперимента с комбинацией, используя коммерчески доступную программу (Calcusyn; Biosoft, Манчестер, Великобритания). Взаимодействие двух указанных агентов анализировали с помощью методики оценки среднего эффекта авторов Chou and Talalay (Adv. Enyme Regul. 1984; 22:27-55).
Таблица 25 показывает значения взвешенного индекса комбинации (CI), полученные при разных схемах обработки клеток AC220 и GDC-0941.
|
Пример 9
AC220 в комбинации с даунорубицином в модели солидной опухоли MV4-11
Изучали in vivo введение AC220 плюс даунорубицин на модели фланковой солидной опухоли MV4-11 на мышах С.В.-17 SCID (Лаборатории Harlan). Самкам мышей SCID инокулировали в правый бок 200 мкл смеси клеток MV4-11 и матригеля в соотношении 50/50. Животным инокулировали клетки в количестве 5e6. Введение начинали на 15 день в девяти группах по 10 животных в каждой группе. Средний объем опухоли составлял около 274 мм3. Средняя исходная масса тела составляла около 20,8 г. Даунорубицин (Sigma Aldrich) вводили каждые 5 дней внутривенно (Q5D, в/в) в рецептуре стерильного солевого раствора в дозе 2,5 мг/мл, при этом дозу регулировали по массе тела. AC220 вводили в рецептуре 5% водного раствора гидроксипропилбетациклодекстрина в дозе 0,5 мг/кг/день (мкд), QD, п/о, при этом дозу регулировали по массе тела. Схема введения показана в Таблице 26, массу тела и клинические симптомы измеряли дважды в неделю. Общий анализ крови делали на 20 день, 31 день и 37 день. В 31 день и в дальнейшем группы 8 и 9 и все другие группы, ежедневно получающие AC220, продолжали лечение AC220, пока объем опухоли не достигал по меньшей мере 1500 мм3. Фигура 7 показывает медианные кривые опухолевого роста, полученные в этом эксперименте.
|
Фигура 7 показывает, что параллельное введение AC220 и даунорубицина (группы 6 и 7) приводит к уменьшению опухолевого роста, что не выявлено в группе, которой последовательно вводили AC220 и даунорубицин (группы 8 и 9). Введение AC220 после даунорубицина на 31 день вначале приводит к уменьшению опухолевого роста в группах 8 и 9, но в целом наибольшее замедление опухолевого роста выявлено в группах, изначально получавших параллельное введение препарата (группы 6 и 7).
Подобное исследование in vivo эффектов параллельного и последовательного введения AC220 и даунорубицина было начато на моделях лейкоза MOLM-14 у мышей NOD/SCID. Клеточная линия MV4-11 является гомозиготной по мутации FLT3 ITD и реагировала на AC220, тогда как клеточная линия MOLM-14 является гетерозиготной по мутации FLT3 ITD и показывает меньший ответ на AC220, в этой связи она представляет собой модель заболевания, которое не будет подавлять действие AC220 и, следовательно, может быть лучшей моделью для тестирования эффектов комбинации AC220.
Рассмотренные выше примеры представлены специалистам в данной области техники для полного раскрытия и описания изготовления и применения заявляемых вариантов осуществления, и не предназначены для ограничения области раскрытия изобретения. Предполагается, что модификации, очевидные для специалистов в данной области техники, входят в объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, цитируемые в настоящем описании, включены в изобретение со ссылкой, как если бы было конкретно и отдельно указано, что каждая такая публикация, патент или патентная заявка включены в изобретение со ссылкой.