Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ (S)-3-(АМИНОМЕТИЛ)-5-МЕТИЛГЕКСАНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
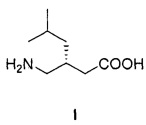
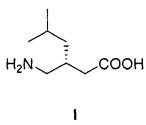
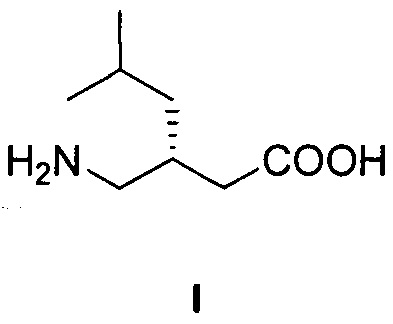
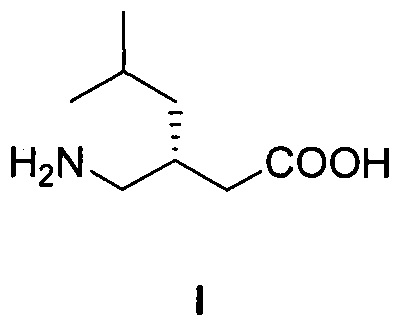
Изобретение относится к способу получения (S)-3-(аминометил)-5-метилгексановой кислоты формулы I:
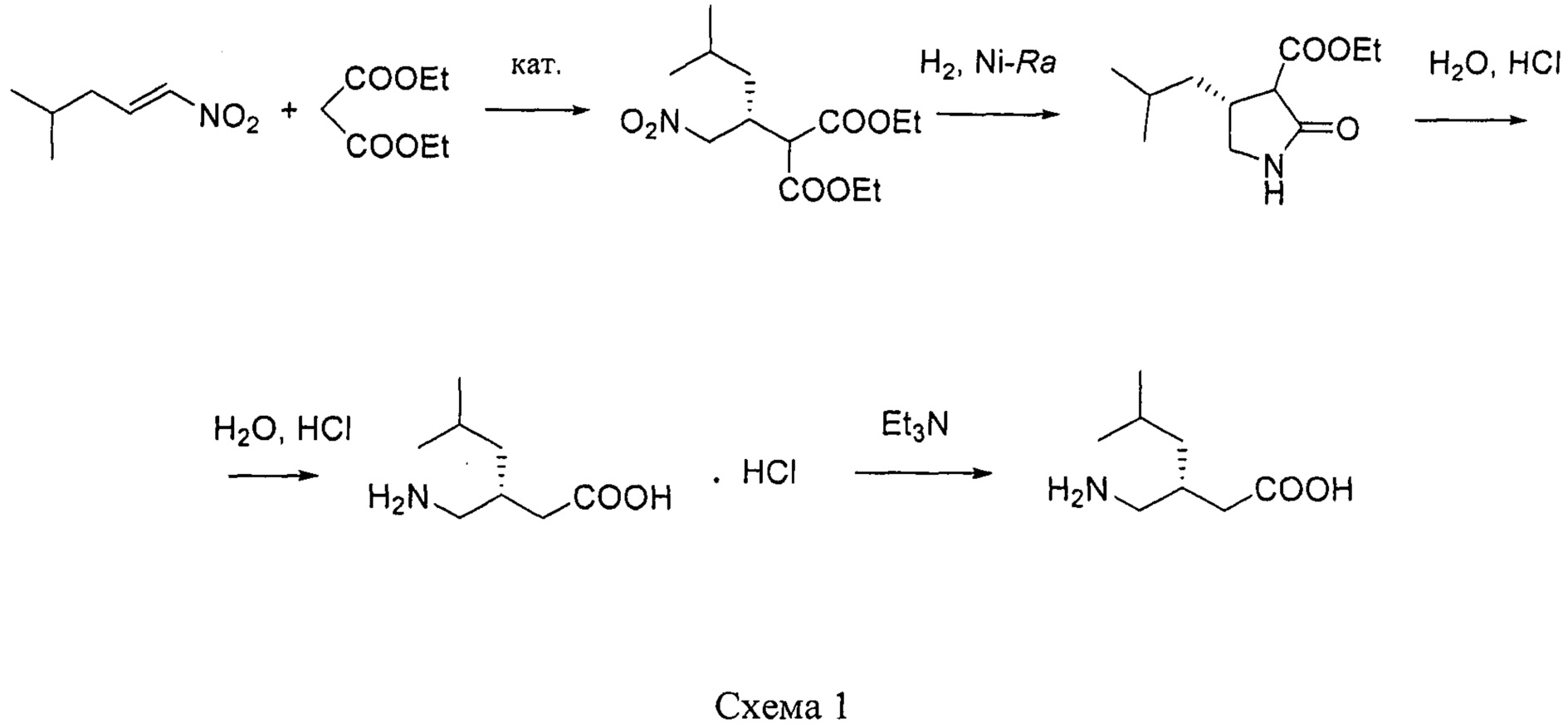
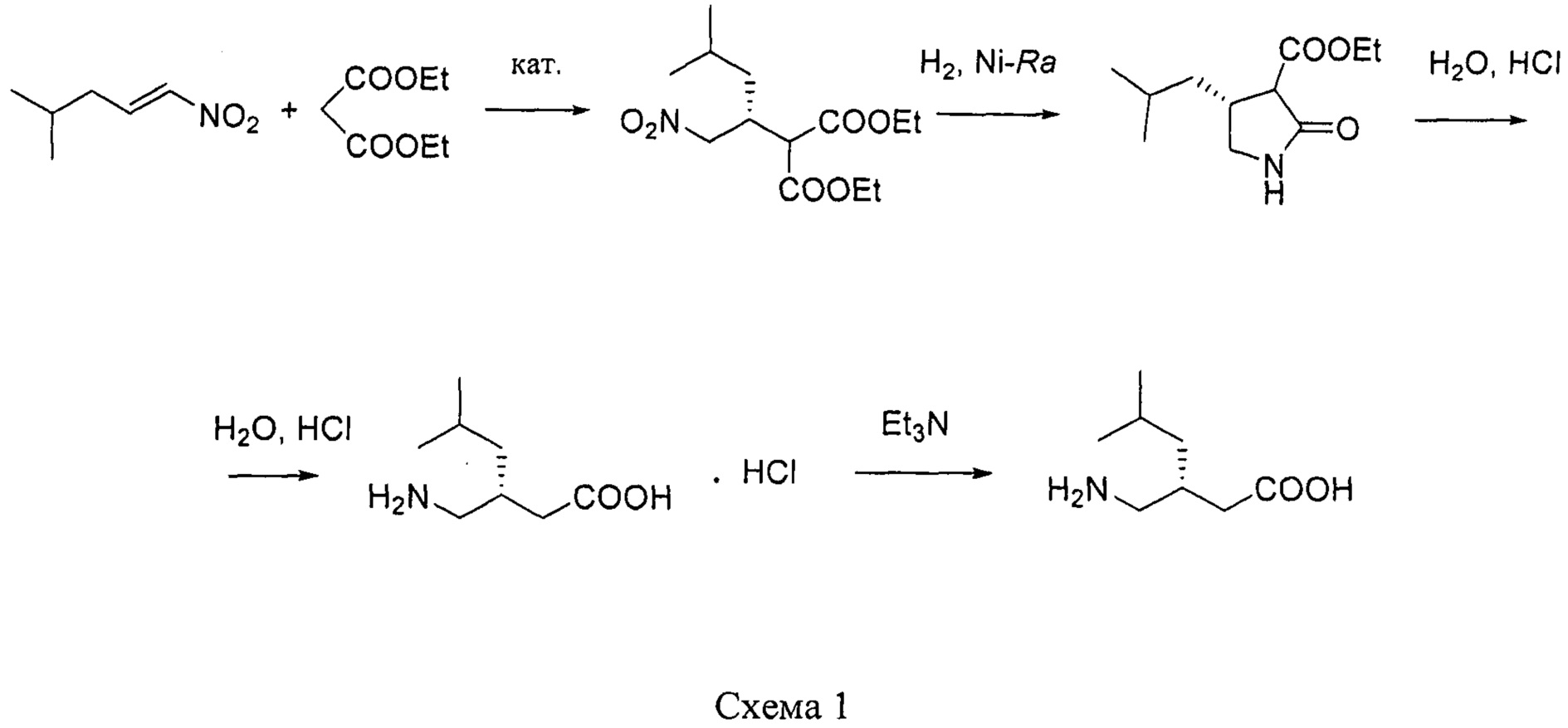
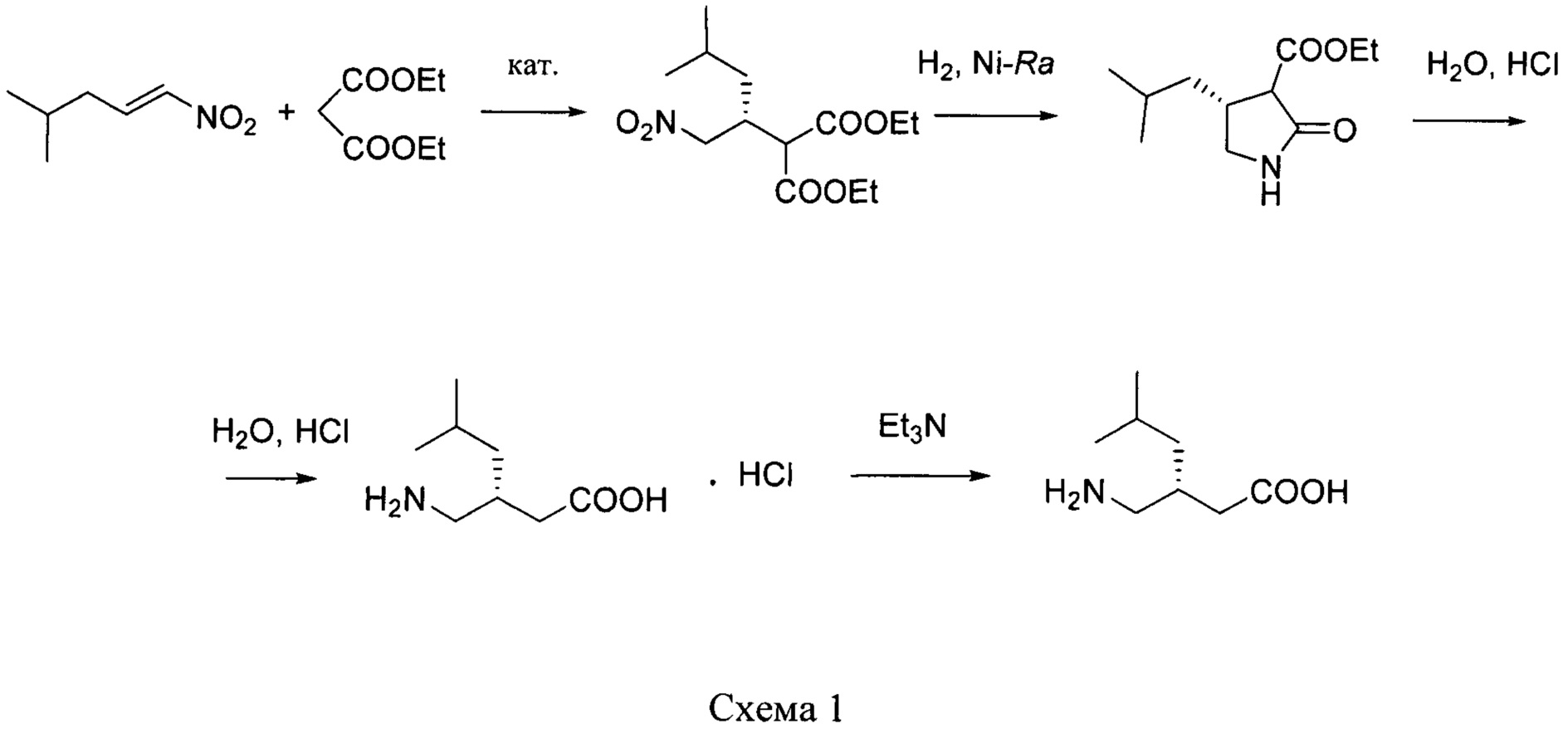
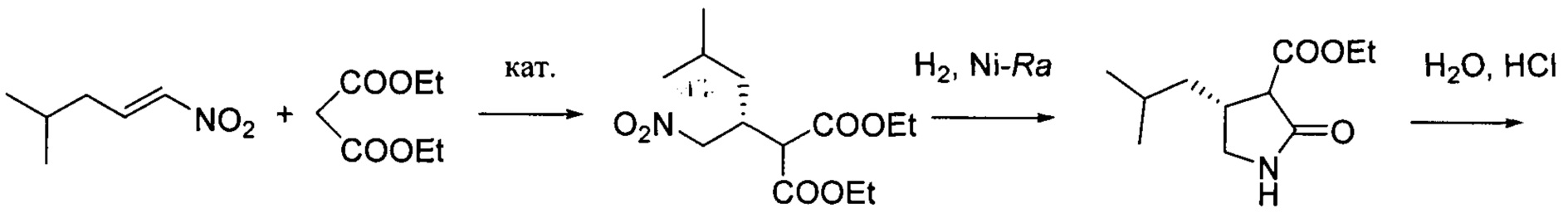
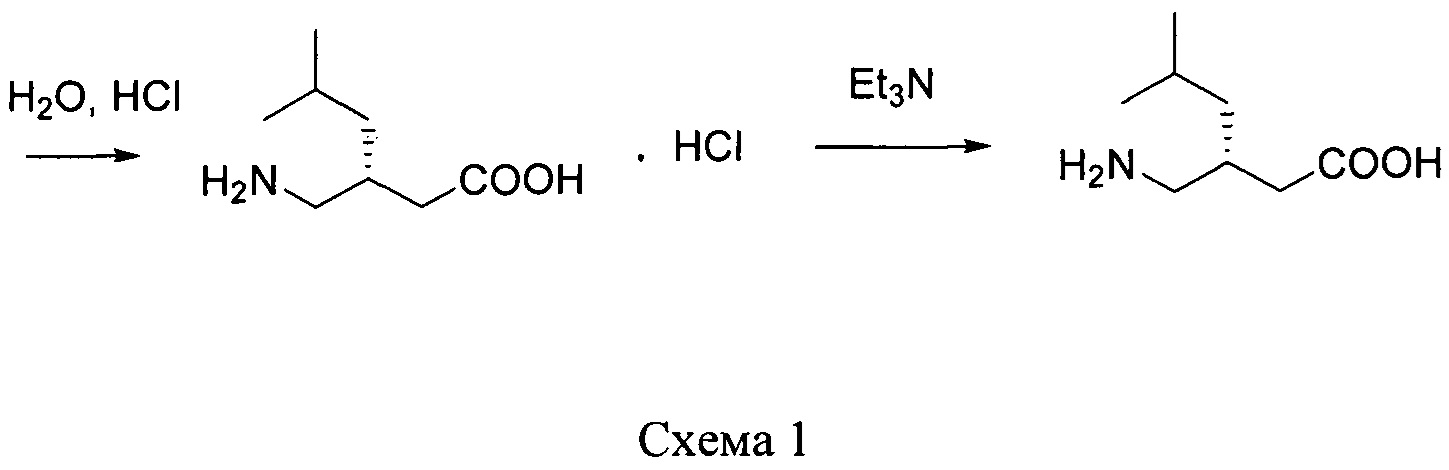
путем энантиоселективного присоединения диэтилмалоната к 4-метил-1-нитропентену-1 с последующим восстановлением и кислотным гидролизом продукта присоединения в соответствии со схемой 1,
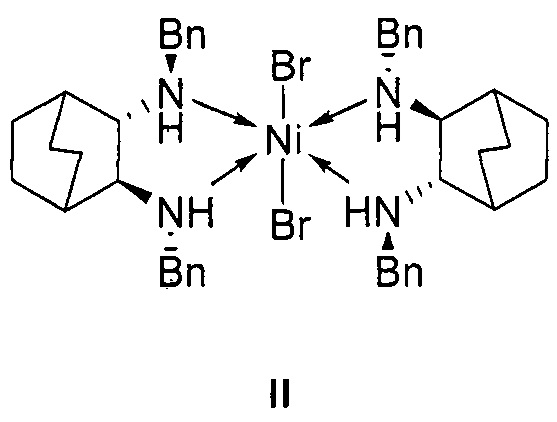
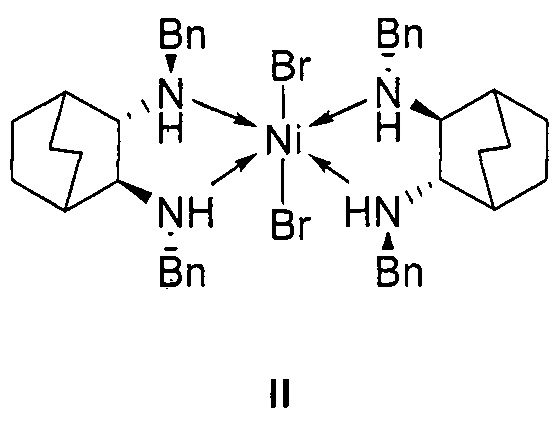
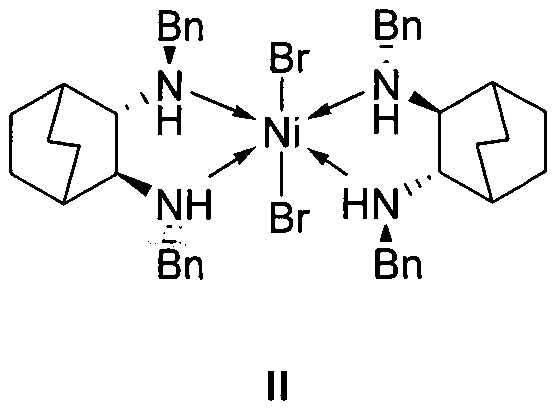
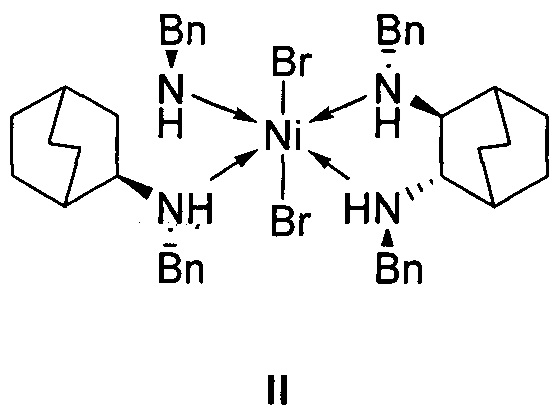
отличающийся тем, что используемый на стадии присоединения катализатор представляет собой комплекс никеля(II) формулы II с (2S,3S)-N,N'-дибензилбицикло[2.2.2]октан-2,3-диамином:
(S)-3-(Аминометил)-5-метилгексановая кислота используется в терапии ряда нейропатических заболеваний и расстройств, в том числе невропатических болей, эпилепсии, фибромиалгии, мигрени, синдрома беспокойных ног, нарушений сна и др. (Silverman R.B., Andruszkiewicz R. Pat. US 6359169 (B1) GABA and L-glutamic acid analogs for antiseizure treatment (дата публикации 19.03.2002); Forster E.R., Koppiker N.P. Pat. MY 138266 (A) Treatment of neuropathy (дата публикации 29.05.2009); Meergans D., Paetz J. Pat. WO 2012016683 (A2) Oral dosage form of pregabalin (дата публикации 09.02.2012); Kusuki N., Hiroshi O. Pat. KR 20120067783 (A) Pharmaceutical composition for treatment of fibromyalgia (дата публикации 26.06.2012)).
Данным изобретением решена задача энантиоселективного синтеза (S)-3-(аминометил)-5-метилгексановой кислоты с использованием легкодоступного и дешевого комплекса Ni(II) формулы II в качестве катализатора, что обеспечивает значительное удешевление и упрощение технологического процесса. Поскольку нейротропная активность (S)-изомера 3-(аминометил)-5-метилгексановой кислоты значительно превосходит активность (R)-изомера (Silverman R.B., Andruszkiewicz R. Pat. US 6359169 (B1) GABA and L-glutamic acid analogs for antiseizure treatment, дата публикации 19.03.2002), формирование асимметрического центра требуемой конфигурации на стадии синтеза соединения формулы I исключает необходимость дополнительных стадий разделения рацемических смесей, обычно используемых в производстве данного фармацевтического препарата.
Известен ряд способов получения (S)-3-(аминометил)-5-метилгексановой кислоты. Группа методов, основанных на разделении конечного продукта или синтетических интермедиатов на (R)- и (S)-энантиомеры. Такие методы были использованы при получении (S)-3-(аминометил)-5-метилгексановой кислоты с использованием промежуточной стадии разделения рацемата 3-(2-амино-2-оксоэтил)-5-метилкапроновой кислоты с помощью (R)-α-фенилэтиламина (Huckabee В.K., Sobieray D.M. Pat. US 5629447 Methods of making (S)-3-(aminomethyl)-5-methylhexanoic acid (дата публикации 13.05.1997).
Рацемат (S)-3-(аминометил)-5-метилгексановой кислоты может быть разделен на энантиомеры с помощью хиральных кислот: (R)-миндальной (Grote Т.М., Huckabee В.K. Pat. US 6046353 Methods of making (S)-3-(aminomethyl)-5-methylhexanoic acid (дата публикации 07.06.1995)), L-винной и ди-пара-толуил-L-винной (Gore V., Datta D. Pat. WO 2009/122215 (A1) Novel process (дата публикации 02.04.2009)).
Хемоэнзиматический способ получения (S)-3-(аминометил)-5-метилгексановой кислоты восстановительным аминированием 5-метил-3-формилгексановой кислоты под действием трансаминазы описан в патенте Pat. WO 2014/155291 A1 (дата публикации 02.10.2014).
Ряд методов получения (S)-3-(аминометил)-5-метилгексановой кислоты основан на использовании хиральных исходных соединений или введении в молекулы реагентов хиральных вспомогательных групп на различных стадиях синтеза.
Описанный в патенте Pat. ЕР 2418194 А1 (дата публикации 15.02.2012 г.) способ получения (S)-3-(аминометил)-5-метилгексановой кислоты основан на использовании (4S)-4-гидроксиметил-1-[(1S)-1-фенилэтил]пирролидин-2-она в качестве исходного хирального соединения. Замещение гидроксильной группы на цианогруппу проводят путем последовательной обработки этого соединения хлористым тионилом и цианидом натрия. Из полученного таким образом нитрила синтезируют в одну стадию метиловый эфир 2-((R)-5-оксо-1-((S)-1-фенилэтил)пирролидин-3-ил)уксусной кислоты. Этот эфир вводят в реакцию с метилмагнийхлоридом, получая соответствующий третичный спирт. Последующей дегидратацией третичного спирта получают смесь (4S)-4-(2-метилпроп-1-енил)-1-[(1S)-1-фенилэтил]пирролидин-2-она и (4R)-4-(2-метилпроп-2-енил)-1-[(1S)-1-фенилэтил]пирролидин-2-она. Удаление вспомогательной 1-фенилэтильной группы осуществляют действием натрия в жидком аммиаке при -76°С. Затем смесь 2-метилпропенилпирролидин-2-онов гидрируют в присутствии Pd/C. Продуктом реакции является (4S)-изобутилпирролидин-2-он, который подвергают кислотному гидролизу с образованием (S)-3-(аминометил)-5-метилгексановой кислоты.
Основным недостатком данного способа является его многостадийность и использование синтетически труднодоступного исходного хирального соединения. Кроме того, описанный способ связан с использованием значительных количеств токсичного цианида натрия. Ряд стадий характеризуется пожароопасностью (использование раствора метилмагнийхлорида в диэтиловом эфире) и взрывоопасность (удаление фенилэтильной вспомогательной группы обработкой натрием в жидком аммиаке). Проведение реакции в жидком аммиаке также требует специального криогенного оборудования. Необходимость использования дорогостоящего Pd/C в качестве катализатора гидрирования приводит к значительным экономическим затратам.
Описан способ получения (S)-3-(аминометил)-5-метилгексановой кислоты из (S)-2-(2-(бензилокси)этил)оксирана (Pat WO 2014181359 (A1), дата публикации 13.11.2014). Региоселективным раскрытием оксиранового цикла действием изопропилмагнийхлорида в присутствии иодида меди из оксирана был получен (R)-1-(бензилокси)-5-метилгексан-3-ол, из которого далее синтезировали соответствующий мезилат. На следующем этапе из мезилата получали цианопроизводное, которое подвергали восстановлению. Продукт восстановления, -(S)-3-(2-аминоэтил)-5-метилгексан-1-ол, - далее окисляли до (S)-3-(аминометил)-5-метилгексановой кислоты действием хлорита натрия в присутствии TEMPO.
Преимуществом энантиоселективного синтеза (S)-3-(аминометил)-5-метилгексановой кислоты является то, что в этом случае не образуется нежелательный (R)-энантиомер, отсутствует необходимость в использовании стехиометрических количеств хиральных реагентов и, потенциально, общий выход может быть удвоен.
Асимметрическим гидрированием солей 3-циано-5-метилгекс-5-еновой кислоты получено хиральное цианопроизводное, из которого последующим восстановлением синтезирована (S)-3-(аминометил)-5-метилгексановая кислота (Burk M.J., Goel О. Pat. US 6891059 Asymmetric synthesis of pregabalin (дата публикации 13.11.2003). Асимметрическое гидрирование проводилось в присутствии дорогостоящих металлокомплексных катализаторов с дифосфиновыми лигандами, такими как (R,R)-Me-DUPHOS.
(S)-3-(Аминометил)-5-метилгексановая кислота также синтезирована с использованием хиральных вспомогательных реагентов, таких как (4R,5S)-4-метил-5-фенил-2-оксазолидинон (Pat. US 6359169, 6028214, 5847151, 5710304, 5684189, 5608090, 5599973).
Хотя эти методы обеспечивают получение (S)-3-(аминометил)-5-метилгексановой кислоты высокой хиральной чистоты, они трудно реализуемы в промышленных условиях, поскольку предполагают использование дорогостоящих реактивов (хиральных оксазолидинонов), а также специального криогенного оборудования для обеспечения требуемых рабочих температур (-78°С).
Хиральный оксазолидинон был использован в синтезе (R)-3-(аминометил)-5-метилгексановой кислоты (Armstrong A., Convine N.J., Popkin М.Е. Diastereoselective conjugate addition of cyanide to α,β-unsaturated oxazolidinones: enantioselective synthesis of ent-pregabalin and backlofen Synlett, 2006, (10), 1589-1591). Присоединением цианида к α,β-непредельному оксазолидинону получено цианопроизводное - хиральный прекурсор (S)-3-(аминометил)-5-метилгексановой кислоты. Однако, производное оксазолидинона, полученное из природного изомера валина, после цианирования приводит к продукту с противоположной абсолютной конфигурацией. Кроме того, для получения ненасыщенного субстрата в реакции цианирования требуется стехиометрическое количество хирального оксазолидинона. В качестве катализатора используется соединение самария. Эти факторы делают данную схему синтеза (S)-3-(аминометил)-5-метилгексановой кислоты экономически невыгодной и экологически опасной при реализации в промышленных масштабах.
Два других метода приводятся в патенте: Davies B.S., Guzman М.М. Pat. WO 2010/070593 Malonate esters (дата публикации 24.06.2010). В первом случае энантиоселективное присоединение цианида к алкилиденмалонату, приводящее к ключевому полупродукту - цианоалкилмалонату, осуществлено в условиях межфазного катализа с использованием хирального катализатора фазового переноса. Во втором случае используется ферментативный катализ для получения хирального циангидрина изовалерианового альдегида, из которого в две стадии получен цианоалкилмалонат.
Наиболее близким по технической сущности к заявляемому способу является способ получения (S)-3-(аминометил)-5-метилгексановой кислоты из диэтилмалоната и 4-метил-1-нитропентена-1 в присутствии комплекса никеля(II) с (S,S)-N,N'-дибензилциклогексан-1,2-диамином (Патент РФ №2529996, приоритет изобретения 18.10.2012 г.).
Описанный способ получения (S)-3-(аминометил)-5-метилгексановой кислоты формулы I заключается в том, что к смеси 4-метил-1-нитропент-1-ена и диэтилмалоната в мольном соотношении 1:2 добавляют катализатор - дибромобис[(S,S)-N,N'-дибензилциклогексан-1,2-диамин]никель(II). Реакционную смесь выдерживают при температуре 50°С в течение 15 ч. Избыток диэтилмалоната отгоняют в вакууме при остаточном давлении 20 мм рт.ст. Полученный хиральный нитроэфир гидрируют в изопропаноле в присутствии никеля Ренея при температуре 50°С и избыточном давлении водорода 10 атм в течение 13 ч. Раствор фильтруют, изопропанол упаривают. Остаток, представляющий собой этиловый эфир (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты, перекристаллизовывают из петролейного эфира с выходом 50-56%.
Хлоргидрат (S)-3-(аминометил)-5-метилгексановой кислоты с выходом 96-99% получают путем гидролиза этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты кипячением с 6М соляной кислотой в течение 18 ч. Свободную аминокислоту выделяют путем обработки раствора хлоргидрата в метаноле гидроксидом натрия с последующей фильтрацией раствора через слой силикагеля и упаривания фильтрата с выходом 93-94% и энантиомерным избытком 96.2%.
Описанный способ обладает рядом существенных недостатков:
1. Энантиомерный избыток хирального нитроэфира на стадии присоединения диэтилмалоната к 4-метил-1-нитропентену невысок (составляет 81.8%). Поэтому для дальнейшего обогащения (S)-энантиомером необходима перекристаллизация на стадии получения этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты, что сопровождается существенными потерями продукта. Общий выход аминокислоты (по 4-метил-1-нитропентену-1) составляет 37-45%.
2. На стадии выделения (S)-3-(аминометил)-5-метилгексановой кислоты из хлоргидрата используется токсичный метанол в качестве растворителя и требуется фильтрование через слой силикагеля, что затрудняет технологическую реализацию процесса.
Технический результат - экономически выгодный и безопасный процесс получения (S)-3-(аминометил)-5-метилгексановой кислоты формулы I с энантиомерным избытком 98.5%.
Технический результат достигается тем, что (S)-3-(аминометил)-5-метилгексановую кислоту формулы I:
получают путем асимметрического присоединения диэтилмалоната к 4-метил-1-нитропентену-1 с последующим восстановлением и кислотным гидролизом продукта присоединения в соответствии со схемой 1:
Отличительные признаки:
1. Используемый на стадии присоединения катализатор представляет собой комплекс никеля(II) формулы II с (2S,3S)-N,N'-дибензилбицикло[2.2.2]октан-2,3-диамином:
2. Получение (S)-3-(аминометил)-5-метилгексановой кислоты осуществляют кислотным гидролизом этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты с последующей обработкой триэтиламином без промежуточной стадии выделения хлоргидрата (S)-3-(аминометил)-5-метилгексановой кислоты.
Заявляемое изобретение имеет следующие преимущества:
Увеличение энантиоселективности процесса за счет применения в качестве катализатора энантиоселективного присоединения диэтилмалоната к 4-метил-1-нитропент-1-ену комплекса никеля(II) формулы II, что исключает необходимость дополнительной стадии обогащения (S)-изомером путем перекристаллизации этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты.
Упрощение технологического процесса и увеличение общего выхода (S)-3-(аминометил)-5-метилгексановой кислоты (71-73% по 4-метил-1-нитропентену-1) с энантиомерным избытком (S)-изомера 96.8% за счет отсутствия необходимости перекристаллизации полупродукта, этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты и исключения промежуточной стадии выделения хлоргидрата.
Обеспечение экологической безопасности процесса за счет отказа от использования больших объемов токсичного растворителя - метанола.
Примеры выполнения способа
Спектры ЯМР регистрировали на приборе Jeol JNM-ECX400 с использованием растворителей CDCl3 и метанол-d4 [399.78 (1Н) и 100.53 МГц (13С)]. Измерения проводили без использования дополнительных эталонов с привязкой частоты к сигналу дейтерированного растворителя.
Масс-спектры синтезированных соединений получены на хромато-масс-спектрометре Finnigan Trace DCQ с использованием капиллярной колонки ВРХ-5 30-0.32 компании SGE при энергии ионизирующих электронов 70 эВ.
Определение удельных углов вращения проводилось на поляриметре Rudolph Research Analitical.
Энантиомерный состав продуктов реакции определен методом ВЭЖХ на жидкостном хроматографе Waters, оснащенном спектрофотометрическим детектором Waters 2487 и рефрактометрическим детектором Waters 2414. Условия анализа для диэтил[(2S)-4-метил-1-нитропент-2-ил]малоната: колонна Chiralcel AD; мобильная фаза: гексан : изопропанол (95:5), расход 1.0 мл/мин. Условия анализа для (S)-прегабалина: колонна YMC Pack Pro C18; мобильная фаза: формиатный раствор (рН 3.0) в метаноле в соотношении 4:6 и метанол. Расход: 0.6 мл/мин. Хиральный модификатор - реагент D-Марфея.
Диэтил[(2S)-4-метил-1-нитропент-2-ил]малонат
Пример 1
К 16.2 г (125 ммоль) 4-метил-1-нитропент-1-ена и 20.8 г (130 ммоль) диэтилмалоната добавляли 2.15 г (2.5 ммоль, 2.0 мол.%) катализатора - дибромобис[(2S,3S)-N,N'-дибензилбицикло[2.2.2]октан-2,3-диамин]никеля(II). Реакционную массу выдерживали при температуре 50°С в течение 12 ч. Избыток диэтилмалоната отгоняли в вакууме при остаточном давлении 5 мм рт.ст. Выход: 34.4 г (95%). ЯМР 1Н (CDCl3), δ, м.д.: 0.85-0.87 м. (6Н), 1.20-1.29 м (8Н), 1.57-1.63 м (1Н), 2.87-2.92 м (1Н), 3.55 д (1H, JHH 5.6 Гц), 4.13-4.19 м (4Н), 4.46 дд (1Н, JHH 13.2, 6.4 Гц), 4.65 дд (1H, JHH 13.2, 4.8 Гц). δC, м.д.: 13.8, 13.9, 22.1, 22.2, 25.0, 34.7, 38.9, 52.6, 61.6, 61.7, 76.8, 167.7, 167.9. ГХ-МС, m/z (Iотн, %): 243 (6, М+ - NO2), 215 (10), 169 (25), 160 (100), 133 (30), 55 (35). ВЭЖХ: время выхода (R)-изомера 6.4 мин, (S)-изомера 8.8 мин; элюент гексан/изопропанол 98:2; расход мобильной фазы 1 мл/мин. По данным ВЭЖХ энантиомерный избыток (S)-изомера 96.8%.
Пример 2
К 32.4 г (250 ммоль) 4-метил-1-нитропент-1-ена и 41.6 г (260 ммоль) диэтилмалоната добавляли 2.15 г (2.5 ммоль, 1.0 мол.%) катализатора - дибромобис[(2S,3S)-N,N'-дибензилбицикло[2.2.2]октан-2,3-диамин]никеля(II). Реакционную массу выдерживали при температуре 50°С в течение 20 ч. Избыток диэтилмалоната отгоняли в вакууме при остаточном давлении 5 мм рт.ст. Выход: 70.1 г (97%). По данным ВЭЖХ энантиомерный избыток (S)-изомера 96.8%.
Пример 3
К 64.8 г (500 ммоль) 4-метил-1-нитропент-1-ена и 83.2 г (520 ммоль) диэтилмалоната добавляли 2.15 г (2.5 ммоль, 0.5 мольн. %) катализатора - дибромобис[(2S,3S)-N,N'-дибензилбицикло[2.2.2]октан-2,3-диамин]никеля(II). Реакционную массу выдерживали при температуре 50°С в течение 48 ч. Избыток диэтилмалоната отгоняли в вакууме при остаточном давлении 5 мм рт.ст. Выход: 140 г (97%). По данным ВЭЖХ энантиомерный избыток (S)-изомера 96.8%.
Этиловый эфир (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты
Пример 1
Раствор 34.4 г (119 ммоль) диэтил[(2S)-4-метил-1-нитропент-2-ил]малоната в 200 мл изопропанола гидрировали в присутствии 2.5 г никеля Ренея при температуре 50°С и избыточном давлении водорода 10 атм в течение 13 ч. Раствор фильтровали, изопропанол упаривали. Выход: 25.4 г (количественный). ЯМР 1Н (CDCl3), δ, м.д.: 0.90 т (6Н, JHH 6.4 Гц), 1.30 т (3Н, JHH 7.2 Гц), 1.34-1.46 м (2Н), 1.51-1.61 м (1Н), 2.06-2.89 м (3Н), 3.52-3.58 м (1Н), 4.21-4.28 м (2Н), 6.69 с (1Н). δС, м.д.: 14.1, 22.4, 22.5, 25.8, 37.4, 43.2, 46.8, 54.9, 61.4, 169.9, 173.7. ГХ-МС, m/z (Iотн, %): 213 (3, М+), 168 (12), 156 (100), 110 (18), 84 (20), 56 (25).
Пример 2
Раствор 70.1 г (242 ммоль) диэтил[(2S)-4-метил-1-нитропент-2-ил]малоната в 400 мл изопропанола гидрировали в присутствии 5.0 г никеля Ренея при температуре 50°С и избыточном давлении водорода 10 атм в течение 13 ч. Раствор фильтровали, изопропанол упаривали. Выход: 51.6 г (количественный).
Пример 3
Раствор 140 г (484 ммоль) диэтил[(2S)-4-метил-1-нитропент-2-ил]малоната в 500 мл изопропанола гидрировали в присутствии 11.0 г никеля Ренея при температуре 50°С и избыточном давлении водорода 20 атм в течение 10 ч. Раствор фильтровали, изопропанол упаривали. Выход: 103 г (количественный).
(S)-3-(Аминометил)-5-метилгексановая кислота
Пример 4
К 75 мл 6М соляной кислоты добавляют 17.1 г (80 ммоль) этилового эфира (4S)-изобутилпирролидин-2-он-3-карбоновой кислоты и полученную смесь кипятят в течение 15 ч. После проведения реакции воду упаривают в вакууме, а остаток растворяют в смеси 45 мл изопропанола и 20 мл воды. Полученный раствор хлоргидрата (S)-3-(аминометил)-5-метилгексановой кислоты фильтруют от незначительного количества примесей. К фильтрату добавляют 9.1 г (90 ммоль) триэтиламина и полученную смесь перемешивают при температуре -5-0°С в течение 6 ч. Выпавший осадок (S)-3-(аминометил)-5-метилгексановой кислоты отфильтровывают, промывают 15 мл изопропанола и сушат. Выход: 9.55 г (75%). Т.пл. 170-172°С. [α]D20 = +7.15° (с 1.03, H2O). Спектр ЯМР 1Н (метанол-d4), δ, м.д.: 0.89-0.92 м (6Н), 1.15-1.28 м (2Н), 1.65-1.72 м (1Н), 2.02-2.12 м (1Н), 2.22-2.28 м (1Н), 2.39-2.44 м (1H), 2.80-2.85 м (1H), 2.94-2.97 м (1Н), 3.29 м (1Н). ВЭЖХ: время выхода (R)-изомера 6.0 мин, (S)-изомера 7.8 мин. По данным ВЭЖХ энантиомерный избыток (S)-изомера 98.5%.