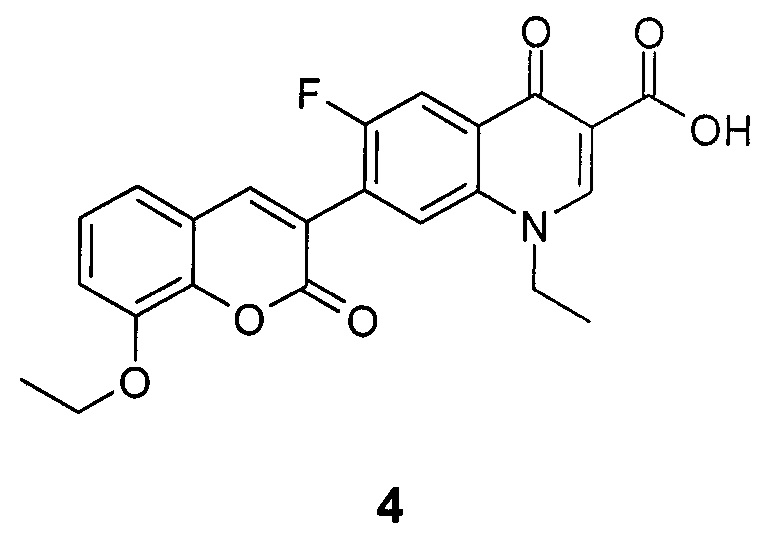
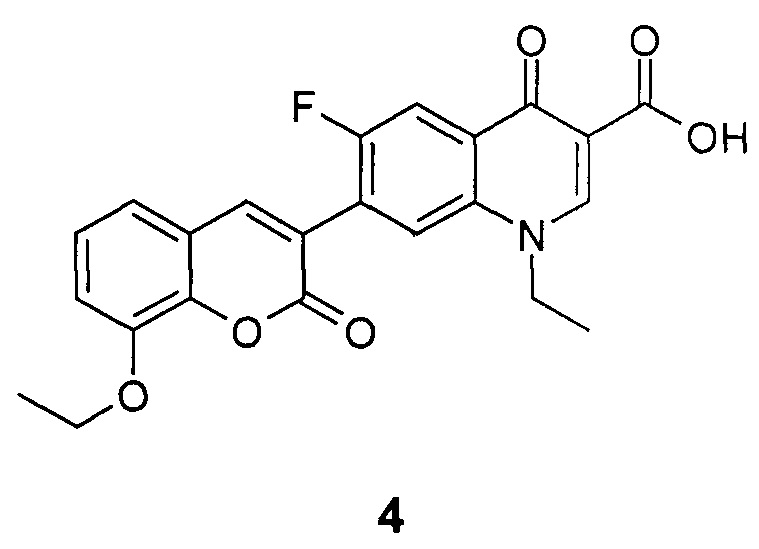
Результат интеллектуальной деятельности: 1-Этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2Н-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновая кислота, обладающая противотуберкулезной активностью
Вид РИД
Изобретение
Изобретение касается области медицинской химии и относится к новому производному фторхинолонкарбоновой кислоты, 1-этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2H-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоте, которая обладает противотуберкулезной активностью и может найти применение в медицине и ветеринарии.
Бактериальные инфекции занимают важное место в структуре социально значимых заболеваний, а туберкулез является одной из 10 ведущих причин смертности. В 2015 г. в мире зафиксировано 10,4 млн новых случаев заражения туберкулезом, а смертность составила 1,8 млн. человек. В России в 2015 г. зарегистрировано 130904 случая заболевания туберкулезом. Российская Федерация включена в список стран с высоким бременем туберкулеза, поскольку уровень заболеваемости и смертности населения от туберкулеза превышает аналогичные показатели в странах Европы в 5-8 раз (http://www.who.int/tb/en) (2009); Global Tuberculosis Control: Surveillance, Planning, Financing; WHO Report 2009; World Health Organization: Geneva, 2009).
http://www.who.int/mediacentre/factsheets/fs104/ru/. Эти данные свидетельствуют, насколько велико социально-экономическое значение туберкулеза. К сожалению, борьба с туберкулезом методами современной химиотерапии должного эффекта не имеет.
К основным проблемам лечения туберкулеза относятся ограниченность арсенала противотуберкулезных средств и развитие множественной лекарственной устойчивости возбудителя (МЛУ), когда микобактерии туберкулеза устойчивы как минимум к двум основным противотуберкулезным препаратам - изониазиду и рифампицину. Микобактерия туберкулеза (МБТ) гипермутабельна - при попадании внутрь клетки начинаются ее многочисленные мутации, ведущие к ее резистентности, повышению скорости роста и другим неприятным качествам этого патогена. В 2015 году в мире насчитывалось около 480000 новых случаев туберкулеза (ТБ) с множественной лекарственной устойчивостью (МЛУ-ТБ), в том числе 42000 случаев - в России. Кроме того, диагностировано более 100000 больных с устойчивыми к лечению рифампицином формами туберкулеза (РР-ТБ). Индия, Китай и Российская Федерация составили 45% от общего числа новых случаев МЛУ-ТБ и РР-ТБ - 261000 случаев.
Препараты фторхинолонового ряда проявляют высокую активность в отношении микобактерий туберкулеза (МБТ) и представляют значительный интерес как препараты для комбинированной химиотерапии лекарственно-устойчивого туберкулеза [Caminero J., Sotgiu G., Zumla A. et al. Best drug treatment for multidrug-resistant and extensively drugresistant tuberculosis // Lancet Infect Dis. 2010. №10. P. 621-629]. В руководстве ВОЗ (2011 г.) в лечении МЛУ-ТБ предпочтение отдается левофлоксацину, моксифлоксацин рекомендуется применять лишь при доказанной широкой лекарственной устойчивости.
Механизм действия фторхинолонов на микобактериальную клетку принципиально отличается от механизма действия известных противотуберкулезных препаратов, что обеспечивает бактерицидный эффект и активность фторхинолонов в отношении штаммов, чувствительных и устойчивых к химиотерапии. Поиск новых препаратов, механизм действия которых на микобактериальную клетку принципиально отличается от механизма действия известных противотуберкулезных препаратов, является актуальной задачей [В. Villemagne, С. Crauste, М. Flipo et al. Eur. J. Med. Chem. 2012, 51, 1-16].
Фторхинолоны оказывают ингибирующее действие на микробную клетку, как в период покоя, так и в период роста. Механизм действия заключается в ингибировании ДНК гиразы, что ведет к нарушению процессов транскрипции и репликации. В результате нарушается синтез ДНК, что в конечном итоге, нарушает деление клетки.
ДНК-гираза бактерий является белковым тетрамером массой 400 kDa, состоящим из двух субъединиц A (GyrA) и двух субъединиц В (GyrB). Связывание и расщепление ДНК связано с GyrA, в то время как АТФ связывается и гидролизуется белком GyrB. GyrB состоит из аминоконцевого домена, который обладает АТФ-азной активностью, и карбоксиконцевого домена, который взаимодействует с GyrA и ДНК. В идеале, антибиотики, механизм действия которых основан на ингибировании ДНК-гиразы бактерий, будут избирательными для данного фермента и относительно неактивны в отношении топоизомераз типа II у эукариот.
Фторхинолоновые антибиотики ингибируют ДНК-гиразу бактерий: связываются с GyrA и стабилизируют расщепленный комплекс, ингибируя, таким образом, функцию гиразы в целом, приводя к гибели клеток.
Менее известны ингибиторы, которые связываются с GyrB. Примеры включают кумарины, новобиоцин и кумермицин А, циклотиалидин, цинодин и клероцидин. Установлено, что кумарины очень прочно связываются с GyrB [Maxwell, Trends in Microbiology, 1997, 5, 102].
Синтез новых соединений, сочетающих в одной молекуле фрагменты, ингибирующие обе субъединицы ДНК-гиразы, может представлять интерес с точки зрения расширения спектра их действия на патоген.
Задача предлагаемого изобретения - поиск нового соединения с высокой антимикобактериальной активностью, в том числе по отношению к мультирезистентным штаммам микобактерий, расширяющего арсенал известных противотуберкулезных средств.
Техническим результатом данного изобретения является создание нового химического соединения - 1-этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2H-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты формулы (4)
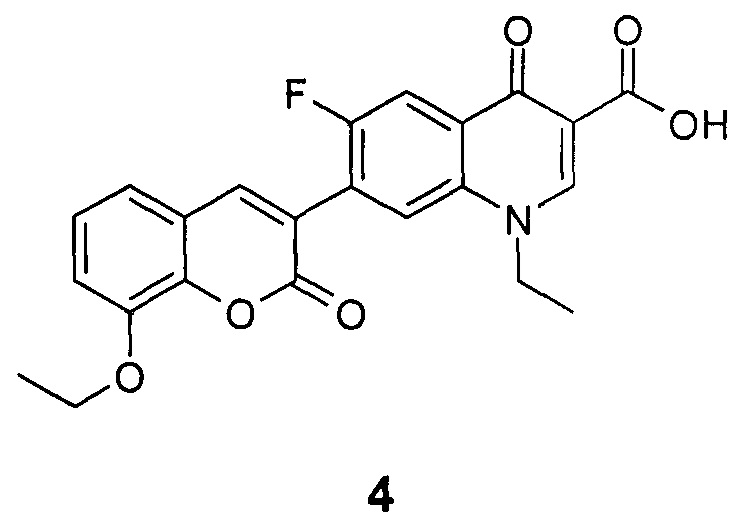
Соединение 4, его физико-химические характеристики, а также способ его получения в литературе не описаны.
Соединение формулы (4) может быть получено в три стадии из доступного этилового эфира 6,7-дифтор-1-этил-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1).
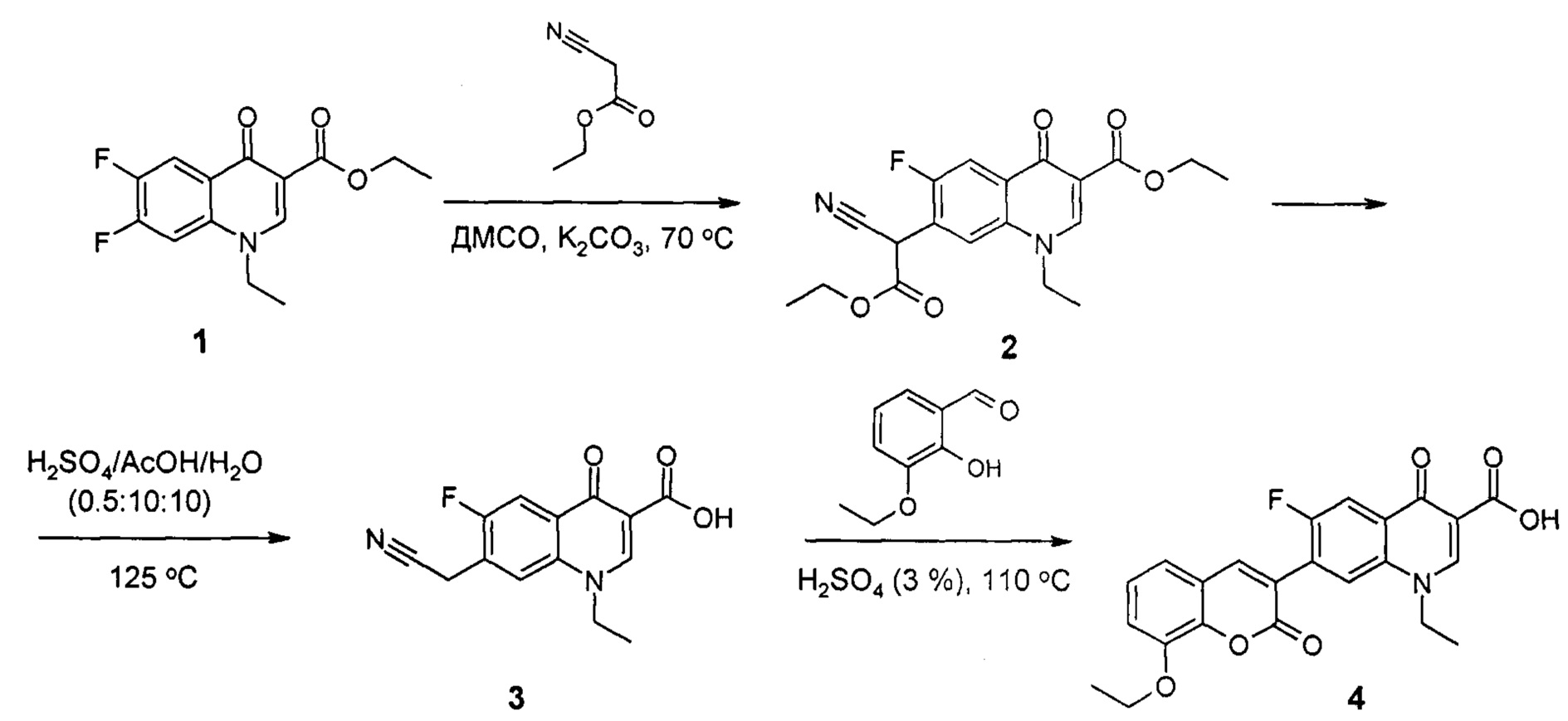
Соединение 1 нагревают с этиловым эфиром циануксусной кислоты в диметилсульфоксиде (ДМСО) в присутствии предварительно прокаленного карбоната калия. В результате выделяют этиловый эфир 7-(1-циано-2-этокси-2-оксоэтил)-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (2), кислотным гидролизом которого получают соединение 3 - 7-цианометил-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту. Соединение 3 вводят в реакцию с 3-этоксисалициловым альдегидом в N,N-диметилформамиде при комнатной температуре, далее полученный продукт отфильтровывают и в смеси серной и уксусной кислот при нагревании получают целевое соединение 4.
Характеристики соединений приведены в примерах конкретного выполнения.
Структуры соединений подтверждают методами элементного анализа, ЯМР 1Н, 19F и 13С спектрами и масс-спектрами. Температуры плавления соединений определяют на приборе Stuart SMP3 (Barloworld Scientific). Элементный анализ выполнен на автоматическом CHNS-O анализаторе РЕ 2400 серия II (Perkin Elmer).
Спектры ЯМР 1Н зарегистрированы на приборах Bruker DRX-400 (400 МГц) или Bruker Avance 500 (500 МГц) в ДМСО-d6 с SiMe4 в качестве внутреннего стандарта при 25°С. Химические сдвиги (δ) приведены в миллионных долях (м.д.), а константы спин-спинового взаимодействия (J) в герцах.
Спектры ЯМР 19F зарегистрированы на приборах Bruker Avance 500 (500 МГц) в ДМСО-d6. Химические сдвиги (δ) приведены в миллионных долях (м.д.), а константы спин-спинового взаимодействия (J) в герцах.
Спектры ЯМР 13С зарегистрированы на приборе Bruker Avance 500 (125 МГц) в ДМСО-d6 с SiMe4 в качестве внутреннего стандарта при 25°С. Химические сдвиги (6) приведены в миллионных долях (м.д.).
Масс-спектры зарегистрированы на спектрометре Shimadzu GCMS-QP 2010 «Ultra». Условия съемки: энергия ионизирующих электронов 70 эВ, прямой ввод образца в источник.
Примеры конкретного выполнения.
Пример 1. Синтез 1-этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2H-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (4).
Стадия 1. Синтез 7-(1-циано-2-этокси-2-оксоэтил)-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (2).
К раствору, содержащему 10,00 г (35,55 ммолей) этилового эфира 6,7-дифтор-1-этил-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1) в 65 мл диметилсульфоксида, прибавляют 4,80 г (42,66 ммоля) этилового эфира циануксусной кислоты и присыпают 11,79 г предварительно прокаленного карбоната калия. Полученную реакционную смесь нагревают с обратным холодильником с хлоркальциевой трубкой при 80°С в течение 4 ч. Реакционную массу выливают в ледяную воду (~ 250 мл) и к полученному раствору при перемешивании добавляют раствор HCl (18%) до рН 2-3. Полученный продукт экстрагируют хлористым метиленом (~ 600 мл). Водный слой отделяют, а органический слой промывают 2 раза по 200 мл дистиллированной водой и 1 раз насыщенным раствором хлорида натрия (200 мл), затем высушивают над безводным сульфатом натрия. Хлористый метилен удаляют на ротационном вакуум-испарителе, к остатку добавляют диэтиловый эфир (~ 75 мл), полученный осадок соединения 2 отфильтровывают и сушат на воздухе, при перекристаллизации из этилового спирта получают бесцветное вещество с т. пл. > 250°С (разложение без плавления). Выход 11,6 г (87,1%).
В следующей стадии соединение 2 используют без дополнительной очистки.
Найдено, %: С 60.92; Н 5.12; N 7.43. Вычислено для C19H19FN2O5 (М 374.377), %: С 60.96; Н 5,12; N7.48.
Спектр ЯМР 1Н (500.1 МГц, ДМСО-d6): 1.22 (т, 3Н, J = 7.1 Гц, Н-4'); 1.30 (т, 3Н, J = 7.1 Гц, Н-3''); 1.41 (т, 3Н, J = 7.1 Гц, NCH2CH3); 4.24 (кв, 2Н, J = 7.1 Гц, Н-2''); 4.27 (кв, 2Н, J = 7.1 Гц, Н-3'); 4.41 (д кв, 1H, J = 14.1, 7.1 Гц, NCHB); 4.45 (д кв, 1Н, J = 14.1, 7.1 Гц, NCHA); 6.13 (с, 1Н, Н-1'); 8.00 (д, 1Н, J = 10.2 Гц, Н-5); 8.09 (д, 1Н, J = 5.9 Гц, Н-8); 8.77 (с, 1Н, Н-2).
Спектр ЯМР 19F (470.5 МГц, DMSO-d6): 42.97 (дд, J = 10.2, 5.9 Гц, F-6).
Спектр ЯМР 13С (125.7 МГц, DMSO-d6): 13.75 (С-4'); 14.25 и 14.28 (2*СН3); 37.94 (С-1'); 48.46 (NCH2); 59.88 (С-2''); 63.21 (С-3'): 109.90 (С-3); 111.93 (д, 2JCF = 22.3 Гц, С-5); 115.19 (CN); 121.41 (д, 3JCF=2.7 Гц, С-8); 124.21 (д, 2JCF = 17.7 Гц, С-7); 130.53 (д, 3JCF = 6.6 Гц, С-4а); 135.28 (дкв, 4JCF = 1.5 Гц, С-8а); 149.50 (С-2); 156.88 (д, 1JCF = 248.5 Гц, С-6); 163.88 (С-2'); 164.36 (С-1''); 171.47 (д, 4JCF = 2.1 Гц, С-4).
Масс-спектр, m/z (Iотн., > 5%): 375 [М+1]+ (1,35); 374 [М]+ (5,91); 329 (6,76); 303 (18,07); 302 (100); 230 (7.07); 229 (7.09); 228 (6.67); 145 (5,12).
Стадия 2. Синтез 7-цианометил-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (3).
К 10,00 г (26,71 ммолей) этилового эфира 7-(1-циано-2-этокси-2-оксоэтил)-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (2) приливают 75 мл смеси кислот (серная кислота, конц.: уксусная кислота: вода дист. - 1: 20: 20). Реакционную массу нагревают при температуре 125°С в течение 6 ч. Затем реакционный раствор охлаждают до комнатной температуры, выпавший осадок отфильтровывают, промывают на фильтре дистиллированной водой и сушат на воздухе. Осадок перекристаллизовывают из смеси этанол:N,N-диметилформамид, получают бесцветное кристаллическое вещество с т. пл. > 250°С (разложение без плавления). Выход: 6,7 г (91,8%).
Найдено, %: С 60.92; Н 5.12; N 7.43. Вычислено для C14H11FN2O3 (М 274.258), %: С 61.31; Н 4.04; N 10.22.
Спектр ЯМР 1Н (500.1 МГц, ДМСО-d6): 1.46 (т, 3Н, J = 7.1 Гц, СН3); 4.34 (с, 2Н, CH2CN); 4.60 (кв, 2Н, J = 7.1 Гц, NCH2); 8.10 (д, 1Н, J = 9.5 Гц, Н-5); 8.22 (д, 1H, J = 6.0 Н-8); 9.10 (с, 1H, Н-2); 14.89 (с, 1Н, ОН).
Спектр ЯМР 19F (470.5 МГц, ДМСО-d6): 44.84 (дд, J = 9.5, 6.0 Гц, F-6).
Спектр ЯМР 13С (125.7 МГц, ДМСО-d6): 14.47 (СН3); 17.81 (CH2CN); 49.44 (NCH2); 107.68 (С-3); 110.87 (д, 2JCF = 22.8 Гц, С-5); 117.26 (CN); 121.23 (д, 3JCF = 3.6 Гц, С-8); 126.67 (д, 2JCF = 18.8 Гц, С-7); 126.94 (д, 3JCF = 7.7 Гц, С-4а); 135.81 (д, 4JCF = 1.4 Гц, С-8а); 149.42 (С-2); 157.68 (д, 1JCF = 249.9 Гц, С-6); 165.66 (СОО); 176.63 (д, 4JCF = 2.6 Гц, С-4).
Масс-спектр, m/z (Iотн., > 9%): 275 [М+1]+ (1,26); 274 [М]+ (7,24); 231 (14,36); 230 (100); 215 (53,38); 147 (9,89).
Стадия 3. Синтез 1-этил-6-фтор-4-оксо-7-(8-этокси-2-оксо-2H-хромен-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (4).
К суспензии, содержащей 0,500 г (1,82 ммолей) 7-цианометил-1-этил-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (3) и 0,303 г (1,82 ммолей) 3-этоксисалицилового альдегида, добавляют 5 капель пиперидина и перемешивают при комнатной температуре в течение 1 ч. К реакционной массе добавляют 15 мл этанола, осадок отфильтровывают, промывают на фильтре небольшим количеством этанола и гептана. Осадок с фильтра переносят в круглодонную колбу, добавляют 20 мл 5% раствора серной кислоты и нагревают при температуре 110°С в течение 6 ч. Реакционную массу охлаждают до комнатной температуры, осадок отфильтровывают и промывают на фильтре водой дистиллированной, затем гексаном или гептаном. Перекристаллизовывают из водного N,N-диметилформамида, получают 375 мг (48,6%) целевого соединения (4). Т. пл. 230°С (разложение без плавления).
Найдено, %: С 64.89; Н 4.28; N 3.36. Вычислено для C23H18FNO6 (М 423.425), %: С 65.25; Н 4.29; N3.31.
Спектр ЯМР 1Н (500.1 МГц, ДМСО-d6): 1.43 (т, 3Н, J = 7.0 Гц, OCH2CH3); 1.47 (т, 3Н, J = 7.1 Гц, NCH2CH3); 4.23 (кв, 2Н, J = 7.0 Гц, OCH2CH3); 4.64 (кв, 2Н, J = 7.1 Гц, NCH2CH3); 7.34-7.41 (м, 3Н, Н-5', 6', 7'); 8.14 (д, 1H, J = 9.7 Гц, Н-5); 8.35 (д, 1H, J = 5.9 Гц, Н-8); 8.42 (с, 1Н, Н-4'); 9.12 (с, 1H, Н-2); 14.97 (с, 1Н, СООН).
Спектр ЯМР 19F (470.5 МГц, DMSO-d6): 47.91 (дд, J = 9.7, 5.9, F-6).
Спектр ЯМР 13С (125.7 МГц, DMSO-d6): 14.59 и 14.65 (2*СН3); 49.46 (NCH2); 64.52 (ОСН2); 107.66 (С-3); 110.76 (д, 2JCF = 24.0 Гц, С-5); 115.97 (С-7'); 119.29 (C-4'a); 121.46 (С-3'); 122.24 (д, 3JCF = 3.1, С-8); 124.96 (С-6'); 127.15 (д, 3JCF = 7.8, С-4а); 129.80 (д, 2JCF = 18.1, С-7); 135.58 (д, 4JCF = 1.2, С-8а); 142.88 (C-8'a); 145.01 (д, 4JCF = 1.5, С-4'); 145.67 (С-8'); 149.50 (С-2); 157.20 (д, 1JCF = 250.5, С-6); 158.43 (С-2'); 165.77 (СОО); 176.66 (d, 4JCF = 2.7, С-4).
Масс-спектр, m/z (Iотн., > 11%): 424 [М+1]+ (2,00); 423 [М]+ (6,86); 380 (25,57); 379 (100); 336 (17,50); 176 (11,20).
Биологическая активность
Туберкулостатическую активность изучали в лаборатории экспериментальных и диагностических исследований ФГБУ «Уральского научно-исследовательского института фтизиопульмонологии» Минздрава России, г. Екатеринбург.
Изучение туберкулостатической активности соединений проводят методом вертикальной диффузии с использованием лабораторного штамма H37Rv на плотной питательной среде «Новая».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл взвеси микобактерий туберкулеза (МБТ) штамма H37Rv, разведенного по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл субстанции раствора соединений в исследуемых концентрациях: 12,5; 6,25; 3,1; 1,5; 0,75 мкг/мл. Затем пробирки помещают в термостат при температуре 37°С и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Соединение 4 проявило высокую туберкулостатическую активность в отношении лабораторного штамма H37Rv (таблица 1).
Изучение туберкулостатической активности в отношении резистентных штаммов проводят методом вертикальной диффузии на плотной питательной среде «Новая» с использованием лабораторных и клинических штаммов микобактерий туберкулеза с множественной лекарственной устойчивостью (МЛУ), выделенных от больных, находящихся на лечении в клинике ФГБУ «УНИИФ».
Питательную среду разливают в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы 1/2 часть дна пробирки оставалась свободной. Свернутую среду засевают по 0,1 мл суспензией микобактерий различных штаммов, разведенных по стандарту мутности 10 ед. ГКИ, и в наклонном положении помещают в термостат на 24 часа для выращивания МБТ. Через сутки пробирки ставят в вертикальное положение и по свободному краю закапывают по 0,3 мл раствора соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,5; 0,7 мкг/мл. Затем пробирки помещают в термостат при температуре 37°С и инкубируют в течение 10 суток. Оценку роста МБТ проводят по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствует о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ. Данные представлены в таблице 1.
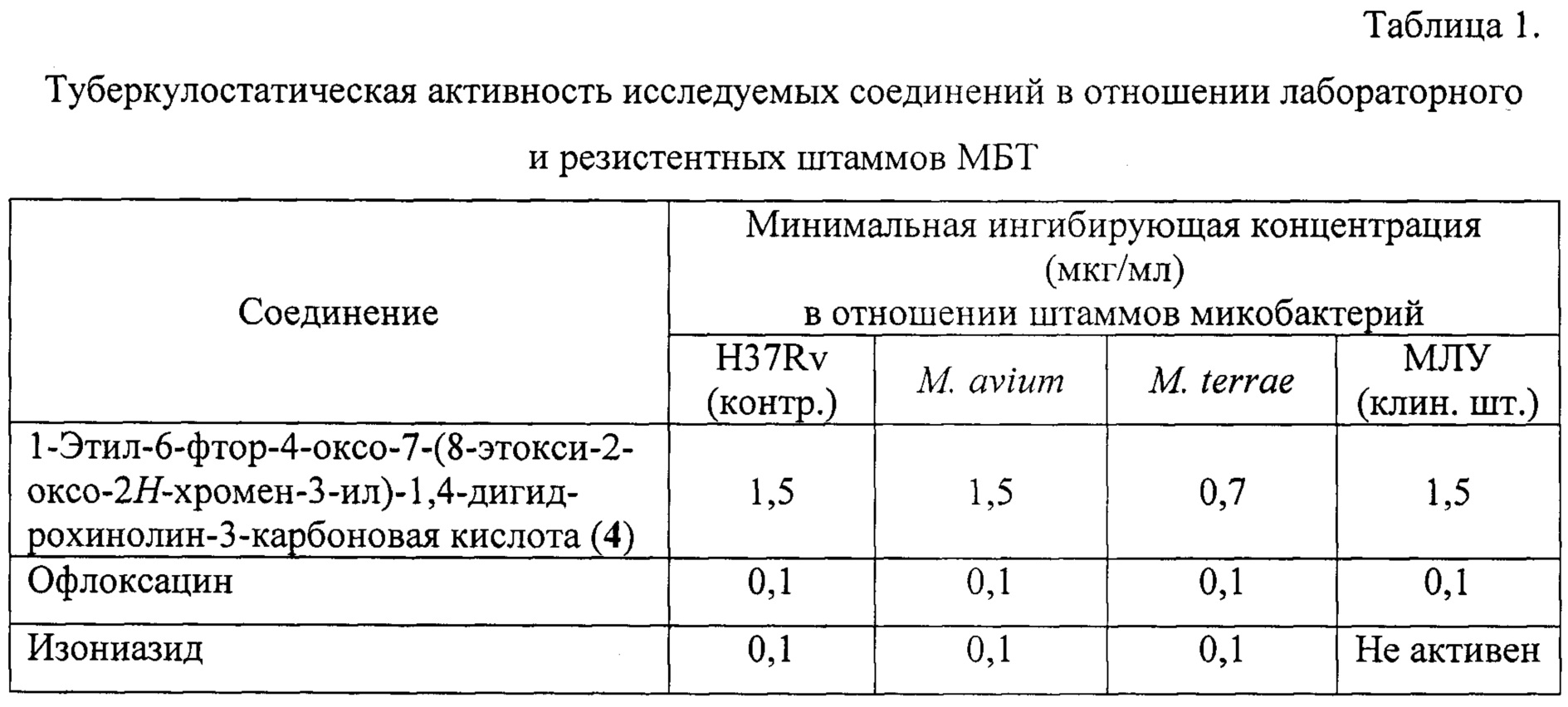
Из данных таблицы 1 следует, что соединение 4 проявляет высокую туберкулостатическую активность (МИК 0,7-1,5 мкг/мл) как в отношении лабораторного штамма H37Rv, так и в отношении ряда лекарственно устойчивых штаммов МБТ. Следует подчеркнуть, что соединение 4 проявило активность в отношении штамма МЛУ, в отношении которого известный противотуберкулезный препарат, изониазид, не активен.
Для заявляемого соединения 4 изучена острая токсичность и определена летальная доза LD50 в опытах на животных (in vivo). Определяют максимально переносимую дозу (МПД), при которой не наблюдалось гибели животных, и дозу, вызывающую гибель 50% животных (ЛД50). В соответствии с методикой (Г.Н. Першин, 1971. М.) расчет ЛД50 проводят по формуле, определяя среднюю смертельную дозу:
х. среднее = [(a+b) (m-n)]:200,
где (а+b) - сумма смежных доз; (m-n) - разность % смертности от 2-х последних доз.
Исследование острой токсичности и отработку летальной дозы ЛД50 соединения 4 проводят на белых мышах весом 17-20 г. Для препарата отбирают индивидуальные дозы: минимальная 150 мг/кг, средняя 300 мг/кг или 600 мг/кг и максимальная 900 мг/кг. Для каждой дозы берут по 5 белых мышек, которым вводят препараты в желудок в объеме 0,5 мл в 1% растворе крахмального клейстера. Контрольной группе вводят только 1% раствор крахмального клейстера.
Наблюдение за животными проводят в течение 14 дней. У всех животных, павших в процессе опыта, проводят макроскопические и гистологические исследования внутренних органов (печени, почек, легких, селезенки). У выживших животных после забоя также проводят гистологические исследования внутренних органов.
Данные по острой токсичности соединения 4 представлены в таблице 2.
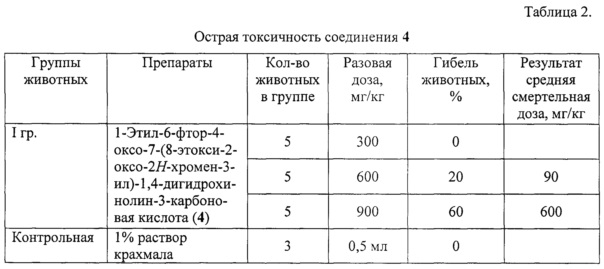
Из представленных в таблице 2 данных следует, что при введении животным соединения 4 в дозе 300 мг/кг гибель животных не отмечена через 24 часа после введения. При введении животным соединения 4 в дозе 600 мг/кг гибель животных наступает через 2 часа после приема (20%). При введении животным соединения 4 в дозе 900 мг/кг гибель животных наступает через 30-60 мин после приема (60%). При вскрытии погибших животных макроскопических изменений во внутренних органах не выявлено. В результате проведенного исследования для соединения 4 установлено, что максимально переносимая доза (МПД) - 300 мг/кг (гибели животных не наблюдалось), ЛД50 - 600 мг/кг (гибель животных в 20%).