Результат интеллектуальной деятельности: СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ
Вид РИД
Изобретение
Изобретение относится к несимметричным 3,6-дизамещенным 1,2,4,5-тетразинам, содержащим в положении 6 тетразинового цикла 3,5-диметилпиразолильную группу, а в положении 3 - остаток ароматического или алифатического амина. Указанные соединения могут быть использованы в качестве противотуберкулезных агентов, в первую очередь для лечения больных туберкулезом.
Структура и способ получения соединений, заявляемых в качестве селективных противотуберкулезных агентов, описаны [ЖОрХ, 1999, 35, с.1392; Abstracts of Second International Symposium of Molecular Design and Synthesis of Supramolecular Architectures, Kazan, 2002, p.154], но их активность в отношении микобактерий туберкулеза не известна и не описана.
Аналогом вышеуказанных веществ по строению является метиловый эфир 2-N-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-аминопропионовой кислоты формулы (I), который проявляет заметную туберкулостатическую активность в отношении штамма микобактерий H37Rv, однако для других представителей этого ряда соединений характерно обратное действие - усиление роста колоний микобактерий в их присутствии, связанное с высвобождением аминокислот [Хим.-фарм. журнал, 39, №1, 2005, с.10-12].
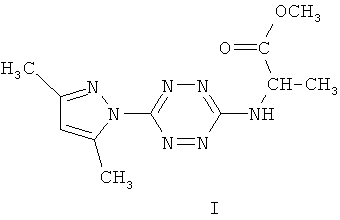
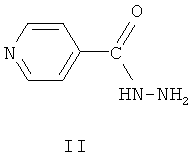
Аналог по назначению, изониазид формулы II, является селективным противотуберкулезным препаратом, однако недостатками этого препарата являются его высокая токсичность и различные побочные эффекты при применении. Изониазид вызывает аллергию, негативно влияет на функцию желудочно-кишечного тракта, имеет побочное действие на нервную систему [М.Д.Машковский. Лекарственные средства, 15-е изд., перераб., испр. и доп. -М.: РИА «Новая волна»: издатель Умеренков, 2007, с.858 и Фармакология и токсикология, 1987, 50, (4), с.87]. Отмечено широкое распространение устойчивых к изониазиду клинических штаммов микобактерий [Антибиотики и химиотерапия, 2002, 47, №6, с.28-30].
Способы получения соединений А описаны. Замещенные 3-(N-R1-амино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразины общей формулы A получают взаимодействием в ацетонитриле 3,6-бис(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина с соответствующим замещенным амином [ЖОрХ, 2006, 42, №3, с.772-780].
Задача изобретения - использование известных веществ в качестве антимикобактериальных агентов с повышенной специфичностью при одновременном расширении спектра антимикобактериального действия.
Поставленная задача решается тем, что в качестве противотуберкулезных агентов используют несимметричные 3,6-дизамещенные 1,2,4,5-тетразины, содержащие в положении 3 остаток замещенного амина - 3-амино-замещенные 6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразины общей формулы A
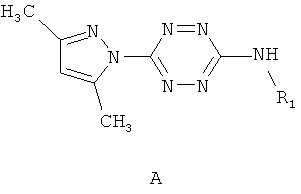
где R1=аминогруппа, C1-C12-алкил, 3-окси-5-гидроксипентил, пропин-2-ил, этилиндолил, адамантил, арил, выбранный из возможно замещенного фенила, гетерил, выбранный из индол-3-ила, хинолин-3-ила, пиридила, при этом замещенный фенил имеет заместитель, выбранный из группы, включающей метил, бром, гидрокси-группу, а пиридил имеет заместители, выбранные из группы хлор, метил.
В отличие от аналогов по строению и назначению указанные соединения представляют собой 3,6-дизамещенные 1,2,4,5-тетразины, содержащие амино-производные фрагменты, а также дополнительные гетероароматические остатки, наличие туберкулостатической активности у которых не было очевидным.
Особенности строения заявляемых соединений приводят к повышению специфичности антимикобактериального действия и расширению спектра действия - повышению активности указанных соединений в отношении типичных и атипичных штаммов микобактерий (табл.1, 3). За счет своей специфичности к микобактериям они не оказывают подавляющего действия на нормальную микрофлору организма, практически не токсичны (табл.2, 4, 5). Выявлен терапевтический эффект 3-(4-бромфениламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина (пример 9) при лечении экспериментального туберкулеза белых мышей.
Исследование антимикобактериальной активности заявляемых соединений в опытах in vitro проводят бактериологически, методом вертикальной диффузии на плотной питательной среде Ливенштейна - Йенсена или "Новая". В пробирку с засеянным тест-микробом по свободному краю на дно закапывают по 0,3 мл каждого разведения. Пробирки помещают в термостат в вертикальном положении и инкубируют при 37°C, результаты учитывают на 10-12 сутки.
Антибактериальную активность заявляемых соединений изучают методом высевания растворов препарата в лунки. В чашку Петри с простым питательным агаром вносят тест-микроб. В лунку, расположенную посредине чашки Петри, вносят по 0,02 мл препарата в необходимых концентрациях. Результаты учитывают после 24-часовой инкубации в термостате при 37°C, определением зоны задержки роста микроорганизмов по краям лунки.
Изучение цитотоксичности заявляемых соединений проводят на клеточной культуре МТ-4 (перевиваемой линии клеток Т лимфоцитов человека). Токсичность различных концентраций соединений определяют по жизнеспособности клеток относительно контроля с использованием спектрофотометра при длине волны 540 нм, по полученным данным строят дозозависимые кривые и определяют концентрации, на 50% снижающие жизнеспособность клеток по сравнению с контролем (CD50).
Исследование острой токсичности заявляемых соединений осуществляют по стандартной методике на белых мышах. Животные получают препарат per os в 10% растворе крахмала. Изучение терапевтического действия соединения (пример 9) осуществляют на белых лабораторных мышах весом 18-23 г, зараженных внутривенно, в хвостовую вену в дозе 0.5 мг двухнедельной культуры (штамм H37R.V) в 0.5 мл физиологического раствора. Лечение начинают через неделю после заражения и проводят ежедневно в течение 8 недель. Исследуемый препарат, в том числе контрольный изониазид, дают мышам в дозе 10 мг/кг веса.
Оптимальным соотношением туберкулостатическая активность - токсичность обладает 3-(2-(1H-индол-3-ил)этиламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин. Это соединение имеет самую низкую токсичность в исследованном ряду. По данным внутрижелудочного введения, согласно ГОСТу 12.1.007-76 и проекту классификации ОЕСД он относится к IV классу малотоксичных - малоопасных веществ (ДЛ50>5000,0 мг/кг). По данным подкожного введения данный препарат находится на границе между III и IV классом опасности (ДЛ50=1949,8 (1183,09 - 3213,43) мг/кг (ДЛ50 для соединений IV класса опасности при подкожном введении должна превышать 2000,0 мг/кг).
Чистоту полученных соединений контролируют методом ТСХ, значения Rf определяют с использованием пластинок "Sorbfil" (Силикагель СТХ-1А, УФ) (Россия) или "Silufol-UV" (Чехословакия). Структуру полученных соединений подтверждают данными элементного анализа (C, H, N, O - анализатор фирмы Karlo Erba). ИК-спектры регистрируют на ИК-Фурье спектрометре «Spectrum One» фирмы «PerkinElmer» с помощью приставки диффузного отражения (Diffuse Reflectance Sampling Accessory (DRA). Спектры ЯМР 1H соединений записывают в ДМСО-d6 на приборе "Bruker-400" с рабочей частотой 400 мГц и ТМС в качестве внутреннего стандарта. Температуры плавления определяют на нагревательном столике «Boetius». Для микроволнового облучения исследуемых реакций используют микроволновой химический реактор ProLabo (частота 2.45 Гц, мощность излучения 200 Вт).
Примеры конкретного выполнения.
Пример 1
3-Гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=аминогруппа)
1.0 Ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина суспендируют в 10 мл ацетонитрила и при перемешивании добавляют 1.1 ммоль гидразин-гидрата.
Реакционную смесь помещают в фарфоровую чашечку, растворитель испаряют, остаток перекристаллизовывают из алифатического спирта, сушат на воздухе. Выход 91%, т.пл. 153-154°C (из CH3CN). C7H10N8. Вычислено, (%): C, 40.77; H, 4.89; N, 54.34. Найдено, (%): C, 40.77; H, 4.98; N, 54.24. 1H ЯМР (CDCl3), δ): 2.37 (с, 3H, 3Pz-CH3); 2.58 (с, 3H, 5Pz-CH3); 6.13 (с, 1Н, 4Pz-CH); 4.18 (уш.с, 2Н, NH2); 7.16 (уш.с 1H, NH).
Пример 2
3-Метиламино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=метил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль метиламина.
Выход 90%. Т.пл. 194-195°C. Вычислено, (%): C, 46.83; H, 5.37; N, 47.80. C8H11N7.
Найдено, (%): C, 47.16; H, 5.32; N, 48.13. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 6.18 (с, 1Н, 4Pz-CH); 8.71 (м, 1H, -NH-CH3), 2.23, 2.38 (оба с, 6Н, 2CH3Pz); 3.01 (д, 3H, J=4.9).
Пример 3
3-Ундециламино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=ундецил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль ундециламина.
Выход (%): 91.4. Т.пл. 57-58°C. Вычислено, (%): C 62.57; H 9.05; N 28.38. C18H31N7. Найдено, (%): C 62.63; H 9.20; N 28.59. Спектр ЯМР lH (CDCl3, δ, м.д., J/Гц): 6.10 (с, 1Н, 4Pz-CH); 5.80 (т, 1H, -NH-CH2 -), 2.56, 2.35 (оба с, 6Н, 2CH3 Pz); 3.62 (кв, 2Н, -NH-CH2 --), 1.76-1.69 (м, 2Н, -NH-(CH2)9CH2CH3); 1.42-1.27 (м, 16Н, -NH-CH2-(CH2)8-C2H5); 0.88 (т, 3H, -NH-(CH2)10CH3 J=7,0 Гц).
Пример 4
3-Додецил-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=додецил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль додециламина.
Выход 94%. Т.пл. 71-72°C. Вычислено, (%): C 63.47; H 9.25; N 27.27. C19H33N7. Найдено, (%): C 63.45; H 9.13; N 27.32. Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 6.10 (с, 1H, 4Pz-CH); 5.79 (т, 1Н, -NH-CH2 -), 2.56, 2.35 (оба с, 6Н, 2CH3 Pz); 3.62 (кв, 2Н, -NH-CH2 -), 1.76-1.69 (м, 2Н, -NH-(CH2)10CH2CH3); 1.43-1.26 (м, 18Н, -NH-CH2-(CH2)9-C2H5); 0.88 (т, 3H, -NH-(СН2)11CH3. J=7,0 Гц).
Пример 5
2-{2-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-иламино]этокси}этанол
(Соединение формулы A, где R1=3-окси-5-гидроксипентил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 3-окси-5-гидрокси-гептиламина.
Выход 95%. Т.пл. 88-89°C. Вычислено, (%): C 47.30; H 6.14; N 35.11. C11H17N7O2. Найдено, (%): C 47.27; H 6.22; N 34.91. Спектр ЯМР 1H (DMCO, δ, м.д., J/Гц): 8.83 (уш.с, 1H, -NH-); 6.19 (с, 1Н, 4Pz-CH); 4.62 (уш.с, 1H, -OH), 2.38, 2.22 (оба с, 6Н, 2CH3 Pz); 3.67-3.65; 3.51-3.46 (оба м, 8Н, -(CH2)2-O-(CH2)2).
Пример 6
3-N(t-Бутиламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=t-бутил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль t-бутиламина.
Выход 93%. Т.пл. 127°C. Вычислено, %: C 53.42, H 6.93, N 39.65. C11H17N7. Найдено, (%): C 53.18, H 6.50, N 39.83. Спектр ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц): 6.09 (с, 1H при C(4) пиразолила), 5.85 (уш.с, 1Н, NH), 2.57, 2.35, 1.56 (все с, 15Н, 5СН3).
Пример 7
3-(Адамантан-1-иламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=адамантил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль адамантиламина.
Выход 92%. Т.пл. 162-164°C. Вычислено, (%): C 62.77; H 7.08; N 30.15. C17H24N8. Найдено, (%): C 62.69; H 7.12; N 30.21. 1H ЯМР (CDCl3), δ): 8.48 (уш.с, 1H, NH); 6.17 (с, 1H, 4Pz-CH); 2.05-2.08 (м, 9Н, адамантил), 2.21, 2.40 (оба с, 6Н, 2СН3).
Пример 8
3-N-(2-Гидроксифениламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=2-гидроксифенил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 2-гидроксиаминобензола.
Выход 94%. Т.пл. 218-218,5°C. Вычислено, (%): C 55.12, H 4.59, N 34.63. C13H13N7O. Найдено, (%): C 55.23, H 4.50, N 34.43. Спектр ЯМР 1H (400 МГц, CDCl3, δ, м.д., J/Гц): 8.16-8.12, 7.07-6.95 (оба м, 5Н, OH, Ar) 6.14 (с, 1Н при C(4) пиразолила), 2.62, 2.38 (оба с, 6Н, 2CH3 при C(3) и C(5) пиразолила).
Пример 9
3-(4-Бромфениламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=4-бромфенил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 4-бром-3-аминобензола.
Выход 95.3%. Т.пл. 215-216°C. Вычислено, (%): C 45.09; H 3.47; N 28.56. d3H12BrN7. Найдено, (%): C 45.21; H 3.56; N 28.58. Спектр ЯМР 1H (CDC13, δ, м.д., J/Гц): 6.23 (с, 1H, 4Pz-CH); 11.14 (с, 1Н, -NH-Ar), 2.25, 2.47 (оба с, 6Н, 2CH3Pz); 7.59, 7.74 (оба д, по 2Н, J=6.8).
Пример 10
3-(Индол-3-ил-этиламино)-6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=2-(индол-3-ил)этил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль индол-3-ил-этиламина.
Выход 92%. Т.пл. 197-198°C. Вычислено, (%): C 61.09, H 5.67, N 33.64. C17H17N8. Найдено, (%): C 61.08, H 5.39, N 33.53. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 8.93 (т, 1H, NH); 6.18 (с, 1H при C(4) пиразолила); 3.07 (т, 2Н, СН2); 3.75 (к, 2Н, СН2); 2.23, 2.38 (оба с, 6Н, 2СН3); 6.97-7.02, 7.05-7.09 (оба м, 2Н, 2СН); 7.25, 7.35, 7.59 (все д, 3H, 3 СН); 10.86 (с, 1Н, NH).
Пример 11
3-(6-Метилпиридин-2-ил-амино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=6-метилпиридин-2-ил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 2-амино-6-метилпиридина.
Выход 93%. Т.пл. 164-165°C. Вычислено, (%): C 55.32, H 4.96, N 39.72. C13H14N8. Найдено, (%): C 55.35, H 4.98, N 39.69. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 11.21 (уш.с, 1H, NH); 6.15 (с, 1Н, 4Pz-CH); 7.63, (к, 1Н, пиридино); 7.96 (д, 1H, пиридино); 8.20 (т, 1Н, пиридино), 2.27, 2.33, 2.52 (все с, 9Н, 3CH3).
Пример 12
3-(Пиридин-2-иламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=пиридин-2-ил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 2-аминопиридина.
Выход 90%. Т.пл. 248°C. Вычислено, (%): C 53.73, H 4.48, N 41.79. C12H12N8. Найдено, (%): C 53.79, H 4.51, N 41.56. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 11.35 (уш.с, 1H, NH); 6.20 (с, 1Н, 4Pz-CH); 7.10-7.14, 7.83-7.86, 8.02-8.04, 8.37-8.39 (все м, 4Н, пиридино) 2.27, 2.48 (оба с, 6Н, 2CH3).
Пример 13
3-(4-метилпиридин-2-иламино)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=4-метилпиридин-2-ил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 2-амино-4-метилпиридина.
Выход 92%. Т.пл. 245°C. Вычислено, (%): C 55.32, H 4.96, N 39.72. C13H14N8. Найдено, (%): C 55.47, H 4.83, N 40.00. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 11.28 (уш.с, 1H, NH); 6.24 (с, 1Н, 4Pz-CH); 6.98-7.00, 7.83-7.85, 8.25-8.26 (все м, 3H, пиридино) 2.24, 2.36, 2.49 (все с, 9Н, 3CH3).
Пример 14
3-(5-хлорпиридин-2-иламино-)-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где R1=5-хлорпиридин-2-ил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 2-амино-5-хлорпиридина.
Выход 90%. Т.пл. 260°C. Вычислено, (%): C 47.60, H 3.64, N 37.02. C12H11ClN8. Найдено, (%): C 47.79, H 3.66, N 37.01. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 11.68 (уш.с, 1H, NH); 6.26 (с, 1H, 4Pz-CH); 7.63, (к, 1H, пиридино); 7.96 (д, 1H, пиридино); 8.20 (т, 1H, пиридино), 2.26; 2.50 (оба с, 6Н, 2CH3); 8.00, 8.06, 8.45 (все к, 3H, пиридино).
Пример 15
3-(Хинолин-3-иламино)-3-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин
(Соединение формулы A, где Ri=хинолин-3-ил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль 3-аминохинолина.
Выход 92.5%. Т.пл. 240-242°C. Вычислено, (%): C 60.38, H 4.40, N 35.22. C14H10N8. Найдено, (%): C 60.40, H 4.32, N 35.31. Спектр ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 11.50 (уш.с, 1H, NH); 6.16 (с, 1Н, 4Pz-CH); 7.53-7.63 (м, 2Н, хинолино); 7.90-7.91 (к, 2Н, хинолино); 8.78; 9.12 (оба д, 2Н, хинолино), 2.29, 2.56 (оба с, 6Н, 2СН3).
Пример 16
[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]проп-2-иниламин
(Соединение формулы A, где R1=проп-2-инил)
Получают аналогично примеру 1 из 1.0 ммоль 3,6-бис-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.1 ммоль пропаргиламина.
Выход 94%. Т.пл. 182°C. Вычислено, (%): C 52.39; H 4.84; N 42.77. C10H11N7. Найдено, (%): C 52.55; H 4.90; N 42.77. 1H ЯМР (DMSO-d6), δ: 2.23 с (3H, 3Pz-CH3); 2.41 д (3H, 5Pz-СН3) (J 0.7 Гц); 6.20 с (1Н, 4Pz-CH3); 3,22 т (1H, СН) (2,5); 4,28 дд (2Н, СН2) (2,5); 9,19 т (1H, NH) (5,8).
Туберкулостатическая активность (минимальная ингибирующая концентрация) и токсичность этих соединений по сравнению с ближайшими аналогами приведена в табл.1.
|
|
|
|
|
Таким образом, заявляемые соединения по своим характеристикам (высокая специфичность к микобактериям, высокая активность в отношении типичных и атипичных штаммов микобактерий, низкая токсичность) превосходят аналоги по структуре и действию. Эти соединения могут быть использованы в практической медицине для лечения больных, зараженных как типичными, так и атипичными микобактериями.
Селективные противотуберкулезные агенты, представляющие собой 3-амино-замещенные 6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразины общей формулы A где R=аминогруппа, C-C-алкил, 3-окси-5-гидроксипентил, пропин-2-ил, этилиндолил, адамантил, арил, выбранный из возможно замещенного фенила, гетерил, выбранный из индол-3-ила, 3-хинолинила, пиридила, при этом замещенный фенил имеет заместитель, выбранный из группы, включающей метил, бром, гидрокси-группу, а пиридил имеет заместители, выбранные из группы хлор, метил.
