Результат интеллектуальной деятельности: ЛЕЧЕНИЕ ВОСПАЛИТЕЛЬНЫХ ПОВРЕЖДЕНИЙ ПРИ РОЗАЦЕА С ПОМОЩЬЮ ИВЕРМЕКТИНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0002] По настоящей заявке испрашивается приоритет на основании патентной заявки США с регистрационным № 14/209927, поданной 13 марта 2014 года, имеющей право на приоритет в соответствии с 35 U.S.C. § 119(e) по предварительной патентной заявке США № 61/843540, поданной 8 июля 2013 года, предварительной патентной заявке США № 61/919208 поданной 20 декабря 2013 года, и предварительной патентной заявке США № 61/927717, поданной 15 января 2014 года, описание каждой из которых, таким образом, включено в настоящее описание посредством ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
[0003] Розацеа является широко распространенным хроническим воспалительным состоянием кожи, оцениваемым как поражающее 16 миллионов американцев.1-2 Розацеа является распространенным хроническим и прогрессирующим воспалительным заболеванием с особенностями кожи, отличающимися покраснением и гиперемией, эритемой лица, папулами, пустулами, телеангиэктазией и, иногда, поражениями глаз, известными как глазная розацеа. В тяжелых случаях, в частности у мужчин, может образовываться ринофима, или луковичное увеличение носа. Розацеа развивается в течение нескольких лет с периодами обострений, запускаемых различными стимулами, такими как изменения температуры, алкоголь, острая пища, инсоляция и эмоциональные факторы.
[0004] Распространенность розацеа в европейской популяции находится в диапазоне от 0,09 до 22% с пиковым возрастом дебюта от 25 до 70 лет, и розацеа гораздо более распространена среди людей с белой кожей. Чаще она поражает женщин, хотя состояние, как правило, является более тяжелым у мужчин. Сообщают о распространенности семейных случаев розацеа.
[0005] Определены четыре подтипа розацеа по степени первичных признаков, таких как вазомоторная гиперемия, постоянная эритема, папулы и пустулы, телеангиэктазы (Wilkin J et al., JAAD, 2002, 46: 584-587). Эритематозно-телеангиэктатическая розацеа (ETR), в основном, отличается вазомоторной гиперемией и постоянной центральной эритемой лица. Как правило, телеангиэктазы наблюдают, но они не являются необходимыми для диагностики этого подтипа. Центральная эритема лица, ощущение жжения и шершавость, шелушение кожи также являются симптомами, о которых иногда сообщают. Гиперемию, как единственный симптом в анамнезе, как правило, обнаруживают у людей с эритематозно-телеангиэктатической розацеа.
[0006] Папулопустулезная розацеа (PPR) отличается постоянной центральной эритемой лица и транзиторным появлением папул и/или пустул в центре лица. Однако папулы и пустулы также могут возникать в периорифициальных областях, т.е. вокруг рта, носа и глаз. Папулопустулезный подтип похож на обыкновенные угри, но отсутствуют комедоны. Розацеа и угри могут сосуществовать у одного пациента, в случае чего комедоны также могут присутствовать вместе с папулами и пустулами, наводящими на мысль о розацеа. Люди с папулопустулезной розацеа иногда жалуются на ощущение жжения. Этот подтип часто наблюдают до или одновременно с ETR (включая наличие телеангиэктазов). Телеангиэктазы могут быть маскированы постоянной эритемой и папулами и пустулами, но они становятся более видимыми после успешного лечения, скрывающего эти признаки. Папулопустулезная розацеа (PPR) является подтипом воспалительных повреждений, ассоциированных со значительным психологическим расстройством.3 Обнаружено, что недостатки кожи лица значительно ухудшают связанное со здоровьем качество жизни, наряду со страхом негативной оценки со стороны других людей.4 Кроме того, PPR отличается наличием воспалительных инфильтратов, сопровождающих покраснения, наряду с повышенным иммунным ответом, включающим нейтрофильную инфильтрацию и повышенную экспрессию гена ИЛ-8 (Steinhoff et al. JInvestig Dermatol Symp Proc 2011; 15:2-11)
[0007] Фиматозная розацеа отличается утолщением кожи, узловыми образованиями с шероховатой поверхностью и отеком. Как правило, она, главным образом, поражает нос, но фиматозная розацеа также может затрагивать другие области, такие как подбородок, лоб, щеки и уши. У пациентов с этим подтипом иногда наблюдают выступающие, увеличенные фолликулы в пораженных областях, а также телеангиэктазы. Этот подтип часто возникает до или одновременно с ETR или PPR (включая наличие постоянной эритемы, телеангиэктазов, папул и пустул). В случае ринофимы эти дополнительные признаки могут быть особенно выраженными в области носа.
[0008] При глазной розацеа (или офтальмической розацеа) проявляются симптомы, ограниченные областью глаз, с блефаритом, конъюнктивитом и кератитом. Диагноз глазной розацеа необходимо рассматривать, когда у пациента присутствует один или несколько из следующих глазных признаков и симптомов: слезящиеся или красные глаза (гиперемия конъюнктивы век), ощущение чужеродного тела, жжения, сухости или зуда в глазах, чувствительность к свету, нечеткое зрение, конъюнктивальные телеангиэктазы или телеангиэктазы края века или эритема века и периокулярной области.
[0009] Патогенез розацеа еще не полностью понятен. Ее этиология является мультифакториальной. В дополнение к экзогенным факторам (включая УФ-излучение, жару и алкоголь), она может являться вторичной по отношению к паразитарной инвазии (в частности, клещей Demodex folliculorum).5-6 Такие факторы активируют нейроваскулярные и/или иммунные ответы и, таким образом, воспалительные каскады. Периодические обострения могут способствовать хронизации розацеа, т.к. они ассоциированы с длительной вазодилатацией, периваскулярным воспалением, отеком и воздействием цитокинов и клеточных инфильтратов. В некоторых исследованиях PPR наблюдали более высокую плотность клещей по сравнению с контролями (Forton et al., Br JDermatol 1993; 128(6):650-9; Karincaoglu et al., JDermatol 2004; 31(8):618-26). Кожа, пораженная розацеа, высокочувствительна и склонна к раздражению.7
[0010] Лечение розацеа является сложным, и в настоящее время наиболее используемые способы терапии включают пероральные антибиотики (тетрациклин или его производные, метронидазол и макролиды) и пероральные ретиноиды. В настоящее время существует лишь несколько вариантов терапии воспалительных повреждений при розацеа и не так много альтернатив с высокой эффективностью и введением дозы один раз в сутки. В недавно опубликованном обзоре Cochrane отмечено, что неясно, что является более эффективным, в то время как некоторые данные подтверждают эффективность местного введения метронидазола, азелаиновой кислоты и субантимикробной дозы доксициклина в лечение розацеа от умеренной до тяжелой.8 В национальном исследовании индивидуумов, в настоящее время принимающих лекарственные средства против розацеа, 46% пациентов ранее меняли лекарственные средства, как правило, по причине отсутствия улучшения.9 При использовании некоторых общепринятых способов лечения отмечают медленное и неполное лечение и короткий безрецидивный период.
[0011] Ивермектин является антипаразитарным лекарственным производным из семейства макроциклических лактонов, одобренным для использования на человеке для лечения и химиопрофилактики онхоцеркоза и стронгилоидоза с 1996 года в США и 1988 года во Франции. Кроме того, во Франции он одобрен для лечения чесотки у человека. Пероральный ивермектин при демодикозе человека и животного являлся эффективным в уменьшении Demodex folliculorum и улучшении демодикоза. Кроме того, при пероральном введении ивермектина в комбинации с последующим еженедельным местным нанесением перметрина демонстрировал эффективность лечения у пациента с хроническим розацеа-подобным демодикозом (14).
[0012] В патенте США № 5952372 описывают способ лечения розацеа у людей, включающий пероральное или местное введение ивермектина. Однако в соответствии с патентом США № 5952372 в результате эффекта кожного барьера можно ожидать, что для местного введения ивермектина потребуется его введение один или два раза в сутки в течение четырех недель для достижения достаточного проникновения в фолликулы и эффективной акарицидной активности. В нем дополнительно описывают, что после осуществления ивермектином его акарицидной активности в отношении организмов Demodex folliculorum в коже воспалительные ответы на них начинают уменьшаться, но остатки мертвых клещей все равно вызывают некоторую гиперемию и образование повреждений, пока процессы очищения организма не удалят их, что занимает от шести до восьми недель. В нем предлагают использовать общепринятые лекарственные средства против розацеа, такие как пероральный тетрациклин и местный метронидазол, для супрессии ранних обострений и обеспечения раннего клинического ответа в течение начальной фазы введения ивермектина. Патент США № 5952372 не содержит конкретного описания местного лечения PPR.
[0013] В патенте США № 6133310 и патенте США № 8415311 также описывают способ лечения розацеа посредством местного использования ивермектина. Однако они не содержат конкретное описание лечения воспалительных повреждений при розацеа или PPR.
[0014] Таким образом, существует потребность в лечении воспалительных повреждений при розацеа посредством местного введения один раз в сутки с более ранним появлением значимой эффективности и более длительным периодом времени до рецидива, чем в случае доступных в настоящее время способов лечения, для обеспечения безопасной, более быстрой и длительной ремиссии и лучшего соблюдения пациентом схемы лечения для тех, кто нуждается в таком лечении. Такая потребность удовлетворяется настоящим изобретением.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0015] В настоящее время показано, что местное введение от 0,5 до 1,5% по массе ивермектина обеспечивает более быстрое уменьшение воспалительных повреждений при розацеа, а также более длительный безрецидивный период по сравнению с доступными в настоящее время способами лечения, такими как местное лечение 0,75% по массе метронидазола.
[0016] В одном общем аспекте варианты осуществления настоящего изобретения относятся к способу лечения воспалительных повреждений при розацеа у нуждающегося в этом индивидуума, включающему местное введение фармацевтической композиции, содержащей от 0,5% до 1,5% по массе ивермектина и фармацевтически приемлемый носитель, один раз в сутки на область кожи, затронутую воспалительными повреждениями при розацеа, где уже через 2 недели после исходного введения фармацевтической композиции наблюдают значительное снижение количества воспалительных повреждений.
[0017] В другом общем аспекте настоящее изобретение относится к способу лечения воспалительных повреждений при розацеа у нуждающегося в этом индивидуума, включающему местное введение один раз в сутки на область кожи, затронутую воспалительными повреждениями, фармацевтической композиции, содержащей 1% по массе ивермектина и фармацевтически приемлемый носитель, где уже через 2 недели после исходного введения фармацевтической композиции индивидууму наблюдают значительное снижение количества воспалительных повреждений и достигают равновесной концентрации ивермектина в плазме индивидуума, где равновесная концентрация имеет среднюю Cmax ивермектина 2,10±1,04 нг/мл с диапазоном 0,69-4,02 нг/мл, и среднюю AUC0-24ч 36,14±15,56 нг⋅ч/мл с диапазоном 13,69-75,16 нг⋅ч/мл.
[0018] В предпочтительном варианте осуществления настоящего изобретения до начала лечения индивидуум имеет папулопустулезную розацеа от умеренной до тяжелой.
[0019] В другом предпочтительном варианте осуществления настоящего изобретения индивидуум имеет по меньшей мере 10, предпочтительно - по меньшей мере 12, и более предпочтительно - по меньшей мере 15 воспалительных повреждений при розацеа до начала лечения.
[0020] Согласно вариантам осуществления настоящего изобретения местное введение ивермектина один раз в сутки значительно превосходит местное введения метронидазола дважды в сутки при лечении воспалительных повреждений при розацеа.
[0021] Другие аспекты, признаки и преимущества изобретения будут очевидны из следующего описания, включающего подробное описание изобретения и его предпочтительных вариантов осуществления и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0022] Изложенное выше краткое описание, а также следующее подробное описание изобретения будут более понятны при прочтении в комбинации с прилагаемыми чертежами. В целях иллюстрирования изобретения на чертежах представлены варианты осуществления, являющиеся предпочтительными в настоящее время. Однако следует понимать, что изобретение не ограничено конкретными вариантами осуществления, представленными на чертежах.
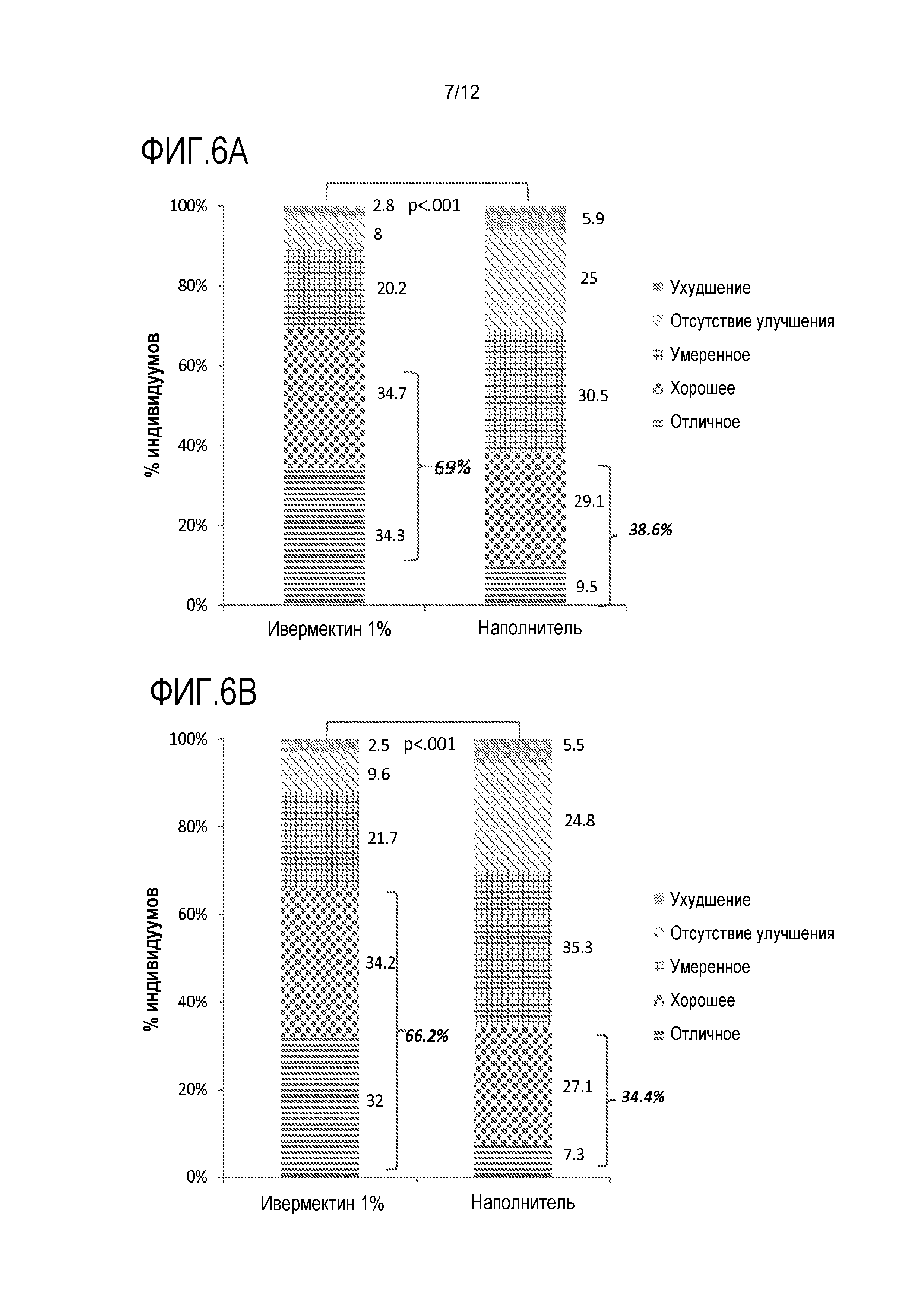
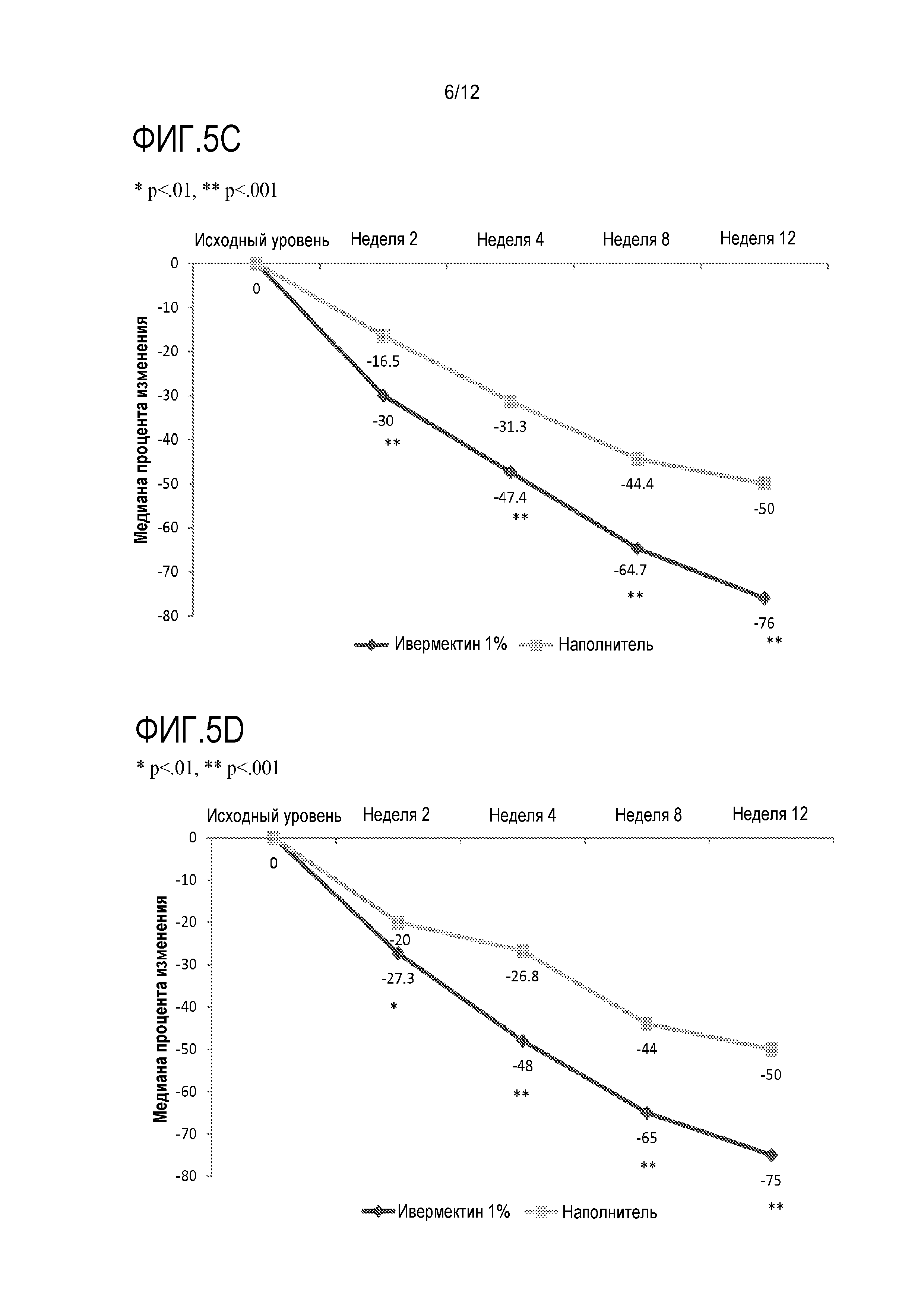
[0023] На фигуре 1 показан средний процент изменения количества повреждений относительно базового уровня (выборка ITT-LOCF) в исследовании диапазона доз после различного местного лечения;
[0024] На фигуре 2 проиллюстрирован ответ индивидуума до утверждения "продукт улучшил мою розацеа" после различного местного лечения (наблюдения ITT);
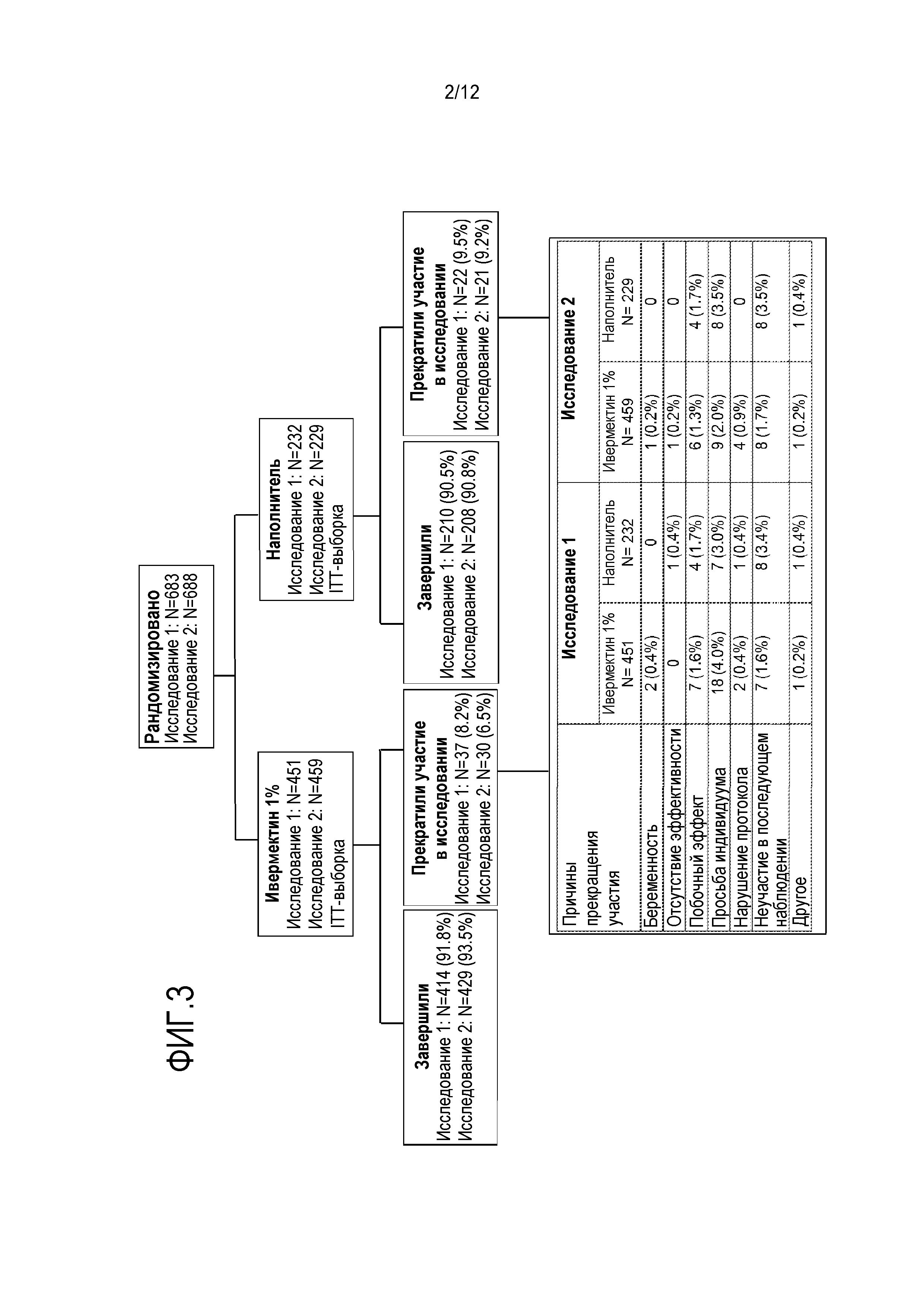
[0025] На фигуре 3 показано распределение индивидуумов в 2 клинических исследованиях безопасности и эффективности местного лечения ивермектином;
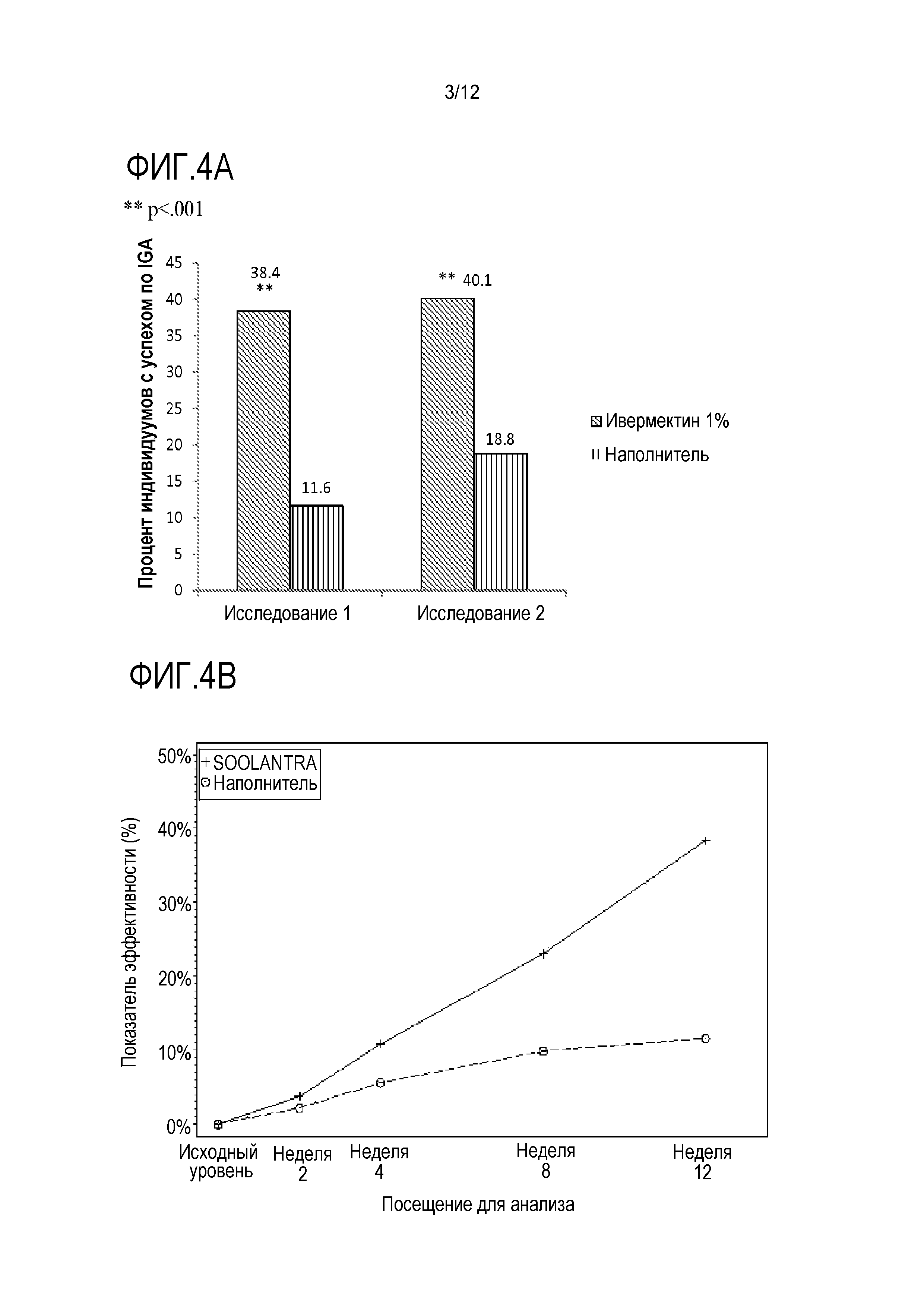
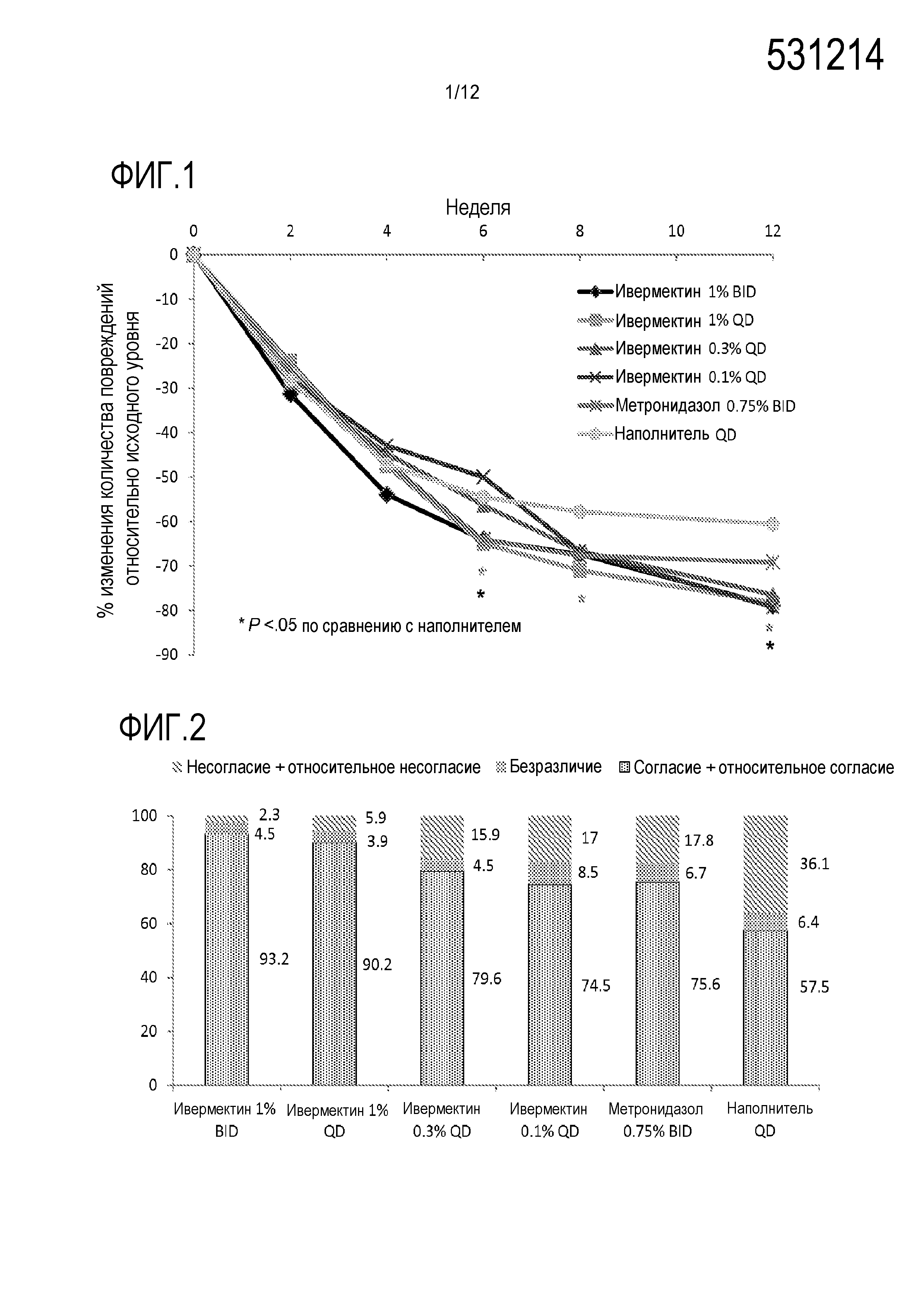
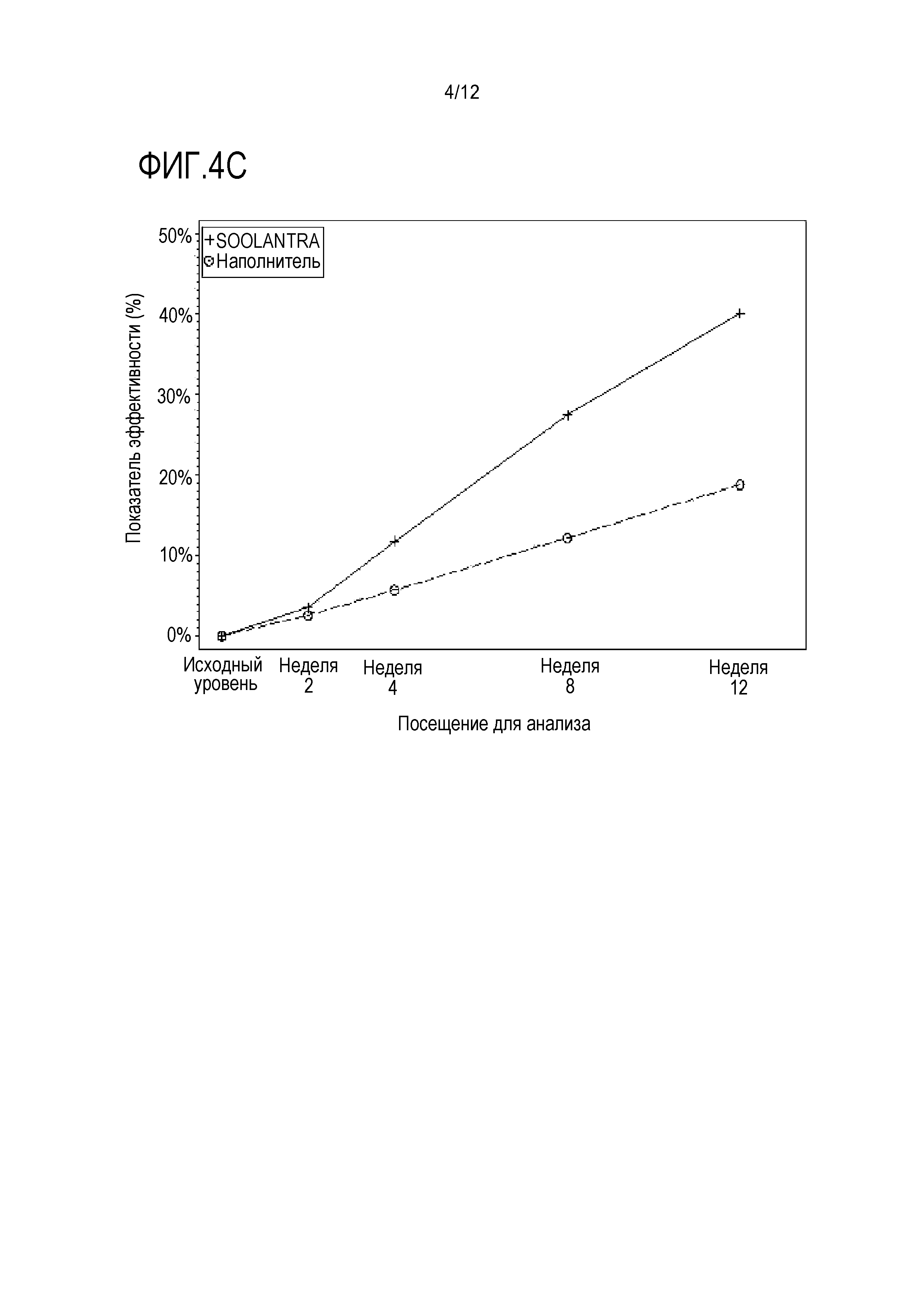
[0026] На фигуре 4 представлены пропорции индивидуумов, достигших положительного результата в IGA ("чистая" или "почти чистая"): (A) на неделе 12 в исследованиях 1 и 2; (B) на неделях 2, 4, 8 и 12 в исследовании 1; и (C)) на неделях 2, 4, 8 и 12 в исследовании 2, где SOOLANTRA является кремом с 1% ивермектина;
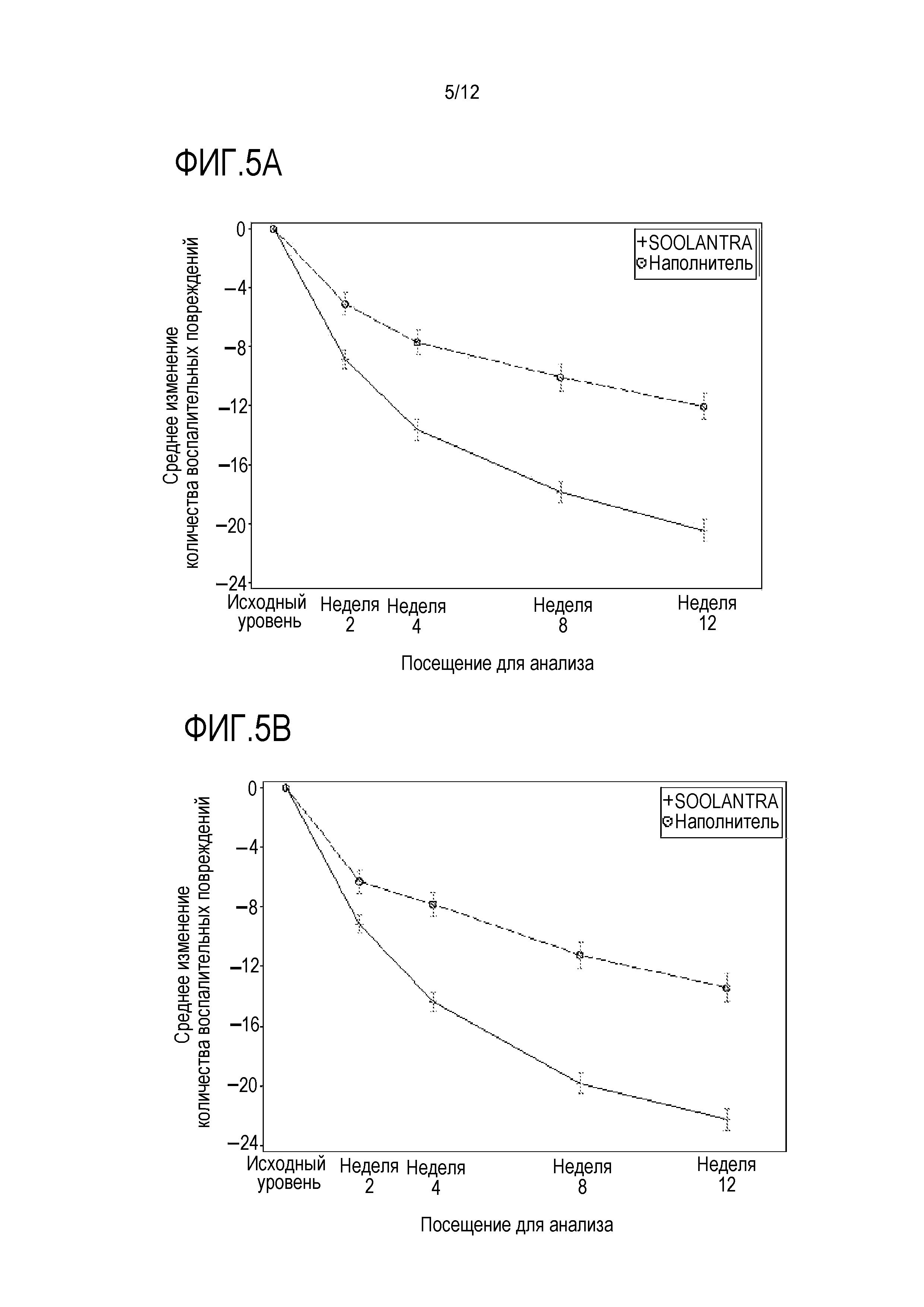
[0027] На фигуре 5 показано изменение количества воспалительных повреждений относительно базового уровня (ITT-LOCF): (A) среднее абсолютное изменение (± стандартная ошибка) в исследовании 1; (B) среднее абсолютное изменение (± стандартная ошибка) в исследовании 2; (C) медиана процента изменения в исследовании 1; и (D) медиана процента изменения в исследовании 2, где SOOLANTRA является кремом с 1% ивермектина;
[0028] На фигуре 6 представлена оценка индивидуумами улучшения розацеа в (A) исследовании 1 и (B) исследовании 2 на неделе 12;
[0029] Фигура 7 представляет собой фотографии пациента на исходном уровне и неделе 12 (стандартное освещение);
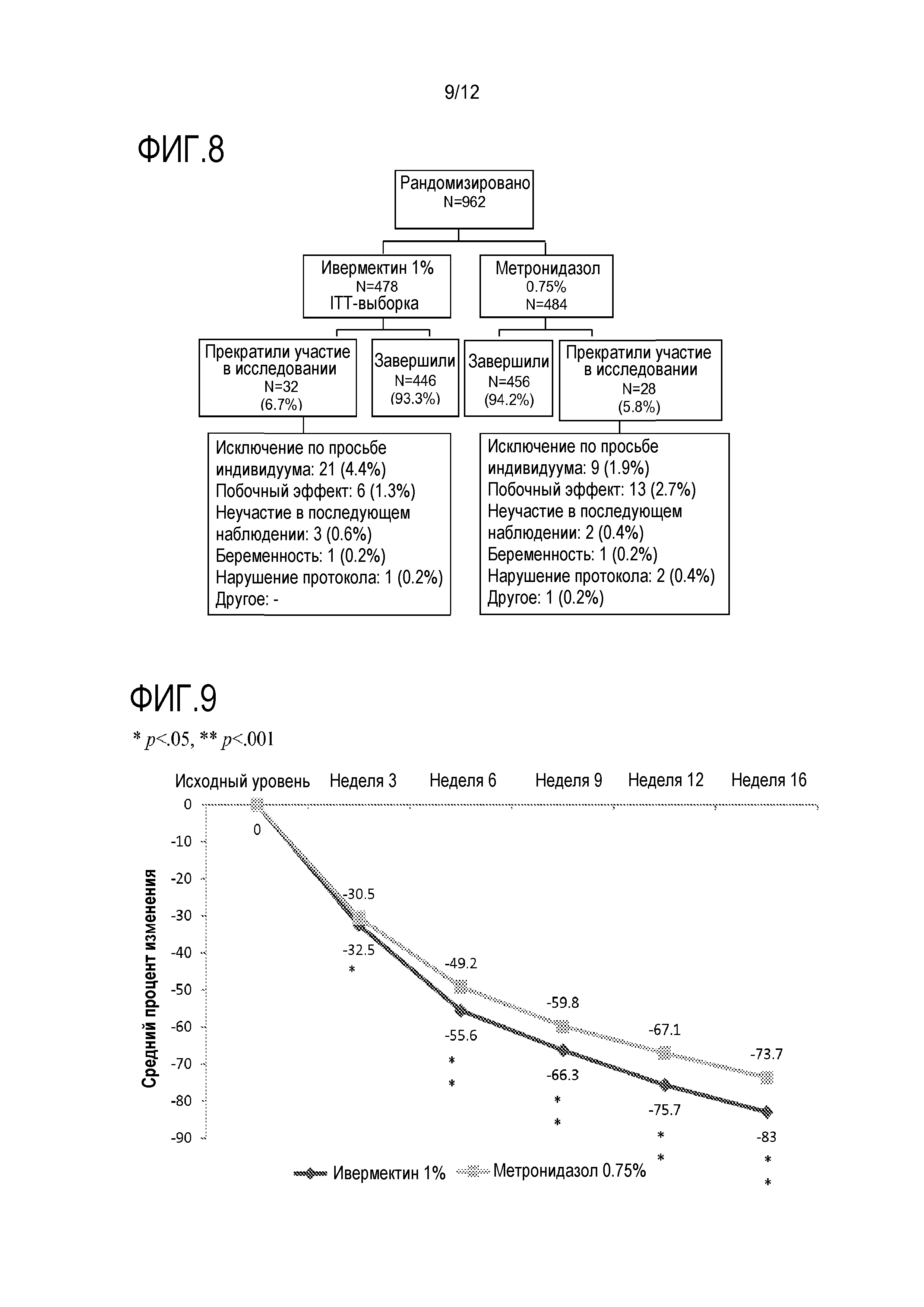
[0030] На фигуре 8 показано распределение индивидуумов в клиническом исследовании, в котором сравнивали местное лечение ивермектином и метронидазолом;
[0031] На фигуре 9 показан средний процент изменения количества воспалительных повреждений относительно базового уровня (ITT-LOCF) после местного лечения ивермектином и метронидазолом, * p<0,05, ** p<0,001;
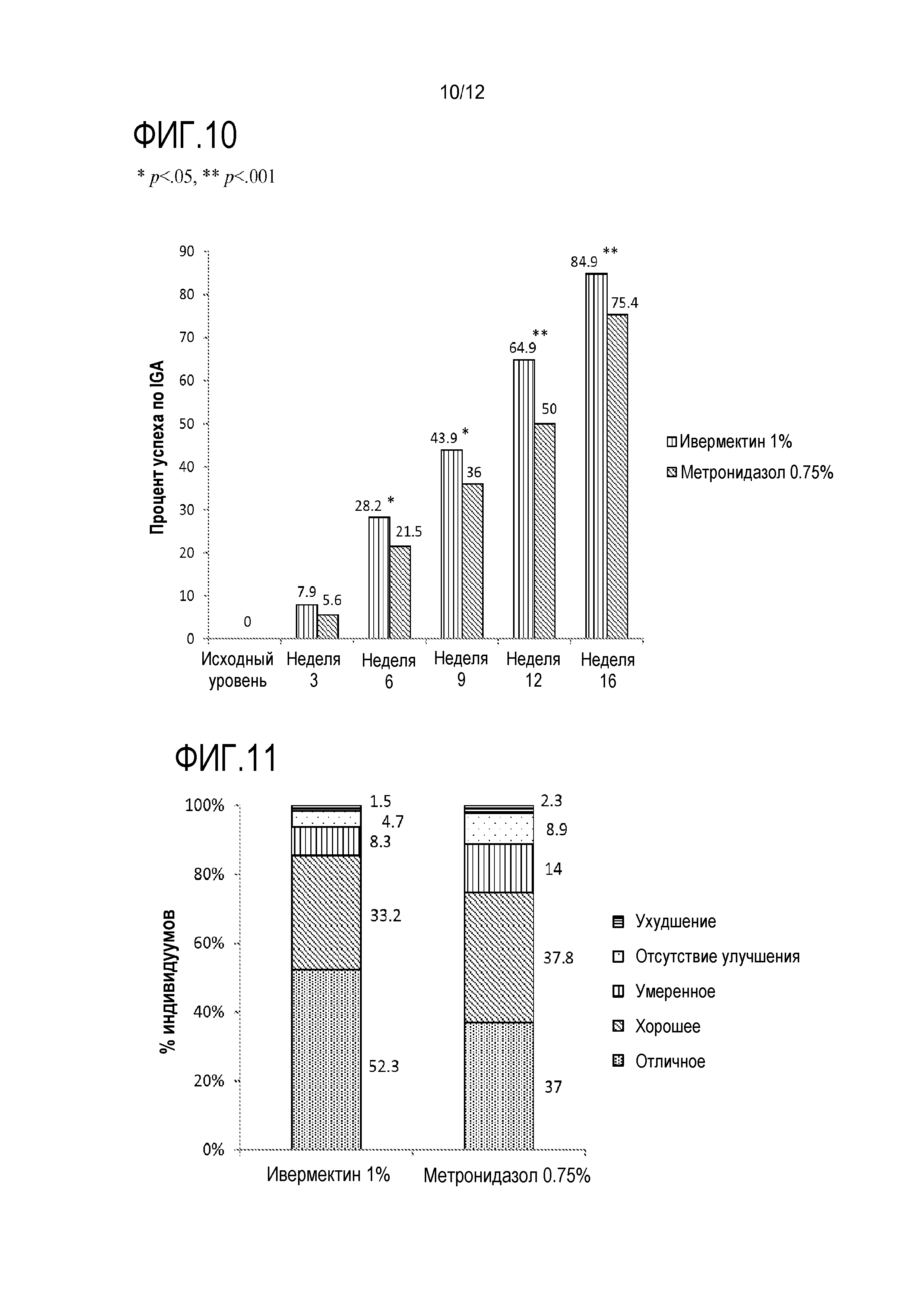
[0032] На фигуре 10 показан показатель эффективности на основе IGA "чистая" или "почти чистая" после местного лечения ивермектином и метронидазолом, * p<0,05, ** p<0,001;
[0033] На фигуре 11 представлена оценка индивидуумами улучшения розацеа после местного лечения ивермектином и метронидазолом;
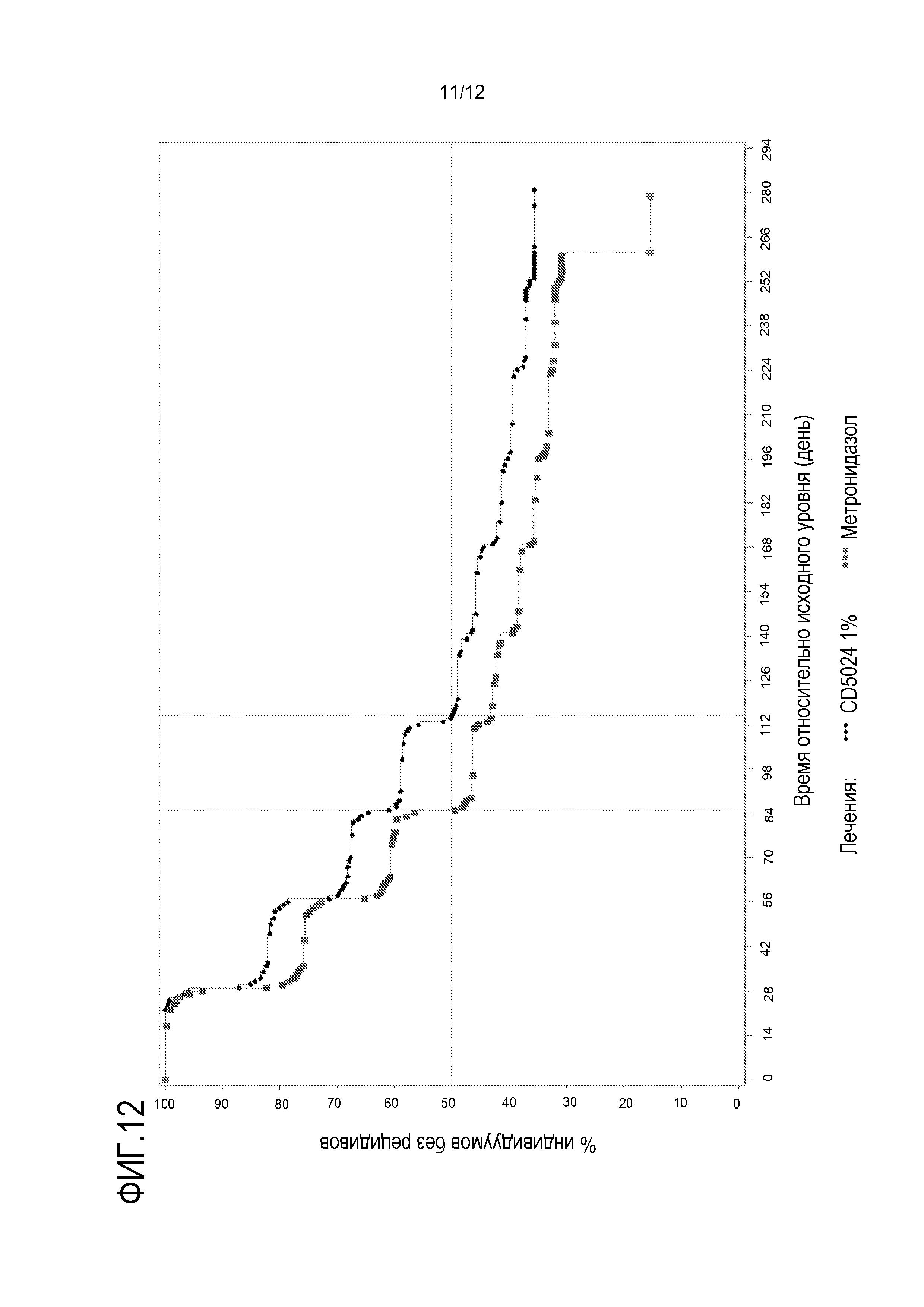
[0034] На фигуре 12 показано время до первого рецидива, определенного как первое повторение IGA≥2 после успешного лечения ивермектином (CD5024) и метронидазолом; и
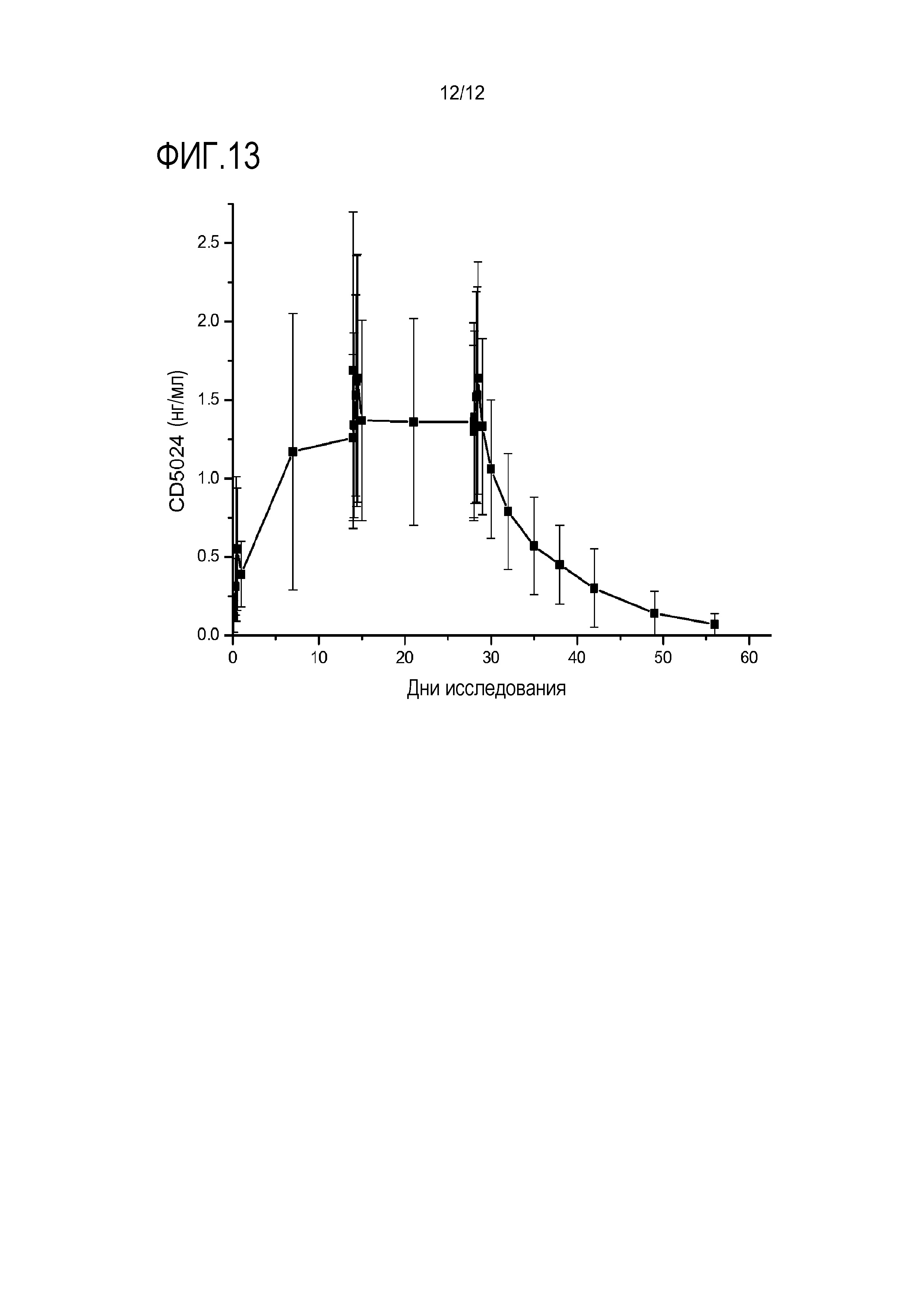
[0035] На фигуре 13 показаны общие средние концентрации ивермектина в плазме (± SD, при N=15).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0036] В уровне техники и на всем протяжении описания цитируют или описывают различные публикации, статьи и патенты; каждая из этих ссылок включена в настоящее описание в качестве ссылки в полном объеме. Обсуждение документов, актов, материалов, устройств, статей или т.п., включенных в настоящее описание, представлено в целях обеспечения контекста для настоящего изобретения. Такое обсуждение не является признанием того, что любой или все из этих объектов образуют часть предшествующего уровня техники в отношении любых описываемых или заявленных изобретений.
[0037] Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое, как правило, понятно специалисту в области, к которой это изобретение относится. В противном случае, конкретные термины, используемые в настоящем описании, обладают значениями, приведенными в описании. Все патенты, опубликованные патентные заявки и публикации, процитированные в настоящем описании, включены в качестве ссылки так, как если бы они были полностью приведены в настоящем описании. Необходимо отметить, что, как применяют в настоящем описании и прилагаемой формуле изобретения, формы в единственном числе включают ссылки на множественное число, если контекст четко не указывает на иное.
[0038] Ивермектин является членом класса авермектинов, которые, как показано в иммунофармакологических исследованиях, проявляют противовоспалительные эффекты посредством ингибирования липополисахарид-индуцированной продукции воспалительных цитокинов, таких как фактор некроза опухоли и интерлейкин (ИЛ)-1b, одновременно повышающе регулируя противовоспалительный цитокин ИЛ-1010. Он является полусинтетическим производным, выделенным при ферментации Streptomyces avermitilis, принадлежащим к авермектиновому семейству макроциклических лактонов. Ивермектин является смесью, содержащей 5-0-деметил-22,23-дигидроавермектин A1a и 5-0-деметил-25-де(1-метилпропил)-25-(1-метилэтил)-22,23-дигидроавермектин A1a, как правило, обозначаемый как 22,23-дигидроавермектин B1a и B1b или H2B1a и H2B1b, соответственно. Соответствующими эмпирическими формулами H2B1a и H2B1b являются C48H74O14 и C47H72O14 с молекулярными массами 875,10 и 861,07, соответственно.
[0039] Ивермектин является производным макроциклического лактона, считают, что его терапевтический эффект, главным образом, является результатом его противовоспалительных свойств, аналогичных таковым других макролидов.11-12 Сообщают, что авермектин проявляет противовоспалительные эффекты посредством ингибирования липополисахарид-индуцированной продукции воспалительных цитокинов. В дополнение к его противовоспалительному механизму действия ивермектин обладает антипаразитарными свойствами. Его предшественник авермектин является антипаразитарным средством, имеющим значение в сельском хозяйстве, впервые выделенным в 1974 году.13 Некоторые исследования подтверждают роль ивермектина в эффективном пероральном лечении кожного демодикоза (в комбинации с кремом с перметрином для местного использования) и чесотки, а также местном лечении педикулеза.14-16 Ивермектин вызывает гибель паразитов, главным образом, посредством селективного связывания с высокой аффинностью с глутамат-зависимыми хлоридными каналами, происходящего в нервных и мышечных клетках беспозвоночных. Это приводит к прерыванию нервных импульсов, вызывая паралич и гибель организмов-паразитов. Известно, что ивермектин действует на клещей Demodex при локализованном и генерализованном демодикозе у животных и людей.
[0040] В случае настоящего изобретения проводили исследования для оценки эффективности и безопасности ивермектина в лечении воспалительных повреждений при розацеа, такой как папулопустулезная розацеа (PPR).
[0041] Обнаруживали, что уже через 2 недели после исходного местного введения индивидууму фармацевтической композиции, содержащей от 0,5 до 1,5% (масс./масс.) ивермектина, наблюдали значимое снижение количества воспалительных повреждений.
[0042] Как применяют в настоящем описании, "значимое снижение" относится к снижению, являющемуся статистически значимым, не только в результате случайности, имеющему значение p 0,05 или меньше. "Значимое снижение" может иметь значение p менее 0,05, 0,04, 0,03, 0,01, 0,005, 0,001 и т.д. Как применяют в настоящем описании, "количество воспалительных повреждений" относится к количеству воспалительных повреждений, ассоциированных с розацеа или PPR. Воспалительные повреждения могут являться папулами и/или пустулами. Папула является небольшим, твердым возвышением менее одного сантиметра в диаметре, и пустула является небольшим, ограниченным возвышением кожи, содержащим желтовато-белый экссудат.
[0043] Повреждения могут являться, например, папулами и/или пустулами любого размера (небольшого или большого). Например, через две недели после исходного введения наблюдали медиану снижения количества воспалительных повреждений приблизительно 30% (p<0,001) и 27,3% (p<0,01) у пациентов, которых лечили ивермектином, в двух отдельных клинических исследованиях с использованием способов по настоящему изобретению. Эти снижения являются статистически значимыми, т.к. они имели значения p менее 0,01 или даже менее 0,001.
[0044] Это раннее появление значимой эффективности является неожиданным при сравнении с общепринятыми способами лечения. Например, значимые различия лечения наблюдали только с недели 4 или недели 8 в двух исследованиях фазы III для местного лечения умеренной PPR с использованием 15% азелаиновой кислоты дважды в сутки (Thiboutot et al., 2003, J. Am Acad Dermatol, 48 (6): 836-845), в то время как не наблюдали статистически значимых различий в отношении медианы количества воспалительных повреждений или медианы процента изменения количества воспалительных повреждений в любой момент оценки в течение исследования (P>0,29) местного лечения PPR от умеренной до тяжелой с использованием 0,75% или 1,0% метронидазола один раз в сутки (Dahl et al., 2001, J. Am Acad Dermatol, 45 (5): 723-730).
[0045] Это раннее появление значимой эффективности также является неожиданным с учетом существовавшей ранее идеи о том, что ожидают, что для местного лечения ивермектином потребуется введение один или два раза в сутки в течение четырех недель для достижения достаточного проникновения в фолликулы и эффективной акарицидной активности; и что после осуществления ивермектином его акарицидной активности в отношении организмов Demodex folliculorum в коже остатки мертвых клещей все еще вызывают некоторую гиперемию и образование повреждений, пока процессы очищения организма не удалят их, что занимает от шести до восьми недель; и что предлагают использовать общепринятые лекарственные средства против розацеа, такие как пероральный тетрациклин и местный метронидазол, для супрессии ранних обострений и обеспечения раннего клинического ответа в течение начальной фазы введения ивермектина (см., например, патент США № 5952372).
[0046] Кроме того, в случае настоящего изобретения обнаружено, что после повторного местного введения фармацевтической композиции, содержащей от 0,5 до 1,5% (масс./масс.) ивермектина и фармацевтически приемлемый носитель, концентрации ивермектина в плазме постепенно повышались до достижения плато или равновесного состояния. Также обнаружено, что повторное местное введение приводит к гораздо большему конечному времени полувыведения ивермектина в организме индивидуума, чем в случае перорально вводимого ивермектина, что свидетельствует о том, что лимитирующим скорость этапом в снижении концентрации ивермектина в плазме является медленное и постоянное высвобождение ивермектина из места введения на коже в кровоток, а не скорость выведения ивермектина из кровотока, т.е. явление "высвобождения с постоянной скоростью" (Toutain et al., 2004, J. Vet. Pharmacol. Therap. 27: 427-439). Неожиданно, несмотря на этот лимитирующий скорость фактор медленного и постоянного высвобождения ивермектина из кожи в кровоток, не наблюдали дополнительного накопления ивермектина в кровотоке после длительного местного лечения 0,5-1,5% (масс./масс.) ивермектином. Таким образом, местное лечение по варианту осуществления настоящего изобретения является безопасным, и его можно осуществлять так долго, как это необходимо без возникновения каких-либо угроз безопасности.
[0047] Параллельные клинические исследования в настоящем изобретении также показали, что способы по вариантам осуществления настоящего изобретения приводят к большему снижению количества воспалительных повреждений, а также большему времени до рецидивирования воспалительных повреждений, чем в случае общепринятого местного лечения, такого как лечение с использованием метронидазола. Кроме того, способы по вариантам осуществления настоящего изобретения также приводят к менее частым побочным эффектам со стороны кожи, чем в случае общепринятых способов местного лечения.
[0048] Не желая быть связанными теорией, полагают, что механизм действия ивермектина при лечении воспалительных повреждений при розацеа может быть связан с противовоспалительными эффектами ивермектина, а также гибелью клещей Demodex, которые, как сообщают, являются фактором воспаления кожи. Т.к. ивермектин обладает противовоспалительной и антипаразитарной активностями, лечение воспалительных повреждений ивермектином представляет собой инновационную терапию, направленную на эти важные патогенетические факторы при розацеа, таким образом, новым дополнением к существующему арсеналу лечения.
[0049] По варианту осуществления настоящего изобретения способ лечения воспалительных повреждений при розацеа у нуждающегося в этом индивидуума включает местное введение один раз в сутки на область кожи, затронутую воспалительными повреждениями при розацеа фармацевтической композиции, содержащей от 0,5% до 1,5% по массе ивермектина и фармацевтически приемлемый носитель, где уже через 2 недели после исходного введения фармацевтической композиции наблюдают значительное снижение количества воспалительных повреждений.
[0050] Как применяют в настоящем описании, "фармацевтически приемлемый носитель" относится к фармацевтически приемлемому наполнителю или дилюенту, содержащему эксципиенты и вспомогательные средства, облегчающие переработку активных соединений в препараты, которые можно использовать фармацевтически.
[0051] Фармацевтические композиции по изобретению подходят для лечения кожи. Они могут находиться в жидкой, пастообразной или твердой форме, и более конкретно, в форме мазей, кремов, молочка, помад, порошков, пропитанных подушечек, синтетических детергентов, влажных салфеток, растворов, гелей, спреев, пенок, суспензий, лосьонов, косметических карандашей, шампуней или моющих основ. Они также могут находиться в форме суспензий микросфер или наносфер или липидных или полимерных везикул или полимерных патчей и гидрогелей для контролируемого высвобождения. Эти композиции для местного использования могут находиться в безводной форме, в водной форме или в форме эмульсии.
[0052] В одном из вариантов осуществления настоящего изобретения фармацевтическая композиция, составляемая в виде эмульсии, фармацевтической эмульсии для местного использования, содержит ивермектин и один или несколько других ингредиентов, выбранных из группы, состоящей из: масляной фазы, содержащей диметикон, циклометикон, изопропилпальмитат и/или изопропилмиристат, масляной фазы, дополнительно содержащей жирные вещества, выбранные из группы, состоящей из цетилового спирта, цетостеарилового спирта, стеарилового спирта, пальмитостеариновой кислоты, стеариновой кислоты и самоэмульгирующегося воска; по меньшей мере одного поверхностно-активного вещества-эмульгатора, выбранного из группы, состоящей из глицерил/PEG100-стеарата, сорбитан моностеарата, сорбитан пальмитата, стеарета-20, стеарета-2, стеарета-21 и цетеарета-20; смеси растворителей и/или средств, усиливающих проникновение, выбранных из группы, состоящей из пропиленгликоля, олеилового спирта, феноксиэтанола и глицерил триацетата; одного или нескольких гелеобразующих средств, выбранных из группы, состоящей из карбомеров, гелеобразующих средств на основе целлюлозы, ксантановой камеди, силикатов магния алюминия, за исключением силиката магния алюминия/диоксида титана/диоксида кремния, гуаровой камеди, полиакриламидов и модифицированных крахмалов; и воды.
[0053] В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит приблизительно 1% (масс./масс.) ивермектина и фармацевтически приемлемый носитель.
[0054] В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит приблизительно 1% (масс./масс.) ивермектина и один или несколько неактивных ингредиентов, выбранных из группы, состоящей из карбомера, такого как сополимер карбомер типа B; цетилового спирта; моногидрата лимонной кислоты; диметикона 20 Cst; эдетата динатрия; глицерина; изопропилпальмитата; метилпарабена; олеилового спирта; феноксиэтанола; полиоксил-20-цетостеарилового эфира; пропиленгликоля; пропилпарабена; очищенной воды; гидроксида натрия; сорбитан моностеарата и стеарилового спирта.
[0055] Как применяют в настоящем описании, термин "индивидуум" означает любое животное, предпочтительно - млекопитающее, наиболее предпочтительно - человека, которому будут вводить или вводят соединения или составы для местного использования по вариантам осуществления изобретения. Предпочтительно, индивидуум нуждается или является объектом наблюдения или эксперимента, лечения или профилактики воспалительных повреждений при розацеа или папулопустулезной розацеа.
[0056] Как известно специалистам в этой области, "выборка пациентов, которым назначено лечение" или "ITT-выборка" относится ко всем индивидуумам, случайным образом отобранным в клиническое исследования и которым вводят исследуемое лекарственное средство. "ITT-LOCF" относится к ITT-выборке при использовании способа переноса данных последнего наблюдения (LOCF), стандартного способа обработки недостающих данных, с помощью которого приписывают или заполняют значения на основе существующих данных. "ITT-MI" относится к ITT-выборке при использовании способа многократного заполнения (MI) на основе всех данных, доступных в модели, другого способа обработки данных, известного специалистам в этой области. "Протокольная выборка" или "PP-выборка" относится к индивидуумам из ITT-выборки в клиническом исследовании, не имевшим значительных отклонений от протокола исследований.
[0057] Как применяют в настоящем описании, термин "воспалительные повреждения при розацеа" включают любой тип повреждений кожи, ассоциированный с воспалительной фазой розацеа. Примеры "воспалительных повреждений при розацеа" включают папулы и пустулы различного размера, ассоциированные с розацеа. В предпочтительном варианте осуществления настоящего изобретения воспалительные повреждения при розацеа включают воспалительные повреждения при папулопустулезной розацеа (PPR), более предпочтительно, воспалительные повреждения при PPR от умеренной до тяжелой.
[0058] В одном из вариантов осуществления термин "лечение" относится к улучшению, профилактике или реверсированию заболевания или нарушения или по меньшей мере одного его видимого симптома. В другом варианте осуществления термин "лечение" относится к улучшению, профилактике или реверсированию по меньшей мере одного измеряемого физического параметра, относящегося к заболеванию или нарушению, подвергаемого лечению, не обязательно видимого у млекопитающего или млекопитающему. В еще одном варианте осуществления термин "лечение" относится к ингибированию или замедлению прогрессирования заболевания или нарушения, физическому, например, стабилизации видимого симптома, физиологическому, например, стабилизации физического параметра, или и тому, и другому. В еще одном варианте осуществления термин "лечение" относится к задержке дебюта заболевания или нарушения.
[0059] Успех лечения воспалительных повреждений при розацеа или PPR можно измерять известными в этой области способами, такими как измерение снижения количества воспалительных повреждений по отношению к исходному уровню до начала лечения, улучшения баллов общей оценки исследователем (IGA) по отношению к исходному уровню или снижения и количества воспалительных повреждений, и баллов IGA.
[0060] Баллы IGA определяет обученный медицинский персонал, оценивающий состояние кожи пациента с использованием общей оценки исследователем состояния кожи. Как правило, при такой общей оценке определяют значение степени розацеа, проявляемой кожей. В дополнение к оценке, осуществляемой медицинским персоналом, участие и наблюдения пациентом состояния своей кожи и ответы на различные вопросы (например, ощущение жжения) также играют роль в определении заданных баллов IGA. Например, баллы IGA в случае розацеа (таблица 1) могут находиться в диапазоне, например, от 0 (чистая) до 1 (почти чистая), до 2 (слабая), до 3 (умеренная), до 4 (тяжелая), включая значения между этими числовыми категориями, такие как 1,5, 2,6, 3,4 и т.д. (например, интервалы 0,1).
[0061]
|
[0062] В свете настоящего описания область кожи, затронутую воспалительными повреждениями при розацеа или папулопустулезной розацеа, можно определять с использованием любых диагностических признаков или средств, известных в этой области, и можно лечить способами по вариантам осуществления настоящего изобретения. Пациенты могут иметь папулопустулезную розацеа на разных стадиях от слабой до тяжелой.
[0063] В предпочтительном варианте осуществления пациент имеет папулопустулезную розацеа от умеренной до тяжелой. Как применяют в настоящем описании, пациент, имеющий "папулопустулезную розацеа от умеренной до тяжелой", имеет, по меньшей мере, умеренную эритему лица и по меньшей мере 10 папулопустулезных повреждений до начала лечения. Например, пациент может иметь IGA розацеа 3 или 4 и по меньшей мере 10, 12, 15, 20, 25 или больше папулопустулезных повреждений до начала лечения.
[0064] По вариантам осуществления настоящего изобретения воспалительные повреждения при розацеа или папулопустулезной розацеа лечат посредством местного введения на пораженную область кожи фармацевтической композиции, содержащей ивермектин и фармацевтически приемлемый носитель, и лечение приводит к снижению количества воспалительных повреждений при розацеа с исходного количества повреждений (до начала лечения) по меньшей мере на 1-100 повреждений или более, например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 50, 60, 70, 80, 90 или 100 повреждений или более. По вариантам осуществления настоящего изобретения после лечения наблюдают снижение количества воспалительных повреждений по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. В зависимости от количества воспалительных повреждений и других факторов, таких как состояние пациента, лечение можно продолжать столько, сколько потребуется, например, от 4 до 12 недель.
[0065] По другим вариантам осуществления настоящего изобретения лечение снижает баллы IGA у подвергнутого лечению индивидуума. Как применяют в настоящем описании, "показатель эффективности" в клиническом исследовании относится к процентной доле индивидуумов в исследовании, имеющих IGA 0 ("чистая") или 1 ("почти чистая") после лечения.
[0066] По вариантам осуществления настоящего изобретения после исходного успешного лечения ивермектином, т.е. до IGA 0 или 1, до рецидивирования, т.е. до IGA 2 или выше, проходит больше времени по сравнению с общепринятыми способами лечения, такими как местное лечение 0,75% по массе метронидазолом. Например, лечение ивермектином (1%) один раз в сутки (QD) приводило к статистически значимой длительной ремиссии розацеа (например, задержке первого рецидива и повышению количества дней без лечения) по сравнению с метронидазолом 0,75% BID у индивидуумов, которых подвергали успешному лечению (IGA 0 или 1) в течение 16 недель. Также наблюдали количественную тенденцию в пользу 1% ивермектина QD в отношении частоты рецидивов.
[0067] Как применяют в настоящем описании, "время до первого рецидива" определяют как время, проходящее между исходным успешным лечением до IGA розацеа 0 или 1 и первым повторением IGA 2 или более у индивидуума. По вариантам осуществления настоящего изобретения среднее время до первого рецидива составляет приблизительно 110, 115, 120, 125, 130, 135, 140, 145 или 150 дней или более у индивидуумов, которых лечили ивермектином, со значением p 0,05 или менее.
[0068] Другой аспект настоящего изобретения относится к способу лечения папулопустулезной розацеа у нуждающегося в этом индивидуума, включающему местное введение один раз в сутки на область кожи, затронутую папулопустулезной розацеа фармацевтической композиции, содержащей 1% по массе ивермектина и фармацевтически приемлемый носитель, где уже через 2 недели после исходного введения фармацевтической композиции индивидууму наблюдают значительное снижение количества воспалительных повреждений.
[0069] Предпочтительно, индивидуум имеет PPR от умеренной до тяжелой. Более предпочтительно, индивидуум имеет по меньшей мере 15 воспалительных повреждений при PPR до начала лечения.
[0070] В другом предпочтительном варианте осуществления через две недели после исходного лечения наблюдают медиану снижения количества воспалительных повреждений приблизительно 27% или более у индивидуумов, которых лечили ивермектином, со значением p 0,01 или менее.
[0071] В варианте осуществления настоящего изобретения уже через 2 недели после исходного введения фармацевтической композиции индивидууму наблюдают большее снижение количества воспалительных повреждений у индивидуума по сравнению с контрольным наполнителем. В других вариантах осуществления настоящего изобретения способ приводит к большему снижению количества воспалительных повреждений у индивидуума по сравнению с достигаемым посредством местного введения индивидууму второй фармацевтической композиции, содержащей 0,75% по массе метронидазола.
[0072] По варианту осуществления настоящего изобретения равновесного состояния концентрации ивермектина в плазме достигают у индивидуума после повторного введения. Например, равновесной концентрации ивермектина в плазме достигают после приблизительно двух недель местного введения фармацевтической композиции, содержащей приблизительно 1% (масс./масс.) ивермектина, один раз в сутки. В своем равновесном состоянии средняя Cmax, т.е. наибольшая средняя (± стандартное отклонение) концентрация ивермектина в плазме, достигавшая пика в течение 10±8 часов после введения дозы, составляет 2,10±1,04 нг/мл (диапазон: 0,69-4,02 нг/мл), и наибольшая средняя (± стандартное отклонение) AUC0-24ч составляет 36,14±15,56 нг∙ч/мл (диапазон: 13,69-75,16 нг∙ч/мл). Эти уровни, полученные в условиях равновесного состояния, являются более низкими, чем наблюдаемые после перорального введения ивермектина.
[0073] По варианту осуществления настоящего изобретения в равновесном состоянии Cmax ивермектина у индивидуума находится в диапазоне приблизительно от 0,5 до 10 нг/мл, и AUC0-24ч находится в диапазоне приблизительно от 10 до 100 нг⋅ч/мл.
[0074] По другому варианту осуществления настоящего изобретения местное введение фармацевтической композиции индивидууму приводит к среднему конечному времени полувыведения ивермектина у индивидуума, являющемуся гораздо большим, чем в случае перорально вводимого ивермектина. В варианте осуществления настоящего изобретения местное введение фармацевтической композиции индивидууму приводит к среднему конечному времени полувыведения ивермектина у индивидуума приблизительно 145 часов.
[0075] В варианте осуществления настоящего изобретения способ лечения воспалительных повреждений при розацеа у нуждающегося в этом индивидуума включает местное введение один раз в сутки на область кожи, затронутую воспалительными повреждениями фармацевтической композиции, содержащей 1% по массе ивермектина и фармацевтически приемлемый носитель, где уже через 2 недели после исходного введения фармацевтической композиции индивидууму наблюдают значительное снижение количества воспалительных повреждений и достигают равновесной концентрации ивермектина в плазме индивидуума, и равновесное состояние имеет среднюю Cmax ивермектина 2,10±1,04 нг/мл с диапазоном 0,69-4,02 нг/мл и среднюю AUC0-24ч 36,14±15,56 нг⋅ч/мл с диапазоном 13,69-75,16 нг⋅ч/мл.
[0076] Настоящее изобретение будет более понятным со ссылкой на следующие неограничивающие примеры, но специалисты в этой области легко поймут, что примеры приведены исключительно в целях иллюстрирования изобретения и приведенной ниже формулы изобретения.
[0077] Если не указано иначе, в настоящей заявке все процентные доли ингредиентов являются процентами по массе (масс./масс.).
[0078] Пример 1: Композиции ивермектина для местного использования
[0079] Примеры фармацевтических композиций, которые можно использовать в настоящем изобретении, описывают в патенте США № 8415311 и патенте США № 8470788, которые включены в настоящее описание в качестве ссылок. Композиции, применимые в настоящем изобретении, включают, в качестве неограничивающих примеров, следующие:
[0080] Композиция 1
|
[0081] Композиция 2
|
[0082] Композиция 3
|
[0083] Композиция 4
|
[0084] Композиция 5
|
[0085] Пример 2: Исследование дозировки в случае местного лечения PPR ивермектином
[0086] Осуществляли рандомизированное, обратное слепое, контролируемое активным препаратом и плацебо исследование фазы II в параллельных группах для определения оптимальной концентрации и режима дозирования крема с ивермектином для местного использования для лечения воспалительных повреждений при розацеа и оценке эффективности и безопасности.
[0087] Подходящими индивидуумами являлись взрослые с PPR. Большинство индивидуумов имело по меньшей мере 15 воспалительных повреждений на лице и, по меньшей мере, слабую эритему лица с учетом IGA тяжести розацеа. В таблице 2 представлены демографические и исходные клинические характеристики (ITT-выборка) индивидуумов.
[0088]
|
[0089] Индивидуумов случайным образом распределяли для использования одного из следующих шести (6) режимов в течение 12 недель: ивермектин 0,1% (масс./масс.) один раз в сутки (QD), ивермектин 0,3% (масс./масс.) QD, ивермектин 1% (масс./масс.) QD, ивермектин 1% (масс./масс.) дважды в сутки (BID), гель с метронидазолом 0,75% (масс./масс.) BID или наполнитель QD. 6 групп являлись сравнимыми в терминах демографических характеристик и исходных характеристик заболевания (таблица 1): большинство являлось женщинами, европеоидами с фототипом кожи II и средним возрастом 51,9±14,2 лет. В среднем индивидуумы имели 35,4±23,8 воспалительных повреждений, и большинство имело (51,0%) IGA 3 (умеренную).
[0090] В течение исследования определяли количество воспалительных повреждений (сумму папул и пустул), показатель эффективности [% индивидуумов с оценкой "чистая" или "почти чистая" на основе общей оценки исследователем (IGA), шкала от 0 (чистая) до 4 (тяжелая)], эритему [от 0 (отсутствие) до 3 (тяжелая)], телеангиэктазию [от 0 (отсутствие) до 3 (тяжелая)], побочные эффекты и результаты по опроснику для определения удовлетворенности пациента (в конце исследования).
[0091] На фигуре 1 показана медиана процента изменения количества повреждений по отношению к исходному уровню (ITT-LOCF-выборка).
[0092] На неделе 12 ивермектин 1% (масс./масс.) QD и BID являлись значимо более эффективными, чем наполнитель QD в анализе ITT-LOCF с учетом процента изменения количества воспалительных повреждений по отношению к исходному уровню (медиана: -78,3% и -78,9% по сравнению с -60,6%; оба с p<0,05) (фигура 1); это также подтверждали в анализе PP. Хотя ивермектин 1% (масс./масс.) BID являлся значимо более эффективным, чем наполнитель, величина его эффекта не являлась большей, чем у 1% ивермектина (масс./масс.) QD. Количественную тенденцию в пользу 1% ивермектина QD по сравнению с метронидазолом 0,75% BID также наблюдали в отношении медианы % изменения количества воспалительных повреждений по отношению к исходному уровню [-78,3% по сравнению с -69,2% на неделе 12 (ITT-LOCF)]; объем выборки являлся недостаточно большим для определения различий между этими группами.
[0093] Все режимы дозирования ивермектина приводили к значимо большему показателю эффективности, чем у наполнителя (70,8%, 65,4%, 63,8% и 62,7% в случае 1% ивермектина BID, 1% QD, 0,3% QD и 0,1% QD, соответственно, по сравнению с 42,0% в случае наполнителя на неделе 12; все с p<0,05). Кроме того, показатель эффективности в случае метронидазола составлял 62,5%. Не наблюдали различий в изменении эритемы или телеангиэктазии между группами активного соединения и контроля.
[0094] Все режимы являлись безопасными и хорошо переносимыми, со схожей низкой частотой побочных эффектов. Не наблюдали значимых сопутствующих AE. Большинство сопутствующих AE являлись слабыми, временными и дерматологическими по своей природе, наиболее частыми из которых в группах ивермектина являлись ощущение дискомфорта в области кожи (4 индивидуума), ощущение жжения на коже (4 индивидуума) и ухудшение розацеа (3 индивидуума).
[0095] На фигуре 2 проиллюстрирован ответ индивидуумов на утверждение "продукт улучшил мою розацеа" (наблюдения в ITT). С повышением дозировки ивермектина все больше индивидуумов соглашалось с утверждением "продукт улучшил мою розацеа" (фигура 2) и были удовлетворены продуктом (данные не представлены). Результаты в группах 1% ивермектина QD и BID превосходили таковые в группе метронидазола 0,75% BID. Большинство индивидуумов во всех группах ивермектина считало, что продукт был легок в использовании (по меньшей мере 95,5%), приятен в использовании (по меньшей мере 77,3%) и не раздражал кожу (по меньшей мере 70,2%).
[0096] Местное использование всех тестируемых режимов дозирования ивермектина (1% BID, 1% QD, 0,3% QD и 0,1% QD) приводило к значимо большему показателю эффективности в лечении PPR, чем в случае наполнителя; результат в группах 1% ивермектина QD и BID превосходил таковой в группе метронидазола 0,75% BID; и местное введение 1% ивермектина (масс./масс.) один
раз в сутки считали оптимальным режимом дозирования, т.к. он являлся безопасным, хорошо переносимым и обеспечивал значимо большую эффективность в лечении PPR, чем наполнитель. Местное введение один раз в сутки дополнительно является предпочтительным, т.к. оно способствует лучшему соблюдению пациентом схемы лечения.
[0097] Пример 3: Исследование эффективности и безопасности крема с 1% ивермектина
[0098] Для демонстрации эффективности и безопасности крема с 1% (масс./масс.) ивермектина, используемого один раз в сутки, у индивидуумов с PPR осуществляли два рандомизированных, двойных слепых, контролируемых исследования с идентичным дизайном (далее обозначаемых как исследование 1 и исследование 2). Исследования осуществляли согласно этическим принципам Хельсинской декларации и стандарта Надлежащей клинической практики и в соответствии с местными нормативными требованиями.
[0099] Каждое исследование включало три части. В первой части исследования индивидуумов с PPR лечили кремом с 1% ивермектина (IVM 1%) или наполнителем один раз в сутки на ночь в течение 12 недель. Во второй части исследования индивидуумов, которых лечили IVM 1% один раз в сутки на ночь, продолжали лечить так же, в то время как индивидуумов, которых лечили наполнителем один раз в сутки, переводили на местное лечение гелем с 15% азелаиновой кислоты дважды в сутки, утром и вечером. Третья часть исследования состояла из 4 недель последующего наблюдения без лечения в отношении безопасности.
[00100] Подходящими индивидуумами являлись индивидуумы возрастом 18 лет или старше, с умеренной или тяжелой папулопустулезной розацеа, на что указывает IGA 3 ("несколько небольших или больших папул/пустул, умеренная эритема") или 4 ("многочисленные небольшие и/или большие папулы/пустулы, тяжелая эритема"), и имеющие 15-70 воспалительных повреждений (папул и пустул) на лице. Всего 683 индивидуумов с PPR от умеренной до тяжелой отбирали случайным образом в исследование 1 (IVM 1%: 451, наполнитель: 232), и 688 индивидуумов - в исследование 2 (IVM 1%: 459, наполнитель: 229) (фигура 3).
[00101] Подходящим индивидуумам получали крем с 1% ивермектина (один раз в сутки каждый день на ночь) или крем с наполнителем (один раз в сутки каждый день на ночь) на все лицо в течение 12 недель. Их инструктировали наносить тонкий слой крема на все лицо (правую и левую щеки, лоб, подбородок и нос), например, количество крема размером с горошину, избегая верхнего и нижнего век, губ, глаз и рта. Индивидуумов инструктировали также избегать триггерных факторов розацеа, таких как внезапное воздействие жары, конкретные продукты питания и чрезмерная инсоляция. Посещения в течение первого исследования являлись следующими: посещения для скрининга, исходное, на неделях 2, 4, 8 и 12 после исходного введения.
[0100] Оценками эффективности при каждом визите являлись IGA тяжести заболевания и количество воспалительных повреждений (папул и пустул) на каждой из пяти областей лица (лбу, подбородке, носу, правой щеке, левой щеке). Оценки безопасности включали побочные эффекты (AE) на всем протяжении исследования, параметры местной переносимости (жжение, сухость, зуд) на каждом посещении в течение исследования, оцениваемые по 4-балльной шкале [от 0 (отсутствие) до 3 (тяжелые)], и лабораторные параметры (гематология и биохимия), измеряемые до и после лечения. Другие оценки включали оценку индивидуумом улучшения своей розацеа в конце исследования (неделя 12) по сравнению с ее состоянием на исходном уровне, и два опросника по качеству жизни (QoL) [дерматологически-специфичный опросник, Dermatology Life Quality Index (DLQI)],17 и розацеа-специфичный опросник, RosaQoL™18, заполняемые в начале и на неделе 12.
[0101] Комбинированными первичными конечными точками в отношении эффективности в обоих исследованиях являлись показатель эффективности на основе результата IGA и абсолютное изменение количества воспалительных повреждений по отношению к исходному уровню в конце недели 12 исследований. Показатель эффективности на основе баллов IGA [% индивидуумов, достигших оценки "чистая" или "почти чистая" по шкале IGA на неделе 12 (ITT-LOCF)] анализировали с помощью теста Кохрана-Мантеля-Гензеля (CMH), стратифицированного по месту анализа, с использованием статистики генерального обобщения. Абсолютное изменение количества воспалительных повреждений по отношению к исходному уровню на неделе 12 (ITT-LOCF) анализировали с помощью ковариационного анализа (ANCOVA). Недостающие данные на неделе 12 в ITT-выборке восполняли с помощью подхода LOCF. Кроме того, осуществляли анализ чувствительности для восполнения недостающих данных для оценки надежности первичных результатов в отношении эффективности. Вторичной конечной точкой в отношении эффективности являлся процент изменения количества воспалительных повреждений по отношению к исходному уровню на неделе 12 (ITT-LOCF). Опросники QoL анализировали с использованием критерия суммы рангов Уилкоксона, и другие переменные анализировали описательно. Высокие средние баллы в опросниках QoL свидетельствовали о низком качестве жизни.
[00102] В исследованиях 1 и 2 подавляющее большинство индивидуумов завершило исследование (91,4% и 92,6%, соответственно). Исследуемые группы являлись схожими на исходном уровне в терминах демографии и исходных характеристик заболевания, где в среднем наблюдали приблизительно 31-33 воспалительных повреждения, и большинство имело умеренную розацеа (таблица 3). Большинство индивидуумов являлось женщинами (68,2% и 66,7% в исследованиях 1 и 2, соответственно) и европеоидами (96,2% и 95,3%) со средним возрастом 50,4 и 50,2 лет, соответственно. Кроме того, исследуемые группы являлись сравнимыми в отношении количества/причин раннего прекращения участия в исследовании (фигура 3).
[00103]
|
|
[00104] Доля индивидуумов, достигших успеха по IGA ("чистая" или "почти чистая"), на неделе 12 для исследований 1 и 2 составляли 38,4% и 40,1%, соответственно, в случае IVM 1% по сравнению с 11,6% и 18,8% в случае наполнителя (оба с p<0,001; фигуры 4A). Наблюдали значимое различие между группами пациентов в обоих исследованиях с учетом IGA с недели 4 (10,9% и 11,8% по сравнению с 5,6% и 5,7%, соответственно; оба с p<0,05), и оно сохранялось до недели 12 (фигуры 4B и 4C).
[00105] Что касается количества воспалительных повреждений, среднее различие между IVM 1% и наполнителем от исходного уровня до недели 12 составляло -8,13 повреждений в исследовании 1 и -8,22 в исследовании 2 (оба с p<0,001 по сравнению с наполнителем) с 95% CI [-10,12, -6,13] и [-10,18, -6,25], соответственно (фигуры 5A и 5B). Среднее снижение количества повреждений наблюдали на неделе 2 в обоих исследованиях при лечении IVM 1% (фигуры 5A и 5B). Медианное снижение количества воспалительных повреждений по отношению к исходному уровню в обоих исследованиях составляло 76,0% и 75,0%, соответственно, по сравнению с 50,0% в обеих группах наполнителя на неделе 12 (p<0,001) со значимым различием, наблюдаемым к неделе 2 при медианном снижении 30% и 27,3% (фигура 5C и 5D). Это значимое снижение количества воспалительных повреждений уже на неделе 2 являлось исключительным при сравнении с аналогичными данными при лечении метронидазолом или азелаиновой кислотой.
[00106] В таблице 4 приведены результаты обоих исследований в отношении эффективности к концу первой части 12-недельных исследований
Таблица 4
|
[00107] Частота AE являлась сравнимой в исследованиях 1 и 2 (40,5% и 36,5% для IVM 1% по сравнению с 39,4% и 36,5% для наполнителя, соответственно). Меньше индивидуумов в группах IVM
1% имело тенденцию сообщать о сопутствующих AE, чем в группах наполнителя (4,2% и 2,6% по сравнению с 7,8% и 6,5%, соответственно), а также о сопутствующих дерматологических AE (3,5% и 1,5% по сравнению с 6,9% и 5,7%) и сопутствующих AE, приведших к прекращению участия в исследовании (1,3% и 0,2%, по сравнению с 1,7% для обоих групп наполнителя). Аналогично низкая доля индивидуумов сообщала о серьезных AE в группах IVM 1% и наполнителя (0,7% и 1,5% по сравнению с 0,4% и 1,7%). Не наблюдали серьезных сопутствующих AE. Наиболее распространенным сопутствующим AE в исследовании 1 являлось ощущение жжения на коже: 8 (1,8%) среди индивидуумов, использовавших IVM 1%, по сравнению с 6 (2,6%) в случае наполнителя. В исследовании 2 наиболее распространенными сопутствующими AE в случае IVM 1% являлись прурит и сухость кожи (по 3 индивидуума (0,7%)) по сравнению с 0 и 2 индивидуумами (0,9%) в случае наполнителя, соответственно. Кроме того, при лабораторных тестах не выявляли значимых клинических аномалий.
[00108] На исходном уровне до начала введения у значительной доли индивидуумов присутствовали местные кожные симптомы, соответствующие розацеа, в частности, слабая или умеренная сухость кожи (в исследованиях 1 и 2, 63,0% и 57,0% в случае IVM 1% и 59,3% и 60,0% в случае наполнителя, соответственно) и слабый или умеренный зуд (57,3% и 49,4% в случае IVM 1% и 45,4% и 49,1% в случае наполнителя). На неделе 12 (последние доступные полученные данные) у большинства индивидуумов не было ни одного из 2 кожных симптомов. Наблюдали тенденцию в отношении отсутствия сухости у 83-86% индивидуумов в группе IVM 1% по сравнению с 72-76% в случае наполнителя, а также в отношении отсутствия зуда у 82-85% в случае IVM 1% по сравнению с 70-78% в случае наполнителя.
[00109] Улучшение после лечения оценивалось индивидуумами как "отличное" или "хорошее" в 69% и 66,2% случаев для IVM 1% по сравнению с 38,6% и 34,4% в случае наполнителя (p<0,001), соответственно (фигура 6). Об "отличном" улучшении сообщали 34,3% и 32,0% в случае IVM 1% по сравнению с 9,5% и 7,3% в случае наполнителя.
[00110] Через 12 недель лечения для индивидуумов в группе IVM 1% получали улучшенные баллы по QoL по сравнению с группами наполнителя. В случае DLQI следует отметить, что не наблюдали различий между исследуемыми группами на исходном уровне. В конце каждого исследования больше индивидуумов в группе IVM 1% (приблизительно 53%), чем в группе наполнителя (приблизительно 35%), считали, что их заболевание не имеет эффекта в отношении их общего QoL (p<0,001). Что касается RosaQoL™, улучшение QoL по отношению к исходному уровню являлось более высоким в обоих исследованиях в случае IVM 1% (-0,64±0,7 и -0,60±0,6 по сравнению с -0,35±0,5 в обеих группах наполнителя (p <0,001 и p=0,001 в исследованиях 1 и 2, соответственно)). Этот результат свидетельствует о том, что в группе, которую лечили IVM, более высокая доля индивидуумов ощущала, что розацеа не влияет негативно на их качество жизни, по сравнению с контрольной группой, которую лечили наполнителем.
[00111] IGA оценивали в течение второй части исследований (40 недель). Процентные доли индивидуумов, которых лечили IVM 1%, достигавших баллов IGA 0 или 1, продолжали повышаться до недели 52, конца второй части исследований. Показатель эффективности (IGA=0 или 1) на неделе 52 составлял 71,1% и 76% в исследованиях 1 и 2, соответственно. В обоих исследованиях частоты являлись сравнимыми в 2 группах индивидуумов, которых лечили кремом с IVM 1% QD и гелем с 15% азелаиновой кислоты BID, в категориях сопутствующих AE, дерматологических AE, серьезных AE, сопутствующих AE, приведших к прекращению участия в исследовании, и конкретно интересующих AE. Не наблюдали серьезных сопутствующих AE.
[00112] В третьей части последующего наблюдения в исследованиях индивидуумы, которых лечили кремом с IVM 1% QD и гелем с 15% азелаиновой кислоты BID в течение второй части исследований, являлись сравнимыми в отношении AE. Ни один из индивидуумов не сообщал о серьезных AE, сопутствующих AE, приведших к прекращению участия в исследовании.
[00113] Наиболее частыми (>0,5% в любой группе) AE являлись кожные нарушения, и они являлись менее частыми при использовании крема с IVM 1% QD, чем геля с 15% азелаиновой кислоты BID в обоих исследованиях.
[00114] Эти два важных исследования показали эффективность и безопасность крема с 1% ивермектина для местного использования в лечении воспалительных повреждений при розацеа с воспроизводимостью. Эффект являлся надежным и высоко значимым (p,0,001) во всех первичных и вторичных конечных точках на неделе 12 (ITT-LOCF). Возникновение эффекта лечения наблюдали на неделе 4 в каждом исследовании с учетом IGA и количества повреждений. Возникновение эффекта лечения наблюдали на неделе 2 в каждом исследовании с учетом количества повреждений. Крем с 1% ивермектина являлся хорошо переносимым и безопасным в обоих исследованиях. Не наблюдали значимых различий между кремом с 1% ивермектина QD и соответствующим наполнителем и гелем с 15% азелаиновой кислоты BID. Наиболее частыми AE (>0,5% в любой группе) являлись кожные нарушения, и они являлись менее частыми при использовании крема с IVM 1% QD, чем при использовании соответствующего компаратора. Кроме того, продолжающееся ежедневное введение крема с 1% ивермектина QD до 1 года является хорошо переносимым без неожиданных результатов в отношении безопасности, ассоциированных с постоянным использованием.
[00115] В заключение, ивермектин, такой как крем с 1% ивермектина, являлся эффективным и безопасным в лечении папулопустулезной розацеа.
[00116] Пример 4: Сравнение эффективности и безопасности крема с 1% ивермектина по сравнению с кремом с 0,75% метронидазола
[00117] Осуществляли обратное слепое, рандомизированное исследование в параллельных группах, в котором сравнивали эффективность и безопасность крема с 1% (масс./масс.) ивермектина (далее обозначаемого как IVM) и крема с 0,75% метронидазола (масс./масс.) с 16-недельным периодом A и 36-недельным периодом B до повторения исследования. Посещения в исследовании в течение периода A являлись следующими: посещение для скрининга и посещения на исходном уровне, неделях 3, 6, 9, 12 и 16.
[00118] Подходящие индивидуумы являлись индивидуумами возрастом 18 лет или старше с умеренной или тяжелой папулопустулезной розацеа, на что указывает IGA 3 ("несколько небольших или больших папул/пустул, умеренная эритема") или 4 ("многочисленные небольшие и/или большие папулы/пустулы, тяжелая эритема") и наличие 15-70 воспалительных повреждений (папул и пустул) на лице.
[00119] Индивидуумов случайным образом отбирали в соотношении 1:1 для использования крема IVM 1% (один раз в сутки, QD, на ночь) или крема с 0,75% метронидазола (дважды в сутки, BID, согласно маркировке утром и на ночь) в течение 16 недель. Исследуемые лекарственные средства тонким слоем наносили на все лицо (правую и левую щеки, лоб, подбородок и нос), избегая верхнего и нижнего век, губ, глаз и рта. Индивидуумов инструктировали поддерживать постоянный образ жизни на всем протяжении исследования в отношении триггерных факторов розацеа (т.е. избегать факторов окружающей среды, конкретных продуктов питания и избыточной инсоляции).
[00120] Оценками эффективности при каждом посещении являлись количество воспалительных повреждений (папул и пустул), подсчитываемое на пяти областях лица (лбу, подбородке, носу, правой щеке, левой щеке), и общая оценка исследователем (IGA) тяжести заболевания. Оценки безопасности включали побочные эффекты (AE) на всем протяжении исследования, параметры местной переносимости (ощущение жжения, сухости, зуда) при каждом посещении, оцениваемые по 4-балльной шкале (от 0 (отсутствие) до 3 (тяжелые)), и лабораторные параметры, измеряемые на исходном уровне, неделях 9 и 16. Другие оценки включали оценку индивидуумом улучшения состояния розацеа по сравнению с состоянием на исходном уровне и положительную оценку индивидуумом по опроснику в конце исследования (в отношении удовлетворенности исследуемым лекарственным средством). И наконец, на исходном уровне и в конце исследования (неделя 16) заполняли опросник в отношении качества жизни (Dermatology Life
Quality Index (DLQI)).
[00121] ITT-выборка включала всех индивидуумов, которых отбирали случайным образом и которым вводили исследуемое лекарственное средство. Выборка для оценки безопасности включала всех индивидуумов, которым вводили исследуемое лекарственное средство. Первичную конечную точку в отношении эффективности, процент изменения количества воспалительных повреждений от исходного уровня до недели 16, анализировали с использованием критерия CMH, стратифицированного по центру выборки, с реддит-трансформацией и логранговым критерием. Вторичные точки в отношении эффективности включали показатель эффективности (процент индивидуумов с IGA 0 ("чистая") или 1 ("почти чистая") (анализировали по критерию CMH, стратифицированному по центру выборки с использованием статистики генерального обобщения), IGA и абсолютного изменения количества повреждений (анализировали с использованием ANCOVA, включающего лечение и центр анализа в качестве факторов и исходный уровень в качестве ковариаты). LOCF являлся основным способом восполнения недостающих данных, и способ многократного заполнения (MI) использовали для анализа чувствительности. Другие переменные анализировали описательно.
[00122] Всего 1034 индивидуумов подвергали скринингу и 962 отбирали случайным образом для использования крема с IVM 1% (n=478) или крема с 0,75% метронидазола (n=484); 902 (93,8%) завершили исследование (фигура 8). Исследуемые группы являлись сравнимыми на исходном уровне в терминах демографии и исходных характеристик заболевания, в среднем с приблизительно 32 воспалительными повреждениями, и большинство имело умеренную розацеа (83,3% с IGA 3) (таблица 5). Как и ожидали, количество продукта, наносимого в группе метронидазола (введения BID) составляло приблизительно в два раза больше, чем у продукта в группе IVM 1% (QD), со средним количеством 1,31 г по сравнению с 0,72 г, соответственно.
[00123]
|
[00124] Что касается первичной конечной точки на неделе 16 (ITT-LOCF), крем IVM 1% значимо превосходил крем с 0,75% метронидазола в терминах процента снижения количества воспалительных повреждений по отношению к исходному уровню (83,0% по сравнению с 73,7%; p<0,001; фигура 9). Это различие наблюдали уже на неделе 3 (ITT-LOCF) (уже на неделе 6 с ITT-MI), и это продолжалось до недели 16 (все значения p≤0,04). Следует отметить, что в этом исследовании не было посещений или оценок до недели 3, таким образом, различие в лечении можно было бы наблюдать ранее недели 3, если бы первое посещение осуществляли ранее. Аналогичные результаты наблюдали для показателя эффективности IGA (индивидуумы с оценками "чистая" или "почти чистая"): 84,9% для крема с IVM 1% по сравнению с 75,4% для крема с 0,75% метронидазола на неделе 16 (ITT-LOCF) (p<0,001). Как показано на фигуре 10, различие в IGA являлось наибольшим на
неделе 12 (на 14,9% больше для ивермектина).
[00125] Приблизительно на 13% больше индивидуумов имели IGA "чистая" в случае IVM 1%, чем в случае 0,75% метронидазола (34,9% по сравнению с 21,7%, соответственно). Кроме того, в анализе показателя эффективности в подгруппах по тяжести согласно IGA приблизительно на 20% больше индивидуумов с тяжелой розацеа на исходном уровне в группе IVM 1% достигали успеха (82,5% по сравнению с 63,0%).
[00126] Частота побочных эффектов (AE) являлась схожей между группами (32,4% по сравнению с 33,1% индивидуумов в группах IVM 1% и 0,75% метронидазола, соответственно), как и в случае сопутствующих AE (2,3% по сравнению с 3,7%). Кроме того, сравнимо низкое количество индивидуумов испытывало сопутствующие дерматологические AE (9 индивидуумов (1,9%) в группе IVM 1% и 12 (2,5%) в группе 0,75% метронидазола). Наиболее распространенным сопутствующим AE являлось раздражение на коже (3 индивидуумов (0,6%) по сравнению с 4 индивидуумами (0,8%) в случае IVM 1% и 0,75% метронидазола, соответственно). Тринадцать индивидуумов сообщали о серьезных, но несопутствующих AE. Всего 3 индивидуума (0,6%) в группе IVM 1% испытывали сопутствующие побочные эффекты, приводившие к прекращению участия в исследовании (по причине раздражения на коже и гиперчувствительности), по сравнению с 10 (2,1%) индивидуумов в группе 0,75% метронидазола (по причине раздражения на коже, аллергического дерматита, ухудшения розацеа, эритемы, прурита и общих нарушений (не ощущений)).
[00127] Что касается местной переносимости, частота ухудшения по отношению к исходному уровню являлась более высокой в группе 0,75% метронидазола в отношении жжения (15,5% по сравнению с 11,1%), сухости (12,8% по сравнению с 10,0%) и зуда (11,4% по сравнению с 8,8%). При лабораторных тестах не наблюдали клинически значимых аномалий.
[00128] В конце периода A этого исследования большинство (85,5%) индивидуумов в группе IVM 1% оценивало общее улучшение своего состояния как "отличное" или "хорошее" по сравнению с 74,8% в группе 0,75% метронидазола. Кроме того, больше индивидуумов, использовавших IVM 1%, сообщали об "отличном" улучшении своей розацеа (52,3% по сравнению с 37,0%, соответственно; фигура 11). Что касается положительной оценки индивидуумом по опроснику, больше индивидуумов в группе IVM 1% были удовлетворены исследуемым лекарственным средством (76,0% по сравнению с 61,3% в группе 0,75% метронидазола). Кроме того, больше индивидуумов, которых лечили IVM 1%, имели тенденцию считать продукт легким в использовании, и что время, необходимое для нанесения, являлось удовлетворительным, в то время как больше индивидуумов считали 0,75% метронидазол раздражающим (данные не представлены).
[00129] На исходном уровне средние баллы DLQI являлись схожими между группами (6,95 в случае IVM 1% и 6,05 в случае 0,75% метронидазола, соответственно). У пациентов, которых лечили IVM 1%, наблюдали более высокое количественное повышение баллов DLQI, чем у пациентов, которых лечили 0,75% метронидазола (-5,18 по сравнению с -3,92; p<0,01), что свидетельствует о более высоком улучшении качества жизни. В конце исследования 71% пациентов, которых лечили IVM 1%, сообщали об отсутствии эффекта в отношении их качества жизни (по сравнению с 64% в случае 0,75% метронидазола), что означает, что более высокая доля индивидуумов чувствовала, что розацеа не влияла негативно на их качество жизни в группе, которую лечили IVM, по сравнению с группой, которую лечили метронидазолом. Исследуемые лекарственные средства отличались в пользу IVM 1% по подшкале симптомов и ощущений (уровень зуда, болезненности, боли или жжения: "совсем нет" в случае 78,7% по сравнению с 63,0% в группе 0,75% метронидазола; уровень дискомфорта или чувства неловкости: "совсем нет" в случае 70,3% по сравнению с 60,1%, соответственно).
[00130] Местное использование 0,75% метронидазола (масс./масс.) является одним из наиболее часто используемых способов терапии в лечении папулопустулезной розацеа. В этом исследовании крем IVM 1% значимо превосходил крем с 0,75% метронидазола в терминах процента снижения количества
воспалительных повреждений по отношению к исходному уровню с возникновением эффективности (первого различия по сравнению с 0,75% метронидазола) уже через 3 недели (или даже ранее), продолжавшейся в течение 16 недель. Результаты свидетельствуют о том, что ивермектин является более эффективным, чем метронидазол, с тенденцией даже у пациентов с более высоким количеством повреждений.
[00131] В случае IVM наблюдали общий хороший профиль безопасности, и он являлся хорошо переносимым по сравнению с метронидазолом. Неудивительно, что в случаях обоих продуктов пациенты испытывали аналогичное низкое количество сопутствующих побочных эффектов, в частности, т.к. переносимость метронидазола, как известно, является удовлетворительной. Более высокая частота ухудшения жжения, сухости и зуда по отношению к исходному уровню в случае метронидазола может быть связана с обычными признаками и симптомами розацеа. Как бы то ни было, это влияло на качество жизни, как измеряли по DLQI, т.к. больше пациентов в группе метронидазола сообщало о зуде, болезненности, боли или жжении.
[00132] Результаты, о которых сообщали пациенты, в случае крема IVM 1% соответствовали данным о его лучшей эффективности. Больше пациентов, использовавших IVM, сообщали о том, что продукт являлся легким в использовании и время, необходимое для нанесения, являлось удовлетворительным, что означает, что ежедневное нанесение является более удобным, чем режим нанесения метронидазола дважды в сутки. Что касается мер качества жизни, меньше пациентов, использовавших IVM, чувствовали дискомфорт или неловкость. Таким образом, ивермектин, по-видимому, адаптирован к сложной этиологии розацеа, и в исследовании крем IVM 1% демонстрировал превосходство в отношении крема с 0,75% метронидазола в терминах снижения воспалительных повреждений. Как указано в упомянутом выше обзоре Cochrane, в нескольких надежных исследованиях сравнивали метронидазол для местного использования с другим лечением розацеа, и в трех указанных исследованиях метронидазол для местного использования незначимо отличался или являлся менее эффективным, чем азелаиновая кислота.8 Хотя метронидазол в прошлом использовали как целесообразное лечение папулопустулезных повреждений при розацеа, его эффективность превзойдена эффективностью ивермектина, вместе с преимуществом дозирования один раз в сутки.
[00133] Рецидивирование среди индивидуумов, которых успешно лечили в конце периода A, исследовали в течение периода B без лечения (36 недели). К концу периода A только индивидуумы с IGA "0" или "1" ("чистая" или "почти чистая") подходили для включения в исследование периода B. Затем исследуемое лечение прекращали и индивидуумов наблюдали в течение 8 месяцев (36 недель). В случае повторения IGA по меньшей мере "2" ("слабая") в любой момент времени в течение периода B индивидуумов снова лечили так же, как и в течение периода A. Повторное лечение прекращали как только IGA возвращалась к "0" или "1" ("чистая" или "почти чистая"). Максимальная длительность повторного лечения составляла 16 последовательных недель для имитации длительности лечения в период A. Для характеризации рецидивов оценивали следующие параметры: (1) время первого рецидива (время, прошедшее между неделей 16 и первым повторением IGA "2", "3" или "4", приводящим к курсу повторного лечения), (2) частоту рецидивов (процентную долю индивидуумов с повторением IGA "2", "3" или "4" после периода без исследуемого лечения) и (3) количество дней без лечения.
[00134] К началу периода B исследуемые группы являлись сравнимыми в отношении демографии. Всего из 757 индивидуумов, включенных в период B (399 в группе 1% ивермектина и 358 в группе 0,75% метронидазола, соответственно), 504 (66,6%) являлись женщинами, 754 (99,6%) являлись европеоидами, и средний возраст составлял 51,9 лет. Что касается характеристик заболевания, среднее количество воспалительных повреждений являлось схожим в обеих группах (медиана 2,0). Но доля индивидуумов с IGA 0 являлась более высокой в группе ивермектина, чем в группе метронидазола (41,6% по сравнению с 29,1%) по причине более высокой эффективности лечения ивермектином в период A.
[00135]
|
[00136] Время до первого рецидива, определяемое как время, прошедшее между неделей 16 и первым повторением IGA "2", "3" или"4", анализировали, следуя 2 определениям: (1) первое основано только на IGA; и (2) во втором также учитывают любые значимые отклонения, приписывая рецидив в день первого значимого отклонения. В случае каждого определения осуществляли анализ чувствительности, приписывая рецидив через 4 недели после прекращения участия в исследовании для всех индивидуумов, которые рано выбывали из периода B исследования без рецидива. Частоты рецидивов подвергали тому же общепринятому анализу, что и время до рецидива.
[00137] Медиана времени до первого рецидива составляла 115 дней в случае 1% ивермектина QD и 85 дней в случае 0,75% метронидазола BID (p=0,0365), частота рецидивов составляла 62,7% и 68,4%, соответственно (таблица 7). Также см. фигуру 12. При осуществлении анализа чувствительности посредством приписывания рецидива через 4 недели для индивидуумов, рано прекративших участие в исследовании без рецидива, медианы составляли 114 дней и 85 дней (p=0,0594), и частоты рецидивов составляли 66,2% и 70,4%, соответственно. Аналогичные результаты получали при учете дня первого значительного отклонения.
[0138]
|
Рецидив основан исключительно на IGA
(1) Логарифмический ранговый критерий
[00139] Количество дней без лечения определяли для каждого индивидуума, включенного в период B, как временной интервал между посещением, когда IGA оценивают как 0 или 1, и следующим посещением. Количество дней без лечения является суммой по всем посещениям периода B, удовлетворяющим этому критерию. Также
осуществляли дополнительный анализ, вычитая из дней без лечения любой временной интервал между посещениями, когда индивидуум, имея IGA 0 или 1, одновременно имел значительное отклонение от протокола.
[00140] Учитывая баллы IGA, получали среднее количество дней без лечения 183 дней в случае 1% ивермектина QD по сравнению с 170 днями в случае метронидазола (p=0,026). Если учитывать отклонения от протокола, среднее количество дней без лечения оставалось приблизительно одинаковым, 181 дней по сравнению с 168 днями (p=0,021) в пользу 1% ивермектина QD.
[00141] Лечение кремом с 1% ивермектина QD приводило к статистически значимой длительной ремиссии розацеа (т.е. задержке первого рецидива и повышению количества дней без лечения) по сравнению с 0,75% метронидазола BID у индивидуумов, которых успешно лечили (IGA 0 ("чистая") или 1 ("почти чистая")) в течение 16 недель. Также наблюдали количественную тенденцию в пользу крема с 1% ивермектина QD в отношении частоты рецидивов (62,7% и 68,4% в группе 1% ивермектина и группе 0,75% метронидазола, соответственно). Следует отметить, что наблюдаемые различия в пользу 1% ивермектина в период B, предположительно, являются следствием более высокой эффективности ивермектина по сравнению с метронидазолом, наблюдаемой в конце периода A, с более высокой долей индивидуумов с IGA=0 в группе ивермектина (41,6% и 29,1% в группе ивермектина и метронидазола, соответственно).
[00142] Общая фармакоэкономическая польза крема с 1% ивермектина QD по сравнению с кремом 0,75% метронидазола BID в течение одного года исследования (периоды A и B) является существенной при рассмотрении в качестве суммы следующих элементов: пользы ивермектина по сравнению с метронидазолом, наблюдаемой в конце периода A (84,9% успеха в группе ивермектина по сравнению с 75,4% в группе метронидазола), времени до первого рецидива (115 дней по сравнению с 85 днями), частоты рецидивов (62,7% по сравнению с 68,4%) и количества дней без лечения (183,4 по сравнению с 170,4).
[00143] Пример 5 : Исследование фармакокинетики в плазме
[00144] Осуществляли многоцентровое, открытое, неконтролируемое исследование для оценки фармакокинетического (PK) профиля крема с 1% ивермектина (масс./масс.) у индивидуумов с тяжелой PPR. Максимизированную дозу приблизительно 2 мг/см2 (1 г крема с 1% ивермектина (масс./масс.), эквивалентная 10 мг ивермектина на нанесение) наносили на лицо один раз в сутки в течение 4 недель. За лечением следовал 28-дневный период последующего наблюдения.
[00145] Всего семнадцать индивидуумов получали по меньшей мере одну дозу лекарственного средства. Для всех индивидуумов получали параметры PK в некоторые моменты времени, но для пятнадцати (9 женщин и 6 мужчин) получали полные профили PK в дни 0, 14 и 28. Эти пятнадцать индивидуумов имели количество воспалительных повреждений от 27 до 88 и тяжелую папулопустулезную розацеа (баллы IGA 4) на исходном уровне (перед лечением).
[00146] Образцы крови для определения уровней ивермектина в плазме получали от всех индивидуумов в дни 0, 7, 14, 21 и 28 (образцы перед введением дозы, соответствующие Cmin). Дополнительные образцы крови получали в дни 0, 14 и 28 через 1, 3, 6, 9 и 12 часов после нанесения. В конце 28-дневнего лечения образцы крови получали в дни 29, 30, 32, 35, 38, 42, 49 и 56 в течение периода последующего наблюдения. Плазму выделяли и замораживали (-20°C) до осуществления анализа.
[00147] Осуществляли фармакокинетический анализ. С помощью индивидуальных концентраций в плазме определяли фармакокинетические параметры посредством программного обеспечения для некомпартментного способа Kinetica™, версия 4.3, InnaPhase Corporation, Philadelphia, USA.
[00148] В течение периода лечения измеряли следующие параметры:
(1) Cmin: Концентрация лекарственного средства в плазме перед введением дозы в дни 0 (24 часа после DO, перед введением дозы в день 1), 7, 14, 21 и 28;
(2) Cmax: Наблюдаемая пиковая концентрация лекарственного
средства в дни 0, 14 и 28;
(3) Tmax: Время, когда достигается Cmax в дни 0, 14 и 28;
(4) AUC0-24ч: Площадь под кривой концентрация-время от момента до нанесения (TO) в течение 24 часов после введения дозы, соответствующих интервалу между введениями доз. AUC0-24ч вычисляли с помощью смешанного линейно-логарифмического способа трапеций в день 0, 14 и 28. BLQ приписывали как ноль в отдельном профиле PK.
[00149] В течение периода последующего наблюдения измеряли следующие параметры:
(1) AUC0-t: Площадь под кривой концентрация-время, вычисленная с помощью смешанного линейно-логарифмического способа трапеций от TO до времени получения образцов, соответствующего последней вычисляемой концентрации (Clast);
(2) Kel: Значение константы скорости выведения (kel) получали с помощью линейной регрессии логлинейной конечной фазы профиля концентрация-время с использованием по меньшей мере 3 точек данных, за исключением Cmax, в ином случае kel не определяли. Критерием приемлемости для определения kel являлся коэффициент регрессии больше или равный 0,98. Если kel не определяли, то не указывали AUC0-inf и t1/2;
(3) t1/2: Значение конечного времени полувыведения (t1/2) вычисляли с использованием уравнения ln2/kel;
(4) AUC0-inf: Площадь под кривой концентрация в плазме-время, вычисленная с помощью смешанного линейно-логарифмического способа трапеций из TO и экстраполированная по времени до бесконечности как: AUC0-inf=AUC0-t+Clast/kel.
[00150] Если экстраполяция представляла собой более 20%, указывали AUC0-inf и t1/2. Средние значения, стандартное отклонение (SD), наименьшее индивидуальное значение (Мин.), максимальное индивидуальное значение (Макс.) и коэффициент вариации (CV) вычисляли и указывали для каждой переменной (арифметическое среднее для AUC, Cmax, Tmax и гармоническое среднее для t1/2). Обратно протоколу, стандартную ошибку среднего (SEM) не вычисляли и не указывали. Кроме того, осуществляли статистический анализ в отношении ивермектин-специфичных параметров (включая норму накопления).
[00151] Всего семнадцать индивидуумов получали по меньшей мере одну дозу лекарственного средства. От всех индивидуумов получали параметры PK в некоторые моменты времени, от пятнадцати (9 женщин и 6 мужчин) получали полные профили PK в дни 0, 14 и 28. В этом отчете представлены параметры PK от всех индивидуумов (17 индивидуумов в дни 0/1 и 15 индивидуумов в последующие дни).
[00152] Не наблюдали неприемлемых отклонений между точным и теоретическим временем забора образцов (согласно заранее определенному приемлемому диапазону). Таким образом, для анализа PK использовали теоретическое время получения образцов. Индивидуальные концентрации ивермектина в плазме, определенные в период лечения, представлены в таблице 8.
[00153]
|
|
[00154] Арифметическое среднее профилей ивермектина в плазме в течение 28-дневного лечения представлено на фигуре 13. Значения среднего ± SD и диапазона (мин.-макс.) Cmin, Cmax и AUC0-24ч во все дни получения образцов приведены в таблице 8.
[00155] После однократного местного использования крема с 1% ивермектина количественные уровни ивермектина обнаруживали в плазме 17 индивидуумов, отобранных для лечения. Наблюдали высокую межиндивидуальную вариабельность, о чем свидетельствует коэффициент вариации (CV) в диапазоне от 57 до 71%. После однократного местного использования (день 0) наблюдали плоский профиль PK в течение интервала между введением доз, концентрации ивермектина в плазме достигали пика в течение 9 часов после введения дозы (диапазон для 0,69 нг/мл: 0,19-1,76 нг/мл) и затем медленно снижались до 0,37 нг/мл через 24 часа после введения дозы.
[00156] Через 28 дней местного использования крема с 1% ивермектина один раз в сутки системные воздействия являлись более высокими, чем вычисленные после однократного нанесения. После повторного введения доз наблюдали более низкую межиндивидуальную вариабельность с CV в диапазоне от 39% до 46%.
[00157] Системные воздействия в течение интервала между введением доз, вычисленные в день 14 (AUC0-24ч: 36,14±15,56 нг⋅ч/мл) и в день 28 (AUC0-24ч: 35,43±14,42 нг⋅ч/мл) являлись схожими, что свидетельствует о том, что равновесного состояния достигали уже через 14 дней после исходного введения. Ту же тенденцию наблюдали в отношении концентраций в плазме перед введением дозы. Средние концентрации ивермектина (±SD) перед введением дозы составляли 1,26±0,53 нг/мл, 1,36±0,66 нг/мл и 1,36±0,63 нг/мл в день 14, день 21 и день, соответственно.
[00158] После самого последнего местного использования ивермектина (день 28) кажущееся конечное время полувыведения, определяемое для 14 включенных индивидуумов, составляло 145 часов (диапазон 92-238 часов), при этом последнюю вычисляемую концентрацию наблюдали приблизительно через 24 дня после нанесения. Кроме того, общее системное воздействие в день 28 (AUC0-inf) составляло 312±173 нг⋅ч/мл. Это длительное кажущееся время полувыведения свидетельствует о том, что ивермектин медленно выводился из плазмы после прекращения лечения ивермектином.
[00159] После 28 дней местного использования крема с 1% ивермектина один раз в сутки системное воздействие ивермектина в течение интервала между введением доз, вычисленное в день 14 (AUC0-24ч: 36,14±15,56 нг⋅ч/мл, диапазон 13,69-75,16 нг⋅ч/мл) и в день 28 (AUC0-24ч: 35,43±14,42 нг⋅ч/мл, диапазон: 12,89-70,08 нг∙ч/мл), являлось схожим, что свидетельствует о том, что равновесного состояния достигали в день 14. В равновесном состоянии (через 2 недели лечения) наибольшие средние (± стандартное отклонение) концентрации ивермектина в плазме достигали пика в течение 10±8 часов после введения дозы (Cmax: 2,10±1,04 нг/мл, диапазон: 0,69-4,02 нг/мл) и наибольшее среднее (± стандартное отклонение) AUC0-24ч составляло 36,14±15,56 нг⋅ч/мл (диапазон: 13,69-75,16 нг⋅ч/мл). Эти уровни, полученные в условиях равновесного состояния, являлись меньшими, чем наблюдаемые после перорального введения ивермектина (относительная биодоступность 16%). При дополнительной оценке системного воздействия при большей длительности лечения (исследование фазы 3) подтверждали, что не было накопления ивермектина в плазме в течение 52-недельного периода лечения, что свидетельствует о том, что ивермектин является безопасным и его можно вводить в течение длительного периода времени.
[00160] В конце 28-дневного периода нанесения ивермектин медленно выводился из плазмы с кажущимся конечным временем полувыведения из плазмы 145 часа, при этом последнюю вычисляемую концентрацию наблюдали приблизительно через 24 дня после
нанесения. Это конечное время полувыведения является более длительным, чем опубликованное для перорального введения ивермектина. В случае перорально вводимого ивермектина t1/2, как правило, составляет приблизительно 18 часов в диапазоне приблизительно от 12 до 20 часов (Fink et al, Guzzo et al). Это длительное конечное время полувыведения после местного введения позволяет предполагать, что скорость-лимитирующим этапом в снижении концентрации ивермектина в плазме является исчезновение ивермектина из места введения, а не скорость выведения. Для описания этого явления используют термин "flip-flop" (Toutain et al, 2004, выше).
[00102] В заключение, местное лечение 1% ивермектином один раз в сутки является безопасным, и его можно осуществлять столько, сколько необходимо, не вызывая каких-либо угроз безопасности.
Ссылки
1. Gupta AK, Chaudhry MM. Rosacea and its management: an overview. J Eur Acad Dermatol Venereol 2005; 19(3):273-85.
2. National Rosacea Society. Rosacea Now Estimated to Affect at Least 16 Million Americans. Rosacea Review, winter 2010 issue. Retrieved December 10, 2013 from http://www.rosacea.org/rr/2010/winter/article_l.php
3. Wilkin J, Dahl M, Detmar M, et al. Standard classification of rosacea: Report of the National Rosacea Society Expert Committee on the classification and staging of rosacea. J Am Acad Dermatol 2002; 46: 584-587.
4. Balkrishnan R, McMichael AJ, Hu JY, Camacho FT, Shew KR, Bouloc A, et al. Correlates of health-related quality of life in women with severe facial blemishes. IntJ Dermatol 2006 ; 45(2): 111-5.
5. Del Rosso JQ, Gallo RL, Tanghetti E, Webster G, Thiboutot D. An evaluation of potential correlations between pathophysiologic mechanisms, clinical manifestations, and management of rosacea. Cutis 2013; 91(3 Suppl):l-8.
6. Holmes AD. Potential role of microorganisms in the pathogenesis of rosacea. J Am Acad Dermatol 2013; 69(6): 1025-32.
7. Pelle MT, Crawford GH, James WD. Rosacea: II. Therapy. J Am Acad Dermatol 2004; 51(4):499 -514.
8. van Zuuren EJ, Kramer SF, Carter BR, Graber MA, Fedorowicz Z. Effective and evidence-based management strategies for rosacea: summary of a Cochrane systematic review. Br J Dermatol 2011; 165(4):760-81.
9. Elewski BE. Results of a national rosacea patient survey: common issues that concern rosacea sufferers. J Drugs Dermatol 2009; 8(2): 120-3.
10. Ci X, Li H, Yu Q, Zhang X, Yu L, Chen N, et al. Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen- activated protein kinase activation pathway. Fundam Clin Pharmacol 2009; 23(4):449-55.
11. Yanagihara K, Kadoto J, Kohno S. Diffuse panbronchiolitis- pathophysiology and treatment mechanisms. Int JAntimicrob Agents 2001; 18 Suppl 1:S83-7.
12. Ianaro A, Ialenti A, Maffia P, Sautebin L, Rombola L, Carnuccio R, et al. Anti inflammatory activity of macrolide antibiotics. J Pharmacol Exp Ther 2000; 292(1): 156-63.
13. Campbell WC. History of avermectin and ivermectin, with notes on the history of other macrocyclic lactone antiparasitic agents. Curr Pharm Biotechnol 2012; 13(6):853-65.
14. Forstinger C, Kittler H, Binder M. Treatment of rosacea-like demodicidosis with oral ivermectin and topical permethrin cream. J Am Acad Dermatol 1999; 41: 775-7.
15. Trendelenburg M, Buchner S, Passweg J, Ratz Bravo AR, Gratwohl A. Disseminated scabies evolving in a patient undergoing induction chemotherapy for acute myeloblastic leukaemia. Ann Hematol 2001;80(2): 116-8.
16. Pariser DM, Meinking TL, Bell M, Ryan WG. Topical 0.5% ivermectin lotion for treatment of head lice. N Engl J Med 2012; 367(18): 1687-93.
17. Finlay AY, Khan GK. Dermatology Life Quality Index (DLQI) - a simple practical measure for routine clinical use.
Clin Exp Dermatol 1994; 19(3): 210-6.
18. Nicholson K, Abramova L, Chren MM, Yeung J, Chon SY, Chen SC. A pilot quality - of-life instrument for acne rosacea. J Am Acad Dermatol 2007; 57(2):213-21.
19. Zhang X, Song Y, Ci X et al. Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res 2008; 57:524-9.
20. Gerber PA, Buhren BA, Steinhoff M, Homey B. Rosacea: The cytokine and chemokine network. J Investig Dermatol Symp Proc 2011; 15(l):40-7.
21. Wolstenholme AJ, Rogers AT. Glutamate-gated chloride channels and the mode of action of the avermectin/milbemycin anthelmintics. Parasitology 2005; 131 Suppl:S85-95.
22. Damian D. Demodex infestation in a child with leukemia: treatment with ivermectin and permethrin. Int J Dermatol 2003; 42:724-6.
23. Filho PA, Hazarbassanov RM, Grisolia AB et al. The efficacy of oral ivermectin for the treatment of chronic blepharitis in patients tested positive for Demodex spp. Br J Ophthalmol 2011; 95: 893-5.
24. Powell FC. Rosacea and the pilosebaceous follicle. Cutis 2004; 74 (3 Suppl): 9-12.
25. Marks R. The enigma of rosacea. J Dermatol Treat 2007; 18:326-8.
26. Forton FMN. Papulopustular rosacea, skin immunity and Demodex: pityriasis folliculorum as a missing link. J Eur Acad Dermatol Venereol 2012; 26:19-28.
27. Reinholz M, Ruzicka T, Schauber J. Cathelicidin LL-37: An antimicrobial peptide with a role in inflammatory skin disease. Ann Dermatol 2012; 24(2): 126-135.
28. Millikan L. Rosacea as an inflammatory disorder: a unifying theory? Cutis 2004; 73(suppl 1): 5-8.
Специалистам в этой области будет понятно, что можно осуществлять изменения в описываемых выше вариантах осуществления без отклонения от широкой концепции изобретения. Таким образом, следует понимать, что настоящее изобретение не ограничено конкретными описываемыми вариантами осуществления, но охватывает модификации в пределах сущности и объема настоящего изобретения, определенных в формуле изобретения.