Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ N-(1S)-1',2',3'-ТРИМЕТОКСИ-6,7-ДИГИДРО-1Н-БЕНЗО[5',6':5,4]ЦИКЛОГЕПТА-[3,2-F]БЕНЗОФУРАН-1-ИЛ)АЦЕТАМИДА И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к области органической химии, к гетероциклическим соединениям, содержащим пятичленные кольца, конденсированные с другими ядрами, с одним атомом кислорода в качестве гетероатома, а именно к фуранам, касается производного N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида и его применения в качестве активного компонента противоопухолевых лекарственных средств для лечения онкологических заболеваний.
В настоящее время онкологические заболевания являются одной из основных причин смерти во всем мире. В 2007 году зарегистрировано 7,9 миллиона случаев смерти от этой болезни. По прогнозам, число случаев смерти от онкологических заболеваний в мире будет продолжать расти и в 2030 году достигнет 12 миллионов. В связи с этим, синтез новых соединений и создание на их основе противоопухолевых препаратов, обладающих улучшенными фармакокинетическими свойствами, является актуальной задачей здравоохранения.
Известны химические соединения, противоопухолевое действие которых заключается в ингибировании митоза активно пролиферирующих опухолевых клеток.
Цитотоксическая и противоопухолевая активность известных антимитотических соединений обусловлена нарушением обратимости процесса полимеризации и деполимеризации белковых молекул α- и β-тубулина, что приводит к нарушению формирования митотического веретена, образование которого предшествует делению клетки (Biochem. Pharmacol., 1976, 25, 138).
Известно достаточно большое количество химических соединений, обладающих цитотоксической активностью по отношению ко многим видам опухолевых клеток. К таким соединениям относятся алкалоиды ряда колхицина, комбретастатин А-4 и его производные, 4-арилкумарины, а также индольные производные аллоколхицина. Однако каждый из них имеет недостатки.
Недостатком комбретастатина А-4 (US 4996237 (A), опубл. 1991.02.26, кл. C07C 43/23, C07D 317/64, A61K 31/075) и его производных (US 2009186857 (A1), опубл. 2009.07.23, кл. A61K 31/66) является низкая эффективность за счет нежелательных побочных эффектов при применении in vivo вследствие их самопроизвольного превращения из активной цис-формы в неактивную транс-форму (Curr. Opin. Pharmacol., 2001, 1, 370).
4-арилкумарины проявляют низкую антипролиферацинную и апоптозиндуцирующую активность по сравнению с производными комбретастатина и колхицина [J. Med. Chem. 2003, 46, 5437; J. Med. Chem. 2011, 54, 3153].
Недостатком колхицина и его производных (например: WO 2011022805 (A1), опубл. 2011.03.03, кл. A61K 31/165, A61P 35/00, C07C 233/32; WO 2010105172 (A1), опубл. 2010.09.16, кл. A01N 37/18, A61K 31/16; EP 2056812 A1, опубл. 2009.05.13, кл. A61K 31/165, A61P 35/04; US 2004204370 (A1), опубл. 2004.10.14, кл. C07C 323/41, C07C 323/42, C07C 323/60) является возникновение побочных эффектов при их применении, в частности, значительная неспецифическая токсичность (Med. Res. Rev. 2008, 28, 155-183; Chem. Nat. Prod. 1998, 34, 343), что делает невозможным их использование в качестве противоопухолевых препаратов.
Индольное производное аллоколхицина известно по N.S. Sitnikjov et al., Chem. Eur. J. 2012, 18, 12096, представлено формулой:
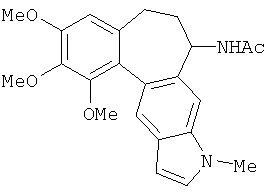
Известное индольное производное аллоколхицина представляет собой карбоциклическое соединение, содержащее конденсированное триметоксизамещенное бензольное кольцо, циклогептановое кольцо с ацетамидной группой и индольный фрагмент.
Известное индольное производное аллоколхицина обладает всеми вышеперечисленными недостатками.
В задачу изобретения положено создание нового производного N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида и его применение в качестве активного компонента противоопухолевых лекарственных средств для лечения онкологических заболеваний.
Технический результат от использования изобретения заключается в повышении активности при ингибировании пролиферации опухолевых клеток.
Это достигается тем, что производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида представлено общей формулой:
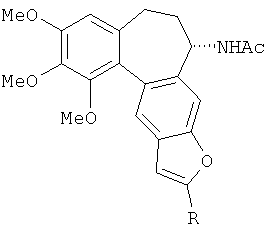
где R - заместитель, R=Ph, 2-пиридинил, CH2OH, CH(CH3)OH, CH2CH2OH, CH2OAc, (CH2)8CO2Me, CH2N(C2H5)2; при R=Ph производное представляет собой N-((1S)-2″-фенил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=2-пиридинил производное представляет собой N-((1S)-2″-(пиридин-2-ил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=CH2OH производное представляет собой N-((1S)-2″-гидроксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=CH(CH3)OH производное представляет собой N-((1S)-2″-(1-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=CH2CH2OH производное представляет собой N-((1S)-2″-(2-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=CH2OAc производное представляет собой N-((1S)-2″-ацетоксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=(CH2)8CO2Me производное представляет собой N-((1S)-2″-(8-(метоксикарбонил)октил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид; при R=CH2N(CH2CH3)2 производное представляет собой N-((1S)-2″-диэтиламинометил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
Это достигается также тем, что производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида применяют в качестве активного компонента противоопухолевого лекарственного средства для лечения онкологических заболеваний.
На фиг.1 представлена общая схема получения производного N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида, в котором группа R соответствует Ph, пиридин-2-ил, CH2OH, CH(CH3)OH, CH2CH2OH, CH2OAc, (CH2)8CO2Me или CH2N(C2H5)2 группам, где
1a - N-((1S)-2″-фенил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует фенильной группе (Ph);
1b - N-((1S)-2″-(пиридин-2-ил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует пиридин-2-ил группе;
1c - N-((1S)-2″-гидроксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует гидроксиметильной группе (CH2OH);
1d - N-((1S)-2″-(1-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует 1-гидроксиэтильной группе (CH(CH3)OH);
1e - N-((1S)-2″-(2-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует 2-гидроксиэтильной группе (CH2CH2OH);
1f - N-((1S)-2″-ацетоксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует ацетоксиметильной группе (CH2OAc);
1g - N-((1S)-2″-(8-(метоксикарбонил)октил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует 8-(метоксикарбонил)октильной группе ((CH2)8CO2Me);
1h - N-((1S)-2″-диэтиламинометил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид, в котором группа R соответствует (диметиламино)метильной группе (CH2N(CH2CH3)2).
На фиг.2 представлена Таблица 1 «Результаты биологических испытаний, отражающие активность при ингибировании пролиферации опухолевых клеток и апоптозиндуцирующую активность производных N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида по отношению к клеткам HEK-T, L-929, Jurkat и AcPc-1».
На фиг.3 представлен график определения эффективной концентрации, подавляющей 50% пролиферации клеток, методом MTT, где кривые тирования - индексы подавления пролиферации (ИПП) клеток HEK-293 препаратами 1c, 1d и 1e; звездочки - уровни 50% эффекта, подсчитываемые от верхнего плато до нулевого значения; вертикальные линии аппроксимируют к эффективной концентрации препаратов; наиболее активным является препарат 1с, наименее активным - 1e.
Производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-1]бензофуран-1-ил)ацетамида представлено общей формулой:

где R - заместитель.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него фенильной группы R=Ph производное представляет собой N-((1S)-2″-фенил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него пиридин-2-ил группы R=пиридин-2-ил производное представляет собой N-((1S)-2″-(пиридин-2-ил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него гидроксиметильной группы R=CH2OH производное представляет собой N-((1S)-2″-гидроксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него 1-гидроксиэтильной группы R=CH(CH3)OH производное представляет собой N-((1S)-2″-(1-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него 2-гидроксиэтильной группы R=CH2CH2OH производное представляет собой N-((1S)-2″-(2-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него ацетоксиметильной группы R=CH2OAc производное представляет собой N-((1S)-2″-ацетоксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него 8-(метоксикарбонил) октильной группы R=(CH2)8CO2Me производное представляет собой N-((1S)-2″-(8-(метоксикарбонил)октил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
При синтезе N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида путем введения в него диэтиламиноэтильной группы R=CH2H(CH2CH3)2 производное представляет собой N-((1S)-2″-диэтиламинометил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид.
Применяют производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида в качестве активного компонента противоопухолевого лекарственного средства для лечения онкологических заболеваний. Получение производного N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида осуществляют следующим образом.
Сначала синтезируют колхицеин. Для этого раствор колхицина (1.5 г, 3.75 ммоль) в 15 мл уксусной кислоты смешивают с 90 мл 0.1 М раствора HCl. Полученную смесь перемешивают при 100°C в течение трех часов. Затем раствор охлаждают до комнатной температуры и добавляют Na2CO3 (тв.) до исчезновения запаха уксусной кислоты (pH=6). Полученный желтый раствор трижды экстрагируют CHCl3, органический слой промывают NaCl и сушат над Na2SO4. После упаривания растворителя и удаления всех летучих веществ в вакууме получают 1.42 г (3.63 ммоль, 98%) колхицеина в виде зеленоватой пены, который затем используют без дополнительной очистки. 1H ЯМР (400 MHz, ДМСО) δ 8.63 (d, J=7.3 Hz, 1H), 7.32 (d, 1H), 7.31 (s, 1H), 7.15 (d, J=11.8 Hz, 1H), 6.80 (s, 1H), 4.43-4.27 (m, 1H), 3.84 (s, 3H), 3.78 (s, 3H), 3.56 (s, 3H), 2.35-1.89 (m, 4H), 1.87 (s, 3H).
Tпл=150°C. Tпл. лит=150°C (Nicolaus, N., Reball, J., Sitnikov, N., Velder, J., Termath, A., Fedorov, A., Schmalz, H.-G. Heterocycles, 2011, 82, 1585).
Затем синтезируют йодоколхинол. Для этого раствор колхицеина (1.42 г, 3.63 ммоль) в 29 мл воды охлаждают до 0°C, затем к раствору добавляют NaOH (1.45 г, 36.3 ммоль) с последующим добавлением по каплям раствора йода (2.82 г, 11.1 ммоль) и NaI (15.83 г, 85.1 ммоль) в 143 мл воды в течение часа. Полученный раствор перемешивают 90 минут при температуре 0-5°C. Затем полученный желто-коричневый раствор доводят до комнатной температуры и добавляют эквивалентное количество Na2SO3 для нейтрализации избытка йода, цвет раствора изменяется на оранжевый. После этого добавляют HCl (конц.) до pH=2, при этом выпадают желто-зеленые кристаллы, которые отделяют фильтрованием, промывают водой и сушат под вакуумом. Оставшийся маточный раствор трижды экстрагируют EtOAc, органический слой промывают NaCl и сушат над Na2SO4. После упаривания растворителя полученные желтоватые кристаллы добавляют к кристаллам, выделенным ранее фильтрованием. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 3:1:1) йодколхинол получают в виде светло-желтого порошка (1.25 г, 2.6 ммоль, 70%).
1H ЯМР (400 MHz, ДМСО) δ 10.28 (s, 1H), 8.38 (d, J=8.0 Hz, 1H), 7.56 (s, 1H), 6.86 (s, 1H), 6.76 (s, 1H), 4.40-4.33 (m, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.48 (s, 3H), 2.23-1.87 (m, 4H), 1.87 (s, 3H).
Tпл=238°C. Tпл. лит=238°C (Nicolaus, N., Reball, J., Sitnikov, N., Velder, J., Termath, A., Fedorov, A., Schmalz, H.-G. Heterocycles, 2011, 82,1585).
Синтез N-((1S)-2″-фенил-1′,2′3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1a) осуществляют следующим образом. В колбу, содержащую 30 мг йодколхинола (0.06 ммоль), 0.7 мг Pd(OAc)2 (0.003 ммоль), 2.43 мг PPh3 (0.009 ммоль), 1.2 мг CuI (0.006 ммоль) и 39.3 мг K3PO4 (0.186 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 8.14 мкл фенилацетилена (0.074 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 5:1:1) N-((1S)-2″-фенил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде желто-коричневых кристаллов (24 мг, 86%). 1H ЯМР (400 MHz, ДМСО) δ 8.49 (d, J=8.5 Hz, 1H), 7.92 (s, 1H), 7.90 (s, 1H), 7.63-7.57 (m, 1H), 7.56 (s, 1H), 7.50 (t, J=7.7 Hz, 2H), 7.43 (s, 1H), 7.39 (t, J=7.3 Hz, 1H), 6.79 (s, 1H), 4.60 (dd, J=7.3, 4.1 Hz, 1H), 3.83 (s, 3H), 3.79 (s, 3H), 3.44 (s, 3H), 2.18 (td, J=12.1, 5.8 Hz, 2H), 2.13-2.00 (m, 2H), 1.91 (s, 3H).
13C ЯМР (101 MHz, ДМСО) δ 168.45, 155.10, 153.72, 152.34, 150.39, 140.61, 138.24, 134.77, 129.89, 129.27, 129.05, 128.71, 127.00, 124.63, 124.54, 121.96, 108.05, 105.75, 102.03, 60.59, 60.53, 55.83, 48.50, 38.35, 30.68, 30.05, 22.71.
Найдено (%): C, 73.48; H, 5.96. C28H27NO5. Вычислено (%): C, 73.51; H, 5.95.
Tпл=140°C.
Синтез N-((1S)-2″-(пиридин-2-ил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1b) осуществляют следующим образом. В колбу, содержащую 60 мг йодколхинола (0.123 ммоль), 1.37 мг Pd(OAc)2 (0.006 ммоль), 4.7 мг PPh3 (0.018 ммоль), 2.4 мг CuI (0.012 ммоль) и 36.6 мг KOAc (0.372 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 15.1 мкл этинилпиридина (0.147 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 4:1:1) N-((1S)-2″-(пиридин-2-ил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде коричневых кристаллов (47 мг, 83%).
1H ЯМР (400 MHz, ДМСО) δ 8.69 (d, J=4.7 Hz, 1H), 8.54 (d, J=8.4 Hz, 1H), 7.96 (d, J=0.7 Hz, 1H), 7.95 (s, 1H), 7.65 (s, 1H), 7.61 (s, 1H), 7.60 (s, 1H), 7.40 (dd, J=8.6, 4.8 Hz, 1H), 6.81 (s, 1H), 4.64 (dt, J=11.9, 7.7 Hz, 1H), 3.85 (s, 3H), 3.81 (s, 3H), 3.46 (s, 3H), 2.58-2.48 (m, 2H), 2.19 (td, J=11.9, 5.7 Hz, 1H), 2.13-2.03 (m, 1H), 1.94 (s, 3H).
13C ЯМР (400 MHz, ДМСО) δ 168.52, 154.78, 154.12, 152.39, 150.41, 150.00, 148.33, 140.62, 139.22, 137.35, 134.78, 129.55, 126.57, 124.45, 123.43, 122.65, 119.41, 108.07, 106.00, 104.89, 60.61, 60.57, 55.83, 48.60, 38.25, 30.03, 22.71.
Найдено (%): C, 70.79; H, 5.69. C28H26N2O5. Вычислено (%): C, 70.73; H, 5.72.
Tпл=140°C.
Синтез N-((1S)-гидроксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1c) осуществляют следующим образом. В колбу, содержащую 30 мг йодколхинола (0.06 ммоль), 0.7 мг Pd(OAc)2 (0.003 ммоль), 2.43 мг PPh3 (0.009 ммоль), 1.2 мг CuI (0.006 ммоль) и 18.3 мг KOAc (0.186 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 4.5 мкл пропаргилового спирта (0.074 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 4:1:1) N-((1S)-2″-гидроксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде кристаллов кремового цвета (21.6 мг, 86%).
1H ЯМР (400 MHz, ДМСО) δ 8.47 (d, J=8.5 Hz, 1H), 7.51 (s, 1H), 7.46 (s, 1H), 6.79 (s, 1H), 6.75 (s, 1H), 4.64-4.68 (m, 1H), 4.56 (s, 2H), 3.84 (s, 3H), 3.79 (s, 3H), 3.42 (s, 3H), 2.16 (dd, 2H), 2.05 (dd, J=12.6, 6.8 Hz, 1H), 1.90 (s, 3H), 1.85 (dd, J=12.0, 6.5 Hz, 1H).
13C ЯМР (400 MHz, ДМСО) δ 168.39, 158.42, 153.73, 152.23, 150.37, 140.59, 137.42, 134.75, 128.69, 126.18, 124.73, 121.81, 108.01, 105.52, 103.21, 60.59, 60.45, 56.22, 54.91, 48.40, 38.37, 30.05, 22.67.
Найдено (%): C, 67.05; H, 6.21. C23H25NO6. Вычислено (%): C, 67.14; H, 6.12.
Tпл=110°C.
Синтез N-((1S)-2″-(1-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1d) осуществляют следующим образом. В колбу, содержащую 50 мг йодколхинола (0.103 ммоль), 1.13 мг Pd(OAc)2 (0.005 ммоль), 4.03 мг PPh3 (0.015 ммоль), 2 мг CuI (0.01 ммоль) и 30.3 мг KOAc (0.309 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 9.3 мкл 3-бутин-2-ола (0.123 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 4:1:1) N-((1S)-2″-(1-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде кристаллов кремового цвета (32.6 мг, 74%).
1H ЯМР (400 MHz, ДМСО) δ 8.43 (d, J=8.4 Hz, 1H), 7.45 (s, 1H), 7.42 (s, 1H), 6.78 (s, 1H), 6.62 (s, 1H), 4.65-4.52 (m, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.76 (d, J=5.7 Hz, 2H), 3.41 (s, 3H), 2.91 (t, J=6.6 Hz, 2H), 2.39 (dd, J=12.8, 6.0 Hz, 1H), 2.15 (dd, J=12.3, 6.2 Hz, 1H), 2.04 (dd, J=12.6, 6.7 Hz, 1H), 1.90 (s, 3H), 1.88-1.81 (m, 1H).
13C ЯМР (400 MHz, ДМСО) δ 168.37, 156.91, 153.46, 152.18, 150.36, 140.59, 136.65, 134.75, 128.49, 126.69, 124.85, 121.21, 107.99, 105.25, 102.91, 60.60, 60.48, 59.03, 55.80, 48.38, 38.41, 31.93, 30.06, 22.67.
Найдено (%): C, 67.81; H, 6.38. C24H27NO6. Вычислено (%): C, 67.75; H, 6.40.
Tпл=125°C.
Синтез N-((1S)-2″-(2-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1е) осуществляют следующим образом. В колбу, содержащую 50 мг йодколхинола (0.103 ммоль), 1.13 мг Pd(OAc)2 (0.005 ммоль), 4.03 мг PPh3 (0.015 ммоль), 2 мг CuI (0.01 ммоль) и 30.3 мг KOAc (0.309 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 9.3 мкл 3-бутин-1-ола (0.123 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 5:1:1) N-((1S)-2″-(2-гидроксиэтил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде кристаллов бежевого цвета (40.9 мг, 93%).
1H ЯМР (400 MHz, ДМСО) δ 8.45 (d, J=8.3 Hz, 1H), 7.50 (s, 1H), 7.45 (s, 1H), 6.79 (s, 1H), 6.70 (s, 1H), 5.49 (d, J=5.1 Hz, 1H), 4.63-4.55 (m, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.41 (s, 3H), 2.16 (dd, J=12.1, 6.1 Hz, 2H), 2.05 (dd, J=12.5, 6.9 Hz, 1H), 1.89 (d, J=10.7 Hz, 3H), 1.85 (dd, J=12.2, 6.6 Hz, 1H), 1.47 (d, J=6.4 Hz, 3H).
13C ЯМР (400 MHz, ДМСО) δ 168.43, 162.01, 153.48, 152.24, 150.39, 140.61, 137.24, 134.77, 128.65, 126.17, 124.79, 121.79, 108.03, 105.55, 101.22, 62.33, 60.60, 60.46, 56.03, 55.83, 48.43, 22.68, 22.03, 18.56.
Найдено (%): C, 67.78; H, 6.39. C24H27NO6. Вычислено (%): C, 67.75; H, 6.40.
Tпл=80°C.
Синтез N-((1S)2″-ацетоксиметил-1′,2′,3′-риметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1f) осуществляют следующим образом. В колбу, содержащую 40 мг йодколхинола (0.082 ммоль), 0.92 мг Pd(OAc)2 (0.004 ммоль), 3.24 мг PPh3 (0.012 ммоль), 1.6 мг CuI (0.008 ммоль) и 24.2 мг KOAc (0.247 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 9.9 мкл пропаргилацетата (0.1 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 6:1:1) N-((1S)-2″-ацетоксиметил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде кристаллов светло-бежевого цвета (14 мг, 37%).
1H ЯМР (400 MHz, ДМСО) δ 8.47 (d, J=8.3 Hz, 1H), 7.56 (s, 1H), 7.49 (s, 1H), 6.99 (s, 1H), 6.79 (s, 1H), 5.22 (s, 2H), 4.64-4.54 (m, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.42 (s, 3H), 2.25-2.11 (m, 2H), 2.08 (s, 3H), 2.06-2.01 (m, 1H), 1.91 (s, 3H), 1.90-1.82 (m, 1H).
13C ЯМР (400 MHz, ДМСО) δ 168.43, 162.01, 153.48, 152.24, 150.39, 140.61, 137.24, 134.77, 128.65, 126.17, 124.79, 121.79, 108.03, 105.55, 101.22, 62.33, 60.60, 60.46, 55.83, 48.43, 38.39, 30.06 22.68, 22.03.
Найдено (%): C, 66.15; H, 6.09. C25H27NO7. Вычислено (%): C, 66.21; H, 6.00.
Tпл=82°C.
Синтез N-((1S)-2″-(8-(метоксикарбонил)октил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1g) осуществляют следующим образом. В колбу, содержащую 50 мг йодколхинола (0.103 ммоль), 1.13 мг Pd(OAc)2 (0.005 ммоль), 4.03 мг PPh3 (0.015 ммоль), 2 мг CuI (0.01 ммоль) и 30.3 мг KOAc (0.309 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 26.7 мкл метилового эфира ундецин-1-оновой кислоты (0.123 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 6:1:1) N-((1S)-2″-(8-(метоксикарбонил)октил)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде коричневого масла (36.8 мг, 65%).
1H ЯМР (400 MHz, ДМСО) δ 8.42 (d, J=8.5 Hz, 1H), 7.44 (s, 1H), 7.42 (s, 1H), 6.78 (s, 1H), 6.57 (s, 1H), 4.63-4.54 (m, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.57 (s, 3H), 3.42 (s, 3H), 2.75 (t, J=7.4 Hz, 2H), 2.15 (td, J=12.0, 5.8 Hz, 2H), 2.07-1.99 (m, 1H), 1.89 (d, J=6.2 Hz, 3H), 1.86 (dd, J=12.7, 5.7 Hz, 1H), 1.68 (dd, J=14.3, 7.1 Hz, 2H), 1.54-1.47 (m, 2H), 1.41-1.18 (m, 10H).
13C ЯМР (400 MHz, ДМСО) δ 173.35, 168.36, 159.13, 153.46, 152.18, 150.36, 140.58, 136.61, 134.76, 131.52, 128.80, 128.68, 128.49, 126.64, 124.84, 121.19, 107.99, 105.23, 101.97, 60.57, 60.46, 55.81, 51.14, 48.35, 33.25, 28.56, 28.50, 28.42, 27.69, 27.21, 24.41, 22.68.
Найдено (%): C, 69.70; H, 7.45. C32H41NO7. Вычислено (%): C, 69.67; H, 7.49.
Синтез N-((1S)-2″-диэтиламинометил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо [5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида (1h) осуществляют следующим образом. В колбу, содержащую 30 мг йодколхинола (0.062 ммоль), 0.97 мг Pd(OAc)2 (0.003 ммоль), 2.4 мг PPh3 (0.009 ммоль), 1.2 мг CuI (0.006 ммоль) и 18.3 мг КОАс (0.186 ммоль) в атмосфере аргона, приливают перегнанный под аргоном MeCN. Затем по каплям прибавляют 10.3 мкл N,N-диэтилпропаргиламина (0.074 ммоль). Полученный раствор перемешивают в течение 3 часов при 60°C, а затем поднимают температуру до 80°C и перемешивают еще 12 часов. Ход реакции контролируют методом TCX. После окончания реакции раствор доводят до комнатной температуры, растворитель удаляют при пониженном давлении. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 5:1:1) N-((1S)-2″-диэтиламинометил-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамид получают в виде кристаллов светло-коричневого цвета (20 мг, 72%).
1H ЯМР (400 MHz, ДМСО) δ 8.45 (d, J=8.6 Hz, 1H), 7.46 (s, 1H), 7.44 (s, 1H), 6.77 (s, 1H), 6.73 (s, 1H), 4.61-4.53 (m, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.73 (s, 2H), 3.41 (s, 3H), 2.54-2.50 (m, 2H), 2.13 (dd, J=12.3, 6.1 Hz, 2H), 2.03 (dd, J=12.5, 7.1 Hz, 1H), 1.88 (s, 3H), 1.86 (s, 2H), 1.82 (d, J=5.8 Hz, 1H), 1.02 (t, J=7.1 Hz, 6H).
13C ЯМР (400 MHz, ДМСО) δ 168.41, 156.02, 153.73, 152.22, 150.35, 140.57, 137.19, 134.76, 128.63, 126.17, 124.75, 121.55, 120.59, 108.02, 105.52, 104.90, 84.81, 62.78, 60.57, 60.51, 55.83, 48.90, 48.38, 46.47, 30.05, 22.70, 12.07.
Найдено (%): C, 69.43; H, 7.39. C27H34N2O5. Вычислено (%): C, 69.50; H, 7.35.
Tпл=148°C.
Биологические испытания
Заявляемое производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида было испытано с целью определения его активности при ингибировании пролиферации опухолевых клеток колориметрическим методом с использованием красителя MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромид). При добавлении красителя в культуры окрашиваются живые клетки за счет восстановления молекулы MTT до нерастворимой формы формазана. Эксперимент проводится в 96-луночном плоскодонном планшете (Costar, USA). Для анализа активности производного использовали клетки человека AsPC-1 (протоковая аденокарцинома поджелудочной железы), HEK-293 (эпителий почки) и линии мышиных клеток L929 (фибробласты мыши), Jurkat (тимома мыши). Набор линий различного происхождения и из разных организмов позволяет исключить случайные эффекты, когда какая-то из линий оказывается более резистентной к препаратам. Эксперименты проводили трижды в разные дни для повышения достоверности данных. Эксперименты проводили в двух форматах: препараты добавляли сразу при засеве клеток или разносили клетки, давали им прикрепляться в течение 12 часов (для эпителиальных клеток и фибробластов), затем разносили препараты в различных концентрациях. Диапазон концентраций составил от 100 мкМ до 1 нМ. Клетки инкубировали с препаратами 72 ч для определения кумулятивного цитотоксичного и цитостатичного эффектов. Анализ проводили с помощью планшетного ридера после растворения кристаллов формазана диметилсульфоксидом при длине волны 540 нм. Активность приведена в виде индексов подавления пролиферации (ИПП), которые подсчитывали по формуле ИПП=1-ОПо/ОПк, где ОПо и ОПк означают оптическую плотность в опыте и контроле соответственно. Примеры ИПП для различных клеточных линий приведены в таблице 1 (Фиг.2). Расчет эффективной концентрации, подавляющей 50% пролиферации (IC50), подсчитывали по концентрации, соответствующей 50% между верхним и нижним плато. Пример определения IC50 и объяснение метода подсчета приведены на Фиг.3. Данные по всем линиям и препаратам по IC50 суммированы в таблице 1 (Фиг.2).
Приведенные данные демонстрируют, что заявляемое производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида 1c и 1d обладает более высокими значениями активности при ингибировании пролиферации опухолевых клеток по сравнению с прототипом - индольным аналогом аллоколхицина.
Заявляемое производное N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида может быть использовано для лечения онкологических заболеваний, связанных с неоваскуляризацией новообразований. Это относится, в частности, к лимфомам, к солидным (твердым) опухолям типа карцином и аденокарцином молочной железы, раку легких и т.д. Кроме того, они могут применяться в терапии в сочетании с другими химиотерапевтическими препаратами, а также после хирургических операций и при облучении.
Применение предложенного производного N-((1S)-1′,2′,3′-триметокси-6,7-дигидро-1H-бензо[5′,6′:5,4]циклогепта[3,2-f]бензофуран-1-ил)ацетамида в качестве активного компонента лекарственного средства для лечения онкологических заболеваний обеспечивает повышение активности при ингибировании пролиферации опухолевых клеток.
![ПРОИЗВОДНОЕ N-(1S)-1',2',3'-ТРИМЕТОКСИ-6,7-ДИГИДРО-1Н-БЕНЗО[5',6':5,4]ЦИКЛОГЕПТА-[3,2-F]БЕНЗОФУРАН-1-ИЛ)АЦЕТАМИДА И ЕГО ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d9/b1/00/16845044a314a5d6c4b4dafc4ad5e312.png)
![ПРОИЗВОДНОЕ N-(1S)-1',2',3'-ТРИМЕТОКСИ-6,7-ДИГИДРО-1Н-БЕНЗО[5',6':5,4]ЦИКЛОГЕПТА-[3,2-F]БЕНЗОФУРАН-1-ИЛ)АЦЕТАМИДА И ЕГО ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d9/b1/00/06f12c377b29306e153c7b842b068284.png)
![ПРОИЗВОДНОЕ N-(1S)-1',2',3'-ТРИМЕТОКСИ-6,7-ДИГИДРО-1Н-БЕНЗО[5',6':5,4]ЦИКЛОГЕПТА-[3,2-F]БЕНЗОФУРАН-1-ИЛ)АЦЕТАМИДА И ЕГО ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/d9/b1/00/1fa11cc71e3183f9e8d7f40a9260055f.png)

