Результат интеллектуальной деятельности: СПОСОБ МОДЕЛЬНО-ДИСКРИМИНАЦИОННОЙ ОЦЕНКИ ФАРМАЦЕВТИЧЕСКОЙ ЭКВИВАЛЕНТНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПОКРЫТЫХ КИШЕЧНОРАСТВОРИМОЙ ОБОЛОЧКОЙ
Вид РИД
Изобретение
Изобретение относится к фармации, фармакологии и клинической фармакологии и касается способа анализа медицинских препаратов. Изобретение позволяет оценивать фармацевтическую эквивалентность воспроизведенных лекарственных средств (ЛС), покрытых кишечнорастворимой оболочкой.
Известен способ оценки фармацевтической эквивалентности лекарственных средств, реализованный в тесте «Растворение», с помощью которого определяют количество действующего вещества, которое в стандартных условиях за определенное время должно перейти в раствор из твердой дозированной лекарственной формы [1]. Способ включает следующие стадии: лекарственные формы помещают в соответствующую среду растворения, предварительно нагретую до T=37±0,05°C, включают аппарат «Вращающаяся корзинка» или «Лопастная мешалка» при определенной скорости вращения (50-100 об/мин) и через время, указанное в частных фармакопейных статьях, или через 45 мин, отбирают аликвоты, фильтруют их и определяют количество действующего вещества, перешедшего в раствор, путем измерения оптической плотности на спектрофотометре при максимальном поглощении изучаемого вещества.
Недостатками данного способа являются:
1. Низкая информативность способа при оценке взаимозаменяемости ЛС: способ не гарантирует подтверждения взаимозаменяемости лекарственных средств у пациентов с болезнями пищеварительного тракта.
2. Способ позволяет определить количественные параметры кинетики растворения ЛС в зависимости от физико-химических свойств активного фармацевтического ингредиента, но без учета экспозиции ЛС в средах с динамически изменяющимися под действием патологического дуодено-гастрального рефлюкса (ДГР) или фармакологической кислотосупрессии значениями pH.
В качестве ближайшего аналога выбран способ оценки фармацевтической эквивалентности лекарственных средств, реализованный в тесте кинетики растворения для твердых дозированных лекарственных форм (ЛФ), таблеток и капсул, покрытых кишечнорастворимой оболочкой [2].
Способ включает следующие стадии: лекарственные формы сначала помещают в среду растворения, нагретую до T=37,0±0,5°C, с pH=1,2±0,05, включают мотор лопастной мешалки, через 2 часа отбирают аликвоту, фильтруют и измеряют количество действующего вещества, затем переносят ЛФ в буферный раствор с pH=6,8±0,05, начинают перемешивание, через 45 мин (если нет других указаний) отбирают пробы, фильтруют и измеряют количество действующего вещества, перешедшего в раствор, методами спектрометрии, высокоэффективной жидкостной хроматографии, масс-спектрометрии, описанными в частной фармакопейной статье.
Недостатками ближайшего аналога являются:
1. Данный способ изучения воздействия высоких значений pH (здесь 6,8±0,05) на стабильность лекарственных форм, защищенных кишечнорастворимыми оболочками, не позволяет дифференцировать влияние среды тонкого кишечника, в которой ЛС должно дезинтегрироваться естественным образом, от влияния патологического ДГР, который может приводить к преждевременному высвобождению ЛС в желудке.
2. Данный способ не позволяет оценивать особенности кинетики растворения ЛС в условиях, соответствующих условиям среды желудка при курсовом применении препаратов, снижающих внутрижелудочную кислотопродукцию.
Задачей настоящего исследования является разработка способа модельно-дискриминационной оценки фармацевтической эквивалентности лекарственных средств, покрытых кишечнорастворимой оболочкой.
Поставленная задача решается благодаря тому, что выбранные условия двухэтапного проведения сравнительного теста кинетики растворения (СКТР) соответствуют по временным характеристикам и параметрам кислотности условиям нахождения ЛС в желудочно-кишечном тракте пациентов с гастроэнтерологической патологией [3, 4].
Техническим результатом заявленного изобретения является повышение точности определения фармацевтической эквивалентности воспроизведенных ЛС, защищенных кишечнорастворимыми оболочками.
Сущность предложенного способа:
1. Способ модельно-дискриминационной оценки фармацевтической эквивалентности лекарственных средств, покрытых кишечнорастворимой оболочкой, заключается в применении двухэтапного сравнительного теста кинетики растворения препаратов для тестирования устойчивости их кишечнорастворимых лекарственных форм к устойчивой медикаментозной кислотосупрессии и патологическому дуоденогастральному рефлюксу, при этом на первом этапе проводится сравнительный тест кинетики растворения путем последовательного помещения по одной единице твердой дозированной лекарственной формы в среду растворения, нагретую до T=37,0±0,5°C, с pH=1,2±0,05, объемом 1000 мл, перемешивания с помощью лопастной мешалки со скоростью 50 об/мин, отбора аликвоты через 2 часа и ее фильтрации, определения в аликвоте количества действующего вещества, перешедшего в раствор, переноса лекарственной формы в фосфатный буферный раствор с рН=6,8±0,05 объемом 1000 мл, перемешивания с помощью лопастной мешалки со скоростью 50 об/мин, отбора аликвоты через 45 мин с восполнением отобранного объема средой растворения, фильтрации аликвоты, измерения в аликвоте количества действующего вещества, перешедшего в раствор, при этом заявленное изобретение отличается тем, что на первом этапе твердую дозированную лекарственную форму помещают в 500 мл кислой среды растворения, перемешивают лопастной мешалкой со скоростью 100 об/мин, переносят в щелочную среду растворения объемом 900 мл с pH=7,0±0,05, перемешивают с помощью лопастной мешалки со скоростью 100 об/мин, отбирают аликвоты через 10, 15, 20, 30, 45 и 60 минут и в дополнительное расчетное время объемом 5 мл с восполнением этого объема средой растворения, аликвоты фильтруют, прибавляют к 2 мл фильтрата аликвот по 400 мкл 0,25 моль/л натрия гидроксида, определяют количество действующего вещества, перешедшего в раствор, параллельно проводят второй этап сравнительного теста кинетики растворения, включающий последовательное помещение по одной единице твердой дозированной лекарственной формы в среду растворения, с рН=4,0±0,05 объемом 500 мл, перемешивание с помощью лопастной мешалки со скоростью 100 об/мин, отбор проб через 10, 15, 20, 30, 45 и 60 минут объемом 5 мл с восполнением этого объема средой растворения, фильтрацию аликвот, прибавление к 2 мл фильтрата аликвот по 400 мкл 0,25 моль/л натрия гидроксида, определение количества действующего вещества, перешедшего в раствор, перенос лекарственной формы в фосфатный буферный раствор с pH=7,0±0,05, объемом 900 мл, перемешивание с помощью лопастной мешалки со скоростью 100 об/мин, отбор проб через 10, 15, 20, 30, 45 и 60 минут и в дополнительное расчетное время.
2. Способ по п. 1, отличающийся тем, что дополнительно определяют точку отбора аликвоты из среды растворения с pH=7,0±0,05 по формуле
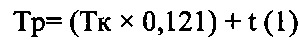 ,
,
где Tp - это расчетная временная точка - время воздействия патологического рефлюкса на твердую дозированную лекарственную форму, покрытую кишечнорастворимой оболочкой;
Тк - это время появления лекарственного средства в крови для референсного препарата, согласно справочным данным;
0,121 - это доля времени, в течение которой согласно справочным данным у больных с патологическим дуоденогастральным рефлюксом при проведении внутрижелудочной pH-метрии регистрируются значения внутрижелудочного pH≥7,0;
t - это 1 минута на равномерное распределение в растворе активного компонента твердой дозированной лекарственной формы.
Между совокупностью существенных признаков заявляемого способа проведения сравнительного теста кинетики растворения и достигаемым техническим результатом существует причинно-следственная связь, а именно в результате моделирования в тесте условий динамических рефлюкс-обусловленных колебаний значений pH или его устойчивого повышения в связи с курсовым применением препаратов, снижающих внутрижелудочную кислотопродукцию, стало возможным применение сравнительного теста кинетики растворения для оценки влияния статистических и динамических изменений внутрижелудочного pH, характерных для пациентов с патологическим дуоденогастральном рефлюксом, на стабильность в желудке твердых лекарственных форм, покрытых кишечнорастворимой оболочкой.
Возможность осуществления заявляемого изобретения показана следующими примерами.
Средства и методы измерений
В качестве объектов исследования используют оригинальные (Препарат Рабепразола натрия; ПР) и воспроизведенные ЛС (ВЛС1, ВЛС2, ВЛС3): таблетки, содержащие 20 мг рабепразола натрия, покрытые кишечнорастворимой оболочкой.
Кинетику растворения изучаемых препаратов проводят на приборе ERWEKA DT 600, Германия (аппарат «Лопастная мешалка»), со скоростью 100 об/мин и температурой нагрева бани 37±0,5°C.
Эквивалентность профилей высвобождения оценивают с помощью факторов различия и сходимости f1 и f2 [5].
Фактор сходимости f2 представляет собой логарифмическое преобразование значения суммы квадратов ошибок, рассчитанных по разности между испытуемым (Tt) и референтным (Rt) препаратом во всех временных точках отбора. При полном сходстве кривых растворения f2 принимает значение 100.
Для подтверждения сходства профилей растворения используют фактор различия f1. Фактор различия f1 отражает процент ошибки между двумя кривыми по всем точкам времени. Он равняется нулю, если профили сравниваемых препаратов идентичны. По мере увеличения различий между двумя профилями растворения значение фактора различия возрастает.
Профили растворения принято считать подобными, если значение f1 находится в пределах диапазона от 0 до 15, а значение f2 - в диапазоне от 50 до 100.
Для каждой временной точки производят расчет стандартных отклонений (RSD, %). Результаты исследования считаются достоверными, если соответствуют действующим нормативным требованиям. Величина относительного стандартного отклонения (RSD, %) не должна превышать 10% для всех временных точек за исключением первой.
Для получения статистически достоверных результатов исследование проводят на 12 таблетках для каждого препарата.
Количественное определение рабепразола натрия проводят на жидкостном хроматографе Shimadzu LC-6A, Япония, со спектрофотометрическим детектором SPD-6A.
Условия хроматографирования:
Подвижная фаза - смесь ацетонитрила с фосфатным буфером с pH=6,8 в соотношении 40:60 v/v. Элюирование осуществлялось в изократическом режиме.
Колонка - ODS Hypersil 125×4,6 мм, 5 мкм
Скорость потока - 0,9 мл/мин
Температура колонки - 22±0,2°C
Длина волны - 280 нм
Объем вводимой пробы - 20 мкл
Общее время анализа - 6 мин
Время удерживания пика рабепразола натрия - 2,9±0,1 мин
Пример 1. Определение дополнительной временной точки (Tp) отбора проб на Этапе I
Рабепразол натрия определяется в крови у здоровых добровольцев через 90 минут, после однократного приема препарата ПР в дозе 20 мг [6].
Tp=(Тк×0,121)+t=(90×0,121)+1=11,89 мин ≈ 12 мин.
Пример 2. Количественное определение рабепразола натрия в аналитах
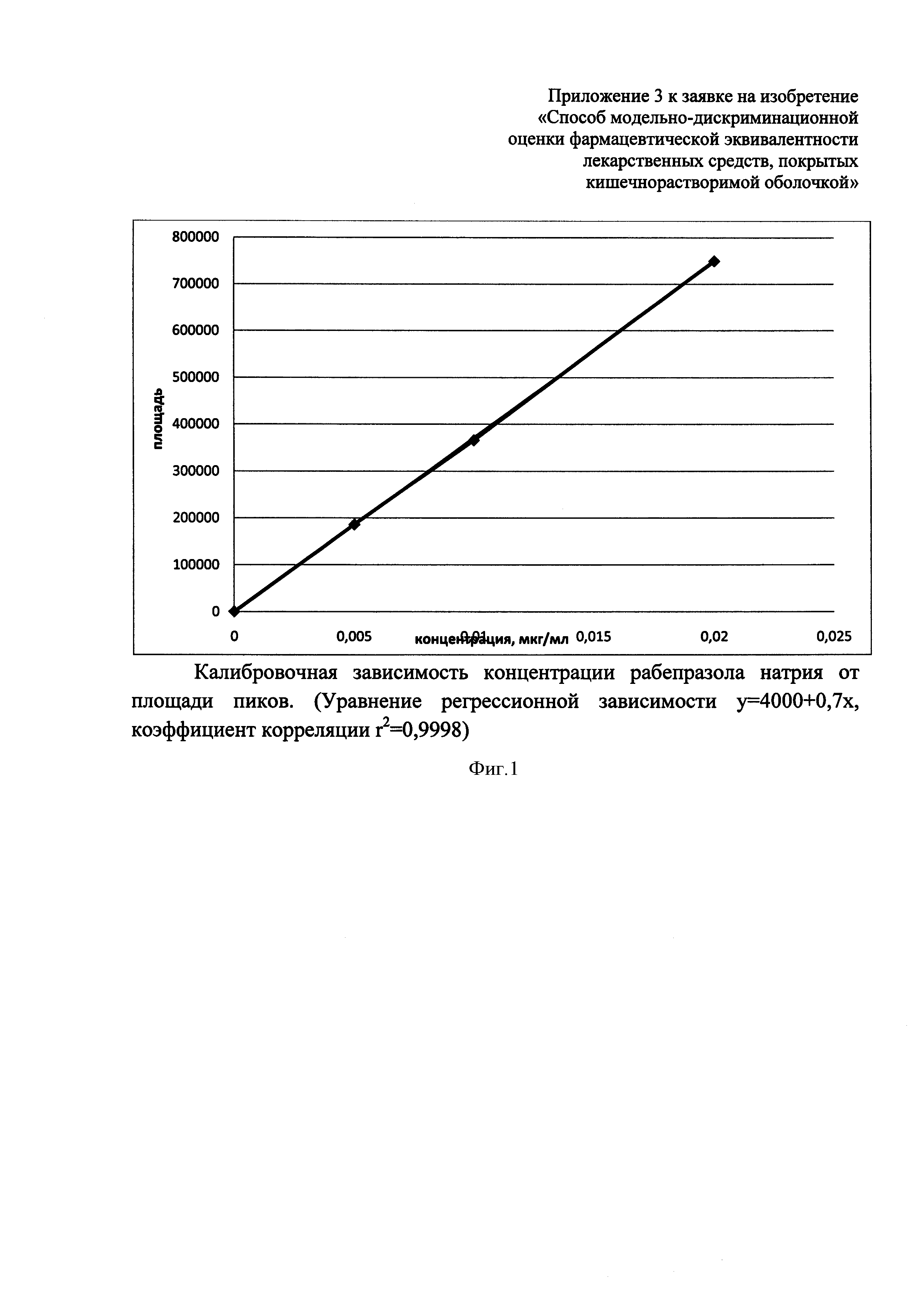
Для количественного определения рабепразола натрия использовали исходный маточный раствор с концентрацией 0,2 мг/мл в метаноле. Из исходного раствора готовили растворы с концентрациями 0,02, 0,01 и 0,005 мг/мл. Для стабилизации полученных стандартных растворов добавляли 0,25М раствор NaOH (из расчета 400 мкл на 2 мл раствора).
В диапазоне концентраций от 0,005 до 0,1 мг/мл наблюдалась линейная зависимость концентрации от площади пиков (фиг. 1). Методика количественного определения рабепразола натрия была валидирована. Правильность и прецизионность методики соответствовала критериям приемлемости.
Пример 3. Определение устойчивости референсного препарата ПР и воспроизведенного лекарственного средства ВЛС1 к патологическому ДГР и к воздействию среды желудка при медикаментозной кислотосупрессии
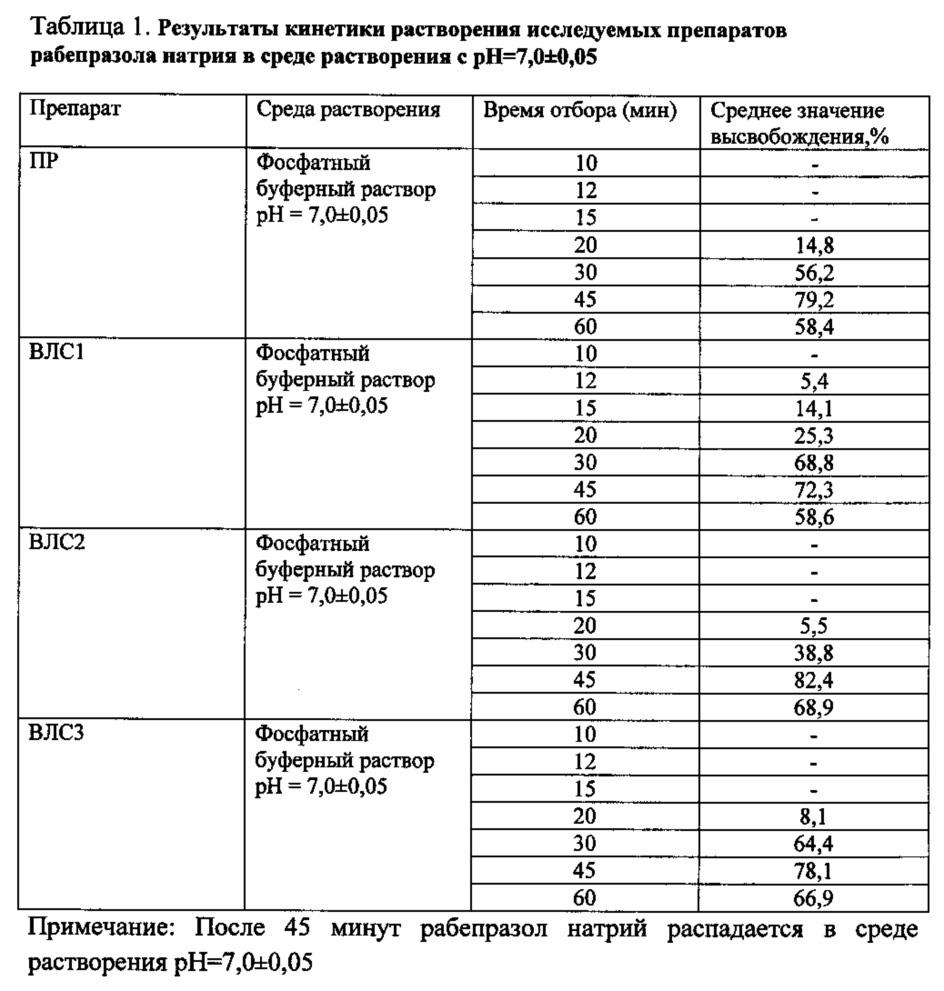
Усредненные значения количества рабепразола натрия (%), высвободившегося в раствор из изучаемых лекарственных средств, приведены в таблице 1.
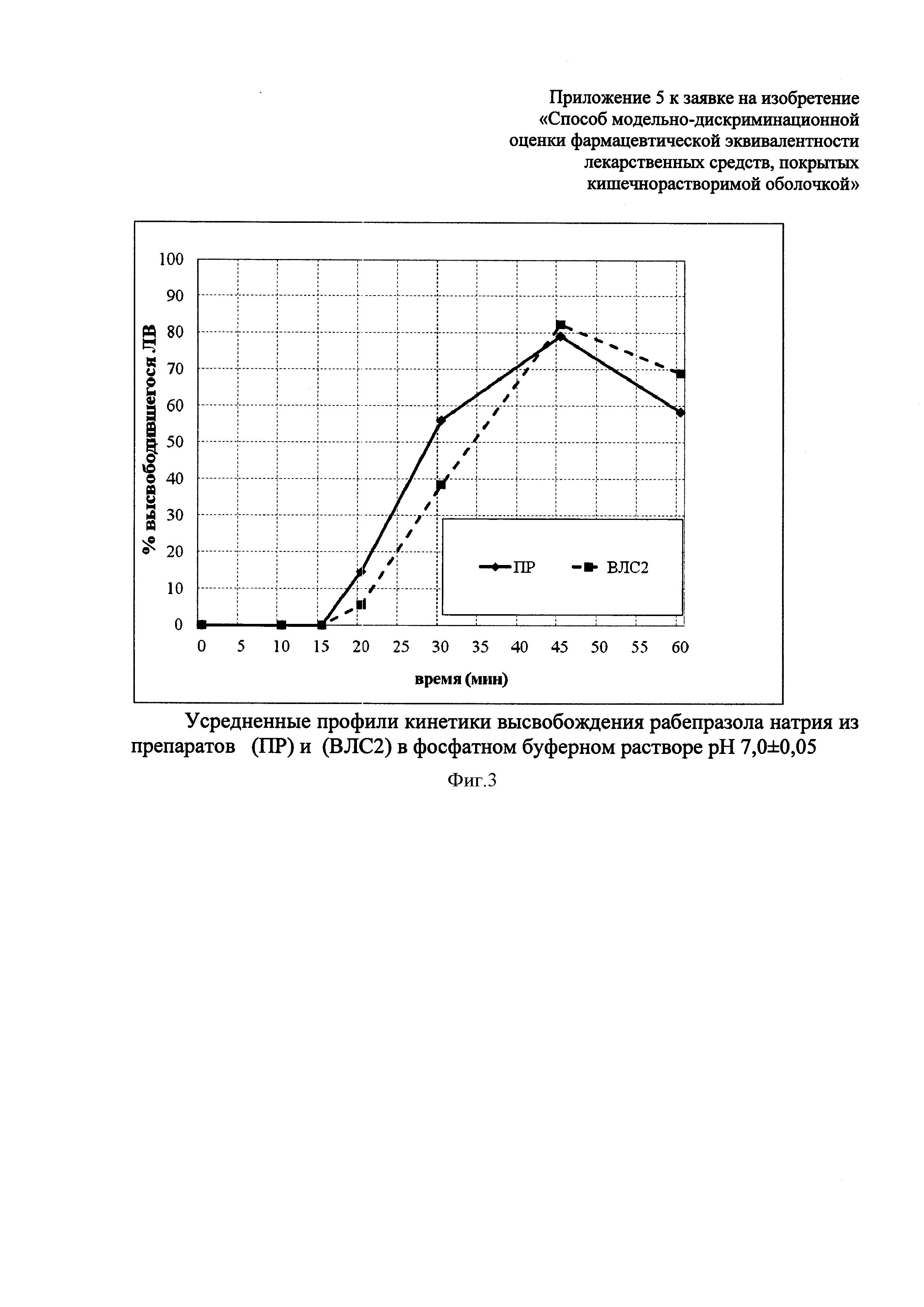
Высвобождение рабепразола натрия в среде растворения с pH=7,0±0,05 из препарата ВЛС1 начинается с 12-ой минуты, а из препарата сравнения ПР - с 20-ой минуты. Согласно данным по фармакокинетике рабепразола натрия и сведениям по доле времени, в течение которого при патологическом рефлюксе внутрижелудочный pH превышает значение 7,0, это означает, что рабепразол натрия будет выходить из лекарственной формы ВЛС1 под влиянием патологического дуоденогастрального рефлюкса уже в желудке. К 45 минутам в раствор переходит из препарата ПР 79,2% рабепразола натрия, из препарата ВЛС1 - 72,3%.
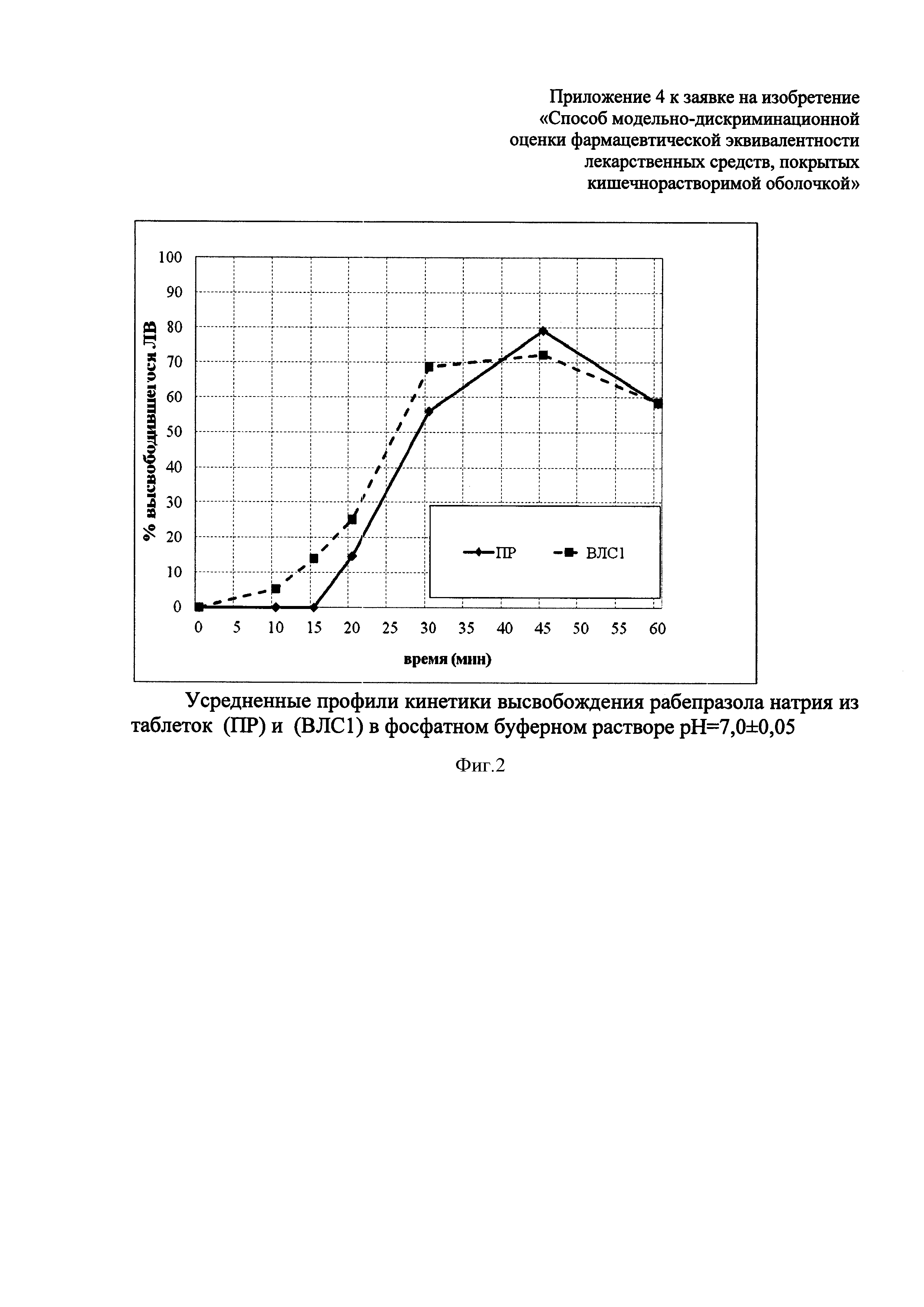
Усредненные профили растворения ПР и ВЛС1 в среде растворения pH=7,0±0,05 представлены на фиг. 2. Изучение кинетики высвобождения рабепразола натрия из исследуемых лекарственных средств в среде растворения pH=7,0±0,05 показало, что имеются различия в динамике высвобождения рабепразола натрия из препарата ВЛС1, по сравнению с ПР. Фактор сходимости составил f2=48,9, а фактор различия - f1=19,9.
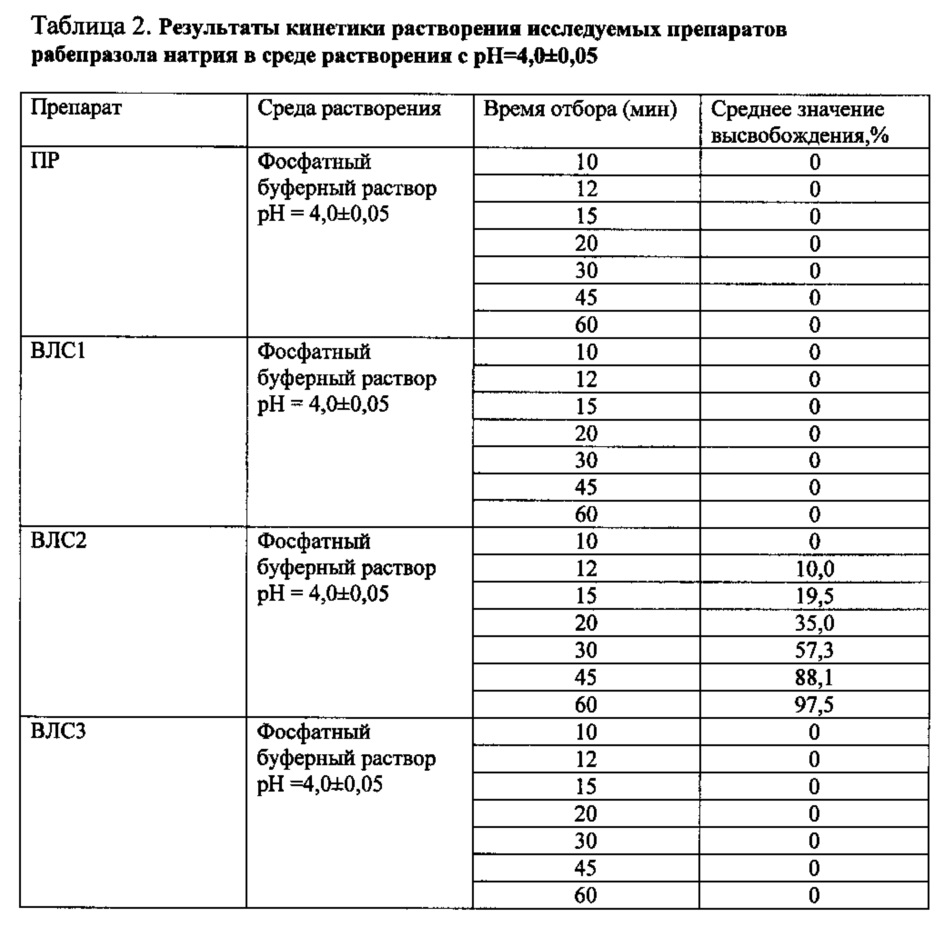
Высвобождения рабепразола натрия из препарата сравнения и воспроизведенного лекарственного средства ВЛС1 в среде растворения pH=4,0±0,05 не происходит (таблица 2).
Таким образом, препарат ВЛС1 неустойчив к действию высокоамплитудных колебаний внутрижелудочного pH, связанных с патологическим ДГР, но устойчив к условиям фармакологической супрессии внутрижелудочной кислотопродукции. Препарат ПР устойчив к воздействию патологического ДГР и фармакологической супрессии кислотопродукции.
Пример 4. Определение устойчивости референсного препарата ПР и воспроизведенного лекарственного средства ВЛС2 к патологическому ДГР и к воздействию среды желудка при медикаментозной кислотосупрессии
Усредненные значения количества рабепразола натрия (%), высвободившегося в раствор из изучаемых лекарственных средств (таблетки 20 мг), приведены в таблице 1. Высвобождение рабепразола натрия в среде растворения с pH=7,0±0,05 из препаратов ВЛС2 и ПР начинается с 20-ой минуты. К 45 минутам в раствор переходит из препарата сравнения ПР 79,2% рабепразола натрия, а из препарата сравнения ВЛС2 - 82,4%.
Изучение кинетики высвобождения рабепразола натрия из исследуемых лекарственных средств в среде растворения pH 7,0±0,05 показало, что имеются различия в динамике высвобождения рабепразола натрия из препарата ВЛС2, по сравнению с ПР. Фактор сходимости составил f2=52,2, а фактор различия - 26,2.
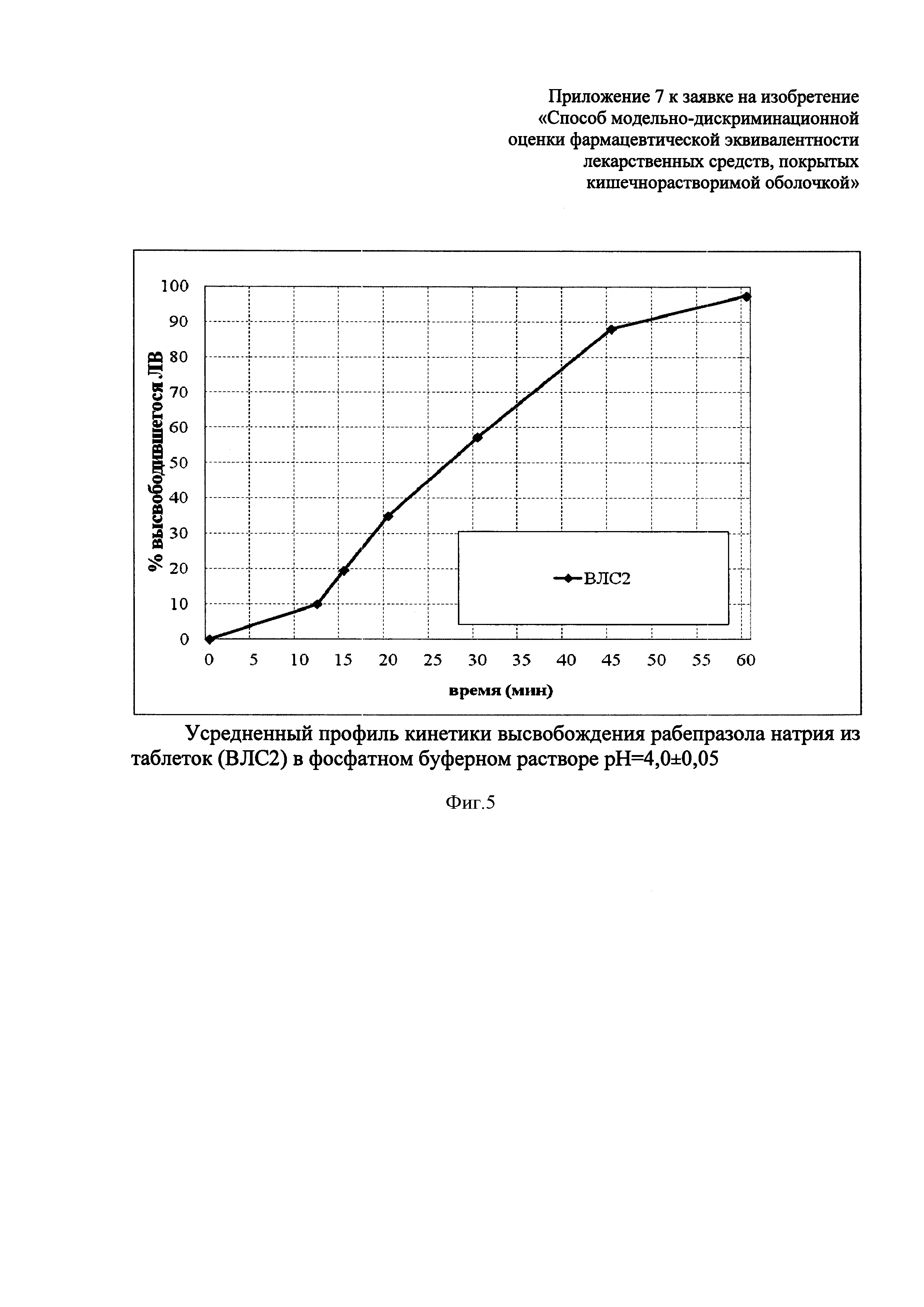
В среде растворения с pH 4,0±0,05 высвобождение рабепразола натрия происходит только из таблеток ВЛС2 (таблица 2, фиг. 5.), из препарата ПР высвобождения изучаемого вещества не происходит. Высвобождение рабепразола натрия из препарата ВЛС2 начинается с 12-й минуты и составляет в среднем 10,0%. Через час в раствор переходит 97,5% изучаемого вещества.
Высвобождение рабепразола натрия из таблеток ВЛС2 в среде растворения с pH=4,0±0,05 свидетельствует о неустойчивости его кишечнорастворимой оболочки в среде желудка с pH=4,0, соответствующим среднесуточным значениям pH при адекватной курсовой кислотосупрессии.
Действующее вещество не должно выходить в раствор с pH=4,0±0,05 из ЛС, защищенного от действия соляной кислоты желудка. Если действующее вещество выходит в раствор, это свидетельствует о нестабильности такого ЛС в среде желудка при медикаментозной супрессии кислотопродукции.
Пример 5. Определение устойчивости референсного препарата ПР и воспроизведенного лекарственного средства ВЛС3 к патологическому ДГР и к воздействию среды желудка при медикаментозной кислотосупрессии
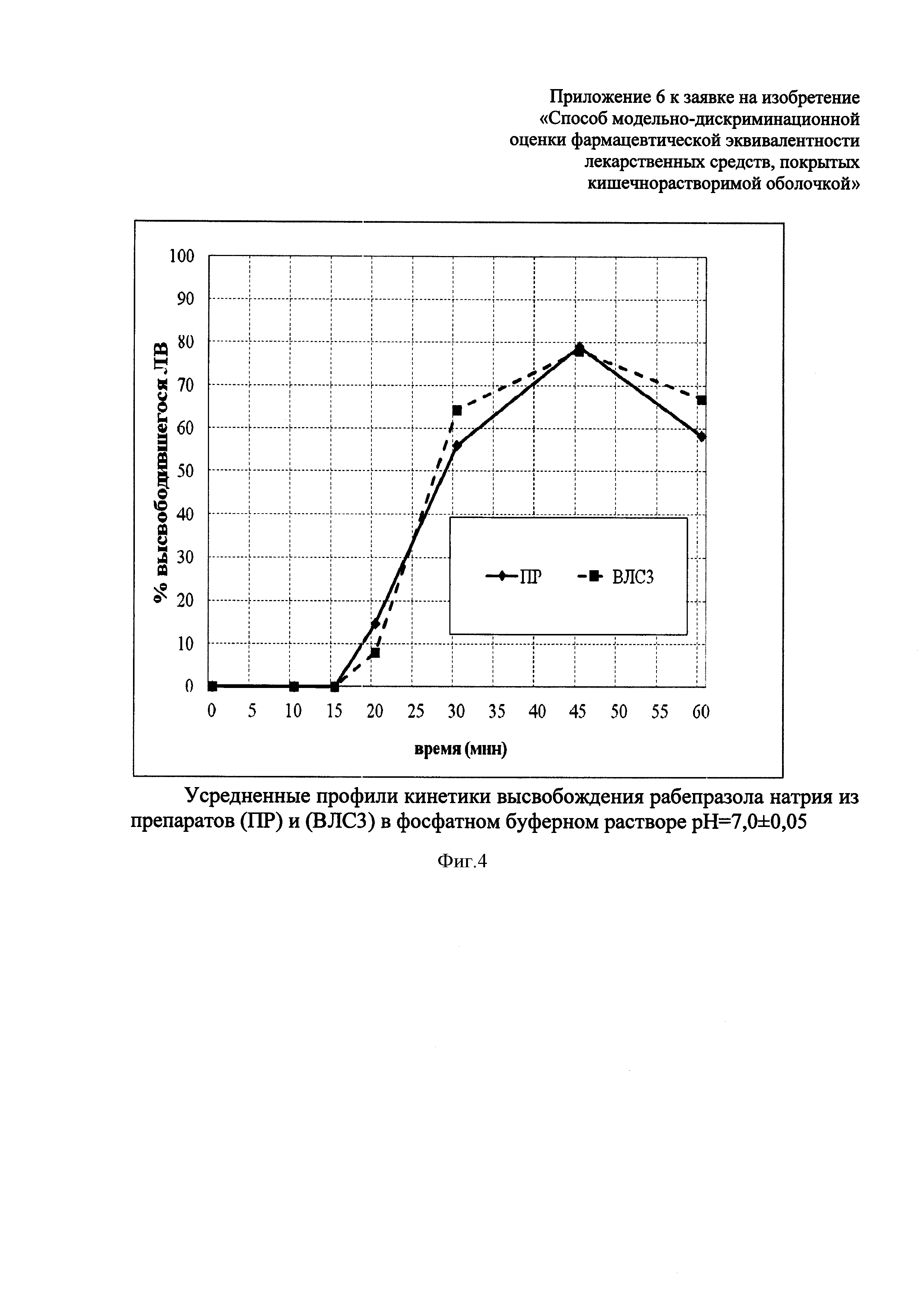
Изучение кинетики высвобождения рабепразола натрия из исследуемых лекарственных средств в среде растворения pH 7,0±0,05 показало, что профили кинетики растворения из препарата ВЛС3, по сравнению с ПР (фиг. 4), сходны. Фактор сходимости составил f2=65,6, а фактор различия - f1=0,44. Высвобождение рабепразола натрия в среде растворения с pH=7,0±0,05 из препаратов ВЛС3 и ПР начинается с 20-ой минуты.
Высвобождения рабепразола натрия из препарата сравнения и воспроизведенного лекарственного средства ВЛС3 в среде растворения pH=4,0±0,05 не происходит.
Приведенные данные свидетельствуют об устойчивости лекарственной формы ВЛС3 к воздействию патологического ДГР и среды желудка при устойчивой фармакологической кислотосупрессии.
Представленные примеры не ограничивают объем притязаний настоящего изобретения и служат только для цели иллюстрации.
СПИСОК СОКРАЩЕНИЙ
ВЛС1 - воспроизведенное лекарственное средство №1
ВЛС2 - воспроизведенное лекарственное средство №2
ВЛС3 - воспроизведенное лекарственное средство №3
ВЛС4 - воспроизведенное лекарственное средство №4
ВК - аппарат «Вращающаяся корзинка»
ВЭЖХ - высокоэффективная жидкостная хроматография
ДГР - дуоденогастральный рефлюкс
ЛМ - аппарат «Лопастная мешалка»
ЛП - лекарственный препарат
ЛС - лекарственное средство
ЛФ - лекарственная форма
ПР - препарат рабепразола натрия (оригинальный)
Тр - расчетная временная точка - время воздействия патологического рефлюкса на твердую дозированную лекарственную форму, покрытую кишечнорастворимой оболочкой
Тк - время появления лекарственного средства в крови для референсного препарата, согласно справочным данным
СТКР - сравнительный тест кинетики растворения
f1 - фактор различия
f2 - фактор сходимости
pH - водородный показатель
ЛИТЕРАТУРА
1. Руководство по экспертизе лекарственных средств / Под ред. проф. А.Н.Миронова. Том 2. - М.: Гриф и К, 2013. - С. 177.
2. ОФС 42-0135-09//XII государственная Фармакопея Российской Федерации, часть 2.
3. Fuchs К.Н., DeMeester T.R., Hinder R.A. et al. Computerized Identification of Pathologic Duodenogastric Reflux Using 24-hour Gastric pH Monitoring. Ann.Surg. - 1991. - Vol. 213. - N1. - P. 13-20.
4. Bell NJ, Burget D, Howden CW, et al. Appropriate acid suppression for the management of gastro-oesophageal reflux disease. Digestion - 1992 - Vol. 51. - P. 59-67.
5. Moore J.W. and Flanner H.H. Mathematical Comparison of Dissolution profiles // Pharm Technol - 1996. - Vol. 20. - No. 6. - P. 64-74.
6. Сереброва С.Ю. Сравнительная клиническая фармакология современных ингибиторов протонной помпы: автореф. дис.… докт. мед. наук. - М., 2009.