Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ МЕТОКСИБЕНЗОЙНЫХ КИСЛОТ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения алкиловых эфиров метоксибензойных кислот.
4-Метоксибензойная или анисовая кислота содержится в анисовом, фенхелевом и ряде других эфирных масел. Анисовая кислота обладает антисептическими свойствами. В исследовательской органической химии она используется в качестве маркера. Эфиры анисовой кислоты применяются в фармакологии, так как они являются антагонистами дофаминовых рецепторов [G. Jaccard, Р-А. Carrupt, J. Lauterwein // Mag. Res. Chem. 1988, 26, 239-244]. Кроме того, эфиры метокси- и гидроксибензойных кислот обладают антифидантными свойствами.
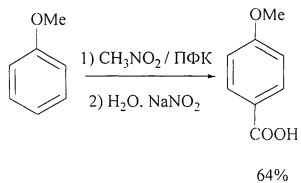
В работе [V.A. Aksenov, N.A. Aksenov, O.N. Nadein, I.V.Aksenova // Synt. Commun. 2012, 42(4), 541-547] описан метод получения 4-метоксибензойной кислоты из анизола. Так, смесь анизола, нитрометана и полифосфорной кислоты кипятят при 90-95°С в течение 5-8 ч. Затем реакционную смесь выливают в воду при интенсивном перемешивании и охлаждают до 0°С, добавляют нитрит натрия. Полученную смесь перемешивают при данной температуре 15 минут и осаждают 4-метоксибеизойную кислоту. Выход продукта составил 64%.
Недостатки метода
1. Использование дорогостоящего и токсичного реагента нитрометана.
2. Необходимость охлаждения и интенсивного перемешивания.
3. Образование большого количества отходов (CH3NO2, NaNO2, Na3PO4).
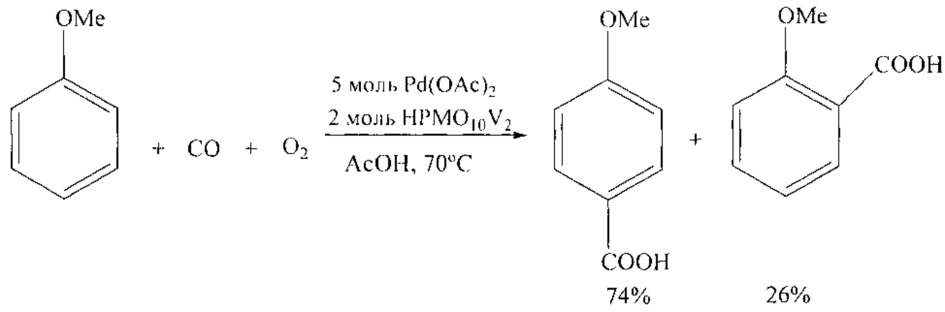
Анизол и его гомологи были подвергнуты окислительному карбонилированию оксидом углерода и кислородом (1:1, давление 0.5 атм) с использованием катализатора Pd(OAc)2, промотированного с помощью HPMoV. [S. Ohashi, S. Sakaguchi and Y. Ishii // Chem. Commun. 2005, 486-488].
Реакция проходит селективно с образованием пара-анисовой и орто-анисовой кислот с выходом 88% (3:1).
Недостатки методов
1. Использование дорогостоящих катализаторов: Pd(OAc)2 и HPMo10V5
2. Необходимость проведения эксперимента в среде агрессивной уксусной кислоты.
3. Высокая пожаро- и взрывоопасность методов из-за необходимости использования СО и кислорода.
4. Все реакции карбонилирования проводятся в специальных аппаратах высокого давления.
В работе [М. Asadullah, Y. Taniguchi, К. Kitamura, Y. Fujiwara // Appl. Organomet. Chem. 1988, 12, 277-279] синтез анисовой кислоты осуществлен карбоксилированием анизола монооксидом углерода в присутствии Pd(OAc)2, пероксодисульфата калия в трифторуксусной кислоте (TFA) при комнатной температуре.
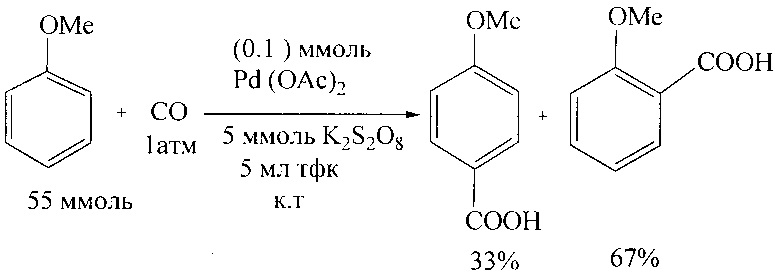
Недостатки метода
1. Применение дорогостоящих реагентов: Pd(OAc)2, CF3COOH, (CF3CO)2O.
2. Значительная продолжительность реакции (48-72 ч).
3. Эксперимент проводится в среде агрессивной трифторуксусной кислоты.
Как известно, ртутьорганические соединения под действием палладиевых катализаторов вступают в реакцию с монооксидом углерода в водных или спиртовых средах, что используется для получения карбоновых кислот или сложных эфиров. Карбоксильная группа вводится избирательно по связи C-Hg. При этом ртуть (0) выделяется в качестве побочного продукта. Выход эфиров составляет 70% и 79% соответственно в зависимости от природы ртутьорганического соединения (Hg(OOCCH3) и Hg(OOCCF3)) [W.С. Baird, R.L. Hartgerink, J.Н. Surridge // J. Org. Chem. 1985, 50 (23), 4601-4605].
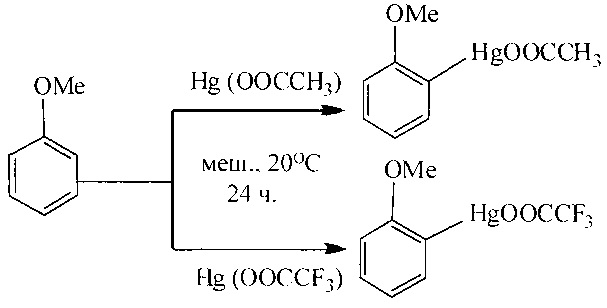
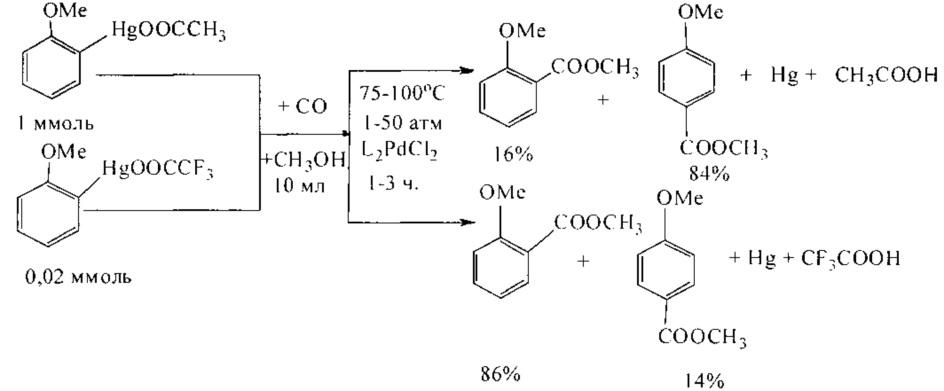
Недостатки метода
1. Использование высокотоксичных соединений ртути.
2. Многостадийность процесса.
3. Необходимость проведения процесса под давлением до 50 атм.
4. Применение дорогостоящего палладиевого катализатора.
В работе [T. Jintoku, Y. Fujiwara, I. Kawata, Т. Kawauchi, H. Taniguchi // J. Organomet. Chem. 1990, 385(2), 297-306] описано получение ароматических кислот карбонилированием анизола под действием палладиевых катализаторов.
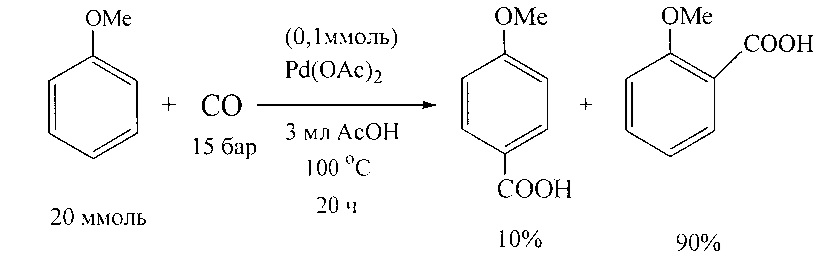
Недостатки методов
1. Использование дорогостоящего катализатора на основе соединений палладия.
2. Необходимость проведения реакции в агрессивной среде уксусной кислоты.
3. Значительная продолжительность реакций (до 20 ч).
4. Все реакции карбонилирования проводятся в специальных аппаратах высокого давления.
5. Образование большого количества отходов.
Авторами предлагается способ получения алкиловых эфиров метоксибензойных кислот, не имеющий вышеперечисленных недостатков.
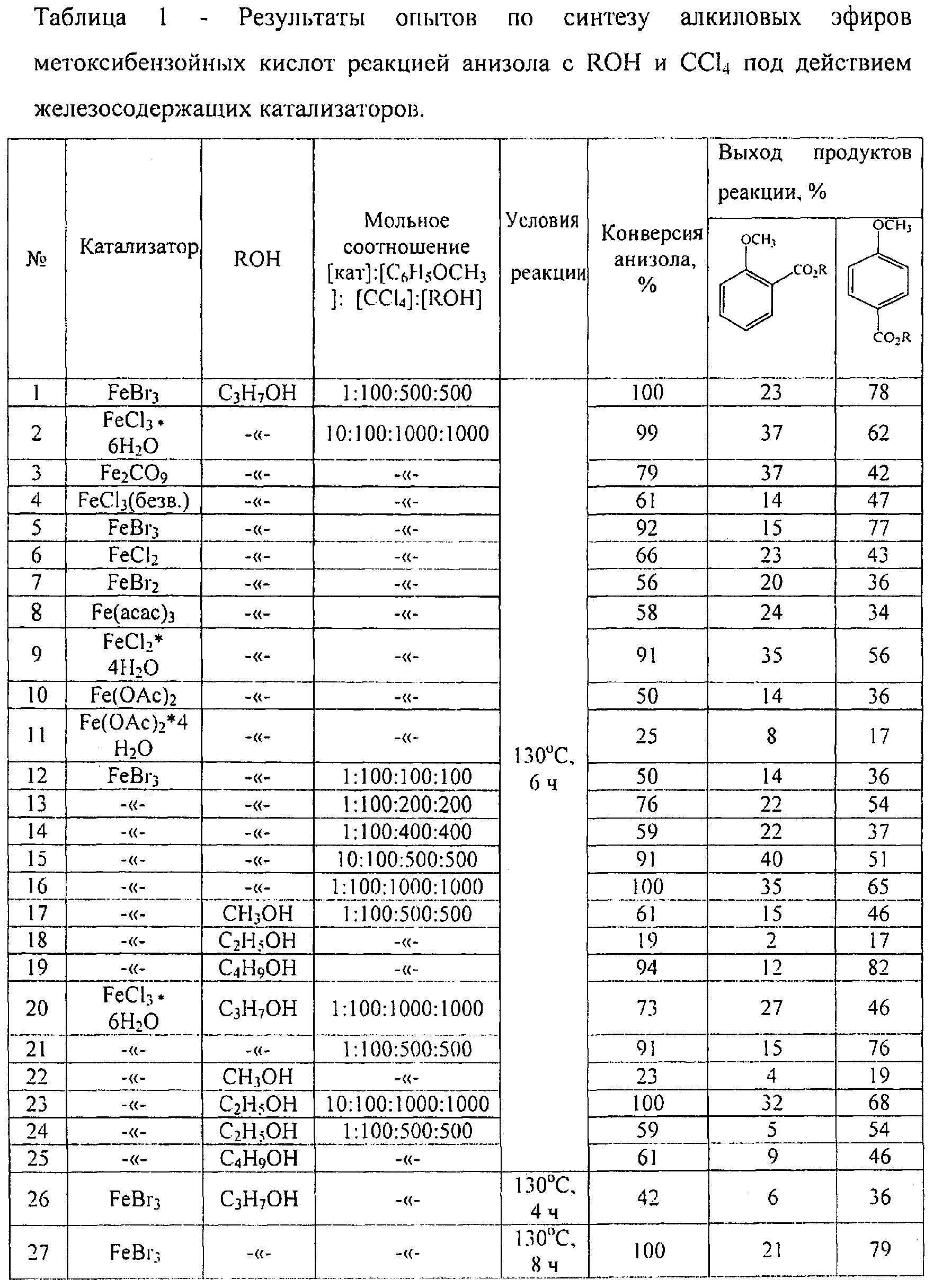
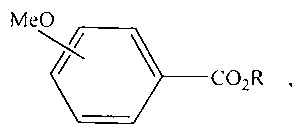
Сущность способа заключается во взаимодействии анизола с четыреххлористым углеродом и спиртом в присутствии соединений железа из ряда Fe(acac)3, Fe(OAc)2, Fe(OAc)2*4H2O, FeCl2*4H2O, FeCl3*6H2O, FeCl2, FeBr3, FeCl3 при температуре 130°C в течение 4-8 ч при мольном соотношении [Fe]:[анизол]:[CCl4]:[спирт]=1-10:100:100-1000:100-1000. Наиболее эффективными катализаторами являются FeBr3, FeCl3*6H2O при температуре 130°С и продолжительности реакции 6 ч и соотношении [Ре]:[анизол]:[СС14]:[спирт]=1:100:500:500, выход алкиловых эфиров п-метоксибензойной кислоты достигает 82%, о-метоксибензойной кислоты составляет 40%.
Синтез проводят в атмосфере аргона.
В отсутствие катализатора и CCl4 реакция не проходит.
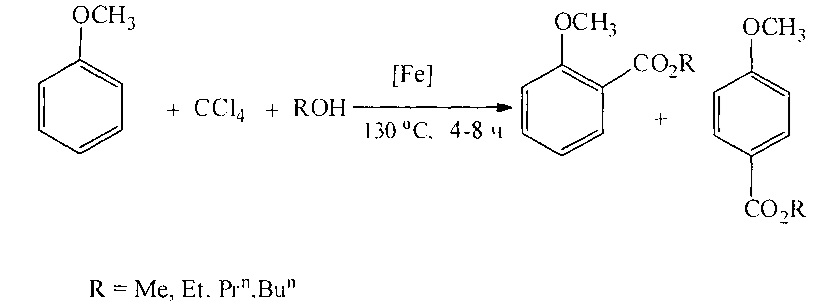
Преимущества предлагаемого метода
1. Высокий выход целевых продуктов.
2. Селективность процесса.
3. Доступность и дешевизна исходных реагентов и катализатора.
4. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
Предлагаемый способ поясняется примерами.
ПРИМЕР 1. Реакцию проводили в стеклянной объемом 17 мл при регулируемом нагреве ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали. В ампулу под аргоном загрузили 0,005 мг (1 моль) железосодержащего катализатора FeBr3, 0,2 мл (100 ммоль) анизола, 0,87 мл (500 ммоль) четыреххлористого углерода и 0,67 мл (500 ммоль) пропилового спирта. Запаянную ампулу поместили в автоклав, автоклав герметично закрыли и нагревали при 130°С в течение 6 часов с постоянным перемешиванием. После окончания реакции автоклав охлаждали до 20°С, ампулу вскрывали, реакционную массу нейтрализовали Na2CO3, кипятили в петролейном эфире в течение 10-15 минут и фильтровали через бумажный фильтр. Растворитель отгоняли, остаток перегоняли в вакууме.
ПРИМЕРЫ 2-25. Аналогично примеру 1. Результаты приведены в таблице 1.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и справочными данными.
Пропиловый эфир орто-метоксибензойной кислоты
Выход 40%. Т кип. 115-116°С/1,5 мм рт.ст. [Словарь органических соединений / Под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]). Спектр ЯМР 13С (δ, м.д.): 117.54 (С1), 159.11 (С2), 112.02 (С3), 135.57 (С4), 120.83 (С5), 133.31 (С6), 55.94 (ОСН3), 166.34 (СОО), 66.40 (CO2CH2CH2CH3), 22.16 (CO2CH2CH2CH3), 10.53 (CO2CH2CH2CH3). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.03 т (3Н, СН3, J 6 Гц), 1.72-1.84 м (2Н, СН2СН2СН3), 4.23-4.28 м (2Н, СН2СН2СН3), 6.95-7.02 м (1Н, С5Н), 6.99-7.02 м (1Н, С3Н), 7.42-7.50 м (1Н, С4Н), 7.77-7.85 м (1Н, С6Н), 3.91 с (3Н, ОСН3). Масс-спектр, m/z (Iотн(%)): 194 [М]+ (15), 165(2), 152(5), 135(100), 123(30), 105(25), 77(40), 64(7), 51(10).
Пропиловый эфир пара-метоксибензойной кислоты
Выход 78%. Т кип. 112-115°С/2 мм рт.ст. (Ткип. 176°С/45 мм рт.ст. [Словарь органических соединений / Под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]). Спектр ЯМР 13С (δ, м.д.): 122.9 (С1), 131.54 (С2,6), 113.55 (С3.5), 163.50 (С4), 55.41 (ОСН3), 166.46 (СОО), 66.24 (CO2CH2CH2CH3), 22.17 (CO2CH2CH2CH3), 10.54 (CO2CH2CH2CH3). Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.05 т (3Н, СН3, J 7.6 Гц), 1.7-1.85 м (2Н, СН2СН2СН3), 4.27 т (2Н, СН2СН2СН3, 6.8 Гц), 6.93 д (2Н, С3.5Н, J 8 Гц), 8.02 д (1Н, С4Н, J 8 Гц), 3.88 с (3Н, ОСН3).
Масс-спектр, m/z (Iотн.(%)): 194 [М]+ (15), 165(2), 152 (50), 135(100), 107(10), 92 (15), 77 (20), 41(5).
Этиловый эфир орто-метоксибензойной кислоты
Выход 32%. Т кип. 135-136°С/10 мм рт.ст. ((Ткип. 246-248°С [Словарь органических соединений/ Под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]).
Масс-спектр, m/z (Iотн.(%)): 180 [М]+ (10), 165(2), 135(100), 133(45), 105(20), 77(45), 64(10), 51(10).
Этиловый эфир пара-метоксибензойной кислоты
Выход 68%. Т кип. 133-134°С/10 мм рт.ст. (Ткип. 263°С [Словарь органических соединений / под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160])
Масс-спектр, m/z (Iотн.(%)): 180 [М]+ (30), 165(2), 152(15), 135(100), 107(10), 92(15), 77(20), 64(5).
Метиловый эфир орто-метоксибензойной кислоты
Выход 15%. Т кип. 126-128°С/10 мм рт.ст. (Ткип. 245-246°С [Словарь органических соединений/ Под ред. И.Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]).
Масс-спектр, m/z (Iотн.(%)): 166 [М]+ (25), 135(100), 120 (5), 92(15), 77(60), 51(20), 45(2).
Метиловый эфир пара-метоксибензойной кислоты
Выход 46%). Т кип. 123-124°С/10 мм рт.ст. (Ткип. 256°С [Словарь органических соединений/ Под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]).
Масс-спектр, m/z (Iотн..(%)): 166 [М]+ (30), 135(100), 107(15), 92(15), 77(25), 64(15).
Бутиловый эфир орто-метоксибензойной кислоты
Выход 12%. Т кип. 120-122° С/2 мм рт.ст. (Ткип. 112°С/1.2 мм рт.ст [G. Yohe // Transactions of the Illionis State Academy of Science. 1950, 43, 75-76].
Масс-спектр, m/z (Ioтн. (%)): 208 [M]+ (15), 152(10), 105 (25), 92(20), 77(40), 51(5), 41(10).
Бутиловый эфир пара-метоксибензойной кислоты
Выход 82%. Т кип. 122-124°С/2 мм рт.ст. (Ткип. 183°С/40 мм рт.ст [Словарь органических соединений / Под ред. И. Хейльборна и Г.М. Бэнбери М., 1949. Т. 1, 160]).
Масс-спектр, m/z (Iотн..(%)): 208 [М]+ (15), 152(90), 135(100), 107(15), 92(20), 77(25), 64(10), 41(10).
Другие примеры, подтверждающие способ, приведены в таблице 1.