Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ 4-БИФЕНИЛКАРБОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Изобретение относится к области органического синтеза, в частности к способу получения алкиловых эфиров 4-бифенилкарбоновой кислоты.
Бифенилкарбоновые кислоты находят широкое применение в фармацевтической химии. Производные 4-бифенилкарбоновой кислоты обладают противомикробным и антибактериальным действием [Aakash D., Sandeep J., Prabodh С.S., Prabhakar V., Mahesh K., and Chander P. D. // Polish Pharmaceutical Society. 2010. V. 67. № 3. P. 255-259]. Кроме того, бифенилкарбоновые кислоты являются перспективными мономерами для получения композиционных материалов и жидкокристаллических термотропных полимеров. Отличительной особенностью таких полимеров является исключительно высокая прочность и термостойкость, что обеспечивает их широкое применение в оптоэлектронике, приборостроении, аэрокосмической технике [Юнкова Т.А., Лебедева Н.В., Кошель С.Ж. и др. // Известия высших учебных заведений. Химия и Химическая технология. 2007. Т. 50. Вып. 4. С. 31-34; Юнкова Т.А., Лебедева Н.В., Кошель С.Ж. и др. // Известия высших учебных заведений. Химия и Химическая технология. 2006. Т. 49. Вып. 3. С. 11-13].
В работе [Aakash D., Sandeep J., Prabodh С.S., Prabhakar V., Mahesh K., and Chander P. D. // Polish Pharmaceutical Society. 2010. V. 67. № 3. P. 255-259] синтез метилового эфира 4-бифенилкарбоновой кислоты (2) осуществлен из соответствующей кислоты (1) с последующим его превращением в гидразин-гидразон 4-бифенилкарбоновой кислоты (3а-g), обладающей антимикробной и антибактериальной активностью. Выход (2) составил 84%.
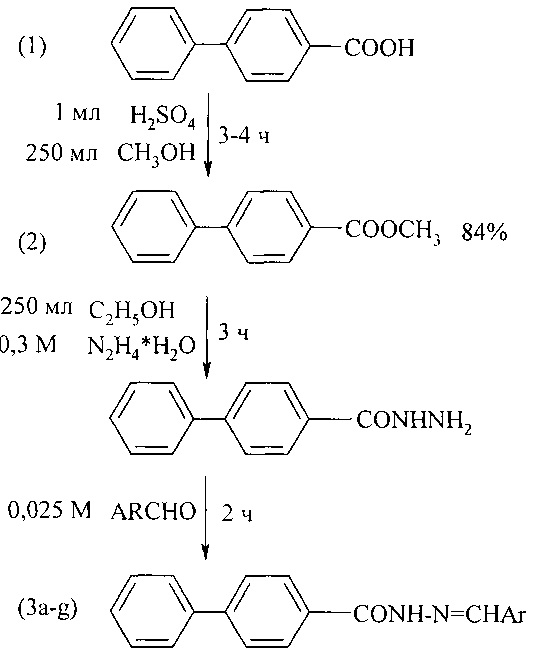
Недостатки метода
1. Дорогостоящий исходный реагент - 4-бифенилкарбоновая кислота.
2. Использование концентрированной серной кислоты, что приводит к коррозии технологического оборудования.
3. Серная кислота является прекурсором.
4. Образование токсичных отходов.
В работах [Юнкова Т.А., Лебедева Н.В., Кошель С.Ж. и др. // Известия высших учебных заведений. Химия и Химическая технология. 2007. Т. 50. Вып. 4. С. 31-34] бифенилкарбоновые кислоты получают окислением алкилбифенилов. Так, окислением метилбифенилов (4) при температуре 90°С и в присутствии ацетата кобальта, ацетата марганца и бромистого натрия получены 2-, 3- и 4-бифенилкарбоновые кислоты (5, 6, 1) с выходом 92-97%.
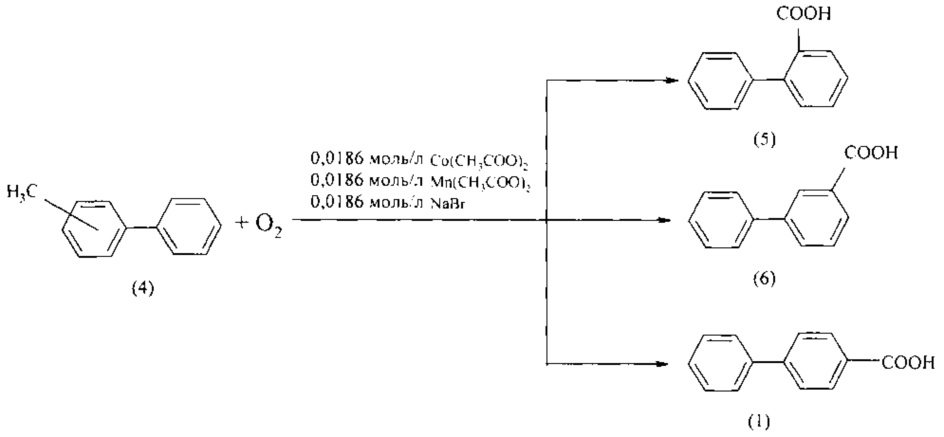
Недостатки метода
1. Дорогостоящие исходные реагенты - 2-, 3-, 4-метилбифенилы.
2. Высокая пожаро- и взрывоопасность метода из-за необходимости использования кислорода под давлением.
3. Образование и обезвреживание отходов.
Представляет интерес метод получения бифенилкарбоновых кислот (1, 5, 6) путем жидкофазного окисления смеси метилбифенилов (4) в уксусной кислоте в присутствии кобальтового катализатора, активированного добавками соединений марганца, циркония и брома при 90°С. Для окисления использовали смесь метилбифенилов (4), полученную при жидкофазном дегидрировании продуктов алкилирования толуола циклогексанолом. Выход (1, 5, 6) составил 80% [Юнкова Т.А., Лебедева Н.В., Кошель С.Ж. и др. // Известия высших учебных заведений. Химия и Химическая технология. 2006. Т. 49. Вып. 3. С. 11-13].
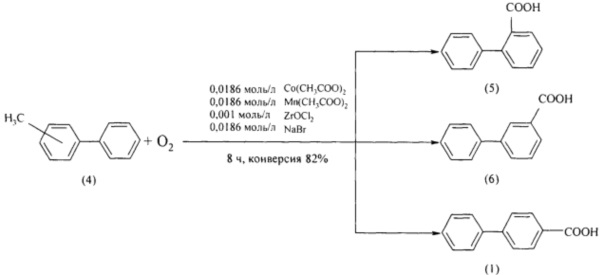
Недостатки метода
1. Дорогостоящий исходный реагент.
2. Дорогостоящий катализатор гипохлорит циркония.
3. Реакция проводится в уксусной кислоте, которая является прекурсором.
4. Коррозия оборудования.
5. Образование большого количества отходов.
Известен способ получения 4-бифенилкарбоновой кислоты (1) окислением 4-ацетилбифенила (7) перманганатом калия. Перманганат калия добавляют к кипящей водной суспензии 4-ацетилбифенила (7) (в шесть приемов с интервалом 45 мин) и затем реакционную массу выдерживают в течение 1 ч при кипячении [GullM., Turner E.E., LXXIII. Orientation-Effectsin in the Diphenyl Series, Part VII. J. Chem. Soc. 1929. 498]. Выход целевой кислоты составляет 80%.
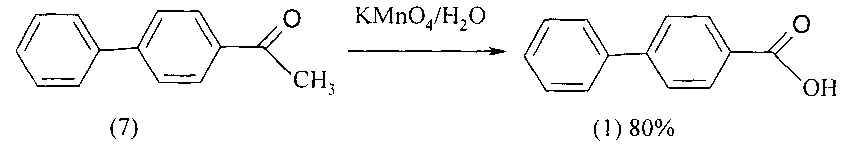
Недостатки метода
1. Использование дорогостоящих исходных реагентов - 4-ацетилбифенила и перманганата калия.
2. Перманганат калия является прекурсором.
3. Образование большого количества сточных вод.
4-Бифенилкарбоновую кислоту (1) можно получить окислением 4-ацетилбифенила (7) гипохлоритом калия, который постепенно добавляют к кипящей водной суспензии 4-ацетилбифенила (7) и затем выдерживают при кипячении до завершения реакции [Реактивы. Особо чистые вещества. Монокристаллы. Сцинциляторы. Методы анализа. Вып. 5. Инф. карта № 2342-69. НИИТЭХИМ - ЦСИФ. 1969]. Выход 4-бифенилкарбоновой кислоты составляет 59-60%.
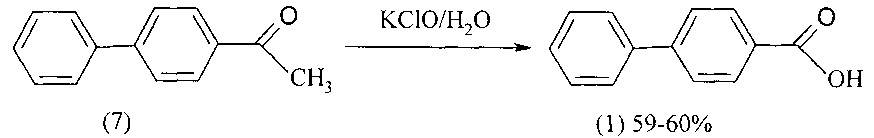
Недостатки метода
1. Использование дорогостоящего исходного реагента - 4-ацетилбифенила.
2. Гипохлорит калия - нестабильное соединение, которое в промышленном масштабе не производится.
При окислении 4-ацетилбифенила (7) бихроматом натрия в среде ледяной уксусной кислоты в присутствии катализатора - хлорного железа выход 4-бифенилкарбоновой кислоты (1) составил 60%. Реакция проходит при кипячении реакционной смеси в течение 12 ч [Продукты и технология органического синтеза. Вып. 10. Инф. карта. ЦСИФ №5476-70 НИИТЭМИХ - ЦСИФ. 1970].
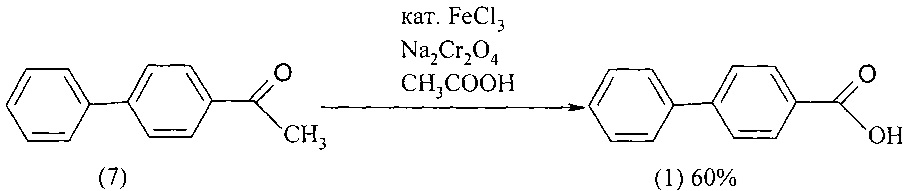
Недостатки метода
1. Дороговизна 4-ацетилбифенила.
2. Использование ледяной уксусной кислоты, которая является прекурсором.
3. Коррозия оборудования.
4. Бихромат натрия токсичен и по степени влияния на организм человека относится к вредным веществам 1-го класса опасности.
5. Образование большого количества отходов.
В патенте [Пат. 1020424 (1981). СССР] 4-бифенилкарбоновая кислота (1) с выходом 64% синтезирована окислением 4-ацетилбифенила (7) при кипячении в среде 30-35%-ной водной уксусной кислоты с помощью 55-60%-ной азотной кислоты в присутствии соляной кислоты.
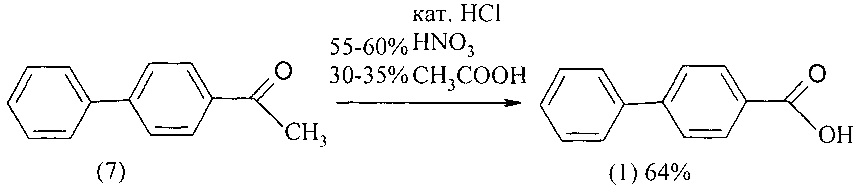
Недостатки метода
1. Дороговизна 4-ацетилбифенила.
2. Использование ядовитого НСl.
3. Использование уксусной кислоты в качестве среды, которая является прекурсором.
4. Агрессивная среда, содержащая растворы концентрированных кислот, требует применения оборудования в коррозионно-стойком исполнении.
Карбонилированием бифенила (8) монооксидом углерода (1 атм) в присутствии K2S2O8 в смеси трифторуксусной кислоты и дихлорметана, применяя Pd(OCOCF3)2 в качестве катализатора, были получены бифенилкарбоновые кислоты (1, 5, 6). Реакция протекает 48 ч при 50°С [Fumitoshi S., Shinsuke К., and Kyoko N. // Org. Lett. 2004. V. 6. № 14. 2437-2439]. Выход смеси изомерных бифенилкарбоновых кислот составил 31%.
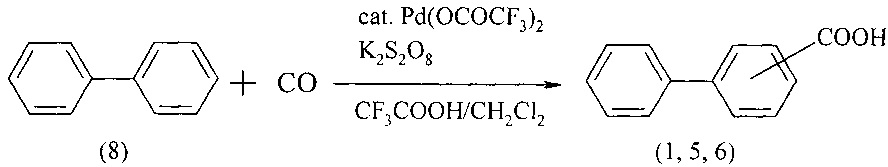
Недостатки метода:
1. Использование газообразного и токсичного угарного газа.
2. Высокая пожаро- и взрывоопасность метода из-за необходимости использования СО под давлением.
3. Монооксид углерода оказывает вредное воздействие на окружающую среду.
4. Дороговизна Pd(CF3CO2)2.
5. Неселективность реакции.
6. Низкий выход целевого продукта.
7. Продолжительность реакции составляет 48 ч.
В работе [Shingo Y., Satoshi S., Yasutaka I. // J. Mol. Catal. 2007. V. 262. 48-51] бифенил (8) вовлечен в реакцию окислительного карбонилирования с помощью газовой смеси СО/O2 (0,5/0,5 атм) в присутствии каталитических систем Pd(OAc)2 и H5PMo10V2O40⋅26 H2O в уксусной кислоте при 110°С в течение 15 ч. В результате образуются 2-, 3- и 4-бифенилкарбоновые кислоты (5, 6, 1) (16:36:58), 2- и 4-гидроксибифенил (9а и б) (40:60), и 2'-, 3'- и 4'-гидроксил-4-бифенилкарбоновые кислоты(10а-в) (34:11:55).
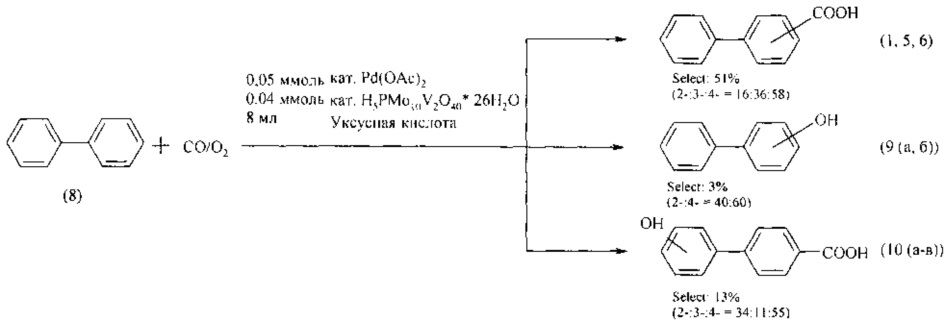
Недостатки метода
1. Использование газообразного и токсичного угарного газа.
2. Высокая пожаро- и взрывоопасность метода из-за необходимости использования кислорода и угарного газа под давлением.
3. Монооксид углерода оказывает вредное воздействие на окружающую среду.
4. Дорогостоящая каталитическая система.
5. Неселективность реакции.
6. Значительная продолжительность процесса (15 ч).
7. В качестве среды используется уксусная кислота, которая является прекурсором и корродирующим реагентом.
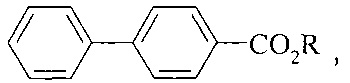
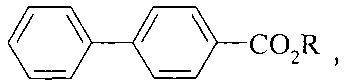
Авторами предлагается способ получения алкиловых эфиров 4-бифенилкарбоновой кислоты, не имеющий вышеперечисленных недостатков.
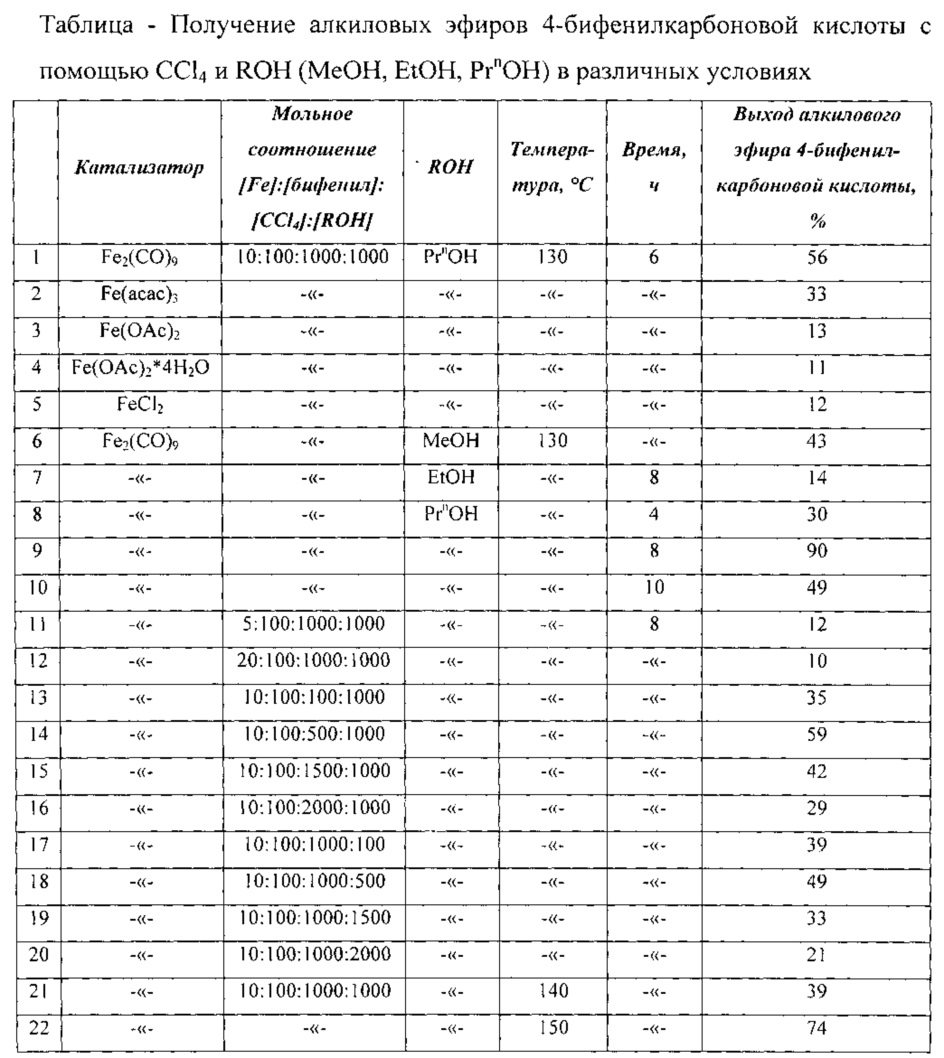
Сущность способа заключается во взаимодействии бифенила С12Н10 с четыреххлористым углеродом и спиртами (МеОН, EtOH, PrnOH) в присутствии катализатора, выбранного из ряда Fe(acac)3, Fe(OAc)2, Fe(OAc)2*4H2O, FeCl2 и Fe2(CO)9, при 130-150°C в течение 4-10 ч при мольном соотношении [Fe]:[бифенил]:[CCl4]:[КОН]=5-20:100:100-2000:100-2000. Оптимальными для проведения реакции являются следующие соотношения катализатора и реагентов [Fe]:[бифенил]:[CCl4]:[ROH]=10:100:1000:1000, при температуре 130°С в течение 8 ч. При температуре 130°С и продолжительности реакции 8 ч выход метилового эфира 4-бифенилкарбоновой кислоты составляет 41%, этилового эфира 4-бифенилкарбоновой кислоты - 14%, пропилового эфира - 90%. Синтез проводят в атмосфере аргона.
В отсутствие катализатора и спирта реакция не проходит.
Оптимальные условия реакции отрабатывали на примере взаимодействия бифенила с CCl4 и н-пропанолом под действием Fe2(CO)9. Примеры, подтверждающие способ, приведены в таблице.
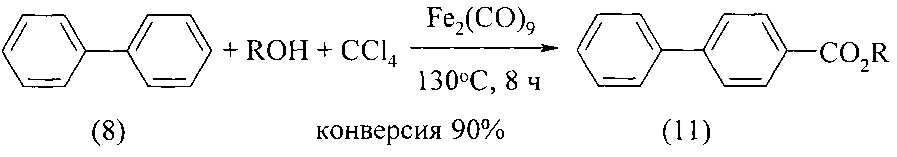
Мольные соотношения реагентов
[Fe2(СО)9]:[бифенил]:[CCl4]:[ROH]=1:10:100:100
ROH=МеОН, ЕtOН, PrnOH.
Преимущества предлагаемого метода:
1. Высокая селективность.
2. Доступность и дешевизна исходных реагентов.
3. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
4. Непрореагировавший бифенил легко отделяется от моноэфиров 4-бифенилкарбоновой кислоты перегонкой: его можно возвратить в реакцию.
Строение полученных эфиров 4-бифенилкарбоновой кислоты доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными.
ПРЕДЛАГАЕМЫЙ СПОСОБ ПОЯСНЯЕТСЯ ПРИМЕРАМИ
ПРИМЕР 1. Реакцию проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при регулируемом нагреве. В ампулу под аргоном загружали 0,0118 г (0,000032 моль) Fe2(CO)9, 0,05 г (0,00032 моль) бифенила, 0,31 мл (0,0032 моль) четыреххлористого углерода и 0,24 мл (0,0032 моль) н-пропанола. Запаянную ампулу поместили в автоклав, автоклав герметично закрыли и нагревали при 130°С в течение 8 часов. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали Na2CO3 и фильтровали через бумажный фильтр. Растворитель отогнали, остаток перегоняли в вакууме. Целевой продукт от исходного бифенила разделяли перегонкой под вакуумом.
ПРИМЕРЫ 2-22. Аналогично примеру 1. Результаты приведены в таблице.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и справочными данными.
Метиловый эфир 4-бифенилкарбоновой кислоты.
Выход 43%. Тпл. 117-118°С (Тпл. 117-118°С [Словарь органических соединений / под ред. И. Хейльборна и Г.М. Бэнбери. М., 1949. Т. 1. С. 1022]). Спектр ЯМР 13С (δ, м.д., TMS): 145,72 (С-1); 127,16 (С-2,6); 130,24 (С-3,5); 128,89 (С-4); 140,09 (С-1'); 127,28 (С-2',6'); 129,05 (С-3',5'); 128,26 (С-4'); 53,56 (-COOCH3). Спектр ЯМР 1Н (δ, м.д., TMS): 7,77 (д, 2Н, С2, С6); 8,25 (д, 2Н, С3, С5); 7,73 (д, 2Н, С2', С6'); 7,56 (д, 2Н, С3', С5'); 7,48 (т, 3Н, С4'); 4,04 (с, 3Н, -СООСН3). Масс-спектр, m/z (Joтн (%)): 212 [М+], 212 (78), 181 (100), 152 (60), 90 (17), 76 (35), 51 (7).
Этиловый эфир 4-бифенилкарбоновой кислоты
Выход 14%. Тпл. 46-46.5°С (Тпл. 46°С [Словарь органических соединений / под ред. И. Хейльборна и Г.М. Бэнбери. М., 1949. Т. 1. С. 1022]). Спектр ЯМР 13С (δ, м.д., TMS): 145,64 (С-1); 127,13 (С-2,6); 130,24 (С-3,5); 129,40 (С-4); 140,13 (С-1'); 127,28 (С-2',6'); 129,06 (С-3',5'); 128,26 (С-4'); 61,11 (-СООСН2СН3); 14,52 (-СООСН2СН3). Спектр ЯМР 1Н (δ, м.д., TMS): 7,78 (д, 2Н, С2, С6); 8,29 (д, 2Н, С3, С5); 7,74 (д, 2Н, С2', С6'); 7,58 (д, 2Н, С3', С5'); 7,48 (т, 3Н, С4'); 4,55 (кв, 2Н, -COOCH2CH3); 1,55 (т, 2Н, -СООСН2СН3). Масс-спектр, m/z (Joтн (%)): 226 [M+], 226 (70), 198 (30), 181 (100), 152 (56), 90 (12), 76 (23), 51 (5).
Пропиловый эфир 4-бифенилкарбоновой кислоты
Выход 90%. Ткип.=114-115°С / 0,2 мм рт.ст. Спектр ЯМР 13С (δ, м.д., TMS): 145,55 (С-1); 127,03 (С-2,6); 130,07 (С-3,5); 129,28 (С-4); 140,08 (С-1'); 127.29 (С-2',6'); 128,93 (С-3',5'); 128,11 (С-4'); 66,57 (-COOCH2CH2CH3); 22,16 (-СООСН2СН2СН3); 10,55 (-СООСН2СН2СН3). Спектр ЯМР 1Н (δ, м.д., TMS): 7,67 (д, 2Н, С2, С6); 8,14 (д, 2Н, С3, С5); 7,65 (д, 2Н, С2', С6'); 7,49 (д, 2Н, С3', С5'); 7,42 (т, 3Н, С4'); 4,33 (т, 2Н, -СООСН2СН2СН3); 1,84 (м, 2Н, -СООСН2СН2СН3); 1,08 (т, 2Н, -СООСН2СН2СН3). Масс-спектр, m/z (Jотн(%)): 240 [М+], 240 (55), 211 (42), 198 (100), 181 (87), 152 (68), 76 (27), 40 (65).
Другие примеры, подтверждающие способ, приведены в таблице.