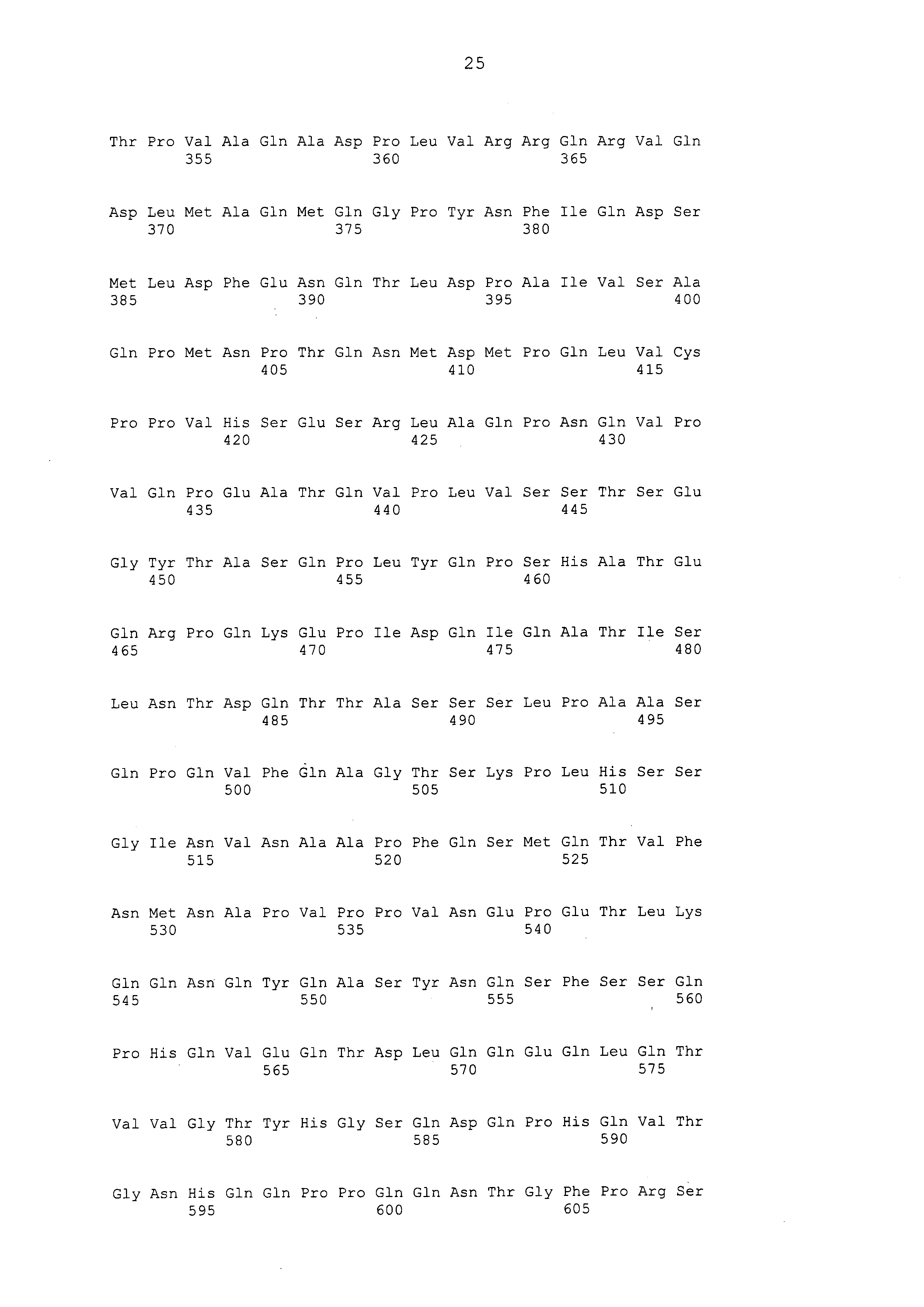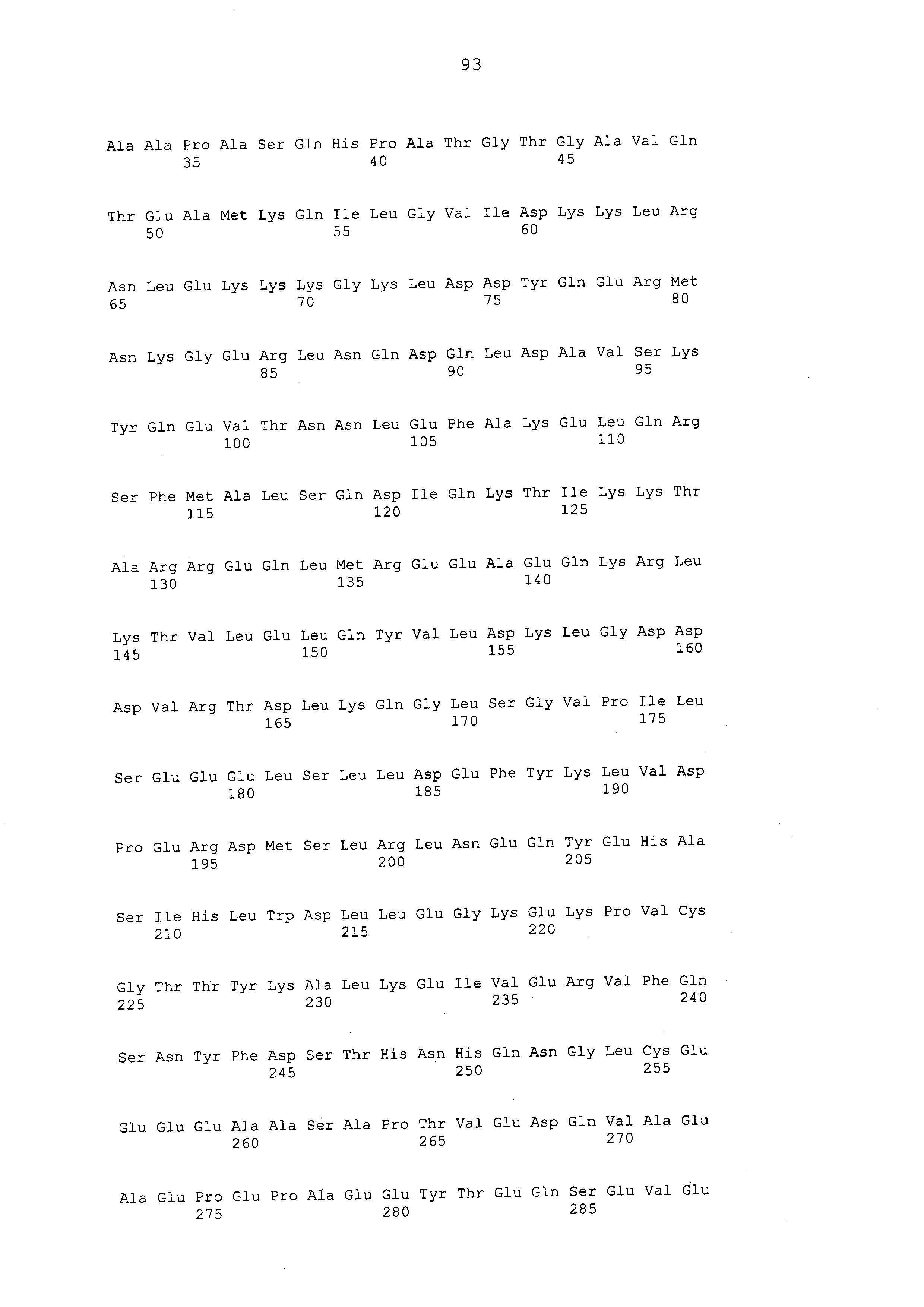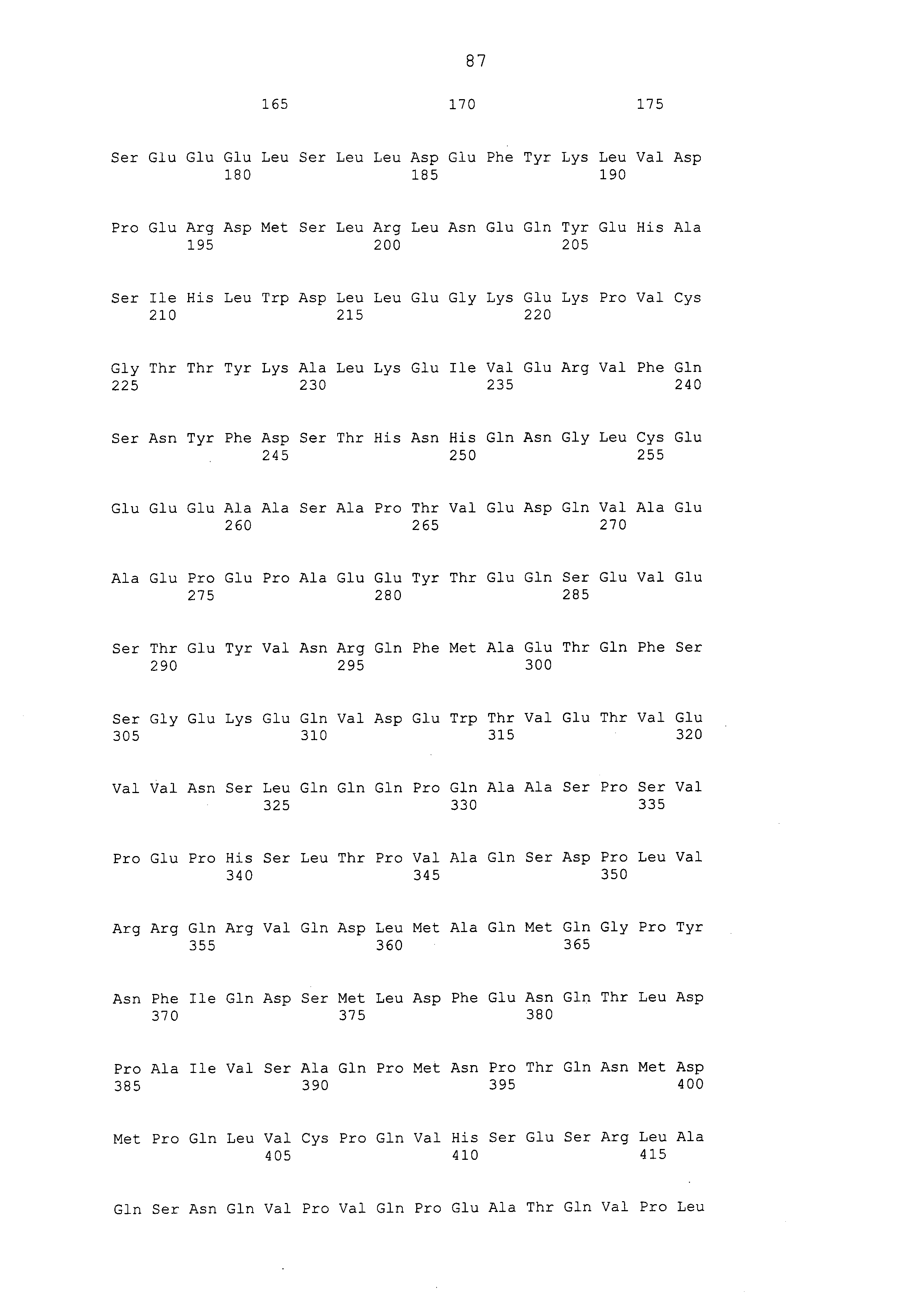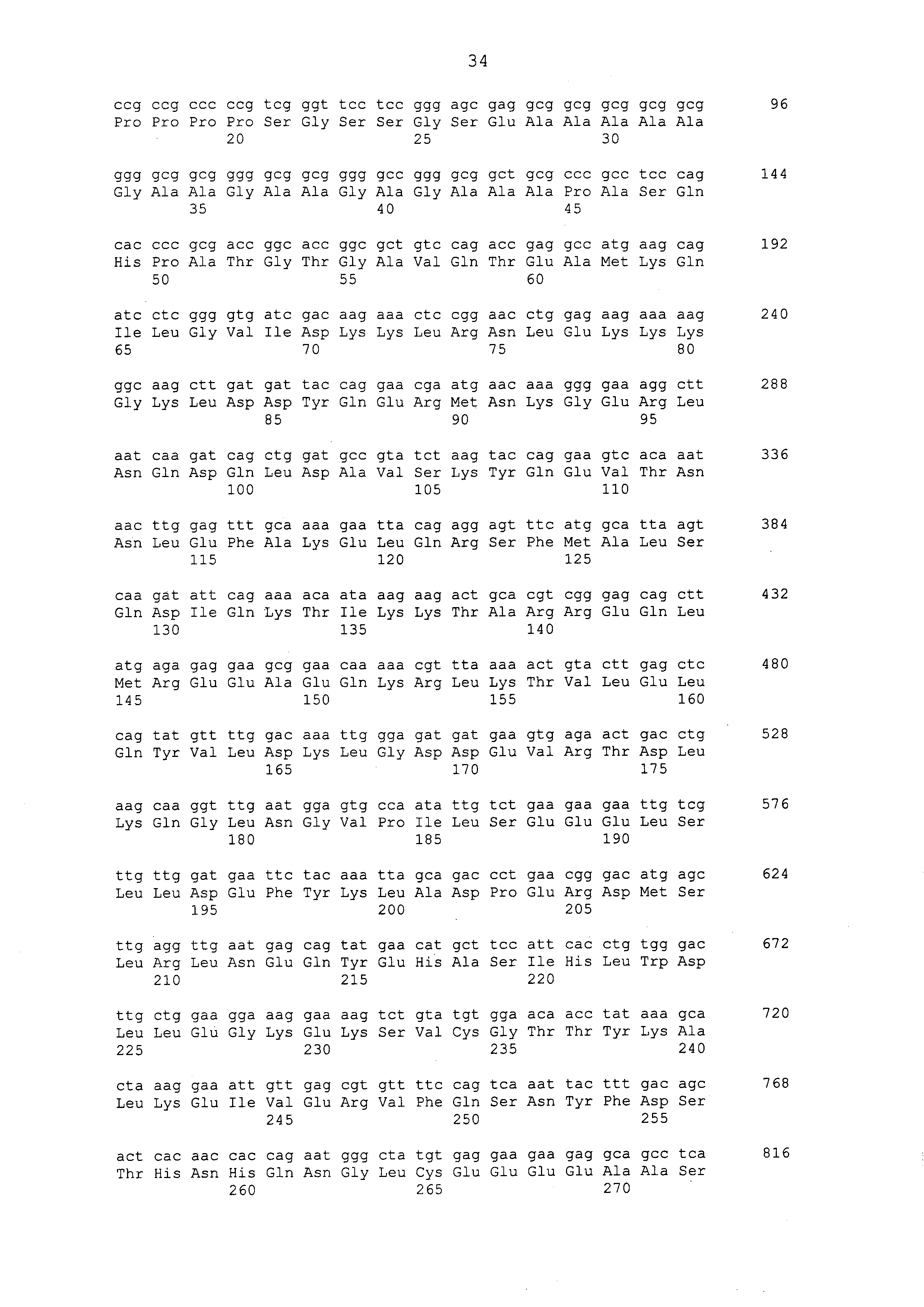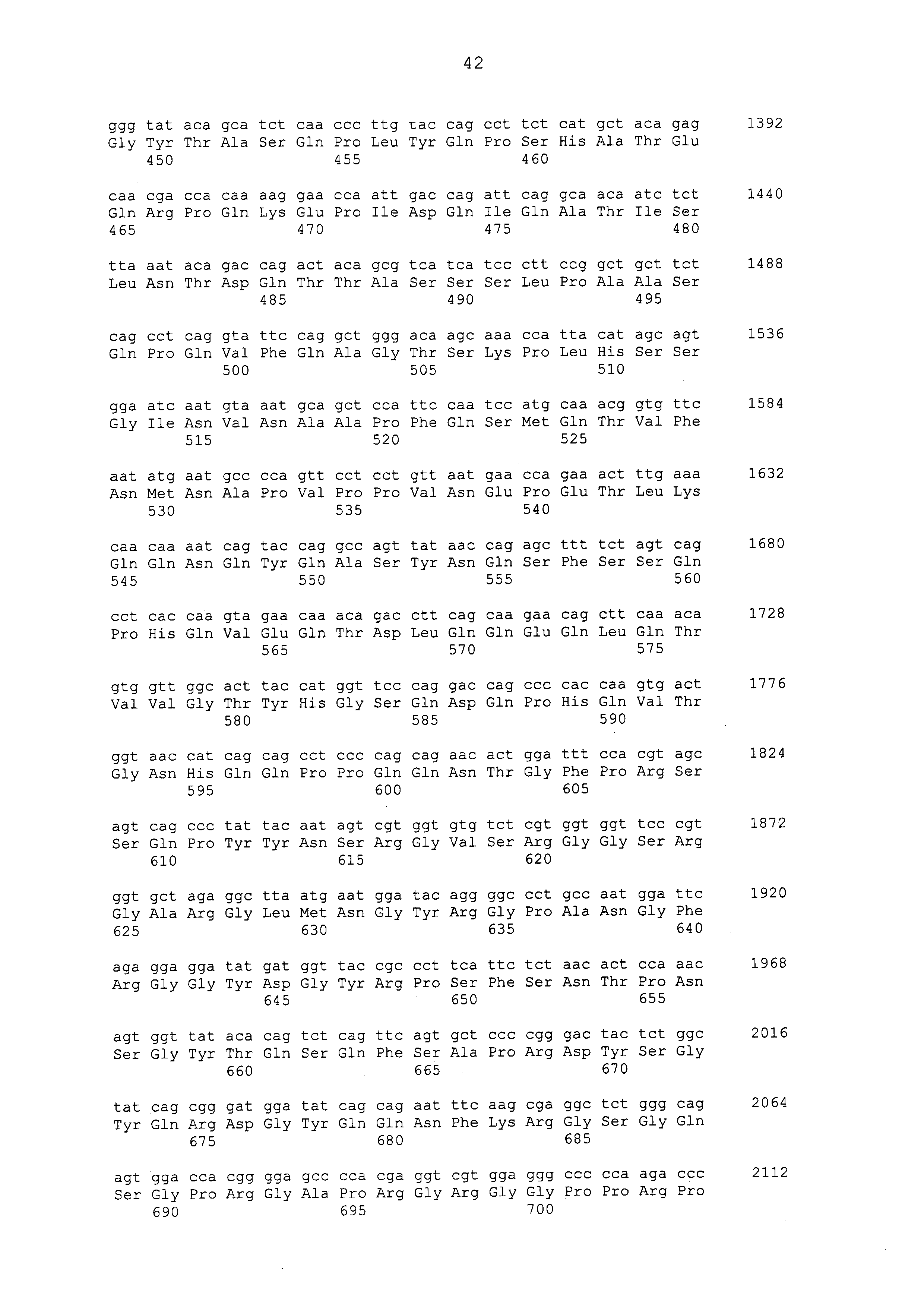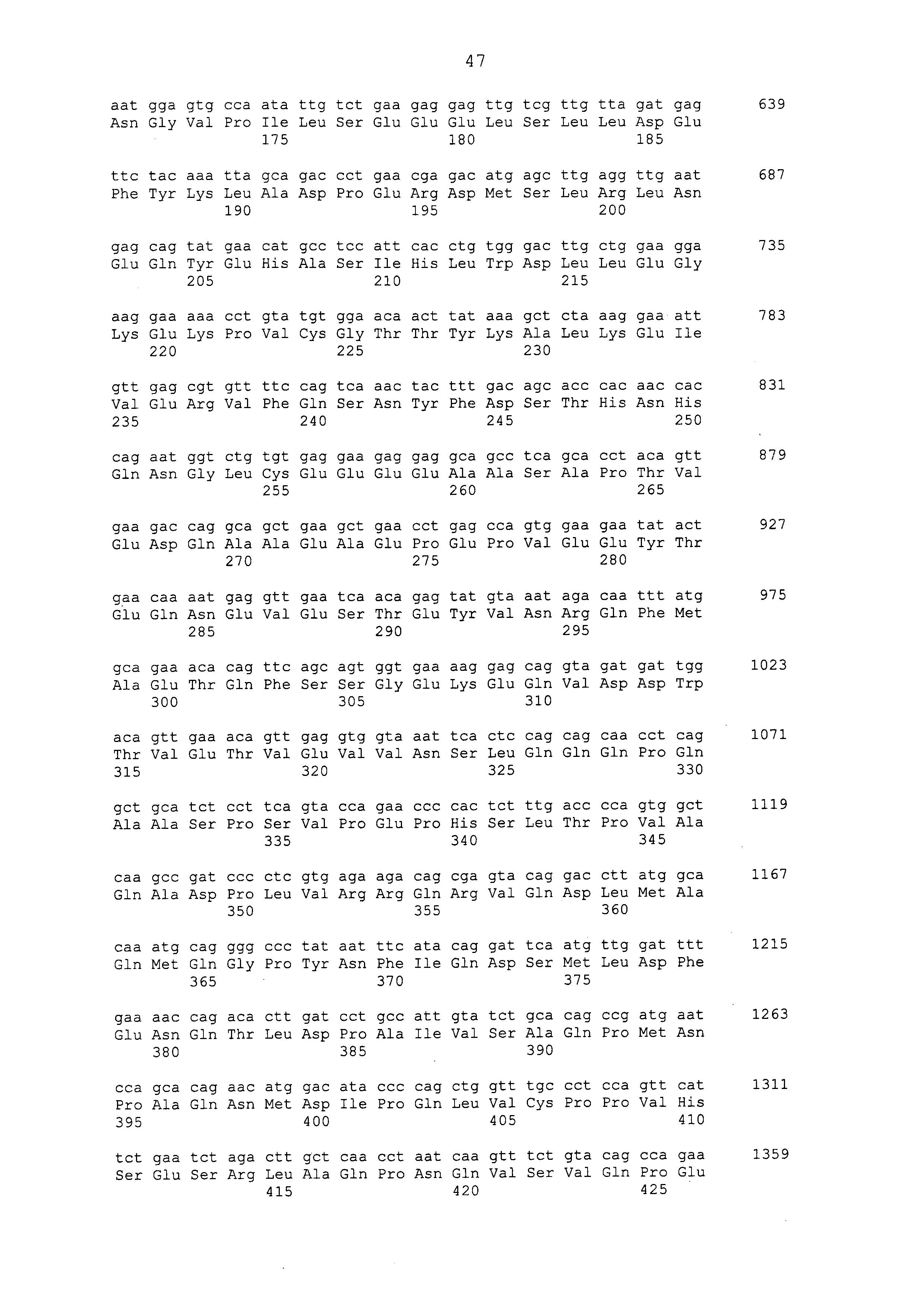Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ РАКА ПЕЧЕНИ
Вид РИД
Изобретение
Область техники
[0001]
Настоящее изобретение относится к новому медицинскому использованию антитела против белка CAPRIN-1 или его фрагмента, например, в качестве средства для лечения и/или предотвращения рака печени.
Уровень техники
[0002]
В последнее время в мире появились различные антительные лекарственные средства для лечения видов рака посредством нацеленного воздействия на белки антигенов на клетках рака. Антительные лекарственные средства показывают определенные положительные эффекты в качестве терапевтических средств со специфичностью к видам рака и получили внимание. Однако большинство белков антигенов-мишеней также экспрессируют нормальные клетки, и введение такого антитела ослабляет не только клетки рака, но также нормальные клетки, экспрессирующие антиген, что ведет к проблеме их побочных эффектов. Соответственно, если идентифицируют антиген рака, в частности, экспрессируемый на клеточной поверхности рака, и в качестве фармацевтического средства можно использовать антитело, нацеленное на антиген, можно ожидать лечение антительным лекарственным средством с меньшими побочными эффектами.
[0003]
Специалистам в данной области известно в качестве общего технического знания, что, несмотря на то что смертность от рака печени постепенно снижается, среди различных видов рака, уровень смертей от рака печени все еще высок, четвертое место по смертности от рака, который классифицирован согласно его месторасположению в Японии, как трудно поддающийся лечению. Соответственно, желательно разработать эффективное терапевтическое средство для рака печени.
[0004]
Ассоциированный с цитоплазмой и пролиферацией белок 1 (CAPRIN-1) известен как внутриклеточный белок, который экспрессируют при активации нормальные клетки в фазе покоя или при возникновении клеточного деления и который участвует в контроле транспортировки и трансляции мРНК через формирование внутриклеточных стрессовых гранул с РНК в клетках. Обнаружено, что экспрессия CAPRIN-1, в частности, происходит на поверхности клеток рака, таких как клетки рака молочной железы, и CAPRIN-1 изучали в качестве мишени антительных лекарственных средств для терапии рака (патентная литература 1). Однако в патентной литературе 1 не отмечена экспрессия CAPRIN-1 на клетках рака печени и не описано или не сделано предположения о том, что CAPRIN-1 может представлять собой белок антигена рака печени.
Список цитируемой литературы
Патентная литература
[0005]
Патентная литература 1: WO 2010/016526
Сущность изобретения
Техническая проблема
[0006]
Цель настоящего изобретения состоит в том, чтобы идентифицировать белок антигена рака, экспрессия которого происходит на поверхности клеток рака печени, и предоставить использование антитела, нацеленного на белок, в качестве средства для лечения и/или предотвращения рака печени.
Решение проблемы
[0007]
Авторы настоящего изобретения проводили тщательные исследования и, как результат, обнаружили, что часть белка CAPRIN-1 экспрессирует клеточная поверхность клеток рака печени, а также обнаружили, что антитело против белка CAPRIN-1 ослабляет клетки рака печени, которые экспрессируют белок CAPRIN-1, и выполнили настоящее изобретение.
[0008]
Соответственно, настоящее изобретение имеет следующие характеристики.
[0009]
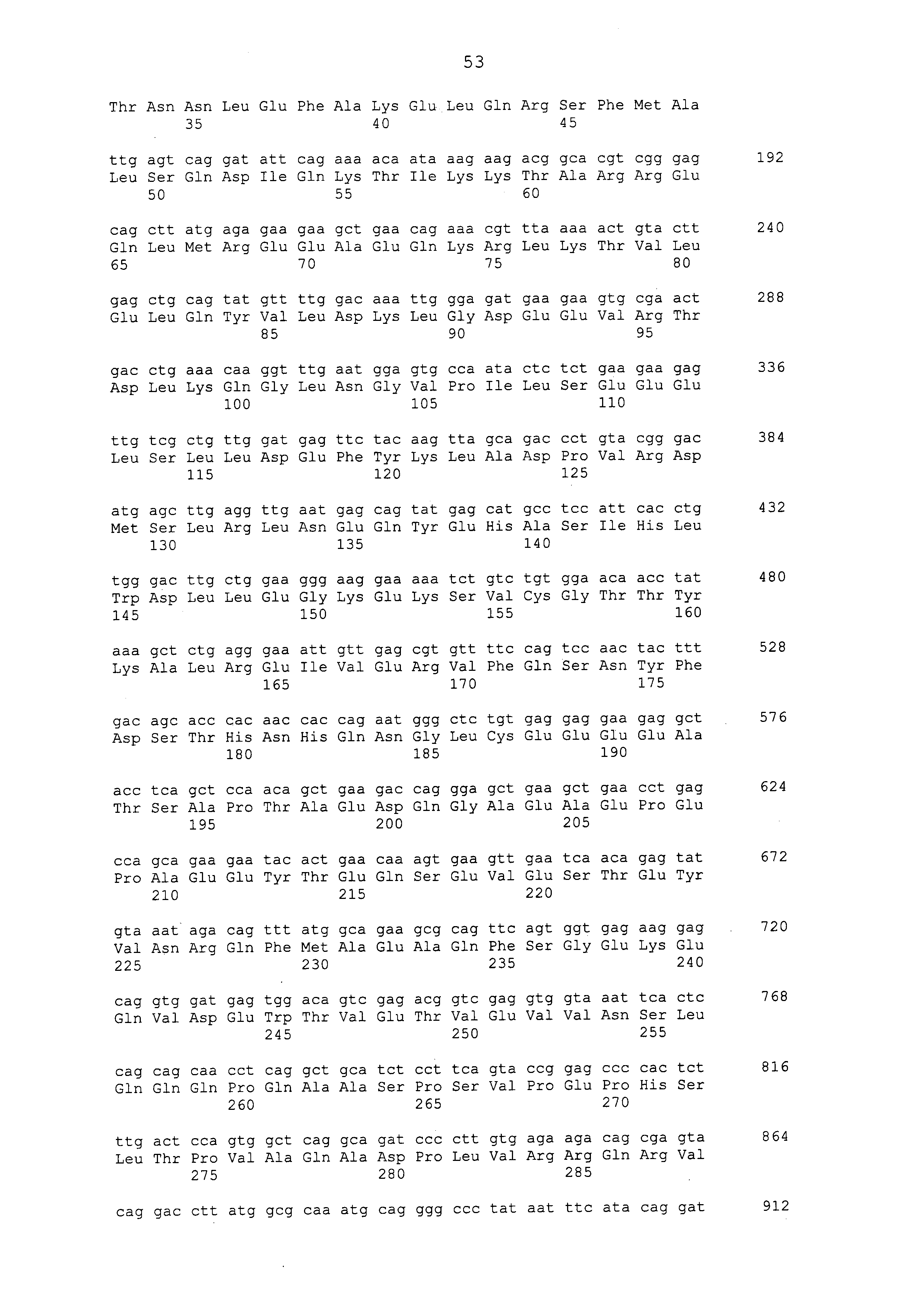
Настоящее изобретение предусматривает фармацевтическую композицию для лечения и/или предотвращения рака печени, которая содержит, в качестве активного ингредиента, антитело или его фрагмент, которое имеет иммунологическую реактивность с белком CAPRIN-1, который содержит аминокислотную последовательность, приведенную в любой из последовательностей с четными номерами от SEQ ID NО: с 2 до 30, или аминокислотную последовательность, которая имеет идентичность последовательностей 80% или больше, предпочтительно 85% или больше, более предпочтительно 90% или больше и наиболее предпочтительно 95% или больше с аминокислотной последовательностью или фрагментом белка CAPRIN-1, содержащим по меньшей мере семь последовательных аминокислотных остатков аминокислотной последовательности белка.
[0010]
В другом варианте осуществления антитело, описанное выше, представляет собой моноклональное антитело или поликлональное антитело.
[0011]
В другом варианте осуществления антитело представляет собой антитело человека, гуманизированное антитело, химерное антитело, одноцепочечное антитело или полиспецифическое антитело.
[0012]
В другом варианте осуществления антитело представляет собой антитело, которое имеет иммунологическую реактивность с пептидом, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 273, SEQ ID NO: 266, SEQ ID NO: 270, SEQ ID NO: 272 или SEQ ID NO: 269, или аминокислотную последовательность, которая имеет идентичность последовательностей 80% или больше, предпочтительно 85% или больше, более предпочтительно 90% или больше и наиболее предпочтительно 95% или больше с аминокислотной последовательностью или фрагментом пептида.
[0013]
В другом варианте осуществления антитело представляет собой любое одно из следующих антител с (a) до (ao), которое имеет иммунологическую реактивность с белком CAPRIN-1.
[0014]
(a) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 37, 38 и 39, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 41, 42 и 43, соответственно.
[0015]
(b) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 47, 48 и 49, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 51, 52 и 53, соответственно.
[0016]
(c) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 57, 58 и 59, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 61, 62 и 63, соответственно.
[0017]
(d) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 67, 68 и 69, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 71, 72 и 73, соответственно.
[0018]
(e) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 77, 78 и 79, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 81, 82 и 83, соответственно.
[0019]
(f) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 87, 88 и 89, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 91, 92 и 93, соответственно.
[0020]
(g) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 97, 98 и 99, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 101, 102 и 103, соответственно.
[0021]
(h) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 107, 108 и 109, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 111, 112 и 113, соответственно.
[0022]
(i) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 117, 118 и 119, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 121, 122 и 123, соответственно.
[0023]
(j) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 127, 128 и 129, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 121, 122 и 123, соответственно.
[0024]
(k) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 132, 133 и 134, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 136, 137 и 138, соответственно.
[0025]
(l) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 142, 143 и 144, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 146, 147 и 148, соответственно.
[0026]
(m) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 142, 143 и 144, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 152, 153 и 154, соответственно.
[0027]
(n) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 157, 158 и 159, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 161, 162 и 163, соответственно.
[0028]
(o) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 171, 172 и 173, соответственно.
[0029]
(p) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 177, 178 и 179, соответственно.
[0030]
(q) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 182, 183 и 184, соответственно.
[0031]
(r) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 187, 188 и 189, соответственно.
[0032]
(s) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 192, 193 и 194, соответственно.
[0033]
(t) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 197, 198 и 199, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 201, 202 и 203, соответственно.
[0034]
(u) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 207, 208 и 209, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 211, 212 и 213, соответственно.
[0035]
(v) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 217, 218 и 219, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 221, 222 и 223, соответственно.
[0036]
(w) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 227, 228 и 229, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 231, 232 и 233, соответственно.
[0037]
(x) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 237, 238 и 239, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 241, 242 и 243, соответственно.
[0038]
(y) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 247, 248 и 249, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 251, 252 и 253, соответственно.
[0039]
(z) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 280, 281 и 282, соответственно.
[0040]
(aa) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 286, 287 и 288, соответственно.
[0041]
(ab) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 291, 292 и 293, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 295, 296 и 297, соответственно.
[0042]
(ac) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 301, 302 и 303, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 305, 306 и 307, соответственно.
[0043]
(ad) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 311, 312 и 313, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 315, 316 и 317, соответственно.
[0044]
(ae) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 321, 322 и 323, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 325, 326 и 327, соответственно.
[0045]
(af) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 331, 332 и 333, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 335, 336 и 337, соответственно.
[0046]
(ag) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 341, 342 и 343, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 345, 346 и 347, соответственно.
[0047]
(ah) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно.
[0048]
(ai) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 357, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно.
[0049]
(aj) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 373, 374 и 375, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 377, 378 и 379, соответственно.
[0050]
(ak) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 383, 384 и 385, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно.
[0051]
(al) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 393, 394 и 395, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно.
[0052]
(am) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 398, 399 и 400, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 402, 403 и 404, соответственно.
[0053]
(an) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 408, 409 и 410, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 412, 413 и 414, соответственно.
[0054]
(ao) Антитело, которое содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 418, 419 и 420, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 422, 423, и 424, соответственно.
[0055]
В другом варианте осуществления антитело или его фрагмент по настоящему изобретению конъюгируют с противоопухолевым средством.
[0056]
Настоящее изобретение дополнительно предусматривает комбинированное фармацевтическое средство, которое содержит комбинацию фармацевтической композиции по настоящему изобретению и фармацевтической композиции, которая содержит противоопухолевое средство.
[0057]
Настоящее изобретение дополнительно предусматривает способ лечения и/или предотвращения рака печени, который включает введение фармацевтической композиции или комбинированного фармацевтического средства по настоящему изобретению субъекту.
[0058]
Данное описание охватывает содержание описания японской патентной заявки № 2012-080779, на основе которой в настоящей заявке испрашивают приоритет.
Полезные эффекты изобретения
[0059]
Антитело против белка CAPRIN-1, используемое в настоящем изобретении (далее в настоящем документе часто обозначаемое как «антитело против CAPRIN-1»), ослабляет клетки рака печени. Соответственно, антитело против белка CAPRIN-1 можно использовать для лечения и предотвращения рака печени.
Описание вариантов осуществления
[0060]
Противоопухолевую активность антитела, используемого в настоящем изобретении, против полипептида, состоящего из аминокислотной последовательности, приведенной в любой из последовательностей с четными номерами с SEQ ID NO: с 2 до 30, можно оценивать посредством исследования супрессии опухолевого роста in vivo в животном-опухоленосителе или исследования того, как описано ниже, наблюдают ли цитотоксичность посредством клеток иммунной системы или комплемента в опухолевых клетках, экспрессирующих полипептид in vitro.
[0061]
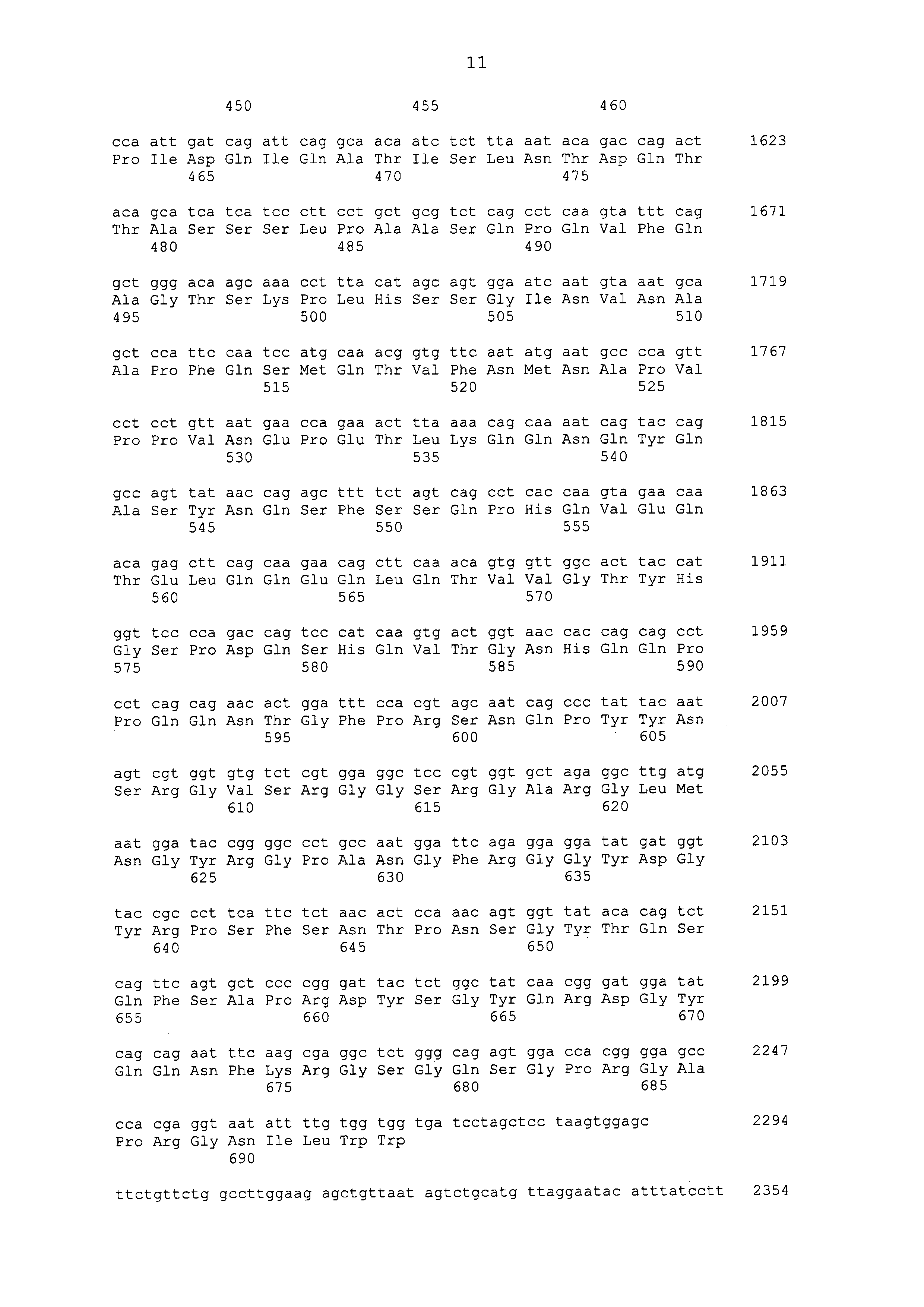
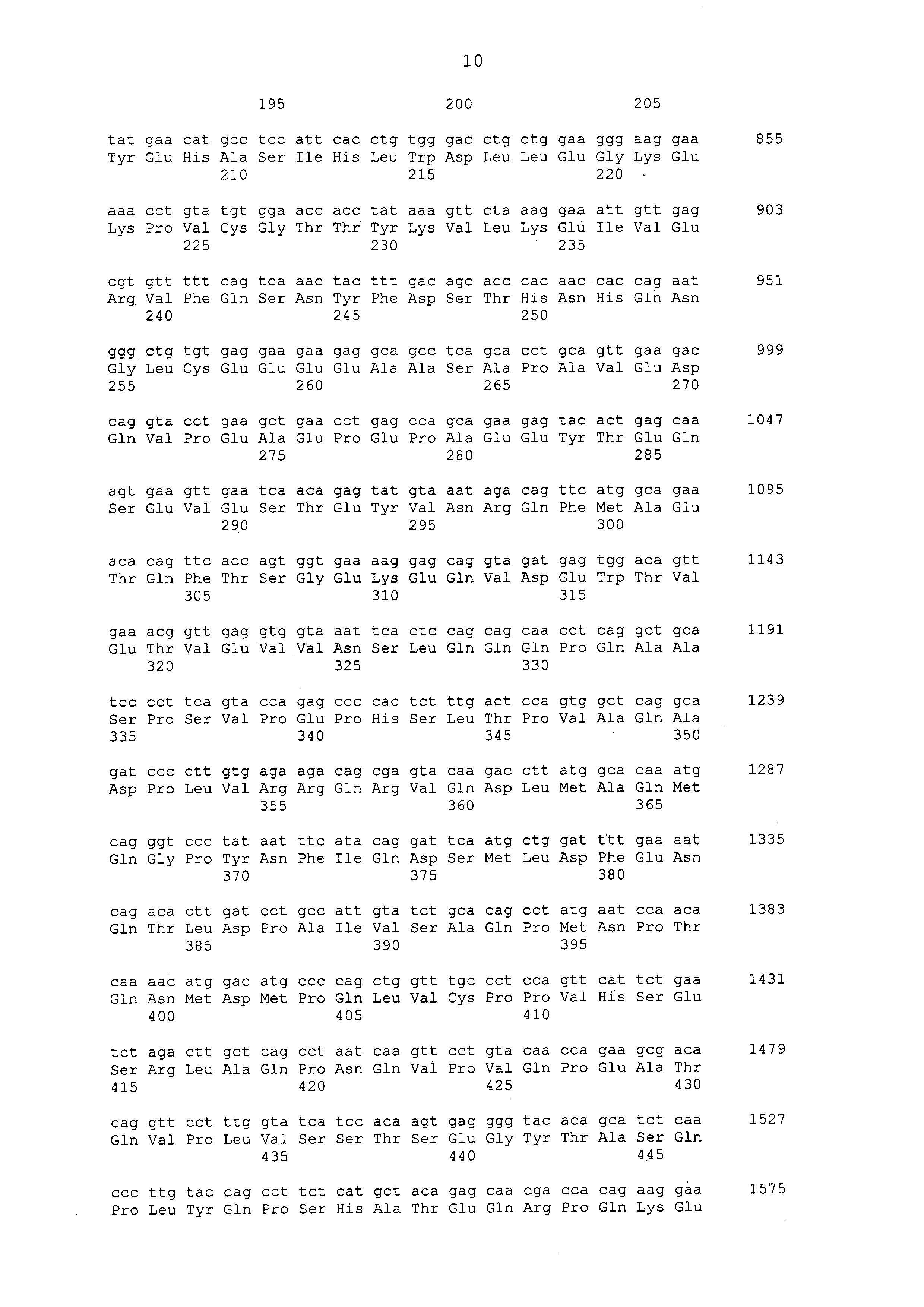
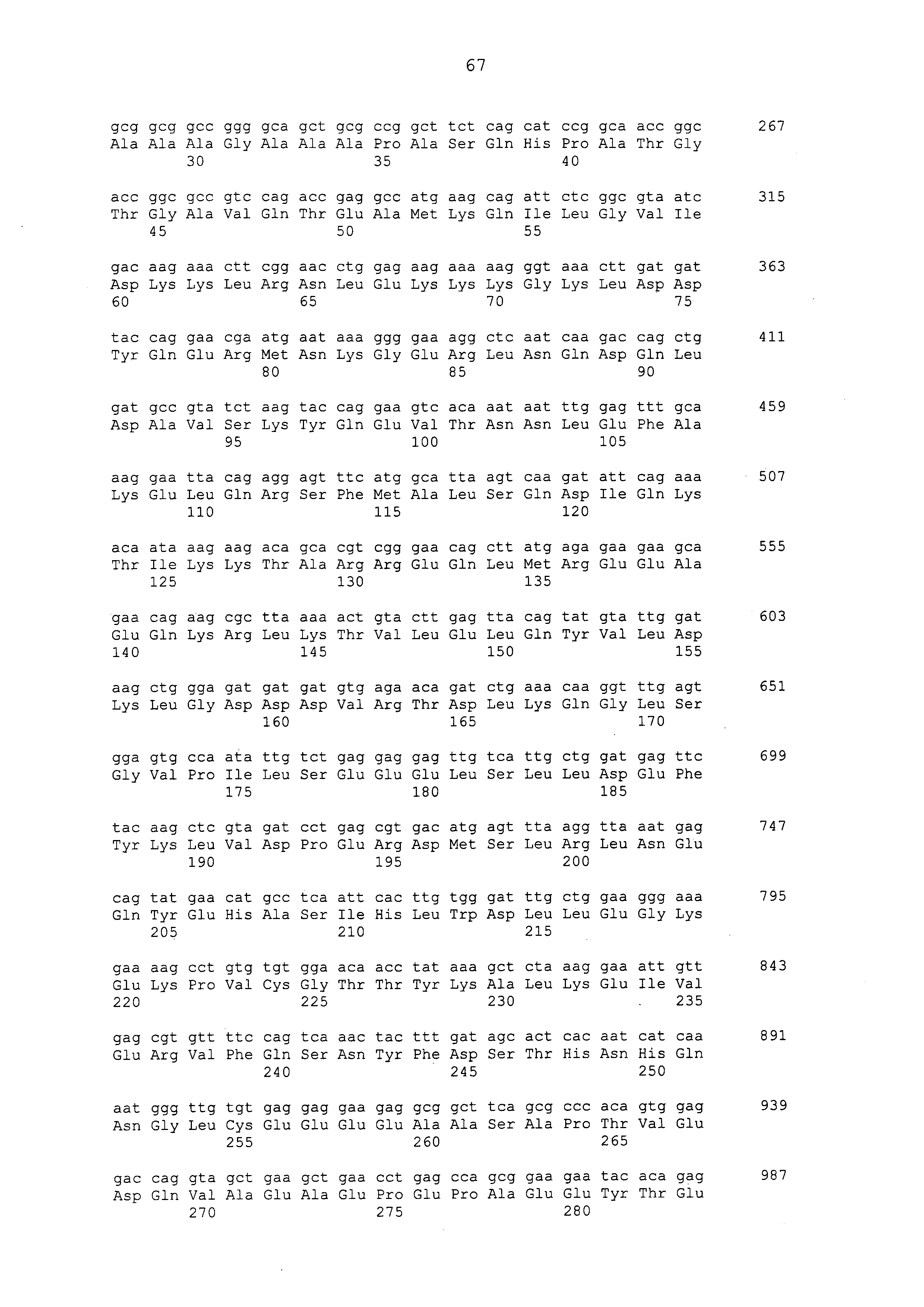
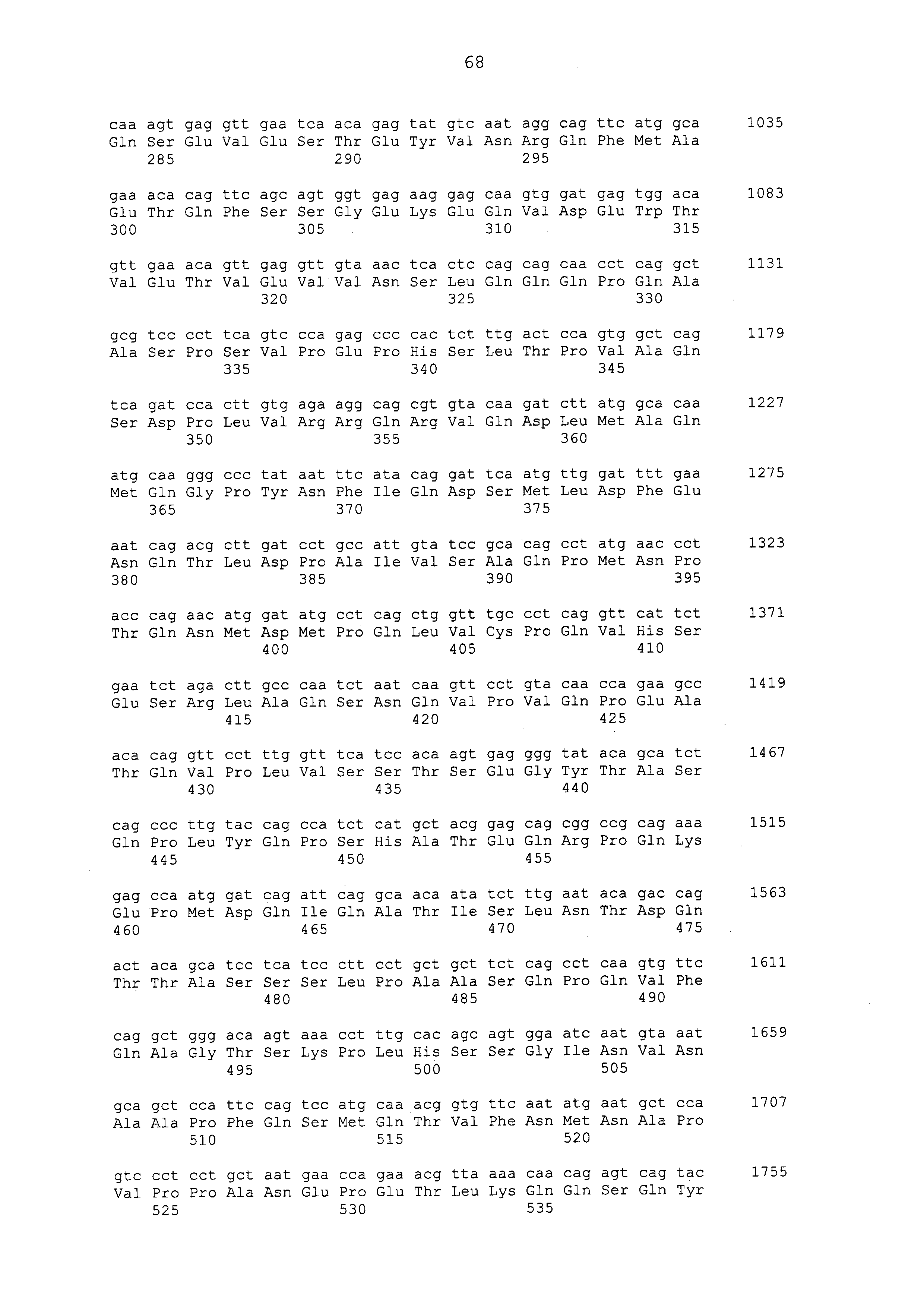
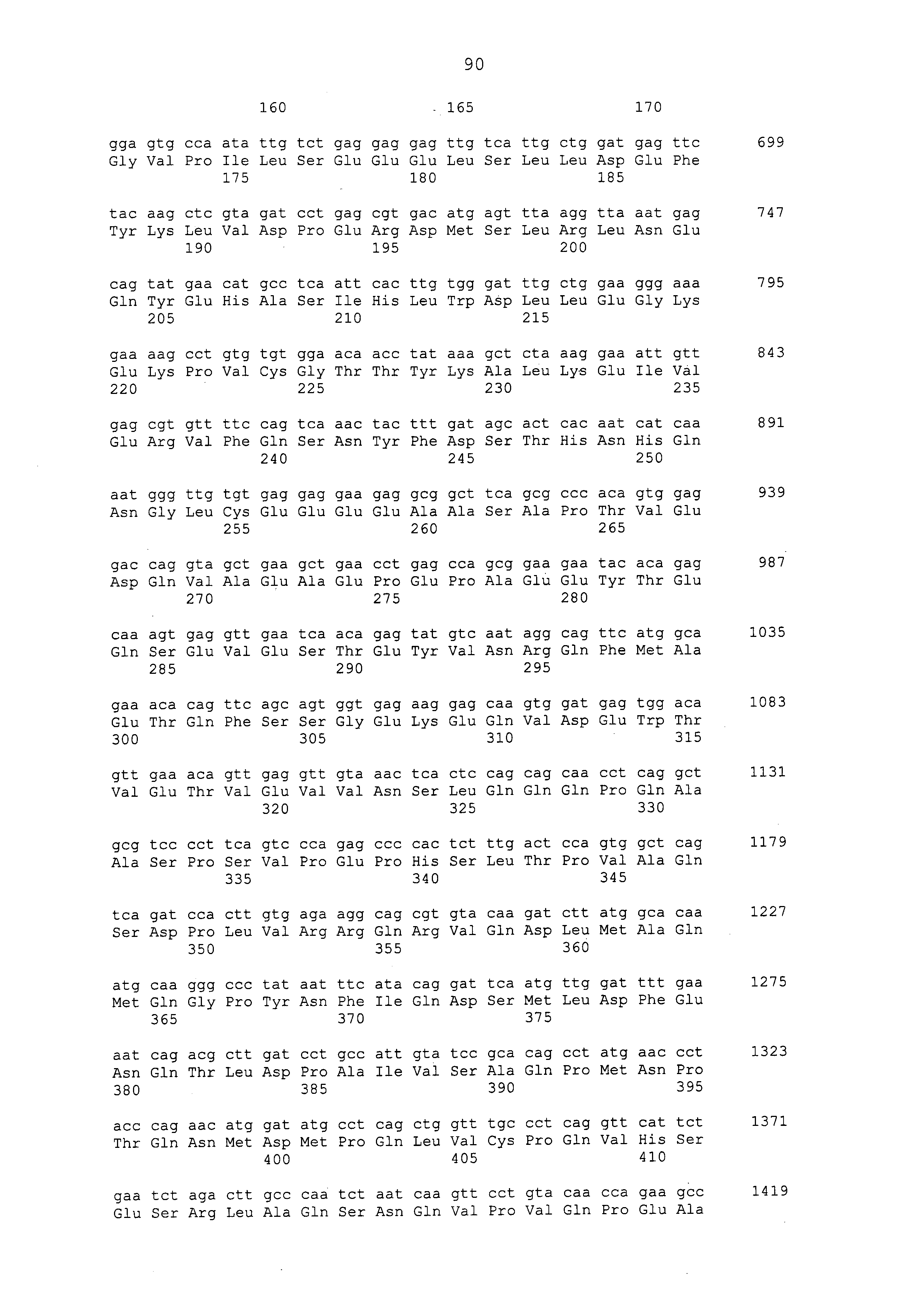
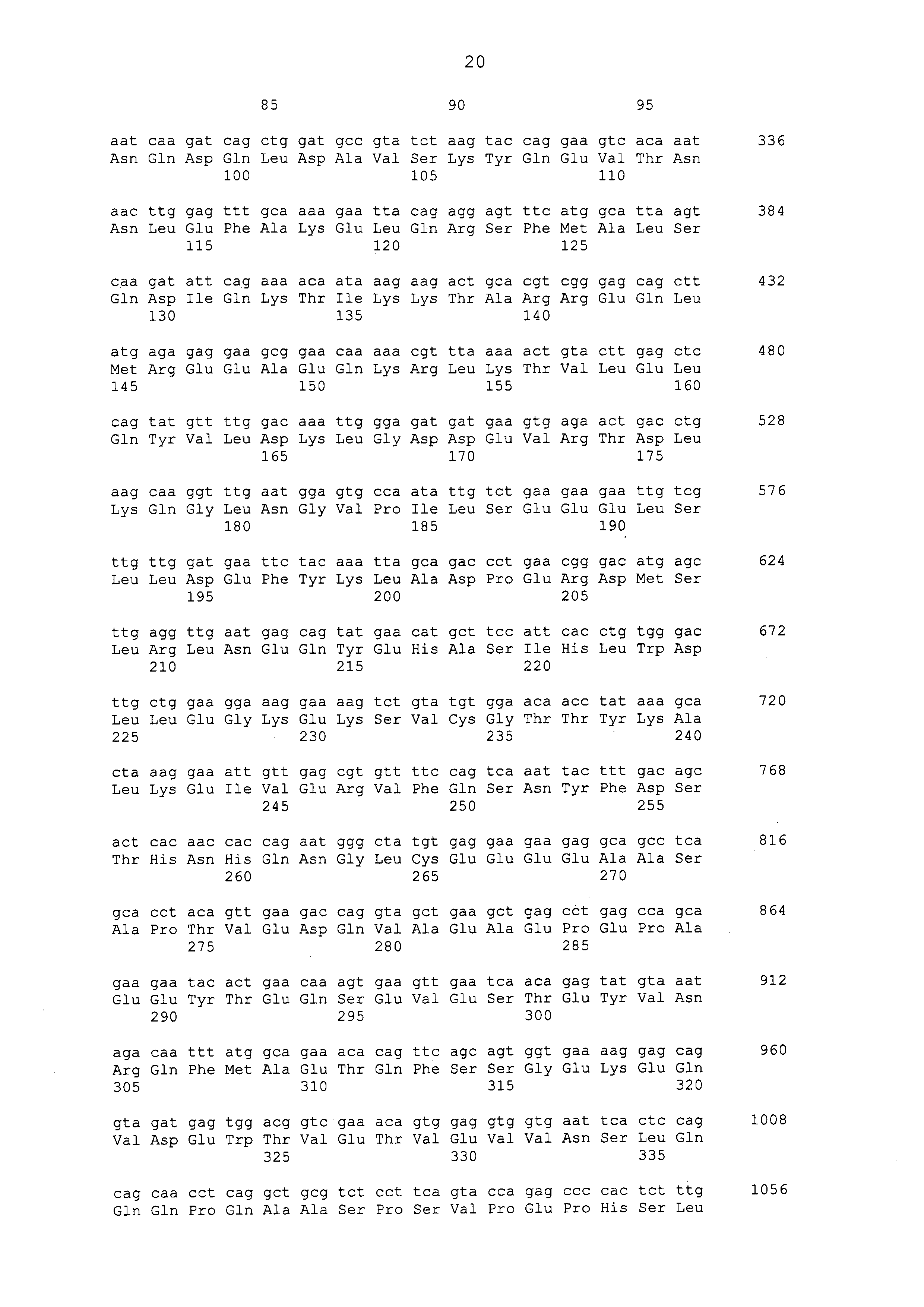
Нуклеотидные последовательности полинуклеотидов, кодирующих белки, состоящие из аминокислотных последовательностей, приведенных в последовательностях с четными номерами от SEQ ID NO: с 2 до 30 (т. е., SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30), изложены в последовательностях с нечетными номерами от SEQ ID NO: с 1 до 29 (т.е. SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 и 29).
[0062]
Аминокислотные последовательности, приведенные в SEQ ID NO: 6, 8, 10, 12 и 14 в списке последовательностей, представляют собой аминокислотные последовательности белка CAPRIN-1, выделенные в качестве полипептидов, которые связываются с антителом, в частности, присутствующим в сыворотке, получаемой от собак-опухоленосителей с помощью способа SEREX, используя библиотеку кДНК, полученную из ткани семенника собаки, и сыворотку собак с раком молочной железы; аминокислотные последовательности, приведенные в SEQ ID NO: 2 и 4, представляют собой аминокислотные последовательности, выделенные в качестве гомологичных факторов человека (гомологов или ортологов) полипептидов; аминокислотная последовательность, приведенная в SEQ ID NO: 16, представляет собой аминокислотную последовательность, выделенную в качестве его гомологичного фактора коровы; аминокислотная последовательность, приведенная в SEQ ID NO: 18, представляет собой аминокислотную последовательность, выделенную в качестве его гомологичного фактора лошади; аминокислотные последовательности, приведенные в SEQ ID NO: с 20 до 28, представляют собой аминокислотные последовательности, выделенные в качестве его гомологичных факторов мыши; и аминокислотная последовательность, приведенная в SEQ ID NO: 30, представляет собой аминокислотную последовательность, выделенную в качестве его гомологичного фактора курицы (см. пример 1, описанный ниже). Известно, что экспрессия белка CAPRIN-1 происходит при активации нормальных клеток в фазе покоя или при возникновении клеточного деления.
[0063]
Исследование выявило, что клеточная поверхность клеток рака печени экспрессирует белок CAPRIN-1. В настоящем изобретении предпочтительно используют антитело, которое связывается с частью белка CAPRIN-1, экспрессированной на клеточной поверхности клеток рака печени. Примеры фрагментарного пептида (фрагмента) белка CAPRIN-1, экспрессируемого на клеточной поверхности клеток рака печени, включают пептиды, которые содержат по меньшей мере семь последовательных аминокислотных остатков в области положений аминокислотных остатков с (aa) 233 до (aa) 343, положений аминокислотных остатков с (aa) 512 до C-конца или положений аминокислотных остатков с (aa) 50 до (aa) 98 аминокислотных последовательностей, приведенных в последовательностях с четными номерами SEQ ID NO: с 2 до 30, за исключением SEQ ID NO: 6 и 18, в списке последовательностей. В частности, например, фрагментарный пептид (фрагмент) представляет собой пептид, который содержит по меньшей мере семь последовательных аминокислотных остатков в аминокислотной последовательности, приведенной в SEQ ID NO: 429, SEQ ID NO: 428, SEQ ID NO: 273 (в аминокислотной последовательности, приведенной в SEQ ID NO: 273, область аминокислотной последовательности, приведенной в SEQ ID NO: 274 или SEQ ID NO: 275, является предпочтительной), SEQ ID NO: 266 (в аминокислотной последовательности, приведенной в SEQ ID NO: 266, область аминокислотной последовательности, приведенной в SEQ ID NO: 267 или SEQ ID NO: 268, является предпочтительной), SEQ ID NO: 270, SEQ ID NO: 272, SEQ ID NO: 269, SEQ ID NO: 430, SEQ ID NO: 431 или SEQ ID NO: 432, или в аминокислотной последовательности, которая имеет идентичность последовательностей 80% или больше, предпочтительно 85% или больше, более предпочтительно 90% или больше и наиболее предпочтительно 95% или больше, такую как 96% или больше, 97% или больше, 98% или больше или 99% или больше с аминокислотной последовательностью, указанной выше. Примеры антитела, используемого в настоящем изобретении, включают все антитела, которые связываются с каким-либо из этих пептидов и проявляют противоопухолевую активность.
[0064]
Антитело против белка CAPRIN-1, используемое в настоящем изобретении, может относиться к любому типу антител, который проявляет противоопухолевую активность, и их примеры включают моноклональные антитела; поликлональные антитела; рекомбинантные антитела, такие как синтетические антитела, полиспецифические антитела (например, диатела и триатела), гуманизированные антитела, химерные антитела и одноцепочечные антитела (scFv); антитела человека; и фрагменты этих антител, такие как Fab, F(abʹ)2 и Fv. Эти антитела и их фрагменты могут получать специалисты в данной области посредством известного способа. В настоящем изобретении, антитело, способное специфически связываться с белком CAPRIN-1, является желательным, и предпочтительно представляет собой моноклональное антитело. Однако антитело может представлять собой поликлональное антитело, которое является гомогенным и которое можно стабильно получать. Когда субъектом является человек, антитело человека или гуманизированное антитело является желательным для ингибирования или супрессии реакции отторжения.
[0065]
Здесь термин «специфически связывается с белком CAPRIN-1» относится к специфичному связыванию с белком CAPRIN-1 и по существу не связыванию других белков.
[0066]
Противоопухолевую активность антитела, которое можно использовать в настоящем изобретении, можно оценивать, как описано ниже, посредством исследования супрессии опухолевого роста in vivo у животного-опухоленосителя или исследования того, наблюдают ли или нет цитотоксичность посредством клеток иммунной системы или комплемента на опухолевых клетках, экспрессирующих полипептид in vitro.
[0067]
Субъект в качестве объекта лечения и/или предотвращения рака печени в настоящем изобретении представляет собой млекопитающее, такое как человек, комнатное животное, домашнее животное или животное для использования в соревнованиях; и предпочтительно является человеком.
[0068]
Далее описаны получение антигена, получение антитела и фармацевтическая композиция в соответствии с настоящим изобретением.
[0069]
<Получение антигена для получения антитела>
Белок или его фрагмент, подлежащий использованию в качестве сенсибилизирующего антигена для получения антитела против белка CAPRIN-1, используемого в настоящем изобретении, можно извлекать из животных любого вида, таких как человек, собака, корова, лошадь, мышь, крыса или курица, и предпочтительно выбор делают с учетом совместимости с родительскими клетками, используемыми для слияния клеток. В целом, белок предпочтительно представляет собой белок, полученный от млекопитающего, в частности, человека. Например, когда белок CAPRIN-1 представляет собой белок CAPRIN-1 человека, можно использовать белок CAPRIN-1 человека, его фрагментарный пептид (фрагмент) или клетки, экспрессирующие белок CAPRIN-1 человека.
[0070]
Нуклеотидные последовательности и аминокислотные последовательности CAPRIN-1 человека и их гомолог можно получать, например, посредством осуществления доступа к GenBank (NCBI, USA) и использования такого алгоритма, как BLAST или FASTA (Karlin and Altschul, Proc. Natl. Acad. Sci. USA, 90: 5873-5877, 1993; Altschul et al., Nucleic Acids Res., 25: 3389-3402, 1997).
[0071]
В настоящем изобретении целью является нуклеиновая кислота или белок, состоящий из последовательности, которая имеет идентичность последовательностей от 70% до 100%, предпочтительно от 80% до 100%, более предпочтительно от 90% до 100% и наиболее предпочтительно от 95% до 100%, например, от 97% до 100%, от 98% до 100%, от 99% до 100% или от 99,5% до 100%, с нуклеотидной последовательностью или аминокислотной последовательностью ORF или зрелой части CAPRIN-1 человека, когда ее нуклеотидная последовательность и аминокислотная последовательность основаны на последовательностях, приведенных в SEQ ID NO: 1 или 3 и SEQ ID NO: 2 или 4, соответственно. Здесь термин «% идентичности последовательностей» между двумя аминокислотными (или нуклеотидными) последовательностями относится к процентной доле (%) числа аминокислот (или нуклеотидов) в одной последовательности, совпадающих с таковыми в другой последовательности от общего числа, когда две последовательности выравнивают (выровнены) с максимальной степенью сходства или совпадения посредством введения или не введения пропуска.
[0072]
Фрагмент белка CAPRIN-1 имеет длину от аминокислотной длины эпитопа (антигенной детерминанты), который представляет собой минимальную единицу, распознаваемую антителом, до аминокислотной длины, которая короче общей длины белка. Эпитоп относится к пептидному фрагменту, который обладает антигенностью или иммуногенностью у млекопитающих, предпочтительно у человека, и его минимальная единица состоит приблизительно из от 7 до 12 аминокислот, например, от 8 до 11 аминокислот. Примеры эпитопа включают аминокислотные последовательности, приведенные в SEQ ID NO: 273, SEQ ID NO: 266, SEQ ID NO: 270, SEQ ID NO: 272 и SEQ ID NO: 269; и фрагментарные пептиды, каждый состоит из аминокислотной последовательности, которая имеет идентичность последовательностей 80% или больше, предпочтительно 85% или больше, более предпочтительно 90% или больше и наиболее предпочтительно 95% или больше с любой из аминокислотных последовательностей.
[0073]
Полипептид, который содержит белок CAPRIN-1 человека или его фрагментарный пептид, можно синтезировать, например, в соответствии со способом химического синтеза, таким как способ с флуоренилметилоксикарбонилом (Fmoc) или с трет-бутилоксикарбонилом (tBoc) (Seikagaku Jikken Koza (Course of Biochemical Experiments) 1, Tanpakushitsu no Kagaku (Protein Chemistry) IV, Kagaku shushoku to peputido gosei (Chemical modification and peptide synthesis), под редакцией the Japanese Biochemical Society, Tokyo Kagaku Dojin (Japan), 1981). Альтернативно, пептид можно синтезировать посредством обычного способа с использованием различных коммерчески доступных пептидных синтезаторов. Кроме того, целевой полипептид можно получать посредством получения полинуклеотида, который кодирует полипептид, посредством известной процедуры генетической инженерии (например, Sambrook, et al., Molecular Cloning, 2nd edition, Current Protocols in Molecular Biology (1989), Cold Spring Harbor Laboratory Press; Ausubel, et al., Short Protocols in Molecular Biology, 3rd edition, A compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley & Sons), встраивания полинуклеотида в экспрессирующий вектор и введения его в клетку-хозяин, и предоставления клетке-хозяину возможности продуцировать полипептид.
[0074]
Полинуклеотид, который кодирует полипептид, можно легко получать посредством известной процедуры генетической инженерии или посредством обычного способа с использованием коммерчески доступного пептидного синтезатора. Например, ДНК, содержащую нуклеотидную последовательность, приведенную в SEQ ID NO: 1, можно получать посредством ПЦР с использованием пары праймеров, разработанных так, что нуклеотидную последовательность, приведенную в SEQ ID NO: 1, можно амплифицировать с использованием хромосомной ДНК человека или библиотеки кДНК в качестве матрицы. Условия реакции для ПЦР можно определять надлежащим образом, и их неограничивающие примеры включают условия, в которых используют ПЦР буфер, содержащий термостабильную ДНК полимеразу (например, полимеразу Taq) и Mg2+, и амплификацию осуществляют посредством повторения, например, 30 циклов процесса, состоящего из реакций при 94°C в течение 30 секунд (денатурация), при 55°C в течение от 30 секунд до 1 минуты (отжиг), и при 72°C в течение 2 минут (достройка) и затем осуществление реакции при 72°C в течение 7 минут. Процедура, условия и другие факторы для ПЦР описаны, например, в Ausubel, et al., Short Protocols in Molecular Biology, 3rd edition, A compendium of Methods from Current Protocols in Molecular Biology, (1995), John Wiley & Sons (в частности, 15-я глава).
[0075]
Желаемую ДНК можно выделять посредством получения подходящих зондов и праймеров на основе информации о нуклеотидных последовательностях и аминокислотных последовательностях, приведенных в SEQ ID NO: с 1 до 30 списка последовательностей в описании, и скрининга, например, библиотеки кДНК человека с использованием получаемых зондов и праймеров. Библиотеку кДНК предпочтительно конструируют из клеток, органа или ткани, экспрессирующих белки, приведенные в любой из последовательностей с четными номерами из SEQ ID NO: с 2 до 30. Примеры клеток и ткани включают те, которые получены из семенника и рака или опухолевых клеток, таких как лейкоз, рак молочной железы, лимфома, опухоль головного мозга, рак легких, рак ободочной кишки и рак печени. Описанные выше процедуры, такие как получение зондов или праймеров, конструирование библиотеки кДНК, скрининг библиотеки кДНК и клонирование целевого гена, известны специалистам в данной области, и их можно осуществлять, например, в соответствии со способом, описанным, например, в Sambrook, et al., Molecular Cloning, 2nd edition, Current Protocols in Molecular Biology, (1989) или Ausbel, et al. (выше). ДНК, кодирующую белок CAPRIN-1 человека или его фрагментарный пептид, можно получать из полученной таким образом ДНК.
[0076]
Клетка-хозяин может представлять собой любую клетку, которая может экспрессировать указанный выше пептид, и ее примеры включают, но не ограничиваясь этим, прокариотические клетки, такие как клетки E. coli, и эукариотические клетки, такие как клетки млекопитающих, например, клетки почки мартышки COS1 и клетки яичника китайского хомячка CHO, линия клеток почки эмбриона человека HEK293, клеточная линия эмбриональных фибробластов мыши NIH3T3, дрожжевые клетки, например, почкующиеся дрожжи и делящиеся дрожжевые клетки, клетки шелковичного червя и яйцеклетки Xenopus.
[0077]
Когда прокариотические клетки используют в качестве клеток-хозяев, используют экспрессирующий вектор, имеющий точку начала репликации в прокариотической клетке, промотор, участок связывания рибосомы, множественный сайт клонирования, терминатор, ген устойчивости к лекарственному средству, ауксотрофный комплементарный ген и т.д. Примеры экспрессирующего вектора для E. coli включают вектор pUC, pBluescriptII, экспрессирующую систему pET и экспрессирующую систему pGEX. Полипептид, описанный выше, можно экспрессировать в прокариотических клетках-хозяевах посредством встраивания ДНК, кодирующей полипептид, в такой экспрессирующий вектор, трансформации прокариотических клеток-хозяев вектором и последующего культивирования получаемого трансформанта. В этом случае полипептид также можно экспрессировать в виде слитого белка с другим белком.
[0078]
Когда эукариотические клетки используют в качестве клеток-хозяев, используют экспрессирующий вектор для эукариотических клеток, имеющий промотор, область сплайсинга, сайт присоединения поли(A) и т.д. Примеры экспрессирующего вектора включают вектор pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, EBV, pRS, pcDNA3 и pYES2. Полипептид, описанный выше, можно экспрессировать в эукариотических клетках-хозяевах, как изложено выше, посредством встраивания ДНК, кодирующей полипептид, в такой экспрессирующий вектор, трансформации эукариотических клеток-хозяев вектором и последующего культивирования получаемого трансформанта. Когда экспрессирующий вектор, например, представляет собой pIND/V5-His, pFLAG-CMV-2, pEGFP-N1 или pEGFP-C1, полипептид можно экспрессировать в виде слитого белка с меткой, такой как гистидиновая (например, от (His)6 до (His)10), метка FLAG, метка myc, метка HA или GFP.
[0079]
Введение экспрессирующего вектора в клетки-хозяева можно осуществлять посредством известного способа, такого как электропорация, трансфекция с фосфатом кальция, липосомный способ, способ с DEAE-декстраном, микроинъекция, вирусная инфекция, липофекция или связывание с пептидом, проникающим в клетки.
[0080]
Целевой полипептид можно выделять и очищать из клеток-хозяев посредством объединения известных процедур разделения. Примеры процедур разделения включают, но не ограничиваясь этим, обработку денатурирующим средством, таким как мочевина или поверхностно-активное вещество, обработку ультразвуком, ферментативное расщепление, высаливание, фракционная преципитация в растворителе, диализ, центрифугирование, ультрафильтрование, гель-фильтрация, SDS-PAGE, форез с изоэлектрическим фокусированием, ионообменная хроматография, гидрофобная хроматография, аффинная хроматография и хроматография с обращенной фазой.
[0081]
<Структура антитела>
Антитело обычно представляет собой гетеромультимерный гликопротеин, который содержит по меньшей мере две тяжелые цепи и две легкие цепи. За исключением IgM, антитело представляет собой гетеротетрамерный гликопротеин приблизительно 150 кДа, который содержит две одинаковые легкие (L) цепи и две одинаковые тяжелые (H) цепи. Типично, легкая цепь соединена с тяжелой цепью через дисульфидную ковалентную связь, и число дисульфидных связей между тяжелыми цепями варьирует в зависимости от изотипа иммуноглобулина. Каждая из тяжелых цепей и легких цепей имеет дисульфидную связь внутри цепи. Каждая тяжелая цепь имеет вариабельный домен (VH домен) на одном конце, за которым следует несколько константных доменов. Каждая легкая цепь имеет вариабельный домен (домен VL) и константный домен на ее другом конце. Константный домен легкой цепи выравнивается с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выравнивается с вариабельным доменом тяжелой цепи. Вариабельные домены антитела придают антителу специфичность связывания со специфичными областями, представляющими конкретную вариабельность, которые называют определяющими комплементарность областями (CDR). Относительно консервативные части вариабельных доменов называют каркасными областями (FR). Вариабельные домены каждой из интактных тяжелых и легких цепей содержат четыре FR, соединенные тремя CDR. Три CDR в тяжелой цепи называют CDRH1, CDRH2 и CDRH3 в таком порядке от N-концевой стороны. Аналогичным образом, в легкой цепи CDR называют CDRL1, CDRL2 и CDRL3. CDRH3 наиболее важен для специфичности связывания антитела с антигеном. CDR каждой цепи удерживаются вместе в смежном состоянии посредством FR и вместе с CDR другой цепи вносят вклад в формирование антигенсвязывающего участка антитела. Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие в антителозависимой клеточноопосредованной цитотоксичности (ADCC), фагоцитозе через связывание с рецептором Fc γ, отношение время полужизни/клиренс через неонатальный рецептор Fc (FcRn) и комплемент-зависимая цитотоксичность (CDC) через компонент C1q каскада комплемента.
[0082]
<Получение антитела>
Антитело против CAPRIN-1 в настоящем изобретении представляет собой антитело, которое имеет иммунологическую реактивность с полноразмерным белком CAPRIN-1 или его фрагментом.
[0083]
Здесь термин «иммунологическая реактивность» относится к свойству антитела и антигена CAPRIN-1 связываться друг с другом in vivo, и через такое связывание проявляется функция ослабления опухоли (например, смерть, супрессия или регрессия). То есть антитело, используемое в настоящем изобретении, может представлять собой какое-либо антитело, которое связывается с белком CAPRIN-1 и, тем самым, может ослаблять рак печени.
[0084]
Примеры антитела включают моноклональные антитела, поликлональные антитела, синтетические антитела, полиспецифические антитела, антитела человека, гуманизированные антитела, химерные антитела, одноцепочечные антитела и фрагменты антител (например, Fab, F(abʹ)2 и Fv). Антитело представляет собой подходящий класс молекулы иммуноглобулина, такой как IgG, IgE, IgM, IgA, IgD или IgY, или подходящий подкласс, такой как IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2.
[0085]
Антитело дополнительно можно модифицировать, например, посредством ацетилирования, формилирования, амидирования, фосфорилирования или полиэтиленгликолирования (пегилирования), а также гликозилирования.
[0086]
Далее описаны примеры получения различных антител.
[0087]
В моноклональном антителе, например, мышь иммунизируют белком CAPRIN-1, клетками рака печени, экспрессирующими белок CAPRIN-1, или клеточной линией (например, Hep3B) этих клеток; у мыши извлекают селезенку; клетки селезенки разделяют и сливают с миеломными клетками мыши; и клоны, продуцирующие антитела, которые имеют ингибирующую рост клеток рака активность, отбирают из получаемых слитых клеток (гибридом). Гибридому, которая продуцирует моноклональное антитело, которое имеет ингибирующую рост клеток рака активность, выделяют и культивируют, и антитело очищают от культурального супернатанта посредством обычной аффинной очистки для того, чтобы получать моноклональное антитело.
[0088]
Гибридому, продуцирующую моноклональное антитело, также можно получать, например, следующим образом. Сначала животное иммунизируют сенсибилизирующим антигеном в соответствии с известным способом. В целом, сенсибилизирующий антиген интраперитонеально или подкожно инъецируют млекопитающему. В частности, сенсибилизирующий антиген надлежащим образом разводят, например, фосфатно-солевым буфером (PBS) или физиологическим раствором. Получаемую суспензию необязательно смешивают с подходящим количеством обычного адъюванта, такого как полный адъювант Фрейнда, и эмульсифицируют, а затем вводят млекопитающему несколько раз с интервалами от 4 до 21 суток. Кроме того, подходящий носитель можно использовать при иммунизации сенсибилизирующим антигеном.
[0089]
После иммунизации млекопитающего и подтверждения увеличения уровня желаемого антитела в сыворотке, у млекопитающего берут клетки иммунной системы и подвергают слиянию клеток. Клетки иммунной системы предпочтительно представляют собой клетки селезенки.
[0090]
Миеломные клетки млекопитающего используют в качестве других родительских клеток, подлежащих слиянию с клетками иммунной системы. В качестве миеломных клеток можно соответствующим образом использовать различные известные клеточные линии, например, P3U1 (P3-X63Ag8U1), P3 (P3x63Ag8.653) (J. Immunol., (1979), 123, 1548-1550), P3x63Ag8U.1 (Current Topics in Microbiology and Immunology, (1978), 81, 1-7), NS-1 (Kohler, G. and Milstein, C., Eur. J. Immunol,. (1976), 6, 511-519), MPC-11 (Margulies, D.H., et al., Cell, (1976), 8, 405-415), SP2/0 (Shulman, M. et al., Nature, (1978), 276, 269-270), FO (deSt. Groth, S.F., et al., J. Immunol. Methods, (1980), 35, 1-21), S194 (Trowbridge, I.S., J. Exp. Med., (1978), 148, 313-323) или R210 (Galfre, G. et al., Nature, (1979), 277, 131-133).
[0091]
Клетки иммунной системы и миеломные клетки в основном можно сливать посредством известного способа, например, в соответствии со способом Kohler and Milstein (Kohler, G. and Milstein, C., Methods Enzymol., (1981), 73, 3-46).
[0092]
Более конкретно, слияние клеток осуществляют, например, в обычном питательном культуральном растворе в присутствии ускорителя слияния клеток. Примеры ускорителя слияния клеток включают полиэтиленгликоль (PEG) и вирус Сендай (HVJ). Кроме того, вспомогательное средство, такое как диметилсульфоксид, можно необязательно использовать для увеличения эффективности слияния.
[0093]
Числовое соотношение между клетками иммунной системы и миеломными клетками можно определять произвольно. Например, отношение числа клеток иммунной системы к числу миеломных клеток предпочтительно составляет от 1 до 10. Культуральный раствор, используемый при слиянии клеток, может представлять собой, например, культуральный раствор RPMI1640 или культуральный раствор MEM, подходящий для роста линии миеломных клеток, или обычный культуральный раствор, который используют для такой клеточной культуры. Кроме того, заменитель сыворотки, такой как эмбриональная телячья сыворотка (FCS) можно добавлять в культуральный раствор.
[0094]
Слияние клеток осуществляют посредством смешивания достаточных предварительно определяемых количеств клеток иммунной системы и миеломных клеток в культуральном растворе, добавления раствора PEG (средняя молекулярная масса: например, приблизительно от 1000 до 6000), предварительно нагретого приблизительно до 37°C, в смесь, обычно, в концентрации от 30% до 60% (масс./об.), и смешивания их для того, чтобы формировать желаемую гибридому. Последовательно в смесь добавляют подходящий культуральный раствор и удаляют супернатант посредством центрифугирования. Эту процедуру повторяют для того, чтобы удалять компоненты, такие как промотор слияния, которые нежелательны для роста гибридомы.
[0095]
Таким образом полученную гибридому можно отбирать посредством культивирования в обычном культуральном растворе для отбора, например, в культуральном растворе HAT (культуральный раствор, который содержит гипоксантин, аминоптерин и тимидин). Культивирование в культуральном растворе HAT продолжают в течение достаточного периода времени (обычно, от нескольких суток до нескольких недель) для того, чтобы убить клетки (не слитые клетки), отличные от целевых гибридом. Впоследствии обычный способ предельного разведения осуществляют для скрининга и отдельного клонирования гибридомы, которая продуцирует целевое антитело.
[0096]
Вместо способа получения гибридомы посредством иммунизации не относящегося к человеку животного антигеном, гибридому, которая продуцирует антитело человека, которое имеет желаемую активность (например, ингибирующую рост клеток активность), можно получать посредством сенсибилизации лимфоцитов человека, например, лимфоцитов человека, инфицированных вирусом EB, с использованием белка, клеток, экспрессирующих белок, или их лизата in vitro, и слияния сенсибилизированных лимфоцитов с миеломными клетками, которые получены от человека и которые имеют способность к постоянному делению, например, U266 (регистрационный № TIB196).
[0097]
Таким образом полученную гибридому, которая продуцирует моноклональное антитело, можно пассировать в обычном культуральном растворе и можно хранить в жидком азоте в течение длительного времени.
[0098]
То есть желаемый антиген или клетку, экспрессирующую желаемый антиген, используют в качестве сенсибилизирующего антигена и иммунизацию проводят в соответствии с обычным способом; получаемые клетки иммунной системы сливают с известными родительскими клетками посредством обычного слияния клеток; и проводят скрининг продуцирующих моноклональные антитела клеток (гибридом) посредством обычного способа скрининга. Таким образом, можно получать гибридому.
[0099]
Другой пример антитела, которое можно использовать в настоящем изобретении, представляет собой поликлональное антитело. Поликлональное антитело можно получать, например, следующим образом.
[0100]
Сыворотку получают посредством иммунизации маленького животного, такого как мышь, продуцирующая антитела человека мышь или кролик, с использованием нативного белка CAPRIN-1, рекомбинантного белка CAPRIN-1, экспрессируемого в микроорганизмах, таких как E. coli, в виде слитого белка, например, с GST, или его фрагментарного пептида. Сыворотку очищают, например, посредством преципитации сульфатом аммония, колоночной хроматографии на белке A или белке G, ионообменной хроматографии с DEAE, или аффинной колоночной хроматографии, объединенной с белком CAPRIN-1 или синтетическим пептидом. В примерах, описанных ниже, получали поликлональное антитело кролика против белка CAPRIN-1 и подтверждали противоопухолевый эффект.
[0101]
Здесь в качестве продуцирующей антитела человека мыши известны мышь KM (Kirin Pharma Company, Limited/Medarex Inc.) и мышь Xeno (Amgen Inc.) (например, международные публикации №№WO 02/43478 и WO02/092812). Иммунизация такой мыши белком CAPRIN-1 или его фрагментом может обеспечивать полное поликлональное антитело человека в крови. Альтернативно, моноклональное антитело человеческого типа можно получать посредством извлечения клеток селезенки у иммунизированной мыши и слияния клеток селезенки с миеломными клетками.
[0102]
Антиген можно получать, например, в соответствии со способом с использованием клеток животных (публикация японского патента (Kohyo) № 2007-530068) или со способом с использованием бакуловируса, (например, международная публикация № WO98/46777). Антиген, который имеет низкую иммуногенность, можно иммунизировать в виде конъюгата с макромолекулой, которая имеет иммуногенность, такой как альбумин.
[0103]
Кроме того, можно использовать трансгенное антитело, созданное посредством технологии рекомбинации генов посредством клонирования гена антитела из гибридомы, встраивания гена в подходящий вектор и введения вектора в организм-хозяин (например, см. Carl, A.K. Borrebaeck, James, W. Larrick, THERAPEUTIC MONOCLONAL ANTIBODIES, Published in the United Kingdom by MACMILLAN PUBLISHERS LTD, 1990). В частности, кДНК вариабельного домена (V-домена) антитела синтезируют с использованием обратной транскриптазы из мРНК гибридомы. Если получают ДНК, которая кодирует V-домен целевого антитела, ДНК соединяют с ДНК, которая кодирует желаемый константный домен антитела (C-домен), за чем следует встраивание в экспрессирующий вектор. Альтернативно, ДНК, которая кодирует V-домен антитела, можно встраивать в экспрессирующий вектор, содержащий ДНК C-домена антитела. ДНК встраивают в экспрессирующий вектор так, что ДНК экспрессируют под управлением управляющего экспрессией домена, например, энхансера и промотора. Впоследствии клетку-хозяин трансформируют экспрессирующим вектором для того, чтобы экспрессировать антитело.
[0104]
Антитело против CAPRIN-1, используемое в настоящем изобретении, предпочтительно представляет собой моноклональное антитело, но может представлять собой поликлональное антитело или генетически измененное антитело (например, химерное антитело или гуманизированное антитело).
[0105]
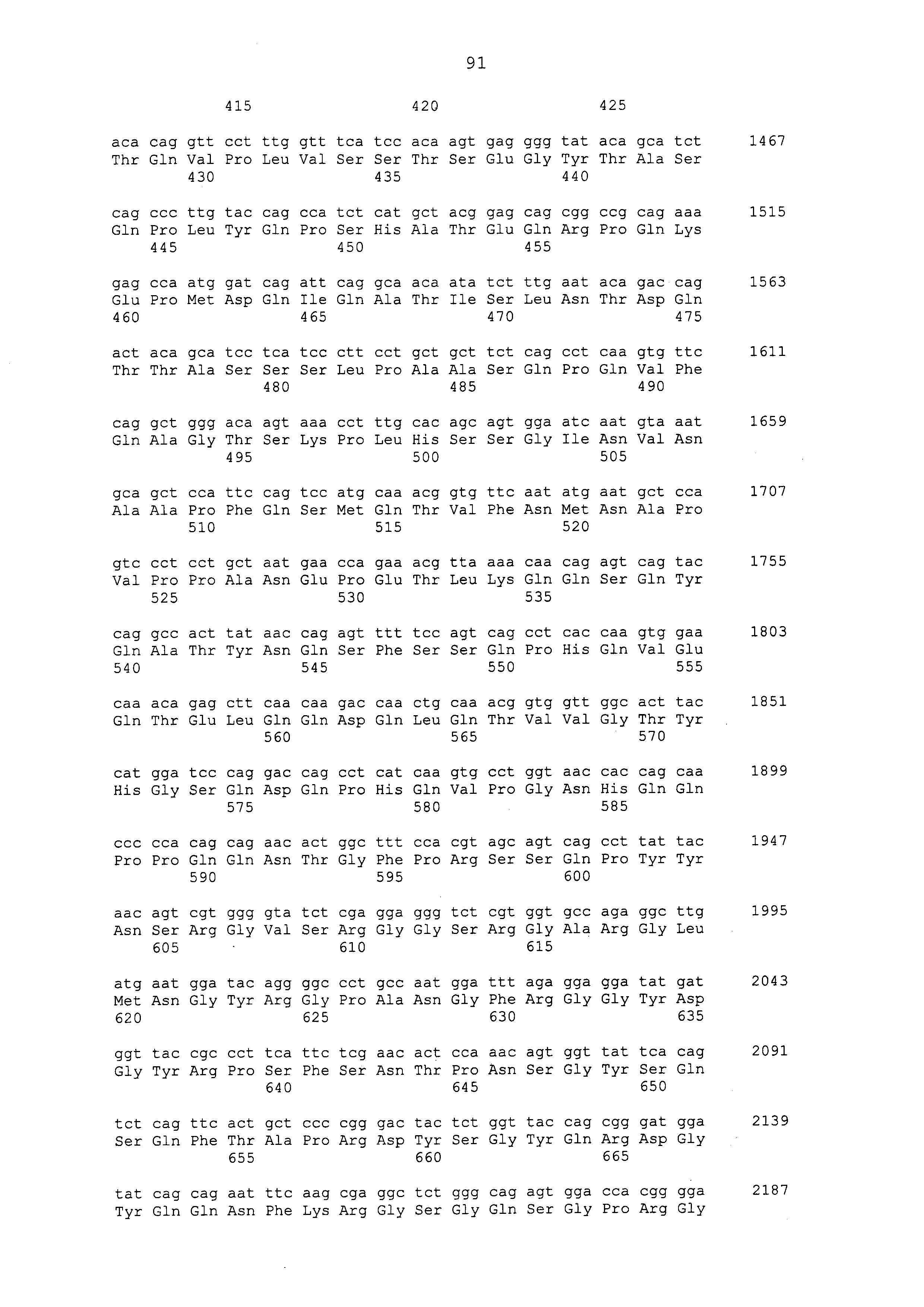
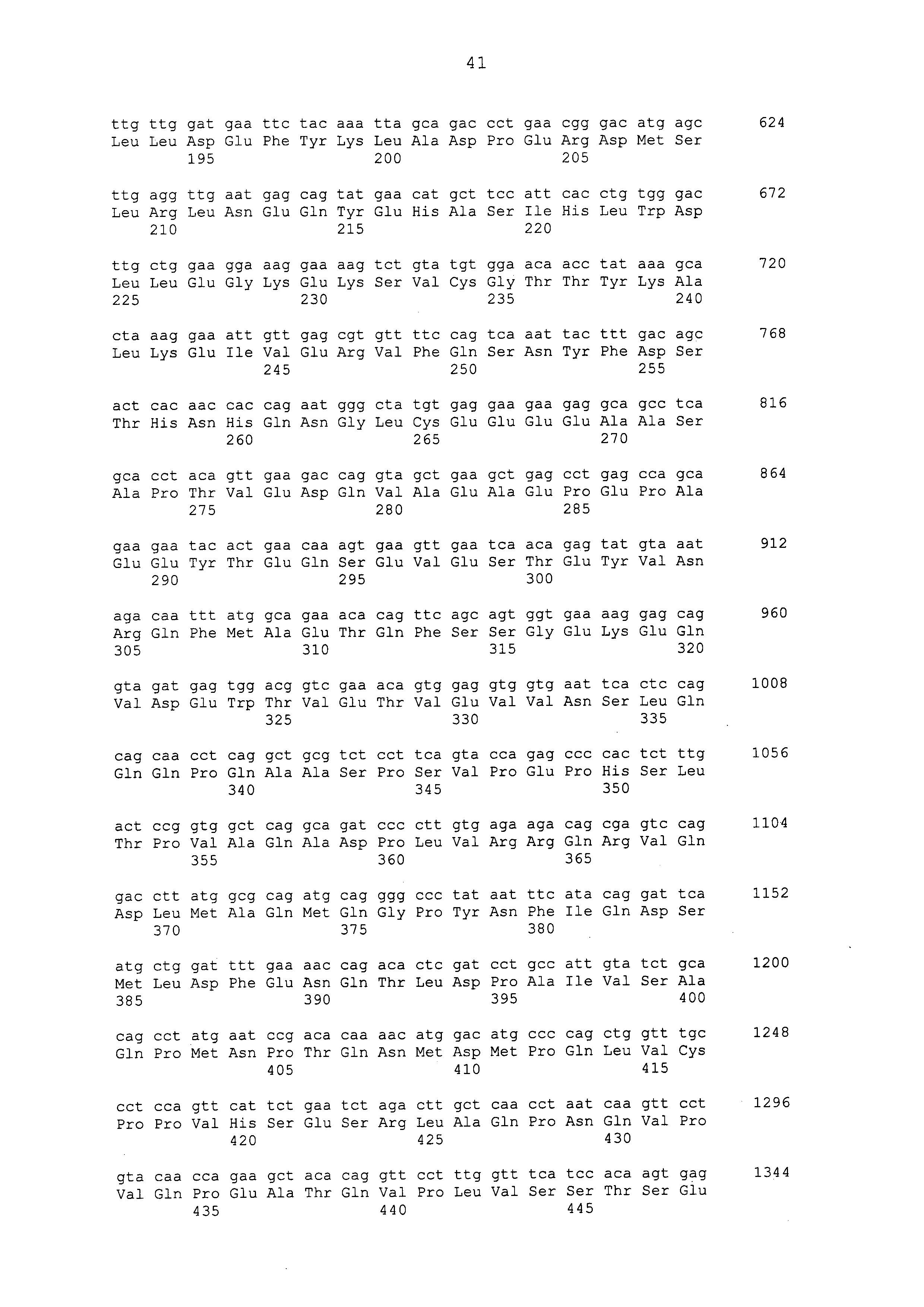
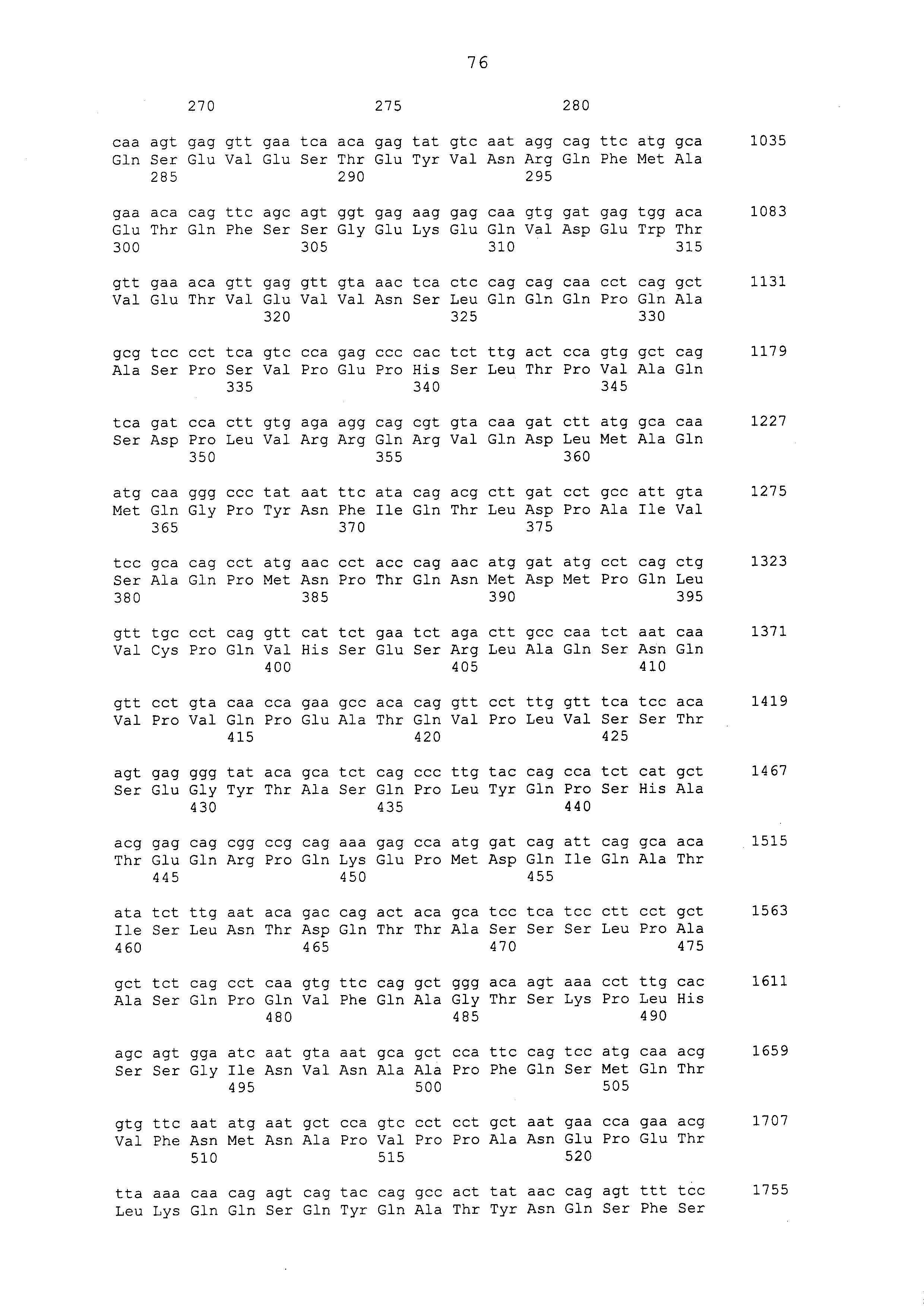
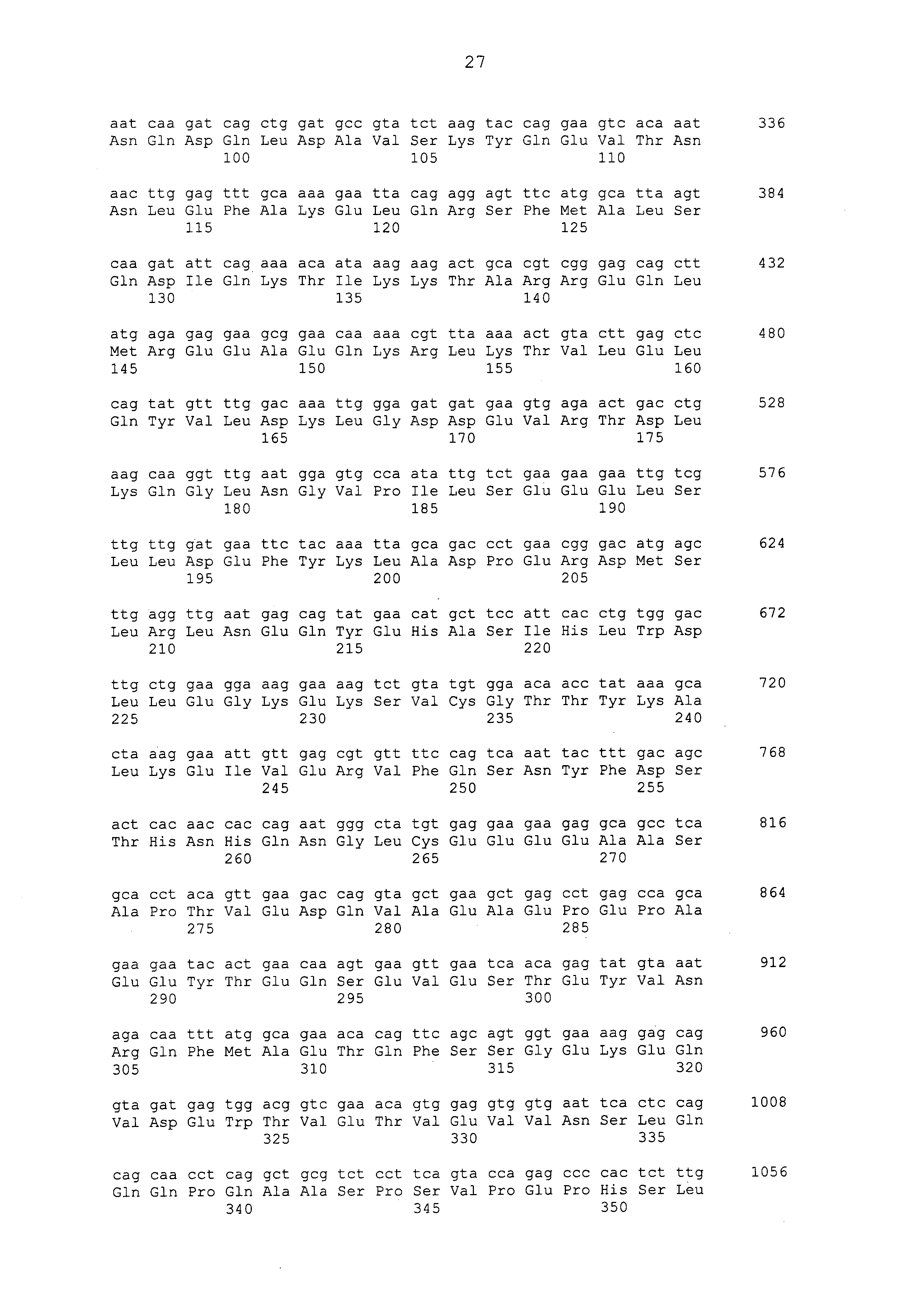
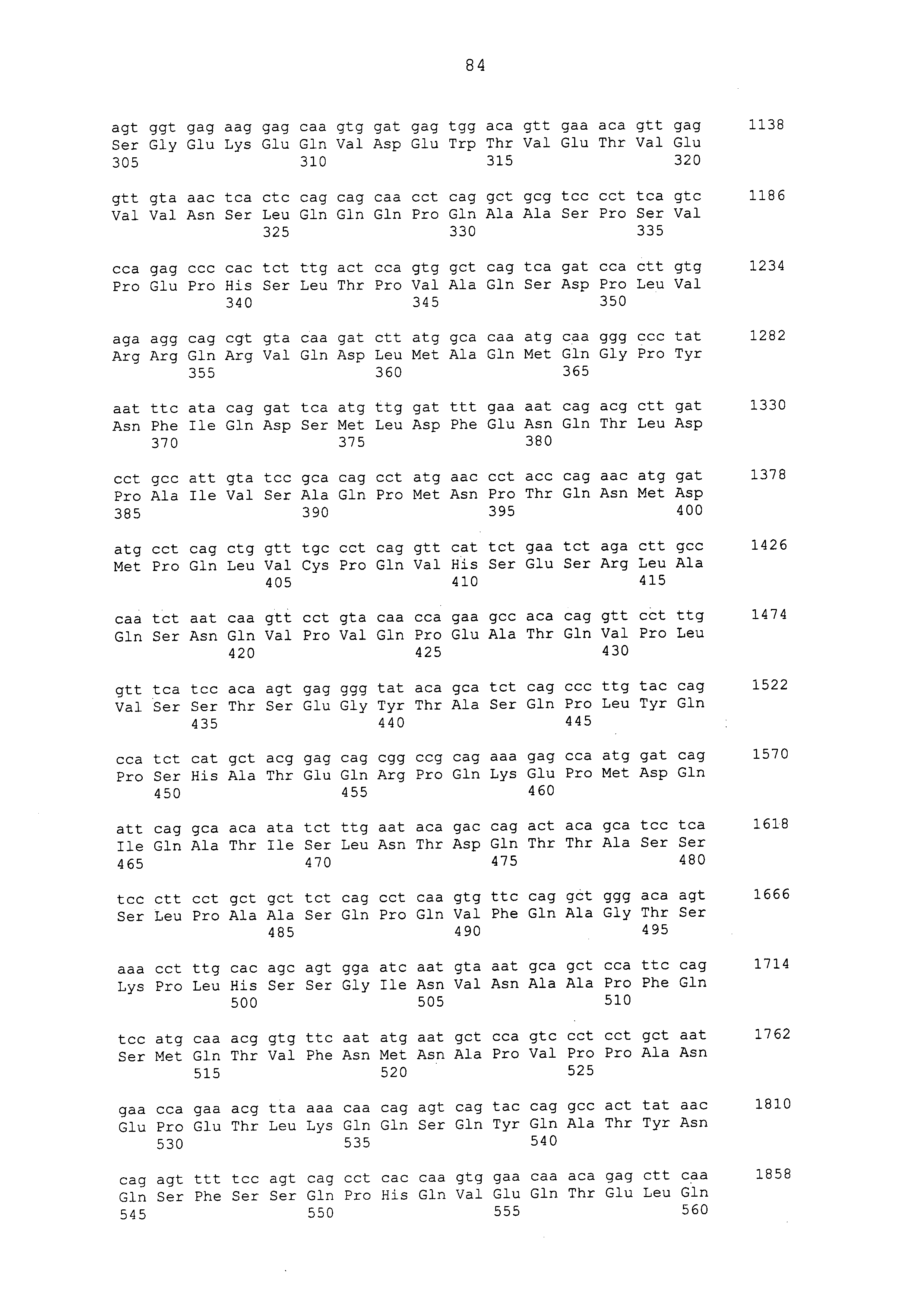
Примеры моноклональных антител включают моноклональные антитела человека, моноклональные антитела не относящегося к человеку животного (например, моноклональные антитела мыши, моноклональные антитела крысы, моноклональные антитела кролика и моноклональные антитела курицы). Моноклональное антитело можно получать посредством культивирования гибридом, полученных посредством слияния миеломных клеток с клетками селезенки, полученными от не относящегося к человеку млекопитающего (например, мыши или продуцирующей антитела человека мыши), иммунизированного белком CAPRIN-1. В примерах, описанных ниже, получали моноклональные антитела и подтверждали их противоопухолевые эффекты. Каждое из этих моноклональных антител содержит вариабельный (VH) домен тяжелой цепи, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 40, SEQ ID NO: 50, SEQ ID NO: 60, SEQ ID NO: 70, SEQ ID NO: 80, SEQ ID NO: 90, SEQ ID NO: 100, SEQ ID NO: 110, SEQ ID NO: 120, SEQ ID NO: 130, SEQ ID NO: 135, SEQ ID NO: 145, SEQ ID NO: 160, SEQ ID NO: 170, SEQ ID NO: 200, SEQ ID NO: 210, SEQ ID NO: 220, SEQ ID NO: 230, SEQ ID NO: 240, SEQ ID NO: 250, SEQ ID NO: 279, SEQ ID NO: 294, SEQ ID NO: 304, SEQ ID NO: 314, SEQ ID NO: 324, SEQ ID NO: 334, SEQ ID NO: 344, SEQ ID NO: 359, SEQ ID NO: 363, SEQ ID NO: 368, SEQ ID NO: 372, SEQ ID NO: 376, SEQ ID NO: 386, SEQ ID NO: 396, SEQ ID NO: 401, SEQ ID NO: 411 или SEQ ID NO: 421, и вариабельный (VL) домен легкой цепи, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 44, SEQ ID NO: 54, SEQ ID NO: 64, SEQ ID NO: 74, SEQ ID NO: 84, SEQ ID NO: 94, SEQ ID NO: 104, SEQ ID NO: 114, SEQ ID NO: 124, SEQ ID NO: 139, SEQ ID NO: 149, SEQ ID NO: 155, SEQ ID NO: 164, SEQ ID NO: 174, SEQ ID NO: 180, SEQ ID NO: 185, SEQ ID NO: 190, SEQ ID NO: 195, SEQ ID NO: 204, SEQ ID NO: 214, SEQ ID NO: 224, SEQ ID NO: 234, SEQ ID NO: 244, SEQ ID NO: 254, SEQ ID NO: 283, SEQ ID NO: 289, SEQ ID NO: 298, SEQ ID NO: 308, SEQ ID NO: 318, SEQ ID NO: 328, SEQ ID NO: 338, SEQ ID NO: 348, SEQ ID NO: 361, SEQ ID NO: 365, SEQ ID NO: 370, SEQ ID NO: 380, SEQ ID NO: 390, SEQ ID NO: 405, SEQ ID NO: 415 или SEQ ID NO: 425. Домен VH содержит CDR1, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 37, SEQ ID NO: 47, SEQ ID NO: 57, SEQ ID NO: 67, SEQ ID NO: 77, SEQ ID NO: 87, SEQ ID NO: 97, SEQ ID NO: 107, SEQ ID NO: 117, SEQ ID NO: 127, SEQ ID NO: 132, SEQ ID NO: 142, SEQ ID NO: 157, SEQ ID NO: 167, SEQ ID NO: 197, SEQ ID NO: 207, SEQ ID NO: 217, SEQ ID NO: 227, SEQ ID NO: 237, SEQ ID NO: 247, SEQ ID NO: 276, SEQ ID NO: 291, SEQ ID NO: 301, SEQ ID NO: 311, SEQ ID NO: 321, SEQ ID NO: 331, SEQ ID NO: 341, SEQ ID NO: 351, SEQ ID NO: 373, SEQ ID NO: 383, SEQ ID NO: 393, SEQ ID NO: 398, SEQ ID NO: 408 или SEQ ID NO: 418, CDR2, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 38, SEQ ID NO: 48, SEQ ID NO: 58, SEQ ID NO: 68, SEQ ID NO: 78, SEQ ID NO: 88, SEQ ID NO: 98, SEQ ID NO: 108, SEQ ID NO: 118, SEQ ID NO: 128, SEQ ID NO: 133, SEQ ID NO: 143, SEQ ID NO: 158, SEQ ID NO: 168, SEQ ID NO: 198, SEQ ID NO: 208, SEQ ID NO: 218, SEQ ID NO: 228, SEQ ID NO: 238, или SEQ ID NO: 248, SEQ ID NO: 277, SEQ ID NO: 292, SEQ ID NO: 302, SEQ ID NO: 312, SEQ ID NO: 322, SEQ ID NO: 332, SEQ ID NO: 342, SEQ ID NO: 352, SEQ ID NO: 374, SEQ ID NO: 384, SEQ ID NO: 394, SEQ ID NO: 399, SEQ ID NO: 409 или SEQ ID NO: 419, и CDR3, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 39, SEQ ID NO: 49, SEQ ID NO: 59, SEQ ID NO: 69, SEQ ID NO: 79, SEQ ID NO: 89, SEQ ID NO: 99, SEQ ID NO: 109, SEQ ID NO: 119, SEQ ID NO: 129, SEQ ID NO: 134, SEQ ID NO: 144, SEQ ID NO: 159, SEQ ID NO: 169, SEQ ID NO: 199, SEQ ID NO: 209, SEQ ID NO: 219, SEQ ID NO: 229, SEQ ID NO: 239, SEQ ID NO: 249, SEQ ID NO: 278, SEQ ID NO: 293, SEQ ID NO: 303, SEQ ID NO: 313, SEQ ID NO: 323, SEQ ID NO: 333, SEQ ID NO: 343, SEQ ID NO: 353, SEQ ID NO: 357, SEQ ID NO: 375, SEQ ID NO: 385, SEQ ID NO: 395, SEQ ID NO: 400, SEQ ID NO: 410, SEQ ID NO: 420. Домен VL содержит CDR1, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 41, SEQ ID NO: 51, SEQ ID NO: 61, SEQ ID NO: 71, SEQ ID NO: 81, SEQ ID NO: 91, SEQ ID NO: 101, SEQ ID NO: 111, SEQ ID NO: 121, SEQ ID NO: 136, SEQ ID NO: 146, SEQ ID NO: 152, SEQ ID NO: 161, SEQ ID NO: 171, SEQ ID NO: 177, SEQ ID NO: 182, SEQ ID NO: 187, SEQ ID NO: 192, SEQ ID NO: 201, SEQ ID NO: 211, SEQ ID NO: 221, SEQ ID NO: 231, SEQ ID NO: 241, SEQ ID NO: 251, SEQ ID NO: 280, SEQ ID NO: 286, SEQ ID NO: 295, SEQ ID NO: 305, SEQ ID NO: 315, SEQ ID NO: 325, SEQ ID NO: 335, SEQ ID NO: 345, SEQ ID NO: 354, SEQ ID NO: 377, SEQ ID NO: 387, SEQ ID NO: 402, SEQ ID NO: 412 или SEQ ID NO: 422, CDR2, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 42, SEQ ID NO: 52, SEQ ID NO: 62, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 92, SEQ ID NO: 102, SEQ ID NO: 112, SEQ ID NO: 122, SEQ ID NO: 137, SEQ ID NO: 147, SEQ ID NO: 153, SEQ ID NO: 162, SEQ ID NO: 172, SEQ ID NO: 178, SEQ ID NO: 183, SEQ ID NO: 188, SEQ ID NO: 193, SEQ ID NO: 202, SEQ ID NO: 212, SEQ ID NO: 222, SEQ ID NO: 232, SEQ ID NO: 242, SEQ ID NO: 252, SEQ ID NO: 281, SEQ ID NO: 287, SEQ ID NO: 296, SEQ ID NO: 306, SEQ ID NO: 316, SEQ ID NO: 326, SEQ ID NO: 336, SEQ ID NO: 346, SEQ ID NO: 355, SEQ ID NO: 378, SEQ ID NO: 388, SEQ ID NO: 403, SEQ ID NO: 413 или SEQ ID NO: 423, и CDR3, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 43, SEQ ID NO: 53, SEQ ID NO: 63, SEQ ID NO: 73, SEQ ID NO: 83, SEQ ID NO: 93, SEQ ID NO: 103, SEQ ID NO: 113, SEQ ID NO: 123, SEQ ID NO: 138, SEQ ID NO: 148, SEQ ID NO: 154, SEQ ID NO: 163, SEQ ID NO: 173, SEQ ID NO: 179, SEQ ID NO: 184, SEQ ID NO: 189, SEQ ID NO: 194, SEQ ID NO: 203, SEQ ID NO: 213, SEQ ID NO: 223, SEQ ID NO: 233, SEQ ID NO: 243, SEQ ID NO: 253, SEQ ID NO: 282, SEQ ID NO: 288, SEQ ID NO: 297, SEQ ID NO: 307, SEQ ID NO: 317, SEQ ID NO: 327, SEQ ID NO: 337, SEQ ID NO: 347, SEQ ID NO: 356, SEQ ID NO: 379, SEQ ID NO: 389, SEQ ID NO: 404, SEQ ID NO: 414 или SEQ ID NO: 424.
[0106]
Химерное антитело получают посредством объединения последовательностей, полученных от различных животных, и, например, представляет собой антитело, которое состоит из вариабельных доменов тяжелых и легких цепей антитела мыши и константных доменов тяжелых и легких цепей антитела человека. Химерное антитело можно получать известным способом, например, посредством соединения ДНК, кодирующей V-домен антитела, и ДНК, кодирующей C-домен антитела человека, встраивания их в экспрессирующий вектор и введения экспрессирующего вектора в организм-хозяин.
[0107]
Примеры поликлональных антител включают антитела, полученные посредством иммунизации продуцирующего антитела человека животного (например, мыши) белком CAPRIN-1.
[0108]
Гуманизированное антитело представляет собой измененное антитело, также называемое реконструированное антитело человека. Гуманизированное антитело конструируют посредством пересадки CDR антитела, полученного от иммунного животного, в определяющую комплементарность область антитела человека. Также известен способ с помощью общей технологии рекомбинации генов.
[0109]
В частности, последовательность ДНК, разработанную для соединения CDR антитела мыши и каркасных областей (FR; включая с FR1 до FR4) антитела человека в порядке: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, с N-концевой стороны, синтезируют посредством ПЦР из нескольких олигонуклеотидов, полученных с тем, чтобы иметь перекрывающиеся части в концевых областях. Получаемую ДНК соединяют с ДНК, кодирующей константный домен антитела человека, и встраивают в экспрессирующий вектор, а экспрессирующий вектор вводят в организм-хозяин для того, чтобы получать гуманизированное антитело (см. патентную заявку EP №EP 239400 и международную публикацию №WO 96/02576). FR антитела человека, соединенные через CDR, отбирают так, что определяющая комплементарность область образует удовлетворительный антигенсвязывающий участок. При необходимости, аминокислоту в каркасной области в вариабельном домене антитела можно заменять так, что определяющая комплементарность область реконструированного антитела человека формирует подходящий антигенсвязывающий участок (Sato K. et al., Cancer Research, 1993, 53: 851-856). Каркасную область можно заменять посредством каркасной области, полученной из различных антител человека (см. международную публикацию №WO 99/51743).
[0110]
Получаемое химерное антитело или гуманизированное антитело дополнительно можно подвергать, например, замене аминокислоты в вариабельном домене (например, FR) или константном домене на другую аминокислоту.
[0111]
При замене аминокислот заменяют, например, меньше чем 15, меньше чем 10, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше аминокислоты, предпочтительно от одной до пяти аминокислот и более предпочтительно одну или две аминокислоты. Антитело с заменой должно представлять собой функциональный эквивалент антитела без замены. Замена по желанию представляет собой консервативную аминокислотную замену, которая представляет собой замену между аминокислотами, которые имеют схожие свойства, такие как заряд, боковая цепь, полярность и ароматичность. Аминокислоты, которые имеют схожие свойства, можно разделить на классы, например, основные аминокислоты (аргинин, лизин и гистидин), кислые аминокислоты (аспарагиновая кислота и глутаминовая кислота), незаряженные полярные аминокислоты (глицин, аспарагин, глутамин, серин, треонин, цистеин и тирозин), неполярные аминокислоты (лейцин, изолейцин, аланин, валин, пролин, фенилаланин, триптофан и метионин), аминокислоты с разветвленной цепью (лейцин, валин и изолейцин) или ароматические аминокислоты (фенилаланин, тирозин, триптофан и гистидин).
[0112]
Примеры модифицированных антител включают антитела, связанные с различными молекулами, такими как полиэтиленгликоль (PEG). В модифицированном антителе, используемом в настоящем изобретении, антитело может быть связано с любым материалом. Эти модифицированные антитела можно получать посредством химической модификации полученного антитела. В этой области уже создан способ модификации.
[0113]
Здесь термин «функционально эквивалентен» относится к тому, что целевое антитело имеет биологическую или биохимическую активность, схожую с таковой у антитела, используемого в настоящем изобретении, в частности, например, к тому, что целевое антитело имеет функцию ослабления опухоли и по существу не вызывает реакции отторжения при применении у человека. Такая активность, например, представляет собой ингибирующую рост клеток активность или авидность.
[0114]
Способ, хорошо известный специалистам в данной области, для получения полипептида, функционально эквивалентного определенному полипептиду, представляет собой способ введения вариаций в полипептид. Например, специалист в данной области может получать антитело, функционально эквивалентное антителу, используемому в настоящем изобретении, посредством введения подходящей вариации в антитело, например, через сайт-специфический мутагенез (Hashimoto-Gotoh, T. et al., (1995), Gene, 152, 271-275; Zoller, M.J., and Smith, M., (1983), Methods Enzymol., 100, 468-500; Kramer, W. et al., (1984), Nucleic Acids Res., 12, 9441-9456; Kramer, W. and Fritz, H.J., (1987), Methods Enzymol., 154, 350-367; Kunkel, TA., (1985), Proc. Natl. Acad. Sci. USA., 82, 488-492; Kunkel, (1988), Methods Enzymol., 85, 2763-2766).
[0115]
Антитело, распознающее эпитоп белка CAPRIN-1, который распознает антитело против CAPRIN-1, можно получать с помощью способа, известного специалистам в данной области. Антитело можно получать, например, с помощью способа получения антитела посредством определения эпитопа белка CAPRIN-1, распознаваемого антителом против CAPRIN-1, обычным способом (например, картирование эпитопов) и использования полипептида, который содержит аминокислотную последовательность эпитопа, в качестве иммуногена, или с помощью способа отбора антитела, которое имеет тот же эпитоп, что и у антитела против CAPRIN-1, из антител, которые имеют различные эпитопы, полученных обычным способом.
[0116]
Антитело, используемое в настоящем изобретении, предпочтительно имеет константу сродства Ka (kon/koff) 107 M-1 или больше, 108 M-1 или больше, 5×108 M-1 или больше, 109 M-1 или больше, 5×109 M-1 или больше, 1010 M-1 или больше, 5×1010 M-1 или больше, 1011 M-1 или больше, 5×1011 M-1 или больше, 1012 M-1 или больше или 1013 M-1 или больше.
[0117]
Антитело, используемое в настоящем изобретении, можно конъюгировать с противоопухолевым средством. Антитело и противоопухолевое средство могут быть связаны друг с другом через спейсер, который имеет реакционно-способную группу, такую как аминогруппа, карбоксильная группа, гидроксильная группа или тиоловая группа (например, сукцинимидильная группа, формильная группа, 2-пиридилдитиогруппа, малеимидильная группа, аклоксикарбонильная группа или гидроксигруппа).
[0118]
Примеры противоопухолевого средства включают следующие противоопухолевые средства, публично известные из документов или других сообщений, т.е. паклитаксел, доксорубицин, даунорубицин, циклофосфамид, метотрексат, 5-фторурацил, тиотепа, бусульфан, импросульфан, пипосульфан, бензодопа, карбоквон, метуредопа, уредопа, алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, триметилоломеламин, буллатацин, буллатацинон, камптотецин, бриостатин, каллистатин, криптофицин 1, криптофицин 8, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктиин, спонгистатин, хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин, кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин, калихимицин, динемицин, клодронат, эсперамицин, аклациномицин, актиномицин, аутрамицин, азасерин, блеомицин, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицин, дактиномицин, деторбицин, 6-диазо-5-оксо-L-норлейцин, адриамицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоксин, туберцидин, убенимекс, зиностатин, зорубицин, деноптерин, птероптерин, триметрексат, флударабин, 6-меркаптопурин, тиамиприн, тиогуанин, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены, такие как калустерон, пропионат дростанолона, эпитиостанол, мепитиостан и тестолактон, аминоглютетимид, митотан, трилостан, фролиновая кислота, ацеглатон, альдофосфамидгликозид, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазиквон, эльфорнитин, ацетат эллиптиния, эпотилон, этоглуцид, лентинан, лонидамин, майтанзин, ансамитоцин, митогуазон, митоксантрон, мопиданмол, нитраэрин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофиллиновая кислота, 2-этилгидразид, прокарбазин, разоксан, ризоксин, шизофилан, спирогерманий, тенуазоновая кислота, триазиквон, роридин A, ангуидин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, доксетаксел, хлорамбуцил, гемцитабин, 6-тиогуанин, меркаптопурин, цисплатин, оксалиплатин, карбоплатин, винбластин, этопозид, ифосфамид, митоксантрон, винкристин, винорелбин, новантрон, тенипозид, эдатрексат, дауномицин, аминоптерин, кселода, ибандронат, иринодекан, ингибиторы топоизомеразы, дифторметилолнитин (DMFO), ретиноевая кислота, капецитабин и их фармацевтически приемлемые (известные) соли или (известные) производные.
[0119]
Показывает конъюгат антитела и противоопухолевого средства противоопухолевую активность или нет, можно оценивать, например, если антитело представляет собой антитело против CAPRIN-1, полученное от мыши, посредством оценки противоопухолевого эффекта, оказываемого на клетки рака человека in vitro через одновременную реакцию конъюгата вторичного антитела, которое связывается с антителом мыши, и лекарственного средства. Например, оценку можно осуществлять с использованием антитела против IgG человека, конъюгированного с сапорином (Hum-ZAP (Advanced Targeting Systems, Inc.)).
[0120]
Кроме того, комбинированное введение антитела, используемого в настоящем изобретении, и противоопухолевого средства может обеспечивать более высокий терапевтический эффект. Этот способ можно применять к пациенту с раком, экспрессирующим белок CAPRIN-1, до или после хирургического вмешательства. В частности, после хирургического вмешательства, можно получать более высокое предотвращение рецидива рака и более длительный период выживаемости при раке, экспрессирующем белок CAPRIN-1, который стандартно лечат только противоопухолевым средством.
[0121]
Примеры противоопухолевого средства, используемого в комбинированном введении, включают указанные выше противоопухолевые средства, общеизвестные из документов или других сообщений, и их фармацевтически приемлемые (известные) соли или (известные) производные. Среди этих средств, в частности, предпочтительно используют циклофосфамид, паклитаксел, доксетаксел, винорелбин и т.д.
[0122]
Альтернативно, антитело, используемое в настоящем изобретении, можно метить радиоизотопом, общеизвестным из документов или других сообщений, таким как 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 175Lu или 176Lu. Изотоп желательно представляет собой изотоп, который эффективен для терапии или диагностики опухоли.
[0123]
Антитело, используемое в настоящем изобретении, представляет собой антитело, которое имеет иммунологическую реактивность с белком CAPRIN-1 или специфичное связывание с белком CAPRIN-1 и проявляет цитотоксичность или ингибирующую опухолевый рост активность против рака печени. Антитело должно иметь структуру, которая может почти или полностью избегать реакции отторжения у целевого животного, которому вводят антитело. Примеры таких антител включают, когда целевым животным является человек, антитела человека, гуманизированные антитела, химерные антитела (например, химерные антитела человека-мыши), одноцепочечные антитела и полиспецифические антитела (например, диатела и триатела). Такое антитело представляет собой рекомбинантное антитело, в котором вариабельные домены тяжелых и легких цепей получают из антитела человека, или в котором вариабельные домены тяжелых и легких цепей состоят из определяющих комплементарность областей (CDR1, CDR2 и CDR3), полученных из антитела не относящегося к человеку животного, и каркасной области, полученной из антитела человека, или в котором вариабельные домены тяжелых и легких цепей получают из антитела не относящегося к человеку животного и константные домены тяжелых и легких цепей получают из антитела человека. Последние антитела являются предпочтительными.
[0124]
Эти рекомбинантные антитела можно получать следующим образом. ДНК, кодирующую моноклональное антитело (например, моноклональное антитело человека, моноклональное антитело мыши, моноклональное антитело крысы, моноклональное антитело кролика или моноклональное антитело курицы) против белка CAPRIN-1 человека клонируют из антителопродуцирующих клеток, таких как гибридомы; ДНК, кодирующую вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антитела, получают с использованием результирующей ДНК в качестве матрицы, например, посредством ОТ-ПЦР; и последовательность каждого вариабельного домена легких и тяжелых цепей или последовательность каждой из CDR1, CDR2 и CDR3 определяют на основе системы нумерации EU по Kabat (Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institute of Health, Bethesda, Md. (1991)).
[0125]
Кроме того, ДНК, которая кодирует вариабельные домены, или ДНК, которая кодирует CDR, получают посредством технологии рекомбинации генов (Sambrook, et al., Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory Press, (1989)) или с использованием синтезатора ДНК. Здесь продуцирующую моноклональные антитела человека гибридому можно получать посредством иммунизации продуцирующего антитела человека животного (например, мыши) белком CAPRIN-1 человека и последующего слияния клеток селезенки, иссеченной у иммунного животного, с миеломными клетками. Отдельно, по мере необходимости, ДНК, кодирующую вариабельный домен и константный домен легкой или тяжелой цепи, полученной из антитела человека, получают посредством технологии рекомбинации генов или с использованием синтезатора ДНК.
[0126]
В случае гуманизированного антитела, кодирующие CDR последовательности в ДНК, кодирующей вариабельные домены легкой цепи или тяжелой цепи, полученной из антитела человека, заменяют на соответствующие кодирующие CDR последовательности антитела, полученного от животного (например, от мыши, крысы или курицы), отличного от человека, чтобы получать ДНК. Всю получаемую ДНК соединяют с ДНК, кодирующей константные домены легкой цепи или тяжелой цепи, полученной из антитела человека, чтобы получать ДНК, кодирующую гуманизированное антитело.
[0127]
В случае химерного антитела, всю ДНК, кодирующую вариабельные домены легкой цепи или тяжелой цепи антитела, полученного от животного (например, от мыши, крысы или курицы), отличного от человека, соединяют с ДНК, кодирующей константные домены легкой цепи или тяжелой цепи, полученной из антитела человека, чтобы получать ДНК, кодирующую химерное антитело.
[0128]
В случае одноцепочечного антитела, антитело состоит из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, линейно соединенных друг с другом через линкер, и ДНК, кодирующую одноцепочечное антитело, можно получать посредством связывания ДНК, кодирующей вариабельный домен тяжелой цепи, ДНК, кодирующей линкер, и ДНК, кодирующей вариабельный домен легкой цепи. Здесь как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи получают из антитела человека или получают из антитела человека, в котором только CDR заменяют на CDR антитела, полученного от животного (например, от мыши, крысы, курицы), отличного от человека. Линкер состоит из от 12 до 19 аминокислот и его примеры включают (G4S)3 из 15 аминокислот (G.-B. Kim, et al., Protein Engineering Design and Selection, 2007, 20(9): 425-432).
[0129]
В случае биспецифического антитела (диатела), антитело может специфично связываться с двумя различными эпитопами, и ДНК, кодирующую биспецифическое антитело, можно получать, например, посредством связывания ДНК, кодирующей вариабельный домен A тяжелой цепи, ДНК, кодирующей вариабельный домен B легкой цепи, ДНК, кодирующей вариабельный домен B тяжелой цепи, и ДНК, кодирующей вариабельный домен A легкой цепи, в этом порядке (при условии, что ДНК, кодирующая вариабельный домен B легкой цепи, и ДНК, кодирующая вариабельный домен B тяжелой цепи, связаны друг с другом через ДНК, кодирующую линкер, как описано выше). Здесь как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи получают из антитела человека или получают из антитела человека, в котором только CDR заменяют на CDR антитела, полученного от животного (например, от мыши, крысы, курицы), отличных от человека.
[0130]
Рекомбинантное антитело можно получать посредством встраивания полученной таким образом рекомбинантной ДНК в один или несколько подходящих векторов и введения вектора или векторов в клетки-хозяева (например, клетки млекопитающего, дрожжевые клетки или клетки насекомого) для того, чтобы (совместно) экспрессировать ДНК (P.J. Delves., ANTIBODY PRODUCTION ESSENTIAL TECHNIQUES, 1997; WILEY, P. Shepherd, and C. Dean., Monoclonal Antibodies, 2000, OXFORD UNIVERSITY PRESS; J.W. Goding., Monoclonal Antibodies: principles and practice, 1993, ACADEMIC PRESS).
[0131]
Примеры антител по настоящему изобретению, полученных посредством описанных выше способов, включают следующие антитела с (a) до (ao).
[0132]
(a) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 37, 38 и 39, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 41, 42 и 43, соответственно, которые описаны в WO 2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 40, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 44).
[0133]
(b) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 47, 48 и 49, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 51, 52 и 53, соответственно, которые описаны в WO 2011/096519 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 50, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 54).
[0134]
(c) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 57, 58 и 59, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 61, 62 и 63, соответственно, которые описаны в WO 2011/096517 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 60, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 64).
[0135]
(d) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 67, 68 и 69, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 71, 72 и 73, соответственно, которые описаны в WO 2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 70, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 74).
[0136]
(e) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 77, 78 и 79, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 81, 82 и 83, соответственно, которые описаны в WO 2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 80, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 84).
[0137]
(f) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 87, 88 и 89, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 91, 92 и 93, соответственно, которые описаны в WO2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 90, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 94).
[0138]
(g) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 97, 98 и 99, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 101, 102 и 103, соответственно, которые описаны в WO 2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 100, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 104).
[0139]
(h) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 107, 108 и 109, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 111, 112 и 113, соответственно, которые описаны в WO 2011/096528 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 110, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 114).
[0140]
(i) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 117, 118 и 119, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 121, 122 и 123, соответственно, которые описаны в WO 2011/096533 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 120, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 124).
[0141]
(j) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 127, 128 и 129, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 121, 122 и 123, соответственно, которые описаны в WO 2011/096533 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 130, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 124).
[0142]
(k) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 132, 133 и 134, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 136, 137 и 138, соответственно, которые описаны в WO 2011/096533 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 135, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 139).
[0143]
(l) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 142, 143 и 144, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 146, 147 и 148, соответственно, которые описаны в WO 2011/096534 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 145, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 149).
[0144]
(m) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 142, 143 и 144, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 152, 153 и 154, соответственно, которые описаны в WO 2011/096534 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 145, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 155).
[0145]
(n) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 157, 158 и 159, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 161, 162 и 163, соответственно, которые описаны в WO 2011/096534 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 160, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 164).
[0146]
(o) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 171, 172 и 173, соответственно, которые описаны в WO2011/096534 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 174).
[0147]
(p) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 177, 178 и 179, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 180).
[0148]
(q) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 182, 183 и 184, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 185).
[0149]
(r) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 187, 188 и 189, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 190).
[0150]
(s) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 167, 168 и 169, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 192, 193 и 194, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 195).
[0151]
(t) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 197, 198 и 199, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 201, 202 и 203, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 200, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 204).
[0152]
(u) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 207, 208 и 209, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 211, 212 и 213, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 210, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 214).
[0153]
(v) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 217, 218 и 219, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 221, 222 и 223, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 220, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 224).
[0154]
(w) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 227, 228 и 229, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 231, 232 и 233, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 230, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 234).
[0155]
(x) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 237, 238 и 239, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 241, 242 и 243, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 240, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 244).
[0156]
(y) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 247, 248 и 249, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 251, 252 и 253, соответственно, которые описаны в WO 2010/016526 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 250, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 254).
[0157]
(z) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 280, 281 и 282, соответственно, которые описаны в WO 2013/018894 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 279, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 283).
[0158]
(aa) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 286, 287 и 288, соответственно, которые описаны в WO2013/018894 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 279, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 289).
[0159]
(ab) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 291, 292 и 293, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 295, 296 и 297, соответственно, которые описаны в WO 2013/018894 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 294, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 298).
[0160]
(ac) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 301, 302 и 303, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 305, 306 и 307, соответственно, которые описаны в WO 2013/018892 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 304, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 308).
[0161]
(ad) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 311, 312 и 313, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 315, 316 и 317, соответственно, которые описаны в WO 2013/018891 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 314, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 318).
[0162]
(ae) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 321, 322 и 323, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 325, 326 и 327, соответственно, которые описаны в WO 2013/018889 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 324, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 328).
[0163]
(af) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 331, 332 и 333, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 335, 336 и 337, соответственно, которые описаны в WO 2013/018883 (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 334, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 338).
[0164]
(ag) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 341, 342 и 343, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 345, 346 и 347, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 344, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 348).
[0165]
(ah) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 359, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 361, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 368, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 370, и антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 372, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 370).
[0166]
(ai) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 357, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 363, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 365).
[0167]
(aj) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 373, 374 и 375, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 377, 378 и 379, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 376, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 380).
[0168]
(ak) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 383, 384 и 385, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 386, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 390).
[0169]
(al) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 393, 394 и 395, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 396, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 390).
[0170]
(am) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 398, 399 и 400, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 402, 403 и 404, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 401, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 405).
[0171]
(an) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 408, 409 и 410, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 412, 413 и 414, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 411, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 415).
[0172]
(ao) Антитела, каждое из которых содержит вариабельный домен тяжелой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 418, 419 и 420, соответственно, и вариабельный домен легкой цепи, который содержит определяющие комплементарность области (CDR1, CDR2 и CDR3), приведенные в SEQ ID NO: 422, 423, и 424, соответственно (например, антитело, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 421, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 425).
[0173]
Здесь аминокислотные последовательности, приведенные в SEQ ID NO: 67, 68 и 69, представляют собой CDR1, CDR2 и CDR3, соответственно, вариабельного домена тяжелой цепи антитела мыши, аналогичным образом, каждый из наборов аминокислотных последовательностей, приведенных в SEQ ID NO: 77, 78 и 79, SEQ ID NO: 87, 88 и 89, SEQ ID NO: 97, 98 и 99, SEQ ID NO: 107, 108 и 109, SEQ ID NO: 117, 118 и 119, SEQ ID NO: 127, 128 и 129, SEQ ID NO: 132, 133 и 134, SEQ ID NO: 142, 143 и 144, SEQ ID NO: 157, 158 и 159, SEQ ID NO: 167, 168 и 169, SEQ ID NO: 197, 198 и 199, SEQ ID NO: 207, 208 и 209, SEQ ID NO: 217, 218 и 219, SEQ ID NO: 227, 228 и 229, SEQ ID NO: 237, 238 и 239, SEQ ID NO: 247, 248 и 249, SEQ ID NO: 276, 277 и 278; 291, 292 и 293; 301, 302 и 303; 311, 312 и 313; 321, 322 и 323; 331, 332 и 333; 341, 342 и 343; 373, 374 и 375; 383, 384 и 385; 393, 394 и 395; 398, 399 и 400; 408, 409 и 410; и 418, 419 и 420 представляет собой набор из CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи антитела мыши. Аналогичным образом, каждый из наборов аминокислотных последовательностей, приведенных в SEQ ID NO: 71, 72 и 73, SEQ ID NO: 81, 82 и 83, SEQ ID NO: 91, 92 и 93, SEQ ID NO: 101, 102 и 103, SEQ ID NO: 111, 112 и 113, SEQ ID NO: 121, 122 и 123, SEQ ID NO: 136, 137 и 138, SEQ ID NO: 146, 147 и 148, SEQ ID NO: 152, 153 и 154, SEQ ID NO: 161, 162 и 163, SEQ ID NO: 171, 172 и 173, SEQ ID NO: 177, 178 и 179, SEQ ID NO: 182, 183 и 184, SEQ ID NO: 187, 188 и 189, SEQ ID NO: 192, 193 и 194, SEQ ID NO: 201, 202 и 203, SEQ ID NO: 211, 212 и 213, SEQ ID NO: 221, 222 и 223, SEQ ID NO: 231, 232 и 233, SEQ ID NO: 241, 242 и 243, SEQ ID NO: 251, 252 и 253, SEQ ID NO: 280, 281 и 282, SEQ ID NO: 286, 287 и 288, SEQ ID NO: 295, 296 и 297, SEQ ID NO: 305, 306 и 307, SEQ ID NO: 315, 316 и 317, SEQ ID NO: 325, 326 и 327, SEQ ID NO: 335, 336 и 337, SEQ ID NO: 345, 346 и 347, SEQ ID NO: 377, 378 и 379, SEQ ID NO: 387, 388 и 389, SEQ ID NO: 402, 403 и 404, SEQ ID NO: 412, 413 и 414, SEQ ID NO: 422, 423, и 424 представляет собой набор из CDR1, CDR2 и CDR3 вариабельного домена легкой цепи антитела мыши.
[0174]
Аналогичным образом, каждая из аминокислотных последовательностей, приведенных в SEQ ID NO: 37, 38 и 39, SEQ ID NO: 47, 48 и 49, или SEQ ID NO: 57, 58 и 59, представляет собой CDR1, CDR2 и CDR3, соответственно, вариабельного домена тяжелой цепи антитела курицы; и каждая из аминокислотных последовательностей, приведенных в SEQ ID NO: 41, 42 и 43, SEQ ID NO: 51, 52 и 53, или SEQ ID NO: 61, 62 и 63, представляет собой CDR1, CDR2 и CDR3, соответственно, вариабельного домена легкой цепи антитела курицы.
[0175]
Аналогичным образом, каждая из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, представляет собой CDR1, CDR2 и CDR3, соответственно, вариабельного домена тяжелой цепи антитела кролика; и аминокислотные последовательности, приведенные в SEQ ID NO: 354, 355 и 356, представляют собой CDR1, CDR2 и CDR3, соответственно, вариабельного домена легкой цепи антитела кролика.
[0176]
Примеры гуманизированного антитела, химерного антитела, одноцепочечного антитела и полиспецифического антитела, используемых в настоящем изобретении, включают следующие антитела (те, которые приведены в качестве примера как антитела (ah)).
[0177]
(i) Антитела, каждое содержит вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности, приведенные в SEQ ID NO: 351, 352 и 353, и аминокислотную последовательность каркасной области, полученной из антитела человека; и вариабельный домен легкой цепи, который содержит аминокислотные последовательности, приведенные в SEQ ID NO: 354, 355 и 356, и аминокислотную последовательность каркасной области, полученной из антитела человека.
[0178]
(ii) Антитела, каждое содержит вариабельный домен тяжелой цепи, который содержит аминокислотные последовательности, приведенные в SEQ ID NO: 351, 352 и 353, и аминокислотную последовательность каркасной области, полученной из антитела человека; константный домен тяжелой цепи, который содержит аминокислотную последовательность, полученную из антитела человека; вариабельный домен легкой цепи, который содержит аминокислотные последовательности, приведенные в SEQ ID NO: 354, 355 и 356, и аминокислотную последовательность каркасной области, полученной из антитела человека; и константный домен легкой цепи, который содержит аминокислотную последовательность, полученную из антитела человека.
[0179]
(iii) Антитела, каждое содержит вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 368, константный домен тяжелой цепи, который содержит аминокислотную последовательность, полученную из антитела человека, вариабельный домен легкой цепи, который содержит аминокислотные последовательности, приведенные в SEQ ID NO: 370, и константный домен легкой цепи, который содержит аминокислотную последовательность, полученную из антитела человека.
[0180]
Последовательности константных доменов и вариабельных доменов тяжелых и легких цепей антитела человека доступны, например, в NCBI (например, GenBank или UniGene, USA). Например, последовательность константного домена тяжелой цепи IgG1 человека может быть обозначена как регистрационный №J00228, последовательность константного домена тяжелой цепи IgG2 человека может быть обозначена как регистрационный №J00230, последовательность константного домена тяжелой цепи IgG3 человека может быть обозначена как регистрационный №X03604, последовательность константного домена тяжелой цепи IgG4 человека может быть обозначена как регистрационный №K01316, последовательность константного домена легкой цепи κ человека может быть обозначена, например, как регистрационный №V00557, X64135 или X64133, и последовательность константного домена легкой цепи λ человека может быть обозначена, например, как регистрационный № X64132 или X64134.
[0181]
Примеры гуманизированных антител, проиллюстрированные как антитела (ah), включают антитела (ai), антитела, которые содержат вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 368, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 370, и антитела, которые содержат вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 372, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 370.
[0182]
Эти антитела предпочтительно имеют цитотоксичность и могут, тем самым, демонстрировать противоопухолевые эффекты.
[0183]
Очевидно, что конкретные последовательности вариабельных доменов и CDR тяжелых цепей и легких цепей указанных выше антител предназначены только для того, чтобы показать примеры, и не ограничены конкретными последовательностями. Получают гибридому, продуцирующую другое антитело человека или антитело не относящегося к человеку животного (например, антитело мыши) против белка CAPRIN-1 человека, и собирают моноклональное антитело, получаемое посредством гибридомы, и определяют, является ли антитело целевым антителом или нет, используя иммунологическую аффинность к белку CAPRIN-1 человека и цитотоксичность в качестве показателей. После идентификации гибридомы, продуцирующей целевое моноклональное антитело, ДНК, кодирующую вариабельные домены тяжелых и легких цепей целевого антитела, получают из гибридомы, как описано выше, и секвенируют ДНК. ДНК используют для получения другого антитела.
[0184]
Кроме того, антитело, используемое в настоящем изобретении, может иметь замену, делецию или добавление от одной до нескольких (предпочтительно одной или двух) аминокислот каждого из антител с (i) до (iv), в частности, в последовательности каркасной области и/или последовательности константного домена, до тех пор, пока сохраняется специфичность, т.е. специфическое распознавание белка CAPRIN-1. В настоящем документе, термин «несколько» относится к от двух до пяти, предпочтительно к двум или трем.
[0185]
Полагают, что противоопухолевый эффект антитела против CAPRIN-1, используемого в настоящем изобретении, на клетках рака печени, экспрессирующих CAPRIN-1, обусловлен следующим механизмом.
[0186]
В механизме участвует антителозависимая клеточная цитотоксичность (ADCC) эффекторных клеток в отношении клеток, экспрессирующих CAPRIN-1, и комплемент-зависимая клеточная цитотоксичность (CDC) в отношении клеток, экспрессирующих CAPRIN-1.
[0187]
Соответственно, активность антитела против CAPRIN-1, используемого в настоящем изобретении, можно оценивать посредством измерения активности ADCC или активности CDC на клетках рака печени, экспрессирующих белок CAPRIN-1 in vitro, как, в частности, показано в следующих примерах.
[0188]
Антитело против CAPRIN-1, используемого в настоящем изобретении, связывается с белком CAPRIN-1 на клетках рака печени и демонстрирует противоопухолевое действие посредством указанной выше активности, и, следовательно, полагают, что антитело можно использовать для терапии или предотвращения рака печени. То есть настоящее изобретение предусматривает фармацевтическую композицию, в которой активный ингредиент представляет собой антитело против CAPRIN-1, для лечения и/или предотвращения рака печени. В случае введения антитела против CAPRIN-1 человеку (терапия антителами), антитело предпочтительно представляет собой антитело человека или гуманизированное антитело для снижения иммуногенности.
[0189]
Более высокая аффинность связывания антитела против CAPRIN-1 с белком CAPRIN-1 на поверхности клеток рака печени обеспечивает более сильную противоопухолевую активность с помощью антитела против CAPRIN-1. Соответственно, ожидают, что антитело против CAPRIN-1, которое имеет высокую аффинность связывания с белком CAPRIN-1, демонстрирует более сильный противоопухолевый эффект и его можно вносить в фармацевтическую композицию для лечения и/или предотвращения рака печени. В качестве высокой аффинности связывания, как описано выше, константа связывания (константа сродства) Ka (kon/koff) предпочтительно составляет 107 M-1 или больше, 108 M-1 или больше, 5×108 M-1 или больше, 109 M-1 или больше, 5×109 M-1 или больше, 1010 M-1 или больше, 5×1010 M-1 или больше, 1011 M-1 или больше, 5×1011 M-1 или больше, 1012 M-1 или больше или 1013 M-1 или больше.
[0190]
<Связывание с клеткой, экспрессирующей антиген>
Способность антитела связываться с белком CAPRIN-1 можно точно определять через анализ связывания, например, посредством ELISA, вестерн-блоттинга, иммунофлуоресценции или проточной цитометрии, как описано в примерах.
[0191]
<Иммуногистохимическое окрашивание>
Антитело, распознающее белок CAPRIN-1, можно тестировать на реактивность к белку CAPRIN-1 посредством иммуногистохимического метода, хорошо известного специалистам в данной области, с использованием фиксированных параформальдегидом или ацетоном срезов или фиксированных параформальдегидом, погруженных в парафин, тканевых срезов из тканей, полученных от пациента во время хирургического вмешательства, или ткани, полученной от животного, несущего гетеротрансплантат, инокулированный клеточной линией, экспрессирующей белок CAPRIN-1 естественным образом или после трансфекции.
[0192]
Антитело, реактивное в отношении белка CAPRIN-1, можно окрашивать посредством различных способов иммуногистохимического окрашивания. Например, антитело можно визуализировать посредством реакции с антителом козы против антитела мыши или против антитела кролика, конъюгированным с пероксидазой хрена.
[0193]
<Фармацевтическая композиция>
Мишенью фармацевтической композиции для лечения и/или предотвращения рака печени по настоящему изобретению может быть какой-либо рак печени (клетки), экспрессирующий ген CAPRIN-1.
[0194]
Термины «опухоль» и «рак», используемые на всем протяжении данного описания, относятся к злокачественному новообразованию, и их используют взаимозаменяемо.
[0195]
Рак печени в качестве мишени в настоящем изобретении экспрессирует ген, который кодирует аминокислотную последовательность, приведенную в любой из последовательностей с четными номерами из SEQ ID NO: с 2 до 30, аминокислотную последовательность, которая имеет идентичность последовательностей 80% или больше с аминокислотной последовательностью, или частичной последовательностью, содержащей по меньшей мере семь последовательных аминокислотных остатков из какой-либо из этих аминокислотных последовательностей.
[0196]
Примеры рака печени включают, но не ограничиваясь этим, гепатоцеллюлярную карциному, холангиокарциному, метастатический рак печени и гепатобластому.
[0197]
Целевым животным является млекопитающее, такое как примат, комнатное животное, домашнее животное и животное для использования в соревнованиях, и предпочтительно является человеком, собакой или кошкой.
[0198]
Фармацевтическую композицию антитела, используемого в настоящем изобретении, можно легко формулировать с помощью способа, известного специалистам в данной области. Фармацевтическую композицию можно использовать, например, парентерально в форме асептического раствора в воде или другой фармацевтически приемлемой жидкости или инъекции суспензионного препарата. Например, предложено формулировать посредством объединения надлежащим образом фармацевтической композиции с фармакологически приемлемым носителем или средой, в частности, стерилизованной водой, физиологическим раствором, растительным маслом, эмульсификатором, суспендирующим средством, поверхностно-активным веществом, стабилизатором, ароматизатором, эксципиентом, наполнителем, антисептиком или связующим средством, и смешивания их в стандартную дозированную форму, которая желательна в соответствии с общепризнанным контролем за производством лекарственных средств. Количеством активного ингредиента в таком лекарственном средстве управляют с тем, чтобы предоставлять подходящую дозу в пределах указанного диапазона.
[0199]
Асептическая композиция для инъекции может быть предписана в соответствии с контролем за обычным фармацевтическим препаратом с использованием наполнителя, такого как дистиллированная вода для инъекций.
[0200]
Примеры водных растворов для инъекций включают физиологический раствор и изотонические растворы, содержащие глюкозу или другие адъюванты, такие как D-сорбит, D-манноза, D-маннит или хлорид натрия. Водный раствор можно использовать вместе с подходящим солюбилизатором, например, спиртом, в частности, этанолом или многоатомным спиртом; пропиленгликолем, полиэтиленгликолем или неионным детергентом; или полисорбатом 80(TM) или HCO-60.
[0201]
Примеры масляных жидкостей включают сезамовое масло и соевое масло, и масляную жидкость можно использовать вместе с бензилбензоатом или бензиловым спиртом в качестве солюбилизатора. Кроме того, можно примешивать буфер, такой как фосфатный буфер или натрий-ацетатный буфер, болеутоляющее средство, такое как гидрохлорид прокаина, стабилизатор, такой как бензиловый спирт или фенол, или антиоксидант. Полученную инъекцию обычно упаковывают в подходящую ампулу.
[0202]
Введение является пероральным или парентеральным и предпочтительно является парентеральным, и его примеры включают инъекционные, трансназальные, пульмональные и трансдермальные дозированные формы. При инъекционной дозированной форме, например, системное или локальное введение можно осуществлять посредством внутривенной, внутримышечной, интраперитонеальной или подкожной инъекции.
[0203]
Способ введения можно надлежащим образом выбирать на основе возраста, массы, пола, симптомов и т.д. пациента. Дозу фармацевтической композиции, содержащей антитело или полинуклеотид, который кодирует антитело, можно выбирать, например, в пределах диапазона от 0,0001 до 1000 мг/кг масса тела за один раз или, например, в пределах диапазона от 0,001 до 100000 мг/ на массу одного пациента. Эти числовые значения не являются обязательно ограничивающими. Доза и способ введения варьируют в зависимости от массы, возраста, пола, симптомов и т.д. пациента, но могут быть надлежащим образом выбраны специалистами в данной области.
[0204]
Рак печени можно лечить и/или предотвращать посредством введения фармацевтической композиции по настоящему изобретению субъекту.
[0205]
Настоящее изобретение кроме того охватывает способ лечения и/или предотвращения рака печени, который включает введение фармацевтической композиции по настоящему изобретению вместе с противоопухолевым средством, как показано на примере выше, или фармацевтической композиции, содержащей такое противоопухолевое средство, субъекту. Антитело или его фрагмент по настоящему изобретению и противоопухолевое средство можно одновременно или отдельно вводить субъекту. В случае раздельного введения, любую фармацевтическую композицию можно вводить раньше или позже, а интервал введения, дозы, пути введения и частоту ее введения может надлежащим образом выбирать медицинский специалист. Примеры другой лекарственной дозированной формы, подлежащей одновременному введению, также включают фармацевтические композиции, полученные посредством смешивания антитела или его фрагмента по настоящему изобретению и противоопухолевого средства в фармакологически приемлемом носителе (или среде) и формулирования смеси. Описание для назначения, состава, пути введения, дозы, рака и т.д., относящееся к фармацевтической композиции, содержащей антитело по настоящему изобретению, и дозированную форму можно применять к любой из фармацевтических композиций, содержащих противоопухолевые средства и дозированные формы. Следовательно, настоящее изобретение также относится к комбинированному фармацевтическому средству (также обозначаемому как «фармацевтический набор») для лечения и/или предотвращения рака печени, который содержит фармацевтическую композицию по настоящему изобретению и фармацевтическую композицию, которая содержит противоопухолевое средство, как показано на примере выше.
[0206]
Настоящее изобретение также относится к фармацевтической композиции для лечения и/или предотвращения рака печени, которая содержит антитело или его фрагмент по настоящему изобретению и противоопухолевое средство вместе с фармакологически приемлемым носителем.
[0207]
Альтернативно, противоопухолевое средство можно конъюгировать с антителом или его фрагментом по настоящему изобретению. Конъюгат можно смешивать с фармакологически приемлемым носителем (или средой) и формулировать в фармацевтическую композицию, как указано выше.
ПРИМЕРЫ
[0208]
Далее настоящее изобретение более конкретно описано на основе примеров, но объем настоящего изобретения не ограничен этими примерами.
[0209]
[Пример 1] Идентификация белка антигена рака печени с помощью способа SEREX
(1) Получение библиотеки кДНК
Общую РНК извлекали из ткани семенника здоровой собаки способом с кислым гуанидием-фенолом-хлороформом и очищали поли(A) РНК с использованием набора Oligotex-dT30 mRNA purification (производства Takara Shuzo Co., Ltd.) в соответствии с протоколом, прилагаемым к набору.
[0210]
Фаговую библиотеку кДНК, полученную из семенника собаки, синтезировали с использованием полученной мРНК (5 мкг). Фаговую библиотеку кДНК получали с использованием набора cDNA Synthesis Kit, ZAP-cDNA Synthesis и набора ZAP-cDNA Gigapack III Gold Cloning (производства Stratagene Corporation) в соответствии с протоколами, прилагаемыми к наборам. Размер получаемой фаговой библиотеки кДНК составляет 7,73×105 БОЕ/мл.
[0211]
(2) Скрининг библиотеки кДНК с использованием сыворотки
Фаговую библиотеку кДНК, полученной из семенника собаки, использовали для иммунного скрининга. В частности, клетки E. coli организма-хозяина (XL1-Blue MRFʹ) инфицировали библиотекой так, что на агарозной чашке Φ 90×15 мм NZY формировали 2210 клонов. Затем клетки E. coli организма-хозяина культивировали при 42°C в течение от 3 до 4 часов для того, чтобы получать бляшки. Чашку накрывали нитроцеллюлозной мембраной (Hybond C Extra: производства GE Healthcare Bio-Sciences), импрегнированной изопропил-β-D-тиогалактозидом (IPTG), при 37°C в течение 4 часов, чтобы ввести и экспрессировать белки, и белки переносили на мембрану. Впоследствии мембраны собирали и погружали в TBS (10 мМ Tris-HCl, 150 мМ NaCl, pH 7,5), содержащий 0,5% обезжиренного молока, и встряхивали в течение ночи при 4°C для того, чтобы предотвращать неспецифичную реакцию. Проводили реакцию этого фильтра с 500-кратно разведенной сывороткой больной собаки при комнатной температуре в течение от 2 до 3 часов.
[0212]
Использовали сыворотку больной собаки, собранную у собак с раком молочной железы. Сыворотку хранили при -80°C и предварительно обрабатывали незамедлительно перед использованием. Предварительную обработку сыворотки осуществляли следующим образом: клетки организма-хозяина E. coli (XL1-Blure MRFʹ) инфицировали фагом λ ZAP Express, в который не вставляли инородные гены, и культивировали на среде для чашек NZY при 37°C в течение ночи. Впоследствии в чашку добавляли 0,2 M NaHCO3 буфер, pH 8,3, содержащий 0,5 M NaCl, после чего ее оставляли стоять при 4°C в течение 15 часов. Затем супернатант собирали в виде экстракта E. coli/фаг. Впоследствии собранному экстракту E. coli/фаг позволяли проходить через колонку NHS (производства GE Healthcare Bio-Sciences) для того, чтобы иммобилизовать белки, извлеченные из E. coli и фага. Сыворотке от больных собак позволяли проходить через колонку с иммобилизованным белком для удаления из сыворотки антител, адсорбируемых на E. coli или фаге. Фракцию сыворотки, прошедшую через колонку, 500-кратно разбавляли TBS, содержащим 0,5% обезжиренного молока, чтобы предоставить материал для иммунного скрининга.
[0213]
Мембрану после блоттинга с обработанной, таким образом, сывороткой и слитым белком промывали в TBS-T (0,05% Tween 20/TBS) четыре раза и затем подвергали реакции со вторичным антителом, IgG козы против антитела собаки, разведенным 5000-кратно в TBS, содержащем 0,5% обезжиренного молока (Goat anti Dog IgG-h+I HRP conjugated: производства BETHYL Laboratories, Inc.), при комнатной температуре в течение 1 часа. Обнаружение осуществляли посредством ферментативной цветной реакции с использованием реакционного раствора NBT/BCIP (производства Roche Diagnostics K.K.), и собирали колонии, соответствующие положениям положительной цветной реакции на агарозной чашке NZY Φ 90×15 мм, и каждый растворяли в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ Tris-HCl, 0,01% желатин, pH 7,5). Второй, третий или последующие скрининги осуществляли посредством той же процедуры, что и выше, до тех пор, пока не унифицировали колонию положительной цветной реакцией. Как результат, выделяли пять положительных клонов посредством скрининга 30940 фаговых клонов, которые вступали в реакцию с IgG в сыворотке.
[0214]
(3) Поиск гомологии выделенного гена антигена
Для того чтобы использовать пять положительных клонов, выделенных описанным выше способом, для анализа нуклеотидной последовательности, фаговый вектор превращали в плазмидный вектор. В частности, 200 мкл раствора организма-хозяина E. coli (XL1-Blue MRFʹ), скорректированного до поглощения OD600 1,0, смешивали с 250 мкл раствора очищенного фага и 1 мкл хелперного фага ExAssist (производства Stratagene Corporation). После реакции при 37°C в течение 15 минут, 3 мл среды LB добавляли в смесь, после чего следовало культивирование при 37°C в течение от 2,5 до 3 часов. Незамедлительно после культивирования, среду для культивирования нагревали на водяной бане до 70°C в течение 20 минут, с последующим центрифугированием при 4°C, 1000×g, в течение 15 минут. Супернатант собирали в качестве раствора фагмиды. Впоследствии 200 мкл раствора фагмидного организма-хозяина E. coli (SOLR), скорректированного до поглощения OD600 1,0, смешивали с 10 мкл раствора очищенного фага. После реакции при 37°C в течение 15 минут, 50 мкл реакционной смеси высевали на агаровую среду LB, содержащую ампициллин (конечная концентрация: 50 мкг/мл), после чего следовало культивирование при 37°C в течение ночи. Отдельные колонии трансформированного SOLR собирали и культивировали в среде LB, содержащей ампициллин (конечная концентрация: 50 мкг/мл) при 37°C, и плазмидную ДНК, которая имеет предполагаемую вставку, очищали с использованием набора QIAGEN plasmid Miniprep (производства Qiagen).
[0215]
Очищенную плазмиду подвергали анализу полноразмерной последовательности вставки способом с блуждающим праймером, используя праймер T3, приведенный в SEQ ID NO: 31, и праймер T7, приведенный в SEQ ID NO: 32. В результате этого анализа последовательностей получали последовательности генов, приведенные в SEQ ID NO: 5, 7, 9, 11 и 13. Поиск гомологии нуклеотидных последовательностей и аминокислотных последовательностей (SEQ ID NO: 6, 8, 10, 12 и 14) генов для известных генов с использованием программы поиска гомологии, поиска BLAST (http://www.ncbi.nlm.nih.gov/BLAST/), выявил, что каждый из всех пяти полученных генов кодирует белок CAPRIN-1. Идентичность последовательностей среди пяти генов составляла 100% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 99% в аминокислотной последовательности. Идентичность последовательностей генов с геном, кодирующим гомологичный фактор человека, составляла 94% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 98% в аминокислотной последовательности. Нуклеотидные последовательности гомологичного фактора человека приведены в SEQ ID NO: 1 и 3 и аминокислотные последовательности приведены в SEQ ID NO: 2 и 4. Идентичность последовательностей полученных генов собаки с геном, кодирующим гомологичный фактор коровы, составляла 94% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 97% в аминокислотной последовательности. Нуклеотидная последовательность гомологичного фактора коровы приведена в SEQ ID NO: 15, а аминокислотная последовательность приведена в SEQ ID NO: 16. Идентичность последовательностей между геном, кодирующим гомологичный фактор человека, и геном, кодирующим гомологичный фактор коровы, составляла 94% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и от 93% до 97% в аминокислотной последовательности. Идентичность последовательностей полученных генов собаки с геном, кодирующим гомологичный фактор лошади, составляла 93% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 97% в аминокислотной последовательности. Нуклеотидная последовательность гомологичного фактора лошади приведена в SEQ ID NO: 17, и аминокислотная последовательность приведена в SEQ ID NO: 18. Идентичность последовательностей между геном, кодирующим гомологичный фактор человека, и геном, кодирующим гомологичный фактор лошади, составляла 93% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 96% в аминокислотной последовательности. Идентичность последовательностей полученных генов собаки с геном, кодирующим гомологичный фактор мыши, составляла от 87% до 89% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и от 95% до 97% в аминокислотной последовательности. Нуклеотидные последовательности гомологичного фактора мыши приведены в SEQ ID NO: 19, 21, 23, 25 и 27, и аминокислотные последовательности приведены в SEQ ID NO: 20, 22, 24, 26 и 28. Идентичность последовательностей между геном, кодирующим гомологичный фактор человека, и геном, кодирующим гомологичный фактор мыши, составляла от 89% до 91% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и от 95% до 96% в аминокислотной последовательности. Идентичность последовательностей полученных генов собаки с геном, кодирующим гомологичный фактор курицы, составляла 82% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 87% в аминокислотной последовательности. Нуклеотидная последовательность гомологичного фактора курицы приведена в SEQ ID NO: 29 и аминокислотная последовательность приведена в SEQ ID NO: 30. Идентичность последовательностей между геном, кодирующим гомологичный фактор человека, и геном, кодирующим гомологичный фактор курицы, составляла от 81% до 82% в нуклеотидной последовательности, в области, подлежащей трансляции в белок, и 86% в аминокислотной последовательности.
[0216]
(4) Анализ экспрессии гена CAPRIN-1 с использованием клеток рака печени человека
Исследовали экспрессию генов, полученных описанным выше способом, в четырех клеточных линиях рака печени человека (Hep3B, HepG2, SK-Hep-1 и SW480) посредством ОТ-ПЦР. Обратную транскрипцию осуществляли следующим образом: Общую РНК извлекали из от 50 до 100 мг каждой ткани и от 5 до 10×106 клеток каждой клеточной линии с реактивом TRIZOL (производства Life Technologies) в соответствии с протоколом, приложенным к реактиву. Используя эту общую РНК, кДНК синтезировали с использованием Superscript First-Strand Synthesis System для ОТ-ПЦР (производства Life Technologies) в соответствии с протоколом, приложенным к системе. ПЦР осуществляли с использованием праймеров (приведены в SEQ ID NO: 33 и 34), специфичных к получаемому гену, следующим образом: общий объем смеси, содержащий 0,25 мкл образца, полученного обратной транскрипцией, 2 мкМ каждого из праймеров, 0,2 мМ каждого dNTP и 0,65 Ед. полимеразы ExTaq (производства Takara Shuzo Co., Ltd.), корректировали до 25 мкл с использованием буфера, приложенного к реактиву, и процесс, состоящий из реакций при 94°C в течение 30 секунд, при 60°C в течение 30 секунд и при 72°C в течение 30 секунд, повторяли 30 циклов в Thermal Cycler (производства BIO-RAD Laboratories, Inc.). Генноспецифические праймеры амплифицировали область от 698 до 1124 нуклеотидов из нуклеотидной последовательности (ген CAPRIN-1 человека), приведенной в SEQ ID NO: 1. Для сравнения, одновременно использовали GAPDH-специфические праймеры (приведены в SEQ ID NO: 35 и 36). Как результат, экспрессию наблюдали во всех клеточных линиях рака печени человека.
[0217]
[Пример 2] Получение поликлонального антитела против белка CAPRIN-1 человека
Смесь 1 мг рекомбинантного белка CAPRIN-1 человека, полученного в соответствии с примером 3 из WO 2010/016526, и эквивалентный объем раствора неполного адъюванта Фрейнда (IFA) подкожно инъецировали кролику четыре раза с интервалами в 2 недели. Затем брали кровь для того, чтобы получить антисыворотку, содержащую поликлональное антитело. Антисыворотку дополнительно очищали с использованием носителя белка G (производства GE Healthcare Bioscience) для того, чтобы получать поликлональное антитело против белка CAPRIN-1. Сыворотку кролика, которому не вводили антиген, аналогичным образом очищали с использованием носителя белка G и использовали в качестве контрольного антитела.
[0218]
[Пример 3] Анализ экспрессии белка CAPRIN-1 в раке печени человека
(1) Анализ экспрессии белка CAPRIN-1 на клетках рака печени человека
У четырех клеточных линий рака печени человека (Hep3B, HepG2, SK-Hep-1 и SW480), у которых подтверждали экспрессию гена CAPRIN-1, исследовали, экспрессируют ли они белок CAPRIN-1 на клеточной поверхности или нет. 1×106 клеток каждой клеточной линии рака печени человека, для которых выше подтверждали экспрессию гена, центрифугировали с использованием 1,5-мл микропробирок для центрифугирования. В клетки добавляли 2 мкг (5 мкл) поликлонального антитела против белка CAPRIN-1, полученного в примере 2. Смесь суспендировали в 95 мкл PBS, содержащего 0,1% эмбриональной телячьей сыворотки, и суспензию оставляли стоять на льду в течение 1 часа. После промывания в PBS, клетки суспендировали в 5 мкл FITC-меченного антитела козы против IgG кролика (производства Santa Cruz Biotechnology, Inc.) и 95 мкл PBS, содержащего 0,1% эмбриональную телячью сыворотку (FBS), и суспензию оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, в качестве контроля, ту же процедуру, что и выше, осуществляли с использованием контрольного антитела, полученного в примере 2, вместо поликлонального антитела против белка CAPRIN-1. Как результат, интенсивность флуоресценции в клетках рака печени, к которым добавляли поликлональное антитело против CAPRIN-1 человека, была выше на 20% или больше, чем таковая в контроле в каждом случае. Это демонстрирует, что белок CAPRIN-1 экспрессировали на клеточной поверхности каждой клеточной линии рака печени человека. Степень увеличения интенсивности флуоресценции представляют посредством степени увеличения средней интенсивности флуоресценции (значение MFI) в каждой клетке и вычисляют посредством следующей расчетной формулы:
[0219]
Степень увеличения средней интенсивности флуоресценции (степень увеличения интенсивности флуоресценции) (%) = ((значение MFI клеток, вступавших в реакцию с антителом против CAPRIN-1 человека) - (значение MFI контроля))/(значение MFI контроля) × 100.
[0220]
(2) Анализ экспрессии белка CAPRIN-1 в ткани рака печени человека
Семнадцать образцов ткани рака печени из набора погруженных в парафин тканей рака печени человека (производства BIOMAX, Inc.) подвергали иммуногистохимическому окрашиванию. Набор тканей рака печени человека обрабатывали при 60°C в течение 3 часов и затем помещали во флакон для окрашивания, заполненный ксилолом. Ксилол в бутылке заменяли на свежий три раза каждые 5 минут. Впоследствии ту же процедуру осуществляли с использованием этанола и PBS-T вместо ксилола. Набор тканей рака печени человека помещали во флакон для окрашивания, заполненный 10 мМ цитратным буфером (pH 6,0), содержащим 0,05% Tween 20, и обрабатывали при 125°C в течение 5 минут, после чего оставляли стоять при комнатной температуре в течение 40 минут или больше. Избыточную воду вокруг среза впитывали с использованием Kimwipe, срез обводили ручкой Dako, и туда по каплям добавляли подходящее количество Peroxidase Block (производства DAKO). После того, как оставляли стоять при комнатной температуре в течение 5 минут, срез помещали во флакон для окрашивания, заполненный PBS-T, и PBS-T заменяли на свежий три раза каждые 5 минут. В качестве блокирующего раствора, раствор PBS-T, содержащий 10% FBS, помещали на срез, после чего его оставляли стоять в увлажнительной камере при комнатной температуре в течение 1 часа. Раствор, в котором концентрацию поликлонального антитела против белка CAPRIN-1, полученного в примере 2, корректировали до 10 мкг/мл с использованием раствора PBS-T, содержащего 5% FBS, дополнительно помещали на срез, и срез оставляли стоять в увлажнительной камере при 4°C в течение ночи и затем промывали в PBS-T в течение 10 минут три раза. Подходящее количество Peroxidase Labelled Polymer Conjugate (производства DAKO) по каплям помещали на срез, после чего его оставляли стоять в увлажнительной камере при комнатной температуре в течение 30 минут. После промывания в PBS-T в течение 10 минут три раза, развивающий окраску раствор DAB (производства DAKO) помещали на срез, после чего его оставляли стоять при комнатной температуре в течение приблизительно 10 минут. Развивающий окраску раствор удаляли, и срез промывали в PBS-T в течение 10 минут три раза, затем ополаскивали дистиллированной водой, помещали в 70%, 80%, 90%, 95% и 100% растворы этанола в этом порядке на 1 минуту в каждый раствор этанола, и оставляли стоять в ксилоле в течение ночи. Предметное стекло изымали и заключали в Glycergel Mounting Medium (производства DAKO) для наблюдения. Результаты демонстрировали высокую экспрессию белка CAPRIN-1 в 14 образцах (82%) из всего 17 образцов ткани рака печени.
[0221]
[Пример 4] Противоопухолевый эффект (ADCC активность) поликлонального антитела против белка CAPRIN-1, оказываемый на клетки рака печени
Изучали, может ли антитело против белка CAPRIN-1 ослаблять клетки рака печени, экспрессирующие белок CAPRIN-1, или нет. Оценку осуществляли с использованием поликлонального антитела против белка CAPRIN-1 человека, полученного в примере 2. 1×106 клеток каждой из клеточных линий рака печени человека SK-Hep-1 и Hep3B, у которых подтверждали экспрессию белка CAPRIN-1, собирали в 50 мл пробирки для центрифугирования, и туда 100 мкКи 51хрома добавляли, после чего следовала инкубация при 37°C в течение 2 часов. Впоследствии клетки промывали в среде RPMI1640, содержащей 10% эмбриональную телячью сыворотку, три раза и затем добавляли в 96-луночный планшет с V-образным дном по 1×103 клеток на лунку. В каждую лунку добавляли 1 мкг поликлонального антитела против белка CAPRIN-1 человека и кроме того добавляли 2×105 лимфоцитов, выделенных из периферической крови человека, после чего следовало культивирование при 37°C в 5% CO2 в течение 4 часов. После культивирования, количество 51хрома (Cr), секретированного ослабленными опухолевыми клетками в культуральный супернатант, измеряли для того, чтобы вычислять ADCC активность посредством поликлонального антитела против белка CAPRIN-1 человека в отношении клеток рака печени. Результаты демонстрировали, что в случае поликлонального антитела против белка CAPRIN-1 человека, ADCC активность в отношении каждой из SK-Hep-1 и Hep3B составляла 15% или больше, тогда как ADCC активность в отношении каждой из SK-Hep-1 и Hep3B составляла меньше, чем 5% в случае использования контрольного антитела, полученного из периферической крови кролика, которого не иммунизировали антигеном, а также составляла меньше, чем 5% в случае не использования каких-либо антител. Соответственно, обнаруживали, что ADCC активность при использовании антитела против белка CAPRIN-1 может ослаблять клетки рака печени, экспрессирующие белок CAPRIN-1. Цитотоксичность является результатом, как описано выше, когда антитело против белка CAPRIN-1, используемое в настоящем изобретении, лимфоциты и 1×103 опухолевых клеток с 51хромом смешивали и культивировали в течение 4 часов, и показано, что она является цитотоксичностью в отношении опухолевых клеток, которая вычислена по следующей расчетной формуле * посредством измерения количества 51хрома, высвобожденного в среду после культивирования.
[0222]
Формула *: цитотоксичность (%) = (количество 51хрома, высвобожденного из опухолевых клеток в присутствии антитела против белка CAPRIN-1 и лимфоцитов)/(количество 51хрома, высвобожденного из опухолевых клеток в присутствии 1н соляной кислоты) × 100.
[0223]
[Пример 5] Получение моноклональных антител мыши и курицы против белка CAPRIN-1
Рекомбинантный белок CAPRIN-1 человека (100 мкг), полученный в примере 2, смешивали с таким же количеством адъюванта MPL/TDM (производства Sigma-Aldrich Co., LLC.), и смесь использовали в качестве раствора антигена для одной мыши. Раствор антигена интраперитонеально вводили мышам Balb/c в возрасте 6 недель (производства Japan SLC, Inc.) и дополнительно вводили три раза или 24 раза с интервалами одну неделю для того, чтобы завершить иммунизацию. Селезенку извлекали на третьи сутки с последней иммунизации и толкли между двумя стерилизованными предметными стеклами и промывали в PBS (-) (производства Nissui Pharmaceutical Co., Ltd.), после чего следовало центрифугирование при 1500 об/мин в течение 10 минут для того, чтобы удалять супернатант. Эту процедуру повторяли три раза для того, чтобы получать клетки селезенки. Получаемые клетки селезенки и миеломные клетки мыши SP2/0 (приобретали в ATCC) смешивали в соотношении 10:1, и раствор PEG, полученный посредством смешивания 200 мкл среды RPMI1640, содержащей 10% FBS и 800 мкл PEG 1500 (производства Boehringer Ingelheim GmbH), и нагретый до 37°C, добавляли в получаемую смесь, после чего ее оставляли стоять в течение 5 минут для слияния клеток. Осуществляли центрифугирование при 1700 об/мин в течение 5 минут и удаляли супернатант. Клетки суспендировали в смеси 150 мл среды RPMI1640 (селективная среда HAT), содержащей 15% FBS, и 2% эквивалентов раствора HAT производства Gibco, и суспензию высевали на 15 планшетов, которые представляли собой 96-луночные планшеты (производства Nunc), по 100 мкл на лунку. Культивирование при 37°C в 5% CO2 в течение 7 суток давало гибридомы клеток селезенки и миеломных клеток.
[0224]
Гибридомы отбирали с использованием, в качестве показателя, аффинности связывания антител, полученных с помощью гибридом, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного в примере 2, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего его оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 400 мкл раствора 0,5% бычьего сывороточного альбумина (BSA) (производства Sigma-Aldrich Co., LLC.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Invitrogen Corporation), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали несколько гибридом, продуцирующих антитела, которые показывают высокие значения поглощения.
[0225]
Отобранные гибридомы высевали в 96-луночный планшет по 0,5 клеток на лунку и культивировали. Через одну неделю в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали и отбирали гибридомы с использованием, в качестве показателя, аффинности связывания антител, продуцируемых клонированными гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного в примере 2, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствор BSA, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Invitrogen Corporation), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, получали 150 гибридомных штаммов, продуцирующих моноклональные антитела мыши, реактивные в отношении белка CAPRIN-1.
[0226]
Впоследствии из этих моноклональных антител мыши отбирали антитела, реактивные в отношении клеточной поверхности клеток рака, экспрессирующих белок CAPRIN-1. В частности, 1×106 клеток клеточной линии рака молочной железы человека MDA-MB-231V центрифугировали в 1,5-мл микропробирке для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело козы против IgG мыши (производства Invitrogen Corporation), разведенное 500-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, в качестве контроля, ту же процедуру, что и выше, осуществляли с использованием необработанной сыворотки мыши Balb/c в возрасте 6 недель, разведенной 500-кратно с использованием гибридомной культуральной среды, вместо антитела. Как результат, отбирали 22 моноклональных антитела мыши (моноклональные антитела мыши с #1 до #22), которые показывали более высокие интенсивности флуоресценции по сравнению с контролем, т.е. вступали в реакцию с клеточной поверхностью клеток рака молочной железы.
[0227]
Для того чтобы получать моноклональное антитело курицы, 300 мкг белка антигена (CAPRIN-1 человека), приведенного в SEQ ID NO: 2, который получали в примере 2, смешивали с таким же количеством полного адъюванта Фрейнда, и смесь использовали в качестве раствора антигена для одной курицы. Раствор антигена интраперитонеально вводили курицам в возрасте 7 недель и кроме того вводили семь раз с интервалами в четыре недели для того, чтобы завершить иммунизацию. Селезенку извлекали на четвертые сутки от последней иммунизации и измельчали между двумя стерилизованными предметными стеклами и промывали в PBS (-) (производства Nissui Pharmaceutical Co., Ltd.), после чего следовало центрифугирование при 1500 об/мин в течение 10 минут для того, чтобы удалять супернатант. Эту процедуру повторяли три раза для того, чтобы получать клетки селезенки. Получаемые клетки селезенки и миеломные клетки курицы с дефицитом легких цепей, созданные посредством трансформации из курицы с использованием вируса ретикулоэндотелиоза птиц, смешивали в соотношении 5:1, и раствор PEG, полученный посредством смешивания 200 мкл среды IMDM, содержащей 10% FBS и 800 мкл PEG 1500 (производства Boehringer Ingelheim GmbH) и нагретый до 37°C добавляли в получаемую смесь, после чего оставляли стоять в течение 5 минут для слияния клеток. Осуществляли центрифугирование при 1700 об/мин в течение 5 минут и удаляли супернатант. Клетки суспендировали в смеси 300 мл среды IMDM (селективная среда HAT), содержащей 10% FBS и 2% эквивалентов раствора HAT производства Gibco, и суспензию высевали в 30 планшетов, которые представляли собой 96-луночные планшеты (производства Nunc), по 100 мкл на лунку. Культивирование при 37°C в 5% CO2 в течение 7 суток давало гибридомы посредством слияния клеток селезенки и миеломных клеток.
[0228]
Гибридомы отбирали с использованием, в качестве показателя, аффинности связывания антител, продуцируемых гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного в примере 2, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 400 мкл 0,5% раствора бычьего сывороточного альбумина (BSA) (производства Sigma-Aldrich Co., LLC.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgY курицы (производства Sigma-Aldrich Co., LLC.), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали несколько гибридом, продуцирующих антитела, которые показывают высокие значения поглощения.
[0229]
Отобранные гибридомы высевали в 96-луночный планшет по 0,5 клеток на лунку и культивировали. Через одну неделю, в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали и отбирали гибридомы с использованием, в качестве показателя, аффинности связывания антител, продуцируемых клонированными гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1 человека добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора BSA, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgY курицы (производства Sigma-Aldrich Co., LLC.), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, получали несколько гибридомных штаммов, продуцирующих моноклональные антитела, показывающие реактивность в отношении белка CAPRIN-1.
[0230]
Впоследствии из этих моноклональных антител отбирали антитела, реактивные в отношении клеточной поверхности клеток рака, экспрессирующих белок CAPRIN-1. В частности, 5×105 клеток клеточной линии рака молочной железы человека MDA-MB-231V центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело козы против IgG (H+L) курицы (производства SouthernBiotech), разведенное 30-кратно с использованием PBS, содержащим 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, ту же процедуру, что и выше, осуществляли с использованием гибридомной культуральной среды для того, чтобы получать контрольный образец. Как результат, отбирали три моноклональных антитела (моноклональные антитела курицы #1, #2 и #3), которые показывали более высокие интенсивности флуоресценции по сравнению с контролем, т.е. вступали в реакцию с клеточной поверхностью клеток рака молочной железы, экспрессирующих белок CAPRIN-1.
[0231]
[Пример 6] Определение характеристик отобранного антитела
(1) Клонирование гена вариабельного домена моноклонального антитела против CAPRIN-1
мРНК извлекали из каждого из гибридомных штаммов, продуцирующих 22 моноклональных антитела мыши и 3 моноклональных антитела курицы, отобранных в примере 5. Гены вариабельных (VH) доменов тяжелой цепи и вариабельных (VL) доменов легкой цепи всех моноклональных антител против CAPRIN-1 получали посредством ОТ-ПЦР с использованием праймеров, специфичных к последовательности, полученной из FR1 мыши, и последовательности, полученной из FR4 мыши, в гибридомах, продуцирующих моноклональные антитела мыши, и праймеров, специфичных к последовательности, полученной из FR1 курицы, и последовательности, полученной из FR4 курицы, в гибридомах, продуцирующих моноклональные антитела курицы. Эти гены клонировали в вектор pCR2.1 (производства Invitrogen Corporation) для секвенирования.
[0232]
(1)-1 ОТ-ПЦР
мРНК получали из 1×106 гибридом каждого штамма, продуцирующего моноклональное антитело мыши, с использованием набора mRNA Micro Purification (производства GE Healthcare Bio-Sciences), и получаемую мРНК подвергали обратной транскрипции с использованием набора SuperScriptII 1st Strand Synthesis (производства Invitrogen Corporation) для того, чтобы синтезировать кДНК. Эти процедуры осуществляли в соответствии с протоколом, приложенным к каждому набору. Ген антитела амплифицировали посредством ПЦР с использованием получаемой кДНК. Для того чтобы получать ген домена VH, использовали праймер (SEQ ID NO: 257), специфичный к последовательности FR1 тяжелой цепи мыши, и праймер (SEQ ID NO: 258), специфичный к последовательности FR4 тяжелой цепи мыши. Для того чтобы получать ген домена VL, использовали праймер (SEQ ID NO: 259), специфичный к последовательности FR1 легкой цепи мыши, и праймер (SEQ ID NO: 260), специфичный к последовательности FR4 легкой цепи мыши. Эти праймеры разрабатывали, обращаясь к Jones, S.T. and Bending, M.M., Bio/Technology, 9, 88-89 (1991). В ПЦР использовали Ex-taq (производства Takara Bio Inc.). Образец кДНК добавляли в 5 мкл 10×EX Taq Buffer, 4 мкл (2,5 мМ) dNTP Мixture, 2 мкл (1,0 мкМ) каждого праймера и 0,25 мкл (5 Ед./мкл) Ex Taq, и общий объем корректировали до 50 мкл с использованием стерилизованной воды. После обработки при 94°C в течение 2 минут, цикл, состоящий из денатурации при 94°C в течение 1 минуты, отжига при 58°C в течение 30 секунд и достройки при 72°C в течение 1 минуты, повторяли в течение 30 циклов.
[0233]
Общую РНК извлекали из 1×106 гибридом каждого штамма, продуцирующего моноклональное антитело курицы, с использованием набора High Pure RNA Isolation (производства Roche Diagnostics K.K.), и кДНК синтезировали с использованием набора PrimeScript II 1st strand cDNA Synthesis (производства Takara Bio Inc.). Эти процедуры осуществляли в соответствии с протоколом, приложенным к каждому набору. Каждый из гена вариабельного домена тяжелой цепи антитела курицы и гена вариабельного домена легкой цепи антитела курицы амплифицировали с использованием синтезированной кДНК в качестве матрицы и KOD-Plus-DNA Polymerase (производства Toyobo Co., Ltd.) посредством ПЦР в соответствии с обычным способом. Для того чтобы получать ген домена VH антитела курицы, использовали праймер, специфичный к последовательности FR1 тяжелой цепи курицы, и праймер, специфичный к последовательности FR4 тяжелой цепи курицы. Для того чтобы получить ген домена VL, использовали праймер, специфичный к последовательности FR1 легкой цепи курицы, и праймер, специфичный к FR4 легкой цепи курицы.
[0234]
(1)-2 Клонирование
Каждый продукт ПЦР, полученный выше, подвергали электрофорезу в агарозном геле и вырезали полосы ДНК домена VH и домена VL. Фрагменты ДНК очищали с использованием набора QIAquick Gel Purification (производства Qiagen) в соответствии с протоколом, приложенным к набору. Каждую очищенную ДНК клонировали в вектор pCR2.1 с использованием набора TA Cloning (производства Invitrogen Corporation). Соединенный вектор трансформировали в компетентные клетки DH5a (производства Toyobo Co., Ltd.) в соответствии с обычным способом. Десять клонов каждого трансформанта культивировали в среде (100 мкг/мл ампициллина) при 37°C в течение ночи, и каждую плазмидную ДНК очищали с использованием набора Qiaspin Miniprep (производства Qiagen).
[0235]
(1)-3 Секвенирование
Гены домена VH и домена VL в каждой из плазмид, полученных выше, секвенировали с использованием прямого праймера M13 (SEQ ID NO: 261) и обратного праймера M13 (SEQ ID NO: 262) с использованием флуоресцентного секвенатора (DNA sequencer 3130XL, производства ABI), используя набор BigDye Terminator Ver 3.1 Cycle Sequencing производства ABI в соответствии с протоколом, приложенным к набору. Как результат, определяли каждую последовательность гена и аминокислотную последовательность.
[0236]
То есть каждое из этих моноклональных антител содержит вариабельный (VH) домен тяжелой цепи (номер последовательности для последовательности гена показан в круглых скобках), содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 40 (SEQ ID NO: 45), SEQ ID NO: 50 (SEQ ID NO: 55), SEQ ID NO: 60 (SEQ ID NO: 65), SEQ ID NO: 70 (SEQ ID NO: 75), SEQ ID NO: 80 (SEQ ID NO: 85), SEQ ID NO: 90 (SEQ ID NO: 95), SEQ ID NO: 100 (SEQ ID NO: 105), SEQ ID NO: 110 (SEQ ID NO: 115), SEQ ID NO: 120 (SEQ ID NO: 125), SEQ ID NO: 130 (SEQ ID NO: 131), SEQ ID NO: 135 (SEQ ID NO: 140), SEQ ID NO: 145 (SEQ ID NO: 150), SEQ ID NO: 160 (SEQ ID NO: 165), SEQ ID NO: 170 (SEQ ID NO: 175), SEQ ID NO: 200 (SEQ ID NO: 205), SEQ ID NO: 210 (SEQ ID NO: 215), SEQ ID NO: 220 (SEQ ID NO: 225), SEQ ID NO: 230 (SEQ ID NO: 235), SEQ ID NO: 240 (SEQ ID NO: 245) или SEQ ID NO: 250 (SEQ ID NO: 255), и вариабельный (VL) домен легкой цепи (номер последовательности для последовательности гена показан в круглых скобках), содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 44 (SEQ ID NO: 46), SEQ ID NO: 54 (SEQ ID NO: 56), SEQ ID NO: 64 (SEQ ID NO: 66), SEQ ID NO: 74 (SEQ ID NO: 76), SEQ ID NO: 84 (SEQ ID NO: 86), SEQ ID NO: 94 (SEQ ID NO: 96), SEQ ID NO: 104 (SEQ ID NO: 106), SEQ ID NO: 114 (SEQ ID NO: 116), SEQ ID NO: 124 (SEQ ID NO: 126), SEQ ID NO: 139 (SEQ ID NO: 141), SEQ ID NO: 149 (SEQ ID NO: 151), SEQ ID NO: 155 (SEQ ID NO: 156), SEQ ID NO: 164 (SEQ ID NO: 166), SEQ ID NO: 174 (SEQ ID NO: 176), SEQ ID NO: 180 (SEQ ID NO: 181), SEQ ID NO: 185 (SEQ ID NO: 186), SEQ ID NO: 190 (SEQ ID NO: 191), SEQ ID NO: 195 (SEQ ID NO: 196), SEQ ID NO: 204 (SEQ ID NO: 206), SEQ ID NO: 214 (SEQ ID NO: 216), SEQ ID NO: 224 (SEQ ID NO: 226), SEQ ID NO: 234 (SEQ ID NO: 236), SEQ ID NO: 244 (SEQ ID NO: 246) или SEQ ID NO: 254 (SEQ ID NO: 256). Домен VH содержит CDR1, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 37, SEQ ID NO: 47, SEQ ID NO: 57, SEQ ID NO: 67, SEQ ID NO: 77, SEQ ID NO: 87, SEQ ID NO: 97, SEQ ID NO: 107, SEQ ID NO: 117, SEQ ID NO: 127, SEQ ID NO: 132, SEQ ID NO: 142, SEQ ID NO: 157, SEQ ID NO: 167, SEQ ID NO: 197, SEQ ID NO: 207, SEQ ID NO: 217, SEQ ID NO: 227, SEQ ID NO: 237 или SEQ ID NO: 247, CDR2, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 38, SEQ ID NO: 48, SEQ ID NO: 58, SEQ ID NO: 68, SEQ ID NO: 78, SEQ ID NO: 88, SEQ ID NO: 98, SEQ ID NO: 108, SEQ ID NO: 118, SEQ ID NO: 128, SEQ ID NO: 133, SEQ ID NO: 143, SEQ ID NO: 158, SEQ ID NO: 168, SEQ ID NO: 198, SEQ ID NO: 208, SEQ ID NO: 218, SEQ ID NO: 228, SEQ ID NO: 238 или SEQ ID NO: 248, и CDR3, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 39, SEQ ID NO: 49, SEQ ID NO: 59, SEQ ID NO: 69, SEQ ID NO: 79, SEQ ID NO: 89, SEQ ID NO: 99, SEQ ID NO: 109, SEQ ID NO: 119, SEQ ID NO: 129, SEQ ID NO: 134, SEQ ID NO: 144, SEQ ID NO: 159, SEQ ID NO: 169, SEQ ID NO: 199, SEQ ID NO: 209, SEQ ID NO: 219, SEQ ID NO: 229, SEQ ID NO: 239 или SEQ ID NO: 249. Домен VL содержит CDR1, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 41, SEQ ID NO: 51, SEQ ID NO: 61, SEQ ID NO: 71, SEQ ID NO: 81, SEQ ID NO: 91, SEQ ID NO: 101, SEQ ID NO: 111, SEQ ID NO: 121, SEQ ID NO: 136, SEQ ID NO: 146, SEQ ID NO: 152, SEQ ID NO: 161, SEQ ID NO: 171, SEQ ID NO: 177, SEQ ID NO: 182, SEQ ID NO: 187, SEQ ID NO: 192, SEQ ID NO: 201, SEQ ID NO: 211, SEQ ID NO: 221, SEQ ID NO: 231, SEQ ID NO: 241 или SEQ ID NO: 251, CDR2, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 42, SEQ ID NO: 52, SEQ ID NO: 62, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 92, SEQ ID NO: 102, SEQ ID NO: 112, SEQ ID NO: 122, SEQ ID NO: 137, SEQ ID NO: 147, SEQ ID NO: 153, SEQ ID NO: 162, SEQ ID NO: 172, SEQ ID NO: 178, SEQ ID NO: 183, SEQ ID NO: 188, SEQ ID NO: 193, SEQ ID NO: 202, SEQ ID NO: 212, SEQ ID NO: 222, SEQ ID NO: 232, SEQ ID NO: 242 или SEQ ID NO: 252, и CDR3, представленную аминокислотной последовательностью, приведенной в SEQ ID NO: 43, SEQ ID NO: 53, SEQ ID NO: 63, SEQ ID NO: 73, SEQ ID NO: 83, SEQ ID NO: 93, SEQ ID NO: 103, SEQ ID NO: 113, SEQ ID NO: 123, SEQ ID NO: 138, SEQ ID NO: 148, SEQ ID NO: 154, SEQ ID NO: 163, SEQ ID NO: 173, SEQ ID NO: 179, SEQ ID NO: 184, SEQ ID NO: 189, SEQ ID NO: 194, SEQ ID NO: 203, SEQ ID NO: 213, SEQ ID NO: 223, SEQ ID NO: 233, SEQ ID NO: 243 или SEQ ID NO: 253.
[0237]
Аминокислотная последовательность вариабельного домена тяжелой цепи каждого из получаемых моноклональных антител приведена в SEQ ID NO: 40, SEQ ID NO: 50, SEQ ID NO: 60, SEQ ID NO: 70, SEQ ID NO: 80, SEQ ID NO: 90, SEQ ID NO: 100, SEQ ID NO: 110, SEQ ID NO: 120, SEQ ID NO: 130, SEQ ID NO: 135, SEQ ID NO: 145, SEQ ID NO: 160, SEQ ID NO: 170, SEQ ID NO: 200, SEQ ID NO: 210, SEQ ID NO: 220, SEQ ID NO: 230, SEQ ID NO: 240 и SEQ ID NO: 250, и аминокислотная последовательность вариабельного домена легкой цепи приведена в SEQ ID NO: 44, SEQ ID NO: 54, SEQ ID NO: 64, SEQ ID NO: 74, SEQ ID NO: 84, SEQ ID NO: 94, SEQ ID NO: 104, SEQ ID NO: 114, SEQ ID NO: 124, SEQ ID NO: 139, SEQ ID NO: 149, SEQ ID NO: 155, SEQ ID NO: 164, SEQ ID NO: 174, SEQ ID NO: 180, SEQ ID NO: 185, SEQ ID NO: 190, SEQ ID NO: 195, SEQ ID NO: 204, SEQ ID NO: 214, SEQ ID NO: 224, SEQ ID NO: 234, SEQ ID NO: 244 и SEQ ID NO: 254.
[0238]
То есть моноклональное антитело мыши #1 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 70, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 74; моноклональное антитело мыши #2 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 80, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 84; моноклональное антитело мыши #3 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 90, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 94; моноклональное антитело мыши #4 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 100, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 104; моноклональное антитело мыши #5 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 110, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 114; моноклональное антитело мыши #6 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 120, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 124; моноклональное антитело мыши #7 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 130, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 124; моноклональное антитело мыши #8 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 135, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 139; моноклональное антитело мыши #9 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 145, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 149; моноклональное антитело мыши #10 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 145, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 155; моноклональное антитело мыши #11 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 160, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 164; моноклональное антитело мыши #12 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 174; моноклональное антитело мыши #13 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 180; моноклональное антитело мыши #14 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 185; моноклональное антитело мыши #15 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 190; моноклональное антитело мыши #16 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 170, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 195; моноклональное антитело мыши #17 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 200, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 204; моноклональное антитело мыши #18 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 210, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 214; моноклональное антитело мыши #19 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 220, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 224; моноклональное антитело мыши #20 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 230, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 234; моноклональное антитело мыши #21 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 240, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 244; и моноклональное антитело мыши #22 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 250, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 254.
[0239]
Аминокислотные последовательности вариабельных доменов тяжелой цепи получаемых моноклональных антител курицы приведены в SEQ ID NO: 40, 50 и 60; и аминокислотные последовательности вариабельных доменов легких цепей приведены в SEQ ID NO: 44, 54 и 64.
[0240]
То есть моноклональное антитело курицы #1 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 40, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 44, где CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 37, 38 и 39, соответственно; и CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 41, 42 и 43, соответственно. Моноклональное антитело курицы #2 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 50, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 54, где CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 47, 48 и 49, соответственно; и CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 51, 52 и 53, соответственно. Моноклональное антитело курицы #3 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 60, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 64, где CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 57, 58 и 59, соответственно; и CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 61, 62 и 63, соответственно.
[0241]
(2) Получение химерного рекомбинантного антитела человека и курицы и химерного антитела мыши и курицы
Оба конца амплифицированного фрагмента гена вариабельного домена тяжелой цепи, приведенного в SEQ ID NO: 40, моноклонального антитела курицы #1, полученного выше в (1), обрабатывали рестрикционными ферментами, и фрагмент очищали и вставляли в вектор pcDNA4/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела курицы, содержащую последовательность, приведенную в SEQ ID NO: 263, и константный домен H-цепи IgG1 человека, содержащий последовательность, приведенную в SEQ ID NO: 264, в соответствии с обычным способом. Отдельно, оба конца амплифицированного фрагмента гена вариабельного домена легкой цепи, приведенного в SEQ ID NO: 44, моноклонального антитела курицы #1 обрабатывали рестрикционными ферментами, и фрагмент очищали и вставляли в вектор pcDNA3.1/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела курицы, содержащего последовательность, приведенную в SEQ ID NO: 263, и константный домен L-цепи IgG1 человека, содержащий последовательность, приведенную в SEQ ID NO: 265, в соответствии с обычным способом.
[0242]
Впоследствии рекомбинантный вектор, содержащий вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 40, моноклонального антитела курицы #1, и рекомбинантный вектор, содержащий вариабельный домен легкой цепи, приведенный в SEQ ID NO: 44, моноклонального антитела курицы #1, вводили в клетки CHO-K1 (полученные из Riken Cell Bank). В частности, 2×105 клеток CHO-K1, культивированных в каждой лунке 12-луночного культурального планшета, содержащей 1 мл среды Хэма F12 (производства Life Technologies), содержащей 10% FBS, промывали в PBS (-). В каждую лунку добавляли 1 мл свежей среды Хэма F12, содержащей 10% FBS, и смесь 30 мкл OptiMEM (производства Life Technologies), содержащую 250 нг каждого из указанных выше векторов, и 30 мкл реактива для трансфекции Polyfect (производства Qiagen). Клетки CHO-K1, которым вводили рекомбинантные векторы, культивировали в среде Хэма F12, содержащей 10% FBS, 200 мкг/мл зеоцина (производства Life Technologies) и 200 мкг/мл генетицина (производства Roche), и после этого высевали в 96-луночный планшет по 0,5 клеток на лунку для того, чтобы получать клеточную линию, стабильно продуцирующую химерное антитело человека и курицы #1 (#1), которое содержит вариабельный домен моноклонального антитела курицы #1. Аналогичным образом, клеточные линии, стабильно продуцирующие химерное антитело человека и курицы #2 (#2) и химерное антитело человека и курицы #3 (#3), получали из моноклональных антител курицы #2 и #3, соответственно.
[0243]
Каждую из полученных клеточных линий культивировали по 5×105 клеток/мл в 150 см2 колбе, содержащей 30 мл бессывороточной среды OptiCHO (производства Life Technologies), в течение 5 суток для того, чтобы получать культуральный супернатант, который содержит #1, #2 или #3.
[0244]
Аналогичным образом, оба конца амплифицированного фрагмента гена вариабельного домена тяжелой цепи, приведенного в SEQ ID NO: 40, моноклонального антитела курицы #1 обрабатывали рестрикционными ферментами и фрагмент очищали и вставляли в вектор pcDNA4/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела курицы, и константный домен H-цепи IgG1 мыши, в соответствии с обычным способом. Отдельно, оба конца амплифицированного фрагмента гена вариабельного домена легкой цепи, приведенного в SEQ ID NO: 44, моноклонального антитела курицы #1 обрабатывали рестрикционными ферментами и фрагмент очищали и вставляли в вектор pcDNA3.1/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела курицы, и константный домен L-цепи IgG1 мыши, в соответствии с обычным способом. Эти векторы вводили в клетки CHO-K1, как изложено выше, чтобы получать клеточную линию, стабильно продуцирующую химерное антитело мыши и курицы #1, которое содержит вариабельный домен моноклонального антитела курицы #1. Аналогичным образом, клеточные линии, стабильно продуцирующие химерное антитело мыши и курицы #2 (#2) и химерное антитело мыши и курицы #3 (#3), получали из моноклональных антител курицы #2 и #3, соответственно.
[0245]
Каждую из полученных клеточных линий культивировали по 5×105 клеток/мл в 150 см2 колбе, содержащей 30 мл бессывороточной среды OptiCHO (производства Life Technologies), в течение 5 суток для того, чтобы получать культуральный супернатант, который содержит химерное антитело мыши и курицы #1, химерное антитело мыши и курицы #2 и химерное антитело мыши и курицы #3.
[0246]
(3) Экспрессия белка CAPRIN-1 на клеточной поверхности рака печени с использованием полученного моноклонального антитела
Впоследствии у четырех клеточных линий рака печени (Hep3GB, HepG2, SK-Hep-1 и SW480), у которых подтверждали экспрессию гена CAPRIN-1, исследовали, экспрессируют ли поверхности этих клеток белок CAPRIN-1 или нет. 1×106 клеток каждой клеточной линии центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли культуральный супернатант (100 мкл), который содержит какое-либо из моноклональных антител мыши с #1 до #22 против белка CAPRIN-1, которые вступают в реакцию с клеточной поверхностью рака, полученного в примере 4, и химерные антитела мыши и курицы с #1 до #3 против белка CAPRIN-1, полученные выше в (2), после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, клетки суспендировали в FITC-меченном антителе козы против IgG мыши (производства Invitrogen Corporation), разведенном 500-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, в качестве контроля, ту же процедуру, что и выше, осуществляли с использованием изотипического контрольного антитела, вместо культуральных супернатантов, содержащих моноклональные антитела мыши с #1 до #22 против белка CAPRIN-1 и химерные антитела мыши и курицы с #1 до #3. Как результат, интенсивность флуоресценции в клетках, в которые добавляли любое из моноклональных антител с #1 до #22 и химерных антител мыши и курицы с #1 до #3, была выше на 20% или больше таковой в контроле в каждом случае. В частности, в случае использования химерного антитела мыши и курицы #1, интенсивность флуоресценции увеличивали на 200% или больше как в SK-Hep-1, так и в Hep3B. Это демонстрирует, что белок CAPRIN-1 экспрессировали на клеточной поверхности клеточных линий рака печени человека. Степень увеличения интенсивности флуоресценции представляют посредством степени увеличения средней интенсивности флуоресценции (значение MFI) в каждой клетке и вычисляют посредством следующей расчетной формулы:
[0247]
Степень увеличения средней интенсивности флуоресценции (степень увеличения интенсивности флуоресценции) (%) = ((значение MFI клеток, вступавших в реакцию с антителом против CAPRIN-1 человека) - (значение MFI контроля))/(значение MFI контроля) × 100.
[0248]
(4) Противоопухолевый эффект (ADCC активность) антитела против белка CAPRIN-1, оказываемый на клетки рака печени человека
Из антител, полученных выше, химерное антитело человека и курицы #1 использовали для оценки цитотоксичности (ADCC активность) в отношении клеток рака печени человека. Химерное антитело человека и курицы #1, содержавшееся в культуральном супернатанте, полученном выше в (2), очищали с использованием Hitrap Protein A Sepharose FF (производства GE Healthcare Bio-Sciences), замещали с использованием PBS (-), и фильтровали через фильтр 0,22 мкм (производства Millipore Corporation), и использовали в качестве антитела для измерения активности. 1×106 клеток каждой из клеточных линий рака печени человека SK-Hep-1 и Hep3B собирали в 50 мл пробирке для центрифугирования, и в нее добавляли 100 мкКи 51хром, после чего следовала инкубация при 37°C в течение 2 часов. Впоследствии клетки промывали средой RPMI1640, содержащей 10% FBS, три раза и после этого добавляли в 96-луночный планшет с V-образным дном по 2×103 клеток на лунку в качестве клеток-мишеней. В каждую лунку добавляли 1,2 мкг антитела, очищенного выше. Отдельно, популяцию клеток, содержащую естественные клетки-киллеры человека, выделяли из лимфоцитов периферической крови человека посредством следующей процедуры: периферические мононуклеарные клетки человека подвергали реакции с меченными флуоресцентным красителем FITC антителами (антитело против CD3 человека, антитело против CD20 человека, антитело против CD19 человека, антитело против CD11c человека и антитело против HLA-DR (Becton, Dickinson and Company)), и популяцию клеток, содержащую естественные клетки-киллеры, не окрашенные этими антителами, выделяли с использованием клеточного сортера (FACS Vantage SE (Becton, Dickinson and Company)) или набора для выделения естественных клеток-киллеров человека (набор NK Cell Isolation (производства Miltenyi Biotec GmbH)). Популяцию клеток, содержащую естественные клетки-киллеры, дополнительно добавляли в планшет по 2×105 клеток на лунку, после чего следовало культивирование при 37°C в 5% CO2 в течение 4 часов. После культивирования, количество 51хрома, секретируемого ослабленными опухолевыми клетками в культуральный супернатант, измеряли для того, чтобы вычислять ADCC активность антитела против CAPRIN-1 в отношении клеток рака печени. Как результат, цитотоксичности химерного антитела человека и курицы #1 в отношении SK-Hep-1 и Hep3B составляли 22% и 18%, соответственно, тогда как цитотоксичности в отношении как SK-Hep-1, так и Hep3B составляли меньше, чем 5% в случае использования моноклонального антитела, которое вступает в реакцию с самим белком CAPRIN-1, но не вступает в реакцию с клеточной поверхностью клеток рака, и в случае не использования антител. Аналогичным образом, цитотоксичности моноклональных антител мыши с #1 до #22 против белка CAPRIN-1, химерных антител человека и курицы #2 и #3 в отношении SK-Hep-1 также исследовали и они все составляли 12% или больше, тогда как цитотоксичности составляли меньше, чем 5% в случае использования моноклонального антитела, которое вступает в реакцию с самим белком CAPRIN-1, но не вступает в реакцию с клеточной поверхностью клеток рака, и в случае не использования антител во всех клетках рака печени. Приведенные выше результаты демонстрировали, что полученные моноклональные антитела против CAPRIN-1 ослабляют клетки рака, экспрессирующие белок CAPRIN-1, через ADCC активность. Цитотоксичность является результатом, как описано выше, когда антитело против белка CAPRIN-1, используемое в настоящем изобретении, популяцию клеток, содержащую естественные клетки-киллеры человека, и 2×103 опухолевых клеток с 51хромом смешивали и культивировали в течение 4 часов, и когда она показана в качестве цитотоксичности в отношении опухолевых клеток, вычисленной с помощью следующей расчетной формулы * посредством измерения количества 51хрома, высвобожденного в среду после культивирования.
[0249]
Формула *: цитотоксичность (%) = (количество 51хрома, высвобожденного из опухолевых клеток в присутствии популяции клеток, содержащей антитело против белка CAPRIN-1 и естественные клетки-киллеры человека)/(количество 51хрома, высвобожденного из опухолевых клеток в присутствии 1н соляной кислоты) × 100.
[0250]
[Пример 7] Идентификация пептида белка CAPRIN-1, связывающегося с антителом против белка CAPRIN-1, вступающим в реакцию с клеточной поверхностью клеток рака
Частичные последовательности белка CAPRIN-1, распознаваемые антителами против белка CAPRIN-1, идентифицировали с использованием моноклональных антител от #12 до #22, которые представляют собой антитела против белка CAPRIN-1 и вступают в реакцию с клеточной поверхностью клеток рака, полученных выше.
[0251]
Сначала DTT (производства Fluka) добавляли в конечной концентрации от 10 мМ до 100 мкл раствора 1 мкг/мкл рекомбинантного белка CAPRIN-1 в PBS, после чего следовала реакция при 95°C в течение 5 минут для того, чтобы восстанавливать дисульфидную связь в белке CAPRIN-1. Затем туда добавляли иодоацетамид (производства Wako Pure Chemical Industries, Ltd.) в конечной концентрации 20 мМ, после чего следовало алкилирование тиоловой группы при 37°C в частично экранирующих условиях в течение 30 минут. К 40 мкг получаемого восстановленного алкилированного белка CAPRIN-1 добавляли 50 мкг какого-либо из моноклональных антител с #12 до #22 против белка CAPRIN-1. Общее количество каждой смеси корректировали до 1 мл 20 мМ фосфатным буфером (pH 7,0), после чего следовала реакция при 4°C в течение ночи при перемешивании.
[0252]
Впоследствии добавляли трипсин (производства Promega K.K.) в конечной концентрации 0,2 мкг в каждую реакционную смесь, после чего следовала реакция при 37°C в течение 1, 2, 4 или 12 часов. Реакционную смесь смешивали со стеклянными бусинами с белком A (производства GE Healthcare Bio-Sciences), блокированными PBS, содержащим 1% BSA (производства Sigma-Aldrich Co., LLC.), и предварительно промывали в PBS и 1 мМ карбонате кальция в буфере NP-40 (20 мМ фосфатный буфер (pH 7,4), 5 мМ ЭДТА, 150 мМ NaCl, 1% NP-40), после чего следовала реакция в течение 30 минут.
[0253]
Каждый реакционный раствор промывали 25 мМ аммоний-карбонатным буфером (pH 8,0), после чего следовало элюирование комплексов антиген-антитело с использованием 100 мкл 0,1% муравьиной кислоты. Элюат анализировали посредством LC-MS, используя Q-TOF Premier (производства Waters-MicroMass) в соответствии с протоколом, приложенным к прибору.
[0254]
Как результат, полипептид, приведенный в SEQ ID NO: 273, идентифицировали как частичную последовательность белка CAPRIN-1, распознаваемую всеми моноклональными антителами с #12 до #22 против белка CAPRIN-1. Кроме того, пептид, приведенный в SEQ ID NO: 274, идентифицировали как частичную последовательность полипептида, приведенного выше в SEQ ID NO: 273, распознаваемого моноклональными антителами с #13 до #16, с #17 до #19 и #21; и обнаруживали, что пептидную частичную последовательность, приведенную в SEQ ID NO: 275, распознавали моноклональные антитела с #13 до #16.
[0255]
Пептиды эпитопов в белке CAPRIN-1, распознаваемых антителами, идентифицировали с использованием химерного моноклонального антитела человека и курицы #1, химерного моноклонального антитела человека и курицы #3, и моноклональных антител мыши с #1 до #11. Пептиды-кандидаты (93 пептида), каждый состоит из от 12 до 16 аминокислот из аминокислотной последовательности белка CAPRIN-1 человека, синтезировали и каждый растворяли в концентрации 1 мг/мл в DMSO.
[0256]
Каждый пептид растворяли в концентрации 30 мкг/мл в 0,1 M натрий-карбонатном буфере (pH 9,6). Раствор добавляли в 96-луночный планшет (производства Nunc, № продукта 436006) по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение ночи. Раствор удаляли, и 200 мкл 10 мМ этаноламина/0,1 M натрий-карбонатного буфера (pH 9,6) добавляли в каждую лунку, после чего оставляли стоять при комнатной температуре в течение 1 часа. Раствор удаляли, и каждую лунку промывали в PBS, содержащем 0,5% Tween 20 (PBST), два раза для того, чтобы получать планшет с иммобилизованными пептидами.
[0257]
Супернатант клеточной культуры, который содержит химерное моноклональное антитело человека и курицы #1 (#1), химерное моноклональное антитело человека и курицы #3 (#3) или моноклональное антитело мыши (#1, #2, #3, #4, #5, #6, #7, #8, #9, #10 или #11), добавляли в каждый планшет в количестве 50 мкл на лунку, после чего следовало встряхивание при комнатной температуре в течение 1 часа. Раствор удаляли, и каждую лунку промывали в PBST три раза. Впоследствии раствор вторичного антитела, содержащий меченное HRP антитело против IgG человека (производства Life Technologies), разведенное в от 3000 до 4000 раз с использованием PBST, добавляли в лунки химерного моноклонального антитела человека и курицы по 50 мкл на лунку, тогда как раствор вторичного антитела, содержащий меченное HRP антитело против IgG мыши (производства Life Technologies), разведенное в от 3000 до 4000 раз с использованием PBST, добавляли в лунки моноклонального антитела мыши по 50 мкл на лунку. Раствор удаляли, и каждую лунку промывали в PBST шесть раз.
[0258]
Цветную реакцию осуществляли, добавляя 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.) в каждую лунку и оставляя смесь стоять в течение от 15 до 30 минут. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, полипептид, приведенный в SEQ ID NO: 266, идентифицировали в качестве частичной последовательности белка CAPRIN-1, распознаваемой всеми антителами против CAPRIN-1: химерное моноклональное антитело человека и курицы #1 и моноклональные антитела с #1 до #5 против белка CAPRIN-1. Кроме того, пептид, приведенный в SEQ ID NO: 267, идентифицировали как фрагментарный пептид полипептида, приведенного в SEQ ID NO: 266, распознаваемой химерным моноклональным антителом человека и курицы #1 и моноклональными антителами мыши #3 и #4; и пептид, приведенный в SEQ ID NO: 268, идентифицировали в качестве фрагментарного пептида полипептида, приведенного в SEQ ID NO: 266, распознаваемого моноклональными антителами мыши #1, #2 и #5. Следовательно, продемонстрировано, что полипептид, приведенный в SEQ ID NO: 266, содержит область эпитопа для антител против CAPRIN-1: химерное моноклональное антитело человека и курицы #1 и моноклональные антитела мыши с #1 до #5. Кроме того, полипептид, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 270, идентифицировали в качестве частичной последовательности белка CAPRIN-1, распознаваемой всеми моноклональными антителами против CAPRIN-1 #6, #7 и #8. Следовательно продемонстрировано, что полипептид, приведенный в SEQ ID NO: 270, содержит область эпитопа для антител против CAPRIN-1 #6, #7 и #8. Кроме того, полипептид, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 272, идентифицировали в качестве частичной последовательности белка CAPRIN-1, распознаваемой всеми моноклональными антителами против CAPRIN-1 #9, #10 и #11. Следовательно, демонстрировали, что полипептид, приведенный в SEQ ID NO: 272, содержит область эпитопа для антител против CAPRIN-1 #9, #10 и #11. Кроме того, полипептид, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 269, идентифицировали в качестве частичной последовательности белка CAPRIN-1, распознаваемой химерным моноклональным антителом человека и курицы #3. Следовательно, демонстрировали, что полипептид, приведенный в SEQ ID NO: 269, содержит область эпитопа для химерного моноклонального антитела человека и курицы #3.
[0259]
[Пример 8] Получение моноклональных антител мыши #30 и от #34 до #36 против белка CAPRIN-1
(1) Получение моноклональных антител мыши против CAPRIN-1 #30 и от #34 до #36
Смесь 100 мкг белка CAPRIN-1 человека, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 2, полученную в соответствии с примером 3 из WO 010/016526, смешанную с таким же количеством адъюванта MPL+TDM (производства Sigma-Aldrich Co., LLC.), использовали в качестве раствора антигена для одной мыши. Раствор антигена интраперитонеально вводили мышам Balb/c в возрасте 6 недель (производства Japan SLC, Inc.) и дополнительно вводили семь раз с интервалами в одну неделю для того, чтобы завершить иммунизацию. Селезенку извлекали на третьи сутки от последней иммунизации и измельчали между двумя стерилизованными предметными стеклами и промывали в PBS (-) (производства Nissui Pharmaceutical Co., Ltd.), после чего следовало центрифугирование при 1500 об/мин в течение 10 минут для того, чтобы удалять супернатант. Эту процедуру повторяли три раза для того, чтобы получать клетки селезенки. Получаемые клетки селезенки и миеломные клетки мыши SP2/0 (приобретали в ATCC) смешивали в соотношении 10:1 и в получаемую смесь добавляли раствор PEG, полученный посредством смешивания 200 мкл среды RPMI1640, содержащей 10% FBS и 800 мкл PEG 1500 (производства Boehringer Ingelheim GmbH) и нагретой до 37°C, после чего оставляли стоять в течение 5 минут для слияния клеток. Осуществляли центрифугирование при 1700 об/мин в течение 5 минут и удаляли супернатант. Клетки суспендировали в смеси из 150 мл среды RPMI1640 (селективная среда HAT), содержащей 15% FBS, и 2% эквивалентов раствора HAT производства Gibco, и суспензию высевали в 15 планшетов, которые представляли собой 96-луночные планшеты (производства Nunc), по 100 мкл на лунку. Культивирование при 37°C в 5% CO2 в течение 7 суток давало гибридомы посредством слияния клеток селезенки и миеломных клеток.
[0260]
Гибридомы отбирали с использованием, в качестве показателя, аффинности связывания антител, продуцируемых гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученный с помощью способа, описанного в примере 3 из WO 010/016526, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора бычьего сывороточного альбумина (BSA) (производства Sigma-Aldrich Co., LLC.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Life Technologies), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали несколько гибридом, продуцирующих антитела, которые показывали высокие значения поглощения.
[0261]
Отобранные гибридомы высевали в 96-луночный планшет по 0,5 клеток на лунку и культивировали. Через одну неделю, в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали и отбирали гибридомы с использованием, в качестве показателя, аффинности связывания антител, продуцируемых клонированными гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного с помощью способа, описанного в примере 3 из WO 2010/016526, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора BSA, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Invitrogen Corporation), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, получали несколько гибридомных клеточных линий, продуцирующих моноклональные антитела, реактивные в отношении белка CAPRIN-1.
[0262]
Впоследствии из получаемых моноклональных антител отбирали антитела, реактивные в отношении клеточной поверхности клеток рака молочной железы, экспрессирующих CAPRIN-1. В частности, 1×106 клеток клеточной линии рака молочной железы человека MDA-MB-231V центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело козы против IgG мыши (производства Invitrogen Corporation), разведенное 500-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно ту же процедуру, что и выше, осуществляли в качестве контроля с использованием необработанной сыворотки мыши Balb/c в возрасте 6 недель, разведенной 500-кратно с использованием гибридомной культуральной среды, вместо антитела. Как результат, отбирали четыре моноклональных антитела (антитела мыши против CAPRIN-1 #30 и от #34 до #36), которые показывали более высокие интенсивности флуоресценции по сравнению с контролем, т.е. вступали в реакцию с клеточной поверхностью клеток рака молочной железы.
[0263]
(2) Идентификация эпитопа CAPRIN-1, распознаваемого посредством каждого моноклонального антитела мыши против CAPRIN-1
Идентифицировали области эпитопов CAPRIN-1, распознаваемые получаемыми четырьмя моноклональными антителами. Синтезировали пептиды-кандидаты (93 пептида), каждый состоит из от 12 до 16 аминокислот из аминокислотной последовательности белка CAPRIN-1 человека, и каждый растворяли в концентрации 1 мг/мл в DMSO.
[0264]
Каждый пептид растворяли в концентрации 30 мкг/мл в 0,1 M натрий-карбонатном буфере (pH 9,6). Раствор добавляли в 96-луночный планшет (производства Nunc, № продукта 436006) по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение ночи. Раствор удаляли и в каждую лунку добавляли 200 мкл 10 мМ этаноламина/0,1 M натрий-карбонатного буфера (pH 9,6), после чего оставляли стоять при комнатной температуре в течение 1 часа. Раствор удаляли и каждую лунку промывали в PBS, содержащем 0,5% Tween 20 (PBST), два раза для того, чтобы получать планшет с иммобилизованными пептидами.
[0265]
Супернатант клеточной культуры, который содержит антитело против CAPRIN-1 #1, добавляли в планшет в количестве 50 мкл на лунку, после чего следовало встряхивание при комнатной температуре в течение 1 часа. Раствор удаляли и каждую лунку промывали в PBST три раза. Впоследствии в каждую лунку добавляли 50 мкл раствора вторичного антитела, содержащего меченное HRP антитело против IgG мыши (производства Life Technologies), разведенное в от 3000 до 4000 раз с использованием PBST. Раствор удаляли и каждую лунку промывали в PBST шесть раз.
[0266]
Цветную реакцию осуществляли, добавляя в каждую лунку 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.) и оставляя смесь стоять в течение от 15 до 30 минут. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра.
[0267]
Как результат, полипептид, приведенный в SEQ ID NO: 429, идентифицировали в качестве частичной последовательности CAPRIN-1, распознаваемой антителом мыши против CAPRIN-1 #30; полипептид, приведенный в SEQ ID NO: 431, идентифицировали в качестве частичной последовательности CAPRIN-1, распознаваемой антителом мыши против CAPRIN-1 #34; и полипептид, приведенный в SEQ ID NO: 432, идентифицировали в качестве частичной последовательности CAPRIN-1, распознаваемой антителами мыши против CAPRIN-1 #35 и #36.
[0268]
(3) Клонирование гена вариабельного домена каждого моноклонального антитела мыши против CAPRIN-1
Анализировали последовательность гена получаемых моноклональных антител, кодирующую вариабельные домены, и их аминокислотные последовательности в соответствии со способом, описанном в примере 5 из WO 2010/016526.
[0269]
Результаты демонстрировали, что антитело мыши против CAPRIN-1 #30, содержит вариабельный домен тяжелой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 344, и вариабельный домен легкой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 348. Последовательность гена, кодирующего вариабельный домен тяжелой цепи, приведена в SEQ ID NO: 349; и последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 350. CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 341, 342 и 343, соответственно. CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 345, 346 и 347, соответственно.
[0270]
Кроме того, результаты демонстрировали, что антитело мыши против CAPRIN-1 #34 содержит вариабельный домен тяжелой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 401, и вариабельный домен легкой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 405. Последовательность гена, кодирующего вариабельный домен тяжелой цепи, приведена в SEQ ID NO: 406; и последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 407. CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 398, 399 и 400, соответственно. CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 402, 403 и 404, соответственно.
[0271]
Результаты демонстрировали, что антитело мыши против CAPRIN-1 #35 содержит вариабельный домен тяжелой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 411, и вариабельный домен легкой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 415. Последовательность гена, кодирующего вариабельный домен тяжелой цепи, приведена в SEQ ID NO: 416; и последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 417. CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 408, 409 и 410, соответственно. CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 412, 413 и 414, соответственно.
[0272]
Результаты демонстрировали, что антитело мыши против CAPRIN-1 #36 содержит вариабельный домен тяжелой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 421, и вариабельный домен легкой цепи, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 425. Последовательность гена, кодирующего вариабельный домен тяжелой цепи, приведена в SEQ ID NO: 426; и последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 427. CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 418, 419 и 420, соответственно. CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 422, 423, и 424, соответственно.
[0273]
(4) Анализ экспрессии белка CAPRIN-1 на клеточной поверхности рака печени с использованием каждого моноклонального антитела мыши против CAPRIN-1
Исследовали четыре клеточные линии рака печени человека (Hep3GB, HepG2, SK-Hep-1 и SW480), экспрессирует клеточная поверхность белок CAPRIN-1 или нет. 5×105 клеток каждой из клеточных линий рака печени центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. Клетки подвергали реакции с каждым антителом мыши против CAPRIN-1 в конечной концентрации 20 мкг/мл, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, проводили реакцию клеток со 100-кратно разведенным Alexa488-меченным антителом козы против IgG мыши (производства Invitrogen Corporation), после чего оставляли стоять на льду в течение 30 часов. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. В качестве отрицательного контроля в реакции использовали только вторичное антитело. Как результат, интенсивности флуоресценции в клетках, в которые добавляли антитело против CAPRIN-1, были выше на 35% или больше таковых в контроле в каждой клеточной линии рака печени. Это демонстрирует, что клеточная поверхность клеточных линий рака печени экспрессирует белок CAPRIN-1.
[0274]
[Пример 9] Получение моноклональных антител мыши от #31 до #33 против белка CAPRIN-1
(1) Получение антитела мыши против CAPRIN-1 #31
Смесь 100 мкг белка CAPRIN-1 человека, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 2, получали в соответствии с примером 3 из WO 2010/016526, смешанного с таким же количеством адъюванта MPL+TDM (производства Sigma-Aldrich Co., LLC.) использовали в качестве раствора антигена для одной мыши. Раствор антигена интраперитонеально вводили мышам Balb/c в возрасте 6 недель (производства Japan SLC, Inc.) и дополнительно вводили семь раз с интервалами в одну неделю для того, чтобы завершить иммунизацию. Селезенку извлекали на третьи сутки от последней иммунизации и измельчали между двумя стерилизованными предметными стеклами и промывали в PBS (-) (производства Nissui Pharmaceutical Co., Ltd.), после чего следовало центрифугирование при 1500 об/мин в течение 10 минут для того, чтобы удалять супернатант. Эту процедуру повторяли три раза для того, чтобы получать клетки селезенки. Получаемые клетки селезенки и миеломные клетки мыши SP2/0 (приобретали в ATCC) смешивали в соотношении 10:1 и в получаемую смесь добавляли раствор PEG, полученный посредством смешивания 200 мкл среды RPMI1640, содержащей 10% FBS, и 800 мкл PEG 1500 (производства Boehringer Ingelheim GmbH) и нагретой до 37°C, после чего оставляли стоять в течение 5 минут для слияния клеток. Осуществляли центрифугирование при 1700 об/мин в течение 5 минут и удаляли супернатант. Клетки суспендировали в смеси 150 мл среды RPMI1640 (селективная среда HAT), содержащей 15% FBS, и 2% эквивалентов раствора HAT производства Gibco, и суспензию высевали в 15 планшетов, которые представляли собой 96-луночные планшеты (производства Nunc), по 100 мкл на лунку. Культивирование при 37°C в 5% CO2 в течение 7 суток давало гибридомы посредством слияния клеток селезенки и миеломных клеток.
[0275]
Гибридомы отбирали с использованием, в качестве показателя, аффинности связывания антител, продуцируемых гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного с помощью способа, описанного в примере 3 из WO 2010/016526, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора бычьего сывороточного альбумина (BSA) (производства Sigma-Aldrich Co., LLC.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Life Technologies), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали несколько гибридом, продуцирующих антитела, которые показывали высокие значения поглощения.
[0276]
Отобранные гибридомы высевали в 96-луночный планшет по 0,5 клеток на лунку и культивировали. Через одну неделю, в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали и отбирали гибридомы с использованием, в качестве показателя, аффинности связывания антител, продуцируемых клонированными гибридомами, с белком CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1, полученного с помощью способа, описанного в примере 3 из WO 2010/016526, добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора BSA, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Invitrogen Corporation), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, получали 61 гибридому, продуцирующие моноклональные антитела, реактивные в отношении белка CAPRIN-1.
[0277]
Впоследствии из получаемых моноклональных антител отбирали антитела, реактивные в отношении клеточной поверхности клеток рака молочной железы, экспрессирующих CAPRIN-1. В частности, 1×106 клеток клеточной линии рака молочной железы человека MDA-MB-231V центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело козы против IgG мыши (производства Invitrogen Corporation), разведенное 500-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, ту же процедуру, что и выше, осуществляли в качестве контроля, используя необработанную сыворотку мыши Balb/c в возрасте 6 недель, разведенную 500-кратно с использованием гибридомной культуральной среды, вместо антитела. Как результат, отбирали одно моноклональное антитело мыши (антитело мыши против CAPRIN-1 #31), показывающее более высокую интенсивность флуоресценции по сравнению с контролем, т.е. вступающее в реакцию с клеточной поверхностью клеток рака молочной железы.
[0278]
(2) Идентификация эпитопа CAPRIN-1, распознаваемого антителом мыши против CAPRIN-1 #31
Распознаваемую область эпитопа CAPRIN-1 идентифицировали с использованием моноклонального антитела (антитела мыши против CAPRIN-1 #31) против CAPRIN-1, реактивного в отношении клеточной поверхности клеток рака, полученных выше (1). Синтезировали пептиды-кандидаты (93 пептида), каждый состоит из от 12 до 16 аминокислот аминокислотной последовательности белка CAPRIN-1 человека, и каждый растворяли в концентрации 1 мг/мл в DMSO.
[0279]
Каждый пептид растворяли в концентрации 30 мкг/мл в 0,1 M натрий-карбонатном буфере (pH 9,6). Раствор добавляли в 96-луночный планшет (производства Nunc, № продукта 436006) по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение ночи. Раствор удаляли, и в каждую лунку добавляли 200 мкл 10 мМ этаноламина/0,1 M натрий-карбонатного буфера (pH 9,6), после чего оставляли стоять при комнатной температуре в течение 1 часа. Раствор удаляли, и каждую лунку промывали в PBS, содержащем 0,5% Tween 20 (PBST) два раза для того, чтобы получать планшет с иммобилизованными пептидами.
[0280]
Супернатант клеточной культуры, который содержит антитело против CAPRIN-1 #31, добавляли в планшет в количестве 50 мкл на лунку, после чего следовало встряхивание при комнатной температуре в течение 1 часа. Раствор удаляли и каждую лунку промывали в PBST три раза. Впоследствии в каждую лунку добавляли 50 мкл раствора вторичного антитела, содержащего меченное HRP антитело против IgG мыши (производства Life Technologies), разведенного в от 3000 до 4000 раз с использованием PBST. Раствор удаляли и каждую лунку промывали в PBST шесть раз.
[0281]
Цветную реакцию осуществляли, добавляя в каждую лунку 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.) и оставляя смесь стоять в течение от 15 до 30 минут. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра.
[0282]
Как результат, полипептид, приведенный в SEQ ID NO: 430, идентифицировали в качестве частичной последовательности CAPRIN-1, распознаваемой антителом мыши против CAPRIN-1 #31, полученным выше (1).
[0283]
(3) Получение антител мыши против CAPRIN-1 #32 и #33
Как в способе выше (1), слитый белок полипептида, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 430, идентифицированную выше (2), и белок-носитель, гемоцианин фисурелла (KLH), использовали в качестве иммуногена; иммуноген смешивали с таким же количеством адъюванта, TiterMax Gold (зарегистрированный товарный знак) (CytRx Corp.); и смесь интраперитонеально вводили каждой мыши четыре раза с интервалами 7 суток по 100 мкг на один раз. Клетки селезенки извлекали на третьи сутки от последней иммунизации. Как в способе выше (1), проводили слияние клеток селезенки с миеломными клетками мыши для того, чтобы получать гибридомы. Впоследствии отбирали антитела с использованием, в качестве показателя, реактивности антител, содержащихся в культуральных супернатантах получаемых гибридом, с использованием раствора 1 мкг/мл белка CAPRIN-1, полученного в примере 3 из WO 2010/016526, и слитого белка аминокислотной последовательности, приведенной в SEQ ID NO: 5, используемой в качестве иммуногена, и белка-носителя, BSA. В частности, 100 мкл раствора 1 мкг/мл белка CAPRIN-1, полученного в примере 3 из WO 2010/016526, и 100 мкл раствора 30 мкг/мл слитого белка аминокислотной последовательности, приведенной в SEQ ID NO: 5, и белка-носителя, BSA, добавляли в каждую лунку 96-луночного планшета, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T и в каждую лунку добавляли 400 мкл раствора Block Ace (DS Pharma Biomedical Co., Ltd.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, и каждую лунку промывали в PBS-T, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T, и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG (H+L) мыши (производства Life Technologies), разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 5 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали гибридомы, продуцирующие антитела, показывающие высокие значения поглощения.
[0284]
Отобранные гибридомы высевали в 96-луночный планшет по 0,3 клеток на лунку и культивировали. Через одну неделю в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали, и гибридомы, продуцирующие антитела против частичной последовательности белка CAPRIN-1, аминокислотной последовательности, приведенной в SEQ ID NO: 430, отбирали с использованием, в качестве показателя, аффинности связывания антител, продуцируемых клонированными гибридомами, с аминокислотной последовательностью, приведенной в SEQ ID NO: 430.
[0285]
Моноклональные антитела, реактивные в отношении клеточной поверхности клеток рака молочной железы, экспрессирующих CAPRIN-1, отбирали из моноклональных антител, продуцируемых получаемыми гибридомами. В частности, 1×106 клеток клеточной линии рака молочной железы человека MDA-MB-231V центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело козы против IgG мыши (производства Invitrogen Corporation), разведенное 500-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно ту же процедуру, что и выше, осуществляли в качестве отрицательного контроля с использованием необработанной сыворотки мыши Balb/c в возрасте 6 недель, разведенной 500-кратно с использованием гибридомной культуральной среды вместо антитела и с использованием только вторичного антитела в реакции. Как результат, получали два моноклональных антитела мыши (антитело мыши против CAPRIN-1 #32 и антитело мыши против CAPRIN-1 #33), показывающие более высокую интенсивность флуоресценции по сравнению с отрицательным контролем, т.е. вступающие в реакцию с клеточной поверхностью клеток рака молочной железы.
[0286]
Изучали, специфично или нет получаемые антитела мыши против CAPRIN-1 #32 и #33, вступают в реакцию с полипептидом, который имеет аминокислотную последовательность, приведенную в SEQ ID NO: 430, частичной последовательностью CAPRIN-1, используемой в качестве иммуногена. Раствор 30 мкг/мл аминокислотной последовательности, приведенной в SEQ ID NO: 430, или частичной последовательности, отличной от аминокислотной последовательности, приведенной в SEQ ID NO: 430 CAPRIN-1, в водном растворе 0,1 M карбоната натрия добавляли в 96-луночный планшет для ELISA, Immobilizer Amino (Nunc), в количестве 100 мкг/мл, после чего следовала реакция при 4°C в течение ночи для того, чтобы иммобилизовать пептид в лунке. Водный раствор 0,1 M карбоната натрия, содержащий 10 мМ этаноламина, добавляли в лунки с иммобилизованным пептидом, после чего оставляли стоять при комнатной температуре в течение 1 часа. Раствор в лунках удаляли. После промывания в PBS-T, 400 мкл раствора Block Ace добавляли в каждую лунку, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор в лунках удаляли. После промывания в PBS-T в каждую лунку добавляли 50 мкл культурального супернатанта, содержащего антитело мыши против CAPRIN-31 #32 или #33, после чего следовала реакция при комнатной температуре в течение 1 часа. После промывания в PBS-T в каждую лунку добавляли 50 мкл меченного HRP антитела против IgG (H+L) мыши (производства Life Technologies), разбавленного 5000-кратно раствором Block Ace, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку в достаточной мере промывали в PBS-T и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 5 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, антитела мыши против CAPRIN-1 #32 и #33 не вступали в реакцию с частичной последовательностью CAPRIN-1, не содержащей аминокислотную последовательность, приведенную в SEQ ID NO: 430, и вступали в специфичную реакцию только с полипептидами, содержащими аминокислотную последовательность, приведенную в SEQ ID NO: 430. Следовательно, это демонстрировало, что полипептид, приведенный в SEQ ID NO: 430, содержит область эпитопа для моноклональных антител мыши #32 и #33.
[0287]
(4) Определение характеристик антител мыши против CAPRIN-1 от #31 до #33
Из антител мыши против CAPRIN-1 от #31 до #33, полученных выше в (1) и (3), амплифицированные фрагменты генов, кодирующих вариабельные домены, получали в соответствии со способом, описанном в примере 5 из WO 2010/016526, и анализировали последовательности генов и аминокислотные последовательности. Полученная последовательность гена, кодирующая вариабельный домен тяжелой цепи антитела мыши против CAPRIN-1 #31, приведена в SEQ ID NO: 381, и ее аминокислотная последовательность приведена в SEQ ID NO: 376. Последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 382, и ее аминокислотная последовательность приведена в SEQ ID NO: 380. Аналогичным образом, полученная последовательность гена, кодирующего вариабельный домен тяжелой цепи антитела мыши против CAPRIN-1 #32, приведена в SEQ ID NO: 391, и ее аминокислотная последовательность приведена в SEQ ID NO: 386. Последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 392, и ее аминокислотная последовательность приведена в SEQ ID NO: 390. Получаемая последовательность гена, кодирующего вариабельный домен тяжелой цепи антитела мыши против CAPRIN-1 #33, приведена в SEQ ID NO: 397, и ее аминокислотная последовательность приведена в SEQ ID NO: 396. Последовательность гена, кодирующего вариабельный домен легкой цепи, приведена в SEQ ID NO: 392, и ее аминокислотная последовательность приведена в SEQ ID NO: 390.
[0288]
Кроме того, подтверждено, что CDR с 1 до 3 в вариабельном домене тяжелой цепи антитела мыши против CAPRIN-1 #31 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 373, 374 и 375, соответственно, и что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 377, 378 и 379, соответственно. Аналогичным образом, подтверждено, что CDR с 1 до 3 в вариабельном домене тяжелой цепи антитела мыши против CAPRIN-1 #32 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 383, 384 и 385, соответственно, и что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно. Также подтверждали, что CDR с 1 до 3 в вариабельном домене тяжелой цепи антитела мыши против CAPRIN-1 #33 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 393, 394 и 395, соответственно, и что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 387, 388 и 389, соответственно.
[0289]
[Пример 10] Анализ экспрессии белка CAPRIN-1 на клеточной поверхности рака печени с использованием моноклональных антител мыши против CAPRIN-1 от #30 до #36
Исследовали четыре клеточные линии рака печени человека (Hep3GB, HepG2, SK-Hep-1 и SW480), экспрессирует клеточная поверхность белок CAPRIN-1 или нет, используя моноклональные антитела мыши против CAPRIN-1 от #30 до #36. 5×105 клеток каждой из клеточных линий рака печени центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. Клетки подвергали реакции с каждым из антител мыши против CAPRIN-1 от #30 до #36 в конечной концентрации 20 мкг/мл, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS проводили реакцию клеток со 100-кратно разведенным Alexa488-меченным антителом козы против IgG мыши (производства Invitrogen Corporation), после чего оставляли стоять на льду в течение 30 часов. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно клетки подвергали реакции только с вторичным антителом в качестве отрицательного контроля. Как результат, интенсивности флуоресценции в клетках, в которые добавляли моноклональные антитела мыши против CAPRIN-1 от #30 до #36, были выше на 35% или больше таковых в контроле в каждой клеточной линии рака печени. Это демонстрирует, что поверхность клеточной мембраны клеточных линий рака печени экспрессирует белок CAPRIN-1.
[0290]
[Пример 11] Получение химерного антитела человека и мыши против CAPRIN-1
Оба конца амплифицированного фрагмента гена, содержащего вариабельный домен тяжелой цепи, каждого из антител мыши против CAPRIN-1 от #30 до #36 обрабатывали рестрикционными ферментами, а фрагмент очищали и вставляли в вектор pcDNA4/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела мыши, и константный домен H-цепи IgG1 человека, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 264, в соответствии с обычным способом. Оба конца амплифицированного фрагмента гена, содержащего вариабельный домен легкой цепи, каждого из антител мыши против CAPRIN-1 от #30 до #36 обрабатывали рестрикционными ферментами, а фрагмент очищали и вставляли в вектор pcDNA4/myc-His (производства Life Technologies), содержащий лидерную последовательность, полученную из антитела мыши, и константный домен L-цепи IgG1 человека, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 265, в соответствии с обычным способом.
[0291]
Впоследствии рекомбинантный вектор, содержащий вариабельный домен тяжелой цепи какого-либо из антител мыши против CAPRIN-1 от #30 до #36, и рекомбинантный вектор, содержащий вариабельный домен легкой цепи антитела мыши против CAPRIN-1, вводили в клетки CHO-K1 (полученные из Riken Cell Bank). В частности, 2×105 клеток CHO-K1, которые культивировали в каждой лунке 12-луночного культурального планшета, содержащей 1 мл среды Хэма F12 (производства Life Technologies), содержащей 10% FBS, промывали в PBS (-). В каждую лунку добавляли 1 мл свежей среды Хэма F12, содержащей 10% FBS, и смесь 30 мкл OptiMEM (производства Life Technologies), содержащего 250 нг каждого из указанных выше векторов, и 30 мкл реактива для трансфекции Polyfect (производства Qiagen). Клетки CHO-K1, в которые вводили рекомбинантные векторы, культивировали в среде Хэма F12, содержащей 10% FBS, 200 мкг/мл зеоцина (производства Life Technologies) и 200 мкг/мл генетицина (производства Roche), и после этого высевали в 96-луночный планшет по 0,5 клеток на лунку для того, чтобы получать клеточные линии, стабильно продуцирующие химерные антитела человека и мыши против CAPRIN-1 от #30 до #36, содержащие вариабельные домены антител мыши против CAPRIN-1 от #30 до #36.
[0292]
Каждую из полученных клеточных линий культивировали по 5×105 клеток/мл в 150 см2 колбе, содержащей 30 мл бессывороточной среды OptiCHO (производства Life Technologies) в течение 5 суток, чтобы получать культуральные супернатанты, содержащие химерное антитело человека и мыши против CAPRIN-1 от #30 до #36, соответственно.
[0293]
[Пример 12] Противоопухолевая активность (ADCC активность) химерных антител человека и мыши против CAPRIN-1 от #30 до #36 в отношении клеток рака печени
Для того чтобы оценивать интенсивность цитотоксичности, в отношении клеток рака, экспрессирующих CAPRIN-1, у антител против пептидов, полученных из CAPRIN-1, которые приведены в SEQ ID NO: с 429 до 432, ADCC активность измеряли с использованием химерных антител человека и мыши против CAPRIN-1 от #30 до #36. 1×105 клеток каждой из четырех клеточных линий рака печени (Hep3GB, HepG2, SK-Hep-1 и SW480) собирали в 50 мл микропробирке для центрифугирования и инкубировали с 100 мкКи 51хрома при 37°C в течение 2 часов. Впоследствии клетки три раза промывали средой RPMI1640, содержащей 10% эмбриональной телячьей сыворотки. Отдельно любое из химерных антител человека и мыши против CAPRIN-1 от #30 до #36 добавляли в каждую лунку 96-луночного планшета с V-образным дном в конечной концентрации 5 мкг/мл и в каждую лунку добавляли 2×105 естественных клеток-киллеров человека, выделенных из лимфоцитов периферической крови человека в качестве эффекторных клеток посредством обычного способа. В каждую лунку добавляли 2×103 клеток рака печени с 51хромом, полученных выше, и смесь культивировали в течение 4 часов. Количество 51хрома, высвобожденного в среду после культивирования, и цитотоксичность в отношении клеток рака вычисляли с помощью следующей расчетной формулы *:
[0294]
Формула *: цитотоксичность (%) = (количество 51хрома, высвобожденного из клеток-мишеней в присутствии антитела против CAPRIN-1 и лимфоцитов)/(количество 51хрома, высвобожденного из клеток-мишеней в присутствии 1н соляной кислоты) × 100.
[0295]
Как результат, каждое химерное антитело человека и мыши против CAPRIN-1 показывало активность 20% или больше в отношении всех клеток рака печени, тогда как активность антитела IgG1 человека, используемого в качестве отрицательного контроля, составляла меньше 7% в отношении всех клеток рака печени.
[0296]
[Пример 13] Получение моноклонального антитела против CAPRIN-1 с использованием кролика
(1) Получение моноклонального антитела кролика против CAPRIN-1 #1
Смесь 300 мкг белка антигена (CAPRIN-1 человека), смешанного с таким же количеством полного адъюванта Фрейнда, использовали в качестве раствора антигена для одного кролика. При второй и последующей иммунизации использовали смесь с неполным адъювантом Фрейнда. Раствор антигена интраперитонеально вводили кроликам в возрасте 7 недель и дополнительно вводили семь раз с интервалами в четыре недели для того, чтобы завершить иммунизацию. Селезенку извлекали на четвертые сутки от последней иммунизации и измельчали между двумя стерилизованными предметными стеклами и промывали в PBS (-) (производства Nissui Pharmaceutical Co., Ltd.), после чего следовало центрифугирование при 1500 об/мин в течение 10 минут для того, чтобы удалять супернатант. Эту процедуру повторяли три раза для того, чтобы получать клетки селезенки. Получаемые клетки селезенки и миеломные клетки кролика смешивали в соотношении 5:1, и в получаемую смесь добавляли раствор PEG, полученный посредством смешивания 200 мкл среды IMDM, содержащей 10% FBS, и 800 мкл PEG 1500 (производства Boehringer Ingelheim GmbH) и нагретый до 37°C, после чего оставляли стоять в течение 5 минут для слияния клеток. Осуществляли центрифугирование при 1700 об/мин в течение 5 минут и удаляли супернатант. Клетки суспендировали в смеси 300 мл среды IMDM (селективная среда HAT), содержащая 10% FBS, и 2% эквивалентов раствора HAT производства Gibco, и суспензию высевали в 30 планшетов, которые представляли собой 96-луночные планшеты (производства Nunc), по 100 мкл на лунку. Культивирование при 37°C в 5% CO2 в течение 7 суток давало гибридомы клеток селезенки и миеломных клеток кролика.
[0297]
Гибридомы отбирали с использованием, в качестве показателя, реактивности антител, продуцируемых гибридомами, к белку CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1 добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 400 мкл 0,5% раствора бычьего сывороточного альбумина (BSA) (производства Sigma-Aldrich Co., LLC.), после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл меченного HRP антитела против кролика, разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, отбирали несколько гибридом, продуцирующих антитела, которые показывали высокие значения поглощения.
[0298]
Отобранные гибридомы высевали в 96-луночный планшет по 0,5 клеток на лунку и культивировали. Через одну неделю, в лунках наблюдали гибридомы, образующие отдельные колонии. Клетки в лунках дополнительно культивировали и отбирали гибридомы с использованием, в качестве показателя, реактивности антител, продуцируемых клонированными гибридомами, в отношении белка CAPRIN-1. Раствор 1 мкг/мл белка CAPRIN-1 добавляли в 96-луночный планшет по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 400 мкл 0,5% раствора BSA, после чего оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли и каждую лунку промывали в 400 мкл PBS-T три раза, и в каждую лунку добавляли 100 мкл культурального супернатанта гибридомы, полученной выше, после чего оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали в PBS-T три раза и в каждую лунку добавляли 100 мкл меченного HRP антитела против IgG кролика, разбавленного 5000-кратно с использованием PBS, после чего оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали в PBS-T три раза, и в каждую лунку добавляли 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.), после чего оставляли стоять в течение от 15 до 30 минут для цветной реакции. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, получали несколько гибридом, продуцирующих моноклональные антитела, реактивные в отношении белка CAPRIN-1.
[0299]
Впоследствии моноклональные антитела, реактивные в отношении клеточной поверхности клеток рака, экспрессирующих CAPRIN-1, отбирали из моноклональных антител кролика, реактивных в отношении белка CAPRIN-1. В частности, 2×105 клеток клеточной линии рака молочной железы человека MDA-MB-231V и клеточной линии рака легких человека QG56 центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли 100 мкл культурального супернатанта описанных выше гибридом, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли FITC-меченное антитело против IgG кролика (H+L) или Alexa488-меченное антитело против IgG кролика (H+L), разбавленное 100-кратно с использованием PBS (-), содержащего 0,05% FBS, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно, ту же процедуру, что и выше, осуществляли с использованием гибридомной культуральной среды для того, чтобы получать отрицательный контрольный образец. Как результат, отбирали одно моноклональное антитело кролика против CAPRIN-1 (моноклональное антитело кролика против CAPRIN-1 #1), показывающее более высокую интенсивность флуоресценции по сравнению с отрицательным контролем, т.е. вступающее в реакцию с клеточной поверхностью клеточных линий рака MDA-MB-231 и QG56, экспрессирующих CAPRIN-1.
[0300]
Впоследствии идентифицировали эпитоп CAPRIN-1, распознаваемый отобранным моноклональным антителом кролика против CAPRIN-1 #1. Синтезировали пептиды-кандидаты (93 пептида), каждый состоит из от 12 до 16 аминокислот из аминокислотной последовательности белка CAPRIN-1 человека и каждый растворяли в концентрации 1 мг/мл в DMSO. Каждый пептид растворяли в концентрации 30 мкг/мл в 0,1 M натрий-карбонатном буфере (pH 9,6). Раствор добавляли в 96-луночный планшет (производства Nunc, № продукта 436006) по 100 мкл на лунку, после чего оставляли стоять при 4°C в течение ночи. Раствор удаляли и в каждую лунку добавляли 200 мкл 10 мМ этаноламина/0,1 M натрий-карбонатного буфера (pH 9,6), после чего оставляли стоять при комнатной температуре в течение 1 часа. Раствор удаляли, и каждую лунку промывали в PBS, содержащем 0,5% Tween 20 (PBST), два раза для того, чтобы получать планшет с иммобилизованными пептидами. Для подтверждения, в этом планшете также предусматривали лунку, в которой белок CAPRIN-1 иммобилизовали в соответствии со способом, описанным выше. Моноклональное антитело кролика против CAPRIN-1 #1, очищенное до концентрации 0,1 мкг/мл обычным способом, добавляли в планшет в количестве 50 мкл на лунку, после чего следовало встряхивание при комнатной температуре в течение 1 часа. Раствор удаляли и каждую лунку промывали в PBST три раза. Впоследствии в каждую лунку добавляли 50 мкл раствора вторичного антитела, содержащего меченное HRP антитело против IgG кролика, разведенное в от 3000 до 4000 раз с использованием PBST. Раствор удаляли и каждую лунку промывали в PBST шесть раз. Цветную реакцию осуществляли, добавляя 100 мкл раствора субстрата TMB (производства Thermo Fisher Scientific K.K.) в каждую лунку и оставляя смесь стоять в течение от 15 до 30 минут. После окрашивания в каждую лунку добавляли 100 мкл 1н серной кислоты для того, чтобы останавливать реакцию. Поглощение измеряли на 450 нм и 595 нм с использованием абсорбционного спектрометра. Как результат, моноклональное антитело кролика против CAPRIN-1 #1 было реактивным в отношении только полипептидов, содержащих аминокислотную последовательность, приведенную в SEQ ID NO: 430, в 93 пептидах, синтезированных в качестве фрагментарных пептидов CAPRIN-1, и не было реактивным в отношении других полипептидов. Кроме того, моноклональное антитело кролика против CAPRIN-1 #1 было специфично реактивным в отношении белка CAPRIN-1. Этот результат демонстрировал, что эпитоп для моноклонального антитела кролика против CAPRIN-1 #1 содержался в полипептиде, приведенном в SEQ ID NO: 430.
[0301]
Впоследствии из моноклонального антитела кролика против CAPRIN-1 #1, полученного выше, получали амплифицированный фрагмент гена, кодирующего вариабельный домен, в соответствии со способом, описанном в примере 5 из WO 010/016526, и анализировали последовательность гена и аминокислотную последовательность. В частности, мРНК извлекали из гибридомы, продуцирующей моноклональное антитело кролика против CAPRIN-1 #1, и получали гены вариабельного (VH) домена тяжелой цепи и вариабельного (VL) домена легкой цепи антитела посредством ОТ-ПЦР с использованием праймеров, специфичных к последовательностям вариабельного домена кролика. Для того чтобы определять последовательность, гены клонировали в векторы pCR2.1 (производства Life Technologies). Последовательности генов домена VH и домена VL в каждой плазмиде, полученной посредством клонирования, определяли с использованием прямого праймера M13 и обратного праймера M13 с использованием флуоресцентного секвенатора.
[0302]
Результаты демонстрировали, что получаемое моноклональное антитело кролика против CAPRIN-1 #1 содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 359, в котором CDR с 1 до 3 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 361, в котором CDR с 1 до 3 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно.
[0303]
(2) Получение химерного антитела человека и кролика против CAPRIN-1 #1
Ген, приведенный в SEQ ID NO: 358, для экспрессии вариабельного домена тяжелой цепи моноклонального антитела кролика против CAPRIN-1 #1, полученного выше, и ген, приведенный в SEQ ID NO: 360, для экспрессии вариабельного домена легкой цепи, соответственно вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен тяжелой цепи IgG1 человека, и экспрессирующий вектор клетки млекопитающего, содержащий константный домен легкой цепи IgG1 человека. Получали культуральный супернатант, который содержит химерное антитело человека и кролика против CAPRIN-1 #1, гуманизированное посредством введения полученных двух рекомбинантных экспрессирующих векторов в клетки млекопитающих в соответствии с обычным способом.
[0304]
(3) Антигенная специфичность, реактивность в отношении клеток рака и противоопухолевая активность химерного антитела человека и кролика против CAPRIN-1 #1
Химерное антитело человека и кролика против CAPRIN-1 #1, содержащееся в культуральном супернатанте, полученном выше в (2), очищали с использованием Hitrap Protein A Sepharose FF (производства GE Healthcare Bio-Sciences) в соответствии с обычным способом, замещали с использованием PBS (-) и фильтровали через фильтр 0,22 мкм (производства Millipore Corporation) и использовали для исследования антигенной специфичности, реактивности в отношении клеток рака и противоопухолевого эффекта.
[0305]
Сначала, как и выше в (1), изучали специфичность реакции химерного антитела человека и кролика против CAPRIN-1 #1 в отношении белка CAPRIN-1 и полипептида, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 430, которая представляет собой эпитоп для моноклонального антитела кролика против CAPRIN-1 #1. Результаты демонстрировали, что химерное антитело человека и кролика против CAPRIN-1 #1 имело специфичность реакции в отношении белка CAPRIN-1 и полипептида, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 430, как у моноклонального антитела кролика против CAPRIN-1 #1.
[0306]
Затем изучали реактивность химерного антитела человека и кролика против CAPRIN-1 #1 в отношении белка CAPRIN-1 на клеточной поверхности четырех клеточных линий рака печени (Hep3GB, HepG2, SK-Hep-1 и SW480). 1×106 клеток каждой клеточной линии центрифугировали с использованием 1,5-мл микропробирки для центрифугирования. В клетки добавляли супернатант клеточной культуры (100 мкл), содержащий антитело, после чего оставляли стоять на льду в течение 1 часа. После промывания в PBS, в клетки добавляли Alexa488-меченное антитело козы против IgG человека (H+L) (производства Invitrogen Corporation), разбавленное 100-кратно с использованием PBS, содержащего 0,1% FBS, после чего оставляли стоять при 4°C в течение 60 минут. После промывания в PBS (-), интенсивность флуоресценции измеряли с использованием FACS Calibur, доступного в Becton, Dickinson and Company. Отдельно проводили реакцию клеток только со вторичным антителом в качестве отрицательного контроля. Как результат, химерное антитело человека и кролика против CAPRIN-1 #1 показывало более высокую реактивность с помощью интенсивности флуоресценции выше на 30% или более по сравнению с отрицательным контролем. Это демонстрировало, что клеточной поверхности клеточных линий рака человека экспрессировала часть белка CAPRIN-1, приведенную в SEQ ID NO: 430. Степень увеличения интенсивности флуоресценции представляют с помощью степени увеличения средней интенсивности флуоресценции (значение MFI) в каждой клетке и вычисляют с помощью следующей расчетной формулы: Степень увеличения средней интенсивности флуоресценции (степень увеличения интенсивности флуоресценции) (%) = ((значение MFI клеток, вступавших в реакцию с антителом против CAPRIN-1 человека) - (значение MFI контроля))/(значение MFI контроля) × 100.
[0307]
Кроме того, оценивали противоопухолевую активность химерного антитела человека и кролика против CAPRIN-1 #1 в отношении двух клеточных линий рака печени (Hep3GB и SK-Hep-1). 1×106 клеток каждой клеточной линии рака печени собирали в 50 мл микропробирке для центрифугирования и инкубировали с 100 мкКи 51хрома при 37°C в течение 2 часов. Впоследствии клетки промывали средой RPMI1640, содержащей 10% FBS, три раза для того, чтобы получать клетки-мишени. Очищенное химерное антитело человека и кролика против CAPRIN-1 #1 добавляли в 96-луночный планшет с V-образным дном в конечной концентрации 5 мкг/мл. Впоследствии в каждую лунку добавляли 2×105 естественных клеток-киллеров человека, выделенных из лимфоцитов периферической крови человека, полученных в соответствии с обычным способом. 2×103 клеток-мишеней смешивали с антителом в каждой лунке 96-луночного планшета с V-образным дном, после чего следовало культивирование при 37°C в 5% CO2 в течение 4 часов. После культивирования, количество 51хрома, секретированного из ослабленных опухолевых клеток в культуральный супернатант измеряли для того, чтобы вычислять цитотоксичность в отношении клеток рака печени посредством антитела против CAPRIN-1. Отдельно осуществляли реакцию с использованием изотипического контрольного антитела в качестве отрицательного контроля. Как результат, химерное антитело человека и кролика против CAPRIN-1 #1 показывало противоопухолевую активность 25% или больше в отношении всех клеток рака печени, тогда как цитотоксичность в случае использования изотипического контрольного антитела составляла меньше 5% в отношении всех клеток рака печени. Эти результаты показывали, что антитело против пептида, полученного из CAPRIN-1, который приведен в SEQ ID NO: 430, химерное антитело человека и кролика против CAPRIN-1 #1, показывает противоопухолевую активность в отношении клеток рака печени, экспрессирующих CAPRIN-1, через ADCC активность.
[0308]
[Пример 14] Получение гуманизированных антител против CAPRIN-1 с #1 до #3
Получали гуманизированное антитело из антитела кролика против CAPRIN-1. На основе информации об аминокислотной последовательности вариабельного домена тяжелой цепи моноклонального антитела кролика против CAPRIN-1 #1, нуклеотидную последовательность, приведенную в SEQ ID NO: 362, конструировали так, что CDR с 1 до 3 в вариабельном домене тяжелой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 357, соответственно, и что каркасная область может экспрессировать вариабельный домен тяжелой цепи (SEQ ID NO: 363), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен тяжелой цепи IgG1 человека. Аналогичным образом, нуклеотидную последовательность, приведенную в SEQ ID NO: 364, конструировали так, что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно, и что каркасная область может экспрессировать вариабельный домен легкой цепи (SEQ ID NO: 365), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен легкой цепи IgG1 человека. Два рекомбинантных экспрессирующих вектора вводили в клетки млекопитающих в соответствии с обычным способом для того, чтобы получать культуральный супернатант, который содержит гуманизированное антитело против CAPRIN-1 #1.
[0309]
Кроме того, на основе информации об аминокислотной последовательности вариабельного домена тяжелой цепи моноклонального антитела кролика против CAPRIN-1 #1, нуклеотидную последовательность, приведенную в SEQ ID NO: 367, конструировали так, что CDR с 1 до 3 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, соответственно, и что каркасная область может экспрессировать вариабельный домен тяжелой цепи (SEQ ID NO: 368), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен тяжелой цепи IgG1 человека. Аналогичным образом, нуклеотидную последовательность, приведенную в SEQ ID NO: 369, конструировали так, что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно, и что каркасная область может экспрессировать вариабельный домен легкой цепи (SEQ ID NO: 370), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен легкой цепи IgG1 человека. Два рекомбинантных экспрессирующих вектора вводили в клетки млекопитающих в соответствии с обычным способом для того, чтобы получать культуральный супернатант, который содержит гуманизированное антитело против CAPRIN-1 #2.
[0310]
Кроме того, на основе информации об аминокислотной последовательности вариабельного домена тяжелой цепи моноклонального антитела кролика против CAPRIN-1 #1, нуклеотидную последовательность, приведенную в SEQ ID NO: 371, конструировали так, что CDR с 1 до 3 состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 351, 352 и 353, соответственно, и что каркасная область может экспрессировать вариабельный домен тяжелой цепи (SEQ ID NO: 372), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен тяжелой цепи IgG1 человека. Аналогичным образом, нуклеотидную последовательность, приведенную в SEQ ID NO: 369, конструировали так, что CDR с 1 до 3 в вариабельном домене легкой цепи состоят из аминокислотных последовательностей, приведенных в SEQ ID NO: 354, 355 и 356, соответственно, и что каркасная область может экспрессировать вариабельный домен легкой цепи (SEQ ID NO: 370), содержащий последовательность антитела человека. Нуклеотидную последовательность вставляли в экспрессирующий вектор клетки млекопитающего, содержащий константный домен легкой цепи IgG1 человека. Два рекомбинантных экспрессирующих вектора вводили в клетки млекопитающих в соответствии с обычным способом для того, чтобы получать культуральный супернатант, который содержит гуманизированное антитело против CAPRIN-1 #3.
[0311]
Антигенная специфичность, реактивность в отношении клеток рака и противоопухолевая активность гуманизированного антитела против CAPRIN-1
Оценивали реактивность трех полученных выше гуманизированных антител против CAPRIN-1 с #1 до #3 в отношении CAPRIN-1. Как результат реактивности этих антител в отношении белка CAPRIN-1, пептид эпитопа приведен в SEQ ID NO: 430, и клеточные линии рака печени эквивалентны таковым для химерного моноклонального антитела человека и кролика против CAPRIN-1 #1. Также оценивали противоопухолевую активность этих трех гуманизированных антител против CAPRIN-1 в отношении клеточных линий рака печени. Результаты демонстрировали, что противоопухолевая активность каждого антитела эквивалентна таковой химерного моноклонального антитела человека и кролика против CAPRIN-1 #1.
[0312]
[Пример 15] Анализ экспрессии белка CAPRIN-1 на клеточной поверхности рака печени с использованием моноклональных антител мыши против CAPRIN-1 от #23 до #29
Как в примере 10, исследовали четыре клеточные линии рака печени человека (Hep3GB, HepG2, SK-Hep-1 и SW480), экспрессирует ли клеточная поверхность белок CAPRIN-1 или нет, используя моноклональное антитело против CAPRIN-1 #23, которое содержит вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 279, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 283, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 280, 281 и 282, соответственно, полученные в WO/2013/018894; моноклональное антитело против CAPRIN-1 #24, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 279, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 276, 277 и 278, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 289, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 286, 287 и 288, соответственно; моноклональное антитело против CAPRIN-1 #25, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 294, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 291, 292 и 293, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 298, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 295, 296 и 297, соответственно; моноклональное антитело против CAPRIN-1 #26, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 304, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 301, 302 и 303, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 308, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 305, 306 и 307, соответственно, полученные в WO/2013/018892; моноклональное антитело против CAPRIN-1 #27, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 314, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 311, 312 и 313, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 318, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 315, 316 и 317, соответственно, полученные в WO/2013/018891; моноклональное антитело против CAPRIN-1 #28, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 324, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 321, 322 и 323, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 328, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 325, 326 и 327, соответственно, полученные в WO/2013/018889; и моноклональное антитело против CAPRIN-1 #29, содержащее вариабельный домен тяжелой цепи, приведенный в SEQ ID NO: 334, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 331, 332 и 333, соответственно, и вариабельный домен легкой цепи, приведенный в SEQ ID NO: 338, содержащий определяющие комплементарность области (CDR1, CDR2 и CDR3), состоящие из аминокислотных последовательностей, приведенных в SEQ ID NO: 335, 336 и 337, соответственно, полученные в WO/2013/018883. Как результат, наблюдали реактивность в отношении клеточных линий рака печени, эквивалентную таковой у моноклональных антител мыши против CAPRIN-1 от #30 до #36 в примере 10.
[0313]
[Пример 16] Противоопухолевая активность химерных антител человека и мыши против CAPRIN-1 от #23 до #29 в отношении клеток рака печени
Клеточные линии, стабильно продуцирующие химерные антитела человека и мыши против CAPRIN-1 от #23 до #29, соответственно, которые имеют вариабельные домены антител мыши против CAPRIN-1 от #23 до #29, описанные в примере 15, получали с помощью способа, схожего с таковым в примере 11, чтобы получать культуральные супернатанты, содержащие химерные антитела человека и мыши против CAPRIN-1 от #23 до #29. Антитела, очищенные от супернатантов обычным способом, использовали для исследования противоопухолевой активности в отношении клеток рака печени. Для того чтобы оценивать интенсивность цитотоксичности в отношении клеток рака, экспрессирующих CAPRIN-1, ADCC активность измеряли с использованием химерных антител человека и мыши против CAPRIN-1 от #23 до #29. ADCC активность в отношении четырех клеточных линий рака печени (Hep3GB, HepG2, SK-Hep-1 и SW480) оценивали с помощью способа, схожего с таковым в примере 12. Как результат, каждое химерное антитело человека и мыши против CAPRIN-1 показывало активность 20% или больше в отношении всех клеток рака печени, тогда как активность антитела IgG1 человека, используемого в качестве отрицательного контроля, составляла меньше чем 9% в отношении всех клеток рака печени.
Промышленная применимость
[0314]
Антитела по настоящему изобретению можно использовать для лечения и/или предотвращения рака печени.
[0315]
Все публикации, патенты и патентные заявки, цитируемые в настоящем описании, таким образом, включены посредством ссылки в полном объеме.