Результат интеллектуальной деятельности: Способ фотодинамической терапии
Вид РИД
Изобретение
Фотодинамическая терапия (ФДТ) является одним из эффективных методов лечения как онкологических, так и неонкологических заболеваний.
В основе фотодинамической терапии лежит накопление фотосенсибилизатора (ФС) в патологически измененной ткани с последующим облучением светом с определенной длиной волны. В результате светового воздействия химическое превращение ФС вызывает образование активных форм кислорода, приводящих к разрушению прилежащих тканей. Кроме того, в результате деструкции клеток эндотелия происходит тромбоз мелких и средних сосудов, питающих опухоль.
Основным преимуществом ФДТ является отсутствие токсических системных эффектов и возможность проведения локального разрушения опухолевой ткани.
Недостатком метода ФДТ является длительная кожная фототоксичность, требующая строго соблюдения светового режима. Кроме того, данный метод лечения требует системного введения препарата и градиент концентрации между нормальной и патологически измененной ткани является незначительным.
Поэтому, поиск методов адресной доставки ФС в патологически измененную ткань является актуальной задачей современной биологии и медицины.
Среди биосовместимых биодеградируемых полимеров, широко используемых в нанофармацевтических исследованиях, особое внимание привлекают алифатические эфиры молочной и гликолевой кислот (polylactic-co-glycolic acid - PLGA), которые могут использоваться для контролируемого высвобождения различных низкомолекулярных лекарственных субстанций, белков и пептидов. Преимуществами PLGA является биосовместимость, нетоксичность, возможность регулировать скорость деградации, возможность модификации поверхности для улучшения взаимодействия с целевыми биообъектами.
Известны частицы, предназначенные для доставки лекарственного средства в организм, в частности фотосенсибилизатора и/или химиопрепарата для лечения рака. Это наночастицы, имеющие оболочку и ядро из синтетически биоразлагаемого полимера (в частности PLGA) с загруженным фотосенсибилизатором и/или химиопрепаратом (WO 2014141289 А1, 18.09.2014).
Причем доставка этих наночастиц может осуществляться пассивными или направленными механизмами, где активное нацеливание достигается путем конъюгирования частиц с лигандами, такими как моноклональное антитело (например, CD20, CD33, CD34, CD38, CD44, CD47, CD52 CD90, CD-123, CD-I 33, EGFR, PDGFR), пептиды (например РГД, CR.GD, LyP-1 пептид, bombes в (BBNi) pepiide, FSH33, усеченный человеческий основной фактор роста фибробластов пептид (tbFG F) октреотид и т.д.,), малые молекулы (folid кислоты, маннозы, гиалуроновая кислота), белки (трансферрин).
Одним из способов повысить концентрацию лекарственного препарата в патологически измененной ткани (опухоли) является использование стволовых клеток, в цитоплазму которых введены ЛП.
Так как известно, что стволовые клетки после трансплантации в организм способны активно мигрировать в опухолевую ткань или зону острого повреждения (Kathryn С. et al., 19F magnetic resonance imaging for stem/progenitor cell tracking with multiple unique perfluorocarbon nanobeacons, The FASEB Journal, 2007 June, vol. 21, p. 1647-1654; Kraitchman D.L. et al. (2003) In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation 107, 2290-2293; Arbab A.S. et al. (2006) Magnetic resonance imaging and confocal microscopy studies of magnetically labeled endothelial progenitor cells trafficking to sites of tumor angiogenesis. Stem Cells 24, 671-678).
Ближайшим аналогом изобретения является способ лечения злокачественных опухолей, включающий проведение фотодинамической терапии с введением стволовых клеток, содержащих частицы эмульсии перфторуглеродов и покрытых фотосенсибилизатором (радахлорином) (RU 2440158, 20.01.2012).
В данном способе создают частицы путем добавления фотосенсибилизатора к наночастицам эмульсии перфторуглеродов (ПФУ), состоящим из перфтордекалина и перфторметилциклогексилпиперидина, стабилизированных раствором проксанола 268. Затем добавляют эмульсию ПФУ с ФС к стволовым клеткам костного мозга, проводят их совместное культивирование и осуществляют введение СККМ после культивирования субъекту, страдающему злокачественными опухолями.
Однако недостатком данного метода является низкая сорбционная способность частиц ПФУ эмульсии сорбировать препарат для ФДТ. Кроме того, при инкубации со стволовыми клетками частиц, покрытых препаратом для ФДТ, наступает процесс десорбции, что приводит к гибели части стволовых клеток под воздействием свободного препарата для ФДТ.
В основе предложенного нами метода лежит создание частиц субмикронных размеров (50-1000 нм), изготовленных из сополимера молочной и гликолевой кислот (ПМГК), содержащих препарат для ФДТ (фотосенсибилизатор) и предназначенных для введения в стволовые клетки.
Использование таких частиц позволяет осуществлять адресную доставку токсичного и биологического активных веществ и резко снизить общий токсический эффект на организм.
Таким образом, техническим результатом предлагаемого способа является увеличение количества «транспортируемого» препарата для фотодинамической терапии путем создания поглощаемых стволовыми клетками микрочастиц, изготовленных из биосовместимого биодеградируемого полимера ПМГК и содержащих препарат для ФДТ, позволяющих увеличить насыщение стволовых клеток препаратом для ФДТ в процессе их совместного культивирования, а также снизить токсическое воздействие свободного препарата для ФДТ на стволовые клетки.
Изобретение иссюстрировано фигурами:
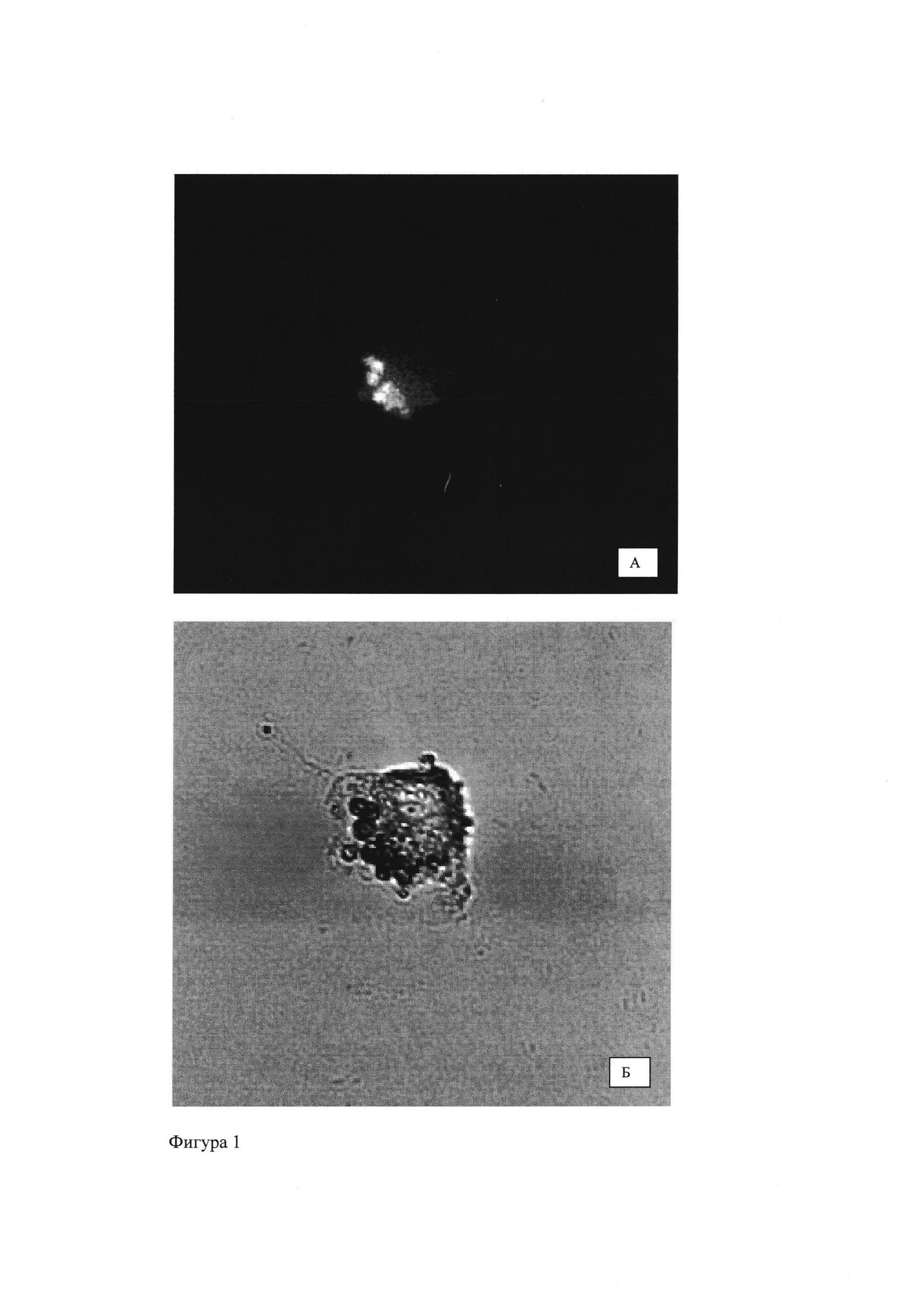
Фигура 1 - Стволовая клетка костного мозга с частицами, содержащими хлорин е6 в цитоплазме: А - УФ-микроскопия (свечение свидетельствует о наличие хлорина еб в частицах); Б - световая микроскопия того же объекта.
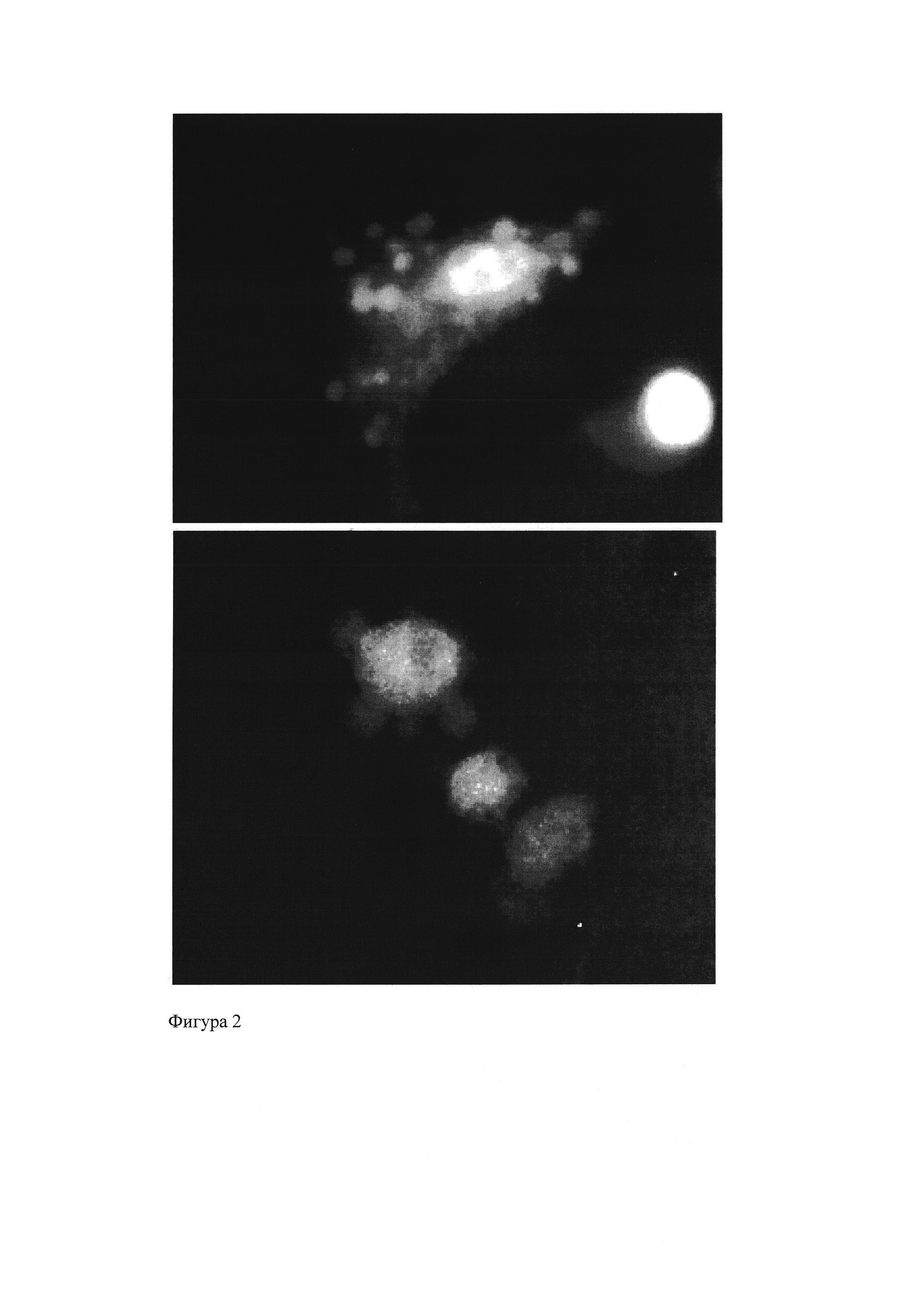
Фигура 2 - Мезенхимальные стволовые клетки, содержащие частицы ПМГК с ФС, после воздействия лазера (662 нм).
Способ осуществляли следующим образом:
A) изготавливают микрочастицы из сополимера молочной и гликолевой кислот (ПМГК), содержащие фотосенсибилизатор (ФС);
Б) добавляют микрочастицы, изготовленные из ПМГК и содержащие ФС, к стволовым клеткам (СК) и проводят их совместное культивирование;
B) после культивирования и отмывки от непоглощенных частиц осуществляют введение СК субъекту, нуждающемуся в ФДТ;
Г) на зону опухолевого роста воздействуют световым облучением в дозе, достаточной для полного или частичного разрушения опухоли.
В другом варианте, микрочастицы ПМГК, содержащие ФС, перед инкубацией со стволовыми клетками предварительно обрабатывают перфторуглеродной эмульсией (ПФУЭ) или раствором полоксамера (блок-сополимера полиоксиэтилена и полиоксипропилена), или дисперсией фосфолипидов.
При этом ПФУЭ в качестве дисперсной фазы содержит 10 об.% смеси перфторуглеродов: перфтордекалин, перфторметилциклогексилпиперидин, перфтортрибутиламин и перфтороктилбромид в соотношении 9:1:0,01:0,01, а в качестве эмульгатора в ней используется полоксамер или фосфолипиды.
В другом варианте изобретения частицы содержат перфторуглерод (ПФУ): перфтордекалин, перфторметилциклогексилпиперидина, перфтортрибутиламина и перфтороктилбромида в соотношении 9:1:0,01:0,01.
Также микрочастицы ПМГК, содержащие ФС, могут создаваться в условиях повышенного >21% содержания кислорода.
ПРИМЕР 1. Получение частиц ПМКГ, содержащих ФС.
Для включения ФС в полимерную матрицу (ПМКГ) используется метод двойной эмульсии вода/масло/вода.
Вариант А. Получение частиц по эмульсионной технологии В1/М/В2.
Сополимер молочной и гликолевой кислот (PLGA) растворяют в дихлорметане (первичная дисперсная среда М). Водный раствор ФС (дисперсная фаза В1) диспергируют в полученном растворе сополимера сначала на Vortex, а затем с помощью ультразвукового гомогенизатора. Полученную первичную эмульсию В1/М диспергируют с использованием Ultra Turrax в холодном водном растворе поливинилового спирта и метилцеллюлозы (вторичная дисперсная среда В2). Готовую тройную эмульсию (В1/М/В2) смешивают с большим количеством холодной воды и выдерживают при постоянном перемешивании с повышением температуры до комнатной в течение нескольких часов. Созревшие микрочастицы осаждают центрифугированием и промывают водой.
Вариант Б.
Сополимер молочной и гликолевой кислот (PLGA) растворяют в дихлорметане (первичная дисперсная среда M1). Водный раствор ФС (дисперсная фаза В) диспергируют в полученном растворе сополимера сначала на Vortex, а затем с помощью ультразвукового гомогенизатора. Полученную первичную эмульсию диспергируют с использованием Ultra Turrax в смеси диметикона с дихлорметаном и span 80 (вторичная дисперсная среда М2). Готовую тройную эмульсию при легком перемешивании оставляют созревать в течение нескольких часов в открытой емкости. Созревшие частицы осаждают центрифугированием и отмывают гептаном. Затем частицы сушат продувкой азотом. Для удаления не включившегося в частицы ФС полученные частицы промывают водой.
ПРИМЕР 2. Получение частиц ПМГК, содержащих фотосенсибилизатор (ФС) и обработанных перфторуглеродной эмульсией (ПФУЭ).
Частицы ПМГК, содержащие ФС (полученные способами, указанными в примере 1), перед инкубацией со стволовыми клетками предварительно обрабатывают перфторуглеродной эмульсией (ПФУЭ), с дисперсной фазой 10 об. %, состоящей из смеси перфторуглеродов: перфтордекалин, перфторметилциклогексилпиперидин, перфтортрибутиламин и перфтороктилбромид в соотношении 9:1:0,01:0,01. Для стабилизации ПФУЭ в качестве эмульгатора используется полоксамер (например, 4% проксанол 286) или фосфолипиды (например, соевый лецитин).
ПРИМЕР 3. Получение частиц ПМГК, содержащих фотосенсибилизатор (ФС) и обработанных раствором полоксамера или дисперсией фосфолипидов.
Частицы ПМГК, содержащие ФС ГК (полученные способами, указанными в примере 1), перед инкубацией со стволовыми клетками предварительно обрабатывают раствором полоксамера (например, 4% проксанола 286) или дисперсией фосфолипидов (например, соевого лецитина).
ПРИМЕР 4. Получение частиц ПМГК, содержащих перфторуглерод (ПФУ).
Сополимер молочной и гликолевой кислот (PLGA) растворяют в дихлорметане. В полученном растворе растворяют перфтороктилбромид или смесь перфторуглеродов: перфтордекалин, перфторметилциклогексилпиперидин, перфтортрибутиламин и перфтороктилбромид в соотношении 9:1:0,01:0,01. Приготовленную фазу диспергируют с использованием Ultra Turrax в холодном водном растворе поливинилового спирта и метилцеллюлозы. Полученную эмульсию смешивают с большим количеством холодной воды и выдерживают при постоянном перемешивании с повышением температуры до комнатной в течение нескольких часов. Созревшие микрочастицы осаждают центрифугированием и промывают водой.
ПРИМЕР 5. Получение частиц ПМКГ, содержащих фотосенсибилизатор (ФС) и перфторуглерод (ПФУ).
Сополимер молочной и гликолевой кислот (PLGA) растворяют в дихлорметане. В полученном растворе растворяют перфтороктилбромид или смесь перфторуглеродов: перфтордекалин, перфторметилциклогексилпиперидин, перфтортрибутиламин и перфтороктилбромид в соотношении 9:1:0,01:0,01. В приготовленной дисперсной среде диспергируют водный раствор ФС сначала на Vortex, а затем с помощью ультразвукового гомогенизатора. Полученную первичную эмульсию диспергируют с использованием Ultra Turrax в холодном водном растворе поливинилового спирта и метилцеллюлозы. Готовую тройную эмульсию смешивают с большим количеством холодной воды и выдерживают при постоянном перемешивании с повышением температуры до комнатной в течение нескольких часов. Созревшие микрочастицы осаждают центрифугированием и промывают водой.
ПРИМЕР 6. Получение частиц ПМГК, содержащих фотосенсибилизатор (ФС) и/или перфторуглерод (ПФУ), обработанных раствором полоксамера или дисперсией фосфолипидов.
Частицы ПМГК, содержащие ФС ГК (полученные способами, указанными в примерах 4 и 5), перед инкубацией со стволовыми клетками предварительно обрабатывают раствором полоксамера (например, 4% проксанола 286) или дисперсией фосфолипидов (например, соевого лецитина).
ПРИМЕР 7. Введение частиц ПМГК, содержащих ФС, в стволовые клетки.
Получение стволовых клеток. В качестве доноров стволовых клеток были использованы мыши линии C57blackl0 GFP, цитоплазма которых содержит белок, флюоресцирующий (зеленый цвет) под действие УФ-излучения. Клетки костного мозга выделяли из бедренной кости и культивировали в среде DMEM, содержащей 10% эмбриональной телячьей сыворотки, 5 мкг/л инсулина, 10 нМ дексаметазона в течение 5 дней при 37°С.
Для введения в стволовые клетки использовали частицы, полученные по примеру 1-6. В качестве фотосенсибилизатора использовали хлорином е6. После 5 дней культивирования к клеткам костного мозга добавляли частицы, содержащие хлорин е6, и инкубировали в течение 30 минут при 37°С. После 5-кратной отмывки раствором Хенкса клетки снимали трипсином и рекультивировали в среде DMEM.
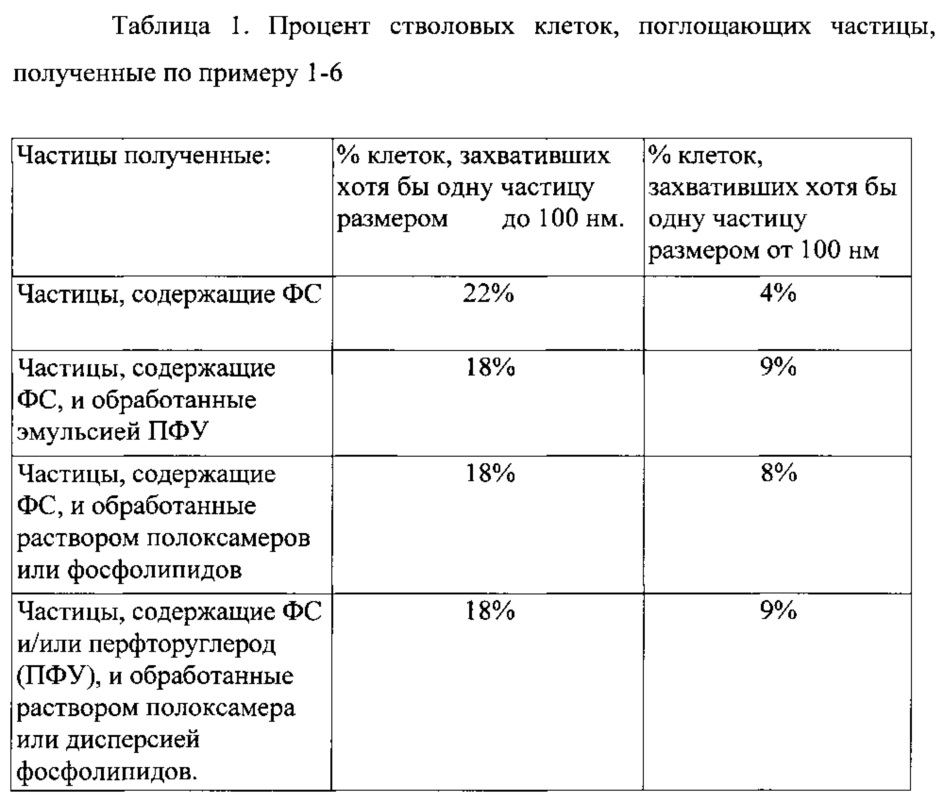
Как видно из представленной таблицы 1 частицы, содержащие ФС, по-разному проникают в цитоплазму стволовых клеток в зависимости от размера и предварительной обработки полоксамером или ПФУ эмульсией.
Мелкие частиц (до 100 нм), которые предварительно не обрабатывались (пример 1) лучше проникают в стволовые клетки по сравнению с обработанными частицами.
Однако, крупные частицы (свыше 100 нм) после обработки полоксамерами или ПФУ эмульсией лучше проникают в цитоплазму стволовых клеток по сравнению с необработанными. Данное различие можно использовать для решения конкретной клинической или экспериментальной задачи, которая может возникнуть.
Таким образом, увеличение количества частиц, захваченное стволовыми клетками, и использование частиц свыше 100 нм позволяет резко увеличить количество препарата, проникающего в клетку, т.е. увеличить количество ФС «транспортируемого» стволовыми клетками в зону, которая будет подвергнута фотодинамической терапии.
В ходе работы было показано, что частицы ПМГК, содержащие ФС, проникают внутрь стволовых клеток костного мозга (Фигура 1).
Проведенные эксперименты показали, что данный метод позволяет существенно увеличить количество препарата для ФДТ переносимой стволовыми клетками. По заявленному методу 10000 стволовых клеток может содержать в своей цитоплазме до 805,4±1,2 пг ФС, находящегося в частицах ПМГК. В качестве сравнения 10000 стволовых клеток с частицами ПФУЭ в цитоплазме и с сорбированным на их поверхности ФС (полученные по методу, описанному в патенте №2440158) содержат около 5,1±0,3 пг ФС.
Таким образом, создание частиц из полимера, содержащих препарат для ФДТ, позволяет увеличить насыщение стволовых клеток в процессе их совместного культивирования и, следовательно, увеличить количество «транспортируемого» препарата для фотодинамической терапии.
Введение частиц ПМКГ, содержащих препарат для ФДТ, не приводит к достоверному снижению жизнеспособности стволовых клеток в процессе культивирования. Так жизнеспособность стволовых клеток составила не ниже 98% в течение 48 часов инкубации.
Таким образом, введение частиц ПМГК, содержащих ФС, позволяет снизить токсическое воздействие свободного (десорбированного) препарата для ФДТ на стволовые клетки.
ПРИМЕР 8. Трансплантация стволовых клеток. Стволовые клетки, содержащие частицы ПМГК с хлорином е6, трансплантировали реципиенту в/в и в/брюшинно в дозе от 2×104 до 2×107 клеток. Реципиентами являлись однородные по группе беспородные мыши, не содержащие GFP и содержащиеся в условиях вивария. Через 3-7 дней после трансплантации животных забивали, извлекали костный мозг и готовили клеточную суспензию. Под микроскопом в УФ-диапазоне проводили поиск клеток, содержащих зеленый белок, и после обнаружения облучали их лазером (662 нм) мощностью 1 Дж/см, в течение 1 минуты. В качестве источника светового излучения использовали полупроводниковый лазерный аппарат «ЛАМИ» длиной волны лазерного излучения 662 нм, что соответствует максимуму спектрального поглощения используемых фотосенсибилизаторов. Мощность излучения на конце световода 1,3 Вт (peг. номер 29/10020203/5212-03 от 20.05.2003 г.) код ОКП 944420, класс II А. Затем в видимом свете проводили фотографирование облученной клетки в течение 3 минут с интервалом 15 секунд.
В ходе работы было показано, что частицы ПМГК, содержащие ФС, проникают внутрь стволовых клеток костного мозга.
При обработке клеток, содержащих частицы с хлорином е6, лазером мощностью 1 Дж/см выделяются активные формы кислорода, что приводит к гибели клетки. Так на Фигура 2 представлен процесс разрушения мембраны клетки (стрелки - образование вакуолей).
Приготовление частиц, содержащих хлорин е6, и получение стволовых клеток осуществляли способом, описанным в примере 6.
Стволовые клетки трансплантировали реципиенту внутривенно в дозе от 2×10'' до 2×10' клеток. Реципиентами являлись мыши линии С57 black, не содержащие GFP и содержащиеся в условиях вивария. Всего в эксперименте использовали 25 животных. У данных животных развивался спонтанный рак молочной железы. Масса животных составляла 28,3±4,0 гр.
Через 5 дней после трансплантации животных забивали, извлекали опухоль, печень, селезенку. Выделенные ткани подвергали спектрометрии и оценивали содержание хлорина е6 основываясь на характерных пиках. Было показано в результате проведенного исследования, что ткань опухоли (100±15 мг) накапливает около 35% клеток, содержащих частицы с ФС (35,4±5,1%).
Введение стволовых клеток с ФС у здоровых беспородных мышей показало следующее распределение клеток: печень 8,3±1,1%, селезенка 5,2±1,2%, костный мозг - 12±2%. Масса животных составляла 25,3±2,8 гр.
Из проведенного исследования видно, что накопление стволовых клеток с ФС осуществляется прежде всего в опухоли, что согласуются с известными работами по распределению стволовых клеток в организме (Kathryn С. et al., 19F magnetic resonance imaging for stem/progenitor cell tracking with multiple unique perfluorocarbon nanobeacons, The FASEB Journal, 2007 June, vol. 21, p. 1647-1654; Kraitchman D.L. et al. (2003) In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation 107, 2290-2293; Arbab A.S. et al. (2006) Magnetic resonance imaging and confocal microscopy studies of magnetically labeled endothelial progenitor cells trafficking to sites of tumor angiogenesis. Stem Cells 24, 671-678).
ПРИМЕР 8. Применение стволовых клеток с частицами ПМГК, содержащими ФС, для проведения фотодинамической терапии.
Реципиентами являлись мыши линии С 57 black, не содержащие GFP и содержащиеся в условиях вивария. У данных животных развивался спонтанный рак молочной железы. Всего для эксперимента было взято 63 мыши.
Через 5 дней после трансплантации животных облучали контактным способом с помощью микролинзы на поверхность ткани в зоне опухоли. В качестве светового излучения использовали полупроводниковый лазерный аппарат «ЛАМИ» длиной волны лазерного излучения 662 нм.
ФДТ осуществляли при следующих параметрах: плотность энергии лазерного излучения 200-300 Дж/см, плотность мощности - 0,141-0,39 Вт/см. Продолжительность облучения (Т, мин) определяли по формуле: Т=E/PS, где Ps - плотность мощности излучения (Вт/см), Е - заданная величина плотности энергии (доза лазерного облучения).
Ps=PB/S, где Рв - мощность лазерного излучения на выходе световода (Вт), S - площадь светового пятна (см). С целью облегчения расчетов использовали таблицу плотности мощности (Ps) в зависимости от выходной мощности на конце световода (Рв) и размеров светового пятна. С целью измерения мощности лазерного излучения нами применялся дозировщик мощности ДИ-6А. Непосредственные, ближайшие и отдаленные результаты ФДТ оценивалась:
- полный регресс - полное исчезновение опухоли;
- частичный регресс - уменьшение опухоли более чем на 50%;
- отсутствие эффекта - уменьшение опухоли менее чем на 50%,
состояние без изменений или увеличение размеров опухоли.
Проведенные исследования показали полный регресс-32% особей, частичный регресс - 58% особей, отсутствие эффекта - 10% особей.
Затем животные забивались и проводилось исследование гистологической картины опухолей. Гистологическая картина соответствовала результатам лечения.
Таким образом, предлагаемый способ может быть широко применен в лечении злокачественных новообразований, для которых применимо использование фотодинамической терапии путем введения стволовых клеток с частицами из сополимера молочной и гликолевой кислот, содержащими фотосенсибилизатор (ФС).