Результат интеллектуальной деятельности: Пептид, обладающий способностью ингибировать миграцию клеток, стимулированную белком TARC
Вид РИД
Изобретение
Изобретение относится к биологически активным пептидам, способным ингибировать подвижность клеток, стимулированную хемокином TARC. Предложен пептид формулы H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-ОН. Заявленный пептид может использоваться в иммунологии для лечения аллергических заболеваний и в онкологии для повышения эффективности противоопухолевой терапии лейкозов.
Хемокины - это группа структурно родственных белков небольшого размера (8-12 кДа). Они представляют собой цитокины, индуцирующие миграцию лейкоцитов в лимфатические органы и очаги воспаления, контролирующие активацию и дифференцировку клеток. Действие хемокинов осуществляется через специфические мембранные рецепторы.
TARC - тимусом и активацией регулируемый хемокин (thymus- and activation-regulated chemokine, или CCL17) относится к подсемейству СС или β-хемокинов, в структуре которых два остатка цистеина расположены рядом (-с-с-) [1]. TARC специфически связывается с рецептором CCR4. Основную популяцию CCR4 + клеток в норме составляют Т-хелперные клетки, обеспечивающие гуморальный иммунный ответ на антигены (Т-хелперы 2 типа) [2-4].
Известно, что Т-хелперы 2 типа играют важную роль в развитии иммунных патологий, таких как аллергии и аутоиммунные расстройства [5]. Было показано значительное увеличение содержания в крови хемокина TARC при атопическом дерматите [6, 7], астме [8] и аллергическом рините [9].
Высокая экспрессия рецептора CCR4 выявлена в клетках Т-клеточной лимфомы/лейкоза взрослых и Т-клеточной лимфомы кожи [10, 11]. Показано, что поражения кожных покровов, характерные для этих неоплазий, обусловлены CCR4-зависимой миграцией опухолевых клеток в дерму.
Все эти факты указывают на необходимость разработки терапевтических подходов, основанных на ингибировании взаимодействия рецептора CCR4 с его лигандом. Некоторые шаги в этом направлении уже предприняты. Разработано несколько химических антагонистов CCR4 различной структуры и получены моноклональные антитела против рецептора CCR4, которые показали достаточно высокую противовоспалительную и противоопухолевую активность в доклинических испытаниях [12, 13]. Однако использование химических антагонистов в клинике может быть сопряжено с такими проблемами, как: низкая эффективность, токсичность, трудности в оценке фармакокинетических характеристик и метаболизма.
В связи с этим представляется целесообразным получение антагониста рецептора CCR4 с минимальным побочным действием. В качестве такого вещества может быть использован пептидный фрагмент TARC человека, обладающий антагонистическими по отношению к TARC свойствами.
Задачей настоящего изобретения является синтез пептидов, лишенных побочных реакций, ингибирующих TARC-опосредованную миграцию лимфоидных клеток.
Поставленная задача решается путем синтеза пептида формулы: TARC 17-28 - H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-OH. Заявляемый пептид содержит 12 аминокислотных остатков. Синтез заявляемого пептида осуществляется твердофазным способом с помощью Fmoc-технологии, что в настоящее время с учетом длины пептида является рутинной задачей. Очистка пептида осуществляется путем обычной одностадийной высокоэффективной жидкостной хроматографией (ВЭЖХ). Все это делает получение заявляемого антагониста значительно проще и дешевле, чем получение «гуманизированных» антител.
Неочевидность изобретения обусловлена тем, что поставленная задача решается путем синтеза пептида последовательности 17-28 TARC, хотя из литературы не известно ни одного фрагмента этого белка, способного ингибировать TARC-стимулированную миграцию лимфоидных клеток. Таким образом, из литературных данных не следовало, что поиск пептидного ингибитора TARC-стимулированной подвижности лимфоидных клеток среди фрагментов молекулы может привести к желаемым результатам. Заявляемый пептид не обладает иммуногенным и токсическим действием, поскольку является низкомолекулярным фрагментом эндогенного хемокина TARC.
Синтез заявляемого пептида осуществляется по стандартной технологии пептидного синтеза на твердой фазе с применением наиболее современной Fmoc-(9-флуоренилметоксикарбонил)-технологии [14]. В качестве нерастворимого носителя использовали сополимер стирола с 1% дивинилбензола с кислотолабильной якорной группой. Для блокирования функциональных групп боковых цепей аминокислот применяли следующие защиты: трет-бутильную для гидроксильных групп треонина и тирозина; трет-бутилоксикарбонильную (Boc) - защиту для ε-аминогруппы лизина и индольного кольца триптофана; 2,2,5,7,8-пентаметилхроман-6-сульфонильную (Pmc) - защиту для гуанидиновой функции аргинина. Пептидную цепь наращивали по одной аминокислоте, начиная синтез с С-конца. Для создания амидных связей использовали 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат (TBTU) в присутствии 2-х эквивалентов N-метилморфолина.
Для заключительного деблокирования и отщепления пептидов от носителя применяли трифторуксусную кислоту со скэвенджерами. Сырой продукт твердофазного синтеза очищали с использованием препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ).
Пример 1. Синтез додекапептида H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-OH, соответствующего последовательности 17-28 тимус-ассоциированного регуляторного хемокина (TARC)
В работе использовали производные L-аминокислот фирмы Bachem (Швейцария), TBTU, TIBS (триизобутилсилан) фирмы Fluka (Швейцария). Для синтеза применяли диметилацетамид, дихлорметан (DCM), 4-метилпиперидин и трифторуксусную кислоту фирмы Fluka (Швейцария).
Аналитическую и препаративную ВЭЖХ проводили на приборе Gilson (Франция), использовали ацетонитрил фирмы Panreac (Испания).
Аналитическую ВЭЖХ проводили на колонке Диасфер 110-С18 (Россия). В качестве элюентов использовали: буфер А - 0.1% ТФА, буфер Б - 80% ацетонитрила в буфере А, элюция градиентом буфера Б от 20 до 80% за 30 мин со скоростью 1 мл/мин; детекция при 220 нм. Препаративную ВЭЖХ проводили на колонке Диасорб С16 130Т (25×250 мм), размер частиц сорбента 10 мкм. В качестве элюентов использовали буфер А -- 0.1% ТФА, буфер Б - 80% ацетонитрила в буфере А. Элюцию проводили градиентом 0.5% в минуту буфера Б в буфере А от 100% буфера А со скоростью 10 мл/мин. Пептиды детектировали при длине волны 220 нм.
1Н-ЯМР-спектры снимали на спектрометре WH-500 Bruker 500 МГц (Германия) в DMSO-d6 (дейтерированный диметилсульфоксид) при 300K, концентрация пептидов составляла 2-3 мг/мл, химические сдвиги измерялись относительно тетраметилсилана. Масс-спектры регистрировали на приборе VISION 2000, (Termobioanalysis corp., Finnigan, США), снабженном импульсным азотным лазером класса 3В с длиной волны излучения 337 нм, методом MALDI с использованием 2,4,6-тригидроксиацетофеноновой матрицы.
Синтез пептидного фрагмента хемокина TARC осуществляли по стандартной технологии синтеза на твердой фазе с использованием Fmoc-методологии. В качестве полимерного носителя использовали Fmoc-аминоацил-полимер Ванга - сополимер стирола с 1% дивинилбензола с гидроксиметилфеноксиметильной якорной группой, с размером частиц 200-400 меш фирмы Bachem (Швейцария). Содержание стартовой аминокислоты составляло 0.7 ммоль/г аминоацилполимера.
Синтез проводили на автоматическом пептидном синтезаторе Tribute-UV фирмы Protein Technologies (США) по стандартной программе для однократной конденсации 0.5 ммоль Fmoc-аминокислоты. Использовали 4-кратный избыток Fmoc-защищенных аминокислот по отношению к содержанию аминогрупп в полимере. Синтез проводили с С-конца в соответствии с протоколом автоматического синтезатора для конденсации методом TBTU/NMM (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат / N-метилморфолин). Для деблокирования α-аминогрупп в процессе твердофазного синтеза (ТФС) использовали раствор 10% 4-MePip и 2% DBU (1,8-диазабицикло[5.4.0]ундец-7-ен) в DMA (N,N-диметилацетамид).
Протокол твердофазного синтеза


По окончании ТФС пептидилполимер переносили из реактора на фильтр Шотта и промывали DMA (3×10 мл), DCM (3×10 мл), сушили на воздухе.
Заключительное деблокирование и отщепление пептида от полимера проводили в одну стадию путем обработки соответствующего пептидилполимера 10 мл смеси 95% TFA, 2.5% деионизованной воды, 2.5% TIBS в течение 1.5 ч. Затем полимер отфильтровывали, промывали 2×2 мл деблокирующей смесью, фильтрат упаривали и к остатку прибавляли сухой диэтиловый эфир. Осадок отфильтровывали, промывали DCM (3×3 мл), эфиром (3×5 мл), сушили в вакуум-эксикаторе. Сырой продукт ТФС содержал, по данным ВЭЖХ, около 80% основного вещества. Очистку полученного соединения проводили методом препаративной ВЭЖХ.
Структуру полученного соединения подтверждали данными 1H-ЯМР- спектроскопии и масс-спектрометрии в указанных выше условиях. Выход синтезированного фрагмента TARC 17-28 в расчете на стартовую аминокислоту, присоединенную к полимеру, составил 46.2%. Данные масс-спектрометрии: найдено m/z=1446.16, вычислено М=1445.79. Данные аналитической ВЭЖХ: время удерживания пептида (Rt) - 12.7 мин, чистота - 96.1%
Пример 2
Тестирование синтезированного пептида проводилось по оценке его влияния на миграцию клеток Т-лимфобластного лейкоза линии CEM.NKR, стимулированную TARC. Клетки были любезно предоставлены зав. лаб. иммунологии и клеточной биотехнологии РНПЦ эпидемиологии и микробиологии МЗ Республики Беларусь д.м.н. Гончаровым А.Е. Клетки культивировали в среде RPMI-1640 с добавлением 10% сыворотки плода коровы, 2 мМ глутамина, по 100 Ед/мл пенициллина и стрептомицина (все реактивы фирмы Invitrogen). Экспрессия клетками рецепторов CCR4 была подтверждена с помощью прямой иммунофлуоресценции (окрашивание антителами к CCR4, меченными фикоэритрином, eBioscience) и проточной цитометрии.
Миграционный ответ клеток оценивали в системе Трансвелл с диаметром пор 8 мкм для 24-луночных планшетов (Corning, NY). Для проведения эксперимента использовали среду RPMI-1640 с добавлением 1% сыворотки плода коровы. В нижнюю часть системы Трансвелл вносили 5 нМ раствор хемокина TARC (R&D Systems) в среде, либо среду без TARC (контроль). Пептид вносили в нижнюю часть системы Трансвелл до конечной концентрации 100 мкМ. 100 мкл суспензии клеток (10 млн/мл) помещали в верхнюю часть системы. Планшеты инкубировали в атмосфере 5% CO2 при 37°С в течение 18 часов. Клетки, промигрировавшие в нижнюю часть системы Трансвелл, подсчитывали в камере Горяева. Количество промигрировавших клеток выражали в относительных единицах (О.Е.), принимая за 1 О.Е. уровень спонтанной миграции клеток в контрольных образцах.
Для межгрупповых сравнений использовали U-критерий Манна-Уитни. Данные выражали как медиана (25; 75 процентили). Для обработки данных использовали программный пакет Statistica 7. Различия считали статистически значимыми при p<0,05.
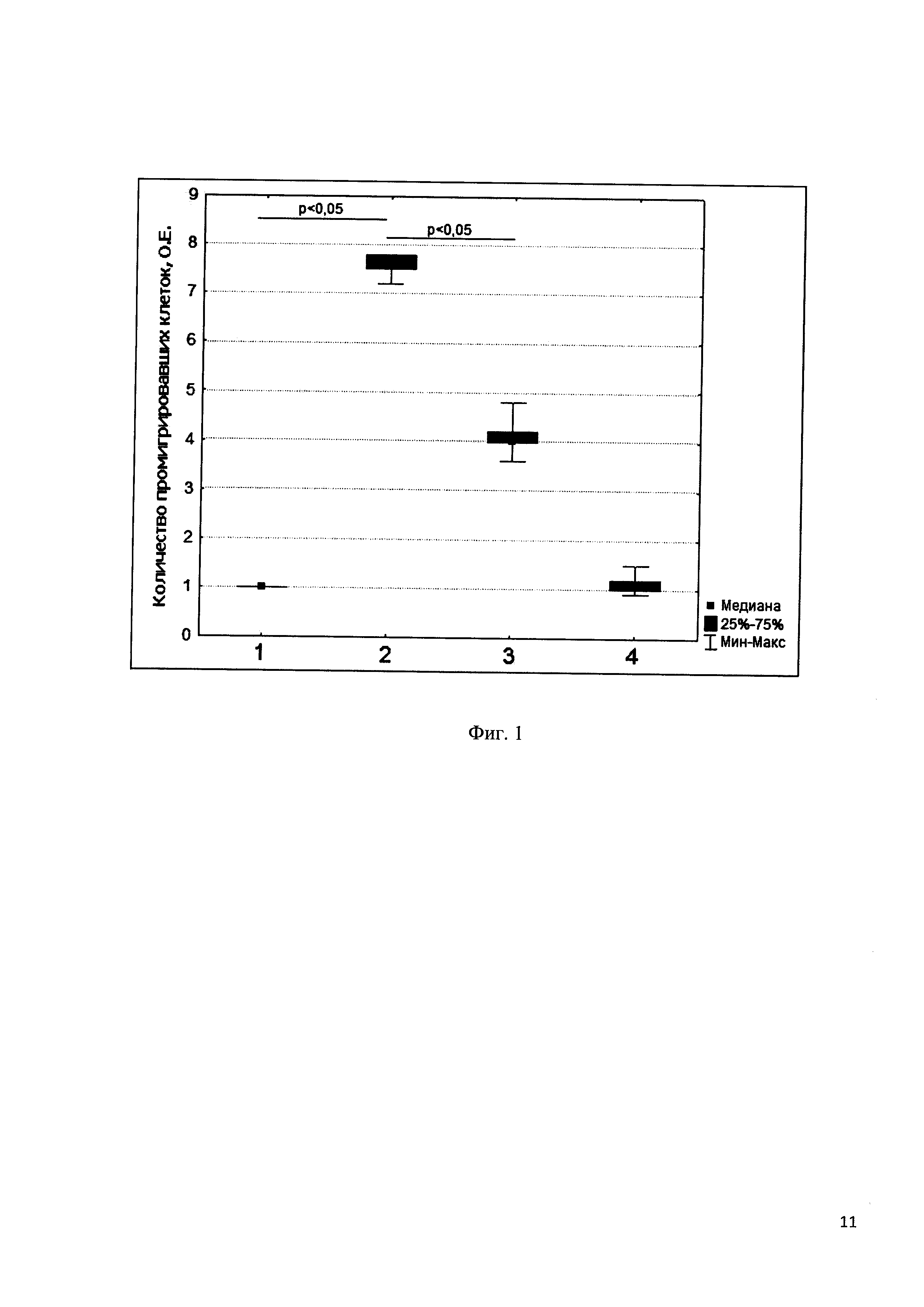
В использованной модельной системе TARC стимулировал миграцию лимфоидных клеток. Количество клеток в нижней части Трансвелл было в 7-8 раз выше по сравнению с контролем. Полученный пептидный фрагмент хемокина TARC подавлял миграцию, индуцированную TARC, примерно в 2 раза, но не оказывал влияния на спонтанную подвижность клеток. Указанный пептид не оказывал влияния на миграцию клеток, стимулированную другими хемокинами, в частности, SDF-1 (данные не представлены).
На фиг. 1. показано влияние пептида H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-OH на миграцию клеток Т-лимфобластного лейкоза линии CEM.NKR, стимулированную хемокином TARC. Вдоль оси X расположены точки эксперимента. В верхнюю часть системы Трансвелл вносили суспензию клеток в среде RPMI-1640 с добавлением 1% сыворотки плода коровы. В нижнюю часть: такую же среду (контроль) (точка 1); хемокин TARC (5 нМ) (2); хемокин TARC (5 нМ) и пептид H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-OH (100 мкМ) (3); пептид H-Gly-Ala-Ile-Pro-Leu-Arg-Lys-Leu-Lys-Thr-Trp-Tyr-OH (100 мкМ) (4). По оси Y приведено количество промигрировавших клеток, выраженное в относительных единицах (О.Е.) 1 О.Е. - количество промигрировавших клеток в контрольных образцах.
СПИСОК ЛИТЕРАТУРЫ
1. Imai Т., Yoshida Т., Baba М., Nishimura М., Kakizaki М., Yoshie О. // J. Biol. Chem. 1996. V. 271. P. 21514-21521.
2. Bonecchi R., Bianchi G., Bordignon P.P., D'Ambrosio D., Lang R., Borsatti A., Sozzani S., Allavena P., Gray P.A., Mantovani A., Sinigaglia F. // J. Exp. Med. 1998. V. 187. P. 129-134.
3. Sallusto F., Lenig D., Mackay C.R., Lanzavecchia A. // J. Exp. Med. 1998. V. 187. P. 875-883.
4. Imai Т., Nagira M., Takagi S., Kakizaki M., Nishimura M., Wang J., Gray P.W., Matsushima K., Yoshie O. // Int. Immunol. 1999. V. 11. P. 81-88.
5. Mosmann T.R., Sad S. // Immunol. Today. 1996. V. 17. P. 138-146.
6. Fujisawa, Т., Fujisawa, R., Kato, Y., Nakayama Т., Morita A., Katsumata PL, Nishimori H., Iguchi K., Kamiya H., Gray P.W., Chantry D., Suzuki R., Yoshie O. // J. Allergy Clin. Immunol. 2002. V. 110. P. 139-146.
7. Horikawa, Т., Nakayama, Т., Hikita, I., Yoshie O. // Int. Immunol. 2002. V. 14. P. 767-773.
8. Sekiya Т., Yamada H., Yamaguchi M., Ishii A., Yamamoto K., Morita A., Sano Y., Yoshie O., Matsushima K., Hirai K. // Allergy. 2002. V.57. P. 173-177.
9. Campbell, J.D., Stinson, M.J., Simons, F.E., HayGlass, K.T. // Int. Immunol. 2002. V. 14. P. 1255-1262.
10. Yoshie O, Fujisawa R, Nakayama T, Harasawa H., Tago H., Izawa D., Hieshima K., Tatsumi Y., Matsushima K., Hasegawa H., Kanamaru A., Kamihira S., Yamada Y. // Blood. 2002. V. 99. P. 1505-1511.
11. Ferenczi K., Fuhlbrigge R.C., Pinkus J., Pinkus G.S., Kupper T.S. // J. Invest. Dermatol. 2002. V. 119. P. 1405-1410.
12. Pease J.E. and Horuk R. // Expert Opin. Drug Discov. 2014. V. 9. P. 467-483.
13. Niwa, R., Shoji-Hosaka, E., Sakurada, Shinkawa Т., Uchida K., Nakamura K., Matsushima K., Ueda R., Hanai N., Shitara K. // Cancer Res. 2004. V. 64. P. 2127-2133.
14. Fmoc solid phase peptide synthesis. 2001. Ed. Chan, W.C., White, P.D. Oxford University Press, New York, USA. 346 p.