Результат интеллектуальной деятельности: СПОСОБ УВЕЛИЧЕНИЯ ЭФФЕКТИВНОСТИ ПРОНИКНОВЕНИЯ ДНК В МИТОХОНДРИИ ЭУКАРИОТИЧЕСКИХ КЛЕТОК
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и молекулярной биологии, а также может использоваться для доставки нуклеиновых кислот в митохондрии. Наличие способа эффективной доставки экзогенного генетического материала в митохондрии открывает широкие возможности для модификации митохондриального генома и регуляции процессов реализации генетической информации в этих органеллах. Такие модификации могут использоваться, в первую очередь, для коррекции митохондриальных дисфункций, опосредованных мутациями в митохондриальном геноме или нарушениями в митохондриальных транскрипции или трансляции. Также возможность эффективной доставки нуклеиновых кислот в митохондрии представляет собой мощный инструмент для фундаментальных исследований молекулярно-биологических процессов в митохондриях.
Уровень техники
Митохондрии являются обязательными органеллами всех эукариотических клеток, осуществляющими получение энергии за счет комплекса реакций окислительного фосфорилирования. Митохондрии имеют свой собственный аппарат хранения, реализации и передачи генетической информации, закодированной в митохондриальной ДНК (мтДНК). Накопление мутаций в митохондриальном геноме происходит с существенно большей частотой, нежели в ядерном, в силу повышенной концентрации активных форм кислорода в митохондриальном матриксе [Vega RB, Horton JL, Kelly DP. Maintaining ancient organelles: mitochondrial biogenesis and maturation. // Circ Res. 2015. V. 116(11). P. 1820-1834]. Накопление мутаций в мтДНК человека ведет к развитию целого ряда заболеваний, в частности мышечных дистрофий и нейродегенеративных расстройств [Lestienne P,  Mitochondrial DNA alterations and genetic diseases: a review. // Biomed Pharmacother. 1994. V. 48(5-6). P. 199-214]. В настоящее время во многих лабораториях мира разрабатываются подходы к коррекции митохондриальных дисфункций, опосредованных мутациями в мтДНК. Однако такие исследования сильно ограничены отсутствием способов доставки корректирующих агентов в митохондрии.
Mitochondrial DNA alterations and genetic diseases: a review. // Biomed Pharmacother. 1994. V. 48(5-6). P. 199-214]. В настоящее время во многих лабораториях мира разрабатываются подходы к коррекции митохондриальных дисфункций, опосредованных мутациями в мтДНК. Однако такие исследования сильно ограничены отсутствием способов доставки корректирующих агентов в митохондрии.
В настоящее время известны способы трансформации митохондрий лишь двух организмов - баллистическая трансформация митохондрий Saccharomyces cerevisiae и Chlamydomonas reinhardtii [Bonnefoy N, Fox TD. Directed alteration of Saccharomyces cerevisiae mitochondrial DNA by biolistic transformation and homologous recombination. // Methods Mol Biol. 2007. V. 372. P. 153-166 - ближайший аналог]. Метод баллистической трансформации подразумевает нанесение ДНК на микрометровые вольфрамовые или золотые «пули», которыми посредством специального устройства - генной пушки производится бомбардировка клеток. После бомбардировки клетки высевают на селективную среду, культивируют, а затем анализируют подросших трансформантов на предмет наличия экзогенной ДНК в митохондриях. Этот метод требует использования дорогостоящего оборудования, реагентов, а также длительного трудоемкого отбора клеток с трансформированными митохондриями.
Известно, что митохондрии эволюционно произошли от прокариотического предшественника [Poole AM, Gribaldo S. Eukaryotic origins: How and when was the mitochondrion acquired? // Cold Spring Harb Perspect Biol. 2014. V. 6(12). P. a015990] и сохранили некоторую часть прокариотических биологических свойств. Одним из них является так называемая «природная компетентность», то есть способность изолированных митохондрий поглощать экзогенную ДНК. Такая способность продемонстрирована для митохондрий дрожжей, растений и человека, однако этот процесс проходит медленно и крайне неэффективно [Weber-Lotfi F, Koulintchenko MV, Ibrahim N, Hammann P, Mileshina DV, Konstantinov YM, Dietrich A. Nucleic acid import into mitochondria: New insights into the translocation pathways. // Biochim Biophys Acta. 2015. V. 1853(12). P. 3165-3181]. При этом также известно, что для увеличения эффективности проникновения экзогенных нуклеиновых кислот в живые клетки может применяться их предварительная обработка ДНК-связывающими белками [Патент РФ №2464314, 20.10.2012].
Раскрытие изобретения
В связи с этим целью настоящего изобретения стала разработка способа увеличения эффективности трансформации митохондрий эукариотических клеток.
Поставленная цель достигается тем, что способ увеличения эффективности проникновения ДНК в митохондрии эукариотических клеток включает предварительную обработку молекулы ДНК рекомбинантным белком Abf2p Saccharomyces cerevisiae, содержащим в своем составе митохондриальную сигнальную последовательность MNSYSLLTRSFHESSKPLFNLASTLL, при соотношении 1 молекула белка на 4 сайта связывания на молекуле ДНК в течение 10-30 минут при 20-30°C в буфере, содержащем физиологическую концентрацию NaCl и с близким к нейтральному значением pH.
Способ получения белка Abf2p Saccharomyces cerevisiae, содержащего в своем составе митохондриальную сигнальную последовательность MNSYSLLTRSFHESSKPLFNLASTL, включает получение рекомбинантной плазмиды pET30/MTS-ABF2-HIS, несущей ген митохондриального белка дрожжей Abf2p, размером 6415 н.п. и содержащей следующие структурные элементы: промотор РНК-полимеразы фага T7 (1088-1072 н.п.), терминатор транскрипции фага T7 (26-72 н.п.), ген ABF2 (72-1122 н.п.), ген устойчивости к канамицину с соответствующим промотером (4048-4860), ген lac-репрессора (1526-2655 н.п.) и бактериальный участок инициации репликации (3339 н.п.) и дальнейшую трансформацию полученной плазмидой штамма Е. coli BL21(DE3).
В качестве буфера, содержащего физиологическую концентрацию NaCl и с близким к нейтральному значением pH, в данном техническом решении использовался буфер следующего состава: 25 мМ Трис-HCl с pH 8,0, 150 мМ NaCl, 2 мМ этилендиаминтетраацетата натрия. В качестве хелатирующего агента могут быть использованы этилендиаминтетраацетат калия или этиленгликоль триуксусная кислота. Под физиологической концентрацией NaCl подразумевается содержание в буфере хлористого натрия около 0,9% или 150 ммоль. Нейтральное значение pH буфера должно находиться в пределах от 6,0 до 8,0.
Технический результат предложенного способа заключается в увеличении трансформации митохондрий эукариотических клеток, а также в расширении арсенала технических средств аналогичного назначения. Данный результат достигается за счет того, что получен ДНК-белковый комплекс, обладающий свойством направляться к мембране митохондрий, создавая у ее поверхности локально повышенную концентрацию ДНК. Это реализуется тем, что сконструированный плазмидный вектор, содержащий последовательность гена белка Abf2p S. cerevisiae (ABF2), вводится в культуру клеток Е. coli, клонированный ген экспрессируется при добавлении соединения-индуктора, рекомбинантный белок синтезируется в бактериях и очищается. После этого проводится инкубация линейной ДНК с препаратом рекомбинантного белка, а затем - трансформация обработанной ДНК изолированных митохондрий дрожжей. Эффективность трансформации митохондрий при этом увеличивается в 8-10 раз. Таким образом полученный препарат рекомбинантного белка Abf2p может быть использован в разнообразных научных исследованиях, а также в работах, направленных на коррекцию мутаций в митохондриальных геномах эукариот.
В предлагаемом техническом решении используется нуклеотидная последовательность гена ABF2 Saccharomyces cerevisiae [ABF2 / YMR072W // URL: http://www.yeastgenome.org/locus/S000004676/overview (дата обращения: 03.11.2015). Saccharomyces genome database [Электронный ресурс]]. В N-концевой части кодируемого им полипептида имеется аминокислотная последовательность, направляющая импорт синтезированного в цитоплазме белка в матрикс митохондрий. Кроме того, в своем составе белок содержит два ДНК-связывающих домена, обеспечивающих эффективное связывание и конденсацию ДНК. Аминокислотная последовательность белка Abf2p приведена на фиг. 1.
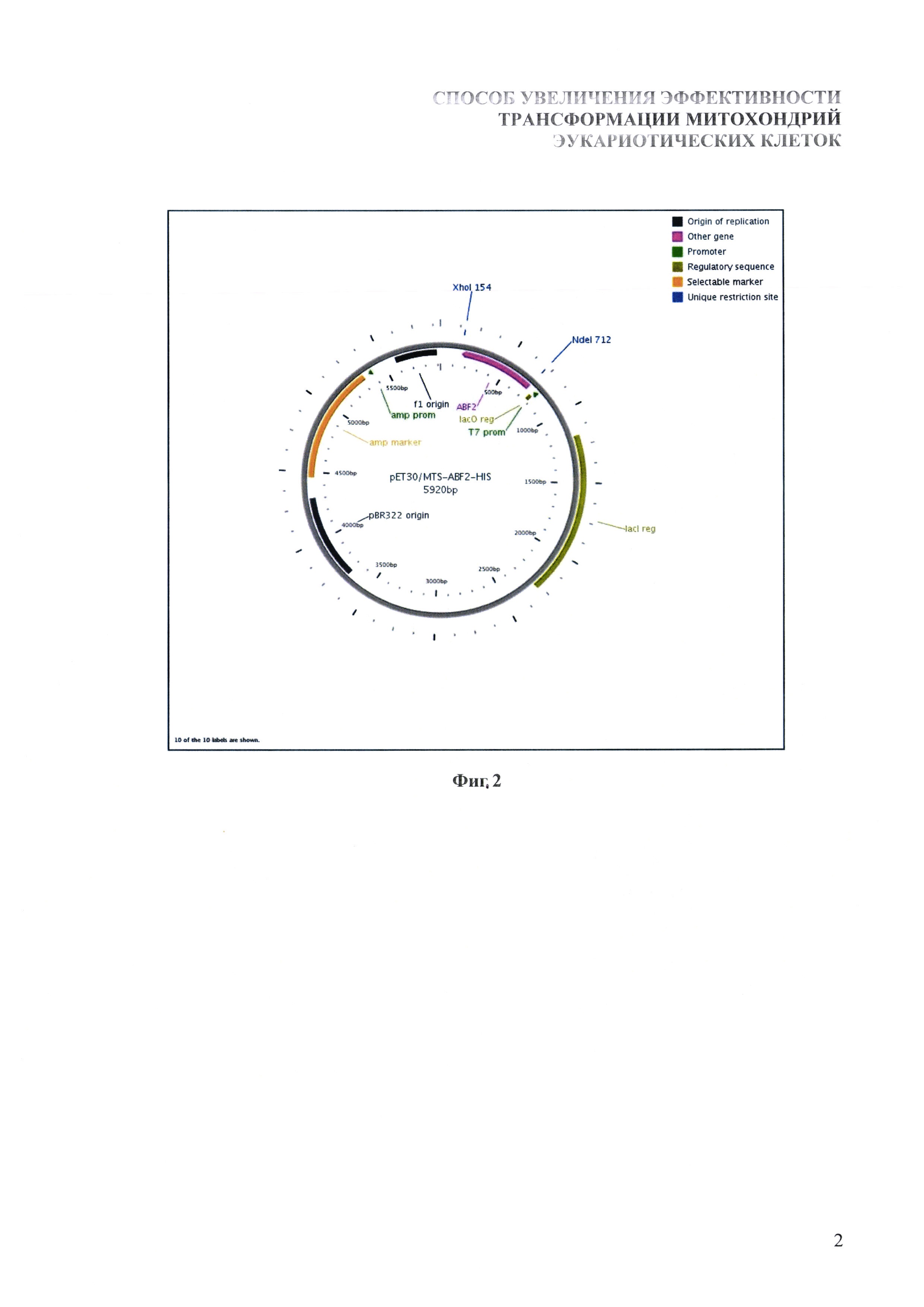
Последовательность гена синтезируется путем амплификации соответствующего участка геномной ДНК S. cerevisiae штамма W303 с использованием подбираемых и синтезируемых нами олигонуклеотидных праймеров, которые в своих 3'-концевых областях комплементарны фланговым участкам гена ABF2, а на 5'-концевых областях несут сайты узнавания эндонуклеаз рестрикции Ndel и Xhol. Синтезированный фрагмент ДНК клонируется в составе плазмидного вектора pET30a (Novagen, США) по сайтам рестрикции Ndel и Xhol. В итоге полученный вектор имеет в своем составе ген ABF2 S. cerevisiae, экспрессия которого контролируется ранним промотором РНК-полимеразы фага T7. При этом в 3'-концевой части гена в одной рамке считывания с последовательностью ABF2 находится участок, кодирующий синтез гексагистидинового пептида, облегчающего выделение и очистку рекомбинантного белка с помощью аффинной хроматографии. Полученный экспрессионный вектор получил название pET30/MTS-ABF2-HIS (фиг. 2).
Плазмидой pET30/MTS-ABF2-HIS трансформируется штамм Е. coli BL21(DE3) (Novagen, США). Выросшие на селективной агаризованной среде LB с канамицином колонии переносятся в жидкую питательную среду 2xYT и культивируются при 37°C до оптической плотности OD600 ~ 0,8. После этого к культуре добавляют индуктор экспрессии (изопропил-β,D-галактотиопиранозид) до концентрации 0,25 мМ и культивируют культуру бактерий при 30°C в течение 4 часов. После этого клетки собирают центрифугированием, ресуспендируют в лизирующем буфере (25 мМ Na-фосфатный буфер pH 7,4; 0,5М NaCl; 25 мМ имидазол) и разрушают при помощи ультразвукового дезинтегратора. После этого лизат центрифугируют 25 минут при 25000 g. Полученный лизат наносят на колонку с никель-сефарозой HisTrap (GE Healthcare, США) и проводят аффинную очистку рекомбинантного белка на хроматографической системе АКТА Purifier (GE Healthcare, США). Элюцию очищенного препарата белка проводят буфером того же состава, содержащим 500 мМ имидазола. Чистоту препарата определяют методом денатурирующего электрофореза в 12% полиакриламидном геле с последующим окрашиванием Coomassii G250.
Ранее другими авторами было показано, что митохондрии клеток различных организмов обладают природной компетентностью, то есть способностью поглощать экзогенную ДНК. Мы исследуем возможность увеличения эффективности этого процесса путем предварительного связывания поглощаемой ДНК, имеющей в своем составе сигнал импорта в митохондрии рекомбинантным белком Abf2p Saccharomyces cerevisiae, выделенным из Е. coli.
Краткое описание чертежей
На фиг. 1 представлена аминокислотная последовательность рекомбинантного ДНК-связывающего белка Abf2p митохондрий дрожжей S. cerevisiae. Полужирным шрифтом выделена последовательность, направляющая импорт белка в митохондрии; курсивом выделен гексагистидиновый пептид.
На фиг. 2 представлено схематическое изображение плазмиды pET30/MTS-ABF2-HIS, экспрессирующей ген ДНК-связывающего белка митохондрий S. cerevisiae. T7 promoter - ранний промотор фага T7; ABF2 - ген ДНК-связывающего белка митохондрий S. Cerevisiae; pBR322 origin - участок инициации репликации плазмиды; lac reg - ген lac-репрессора, обуславливающего строгий контроль экспрессии.
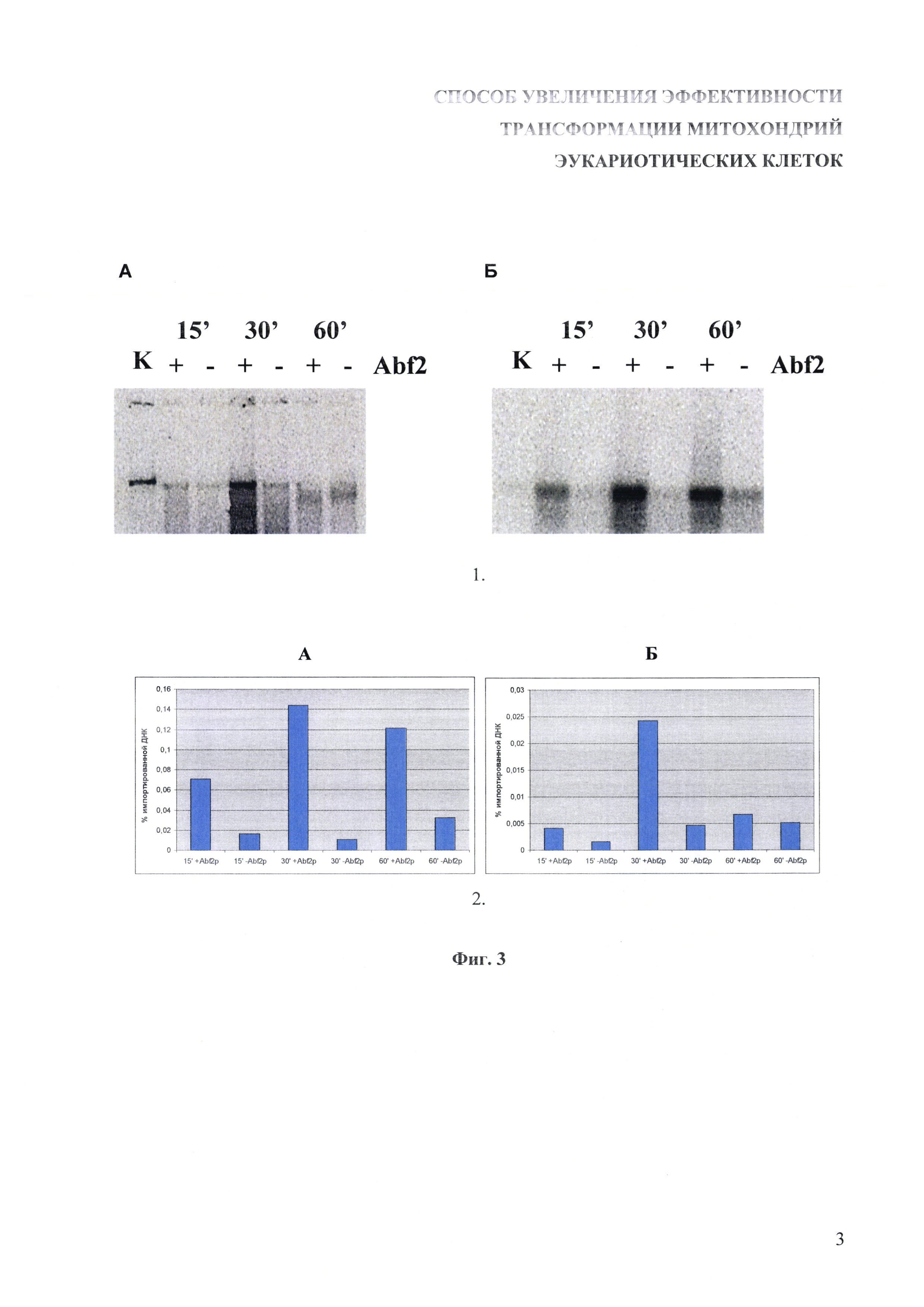
На фиг. 3 показано увеличение эффективности импорта линейной двуцепочечной ДНК в изолированные митохондрии дрожжей после предварительной обработки ДНК-связывающим белком с сигналом импорта в митохондрии.
1. Импорт линейной двуцепочечной ДНК в изолированные митохондрии дрожжей S. cerevisiae. К суспензии изолированных митохондрий добавляли радиоактивно меченую ДНК, предварительно проинкубированную с рекомбинантным белком Abf2p в соотношении 1 молекула белка на 4 сайта связывания, либо необработанную ДНК, после чего смеси инкубировали 15, 30 и 60 минут. Затем смеси обрабатывали ДНКазой I в присутствии 10 мМ MgCl2 в течение 15 минут, после чего митохондрии осаждали, и из их осадка выделяли ДНК методом фенол-хлороформенной экстракции. Выделенную ДНК разделяли в 1% агарозном геле, переносили на нитроцеллюлозную мембрану, после чего радиоавтографировали. А - импорт фрагмента длиной 3900 п.о.; Б - импорт фрагмента длиной 250 п.о.; К - 0,01% от вносимого в каждую реакцию количества ДНК.
2. Оценка эффективности импорта относительно внесенного в реакционную смесь количества по интенсивности окрашивания соответствующих полос на радиоавтографе с помощью программного пакета ImageJ.
Осуществление изобретения
В настоящее время считается, что митохондрии эукариотических клеток произошли от общего предка и обладают сходными функциональными свойствами [Vega RB, Horton JL, Kelly DP. Maintaining ancient organelles: mitochondrial biogenesis and maturation. // Circ Res. 2015. V. 116(11). P. 1820-1834]. К таким функциональным свойствам можно отнести и природную компетентность - способность захватывать ДНК, характерную для митохондрий грибов, растений и животных. Считается, что молекулярные механизмы этого явления едины для всех перечисленных организмов. Исходя из этого пример использования изобретения реализован на митохондриях легкокультивируемых клеток дрожжей S. cerevisiae. Способ увеличения эффективности трансформации митохондрий эукариотических клеток реализуется по нижеприведенной схеме.
1. С помощью ПЦР-амплификации синтезировали линейный двуцепочечньгй фрагмент ДНК длиной 250 п.н. Также с помощью гидролиза эндонуклеазой рестрикции EcoRI линеаризовали плазмиду pCR2.1 (Invitrogen, США). Данные фрагменты очищали с помощью набора QIAquick PCR Purification Kit (QIAGEN, ФРГ), после чего с помощью полинуклеотидкиназы фага T4 (ThermoScientific, США) к 5'-концам фрагментов присоединяли радиоактивные фосфатные группы (32P).
2. Из культуры пекарских дрожжей Saccharomyces cerevisiae штамма BW303 выделяли митохондрии по протоколу, приведенному в [Gregg, С, Kyryakov, P., Titorenko, V.I. Purification of Mitochondria from Yeast Cells. // J. Vis. Exp.2009. V. 30. P. e1417]. После выделения митохондрии ресуспендировали в буфере для импорта ДНК (30 мМ калий-фосфатный буфер с pH 7,2; 0,4 М сорбитол).
3. Полученные на первом этапе фрагменты обрабатывали рекомбинантным белком Abf2p в молярном соотношении (относительно количества сайтов связывания на линейной ДНК) 4:1 в течение 15 минут при комнатной температуре (20-30°C) в 10 мкл буфера (25 мМ Трис-HCl с pH 8,0,150 мМ NaCl, 2 мМ этилендиаминтетраацетата натрия). Образовавшиеся комплексы ДНК : Abf2p смешивали с 90 мкл полученной на 2 этапе суспензией митохондрий. Смеси инкубировали при 25°C в течение 15, 30 и 60 минут. После этого к ним добавляли MgCl2 до концентрации 10 мМ и ДНКаза I (ThermoScientific, США), инкубацию проводили в течение 15 минут при 37°C. Таким образом ДНК, не попавшая в митохондрии, расщепляется.
4. Митохондрии отделялись центрифугированием при 18000 g в течение 5 минут при 4°C, промывались 100 мкл буфера для импорта ДНК, снова центрифугировались. Полученный осадок ресуспендировали в 200 мкл буфера 50 мМ Трис-HCl с pH 8,0, содержащего 0,5% додецилсульфат натрия. После этого из суспензии методом фенольно-хлороформенной экстракции выделяли ДНК. ДНК разделяли в 1% агарозном геле, после чего переносили на нитроцеллюлозный фильтр. Фильтр экспонировали в течение 8-12 часов с многоразовым фотолюминесцентным экраном Phosphor Storage Screen (GE Healthcare, США), после чего экран визуализировали с помощью сканера Storm 860 (GE Healthcare, США). Полученный рисунок обрабатывали с использованием программного обеспечения Image J (NCBI, США) для сравнительного анализа числа пикселей, характеризующих количество попавшей внутрь митохондрий ДНК. При таком подсчете выясняли, что после 30 минут инкубации (оптимальные условия) эффективность проникновения ДНК внутрь митохондрий при предварительной ее обработке рекомбинантным белком Abf2p выше в 5 раз при длине фрагмента 250 п.о. и в 10 раз при длине фрагмента 3900 п.о. по сравнению с необработанной ДНК. Результаты приведены на фиг. 3.
Способ увеличения эффективности проникновения ДНК в митохондрии эукариотических клеток, включающий предварительную обработку молекулы ДНК рекомбинантным белком Abf2p Saccharomyces cerevisiae, содержащим в своем составе митохондриальную сигнальную последовательность MNSYSLLTRSFHESSKPLFNLASTLL, при соотношении 1 молекула белка на 4 сайта связывания на молекуле ДНК в течение 10-30 минут при 20-30°С в буфере, содержащем физиологическую концентрацию NaCl и с близким к нейтральному значением рН.