Результат интеллектуальной деятельности: N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2
Вид РИД
Изобретение
Настоящее изобретение относится к новым производным пиридо[4,3-d]пиримидин-2,4,7-триона, а именно к N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольвату, представляющему интерес в качестве средства для лечения заболеваний, вызванных нежелательной пролиферацией клеток, в частности в качестве противоопухолевого средства. Более конкретно настоящее изобретение относится к МЕK1, МЕK2 и МЕK1/2 ингибитору, представляющему интерес в качестве противоопухолевого препарата, в том числе для лечения злокачественных меланом.
Известны многочисленные ингибиторы к МЕK1, МЕK2 и МЕK1/2, структура которых включает фрагмент 1Н,6Н-пиридо[4,3-d]пиримидин-2,4,7-триона [WO 2005/121142, WO 2012/088033, США 7378423], среди которых наиболее продвинутым препаратом является Mekinist (Trametinib dimethyl sulfoxide, GSK1120212) [H. Abe, S. Kikuchi, K. Hayakawa et al. ACS Med. Chem. Lett. 2011, 2, 320-324]. GSK1120212 является эффективным ингибитором MEK1/2, который показывает более высокую эффективность против u-MEK1/2 до активации C-Raf (u-MEK1:IC50=0,7 нМ) по сравнению с предварительно активированным (рр-МЕК1:IC50=14,9 нМ) [http://clincancerres.aacrjournals.org/content/17/5/989.full].
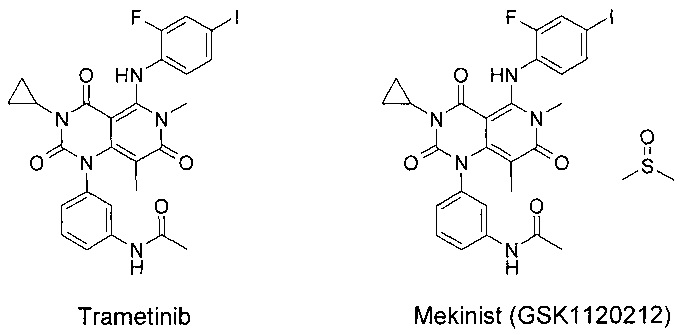
Однако Траметиниб и Мекинист практически нерастворимы в водных средах в интервале от рН=2 до рН=8. Траметиниб и Мекинист имеют также крайне малую растворимость в органических растворителях, включая высокополярные (ограниченно растворимы в горячих апротонных растворителях).
Поэтому до сих пор остается потребность в соединениях, которые могут демонстрировать благоприятные профили эффективности по отношению к МЕK1, МЕK2 и МЕK1/2 и иметь хорошую растворимость в водных либо органических средах. Такие соединения, ввиду улучшенной биодоступности, будут, как ожидается, больше подходить в качестве терапевтических агентов для лечения рака.
Кроме этого, хотя Мекинист имеет низкую токсичность при однократном пероральном применении (LD50>2000 мг/кг, мыши), при длительном дозировании в высоких концентрациях у животных наблюдается критическое снижение веса и иногда даже отмечается гибель животных. Поэтому поиск препаратов данной группы, имеющих меньшую токсичность при длительном дозировании, остается весьма актуальным.
Цель настоящего изобретения заключается в создании новых ингибиторов МЕK1, МЕK2 и МЕK1/2, обладающих меньшей токсичностью при длительном дозировании.
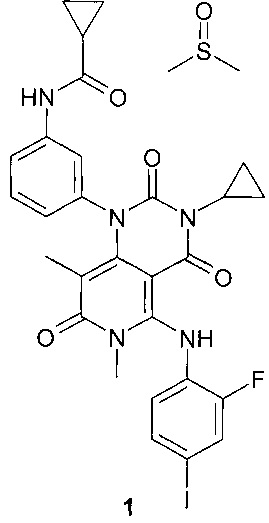
Поставленная цель достигается новым соединением N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольватом формулы 1.
Заявители неожиданно обнаружили, что новое соединение - N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольват формулы 1 - сравнимо с Траметинибом эффективно по отношению к МЕK1, МЕK2 и МЕK1/2 и не имеет токсичности при продолжительном курсовом приеме.
Таким образом, новое соединение - N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольват формулы 1 - может быть особенно полезным при лечении болезненных состояний, в которых участвуют МЕK1, МЕK2 и МЕK1/2, например при лечении рака, в том числе при лечении злокачественных меланом.
Предметом настоящего изобретения является N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольват формулы 1
Предметом настоящего изобретения является также ингибитор МЕK1, МЕK2 и МЕK1/2, представляющий собой соединение формулы 1.
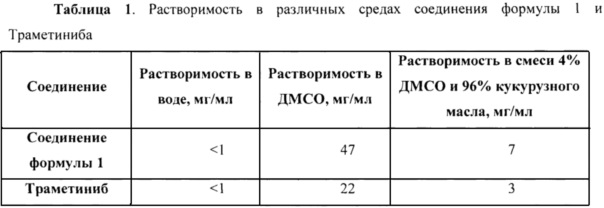
Преимуществом нового соединения формулы 1 является более высокая растворимость в органических средах, что может обеспечивать большее разнообразие подходящих формуляций и в результате дает возможность получать лучшую биодоступность и другие фармакокинетические параметры. Так, например, растворимость соединения формулы 1 в диметилсульфоксиде более чем в 2 раза выше растворимости Траметиниба. Выше также растворимость в смеси 4% диметилсульфоксида и 96% растительного масла. В Таблице 1 указана растворимость соединения формулы 1 в различных средах в сравнении с Траметинибом.
Ингибирующая активность нового соединения формулы 1 сопоставима с ингибирующей активностью Траметиниба по отношению к МЕK1 и составила в эксперименте IC50=8,02 нМ (в случае Траметиниба IC50=8,14 нМ).
Безусловным преимуществом нового соединения формулы 1 является существенно более низкая токсичность при курсовом дозировании по сравнению с прототипом (Мекинист - комплекс Траметиниба с диметилсульфоксидом). Исследования эффективности на модели ксенографтов меланомы человека линии A375 показали, что соединение формулы 1 дозозависимо подавляет рост опухолей и вызывает их регрессию. Эффективность соединения формулы 1 сопоставима с Мекинистом, и при этом соединение формулы 1 менее токсично - лечение Мекинистом в эксперименте привело к критическому снижению веса и гибели двух животных, тогда как соединение формулы 1 даже в более высоких дозах не вызывало гибели животных.
Исследование противоопухолевой активности соединения формулы 1 в сравнении с Мекинистом проведено на самках мышей линии NMRI nude. После формирования опухолей животных разделили на группы таким образом, чтобы средний размер опухоли в группе был ~150 мм3. Животных лечили исследуемыми препаратами в течение 21 дня. Вес животных экспериментальных групп, получавших соединение формулы 1 в дозах до 3 мг/кг включительно, не отличался существенно от веса животных контрольной группы (Фиг. 1). Лечение соединением формулы 1 в дозе 10 мг/кг привело к снижению веса животных, которое наблюдалось на протяжении всего исследования с первого же введения, однако не превышало 20% относительно дня начала лечения. При этом внутрижелудочное введение Мекиниста в дозе 3 мг/кг в течение уже 9 дней привело к критическому снижению веса и гибели двух животных, в результате чего лечение в этой группе было приостановлено на 3 дня до восстановления веса.
Динамика роста опухолей приведена на Фиг. 2. Внутрижелудочное введение соединения формулы 1 в дозе 0.3 мг/кг не оказало влияния на рост опухолей, тогда как во всех остальных группах наблюдалось существенное торможение роста опухолей. Также отмечалась регрессия опухолей у трех из восьми животных, получавших соединение формулы 1 в дозе 1 мг/кг, и у 7/8 и 8/8 в группах, получавших соединение формулы 1 в дозах 3 и 10 мг/кг соответственно. Внутрижелудочное введение Мекиниста в дозе 3 мг/кг также вызвало регрессию у 100% животных в группе.
Таким образом, соединение формулы 1 проявило дозозависимое подавление роста и регрессию опухолей, при этом не вызывало гибели животных и умеренно снижало вес животных только в максимальной исследованной дозе.
Предметом настоящего изобретения является также ингибитор МЕK1, МЕK2 и МЕK1/2, представляющий собой соединение формулы 1. Предпочтительно такой ингибитор используется для лечения у пациента рака, в том числе для лечения злокачественных меланом.
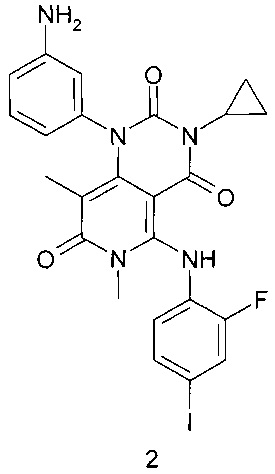
Предметом настоящего изобретения является также способ получения соединения формулы 1, который заключается во взаимодействии 1-(3-аминофенил)-3-циклопропил-5-{(2-фторо-4-иодофенил)амино}-6,8-диметилпиридо[4,3-d]пиримидин-2,4,7(1Н,3Н,6Н)-триона формулы 2 или его соли с циклопропилкарбоновой кислотой или ее активированным производным (например, хлорангидридом или соответствующим активированным сложным эфиром или ангидридом данной кислоты) в растворителе, например, таком как СН2Cl2, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон, с последующим получением кристаллосольвата конечного продукта медленным охлаждением горячего насыщенного раствора в диметилсульфоксиде.
Предметом настоящего изобретения является активный компонент для приготовления фармацевтических композиций и лекарственных форм, представляющий собой соединение формулы 1.
Предметом настоящего изобретения является фармацевтическая композиция, обладающая свойствами ингибитора МЕK1, МЕK2 и МЕK1/2, содержащая в качестве активного компонента соединение формулы 1 в терапевтически эффективном количестве и фармацевтически приемлемые наполнители.
Фармацевтическая композиция может быть в форме, подходящей для перорального применения (например, в виде таблеток, пастилок, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде тонкоизмельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде тонкоизмельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного или внутримышечного введения дозы или в виде суппозиториев для ректального введения).
Фармацевтическая композиция может быть получена обычными способами с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Таким образом, фармацевтическая композиция, предназначенная для перорального применения, может содержать, например, одну или несколько окрашивающих, подслащивающих, вкусовых добавок и/или консервант.
Соединения формулы 1 обычно вводят пациенту в единичной дозе в диапазоне 5-5000 мг/м2 площади тела, то есть примерно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Форма единичной дозы, такой как таблетка или капсула, обычно содержит, например, 1-250 мг активного ингредиента. Суточная доза обязательно будет варьироваться в зависимости от пациента, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно доктор, который лечит конкретного пациента, может определить оптимальную дозу. В данном описании термин "терапия" также включает "профилактику".
Соединение формулы 1, обладающее ингибирующей активностью по отношению к МЕK1, МЕK2 и МЕK1/2, может применяться при лечении заболеваний или медицинских состояний, опосредованных с МЕK1, МЕK2 и МЕK1/2 активностью, например при лечении рака. Типы рака, которые могут быть восприимчивы к лечению с помощью соединения формулы 1 или его фармацевтически приемлемых солей и/или сольватов, включают в себя, но не ограничиваются злокачественными меланомами.
Предметом настоящего изобретения является также лекарственное средство для лечения заболевания, опосредованного МЕK1, МЕK2 и МЕK1/2, включающее соединение формулы 1 в терапевтически эффективном количестве. Один из вариантов настоящего изобретения заключается в том, что указанное лекарственное средство предназначено для лечения заболевания, опосредованного МЕK1, МЕK2 и МЕK1/2, представляющего собой рак.
Предметом настоящего изобретения является также способ лечения заболевания, опосредованного через МЕK1, МЕK2 и МЕK1/2, включающий использование соединения формулы 1, как определено выше. Один из вариантов настоящего изобретения заключается в лечении заболевания, опосредованного МЕK1, МЕK2 и МЕK1/2, представляющего собой рак.
В соответствии с другим аспектом настоящего изобретения предлагается использование соединения формулы 1, как определено выше, для изготовления лекарственного средства для лечения рака путем смешения соединения формулы 1 в терапевтически эффективном количестве с фармацевтически приемлемым наполнителем.
В соответствии с другим аспектом настоящего изобретения предложен также способ получения противоракового эффекта у пациента, нуждающегося в таком лечении, который включает введение указанному пациенту эффективного количества соединения формулы 1.
В соответствии с другим аспектом настоящего изобретения предложен также способ лечения человека, страдающего от заболевания, при котором ингибирование МЕK1/2 является полезным, способ содержит этапы по введению человеку, нуждающемуся в этом, терапевтически эффективного количества соединения формулы 1. В частности, заболеванием, при котором полезно ингибирование МЕK1, МЕK2 и МЕK1/2, является рак.
В любом из аспектов или вариантов, упомянутых здесь, где рак указан в общем смысле, указанный рак может быть выбран из опухоли головного мозга (нейроглиомы, имеющей компонент злокачественной астроглиомы и олигодендроглиом и т.п.), рака пищевода, рака желудка, рака печени, рака поджелудочной железы, колоректального рака (рака толстой кишки, рака прямой кишки и т.д.), рака легкого (немелкоклеточного рака легкого, мелкоклеточного рака легкого, первичных и метастатических раковых плоскоклеточных и т.д.), рака почки, рака молочной железы, рака яичников, рака предстательной железы, рака кожи, нейробластомы, саркомы, остеохондромы, остеомы, остеосаркомы, семиномы, внегонадных опухолей, опухоли яичка, рака матки (рака шейки матки, рака эндометрия и т.п.), рака головы и опухоли шеи (гайморовой пазухи, рака гортани, рака глотки, рака языка, рака внутриротовых органов и т.п.), множественной миеломы, злокачественной лимфомы (ретикулосаркомы, лимфосаркомы, болезни Ходжкина и т.п.), истинной полицитемии, лейкоза (острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфолейкоза, хронического лимфоцитарного лейкоза и т.д.), зоба, рака таза, опухоли мочеточника, опухоли мочевого пузыря, рака желчного пузыря, рака желчных протоков, злокачественной меланомы, детской опухоли (саркомы семьи Юинга, опухоли Вильмса, рабдомиосаркомы, сосудистой саркомы, эмбрионального рака яичка, нейробластомы, ретинобластомы, гепатобластомы, нефробластомы и т.д.) и тому подобного.
Описанное выше лечение раковых заболеваний может применяться в качестве единственной терапии или может включать в дополнение к соединению по настоящему изобретению обычную хирургию, или лучевую терапию, или химиотерапию, или иммунотерапию. Такая химиотерапия может вводиться одновременно, последовательно или раздельно и может включать дополнительно один или более из следующих категорий противоопухолевых агентов: антипролиферативные/противоопухолевые препараты и их комбинации, используемые в медицинской онкологии; цитостатические агенты; агенты антивторжения; ингибиторы функции фактора роста; антиангиогенные агенты; сосудистые средства; повреждающие антагонисты рецепторов эндотелина; антисмысловые терапии; подходы генной терапии и подходы (J) иммунотерапии.
Таким образом, согласно настоящему изобретению предложена фармацевтическая композиция, включающая соединение формулы 1 и дополнительное противоопухолевое вещество, как определено выше, для совместного лечения рака.
Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая соединение формулы 1 и дополнительно противоопухолевое вещество, как определено выше, для комбинированного лечения рака.
Термин "совместное лечение", используемый по отношению к комбинированной терапии, следует понимать как одновременное, раздельное или последовательное введение.
Согласно изобретению предлагается использование соединения формулы 1 и дополнительно противоопухолевого вещества для совместного лечения рака.
Данное изобретение поясняется чертежами.
Фиг. 1. Динамика изменения веса тела животных в процессе лечения исследуемыми препаратами.
Фиг. 2. Динамика роста опухолей меланомы линии А375 в модели ксенографтов при лечении Мекинистом и соединением формулы 1.
Далее изобретение будет описано более подробно с помощью конкретных примеров. Следующие примеры представлены с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области техники легко поймут различные некритические параметры, которые могут быть изменены или модифицированы, чтобы дать, по существу, те же результаты.
Пример 1. Способ получения N-{3-[3-циклoпpoпил-5-(2-фтopo-4-иoдoфeнилaминo)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольвата
К раствору 1-(3-аминофенил)-3-циклопропил-5-{(2-фторо-4-иодофенил)амино}-6,8-диметилпиридо[4,3-d]пиримидин-2,4,7(1Н,3Н,6Н)-триона формулы 2 (500 мг, 0,87 ммоль) и диизопропилэтиламина (225 мг, 1,74 ммоль) в 5 мл диметилформамида при комнатной температуре добавили циклопропилкарбонилхлорид (182 мг, 1,74 ммоль) и перемешивали реакционную массу в течение ночи. По завершении реакции отогнали растворитель в вакууме, остаток растворили в 5 мл дихлорметана и промыли последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой отделили и высушили над безводным сульфатом натрия в течение ночи, профильтровали и фильтрат упарили в вакууме. Продукт выделяли с помощью флэш-хроматографии на силикагеле, используя в качестве элюента дихлорметан и смесь дихлорметана с этилацетатом (1:1). Сырой продукт (250 мг) растворяли в 1,3 мл диметилсульфоксида при 70°С и перемешивали раствор в течение 1 часа, а затем охлаждали до комнатной температуры и перемешивали в течение ночи. Образовавшийся осадок отфильтровывали, промывали на фильтре дихлорметаном и высушивали в высоком вакууме при 40-50°С в течение 2 часов. Получали N-{3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил}-циклопропанкарбоксамида диметилсульфоксида сольват (130 мг, 48%) в виде белого кристаллического порошка.
1H-NMR (CDCl3, 400 MHz): 0,79 (m, 2Н), 0,86 (m, 2Н), 1,05-1,15 (m, 4Н), 1,44 (s, 3Н), 1,5 (m, 1Н), 2,62 (s, 6H), 2,74 (m, 1H), 3,21 (s, 3H), 6,7 (t, 1H), 7,03 (m, 1H), 7,31-7,4 (m, 2H), 7,45 (d, 1H), 7,53 (d, 1H), 7,65 (s, 1H), 7,71 (s, 1H), 11,3 (s, 1H).
Пример 2. Определение термодинамической растворимости соединения формулы 1 и прототипа Траметиниб (Trametinib)
Смешивали 5 мг исследуемого соединения с 1 мл универсального буфера (Pion Ltd) с рН=2,0; 4,0 или 7,0 в течение 15 мин при 25°С. Дополнительные количества веществ добавляли до тех пор, пока раствор не становился мутным. Виалы с раствором инкубировали при перемешивании в течение 24 ч при 25°С для достижения равновесия между раствором и осадком при насыщении. После уравновешивания 200 мкл раствора (в 2-х повторах) фильтровали через 96-луночный фильтровальный планшет (Millipore) для отделения осадка. Концентрацию соединений в фильтрате определяли спектрофотометрически с помощью стандартной калибровочной кривой. Проводили измерение спектра оптического поглощения вещества и построение калибровочной кривой при выбранной длине волны (обычно соответствующей максимуму поглощения вещества λmax). Концентрацию вещества в фильтрате (т.е. растворимость) рассчитывали по нижеприведенной формуле:
Solubility = (ODλmax filtrate - ODλmax blank) / Slope × 1,67 × Filtrate dilution,
где
ODλmax filtrate - оптическая плотность фильтрата,
ODλmax blank - оптическая плотность холостого раствора без вещества,
Slope - наклон калибровочной кривой,
1,67 - фактор разведения фильтрата ацетонитрилом,
Filtrate dilution - фактор разведения фильтрата буфером.
Полученные результаты представлены в Таблице 1.
Пример 3. Анализ
Вещества тестировали по влиянию на активность киназы МЕK1 с помощью скрининговой платформы Z'-LYTE (Life Technologies). Концентрация ДМСО в реакционной смеси составляла 1%. 100 нл 100-кратных стоков исследуемых веществ в 100% ДМСО были разбавлены в 2,4 мкл киназного буфера (50 мМ HEPES рН 7,5, 0,01% BRIJ-35, 10 мМ MgCL, 1 мМ EGTA) и добавлены к 5 мкл 2-кратной смеси Субстрат/Киназа (МЕK1/инактивированная МАРK1(ЕRK2)/Ser/Тhr03, финальное содержание - 0,08-0,31 нг МЕK1, 105 нг инактивированной МАРK1 (ERK2) и 2 мкМ Ser/Thr03) в 384-луночном планшете (черные, малого объема, производство Corning, кат. #3676). Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 2,5 мкл 4-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси 100 мкМ). После 30 с инкубации на шейкере реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента В (Life Technologies), разбавленного 1:1024, и инкубировали еще 60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 400 нм и эмиссии при 445 и 520 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).
% фосфорилирования рассчитывается как
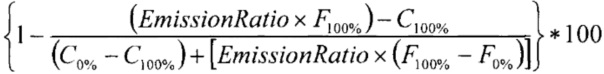 ,
,
% ингибирования рассчитывается как
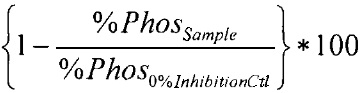
где
С100% = средний сигнал эмиссии кумарина, контроль 100% фосфорилирования;
С0% = средний сигнал эмиссии кумарина, контроль 0% фосфорилирования;
F100% = средний сигнал эмиссии флуоресцеина, контроль 100% фосфорилирования;
F0% = средний сигнал эмиссии флуоресцеина, контроль 0% фосфорилирования.
Пример 4. Исследование эффективности в модели ксенографтов меланомы человека
Исследование проведено в ProQinase GmbH Freiburg, Breisacher Str. 117, D-79106 Freiburg, GERMANY.
Клетки меланомы человека линии А375 наращивали во флаконах в среде DMEM с добавлением 10% FBS во влажной атмосфере при 95% воздуха и 5% СO2 при 37°С. После периода адаптации животным перевивали раковые клетки. Для этого клетки собирали с помощью TrypLE Express (Invitrogen), промывали и суспендировали в стерильном PBS до конечной концентрации клеток 3×107 клеток/мл. Полученную суспензию клеток ввели SC (подкожно) в левый бок мышам по 3×106 клеток (по 100 мкл) на мышь.
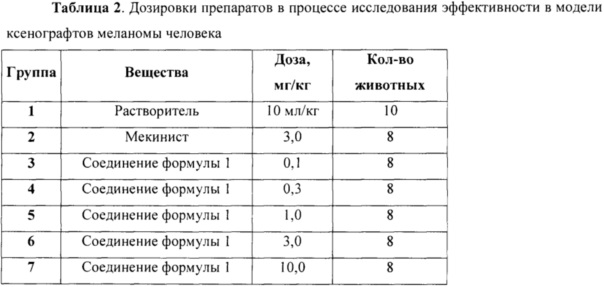
Когда средний размер опухолей достиг 100-200 мм3, животных разделили на экспериментальные группы и начали лечение исследуемыми препаратами. Препараты вводили внутрижелудочно, ежедневно, контрольная группа получала растворитель. Дозировки препаратов в процессе эксперимента представлены в Таблице 2.
Основные измеряемые параметры
Измерение подкожно имплантированных опухолей проводили 2 раза в неделю, начиная со дня введения клеток. Объем опухоли (мм3) определяли по формуле
V=L×W2/2,
где L соответствует наибольшему диаметру опухоли (мм), W - наименьшему (мм). Измерения проводили с помощью штангенциркуля.
В ходе исследования рассчитывали значения торможения роста опухоли
T/C=Vэксп/Vконтр*100%,
где Vконтр - средний объем опухолей в контрольной группе,
Vэксп - средний объем опухолей в экспериментальной группе.
Также следили за здоровьем и поведением животных, фиксировали число летальных исходов, количество регрессий опухолей
Регрессия=(Vи-Vт)/Vи*100%,
где Vи - объем исходной опухоли в начале лечения,
Vт - объем опухоли в конце лечения.
Измерение веса животных проводили 3 раза в неделю.
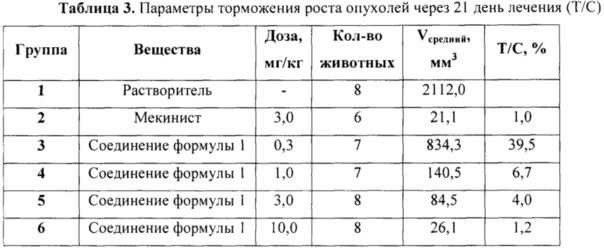
На Фиг. 2 представлена динамика роста опухолей меланомы линии А375 в модели ксенографтов при лечении Мекинистом и соединением формулы 1.
Соединение формулы 1 проявило дозозависимое подавление роста и регрессию опухолей, сравнимое по выраженности с эффектом Мекиниста. При этом в отличие от Мекиниста соединение формулы 1 не вызывало гибели животных ни в одной из исследованных доз (лечение Мекинистом привело к критическому снижению веса и гибели двух животных) и лишь умеренно снижало вес животных в максимальной исследованной дозе. Таким образом, можно предположить меньшую токсичность соединения формулы 1 по сравнению с Мекинистом без потери эффективности для лечения меланомы.
Пример 5. Приготовление лекарственного средства в виде таблеток
Смешивают 1600 мг крахмала, 1600 мг размолотой лактозы, 400 мг талька и 1000 мг ингибитора формулы 1 и прессуют в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в таблетки пригодных форм весом 500 мг каждая.
Пример 6. Приготовление лекарственного средства в виде капсул
Ингибитор формулы 1 тщательно смешивают с лактозой в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 600 мг в желатиновые капсулы подходящего размера.
Пример 7. Приготовление лекарственного средства в виде композиций для внутримышечных, внутрибрюшинных или подкожных инъекций
Смешивают 500 мг ингибитора формулы 1 и 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл воды для инъекций. Раствор фильтруют и помещают в 1 мл ампулы, которые укупоривают.
Специалисты в данной области техники легко поймут различные некритические параметры, которые могут быть изменены или модифицированы, чтобы получить те же результаты. Различные модификации изобретения, в дополнение к описанным здесь, станут очевидными специалистам в данной области техники из приведенного выше описания.
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/246b5bac200ebb524a0a581cba9c2915.jpg)
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/4246c8c77d14a2752825c366946453f9.jpg)
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/eab051e5856eee4eb461521c55ab127e.jpg)
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/af79c54d78244a72b3165cfdd336ef5b.jpg)
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/e6b40889da347415319d116715b8bf8f.jpg)
![N-{ 3-[3-циклопропил-5-(2-фторо-4-иодофениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]-фенил} -циклопропанкарбоксамида диметилсульфоксида сольват в качестве ингибитора МЕК1/2](https://fips.edrid.ru/images/rid/b6/79/d4/ffdf2f1fd2664cb418e9e10ac2dc8435.jpg)

