Результат интеллектуальной деятельности: Фармацевтическая композиция с противогрибковой активностью и способ ее получения
Вид РИД
Изобретение
Настоящая группа изобретений относится к медицине и фармацевтической промышленности, а именно к пероральным композициям, содержащим химические соединения с противогрибковыми свойствами, и способу их получения.
Известны вещества из ряда производных имидазола, обладающие противогрибковой активностью (клотримазол, кетоконазол, флуконазол). Известны также производные триазола, нафтифина, также обладающие противогрибковой активностью. Вышеуказанные фармацевтические субстанции применяются в виде как пероральных (таблетки, гранулы, капсулы), так и наружных (мази, кремы) лекарственных форм.
Синтезированное в СПХФА соединение - хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия (ТДЗ) - обладает высокой противогрибковой активностью [Заявка на патент 2009119977/04, 26.05.2009, патент РФ 2402550].
Токсичность этого соединения оставалась неизученной, что не позволяло рассматривать его как возможную субстанцию лекарственного средства. Пероральные лекарственные формы этого соединения в настоящее время неизвестны.
ТДЗ практически не растворим в воде и водных средах организма. Таблетки или гранулы, содержащие ТДЗ и полученные известными методами, практически не обладают свойством высвобождать активное вещество в водных средах, следовательно, не могут обеспечивать биодоступность и эффективность готовых препаратов.
Нерастворимость в воде субстанции сама по себе может и не быть причиной низкой биодоступности, т.к. существуют иные, в частности, липидные механизмы всасывания. Известны многие, в том числе противогрибковые, препараты, которые малорастворимы в воде, но, тем не менее, хорошо всасываются из ЖКТ и обеспечивают системный терапевтический эффект, например, гризеофульвин, кетоконазол (например, вспомогательные вещества: сахар молочный (лактоза), крахмал кукурузный, поливинилпиролидон низкомолекулярный (повидон), магния стеарат, кроссповидон, аэросил (кремния диоксид коллоидный), тербинафин.
При пероральном введении композиции с активным веществом происходят последовательно следующие физико-химические и физиологические процессы:
1) механическое разрушение (распадание) таблетки;
2) диффузия активного вещества из состава композиции в окружающую среду;
3) распределение активного вещества на поверхности клеток слизистой оболочки ЖКТ;
4) всасывание, т.е. проникновение молекул активного вещества через мембраны клеток ЖКТ и последующее поступление их в кровоток с распределением в организме.
Для водорастворимых активных веществ лимитирующей является 1-я стадия, т.е. распадаемость таблетки гарантирует биодоступность, правда, при условии достаточно высокой проникающей способности через клеточные мембраны.
Для водонерастворимых активных веществ лимитирующей является 2-я стадия, т.е. способность к высвобождению, диффузии активного вещества в окружающую среду, несмотря на низкую растворимость его в водных средах. На этой стадии активное вещество должно преодолеть межмолекулярное связывание и силы связывания с иными ингредиентами лекарственной формы и диффундировать в окружающую жидкость с последующим транспортом к мембранам клеток слизистой оболочки.
Принятый в фармацевтической практике тест «Растворение» не позволяет оценить высвобождение малорастворимых лекарственных веществ, т.к. основан фактически на измерении концентраций лекарственного вещества в водной среде после фильтрации образца. При этом активное вещество остается на фильтре и в фильтрат не проходит.
Известен метод количественного определения концентрации антибиотических веществ, который основан на диффузии вещества в агаризованную питательную среду, засеянную тест-культурой, с последующим измерением зон задержки роста (ГФXII, ОФС 42-0068-07, с. 197-211). Растворы образцов, содержащих антибиотик, для количественного анализа готовят следующим образом: навеску образца растворяют в подходящем растворителе, например, в диметилсульфоксиде. Затем раствор разводят нейтральным фосфатным буфером до концентраций, близких к активным. Разведенные растворы вносят в лунки; чашки помещают в термостат при 30°С на период, достаточный для отчетливого роста тест-культуры (обычно для Candida utilis 1 сутки). Измеряют наблюдаемые зоны задержки роста и производят расчет.
Метод диффузии в агаризованную среду использован нами для определения диффузионной активности как параметра биодоступности малорастворимых антибиотических веществ.
В целом процедура похожа на количественное определение антибиотиков, но отличие методики определения диффузионной активности испытуемой композиции заключается в том, что навеску фармацевтической композиции (ФК) не растворяют и не выделяют из нее антибиотическое вещество, а закладывают в лунку в полном составе, т.е. порошок растертой таблетки или гранул. В этом случае диаметр зон задержки роста зависит не столько от количественного содержания ТДЗ в таблетке, сколько от его высвобождения, т.е. от диффузии активного вещества в засеянную питательную среду. Площадь зоны задержки роста коррелирует с количеством высвободившегося и диффундировавшего в среду активного вещества.
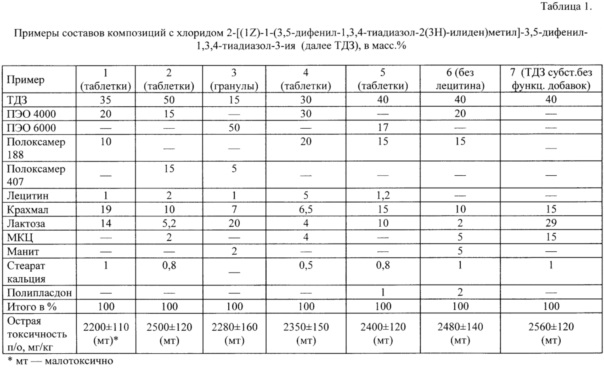
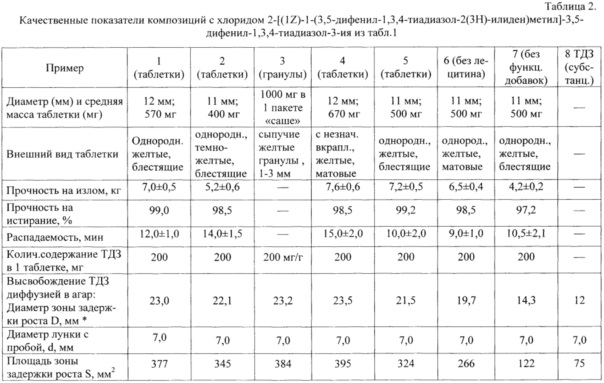
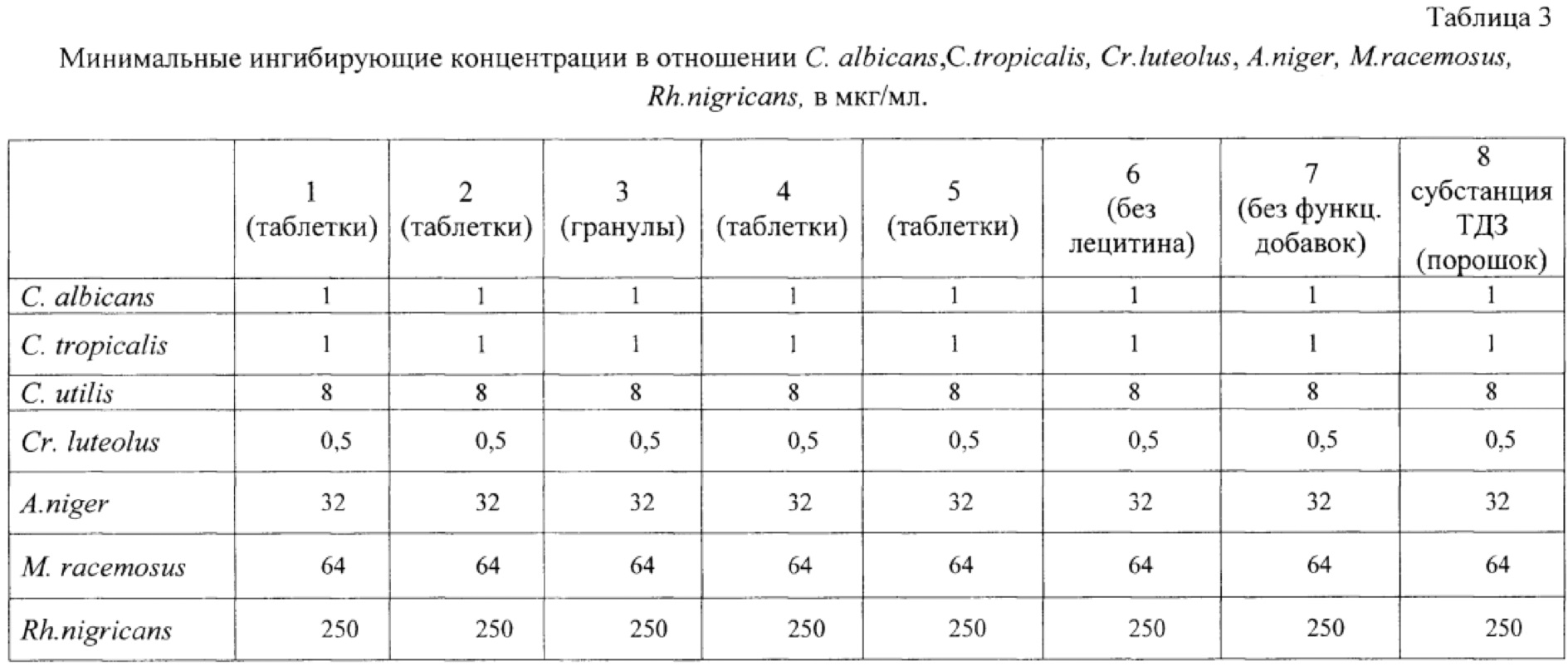
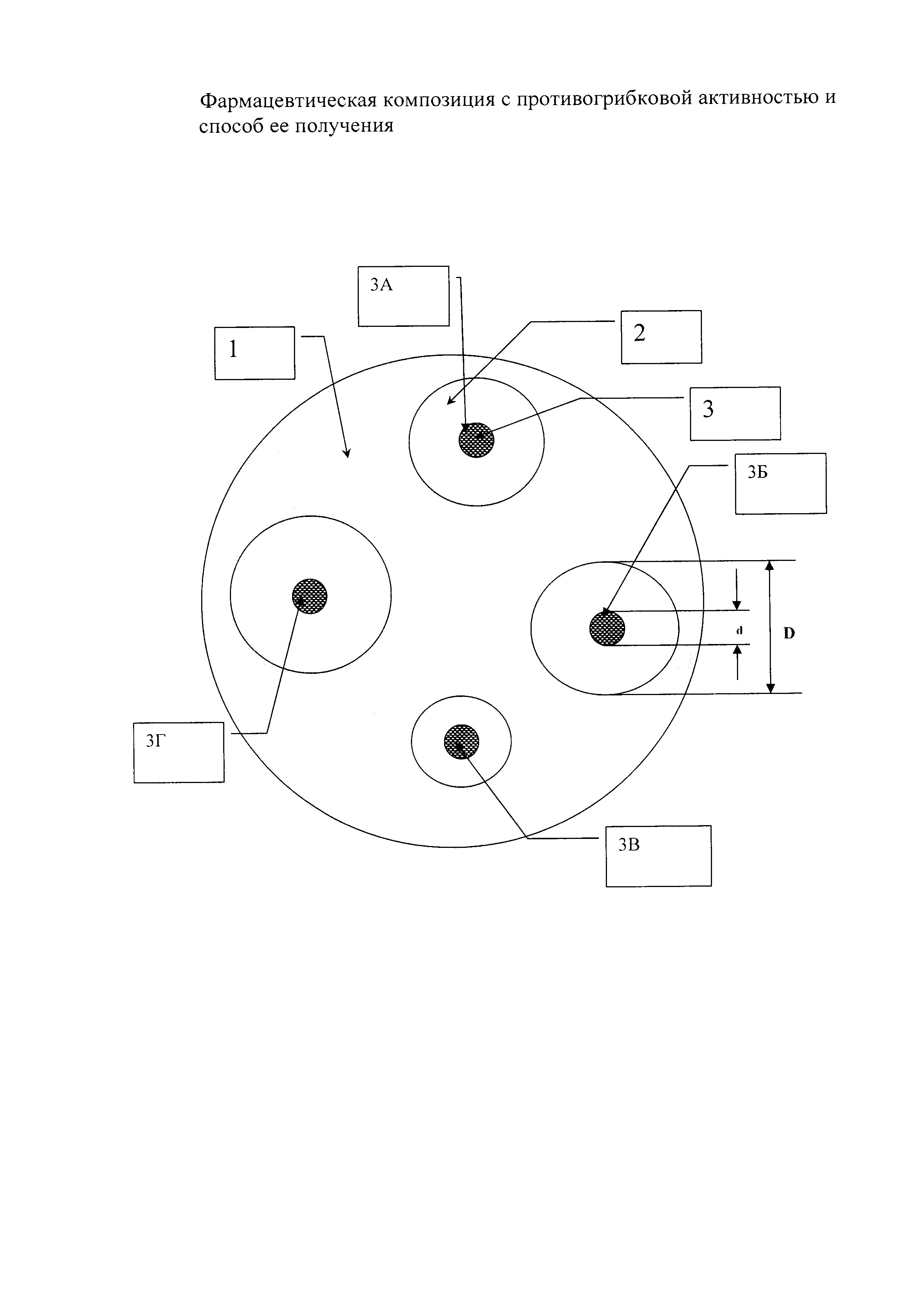
На рисунке приведена схема опыта по определению диффузии ТДЗ в питательную среду, засеянную тест-микробом Candida utilis (C. utilis), где
1 - Рост тест-культуры С. utilis;
2 - Зона задержки роста тест-культуры;
3 - Лунка с испытуемым образцом:
3А - Гранулы ФК,
3Б - Таблетки ФК, вариант 3,
3В - Субстанция ТДЗ,
3Г - Таблетки ФК, вариант 1.
Площадь зоны задержки роста (S) определяют по формуле:
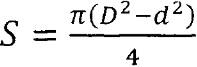 , где
, где
D - диаметр зоны задержки роста;
d - диаметр лунки с внесенным образцом.
Как видно из рисунка, диаметры зон задержки роста для образцов заявляемой композиции значительно больше, чем зоны задержки роста для ТДЗ-субстанции. Вычисленные значения площадей зон задержки роста представлены в таблице 2, откуда видно, что композиции с ТДЗ, содержащие дополнительно полиэтиленоксид, полоксамер и лецитин существенно превосходят субстанцию ТДЗ по степени высвобождения активного вещества.
Известно, что с целью оптимизации свойств в составы таблеточных форм разных препаратов вводят полоксамеры или полиэтиленоксиды.
Например, в патенте RU 2445963 (Фармацевтическая противодиабетическая композиция) для получения таблеток противодиабетического средства на основе глимепирида предложено наряду с рядом фармацевтически приемлемых ингредиентов дополнительно вводить полоксамер и натрия кроскармеллозу.
Задачей такого изобретения являлось создание противодиабетического препарата на основе глимепирида в виде твердой лекарственной формы, с оптимальным сочетанием вспомогательных веществ, проявляющего высокую терапевтическую активность и имеющего срок годности более 2 лет.
При этом введение полоксамера в сочетании с кроскармеллозой натрия по заявленному результату повышает прочность таблетки и стабилизирует качество по показателю «Растворение» препарата глимепирид.
Тест «Растворение», как было указано выше, для ТДЗ непригоден.
Известна фармацевтическая композиция, включающая полоксамер и полиэтиленоксид (ПЭО), в которую полоксамер вводят в виде водного раствора или в расплавленном состоянии [Пат. 2191578 РФ. Твердая фармацевтическая композиция, содержащая производные бензофурана].
Задачей этого изобретения являлась разработка фармацевтической композиции для перорального введения, характеризующихся низкой растворимостью в водной среде дронедарона, амиодарона или их фармацевтически приемлемых солей, способной избежать осаждения действующего начала в нейтральной среде и снизить изменчивость всасывания этого действующего начала в плазму, т.е. обеспечить приемлемую биодоступность независимо от присутствия пищи.
Авторы отмечают, что в настоящее время неожиданно обнаружилось, что сочетание неионогенного гидрофильного ПАВ (полоксамера) с дронедароном, амиодароном или их фармацевтически приемлемыми солями позволяет поддерживать солюбилизацию действующего начала в нейтральной среде и снижать изменчивость его всасывания в кровь у человека.
В то же время предварительно проведенные на собаках исследования не показали, что неионогенное гидрофильное ПАВ способно повысить биодоступность гидрохлорида дронедарона натощак и в то же время снизить изменчивость всасывания этого действующего начала в плазму.
Это наблюдение удивительно и только подтверждает невозможность однозначных предположений о свойствах лекарственной формы в зависимости от сочетания действующего и вспомогательных веществ.
Согласно вариантам способа получения композиции по №2191578:
а) все ингредиенты, в том числе действующее начало, смешивают вместе на начальной стадии, за исключением ПАВ и смазывающего вещества, и далее процесс продолжают операциями увлажнения водным раствором ПАВ, гранулирования, высушивания, разделения по размерам, опудривания и таблетирования или прямого заполнения желатиновых капсул;
или
б) все ингредиенты, в том числе действующее начало и ПАВ, смешивают вместе на начальной стадии, за исключением связывающего и смазывающего веществ, затем процесс продолжают операциями увлажнения водным раствором связывающего вещества, гранулирования, высушивания, разделения по размерам, опудривания и таблетирования или прямого заполнения желатиновых капсул.
Также эти способы могут быть изменены включением способа непрерывного гранулирования, при котором используется метод псевдоожиженного слоя на стадии операции увлажнения.
Кроме того, возможно использование способа, при котором все ингредиенты смешивают вместе на начальной стадии, за исключением смазывающего вещества, которое нагревают до температуры примерно от 60 до 65°С. Затем выполняют операции горячего гранулирования, разделения по размерам, после чего следует охлаждение, опудривание и таблетирование или прямое заполнение желатиновых капсул.
Согласно методу сухого гранулирования все ингредиенты, в том числе и действующее начало и ПАВ, сначала смешивают вместе, за исключением смазывающего вещества, а потом процесс продолжают операциями просеивания, прессования, разделения по размерам, опудривания и таблетирования или прямого заполнения желатиновых капсул.
Наконец, способ можно осуществить путем прямого таблетирования, используя следующую последовательность операций: смешивание ингредиентов, включая действующее начало и ПАВ, за исключением смазывающего вещества, затем просеивание и смешивание, затем опудривание и, наконец, таблетирование или прямое заполнение желатиновых капсул.
Наши исследования показали, что описанные способы введения полоксамера или полиэтиленгликоля не влияют на улучшение растворения ТДЗ из таблеток или гранул.
В ходе исследования композиций с ТДЗ и испытаний получаемых таблеток было установлено, что при введении в состав применяемых в аналогах солюбилизаторов, таких как твин 80, кремафоры, полимеры и сополимеры окиси этилена и окиси пропилена, и прочих вспомогательных веществ, при проведении теста «Растворение» в соответствии с USP, ГФ XI, ГФ XIII, ТДЗ в раствор практически не переходит, что вполне объясняется водонерастворимостью этого вещества.
Для производных тиадиазола пероральные композиции с противогрибковой активностью, содержащие полоксамеры или полиэтиленоксиды, неизвестны и неизвестен, соответственно, способ создания лекарственной формы.
Задачей данного предполагаемого изобретения является разработка состава и способа получения перорального препарата - таблеток или гранул на основе ТДЗ, обладающего противогрибковой активностью, способного высвобождать активное вещество путем диффузии в окружающую среду.
Задача решается тем, что фармацевтическая композиция с противогрибковой активностью в виде таблеток или капсул содержит хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия (ТДЗ) в качестве активного компонента, полиэтиленоксид, полоксамер, лецитин и фармацевтически приемлемые вспомогательные вещества при следующем соотношении компонентов, масс. %:
|
Задача решается также тем, что фармацевтическая композиция в качестве фармацевтически приемлемых вспомогательных веществ включает крахмал, лактозу, манит, дезинтегранты, антифрикционные и скользящие вещества, принятые в фармацевтической технологии.
Задача решается также тем, что фармацевтическая композиция может быть выполнена в виде таблеток или капсул с терапевтически эффективной дозой активного компонента.
Осуществленные примеры составов приведены в таблице 1.
Задача решается также тем, что способ получения указанной фармацевтической композиции с противогрибковой активностью в виде таблеток или капсул характеризуется тем, что хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия растворяют в летучем органическом растворителе, к раствору прибавляют полиэтиленоксид, лецитин и полоксамер, перемешивают, прибавляют фармацевтически приемлемые вспомогательные вещества, смесь компонентов в указанных соотношениях высушивают, гранулируют и получают таблетки или капсулы.
Задача решается также тем, что по указанному способу получения фармацевтической композиции в качестве фармацевтически приемлемых вспомогательных веществ используют крахмал, лактозу, маннит, дезинтегранты, антифрикционные и скользящие вещества, принятые в фармацевтической технологии.
Задача решается также тем, что по указанному способу получения фармацевтической композиции в качестве летучего органического растворителя используют этиловый спирт, изопропиловый спирт, хлористый метилен или их смеси.
Введенные в состав композиции ТДЗ, полиэтиленоксид, полоксамер и лецитин, а также фармацевтически приемлемые наполнители, например, крахмал, лактозу, маннит, магния стеарат, полипласдон, придают таблетной массе прессуемость и сыпучесть, а полученным таблеткам - требуемые прочность, распадаемость и фармакопейный внешний вид.
Решение задачи обеспечивается также тем, что ингредиенты вводятся в определенном экспериментально найденном соотношении.
Сущность предполагаемых изобретений:
В ходе исследований изучали влияние состава композиций с ТДЗ на высвобождение ТДЗ методом диффузии в агаризованную питательную среду, засеянную тест-культурой Candida utilis (рис.).
При этом неожиданно было установлено (и этим решается задача), что при введении в состав ТДЗ путем предварительного растворения в подходящем растворителе, а именно, в этиловом, изопропиловом спирте или хлористом метилене, или их смесях, смешении раствора с полоксамером, полиэтиленоксидом и лецитином, последующем увлажнении этой смесью фармацевтических наполнителей (крахмала, лактозы, маннита, микрокристаллической целлюлозы), высушивании и гранулировании полученной смеси, образуются гранулы размером от 0,5 до 3 мм, которые затем, после введения опудривающих компонентов (стеарата магния, полипласдона), могут быть спрессованы в таблетки либо расфасованы в желатиновые капсулы или пакеты «саше».
Таблетки и гранулы вышеуказанных составов проявили достоверно и значительно более высокую диффузионную способность, чем композиции без полоксамера, полиэтиленоксида и лецитина (табл. 2). Оказалось также, что на диффузионную активность, т.е., на высвобождение ТДЗ, влияет соотношение ингредиентов; при этом экспериментально были найдены пределы относительных количеств ТДЗ, полоксамера, полиэтиленоксида и лецитина, при которых эффект высвобождения ТДЗ из композиции наблюдается в наиболее выраженной степени, масс. %:
|
При этом также достигается достаточная для таблетной массы сыпучесть и прессуемость, а для таблеток - однородность, прочность, распадаемость и внешний вид таблетки.
Техническими результатами заявляемых изобретений являются:
Создание композиции и способа ее получения.
Увеличение высвобождения активного вещества из таблетки или порошка растертых гранул, измеренное по площади зоны задержки роста тест-культуры Candida utilis по сравнению с зонами задержки роста, образуемыми субстанцией ТДЗ и фармацевтическими композициями ТДЗ с известными наполнителями, не содержащими полоксамера, полиэтиленоксида и лецитина.
Получение таблеток, соответствующих фармакопейным требованиям, в том числе прочности, распадаемости, внешнего вида.
Достижение технического результата доказывается определением высвобождения путем сравнения площадей зон задержки роста при диффузии в агаризованную среду, а также прочности, растворения и распадаемости таблеток в соответствии с фармакопейными методиками.
Изобретение характеризуется следующими примерами.
Пример 1. Получение фармацевтической композиции в виде таблеток
В колбе вместимостью 250 мл при перемешивании растворяют 10 г ТДЗ в 50 мл этилового спирта. К раствору при перемешивании прибавляют 5,7 г ПЭО 4000; 2,86 г полоксамера 188; 0,286 г лецитина; перемешивают при (50±10)°С. К полученной смеси прибавляют 5,43 г крахмала картофельного подсушенного и 4,0 г лактозы. К колбе присоединяют холодильник и отгоняют растворитель под вакуумом водоструйного насоса при температуре бани (50-60)°С. Влажную смесь выгружают и распределяют на поддоне, затем высушивают в вакуум-сушильном шкафу при (50-60)°С. Сухую массу протирают через сито с величиной отверстий 1,5 мм и опудривают с добавлением 0,25 г стеарата кальция.
Прессуют таблетки диаметром 12 мм, средней массой (570±10) мг. Каждая таблетка содержит (200±10) мг ТДЗ. Эффективная доза в таблетке установлена на основании предварительных оценок эффективности и соответствует дозам аналогичных противогрибковых препаратов ряда имидазола - кетоконазола, флуконазола, клотримазола.
Выход в пересчете на ТДЗ составляет 87%.
Пример 2. Получение фармацевтической композиции в виде гранул
Смесь ТДЗ, ПЭО, полоксамера и лецитина получают так, как описано в примере 1. Для приготовления смеси берут 15 г ТДЗ, 50 г ПЭО 6000, 5 г полоксамера 407, 1 г лецитина. После частичной отгонки растворителя к влажной смеси прибавляют 20 г лактозы, 7 г крахмала картофельного и 2 г маннита. Массу перемешивают, гранулируют через сито 3 мм и высушивают в сушилке псевдоожиженного слоя. Сухой гранулят фракционируют на сите 3 мм, отбирая фракцию 0,5-3 мм. Мелкий порошок, отсеянный через сито 0,5 мм, присоединяют для гранулирования к следующей партии продукта.
Гранулы размером 0,5-3,0 мм фасуют по 1,00 г в однодозовые упаковки типа «саше». 1 упаковка содержит (200±15) мг ТДЗ.
Выход в пересчете на ТДЗ с учетом возвращения в производство тонкой фракции составляет 90%.
Пример 3. Экспериментальное определение высвобождения ТДЗ из таблетки методом диффузии в агаровую среду, засеянную тест-культурой Candida utilis
Готовят чашки Петри, засеянные питательной средой с тест-культурой С. utilis, как описано в ГФXII, ОФС 42-0068-07, стр. 197-211. В чашке делают лунки (см. рисунок). В лунки вносят навески сухого порошка растертых таблеток. Масса навески выбирается такой, чтобы каждая навеска содержала одинаковое количество ТДЗ-10 мг. Закрытые чашки помещают в термостат с температурой 30°С на 24 часа. Затем чашки извлекают, измеряют диаметры зон задержки роста D и рассчитывают площадь зон задержки роста S по формуле. Каждую пробу делают в 6 повторностях, диаметр D вычисляют как среднее из 6 измерений.
Как видно из представленных испытаний опытных образцов заявляемых композиций (табл. 2), наибольшее высвобождение, т.е. наибольшую противогрибковую активность проявляют образцы 1-5, в составы которых входят, помимо ТДЗ, функциональные добавки: полиэтиленоксид, полоксамер и лецитин. Вариант 6, который не содержит лецитина, но содержит полиэтиленоксид и полоксамер, проявляет несколько меньшую активность. Вариант 7 - контрольный, содержащий традиционные в фармацевтической технологии наполнители, но не содержащий полиэтиленоксида, полоксамера и лецитина, образует гораздо меньшую зону задержки роста, что свидетельствует о гораздо меньшей степени высвобождения и активности.
Таким образом, проведенный тест доказывает, что введение в состав определенных функциональных добавок - полиэтиленоксида, полоксамера и лецитина в экспериментально найденных соотношениях - существенно увеличивает степень высвобождения ТДЗ в окружающую питательную среду, следовательно, может обеспечить более высокую биологическую активность по сравнению с субстанцией ТДЗ или композициями, содержащими ТДЗ с традиционными фармацевтическими наполнителями. При этом существенное значение имеет способ получения композиции.
Пример 4. Определение противогрибковой активности
Противогрибковую активность в отношении дрожжей рода Candida albicans, Candida tropicalis, Criptococus luteolus и мицелиальных грибов Aspergillus niger, Mucor racemosus, Rhizopus nigricans определяли методом серийных разведений в жидких питательных средах.
Для получения конидий гриба A. niger, М. racemosus, Rh. nigricans проводили смыв с пятисуточной культуры, выращенной на плотной питательной среде Сабуро или среде №2 фосфатным буферным раствором с 0,05% твина-80 [Государственная Фармакопея РФ XII. М.: Научный центр экспертизы средств медицинского применения, 2007. С. 1039-1049]. Определяли количество конидий в 1 мл смыва, используя камеру Горяева, и разводили до концентрации 106 КОЕ/мл.
В ряд пробирок наливали по 1 мл среды Сабуро. В первую пробирку вносили 1 мл раствора исследуемого соединения и проводили последовательные разведения в ряду пробирок (перенося по 1 мл из предыдущей в последующую), после чего в каждую пробирку ряда вносили по 0,1 мл микробной взвеси (микробная нагрузка составляла 105 клеток/мл), пробирки культивировали при 30°С 24 часа (для дрожжей рода Candida spp. и Cr. luteolus) и 72 часа (для мицелиальных грибов A. niger, М. racemosus, Rh. nigricans).
Из пробирки, где не наблюдали роста культуры, делали высев в чашки Петри на агаризованную среду Сабуро для С albicans, С. tropicalis, Cr. luteolus, A. niger, M.racemosus, Rh. nigricans. Чашки культивировали при 30°С 24 часа (72 часа для A. niger, М. racemosus, Rh. nigricans).
Как видно из результатов, представленных в табл. 3, полиэтиленоксид, сополимер окиси этилена и окиси пропилена (полоксамер), лецитин и фармацевтически приемлемые наполнители не уменьшают активность субстанции хлорида 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия.
Пример 5. Определение острой токсичности
Хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия вводили в организм. Исследования проведены на беспородных мышах в соответствии с принятыми международными правилами и протоколами. В результате эксперимента установлено:
1. Величина LD50 для мышей обоего пола при подкожном введении превышает 2000 мг/кг;
2. При внутрижелудочном введении величина LD50 для мышей самцов составила 2780±170 мг/кг, для самок - 2280±190 мг/кг;
3. При внутрибрюшинном введении величина LD50 для мышей самцов составила 167±26 мг/кг, для самок - 129±11 мг/кг.
4. Тестируемое вещество оказалось более токсичным для мышей самок при пероральном и внутрибрюшинном введении по сравнению с самцами (различия достоверные).
В соответствии с градацией Hodge и Sterner тестируемая фармацевтическая субстанция может быть отнесена к малотоксичным веществам.
Пример 6. Определение острой токсичности при пероральном введении фармацевтической композиции с ТДЗ
Фармацевтические композиции на основе хлорида 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия вводили в организм. Исследования проведены на беспородных мышах самцах в соответствии с принятыми международными правилами и протоколами при внутрижелудочном введении, что соответствует целевому пути введения препарата. В результате эксперимента установлено:
При внутрижелудочном введении фармацевтических композиций величина LD50 для мышей самцов составила от 2200±110 до 2560±120 мг/кг, что позволяет говорить об их малой токсичности, используя градацию Hodge и Sterner.
При пероральном введении фармацевтической композиции, содержащей субстанцию хлорид 2-[(1Z)-1-(3,5-дифенил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-дифенил-1,3,4-тиадиазол-3-ия, расчет дозы производили в пересчете на субстанцию.