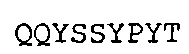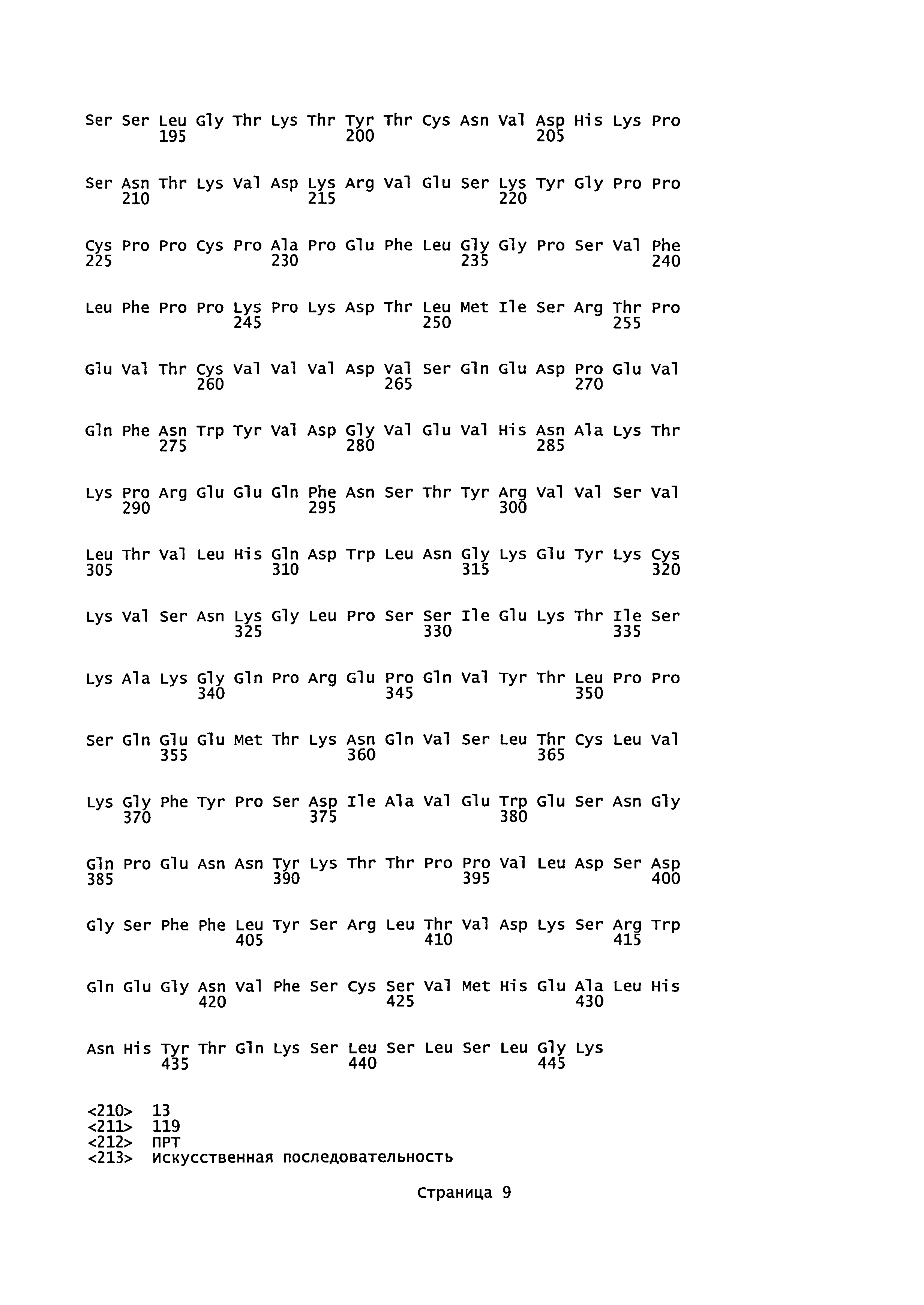Результат интеллектуальной деятельности: Конъюгаты "антитело-лекарственное средство"
Вид РИД
Изобретение
ОБЛАСТЬ ПРИМЕНЕНИЯ
В целом, настоящее изобретение относится к конъюгатам «антитело против 5Т4-лекарственное средство» для лечения рака.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Конъюгаты «антитело-лекарственное средство» (ADC) сочетают специфичность связывания моноклональных антител с активностью химиотерапевтических агентов. Технологии, связанные с разработкой моноклональных антител к опухоль-ассоциированным молекулам-мишеням, применением более эффективных цитотоксических агентов и разработкой химических линкеров для ковалентного связывания этих компонентов, быстро развивались в последние годы (Ducry L., et al. Bioconjugate Chemistry, 21:5-13, 2010).
Перспективные ADC, такие как SGN-75 (US 2009/148942) и трастузумаб-DM1 (US 2009/0226465) в настоящее время проходят клинические испытания. Тем не менее, в связи с рассмотрением других опухоль-ассоциированных антигенов в качестве мишеней сохраняется множество проблем. Необходимо по отдельности описывать каждое моноклональное антитело, разрабатывать подходящий линкер и определять подходящий цитотоксический агент, сохраняющий свою активность при доставке в опухолевые клетки. Необходимо принимать во внимание плотность антигена на раковой мишени и то, экспрессируют ли нормальные ткани антиген-мишень. Другие факторы, которые следует иметь в виду, включают следующее: происходит ли полная интернализация ADC при связывании с мишенью; какое лекарственное средство, цитостатическое или цитотоксическое, является предпочтительным с учетом возможного воздействия на нормальные ткани, и/или тип и стадию рака, по поводу которого проводят лечение; и какую связь, расщепляемую или нерасщепляемую, обеспечивает линкер, соединяющий антитело с лекарственным средством. Кроме того, соотношение антитела и группировки лекарственного средства при конъюгации должно быть достаточным без снижения связывающей активности антитела и/или активности лекарственного средства. Очевидно, что ADC являются сложными биологическими агентами и проблемы разработки эффективного ADC сохраняют свою значимость.
Опухоль-ассоциированный человеческий антиген 5Т4 представляет собой антиген-мишень по настоящему изобретению. Недавно были показаны высокие уровни экспрессии антигена 5Т4 на определенных высокоонкогенных клетках, также называемых опухоль-инициирующими клетками (WO 2010/111659). Опухоль-инициирующие клетки демонстрируют устойчивость к стандартной терапии, и полагают, что они приводят к рецидивированию и метастазированию и поэтому являются еще одним препятствием развитию ADC.
Новые ADC против 5Т4 по настоящему изобретению позволяют решить проблемы, связанные с ADC-технологиями, и обеспечивают высокоспецифичные и активные ADC, связывающиеся с опухолевыми клетками, экспрессирующими антиген 5Т4, и доставляющие достаточное количество цитотоксического лекарственного средства в клетки, обеспечивая посредством этого инновационное и эффективное лечение рака.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении конъюгат «антитело-лекарственное средство» по настоящему изобретению имеет формулу Ab-(LU-D)p или представляет собой ее фармацевтически приемлемую соль, где Ab представляет собой антитело против 5Т4 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи, имеющую область VH CDR1 (определяющую комплементарность область 1 вариабельной области тяжелой цепи), как показано в SEQ ID NO: 5, область VH CDR2, как показано в SEQ ID NO: 6, и область VH CDR3, как показано в SEQ ID NO: 7; LU представляет собой линкерную единицу, выбранную из группы, состоящей из малеимидокапроила и малеимидокапроил-Val-Cit-PABA; p представляет собой целое число от приблизительно 1 до приблизительно 8; и D представляет собой структурную единицу лекарственного средства, выбранную из группы, состоящей из MMAE (монометилауристатин E), MMAF (монометилауристатин F) и MMAD (монометилауристатин D).
Согласно настоящему изобретению также предложены конъюгаты «антитело против 5Т4-лекарственное средство», где указанные антитело против 5Т4 или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, имеющую (а) область VH CDR1, как показано в SEQ ID NO: 5, (б) область VH CDR2, как показано в SEQ ID NO: 6, и (в) область VH CDR3, как показано в SEQ ID NO: 7.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где указанные антитело против 5Т4 или его антигенсвязывающий фрагмент содержат вариабельную область легкой цепи, имеющую (а) область VL CDR1 (вариабельной области легкой цепи), как показано в SEQ ID NO: 8, (б) область VL CDR2, как показано в SEQ ID NO: 9, и (в) область VL CDR3, как показано в SEQ ID NO: 10.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где указанные антитело против 5Т4 или его антигенсвязывающий фрагмент дополнительно содержат вариабельную область тяжелой цепи, имеющую: (а) область VH CDR1, как показано в SEQ ID NO: 5, (б) область VH CDR2, как показано в SEQ ID NO: 6, и (в) область VH CDR3, как показано в SEQ ID NO: 7; и вариабельную область легкой цепи, имеющую (а) область VL CDR1, как показано в SEQ ID NO: 8, (б) область VL CDR2, как показано в SEQ ID NO: 9, и (в) область VL CDR3, как показано в SEQ ID NO: 10.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где указанные антитело против 5Т4 или его антигенсвязывающий фрагмент содержат область VH по SEQ ID NO: 3 и область VL по SEQ ID NO: 4.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где указанное антитело против 5Т4 состоит из тяжелой цепи, имеющей SEQ ID NO: 1, и легкой цепи, имеющей SEQ ID NO: 2.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где:
(а) указанное антитело против 5Т4 состоит из тяжелой цепи, имеющей SEQ ID NO: 1, и легкой цепи, имеющей SEQ ID NO: 2, (б) указанная LU представляет собой малеимидокапроил, (в) указанное лекарственное средство представляет собой MMAF, и (г) p представляет собой целое число, составляющее приблизительно 4.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где:
(а) указанное антитело против 5Т4 состоит из тяжелой цепи, имеющей SEQ ID NO: 1, и легкой цепи, имеющей SEQ ID NO: 2, (б) указанная LU представляет собой малеимидокапроил-Val-Cit-PABA, (в) указанное лекарственное средство представляет собой ММАЕ, и (г) p представляет собой целое число, составляющее приблизительно 4.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где:
(а) указанное антитело против 5Т4 состоит из тяжелой цепи, имеющей SEQ ID NO: 1, и легкой цепи, имеющей SEQ ID NO: 2, (б) указанная LU представляет собой малеимидокапроил-Val-Cit-PABA, (в) указанное лекарственное средство представляет собой MMAD, и (г) p представляет собой целое число от приблизительно 1 до приблизительно 8.
Согласно настоящему изобретению также предложен конъюгат «антитело против 5Т4-лекарственное средство», где: (а) указанное антитело против 5Т4 состоит из тяжелой цепи, имеющей SEQ ID NO: 15, и легкой цепи, имеющей SEQ ID NO: 2, (б) указанная LU представляет собой малеимидокапроил-Val-Cit-PABA, (в) указанное лекарственное средство представляет собой ММАЕ, и (г) p представляет собой целое число от приблизительно 1 до приблизительно 8.
Согласно настоящему изобретению предложен конъюгат «антитело против 5Т4-лекарственное средство», где указанное антитело распознает эпитоп человеческого антигена 5Т4, содержащий аминокислотные остатки 173-258 и 282-361 аминокислотной последовательности SEQ ID NO: 11.
Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая конъюгат «антитело-лекарственное средство», указанный выше, и фармацевтически приемлемый носитель.
Согласно настоящему изобретению также предложен способ лечения 5Т4-положительного рака у пациента, нуждающегося в этом, включающий введение указанному пациенту конъюгата «антитело-лекарственное средство», указанного выше.
Согласно настоящему изобретению также предложен способ лечения 5Т4-положительного рака, где указанный рак выбран из группы, состоящей из раковых заболеваний мочевого пузыря, молочной железы, шейки матки, толстой кишки, эндометрия, почек, легкого, пищевода, яичника, предстательной железы, поджелудочной железы, печени, кожи, желудка и яичек.
Более предпочтительно, согласно настоящему изобретению предложен способ лечения 5Т4-положительного рака, где указанный рак выбран из группы, состоящей из колоректального рака, рака молочной железы, рака поджелудочной железы и немелкоклеточных карцином легкого.
Согласно изобретению также предложен конъюгат «антитело-лекарственное средство», указанный выше, для применения в терапии.
Согласно изобретению также предложено применение конъюгата «антитело-лекарственное средство», указанного выше, для изготовления лекарственного средства.
Согласно изобретению также предложено применение, указанное выше, для лечения 5Т4-положительного рака, где указанный рак выбран из группы, состоящей из раковых заболеваний мочевого пузыря, молочной железы, шейки матки, эндометрия, почек, легкого, пищевода, яичника, предстательной железы, поджелудочной железы, кожи, желудка и яичек.
Более предпочтительно, согласно изобретению также предложено применение, указанное выше, для лечения 5Т4-положительного рака, где указанный рак выбран из группы, состоящей из колоректального рака, рака молочной железы, рака поджелудочной железы и немелкоклеточных карцином легкого.
Согласно изобретению также предложены нуклеиновая кислота, кодирующая антитело против 5Т4, вектор, содержащий указанную нуклеиновую кислоту, и клетка-хозяин, содержащая указанный вектор.
Согласно изобретению также предложен способ получения антитела против 5Т4, включающий культивирование клетки-хозяина, содержащей указанный выше вектор, и выделение антитела из клеточной культуры.
Согласно изобретению также предложен способ получения конъюгата «антитело против 5Т4-лекарственное средство», включающий: (а) получение антитела, выделенного из клеточной культуры, (б) химическое связывание указанного антитела, через линкерную единицу, выбранную из группы, состоящей из малеимидокапроила и малеимидокапроил-Val-Cit, со структурной единицей лекарственного средства, выбранной из группы, состоящей из ММАЕ, MMAD или MMAF; и (в) очистку конъюгата «антитело-лекарственное средство».
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены конъюгаты «антитело против 5Т4-лекарственное средство» для лечения рака. Для лучшего понимания настоящего изобретения сначала приведено определение некоторых терминов.
Все сокращения аминокислот, использованные в данном описании, представляют собой сокращения, принятые Управлением по патентам и товарным знакам США, как изложено в § 1.822 (B)(1) раздела 37 Свода федеральных постановлений США.
5Т4 относится к онкофетальному антигену 5Т4, 72 кДа высокогликозилированному трансмембранному гликопротеину, содержащему 42 кДа негликозилированное ядро (см. US 5869053). Человеческий 5Т4 экспрессирован во множестве типов раковых заболеваний, включая раковые заболевания мочевого пузыря, молочной железы, шейки матки, толстой кишки, эндометрия, почек, легкого, пищевода, яичника, предстательной железы, поджелудочной железы, печени, кожи, желудка и яичек. Показаны высокие уровни экспрессии 5Т4 на высокоонкогенных клетках, также называемых раковыми стволовыми клетками или опухоль-инициирующими клетками (WO 2010/111659). Антитела против 5Т4 по изобретению включают антитела, специфично связывающиеся с человеческим антигеном 5Т4 (см. US 2007/0231333).
«Антитело» представляет собой молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и так далее, через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. При использовании здесь термин «антитело» включает не только интактные поликлональные или моноклональные антитела, но также любой антигенсвязывающий фрагмент (то есть «антигенсвязывающую часть») или его отдельную цепь, слитые белки, содержащие антитело, или любую другую модифицированную конфигурацию молекулы иммуноглобулина, содержащую сайт распознавания антигена, включая, например, без ограничения, Fab-, Fab'-, F(ab')2-, Fd-фрагмент, состоящий из доменов VH и VH, Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, выделенную область, определяющую комплементарность (CDR), scFv, однодоменные антитела, (например, антитела акулы и представителей семейства Верблюдовых), макситела, минитела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv.
Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подкласса), и нет необходимости в том, чтобы антитело представляло собой антитело какого-либо определенного класса. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела, иммуноглобулинам могут быть присвоены различные классы. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены далее на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелых цепей, соответствующие различным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, самим по себе или в комбинации. Как известно в данной области техники, каждая вариабельная область тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области, участвующими в образовании антигенсвязывающего сайта антител. Если желательны варианты рассматриваемой вариабельной области, особенно с заменой аминокислотных остатков вне CDR-области (то есть в каркасной области), подходящая аминокислотная замена, предпочтительно консервативная аминокислотная замена, может быть определена сравнением рассматриваемой вариабельной области с вариабельными областями других антител, содержащих последовательности CDR1 и CDR2 того же канонического класса, что и рассматриваемая вариабельная область (Chothia and Lesk, J Mol Biol 196(4): 901-917, 1987). При выборе FR для фланкирования CDR, например, при гуманизации или оптимизации антитела, предпочтительны FR антител, содержащих последовательности CDR1 и CDR2 того же канонического класса.
«CDR» вариабельного домена представляют собой аминокислотные остатки вариабельной области, определенные в соответствии со способами определения Kabat, Chothia, сочетанием способов Kabat и Chothia, способом AbM, контактным и/или конформационным способами определения или любым способом определения CDR, хорошо известным в данной области техники. CDR антитела могут быть определены как гипервариабельные области, изначально определенные Kabat et al. См., например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington, D.C. Положения CDR могут также быть определены как петлевые структуры, изначально описанные Chothia et al. См., например, Chothia et al., 1989, Nature 342:877-883. Другие способы определения CDR включают «способ определения AbM», представляющий собой сочетание способов Kabat и Chothia и разработанный с применением программного обеспечения для моделирования антител AbM от Oxford Molecular (в настоящее время Accelrys®), или «контактный способ определения» CDR, основанный на наблюдаемых контактах с антигенами, изложенный в MacCallum et al., 1996, J. Mol. Biol., 262:732-745. В другом способе, названном здесь «конформационным способом определения» CDR, положения CDR могут быть определены как остатки, влияющие на энтальпию связывания с антигеном. См., например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166. В других способах определения границ CDR может не быть строгого соответствия одному из указанных способов, но, тем не менее, они могут перекрываться по меньшей мере с частью CDR по Kabat, хотя их длина может быть уменьшена или увеличена в свете прогнозов или экспериментальных данных об отсутствии существенного влияния определенных остатков, или групп остатков, или даже целых CDR на связывание с антигеном. При использовании здесь CDR может относится к CDR, определенным любым способом, известным в данной области техники, включая комбинированные способы. В способах, примененных здесь, могут быть использованы CDR, определенные любым из этих способов. Для любого заданного воплощения, включающего более одной CDR, CDR могут быть определены любым из способов определения Kabat, Chothia, расширенного способа определения, способа определения AbM, контактного и/или конформационного способа определения.
Термин «моноклональное антитело» (mAb) относится к антителу, имеющему происхождение от одной копии или клона, включая, например, любой эукариотический, прокариотический или фаговый клон, и не к способу, которым оно получено. Предпочтительно, моноклональное антитело по изобретению представлено в однородной или практически однородной популяции.
«Гуманизированное» антитело относится к формам антител, не являющимся человеческими (например, мышиным), представляющим собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), содержащим минимальную последовательность, имеющую происхождение от иммуноглобулина, не являющегося человеческим. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), где остатки области, определяющей комплементарность, (CDR) реципиента заменены остатками CDR вида, не являющегося человеком (антитела-донора), такого как мышь, крыса или кролик, имеющему желаемую специфичность, аффинность и активность.
Термин «химерное антитело» предназначен для обозначения антител, в которых последовательности вариабельных областей имеют происхождение от одного вида и последовательности константных областей имеют происхождение от другого вида, таких как антитело, где последовательности вариабельных областей имеют происхождение от мышиного антитела и последовательности константных областей имеют происхождение от человеческого антитела.
Антитела по изобретению могут быть получены с применением методик, хорошо известных в данной области техники, например, рекомбинантных технологий, технологий фагового дисплея, технологий синтеза или комбинаций таких технологий или по другим технологиям, хорошо известным в данной области техники (см., например, Jayasena, S.D., Clin. Chem., 45: 1628-50 (1999) and Fellouse, FA, et al, J. Mol. Biol., 373(4): 924-40 (2007)).
В Таблицах 1 и 2 ниже показаны предпочтительные CDR для антител по настоящему изобретению.
|
Настоящее изобретение включает антитело или его антигенсвязывающий фрагмент, содержащие:
а) вариабельную область легкой цепи, содержащую:
1) LCDR1, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и 17;
2) LCDR2, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9 и 18; и
3) LCDR3, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10 и 19; и
б) вариабельную область тяжелой цепи, содержащую:
1) HCDR1, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5 и 22;
2) HCDR2, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6 и 23; и
3) LCDR1, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 24.
Предпочтительные антитело или его антигенсвязывающий фрагмент по изобретению содержат:
а) вариабельную область легкой цепи (LCVR), содержащую: LCDR1 по SEQ ID NO: 8, LCDR2 по SEQ ID NO: 9 и LCDR3 по SEQ ID NO: 10; и
б) вариабельную область тяжелой цепи (HCVR), содержащую: a HCDR1 по SEQ ID NO: 5, HCDR2 по SEQ ID NO: 6 и HCDR3 по SEQ ID NO: 7.
Предпочтительные моноклональные антитела по изобретению названы здесь A1 (гуманизированное антитело IgG1 против 5Т4); A1-IgG4 (гуманизированное антитело IgG4 против 5Т4); A3 (мышиное/человеческое химерное антитело); и A3hu (гуманизированное антитело IgG1 против 5Т4). SEQ ID NO: аминокислотных последовательностей, кодирующих моноклональные антитела A1, A1-IgG4 и A3, представлены в Таблице 3 ниже.
|
Фразы «антитело, распознающее антиген» и «антитело, специфичное в отношении антигена», использованы здесь взаимозаменяемо с термином «антитело, специфично связывающееся с антигеном».
Конъюгат «антитело против 5Т4-лекарственное средство» относится к антителу против 5Т4 или его антигенсвязывающему фрагменту, как описано здесь, связанным с группировкой цитотоксического лекарственного средства (D) через молекулу линкерной единицы (LU).
Линкерная единица (LU): LU описывает прямую или непрямую связь антитела с лекарственным средством. Присоединение линкера к моноклональному антителу (mAb) может быть проведено множеством способов, как например, через поверхностные лизины, восстановительным сочетанием с окисленными углеводами и через цистеиновые остатки, освобожденные восстановлением межцепочечных дисульфидных связей. В данной области техники известно множество систем связывания ADC, включая связи на основе гидразонов, дисульфидов и пептидов.
Лекарственное средство (D): лекарственное средство представляет собой любое вещество, обладающее биологической или выявляемой активностью, например, терапевтические агенты, выявляемые метки, связывающие агенты, и так далее, и пролекарства, метаболизируемые с образованием активного агента in vivo. Термины «лекарственное средство» и «полезная нагрузка» использованы взаимозаменяемо. В некоторых воплощениях лекарственное средство представляет собой ауристатин, такой как ауристатин E (также известный в данной области техники как производное доластатина-10) или его производное. Ауристатин может представлять собой, например, эфир, образованный ауристатином E и кетокислотой. Например, ауристатин E может быть подвергнут взаимодействию с параацетилбензойной кислотой или бензоилвалериановой кислотой с получением AEB и AEVB, соответственно. Другие типичные ауристатины включают AFP (ауристатин F фенилендиамин), MMAF и MMAE. Синтез и структура типичных ауристатинов описаны в патентах США №№6884869, 7098308, 7256257, 7423116, 7498298 и 7745394, каждый из которых полностью включен сюда посредством ссылки в любых целях.
Показано, что ауристатины нарушают динамику микротрубочек и деление ядер и клеток и обладают противораковой активностью. Ауристатины по настоящему изобретению связываются с тубулином и могут оказывать цитотоксический или цитостатический эффект на клетку или клеточную линию, экспрессирующую 5Т4. Существует несколько различных анализов, известных в данной области техники, которые могут быть применены для определения того, какой эффект, цитостатический или цитотоксический, оказывает ауристатин или полученный конъюгат «антитело-лекарственное средство» на желаемую клетку или клеточную линию. Способы определения связывания соединения с тубулином известны в данной области техники. См., например, Muller et al., Anal. Chem 2006, 78, 4390-4397; Hamel et al., Molecular Pharmacology, 1995 47: 965-976; и Hamel et al., The Journal of Biological Chemistry, 1990 265:28, 17141-17149.
Примеры лекарственных средств или полезных нагрузок выбраны из группы, состоящей из DM1 (майтансина, N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)- или N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)-майтансина), mc-MMAD (6-малеимидокапроил-монометилауристатин D или N-метил-L-валил-N-[(1S,2R)-2-метокси-4-[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[[(1S)-2-фенил-1-(2-тиазолил)этил]амино]пропил]-1-пирролидинил]-1-[(1S)-1-метилпропил]-4-оксобутил]-N-метил-(9Cl)-L-валинамида), mc-MMAF (малеимидокапроил-монометилауристатин F или N-[6-(2,5-дигидро-2,5-диоксо-1H-пиррол-1-ил)-1-оксогексил]-N-метил-L-валил-L-валил-(3R,4S,5S)-3-метокси-5-метил-4-(метиламино)гептаноил-(αR,βR,2S)-β-метокси-α-метил-2-пирролидинпропаноил-L-фенилаланина) и mc-Val-Cit-PABA-MMAE (6-малеимидокапроил-ValcCit-(п-аминобензилоксикарбонил)-монометилауристатин E или N-[[[4-[[N-[6-(2,5-дигидро-2,5-диоксо-1H-пиррол-1-ил)-1-оксогексил]-1-валил-N5-(аминокарбонил)-1-орнитил]амино]фенил]метокси]карбонил]-N-метил-L-валил-N-[(1S,2R)-4-[(2S)-2-[(1R,2R)-3-[[(1R,2S)-2-гидрокси-1-метил-2-фенилэтил]амино]-1-метокси-2-метил-3-оксопропил]-1-пирролидинил]-2-метокси-1-[(1S)-1-метилпропил]-4-оксобутил]-N-метил-L-валинамид). DM1 является производным ингибитора тубулина майтансина, в то время как MMAD, ММАЕ и MMAF являются производными ауристатинов. Предпочтительные лекарственные средства по настоящему изобретению выбраны из группы, состоящей из mc-MMAF и mc-Val-Cit-PABA-ММАЕ.
Термин «эпитоп» относится к той части молекулы, которая может быть распознана и связана антителом в одной или более антигенсвязывающих областях антитела. Эпитопы часто состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и имеют определенные трехмерные структурные характеристики, а также определенные зарядные характеристики. При использовании здесь термин «антигенный эпитоп» определяют как часть полипептида, с которой может специфично связываться антитело, как определено любым способом, хорошо известным в данной области техники, например, стандартными иммунологическими анализами. «Нелинейный эпитоп» или «конформационный эпитоп» содержит несмежные полипептиды (или аминокислоты) антигенного белка, с которыми связывается антитело, специфичное в отношении эпитопа.
При использовании здесь термин «аффинность связывания (KD)» предназначен для обозначения скорости диссоциации взаимодействия определенного антигена с антителом. KD представляет собой отношение скорости диссоциации, также называемой «koff», к скорости ассоциации или «kon». Таким образом, KD равна koff/kon, и ее выражают как молярную концентрацию (M). Следовательно, чем меньше KD, тем выше аффинность связывания. Поэтому KD 1 мкМ указывает на низкую аффинность связывания, по сравнению с KD 1 нМ. Значения KD антител могут быть определены с применением способов, хорошо известных в данной области техники. Одним способом определения KD антитела является применение поверхностного плазмонного резонанса (SPR), обычно с использованием биосенсорной системы, такой как система Biacore®.
Термин «специфичное связывание» при использовании здесь в отношении связывания антитела с антигеном 5Т4 означает, что антитело связывается с антигеном 5Т4 с KD менее чем приблизительно 30 нМ, как определено посредством SPR при 25°C.
При использовании здесь термин «фармацевтически приемлемая соль» относится к фармацевтически приемлемым органическим или неорганическим солям молекулы или макромолекулы.
Термин «активность» является мерой биологической активности и может быть обозначен как IC50 или эффективная концентрация антитела, необходимая для 50%-го ингибирования роста 5Т4-положительной клеточной линии, как описано в Примере 3. Альтернативно, активность может относиться к противоопухолевой активности, определенной в ксенотрансплантационной модели опухоли in vivo, как показано в Примере 4.
При использовании здесь термины «полинуклеотид» или «молекула нуклеиновой кислоты» предназначены для включения молекул ДНК и молекул РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК.
Полинуклеотиды, кодирующие антитела по настоящему изобретению, могут содержать следующее: только кодирующую последовательность для варианта; кодирующую последовательность для варианта и дополнительные кодирующие последовательности, например, для функционального полипептида или сигнальной или секреторной последовательности, или последовательности пробелка; кодирующую последовательность для антитела и некодирующую последовательность, такую как интроны или некодирующая последовательность, расположенная в 5'- и/или 3'-направлении от последовательности, кодирующей антитело. Термин «полинуклеотид, кодирующий антитело», включает полинуклеотид, содержащий дополнительную кодирующую последовательность для варианта, а также полинуклеотид, содержащий дополнительную кодирующую и/или некодирующую последовательность. В данной области техники известно, что полинуклеотидная последовательность, оптимизированная для определенной клетки-хозяина/системы экспрессии, может легко быть получена, исходя из аминокислотной последовательности желаемого белка (см. GENEART® AG, Regensburg, Germany).
Полинуклеотиды, кодирующие антитела по настоящему изобретению, будут обычно содержать полинуклеотидную последовательность контроля экспрессии, функционально связанную с последовательностями, кодирующими антитела, включая природные или гетерологичные промоторные области, известные в данной области техники. Предпочтительно, последовательности контроля экспрессии будут представлять собой эукариотические промоторные системы в векторах, способных к трансформации или трансфекции эукариотических клеток-хозяев, но также могут быть использованы контрольные последовательности для прокариотических хозяев. После введения вектора в подходящую линию клеток-хозяев проводят культивирование клеток-хозяев в условиях, подходящих для экспрессии нуклеотидных последовательностей и, если желательно, для сбора и очистки антител. Предпочтительные эукариотические клеточные линии включают клеточные линии CHO, различные клеточные линии COS, клетки HeLa, миеломные клеточные линии, трансформированные В-клетки или линии клеток почки человеческого эмбриона. Наиболее предпочтительной клеткой-хозяином является клеточная линия CHO.
Настоящее изобретение включает антитела или их антигенсвязывающие фрагменты, связывающиеся с определенным эпитопом антигена 5Т4. Определенный эпитоп представляет собой нелинейный или конформационный эпитоп, содержащий первую контактную область человеческого антигена 5Т4 (SEQ ID NO: 11) между аминокислотными остатками 173 и 252 и содержащий вторую контактную область между аминокислотными остатками 276 и 355 (см. Пример 7). Таким образом, CDR и вариабельные области тяжелой и легкой цепи, описанные здесь, используют для получения полноразмерных антител, а также функциональных фрагментов и аналогов, сохраняющих аффинность связывания белка, в котором использованы CDR, специфичные в отношении указанного выше эпитопа антигена 5Т4.
Аффинность связывания антител по настоящему изобретению определяют с применением SPR (Пример 6). В этих экспериментах антигены 5Т4 иммобилизуют в низких плотностях на чипе BIAcore® и пропускают рядом с ними антитела. Измеряют увеличение массы на поверхности чипа. Данный способ анализа позволяет в реальном времени определять как скорость ассоциации, так и скорость диссоциации с получением аффинности (KD) связывания. Гуманизированные антитела по настоящему изобретению имеют KD от приблизительно 0,30 до приблизительно 30 нМ; от приблизительно 0.30 до приблизительно 20 нМ; от приблизительно 0,30 до приблизительно 10 нМ; от приблизительно 0,5 до приблизительно 7 нМ; от приблизительно 1,0 до приблизительно 5 нМ; и от приблизительно 1,0 до приблизительно 3 нМ.
Конъюгация лекарственных средств с антителом
Лекарственное средство имеет группу, взаимодействующую с конъюгационной точкой антитела, или модифицировано, чтобы содержать такую группу. Например, лекарственное средство может быть присоединено алкилированием (например, по лизинам с эпсилон-аминогруппами или N-концу антител), восстановительным аминированием окисленного углевода, трансэстерификацией между гидроксильными и карбоксильными группами, амидированием по аминогруппам или карбоксильным группам и конъюгацией с тиолами. В некоторых воплощениях число группировок лекарственного средства p, конъюгированных с молекулой антитела, составляет в среднем от 1 до 8; от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2. В некоторых воплощениях p составляет в среднем от 2 до 8, от 2 до 7, от 2 до 6, 2 to 5, от 2 до 4 или от 2 до 3. В некоторых воплощениях p составляет в среднем 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых воплощениях p составляет в среднем от приблизительно 1 до приблизительно 8; от приблизительно 1 до приблизительно 7, от приблизительно 1 до приблизительно 6, от приблизительно 1 до приблизительно 5, от приблизительно 1 до приблизительно 4, от приблизительно 1 до приблизительно 3 или от приблизительно 1 до приблизительно 2. В некоторых воплощениях p составляет от приблизительно 2 до приблизительно 8, от приблизительно 2 до приблизительно 7, от приблизительно 2 до приблизительно 6, от приблизительно 2 до приблизительно 5, от приблизительно 2 до приблизительно 4 или от приблизительно 2 до приблизительно 3. Примеры химических способов, которые могут быть применены для конъюгации, приведены, например, в Current Protocols in Protein Science (John Wiley & Sons, Inc.), Chapter 15 (Chemical Modifications of Proteins) (содержание которой полностью включено сюда посредством ссылки).
Например, когда химическая активация белка приводит к образованию свободных тиоловых групп, белок можно конъюгировать с сульфгидрильным реакционноспособным агентом. В одном аспекте агент по существу специфичен в отношении свободных тиоловых групп. Такие агенты включают, например, малеимид, галогенацетамиды (например, йод-, бром- или хлорацетамиды), галогенэфиры (например, йод-, бром- или хлорэфиры), галогенметилкетоны (например, йод-, бром- или хлорметилкетоны), бензиловые галогениды (например, йодид, бромид или хлорид), винилсульфон и пиридилтио.
Линкеры
Лекарственное средство может быть связано с антителом посредством линкера. Подходящие линкеры включают, например, расщепляемые и нерасщепляемые линкеры. Расщепляемый линкер обычно подвержен расщеплению во внутриклеточных условиях. Подходящие расщепляемые линкеры включают, например, пептидный линкер, расщепляемый внутриклеточной протеазой, такой как липосомальная протеаза или эндосомальная протеаза. В типичных воплощениях линкер может представлять собой дипептидный линкер, такой как валин-цитруллиновый (val-cit), фенилаланин-лизиновый (phe-lys) линкер или малеимидокапроновый валин-цитруллиновый п-аминобензилоксикарбонильный (mc-Val-Cit-PABA) линкер. Другим линкером является сульфосукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат (smcc). Сульфо-smcc-конъюгация происходит через малеимидную группу, взаимодействующую с сульфгидрилами (тиолами, -SH), в то время как его сульфо-NHS-эфир взаимодействует с первичными аминами (присутствующими в лизине и N-конце белка или пептида). Еще одним линкером является малеимидокапроил (mc). Другие подходящие линкеры включают линкеры, гидролизуемые при определенном pH или диапазоне pH, такие как гидразоновый линкер. Дополнительные подходящие расщепляемые линкеры включают дисульфидные линкеры. Линкер может быть ковалентно связан с антителом в такой степени, что для высвобождения лекарственного средства необходимо внутриклеточное расщепление антитела, например, mc-линкер и тому подобные.
Линкер может содержать группу для связывания с антителом. Например, линкер может содержать реакционноспособные аминогруппы, гидроксильные, карбоксильные или сульфгидрильные группы (например, малеимид, галогенацетамиды (например, йод-, бром- или хлорацетамиды), галогенэфиры (например, йод-, бром- или хлорэфиры), галогенметилкетоны (например, йод-, бром- или хлорметилкетоны), бензиловые галогениды (например, йодид, бромид или хлорид), винилсульфон и пиридилтио). В целом, см. Wong, Chemistry of Protein Conjugation and Cross-linking; CRC Press, Inc., Boca Raton, 1991.
Иммунотерапия
Для иммунотерапии антитело может быть конъюгировано с подходящим лекарственным средством, таким как цитотоксический или цитостатический агент, иммуносупрессивный агент, радиоизотоп, токсин или тому подобное. Конъюгат может быть использован для ингибирования размножения опухолевой клетки или раковой клетки, приводя к апоптозу опухолевой или раковой клетки, или для лечения рака у пациента. Конъюгат может быть использован соответствующим образом во множестве ситуаций для лечения раковых заболеваний животных. Конъюгат может быть использован для доставки лекарственного средства в опухолевую клетку или раковую клетку. Безотносительно теории, в некоторых воплощениях происходит связывание или ассоциация конъюгата с антигеном раковой клетки или опухоль-ассоциированным антигеном, и конъюгат и/или лекарственное средство могут проникать внутрь опухолевой клетки или раковой клетки посредством рецептор-опосредованного эндоцитоза. Антиген может быть прикреплен к опухолевой клетке или раковой клетке или может представлять собой белок внеклеточного матрикса, связанный с опухолевой клеткой или раковой клеткой. После проникновения конъюгата в клетку происходит гидролитическое расщепление одной или более определенных пептидных последовательностей конъюгата (например, линкера) одной или более протеазами опухолевой клетки или раковой клетки, приводя к высвобождению лекарственного средства. После этого лекарственное средство может свободно перемещаться по клетке и проявлять цитотоксическую, цитостатическую или иную активность. В некоторых воплощениях отщепление лекарственного средства от антитела происходит вне опухолевой клетки или раковой клетки, и лекарственное средство затем проникает в клетку или действует на поверхности клетки.
Терапия рака
Как обсуждено выше, раковые заболевания, включая, без ограничения, опухоль, метастаз или другое заболевание или расстройство, для которых характерен неконтролируемый рост клеток, можно лечить или предотвращать введением конъюгата «белок-лекарственное средство».
В других воплощениях предложены способы лечения или предотвращения рака, включающие введение пациенту, нуждающемуся в этом, эффективного количества конъюгата и химиотерапевтического агента. В некоторых воплощениях химиотерапевтический агент представляет собой агент, лечение рака которым не было признано рефрактерным. В некоторых воплощениях химиотерапевтический агент представляет собой агент, лечение рака которым было признано рефрактерным. Конъюгат можно вводить пациенту, также прошедшему лечение, такое как хирургическое вмешательство для лечения рака. В другом воплощении дополнительный способ лечения представляет собой лучевую терапию.
Терапия рака несколькими лекарственными средствами
Способы лечения рака включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата «антитело-лекарственное средство» и другого терапевтического агента, представляющего собой противораковый агент. Подходящие противораковые агенты включают, без ограничения, метотрексат, таксол, L-аспарагиназу, меркаптопурин, тиогуанин, гидроксимочевину, цитарабин, циклофосфамид, ифосфамид, нитрозомочевины, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбазин, топотекан, азотистые иприты, цитоксан, этопозид, 5-фторурацил, BCNU, иринотекан, камптотецины, блеомицин, доксорубицин, идарубицин, даунорубицин, дактиномицин, пликамицин, митоксантрон, аспарагиназу, винбластин, винкристин, винорелбин, паклитаксел, калихеамицин и доцетаксел.
ADC по настоящему изобретению могут быть представлены в форме фармацевтической композиции для введения, изготовленной таким образом, что она является подходящей для выбранного способа введения, с фармацевтически приемлемыми разбавителем или эксципиентами, такими как буферы, поверхностно-активные вещества, консерванты, солюбилизаторы, изотонические агенты, стабилизаторы, носители и тому подобное. В Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton Pa., 18th ed., 1995, включенной сюда посредством ссылки, представлено руководство по методикам изготовления, обычно известным специалистам в данной области техники.
Эти фармацевтические композиции могут быть введены любым способом, известным в данной области техники, позволяющим достигнуть обычно подразумеваемой цели лечения рака. Предпочтительным способом введения является парентеральный, определенный здесь как относящийся к способам введения, включающим, без ограничения, внутривенную, внутримышечную, внутрибрюшинную, подкожную и внутрисуставную инъекцию и инфузию. Вводимая доза будет зависеть от возраста, состояния здоровья и массы тела реципиента, типа сопутствующей терапии в случае ее проведения, частоты введения и природы желаемого эффекта.
Композиции, входящие в объем изобретения, включают все композиции, где ADC присутствует в количестве, эффективном для достижения желаемого медицинского эффекта для лечения рака. В то время как индивидуальные потребности могут варьировать от одного пациента к другому, клиницист обычного уровня компетентности может определить оптимальные диапазоны эффективных количеств всех компонентов.
Пример 1
Получение ADC против 5Т4
Конъюгат «антитело A1 против 5Т4 (5Т4-A1)-лекарственное средство» (ADC) получают частичным восстановлением mAb трис(2-карбоксиэтил)фосфином (TCEP) с последующим взаимодействием восстановленных цистеиновых остатков с желаемым лекарственным средством с малеимидным линкером на конце. В частности, mAb 5Т4-A1 частично восстанавливают добавлением 2,8 молярного избытка трис(2-карбоксиэтил)фосфина (ТСЕР) в 100 мМ HEPES (буфере с 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислотой), pH 7,0 и 1 мМ диэтилентриаминпентауксусной кислоте (DTPA) на 2 часа при 37°C. Затем в реакционную смесь добавляют желаемый «линкер-лекарственное средство» при молярном отношении «линкер-лекарственное средство»/«mAb-тиол» 5,5 (малеимидокапроновый линкер-монометилауристатин F [mc-MMAF]) или 8 (малеимидокапроновый валин-цитруллиновый п-аминобензилоксикарбонильный линкер-монометилауристатин E [mc-Val-Cit-РАВА-ММАЕ]) и подвергают их взаимодействию в течение еще 1 часа при 25°C в присутствии 15% об./об. диметилацетамида (DMA). После периода инкубации продолжительностью 1 час добавляют N-этилмалеимид (4,5-кратный избыток для mc-MMAF и 2-кратный избыток для mc-Val-Cit-PABA-MMAE) для устранения непровзаимодействовавших тиолов и дают им взаимодействовать в течение 15 минут с последующим добавлением 6-кратного избытка L-цистеина для погашения любого непрореагировавшего «линкера-лекарственного средства». Проводят диализ реакционной смеси в течение ночи при 4°C в забуференный фосфатом физиологический раствор (PBS), pH 7,4 и ее очистку гель-хроматографией (SEC) (АКТА explorer, колонка Superdex 200 10/30 GL). Затем оценивают чистоту ADC гель-хроматографией (SEC), проводят хроматографию гидрофобного взаимодействия (HIC) и жидкостную хроматографию с электрораспылительной ионизацией и тандемной масс-спектрометрией (LC-ESI MS) для вычисления нагруженности и определяют концентрацию с использованием ультрафиолетового (UV) спектрофотометра.
Пример 2
Анализы связывания
Клетки, экспрессирующие антиген 5Т4, и отрицательные контрольные клетки Raji высевают в плотности 500000 клеток на лунку в 96-луночные планшеты без обработки для тканевых культур и держат на льду. Приготавливают разведения антител A1 и A1-IgG4 или ADC A1-mcMMAF в 3%-м бычьем сывороточном альбумине (BSA) в физиологическом растворе, забуференном фосфатом Дульбекко (DPBS), и добавляют их в планшет в конечной концентрации 10 мкг/мл. Затем планшеты инкубируют на льду в течение 1 часа с последующими 2 отмывками. В лунки добавляют вторичное антитело, конъюгированное с РЕ (фикоэритрином) козье антитело против Fc-фрагмента человеческого IgG. Через 30 минут инкубации при 4°C измеряют среднюю интенсивность флуоресценции с использованием проточного цитометра.
Данные в Таблице 4 показывают, что антитело A1 связывается с широким спектром 5Т4-положительных клеток. Данные в Таблице 5 показывают, что сходное связывание с несколькими различными клеточными линиями наблюдают с антителами A1 и A1-IgG4, а также ADC A1-mcMMAF.
|
|
Пример 3
Анализ цитотоксичности
Клеточные линии, экспрессирующие 5Т4, и отрицательную контрольную клеточную линию Raji культивируют с возрастающими концентрациями ADC. Через четверо суток оценивают жизнеспособность каждой культуры. Значения IC50 вычисляют логистической нелинейной регрессией и они представлены как нг антитела/мл. Показано, что A1-mcMMAF, A1-vcMMAE, А3-mcMMAF и А3-mcMMAE ингибируют рост клеточных линий, экспрессирующих 5Т4 (MDAMB435/5T4, MDAMB468 и MDAMB361DYT2), будучи в то же время неактивными в отношении 5Т4-отрицательных клеток (Raji), Таблица 6.
|
Кроме того, выделяют и выращивают в культуре 5Т4-положительные первичные клетки опухоли легкого 37622а. Клетки культивируют с возрастающими концентрациями ADC. Через десять суток оценивают жизнеспособность каждой культуры с применением MTS-способа. Значения IC50 вычисляют логистической нелинейной регрессией, и они представлены как нг антитела/мл. A1-mcMMAF, A1-vcMMAE, А3-mcMMAF и А3-vcMMAE ингибируют рост первичных клеток опухоли легкого, Таблица 7.
|
Пример 4
Модель с подкожной ксенотрансплантацией
Самкам бестимусных (голых) мышей (или другой линии мышей с иммуносупрессией) подкожно вводят опухолевые клетки MDAMB435/5T4, MDAMB361DYT2 или Н1975. Мышам со стадированными опухолями массой приблизительно от 0,1 до 0,3 г (n=от 6 до 10 мышей на группу введения) внутривенно вводят Q4D×4 с обычным физиологическим раствором (наполнитель), A1-mcMMAF, A1-vcMMAE, A1-mcMMAD, A1-smccDM1, А3-mcMMAF, A3-vcMMAE или несвязывающим контрольным антителом, конъюгированным с mcMMAF или vcMMAE, в дозе 3 мг антитела/кг. Дозу всех ADC определяют, исходя из содержания антител. Опухоли измеряют по меньшей мере один раз в неделю и их размер (мм2 ± стандартная ошибка среднего (SEM)) вычисляют как мм2 = 0,5×(ширина опухоли)2×(длина опухоли).
Данные в Таблице 8 показывают, что A1-mcMMAF, A1-vcMMAE, A1-vcMMAD, А3-mcMMAF и A3-vcMMAE ингибируют рост ксенотрансплантатов MDAMB435/5T4, в то время как A1-mcMMAD и A1-smccDM1 не были активны в данной модели.
Данные в Таблице 9 показывают, что A1-mcMMAF, A1-vcMMAE, A1-vcMMAD, A1-smccDM1, А3-mcMMAF и A3-vcMMAE ингибируют рост ксенотрансплантатов MDAMB361DYT2, в то время как A1-mcMMAD не был активен в данной модели.
Данные в Таблице 10 показывают, что A1-mcMMAF, A1-vcMMAE, A1-vcMMAD, А3-mcMMAF и А3-vcMMAE ингибируют рост ксенотрансплантатов Н1975, в то время как A1-mcMMAD и A1-smccDM1 не были активны в данной модели.
|
|
Альтернативно, бестимусным мышам с введенными подкожно ксенотрансплантатами первичных опухолевых клеток 37622а внутривенно вводят Q4D×4 с A1-mcMMAF, A1-mcMMAD, A1-vcMMAD или А3-mcMMAF в дозе 3 мг антитела/кг и проводят мониторинг роста опухоли в течение периода продолжительностью 96 суток. В Таблице 11 показано, что A1-mcMMAF, A1-vcMMAD и А3-mcMMAF ингибируют рост первичных опухолевых ксенотрансплантатов 37622а по сравнению с животными, которым вводили контрольный наполнитель, в то время как A1-mcMMAD не был активен в данной модели.
|
Неожиданно, данные в Таблицах 8-11 демонстрируют, что ADC с одинаковыми антителом и лекарственным средством, но с разными линкерами имели разный профиль эффективности, то есть A1-mcMMAD в сравнении с A1-vcMMAD, во всех четырех ксенотрансплантационных моделях. Кроме того, данные демонстрируют, что ADC с одинаковыми антителом и линкером, но с разными лекарственными средствами также имели разный профиль эффективности, то есть A1-mcMMAF в сравнении с A1-mcMMAD, во всех четырех ксенотрансплантационных моделях. Таким образом, лекарственное средство MMAD эффективно во всех четырех ксенотрансплантационных моделях при связывании с антителом A1 vc-линкером, но не активно ни в одной из исследованных ксенотрансплантационных моделей при связывании mc-линкером. В отличие от этого, лекарственное средство MMAF эффективно во всех 4 ксенотрансплантационных моделях при связывании с антителом A1 mc-линкером, в то время как химически родственное лекарственное средство MMAD неэффективно во всех 4 ксенотрансплантационных моделях при связывании с тем же антителом тем же линкером.
Еще одно неожиданное наблюдение отмечено для ADC A1-smccDM1 (Таблицы 8-10). Данный ADC был очень эффективен против ксенотрансплантата MDAMB361DYT2, но практически не имел эффекта против ксенотрансплантатов MDAMB435/5T4 и Н1975, несмотря на высокие уровни экспрессии антигена-мишени 5Т4 во всех ксенотрансплантатах. Эти данные показывают, что эффективность «линкера-лекарственного средства» нельзя предсказать, даже при использовании одного и того же высокоаффинного антитела или даже при использовании одного и того же ADC.
Пример 5
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC)
Анализ ADCC
Кровь здорового добровольца отбирают в пробирку BD Vacutainer СРТ с гепарином натрия для получения клеток. Отбирают человеческие мононуклеарные клетки периферической крови (РВМС) и ресуспендируют их в буфере для анализа (RPMI 1640, дополненной 10 мМ HEPES) в концентрации 2,5×107 клеток/мл. Клетки-мишени (MDAMB435/5T4 или MDAMB435/neo) высевают в плотности 1×104 клеток на лунку в 96-луночный планшет. Добавляют антитело A1 или A1-mcMMAF, затем в лунки вносят человеческие эффекторные РВМС-клетки (5×105) при отношении эффектор:мишень (E:T) 50:1. Планшет для анализа инкубируют при 37°C в течение 4 часов для ADCC-активности. В планшет добавляют равный объем реагента CytoTox-One (Promega). В каждую лунку добавляют стоп-раствор (Promega; 50 мкл) и высвобождение лактатдегидрогеназы оценивают количественно измерением интенсивности флуоресценции. В качестве положительного контроля в контрольные лунки добавляют 2 мкл лизирующего буфера на лунку с получением максимального высвобождения LDH (100%-ая цитотоксичность). Процент цитотоксичности вычисляют с использованием следующего уравнения:
% специфичной цитотоксичности = [(экспериментальный сигнал-спонтанный сигнал эффектора-спонтанный сигнал мишени)/(максимальный сигнал мишени - спонтанный сигнал мишени)]×100;
где «экспериментальный сигнал» соответствует сигналу, измеренному в одном из экспериментальных условий, «спонтанный сигнал эффектора» соответствует сигналу, измеренному в присутствии РВМС самих по себе, «спонтанный сигнал мишени» соответствует сигналу, измеренному в присутствии клеток-мишеней самих по себе, и «максимальный сигнал мишени» соответствует сигналу, измеренному в присутствии лизированных детергентом клеток-мишеней самих по себе.
ADCC-активность антитела A1-IgG1 и A1-mcMMAF в сравнении с антителом A1-IgG4 показана в Таблице 12. Антитело A1 и A1-mcMMAF демонстрируют сопоставимую ADCC-активность, указывая на то, что ADCC-активность A1-mcMMAF может способствовать его противоопухолевой активности.
|
Пример 6
Аффинность связывания
Анализ поверхностного плазмонного резонанса (SPR) проводят с использованием BIAcore® для определения констант аффинности связывания A1-IgG1 и A1-IgG4 с человеческим 5Т4 или 5Т4 яванского макака при pH 6,0 и pH 7,4. В технологии BIAcore® используют изменения коэффициента преломления поверхностного слоя при связывании вариантов антитела huA1 с человеческим белком 5Т4, иммобилизованным на поверхностном слое. Связывание выявляют по SPR лазерного излучения, отраженного от поверхности. Анализ сигнальных кинетических скоростей ассоциации и диссоциации позволяет различить неспецифичные и специфичные взаимодействия. Белки 5Т4, используемые для данного анализа, состоящие из эктодомена человеческого 5Т4 или 5Т4 яванского макака, слитого с Fc-доменом человеческого IgG1, иммобилизуют в низкой плотности (45,1 и 45,4 резонансных единиц (RU) для человеческого 5Т4 и 5Т4 яванского макака, соответственно) на чипе СМ5 для точного измерения констант аффинности.
Значение специфичного связывания с эктодоменом 5Т4 получают вычитанием связывания с контрольной поверхностью, имевшей только человеческий белок IgG1-Fc, иммобилизованный на чипе СМ5 в той же плотности, что и на поверхностях с 5T4-Fc. Затем над поверхностью пропускают различные концентрации антител A1, A1-IgG4 или A3 в буфере HBS-EP, pH 7,4, или MES-EP, pH 6,0. В промежутках между инъекционными циклами поверхность восстанавливают два раза глицином, pH 1,7 с 0,05%-ым поверхностно-активным веществом Р20 (GE Healthcare, BR-1000-54).
Результаты показывают, что A1 имеет несколько большую аффинность в отношении человеческого 5Т4 при использовании поверхности с низкой плотностью 5Т4 как при pH 6,0, так и при pH 7,4, по сравнению с A1-IgG4 (в 1,5 раза и 1,2 раза, соответственно; Таблица 13). Кроме того, A1 демонстрировало несколько лучшее связывание с 5Т4 яванского макака как при pH 6,0, так и при pH 7,4, по сравнению с A1-IgG4 (в 1,7 раза и 1,2 раза, соответственно), и как A1, так и A1-IgG4 связывались с человеческим 5Т4 в 3-4 раза лучше, чем с 5Т4 яванского макака (Таблица 12).
|
При сравнении антител A1 и A3 видно, что антитело A1 лучше связывается с человеческим 5Т4 и 5Т4 яванского макака при pH 7,4, по сравнению с pH 6,0, в то время как антитело A3 демонстрирует усиленное связывание при pH 6,0, по сравнению с pH 7,4, Таблица 14.
|
Пример 7
Картирование эпитопов с использованием химерных 5Т4
Для определения эпитопов, с которыми связывается каждое из антител A1 и A3, проводят твердофазный иммуноферментный анализ (ELISA) с использованием (1) конструкции «эктодомен 5T4-Fc» и (2) химерных конструкций человеческого/мышиного 5Т4, транзиторно экспрессированных в клетках COS-1. Эктодомен содержит N-концевую область, два повтора, богатых лейцином, и расположенную между ними гидрофильную область. Эктодомены мышиного и крысиного 5Т4 содержат в их гидрофильной области прямой повтор из 6 аминокислот.
Слитые белки, содержащие эктодомен 5Т4 и Fc-константную область человеческого IgG1, получают с использованием человеческого 5Т4 (аминокислот 1-355), мышиного 5Т4 (аминокислот 1-361), крысиного 5Т4 (аминокислот 1-361), 5Т4 яванского макака (аминокислот 1-355), 5Т4 шимпанзе (аминокислот 1-355) и серебристой игрунки (аминокислот 1-355). Результаты связывания с человеческими/мышиными 5Т4-химерными конструкциями представлены в Таблице 14, где указано специфичное связывание, частичное связывание или отсутствие связывания антителами A1 и A3.
Таблица 15 относится к способности антител связываться с различными человеческими/мышиными химерными конструкциями, и номенклатура основана на содержании мышиного 5Т4. Отсутствие связывания указывает на место связывания антитела с человеческим 5Т4, поскольку эти антитела не связываются с мышиным 5Т4. Например, антитело A3 имеет связывающийся эпитоп, расположенный ближе к N-концу (между аминокислотными остатками 83-163), что продемонстрировано отсутствием связывания с химерным 5Т4, где остатки 83-163 заменены мышиным 5Т4, что приводит к отсутствию связывания с антителом A3. На основании этих результатов определено, что первая контактная область человеческого 5Т4 для гуманизированного антитела A1 расположена между аминокислотными остатками 173 и 252 и вторая контактная область человеческого 5Т4 для гуманизированного антитела A1 расположена между аминокислотными остатками 276 и 355. Антитело A3 связывается с областью первого повтора, богатого лейцином, человеческого 5Т4 между аминокислотными остатками 83 и 163. Номера аминокислотных остатков соответствуют аминокислотной последовательности человеческого 5Т4 по SEQ IDNO: 11.
|
Пример 8
Сравнение ADC A1-mcMMAF с ADC A1-IgG4-CM
Проводят сравнение безопасности и эффективности A1-mcMMAF и A1-lg64-AcBut-калихеамицина (A1-IGG4-CM). A1-4-СМ состоит из антитела A1-IgG4, конъюгированного с линкером, AcBut [-(4'-ацетилфенокси)бутановой кислотой], с лекарственным средством калихеамицином. Калихеамицины являются сильными противоопухолевыми агентами класса энединовых антибиотиков, имеющих происхождение от бактерии Micromonospora echinospora.
Активность связывания антитела A1, антитела A1-IgG4, ADC A1-mcMMAF и ADC A1-IgG4-CM с клетками сравнивают с использованием нескольких 5Т4-положительных клеточных линий (см. Пример 2, Таблицу 5). Данные показывают, что сходное связывание наблюдают с антителами A1 и A1-IgG4, а также ADC A1-mcMMAF, имевшими большую среднюю интенсивность флуоресценции, чем A1-IgG4-CM, со всеми исследованными 5Т4-положительными клеточными линиями.
Проводят одновременное исследование A1-mcMMAF и A1-IgG4-CM в модели с подкожным ксенотрансплантатом MDAMB435/5T4. Оба ADC вводят внутривенно (Q4dx2) по достижении опухолями размера приблизительно 200 мм2. Противоопухолевая активность A1-IgG4-CM в дозе 3 мг/кг сходна с противоопухолевой активностью A1-mcMMAF, вводимого в дозе 10 мг/кг (Таблица 16). На основании этих результатов, противоопухолевая активность A1-IgG4-CM приблизительно в 3,3 раза выше, чем у A1-mcMMAF.
|
Можно (было ожидать, что в 3,3 раза большая активность A1-gG4-CM, по сравнению с A1-mcMMAF, приведет к в 3,3 раза большему пределу безопасности A1-mcMMAF, по сравнению с A1-IgG4-CM, в исследовании токсичности на животных. Тем не менее, при изучении профиля безопасности A1-IgG4-CM на яванских макаках определено, что у яванских макаков A1-IgG4-СМ по меньшей мере в 100 раз токсичнее A1-mcMMAF. При введении A1-IgG4-СМ в дозах 0,032, 0,095 и 0,32 мг антитела/кг/цикл (2, 6, 20 мкг калихеамицина/кг/цикл) самцам (n=3) и самкам (n=3) яванских макаков токсичность наблюдали на каждом уровне дозы. После 2 циклов (2 введений) 4 из 6 животных в группе введения в дозе 0,095 мг антитела/кг/цикл были либо умерщвлены, либо найдены мертвыми. С другой стороны, после 2 циклов (2 введений) A1-mcMMAF в дозах до 10 мг/кг (247 мкг mcMMAF/кг/цикл) на протяжении того же 4-хнедельного периода летальных исходов не было. В заключение, введение A1-mcMMAF в дозе 10 мг/кг безопасно, в то время как введение A1-IgG4-CM в дозе 0,096 мг/кг токсично при двукратном введении яванским макакам за 4-недельных период наблюдения.
Неожиданно, эти данные демонстрируют в 105 раз (10/0,095=105) больший предел безопасности A1-mcMMAF, по сравнению с A1-IgG4-CM, а не ожидаемый в 3,3 раза больший предел безопасности, основанный на относительной противоопухолевой активности каждого ADC. Эти данные показывают непредсказуемость свойств конъюгатов «антитело-лекарственное средство», в которых использованы антитела к одному и тому же антигену-мишени, но конъюгированные с разными лекарственными средствами.
Пример 9
Фармакокинетическое/фармакодинамическое (PK/PD) моделирование на мышах и прогнозируемые клинические дозы A1-mcMMAF
PK/PD-моделирование было применено для количественной оценки ответа опухоли на A1-mcMMAF в исследованиях с ксенотрансплантатами на мышах с целью определения эффективной концентрации для разных клеточных линий. Использованная PK/PD-модель нейтрализации опухоли с транзитным компартментом была описана ранее Simeoni et al. (Simeoni et al, Cancer Res, 64:1094, (2004)). Модель была модифицирована для учета линейного, экспоненциального и логистического роста опухоли и насыщающей нейтрализации лекарственным средством. Параметры PK/PD-модели включают:
|
Результаты PK/PD-моделирования используют для вычисления концентрации, приводящей к прекращению увеличения объема опухоли (Tumor Static Concentration (TSC, уравнение 1)). Она представляет собой концентрацию лекарственного средства, при которой скорость роста опухоли и нейтрализации опухоли равны и объем опухоли не меняется. TSC может быть определена как минимальная концентрация, необходимая для эффективности. TSC используют в качестве ориентира при выборе клинической дозы, при этом для клинической эффективности необходимы концентрации, превышающие TSC.
Фармакокинетику A1-mcMMAF у мышей определяли в отдельном исследовании (3 мг/кг, внутривенное введение самкам бестимусных мышей nu/nu). Ксенотрансплантационные исследования на мышах проводили с использованием 3 разных 5Т4-клеточных линий с введением A1-mcMMAF в дозах от 1 до 30 мг/кг каждые 4 суток: клеточной линии MDAMB435/5T4 (введение в дозах 1,3, 10 и 30 мг/кг), клеточной линии Н1975 (введение в дозах 1, 3 и 10 мг/кг) и клеточной линии 37622А (введение в дозах 1 и 10 мг/кг). PK/PD-моделирование проводили, как описано ранее, и TSC приведены в Таблице 17.
PK/PD-параметры у мышей для каждой ксенотрансплантированной клеточной линии сочетали с прогнозируемой фармакокинетикой A1-mcMMAF у человека для имитации доз, необходимых для клинической эффективности. При применении этой методологии прогнозируемая минимальная эффективная клиническая доза A1-mcMMAF составляет от приблизительно 0,22 до приблизительно 2,3 мг/кг один раз в 3 недели [каждые три недели] (Таблица 17).
В одном воплощении настоящего изобретения диапазоны доз могут быть в диапазоне от приблизительно 0,18 мг/кг до приблизительно 2,7 мг/кг, от приблизительно 0,22 мг/кг до приблизительно 2,6 мг/кг, от приблизительно 0,27 мг/кг до приблизительно 2,5 мг/кг, от приблизительно 0,32 мг/кг до приблизительно 2,3 мг/кг, от приблизительно 0,37 мг/кг до приблизительно 2,15 мг/кг, от приблизительно 0,42 мг/кг до приблизительно 2,10 мг/кг, от приблизительно 0,47 мг/кг до приблизительно 2,05 мг/кг, от приблизительно 0,52 мг/кг до приблизительно 2,00 мг/кг, от приблизительно 0,57 мг/кг до приблизительно 1,95 мг/кг, от приблизительно 0,62 мг/кг до приблизительно 1,90 мг/кг, от приблизительно 0,67 мг/кг до приблизительно 1,85 мг/кг, от приблизительно 0,72 мг/кг до приблизительно 1,80 мг/кг, от приблизительно 0,82 мг/кг до приблизительно 1,70 мг/кг, от приблизительно 0,92 мг/кг до приблизительно 1,60 мг/кг, от приблизительно 1,02 мг/кг до приблизительно 1,50 мг/кг, от приблизительно 1,12 мг/кг до приблизительно 1,40 мг/кг или от приблизительно 1,20 мг/кг до приблизительно 1,30 мг/кг при введении один раз в 3 недели. Предпочтительно, диапазоны доз могут быть в диапазоне от приблизительно 0,22 мг/кг до приблизительно 2,3 мг/кг.
Уравнение 1
1.1
Если 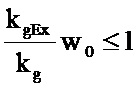
 , то
, то 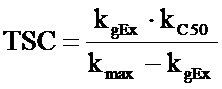 .
.
1.2
Если 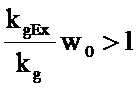 , то
, то 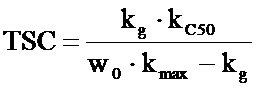 .
.
|
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1: Тяжелая цепь человеческого IgG1 гуманизированного A1

SEQ ID NO: 2: Человеческая легкая цепь каппа гуманизированного A1

SEQ ID NO: 3: VH A1

SEQ ID NO: 4: VLA1

SEQ ID NO: 5: CDR1 тяжелой цепи A1
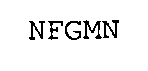 SEQ ID NO: 6: CDR2 тяжелой цепи A1
SEQ ID NO: 6: CDR2 тяжелой цепи A1
WINTNTGEPRYAEEFKG
SEQ ID NO: 7: CDR3 тяжелой цепи A1
DWDGAYFFDY
SEQ ID NO: 8: CDR1 легкой цепи A1
KASQSVSNDVA
SEQ ID NO: 9: CDR2 легкой цепи A1
FATNRYT
SEQ ID NO: 10: CDR3 легкой цепи A1
QQDYSSPWT
SEQ ID NO: 11: Человеческий антиген 5T4

SEQ ID NO: 12: Тяжелая цепь человеческого IgG4m гуманизированного A1

SEQ ID NO: 13: VH человеческого IgG4m A1 (A1-IGG4-VH)

SEQ ID NO: 14: A1-IgG4-VH-CDR1
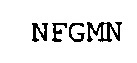
SEQ ID NO: 15: Тяжелая цепь химерного A3 (muA3-huIgG1)

SEQ ID NO: 16: VH химерного A3
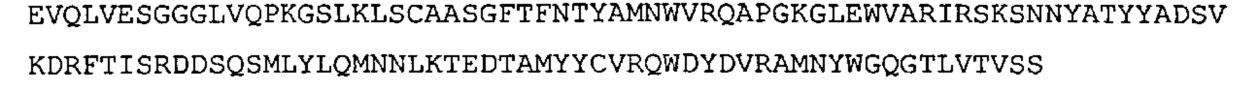
SEQ ID NO: 17: CDR1 VH химерного A3
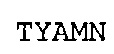
SEQ ID NO: 18: CDR2 VH химерного A3

SEQ ID NO: 19: CDR3 VH химерного A3
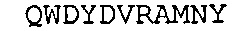
SEQ ID NO: 20: Легкая цепь химерного A3 (плиА3-huKappa)

SEQ ID NO: 21: VL химерного A3
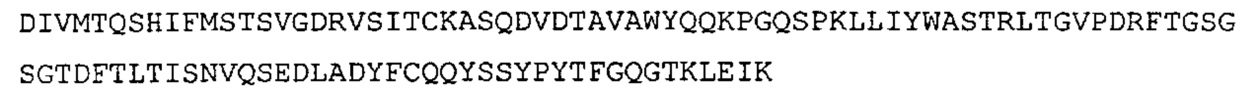
SEQ ID NO: 22: CDR1 VL химерного A3
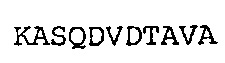
SEQ ID NO: 23: CDR2 VL химерного A3
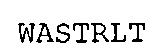
SEQ ID NO: 24: CDR3 VL химерного A3
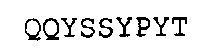
SEQ ID NO: 25: Тяжелая цепь человеческого IgG1 гуманизированного A3

SEQ ID NO: 26: VH гуманизированного A3
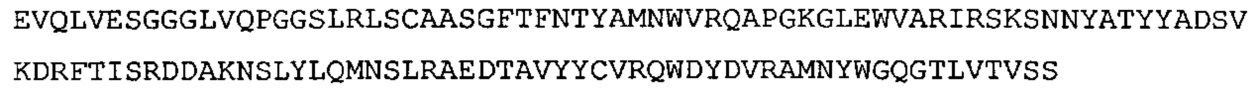
SEQ ID NO: 27: CDR1 VH гуманизированного A3

SEQ ID NO: 28: CDR2 VH гуманизированного A3

SEQ ID NO: 29: CDR3 VH гуманизированного A3
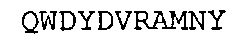
SEQ ID NO: 30: Человеческая легкая цепь каппа гуманизированного A3

SEQ ID NO: 31: VL гуманизированного A3
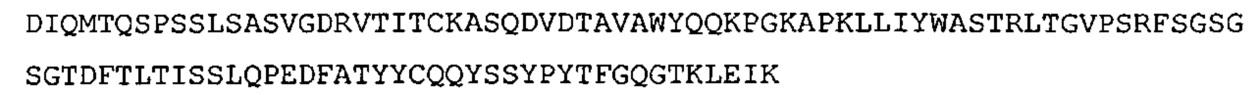
SEQ ID NO: 32: CDR1 VL гуманизированного A3
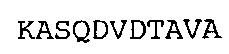
SEQ ID NO: 33: CDR2 VL гуманизированного A3
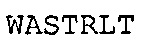
SEQ ID NO: 34: CDR3 VL гуманизированного A3