Результат интеллектуальной деятельности: КОНЪЮГАТ ПОЛИСАХАРИД-БЕЛОК ДЛЯ ИНДУЦИРОВАНИЯ ИММУННОГО ОТВЕТА И ЗАЩИТЫ ПРОТИВ ИНФЕКЦИИ Staphylococcus aureus, СПОСОБЫ ПОЛУЧЕНИЯ КОНЪЮГАТА (ВАРИАНТЫ), КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТ И СПОСОБЫ ИНДУЦИРОВАНИЯ ИММУННОГО ОТВЕТА И ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ Staphylococcus aureus
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
Эта заявка заявляет приоритет предварительных заявок на патент США №61/219143 и 61/219151 с датой подачи 22 июня 2009 г., полное описание которых включено посредством ссылки во всей их полноте.
Область изобретения
Это изобретение в общем относится к иммуногенным композициям конъюгатов капсулярных полисахаридов Staphylococcus aureus серотипов 5 и 8 и способам их получения и применения.
Предшествующий уровень техники
Люди являются природным резервуаром для грамположительных Staphylococcus aureus. Например, S.aureus могут колонизировать кожу, носовую полость и горло либо постоянно, либо временно, не вызывая заболевание. Инфекции S.aureus находятся в диапазоне от легких кожных инфекций до эндокардита, остеомиелита, бактериемии и сепсиса. S.aureus также вызывает большинство нозокомиальных инфекций, и его распространенность в локальных вспышках инфекций растет. Более того, в 2005 г. устойчивые к метициллину инфекции S.aureus (MRSA) в США были установлены в 31,8 случаев на 100000 индивидов, включая 16650 случаев смерти в 2005 г. (Klevens et al. (2007) J.Am.Med. Assoc. 298:1763-1771). Впоследствии заболевание может иметь место у лиц с ослабленным иммунитетом по причине брешей в иммунных барьерах, таких как возникающие во время хирургии, при установке постоянных катетеров или других устройств, при травме или ранениях.
S.aureus продуцирует большое число вне- и внутриклеточных антигенов, в том числе многочисленных токсинов и ферментов. Особый интерес представляют капсулярные полисахариды определенных серотипов S.aureus (см. Karakawa & Vann, "Capsular polysaccharides of Staphylococcus aureus" в Weinstein & Fields, eds. Seminars in Infectious Diseases IV, Bacterial Vaccines. (New York, NY; Thieme Stratton; 1982. pp.285-293), особенно капсулярные полисахариды серотипов 5 и 8. Эпидемиологические исследования на большом числе штаммов S.aureus, изолированных из отдельных лиц, показали, что от 70% до 80% относятся к капсулярным полисахаридам серотипов 5 или 8 (Arbeit et al. (1984) Diagn. Microbiol. Infect. Dis. 2:85-91). К несчастью, сами по себе эти капсулярные полисахариды являются плохими иммуногенами.
Стафилококковые инфекции и заболевания резко возросли в последний двадцать лет, как и применение внутрисосудистых устройств и инвазивных процедур. Этот рост заболеваемости вызывает еще больше беспокойства в связи с параллельным ростом устойчивости к антибиотикам; поэтому имеется острая необходимость в иммуногенных композициях для предотвращения стафилококковых инфекций и заболеваний.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на иммуногенные конъюгаты, содержащие капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком-носителем, и на способы получения таких конъюгатов. Капсулярные полисахариды S.aureus серотипа 5 или 8 можно получать непосредственно из бактерий, используя способы выделения, известные специалистам, их можно получать с помощью синтетических способов, либо их можно получать рекомбинантным образом, используя генно-инженерные способы, также известные специалистам. Кроме того, в настоящем изобретении предложены способы индукции иммунного ответа против бактерии Staphylococcus, способы предупреждения заболевания, вызываемого бактерией Staphylococcus, и способы снижения тяжести по меньшей мере одного симптома заболевания, вызываемого инфекцией бактерией Staphylococcus.
В одном из воплощений это изобретение включает иммуногенный конъюгат полисахарид-белок, содержащий выделенный капсулярный полисахарид Staphylococcus aureus серотипа 5 или 8, конъюгированный с белком носителем, где полисахарид имеет молекулярную массу между 20 кДа и 1000 кДа. В некоторых воплощениях иммуногенный конъюгат имеет молекулярную массу между 200 кДа и 5000 кДа. В одном из воплощений полисахаридная часть иммуногенного конъюгата имеет диапазон молекулярных масс между 70 кДа и 300 кДа. В одном из воплощений иммуногенный конъюгат имеет диапазон молекулярных масс между 500 кДа и 2500 кДа.
В одном из воплощений капсулярный полисахарид серотипа 5 или 8 имеет степень O-ацетилирования, равную 10-100%. В одном из воплощений степень O-ацетилирования составляет 50-100%. В одном из воплощений степень O-ацетилирования составляет 75-100%. В одном из воплощений иммуногенный конъюгат генерирует антитело, которое является функциональным при измерении по умерщвлению бактерий либо в модели эффективности на животном, либо в анализе опсонофагоцитарного умерщвления.
В одном из воплощений белок носитель иммуногенного конъюгата содержит CRM197. В одном из воплощений CRM197 ковалентно связан с полисахаридом посредством карбаматной связи, амидной связи или их обеих. В одном из воплощений молярное соотношение лизинов, конъюгированных с CRM197, может составлять от примерно 10:1 до примерно 25:1. В одном из воплощений конъюгат содержит одну ковалентную связь между CRM197 и полисахаридом по меньшей мере на каждые 5-10 повторяющихся сахаридных единиц полисахарида. В одном из воплощений связь между белком носителем и полисахаридом имеет место один раз на каждые 5 повторяющихся единиц полисахарида.
В одном из воплощений иммуногенный конъюгат, содержащий CRM197, содержит от 5 до 22 лизинов или от 8 до 15 лизинов, ковалентно связанных с полисахаридом. В одном из воплощений иммуногенный конъюгат, содержащий CRM197, содержит от 5 до 23 лизинов или от 8 до 12 лизинов, ковалентно связанных с полисахаридом.
В одном из воплощений иммуногенный конъюгат содержит полисахарид типа 5 или 8, который O-ацетилирован на 10-100%. В одном из воплощений иммуногенный конъюгат содержит полисахарид типа 5 или 8, который O-ацетилирован на 50-100%. В одном из воплощений иммуногенный конъюгат содержит полисахарид типа 5 или 8, который O-ацетилирован на 75-100%. В некоторых воплощениях иммуногенную композицию можно использовать для получения антител, которые являются функциональными в модели эффективности на животном или в анализе опсонофагоцитарного умерщвления.
В одном из воплощений иммуногенный конъюгат содержит менее примерно 30% свободного полисахарида типа 5 или 8 по сравнению с суммарным количеством полисахарида типа 5 или 8.
В одном из воплощений иммуногенный конъюгат содержит менее примерно 20% свободного полисахарида типа 5 или 8 по сравнению с суммарным количеством полисахарида типа 5 или 8.
В одном из воплощений это изобретение включает иммуногенную композицию, содержащую иммуногенный конъюгат, как он описан здесь, и по меньшей мере один адъювант, разбавитель или носитель.
Адъювант может быть адъювантом на основе алюминия, таким как один или более чем один из фосфата алюминия, сульфата алюминия и гидроксида алюминия. В одном из воплощений адъювант содержит фосфат алюминия.
В одном из воплощений иммуногенная композиция содержит менее примерно 30% свободного полисахарида типа 5 или 8 по сравнению с суммарным количеством полисахарида типа 5 или 8.
В одном из воплощений иммуногенная композиция содержит менее примерно 20% свободного полисахарида типа 5 или 8 по сравнению с суммарным количеством полисахарида типа 5 или 8.
В одном из воплощений это изобретение включает способ индуцирования иммунного ответа на конъюгат капсулярного полисахарида Staphylococcus aureus серотипа 5 или 8 у субъекта, включающий введение этому субъекту иммунологически эффективного количества иммуногенной композиции, как она описана здесь.
В одном из воплощений это изобретение включает способ получения иммуногенного конъюгата полисахарид-белок, содержащего выделенный капсулярный полисахарид Staphylococcus aureus серотипа 5 или 8, конъюгированный с белком носителем, включающий стадии: взаимодействия выделенного капсулярного полисахарида S.aureus серотипа 5 или 8 с реагентом 1,1-карбонил-ди-(1,2,4-триазол) (CDT) в органическом растворителе с получением активированного полисахарида серотипа 5 или 8; и взаимодействия активированного полисахарида серотипа 5 или 8 с белком носителем в органическом растворителе с получением конъюгата полисахарида серотипа 5 или 8 с белком носителем.
В одном из воплощений способ активации капсулярного полисахарида Staphylococcus aureus серотипа 5 или 8 дополнительно включает лиофилизацию выделенного полисахарида серотипа 5 или 8 и ресуспендирование лиофилизированного полисахарида в органическом растворителе. В одном из воплощений ресуспендированный полисахарид активируют и затем непосредственно подвергают взаимодействию с белком носителем. В одном из воплощений активированный выделенный полисахарид серотипа 5 или 8 выделяют перед взаимодействием с белком носителем. В одном из воплощений выделенный активированный полисахарид серотипа 5 или 8 лиофилизируют с получением лиофилизированного активированного выделенного полисахарида серотипа 5 или 8 перед взаимодействием полисахарида с белком носителем. В одном из воплощений способ получения выделенного конъюгата полисахарида с белком носителем включает стадию лиофилизации белка носителя с получением лиофилизированного белка носителя перед взаимодействием белка носителя с полисахаридом. В одном из воплощений способ получения выделенного конъюгата полисахарида с белком носителем включает стадию ресуспендирования лиофилизированного активированного выделенного полисахарида серотипа 5 или 8 и лиофилизированного белка носителя в органическом растворителе в качестве части взаимодействия активированного выделенного полисахарида серотипа 5 или 8 с белком носителем.
В одном из воплощений способ получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем включает стадию разбавления реакционной смеси активированного полисахарида и белка носителя и поддержания рН от примерно 8,8 до примерно 9,2 в течение по меньшей мере 4 часов при температуре от примерно 20°С до примерно 26°С.
В одном из воплощений реакционную смесь активированного капсулярного полисахарида S.aureus типа 5 или 8 и белка носителя поддерживают при рН примерно 9,0 в течение по меньшей мере 4 часов при температуре примерно 23°С.
В одном из воплощений способ получения выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем включает стадию выделения конъюгата выделенного полисахарида серотипа 5 или 8 с белком после его получения. В одном из воплощений органический растворитель, используемый в способе получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем, представляет собой полярный апротонный растворитель. В одном из воплощений полярный апротонный растворитель выбран из группы, состоящей из диметилсульфоксида (DMSO). В одном из воплощений способа получения конъюгата выделенного полисахарида с белком носителем органический растворитель представляет собой DMSO.
В одном из воплощений способ получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 с белком носителем включает стадию доведения концентрации воды в реакционной смеси, содержащей капсулярный полисахарид типа 5 и CDT в органическом растворителе, до примерно 0,1-0,3%. В одном из воплощений концентрацию воды в реакционной смеси, содержащей капсулярный полисахарид типа 5 и CDT в органическом растворителе, доводят до примерно 0,2%.
В одном из воплощений стадия активации выделенного капсулярного полисахарида S.aureus типа 5 включает взаимодействие полисахарида с количеством CDT, которое составляет примерно 20-кратный молярный избыток относительно количества полисахарида, присутствующего в реакционной смеси, содержащей капсулярный полисахарид типа 5 и CDT в органическом растворителе.
В одном из воплощений способ получения конъюгата выделенного капсулярного полисахарида S.aureus типа 8 с белком носителем включает стадию определения содержания воды в реакционной смеси, содержащей капсулярный полисахарид типа 8. В одном из воплощений CDT добавляют к реакционной смеси для активации полисахарида в количестве, примерно равном количеству CDT, которое является эквимолярным количеству воды, присутствующей в реакционной смеси, содержащей капсулярный полисахарид типа 8 и CDT в органическом растворителе.
В одном из воплощений CDT добавляют к реакционной смеси для активации полисахарида в таком количестве, что оно находится в молярном соотношении примерно 0,5:1 по сравнению с количеством воды, присутствующей в реакционной смеси, содержащей капсулярный полисахарид типа 8 и CDT в органическом растворителе. В одном из воплощений CDT добавляют к реакционной смеси для активации полисахарида в таком количестве, что оно находится в молярном соотношении примерно 0,75:1 по сравнению с количеством воды, присутствующей в реакционной смеси, содержащей капсулярный полисахарид типа 8 и CDT в органическом растворителе.
В одном из воплощений способ, который включает стадию выделения активированного полисахарида, включает стадию диафильтрации.
В одном из воплощений способа, который включает лиофилизацию белка-носителя, белок-носитель перед лиофилизацией подвергают диафильтрации против NaCl, и массовое соотношение NaCl/белок носитель доводят до примерно 0,5-1,5. В одном из воплощений соотношение NaCl и белка носителя составляет примерно 1.
В одном из воплощений белок-носитель, используемый в способе получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 и белка носителя, содержит CRM197.
В одном из воплощений CRM197, используемый в способе получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем, подвергают взаимодействию с активированным полисахаридом серотипа 5 или 8 в массовом соотношении примерно 1:1.
В одном из воплощений способ получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем включает стадию смешивания капсулярного полисахарида типа 5 или 8 с имидазолом или триазолом перед перемешиванием с CDT в органическом растворителе.
В одном из воплощений способ получения конъюгата выделенного капсулярного полисахарида S.aureus типа 5 или 8 с белком носителем включает стадию гидролиза конъюгата полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп.
В одном из воплощений в этом изобретении предложен способ получения иммуногенного конъюгата, содержащего выделенный капсулярный полисахарид Staphylococcus aureus серотипа 5 или 8, конъюгированный с белком носителем, включающий стадии: взаимодействия капсулярного полисахарида S.aureus серотипа 5 или 8 с 3-(2-пиридилдитио)-пропионилгидразидом (PDPH) и карбодиимидом в органическом растворителе с получением полисахарида, связанного с PDPH; взаимодействия полисахарида, связанного с PDPH, с восстановителем с получением активированного полисахарида; выделения активированного полисахарида серотипа 5 или 8 с получением выделенного активированного полисахарида серотипа 5 или 8; предоставления активированного белка носителя; взаимодействия выделенного активированного полисахарида серотипа 5 или 8 с активированным белком носителем с получением конъюгата полисахарида серотипа 5 или 8 с белком носителем; посредством которых получают иммуногенный конъюгат, содержащий выделенный капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем. В одном из воплощений активированный белок носитель выделяют перед взаимодействием активированного белка носителя с активированным полисахаридом.
В одном из воплощений стадия выделения активированного белка носителя дополнительно включает лиофилизацию выделенного активированного полисахарида серотипа 5 или 8 с получением лиофилизированного активированного полисахарида серотипа 5 или 8.
В одном из воплощений бромуксусная кислота включает N-гидроксисукцинимидный эфир бромуксусной кислоты (BAANS).
В одном из воплощений способ получения конъюгата капсулярного полисахарида серотипа 8 с белком носителем, в котором используют PDPH, включает использование органического растворителя, который представляет собой полярный апротонный растворитель. В одном из воплощений полярный апротонный растворитель выбран из группы, состоящей из диметилсульфоксида (DMSO), диметилформамида (DMF), диметилацетамида, N-метил-2-пирролидона и гексаметилфосфорамида (НМРА). В одном из воплощений органический растворитель представляет собой диметилсульфоксид (DMSO).
В одном из воплощений карбодиимид, используемый в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH, представляет собой 1-этил-3-(3-диметиламинопропил)-карбодиимид (EDAC).
В одном из воплощений способ получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, включает стадию взаимодействия капсулярного полисахарида серотипа 5 или 8 с PDPH и EDAC в органике в массовом соотношении полисахарид:PDPH:EDAC примерно 1:5:3.
В одном из воплощений восстанавливающий агент, используемый в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором использует PDPH и EDAC, представляет собой дитиотрейтол (DTT).
В одном из воплощений активация белка носителя в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, включает взаимодействие белка носителя с бромуксусной кислотой.
В одном из воплощений стадия выделения активированного полисахарида серотипа 5 или 8 в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, включает диафильтрацию.
В одном из воплощений способ получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, включает стадию гидролиза конъюгата полисахарида серотипа 5 и 8 с белком носителем для удаления непрореагировавших активационных групп. В одном из воплощений стадия гидролиза конъюгата полисахарида серотипа 5 и 8 с белком носителем включает добавление гидрохлорида цистеамина.
В одном из воплощений способ получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, дополнительно включает выделение иммуногенного конъюгата, содержащего выделенный капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем.
В одном из воплощений выделение конъюгата полисахарида серотипа 5 и 8 с белком носителем включает диафильтрацию.
В одном из воплощений белок-носитель, используемый в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, содержит CRM197.
В одном из воплощений CRM197 в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с CRM197, в котором используют PDPH и EDAC, добавляют в массовом соотношении CRM197:молекула капсулярного полисахарида примерно 1:1.
В одном из воплощений активированный капсулярный полисахарид типа 5 или 8, используемый в способе получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, имеет размер от примерно 50 кДа до примерно 500 кДа.
В одном из воплощений иммуногенный конъюгат, получаемый способом получения конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, в котором используют PDPH и EDAC, имеет размер между примерно между 400 кДа и примерно 5000 кДа.
В одном из воплощений в этом изобретении предложена иммуногенная композиция, содержащая конъюгат капсулярного полисахарида типа 5 или 8 с белком носителем, получаемым любым описанным здесь способом.
В одном из воплощений в этом изобретении предложена иммуногенная композиция, содержащая конъюгат капсулярного полисахарида типа 5 или 8 с белком носителем, получаемый любым описанным здесь способом, и по меньшей мере один адъювант, разбавитель или носитель. В одном из воплощений иммуногенные композиции содержат адъювант на основе алюминия, который может быть выбран из группы, состоящей из фосфата алюминия, сульфата алюминия и гидроксида алюминия. В одном из воплощений описанные здесь иммуногенные композиции содержат адъювант, представляющий собой фосфат алюминия.
Описанные здесь иммуногенные композиции могут содержать менее 30% и менее 20% свободного полисахарида типа 5 или 8 по сравнению с суммарным количеством полисахарида типа 5 или 8. Описанные здесь иммуногенные композиции можно хранить в воде или в буфере с низкой ионной силой с нейтральным рН.
В одном из воплощений в этом изобретении предложен способ редуцирования или предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного с бактериями Staphylococcus, у субъекта, включающий стадию введения терапевтического или профилактического количества иммуногенной композиции, как она описана здесь, этому субъекту. В одном из воплощений инфекция, заболевание или состояние выбраны из группы, состоящей из инвазии Staphylococcus aureus, сепсиса и носительства.
В одном из воплощений в этом изобретении предложен способ редуцирования или предупреждения стафилококковой инфекции у субъекта, проходящего хирургическую процедуру, включающий стадию введения профилактически эффективного количества иммуногенной композиции, как она описана здесь, этому субъекту перед хирургической процедурой.
В одном из воплощений способ по этому изобретению включает замену CDT на CDI.
В одном из воплощений в этом изобретении предложен капсулярный полисахарид Staphylococcus aureus типа 5 или 8, имеющий молекулярную массу между 50 кДа и 800 кДа, ковалентно связанный с белком носителем, где объединенная молекулярная масса полисахарида, ковалентно связанного с белком носителем, находится между примерно 400 кДа и 5000 кДа.
В одном из воплощений полисахарид, ковалентно связанный с белком носителем, содержит полисахаридную часть, которая имеет диапазон молекулярных масс между 70 кДа и 300 кДа. В одном из воплощений полисахарид, ковалентно связанный с белком носителем, имеет диапазон молекулярных масс между 500 кДа и 2500 кДа.
В одном из воплощений часть, представляющая собой белок носитель, полисахарида, ковалентно связанного с белком носителем, содержит CRM197. В одном из воплощений CRM197 ковалентно связан с полисахаридом посредством карбаматной связи, амидной связи или их обеих. В некоторых воплощениях молярное соотношение конъюгированных лизинов к CRM197 составляет от примерно 10:1 до примерно 25:1. В некоторых воплощениях полисахарид, ковалентно связанный с белком носителем, содержит по меньшей мере одну ковалентную связь с CRM197 по меньшей мере на каждые 5-10 повторяющихся сахаридных единиц полисахарида. В некоторых воплощениях полисахарид, ковалентно связанный с белком носителем, содержит по меньшей мере одну связь между CRM197 и полисахаридом, которая приходится на каждые 5 повторяющихся сахаридных единиц полисахарида. В некоторых воплощениях CRM197 часть полисахарида, ковалентно связанного с CRM197, содержит от 5 до 22 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях CRM197 часть полисахарида, ковалентно связанного с CRM197, содержит от 5 до 23 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях CRM197 часть полисахарида, ковалентно связанного с белком носителем, содержит от 8 до 15 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях CRM197 часть полисахарида, ковалентно связанного с белком носителем, содержит от 8 до 12 лизинов, ковалентно связанных с полисахаридом.
В одном из воплощений в этом изобретении предложена иммуногенная композиция, содержащая полисахарид S.aureus типа 5 или 8, ковалентно связанный с белком носителем, как он описан здесь, и по меньшей мере один адъювант, разбавитель, или носитель.
В одном из воплощений в этом изобретении предложен способ введения иммуногенной композиции, содержащей полисахарид S.aureus типа 5 или 8, ковалентно связанный с белком носителем, как он описан здесь, субъекту для получения иммунного ответа, как описано здесь.
В одном из воплощений в этом изобретении предложен способ выделения полисахарида с молекулярной массой между 20 кДа и 1000 кДа.
В одном из воплощений в этом изобретении предложено антитело, генерируемое капсулярным полисахаридом, иммуногенным конъюгатом или иммуногенной композицией по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Настоящее изобретение будет лучше понято, и иные признаки, аспекты и преимущества, чем те, что указаны выше, станут очевидными при рассмотрении его нижеследующего подробного описания. В этом подробном описании делаются ссылки на следующие графические материалы.
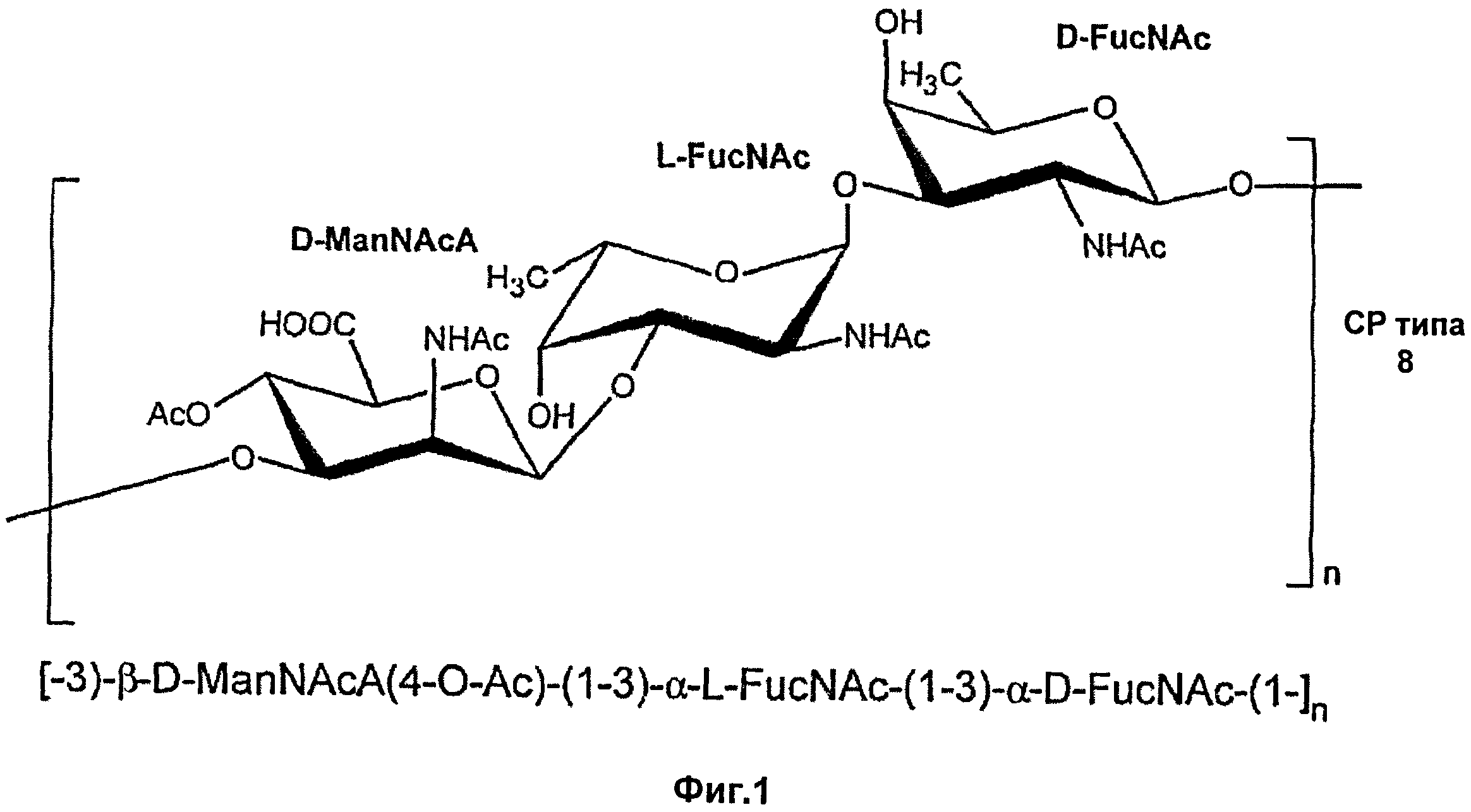
Фиг.1 показывает повторяющуюся полисахаридную структуру капсулярного полисахарида S.aureus серотипа 8 (N-ацетилманнозаминуроновая кислота обозначена как ManNAca, N-ацетил-L-фукозамин обозначен как L-FucNAc, и N-ацетил-D-фукозамин обозначен как D-FucNAc).
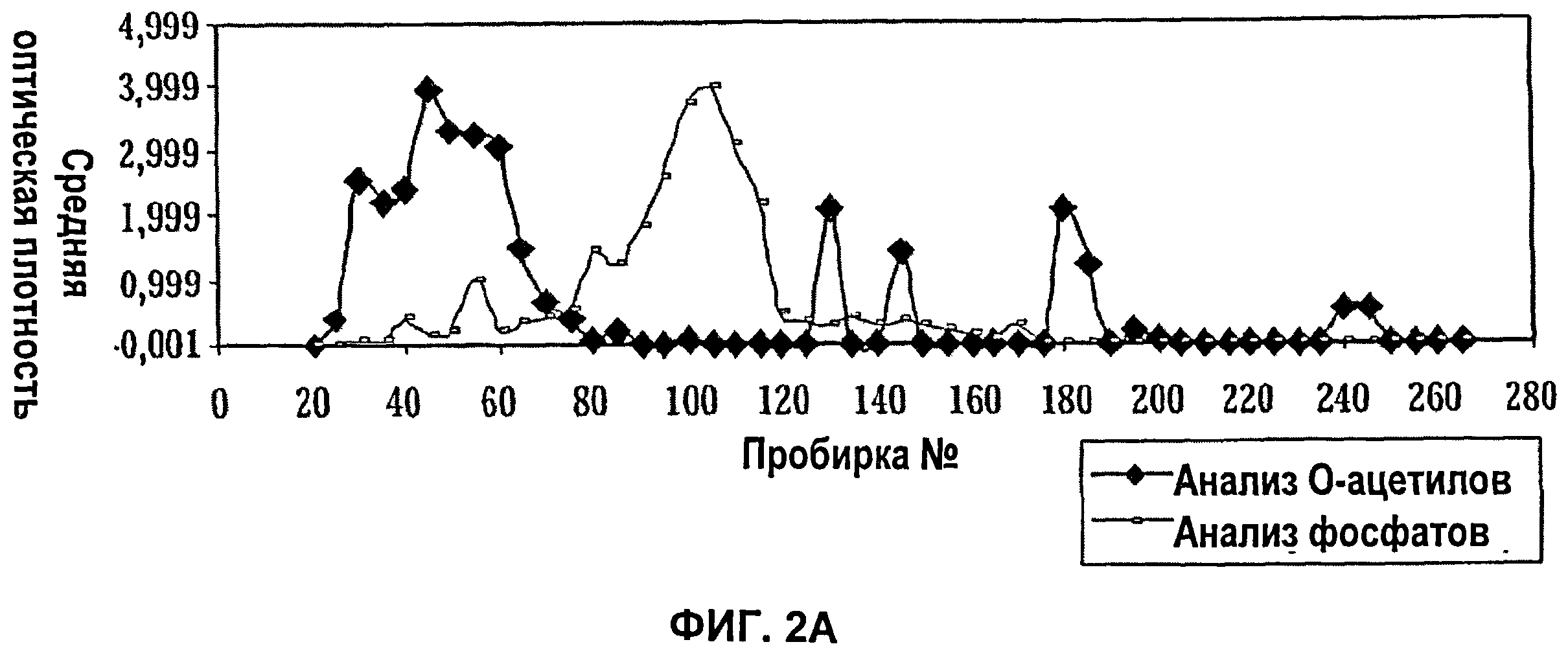
Фиг.2А показывает анализ фракций при ионообменной хроматографии (Q-Сефароза) капсулярного полисахарида S.aureus серотипа 8 (анализ O-ацетила) и тейхоевой кислоты (анализ фосфата); Фиг.2Б показывает анализ фракций при ионообменной хроматографии (Q-Сефароза) капсулярного полисахарида S.aureus серотипа 8 способом двойной иммунодиффузии.
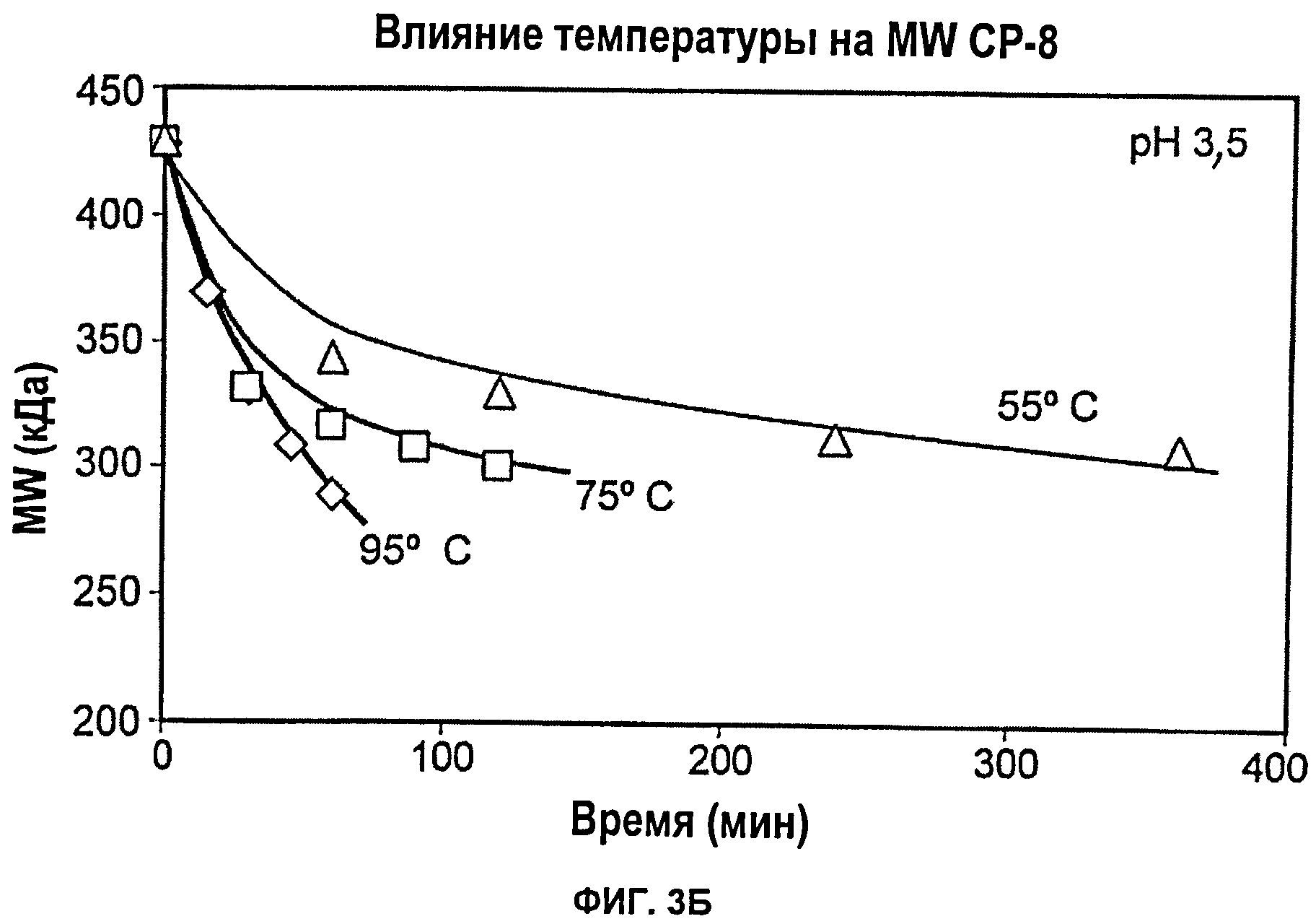
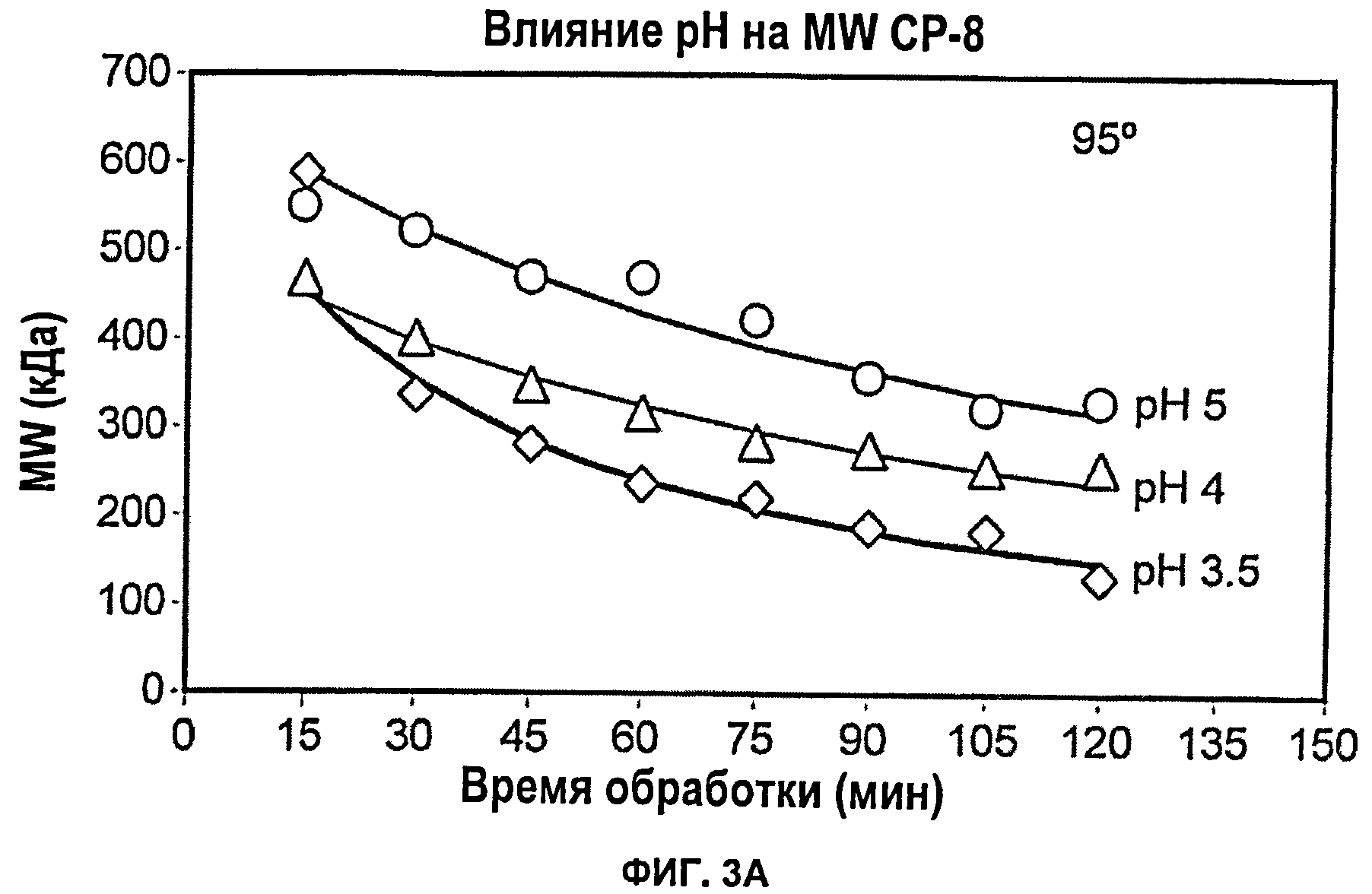
Фиг.3А показывает влияние рН (3, 5, 4 или 5) при 95°С на снижение молекулярной массы капсулярного полисахарида S.aureus серотипа 8 при тепловой обработке; Фиг.3Б показывает влияние температуры (55°С, 75°С или 95°С) при рН 3,5 на снижение молекулярной массы капсулярного полисахарида S.aureus серотипа 8 при тепловой обработке.
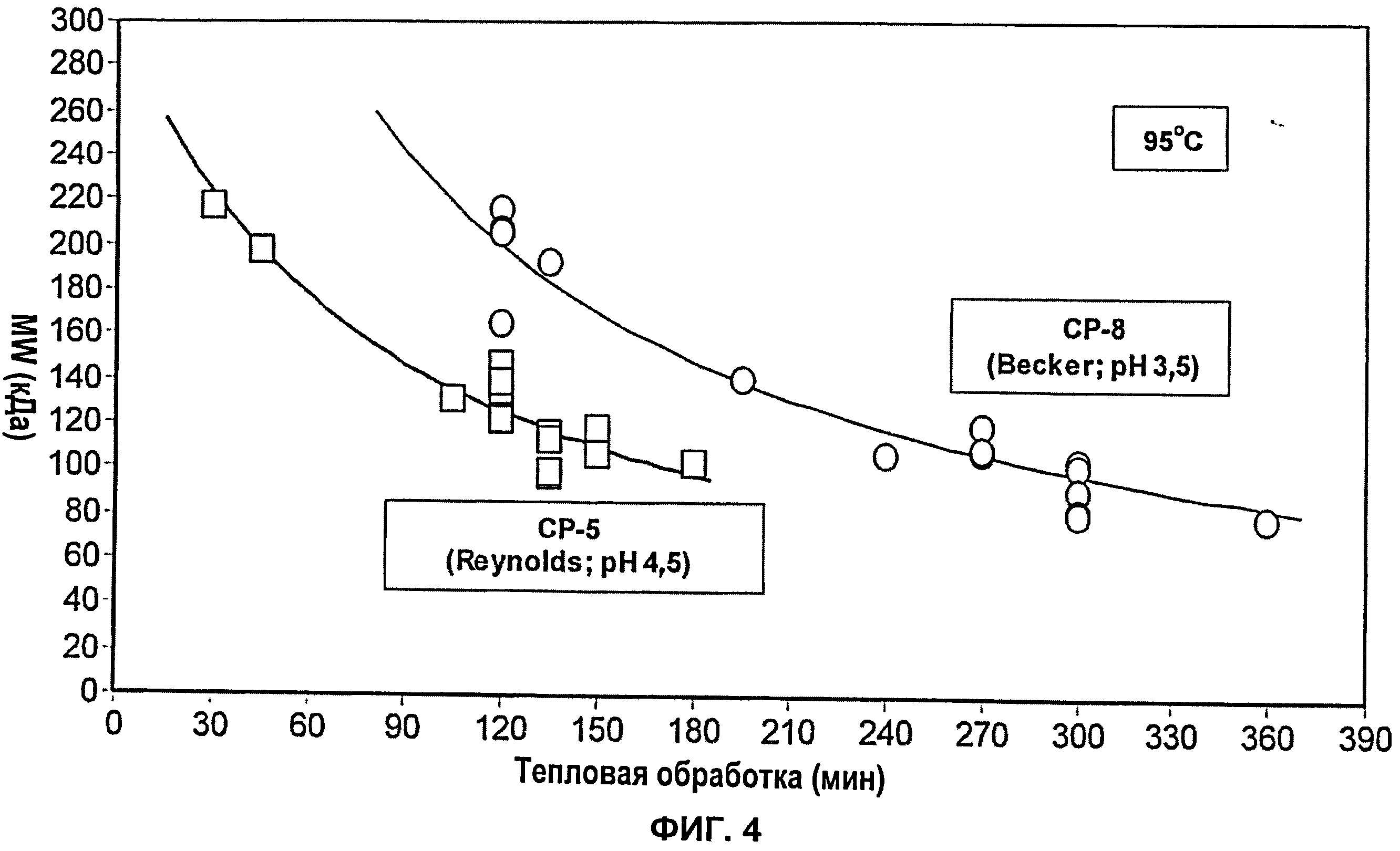
Фиг.4 показывает молекулярную массу очищенного капсулярного полисахарида S.aureus серотипа 8 по сравнению с капсулярным полисахаридом серотипа 5 с течением времени в ходе нагревания при рН 3,5 и 4,5, соответственно, и 95°С.
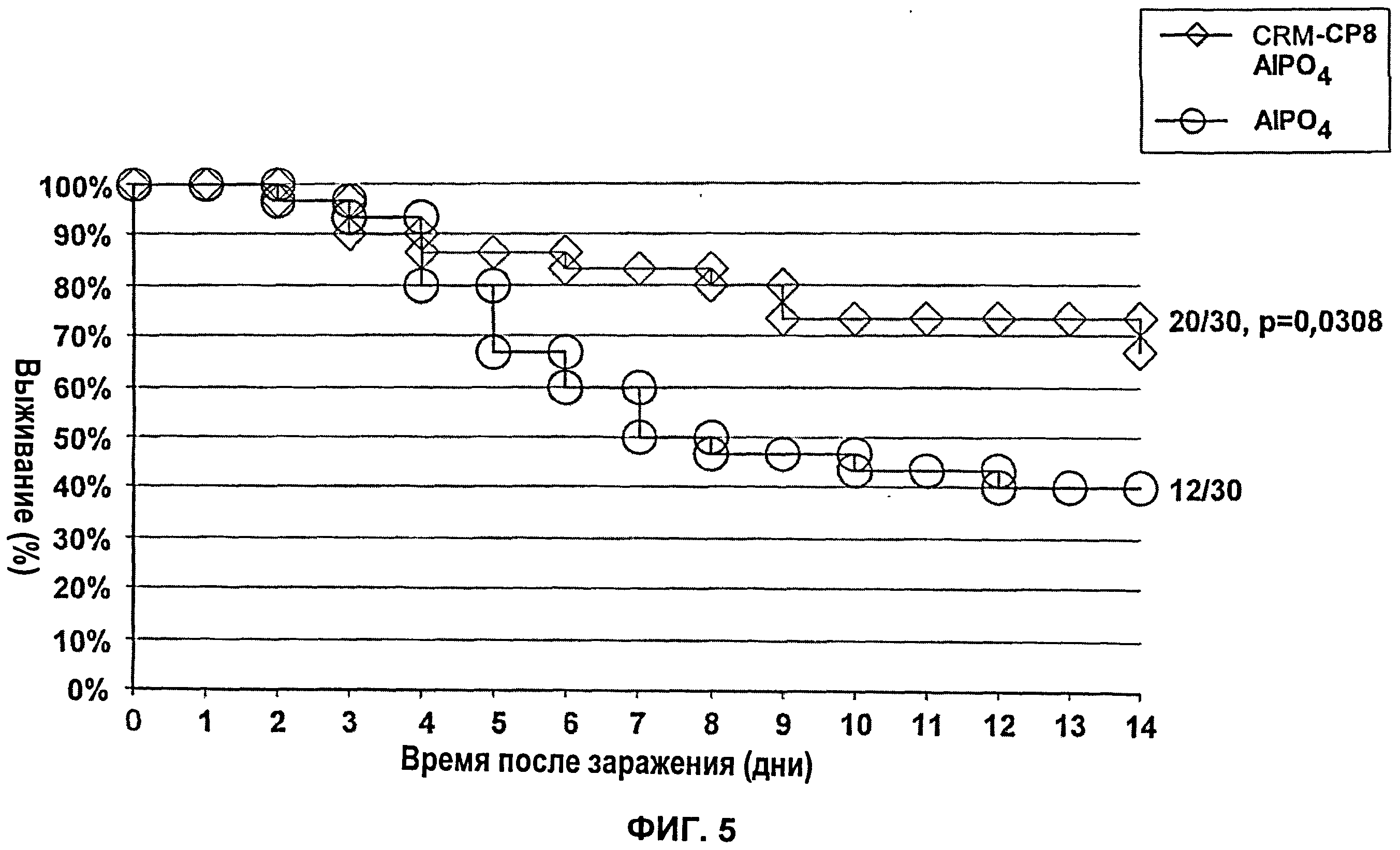
Фиг.5 показывает повышенное выживание мышей, которые получали конъюгат капсулярного полисахарида серотипа 8 с CRM197 (ромбики) при сравнении с контролями, которые получали AlPO4 (кружки).
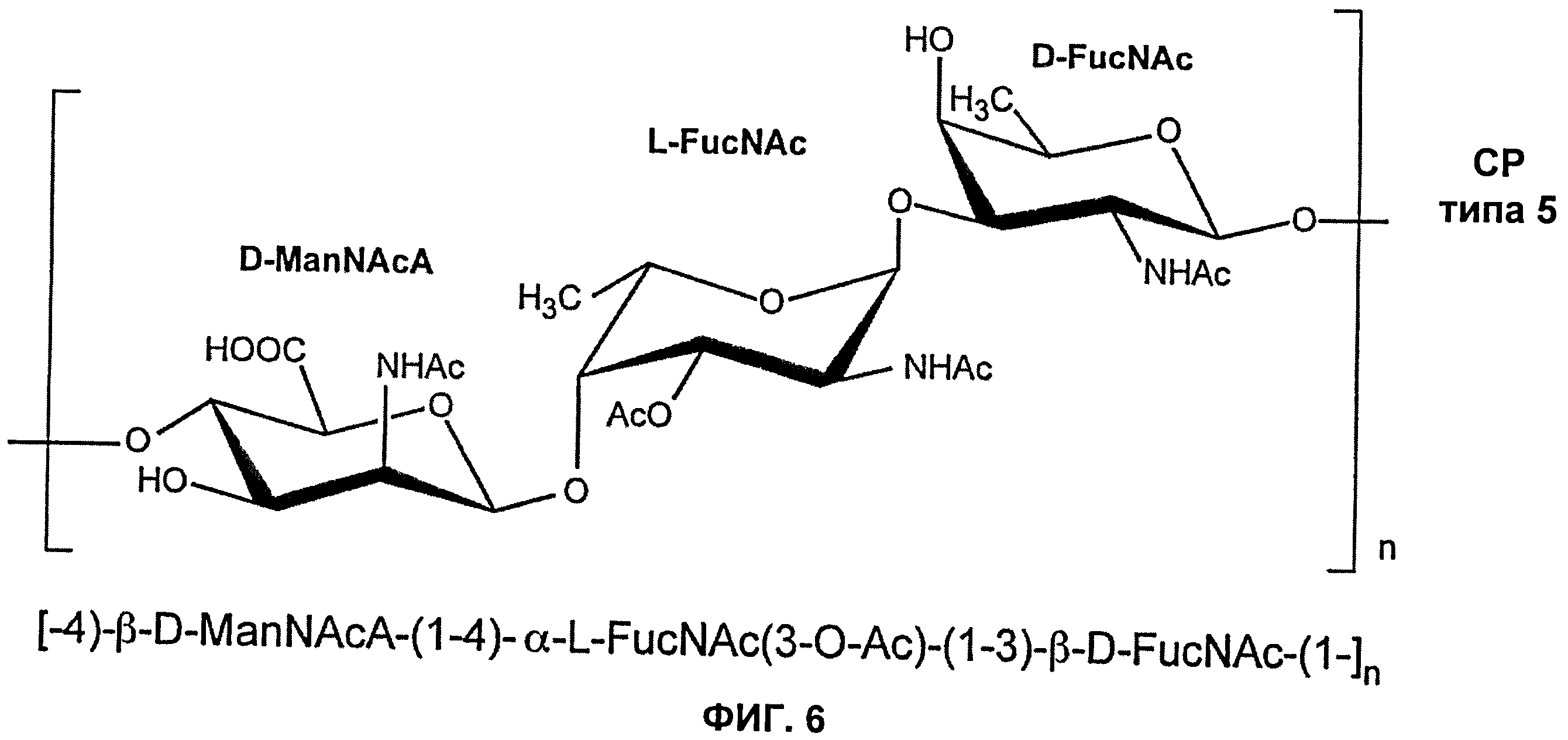
Фиг.6 показывает повторяющуюся полисахаридную структуру полисахарида S.aureus серотипа 5 (N-ацетилманнозаминуроновая кислота обозначена как ManNAcA, N-ацетил-L-фукозамин обозначен как L-FucNAc, и N-ацетил-D-фукозамин обозначен как D-FucNAcA).
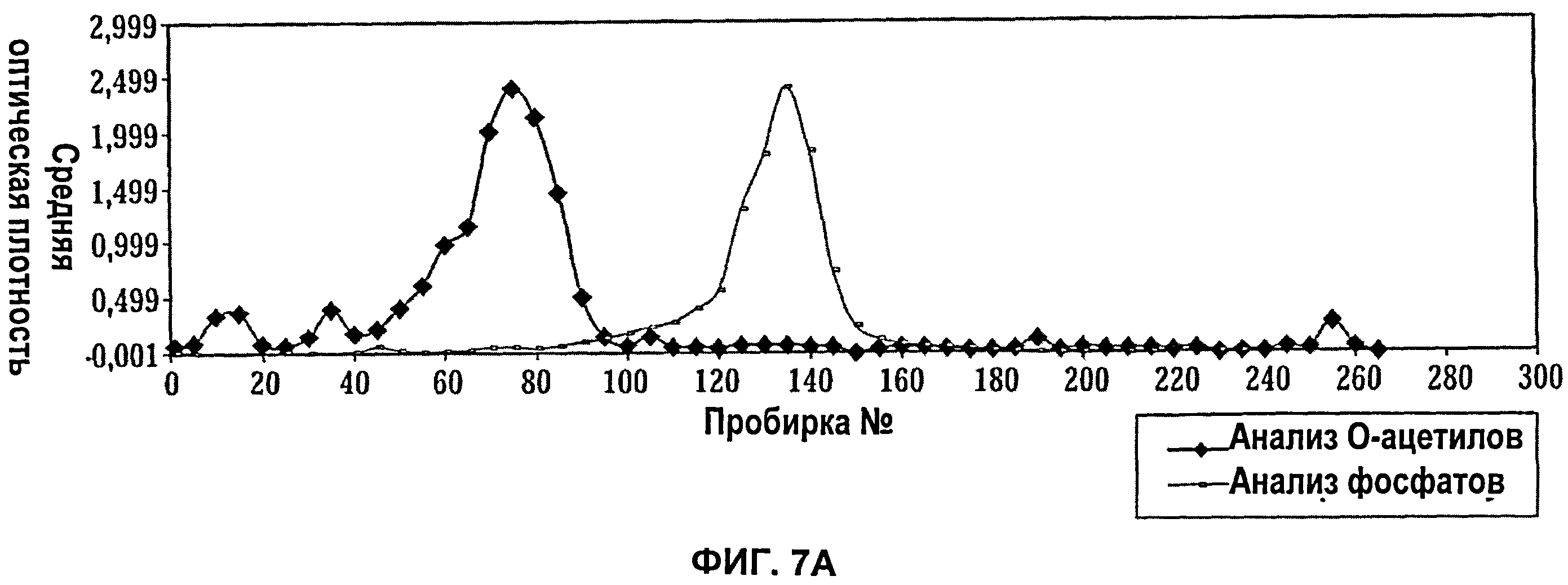
Фиг.7А показывает анализ фракций при ионообменной хроматографии (Q-Сефароза) полисахарида S.aureus серотипа 5 (анализ O-ацетила) и тейхоевой кислоты (анализ фосфата); Фиг.7Б показывает анализ фракций при ионообменной хроматографии (Q-Сефароза) полисахарида S.aureus серотипа 5 способом двойной иммунодиффузии.
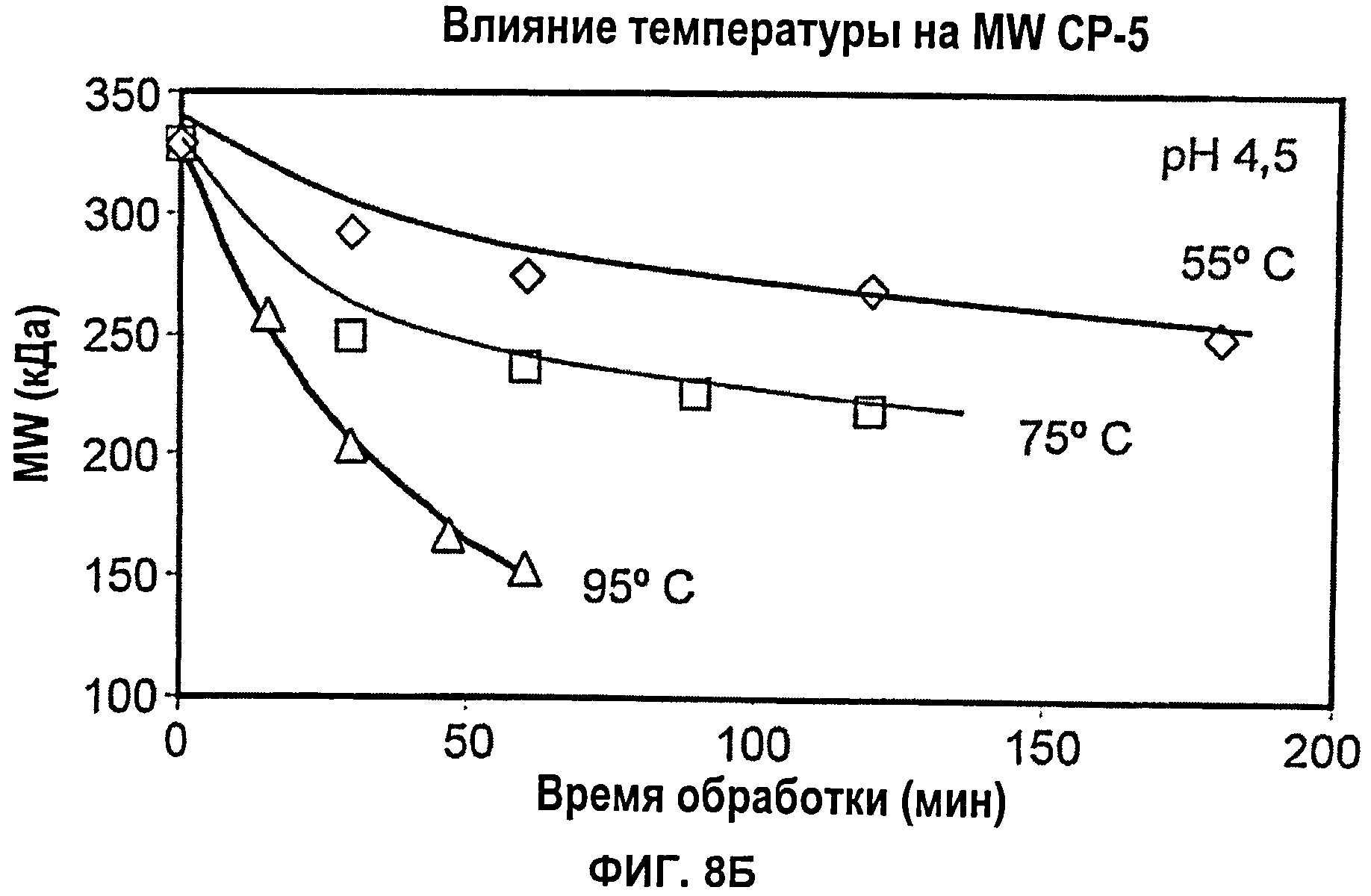
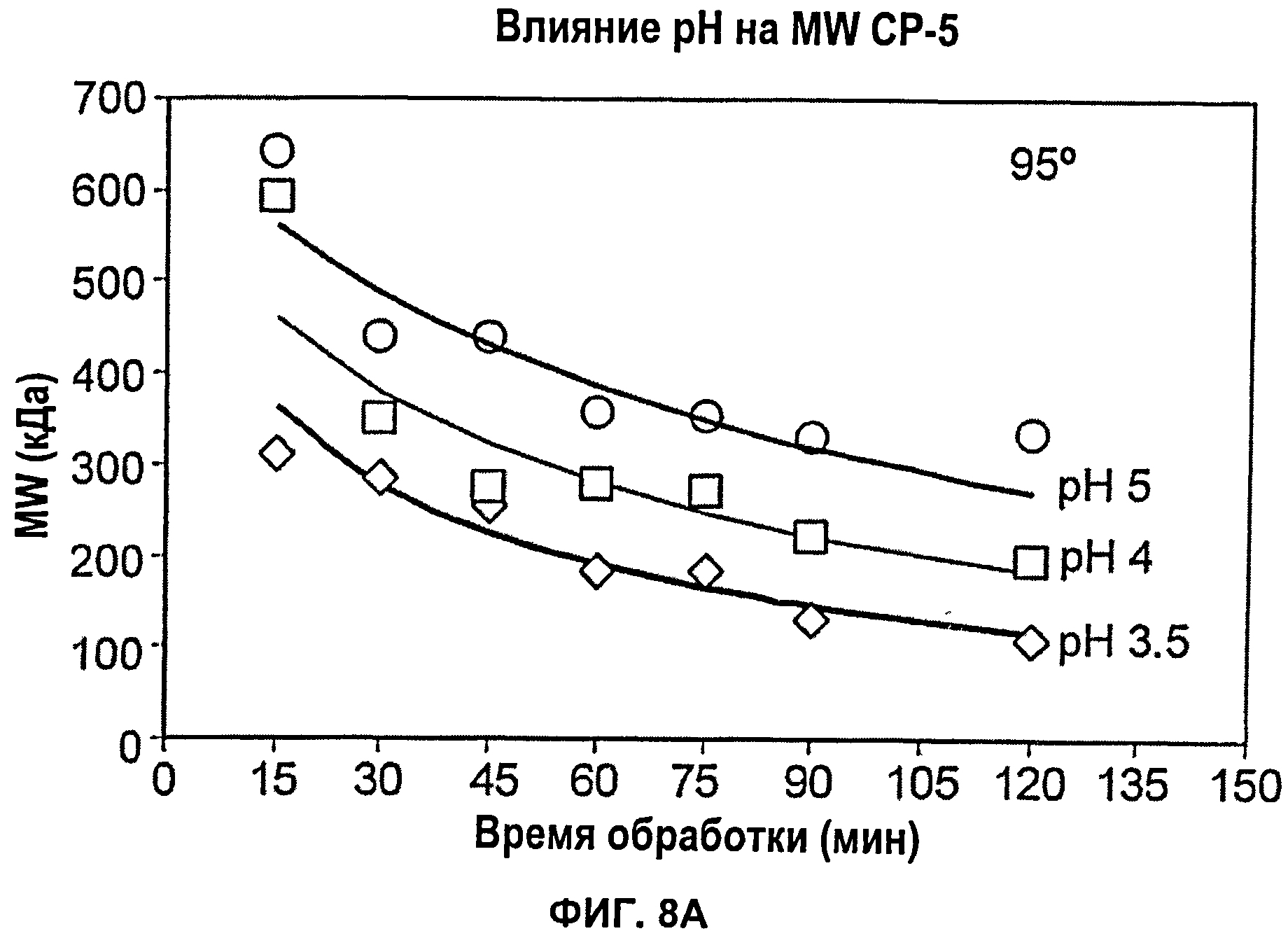
Фиг.8А показывает влияние рН (3,5, 4 или 5) при 95°С на снижение молекулярной массы капсулярного полисахарида S.aureus серотипа 5 при тепловой обработке; Фиг.8Б показывает влияние температуры (55°С, 75°С или 95°С) при рН 3,5 на снижение молекулярной массы капсулярного полисахарида S.aureus серотипа 5 при тепловой обработке.
Фиг.9 показывает ослабление пиелонефрита у мышей, которые получали конъюгат полисахарида серотипа 5 с CRM197 по сравнению с контролями, которые получали забуференный фосфатами физиологический раствор (PBS) (затемненная область представляет обработанных мышей).
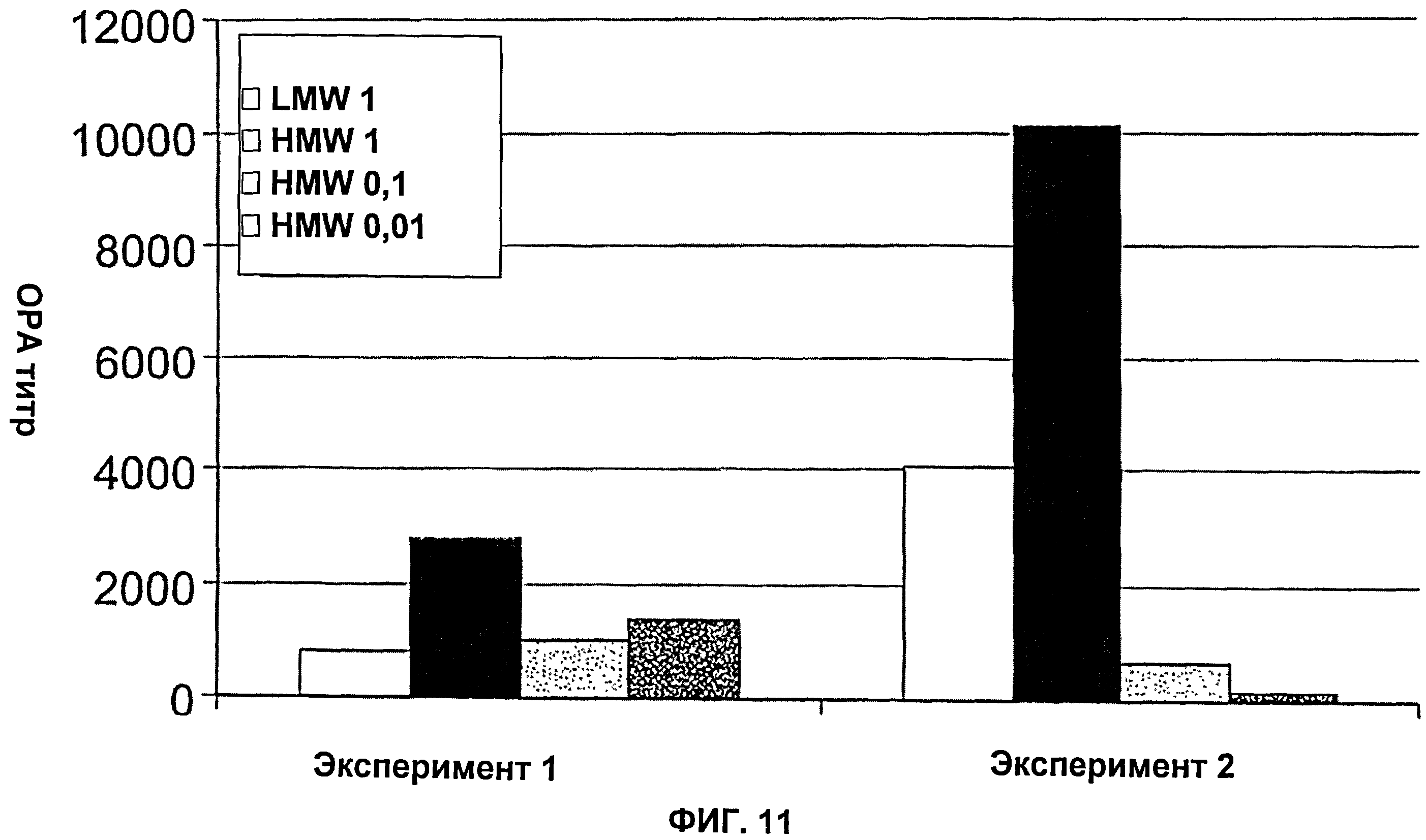
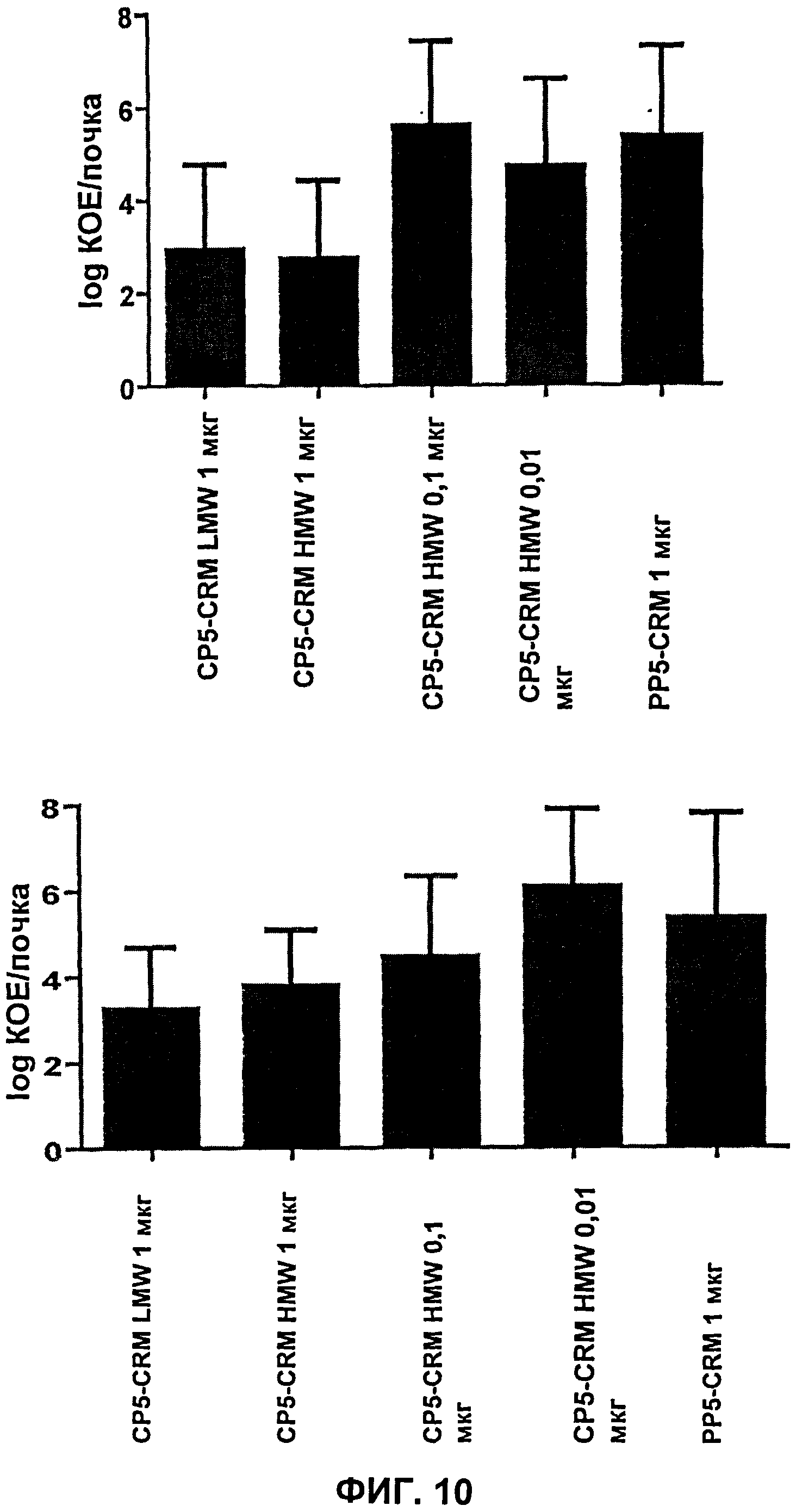
Фиг.10 показывает колониеобразующие единицы (КОЕ), выделенные из почек после заражения S. aureus PFESA0266 мышей, вакцинированных высокомолекулярным (HMW) CP5-CRM, низкомолекулярным (LMW) CP5-CRM или контрольным PP5-CRM.
Фиг.11 показывает сравнение титров ОРА (геометрические средние) из сывороток, полученных от мышей, вакцинированных разными композициями полисахаридного конъюгата (высокомолекулярный (HMW) CP5-CRM, низкомолекулярный (LMW) CP5-CRM). Группы состояли из 5-9 мышей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общий обзор
Настоящее изобретение относится к иммуногенным конъюгатам, содержащим капсулярные полисахариды S. aureus серотипа 5 или 8, конъюгированные с белками носителями, и к способам их получения и применения. Новые признаки иммуногенных конъюгатов по этому изобретению включают в себя профили молекулярной массы полисахаридов и получаемых конъюгатов, соотношение конъюгированных лизинов на белке носителе CRM197 и числа лизинов, ковалентно связанных с полисахаридом, число ковалентных связей между белком носителем и полисахаридами как функцию повторяющихся единиц полисахарида и относительное количество свободного полисахарида по сравнению с общим полисахаридом. Термин ″свободный полисахарид″ при использовании здесь означает полисахарид, который не конъюгирован с белком носителем, но, тем не менее, присутствует в конъюгатной композиции.
Способы получения иммуногенных конъюгатов по этому изобретению включают ковалентное конъюгирование капсулярных полисахаридов с белками носителями посредством химической конъюгации с участием CDI (1,1-карбонилдиимидазол), CDT (1,1-карбоил-ди-1,2,4-триазол) или PDPH (3-(2-пиридилдитио)-пропионилгидразид). CDI специфичен только для конъюгации СР8. Использование CDI/CDT имеет результатом одноуглеродный или нуль-углеродный линкер между капсулярным полисахаридом и белком носителем, в то время как использование PDPH имеет результатом ковалентную тиоэфирную связь между капсулярным полисахаридом и белком носителем.
Дополнительные поперечные линкеры для -SH (тиолированный СР) к -NH2 связям включают, без ограничения ими, следующие: сульфо-LC-SMPT; сульфо-LC-SMPT (4-сульфосукцинимидил-6-метил-а-(2-пиридилдитио)-толуамидо]гексаноат)); сульфо-KMUS (N-[k-малеимидоундеканоилокси]-сульфосукцинимидный эфир); сульфо-LC-SPDP (сульфосукцинимидил-6-(3'-[2-пиридилдитио]-пропионамидо)гексаноат), который расщепляется тиолами; сульфо-SMPB (сульфосукцинимидил-4-[п-малеимидофенил]бутират); сульфо-SIAB (N-сульфосукцинимидил[4-йодацетил]аминобензоат); сульфо-EMCS ([N-е-малеимидокапроилокси]-сульфосукцинимидный эфир); ЕМСА (N-е-малеимидокапроевая кислота); сульфо-SMCC (сульфосукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат); сульфо-MBS (м-малеимидобензоил-N-гидроксисульфосукцинимидный эфир); сульфо-GMBS (N-[g-малеимидобутирилокси]сульфосукцинимидный эфир); ВМРА (N-β-малеимидопропионовая кислота); 2-иммунотиолана гидрохлорид; 3-(2-пиридилдитио)пропионовой кислоты N-сукцинимидиловый эфир; 3-малеимидопропионовой кислоты N-сукцинимидиловый эфир; 4-малеимидомасляной кислоты N-сукцинимидиловый эфир; SMPT (4-сукцинимидилоксикарбонил-метил-а-[2-пиридилдитио]толуол)); LC-SMCC (сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбокси-[6-амидокапроат]); KMUA (N-k-малеимидоундекановая кислота); LC-SPDP (сукцинимидил-6-(3-[2пиридилдитио]-пропионамидо)гексаноат); SMPH (сукцинимидил-6-[β-малеимидопропионамидо]гексаноат); SMPB (сукцинимидил-4-[п-малеимидофенил]бутират); SIAB (N-сукцинимидил-[4-йодацетил]-аминобензоат); EMCS ([N-е-малеимидокапроилокси]-сукцинимидный эфир); SMCC (сукцинимидил-4-[N-малеимидометил]циклогексан-1 -карбоксилат); MBS (м-малеимидобензоил-N-гидроксисукцинимидный эфир); SBAP (сукцинимидил-3-[бромацетамидо]пропионат); BMPS (N-[β-малеимидопропилокси]сукцинимидный эфир); AMAS (N-(a-малеимидоацетокси)сукцинимидный эфир); SIA (N-сукцинимидилйодацетат) и N-сукцинимидил-(4-йодацетил)-аминобензоат.
Агенты можно также поперечно связывать, используя поперечные линкеры от групп -SH к группам -ОН. Такие поперечные линкеры включают, без ограничения, РМР1 (N-[п-малеимидофенил]изоцианат).
Композиции и способы, описанные здесь, являются полезными во многих применениях. Например, конъюгаты можно использовать в получении конъюгатных иммуногенных композиций для защиты реципиентов от инфекций S.aureus. Альтернативно, различные конъюгаты можно использовать в получении антител против бактериальных капсулярных полисахаридов, которые затем можно использовать в исследовательских и клинических лабораторных анализах, таких как детектирование и серотипирование бактерий. Такие антитела можно также использовать для создания пассивного иммунитета у субъекта. В некоторых воплощениях антитела, полученные против бактериальных полисахаридов, являются функциональными либо в моделях эффективности на животном, либо в анализе опсонофагоцитарного умерщвления.
Если не указано иначе, все использованные здесь технические и научные термины имеют то же значение, как они понимаются обычным специалистом в области, к которой относится это изобретение. Хотя любые способы и вещества, такие же, как те, что описаны здесь, или эквивалентные им, можно использовать в практике или тестировании настоящего изобретения, предпочтительные способы и вещества раскрыты здесь. В описании воплощений и формуле этого изобретения будет использована определенная терминология в соответствии с определениями, указанными ниже. При использовании здесь формы единственного включают в себя отсылки к множественному числу, если контекст не диктует четко обратное. Таким образом, например, отсылки к "способу" включают в себя один или более чем один способ и/или стадию описанного здесь типа и/или становящихся очевидными обычному специалисту в данной области при чтении этого описания и так далее.
При использовании здесь "примерно" означает в пределах статистически значимого диапазона величин, таких как указанный диапазон концентраций, временная рамка, молекулярная масса, температура или рН. Такой диапазон может быть в пределах порядка величины, в типичных случаях в пределах 20%, в более типичных случаях все еще в пределах 10%, и даже в более типичных случаях в пределах 5% данной величины или диапазона. Возможные вариации, охватываемые термином "примерно", должны зависеть от конкретной исследуемой системы, и их может легко оценить обычный специалист в данной области. Всякий раз, когда в этом описании указан диапазон, каждое целое число в этом диапазоне также предусмотрено в качестве воплощения этого изобретения.
Отмечено, что в этом описании такие термины, как "содержит", "содержал", "содержащий", "охватывает", "охватывающий" и тому подобные могут иметь значение, придаваемое им в патентном законодательстве США, например, они могут означать "включает в себя", "включал в себя", "включающий в себя" и тому подобные. Такие термины относятся к введению конкретных ингредиентов или совокупностей ингредиентов без исключения любых других ингредиентов. Такие термины, как "состоящий по существу из" и "состоит по существу из", имеют значение, придаваемое им в патентном законодательстве США, например, они позволяют включение дополнительных ингредиентов или стадий, которые не умаляют новых или основных характеристик этого изобретения, то есть они исключают дополнительные неуказанные ингредиенты или стадии, которые умаляют новые или основные характеристики этого изобретения, и они исключают ингредиенты или стадии из уровня техники, такие как документы в данной области техники, которые цитируются здесь или включены сюда посредством ссылки, особенно постольку, поскольку цель этого документа состоит в определении воплощений, которые являются патентоспособными, например, новых, неочевидных, изобретательских относительно уровня техники, например относительно документов, цитированных здесь или включенных сюда посредством ссылки. А также термины "состоит из" и "состоящий из" имеют значение, приписываемое им в патентном законодательстве США; а именно, они являются терминами закрытого типа. Соответственно, эти термины относятся к включению конкретного ингредиента или совокупности ингредиентов и исключению всех других ингредиентов.
Иммуногенные конъюгаты
Как описано выше, настоящее изобретение относится к иммуногенным конъюгатам, содержащим капсулярные полисахариды S.aureus серотипа 5 или 8, конъюгированные с белками носителями. В одном из воплощений этого изобретения предложены иммуногенные конъюгаты, содержащие капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с молекулой или белком носителем, имеющие один или более из следующих признаков: полисахарид имеет молекулярную массу между 50 кДа и 700 кДа; иммуногенный конъюгат имеет молекулярную массу между 500 кДа и 2500 кДa; и конъюгат содержит менее чем примерно 30% свободного полисахарида относительно суммарного полисахарида. В некоторых воплощениях полисахарид имеет молекулярную массу между 20 кДа и 1000 кДа. В некоторых воплощениях иммуногенный конъюгат имеет молекулярную массу между 200 кДа и 5000 кДа. В других воплощениях конъюгат содержит менее чем примерно 25%, примерно 20%, примерно 15%, примерно 10% или примерно 5% свободного полисахарида относительно суммарного полисахарида.
"Конъюгаты" при использовании здесь содержат капсулярный полисахарид, обычно с желаемым диапазоном молекулярных масс, и белок-носитель, причем капсулярный полисахарид конъюгирован с белком-носителем. Конъюгаты могут содержать или не содержать некоторое количество свободного капсулярного полисахарида. При использовании здесь "свободный капсулярный полисахарид" относится к капсулярному полисахариду, который нековалентно ассоциирован (то есть нековалентно связан, адсорбирован или захвачен «в» или «с») с конъюгатом капсулярного полисахарида с белком носителем. Термины "свободный капсулярный полисахарид", "свободный полисахарид" и "свободный сахарид" можно использовать взаимозаменяемым образом, и они предназначены передавать один и тот же смысл.
Независимо от природы молекулы носителя, его можно конъюгировать с капсулярным полисахаридом либо непосредственно, либо через линкер. При использовании здесь "конъюгировать", "конъюгированный" и "конъюгация" относятся к процессу, посредством которого бактериальный капсулярный полисахарид ковалентно присоединяют к молекуле носителя. Конъюгация усиливает иммуногенность бактериального капсулярного полисахарида. Конъюгацию можно осуществлять в соответствии со способами, описанными ниже, или другими способами, известными в данной области.
Молекулярная масса капсулярного полисахарида S.aureus должна быть учтена для применения в иммуногенной композиции. Высокомолекулярные капсулярные полисахариды способны индуцировать определенные антительные иммунные ответы благодаря более высокой валентности эпитопов, присутствующих на антигенной поверхности. Выделение "высокомолекулярных капсулярных полисахаридов" предусмотрено для применения в композициях и способах по настоящему изобретению. В одном из воплощений этого изобретения может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 20 кДа до 1000 кДа. В одном из воплощений этого изобретения может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 50 кДа до 700 кДа. В одном из воплощений этого изобретения может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 50 кДа до 300 кДа. В одном из воплощений может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 70 кДа до 300 кДа. В одном из воплощений может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 90 кДа до 250 кДа. В одном из воплощений может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 90 кДа до 150 кДа. В одном из воплощений может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 90 кДа до 120 кДа. В одном из воплощений может быть выделен и очищен высокомолекулярный капсулярный полисахарид серотипа 5 или 8 в диапазоне молекулярных масс от 80 кДа до 120 кДа. Другие диапазоны высокомолекулярного капсулярного полисахарида серотипа 5 или 8, который может быть выделен и очищен способами по этому изобретению, включают в себя от 70 кДа до 100 кДа по молекулярной массе; от 70 кДа до 110 кДа по молекулярной массе; от 70 кДа до 120 кДа по молекулярной массе; от 70 кДа до 130 кДа по молекулярной массе; от 70 кДа до 140 кДа по молекулярной массе; от 70 кДа до 150 кДа по молекулярной массе; от 70 кДа до 160 кДа по молекулярной массе; от 80 кДа до 110 кДа по молекулярной массе; от 80 кДа до 120 кДа по молекулярной массе; от 80 кДа до 130 кДа по молекулярной массе; от 80 кДа до 140 кДа по молекулярной массе; от 80 кДа до 150 кДа по молекулярной массе; от 80 кДа до 160 кДа по молекулярной массе; от 90 кДа до 110 кДа по молекулярной массе; от 90 кДа до 120 кДа по молекулярной массе; от 90 кДа до 130 кДа по молекулярной массе; от 90 кДа до 140 кДа по молекулярной массе; от 90 кДа до 150 кДа по молекулярной массе; от 90 кДа до 160 кДа по молекулярной массе; от 100 кДа до 120 кДа по молекулярной массе; от 100 кДа до 130 кДа по молекулярной массе; от 100 кДа до 140 кДа по молекулярной массе; от 100 кДа до 150 кДа по молекулярной массе; от 100 кДа до 160 кДа по молекулярной массе; и сходные желаемые диапазоны молекулярных масс. Любое целое число в пределах любого указанного диапазона предусмотрено в качестве воплощения этого изобретения.
В одном из воплощений конъюгат имеет молекулярную массу между примерно 50 кДа и примерно 5000 кДа по молекулярной массе. В одном из воплощений конъюгат имеет молекулярную массу между примерно 200 кДа и примерно 5000 кДа по молекулярной массе. В одном из воплощений иммуногенный конъюгат имеет молекулярную массу между примерно 500 кДа и примерно 2500 кДа. В одном из воплощений иммуногенный конъюгат имеет молекулярную массу между примерно 500 кДа и примерно 2500 кДа. В одном из воплощений иммуногенный конъюгат имеет молекулярную массу между примерно 600 кДа и примерно 2800 кДа. В одном из воплощений иммуногенный конъюгат имеет молекулярную массу между примерно 700 кДа и примерно 2700 кДа. В одном из воплощений иммуногенный конъюгат имеет молекулярную массу между примерно 1000 кДа и примерно 2000 кДа; между примерно 1800 кДа и примерно 2500 кДа; между примерно 1100 кДа и примерно 2200 кДа; между примерно 1900 кДа и примерно 2700 кДа; между примерно 1200 кДа и примерно 2400 кДа; между примерно 1700 кДа и примерно 2600 кДа; между примерно 1300 кДа и примерно 2600 кДа; между примерно 1600 кДа и примерно 3000 кДа. Любое целое число в пределах любого указанного диапазона предусмотрено в качестве воплощения этого изобретения
При использовании здесь "иммуногенный" означает способность антигена (или эпитопа антигена), такого как бактериальный капсулярный полисахарид или конъюгатная иммуногенная композиция, содержащая этот антиген, вызывать иммунный ответ у хозяина, такого как млекопитающее, либо гуморальный, либо клеточный, либо оба. Соответственно, "иммуногенный конъюгат" или "конъюгат" при использовании здесь означает любой иммуногенный конъюгат, содержащий антиген или антигенную детерминанту (то есть эпитоп) бактериального капсулярного полисахарида, конъюгированного с молекулой носителем, который можно использовать для того, чтобы вызывать иммунный ответ. Иммуногенный конъюгат может служить для сенсибилизации хозяина путем представления антигена в ассоциации с молекулами главного комплекса гистосовместимости (МНС) на клеточной поверхности. Кроме того, можно генерировать антиген-специфичные Т-клетки или антитела для защиты иммунизированного хозяина в будущем. Иммуногенные конъюгаты, таким образом, могут защищать хозяина от одного или более чем одного симптома, ассоциированного с инфекцией бактериями, или могут защищать хозяина от гибели по причине инфекции бактериями, ассоциированными с этим капсулярным полисахаридом. Иммуногенные конъюгаты можно также использовать для получения поликлональных или моноклональных антител, которые можно использовать для придания пассивного иммунитета субъекту. Иммуногенные конъюгаты можно также использовать для получения антител, которые являются функциональными при измерении по умерщвлению бактерий в любой модели эффективности на животном или в анализе опсонофагоцитарного умерщвления.
"Антитело" представляет собой молекулу иммуноглобулина, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., через по меньшей мере один сайт распознавания антигенов, локализованный в вариабельной области молекулы иммуноглобулина. При использовании здесь, если контекст не указывает иное, этот термин предназначен охватывать не только интактные поликлональные или моноклональные антитела, но также сконструированные антитела (например, химерное, гуманизированное и/или дериватизированное для изменения эффекторных функций, стабильности и других биологических активностей) и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv) и доменные антитела, в том числе акульи и верблюжьи антитела, и слитые белки, содержащие часть, представляющую собой антитело, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела постольку, поскольку они проявляют желаемую биологическую активность) и фрагменты антитела, какие описаны здесь, и любые другие модифицированные конфигурации молекулы иммуноглобулина, которые содержат сайт распознавания антигена. Антитело включает в себя антитело любого класса, такого как IgG, IgA или IgM (или его подкласса), и антитело не обязательно относится к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, иммуноглобулины можно относить к разным классам. Существует пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, lgG1, lgG2, lgG3, lgG4, IgA1 и IgA2 у людей. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, обозначены как альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
"Фрагменты антитела" содержат только часть интактного антитела, причем эта часть предпочтительно сохраняет по меньшей мере одну функцию, предпочтительно большую часть функций или все функции, в норме ассоциированные с этой частью, когда она присутствует в интактном антителе.
Термин "антиген" в общем относится к биологической молекуле, обычно белку, пептиду, полисахариду или конъюгату в иммуногенной композиции, или к иммуногенной субстанции, которая может стимулировать продукцию антител, или Т-клеточных ответов, или и того, и другого в животном, включая композиции, которые инъецированы животному или абсорбированы на животном. Иммунный ответ может генерироваться на целую молекулу или на различные части молекулы (например, на эпитоп или гаптен). Этот термин можно использовать по отношению к индивидуальной молекуле или гомогенной или гетерогенной популяции антигенных молекул. Антиген распознается антителами, Т-клеточными рецепторами или другими элементами специфического гуморального и/или клеточного иммунитета. "Антиген" также включает в себя все родственные антигенные эпитопы. Эпитопы данного антигена можно идентифицировать путем использования любого числа методик картирования эпитопов, хорошо известных в данной области. См., например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol.66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, N.J. Например, линейные эпитопы можно определять, например, одновременным синтезом большого числа пептидов на твердых подложках, причем эти пептиды соответствуют частям белковой молекулы, и взаимодействием пептидов с антителами в то время, когда пептиды все еще присоединены к подложкам. Такие методики известны в данной области и описаны, например, в патенте США №4708871; Geysen et al. (1984) Proc. Natl. Acad Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715; каждый из которых включен сюда посредством ссылки, как если бы он был изложен во всей полноте. Аналогичным образом, конформационные эпитопы можно идентифицировать путем определения пространственной конформации аминокислот, например, рентгеновской кристаллографией и 2-мерным ядерным магнитным резонансом. См., например, Epitope Mapping Protocols выше. Более того, для целей настоящего изобретения "антиген" можно также использовать по отношению к белку, который включает в себя такие модификации нативной последовательности, как делеции, вставки и замены (обычно консервативные по природе, но они могут быть не консервативными) постольку, поскольку белок сохраняет способность вызывать иммунологический ответ. Эти модификации могут быть неслучайными, как при сайт-направленном мутагенезе или при использовании конкретных синтетических способов или генно-инженерного подхода, или случайными, такими как при мутациях у хозяина, который продуцирует антигены. Более того, антиген можно производить, получать или выделять из микроба, например бактерии, или он может представлять собой целый организм. Аналогичным образом, олигонуклеотид или полинуклеотид, который экспрессирует антиген, как при иммунизации нуклеиновой кислотой, также включен в это определение. Также включены синтетические антигены, например полиэпитопы, фланкирующие эпитопы и другие рекомбинантные или синтетически полученные антигены (Bergmann et al. (1993) Eur. J.Immunol. 23:2777 2781; Bergmann et al. (1996) J.Immunol. 157:3242-3249; Suhrbier (1997) Immunol. Cell Biol. 75:402 408; Gardner et al. (1998) 12 th World AIDS Conference, Geneva, Switzerland, Jun. 28 to Jul. 3,1998).
"Защитный" иммунный ответ относится к способности иммуногенной композиции вызывать иммунный ответ, либо гуморальный, либо клеточный, либо оба, который служит защите субъекта от инфекции. Обеспеченная защита не обязательно должна быть абсолютный, то есть инфекция не обязательно должна быть полностью предотвращена или уничтожена, если имеется статистически достоверное улучшение при сравнении с контрольной популяцией субъектов, например инфицированных животных, которым не введена вакцина или иммуногенная композиция. Защита может быть ограничена снижением тяжести или скорости начала симптомов инфекции. В общем, "защитный иммунный ответ" должен включать в себя индукцию увеличения уровней антител, специфичных к конкретному антигену по меньшей мере у 50% субъектов, что включает в себя некоторые уровни измеримых функциональных антительных ответов на каждый антиген. В частных ситуациях "защитный иммунный ответ" может включать в себя индукцию двукратного увеличения уровней антител или четырехкратного увеличения уровней антител, специфичных к конкретному антигену, по меньшей мере у 50% субъектов, что включает в себя некоторый уровень измеримых функциональных антительных ответов на каждый антиген. В определенных воплощениях с защитным иммунным ответом коррелируют опсонизирующие антитела. Таким образом, защитный иммунный ответ можно анализировать измерением процента снижения числа бактерий в анализе опсонофагоцитоза, например, как описано ниже. Предпочтительно имеет место уменьшение числа бактерий по меньшей мере на 10%, 25%, 50%, 65%, 75%, 80%, 85%, 90%, 95% или более чем 95%. "Иммуногенное количество" конкретного конъюгата в композиции обычно дозируют на основании суммарного полисахарида, конъюгированного и неконъюгированного, в данном конъюгате. Например, конъюгат капсулярного полисахарида серотипа 5 или 8 с 20% свободного полисахарида должен в дозе 100 мкг иметь примерно 80 мкг конъюгированного полисахарида и примерно 20 мкг неконъюгированного полисахарида. При вычислении дозы конъюгата вклад белка в конъюгат обычно не берут в расчет. Количество конъюгата может варьировать в зависимости от серотипа стафилококка. Обычно каждая доза должна содержать от 0,1 до 100 мкг полисахарида, в частности от 0,1 до 10 мкг и, более конкретно, от 1 до 10 мкг.
Термин "субъект" относится к млекопитающему, птице, рыбе, рептилии или любому другому животному. Термин "субъект" также включает в себя людей. Термин "субъект" также включает в себя домашних животных. Неограничивающие примеры домашних животных включают в себя собак, кошек, свиней, кроликов, крыс, мышей, песчанок, хомяков, морских свинок, хорьков, птиц, змей, ящериц, рыб, черепах и лягушек. Термин "субъект" также включает в себя сельскохозяйственных животных. Неограничивающие примеры сельскохозяйственных животных включают в себя альпаку, бизона, верблюда, крупный рогатый скот, оленя, свиней, лошадей, лам, мулов, ослов, овец, коз, кроликов, северных оленей, яков, кур, гусей и индюков.
Как показано на Фиг.1, капсулярные полисахариды S.aureus серотипа 5 и 8 имеют следующие структуры:
серотип 5
[→4)-β-D-ManNAcA-(1→4)-3-0-Ac-α-L-FucNAc-(1→3)-β-DFucNAc-(1→]n
и серотип 8
[→3)-4-O-Ac-β-D-ManNAcA-(1→3)-α-L-FucNAc-(1→3)-β-DFucNAc-(1→]n,
см., Jones (2005) Carbohydr. Res. 340:1097-1106. Капсулярный полисахарид серотипа 8 имеет такие же трисахаридные повторяющиеся единицы, какие имеет капсулярный полисахарид серотипа 5; однако они отличаются по связям между сахарами и по сайтам O-ацетилирования, что вызывает серологически различающиеся профили иммунореактивности (Fournier et al. (1984) Infect. Immun. 45:87-93; и Moreau et al. (1990) Carbohydr. Res. 201:285-297). Поэтому капсулярные полисахариды серотипов 8 и 5 представляют собой относительно сложные углеводы, которые являются водорастворимыми, обычно кислыми, и ранее считалось, что они имеют молекулярные массы примерно 25 кДа (Fattom (1990) Infect. Immun. 58, 2367-2374).
В некоторых воплощениях капсулярные полисахариды серотипа 5 и/или 8 по этому изобретению O-ацетилированы. В некоторых воплощениях степень O-ацетилирования капсулярного полисахарида или олигосахарида типа 5 составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых воплощениях степень O-ацетилирования капсулярного полисахарида или олигосахарида типа 8 составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых воплощениях степень O-ацетилирования капсулярных полисахаридов или олигосахаридов типа 5 и типа 8 составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%.
Степень O-ацетилирования полисахарида или олигосахарида можно определять любым способом, известным в данной области, например, протонным ЯМР (Lemercinier and Jones 1996, Carbohydrate Research 296; 83-96, Jones and Lemercinier 2002, J Pharmaceutical and Biochemical Analysis 30; 1233-1247, WO 05/033148 или WO 00/56357). Другой обычно используемый способ описан в Hestrin (1949) J.Biol. Chem. 180; 249-261.
В некоторых воплощениях капсулярные полисахариды серотипа 5 и/или 8 по этому изобретению используют для получения антител, которые являются функциональными при измерении по умерщвлению бактерий в модели эффективности на животных или анализом опсонофагоцитарного умерщвления, который демонстрирует, что антитела убивают бактерии. Функциональное уничтожение может не быть продемонстрировано при использовании анализа, который отслеживает только генерирование антител, что не является показателем важности O-ацетилирования для эффективности.
Капсулярные полисахариды, такие как относящиеся к серотипу 5 или 8, можно получать прямо из бактерий, используя способы выделения, известные обычному специалисту в данной области. См., например, Fournier et al. (1984), выше; Fournier et al. (1987) Ann. Inst. Pasteur/Microbiol. 138:561-567; публикация заявки на патент США №2007/0141077; публикация международной заявки на патент WO 00/56357; каждый из которых включен сюда посредством ссылки, как если бы были представлены полностью. Кроме того, их можно получать с помощью синтетических способов. Более того, капсулярные полисахариды серотипа 5 или 8 можно получать рекомбинантным путем, используя методы генной инженерии, также известные специалисту в данной области (см. Sau et al. (1997) Microbiology 143:2395-2405; патент США №6027925; каждый из которых включен сюда посредством ссылки, как если бы были представлены полностью).
Одним из штаммов S.aureus, который можно использовать для получения выделенного капсулярного полисахарида серотипа 8, является S.aureus R2 PFESA0286. Это штамм был выбран проточной цитометрией с кроличьими антителами против полисахарида серотипа 8 после культивирования S.aureus PFESA0286 (Американская коллекция типовых культур (American Type Culture Collection); Manassas, VA; номер доступа АТСС 49525) в модифицированном бульоне Франца. Во время проточной цитометрии наблюдали две популяции, R1 и R2. R1 и R2 очищали и рекультивирвали. R2 давал капсулярный полисахарид серотипа 8. Анализ проточной цитометрией показал гомогенную интенсивность флуоресценции. Как таковой, R2 бы выбран для получения капсулярного полисахарида серотипа 8.
Одним из штаммов S.aureus, который можно использовать для получения выделенного капсулярного полисахарида серотипа 5, является S.aureus PFESA0266. Это штамм продуцирует капсулярный полисахарид серотипа 5 во время роста, и продукция достигает пика, когда клетки находятся в стационарной фазе. Для получения соответствующих полисахаридов можно использовать другие штаммы S.aureus типа 5 или типа 8, которые получают либо из коллекций стабильных культур, либо из клинических образцов.
Другим компонентом иммуногенного конъюгата по этому изобретению является молекула или белок носитель, с которым конъюгирован бактериальный капсулярный полисахарид. Термин "белковый носитель" или "белок носитель" относится к любой белковой молекуле, которую можно конъюгировать с антигеном (таким как капсулярные полисахариды), против которого желателен иммунный ответ. Конъюгация с носителем может усиливать иммуногенность антигена. Конъюгацию можно осуществлять стандартными способами. Предпочтительными белками носителями для антигенов являются токсины, анатоксины или любой мутантный перекрестно-реактивный материал (CRM) токсина из возбудителя столбняка, дифтерии, коклюша, Pseudomonas, E.coli, Staphylococcus и Streptococcus. В одном из воплощений особенно предпочтительным носителем является дифтерийный анатоксин CRM197, получаемый из штамма С7 С.diphtheriae (p197), который продуцирует белок CRM197. Этот штамм имеет в АТСС номер доступа 53281. Способ получения CRM197 описан в патенте США №5614382, который включен сюда ссылкой, как если бы он был описан полностью. Альтернативно, можно использовать фрагмент или эпитоп белка носителя или другого иммуногенного белка. Например, гаптенный антиген может быть связан с Т-клеточным эпитопом бактериального токсина, анатоксина или CRM. См. заявку на патент США №150688, дата подачи 1 февраля 1988, озаглавленную "Synthetic peptides Representing a T-CeIl Epitope as a Carrier Molecule For Conjugate Vaccines", включенную сюда посредством ссылки, как если бы она была описана полностью. Другие подходящие белки носители включают инактивированные бактериальные токсины, такие как холерный анатоксин (например, как описано в международной заявке на патент WO 2004/083251), Е.coll LT, Е.coli ST и экзотоксин А из Pseudomonas aeruginosa. Также можно использовать белки бактериальной внешней мембраны, такие как комплекс белков наружной мембраны С (ОМРС), порины, трансферрин-связывающие белки, пневмолизин, пневмококковый поверхностный белок A (PspA), белок адгезии пневмококков (PsaA) или белок D Haemophilus influenzae. Также можно использовать в качестве белков носителей другие белки, такие как овальбумин, гемоцианин морского блюдечка (KLH), бычий сывороточный альбумин (BSA) или очищенное белковое производное туберкулина (PPD).
Соответственно, в одном из воплощений белком носителем в иммуногенном конъюгате по этому изобретению является CRM197, и этот CRM197 ковалентно связан с капсулярным полисахаридом карбаматной связью, амидной связью или ими обеими. В некоторых воплощениях белком носителем в иммуногенном конъюгате по этому изобретению является CRM197, и этот CRM197 ковалентно связан с капсулярным полисахаридом тиоэфирной связью. Число остатков лизина в белке носителе, который становится конъюгированными с капсулярным полисахаридом, можно охарактеризовать как диапазон конъюгированных лизинов. Например, в данной иммуногенной композиции CRM197 может содержать от 5 до 15 лизинов из 39, ковалентно связанных с капсулярным полисахаридом. Другим способом выражения этого параметра является то, что от 12% до 40% лизинов CRM197 ковалентно связаны с капсулярным полисахаридом. Например, в данной иммуногенной композиции CRM197 может содержать от 18 до 22 лизинов из 39, ковалентно связанных с капсулярным полисахаридом. Другим способом выражения этого параметра является то, что от 40% до 60% лизинов CRM197 ковалентно связаны с капсулярным полисахаридом. В некоторых воплощениях CRM197 содержит от 5 до 15 лизинов из 39, ковалентно связанных с СР8. Другим способом выражения этого параметра является то, что от 12% до 40% лизинов CRM197 ковалентно связаны с СР8. В некоторых воплощениях CRM197 содержит от 18 до 22 лизинов из 39, ковалентно связанных с СР5. Другим способом выражения этого параметра является то, что от 40% до 60% лизинов CRM197 ковалентно связаны с СР5.
Как обсуждалось выше, число остатков лизина в белке носителе, конъюгированном с капсулярным полисахаридом, можно охарактеризовать как диапазон конъюгированных лизинов, который можно выразить как молярное соотношение. Например, молярное соотношение конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может находиться между примерно 18:1 и примерно 22:1. В одном из воплощений диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может находиться между примерно 15:1 и примерно 25:1. В одном из воплощений диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может находиться между примерно 14:1 и примерно 20:1; примерно 12:1 и примерно 18:1; примерно 10:1 и примерно 16:1; примерно 8:1 и примерно 14:1; примерно 6:1 и примерно 12:1; примерно 4:1 и примерно 10:1; примерно 20:1 и примерно 26:1; примерно 22:1 и примерно 28:1; примерно 24:1 и примерно 30:1; примерно 26:1 и примерно 32:1; примерно 28:1 и примерно 34:1; примерно 30:1 и примерно 36:1; примерно 5:1 и примерно 10:1; примерно 5:1 и примерно 20:1; примерно 10:1 и примерно 20:1 или примерно 10:1 и примерно 30:1. Также молярное соотношение конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате может находиться между примерно 3:1 и 25:1. В одном из воплощений диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате может находиться между примерно 5:1 и примерно 20:1. В одном из воплощений диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате может находиться между примерно 4:1 и примерно 20:1; примерно 6:1 и примерно 20:1; примерно 7:1 и примерно 20:1; примерно 8:1 и примерно 20:1; примерно 10:1 и примерно 20:1; примерно 11:1 и примерно 20:1; примерно 12:1 и примерно 20:1; примерно 13:1 и примерно 20:1; примерно 14:1 и примерно 20:1; примерно 15:1 и примерно 20:1; примерно 16:1 и примерно 20:1; примерно 17:1 и примерно 20:1; примерно 18:1 и примерно 20:1; примерно 5:1 и примерно 18:1; примерно 7:1 и примерно 16:1 или примерно 9:1 и примерно 14:1.
Другим способом выражения числа остатков лизина в белке носителе, конъюгированных с капсулярным полисахаридом, может быть диапазон конъюгированных лизинов. Например, в данном СР8 иммуногенном конъюгате CRM197 может содержать от 5 до 15 лизинов из 39, ковалентно связанных с капсулярным полисахаридом. Альтернативно, этот параметр можно выразить в процентах. Например, в данном СР8 иммуногенном конъюгате процент конъюгированных лизинов может находиться между 10% и 50%. В некоторых воплощениях от 20% до 50% лизинов могут быть ковалентно связаны с СР8. Альтернативно, от 30% до 50% лизинов CRM197 могут быть ковалентно связаны с СР8; от 10% до 40% лизинов CRM197; от 10% до 30% лизинов CRM197; от 20% до 40% лизинов CRM197; от 25% до 40% лизинов CRM197; от 30% до 40% лизинов CRM197; от 10% до 30% лизинов CRM197; от 15% до 30% лизинов CRM197; от 20% до 30% лизинов CRM197; от 25% до 30% лизинов CRM197; от 10% до 15% лизинов CRM197 или от 10% до 12% лизинов CRM197 ковалентно связаны с СР8. Также, в данном СР5 иммуногенном конъюгате CRM197 может содержать от 18 до 22 лизинов из 39, ковалентно связанных с капсулярным полисахаридом. Альтернативно, этот параметр можно выразить в процентах. Например, в данном СР5 иммуногенном конъюгате процент конъюгированных лизинов может находиться между 40% и 60%. В некоторых воплощениях от 40% до 60% лизинов могут быть ковалентно связаны с СР5. Альтернативно, от 30% до 50% лизинов CRM197 могут быть ковалентно связаны с СР5; от 20% до 40% лизинов CRM197; 10% до 30% лизинов CRM197; от 50% до 70% лизинов CRM197; от 35% до 65% лизинов CRM197; от 30% до 60% лизинов CRM197; от 25% до 55% лизинов CRM197; от 20% до 50% лизинов CRM197; от 15% до 45% лизинов CRM197; от 10% до 40% лизинов CRM197; от 40% до 70% лизинов CRM197; или от 45% до 75% лизинов CRM197 ковалентно связаны с СР5.
Частота присоединения цепи капсулярного полисахарида к лизину на молекуле носителя является еще одним параметром для характеристики конъюгатов капсулярных полисахаридов. Например, в одном из воплощений по меньшей мере одна ковалентная связь между CRM197 и полисахаридом имеет место для по меньшей мере каждых 5-10 сахаридных повторяющихся единиц капсулярного полисахарида. В еще одном воплощении имеется по меньшей мере одна ковалентная связь между CRM197 и капсулярным полисахаридом для каждых 5-10 сахаридных повторяющихся единиц; каждых 2-7 сахаридных повторяющихся единиц, каждых 3-8 сахаридных повторяющихся единиц; каждых 4-9 сахаридных повторяющихся единиц; каждых 6-11 сахаридных повторяющихся единиц; каждых 7-12 сахаридных повторяющихся единиц; каждых 8-13 сахаридных повторяющихся единиц; каждых 9-14 сахаридных повторяющихся единиц; каждых 10-15 сахаридных повторяющихся единиц; каждых 2-6 сахаридных повторяющихся единиц, каждых 3-7 сахаридных повторяющихся единиц; каждых 4-8 сахаридных повторяющихся единиц; каждых 6-10 сахаридных повторяющихся единиц; каждых 7-11 сахаридных повторяющихся единиц; каждых 8-12 сахаридных повторяющихся единиц; каждых 9-13 сахаридных повторяющихся единиц; каждых 10-14 сахаридных повторяющихся единиц; каждых 10-20 сахаридных повторяющихся единиц или каждых 5-10 сахаридных повторяющихся единиц капсулярного полисахарида. В еще одном воплощении по меньшей мере одна связь между CRM197 и капсулярным полисахаридом имеет место для каждых 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридных повторяющихся единиц капсулярного полисахарида.
В одном из воплощений этого изобретения предложена иммуногенная композиция, содержащая любой иммуногенный конъюгат, содержащий капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем, описанным выше.
Термин "иммуногенная композиция" относится к любой фармацевтической композиции, содержащей антиген, например микроорганизм или его компонент, которую можно использовать для того, чтобы вызывать иммунный ответ у субъекта. Иммуногенные композиции по настоящему изобретению можно использовать для защиты или лечения человека, чувствительного к инфекции S.aureus, путем введения иммуногенных композиций системным, трансдермальным путем или через слизистые оболочки, либо можно использовать для получения препарата поликлонального или моноклонального антитела, который можно использовать для придания пассивного иммунитета другому субъекту. Введения могут включать инъекцию в мышцу, в брюшную полость, в кожу или под кожу или через слизистые в ротовые/пищеварительные, дыхательные или мочеполовые пути. В одном из воплощений интраназальное введение используют для лечения или предупреждения носоглоточного носительства S.aureus и тем самым для ослабления инфекции на ее самой ранней стадии. Иммуногенные композиции можно также использовать для получения антител, которые являются функциональными при измерении по гибели бактерий либо в модели эффективности на животном, либо анализом опсонофагоцитарного умерщвления.
Оптимальные количества компонентов для конкретной иммуногенной композиции можно уточнять стандартными исследованиями, включающими наблюдение надлежащих иммунных ответов у субъектов. После исходной вакцинации субъекты могут получать одну или несколько бустерных иммунизаций через адекватные промежутки времени.
Иммуногенные композиции по настоящему изобретению могут также включать в себя один или более следующих антигенов: ClfA, ClfB, SdrC, SdrD, SdrE, MntC/SitC-связывающий белок слюны, IsdB, IsdA, Орр3а, DItA, HtsA, LtaS, SdrH, SrtA, SpA, SB1, альфа-гемолизин (hia), бета-гемолизин, фибронектин-связывающий белок A (fnbA), коагулаза, map, лейкоцидин Пантона-Валентина (pvl), гамма-токсин (nlg), ica, иммунодоминантный АВС-транспортер, RAP, аутолизин, рецепторы ламинина, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, SasF, SasH, EFB (FIB), FnbB, Npase, ЕВР, костный сиалосвязывающий белок II, предшественник ауреолизина (AUR)/Seppl, Cna, TSST-1, mecA, dPNAG, GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектин-связывающий белок, HarA, энтеротоксин А, энтеротоксин В, энтеротоксин CI и новый аутолизин.
В одном из воплощений иммуногенные композиции по этому изобретению дополнительно содержат по меньшей мере один адъювант, буфер, криопротектор, соль, двухвалентный катион, неионный детергент, ингибитор свободнорадикального окисления, разбавитель или носитель. В одном из воплощений адъювант в иммуногенной композиции по этому изобретению является адъювантом на основе алюминия. В одном из воплощений адъювант является адъювантом на основе алюминия, выбранным из группы, состоящей из фосфата алюминия, сульфата алюминия и гидроксида алюминия. В одном из воплощений адъювант представляет собой фосфат алюминия.
Адъювант представляет собой вещество, которое усиливает иммунный ответ при введении вместе с иммуногеном или антигеном. Было показано, что иммуномодулирующую активность имеют и, таким образом, могут быть полезными аналогично адъювантам или сходным с ними образом многие цитокины или лимфокины, включая, без ограничения ими, интерлейкины 1-α, 1-β, 2, 4, 5, 6, 7, 8, 10, 12 (см., например, патент США №5723127), 13, 14, 15, 16, 17 и 18 (и его мутантные формы); интерфероны-α, β и γ; фактор, стимулирующий колонии гранулоцитов/макрофагов (GM-CSF) (см., например, патент США №5078996 и номер доступа в АТСС 39900); фактор, стимулирующий колонии макрофагов (M-CSF); фактор, стимулирующий колонии гранулоцитов (G-CSF), и факторы а и р некроза опухолей. Дополнительные другие адъюванты, которые являются полезными с иммуногенными композициями, описанными здесь, включают в себя хемокины, включая, без ограничения ими, МСР-1, М1Р-1α, М1Р-1β и RANTES; молекулы адгезии, такие как селектин, например L-селектин, Р-селектин и Е-селектин; муциноподобные молекулы, например CD34, GIyCAM-1 и MadCAM-1; член семейства интегринов, такой как LFA-1, ILA-1, Мас-1 и р150.95; член надсемейства иммуноглобулинов, такой как РЕСАМ, ICAM, например ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3; ко-стимулирующие молекулы, такие как В7-1, В7-2, CD40 и CD40L; ростовые факторы, в том числе сосудистый ростовой фактор, фактор роста нервов, фактор роста фибробластов, эпидермальный ростовой фактор, PDGF, BL-1 и васкулярно-эндотелиальный ростовой фактор; рецепторные молекулы, в том числе Fas, рецептор TNF, Fit, Apo-1, p55, VVSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TR1CK2 и DR6; и каспазы, в том числе ICE.
Подходящие адъюванты, используемые для усиления иммунного ответа, могут дополнительно включать, без ограничения ими, MPL™ (3-O-деацилированный монофосфориллипид A, Corixa; Hamilton, MT), который описан в патенте США №4912094. Также подходящими для применения в качестве адъювантов являются синтетические аналоги липида А или соединения аминоалкилглюкозаминфосфата (AGP) или их производные или аналоги, которые доступны от Corixa, а также те, что раскрыты в патенте США №6113918. Одним таким AGP является 2-[(R)-3-тетрадеканоилокси-тетрадеканоиламино]-этил-2-дезокси-4-O-фосфоно-3-O-[(R)-3-тетрадеканоил-окситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоил-амино]-b-D-глюкопиранозид, который также известен как 529 (ранее был известен как RC529). Этот адъювант 529 приготавливают в виде водной формы (AF) или в виде стабильной эмульсии (SE).
Дополнительные другие адъюванты включают в себя мурамилпептиды, такие как N-ацетил-мурамил-L-треонил-О-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланин-2-(1',2'-дипальмитоил-sn-глицеро-3-гидроксифосфорил-окси)-этиламин (МТР-РЕ); эмульсии типа масло-в-воде, такие как MF59 (патент США №6299884) (содержащая 5% сквалена, 0,5% полисорбата 80 и 0,5% Span 85 (возможно содержащая различные количества МТР-РЕ)), приготовленные в виде субмикронных частиц с помощью микрофлуидизатора, такого как микрофлуидизатор Model HOY (Microfluidics, Newton, MA)) и SAF (содержащий 10% сквалена, 0,4% полисорбата 80,5% полимера с плюроновыми блоками L121 и thr-MDP, либо микрофлуидизированный в субмикронную эмульсию, либо обработанный вихревым встряхивателем с получением эмульсии с большим размером частиц); неполный адъювант Фрейнда (IFA); соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия; Амфиген (Amphigen); Авридин (Avridine); L121/сквален; D-лактид-полилактид/гликозид; плюроновые полиолы; убитые клетки Bordetella; сапонины, такие как Stimulon™ QS-21 (Antigenics, Framingham, MA), описанный в патенте США №5057540, Iscomatrix® (CSL Limited, ParkviIIe, Австралия), описанный в патенте США №5254339, и иммуностимулирующие комплексы (ISCOMS); Mycobacterium tuberculosis; бактериальные липополисахариды; синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие CpG-мотив (например, патент США №6207646); IC-31 (Intercell AG, Vienna, Австрия), описанный в Европейских патентах №№1296713 и 1326634; коклюшный токсин (РТ) или его мутанты, холерный токсин или его мутанты (например, патенты США №№7285281, 7332174, 7361355 и 7384640); или термолабильный токсин Е.coli (LT) или его мутант, в частности LT-K63, LT-R72 (например, патенты США №№6149919, 7115730 и 7291588).
Иммуногенная композиция возможно может содержать фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" означает носитель, одобренный федеральными, правительственными или другими регулирующими органами, или указанный в Фармакопее США или в других общепринятых фармакопеях для применения у животных, в том числе людей, а также млекопитающих, не являющихся людьми. Термин "носитель" относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят фармацевтическую композицию. В качестве жидких носителей, особенно для инъецируемых растворов, можно использовать воду, физиологические растворы и водные растворы декстрозы и глицерина. Примеры подходящих фармацевтических носителей раскрыты в "Remington's Pharmaceutical Sciences" by Е. W. Martin. Препарат должен соответствовать способу введения.
Иммуногенные композиции по настоящему изобретению могут дополнительно содержать один или более дополнительных "иммуномодуляторов", которые представляют собой агенты, которые возбуждают или изменяют иммунную систему так, что наблюдается либо усиление, либо ослабление гуморального и/или клеточного иммунитета. В одном из воплощений обеспечена активация гуморального и/или клеточно-опосредованного компонента иммунной системы. Примеры определенных иммуномодуляторов включают, например, адъювант или цитокин, или Iscomatrix® (CSL Limited; Parkville, Австралия), описанный в патенте США №5254339 среди прочего. Неограничивающие примеры адъювантов, которые можно использовать в иммуногенной композиции по настоящему изобретению, включают адъювантную систему RIBI (Ribi Inc.; Hamilton, MT), квасцы, минеральные гели, такие как гель гидроксида алюминия, эмульсии типа масло-в-воде, эмульсии типа вода-в-масле, такие как, например, полный и неполный адъюванты Фрейнда, и блок-сополимер (CytRx; Atlanta, GA), QS-21 (Cambridge Biotech Inc.; Cambridge, MA), SAF-M (Chiron; Emeryville, CA), адъювант Amphigen®, сапонин, Quil А или другая фракция сапонинов, монофосфориллипид А и липид-аминный адъювант Авридин. Неограничивающие примеры эмульсий типа масло-в-воде, полезных в иммуногенной композиции по этому изобретению, включают модифицированные препараты SEAM62 и SEAM 1/2. Модифицированный SEAM62 представляет собой эмульсию типа масло-в-воде, содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента Span® 85 (ICI Surfactants), 0,7% (об./об.) детергента полисорбата 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil A, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированный SEAM 1/2 представляет собой эмульсию типа масло-в-воде, содержащую 5% (об./об.) сквалена, 1% (об./об.) детергента Span® 85, 0,7% (об./об.) детергента полисорбата 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина. Другие "иммуномодуляторы", которые можно включать в иммуногенную композицию, включают, например, один или более чем один интерлейкин, интерферон или другие известные цитокины или хемокины. В одном из воплощений адъювант может представлять собой производное циклодекстрина или полианионный полимер, такие как те, что описаны в патентах США №№6165995 и 6610310, соответственно. Надо понимать, что иммуномодулятор и/или адъювант для использования будет зависеть от субъекта, которому надо вводить иммуногенную композицию, пути инъекции и числа инъекций, которые надо сделать.
Иммуногенные композиции по этому изобретению могут, в дополнение к совокупности конъюгатов стафилококкового капсулярного полисахарида с белком, дополнительно содержать один или более чем один консервант FDA (Федеральное управление США по пищевым и медицинским продуктам) требует, чтобы биологические продукты в многодозовых флаконах (мультидозовых) только за немногими исключениями содержали консервант. Вакцинные продукты, содержащие консерванты, включают вакцины, содержащие хлорид бензетония (сибирская язва), 2-феноксиэтанол (DTaP, НерА, болезнь Лайма, Polio (полиомиелит) (парентерально)), фенол (Pneumo (пневмония), Typhoid (тиф) (парентерально), Vaccinia (оспа)) и тимеросал (DTaP, DT, Td, HepB, Hib, грипп, JE, менингит (Mening), пневмония (Pneumo), бешенство (Rabies)). Консерванты, одобренные для применения в инъецируемых лекарственных средствах, включают в себя, например, хлорбутанол, м-крезол, метилпарабен, пропилпарабен, 2-феноксиэтанол, хлорид бензетония, хлорид бензалкония, бензойную кислоту, бензиловый спирт, фенол, тимеросал и нитрат фенилртути.
Препараты по этому изобретению могут дополнительно содержать один или более чем один буфер, соль, двухвалентный катион, неионный детергент, криопротектор, такой как сахар, и антиоксидант, такой как поглотитель свободных радикалов или хелатирующий агент, или любую их множественную комбинацию. Выбор любого компонента, например, хелатирующего агента, может определять желательность или нежелательность другого компонента (например, поглотителя). Готовая композиция, приготовленная для введения, должна быть стерильной и/или апирогенной. Опытный специалист может эмпирически определить, какие комбинации этих и других компонентов должны быть оптимальными для включения в содержащие консервант иммуногенные композиции по этому изобретению в зависимости от множества разных факторов, таких как конкретные требуемые условия хранения и введения.
В определенных воплощениях композиция по этому изобретению, которая является совместимой с парентеральным введением, содержит один или более чем один физиологически приемлемый буфер, выбранный из следующих, но без ограничения ими: Трис (триметиламин), фосфат, ацетат, борат, цитрат, глицин, гистидин и сукцинат. В определенных воплощениях композиция забуферена в диапазоне рН от примерно 6,0 до примерно 9,0, предпочтительно от примерно 6,4 до примерно 7,4.
В определенных воплощениях может быть желательно корректировать рН иммуногенной композиции или препарата по этому изобретению. Величину рН препарата по этому изобретению можно корректировать с помощью стандартных методик в данной области. Величину рН препарата можно корректировать так, чтобы она находилась между 3,0 и 8,0. В определенных воплощениях рН препарата может составлять или может быть скорректирован до величины между 3,0 и 6,0, 4,0 и 6,0 или 5,0 и 8,0. В других воплощениях рН препарата может составлять или может быть скорректирован до примерно 3,0, примерно 3,5, примерно 4,0, примерно 4,5, примерно 5,0, примерно 5,5, примерно 5,8, примерно 6,0, примерно 6,5, примерно 7,0, примерно 7,5 или примерно 8,0. В определенных воплощениях рН может составлять или может быть скорректирован в диапазоне от 4,5 до 7,5, или от 4,5 до 6,5, от 5,0 до 5,4, от 5,4 до 5,5, от 5,5 до 5,6, от 5,6 до 5,7, от 5,7 до 5,8, от 5,8 до 5,9, от 5,9 до 6,0, от 6,0 до 6,1, от 6,1 до 6,2, от 6,2 до 6,3, от 6,3 до 6,5, от 6,5 до 7,0, от 7,0 до 7,5 или от 7,5 до 8,0. В конкретном воплощении рН препарата составляет примерно 5,8.
В определенных воплощениях препарат по этому изобретению, который является совместимым с парентеральным введением, содержит один или более чем один двухвалентный катион, включая, без ограничения ими, MgCl2, CaCl2 и MnCl2, в концентрации в диапазоне от примерно 0,1 мМ до примерно 10 мМ, причем до примерно 5 мМ является предпочтительным.
В определенных воплощениях препарат по этому изобретению, который является совместимым с парентеральным введением, содержит одну или более чем одну соль, в том числе, без ограничения ими, хлорид натрия, хлорид калия, сульфат натрия и сульфат калия, присутствующую при ионной силе, которая является физиологически приемлемой для субъекта при парентеральном введении и которая включена в конечной концентрации для достижения выбранной ионной силы или осмолярности в готовом препарате. Конечная ионная сила или осмолярность препарата определяется совокупностью компонентов (например, ионами из буферного(ных) соединения(й) и других не буферных солей). Предпочтительная соль, NaCl, присутствует в диапазоне до примерно 250 мМ, причем концентрации соли выбирают для дополнения других компонентов (например, сахаров), так, чтобы конечная суммарная осмолярность препарата была совместимой с парентеральным введением (например, внутримышечной или подкожной инъекцией) и должна способствовать длительной стабильности иммуногенных компонентов препарата иммуногенной композиции в различных температурных диапазонах. Свободные от солей препараты должны выдерживать повышенные диапазоны одного или более чем одного выбранного криопротектора для поддержания желаемых конечных уровней осмолярности.
В определенных воплощениях препарат по этому изобретению, который является совместимым с парентеральным введением, содержит один или более чем один криопротектор, выбранный, без ограничения ими, из дисахаридов (например, лактозы, мальтозы, сахарозы или трегалозы) и полигидроксиуглеводородов (например, дульцита, глицерина, маннита и сорбита).
В определенных воплощениях осмолярность препарата находится в диапазоне от примерно 200 мОсм/л до примерно 800 мОсм/л, причем предпочтительным диапазоном является от примерно 250 мОсм/л до примерно 500 мОсм/л или от примерно 300 мОсм/л до примерно 400 мОсм/л. Свободный от солей препарат может содержать, например, от примерно 5% до примерно 25% сахарозы и, предпочтительно, от примерно 7% до примерно 15% или от примерно 10% до примерно 12% сахарозы. Альтернативно, свободный от солей препарат может содержать, например, от примерно 3% до примерно 12% сорбита и, предпочтительно, от примерно 4% до 7% или от примерно 5% до примерно 6% сорбита. Если добавлена соль, такая как хлорид натрия, то эффективный диапазон сахарозы или сорбита относительно снижен. Эти и другие показатели, такие как осмолярность и рассмотрение осмолярностей, вполне находятся в пределах квалификации в данной области.
В определенных воплощениях препарат по этому изобретению, который является совместимым с парентеральным введением, содержит один или более чем один ингибитор свободнорадикального окисления и/или хелатирующий агент. Разнообразные поглотители свободных радикалов и хелатирующие агенты известны в данной области и применимы к препаратам и способам применения, описанным здесь. Примеры включают в себя, без ограничения ими, этанол, EDTA (этилендиаминтетрауксусная кислота), комбинацию EDTA/этанол, триэтаноламин, маннит, гистидин, глицерин, цитрат натрия, инозитгексафосфат, триполифосфат, аскорбиновую кислоту/аскорбат, янтарную кислоту/сукцинат, яблочную кислоту/малеат, десферал, EDDHA (этилендиамин-N,N'-бис(2-гидроксифенилуксусная кислота) и DTPA (диэтилентриаминпентауксусная кислота), и различные комбинации двух или более чем двух указанных агентов. В определенных воплощениях по меньшей мере один невосстанавливающий поглотитель свободных радикалов можно добавлять в концентрации, которая эффективно повышает длительную стабильность препарата. Один или более чем один ингибитор свободнорадикального окисления /хелатирующий агент можно также добавлять в различных комбинациях, таких как поглотитель и двухвалентный катион. Выбор хелатирующего агента будет определять необходимость в добавлении поглотителя.
В определенных воплощениях препарат по этому изобретению, который является совместимым с парентеральным введением, содержит одно или более чем одно неионное поверхностно-активное вещество, в том числе, без ограничения ими, сложные эфиры жирной кислоты с полиоксиэтиленсорбитаном, Полисорбат-80 (Tween 80), Полисорбат-60 (Tween 60), Полисорбат-40 (Tween 40) и Полисорбат-20 (Tween 20), полиоксиэтиленалкиловые эфиры, в том числе, без ограничения ими, Brij 58, Brij 35, а также другие, такие как Тритон Х-100; Тритон Х-114, NP40, Span 85 и плюроновая серия неионных поверхностно-активных веществ (например Pluronic 121), причем предпочтительными компонентами являются Полисорбат-80 в концентрации от примерно 0,001% до примерно 2% (причем предпочтительно вплоть до примерно 0,25%) или Полисорбат-40 в концентрации от примерно 0,001% до 1% (причем предпочтительно вплоть до примерно 0,5%).
В определенных воплощениях препарат по этому изобретению содержит один или более чем один дополнительный стабилизатор, подходящий для парентерального введения, например восстановитель, содержащий по меньшей мере одну тиольную (-SH) группу (например, цистеин, N-ацетилцистеин, восстановленный глутатион, тиогликолят натрия, тиосульфат, монотиоглицерин или их смеси). Альтернативно или возможно, содержащие консервант препараты иммуногенной композиции по этому изобретению можно дополнительно стабилизировать удалением кислорода из контейнеров для их хранения, защитой препарата от света (например, использованием стеклянных контейнеров из темного стекла).
Содержащие консервант препараты иммуногенной композиции по этому изобретению могут содержать один или более чем один фармацевтически приемлемый носитель или эксципиент, которые включают любой эксципиент, который сам не индуцируют иммунный ответ. Подходящие эксципиенты включают, без ограничения ими, макромолекулы, такие как белки, сахариды, полимолочные кислоты, полигликолевые кислоты, полимеры аминокислот, сополимеры аминокислот, сахарозу (Paoletti et al, 2001, Vaccine, 19:2118), трегалозу, лактозу и агрегаты липидов (такие как капельки масла или липосомы). Такие носители хорошо известны специалисту. Фармацевтически приемлемые эксципиенты обсуждены, например, в Gennaro, 2000, Remington: The Science and Practice of Pharmaceutics, 20th edition, ISBN:0683306472.
Композиции по этому изобретению могут быть лиофилизированными или могут находиться в водной форме, то есть в виде растворов или суспензий. Жидкие препараты можно преимущественно вводить прямо из их упакованной формы, и они, таким образом, являются идеальными для инъекции без необходимости в растворении в водной среде, как это в противном случае требуется для лиофилизированной композиции по этому изобретению.
Прямую доставку иммуногенных композиций по настоящему изобретению субъекту можно осуществлять парентеральным введением (внутримышечным, внутрибрюшинным, интрадермальным, подкожным, внутривенным путем или в интерстициальное пространство ткани); или ректальным, пероральным, вагинальным, местным, трансдермальным, интраназальным путем, глазным, ушным, легочным или другим введением через слизистые оболочки. В предпочтительном воплощении парентеральное введение представляет собой внутримышечную инъекцию, например, в бедро или верхнюю часть руки субъекта. Инъекцию можно делать иглой (например, гиподермальной иглой), но можно использовать безыгольную инъекцию. Типичная внутримышечная доза составляет 0,5 мл. Композиции по этому изобретению можно получать в различных формах, например в форме для инъекции, либо в виде жидких растворов или суспензий. В определенных воплощениях композицию можно готовить в виде порошка или спрея для легочного введения, например в ингаляторе. В других воплощениях композицию можно готовить в виде суппозитория или пессария, либо для носового, ушного или глазного введения, например, в виде спрея, капель, геля или порошка.
Количество конъюгата в каждой дозе иммуногенной композиции выбирают как количество, которое индуцирует иммунный защитный ответ без значительных побочных эффектов. Такое количество может варьировать в зависимости от стафилококкового серотипа. Обычно каждая доза содержит от 0,1 до 100 мкг полисахарида, в частности от 0,1 до 10 мкг, и более конкретно от 1 до 5 мкг. Оптимальные количества компонентов для конкретной иммуногенной композиции можно уточнять стандартными исследованиями, включающими наблюдение надлежащих иммунных ответов у субъектов. После исходной вакцинации субъекты могут получать одну или несколько бустерных иммунизации через адекватные промежутки времени.
Упаковка и лекарственные формы
Иммуногенные композиции по этому изобретению могут быть упакованы в однодозовой форме или в многодозовой форме (например, 2 дозы, 4 дозы или более). Для многодозовых форм флаконы являются типичными, но не обязательно более предпочтительными, чем шприцы. Подходящие многодозовые форматы включают, без ограничения ими, следующие: от 2 до 10 доз на контейнер при 0,1-2 мл на дозу. В определенных воплощениях доза представляет собой дозу 0,5 мл. См., например, международную заявку на патент WO 2007/127668, которая включен сюда посредством ссылки.
Композиции могут быть предоставлены во флаконах или других подходящих контейнерах для хранения, либо они могут быть предоставлены в предварительно заполненных устройствах для доставки, например в одно- или многокомпонентных шприцах, причем шприцы могут быть или не быть снабжены иглами. Шприц, как правило, но не обязательно, содержит одну дозу содержащей консервант иммуногенной композиции по этому изобретению, хотя также предусмотрены предварительно заполненные шприцы на много доз. Аналогично, флакон может содержать одну дозу, но может также содержать множественные дозы.
Эффективные объемы дозировки могут быть установлены рутинным образом, но типичная доза композиции для инъекции имеет объем 0,5 мл. В определенных воплощениях дозу готовят для введения субъекту-человеку. В определенных воплощениях дозу готовят для введения взрослому субъекту, тинэйджеру, подростку, начинающему ходить ребенку или младенцу (то есть не старше одного года), и ее можно в предпочтительных воплощениях вводить инъекцией.
Жидкие иммуногенные композиции по этому изобретению также являются подходящие для растворения других иммуногенных композиций, которые представлены в лиофилизированной форме. Если иммуногенная композиция предназначена для использования для такого растворения непосредственно перед применением, в этом изобретении предложен набор с двумя или более флаконами, с двумя или более готовыми заполненными шприцами или с одним или более чем одним из каждого, причем содержимое шприца используют для растворения содержимого флакона перед инъекцией или наоборот.
Альтернативно, иммуногенные композиции по настоящему изобретению могут быть лиофилизированы и растворены с помощью одного из множества способов сублимационной сушки, хорошо известных в данной области, с образованием сухих, имеющих регулярную форму (например, сферическую) частиц, таких как микропеллеты или микросферы, имеющие характеристики частиц, такие как средние размеры в диаметре, которые можно выбирать и контролировать варьированием конкретных способов, используемых для их получения. Иммуногенные композиции могут дополнительно содержать адъювант, который может возможно быть приготовлен с отдельными сухими, имеющими регулярную форму (например, сферическую) частицами, такими как микропеллеты или микросферы, или содержаться в них. В таких воплощениях в настоящем изобретении дополнительно предложен набор с иммуногенной композицией, содержащий первый компонент, который включает стабилизированную сухую иммуногенную композицию, возможно дополнительно содержащую один или более чем один консервант по этому изобретению, и второй компонент, содержащий стерильный водный раствор для растворения первого компонента. В определенных воплощениях водный раствор содержит один или более чем один консервант и возможно может содержать по меньшей мере один адъювант (см., например, WO2009/109550 (включено сюда посредством ссылки)).
В еще одном воплощении контейнер многодозового формата выбирают из одной или более чем одной группы, состоящей из, без ограничения ими, обычной лабораторной стеклянной посуды, колб, химических стаканов, мерных цилиндров, ферментаторов, биореакторов, трубок, пипеток, мешочков, банок, флаконов, крышек для флаконов (например, резиновой пробки, навинчивающегося колпачка), ампул, шприцов, двух- и многокамерных шприцов, шприцевых пробок, шприцевых поршней, резиновых пробок, пластиковых пробок, стеклянных пробок, картриджей и одноразовых ручек и тому подобного. Контейнер по настоящему изобретению не ограничен материалом для его изготовления и включает такие материалы, как стекло, металлы (например, сталь, нержавеющую стать, алюминий, и т.д.) и полимеры (например, термопластики, эластомеры, термопластики-эластомеры). В конкретном воплощении контейнер этого формата представляет собой стеклянный флакон Шота типа 1 объемом 5 мл с бутиловой пробкой. Специалист должен понимать, что формат, указанный выше, никоим образом не представляет собой исчерпывающий перечень, но просто служит руководством для специалиста относительно множества разных форматов, доступных по настоящему изобретению. Дополнительные форматы, предусмотренные для применения в настоящем изобретении, можно найти в опубликованных каталогах поставщиков и изготовителей лабораторного оборудования, таких как United States Plastic. (Lima, OH), VWR.
Способы получения иммуногенных конъюгатов
Настоящее изобретение также включает способы получения описанных здесь иммуногенных конъюгатов. Способы получения иммуногенных конъюгатов по этому изобретению включают ковалентное конъюгирование капсулярных полисахаридов с белками носителями при помощи конъюгационной химии с участием CDI (1,1-карбонилдиимидазол), CDT (1,1-карбоил-ди-1,2,4-триазол) или PDPH (3-(2-пиридилдитио)-пропионилгидразид).
Соответственно, в одном из воплощений этого изобретения предложен способ на основе CDT для получения иммуногенного конъюгата, содержащего капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем, включающий стадии: (а) получения соединения капсулярного полисахарида S.aureus серотипа 5 или 8 с имидазолом или триазолом с получением компаундированного полисахарида; (б) взаимодействия компаундированного полисахарида с CDT в органическом растворителе, содержащем от примерно 0,1% до примерно 0,3% (масс./об.) воды, с получением активированного капсулярного полисахарида серотипа 5 или 8; (в) очистки активированного капсулярного полисахарида серотипа 5 или 8 с получением очищенного активированного капсулярного полисахарида серотипа 5 или 8; (г) взаимодействия очищенного активированного капсулярного полисахарида серотипа 5 или 8 с белком носителем в органическом растворителе с получением конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем; и (д) гидролиза конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп; посредством которых получают иммуногенный конъюгат, содержащий капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем. В одном из воплощений перед стадией (г) очищенный активированный капсулярный полисахарид серотипа 5 или 8 компаундируют с белком носителем.
В одном из воплощений этого изобретения предложен другой способ получения иммуногенного конъюгата, содержащего капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем, на основе CDT, включающий стадии: (а) компаундирования капсулярного полисахарида S.aureus серотипа 5 или 8 с имидазолом или триазолом с получением компаундированного полисахарида; (б) взаимодействия компаундированного полисахарида с CDT в органическом растворителе, содержащем от примерно 0,1% до примерно 0,3% (масс./об.) воды, с получением активированного капсулярного полисахарида серотипа 5 или 8; (в) взаимодействия активированного капсулярного полисахарида серотипа 5 или 8 с белком-носителем в органическом растворителе с получением конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем, и (г) гидролиза конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп; посредством которых получают иммуногенный конъюгат, содержащий капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем.
В одном из воплощений органический растворитель в способах получения иммуногенного конъюгата на основе CDT представляет собой полярный апротонный растворитель. В одном из воплощений органический растворитель представляет собой полярный апротонный растворитель, выбранный из группы, состоящей из диметилсульфоксида (DMSO), диметилформамида (DMF), диметилацетамида, N-метил-2-пирролидона и гексаметилфосфорамида (НМРА). В одном из воплощений органический растворитель представляет собой DMSO.
В одном из воплощений стадия взаимодействия компаундированного полисахарида с CDT в способах получения иммуногенного конъюгата на основе CDT включает обеспечение примерно 20-кратного молярного избытка CDT по сравнению с полисахаридом.
В одном из воплощений стадия очистки активированного капсулярного полисахарида серотипа 5 или 8 в способах получения иммуногенного конъюгата на основе CDT включает диафильтрацию.
В одном из воплощений белок носитель в способах получения иммуногенного конъюгата на основе CDT представляет собой CRM197. В одном из воплощений активированный капсулярный полисахарид серотипа 5 или 8 в способах получения иммуногенного конъюгата подвергают взаимодействию с CRM197 в массовом соотношении примерно 1:1.
В одном из воплощений стадия гидролиза конъюгата полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп в способах получения иммуногенного конъюгата на основе CDT включает разведение в буфере и поддержание рН от примерно 8,8 до примерно 9,2 в течение по меньшей мере 4 часов при температуре от примерно 20°С до примерно 26°С. В одном из воплощений стадия гидролиза конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем включает разведение в буфере и поддержание рН примерно 9,0 в течение по меньшей мере 4 часов при температуре примерно 23°С.
В одном из воплощений конъюгат капсулярного полисахарида серотипа 5 или 8 с белком носителем, полученный в соответствии со способами получения иммуногенного конъюгата на основе CDT, подвергают очистке. В одном из воплощений очистка конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем включает диафильтрацию.
В одном из воплощений перед взаимодействием компаундированного полисахарида с CDT в способах получения иммуногенного конъюгата на основе CDT компаундированный полисахарид серотипа 5 или 8 лиофилизируют и ресуспендируют. В одном из воплощений как компаундированный полисахарид, так и белок носитель по-отдельности лиофилизируют и ресуспендируют перед взаимодействием компаундированного полисахарида с CDT. В одном из воплощений лиофилизированный компаундированный полисахарид и/или лиофилизировали белок носитель ресуспендируют в органическом растворителе. В одном из воплощений органический растворитель представляет собой DMSO.
В одном из воплощений перед взаимодействием активированного капсулярного полисахарида серотипа 5 или 8, компаундированного с белком носителем, в способе получения иммуногенного конъюгата на основе CDT очищенный активированный капсулярный полисахарид серотипа 5 или 8 и белок носитель по отдельности лиофилизируют и ресуспендируют. В одном из воплощений белок носитель представляет собой CRM197, и перед лиофилизацией CRM197 подвергают диафильтрации против NaCl. В одном из воплощений перед лиофилизацией CRM197 подвергают диафильтрации против NaCl и массовое соотношение NaCl/CRM доводят до величины от примерно 0,5 до примерно 1,5.
В одном из воплощений настоящего изобретения предложен способ получения иммуногенного конъюгата, содержащего капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем, на основе PDPH, включающий стадии: (а) взаимодействия капсулярного полисахарида S.aureus серотипа 5 или 8 с PDPH и карбодиимидом в органическом растворителе с получением PDPH-связанного полисахарида; (б) взаимодействия PDPH-связанного полисахарида с восстановителем с получением активированного полисахарида; (в) очистки активированного капсулярного полисахарида серотипа 5 или 8 с получением очищенного активированного капсулярного полисахарида серотипа 5 или 8; (г) взаимодействия белка носителя с бромуксусной кислотой в органическом растворителе с получением активированного белка носителя; (д) очистки активированного белка носителя с получением очищенного активированного белка носителя; (е) взаимодействия очищенного активированного капсулярного полисахарида серотипа 5 или 8 с очищенным активированным белком носителем с получением конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем; и (ж) гидролиза конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп; посредством которых получают иммуногенный конъюгат, содержащий капсулярный полисахарид S.aureus серотипа 5 или 8, конъюгированный с белком носителем.
В одном из воплощений бромуксусная кислота, используемая в способах получения иммуногенного конъюгата на основе PDPH, представляет собой N-гидроксисукцинимидный эфир бромуксусной кислоты (BAANS). В одном из воплощений белок носитель, используемый в основанных на PDPH способах по этому изобретению, представляет собой CRM197, и BAANS добавляют в массовом соотношении CRM197:BAANS от примерно 1:0,1 до примерно 1:0,5.
В одном из воплощений органический растворитель в основанных на PDPH способах получения иммуногенного конъюгата представляет собой полярный апротонный растворитель. В одном из воплощений органический растворитель представляет собой полярный апротонный растворитель, выбранный из группы, состоящей из DMSO, DMF, диметилацетамида, N-метил-2-пирролидона и НМРА. В одном из воплощений органический растворитель представляет собой DMSO. В одном из воплощений карбодиимид, используемый в основанных на PDPH способах получения иммуногенного конъюгата, представляет собой 1-этил-3-(3-диметиламинопропил)-карбодиимид (EDAC). В одном из воплощений стадия взаимодействия капсулярного полисахарида серотипа 5 или 8 с PDPH и EDAC в органическом растворителе включает поддержание массового соотношения полисахарид:PDPH:EDAC равным примерно 1:5:3.
В одном из воплощений восстановитель, используемый в основанных на PDPH способах получения иммуногенного конъюгата, представляет собой дитиотрейтол (DTT).
В одном из воплощений каждая стадия очистки активированного капсулярного полисахарида серотипа 5 или 8 и очистки белка носителя в основанных на PDPH способах получения иммуногенного конъюгата включает диафильтрацию.
В одном из воплощений белок носитель в основанных на PDPH способах получения иммуногенного конъюгата представляет собой CRM197. В одном из воплощений активированный полисахарид серотипа 5 или 8 в этих способах получения иммуногенного конъюгата подвергают взаимодействию с CRM197 в массовом соотношении примерно 1:1.
В одном из воплощений стадия гидролиза конъюгата полисахарида серотипа 5 или 8 с белком носителем для удаления непрореагировавших активационных групп в основанных на PDPH способах получения иммуногенного конъюгата включает добавление гидрохлорида цистеамина.
В одном из воплощений конъюгат капсулярного полисахарида серотипа 5 или 8 с белком носителем, полученный в соответствии с основанными на PDPH способами получения иммуногенного конъюгата, очищают. В одном из воплощений очистка конъюгата капсулярного полисахарида серотипа 5 или 8 с белком носителем включает диафильтрацию.
В одном из воплощений перед взаимодействием очищенного активированного капсулярного полисахарида серотипа 5 или 8 с очищенным активированным белком носителем в основанных на PDPH способах получения иммуногенного конъюгата как очищенный активированный полисахарид, так и очищенный активированный белок носитель по-отдельности лиофилизируют и ресуспендируют. В одном из воплощений лиофилизированный активированный полисахарид и/или лиофилизированный активированный белок носитель ресуспендируют в органическом растворителе. В одном из воплощений органический растворитель представляет собой DMSO.
При использовании здесь "лиофилизация" означает способ дегидратации, в котором бактериальный капсулярный полисахарид замораживают и при этом окружающее давление снижают в присутствии достаточного нагревания для того, чтобы обеспечить сублимацию замороженной воды прямо из твердой фазы в газовую фазу. Можно использовать любой способ, известный в данной области для лиофилизации полисахаридов. См., например, Harris & Angal (1989) "Protein Purification Methods," в: Kennedy & Cabral, eds. "Recovery Processes for Biological Materials" (John Wiley & Sons; 1993); патент США №4134214; и публикацию международной заявки на патент WO 2003/086471; каждое из которых включено сюда посредством ссылки, как если бы было приведено полностью. Возможно во время лиофилизации может быть использован криопротектор, такой как, например, сахароза, глюкоза, лактоза, трегалоза, арабиноза, ксилоза, галактоза, сорбит или маннит.
При использовании здесь "активировать" и "активация" означают, что бактериальный капсулярный полисахарид или белок носитель модифицируют так, что он становится «склонным» к конъюгации (то есть по меньшей мере одну группировку необходимо сделать способной ковалентно связываться с молекулой носителя). Например, что касается способов на основе CDT конъюгации по настоящему изобретению, то полисахарид активируют в среде с низкой влажностью (например, в DMSO) с образованием триазолкарбаматных группировок с доступными гидроксилами и ацилтриазольных группировок с карбоновыми кислотами. Активированные полисахариды затем могут быть подвергнуты взаимодействию с белком CRM197, что приводит к нуклеофильному замещению триазола лизиновыми остатками в CRM197 и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот). Напротив, что касается основанных на PDPH способах конъюгации по настоящему изобретению, то как белок носитель, так и полисахариды перед конъюгацией активируют следующим образом: (1) активация CRM197 включает введение бромацетильных групп в белок CRM197 взаимодействием аминных групп с N-гидроксисукцимидным эфиром бромуксусной кислоты; и (2) активация полисахарида включает сочетание активированных карбодиимидом карбоксилатных групп N-ацетилманнозаминоуроновой кислоты в полисахариде с гидразидной группой сульфгидрил-реактивного гидразидного гетеробифункционального линкера PDPH с последующим восстановлением с помощью DTT. Активированные полисахариды затем могут быть подвергнуты взаимодействию с активированным белком носителем таким образом, чтобы тиолы PDPH-тиолированных полисахаридов взаимодействовали с бромацетильными группами активированного белка носителя с образованием ковалентной тиоэфирной связи, образованной замещением бромида.
В соответствии со способами по этому изобретению капсулярные полисахариды, белки носители и/или конъюгаты полисахарид-белок могут быть очищены. Может быть использован любой способ, известный в данной области для очистки полисахаридов или белков, такой как концентрирование/диафильтрация, осаждение/элюирование, колоночная хроматография и фильтрование через объемный фильтр. См., например, Farres et al. (1996) Biotechnol. Tech. 10:375-380; Goncalves et al. B: Communicating Current Research and Educational Topics and Trends in Applied Microbiology (Antonio Mendez Vilas, ed. 1st ed. Badajoz, Espanha: Formatex; 2007, pp.450-457); Tanizaki et al. (1996) J.Microbiol. Methods 27:19-23; и патент США №6146902 и публикация заявки на патент США №2008/0286838; каждое из которых включено сюда посредством ссылки, как если бы было приведено полностью.
При использовании здесь термин "выделенный" или "очищенный" означает, что вещество удалено из среды его происхождения (например, природной среды, если оно встречается в природе, или из организма его хозяина, если оно является рекомбинантным, или перенесено из одной среды в другую среду). Например, выделенный полисахарид, пептид или белок является по существу свободным от клеточного материала или других загрязняющих белков из клетки-источника или ткани-источника, из которой получен белок, либо по существу свободным от химических предшественников или других химических веществ, если он синтезирован химически или присутствует иным образом в смеси как часть химической реакционной среды. В настоящем изобретении белок или полисахарид может быть выделен из бактериальной клетки или из клеточных остатков таким образом, чтобы они были представлены в форме, пригодной для получения иммуногенной композиции. Термин "выделенный" или "выделение" может включать очистку или процедуру очистки, включая, например, описанные здесь методы очистки капсулярных полисахаридов. Выражение "по существу свободный от клеточного материала" включает препараты полисахарида/полипептида/белка, в которых полисахарид/полипептид/белок отделен от клеточных компонентов клеток, из которых его выделяют или получают рекомбинантным способом. Таким образом, полипептид/белок, полисахарид или конъюгат, который является по существу свободным от клеточного материала или других соединений, включает препараты полипептида/белка, полисахарида или конъюгата, имеющие менее чем примерно 30%, 20%, 10%, 5%, 2,5% или 1% (по сухой массе) загрязняющего белка, полисахарида или других соединений. Когда полипептид/белок получен рекомбинантным способом, он также предпочтительно является по существу свободным от культуральной среды, то есть культуральная среда составляет менее чем примерно 20%, 10%, 5%, 4%, 3%, 2% или 1% объема препарата белка. Когда полипептид/белок или полисахарид получен химическим синтезом, он предпочтительно является по существу свободным от химических предшественников или других химических реагентов, то есть он отделен от химических предшественников или других химических реагентов, которые участвуют в синтезе белка или полисахарида. Соответственно, такие препараты полипептида/белка или полисахарида имеют менее чем примерно 30%, 20%, 10%, 5%, 4%, 3%, 2% или 1% (по сухой массе) химических предшественников или соединений иных, чем полипептид/белок или фрагмент полисахарида, представляющий интерес.
Иммуногенные конъюгаты, полученные любым описанным здесь способом, можно хранить в воде или буфере с низкой ионной силой и нейтральным рН или лиофилизировать в сухой порошок.
Способы индукции иммунного ответа и защиты против инфекции S.aureus
Настоящее изобретение также включает способы применения описанных здесь иммуногенных композиций. Например, в одном из воплощений этого изобретения предложен способ индукции иммунного ответа против S.aureus, включающий введение субъекту иммуногенного количества любой описанной здесь иммуногенной композиции. В одном из воплощений этого изобретения предложен способ защиты субъекта против инфекции S.aureus или способ предупреждения инфекции S.aureus, или способ снижения тяжести или замедления начала наступления по меньшей мере одного симптома, ассоциированного с инфекцией, которую вызывает S.aureus, включающий введение субъекту иммуногенного количества любой описанной здесь иммуногенной композиции. В одном из воплощений этого изобретения предложен способ лечения или предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного со Staphylococcus sp. у субъекта, включающий стадию введения терапевтически или профилактически эффективного количества описанной здесь иммуногенной композиции субъекту. В некоторых воплощениях способ лечения или предупреждения стафилококковой инфекции, заболевания или состояния включает лечение человека, ветеринарное лечение, лечение животного или сельскохозяйственное лечение. В другом воплощении предложен способ лечения или предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного со Staphylococcus sp. у субъекта, включающий получение препарата поликлонального или моноклонального антитела из описанной здесь иммуногенной композиции и использование указанного препарата антитела для создания пассивного иммунитета у субъекта. В одном из воплощений этого изобретения предложен способ предупреждения стафилококковой инфекции у субъекта, проходящего хирургическую процедуру, включающий стадию введения профилактически эффективного количества описанной здесь иммуногенной композиции субъекту перед хирургической процедурой.
"Иммунный ответ" на антиген или иммуногенную композицию представляет собой развитие у субъекта гуморального и/или клеточно-опосредованного иммунного ответа на молекулы, присутствующие в антигенной или вакцинной композиции, представляющей интерес. Для целей настоящего изобретения "гуморальный иммунный ответ" представляет собой опосредованный антителами иммунный ответ и включает индукцию и генерирование антител, которые распознают антиген в иммуногенной композиции по этому изобретения, связываются с ним с определенной аффинностью, тогда как "клеточно-опосредованный иммунный ответ" представляет собой ответ, опосредованный Т-клетками и/или другими белыми клетками крови. "Клеточно-опосредованный иммунный ответ" вызывается представлением антигенных эпитопов в ассоциации с молекулами главного комплекса гистосовместимости (МНС) Класса I или Класса II, CD 1 или с другими неклассическими МНС-подобными молекулами. Это активирует антиген-специфичные Т-хелперные клетки CD4+ или цитотоксические Т-лимфоциты CD8+ ("CTL"). CTL имеют специфичность к пептидным антигенам, которые представлены в ассоциации с белками, кодируемыми классическими или неклассическими МНС и экспрессирующимися на поверхности клеток. CTL помогают индуцировать и активировать внутриклеточную деструкцию внутриклеточных микробов или лизис клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфичный ответ хелперных Т-клеток. Хелперные Т-клетки действуют, помогая стимулировать функции и направлять активность неспецифичных эффекторных клеток против клеток, экспрессирующих пептидные или другие антигены в ассоциации с классическими или неклассическими молекулами МНС на их поверхности. "Клеточно-опосредованный иммунный ответ" также относится к продукции цитокинов, хемокинов и других таких молекул, продуцируемых активированными Т-клетками и/или другими белыми клетками крови, в том числе теми, что происходят из Т-клеток CD4+ и CD8+. Способность конкретного антигена или композиции стимулировать клеточно-опосредованный иммунологический ответ можно определять многочисленными анализами, такими как анализы лимфопролиферации (активации лимфоцитов), анализы цитотоксических клеток CTL, анализами на Т-лимфоциты, специфичные к антигену у сенсибилизированного субъекта, или измерением продукции цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны в данной области. См., например, Erickson et al. (1993) J.Immunol. 151: 4189-4199; и Doe et al. (1994) Eur. J.Immunol. 24:2369-2376.
При использовании здесь "лечение" (включая его вариации, например, "лечить" или "подвергающийся лечению") означает любое одно или более чем одно из нижеследующего: (1) предупреждение инфекции или повторной инфекции, как с традиционной вакциной, (2) снижение тяжести или элиминирование симптомов и (3) существенную или полную элиминацию данного патогена или нарушения. Следовательно, лечение можно осуществлять профилактически (перед инфекцией) или терапевтически (после инфекции). В настоящем изобретении профилактическое лечение является предпочтительным. В соответствии с одним из конкретных воплощений настоящего изобретения предложены композиции и способы, которые лечат, включая профилактическую и/или терапевтическую иммунизацию, животное-хозяина от микробной инфекции (например, бактерии, такой как Staphylococcus). Способы по настоящему изобретению являются полезными для придания профилактического и/или терапевтического иммунитета субъекту. Способы по настоящему изобретению можно также практиковать на субъектах для биомедицинских исследовательских приложений.
При использовании здесь "млекопитающее" означает человека или животное, не являющееся человеком. Более конкретно, млекопитающее относится к любому животному, классифицированному как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и животных, содержащихся в зоопарках, для спорта и домашних питомцев, таких как живущее в доме и другое одомашненное животное, в том числе, без ограничения ими, рогатый скот, овцы, хорьки, свиньи, лошади, кролики, козы, собаки, кошки и тому подобные. Предпочтительными животными для дома являются собаки и кошки. Предпочтительно, млекопитающим является человек.
Термины "иммуногенное количество" и "иммунологически эффективное количество", используемые взаимозаменяемым образом, относятся к количеству антигена или иммуногенной композиции, достаточному для элисирования иммунного ответа, либо клеточного (Т-клеточного), либо гуморального (В-клеточного или антительного) ответа, или их обоих при измерении стандартными анализами, известными специалисту.
Количества конкретного конъюгата в композиции обычно вычисляют по суммарному полисахариду, конъюгированному и неконъюгированному, для данного конъюгата. Например, конъюгат СР5 с 20% свободного полисахарида должен иметь примерно 80 мкг конъюгированного полисахарида СР5 и примерно 20 мкг неконъюгированного полисахарида СР5 в дозе 100 мкг полисахарида СР5. Вклад белка в конъюгат обычно не учитывают при вычислении дозы конъюгата. Количество конъюгата может варьировать в зависимости от стафилококкового серотипа. Обычно каждая доза должна содержать от 0,1 до 100 мкг полисахарида, конкретно, от 0,1 до 10 мкг и, более конкретно, от 1 до 10 мкг. "Иммуногенное количество" разных полисахаридных компонентов в иммуногенной композиции может варьировать, и каждый может составлять 1 мкг, 2 мкг, 3 мкг, 4 мкг, 5 мкг, 6 мкг, 7 мкг, 8 мкг, 9 мкг, 10 мкг, 15 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг или примерно 100 мкг любого конкретного полисахаридного антигена.
"Инвазивное заболевание" S.aureus представляет собой выделение бактерий из области, которая в норме является стерильной, где имеются клинические признаки/симптомы, ассоциированные с заболеванием. Стерильные в норме области организма включают кровь, цереброспинальную жидкость (CSF), плевральную жидкость, перикардиальную жидкость, перитонеальную жидкость, суставную/синовиальную жидкость, кость, внутренние органы организма (лимфатический узел, мозг, сердце, печень, селезенка, стекловидная жидкость, почка, поджелудочная железа, яичник) или другие области, стерильные в норме. Клинические состояния, характеризующие инвазивные заболевания, включают бактериемию, пневмонию, целлюлит, остеомиелит, эндокардит, септический шок и другие.
Эффективность антигена в качестве иммуногена можно измерять либо анализами пролиферации, либо анализами цитолиза, такими как анализы высвобождения хрома для измерения способности Т-клетки лизировать ее специфическую клетку-мишень, либо измерением уровней В-клеточной активность путем измерения уровней циркулирующих антител, специфических для антигена, в сыворотке. Иммунный ответ можно также детектировать измерением уровней антитела, специфичного к антигену, в сыворотке, которое индуцировано после введения антигена, и, более специфично, измерением способности антител, индуцированных таким образом, усиливать опсонофагоцитарную способность конкретных белых клеток крови, как описано здесь. Уровень защиты иммунным ответом можно измерять действием на иммунизированного хозяина антигеном, который был введен. Например, если антиген, в отношении которого желателен иммунный ответ, представляет собой бактерию, уровень защиты, индуцированной иммуногенным количеством антигена, измеряют определением процента выживаемости или процента смертности после воздействия бактериальными клетками на животных. В одном из воплощений количество защиты можно оценивать посредством измерения по меньшей мере одного симптома, ассоциированного с бактериальной инфекцией, например лихорадки, ассоциированной с инфекцией. Количество каждого антигена в мультиантигенной или многокомпонентной вакцине или иммуногенной композиции будет варьировать относительно каждого другого компонента, и его можно определять способами, известными специалисту. Такие способы могут включать процедуры измерения иммуногенности и/или эффективности in vivo.
В определенных воплощениях термин "примерно" означает в пределах 20%, предпочтительно, в пределах 10% и, более предпочтительно, в пределах 5%.
В этом изобретении дополнительно предложены антитела и антительные композиции, которые связываются специфично и селективно с капсулярными полисахаридами серотипа 5 или 8 или с иммуногенными конъюгатами по настоящему изобретению. В некоторых воплощениях антитела образуются при введении субъекту капсулярных полисахаридов серотипа 5 или 8 или иммуногенных конъюгатов по настоящему изобретению. В некоторых воплощениях в этом изобретении предложены очищенные или выделенные антитела, направленные против одного или более чем одного капсулярного полисахарида серотипа 5 или 8 или иммуногенного конъюгата по настоящему изобретению. В некоторых воплощениях антитела по настоящему изобретению являются функциональными при измерении по умерщвлению бактерий либо в модели эффективности на животном, либо анализом опсонофагоцитарного умерщвления. В некоторых воплощениях антитела по этому изобретению придают субъекту пассивный иммунитет. В настоящем изобретении дополнительно предложены полинуклеотидные молекулы, кодирующие антитело или фрагмент антитела по этому изобретению, и клетка, клеточная линия (такая как гибридомные клетки или другие сконструированные клеточные линии для рекомбинантной продукции антител) или трансгенное животное, которые продуцируют антитело или антительную композицию по этому изобретения при использовании методик, хорошо известных специалистам в данной области.
Антитела или антительные композиции по этому изобретению можно использовать в способе лечения или предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного со Staphylococcus sp., у субъекта, включающем генерирование препарата поликлонального или моноклонального антитела и использовании указанного антитела или антительной композиции для обеспечения пассивного иммунитета у субъекта. Антитела по этому изобретению могут также быть полезными для диагностических способов, например детектирования присутствия или количественного определения уровней СР5, СР8 или его конъюгата.
Для оценки эффективности любой описанной здесь иммуногенной композиции можно использовать несколько моделей на животном, известных в данной области. Например, следующих.
Модель пассивного сепсиса на мышах. Мышей пассивно иммунизируют внутрибрюшинным (i.p.) введением иммунного IgG или моноклонального антитела. На мышей через 24 часа воздействуют летальной дозой S.aureus. Бактериальную дозу вводят внутривенно (i.v. или i.p.), будучи уверенными, что любую выживаемость можно приписать специфичному взаимодействию антитела с бактериями in vivo. Дозу бактериального заражения определяют как дозу, требуемую для достижения летального сепсиса у примерно 20% не иммунизированных контрольных мышей. Статистическую оценку исследований выживаемости можно осуществлять анализом по Каплану-Мейеру.
Модель активной иммунизации и воздействия бактериями. В этой модели мышей подвергают активной иммунизации подкожно (s.c.) при использовании целевого антигена на сроках 0, 3 и 6 недель (или в похожем режиме, известном специалистам) и осуществляют контрольное заражение S.aureus на сроке 8 недель (или в другом похожем режиме, известном специалистам) внутривенным или внутрибрюшинным путем. Дозу бактериального заражения калибруют для достижения примерно 20% выживаемости в контрольной группе в течение 14-дневного периода. Статистическую оценку исследований выживаемости можно осуществлять анализом по Каплану-Мейеру.
Пассивная модель инфекционного эндокардита. Модель пассивной иммунизации против инфекционного эндокардита (IE), вызываемого S.aureus, использовали ранее, чтобы показать, что защитный иммунитет могут индуцировать Clfa. См., Vernachio et al. (2006) Antimicro. Agents & Chemo. 50:511-518. В этой модели IE использовали кроликов или крыс для моделирования клинических инфекций, в том числе при центральном венозном катетере, бактериемии и гематогенном переносе в дистальные органы. Катетеризированным кроликам или крысам со стерильными разрастаниями клапана аорты делали одну внутривенную инъекцию моноклонального или поликлонального антитела, специфичного к целевому антигену. Через 24 часа животным внутривенно вводили гетерологичные стафилококковые штаммы или штамм MRSA. Через 48 часов после заражения сердечные разрастания, почки и кровь собирали и культивировали. Затем определяли частоту стафилококковой инфекции в разрастаниях сердечного клапана, почках и крови. В одном из исследований, когда на животных воздействовали либо штаммом MRSE АТСС 35984, либо штаммом MRSA PFESA0003, было показано значительное снижение инфицирования при использовании препарата либо поликлонального антитела, либо моноклонального антитела против ClfA. См. выше Vernachio et al.
Пассивная модель инфекционного эндокардита. Эту модель инфекционного эндокардита также адаптировали для исследований активной иммунизации. Кроликов или крыс иммунизировали внутримышечно (i.m.) целевым антигеном и заражали S.aureus через две недели внутривенным путем.
Модель пиелонефрита. В модели пиелонефрита мышей иммунизируют на сроках 0, 3 и 6 недель (или в таком же режиме, известном специалистам) целевыми антигенами. На сроке 8 недель на животных заражают, например, интраперитонеальной инъекцией, например, 1,7×108 КОЕ (колониеобразующие единицы) S.aureus PFESA0266. Через 48 часов почки и/или другие ткани собирают и культивируют. Наконец, в почках и/или других тканях подсчитывают колониеобразующие единицы введенных бактерий. Эта модель оценивает системную диссеминацию у животного.
Мониторинг функциональных антител анализом посредством опсонофагоцитарного умерщвления
Для этого анализа можно использовать дифференцированные эффекторные клетки из клеточной линии (например HL60) или полиморфоядерные клетки (PMN), выделенные из донорской человеческой крови с использованием раствора LYMPHOLYTE®-poly (Cedariane laboratories limited, Онтарио, Канада) по инструкциям изготовителя. Эффекторные клетки ресуспендировали в буфере для анализа (модифицированная среда Игла, содержащая 1% бычьего сывороточного альбумина) в концентрации примерно 2×107 клеток/мл и помещали в инкубатор при 37°С до использования. S.aureus штамм PFESA0266 выращивали в течение ночи на агаровых планшетах с трипсиновым гидролизатом сои. Бактериальные клетки соскребали, дважды промывали и ресуспендировали в буфере для анализа, содержащем 5% глицерина, до оптической плотности OD600=1, что равно концентрации примерно 5×108 КОЕ/мл. Аликвоты по 1 мл бактериальной суспензии замораживали и хранили при -40°С до использования. Замороженную бактериальную суспензию оттаивали и доводили до концентрации 106 КОЕ/мл в буфере для анализа и помещали на лед. Анализ осуществляли с использованием стерильных полипропиленовых планшетов с 96 глубокими лунками на 1 мл. Получали двукратные серийные разведения проб антитела (50 мкл) и затем добавляли 300 мкл буфера для анализа к смеси с антителом. Добавляли в планшеты бактерии (50 мкл) и помещали на роторный шейкер при 4°С на 30 минут. За стадией опсонизации следовало добавление 50 мкл человеческого комплемента (конечная концентрация 1%). Наконец, в планшет добавляли 50 мкл эффекторных клеток (концентрация 107 клеток/мл) и хорошо перемешивали суспензию многократным пипетированием. Проводили 10-кратное серийное разведение аликвоты 50 мкл суспензии в стерильном 1%-ном растворе сапонина, перемешивали на вортексе для минимизации слипания бактерий и высевали на агар с трипсиновым гидролизатом сои в двух параллелях. Планшет для анализа инкубировали при 37°С в течение 1 часа при непрерывном перемешивании на ротационном шейкере. В конце инкубации проводили 10-кратное серийное разведение аликвоты 50 мкл суспензии в стерильном 1%-ном растворе сапонина, перемешиваемом на вортексе для минимизации слипания бактерий, и высевали в двух параллелях на агар с трипсиновым гидролизатом сои. Процент умерщвления рассчитывали путем определения соотношения числа КОЕ, выживающих на сроке 60 минут в лунках с бактериями, антителами, комплементом и эффекторными клетками, и числа КОЕ, выживающих в пробирках, не содержащих антитела, но содержащих бактерии, комплемент и эффекторные клетки. Контроли, содержащие бактерии, комплемент и сыворотки, учитывали для поправок на любое снижение КОЕ по причине слипания.
Адсорбция комплемента
В этом анализе можно в качестве источника комплемента можно использовать человеческую донорскую сыворотку, подвергнутую адсорбции против штаммов S.aureus PFESA0266, PFESA0286 и PFESA0270. Штаммы S.aureus выращивали в течение ночи на TSA-планшетах при 37С. Клетки соскребали с планшета и ресуспендировали в стерильном PBS. Бактериальные клетки центрифугировали при 10000 об/мин в течение 10 минут при 4°С и клеточный осадок ресуспендировали в человеческой сыворотке для адсорбции. Сыворотку инкубировали с бактериями на качалке при 4°С в течение 30 минут. Клетки центрифугировали, сыворотку переносили в другую пробирку, содержащую бактерии, и стадию адсорбции повторяли снова в течение 30 минут. Наконец, клетки центрифугировали и пропускали сыворотку через 0,2-микронный фильтр, после чего аликвоты по 0,5 мл замораживали в жидком азоте.
Способ II - Анализ опсонофагоцитоза (ОРА) с использованием клеток HL-60
Клетки HL-60 подвергали дифференцировке по S.Romero-Steiner et al., Clin Diagn Lab Immunol 4 (4) (1997), pp.415-122. Собранные клетки HL-60 ресуспендировали в буфере для анализа (модифицированная среда Игла, содержащая 1% бычьего сывороточного альбумина) при примерно 108 клеток/мл и помещали в инкубатор при 37°С до использования. S.aureus выращивали в течение ночи на агаровых планшетах с трипсиновым гидролизатом сои. Бактериальный клетки соскребали, дважды промывали и ресуспендировали в буфере для анализа, содержащем 5% глицерина, до оптической плотности OD600=1, что соответствует примерно 5×108 КОЕ/мл. Аликвоты по 1 мл бактериальной суспензии замораживали и хранили при -40°С до использования. Замороженную бактериальную суспензию оттаивали и доводили до концентрации 106 КОЕ/мл в буфере для анализа и помещали на лед. Анализ осуществляли с использованием стерильных полипропиленовых планшетов с 96 глубокими лунками на 1 мл. Получали серийные двукратные разведения образцов моноклонального антитела (25 мкл) и затем к суспензии антитела добавляли по 150 мкл буфера для анализа. Добавляли в планшеты бактерии (25 мкл) и помещали на роторный шейкер при 4°С на 30 минут и затем добавляли 25 мкл человеческого комплемента (конечная концентрация 1%). Наконец, добавляли в планшет 25 мкл клеток HL-60 (107 клеток/мл) и хорошо перемешивали суспензию неоднократным пипетированием. Осуществляли 10-кратное серийное разведение аликвоты суспензии 25 мкл в стерильном 1%-ном растворе сапонина, перемешивали на вортексе для минимизации слипания бактерий и высевали в двух параллелях на агар с трипсиновым гидролизатом сои. Планшет для анализа инкубировали при 37°С в течение 1 часа при постоянном перемешивание на роторной качалке. В конце инкубации осуществляли 10-кратное серийное разведение аликвоты суспензии 25 мкл в стерильном 1%-ном растворе сапонина, перемешивали на вортексе и высевали в двух параллелях на агар с трипсиновым гидролизатом сои. Процент гибели рассчитывали посредством определения соотношения числа КОЕ, выживающих на сроке 60 минут в лунках с бактериями, антителами, комплементом и клетками HL-60, и числа КОЕ, выживающих в пробирках, не содержащих антител, но содержащих бактерии, комплемент и клетки HL-60. Контроли, содержащие бактерии, комплемент и mAb, учитывали для поправок на любое снижение КОЕ по причине слипания.
Нижеследующее примеры приведены для иллюстрации, но не для ограничения.
ПРИМЕРЫ
Пример 1: Получение капсулярного полисахарида S.aureus серотипа 8
В этом примере описано получение различных диапазонов размера капсулярного полисахарида S.aureus серотипа 8. Структура повторяющейся единицы капсулярного полисахарида S.aureus серотипа 8 показана на Фиг.1. Описанные здесь способы являются эффективными в получении капсулярного полисахарида серотипа 8 с молекулярными массами, варьирующими в диапазоне от примерно 20 кДа до 700 кДа. Посредством правильного выбора условий можно выделять и очищать высокомолекулярные капсулярные полисахариды серотипа 8 в диапазоне от 50 кДа до 700 кДа по молекулярной массе. Для применения в иммуногенных композициях можно выделять и очищать капсулярный полисахарид серотипа 8 в диапазоне от 70 кДа до 300 кДа по молекулярной массе и во многих желаемых диапазонах. На основании характеристик роста и количества получаемых капсул для получения капсулярного полисахарида серотипа 8 были использованы штаммы PFESA0005 или PFESA0286. Было показано, что капсулы, выделенные из штаммов PFESA0005 или PFESA0286, являются идентичными.
Для получения капсулярных полисахаридов серотипа 8 штаммы выращивали в комплексной среде, состоящей главным образом из источника углерода (либо лактоза, либо сахароза), гидролизованной соевой муки в качестве источника азота и следовых количеств металлов. Штаммы выращивали в биореакторах в течение 2-5 суток.
Перед автоклавированием брали образец для тестирования уровня стафилококкового энтеротоксина В (SEB) в культуре. В присутствии 0,05% полисорбата 80 концентрация SEB в продукте ферментации составляла 15-20 нг/мл. Предыдущие эксперименты показали, что автоклавирование культуры в течение 1 часа снижало уровень SEB до менее чем 0,1 нг/мл, что ниже предела детектирования набором TECRA.
После диафильтрации и фракционирования этанолом полисахарид наносили на колонку с Q-Сефарозой АЕС и элюировали линейным градиентом NaCl, как описано выше. Фракции анализировали посредством O-ацетильного анализа и тестом двойной иммунодиффузии на присутствие полисахарида серотипа 5 и анализом фосфатов на присутствие тейхоевой кислоты (ТА). Присутствие полисахарида серотипа 8 детектировали во фракциях от 35 до 95 (Фиг.2А-Б).
Для снижения загрязнения тейхоевой кислотой фракции от 35 до 75 объединяли и всю остаточную тейхоевую кислоту окисляли метаперйодатом натрия, чтобы сделать возможным ее удаление 3К-диафильтрацией против дистиллированной воды.
Очистку капсулярного полисахарида серотипа 8, используемого для получения конъюгатов, осуществляли двумя разными способами, которые основаны на том, что повышенная температура и низкий рН влияют на освобождение капсулы из клетки и снижают молекулярную массу полисахарида. Получившаяся молекулярная масса зависела от времени, температуры и рН стадии гидролиза.
Характеристику капсулярного полисахарида серотипа 8 осуществляли с помощью методик, указанных в Таблице 1.
|
|
Капсулярные полисахариды, полученные способами, описанными ниже, приводят к чистым хорошо охарактеризованным полисахаридам с низкими уровнями загрязнения белками, нуклеиновыми кислотами, пептидогликанами и тейхоевой кислотой.
В первом способе после высвобождения капсулярного полисахарида из клетки и снижения молекулярной массы препарат обрабатывали смесью ферментов (например, рибонуклеазы, дезоксирибонуклеазы, лизоцима и протеазы) для разложения примесей. После инкубации оставшиеся примеси осаждают добавлением этанола (конечная концентрация примерно 25%). После удаления остаточного этанола раствор, содержащий капсулярный полисахарид, наносили на анионообменную колонку (Q-Сефароза) и элюировали линейным солевым градиентом. Фракции, содержащие капсулярный полисахарид, объединяли и обрабатывали метаперйодатом натрия. Эта обработка приводила к окислительному гидролизу примеси, представляющей собой остаточную тейхоевую кислоту, но не влияла на капсулярный полисахарид серотипа 8. Эту реакционную смесь гасили добавлением этиленгликоля. Вещество концентрировали и подвергали диафильтрации против дистиллированной воды для удаления любых остаточных реагентов и побочных продуктов.
Второй способ использовали для получения капсулярного полисахарида без применения ферментов для разложения различных происходящих из клеток примесей. В этом способе после высвобождения капсулярного полисахарида из клетки и снижения молекулярной массы гидролизованный ферментационный бульон осветляли микрофильтрацией и далее ультрафильтрацией и диафильтрацией. Раствор обрабатывали активированным углем для удаления примесей. Вещество после обработки углем обрабатывали метаперйодатом натрия для окисления остаточной тейхоевой кислоты и далее гасили пропиленгликолем. Вещество концентрировали и подвергали диафильтрации против дистиллированной воды для удаления любых остаточных реагентов и побочных продуктов.
Препараты, полученные при использовании любого способа, давали чистые капсулярные полисахариды с низкими уровнями примесей, представляющих собой белки, нуклеиновые кислоты и тейхоевую кислоту. Описанные способы можно использовать для получения конкретных диапазонов желаемых высокомолекулярных полисахаридов варьированием условий гидролиза. Примеры капсулярного полисахарида, получаемого описанными здесь способами, показаны ниже в Таблице 2. Партии очищенного капсулярного полисахарида серотипа 8 имели высокую чистоту, о чем свидетельствует отсутствие тейхоевой кислоты (ТА) и пептидогликана и низкий уровень остаточного белка (см., Таблицу 2). Диапазон более низких молекулярных масс простирался от 20,4 кДа до 65,1 кДа, и очищенные полисахариды были высоко O-ацетилированными (примерно 100%). Уровни загрязнения нуклеиновыми кислотами были низкими (0,12-2,45%).
|
Селекция капсулярных полисахаридов по молекулярной массе
Кинетический анализ продемонстрировал, что описанными здесь способами можно получать широкий диапазон молекулярных масс капсулярных полисахаридов. Исходно бактериальные клетки продуцировали более крупные полисахариды, и впоследствии выбирали желаемый диапазон молекулярной массы и затем очищали манипулированием рН и условий нагревания на стадиях нагревания и гидролиза.
Тепловая обработка ферментационного бульона S.aureus является стадией между ферментацией и извлечением капсулярного полисахарида. На этой стадии используют нагревание для обработки бульона с установленным рН в течение определенного времени. Задачи тепловой обработки при низком рН заключаются в умерщвлении клеток, инактивации энтеротоксинов, высвобождении связанного с клетками полисахарида и снижении молекулярной массы до желаемого размера. Среди этих задач снижение молекулярной массы было самым медленным по времени, требуемому на этой стадии. Поэтому за соответствующее время неизбежно решались другие задачи.
Тепловая обработка нагреванием. Определяли рН и температурные условия для селекции различных диапазонов молекулярной массы капсулярных полисахаридов. Для этих исследований использовали ферментатор Biolafitte 15L. Ферментационный бульон перемещали в ферментатор перистальтическим насосом. При скорости перемешивания примерно 200 об/мин доводили рН бульона концентрированной серной кислотой. Затем температуру бульона поднимали до установленной величины. Время тепловой обработки засекали, как только температура достигала установленной точки. Когда проходило желаемое время обработки, бульон охлаждали до комнатной температуры. Во время процесса брали пробы для определения концентрации и молекулярной массы полисахарида системами HPLC (высокоэффективная жидкостная хроматография) и SEC-MALLS, соответственно. Данные по молекулярной массе (MW) использовали в кинетическом анализе. Профили молекулярной массы определяли с течением времени при рН 3,5, 4,0 и 5,0 (см. Фиг.3А).
Кинетику мягкого кислотного гидролиз полисахаридов определяли с помощью очищенного капсулярного полисахарида серотипа 8, полученного во время этого процесса. Очищенный раствор полисахарида доводили серной кислотой до желаемого для эксперимента рН. Примерно по 1,5 мл раствора переносили в каждую центрифужную пробирку емкостью 15 мл. Пробирки помещали на масляную баню, снабженную прецизионной системой температурного контроля. Пробирки отбирали через определенные интервалы времени и гасили в ведре со льдом. В конце эксперимента аликвоту 1 М Трис-буфера (рН 7,5) добавляли к пробе для доведения рН обратно до примерно 7. Пробы анализировали на системе SEC-MALLS. Данные по молекулярной массе использовали в кинетическом анализе. Влияние температуры на профиль MW СР8 при рН 3,5 определяли с течением времени (см. Фиг.3Б).
Результаты
Как показано на Фиг.3А, более низкий рН был более эффективным в снижении молекулярной массы полисахарида. Молекулярные массы между 300 кДа и 600 кДа можно получать при использовании рН 5 при 95°С за время между 15 минутами и 120 минутами. Подобным же образом, молекулярные массы между 250 кДа и 450 кДа можно получать при использовании рН 4 при 95°С за время между 15 минутами и 120 минутами. Более того, молекулярные массы между 120 кДа и 450 кДа можно получать при использовании рН 3,5 при 95°С за время между 15 минутами и 120 минутами.
Как показано на Фиг.3Б, чем выше температура, тем выше скорость гидролиза, и тем более широкий диапазон молекулярных масс полисахарида получается с течением времени. Применение сниженной температуры, 55°С в сравнении 95°С, при том же рН дает более узкий диапазон молекулярных масс полисахарида.
Более того, Фиг.4 демонстрирует корреляцию между молекулярной массой очищенного СР8 и временем обработки при мягком кислотном (рН 3,5 при 95°С) гидролизе. Очищенный полисахарид представляет собой конечный продукт, получаемый в процессе извлечения, детализированном выше. Как также показано на Фиг.4, увеличение времени тепловой обработки S.aureus штамма PFESA0005 при рН 3,5 приводит к меньшей молекулярной массе СР8, тогда как сокращение времени тепловой обработки при рН 3,5 приводит к более высокой молекулярной массе СР8. Размер капсулярных полисахаридов серотипа 8 находится в диапазоне от примерно 80 кДа до примерно 220 кДа в зависимости от длительности времени тепловой обработки при рН 3,5. Корреляция между временем тепловой обработки при низком рН и размером очищенного СР8, как показано на Фиг.4, позволяет оценивать время обработки, требуемой для получения очищенного полисахарида с определенным диапазоном молекулярной массы.
Важно отметить, что, как продемонстрировано выше, можно получать, извлекать и очищать полный диапазон молекулярных масс капсулярных полисахаридов серотипа 8 от 20 кДа до более чем 500 кДа. Поэтому эти способы можно использовать для получения конкретных диапазонов желаемых высокомолекулярных капсулярных полисахаридов, таких, какие показаны в Таблице 3. Относительно узкий диапазон молекулярных масс полисахарида, получаемый, если пик молекулярных масс находится в диапазоне от 87 кДа до 108 кДа, является хорошо охарактеризованным молекулярных диапазоном масс, который можно получать описанными здесь способами. Особенно предпочтительные диапазоны высокомолекулярных полисахаридов, в диапазоне от 70 кДа до 300 кДа или от 70 кДа до 150 кДа, являются полезными в получении иммуногенных композиций конъюгацией капсулярного полисахарида с молекулой носителя или белком (см. Таблица 3). Условия, используемые для получения капсулярного полисахарида СР8, имеющего диапазон молекулярных масс от примерно 80 до 120 кДа, являются следующими: 95°С, рН 3,5 в течение 300 минут.
|
Пример 2: Конъюгирование капсулярных полисахаридов серотипа 8 с CRM197
Этот пример описывает способы и анализы для характестики, используемые в получении конъюгатов капсулярного полисахарида S.aureus серотипа 8 с CRM197. Разные химические способы конъюгирования были разработаны для конъюгации капсулярного полисахарида S.aureus серотипа 8 с этим белком носителем. Например, конъюгирование с использованием PDPH (3-(2-пиридилдитио)-пропионилгидразид) имеет результатом ковалентную тиоэфирную связь между СР и белком носителем. Альтернативно, конъюгирование с использованием CDI/CDT (1,1-карбоилдиимидазол/1,1-карбоил-ди-1,2,4-триазол) имеет результатом одноуглеродный или нуль-углеродный линкер между СР и белком носителем.
Конъюгация капсулярного полисахарида серотипа 8 с CRM197 с использованием PDPH
Способ химического конъюгирования с использованием PDPH является многостадийным и включает активацию полисахарида, удаление тиольной защитной группы, очистку промежуточного активированного полисахарида, активацию и очистку белка CRM197 и конъюгирование активированных компонентов и последующую очистку. После введения линкера, содержащего тиольную группу, в полисахарид и галогеноацетильной группы в белок носитель CRM197 капсулярный полисахарид S.aureus серотипа 8 связывали с белком-носителем через тиоэфирную связь. Бромацетильные группы вводили в белок CRM197 путем взаимодействия аминных групп с N-гидроксисукцимидным эфиром бромуксусной кислоты. Для получения тиолированного полисахарида активированные карбодиимидом карбоксилатные группы N-ацетилманнозаминуроновой кислоты в полисахариде подвергали сочетанию с гидразидной группой сульфгидрил-реактивного гидразидного гетеробифункционального линкера 3-(2-пиридилдитио)-пропионилгидразида (PDPH). Тиолы PDPH-тиолированного полисахарида, полученного восстановлением с помощью DTT и очищенного посредством SEC на колонке с Сефадексом G25, приводили во взаимодействие с бромацетильными группами активированного белка, что приводит к образованию ковалентной тиоэфирной связи в результате бромного замещения между полисахаридом и белком-носителем. Непрореагировавшие бромацетильные группы "прикрывали" гидрохлоридом цистеамина (гидрохлоридом 2-аминоэтантиола). Затем реакционную смесь концентрировали и подвергали диафильтрации. Оставшиеся несконъюгированные бромацетильные группы «прикрывали» гидрохлоридом цистеамина для обеспечения отсутствия реактивных бромацетильных групп, оставшихся после конъюгирования. Это давало ковалентную связь между тиольным концом цистеамина и ацетильной группой на лизиновом остатке после бромного замещения.
1. Тиолирование капсулярного полисахарида S.aureus серо/пула 8 с помощью PDPH. Полисахарид сначала активировали тиолированием с помощью PDPH. Полисахарид смешивали со свежеполученным маточным раствором PDPH (250 мг/мл в DMSO), маточным раствором EDAC (90 мг/мл в дистиллированной воде) и маточным раствором буфера MES (0,5 М, рН 4,85) с получением конечного раствора 0,1 М MES и 2 и 4 мг полисахарида/мл при поддержании массового соотношения полисахарид: PDPH:EDAC 1:0,6:1,25. Эту смесь инкубировали в течение 1 часа при комнатной температуре и затем диализировали против 1000-кратного объема дистиллированной Н2О четыре раза, используя устройство для диализа 3500 М WCO, при температуре между 4°С и 8°С для удаления непрореагировавшего PDPH. PDPH-связанный полисахарид обрабатывали 0,2 М DTT и инкубировали при комнатной температуре в течение 3 часов или в течение ночи при температуре между 4°С и 8°С. Избыток DTT, а также побочные продукты этого взаимодействия отделяли от активированного сахарида посредством SEC, используя смолу Сефадекс G25 и дистиллированную воду в качестве подвижной фазы. Фракции анализировали с использованием дитиопиридина (DTDP) на наличие тиольных групп и объединяли тиол-положительные фракции, которые элюировались близко к «свободному объему» колонки. Пул фракций анализировали с помощью гидразида парагидроксибензойной кислоты (РАНВАН) и анализов на O-ацетил для определения степени активации, которую выражали как молярный процент повторяющихся единиц, содержащих тиольную группу (молярная концентрация тиолов/молярная концентрация повторяющихся единиц). Активированный полисахарид лиофилизировали и хранили при -25°С перед конъюгированием.
Результаты по воспроизводимости тиолирования полисахарида серотипа 8 с помощью PDPH показаны в Таблице 4. Степень активации полисахарида серотипа 8 находилась в диапазоне от 12% до 16%, что соответствует диапазону от примерно одной присоединенной молекулы линкера на десять повторяющихся единиц капсулярного полисахарида до одной молекулы линкера на пять повторяющихся единиц.
|
2. Активация белка носителя. Белок носитель отдельно активировали путем бромацетилирования. CRM197 разбавляли до 5 мг/мл в 10 мМ забуференном фосфатом 0,9%-ном NaCl рН 7 (PBS) и затем доводили 1 М маточным раствором до 0,1 М NaHCO3 при рН 7,0. Добавляли N-гидроксисукцинимидный эфир бромуксусной кислоты (BAANS) в массовом соотношении CRM197:BAANS 1:0,25 масс., используя маточный раствор 20 мг/мл BMNS в DMSO. Эту реакционную смесь инкубировали при температуре между 4°С и 8°С в течение 1 часа, затем очищали с помощью SEC на Сефадексе G-25. Очищенный активированный CRM197 анализировали методом Лоури для определения концентрации белка и затем разбавляли PBS до 5 мг/мл. Сахарозу добавляли в качестве криопротектора до 5% масс./об. и активированный белок замораживали и хранили при -25°С до возникновения необходимости в конъюгации
Бромацетилирование лизиновых остатков CRM197 было очень устойчивым и приводило к активации 19-25 лизинов из 39 доступных лизинов (см. Таблица 5). Это взаимодействие давало высокие выходы активированного белка.
|
|
3. Реакция сочетания. Сразу по получении активированного капсулярного полисахарида и активированного белка носителя их объединяли в реакционной смеси для конъюгирования. Лиофилизированный и тиолированный полисахарид растворяли в 0,16 М борате при рН 8,95 и смешивали с размороженным бромацетилированным CRM197 и дистиллированной водой для получения конечного раствора 0,1 М бората и 1 мг/мл полисахарида при соотношении CRM197: полисахарид 1:1 по массе. Эту смесь инкубировали при комнатной температуре в течение 16-24 часов. Непрореагировавшие бромацетильные группы на белке «прикрывали» добавлением гидрохлорида цистеамина в соотношении CRM197: цистеамин 1:2 (по массе), используя маточного раствора цистеамина 135 мг/мл, растворенного в 0,1 М борате при рН 8,95 и инкубировали в течение 4 часов при комнатной температуре. Конъюгат капсулярного полисахарида с CRM197 (конъюгат) очищали 50-кратной диафильтрацией против 0,9%-ного NaCl, используя полиэфирсульфоновый ультрафильтр 100К.
Результаты исследований воспроизводимости тиолирования капсулярного полисахарида серотипа 8 с помощью PDPH продемонстрировали, что степень активации полисахарида была в диапазоне от 12% до 16%, что соответствует приблизительно от одной присоединенной молекуле линкера на десять полисахаридных повторяющихся единиц до одной молекулы линкера на пять повторяющихся единиц.
Конъюгация капсулярного полисахарида серотипа 8 с CRM197 посредством CDI/CDT конъюгационной химии
CDI и CDT обеспечивают одностадийный способ конъюгации, в котором полисахарид активируют в безводной среде (DMSO) с образованием имидазол- или триазолкарбаматных группировок с доступными гидроксилами и ацилимидазольных или ацилтриазольных группировок с карбоновыми кислотами. Добавление белка носителя (в DMSO) приводит к нуклеофильному замещению имидазола или триазола лизином и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот).
Способы конъюгации при использовании как CDI, так и CDT дают капсулярный полисахарид серотипа 8, ковалентно связанный с белком носителем, о чем свидетельствует присутствие сахаридов и белка во фракциях при гель-фильтрации и аминокислотный анализ конъюгата, «прикрытого» гликольальдегидом или гидрохлоридом цистеамина.
Сводка по результатам получения нескольких партий конъюгатов, получаемых посредством как PDPH, так и CDI/CDT химии, для диапазона размеров капсулярного полисахарида серотипа 8 от 20 кДа до 40 кДа, показана в Таблице 6 ниже. Значительных различий в свободном капсулярном полисахариде, соотношении полисахарид-белок и выходах конъюгатов, получаемых этими двумя способами конъюгации, не было. Антигенность конъюгированного капсулярного полисахарида серотипа 8 не была изменена конъюгацией, как показывает идентичность линий преципитации конъюгатов и нативного полисахарида.
|
Как показано выше, описанные здесь способы можно использовать для получения конкретных диапазонов желаемых высокомолекулярных капсулярных полисахаридов. Авторы хотели получать конъюгаты из предварительно выбранного диапазона высокомолекулярных капсулярных полисахаридов серотипа 8, которые можно фильтровать и очищать для применения в иммуногенных композициях. Таблица 7 суммирует анализ конъюгатов капсулярного полисахарида серотипа 8, где капсулярный полисахарид серотипа 8 по молекулярной массе находился в диапазоне от примерно 80 кДа до 120 кДа и был использован способ имидазольной конъюгации. Молекулярные массы полученных конъюгатов находятся в диапазоне от 595 кДа до 1708 кДа. Число конъюгированных лизинов на CRM197 находилось в диапазоне от высокого - 9 до низкого - 3. Содержание свободного капсулярного полисахарида находилось в диапазоне от высокого (6%) до низкого (2%).
|
Оба способа конъюгации дают капсулярный полисахарид серотипа 8, ковалентно связанный с белком носителем. Значительных различий по свободному капсулярному полисахариду, соотношению капсулярного полисахарида серотипа 8 и белка и выходам конъюгатов, получаемых этими двумя способами, не было.
Пример 3: Способ с использованием CDI/CDT в одной емкости в сравнении с комплексным способом
Как описано выше, способы получения иммуногенных конъюгатов по этому изобретению включают ковалентную конъюгацию капсулярных полисахаридов с белками-носителями с использованием конъюгационной химии, включающей CDI (1,1-карбонилдиимидазол), CDT (1,1-карбоил-ди-1,2,4-триазол) или PDPH (гидразид 3-(2-пиридилдитио)-пропионила). Использование CDI/CDT имеет результатом одноуглеродный или нуль-углеродный линкер между капсулярным полисахаридом и белком носителем, в то время как использование PDPH имеет результатом ковалентную тиоэфирную связь между капсулярным полисахаридом и белком носителем.
Способ на основе PDPH представлял собой многостадийный процесс, который включал активацию полисахарида, удаление тиольной защитной группы на полисахариде, очистку промежуточного активированного полисахарида, активацию и очистку белка носителя и конъюгирование активированных компонентов с последующей очисткой. В этом способе капсулярные полисахариды S.aureus серотипа 8 приводили во взаимодействие с PDPH и карбодиимидом в водном растворе, таком как 0,1 М MES, с получением полисахаридов, связанных с PDPH. Полисахариды, связанные с PDPH, приводили во взаимодействие с восстановителем с получением активированных полисахаридов, которых затем очищали. Белки носители приводили во взаимодействие с N-гидроксисукцинимидным эфиром бромуксусной кислоты в водном растворе с получением активированных белков носителей, которые затем очищали. Очищенные активированные полисахариды серотипа 8 затем приводили во взаимодействие с очищенными активированными белками носителями с получением конъюгатов полисахарида серотипа 8 с белком-носителем.
Напротив, способы на основе CDI и CDT представляли собой одностадийные или двухстадийные процессы конъюгации, в которых капсулярный полисахарид активировали в безводной среде (то есть DMSO) с образованием имидазол- или триазолкарбаматных группировок с доступными гидроксилами и ацилимидазольных или ацилтриазольных группировок с карбоновыми кислотами. Добавление белка носителя (в DMSO) приводило к нуклеофильному замещению имидазола или триазола лизином и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот). Соответственно, были разработаны два способа на основе CDI или CDT: более сложный способ и более простой способ, осуществляемый в одной емкости. В более сложном способе капсулярный полисахарид S.aureus серотипа 8 компаундировали с имидазолом или триазолом, лиофилизировали и затем подвергали взаимодействию с CDI или CDT в органическом растворителе (таком как DMSO) с получением активированных полисахаридов серотипа 8. Активированные полисахариды серотипа 8 очищали и затем приводили во взаимодействие с белками носителями в органическом растворителе с получением конъюгатов полисахарида серотипа 8 с белком носителем. Способ, осуществляемый в одной емкости, был таким же, как сложный способ, за исключением того, что активированные полисахариды серотипа 8 не очищали перед взаимодействием с белками носителями.
Комплексный способ с CDI/CDT
Активация полисахарида. Полисахарид серотипа 8 смешивали с 10 г триазола на 1 г полисахарида серотипа 8 и лиофилизировали. Получившуюся массу растворяли в DMSO в концентрации 2,0 мг полисахарида серотипа 8 на 1 мл. Определяли содержание воды. Добавляли свежеприготовленный маточный раствор CDT в концентрации 100 мг/мл в DMSO для достижения молярного количества CDT, эквивалентного количеству воды. Альтернативно, количество добавленного CDT можно корректировать для достижения более высокой или более низкой степени активации. Выдерживали 30 минут при 23°С.
Очистка активированного полисахарида серотипа 8. Раствор активированного полисахаридам серотипа 8 (АСР8) вливали в 25 объемов воды для разрушения избытка CDT. Концентрировали до исходного объема на PES-мембране на 10 кДа при приблизительно 1 мг/см3 и подвергали диафильтрации против воды при по меньшей мере 10 объемах. Эту стадию завершали менее чем за 4 часа. Подвергнутое диафильтрации вещество смешивали с 10 г триазола на 1 г исходного полисахарида серотипа 8 и лиофилизировали.
Получение лиофилизированного CRM. CRM подвергали диафильтрации против раствора 0,4% NaCl/5% сахарозы при постоянном объеме на PES-мембране на 10 кДа при по меньшей мере 10 объемах. Определяли концентрацию белка и добавляли количество буфера для диафильтрации, достаточное для доведения концентрации белка до 5,0 г/л, таким образом доводя массовое соотношение NaCl/CRM до 0,8. CRM лиофилизировали.
Конъюгация. Активированный подвергнутый диафильтрации полисахарид серотипа 8 растворяли в DMSO в концентрации 1 мг/мл. Добавляли 100 мМ раствор бората для достижения 2% об./об.
CRM ресуспендировали в концентрации 2 мг/мл и, когда растворение было полным, объединяли с раствором АСР8. Оставляли для взаимодействия при 23°С в течение 20 часов. Реакционную среду конъюгирования вливали в 24 объема 5 мМ бората с рН 9,0 и оставляли перемешиваться при комнатной температуре в течение 1 часа. Затем доводили до рН 7,5 с помощью 0,5 М фосфатного буфера при рН 6,5. Фильтровали через 5-микронный фильтр и концентрировали до исходного объема на PES-мембране на 300 кДа при нагрузке примерно 1 мг/см2 и подвергали диафильтрации против по меньшей мере 10 объемов воды. Получившийся концентрат фильтровали через 0,22-микронный фильтр и хранили при 2°С-8°С.
Способ с CDI/CDT в одной емкости.
Матричный обмен CRM197. CRM197 подвергали диафильтрации для обмена из матричной массы примерно 10 мМ фосфат/80 мМ NaCl/15% сахароза при рН 7 на 5 мМ имидазол/0,72% NaCl/15 мМ октил-β-D-глюкозид при рН 7. Этот обмен обеспечивал удаление фосфата и сахарозы, которые являются вредными для конъюгации, и определял содержание хлорида натрия, переносимого в конъюгацию. Октил-β-D-глюкопиранозид добавляют для предотвращения образования частиц после стерильного фильтрования.
Матрицу CRM197 заменяли фильтрованием в тангенциальном потоке против 5 мМ имидазол/0,72%/15 мМ октил-β-D-глюкопиранозид при рН 7 через 10 диализных объемов с использованием 10К MWCO PES мембран с концентрацией удерживания примерно 4 мг/мл. Типичная нагрузка на мембрану была 2 г/фут2 (21,5 г/м2), целевая конечная концентрация CRM197 в матрице составляла 6 мг/мл. CRM197 хранили при 2°C-8°C.
Активация/Конъюгирование. Способ активации/конъюгирования для капсулярного полисахарида S.aureus серотипа 8 состоял из следующих стадий: (1) матричный обмен CRM197; (2) компаундирование полисахарида; (3) замораживание на оболочке и лиофилизация CRM197 и компаундированного полисахарида; (4) растворение лиофилизированного полисахарида и CRM197; (5) активация полисахарида; (6) конъюгирование активированного полисахарида с CRM197; и (7) очистка конъюгата (разведение, диафильтрация, стерильное фильтрование).
Полисахарид компаундировали с 10 граммами эксципиента 1,2,4-триазола на 1 грамм полисахарида. Эксципиент добавляли в виде порошка к полисахариду, причем раствор получали менее чем через 15 минут перемешивания при температуре окружающей среды.
Компаундированный полисахарид и CRM197 по отдельности замораживали на оболочке с помощью этанольной бани при -75°С. Объем на бутыль емкостью 1 л составлял приблизительно 500 мл.
Для растворения полисахарида DMSO добавляли в индивидуальные бутыли для лиофилизации полисахарида с получением суспензии и затем переносили для нагревания в сосуд для активации/конъюгирования. Добавляли DMSO с получением концентрации 2 г/л. Прозрачный раствор получали, когда суспензия достигала примерно 45°С при перемешивании. Раствор затем охлаждали до 23°С±2°С.
Для растворения CRM197 добавляли DMSO в индивидуальные бутыли для лиофилизации, содержащим CRM197, с получением суспензии и затем переносили во второй сосуд для перемешивания. DMSO добавляли с получением концентрации 2 г/л. Прозрачный раствор в типичных случаях получали менее чем за 15 минут. Из раствора полисахарида в DMSO брали пробы для анализа по Карлу Фишеру для определения содержания влаги. CDT готовили в виде раствора 100 мг/мл в DMSO и добавляли на основании определенного содержания влаги. Непрерывное добавление раствора CDT осуществляли в течение примерно 5 минут при 23°С±2°С при перемешивании. Реакции давали продолжаться минимум 30 минут при 23°С±2°С. Из реакционной смеси брали пробы для определения уровня активация (УФ при 220/205 нм) и затем добавляли 100 мМ борат натрия при рН 9 с получением 1,5%-ного водного раствора. Этот реакционный раствор затем перемешивали минимум 30 минут при 23°С±2°С.
Для конъюгации активированного полисахарида с CRM197 добавляли DMSO до намеченной концентрации 0,8 мг/мл в реакционной среде. Затем CRM197, растворенный в DMSO, добавляли к раствору активированного полисахарида при перемешивании. Эту реакционную смесь перемешивали минимум 4 часа при 23°С±2°С.
Для гидролиза оставшихся активационных групп реакционный раствор разбавляли в 10 раз добавлением в 5 мМ тетраборат натрия при рН 9 при перемешивании. Разбавленный раствор пропускали через 5-мкм фильтр и концентрировали до намеченной концентрации удерживания 2 г/л. Фильтрование в тангенциальном потоке осуществляли с помощью мембран из регенерированной целлюлозы на 300 кДа посредством 20 диализных объемов с 5 мМ сукцинатом, рН 7. Типичная нагрузка на мембрану была 1 г/фут2 (10,75 г/м2). Очищенный конъюгат пропускали через 0,22-микронный фильтр и хранили при 2°С-8°С.
Пример 4: Конъюгация капсулярного полисахарида серотипа 8 посредством одноемкостного и комплексного способов конъюгации
Это пример показывает, что предварительно выбранный диапазон молекулярных масс капсулярных полисахаридов можно использовать для конъюгации либо одноемкостным, либо комплексным способом. Бактериальные клетки исходно производят более крупные полисахариды, и очистку полученного диапазона молекулярных масс можно контролировать с помощью рН и нагревания в процессе гидролиза по Примеру 1 (как показано в Таблице 3).
В этом примере выбирали восемь партий, где капсулярные полисахариды серотипа 8 имели молекулярные массы в диапазоне от примерно 80 кДа до примерно 120 кДа, и конъюгацию капсулярного полисахарида серотипа 8 осуществляли, используя для активации 1,1-карбонил-ди-(1,2,4-триазол), см. Таблицу 8. Молекулярные массы полученных конъюгатов были в диапазоне от 595 кДа до 1708 кДа. Число конъюгированных лизинов на CRM варьировало в диапазоне от высокого 13 до низкого 3. Содержание свободного сахара было в диапазоне от высокого (11%) до низкого (1%).
|
Пример 5: Оценка конъюгированного нативного и обработанного основанием капсулярного полисахарида серотипа 8 в модели бактериемии на мышах
Для конъюгатов капсулярного полисахарида оценивали важность O-ацетильных групп, присутствующих в нативном капсулярном полисахариде серотипа 8 до конъюгации, для индукции функциональных антительных ответов. Капсулярный полисахарид серотипа 8 де-O-ацетилировали в мягких щелочных условиях, и как ЯМР, так и ионная хроматография (IC) подтвердили отсутствие O-ацетилирования в капсулярном полисахариде серотипа 8 в de-O-Ac-CRM. Конъюгат СР8 de-O-Ac-CRM получали конъюгированием полисахарида de-O-Ac СР8 с CRM посредством PDPH химии, как описано в Примере 2.
Конъюгат капсулярного полисахарида серотипа 8 неожиданно показал отсутствие ацетильных групп, определяемых способом IC. Это можно объяснить отличиями в структуре сайтов O-ацетилирования по сравнению с другими капсулярными полисахаридами S.aureus, которые в свою очередь могут вызывать удаление или модификацию ацетильных групп в капсулярных полисахаридах серотипа 8 во время конъюгирования.
Модель бактериемии на мышах использовали для оценки эффективности нативного, в сравнении с обработанным основанием, капсулярного полисахарида серотипа 8, конъюгированного с CRM197. Группы самок мышей BALB/c (15/группа) вакцинировали на сроках 0, 3 и 6 недель, используя 1 мкг капсулярного полисахарида серотипа 8 de-O-Ac-CRM или 1 мкг капсулярного полисахарида серотипа 8 O-Ac-CRM. Вакцины готовили с 22 мкг AlPO4. Животным вводили S.aureus PFESA0003 и подсчитывали бактерии в крови три часа спустя. Данные показали статистически достоверное (р=0,0362) снижение бактериальных КОЕ, выделенных из крови животных, иммунизированных конъюгатом необработанного нативного капсулярного полисахарида серотипа 8, при оценке по t-тесту Стьюдента (Таблица 9). У животных, которых иммунизировали конъюгатом обработанного основанием капсулярного полисахарида серотипа 8, бактериальные КОЕ, выделенные из крови, были такими же, как в контрольной группе с физиологическим раствором.
|
Пример 6: Оценка конъюгированного нативного и обработанного основанием капсулярного полисахарида серотипа 8 в модели бактериемии на мышах
Конъюгаты капсулярного полисахарида серотипа 8 оценивали на их способность защищать мышей в модели пиелонефрита. Содержание бактерий в крови мышей, получавших внутрибрюшинным путем S.aureus, было значительно снижено при сравнении с контролями, которым вводили PBS.
Два исследования осуществляли для оценки эффективность конъюгата CP8-CRM197 в модели бактериемии на мышах, описанной выше, после введения S.aureus PFESA0268 (Тип 8). Первое исследование (Фиг.5) показало значительное снижение бактериемии (р=0,0308). Для этого исследования группы мышей Swiss Webster в возрасте 6-8 недель (n=30) были подвергнуты активной иммунизации подкожной инъекцией 1 мкг конъюгата капсулярного полисахарида серотипа 8 с CRM197 или физраствора, причем и то, и другое готовили со 100 мкг AlPO4, на сроках 0, 2 и 4 недель, после чего им вводили на сроке 6 недель внутривенным путем S.aureus PFESA0268 (Тип 8). Предварительные эксперименты по введению S.aureus PFESA0268 осуществляли для оптимизации дозы вводимого штамма для возраста мышей, достигнутого после трех вакцинаций. Статистическую оценку исследований выживаемости осуществляли анализом по Каплану-Мейеру.
Пример 7: Опсоническая активность сывороток от мышей, иммунизированных конъюгатами нативного и химически модифицированного капсулярного полисахарида серотипа 8
Отобранные мышиные сыворотки из исследования вакцинации (n=5) с высокими титрами капсулярного полисахарида серотипа 8 сравнивали по опсонической активности (ОРА), используя штамм PFESA0005. Результаты по ОРА (Таблица 10) показывают, что только конъюгаты, полученные конъюгацией нативного капсулярного полисахарида серотипа 8, вызывают у мышей опсонические антитела. Следует отметить, что конъюгат капсулярного полисахарида серотипа 8 de-OAc был иммуногенным у мышей, но вызванные им антитела не были опсоническими в этом анализе. Титры ОРА выражены как обратные разведения, при которых наблюдали 40%-ную гибель.
|
Пример 8: Гибель штаммов S.aureus антисыворотками конъюгата серотипа 8 можно ингибировать добавлением нативного капсулярного полисахарида серотипа 8
Для подтверждения специфичности гибели, опсонофагоцитарную реакцию осуществляли в присутствии нативного капсулярного полисахарида серотипа 8 или неродственного пневмококкового полисахарида (Pn 14 poly) пo существу, как описано выше.
Результаты (Таблица 11) показали, что присутствие нативного капсулярного полисахарида серотипа 8 в реакционной смеси ингибировало опсонофагоцитарную гибель S.aureus PFESA0286 (Тип 8). Эти результаты подтверждают, что опсонофагоцитарная гибель под воздействием иммунных сывороток опосредовано антителами, специфичными к капсуле.
|
ЗАКЛЮЧЕНИЕ
Все способы химической конъюгации давали капсулярный полисахарид серотипа 8, ковалентно связанный с белком носителем CRM197. He было значительный различий по свободному сахариду, соотношению капсулярный полисахарид серотипа 8: белок и выходам конъюгатов, получаемых этими способами.
Пример 9: Получение капсулярного полисахарида S.aureus серотипа 5
В этом примере описано получение различных диапазонов размера капсулярного полисахарида S.aureus серотипа 5. Структура повторяющихся единиц капсулярного полисахарида S.aureus серотипа 5 показана на Фиг.6. Описанные здесь способы являются эффективными в получении капсулярного полисахарида серотипа 5 с молекулярными массами в диапазоне от примерно 20 кДа до 800 кДа. Надлежащим выбором условий можно выделять и очищать высокомолекулярные капсулярные полисахариды серотипа 5 в диапазоне от 50 кДа до 800 кДа по молекулярной массе. Для применения в иммуногенных композициях капсулярный полисахарид серотипа 5 можно выделять и очищать в диапазоне от 70 кДа до 300 кДа по молекулярной массе, от 70 кДа до 150 кДа и во многих других желаемый диапазонах. Штамм PFESA0266 был выбран для получения капсулярного полисахарида серотипа 5 на основании характеристик роста и количества получаемой капсулы.
Для получения капсулярного полисахарида серотипа 5 штамм PFES А0266 выращивали в комплексной среде, состоящей главным образом из источника углерода (лактоза или сахароза), из гидролизованной соевой муки в качестве источника азота и следовых количеств металлов. Штамм выращивают в биореакторе в течение 2-5 суток.
Ферментацию штамма PFESA0266 осуществляли, как детально описано выше. Во время сбора оптическая плотность OD600 культуры составляла 7,38. Культуру автоклавировали в течение 1 часа и после охлаждения обрабатывали, как описано выше, для отделения клеток от вещества супернатанта. Получали приблизительно по 1 л отфильтрованного и концентрированного супернатанта и клеток.
Перед автоклавированием брали пробы для тестирования уровня стафилококкового энтеротоксина В (SEB) в культуре. В присутствии 0,05% полисорбата 80 концентрация SEB в ферментационной среде составляла 15-20 нг/мл. Предыдущие эксперименты показали, что автоклавирование культуры в течение 1 часа снижает уровень SEB до менее чем 0,1 нг/ мл, что ниже предела детектирования набором TECRA.
Подвергнутый диафильтрации фракционированный этанолом полисахарид наносили на колонку с Q-Сефарозой АЕС и элюировали линейным градиентом NaCl, как описано выше. Фракции анализировали на О-ацетилmyst группы и тестом двойной иммунодиффузии на присутствие полисахарида серотипа 5 и анализом фосфата на присутствие тейхоевой кислоты. Присутствие полисахарида серотипа 5 детектировали во фракциях 60-105 (Фиг.7А-Б). Для снижения загрязнения тейхоевой кислотой фракции 60-85 объединяли и всю оставшуюся тейхоевую кислоту окисляли метаперйодатом натрия, чтобы сделать возможным ее удаление 3К диафильтрацией против дистиллированной воды.
Очистку капсулярного полисахарида серотипа 5, используемого для получения конъюгатов, осуществляли двумя разными способами, которые основаны на том, что повышенная температура и низкий рН влияют на высвобождение капсул из клеток и снижают молекулярную массу полисахарида. Получившаяся молекулярная масса зависит от времени, температуры и рН стадии гидролиза.
Характеристику капсулярного полисахарида серотипа 5 осуществляли с помощью методик, указанных выше в Таблице 1.
Капсулярные полисахариды, полученные способами, описанными ниже, приводят к чистым полисахаридам с низкими уровнями загрязнения белками, нуклеиновыми кислотами, пептидогликанами и тейхоевой кислотой.
В первом способе после высвобождения капсулярного полисахарида из клетки и снижения молекулярной массы препарат обрабатывали ферментным коктейлем (например рибонуклеаза, дезоксирибонуклеаза, лизоцим и протеаза) для разрушения примесей. После инкубирования оставшиеся примеси осаждали добавлением этанола (конечная концентрация примерно 25%). После удаления остаточного этанола раствор, содержащий капсулярный полисахарид, наносили на анионообменную колонку (Q-Сефароза) и элюировали линейным солевым градиентом. Фракции, содержащие капсулярный полисахарид, объединяли и обрабатывали метаперйодатом натрия. Эта обработка приводила к окислительному гидролизу оставшейся примеси тейхоевой кислоты, но не влияла на капсулярный полисахарид серотипа 5. Реакционную смесь гасили добавлением этиленгликоля. Вещество концентрировали и подвергали диафильтрации против дистиллированной воды (dH2O) для удаления любых остаточных реагентов и побочных продуктов.
Второй способ использовали для получения капсулярного полисахарида без применения ферментов для разрушения различных примесей, происходящих из клеток. В этом способе после высвобождения капсулярного полисахарида из клетки и снижения молекулярной массы гидролизованный ферментационный бульон осветляли микрофильтрацией и затем ультрафильтрацией и диафильтрацией. Раствор обрабатывали активированным углем для удаления примесей. После обработки углем материал обрабатывали метаперйодатом натрия для окисления оставшейся тейхоевой кислоты и затем гасили пропиленгликолем. Вещество концентрировали и подвергали диафильтрации против дистиллированной H2O для удаления любых остаточных реагентов и побочных продуктов.
Препараты, полученные при использовании любого способа, приводили к чистым капсулярным полисахаридам с низкими уровнями загрязнения белками, нуклеиновыми кислотами и тейхоевой кислотой. Описанные способы можно использовать для получения конкретных диапазонов желаемых высокомолекулярных полисахаридов манипулированием условий гидролиза.
Примеры капсулярного полисахарида, получаемого описанными здесь способами, показаны ниже в Таблице 12. Партии очищенного капсулярного полисахарида серотипа 5 имели высокую чистоту, как свидетельствует отсутствие тейхоевой кислоты (ТА) и пептидогликанов и низкий уровень остаточного белка (см. Таблицы 12 и 13). Диапазон молекулярных масс простирался от 132,7 кДа до 800 кДа, и очищенные полисахариды были высоко O-ацетилированными, в диапазоне 90%-100%, и были на 100% N-ацетилированными. Выходы очистки капсулярного полисахарида серотипа 5 составляли от 39% до 63%, и размер очищенного полисахарида серотипа 5 варьировал от 35 кДа до 65 кДа (см. Таблицу 12). Уровень загрязнения тейхоевой кислотой (ТА) был приемлемым, и уровни остаточных белков и нуклеиновой кислоты были также в приемлемом диапазоне. ЯМР-спектры полисахарида серотипа 5 были идентичными описанным в литературе.
|
|
Выбор молекулярной массы капсулярных полисахаридов. Кинетический анализ продемонстрировал, что описанными здесь способами можно получать широкий диапазон молекулярных масс капсулярных полисахаридов. Исходно бактериальные клетки продуцируют более крупные полисахариды, и желаемый диапазон молекулярных масс выбирают и затем очищают манипулированием рН и условий нагревания на стадиях нагревания и гидролиза.
Тепловая обработка ферментационного бульона S.aureus представляет собой стадию процесса между ферментацией и извлечением капсулярного полисахарида. На этой стадии процесса нагревание используют для обработки бульона при установленном рН в течение определенного времени. Цели тепловой обработки при низком рН состоят в умерщвлении клеток, инактивации энтеротоксинов, высвобождении связанного с клетками полисахарида и снижении молекулярной массы до желаемого размера. Среди этих целей снижение молекулярной массы было самым медленным в смысле времени обработки, требуемой на этой стадии. Поэтому за указанное время обработки неизбежно должны быть достигнуты другие цели.
Тепловая обработка. Определяли условия рН и температуры для выбора различных диапазонов молекулярной массы капсулярных полисахаридов. Для этих исследований использовали ферментатор BioIafitte15L. Ферментационный бульон перемещали в ферментатор перистальтическим насосом. При использовании скорости перемешивания примерно 200 об/мин доводили рН бульона концентрированной серной кислотой. Затем температуру бульона повышали до заданной величины. Время тепловой обработки засекали, как только температура достигала заданного уровня. По достижении желаемого времени обработки бульон охлаждали до комнатной температуры. Во время этого процесса брали пробы для определения концентрации полисахарида и молекулярной массы системами HPLC и SEC-MALLS, соответственно. Данные по молекулярной массе (MW) использовали в кинетическом анализе. Профили молекулярной массы определяли в зависимости от времени при рН 3,5, 4,0 и 5,0. См. Фиг.8А.
Кинетику мягкого кислотного гидролиза полисахаридов определяли с помощью очищенного капсулярного полисахарида серотипа 8, получаемого этим способом. Раствор очищенного полисахарида доводили серной кислотой до рН, желаемого для эксперимента. Примерно по 1,5 мл раствора переносили в центрифужные пробирки объемом 15 мл. Пробирки помещали на масляную баню, снабженную прецизионной системой температурного контроля. Пробирки извлекали через определенные интервалы времени и гасили в ведре со льдом. В конце эксперимента аликвоту 1 М Трис-буфера (рН 7,5) добавляли к пробе для доведения рН обратно до примерно 7. Пробы анализировали системой SEC-MALLS. Данные по молекулярной массе использовали в кинетическом анализе. Влияние температуры на профиль молекулярных масс СР5 при рН 4,5 определяли в зависимости от времени (см. Фиг.8Б).
Результаты
Как показано на Фиг.8А, более низкий рН был более эффективным в снижении молекулярной массы полисахарида. В этом примере диапазон молекулярных масс между примерно 300 кДа и примерно 600 кДа можно получать, используя рН, равное 5, при 95°С в течение промежутка времени от 15 минут до 120 минут (см. Фиг.8А). Аналогично, выбирая рН 4,5 при 95°С в течение промежутка времени от 15 минут до 120 минут, можно получать молекулярные массы полисахарида в диапазоне между 200 кДа и 400 кДа. Кроме того, выбирая рН 4,0 при 95°С в течение промежутка времени от 15 минут до 120 минут, можно получать молекулярные массы полисахарида в диапазоне между 120 кДа и 300 кДа.
Как показано на Фиг.8Б, чем выше температура, тем выше скорость гидролиза и более широкий диапазон молекулярных масс полисахарида получают с течением времени. Другими словами, применение более низкой температуры, 55°С против 95°С, при том же рН дает более узкий диапазон молекулярных масс полисахарида.
Более того, Фиг.4 демонстрирует корреляцию между молекулярной массой очищенного капсулярного полисахарида серотипа 5 и временем обработки при мягком кислотном (рН 4,5 при 95°С) гидролизе. Очищенный полисахарид является конечным продуктом, получаемым в процессе извлечения, детализированном выше. Как также показано на Фиг.4, увеличение времени тепловой обработки штамма S.aureus PFESA0266 при рН 4,5 приводило к капсулярному полисахариду серотипа 8 с меньшей молекулярной массой, тогда как более короткие периоды времени тепловой обработки при рН 4,5 приводили капсулярному полисахариду серотипа 5 с более высокой молекулярной массой. Размер капсулярных полисахаридов серотипа 5 находился в диапазоне от примерно 90 кДа до примерно 220 кДа в зависимости от длительности времени тепловой обработки при рН 4,5. Корреляция между временем тепловой обработки при низком рН и размером очищенных капсулярных полисахаридов серотипа 5, как показано на Фиг.4, позволяет оценивать время обработки, требуемое для получения очищенного полисахарида с конкретным диапазоном молекулярных масс.
Как продемонстрировано выше, может быть получен, высвобожден и очищен полный диапазон молекулярных масс капсулярных полисахаридов серотипа 5 от 20 кДа до более чем 500 кДа. Описанные способы можно использовать для получения конкретного диапазона желаемых высокомолекулярных капсулярных полисахаридов, как показано в Таблице 14. Относительно узкий получаемый диапазон молекулярных масс полисахарида, где пик молекулярных масс находится в диапазоне от 63 кДа до 142 кДа, является хорошо охарактеризованным диапазоном молекулярных масс, который можно получать описанными здесь способами. Особенно предпочтительный диапазон высокомолекулярных полисахаридов, варьирующий от 70 кДа до 300 кДа или от 70 кДа до 150 кДа, является полезным в получении иммуногенных композиций посредством конъюгирования капсулярного полисахарида с молекулой или белком носителем. Условия, использованные для получения капсулярного полисахарида СР5, имеющего диапазон молекулярных масс от примерно 100 кДа до 140 кДа, являются нижеследующими: 95°С, рН 4,5 в течение 135 минут. Другие комбинации рН, температуры и времени будут, однако, также генерировать молекулы СР5 с диапазоном молекулярных масс от примерно 100 кДа до 140 кДа.
|
Пример 10: Конъюгация капсулярных полисахаридов серотипа 5 с CRM197
Этот пример описывает способы и анализы для характеризации, используемые в получении конъюгатов капсулярного полисахарида S.aureus серотипа 5 с CRM197. Разные химические способы конъюгирования были разработаны для конъюгации капсулярного полисахарида S.aureus серотипа 5 с этим белком носителем. Например, конъюгирование с помощью PDPH (3-(2-пиридилдитио)-пропионилгидразид) имеет результатом ковалентную тиоэфирную связь между СР и белком носителем, тогда как конъюгирование с помощью CDT (1,1-карбоил-ди-1,2,4-триазол) приводит к одноуглеродному или нуль-углеродному линкеру между капсулярным полисахаридом и белком носителем.
Конъюгация капсулярного полисахарида серотипа 5 с CRM197 посредством PDPH конъюгационной химии
Конъюгационная химия с помощью PDPH является многостадийным процессом и включает активацию полисахарида, удаление тиольной защитной группы, очистку промежуточного активированного полисахарида, активацию и очистку белка CRM197 и конъюгацию активированных компонентов с последующей очисткой. После введения линкера, содержащего тиольную группу, в полисахарид и галогеноацетильной группы в белок носитель CRM197 капсулярный полисахарид S.aureus серотипа 5 связывали с белком носителем через тиоэфирную связь. Бромацетильные группы вводили в белок CRM197 взаимодействием аминных групп с N-гидроксисукцимидным эфиром бромуксусной кислоты. Для получения тиолированного полисахарида активированные карбодиимидом карбоксилатные группы N-ацетилманнозаминуроновой кислоты в полисахариде подвергали сочетанию с гидразидной группой сульфгидрил-реактивного гидразидного гетеробифункционального линкера 3-(2-пиридилдитио)-пропионилгидразида (PDPH). Тиолы PDPH-тиолированного полисахарида, полученного восстановлением с помощью DTT и очищенного посредством SEC на колонке с Сефадексом G25, подвергали взаимодействию с бромацетильными группами активированного белка, что имело результатом ковалентную тиоэфирную связь, образованную замещением брома, между полисахаридом и белком носителем. Непрореагировавшие бромацетильные группы "прикрывали" гидрохлоридом цистеамина (гидрохлоридом 2-аминоэтантиола). Затем реакционную смесь концентрировали и подвергали диафильтрации. Оставшееся несконъюгированные бромацетильные группы «прикрывали» гидрохлоридом цистеамина для обеспечения отсутствия реактивных бромацетильных групп, оставшихся после конъюгации. После замещения брома это давало ковалентную связь между тиольным концом цистеамина и ацетильной группой на лизиновом остатке.
1. Тиолирование капсулярного полисахарида S.aureus cepomuna 5 с помощью PDPH. Полисахарид сначала активировали тиолированием с помощью PDPH, для капсулярного полисахарида серотипа 5 полисахарид смешивали со свежеприготовленным маточным раствором PDPH (250 мг/мл в DMSO), маточным раствором EDAC (90 мг/мл в дистиллированной воде) и маточным раствором буфера MES (0,5 М, рН 4,85) с получением конечного раствора 0,1 М MES и 2 и 4 мг полисахарида/мл при поддержании массового соотношения полисахарид: PDPH:EDAC равным 1:5:3. Эту смесь инкубировали в течение 1 часа при комнатной температуре и затем диализировали против 1000-кратного объема дистиллированной Н2О четыре раза, используя диализное устройство 3500 М WCO при температуре между 4°С и 8°С для удаления непрореагировавшего PDPH. PDPH-связанный полисахарид обрабатывали 0,2 М DTT и инкубировали при комнатной температуре в течение 3 часов или в течение ночи при температуре между 4°С и 8°С. Избыток DTT, a также побочные продукты этого взаимодействия отделяли от активированного сахарида с помощью SEC, используя смолу Сефадекс G25 и дистиллированную воду в качестве подвижной фазы. Фракции анализировали с помощью DTDP на тиольные группы и тиол-положительные фракции, которые элюировались около пустого объема колонки, объединяли. Пул фракций анализировали посредством РАНВАН и анализов на O-ацетил для определения степени активации, которую выражали как молярный процент повторяющихся единиц, содержащих тиольную группу (молярная концентрация тиолов/молярная концентрация повторяющихся единиц). Активированный полисахарид лиофилизировали и хранили при -25°С до возникновения необходимости в конъюгации.
Результаты по воспроизводимости тиолирования полисахарида серотипа 5 с помощью PDPH показаны в Таблице 15. Степень активации полисахарида серотипа 5 находилась в диапазоне от 11% до 19%, что соответствует диапазону от приблизительно одной присоединенной линкерной молекуле на десять повторяющихся единиц капсулярного полисахарида до одной молекулы линкера на пять повторяющихся единиц.
|
2. Активация белка носителя. Белок носитель активировали бромацетилированием отдельно. CRM197 разбавляли до 5 мг/мл 10 мМ забуференным фосфатом 0,9%-ным NaCl с рН 7 (PBS) и затем доводили 1 М маточным раствором до 0,1 М NaHCO3 при рН 7,0. Добавляли N-гидроксисукцинимидный эфир бромуксусной кислоты (BAANS) при соотношении CRM197:BAANS 1:0,25 (масс./масс.), используя маточный раствор BAANS в DMSO 20 мг/мл. Эту реакционную смесь инкубировали при температуре между 4°С и 8°С в течение 1 часа, затем очищали посредством SEC на Сефадексе G-25. Очищенный активированный CRM197 анализировали методом Лоури для определения концентрации белка и затем разбавляли PBS до 5 мг/мл. Сахарозу в качестве криопротектора добавляли до 5% масс./об. и активированный белок замораживали и хранили при -25°С до возникновения необходимостью для конъюгации.
Бромацетилирование лизиновых остатков CRM197 было очень устойчивым и приводило к активации 19-25 лизинов из 39 доступных лизинов (см. Таблицу 16). Это взаимодействие давало высокие выходы активированного белка.
|
3. Реакция сочетания. Сразу по получении активированного капсулярного полисахарида и активированного белка-носителя их объединяли в реакционной смеси для конъюгации. Лиофилизированный и тиолированный полисахарид растворяли в 0,16 М борате при рН 8,95, смешивали с размороженным бромацетилированным CRM197 и дистиллированной водой с получением конечного раствора 0,1 М бората и 2 мг/мл капсулярного полисахарида серотипа 5 при соотношении CRM197: полисахарид 1:1 масс./масс. Эту смесь инкубировали при комнатной температуре от 16 до 24 часов. Непрореагировавшие бромацетильные группы на белке «прикрывали» добавлением гидрохлорида цистеамина в соотношении CRM197: циетеамин 1:2 (масс./масс.) с помощью маточного раствора цистеамина 135 мг/мл в 0,1 М борате при рН 8,95 и инкубировали в течение 4 часов при комнатной температуре. Конъюгат капсулярного полисахарида с CRM197 (конъюгат) очищали 50-кратной диафильтрацией против 0,9%-ного NaCl, используя полиэфирсульфоновый ультрафильтр 100К.
Результаты исследований воспроизводимости тиолирования капсулярного полисахарида серотипа 5 с помощью PDPH продемонстрировали, что степень активации полисахарида находилась в диапазоне от 11% до 19%, что соответствует диапазону от приблизительно одной присоединенной молекуле линкера на десять полисахаридных повторяющихся единиц до одной молекулы линкера на пять повторяющихся единиц.
Конъюгация капсулярного полисахарида серотипа 5 с CRM197 посредством CDT конъюгационной химии
CDT обеспечивает одностадийный способ конъюгации, при котором полисахарид активируют в безводной среде (DMSO) с образованием триазолкарбаматных группировок с доступными гидроксилами и ацилимидазольных или ацилтриазольных группировок с карбоновыми кислотами. Добавление белка носителя (в DMSO) приводит к нуклеофильному замещению триазола лизином и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот). Реакционный раствор разбавляют в 10 раз в водном растворе для подготовки к очистке фильтрацией в тангенциальном потоке.
Способ химической конъюгации с помощью CDT давал капсулярный полисахарид серотипа 5, ковалентно связанный с белком носителем, о чем свидетельствует присутствие сахарида и белка во фракциях при гель-фильтрации и аминокислотный анализ конъюгата, «прикрытого» гликольальдегидом или гидрохлоридом цистеамина.
Сводка по результатам получения нескольких партий конъюгатов, полученных с помощью как PDPH, так и CDT химии, для диапазона размеров капсулярного полисахарида серотипа 5 от 20 кДа до 40 кДа показана в Таблице 17 ниже. Значительных различий в свободном капсулярном полисахариде, соотношении полисахарид-белок и выходах конъюгатов, получаемых этими способами конъюгации, не было. Антигенность конъюгированного капсулярного полисахарида серотипа 5 не была изменена конъюгацией, как показывает идентичность линий преципитации конъюгатов и нативного полисахарида.
|
Как показано выше, описанные здесь способы можно использовать для получения конкретного диапазона желаемых высокомолекулярных капсулярных полисахаридов. Авторы хотели получить конъюгаты из предварительно выбранного диапазона высокомолекулярных капсулярных полисахаридов серотипа 5, которые можно фильтровать и очищать для применения в иммуногенных композициях. Таблица 18 суммирует анализ конъюгатов капсулярного полисахарида серотипа 5, где капсулярный полисахарид серотипа 5 по молекулярной массе находился в диапазоне от примерно 92 кДа до 119 кДа, и активирован триазолом (CDT). Молекулярные массы полученных конъюгатов находились в диапазоне от 1533 кДа до 2656 кДа. Число конъюгированных лизинов на CRM197 находилось в диапазоне от высокого - 22 до низкого - 15. Содержание свободного капсулярного полисахарида варьировало от высокого -18% до низкого -11%.
|
Оба способа химической конъюгации дают капсулярный полисахарид серотипа 5, ковалентно связанный с белком носителем. Значительных различий по свободному капсулярному полисахариду, соотношению капсулярного полисахарида серотипа 5 и белка и выходам конъюгатов, получаемых этими двумя способами, не было.
Пример 11: Способ CDT в одной емкости в сравнении с комплексным способом
Как описано выше, способы получения иммуногенных конъюгатов по этому изобретению включают ковалентную конъюгацию капсулярных полисахаридов с белками носителями с использованием конъюгационной химии, включающей CDI (1,1-карбонилдиимидазол), CDT (1,1-карбоил-ди-1,2,4-триазол) или PDPH (гидразид 3-(2-пиридилдитио)-пропионила). Использование CDI/CDT имеет результатом одноуглеродный или нуль-углеродный линкер между капсулярным полисахаридом и белком носителем, в то время как использование PDPH имеет результатом ковалентную тиоэфирную связь между капсулярным полисахаридом и белком носителем.
Способ на основе PDPH представлял собой многостадийный процесс, который включал активацию полисахарида, удаление тиольной защитной группы на полисахариде, очистку промежуточного активированного полисахарида, активацию и очистку белка носителя и конъюгирование активированных компонентов с последующей очисткой. В этом способе капсулярные полисахариды S.aureus серотипа 5 приводили во взаимодействие с PDPH и карбодиимидом в органическом растворителе, таком как DMSO, с получением полисахаридов, связанных с PDPH. Полисахариды, связанные с PDPH, приводили во взаимодействие с восстановителем с получением активированных полисахаридов, которые затем очищали. Белки носители приводили во взаимодействие с бромуксусной кислотой в органическом растворителе с получением активированных белков носителей, которые затем очищали. Очищенные активированные полисахариды серотипа 5 затем приводили во взаимодействие с очищенными активированными белками носителями с получением конъюгатов полисахарида серотипа 5 с белком носителем.
Напротив, способы на основе CDT представляли собой одностадийные процессы конъюгации, в которых капсулярный полисахарид активировали в безводной среде (то есть DMSO) с образованием триазолкарбаматных группировок с доступными гидроксилами и ацилимидазольных или ацилтриазольных группировок с карбоновыми кислотами. Добавление белка носителя (в DMSO) приводило к нуклеофильному замещению имидазола или триазола лизином и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот), тем самым обеспечивая возможность осуществления конъюгации «в одной емкости». Соответственно, были разработаны два способа на основе CDT: более сложный способ и более простой способ, осуществляемый в одной емкости. В более сложном способе капсулярный полисахарид S.aureus серотипа 5 компаундировали с имидазолом или триазолом и затем подвергали взаимодействию с CDT в органическом растворителе (таком как DMSO) и примерно 0,2% масс./об. воды с получением активированных полисахаридов серотипа 5. Активированные полисахариды серотипа 5 очищали и затем приводили во взаимодействие с белками носителями в органическом растворителе с получением конъюгатов полисахарида серотипа 5 с белком носителем. Способ, осуществляемый в одной емкости, был таким же, как сложный способ, за исключением того, что активированные полисахариды серотипа 5 не очищали перед взаимодействием с белками носителями.
Комплексный способ с CDT
Активация капсулярного полисахарида серотипа 5. Капсулярный полисахарид серотипа 5 смешивали с 10 г триазола на 1 г полисахарида серотипа 5 и лиофилизировали. Получившуюся массу растворяли в DMSO в концентрации 2,0 мг капсулярного полисахарида серотипа 5 на 1 мл. Определяли содержание воды и доводили до 0,2%. Добавляли свежеприготовленный маточный раствор CDT в концентрации 100 мг/мл в DMSO для достижения 20-кратного молярного избытка количества CDT по сравнению с количеством СР5. Альтернативно, количество добавленного CDT можно корректировать для достижения более высокой или более низкой степени активации. Выдерживали 30 минут при 23°С.
Очистка активированного капсулярного полисахарида серотипа 5. Раствор активированного полисахарида серотипа 5 (АСР5) вливали в 25 объемов воды для разрушения избытка CDT. Концентрировали до исходного объема на PES-мембране на 10 кДа при приблизительно 1 мг/см2 и подвергали диафильтрации против воды при по меньшей мере 10 объемах. Эту стадию завершали менее чем за 4 часа. Подвергнутое диафильтрации вещество смешивали с 10 г триазола на 1 г исходного полисахарида серотипа 5 и лиофилизировали.
Получение лиофилизированного CRM. CRM подвергали диафильтрации против раствора 0,4% NaCl/5% сахарозы при постоянном объеме на PES-мембране на 10 кДа при по меньшей мере 10 объемах. Определяли концентрацию белка и добавляли количество буфера для диафильтрации, достаточное для доведения концентрации белка до 5,0 г/л, таким образом доводя массовое соотношение NaCl/CRM до 0,8. CRM лиофилизировали.
Конъюгация. Активированный подвергнутый диафильтрации капсулярный полисахарид серотипа 5 растворяли в DMSO в концентрации 1 мг/мл. Добавляли 100 мМ раствор бората для достижения 2% об./об.
CRM ресуспендировали в концентрации 2 мг/мл и, когда растворение было полным, объединяли с раствором АСР5. Оставляли для взаимодействия при 4°С в течение 20 часов.
Реакционную среду конъюгирования вливали в 24 объема 5 мМ бората с рН 9,0 и оставляли перемешиваться при комнатной температуре в течение 1 часа. Затем доводили до рН 7,5 с помощью 0,5 М фосфатного буфера при рН 6,5. Фильтровали через 5-микронный фильтр и концентрировали до исходного объема на PES-мембране на 300 кДа при нагрузке примерно 1 мг/см2 и подвергали диафильтрации против по меньшей мере 10 объемов воды. Получившийся концентрат фильтровали через 0,22-микронный фильтр и хранили при 2°С-8°С.
Способ с CDT в одной емкости
Матричный обмен CRM197. CRM197 подвергали диафильтрации для обмена из матричной массы примерно 10 мМ фосфат/80 мМ NaCl/15% сахароза при рН 7 на 5 мМ имидазол/0,72% NaCl/15 мМ октил-β-D-глюкопиранозид при рН 7. Этот обмен обеспечивал удаление фосфата и сахарозы, которые являются вредными для конъюгации, и определял содержание хлорида натрия, переносимого в конъюгацию. Октил-β-D-глюкопиранозид добавляют для предотвращения образования частиц после стерильного фильтрования.
Матрицу CRM197 заменяли фильтрованием в тангенциальном потоке против 5 мМ имидазол/0,72%/15 мМ октил-β-D-глюкопиранозид при рН 7 через 10 диализных объемов с использованием 10К MWCO PES мембран с концентрацией удерживания примерно 4 мг/мл. Типичная нагрузка на мембрану была 2 г/фут2 (21,5 г/м2), целевая конечная концентрация CRM197 в матрице составляла 6 мг/мл. CRM197 хранили при 2°С-8°С.
Активация/Конъюгирование. Способ активации/конъюгирования для капсулярного полисахарида S.aureus серотипа 5 состоял из следующих стадий: (1) компаундирование полисахарида; (2) замораживание на оболочке и лиофилизация CRM197 и компаундированного полисахарида; (3) растворение лиофилизированного полисахарида и CRM197; (4) активация полисахарида; (5) конъюгирование активированного полисахарида с CRM197; и (6) очистка конъюгата (разведение, диафильтрация, стерильное фильтрование).
Полисахарид компаундировали с 10 граммами эксципиента 1,2,4-триазола на 1 грамм полисахарида. Эксципиент добавляли в виде порошка к полисахариду, причем раствор получали менее чем через 15 минут перемешивания при температуре окружающей среды.
Компаундированный полисахарид и CRM197 по отдельности замораживали на оболочке с помощью этанольной бани при -75°С. Объем на бутыль емкостью 1 л составлял приблизительно 500 мл.
Для растворения полисахарида DMSO добавляли в индивидуальные бутыли для лиофилизации полисахарида с получением суспензии и затем переносили для нагревания в сосуд для активации/конъюгирования. Добавляли DMSO с получением концентрации 2 г/л. Прозрачный раствор получали после смешивания в течение 5-10 минут.
Для растворения CRM197 добавляли DMSO в индивидуальные бутыли для лиофилизации, содержащим CRM197, с получением суспензии и затем переносили во второй сосуд для перемешивания. DMSO добавляли с получением концентрации 2 г/л. Прозрачный раствор в типичных случаях получали менее чем за 15 минут.
Из раствора полисахарида в DMSO брали пробы для анализа по Карлу Фишеру для определения содержания влаги. CDT готовили в виде раствора 100 мг/мл в DMSO и добавляли с примерно 5-кратным молярным избытком по отношению к полисахариду типа 5 (в комплексном способе использовали 20 молярных эквивалентов CDT, тогда как в одноемкостном способе использовали 5 молярных эквивалентов CDT:CP5). Непрерывное добавление раствора CDT осуществляли в течение примерно 5 минут при 23°С±2°С при перемешивании. Реакции давали продолжаться минимум 30 минут при 23°С±2°С.Из реакционной смеси брали пробы для определения уровня активация (УФ при 220/205 нм) и затем добавляли 100 мМ борат натрия при рН 9 с получением 1,5%-ного водного раствора. Этот реакционный раствор затем перемешивали минимум 30 минут при 23°С±2°С.
Для конъюгации активированного полисахарида с CRM197 добавляли DMSO до намеченной концентрации 0,55 мг/мл в реакционной среде. Затем CRM197, растворенный в DMSO, добавляли к раствору активированного полисахарида при перемешивании. Эту реакционную смесь перемешивали минимум 16 часов при 23°С±2°С.
Реакционный раствор разбавляли в 10 раз 5 мМ тетраборатом натрия при рН 8,6 с получением конечного разведенного рН 9±0,2. Раствор перемешивали при 23°С±2°С в течение минимум 4 часов. Разбавленный раствор пропускали через 5-мкм фильтр и концентрировали до намеченной концентрации удерживания 2 г/л. Фильтрование в тангенциальном потоке осуществляли с помощью мембран из регенерированной целлюлозы на 300 кДа посредством 20 диализных объемов с 5 мМ сукцинатом, рН 7. Типичная нагрузка на мембрану была 1 г/фут2 (10,75 г/м2). Очищенный конъюгат пропускали через 0,22-микронный фильтр и хранили при 2°С-8°С.
Пример 12: Конъюгация капсулярного полисахарида серотипа 5 посредством одноемкостного и комплексного способов конъюгации
Это пример показывает, что предварительно выбранный диапазон молекулярных масс капсулярных полисахаридов можно использовать для конъюгации либо одноемкостным, либо комплексным способом. Бактериальные клетки исходно производят более крупные полисахариды, и очистку полученного диапазона молекулярных масс можно контролировать с помощью рН и нагревания в процессе гидролиза по Примеру 9. В этом примере выбирали восемь партий, где капсулярные полисахариды серотипа 5 имели молекулярные массы в диапазоне от примерно 90 кДа до примерно 140 кДа, и конъюгацию осуществляли, используя активацию триазолом (CDT) либо одноемкостным, либо комплексным способами, описанными выше, см. Таблицу 19. Молекулярные массы полученных конъюгатов варьировали от 1125 кДа до 2656 кДа. Число конъюгированных лизинов на CRM варьировало в диапазоне от высокого - 22 до низкого - 15. Содержание свободного сахара было в диапазоне от высокого - 23% до низкого - 11%.

Пример 13: Конъюгаты капсулярного полисахарида серотипа 5 устойчиво обеспечивают защиту в модели пиелонефрита у мышей
Конъюгаты капсулярного полисахарида серотипа 5 оценивали по их способности защищать мышей в модели пиелонефрита. Содержание бактерий в крови мышей, получавших внутрибрюшинным путем S.aureus, было значительно снижено при сравнении с контролями, получавшими PBS.
Все шесть отдельных исследований показали значительное снижение КОЕ/мл в почках иммунизированных животных (Фиг.9). Когда эти исследования объединили для мета-анализа, общая значимость для исследований в целом повысилась до ниже 0,0001. Эти данные показали устойчивое снижение колонизации почек после активных вакцинаций конъюгатом капсулярного полисахарида.
Пример 14: Конъюгаты капсулярного полисахарида серотипа 5, полученные разными способами химической конъюгации, защищают мышей против экспериментальных инфекций
Исследования активной иммунизации в модели пиелонефрита на мышах осуществляли с конъюгатами капсулярного полисахарида серотипа 5, полученными посредством либо PDPH, либо CDT химии. Эти способы конъюгации капсулярных полисахаридов с CRM197 раскрыты выше. Результаты показали, что оба конъюгата снижают колонизацию у мышей при сравнении с ложно иммунизированными животными (Таблица 20).
|
|
Пример 15: Активная иммунизация конъюгатом капсулярного полисахарида серотипа 5 защищает крыс в модели эндокардита у крыс
Осуществляли четыре исследования с PDPH-конъюгатом CP5-CRM197. Конъюгаты капсулярного полисахарида серотипа 5 значительно снижали количество выделенных КОЕ после заражения S.aureus PFESA0266 как в сердце, так и в почках в 2 из 3 экспериментов (Таблица 21). В третьем исследовании геометрический средний титр (GMT) анти-СР5 был наименьшим из полученных в трех экспериментах, но только слегка ниже, чем в предыдущем эксперименте.
|
Пример 16: Усиленная иммуногенность вакцин, представляющих собой конъюгат высокомолекулярного СР5, у мышей при сравнении с вакцинами, представляющими собой конъюгат низкомолекулярного СР5
Проводили исследование в модели мышиного пиелонефрита для оценки иммуногенности и эффективности препаратов разных конъюгатов СР5. Тестировали два препарата. Первый препарат состоял из высокомолекулярного (HMW) СР5 (примерно 300 кДа), конъюгированного с CRM197. Второй препарат содержал низкомолекулярный (LMW) СР5 (примерно 25 кДа), конъюгированный с CRM197. Для высокомолекулярной вакцины тестировали три уровня доз (1, 0,1 и 0,01 мкг). Низкомолекулярную вакцину тестировали в дозе 1 мкг. Группа отрицательного контроля также включала вакцину, состоящую из конъюгата полисахарида, полученного из Streptococcus pneumoniae, конъюгированного с CRM197 (РР5). Полисахариды готовили с 22 мкг AlPO4 на сроках 0, 3 и 6 недель и заражение S.aureus PFESA0266 проводили на сроке 8 недель. Через 48 часов после заражения извлекали почки и подсчитывали бактериальные колонии. Обе вакцины эффективно вызывали иммунный ответ и снижали КОЕ S.aureus PFESA0266 в почках мышей, вакцинированных группами по 1 мкг как высокомолекулярной, так и низкомолекулярной вакцин. Это зависело от дозировки, как продемонстрировала сниженная эффективность при сниженных дозировках вакцины (Фиг.10). Подсчет КОЕ был недостаточно чувствительным для детектирования различий по эффективности между высокомолекулярными и низкомолекулярными вакцинами. Поэтому сыворотки из мышей были тестированы анализом ОРА (опсонофагоцитоза). Титры в анализе опсонофагоцитоза определяли как разведение сыворотки, требуемое для умеровления 40% S.aureus штамма PFESA0266 в анализе ОРА. Улучшенные ОРА титры были отмечены для высокомолекулярной вакцины по сравнению с низкомолекулярным препаратом (Фиг.11).
Пример 17: Конъюгаты капсулярного полисахарида, содержащие высокомолекулярные полисахариды, показывают усиленную иммуногенность при сравнении с конъюгатами, содержащими низкомолекулярные полисахариды
Исследования на приматах, не представляющих собой людей (NHP), осуществляли для оценки иммуногенности препаратов разных капсулярных конъюгатов. Два препарата тестировали в двух разных уровнях дозировки (2 и 20 мкг). Первый препарат содержал высокомолекулярный (HMW) полисахарид (примерно 130 кДа), конъюгированный с CRM197. Второй препарат содержал низкомолекулярный (HMW) полисахарид (примерно 25 кДа), конъюгированный с CRM197. Группы по пять приматов вакцинировали одной дозой вакцины и иммунные титры отслеживали перед вакцинацией и через две недели после вакцинации. ОРА титры определяли как разведение сыворотки, требуемое для умерщвления 40% S.aureus штамма PFESA0266 в ОРА анализе. Титры антител также отслеживали твердофазным иммуноферментным анализом (ELISA). Усиленную активность наблюдали с высокомолекулярной вакциной по сравнению с низкомолекулярным препаратом (Таблица 22), о чем свидетельствует десятикратное повышение титров антител для высокомолекулярной вакцины по сравнению с низкомолекулярной вакциной. Доля ОРА респондеров для NHP, которые получали высокомолекулярную вакцину, также была выше (80% по сравнению с 40%).
|
Пример 18: O-Ацетилирование полисахарида является важным для индукция защитных антительных ответов на конъюгат капсулярного полисахарида серотипа 5
Для оценки важности O-ацетилирования капсулярного полисахарида серотипа 5, нативный капсулярный полисахарид де-O-ацетилировали (dOAc) и конъюгировали с CRM197 (dOAc-CRM197), используя PDPH химическую конъюгацию, как обсуждено выше. Эффективность конъюгата dOAcCP-CRM197 сравнивали с CP5-CRM197 в модели пиелонефрита у мышей.
Иммунизация конъюгатами, лишенными O-ацетильных групп (dOAc СР5-CRM), не могла снижать количество бактериальных КОЕ в почках. Эти данные (Таблица 23) показывают, что O-ацетилирование является важным для образования функциональных антител против СР5.
|
Пример 19: Подтверждение важности O-ацетилирования как функционального эпитопа капсулярного полисахарида серотипа 5 посредством ОРА при использовании моноклональных антител с известными специфичностями
Моноклональные антитела против капсулярного полисахарида серотипа 5 со специфичностями ОАс+(СР5-7-1), ОАс+/-(СР5-5-1) и ОАс-(СР5-6-1), оценивали в анализе опсонофагоцитарной активности по умертщлению штамма PFESA0266, относящегося к типу 5 (Таблица 24). Моноклональные антитела против капсулярного полисахарида серотипа 8 (СР8-3-1, специфичны к СР8 ОАс+) использовали как отрицательный контроль.
ОАс-специфичные анти-СР5 mAb СР5-7-1 опосредовали умерщвление S.aureus PFESA0266 (Таблица 24). Также опосредовало умерщвление штамма PFESA0266 моноклональное антитело СР5-5-1, которое распознает эпитопы, общие для СР5 ОАс+ и СР5 ОАс-. Моноклинальное антитело, специфичное к эпитопам, присутствующим на капсулярном Оас-полисахариде серотипа 5, не опосредовало умерщвление штамма PFESA0266. Эти результаты показывают, что O-ацетильные эпитопы на капсулярном полисахариде серотипа 5 необходимы для функциональной активности антител, специфичных к серотипу 5.
Антитела должны быть функциональными при измерении по умерщвлению бактерий в модели эффективности на животном или в анализе опсонофагоцитарного умерщвления, которые демонстрируют, что антитела убивают бактерии. Функциональное умерщвление может не быть демонстрируемым при использовании анализа, который отслеживает только генерирование антител, что не показывает важности O-ацетилирования для эффективности.
|
Пример 20: Усиление иммуногенности наблюдается у конъюгатов СР5, состоящих из высокомолекулярных полисахаридов, при сравнении с низкомолекулярными полисахаридами у приматов, не представляющих собой человека (NHP)
Исследования на приматах, не представляющих собой человека (NHP), осуществляли для оценки иммуногенности препаратов разных капсулярных конъюгатов. Два препарата тестировали при двух разных уровнях дозировки (2 и 20 мкг). Первый препарат содержал высокомолекулярный (HMW) полисахарид (примерно 130 кДа), конъюгированный с CRM197. Второй препарат содержал низкомолекулярный (LMW) полисахарид (примерно 25 кДа), конъюгированный с CRM197. Группы по пять приматов вакцинировали одной дозой вакцины, и иммунные титры отслеживали перед вакцинацией и две недели после вакцинации. ОРА титры определяли как разведение сыворотки, требуемое для умерщвления 40% S.aureus штамма PFESA0266 в ОРА анализе. Титры антител также отслеживали твердофазным иммуноферментным анализом (ELISA). Усиленную активность наблюдали для HMW вакцины по сравнению с LMW препаратом (Таблица 25). Имело место от трехкратного до десятикратного повышение титров антител для HMW вакцины по сравнению с LMW вакциной. Доля ОРА респондеров для NHP, которые получали HMW вакцину, также была выше (80% по сравнению с 40%).
|
РЕЗЮМЕ
Оба способа химической конъюгации, описанные здесь, дают капсулярный полисахарид серотипа 5, ковалентно связанный с белком-носителем CRM197. He было значительный различий по свободному сахариду, соотношению полисахарид серотипа 5: белок и выходам конъюгатов, получаемых этими двумя способами.
Все публикации и заявки на патент, упомянутые в этом описании, свидетельствуют об уровне специалистов, к которым относится это изобретение. Все публикации и заявки на патент включены сюда посредством ссылки, как если каждая индивидуальная публикация или заявка на патент была конкретно и индивидуально указана как включенная сюда ссылкой.
Хотя указанное изобретение было описано в некоторых подробностях путем иллюстраций и примеров для ясности понимания, определенные изменения и модификации можно делать в пределах объема прилагаемой формулы изобретения.