Результат интеллектуальной деятельности: 3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
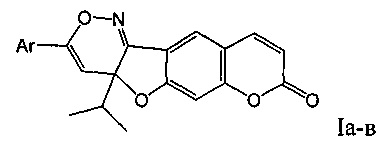
Изобретение относится к новым химическим соединениям, конкретно - к 3-арил-4а-изопропил-4аH-хромено[6',7':4,5]фуро[3,2-с][1,2]оксазин-8-онам (Iа-в),
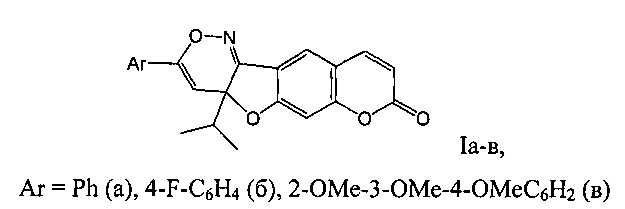
обладающим противовоспалительной и анальгетической активностью.
Указанные свойства позволяют предполагать возможность использования соединения в медицине в качестве фармацевтического препарата системного действия.
Широкая распространенность воспалительных заболеваний, а также несовершенство известных противовоспалительных средств, заключающееся не столько в недостаточной эффективности, сколько в существовании побочных эффектов практически всех существующих групп соединений этого типа, стали стимулом для поиска новых нестероидных противовоспалительных средств (НПВС) системного действия, обладающих дополнительными эффектами, например анальгетическим действием.
Известно использование в качестве противовоспалительного средства препарата системного действия ортофена (вольтарен, диклофенак-натрий), имеющего формулу (II)
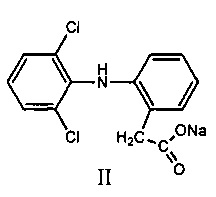
Это соединение представляет собой лекарственный препарат, обладающий выраженным обезболивающим действием и умеренным противовоспалительным и жаропонижающим эффектом. Именно поэтому вольтарен используется в качестве ненаркотического обезболивающего препарата (анальгетика). Соединение обладает выраженным ульцерогенным эффектом, негативно влияет на функцию желудочно-кишечного тракта [М.Д. Машковский, Лекарственные средства, Новая Волна, Москва, 2010, с. 175].
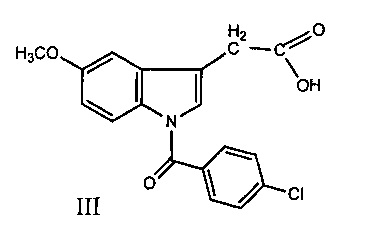
Другой препарат - индометацин (III) оказывает мощное противовоспалительное и обезболивающее действие. Однако этот препарат считается устаревшим, поскольку лидирует по вероятности развития разнообразных побочных эффектов и имеет много противопоказаний, прежде всего - сильное ульцерогенное действие [М.Д. Машковский, Лекарства XX века, Новая Волна, Москва, 1998, с. 154].
Анализ литературных данных показывает, что синтез и фармакологические испытания новых химических соединений, отличающихся от существующих НПВС системностью действия (одновременно противовоспалительным и обезболивающим действием) и отсутствием побочных эффектов, является актуальной задачей.
Линейные фурокумарины (псоралены) находят применение в PUVA (псорален + УФ-облучение) терапии для лечения аутоиммунных или гипер-пролиферативных кожных заболеваний, включая псориаз и витилиго [Wu, L.; Wang, X.; Xu, W.; Farzaneh, F.; Xu, R. The structure and pharmacological functions of coumarins and their derivatives. Curr. Med. Chem. 2009, 16, 4236-4260]. В последнее десятилетие найдены новые терапевтические приложения фурокумаринов. Например, экстракты, содержащие природные фурокумарины бергаптен и изоимператорин, обладают противовоспалительной и анальгетической активностью in vivo на различных моделях боли (горячая пластинка, уксусные корчи, отведение хвоста). [Koriem К.М.М., Asaad G.F., Megahed Н.А., Zahran H., Arbid M.S. Evaluation of Antihyperlipedemic, Anti-inflammatory, Analgesic, And Antipyretic Activities of Ethenolic Extract of Ammi Majus Seeds in Albino Rats And Mice, Internal. J. Toxicol., 2012, 31 (3) 294-300]. Механизм снятия болевой реакции кумаринами не изучен. Для азотсодержащих гетероциклических производных кумаринов установлено, что их терапевтический эффект коррелирует с ингибированием нейтрофильной мигрени, цитокинового релиза и продукцией простагландина PGE2 [Keri R.S., Hosamani К.М., Shingalapur R.V., Hugar M.H. Analgesic, Anti-pyretic and DNA Cleavage Studies of Novel Pyrimidine Derivatives of Coumarin Moiety. Eur. J. Med. Chem., 2010, 45, 2597-2605; Oliveira de Lima F., Nanato F.R., Couto R.D., Barbosa F.J.M., Nunes X.P., Ribeiro S.R., Soares M.B.P., Villarreal C.F. Mechanisms Involved in the Antinociceptive Effects of 7-Hydroxycoumarin. J. Nat. Prod., 2011, 74, 4, 596-602; Sandhya В., Giles D., Mathev V., Basavarajaswamy G., Abraham R. Synthesis, Phaermacological Evaluation and Doking Studies of Coumarin Derivatives. Eur. J. Med. Chem., 2011, 46, 4696-4701].
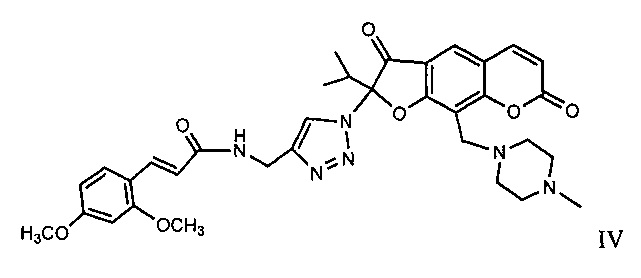
Известно гетероциклическое производное ореозелона - 2-[(арилакриламидо)триазолил]-9-(пиперазинилметил)-ореозелон (IV), обладающее анальгетической активностью [Патент РФ №2549574 "(Е)-2-(4-{[3-(2,4-диметоксифенил)акриламидо]метил}-1H-1,2,3-триазол-1-ил)-2-изопропил-9-(4-метилпиперазин-1-ил)-3,7-диоксо-3,7-дигидро-2H-фуро[3,2-g]хромен, обладающий анальгетической активностью" Э.Э. Шульц, А.В. Липеева, М.П. Долгих, Е.А. Морозова, Т.Г. Толстикова. Заявка №2014109814/04(015444). приоритет от 13.03.2014. Положительное решение от 03.02.2015 г. Опубл. Бюлл. изобр. №12 от 27.04.2015 г.].
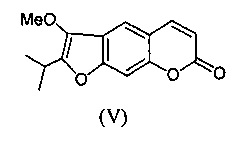
Задачей предлагаемого изобретения, является разработка новых агентов системного действия, обладающих противовоспалительной и анальгетической активностью на основе доступного растительного фурокумарина пеуцеданина (V).
Поставленная задача решается новыми химическими соединениями 3-арилзамещенными 4а-изопропил-4аH-хромено[6',7':4,5]фуро[3,2-с][1,2]оксазин-8-онами формулы (Ia-в), обладающими выраженной противовоспалительной активностью в сочетании с анальгетическим действием.
Исходным веществом для получения агентов (Ia-в) является фурокумарин пеуцеданин формулы (V), обладающий противоопухолевой активностью и индуцирующий апоптоз опухолевых клеток человека [Bartnik, М.; Glowniak, К.; Jakubowicz-Gil, J.; Pawlikowska-Pawlega, В.; Gawron, A. Effect of peucedanin and bergapten (5-MOP), furanocoumarins isolated from Peucedanum tauricum Bieb. (Apiaceae) fruits, on apoptosis induction and heat-shock protein expression in HeLa cells. Herba Polonica, 2006, 52 (4), 71-78]. Соединение (V) выделяли экстракцией корней горичника Морисона Peucedanum morisonii Bess. [Э.Э. Шульц, Т.Н. Петрова, М.М. Шакиров, Е.И. Черняк, Л.М. Покровский, С.А. Нехорошее, Г.А. Толстиков. Кумарины корней горичника Морисона (Peucedanum morisonii Bess.). Химия в интересах устойчивого развития. 2003. Т. 11. С. 683-688]. Указанное растение широко представлено во флоре Сибири; содержание соединения (V) в корнях горичника Морисона достигает 4% от веса воздушно-сухого сырья. Пеуцеданин легко выделяется из растительного сырья экстракцией органическим растворителем и последующей перекристаллизацией. Таким образом, пеуцеданин (V) является весьма доступным соединением для получения на его основе различных фармакологически ценных производных.
Способ получения соединений (Ia-в) из пеуцеданина (V) реализуется по приведенной схеме 1. Гидролиз пеуцеданина (V) количественно приводит к ореозелону (VI) [С.А. Осадчий, Э.Э. Шульц, М.М. Шакиров, Г.А. Толстиков. Исследование растительных кумаринов. Сообщение 1. Некоторые превращения пеуцеданина. Известия АН. Серия химическая. 2006. №2. С. 362-366]. При обработке ореозелона (VI) действием толуолсульфохлорида (12 экв.) в ТГФ в присутствии Et3N (1.3 экв.) и последующей (без выделения 2-тозилореозелона) реакции кросс-сочетания с терминальным ацетиленом (фенилацетиленом, 4-фторфенилацетиленом, 2,3,4-триметоксифенилацетиленом) в присутствии Pd(PPh3)2Cl2 (5 мол. %) образуются соответствующие 2-(арилэтинил)ореозелоны (VIIa-в) (выход 62-72%). Обработка водно-спиртового раствора соединения (VIIa-в) и гидроксиламина (4 экв) действием 10%-ного раствора NaOH (при добавлении рН~6) приводила к (E)-3-(гидроксимино)-производным кумаринов (VIIIa-в) (выход 45-51%). Циклоизомеризация пропаргильных оксимов (VIIIa-в) под действием хлорида золота(III) приводит к кумаринооксазинам (Ia-в) (выход 36-40%). Общий выход агентов (Ia-в) в расчете на исходный растительный метаболит пеуцеданин (V) составляет 10-14%.
Достоинством изобретения является способ получения соединений (Ia-в) путем химической модификации доступного растительного кумарина пеуцеданина (V). Физико-химические константы новых, впервые полученных соединений (VII6, VIIIa-в, Iа-в), приведены в примерах 1-7.
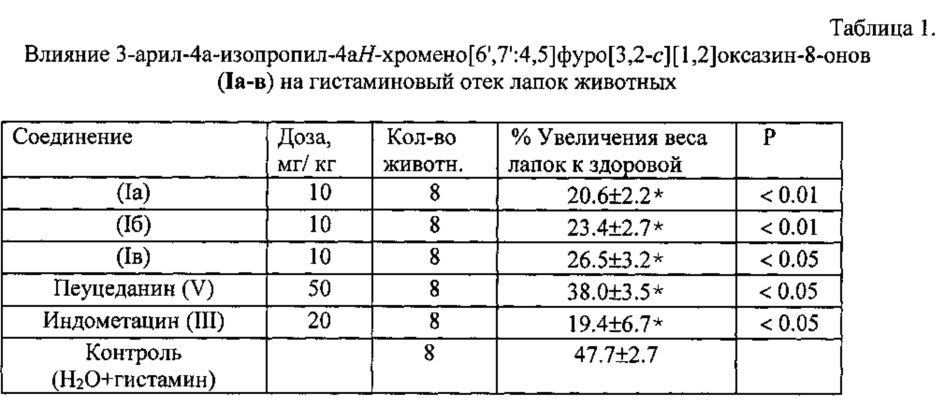
Биологическая активность соединений (Ia-в) изучалась путем определения острой токсичности, противовоспалительной активности (по индексу отека лапы мышей, индуцировапнного введением гистамина) и анальгетической активности (в тесте «уксусные корчи»). Условия экспериментов и методы исследования выбирали в соответствии с рекомендациями [Хабриев. Руководство по экспериментальному доклиническому изучению новых фармакологических веществ, Москва, 2006 г.).
Острую токсичность определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединений (Ia-в) превышает максимально возможную для разового введения дозу 2000 мг/кг. Заявляемые соединения относятся к 3-му классу умеренно опасных веществ. LD50 препарата сравнения диклофенака-натрия (II) составляет 350 мг/кг [Чернух A.M. Воспаление, Медицина, М., 1979, 448 с.].
Противовоспалительное действие соединений (Ia-в) в дозе 10 мг/кг изучали на модели воспаления, вызванного введением 0.1% раствором гистамина под апоневроз одной из задних лапок мыши в дозе 0.05 мл. О противовоспалительном действии соединения судили по проценту увеличения массы воспаленной лапки по сравнению со здоровой. Препаратом сравнения служил индометацин. Результаты исследования приведены в табл. 1. Исследования показали, что соединения (Ia-в) в дозе 10 мг/кг достоверно задерживают развитие гистаминового отека. Как видно, производные (Ia-в) обладали достоверной противовоспалительной активностью. Их активность была аналогична активности индометацина (III), введенного в дозе 20 мг/кг. Исходное соединение (V) обладало активностью только в дозе 50 мг/кг; при этом его активность была ниже, чем у заявляемых соединений (Ia-в), введенных в дозе 10 мг/кг.
Анальгетическая активность соединения (Ia-в) изучалась на модели химического раздражения (тест «уксусные корчи») путем однократного введения в дозе 50 мг/кг. Обезболивающее действие соединения сравнивали с активностью исходного соединения пеуцеданина (V) и активностью препарата сравнения (II), введенных в дозе 50 мг/кг. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Результаты представлены в таблице 2.
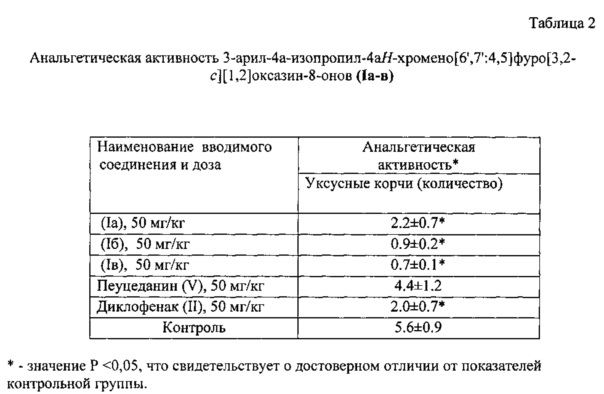
Из данных таблицы видно, что соединения (Ia-в) проявляли достоверную анальгетическую активность на модели болевой реакции, вызванной введением химического раздражителя, достоверно уменьшали болевую реакцию и в 2-5 раз снижали количество корчей при введении в дозах 50 мг/кг. Активность (1а) была аналогична активности диклофенака натрия (II), а соединения (1б,в) обладали в 2-3 раза более высокой активностью по сравнению с эталоном (II). Таким образом, соединения (Ia-в) обладали выраженной анальгетической активностью в тесте «уксусные корчи». Пеуцеданин (V) не проявил достоверной анальгетической активности в тесте «уксусные корчи» (% уменьшения болевой реакции составил 6.6%). На модели термической боли (тест «горячая пластинка») соединения (Ia-в), а также пеуцеданин (V) не обладали достоверной анальгетической активностью.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 2-изопропил-2-[(4-фторфенил)этинил]-2H-фуро[3,2-g]хромен-3,7-диона (VIIб). Раствор 0.5 г (2 ммоль) ореозелона (VI), 0.47 г (2.5 ммоль) хлористого тозила и 0.07 г (0.1 ммоль) Pd(PPh3)Cl2 в 5 мл абсолютного ТГФ в токе аргона нагревали до 60°C 5 ч, затем добавили 0.46 г (2 экв) фенилацетилена, 0.42 г (3 экв) триэтиламина и 0.07 г Pd(PPh3)Cl2, в 5 мл ТГФ и нагревали при 60°C еще 5 ч (контроль по ТСХ до исчезновения пятна исходного соединения). По окончании реакции к реакционной смеси добавили 10 мл воды, продукт экстрагировали хлористым метиленом (4×5 мл), объединенные экстракты сушили MgSO4, растворитель удаляли в вакууме. После перекристаллизации из этанола получили 0.49 г (62%) соединения (VIIб). 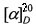 +11° (с 0.5, CHCl3). Т.пл. 95-96°C (из этанола). ИК спектр, ν, см-1: 3078, 3061, 3050, 2962, 2926, 2874, 2854, 2216, 2195, 1742, 1726, 1713, 1626, 1597, 1576, 1485, 1441, 1392, 1355, 1317, 1302, 1178, 1141, 1121, 1105, 1090, 1070, 1045, 1026, 935, 914, 881, 826, 814, 756, 723, 688. УФ спектр (CHCl3), λмакс, нм (lgε): 298 (4.25), 340 (4.28. Спектр ЯМR 1Н (CDCl3), δ, м.д. (J, Гц): 1.29 (6Н, д, J 6.9, 2×CH3), 3.18 (1H, м, СН-i-Pr), 6.24 (1Н, д, J 9.4, Н6), 6.92 (1Н, с, Н9), 6.95 (3Н, м, H3',5'), 7.43 (2Н, м, H2',6'), 7.49 (1Н, с, Н4), 7.71 (1Н, д, J 9.4, Н5). Спектр ЯМR 13C (CDCl3), δ, м.д.: 20.26 (2×CH3), 25.96 (С-i-Pr), 73.55 (С1а), 80.39 (С1b), 94.13 (С2), 101.06 (С9), 115.62 (С3а), 115.77 (С6), 116.08 (С4а), 116.64 (С3',5'), 119.36 (С1'), 126.20 (С4), 134.52 (С2',6'), 143.89 (С5), 156.96 (С9а), 162.02 (С8а), 164.92 (С4'), 172.51 (С7), 191.73 (С3). Масс-спектр, m/z (Iотн., %): 345 (2), 344 (15), 278 (4), 277 (5), 263 (18), 262 (100), 247 (67), 243 (28), 229 (36), 202 (95), 189 (27), 188 (21), 174 (8), 160 (11), 155 (18), 91 (32), 88 (10). Найдено, %: С 76.39; Н 4.38. [М+] 344.1000. С22Н16O4. Вычислено, %: С 76.73; Н 4.68. М 344.1008.
+11° (с 0.5, CHCl3). Т.пл. 95-96°C (из этанола). ИК спектр, ν, см-1: 3078, 3061, 3050, 2962, 2926, 2874, 2854, 2216, 2195, 1742, 1726, 1713, 1626, 1597, 1576, 1485, 1441, 1392, 1355, 1317, 1302, 1178, 1141, 1121, 1105, 1090, 1070, 1045, 1026, 935, 914, 881, 826, 814, 756, 723, 688. УФ спектр (CHCl3), λмакс, нм (lgε): 298 (4.25), 340 (4.28. Спектр ЯМR 1Н (CDCl3), δ, м.д. (J, Гц): 1.29 (6Н, д, J 6.9, 2×CH3), 3.18 (1H, м, СН-i-Pr), 6.24 (1Н, д, J 9.4, Н6), 6.92 (1Н, с, Н9), 6.95 (3Н, м, H3',5'), 7.43 (2Н, м, H2',6'), 7.49 (1Н, с, Н4), 7.71 (1Н, д, J 9.4, Н5). Спектр ЯМR 13C (CDCl3), δ, м.д.: 20.26 (2×CH3), 25.96 (С-i-Pr), 73.55 (С1а), 80.39 (С1b), 94.13 (С2), 101.06 (С9), 115.62 (С3а), 115.77 (С6), 116.08 (С4а), 116.64 (С3',5'), 119.36 (С1'), 126.20 (С4), 134.52 (С2',6'), 143.89 (С5), 156.96 (С9а), 162.02 (С8а), 164.92 (С4'), 172.51 (С7), 191.73 (С3). Масс-спектр, m/z (Iотн., %): 345 (2), 344 (15), 278 (4), 277 (5), 263 (18), 262 (100), 247 (67), 243 (28), 229 (36), 202 (95), 189 (27), 188 (21), 174 (8), 160 (11), 155 (18), 91 (32), 88 (10). Найдено, %: С 76.39; Н 4.38. [М+] 344.1000. С22Н16O4. Вычислено, %: С 76.73; Н 4.68. М 344.1008.
По приведенной методике синтезировали описанные ранее 2-изопропил-2-(фенилэтинил)-2H-фуро[3,2-g]хромен-3,7-диона (VIIa) [А.В. Липеева, Э.Э. Шульц, М.М. Шакиров, Г.А. Толстиков. Исследование растительных кумаринов. XI. Реакции кросс-сочетания с участием 2-(тозил)ореозелона. Журнал органической химии. - 2013. - Т. 49. - Вып. 1. - С. 105-112] и 2-изопропил-2-[(2,3,4-триметоксифенил)этинил]-2H-фуро[3,2-g]хромен-3,7-дион (VIIb) [A.V. Lipeeva, Е.Е. Shults, М.М. Shakirov, М.А. Pokrovsky, A.G. Pokrovsky. Synthesis and Cytotoxic Activity of a New Group of Heterocyclic Analogues of the Combretastatins. Molecules. - 2014. - V. 19. - P. 7881-7900].
Пример 2. Получение (E)-3-(гидроксимино)-2-изопропил-2-(фенилэтинил)-2,3-дигидрофуро[3,2-g]хромен-7-она (VIIIa). Смешивали растворы 0.5 г (0.0014 моль) соединения (Vila) в 10 мл этанола и 0.4 г (0.0056 моль, 4 экв.) гидрохлорида гидроксиламина в 2 мл воды и при перемешивании и нагревании до 55-60°C добавляли по каплям (10%-ный раствор NaOH (из 0.24 г, 0.006 моль NaOH) с такой скоростью, чтобы pH оставался нейтральным. По окончании реакции (4 ч, контроль ТСХ) реакционную смесь разбавили 10 мл воды, продукт экстрагировали Et2O (5×4 мл), объединенные экстракты сушили MgSO4, растворитель удаляли в вакууме. После перекристаллизации из эфира получили 0.23 г (45%) соединения (Villa). Т.пл. 143-146°С. ИК спектр, ν, см-1: 3425, 2960, 2923, 2852, 1664, 1604, 1562, 1467, 1367, 1342, 1307, 1222, 1151, 1122, 1049, 975, 837, 719. УФ спектр (EtOH), λмакс, нм (lgε): 203 (3.76), 255 (3.73), 305 (3.11), 337 (3.18), 352 (3.21). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.88 (3Н, д, J 6.9, CH3), 1.11 (3Н, д, J 6.9, CH3), 2.36 (1H, м, СН-i-Pr), 6.24 (1Н, д, J 9.6, H6), 6.83 (1H, с, Н9), 7.23-7.51 (5Н, м, Ph), 7.64 (1Н, д, J 9.6, Н5), 8.33 (1Н, с, H4), 11.91 (1Н, уш.с, N-OH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 18.35 (CH3), 19.56 (CH3), 29.09 (С-i-Pr), 73.87 (С1a), 81.51 (С1b), 98.94 (С2), 113.09 (С9), 113.26 (С4a), 117.25 (С6), 118.06 (С3а), 121.72 (С4), 128.39 (С3',5'), 128.58 (С4'), 132.04 (С1'), 132.44 (С2',6'), 143.98 (С5), 153.44 (С9а), 158.30 (С8а), 160.62 (С7), 167.27 (С3). Найдено, %: С 72.99; Н 4.52; N 3.97. C22H17NO4. Вычислено, %: С 73.53; Н 4.77; N 3.90.
Пример 3. Синтез (E)-3-(гидроксимино)-2-изопропил-2-[(4-фторфенил)этинил]-2,3-дигидрофуро[3,2-g]хромен-7-она (VIIIб). Получали по методике примера 2. Выход 42% (0.221 г). Т.пл. 161-162°С. ИК спектр, ν, см-1: 3437, 2979, 2933, 2143, 1732, 1718, 1633, 1597, 1502, 1431, 1411, 1388, 1249, 1224, 1213, 1137, 1114, 1047, 869, 829, 819, 696, 625, 601. УФ спектр (EtOH), λмакс, нм (lgε): 205 (3.74), 228 (3.57), 255 (3.96), 291 (3.4), 307 (3.31), 349 (3.38). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.66 (3Н, д, J 6.9, CH3), 1.08 (3Н, д, J 6.9, CH3), 2.11 (1H, м, CH-i-Pr), 6.17 (1Н, д, Н6, J 9.6), 6.75 (1Н, с, Н9), 6.92 (2Н, м, H2',6'), 7.38 (2Н, м, H3',5'), 7.58 (1H, д, H5, J 9.6), 8.28 (1Н, с, Н4). Спектр ЯМР 13С (CDCl3+CD3OD), δ, м.д.: 14.21 (CH3), 18.85 (CH3), 28.83 (С-i-Pr), 74.23 (С1а), 88.51 (С1b), 98.25 (С2), 109.68 (С9), 113.13 (С6), 114.91 (С4а), 115.15 (С3а), 117.41 (С3',5'), 120.39 (С1'), 128.28 (С4), 133.55 (С2',6'), 144.18 (С5), 153.24 (С9а), 157.10 (С8а), 161.03 (7a), 165.12 (С4'), 171.25 с (С7). Найдено, %: С 69.91; Н 3.78; N 3.47; F 5.00. C22H16NFO4. Вычислено, %: С 70.02; Н 4.27; N 3.71; F 5.03.
Пример 4. Синтез (E)-3-(гидроксимино)-2-изопропил-2-[(2,3,4-триметоксифенил)-этинил]-2,3-дигидрофуро[3,2-g]хромен-7-она (VIIIb). Получали по методике примера 2. Выход 51% (0.292 г). Т.пл. 188-190°С. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.88 (3Н, д, J 6.9, CH3), 1.10 (3Н, д, J 6.9, CH3), 2.30 (1Н, м, CH-i-Pr), 3.84 (с, 6Н, 2×ОCH3), 3.89 (с, 3H, ОCH3), 6.32 (1Н, д, J 9.6, Н6), 6.70 (1Н, д, J 7.8, Н5'), 6.99 (1Н, с, Н9), 7.53 (1Н, д, J 9.6, H5), 7.69 (1Н, д, J 7.8, H6'), 7.83 (1Н, с, Н4), 10.18 (1Н, с, N-OH). Спектр ЯМР 13С (CDCl3), δ, м.д. (J, Гц): 14.48 (CH3), 19.12 (CH3), 28.90 (С-i-Pr), 54.91, 61.82, 62.70 (3×ОCH3), 74.50 (С1а), 91.42 (С1b), 98.52 (С2), 106.00 (С5'), 109.95 (С9), 113.40 (С4а), 115.18 (С6), 115.41 (С3а), 120.66 (С1'), 122.92 (С61), 128.55 (С4), 141.60 (С3'), 144.44 (С5), 153.51 (С3), 153.51 (С9а), 154.13 (С2'), 154.66 (С4'), 157.36 (С8a'), 161.30 (С7), 166.98 (С3). Найдено, %: С 65.89; Н 5.52; N 3.17. C25H23NO7. Вычислено, %: С 66.81; Н 5.16; N 3.12.
Пример 5. Синтез 4а-изопропил-3-фенилхромено[6',7':4,5]фуро[3,2-с][1,2]оксазин-8(4аH)-она (Iа). К раствору 200 мг (0.55 ммоль) оксима (Villa) в 4 мл MeCN прибавили 8 мг (0.028 моль, 5 мол %) AuCl3. Реакционную смесь перемешивали 6 ч при 30°С (контроль ТСХ). Затем смесь разбавили 6 мл воды и проэкстрагировали CH2Cl2 (3×5 мл), объединенные экстракты сушили MgSO4, растворитель удаляли в вакууме. Остаток хроматографировали на колонке с силикагелем, фракцию, содержавшую продукт, перекристаллизовали из этилацетата. Получили 71 мг соединения (Iа) (выход 36%), т.пл. 186-188°C (разл). ИК спектр, ν, см-1: 3145, 3062, 3047, 2979, 2941, 2883, 1751, 1728, 1625, 1581, 1481, 1388, 1352, 1284, 1238, 1147, 1126, 1095, 1083, 997, 952, 862, 819, 763, 740, 700. УФ спектр (ETOH), λмакс, нм (lgε): 201 (3.95), 237 (3.7), 273 (3.72), 325 (3.63), 338 (3.63). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.06 (3H, д, J 6.9, CH3), 1.09 (3H, д, J 6.9, CH3), 3.28 (1Н, м, CH-i-Pr), 6.40 (1Н, д, J 9.6, Н9), 7.15 (1Н, с, H6), 7.32 (2Н, м, Ph-H3',5'), 7.40 (1Н, м, Н4'), 7.67 (2Н, м, Ph-H2',6'), 7.75 (1Н, д, J 9.6, H10), 7.85 (с, Н11), 7.91 (1Н, с, Н4). Спектр ЯМР 13C (CDCl3), δ, м.д.: 20.71 (CH3), 20.76 (CH3), 34.03 (С-i-Pr), 96.10 (С4а), 98.62 (С4), 101.33 (С6), 114.97 (С11а), 115.82 (С9), 116.62 (С10а), 125.85 (С11), 128.44 (С2',6'), 128.85 (С3',5'), 129.64 (С1'), 132.59 (С4'), 143.13 (С10), 148.16 (С11b), 158.78 (С6а), 161.85 (С8), 168.89 (С5а), 171.68 (С3). Масс-спектр, m/z (Iотн., %): 360 (2), 359 (10), 344 (26), 316 (29), 290 (21), 244 (18), 243 (75), 242 (64), 229 (21), 202 (15), 201 (15), 189 (54), 188 (81), 170 (15), 161 (16), 160 (25), 149 (23), 116 (77), 102 (100), 83 (26), 76 (23), 57 (20). Найдено, %: С 73.59; Н 4.81; N 4.19. [М] 359.1154. C22H17NO4. Вычислено, %: С 73.53; Н 4.77; N 3.90. М 359.11152.
Пример 6. Синтез 4а-изопропил-3-(4-фторфенил)хромено[6',7':4,5]фуро[3,2-с][1,2]-оксазин-8(4аH)-она (Iб). Получали по методике примера 5. Выход 38% (78 мг), т.пл. 213-215°С (разл). ИК спектр, ν, см-1: 3149, 3111, 3051, 2981, 2924, 2854, 1749, 1739, 1625, 1579, 1494, 1481, 1388, 1352,1244, 1218, 1124, 1095,1082, 1037, 948, 910, 827, 815, 740. УФ спектр (EtOH), λмакс, нм (lgε): 205 (3.74), 255 (3.96), 306 (3.28), 349 (3.38). Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.02 (3H, д, J 6.9, CH3), 1.05 (3H, д, J 6.9, CH3), 3.21 (1Н, м, CH-i-Pr), 6.35 (1Н, д, J 9.6, H9), 7.03 (2Н, м, Ph-H2',6'), 7.07 (1Н, с, H6), 7.71 (2Н, м, H3',5'), 7.74 (1Н, д, J 9.6, H10), 7.88 (с, Н11), 7.94 (1Н, с, H4). Спектр ЯМР 13С (CDCl3), δ, м.д.: 15.45 (CH3), 15.79 (CH3), 33.98 (С-i-Pr), 98.63 (С4а), 100.78 (С4), 101.29 (С6), 115.70 (С11а), 115.77 (С9), 115.87 (C10a), 116.72 (С3,'5'), 125.75 (С11), 127.60 (С2'6'), 128.67 (С1'), 142.85 (С10), 150.70 (С11b), 158.56 (С6a), 161.89 (С8), 162.87 (С4'), 168.85 (С5а), 171.76 (С3). Найдено, %: С 70.18; Н 3.87; N 3.96; F 4.77. C22H16NFO4. Вычислено, %: С 70.02; Н 4.27; N 3.71; F 5.03.
Пример 7. Синтез 4а-изопропил-3-(2,3,4-триметоксифенил)хромено[6',7':4,5]фуро[3,2-с][1,2]оксазин-8(4аH)-она (Iв). Получали по методике примера 5. Выход 40% (90 мг), т.пл. 221-224°C (разл). ИК спектр, ν, см-1: 3157, 3107, 3066, 2978, 2935, 2852, 1739, 1627, 1581, 1487, 1475, 1406, 1487, 1475, 1390, 1352, 1286, 1222, 1143, 1122, 1091, 1022, 983, 900, 866, 825, 790, 734, 518. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.02 (3H, д, J 6.9, CH3), 1.04 (3H, д, J 6.9, CH3), 3.18 (1H, м, CH-i-Pr), 3.80 (с, 3H, ОCH3), 3.81 (с, 3H, ОCH3), 3.82 (с, 3H, ОCH3), 6.33 (1H, д, J 9.6, Н10), 6.70 (1Н, д, J 8.4, H5'), 7.07 (1Н, с, H6), 7.71 (1Н, д, J 9.6, H10), 7.84 (1Н, д, J 8.4, Н6'), 7.89 (1H, с, H11), 8.09 (1H, с, Н4). Спектр ЯМР 13С (CDCl3), δ, м.д.: 15.36 (CH3), 15.74 (CH3), 33.79 (С-i-Pr), 55.95 (ОCH3), 60.21 (ОCH3), 60.76 (ОCH3), 98.35 (С4а), 100.89 (С4), 101.06 (С6), 107.89 (C5'), 115.39 (С9), 115.66 (С11а), 116.66 (С10а), 116.73 (С1'), 122.26 (С2'), 125.67 (С11), 141.83 (С3'), 142.99 (С10), 150.53 (С11b), 153.81 (С2'), 154.75 (С4'), 158.68 (С6'), 161.70 (С8), 169.04 (С5а), 171.69 (С3). Найдено, %: С 67.08; Н 4.88; N 3.16. C25H23NO7. Вычислено, %: С 66.81; Н 5.16: N 3.12.
Пример 8. Изучение противовоспалительной активности соединений (Ia-в). Влияние соединений на гистаминовый отек изучали на белых беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. Воспаление вызывалось введением под плантарный апоневроз правой задней лапки 0,05 мл 0,1% раствора гистамина. Соединение вводили внутрь за 2 ч до введения гистамина и через 3 и 6 ч после введения гистамина. Через 3 часа после последнего введения животных умерщвляли путем кранио-цервикальной дислокации, отсекали задние лапы ниже голеностопного сустава и определяли массу каждой. Противовоспалительный эффект оценивали по уменьшению, по сравнению с контролем, индекса отека, который определяли в процентах как отношение разности здоровой и воспаленной лапы к массе здоровой. Эталонный препарат – индометацин - вводили внутрижелудочно в дозе 20 мг/кг.
Результаты исследований приведены в табл. 1.
Пример 9. Исследование анальгетической активности соединений (Ia-в) в тесте «уксусные корчи». Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Одной группе внутрижелудочно за час до воспроизведения модели вводили исследуемый агент (I) в дозе 50 мг/кг, вторая группа получала препарат (III) в этой же дозе, третья группа - пеуцеданин (II). Животным контрольной группы вводили 0.2 мл воды на 10 г веса животного. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Результаты исследования приведены в табл. 2.
Таким образом, в результате исследования установлено, что соединения (Ia-в) обладают выраженной противовоспалительной активностью на модели гистаминового воспаления и анальгетическим действием, причем изменения носят достоверный характер по сравнению с соответствующими показателями у животных в контрольной группе. Активность соединений (Ia-в) сравнима с активностью препаратов сравнения и в ряде случаев превышает ее.
Таким образом, предлагаемое изобретение обладает следующими преимуществами, а именно:
- Противовоспалительная активность на модели гистаминового воспаления.
- Анальгетическая активность в тесте «уксусные корчи».
- Использование для получения заявляемого соединения доступного растительного сырья - широко распространенного ландшафтного растения горичника Морисона.
Схема. Синтез 3-арилзамещенных 4а-изопропил-4аH-хромено[6',7':4,5]фуро[3,2-с][1,2]оксазин-8-онов (Iа-в)
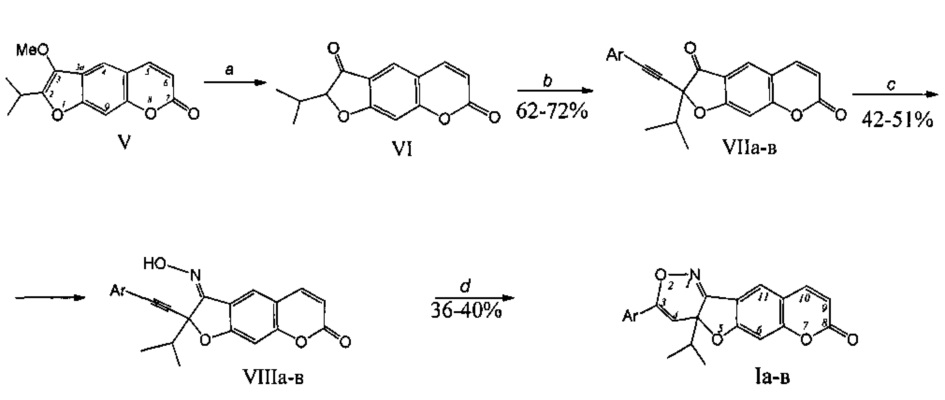
Ar=Ph (a), 4-F-C6H4 (б), 2-ОМе-3-ОМе-4-ОМеС6Н2 (в)
Реагенты и условия: а) HCl, МеОН, 25°С; b) TsCl, Et3N, Pd(PPh3)2Cl2, THF, 60°C, 5h, затем ArC≡CH, 60C, 3-7 h; c) NH2OH'HCl, 10%-NaOH, EtOH, 55-60°C, 10h; d) AuCl3, MeCN, 30°C, 6-8 h.
![3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/6b/83/1f/75f9af5511908453476780075be205a5.jpg)
![3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/6b/83/1f/34b1afe413a216353a79d30aaec7cfe6.jpg)

