Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ШТАММА BACILLUS SUBTILIS EO-11 ВКПМ В-11978 В КАЧЕСТВЕ ПРОДУЦЕНТА СУБТИЛИЗИНОПОДОБНОЙ ПРОТЕИНАЗЫ, ВЕЩЕСТВА С ТРОМБОЛИТИЧЕСКИМИ И АНТИКОАГУЛЯНТНЫМИ СВОЙСТВАМИ
Вид РИД
Изобретение
Изобретение относится к области удовлетворения жизненных потребностей человека, может быть использовано в медицине и ветеринарии для лизиса (растворения) образовавшихся в кровеносных сосудах сгустков крови (далее по тексту - тромбов), нарушающих нормальную циркуляцию (крови) и угрожающих жизни (тромболитические свойства), и предотвращения (профилактики) образования тромбов (антикоагулянтные свойства).
Известен тромболитический фармацевтический препарат стафилокиназа [1]. Сущностью является бифункциональное рекомбинантное производное стафилокиназы с активностями тромболитического и антикоагулирующего агента, отличающееся от стафилокиназы дикого типа тем, что один или более аминокислотных остатков между аминокислотными остатками 104 и 113 стафилокиназы дикого типа замещены другими аминокислотами с образованием последовательности RGD или последовательности KGD, вследствие чего его способность к полимеризации, а также клеточная и гуморальная иммуногенность существенно понижены по сравнению со стафилокиназой дикого типа, или его усеченный с NH2-конца вариант, сохраняющий активности полноразмерной формы.
Недостатком [1] является то, что рассасывание тромба (сгустка крови), например, образовавшегося в кровеносном сосуде и нарушившего кровообращение, происходит весьма замедленно вследствие крайне медленной активации плазминогена под ее (стафилокиназы) воздействием [2]. Весьма замедленное лечебное действие препарата приводит к нарушениям кровоснабжения живых тканей и органов, вплоть до их отмирания с угрозой жизни живого организма.
Известен тромболитический фармацевтический препарат урокиназа [3]. Недостатком [3] являются многочисленные осложнения, выражающиеся в возникновении кровотечений, обусловленных повышением в крови продуктов деградации фибрина. Кроме того, при использовании урокиназы системно снижается концентрация фибриногена и других факторов свертывания. Недостатки [3] приводят к угрожающему для жизни живого организма нарушению коагуляционного звена системы гемостаза.
Известен тромболитический препарат тканевый активатор плазминогена [4]. Недостатком [4] является быстрое выведение препарата из циркуляции в кровеносной системе. В связи с этим необходима длительная обработка пациента системным введением активатора. А системное введение активатора стимулирует фибринолитическую систему, результатом чего являются опасные кровотечения из-за разрушения фибриногена, нарушающие жизнедеятельность органов, например головного мозга, и сопровождающиеся неврологической симптоматикой. Кроме того, наличие у больных сопутствующих сердечно-легочных заболеваний ограничивает область применения [4] из-за отрицательного влияния препарата так, что введение и увеличение его (препарата) дозы чревато непредсказуемыми тяжелыми геморрагическими осложнениями [5] с возникновением угрозы жизни живого организма.
Наиболее близким по существу заявляемого изобретения, выбранным заявителем в качестве прототипа, является изобретение «Способ получения рекомбинантной стрептокиназы», продуктом которого является тромболитический препарат стрептокиназа [6]. Недостатком прототипа является отсутствие специфического сродства стрептокиназы к фибрину. Поэтому в случае необходимости применения препарата в высоких дозах, для достижения требуемого терапевтического эффекта, указанный препарат способствует истощению свертывающей системы крови и возникновению неконтролируемых кровотечений.
Целью предлагаемого изобретения является одновременное повышение эффективности лизиса тромба (повышение эффективности растворения тромба в кровеносной системе) и исключение (предотвращение) тромбообразования в кровеносной системе организмов.
Сущность заявляемого изобретения заключается в применении рекомбинантного штамма Bacillus subtilis ЕО-11 ВКПМ В-11978 [7] в качестве продуцента субтилизиноподобной протеиназы, т.е. вещества, обладающего одновременно тромболитическими и антикоагулянтными свойствами.
Заявленное техническое решение поясняется следующими иллюстрациями.
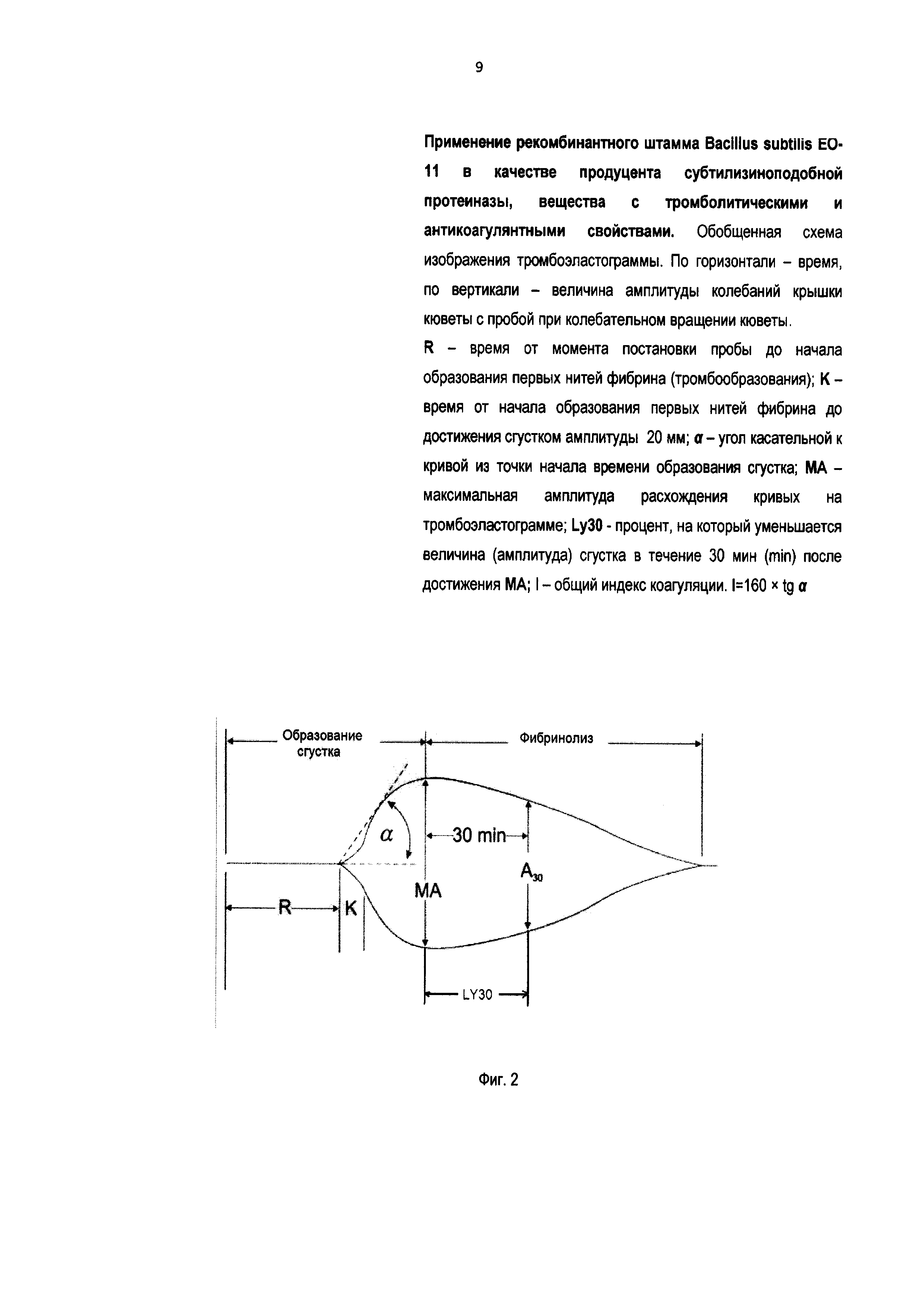
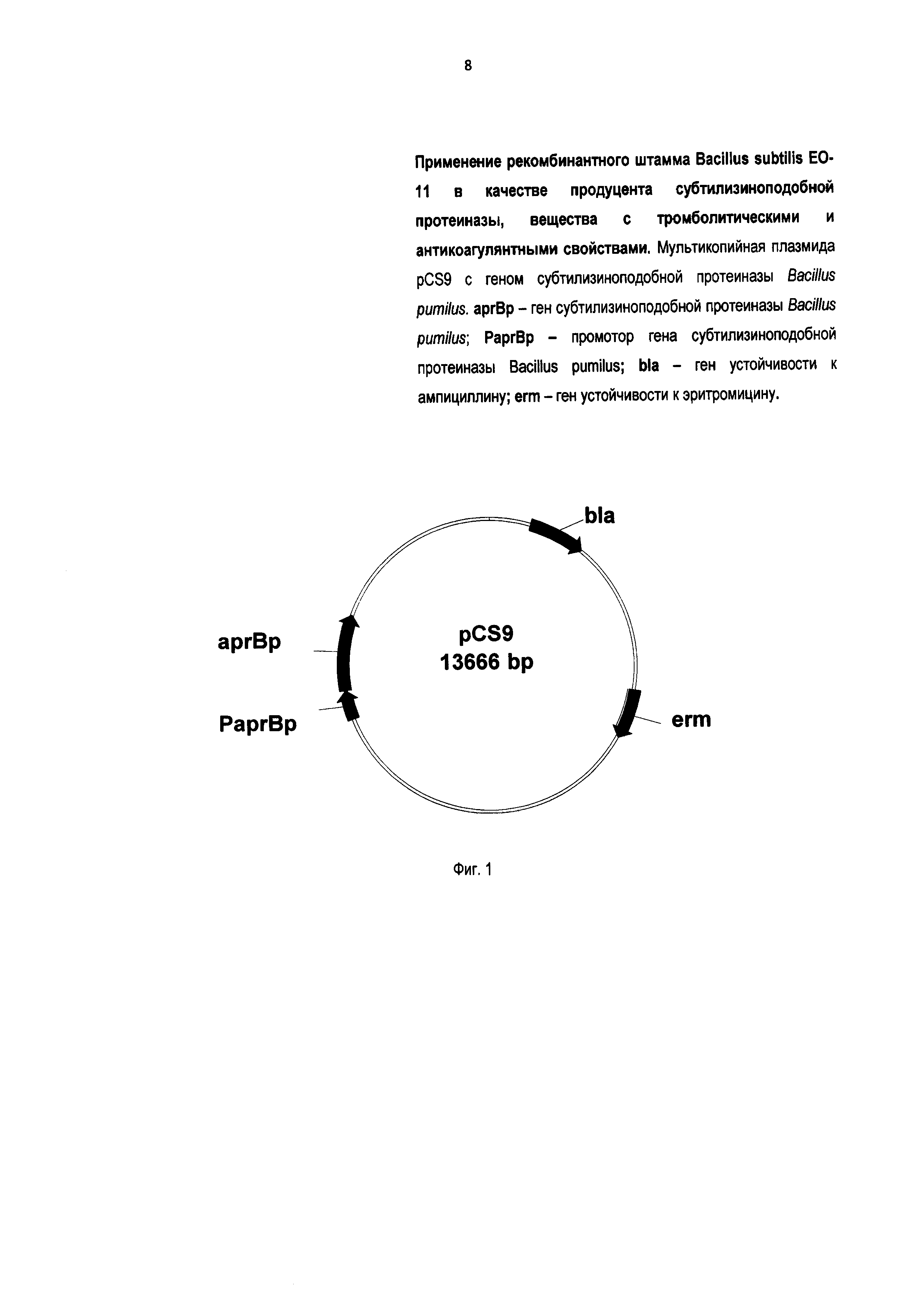
На Фиг. 1 показана мультикопийная плазмида pCS9 с геном субтилизиноподобной протеиназы. На Фиг. 2 представлена схема тромбоэластограммы, которая позволяет охарактеризовать весь процесс образования сгустка, от момента выпадения первых нитей фибрина до стабилизации сгустка или его лизиса. На Фиг. 3 изображены тромбоэластограммы: 3-1 - проба без фермента субтилизиноподобная протеиназа (контроль), где ОС-К - Образование Сгустка в Контроле; 3-2 - проба с субтилизиноподобной протеиназой, где ОС-С - Образование Сгустка в присутствии Субтилизиноподобной протеиназы.
Заявленное техническое решение описывается в следующей последовательности:
Для доказательства того, что заявленное техническое решение обладает одновременно как тромболитическими, так и антикоагулянтными свойствами заявителем далее приведены результаты экспериментов в следующей последовательности, на одном и том же препарате, а именно в первую очередь описаны эксперименты по получению фермента, а далее описаны эксперименты в отношении его тромболитической и антикоагулянтной активности, соответственно.
Заявляемое изобретение осуществляют, например, следующим путем.
1. Создают рекомбинантную субтилизиноподобную протеиназу.
Для этого:
1.1. Создают рекомбинантный штамм Bacillus subtilis ЕО-11 ВКПМ В-11978.
1.1.1. Известным способом [8] конструируют мультикопийную плазмиду pCS9 (Фиг. 1) с геном субтилизиноподобной протеиназы Bacillus pumilus под контролем собственных регуляторных элементов. На Фиг. 1 показана мультикопийная плазмида pCS9 с геном субтилизиноподобной протеиназы Bacillus pumilus, где: aprBp - ген субтилизиноподобной протеиназы Bacillus pumilus; PaprBp - промотор гена субтилизиноподобной протеиназы Bacillus pumilus; bla - ген устойчивости к ампициллину; erm - ген устойчивости к эритромицину. Регуляторный элемент - это участок ДНК или РНК, регулирующий работу генов [9], находящихся на той же молекуле (ДНК или РНК). Выполняют трансформацию клеток Bacillus subtilis BG2036 плазмидной ДНК, например, по известному методу [10]. В штамм (Bacillus subtilis BG2036) помещают полученную плазмиду с геном субтилизиноподобной протеиназы Bacillus pumilus (Фиг. 1). В результате трансформации получают рекомбинантный штамм Bacillus subtilis ЕО-11. Bacillus subtilis ЕО-11 задепонирован во Всероссийской Коллекции Промышленных Микроорганизмов, как ВКПМ-11979 [7].
1.1.2. Полученный рекомбинантный штамм Bacillus subtilis ЕО-11 ВКПМ В-11978 культивируют в питательной среде, например, состава (%): бактериологический пептон («Sigma») - 2,00; CaCl2⋅2Н2О - 0,06; MgSO4⋅Н2О - 0,05; NaCl - 0,30; NH4Cl - 0,02; MnSO4 - 0,01; Na2HPO4 - 0,04; pH - 8,5 (пептонсодержащая среда); L-бульон (среда LB, Лурия-Бертани) состава: триптон - 10,00 г/л; дрожжевой экстракт - 5,00 г/л; NaCl - 5,00 г/л; рН 8,5. Для получения максимальной продукции субтилизиноподобной протеиназы используют колламин в концентрации 1,2 об.% в качестве добавки к среде LB и пептонсодержащей среде. Непосредственно перед посевом в среду культивирования добавляют эритромицин в концентрации 20 мкг/мл. Культивирование проводят при атмосферном давлении на лабораторных качалках BIOSAN, при температуре от плюс 25 до плюс 35°С, с интенсивностью качания 200 об/мин.
1.2. Из культуральной жидкости рекомбинантного штамма Bacillus subtilis ЕО-11 ВКПМ В-11978 выделяют и очищают заявляемый фермент - субтилизиноподобную протеиназу методом ионообменной хроматографии с использованием КМ-целлюлозы [11] и в системе FPLC на колонке Mono S [12]. По завершении очистки получают фермент - субтилизиноподобную протеиназу - в буферном растворе (применяемом в процессе очистки), например в 0,05М Трисе HCl, рН 8,5. Полученный и очищенный фермент - субтилизиноподобную протеиназу, упаковывают и хранят, например, при температуре не выше плюс 4°С, применяют по назначению, например, в качестве тромболитического препарата. Неоднократная заморозка/разморозка вещества понижает активность препарата.
Далее согласно «Паспорту штамма микроорганизма» (приложение к [7]) приведены основные характеристики и сведения о гарантированном неоднократном воспроизведении созданного рекомбинантного штамма Bacillus subtilis ЕО-11 [8].
- Родовое и видовое название культуры: Bacillus subtilis, Семейство: Bacillaceae.
- Номер или наименование штамма: Bacillus subtilis ЕО-11.
- Область применения штамма: в биотехнологии как продуцент субтилизиноподобной протеиназы, обладающей тромболитическими свойствами.
- Продукт, синтезируемый штаммом: Внеклеточная субтилизиноподобная протеиназа.
- Активность (продуктивность) штамма, другие производственные показатели: Активность субтилизиноподобной протеиназы в культуральной жидкости составляет 0,1 мг/мл.
- Способ, условия и состав сред для длительного хранения штамма:
длительное время хранения (до трех лет) - метод лиофилизации и замораживание культуры с 50% глицерином при минус 80°С. По мере необходимости хранимый штамм обновляют путем его культивирования;
при хранении до года: 1,2 мл 0,7% агара с антибиотиком эритромицином (20 мкг/мл) заливают в пробирки столбиком, посев делается уколом, после выращивания в течение суток при плюс 37°С заливают сверху стерильным вазелиновым маслом (2 мл) и культуру хранят в темноте при комнатной температуре.
- Способ, условия и состав сред для размножения штамма: оптимальная температура роста +37°С. Среда: Лурия-Бертани (LB) (триптон - 1,0; дрожжевой экстракт - 0,5; NaCl - 0,5; рН 8,5) с антибиотиком эритромицином в конечной концентрации 20 мкг/мл. Для создания твердой питательной среды дополнительно вносят 2% агар.
- Оптимальные условия и состав среды для ферментации: 1% глюкозы; 2% пептона; 0,05% MgSO4*7H2O; 0,01% CaCl2*2H2O; 0,01% MnSO4; 0,30% NaCl; 0,01% NH4Cl; 0,04% Na2HPO4; эритромицин 20 мкг/мл; рН 8,5. Культивирование на вибростенде (2…3 с-1) при температуре плюс 30 ± 1°С. Соотношение среда в колбе: воздух равно 1:7,5.
2. Действие субтилизиноподобной протеиназы на кровяные сгустки
Для определения тромболитических свойств протеиназы в чистую пробирку отбирают аликвоту (определенное количество) анализируемой крови, например - крыс. Кровь, в количестве 0,10 мл, смешивают с 0,05 мл раствора тромбина, в концентрации 2,00 мг/мл в 0,14М NaCl. Раствор выдерживают в течение 10 мин в водяном термостате при плюс 37°С и получают сгусток крови. Пробирку со сгустком крови закрывают ватной пробкой. Таким путем заготавливают несколько пробирок со сгустками крови.
К сгустку крови в отдельной пробирке добавляют (предварительно сняв ватную пробку) 0,50 мл раствора препарата заявляемого фермента - субтилизиноподобной протеиназы, в концентрации 0,10 мг/мл раствора препарата. Пробирку закрывают ватной пробкой. Сгусток с ферментом помещают в термостат, куда устанавливают контрольные пробирки со сгустками крови без фермента, но с добавкой NaCl в концентрации 0,14 М. Отмечают время полного лизиса (растворения) сгустков. Полноту лизиса определяют путем выливания содержимого пробирок - с добавленным заявляемым ферментом и контрольных - на бумажные фильтры. Полная, без остатков в виде сгустков крови, фильтрация содержимого пробирки через фильтр свидетельствует о полном лизисе сгустков. Наличие оставшихся на фильтре сгустков свидетельствует о неполноте растворения сгустков крови.
Вышеописанные действия с пробирками со сгустками крови поочередно выполняют, изменяя концентрацию заявляемого фермента, вливаемого в каждую отдельную пробирку со сгустком крови, доведя концентрацию фермента до 0,80 мг/мл.
Показано, что заявляемый фермент субтилизиноподобная протеиназа в концентрации 0,2 и 0,4 мг/мл лизирует (растворяет) тромб за 11000 с (183 мин) и 7500 с (125 мин) соответственно. В этих же концентрациях прототип лизирует тромб за 18000 с (300 мин) и 15200 с (253 мин) соответственно.
Таким образом, доказано наличие у заявляемого фермента лизирующей (растворяющей тромб) способности, причем заявляемый фермент растворяет тромб быстрее прототипа, например, в 1,64 раза (1,64=18000 с/11000 с) при концентрации фермента 0,2 мг/мл и в 2,03 раза (2,03=15200 с/7500 с) при концентрации фермента 0,4 мг/мл. Кроме того, полученные данные показывают, что протеиназа рекомбинантного штамма Bacillus subtilis ЕО-11 ВКПМ В-11978 обладает дозозависимой тромболитической активностью. Это свойство фермента позволяет растворять и удалять образовавшиеся в кровеносных сосудах тромбы.
При увеличении дозы субтилизиноподобной протеиназы расщепление тромба происходит более интенсивно и эффективно, не влияя при этом на состояние свертывающей системы крови. При использовании субтилизиноподобной протеиназы в качестве тромболитического средства сопровождающие применение препарата побочные явления, в том числе возникновение антител к бациллам, не наблюдаются. При применении субтилизиноподобной протеиназы в концентрации менее 0,6 мг/мл препарат нетоксичен для животных.
3. Антикоагулянтные свойства фермента субтилизиноподобная протеиназа
Способность заявляемого фермента предотвращать образование фибриновых сгустков, например в профилактических целях, исследуют с помощью тромбоэластографа (например, фирмы "Hellige", Австрия).
Методика тромбоэластографии позволяет охарактеризовать весь процесс образования сгустка, от момента выпадения первых нитей фибрина до стабилизации сгустка или его лизиса. Для этого в небольшую кювету, например, объемом 50 мл помещают исследуемую пробу (образец), кювету закрывают соприкасающейся с образцом крышечкой, подвешенной на тонкой чувствительной нити. Кювету заставляют совершать непрерывные попеременные вращательные движения по часовой и против часовой стрелки вокруг оси. Пока проба в кювете остается жидкой, вращение не передается на крышку. С момента, когда происходит образование первых нитей фибрина сгустка, начинается передача вращения с кюветы на крышку и, соответственно, на удерживающую крышку в подвешенном состоянии нить. С нити вращение регистрируется и для дальнейшей обработки передается на тромбоэластограф с самописцем. В зависимости от величины поступающего с прибора сигнала меняется амплитуда колебания пишущего пера самописца, рисующего картину, называемую тромбоэластограммой. Схему тромбоэластограммы показывает Фиг. 2, где изображены: по горизонтали - время, по вертикали - величина амплитуды колебаний крышки кюветы с пробой при колебательном вращении кюветы, R - время от момента постановки пробы до начала образования первых нитей фибрина (тромбообразования); K - время от начала образования первых нитей фибрина до достижения сгустком амплитуды 20 мм; α - угол касательной к кривой из точки начала времени образования сгустка; МА - максимальная амплитуда расхождения кривых на тромбоэластограмме; Ly30 - процент, на который уменьшается величина (амплитуда) сгустка в течение 30 мин (min) после достижения MA; I - общий индекс коагуляции. I=160×tg α.
На тромбоэластограмме (Фиг. 2) с некоторого момента наблюдается расхождение охватывающих картину кривых. Момент расхождения кривых соответствует началу образования фибриновых нитей и формированию сгустка. После завершения процесса формирования сгустка вращательные колебания кюветы в полной мере, без проскальзывания, передаются соприкасающейся с пробой (образцом) крышке и далее, в виде электрического сигнала - на тромбоэластограф с самописцем, а пишущее перо самописца рисует картину, где охватывающие кривые представляют прямую на Фиг. 2. В дальнейшем, при растворении сгустка, перо самописца рисует картину, ограничиваемую сходящимися кривыми (Фиг. 2).
По тромбоэластограмме (Фиг. 2) выполняют расчет характеризующих процесс основных параметров): R - время от момента постановки пробы до начала образования первых нитей фибрина (тромбообразования); K - время от начала образования первых нитей фибрина до достижения сгустком амплитуды 20 мм; α - угол касательной к кривой из точки начала времени образования сгустка; МА - максимальная амплитуда расхождения кривых на тромбоэластограмме; LY30 - процент, на который уменьшается величина (амплитуда) сгустка в течение 30 мин (min) после достижения MA; I - общий индекс коагуляции. I=160×tg α.
Для снятия тромбоэластограммы при применении субтилизиноподобной протеиназы используют, например, плазму крови человека, титрованную цитратом натрия (3,8 об.%) в соотношении 9:1. Аликвоту плазмы крови в пробирке, в количестве 0,20 мл, смешивают с 0,10 мл субтилизиноподобной протеиназы в буферном растворе (в концентрациях 0,20 и 0,40 мг/мл протеиназы) и выдерживают в течение 10 мин при температуре плюс 22°С. Затем в пробирку добавляют по 0,06 мл 1,3%-ного раствора CaCl2, тем самым запускают коагуляционный каскад. В контрольные пробирки вместо белка добавляют 0,14 М NaCl. За процессом тромбообразования следят по кривой тромбоэластографа. При инкубации крови с ферментом (субтилизиноподобной протеиназой) сгусток не образуется. Это связано с тем, что добавленная к крови субтилизиноподобная протеиназа разрушает компоненты гемостаза и предотвращает образование сгустка. Результат действия протеиназы во времени подтверждает тромбоэластограмма (Фиг. 3) плазмы крови после инкубации ее (плазмы) с ферментом, где время отложено по горизонтальной оси. На Фиг. 3 изображены: 3-1 - проба без фермента субтилизиноподобная протеиназа (контроль), где ОС-К - Образование Сгустка в Контроле; 3-2 - проба с субтилизиноподобной протеиназой, где ОС-С - Образование Сгустка в присутствии Субтилизиноподобной протеиназы; РФН - растворение фибриновых нитей. R - продолжительность времени от момента постановки пробы до начала образования первых нитей фибрина - тромбообразования; R1 - в контроле (без фермента), R2 - с субтилизиноподобной протеиназой; R1<R2.
На Фиг. 3 видно, что в пробе с субтилизиноподобной протеиназой зона образования сгустка (ОС) существенно (участок ОС-С кратно<ОС-K) меньше, чем в контрольной пробе. Этот участок характеризует максимум динамических свойств соединения фибрина и тромбоцитов посредством факторов свертывания крови и отображает максимальную прочность сгустка. То есть в присутствии в крови продуцируемой Bacillus subtilis ЕО-11 ВКПМ В-11978 субтилизиноподобной протеиназы сгусток (крови) не образуется. Это свойство продуцируемого штаммом фермента позволяет предупредить тромбообразование в кровеносных сосудах организмов.
В опытах с пробой без фермента (контроль) по истечении времени R1 начинается образование сгустка. По истечении времени ОС-K образование сгустка завершается и в дальнейшем масса крови остается в состоянии сгустка. Сгусток сохраняется во времени, то есть растворения фибриновых нитей не происходит. Это подтверждается тем, что на тромбоэластограмме (Фиг. 3-1) амплитуда вращательных колебательных движений крышки кюветы не уменьшается вследствие того, что движения кюветы (с пробой) крышке кюветы передаются без проскальзывания. В кровеносном сосуде такой сгусток был бы тромбом, нарушающим кровоток.
В опытах с содержащей субтилизиноподобную протеиназу пробой по истечении времени R2 также начинается образование сгустка, причем R1<R2. Затем по истечении времени ОС-С образование сгустка прекращается. При этом ОС-K>ОС-С. В дальнейшем начинается растворение фибриновых нитей, разрушение сгустка, масса сгустка крови разжижается, что на тромбоэластограмме (Фиг. 3-2) показывает уменьшение амплитуды колебательных движений крышки кюветы, соприкасающейся с образцом в кювете. То есть при наличии заявляемой субтилизиноподобной протеиназы в пробе начавшееся образование сгустка прекращается, образовавшийся сгусток разрушается. Это подтверждается тем, что на тромбоэластограмме (Фиг. 3-2) уменьшается амплитуда вращательных колебательных движений крышки кюветы вследствие того, что движения кюветы с пробой крышке кюветы передаются с нарастающим проскальзыванием.
Таким образом, доказано, что в условиях in vitro субтилизиноподобная протеиназа рекомбинантного штамма Bacillus subtilis ОЕ-11 ВКПМ В-11978 обладает антикоагулянтной активностью. То есть продуцируемый штаммом Bacillus subtilis ОЕ-11 ВКПМ В-11978 фермент может быть активным ингредиентом медицинских лекарственных средств для предотвращения тромбообразования, например для предотвращения закупорки кровеносных сосудов ног человека при тромбофлебите.
Как видно из приведенных данных, изобретение охватывает область создания и применения препаратов для ферментативного гидролиза образующих тромбы белков. Проявленные и доказанные в опытах свойства предполагаемого изобретения показывают также его полезность для профилактики и/или лечения заболеваний людей в медицине и сельскохозяйственных животных в ветеринарии. Применение продуцируемой штаммом Bacillus subtilis ЕО-11 ВКПМ В-1197 субтилизиноподобной протеиназы - вещества с тромболитическими и антикоагулянтными свойствами - способствует предупреждению тромбообразования в кровеносной системе, например, когда под влиянием внешних воздействий возникает или возрастает опасность образования тромбов. Возможность образования тромбов возрастает, например, при длительном пребывании на ногах работающего человека с нарушенной структурой кровеносных сосудов ног. В последующем образовавшиеся в венах тромбы могут оторваться от стенок кровеносного сосуда, могут быть унесены кровотоком и занесены в сердце, что угрожает летальным исходом.
Уменьшение вероятности тромбообразования, профилактика тромбообразования путем применения продукта жизнедеятельности штамма Bacillus subtilis ЕО-11 ВКПМ В-11978 или растворения образовавшегося тромба на ранних стадиях заболевания способствуют предупреждению опасного заболевания или более раннему началу лечения, когда оно (лечение) наиболее эффективно, производится с меньшей затратой лечебных препаратов, труда и времени медицинских работников, с наименьшим ущербом для здоровья пациентов по сравнению с лечением болезней в поздней, запущенной стадии.
Предлагаемое изобретение удовлетворяет критериям новизны, так как при определении уровня техники не обнаружено средство, которому присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, перечисленным в формуле изобретения, включая характеристику назначения.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. из исследованного уровня техники не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками данного изобретения, и не установлена известность влияния отличительных признаков на указанный технический результат, кроме указанного заявленное техническое решение является не очевидным для специалиста, т.к. обеспечивает разрешение казалось бы неразрешимой проблемы, т.к. одновременно обеспечивает лизис (растворение) образовавшихся тромбов (сгустков крови) в кровеносной системе организмов (обеспечивает тромболитическое свойство) и предупреждение образования тромбов в кровеносной системе организмов (обеспечивает антикоагулянтное свойство).
Заявленное техническое решение можно реализовать в промышленном производстве лекарственных средств, в деятельности организаций здравоохранения, животноводства посредством использования известных стандартных технических устройств и оборудования. Это соответствует критерию «промышленная применимость», предъявляемому к изобретениям.
ИСПОЛЬЗОВАННЫЕ ИСТОЧНИКИ
1. Патент RU №2283863, приоритеты: подача заявки: 23.01.2001; начало действия патента: 23.01.2001; публикация патента: 20.09.2006 Рекомбинантное производное стафилокиназы, его получение и применение // Сонг Хоуян (CN), СонгГ Ганг (CN) / Университет Фудан (CN).
2. Марков В.А., Вышлов Е В. Тромболитическая терапия при инфаркте миокарда. - Томск.: STT, 2011. - С. 148.
3. Патент RU №2259212, приоритеты: подача заявки: 15.03.2002; начало действия патента: 15.03.2002; публикация патента: 27.08.2005. Способ получения фармацевтически активных рекомбинантных белков // Арини Акилле (СН), Копполеккия Раффаэлла (СН), Пагани Франческа Паола (IT), Хербст Детлев (СН), Тоньини Антонио (СН) / Сербиос-Фарма С.А. (СН).
4. Патент RU №2107727, приоритеты: подача заявки: 28.10.1988; публикация патента: 27.03.1998. Рекомбинантный тканевой активатор плазминогена и способ его получения // Ясуси Каваути[JP], Тосиюки Такемото[JP], Макото Такаяма[JP], Масами Екотак[JP], Macao KaTo[JP], Кимио Катсутак[JP], Хироси Гусима[JP]/ Яманути Фармасьютикал Ко., Лтд. (JP).
5. Леонтьев С.Г., Чуриков Д.А. Стрептокиназа и тканевой активатор плазминогена в лечении массивной легочной эмболии. Что эффективнее? Флебология, 2001. - №13. - С. 24.
6. Патент RU №2127758, приоритеты: подача заявки: 03.04.1995; публикация патента: 20.03.1999. Способ получения рекомбинантной стрептокиназы // Хоуйан Сонг (CN) / Шангай Медикал Юниверсити (CN).
7. Справка о депонировании культуры Bacillus subtilis ЕО-11. Регистрационный номер ВКПМ: В-11979. Дата депонирования 10 декабря 2014 г.
8. Rebrikov D.V., Akimkina T.V., Shevelev А.В., Demiduyk I.V., Bushueva A.M., Kostrov S.V., Chestukhina G.G., Stepanov V.M. Molecular cloning and nucleotide sequence of Bacillus intermedius glutamylendopeptidase gene. J. Prot. Chem, 1999. - V. 18. - P. 21-26.
9. Wray G. A. The evolutionary significance of cis-regulatory mutations. Nature Reviews Genetics, 2007. - V. 8(3). - P. 206-216.
10. Anagnostopoulos C, Spizizen J. Requirements for transformation in Bacillus subtilis. J Bacteriol, 1961. - V.81. - №5. - P. 741-746.
11. Фритц Дж., Гьертде Д., Поланд К. Ионная хроматография. - М.: Мир, 1984. - С. 221.
12. Скоупс Р. Методы очистки белков. - М.: Мир, 1985. - С. 358.