КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки США, серийный номер 61/536824, поданной 20 сентября 2011, и предварительной заявки США, серийный номер 61/537229, поданной 21 сентября 2011, которые включены в описание посредством ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее раскрытие относится к применению композиции для лечения аутоиммунного заболевания. Более подробно, композиция включает комбинацию антибиотиков, которые можно использовать для лечения аутоиммунных заболеваний, включая рассеянный склероз.
УРОВЕНЬ ТЕХНИКИ
Рассеянный склероз (РС) представляет собой хроническое аутоиммунное и демиелинизирующее заболевание, которое поражает главным образом центральную нервную систему. РС характеризуется инфильтрацией миелин-специфических CD4+ T-клеток, которые поражают миелиновую оболочку аксонов и другие элементы центральной нервной системы (ЦНС), разрушая миелин и базальный аксон.
Авторы настоящего изобретения обнаружили, что комбинация антибиотиков, применяемая ранее в лечении воспалительных заболеваний кишечника, влияет на воспалительную реакцию субъекта, имеющего аутоиммунное заболевание, включая РС и другие аутоиммунные заболевания.
Любое обсуждение документов, актов, веществ, устройств, статей и т.п., которые включены в настоящее описание, не следует принимать как признание, что любой материал или все указанные материалы создают часть известного уровня техники, или что они представляли собой общедоступные сведения в области, относящейся к настоящему раскрытию, из-за того, что они существовали до даты приоритета каждого пункта формулы настоящей заявки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрытие предоставляет комбинацию рифабутина, кларитромицина и клофазимина для лечения аутоиммунного заболевания.
Раскрытие в одном аспекте предоставляет композицию, содержащую рифабутин, кларитромицин и клофазимин, для лечения аутоиммунного заболевания.
Настоящее раскрытие также предоставляет композицию, содержащую рифабутин, кларитромицин и клофазимин, для лечения рассеянного склероза.
В другом аспекте предоставляется композиция, содержащая рифабутин, кларитромицин и клофазимин, для лечения аутоиммунного заболевания.
В другом аспекте предоставляется композиция, содержащая рифабутин, кларитромицин и клофазимин, для лечения рассеянного склероза (РС).
В другом аспекте предоставляется композиция, содержащая комбинацию антибиотических средств для лечения рассеянного склероза, указанная композиция содержит рифабутин, кларитромицин и клофазимин.
В другом аспекте предоставляется композиция, содержащая комбинацию двух или более антибиотических средств для лечения аутоиммунного заболевания, указанные два или более антибиотических средств выбирают из рифабутина, клофазимина и по меньшей мере одного макролида.
В другом аспекте предоставляется композиция, содержащая комбинацию двух или более антибиотических средств для лечения аутоиммунного заболевания, указанные два или более антибиотических средств выбирают из рифабутина, клофазимина и кларитромицина.
В другом аспекте предоставляется композиция, содержащая комбинацию двух или более антибиотических средств для лечения аутоиммунного заболевания, указанные два или более антибиотических средств выбирают из клофазимина, кларитромицина и по меньшей мере одного антибиотика, обладающего бактерицидной активностью.
В другом аспекте настоящее раскрытие предоставляет способ лечения аутоиммунного заболевания у пациента, включающий введение композиции, содержащей рифабутин, кларитромицин и клофазимин, указанному пациенту.
В другом аспекте предоставляется способ лечения пациента, имеющего аутоиммунное заболевание, и имеющего инфекцию, или восприимчивого к инфекции, вызываемой Mycobacterium, включающий введение пациенту композиции, содержащей рифабутин, кларитромицин и клофазимин.
В другом аспекте предоставляется способ лечения пациента, имеющего рассеянный склероз, указанный пациент также имеет положительный результат теста на определение микобактериальной инфекции, включающий введение пациенту композиции, содержащей рифабутин, кларитромицин и клофазимин.
В другом аспекте настоящее раскрытие предоставляет способ лечения аутоиммунного заболевания у пациента, включающий введение композиции, содержащей комбинацию антибиотиков, выбранных из группы, включающей рифабутин, кларитромицин, и клофазимин, указанному пациенту.
В другом аспекте настоящее раскрытие предоставляет способ лечения рассеянного склероза у пациента включающий введение композиции, содержащей комбинацию антибиотиков, выбранных из группы, включающей рифабутин, кларитромицин и клофазимин, указанному пациенту.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
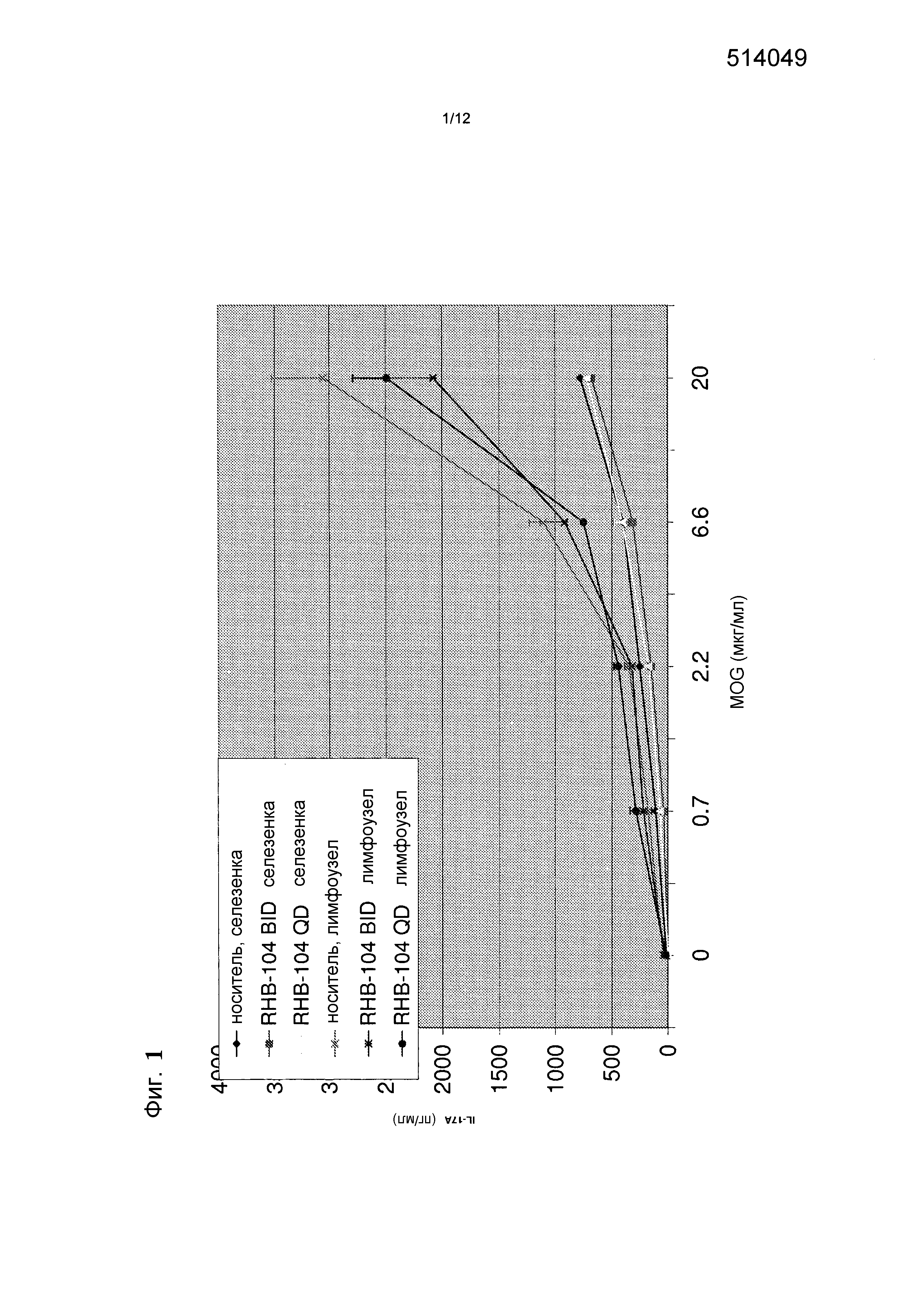
Фигура 1 представляет собой график, демонстрирующий эффекты введения RHB 104 на концентрацию цитокина IL-17 в мышиной модели;
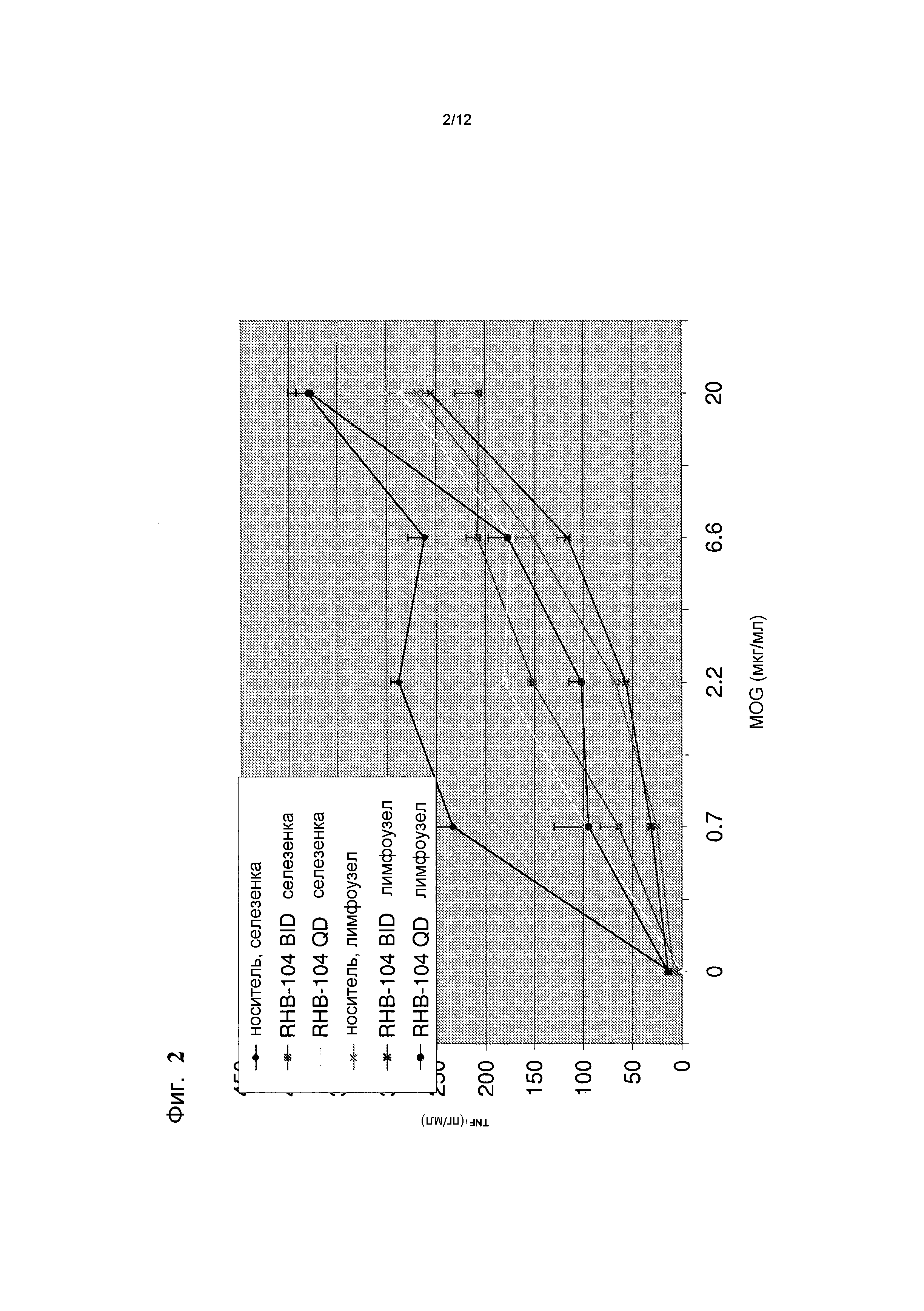
Фигура 2 представляет собой график, демонстрирующий эффекты введения RHB 104 на концентрацию цитокина TNF-альфа в мышиной модели;
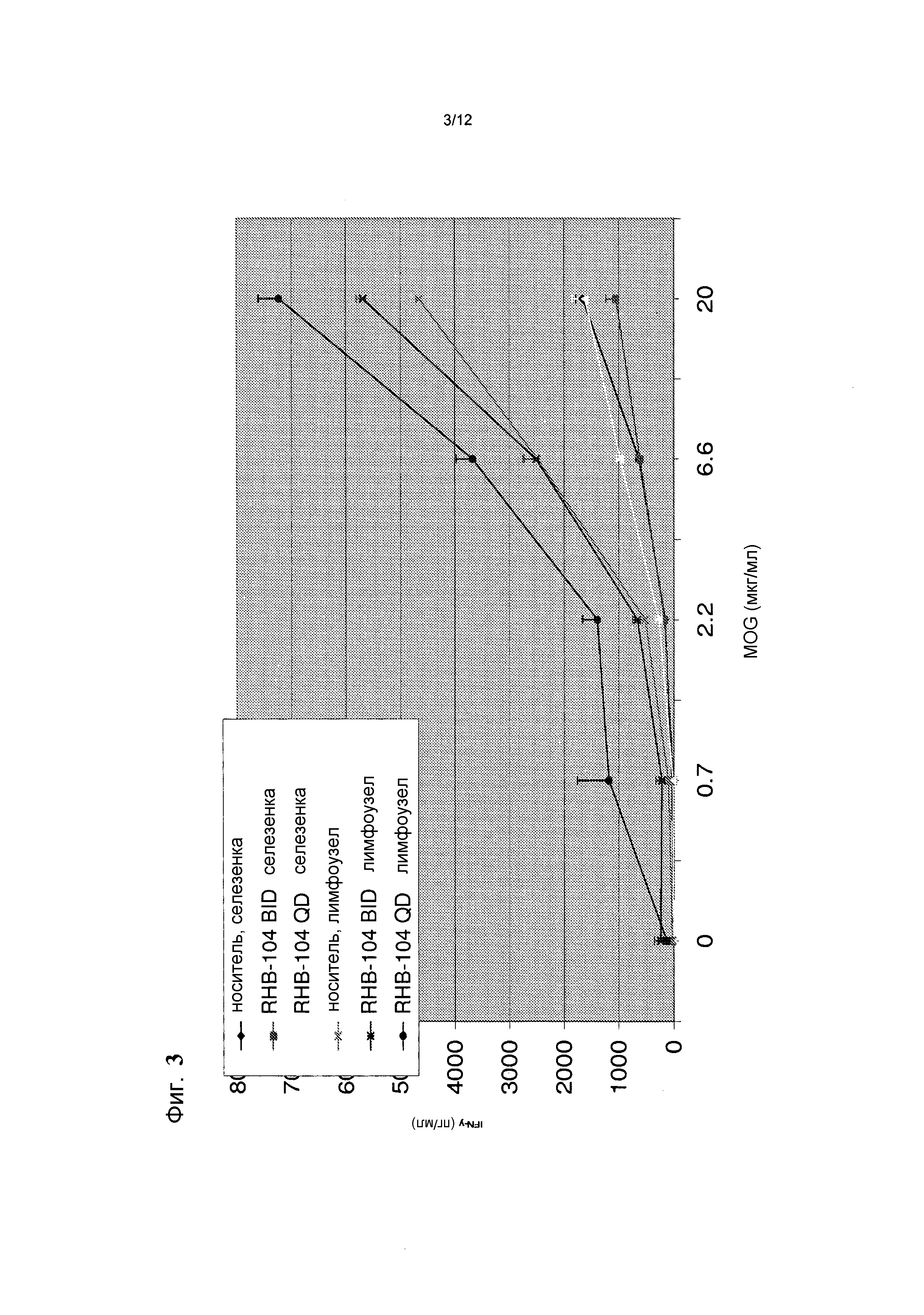
Фигура 3 представляет собой график, демонстрирующий эффекты введения RHB 104 на концентрацию цитокина IFN-гамма в мышиной модели;
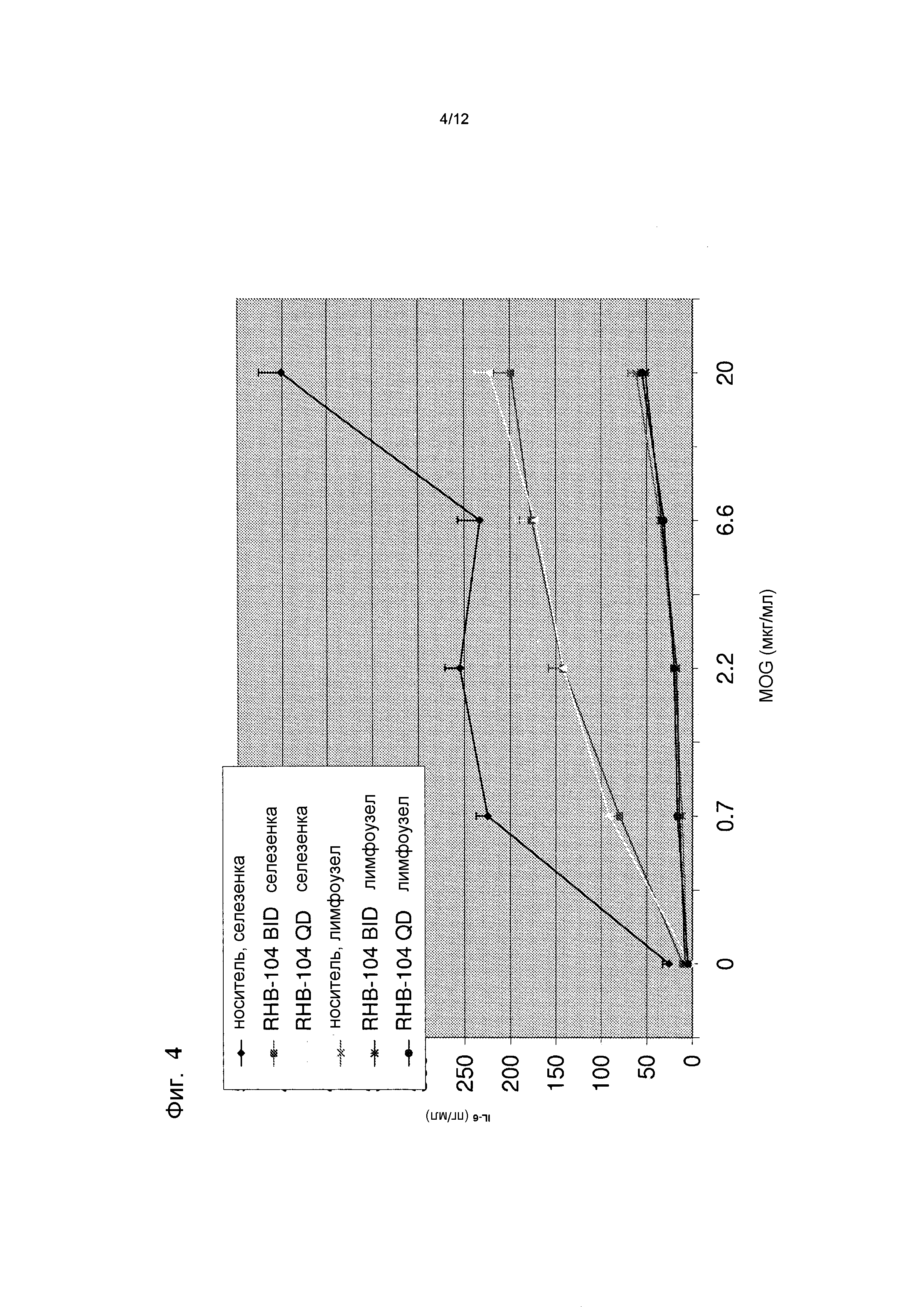
Фигура 4 представляет собой график, демонстрирующий эффекты введения RHB 104 на концентрацию цитокина IL-6 в мышиной модели;
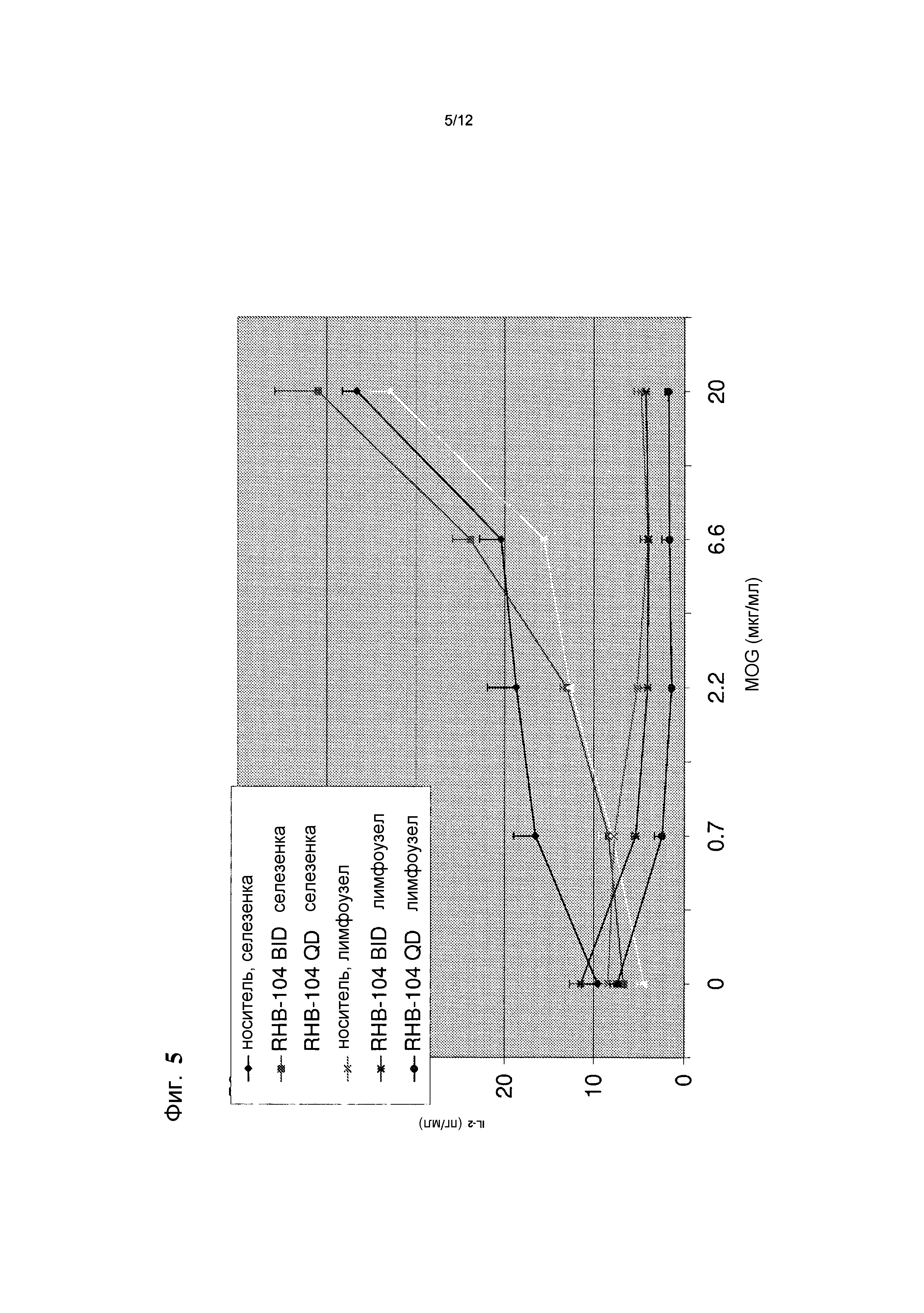
Фигура 5 представляет собой график, демонстрирующий эффекты введения RHB 104 на концентрацию цитокина IL-2 в мышиной модели;
Фигура 6 представляет собой график, демонстрирующий тяжесть EAE в различных группах лечения в общепринятой мышиной модели РС;
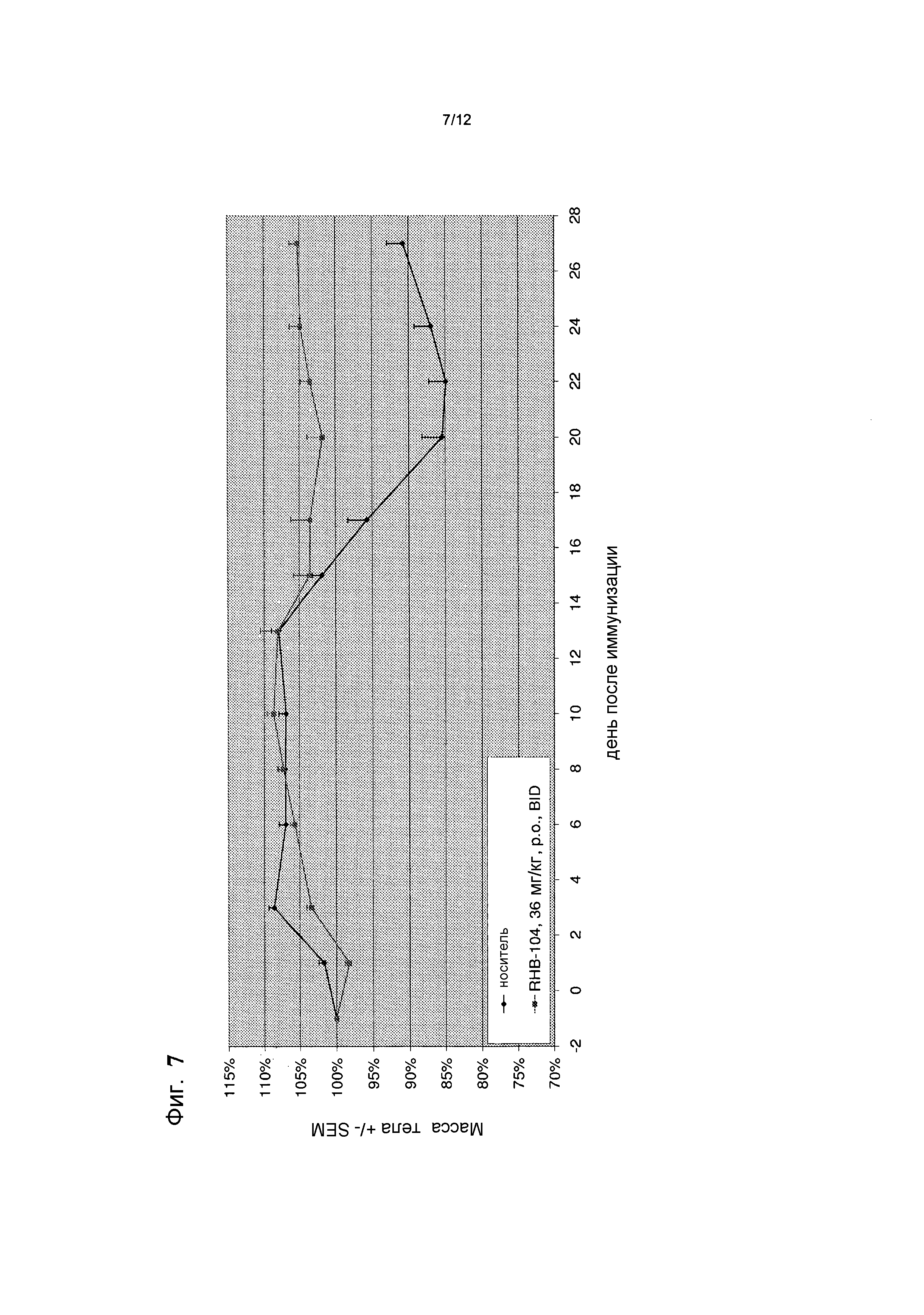
Фигура 7 представляет собой график, демонстрирующий изменение массы тела в различных группах лечения в общепринятой мышиной модели РС;
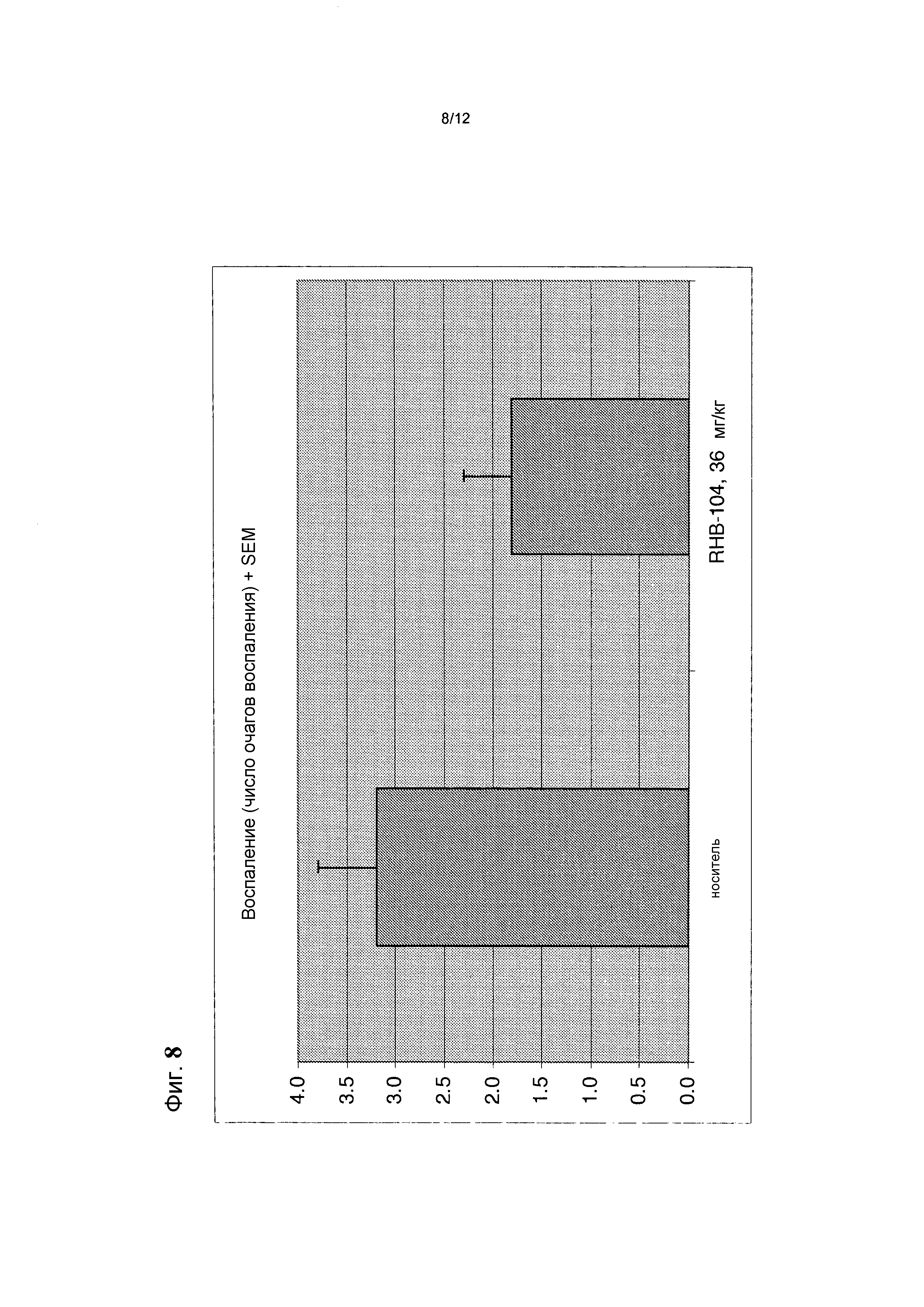
Фигура 8 представляет собой график, демонстрирующий среднее количество очагов воспаления, обнаруживаемых гистологически (в срезах H&E) в контрольной группе и в группе лечения в общепринятой мышиной модели РС;
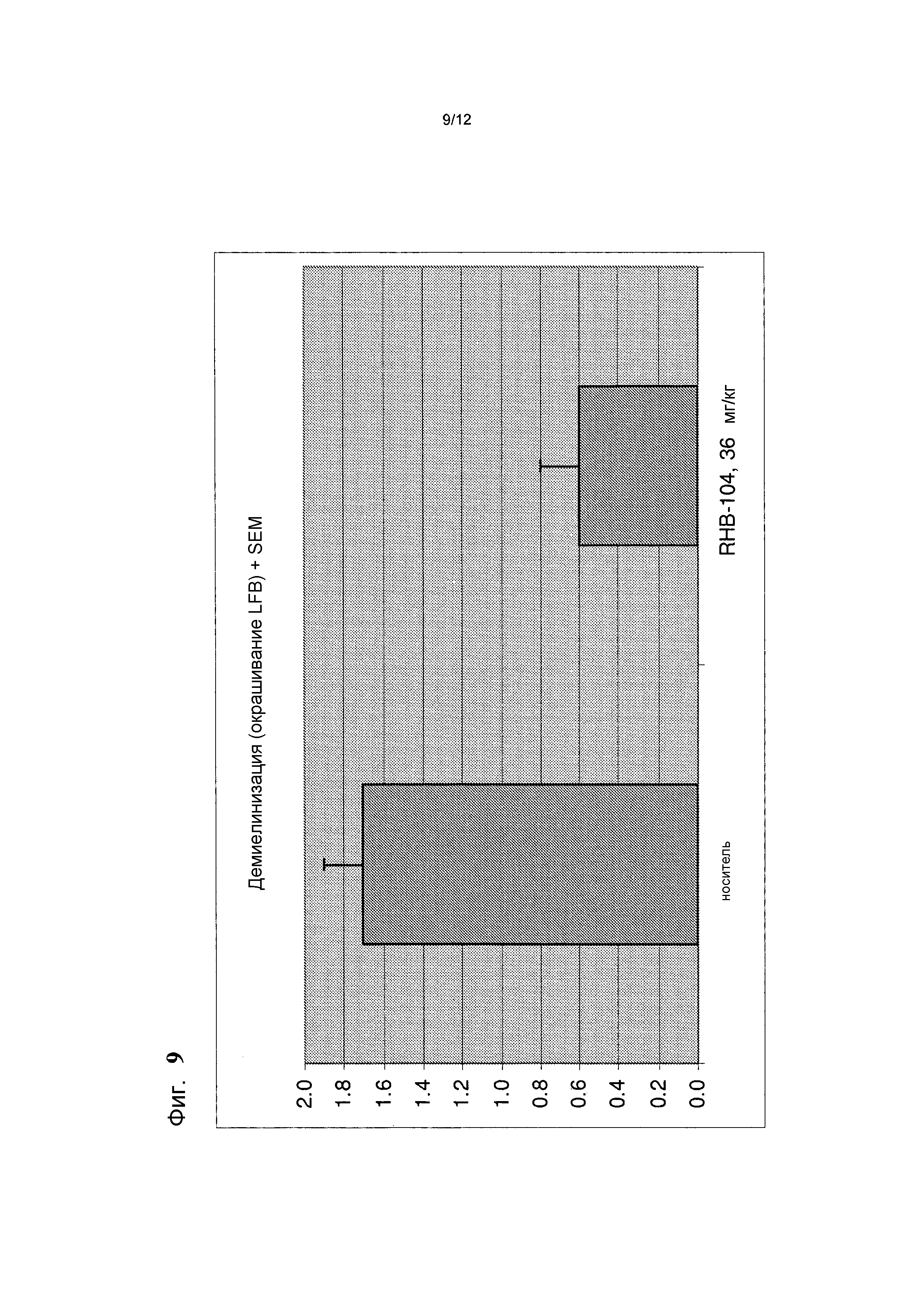
Фигура 9 представляет собой график 9, на котором представлена средняя оценка демиелинизации, полученная в результате гистологического анализа (на основании срезов, окрашенных красителем люксолом быстрым голубым) в контрольной группе и в группе лечения в общепринятой мышиной модели РС;
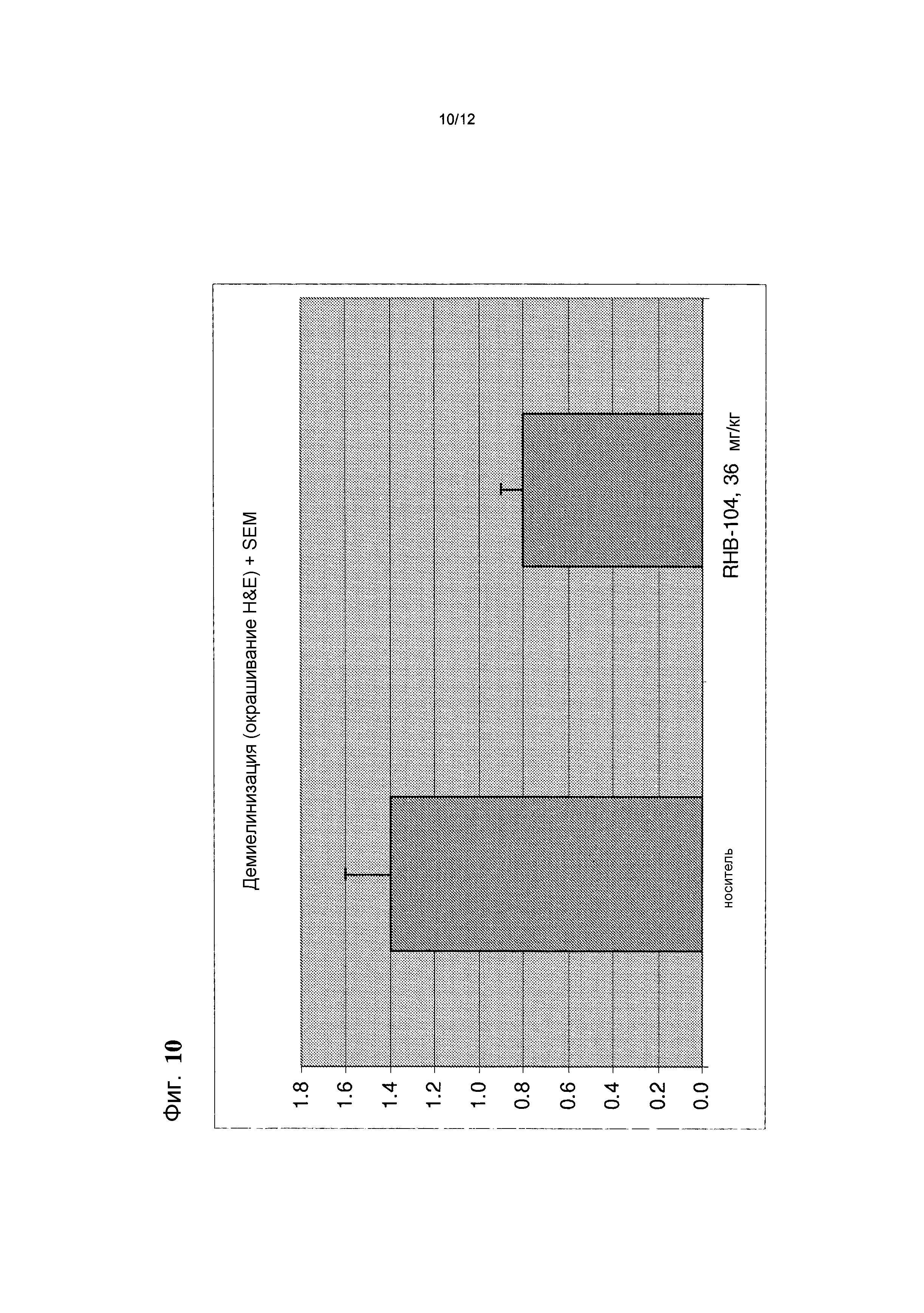
Фигура 10 представляет собой график, на котором представлена средняя оценка демиелинизации, полученная гистологически (на основании срезов H&E) в контрольной группе и в группе лечения в общепринятой мышиной модели РС;
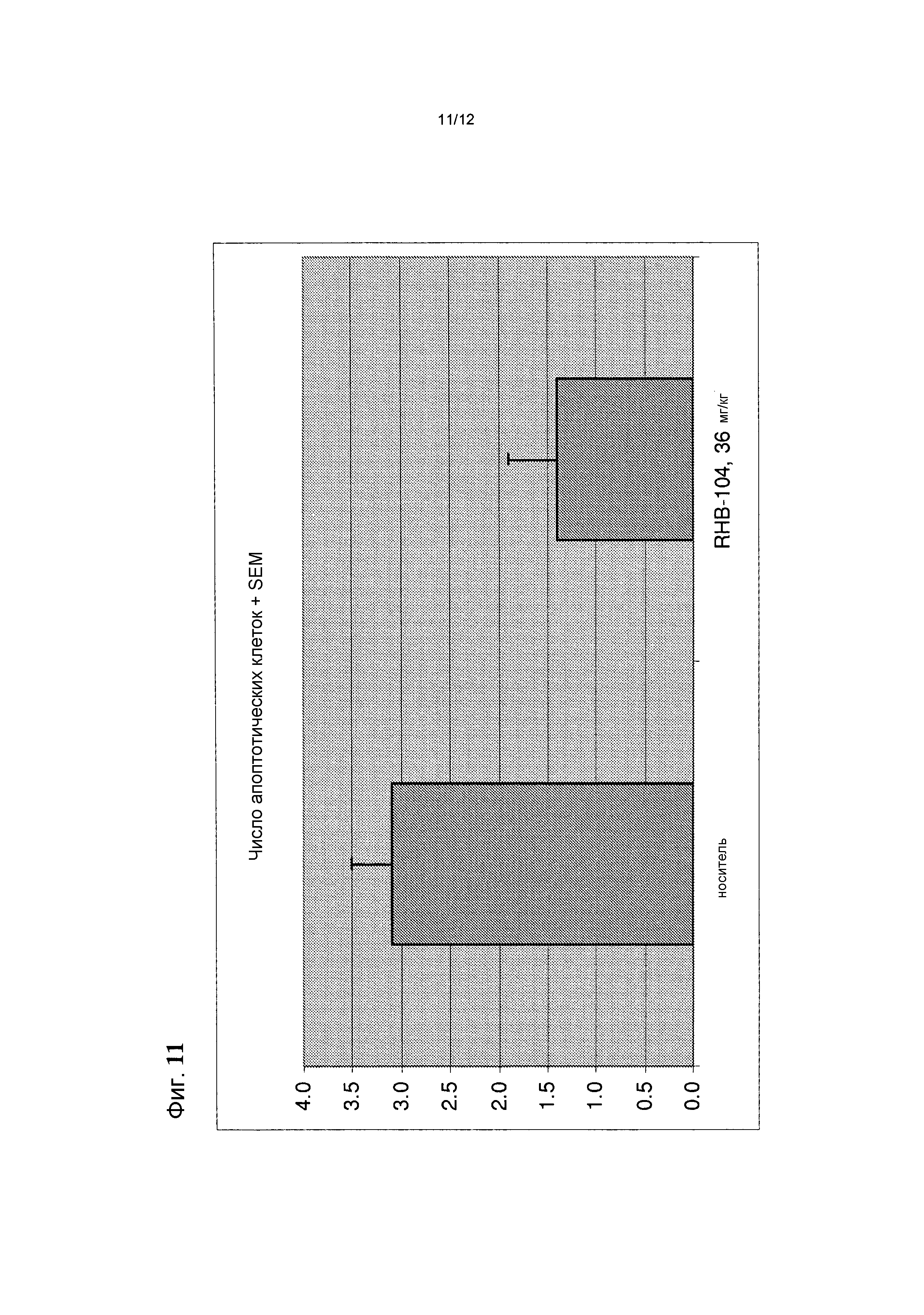
Фигура 11 представляет собой график, на котором показано среднее количество апоптотических клеток, определяемых гистологически (в срезах H&E) в контрольной группе и в группе лечения в общепринятой мышиной модели РС; и
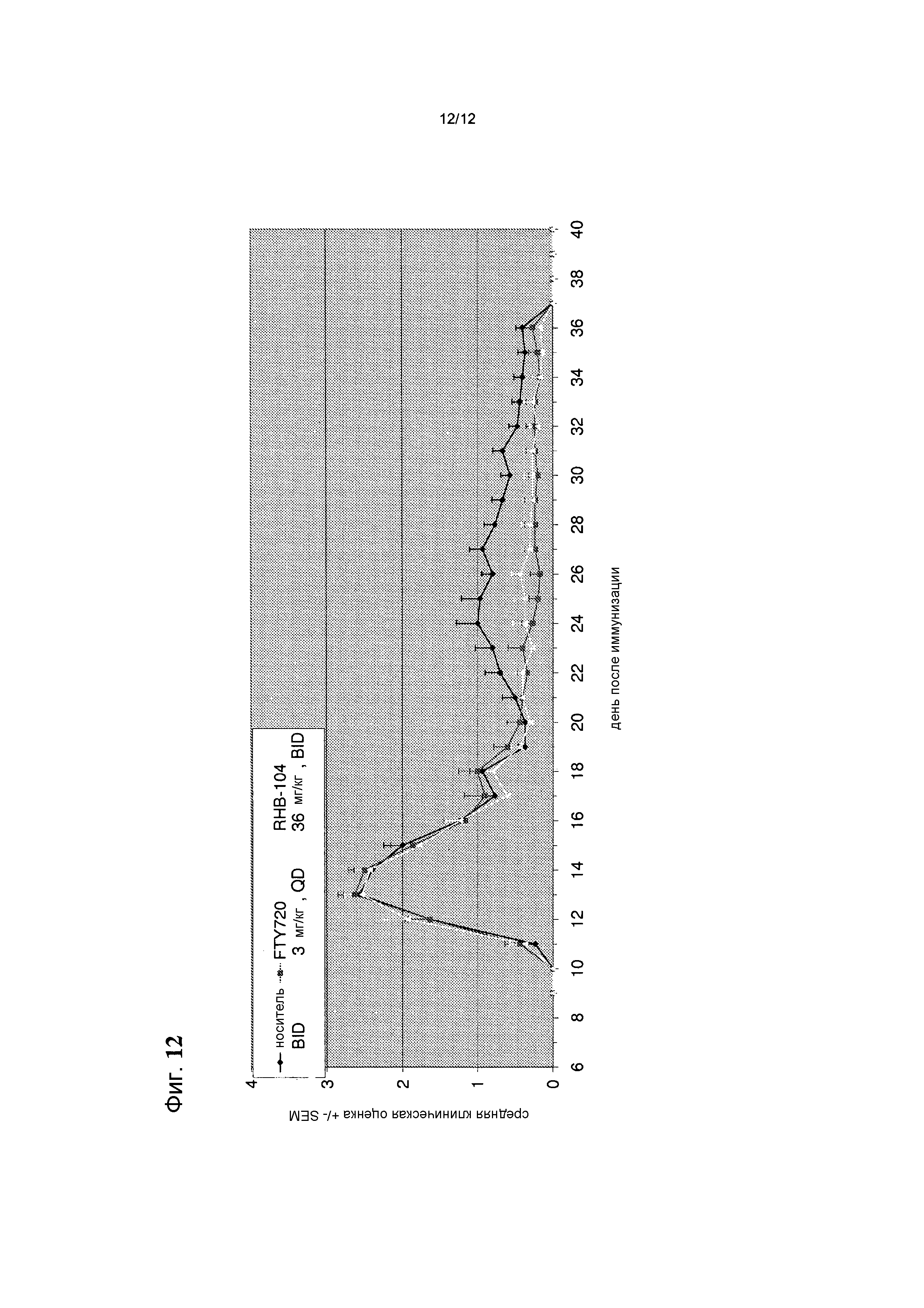
Фигура 12 представляет собой график, на котором показана тяжесть рецидива заболевания в различных группах лечения в общепринятой мышиной модели.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ РАСКРЫТИЯ
Термин "рассеянный склероз", также включает варианты рассеянного склероза, такие как оптиконевромиелит (болезнь Девика), диффузный склероз, транзиторный склероз, острый рассеянный энцефаломиелит и неврит зрительного нерва.
Применение термина "субъект" охватывает как человека, так и животных.
"Лечение" означает, что достигается по меньшей мере уменьшение интенсивности симптомов, ассоциированных с состоянием (например, с РС), поражающим субъекта, где уменьшение интенсивности используют в широком смысле для обозначения по меньшей мере уменьшения величины параметра, например, симптома, ассоциированного с состоянием, которое лечат. По существу, лечение также включает ситуации, в которых состояние или по меньшей мере симптомы, ассоциированные с ним, полностью подавляют, например, предотвращают появление, или останавливают, например, прекращают, так что субъект уже не страдает от состояния, или по меньшей мере симптомов, которые характеризуют состояние. "Лечение" также включает предотвращение эпизода обострения у субъекта или в случае, если эпизод обострения имеет место, то термин "лечение" следует понимать, как указано выше.
Согласно заявленным способам можно лечить различных субъектов. Во многих вариантах осуществления субъекты являются "млекопитающими", в тех случаях, когда указанные термины используют в широком смысле для описания организмов, которые относятся к классу млекопитающих, включающему отряд плотоядных (например, собаки и кошки), отряд грызунов (например, мыши, морские свинки и крысы), и отряд приматов (например, человек, шимпанзе и обезьяны). Во многих вариантах осуществления субъекты представляют собой человека. Наряду с тем, что настоящее изобретение можно использовать для лечения субъекта-человека, следует понимать, что заявленные способы также можно осуществить в отношении других субъектов-животных, таких как, но без ограничения мыши, крысы, собаки, кошки, домашний скот, лошади и т.д. Соответственно следует понимать, что любой субъект, который нуждается в лечении согласно рассматриваемому изобретению, является подходящим.
Кроме того, подходящие субъекты настоящего изобретения включают субъектов, которые ранее имели или не имели какое-либо состояние, у которых ранее был выявлен риск возникновения состояния, и субъектов, у которых первично диагностировано или выявлено текущее поражение каким-либо состоянием или наличие какого-либо состояния.
Лечение можно оценить с помощью одного или более критериев. Оценка указанного лечения может быть либо количественной, либо качественной, либо как количественной, так и качественной. Оценка лечения может быть осуществлена на основе клинической шкалы тяжести заболевания. У субъектов, получающих лечение по поводу аутоиммунного заболевания, такого как РС, лечение можно оценить с помощью нескольких шкал, таких как Расширенная шкала инвалидизации (EDSS), Индекс ходьбы (AI) или Шкала оценки неврологического статуса Скриппса (SNRS).
Оценка лечения может включать оценку одного или более симптомов, ассоциированных с определенным заболеванием. В примере РС симптомы включают: слабость и/или онемение одной или более конечностей; покалывание в конечностях и ощущения скованности в теле или конечностях; приволакивание или неудовлетворительный контроль одной или обеих ног вплоть до спастического или атаксического пареза; гиперактивные сухожильные рефлексы; исчезновение брюшных рефлексов; симптом Лермитта; ретробульбарный неврит или неврит зрительного нерва; неустойчивость при ходьбе; симптомы поражения ствола мозга (диплопия, головокружение, рвота); нарушения мочеиспускания; гемиплегия; невралгия тройничного нерва; другие болевые синдромы; нистагм и атаксия; атаксия мозжечкового типа; триада Шарко; диплопия; билатеральная межъядерная офтальмоплегия; миокимия или паралич мышц лица; глухота; звон в ушах; неоформленные слуховые галлюцинации; головокружение и рвота; транзиторная лицевая потеря чувствительности или невралгия тройничного нерва; дисфункция мочевого пузыря; эйфория; депрессия; деменция, тупая ноющая боль в пояснице; острые, жгучие, плохо локализуемые боли в конечности или в обеих ногах и опоясывающие боли; внезапные обострения неврологического расстройства; дизартрия и атаксия; пароксизмальная боль и дизестезия в конечности; вспышки света; пароксизмальный зуд; и/или тонические судороги, принимающие форму сгибательного (дистонического) спазма руки, кисти, и локтя с распрямлением нижней конечности.
При РС уменьшение интенсивности симптомов заболевания также включает уменьшение числа эпизодов воспаления ("эпизод" включает любое указанное выше клиническое проявление или комбинацию по меньшей мере указанных выше клинических проявлений), замедление прогрессирования заболевания, или уменьшение/замедление появления повреждений мозга (идентифицируемых с помощью магнитно-резонансной томографии). Рекуррентность заболеваний, включая РС, можно улучшить путем снижения тяжести симптомов (например, симптомов, описанных выше), ассоциированных с эпизодом РС, или путем удлинения периода времени между появлением эпизодов.
При РС и ассоциированных заболеваниях, также можно использовать количественный анализ для оценки лечения. Примеры методик количественного анализа включает идентификацию биологических маркеров. Примеры включают, но без ограничения биомаркеры, которые отражают изменение иммунной системы; биомаркеры нарушения гематоэнцефалического барьера, демиелинизации, оксидативных состояний и эксайтотоксичности, глиоза или ремиелинизации и восстановления. Можно оценить панель различных маркеров, которая отображает различные стадии заболевания, включая различные стадии воспаления, демиелинизации, аксональной дегенерации и ремиелинизации.
Следует понимать, что оценка лечения может быть получена в результате нескольких способов и может основываться как на клиническом проявлении, так и на анализе различных неклинических маркеров, таких как биомаркеры. При заболеваниях, таких как РС, которые являются комплексными заболеваниями с несколькими патофизиологическими механизмами, которые неоднородны в подгруппах пациентов с РС, необходимо оценивать виды лечения на основе различных и отличающихся критериев и маркеров, и следует понимать, что приведенные выше примеры оценки лечения не составляют полный перечень, но лишь дают пример способов, с помощью которых можно оценить лечение.
Следует понимать, что в настоящем описании слово "включать" или его варианты, такие как "включает" или "включающий", подразумевают включение указанного элемента, целого числа или стадии, или группы элементов, целых чисел или стадий, но не исключение любого другого элемента, целого числа или стадии или группы элементов, целых чисел или стадий.
Композиция настоящего раскрытия также может включать по меньшей мере один антибиотик, активный в отношении грамположительных бактерий "Грамположительный антибиотик". Грамположительный антибиотик можно выбрать из одного или более антибиотиков группы, включающей даптомицин, клиндамицин, рифампицин, эритромицин, олеандомицин, рокситромицин, азитромицин, канамицин, гентамицин, тобрамицин, стрептомицин, неомицин, паромомицин, этамбутол, изониазид, миноциклин, тетрациклин.
Термин "один или более" антибиотических средств включает, но без ограничения один, два, три, четыре, пять, шесть и т.д. антибиотических средств. Следует понимать, что специалист в данной области может эмпирически определить конкретное число антибиотических средств, необходимых для применения согласно вариантам осуществления, предложенным в описании и известным в данной области.
Настоящие композиции можно использовать для лечения пациента, имеющего аутоиммунное заболевание, где указанный пациент также имеет положительные результаты тестов на инфекцию, вызываемую бактерией Mycobacterium avium paratuberculosis (MAP).
Аутоиммунное заболевание может представлять собой рассеянный склероз.
Более того, аутоиммунное заболевание может представлять собой тиреоидит Хашимото, синдром Мелькерссона-Розенталя, саркоидоз или другие сходные заболевания.
В другом варианте осуществления термин “аутоиммунное заболевание” включает любое заболевание из большой группы заболеваний, характеризующихся аномальным функционированием иммунной системы, приводящим к образованию антител против собственной ткани.
Раскрытые антибиотики или композиции можно ввести перорально. Альтернативно антибиотики можно ввести внутривенно.
Рассматриваются другие пути введения, включая, но без ограничения внутримышечный и внутрикостный пути.
Каждый антибиотик можно ввести по отдельности. Альтернативно два или более антибиотиков можно ввести вместе.
В одном варианте осуществления композиции, предлагаемые в описании, включают по меньшей мере два антибиотических средства, которые совместно включают в одну лекарственную форму. В другом варианте осуществления композиция, предлагаемая в описании, содержит по меньшей мере три антибиотика, которые совместно включают в одну лекарственную форму.
В одном варианте осуществления каждый из антибиотиков рифабутин, кларитромицин и клофазимин совместно включают в одну лекарственную форму.
Альтернативно каждый антибиотик можно включить в лекарственную форму отдельно от других антибиотических средств. В указанном варианте осуществления предусматривается, что отдельные лекарственные формы будут упакованы вместе в наборе, обычно чтобы обеспечить одновременный прием пациентом каждой из лекарственных форм. В другом варианте осуществления два антибиотических средства могут быть включены в одну первую лекарственную форму и оставшееся антибиотическое средство(а) может быть отдельно включено во вторую лекарственную форму, которую нужно принимать вместе с первой лекарственной формой.
В одном варианте осуществления настоящие антибиотики и композиции могут предоставляться в форме таблетки, содержащей по меньшей мере один антибиотик из рифабутина, кларитромицина, и клофазимина в порошкообразной форме. В ряде случаев два или все три препарата, выбранные из рифабутина, кларитромицина и клофазимина, представлены в порошкообразной форме. Альтернативно настоящие композиции могут быть представлены в виде капсулы в форме таблетки, содержащей по меньшей мере одно вещество, выбранное из рифабутина, кларитромицина и клофазимина в микроинкапсулированной форме. В одном варианте осуществления два или все препараты, выбранные из рифабутина, кларитромицина и клофазимина, находятся в микроинкапсулированной форме.
В другом варианте осуществления настоящие композиции могут быть представлены в виде капсулы в форме таблетки, содержащей по меньшей мере один антибиотик, выбранный из рифабутина, кларитромицина и клофазимина в порошкообразной форме, и остальные вещества, представленные в микроинкапсулированной форме. В качестве дополнительной возможности, настоящие композиции могут быть представлены в виде капсулы в форме таблетки, содержащей одно вещество или более из рифабутина, кларитромицина и клофазимина, представленных в микрогранулированной форме. В дополнительных вариантах осуществления настоящие композиции могут быть представлены в форме таблетки, содержащей одно или более веществ, выбранных из рифабутина, кларитромицина и клофазимина, внутри капсулы; капсулы, содержащей одно или более веществ, выбранных из рифабутина, кларитромицина и клофазимина внутри таблетки; капсулы, содержащей одно или больше веществ, выбранных из рифабутина, кларитромицина и клофазимина, внутри внешней капсулы, содержащей другие вещества, или любую комбинацию из указанных выше.
В другом варианте осуществления настоящие композиции включают внутреннюю капсулу, содержащую рифабутин, внутри внешней капсулы, содержащей кларитромицин и клофазимин, где кларитромицин и клофазимин могут быть представлены в порошкообразной, микроинкапсулированной, или микрогранулированной формах. Более того, настоящие композиции могут содержать формы, включенные в липосомы, не инкапсулированные формы или включенные в липосомы формы с полимерным покрытием.
Настоящие способы можно осуществить путем введения одной или более таблеток/капсул, содержащих рифабутин, кларитромицин и клофазимин, как описано выше, или путем введения каждого из указанных антибиотиков отдельно. В предпочтительных вариантах осуществления рифабутин, кларитромицин, и клофазимин вводят одновременно в одной дозе.
Настоящие композиции можно получить с помощью способов, известных в данной области для получения фармацевтических композиций, включая смешивание на блендере, измельчение, гомогенизацию, суспендирование, растворение, эмульгирование, диспергирование и, когда уместно, смешивание рифабутина, кларитромицина и клофазимина вместе с выбранными вспомогательными веществами, разбавляющими веществами, носителями и активирующими веществами.
В случае перорального введения настоящие композиции могут быть представлены в форме таблеток, пастилок, пилюль, лепешек, капсул, эликсиров, порошков, включая лиофилизированные порошки, растворов, гранул, суспензий, эмульсий, сиропов и настоек. Настоящие композиции могут включать формы с замедленным высвобождением, или формы с отсроченным высвобождением лекарственного вещества, например, в форме покрытых частиц, многослойных таблеток или микрогранул.
Твердые формы настоящих композиций для перорального введения могут содержать фармацевтически приемлемые связывающие вещества, подсластители, дезинтегрирующие вещества, разбавляющие вещества, ароматизаторы, покрывающие вещества, консерванты, лубриканты, и/или вещества, замедляющие высвобождение. Подходящие связывающие вещества включают аравийскую камедь, желатин, кукурузный крахмал, трагакантовую камедь, альгинат натрия, карбоксиметилцеллюлозу или полиэтиленгликоль (PEG). Подходящие подсластители включают сахарозу, лактозу, глюкозу, аспартам или сахарин. Подходящие дезинтегрирующие вещества включают кукурузный крахмал, метилцеллюлозу, поливинилпирролидон, ксантановую смолу, бентонит, альгиновую кислоту или агар. Подходящие разбавляющие вещества включают лактозу, сорбит, маннит, декстрозу, каолин, целлюлозу, карбонат кальция, силикат кальция или дикальция фосфат. Подходящие вкусовые добавки включают мятное масло, винтергреновое масло, ароматизатор со вкусом вишни, апельсина или малины. Подходящие покрывающие вещества включают полимеры или сополимеры акриловой кислоты и/или метакриловой кислоты и/или их сложные эфиры, воски, жирные спирты, зеин, шеллак или глютен. Подходящие консерванты включают бензоат натрия, витамин E, альфа-токоферол, аскорбиновую кислоту, метилпарабен, пропилпарабен или бисульфат натрия. Подходящие лубриканты включают стеарат магния, стеариновую кислоту, олеат натрия, хлорид натрия или тальк. Подходящие вещества, замедляющие высвобождение, включают глицерилмоностеарат или глицерилдистеарат.
Жидкие формы настоящих композиций для перорального введения могут содержать, в дополнение к указанным выше веществам, жидкий носитель. Подходящие жидкие носители включают воду, масла, такие как оливковое масло, арахисовое масло, кунжутное масло, подсолнечное масло, сафлоровое масло, ореховое масло, кокосовое масло, жидкий вазелин, этиленгликоль, пропиленгликоль, полиэтиленгликоль, этанол, пропанол, изопропанол, глицерин, жирные спирты, триглицериды или их смеси.
Суспензии настоящих композиций для перорального введения могут также включать диспергирующие вещества и/или суспендирующие вещества. Подходящие суспендирующие вещества включают такие вещества как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметил-целлюлоза, поливинилпирролидон, альгинат натрия или цериловый спирт. Подходящие диспергирующие вещества включают лецитин, полиоксиэтиленовый эфиры жирных кислот, таких как стеариновая кислота, полиоксиэтиленсорбит моно- или ди- олеат, -стеарат или -лаурат, полиоксиэтиленсорбитан моно- или ди- олеат, -стеарат или -лаурат и т.п.
Эмульсии настоящих композиций для перорального введения могут также включать одно или более эмульгирующих веществ. Подходящие эмульгирующие вещества включают диспергирующие вещества, в соответствии с примерами, приведенными выше, или природные камеди, такие как аравийская камедь или трагакантовая камедь.
Каждый антибиотик можно вводить ежедневно. Альтернативно каждый антибиотик можно вводить два раза в день. В другом варианте осуществления каждый антибиотик можно вводить три раза в день. В другом варианте осуществления каждый антибиотик можно вводить исходя из изложенного: каждые 3 часа, каждые 4 часа, каждые 5 часов, каждые 6 часов, каждые 7 часов, каждые 8 часов, каждые 9 часов, каждые 10 часов, каждые 11 часов или каждые 12 часов. Введение указанных антибиотиков может происходить в течение периода времени продолжительностью 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель или больше. Следует учитывать, что период лечения может продолжаться в течение 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или больше.
Доза кларитромицина может составлять от 250 мг до 1,5 г в день, чаще приблизительно 950 мг в день. Указанные 950 мг можно вводить в 95 мг капсулах, при этом требуется десять капсул в день. Типичная доза рифабутина составляет от 150 мг до 750 мг в день, чаще приблизительно 450 мг в день. Типичная доза клофазимина составляет от 50 до 500 мг в день. Обычно доза клофазимина составляет приблизительно 100 мг/день. Указанные 100 мг можно вводить в 10 мг капсулах, десять раз в день. Дозу клофазимина также можно рассчитать по массе, и она может составлять приблизительно от 1 мг/кг до 6 мг/кг, чаще приблизительно 2 мг/кг.
Для детей предусмотрены следующие дозы (в мг/день):
|
В другом варианте осуществления нарастающая дозировка у детей может представлять собой дозировку, которая представлена ниже.
Например:
Масса ребенка 15-29,9 кг
Недели 1, 2&3 = 1 капсула в день
Недели 4&5 = 1 капсула два раза в день (BID)
Недели 6&7 = 3 капсулы в день
Недели 8 и позже = 2 капсулы два раза в день (BID)
Вес ребенка 30-45 кг
Неделя 1 = 1 капсула в день
Недели 2&3 = 1 капсула два раза в день (BID)
Недели 4&5 = 3 капсулы в день
Недели 6&7 = 2 капсулы два раза в день (BID)
Недели 8 и позже = 5 капсул в день
Вес ребенка >45 кг
Неделя 1 = 1 капсула два раза в день (BID)
Недели 2&3 = 2 капсулы два раза в день (BID)
Недели 4&5 = 3 капсулы два раза в день (BID)
Недели 6&7 = 4 капсулы два раза в день (BID)
Недели 8 и позже = доза 5 капсул два раза в день (BID).
По меньшей мере один антибиотик можно комбинировать с веществом, способствующим всасыванию, которое может увеличивать биодоступность указанного антибиотика. Количество вещества, способствующего всасыванию, может составлять 300-700% масс./масс. относительно количества антибиотика. В определенных вариантах осуществления вещество, способствующее всасыванию, представляет собой полиэтиленгликоль. В одном примере полиэтиленгликоль имеет среднюю молекулярную массу 200-20000 (например, 1000-15000, 5000-12000, 7000-9000 или 7500-8500).
В другом варианте осуществления способ создания настоящих композиций включает диспергирование по меньшей мере указанного клофазимина в PEG с образованием дисперсии PEG/клофазимин и последующее смешивание указанной дисперсии PEG/клофазимин по меньшей мере с одним из указанных других антибиотических средств. В одном варианте осуществления дисперсию PEG/клофазимин смешивают с кларитромицином и рифабутином. Аналогично кларитромицин или рифабутин вначале можно диспергировать в PEG и затем смешать с остальными антибиотиками.
Настоящие композиции могут также содержать витамин. В определенном варианте осуществления настоящие композиции содержат витамин D.
Настоящие композиции могут также содержать противовоспалительное средство. Противовоспалительное средство может включать 5-аминосалициловую кислоту. Альтернативно противовоспалительное средство может включать азатиоприн. Другое противовоспалительное средство может включать метотрексат.
Настоящие композиции также могут содержать ингибитор циклинзависимой киназы. Пример включает R-росковитин. Другой пример включает флавопиридол.
Кроме того, настоящие композиции могут включать ингибитор транскрипции в активированных Т-клетках. Пример включает такролимус.
Обнаружили, что у пациентов с РС наблюдаются повышенные иммунологические и цитокиновые значения, соответствующие значениям, наблюдаемым при хронических инфекциях. Настоящее раскрытие относится к использованию иммуномодуляторных свойств антибиотиков, в качестве одного терапевтического подхода для уменьшения воспалительной реакции у хозяина, в особенности в случаях аутоиммунных ответов в целях лечения аутоиммунных заболеваний.
Бактериолитические антибиотики, такие как β-лактамы, действуют путем ингибирования синтеза клеточной стенки бактерий, приводящему к лизису патогена и, следовательно, к высвобождению провоспалительных бактериальных компонентов, что приводит к увеличению смертности и осложнений. В отличие от них, бактерицидные антибиотики, такие как рифабутин, предотвращают начальный воспалительный всплеск. Результаты, полученные in vitro, позволяют предположить, что терапия небактериолитическими антибиотиками вызывает менее интенсивное воспаление и может улучшить исход тяжелых инфекций.
Макролидные антибиотики обладают превосходным иммуномодулирующим действием. Кларитромицин уменьшает жизнеспособность бактерий, которая коррелирует со снижением синтеза бактериальных белков, что показано с помощью внутриклеточного накопления, оцениваемого в динамике по времени при ряде бактериальных инфекций. Макролиды, такие как кларитромицин, ингибируют синтез активных форм кислорода и/или секрецию провоспалительных цитокинов in vitro, в то же время, оказывая различные эффекты на высвобождение провоспалительных цитокинов. Изучали роль воспалительных цитокинов в воспалительных заболеваниях человека и оценивали эффекты комбинации антибиотиков на уровни цитокиновых белков.
Как отмечали ранее, рассеянный склероз представляет собой аутоиммунное заболевание, которое приводит к повреждению миелиновой оболочки, которая окружает нейроны в головном и спинном мозге. Заболевание затрагивает движение, чувствительность и физические функции и характеризуется инфильтрацией воспалительных клеток в ЦНС. Этиология включает комбинацию генетических и внешних факторов. Хотя необходимы дальнейшие исследования патогенеза заболевания, по всей видимости, вирусные и/или микробные инфекции участвуют в развитии заболевания. Обычно заболевание поражает молодых людей, женщин и европейцев североевропейского происхождения.
При рассеянном склерозе белки класса II главного комплекса гистосовместимости (MHC), экспрессированные на поверхности антигенпрезентирующих клеток, связываются с миелиновыми белками или родственными миелиновыми белками, заставляя клетки Th0 осуществлять активацию и дифференцировку. Затем клетки Th1 проходят через гематоэнцефалический барьер в ЦНС, образуют комплексы антиген-MHC и продуцируют провоспалительные цитокины.
Экспериментальный аутоиммунный энцефаломиелит (EAE) является обычно используемой мышиной моделью рассеянного склероза человека (РС). Благодаря многим сходным с РС элементам, EAE используют для изучения патогенеза аутоиммунной реакции, воспаления ЦНС, демиелинизации, перемещения клеток и индукции толерантности.
Недавно проведенное исследование с использованием животных моделей EAE указывает на роль провоспалительного каскада из клеток Th17, IL-6 и TGF-β в центральной нервной системе в патогенезе EAE и РС. EAE имеет сходство клинических и патологических проявлений с РС. Модель EAE является главной при определении терапевтических видов лечения (валидность мишени, оценка потенциальных лекарств-кандидатов, ускоренный режим исследования, анализ гистопатологии).
ПРИМЕР 1. Эксперимент с определением уровней цитокинов
Мышиная модель - иммунизация MOG35-55/CFA
Целью настоящего исследования являлось определение эффектов композиции, содержащей рифабутин, кларитромицин и клофазимин, в дальнейшем обозначаемой как препарат RHB 104, на продукцию цитокинов T-лимфоцитами из дренирующих лимфатических узлов и селезенки после иммунизации MOG35-55/CFA.
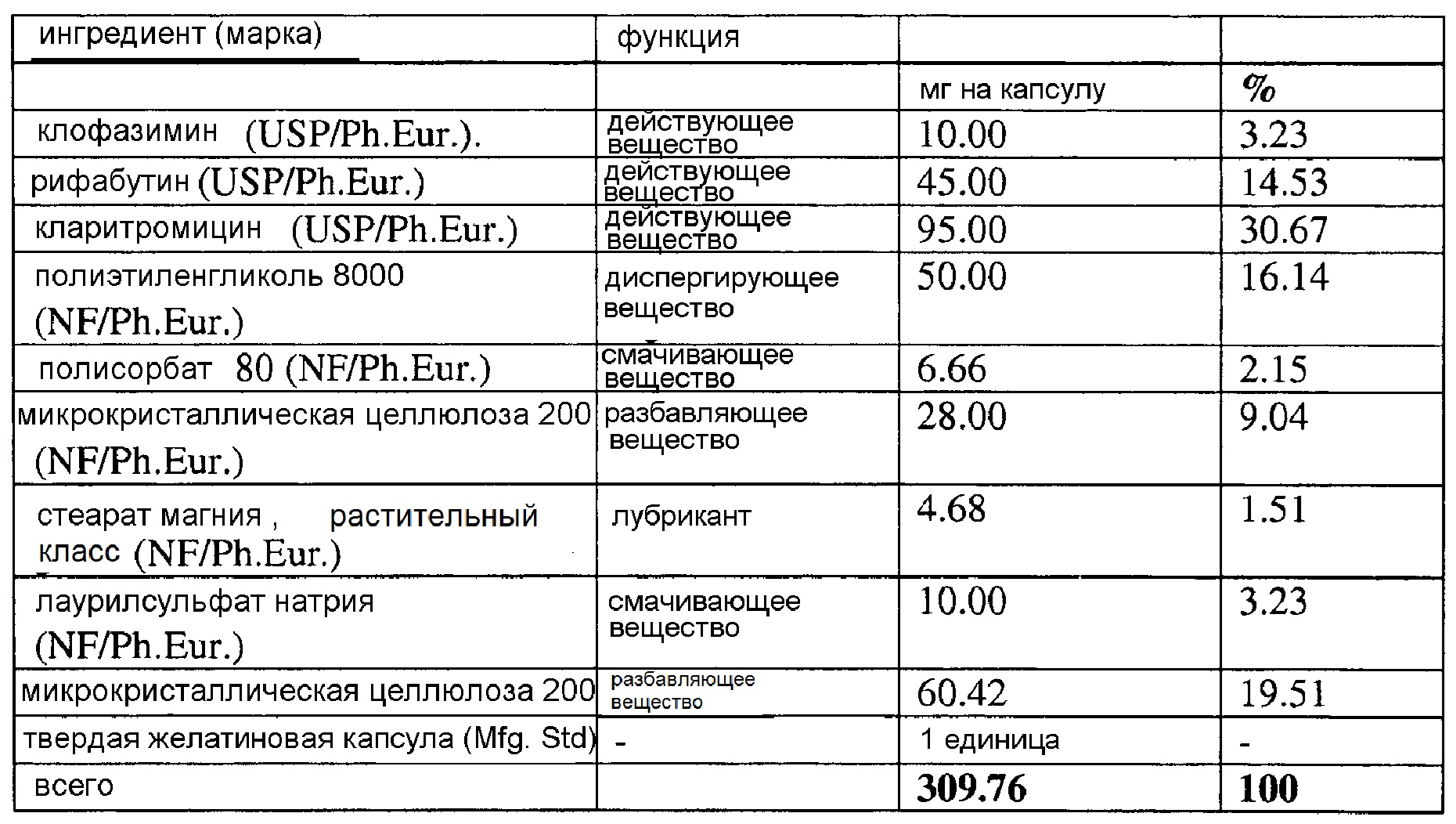
Капсулы RHB-104 включают 10 мг клофазимина, 95 мг кларитромицина и 45 мг рифабутина, и также различные вспомогательные вещества.
Вариант осуществления композиции, используемой в настоящем исследовании и обозначаемой как RHB 104, представлен ниже.
Состав капсул RHB-104
Дизайн эксперимента
Создавали 3 экспериментальные группы, состоящие из 4 мышей/группу.
Заболевание вызывали, иммунизируя мышей в день 0 миелин-олигодендроцитарным гликопротеином, пептидом 33-55 (MOG35-55) эмульгированном в полном адъюванте Фрейнда (CFA), и начинали лечение в тот же день. Через одиннадцать дней мышей умерщвляли, выделяли селезенку и лимфоузлы, готовили клеточные суспензии. Клеточные суспензии культивировали в течение 3 дней в присутствии различных концентраций MOG35-55. Собирали культуральные супернатанты по окончании указанного 3-дневного периода культивирования. Концентрации 7 цитокинов (IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-альфа и IFN-гамма) определяли в культуральных супернатантах с использованием наборов для детекции цитокинов Th1/Th2/Th17 Cytokine Bead Assay (CBA) от Becton Dickinson.
Мыши и иммунизация
В исследовании использовали всего 12 самок мышей C57BL/6 (Taconic Farms, в возрасте 14 недель).
В день 0 мышей иммунизировали путем введения MOG35-55/CFA в два участка на спине, s.c.
Группы и лечение
Лечение начинали в день 0 (день иммунизации) и продолжали до выведения животных из эксперимента в день 11.
Группа 1 - носитель, 10 мл/кг, p.o., BID (отрицательный контроль)
Группа 2 - RHB-104, 36 мг/кг, p.o., BID, 10 мл/кг
Группа 3 - RHB-104, 36 мг/кг, p.o., QD, 10 мл/кг
Дозировка AM: RHB-104, 36 мг/кг, p.o., QD, 10 мл/кг
Дозировка PM: носитель, QD, 10 мл/кг (контроль для учета стресса при введении препарата)
Введение всех доз осуществляли в одно и то же время (+/- 1 час) каждый день. Интервал между введением доз утром и вечером составлял по меньшей мере 10 часов и между введением доз вечером и утром не более 14 часов.
Всех мышей умерщвляли через 1-4 часа после введения утренней дозы в день 11.
Культуры клеток селезенки и лимфатических узлов
Получали селезенки от всех мышей, объединяли в каждой группе, и получали клеточные суспензии.
Получали паховые лимфоузлы всех мышей, объединяли для каждой группы и готовили клеточные суспензии.
Из каждой клеточной суспензии создавали культуры в 96-луночных планшетах с использованием MOG35-55 в пяти концентрациях: MOG35-55 отсутствует, 0,7, 2,2, 6,7, и 20,0 мкг/мл MOG35-55, все концентрации использовали в трех экземплярах.
Супернатанты собирали через 72 часа культивирования.
Концентрации цитокинов в каждой культуре определяли с использованием набора CBA Th1/Th2/Thl7 (набор Mouse Th1/Th2/Th17 BDTM Cytometric Bead Array (CBA), Becton Dickinson). Указанный набор позволяет провести одновременное измерение концентраций 7 различных цитокинов (IL-10, IL-4, IL-2, IL-17A, IFN-γ, TNF-альфа, IL-6).
Результаты
1) Цитокин IL-10
Уровни IL-10 находились ниже стандартного диапазона определения, поэтому какие-либо изменения не могли быть обнаружены.
2) Цитокин IL-17 A
При введении дозы RHB-104 BID наблюдали снижение уровней цитокинов в лимфоузлах и в меньшей степени в селезенке, как видно на фиг. 1.
3) Цитокин TNF-альфа
Введение доз RHB-104 BID и QD снижало уровень TNF-альфа в селезенке. Кроме того, введение доз BID уменьшало TNF-альфа в лимфоузлах. Снижение уровня TNF-альфа в селезенке, при введении доз BID, составляло почти 50%, как показано на фиг. 2.
4) Цитокин IFN-гамма
RHB-104 снижал IFN-гамма при введении дозы BID в селезенке, как показано на фиг. 3:
5) Цитокин IL-6
При введении дозы RHB 104 BID наблюдали почти 50% уменьшение IL-6 в селезенке, как показано на фиг. 4.
Цитокин IL-4
Значения IL-4 находились ниже стандартного диапазона определения.
7) Цитокин IL-2
RHB-104 снижал IL-2 при введении дозы QD как в селезенке, так и в лимфоузлах, как показано на фиг. 5.
Эффект препарата RHB 104, содержащего рифабутин, кларитромицин и клофазимин, на уровни цитокинов в указанной выше мышиной модели подтвержден последующим анализом в мышиной модели EAE, которая является широко известной моделью РС человека.
Эксперимент 2. Оценка эффективности RHB 104 при введении в мышиной модели EAE.
Предварительная информация и описание модели EAE
Индукция EAE
Хронический EAE развивается у мышей C57BL/6 после иммунизации эмульсией MOG35-55/CFA или MOG1-125/CFA с последующей инъекцией коклюшного токсина. Указанную модель используют для проверки эффективности соединений, предназначенных для предотвращения или ослабления заболевания EAE. Модель можно осуществить с использованием соединения, которое вводят с момента иммунизации (профилактическое лечение), или с целью вызвать обратное развитие заболевания и облегчить восстановление путем введения доз соединения с момента наступления EAE (терапевтическое лечение).
В модели используют самок мышей C57BL/6 в возрасте 10-14 недель в начале заболевания. Обычно развивается через 8-18 дней после иммунизации. Развитие EAE обычно протекает в течение 4 недель (28 дней) после иммунизации.
Стресс снижает у мышей подверженность EAE. Независимо от эффектов любого соединения, введение препарата во время периода индукции заболевания (~0-10 дней после иммунизации) отодвигает наступление заболевания и уменьшает тяжесть заболевания. Данный факт связан со стрессом, вызванным введением препарата и с эффектами, оказываемыми носителем на мышь. Чем чаще проводят введение и чем менее переносимый носитель используют, тем большее влияние оказывается на развитие заболевания.
Стресс, связанный с лечением и введением носителя, оказывает значительно меньший эффект на развитие заболевания после появления клинических признаков EAE.
Профилактическое лечение
В исследованиях, связанных с профилактическим применением препарата, лечение начинали до наступления заболевания, во время иммунизации и распределения по группам. Мышей распределяют по группам лечения сбалансированным образом, чтобы создать группы со сходными распределениями значений массы тела мышей.
В исследованиях профилактического применения препарата оценивают, будет ли лечение оказывать эффект на течение заболевания до и после появления первых клинических признаков EAE.
Чтобы компенсировать стресс, вызванный лечением, в исследованиях профилактического лечения и достичь заданной тяжести заболевания, EAE индуцируют с помощью более высокой дозы коклюшного токсина, чем доза, применяемая в терапевтических исследованиях. Дозу коклюшного токсина определяют исходя из ожидаемого стресса, вызванного введением дозы (путь, частота введения и состав носителя).
В исследованиях, связанных с профилактическим применением препарата, среднее время до наступления заболевания является наиболее чувствительным показателем эффективности соединения.
Небольшие изменения иммунного ответа могут приводить к отсроченному началу заболевания - супрессия T-клеточной активации и пролиферации, презентация антигена, дифференцировка в клетки Th1 и/или Th17 будут приводить к отсроченному началу EAE.
Отсроченное начало EAE, сопровождающееся более низким показателем максимальной тяжести заболевания, свидетельствует об общей эффективности лечения, по сравнению с группой отрицательного контроля.
Терапевтическое лечение
В исследованиях, связанных с терапевтическим лечением, лечение начинали во время начала EAE. Мышей распределяют в различные группы лечения по мере того, как у них развивается EAE (скользящее включение) сбалансированным образом, для получения групп со сходным временем манифестации EAE и сходными показателями при появлении заболевания.
В терапевтических исследованиях определяют, будет ли лекарственный препарат способствовать устранению заболевания или способствовать восстановлению после EAE.
Наиболее важным показателем в данной модели является средний показатель клинического окончания EAE. Данный показатель представляет собой клинический результат эксперимента; снижение показателя по сравнению с группой отрицательного контроля свидетельствует об эффективности лечения.
Развитие EAE у мышей, не получавших лечение
Течение заболевания будет отличаться у отдельных мышей. У большинства мышей начальные признаки EAE появляются между 9 и 14 днями после иммунизации. После начала EAE, пик заболевания почти всегда наступает спустя 3-4 дня. Максимально значение оценки заболевания по шкале в баллах сохраняется в течение нескольких дней и затем мыши частично выздоравливают. У некоторых мышей максимально тяжелая степень заболевания сохраняется до окончания исследования. Реже у мыши пик тяжести заболевания сохраняется только в течение одного дня, и затем начинается выздоровление.
Степень восстановления зависит, главным образом, от максимальной тяжести заболевания, наблюдаемой у мыши. Большинство мышей, не получавших лечение или получавших носитель, не восстанавливаются полностью, но их заключительная оценка обычно на 0,5-1,5 баллов ниже наблюдаемой у них максимальной оценки. Приблизительно у 25% мышей, не получавших лечение или получавших носитель, наблюдают ухудшение EAE между 24 и 28 днями после иммунизации, напоминающее рецидив. В спинном мозге у данных мышей во время ухудшения EAE обнаруживают большое количество очагов воспаления (>7 очагов в срезе), что соответствует результатам гистологического исследования, получаемым во время манифестации и пика EAE, что позволяет предположить, что у указанных мышей происходят истинные рецидивы заболевания с новой волной воспаления в спинном мозге.
При наблюдении за мышами в течение более длительного периода времени, тяжесть заболевания медленно возрастает, что напоминает хроническое прогрессирующее течение заболевания у пациентов с РС.
Во время течения EAE, изменения массы тела отражают тяжесть заболевания. У мышей часто наблюдается небольшое снижение массы на следующий день после иммунизации. Указанное снижение по-видимому вызвано эффектами введенного адъюванта и коклюшного токсина. Затем масса мышей неуклонно возрастала до начала заболевания. В день манифестации EAE мыши обязательно теряли 1-2 г своей массы (5-10% массы тела). Потеря массы продолжается при прогрессировании тяжести заболевания EAE, при этом потеря массы на пике заболевания достигает приблизительно 20% от начальной массы. Снижение массы происходит, скорее всего, в результате паралича и снижения потребления пищи, а также высокой продукции провоспалительных цитокинов, таких как TNF, во время острой фазы воспаления. После достижения пика заболевания у мышей медленно увеличивается масса, даже если их клинические показатели не улучшаются. Указанное увеличение массы может быть вызвано подавлением воспаления, что приводит к более низким уровням провоспалительных цитокинов в крови. У мышей, не получавших лечения, или получавших носитель, через 28 дней после иммунизации масса тела обычно составляет приблизительно 90% от массы тела до иммунизации.
Гистология
Воспаление при EAE обычно начинается в поясничной области спинного мозга, распространяясь на весь спинной мозг при пике заболевания.
В начале заболевания число очагов воспаления строго коррелирует с тяжестью заболевания. Число очагов возрастает до наступления пика заболевания, когда обнаруживают обычно 6-15 очагов воспаления/препарат по всему спинному мозгу. При хронической стадии EAE (начинающейся через несколько дней после пика заболевания), многие воспалительные очаги рассасываются, обычно приводя к образованию 3-4 очагов воспаления в каждом препарате спинного мозга приблизительно к 28-му дню после иммунизации.
Поскольку наибольшие количества очагов воспаления представлены в начале течения заболевания, если гистологический анализ выполняют при окончании исследования, у мышей, которые характеризуются поздней манифестацией EAE, часто обнаруживают больше очагов воспаления в спинном мозге, чем можно было бы ожидать, исходя из их клинических показателей. Например, на 28-й день исследования мышь с манифестацией EAE на 27-й день после иммунизации и заключительной клинической оценкой 2, по всей вероятности, будет иметь больше очагов воспаления, чем мышь с манифестацией EAE через 9 дней после иммунизации и заключительной оценкой 3,5. Аналогично у мыши, перенесшей рецидив незадолго до окончания исследования (рецидив определяют, как увеличение клинической оценки на 1 или более баллов), как правило, будут определять больше очагов воспаления при окончании исследования, чем у мыши со стойким хроническим заболеванием, даже если обе мыши имели одинаковый клинический показатель в баллах при окончании исследования.
Демиелинизацию обычно не обнаруживают в течение первых двух дней после начала заболевания, но выявляют на пике заболевания (через 4-5 дней после манифестации EAE) и она сохраняется во время хронической фазы EAE. Показатели демиелинизации незначительно изменяются между пиком и 28-м днем после иммунизации и обычно составляют в среднем от 1,2 до 2,5.
Демиелинизацию оценивают в препаратах, окрашенных как люксолом быстрым голубым (LFB), так и H&E.
В препаратах LFB белое вещество спинного мозга окрашивается в темно-голубой цвет, и участки демиелинизации окрашиваются в более светлый голубой цвет и ассоциируются с крупными вакуолями.
В препаратах, окрашенных H&E, повреждение нормальной структуры за счет крупных вакуолей свидетельствует о демиелинизации.
Апоптотические клетки выявляют в препаратах H&E, и обычно не обнаруживают в течение первых двух дней развития заболевания. Их обнаруживают на пике и во время хронической стадии EAE. Среднее число апоптотических клеток обычно составляет от 2 до 4 в препарате.
Дизайн эксперимента
Мышей взвешивали перед началом исследования и затем распределяли по группам и сбалансированным образом. Лечение соединением начинали в день иммунизации (день 0 исследования).
Заболевание вызывали путем иммунизации мышей в день 0 миелиновым олигодендроцитарным гликопротеином, пептидом 35-55 (MOG35-55), эмульгированном в полном адъюванте Фрейнда (CFA), с последующим введением двух инъекций коклюшного токсина (введенными в дни 0 и 1).
Для оценки развития заболевания мышей взвешивали три раза в неделю (в понедельник, среду и пятницу) с момента иммунизации и ежедневно производили оценку в баллах клинических признаков EAE, начиная с 7-го дня.
Материалы и методы
Мыши
В исследовании использовали всего 24 самки мышей C57BL/6 (Taconic FarPC, в возрасте 10 недель).
Группы и лечение
Мышей распределяли по группам равномерным образом для достижения сходного показателя массы мышей в группах в начале исследования.
В таблице 1 ниже показано, какой препарат вводили каждой группе.
|
Каждая группа состояла из 12 мышей.
Лечение во всех группах осуществляли p.o., BID в объеме 10 мл/кг.
Лечение начинали в день иммунизации (день 0) и продолжали до 27-го дня после иммунизации. Введение всех доз осуществляли в одно и то же время (+/-1 час), каждый день. Интервал между введением доз вечером и утром составлял по меньшей мере 14 часов и между введением доз утром и вечером не более 10 часов.
Индукция EAE
EAE вызывали у 24 самок мышей C57BL/6 (в возрасте 10 недель), как указано ниже:
День 0, час 0 - иммунизация MOG35-55/CFA
День 0, час 2 - инъекция коклюшного токсина
День 1, час 0 - 2-я инъекция коклюшного токсина (24 часа после первичной иммунизации)
Мышам вводили инъекцию модифицированного компонента эмульсии из набора (содержащего MOG35-55)подкожно в два участка на спине. Одно место инъекции находилось в области верхней части спины, приблизительно на 1 см ниже линии шеи. Второй участок находился в области нижней части спины, приблизительно на 2 см выше основания хвоста. Объем инъекции составлял 0,1 мл для каждого участка.
В течение 2 часов после инъекции эмульсии, и затем повторно через 24 часа после инъекции эмульсии компонент коклюшного токсина из набора вводили внутрибрюшинно. Объем каждой инъекции составлял 0,1 мл.
Подсчет баллов и показатели
Показатели представляли собой оценки EAE и значения массы при окончании исследования.
Оценку показателей в баллах у мышей проводили ежедневно с 7-го дня и до окончания исследования, и массу тела измеряли три раза/неделю (понедельник, среда и пятница), начиная со дня 1.
Последним днем проведения оценки являлся 28-й день после иммунизации.
Оценку осуществляли слепым методом, с привлечением субъекта, не знающего о лечении и о предыдущих оценках для каждой мыши.
Оценка EAE
EAE оценивали по шкале от 0 до 5:
Оценка 0.
У мыши отсутствуют очевидные изменения моторных функций, по сравнению с неиммунизированными мышами.
При поднятии мыши за хвост, хвост является упругим и выпрямляется. Задние лапы обычно направлены в разные стороны.
При движении мыши не наблюдается нарушения походки и покачивания головы.
Оценка 1.
Поникший хвост.
Когда мышь поднимают за хвост, хвост не выпрямляется, а полностью свешивается выше пальца.
Оценка 2.
Поникший хвост и слабость задних конечностей.
Когда мышь поднимают за хвост, она не разводит лапы в стороны, а поджимает их вместе. При наблюдении за движениями мыши, отчетливо видна неустойчивая походка.
Оценка 3.
Поникший хвост и полный паралич задних конечностей (наиболее часто); или
поникший хвост в сочетании с параличом одной передней лапы и одной задней лапы; или
все из перечисленного:
выраженное качание головы,
перемещение только вдоль стенок клетки,
припадание к стенке клетки,
вращение при поднятии за хвост.
Оценка 4.
Поникший хвост, полный паралич задних лап и частичный паралич передних лап.
Мышь минимально перемещается по клетке, но выглядит настороженной и принимает пищу.
Обычно рекомендуют проводить эвтаназию после того, как у мыши получают уровень оценок 4 в течение 2 дней. Когда мышь подвергают эвтаназии из-за тяжелого паралича, такой мыши следует присваивать оценку 5 во время остальной части эксперимента.
Оценка 5.
Полный паралич задних и передних лап, отсутствует перемещение по клетке; или
мышь спонтанно кружится в клетке; или
обнаруживают мышь, погибшую от паралича.
Промежуточные оценки присваивают, если клинические признаки расположены между двумя указанными выше оценками.
Гистологический анализ препаратов спинного мозга
В день 28 (окончание исследования) всех мышей умерщвляли для проведения гистологического анализа.
Мышей перфузировали PBS и помещали спинной мозг в 10% буферный раствор формалина.
Для каждой мыши получали 3 препарата, окрашенных люксолом быстрым голубым, и 3 препарата, окрашенных H&E, из люмбального, торакального и цервикального отдела спинного мозга, и проводили анализ. Гистологический анализ осуществлял патолог, который не имел информации об экспериментальных группах и всех клинических показателях.
Подсчет очагов воспаления
Подсчитывали очаги воспаления приблизительно для 20 клеток в каждом препарате, окрашенном H&E. Если воспалительные инфильтраты состояли более чем из 20 клеток, осуществляли подсчет количества очагов, представленных в 20 клетках.
Оценка демиелинизированного участка
Оценка демиелинизации представляет собой определение демиелинизированного участка для каждого среза, как указано ниже:
0 - отсутствие демиелинизации (менее 5% демиелинизированного участка)
1 - 5-20% демиелинизированного участка
2 - 20-40% демиелинизированного участка
3 - 40-60% демиелинизированного участка
4 - 60-80% демиелинизированного участка
5 - 80-100% демиелинизированного участка
В случае препаратов, окрашенных люксолом быстрым голубым, размер участка демиелинизации определяли на основе менее интенсивного голубого окрашивания миелина.
В случае препаратов, окрашенных H&E, участок демиелинизации оценивали путем поиска нарушения нормальной структуры - бледности и вакуолизации, указывающих на отек и демиелинизацию, и увеличенных аксонов.
Подсчет апоптотических клеток
Определяли число апоптотических клеток в каждом из трех препаратов, окрашенных H&E. Апоптотические клетки представляют собой нейроны, и их число коррелирует со стадиями заболевания. Апоптотические клетки появляются вскоре после начала заболевания, так что при манифистации EAE будут присутствовать многочисленные очаги воспаления, но незначительное число апоптотических клеток. Затем число апоптотических клеток возрастает до пика заболевания и остается повышенным в дальнейшем.
Статистический анализ
Статистический анализ осуществляли, как указано ниже.
Частоту возникновения заболевания сравнивали с использованием критерия хи-квадрат
Медианное время манифистации EAE сравнивали с использованием анализа выживаемости по критерию Вилкоксона
Среднее время манифистации EAE сравнивали с использованием двустороннего критерия Стьюдента
Среднюю максимальную оценку (MPC) сравнивали с использованием критерия суммы рангов Вилкоксона
Заключительную оценку сравнивали с использованием критерия суммы рангов Вилкоксона
Изменение массы тела сравнивали с использованием двустороннего критерия Стьюдента
Оценки демиелиниации (LFB) сравнивали с использованием непараметрического критерия Вилкоксона
Оценки демиелинизации (H&E) сравнивали с использованием непараметрического критерия Вилкоксона
Число апоптотических клеток сравнивали с использованием двустороннего критерия Стьюдента
Результаты и интерпретация данных
Развитие EAE оценивали путем сравнения следующих показателей:
частота возникновения EAE, медианное и среднее время манифистации EAE (MME), средняя максимальная оценка (MPC), средние оценки EAE при окончании исследования, и средний показатель массы тела при окончании исследования по сравнению с начальной массой между группой, получавшей носитель (отрицательный контроль), и группой RHB-104
Заключение о результатах - клинические данные
Таблица 2

Группа 1: группа, получавшая носитель, p.o., BID (отрицательный контроль)
У большинства мышей данной группы развивался тяжелый EAE (таблица 1 и фиг. 6).
У большинства мышей данной группы отмечали потерю массы во время исследования, которая являлась ожидаемой (таблица 1 и фиг. 7).
В данной группе не наблюдали гибели мышей.
Группа 2: RHB-104, 36 мг/кг, p.o., BID
У большинства мышей в данной группе заболевание развивалось в более легкой форме, чем наблюдали в группе, получающей носитель.
В данной группе наблюдали существенное улучшение большинства клинических показателей EAE, по сравнению с группой, получающей носитель (таблица 1 и фиг. 6 и 7).
В данной группе не наблюдали гибели мышей.
Приведенные выше результаты свидетельствуют о выраженном эффекте в отношении тяжести заболевания, в соответствии с указанными выше показателями при лечении RHB 104, по сравнению с контролем, в принятой мышиной модели РС человека.
Результаты - Данные гистологического исследования
Таблица 3
Мыши, получавшие носитель
Данные гистологического исследования мышей, получавших носитель, являлись типичными для данной стадии и степени тяжести EAE. Полученные при небольшом увеличении изображения характерных срезов торокального и люмбального отделов спинного мозга мышей, получавших носитель, показали, что воспаление было представлено в мягкой и паутинной оболочках мозга и в белом веществе мозга. В данной группе не было погибших мышей.
Мыши, получавшие RHB 014
В соответствии с клиническими данными, большинство гистологических показателей у данных мышей указывало на существенно менее тяжелую степень заболевания, чем у мышей, получавших носитель. На полученных при небольшом увеличении изображениях характерных срезов торокального и люмбального отделов спинного мозга мышей, получавших RHB-104 обнаружили меньшее число очагов воспаления в указанных препаратах, чем в препаратах, полученных от мышей, получавших носитель. Кроме того, очаги воспаления были меньше у мышей группы RHB-104, чем у мышей, получавших носитель.
Участки демиелинизации были существенно меньше у мышей группы RHB-104, чем у мышей, получавших носитель. В данной группе не было погибших мышей.
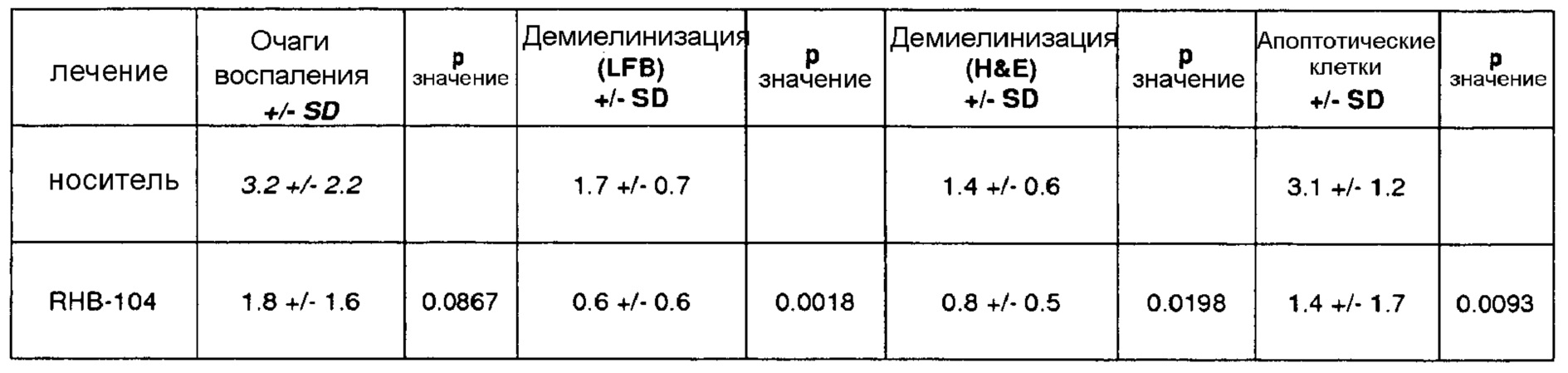
Среднее число очагов воспаления, обнаруженных в препаратах, окрашенных H&E, представлено на фиг. 8 и средняя оценка демиелинизации на основании препаратов, окрашенных люксолом быстрым голубым, показана на фиг. 9.
Согласующиеся с клиническими данными гистологические показатели указывали на существенно менее тяжелую форму заболевания у мышей данной группы, чем у мышей, получавших носитель. В препаратах мышей, получавших RHB 104, обнаруживали меньше очагов воспаления, чем в препаратах мышей, получавших носитель. Кроме того, очаги воспаления были меньше у мышей, получавших RHB 104, чем у мышей, получавших носитель.
Участки демиелинизации были значительно меньше у мышей, получавших RHB-104, чем у мышей, получавших носитель. Все указанные результаты подтверждают клиническое наблюдение, что у мышей, получавших RHB-104, наблюдали значительно менее тяжелую форму EAE, чем у мышей, получавших носитель, в конце исследования с применением мышиной модели РС.
Эксперимент 3. Исследование рецидива EAE.
Модель имеет наиболее сильное сходство с рецидивирующе-ремиттирующей формой РС (самая распространенная форма РС).
В качестве кратной информации о модели, следует понимать, что первый эпизод паралича развивается у мышей через 11-14 дней после иммунизации в модели EAE и, аналогично большинству пациентов РС, они полностью или почти полностью восстанавливаются после первой волны паралича. После безрецидивного периода продолжительностью 1-2 недели у 50-100% мышей развивается вторая волна паралича (рецидив).
Указанную модель используют для проверки действия соединений на проявление рецидивов EAE (терапевтическое лечение). Лечение можно начинать при появлении клинических признаков EAE, или в начале восстановления после первой волны EAE. Указанную модель обычно осуществляют в течение 5-7 недель, но иногда наблюдения за мышами проводят в течение более продолжительного времени.
Дизайн эксперимента
Заболевание вызывали путем иммунизации мышей в день 0 пептидом PLP139-151, эмульгированном в полном адъюванте Фрейнда (CFA).
Чтобы оценить развитие заболевания, мышей взвешивали три раза в неделю (понедельник, среда и пятница), начиная от момента иммунизации, и проводили ежедневное определение в баллах клинических признаков EAE, начиная с 9-го дня.
Включение мышей в группы исследования осуществляли на второй день появления клинических признаков EAE для каждой мыши. Мышей включали в группы лечения по мере того, как у них развивались признаки EAE (скользящее включение).
Распределение по группам и лечение
Исходно всех мышей рассматривали как одну группу. Ежедневную оценку в баллах начинали осуществлять на 9-й день после иммунизации.
Включение мышей в группы исследования осуществляли на второй день появления клинических признаков EAE для каждой мыши. Мышей включали в группы лечения по мере того, как у них развивались признаки EAE (скользящее включение).
Сорок пять мышей включали в 3 группы исследования, по 15 мышей, и лечение начинали в день включения в исследование. Распределение по группам было сбалансированным для получения сходных оценок среди групп при включении в исследование.
Семь мышей, у которых заболевание развилось значительно позже, или у которых наблюдали необычные симптомы, не включали в группы и не использовали в исследовании.
Группы
Группа 1 - носитель (PBS), p.o., BID, 5 мл/кг (отрицательный контроль)
Группа 2 - лечение FTY-720 (Fingolimod, Gilenya) 3 мг/кг, p.o., QD (лекарство применяли для лечения РС и использовали в качестве положительного контроля)
Группа 3 - лечение RHB-104, p.o., BID, 5 мл/кг
Лечение
Лечение начинали в день включения в исследование и продолжали до 39-го дня.
Введение всех доз осуществляли в одно и то же время (+/- 1 час), каждый день. Интервал между введением утренних и вечерних доз составлял по меньшей мере 10 часов и между введением вечерних и утренних доз не более 14 часов.
Для всех мышей последним днем введения доз являлся 39-й день.
Оценка в баллах и полученные данные
Оценку показателей у мышей проводили ежедневно с 9-го по 40-й день, и массу измеряли три раза/неделю (понедельник, среда и пятница), начиная до момента проведения иммунизации (Day -1).
Оценку осуществляли слепым методом, с привлечением субъекта, не знающего о лечении и о предыдущих оценках, полученных для каждой мыши.
Показатели представляли собой оценки EAE по шкале 0-5 с шагом измерения 0,5 и значения изменений массы тела.
Оценка в баллах EAE
EAE оценивали по шкале от 0 до 5, как описано выше.
Статистический анализ
Статистический анализ осуществляли, как указано ниже:
Медианное время манифестации EAE сравнивали с применением анализа выживаемости по критерию Вилкоксона
Среднее время манифестации EAE сравнивали с применением двустороннего критерия Стьюдента
Среднюю максимальную оценку (MPC) первой волны сравнивали с применением критерия суммы рангов Вилкоксона
Частоту возникновения рецидивов сравнивали с применением критерия хи-квадрат
Среднюю максимальную оценку (MPC) рецидива сравнивали с применением критерия суммы рангов Вилкоксона
Заключительную оценку сравнивали с применением критерия суммы рангов Вилкоксона
Изменение массы тела сравнивали с применением двустороннего критерия Стьюдента
Результаты
У 8 мышей в группе 1 наблюдали рецидив, в соответствии с их клиническими оценками, тогда как только у 2 мышей из групп 2 и 3 отмечали рецидив.
Кроме того, тяжесть рецидива заболевания в группе 3 была значительно менее выражена, чем в группе 1, о чем свидетельствует график, представленный на фиг. 12.
Заключение
Помимо уменьшения симптомов при начальном появлении EAE, показано, что настоящая композиция RHB-104 защищает от рецидива заболевания в широко известной мышиной модели, используемой, как указано выше, и в случаях, когда происходит рецидив, тяжесть заболевания существенно снижена, по сравнению с группой отрицательного контроля. Результаты, в совокупности, показывают, что RHB-104 обладал высокой эффективностью в уменьшении тяжести заболевания в настоящем исследовании.
Специалистам понятно, что осуществлены многочисленные вариации и/или модификации описанных выше вариантов осуществления, без нарушения общего широкого объема настоящего раскрытия. Поэтому настоящие варианты осуществления следует рассматривать во всех отношениях, как иллюстративные и не ограничивающие.'