Результат интеллектуальной деятельности: ДИ(3-СУЛЬФОФЕНИЛФОСФИНИЛ)ПРОИЗВОДНЫЕ 2,2'-БИПИРИДИЛА, 1,10-ФЕНАНТРОЛИНА И ПИРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к новым соединениям 6,6'-ди(3-сульфофенил)фосфинил-2,2'-бипиридилов, 6,6'-бис[(трет-бутил)(3-сульфофенил)фосфинил]-2,2'-дипиридил, 2,9-ди(3-сульфофенил)фосфинилфенантролинов, 2,9-бис[(трет-бутил)(3-сульфофенил)фосфинил]-1,10-фенантролин, 2,6-ди(3-сульфофенил)фосфинилпиридинов и 2,6-бис[(трет-бутил)(3-сульфофенил)фосфинил]пиридин и способу их синтеза, для использования в качестве органических водорастворимых лигандов для комплексообразования с ионами f-элементов, что может быть использовано во времяразрешенном иммунофлуоресцентном и других видах флуоресцентного анализа, а также для экстракционного разделения ионов редкоземельных элементов.
Уровень техники
Одним из ключевых направлений современной медицины является диагностика, без которой не ставится ни один врачебный диагноз. Этот сегмент все последние годы переживает бурный рост. Сегодня потребители ожидают от современных тест-систем следующих качеств: отличных метрологических характеристик; удобства в использовании (срок хранения до вскрытия не менее 12-18 месяцев и не менее 2 месяцев после вскрытия); совместимости с существующим оборудованием или вообще отказа от дополнительного оборудования; мультиплексности; минимального времени анализа, минимального количества анализируемого биоматериала, а также низкой цены реагентов.
На протяжении многих лет иммунохимический анализ, основанный на специфическом связывании определяемого антигена антителами, занимает прочное положение среди наиболее важных биохимических методов исследования. Он нашел применение в медицинской практике для диагностики инфекционных, опухолевых заболеваний, аутоиммунных и эндокринных расстройств, в лекарственном, санитарно-эпидемиологическом, экологическом мониторинге и т.д. Иммунофлуоресцентный метод отличает богатство и разнообразие меток, стабильных в течение длительного времени. Применение флуоресцентных меток не ограничивается только иммунофлуоресцентным анализом. Многие флуоресцентные красители в литературе и в каталогах фирм-производителей выступают под названием «molecular probes» («молекулярные зонды»). Подобное название подразумевает, что данные маркеры являются тонким инструментом для изучения огромного количества процессов in vivo и ex vivo в клеточной и молекулярной биологии, обладают высокой информативностью и чувствительностью вплоть до детектирования одиночной молекулы или единичного процесса. Наиболее актуальными задачами разработки современных биоаналитических систем являются миниатюризация формата и мультианалитные исследования с выходом на высокоэффективный скрининг.
Развитие флуоресцентного анализа в настоящее время происходит в следующих направлениях: поиск новых способов (технологий) проведения иммунохимических реакций и разделения их компонентов, разработка новых методов детекции и обработки флуоресцентного сигнала, увеличение чувствительности методов и поиск новых высокочувствительных маркеров, в первую очередь на основе хелатов ионов лантаноидов с гетероциклическими ароматическими соединениями.
Из уровня техники известен синтез фенил-4-сульфоновых кислот и их производных на основе 4,7-дизамещенных 1,10-фенантролинов, описанный в патенте US 4772563 R.A. Evangelista и A. Pollak "1,10-Phenanthroline Derivatives and Use in Fluorescence Immunoassay" 20 сентября 1988 г. Описанный способ получения сульфопроизводных фенантролина заключается в обработке 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты хлорсульфоновой кислотой, т.е. введение сульфогрупп в фенильные заместители фенантролина.
Однако этот метод не может быть применен для сульфирования фенильных групп фенилфосфиновых производных N-гетероциклов - пиридина, бипиридила и фенантролина. В этом случае требуются более жесткие условия проведения реакции.
В ряде работ описано сульфирование фенилфосфинов олеумом (C. Larpent, H. Patin, N. Thilmont, J.F. Valdor, "A New Route to Water-Soluble Sulfonated Phosphines", Synthetic Communications, 21(4), 495, (1991)"; Ahrland S., Chatt J., Davies N.R., Williams A., J. Chem. Soc., 1958, 276; Amrani Y., Lecomte L., Sinou D., Bakos J., Toth I., Heil В., Organomet., 1989, 8, 542). Метод заключается в обработке растворов фенилфосфинов олеумом (20%-65%) в концентрированной серной кислоте при температуре 0°-50°C в течение 1-5 дней. В случае сульфирования трифенилфосфина в зависимости от условий получают моносульфокислоту (J. Chem. Soc., 1958, 276) или трисульфокислоту (Synthetic Communications, 21(4), 495, (1991). В случае сульфирования соединений, содержащих несколько фенилфосфиновых колец (бис-дифенилфосфиновые производные алканов), образуются смеси соединений, имеющих различную степень сульфирования (образование моно-, ди-, три- и тетра- сульфопроизводных) и происходит окисление фосфора до соответствующего фосфиноксида (Organomet., 1989, 8, 542). В связи с отсутствием в литературе данных по сульфированию (в том числе исчерпывающему сульфированию) гетарилфосфиноксидов указанный метод был выбран нами в качестве прототипа.
Раскрытие изобретения
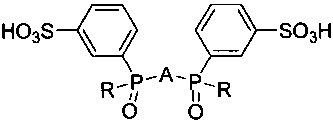
Целью изобретения является способ синтеза сульфозамещенных фосфиноксидов на основе гетероароматических соединений общей формулы:
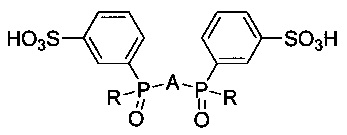
где R = 3-сульфофенил или трет-бутил, A = 2,6-пиридил, 2,2'-бипиридил-6,6'-диил, 1,10-фенантрен-2,9-диил для получения люминесцирующих комплексов с ионами f-элементов.
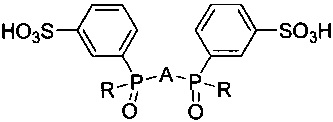
Поставленная цель достигается тем, что получены новые соединения, представляющие собой ди(3-сульфофенилфосфинил)производные 2,2'-бипиридила, 1,10-фенантролина и пиридина общей формулы:
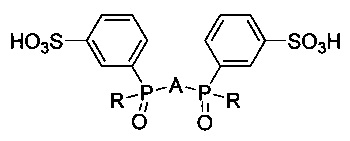
где R = 3-сульфофенил или трет-бутил, A = 2,6-пиридил, 2,2'-бипиридил-6,6'-диил, 1,10-фенантрен-2,9-диил для получения люминесцирующих комплексов с ионами f-элементов.
А также к способу получения вышеуказанных соединений, где R = 3-сульфофенил, A = 2,6-пиридил или 2,2'-бипиридил-6,6'-диил или 1,10-фенантролин-2,9-диил, характеризующийся обработкой бис(дифенилфосфинил) производных пиридина или 2,2'-бипиридила или 1,10-фенантролина раствором 40-65% олеума в серной кислоте при температуре 50-80°C.
А также к способу получения вышеуказанных соединений, где R = трет-бутил, A = 2,6-пиридил или 2,2'-бипиридил-6,6'-диил или 1,10-фенантролин-2,9-диил, характеризующийся обработкой трет-бутилфенилфосфинхлорида металлическим натрием, с последующим добавлением гетарилгалогенидов - 2,6-дибромпиридина или 6,6'-дихлор-2,2'-бипиридина или 2,9-дихлор-1,10-фенантролина, полученные (трет-бутил)фенилфосфины окисляют 20-50% перекисью водорода, полученные ди[(трет-бутил)фенилфосфинил] производные пиридина или 2,2'-бипиридила или 1,10-фенантролина обрабатывают раствором 40-65% олеума в серной кислоте при температуре 50-80°C.
Технический результат предложенного изобретения заключается в получении новых соединений, которые образуют люминесцирующие комплексы с ионами f-элементов. Также данные соединения могут применяться в качестве лигандов для экстракционного разделения редкоземельных элементов.
В отличие от известного метода (прототипа) в нашем случае сульфирование протекает сразу по всем фенильным кольцам исходных фосфиноксидов с образованием индивидуальных ди- (в случае фенил-трет-бутилфенилоксидов) или тетра- (в случае дифенилфосфиноксидов) сульфокислот. В способе получения заявляемых сульфопроизводных согласно изобретению, соответствующие бис[(трет-бутил)фенилфосфинил] и бис(дифенилфосфинил) производные 2,2'-бипиридила, 1,10-фенантролина и пиридина (1) обрабатывают раствором олеума в концентрированной серной кислоте при повышенной температуре с образованием ранее не описанных целевых продуктов (2) согласно следующей схеме:
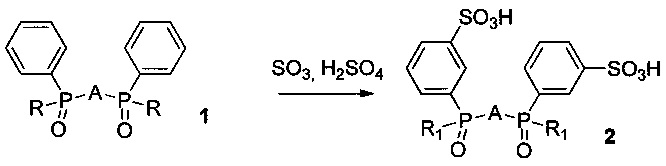
Исходные соединения, содержащие дифенилфосфинильные группы, 6,6'-бис(дифенилфосфинил)-2,2'-бипиридил, 2,9-бис(дифенилфосфинил)-1,10-фенантролин и 2,6-бис(дифенилфосфинил)-пиридин (1, R=фенил), описаны в литературе (Raymond Ziessel, Tetrahedron Letters, Vol. 30, No 4, pp 463-466, 1989; Marek Pietraszkiewicz, Andrzej Klonkowski, Krzysztof Staniszewski, Jerzy Karpiuk, Slawomir Bianketti, Journal of Alloys and Compounds, 380 (2004), 241-247) и были получены по известным методикам.
Исходные (трет-бутил)фенилфосфинилоксиды (1, R = трет-бутил) ранее не были описаны и были получены впервые согласно следующей схеме:
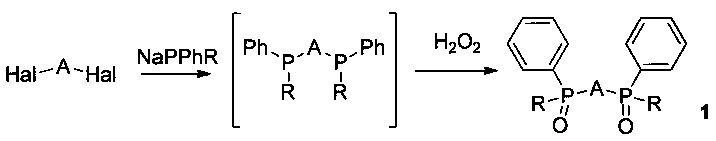
В качестве гетарилдигалогенидов Hal-A-Hal используют 6,6'-дихлор-2,2'-бипиридин, 2,6-дихлорпиридин, 2,9-дихлор-1,10-фенантролин.
Согласно изобретению соответствующие гетарилгалогениды обрабатывают (трет-бутил)фенилфосфидом натрия, а затем перекисью водорода и получают соответствующие (трет-бутил)фенилфосфинилоксиды (1, R = трет-бутил).
Заявляемые соединения образуют комплексы с ионами f-элементов, предпочтительнее с ионами лантана, европия, эрбия. На примере комплексов с эрбием показано, что они обладают люминесцентными свойствами.
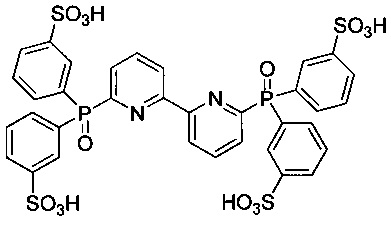
6,6'-Бис[ди(3-сульфофенил)фосфинил]-2,2'-дипиридил - формулы C34H26N2O14P2S4 и структуры:
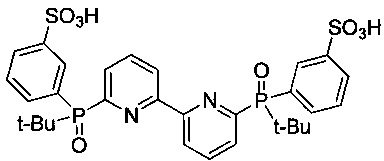
6,6'-Бис[(трет-бутил)(3-сульфофенил)фосфинил]-2,2'-дипиридил - формулы C30H34N2O8P2S2 и структуры:
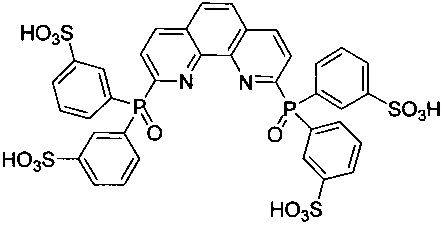
2,9-Бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролин - формулы C36H26N2O14P2S4 и структуры:
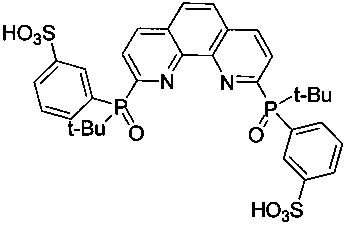
2,9-Бис[(трет-бутил)(3-сульфофенил)фосфинил]-1,10-фенантролин - формулы C32H34N2O8P2S2 и структуры:
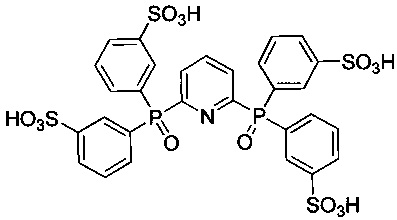
2,6-Бис[ди(3-сульфофенил)фосфинил]пиридин - формулы C29H23NO14P2S4 и структуры:
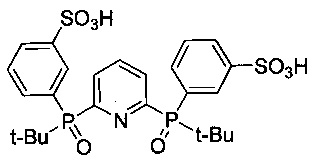
2,6-Бис[(трет-бутил)(3-сульфофенил)фосфинил]пиридин - формулы C25H31NO8P2S2 и структуры:
Краткое описание чертежей
Изобретение поясняется чертежами.
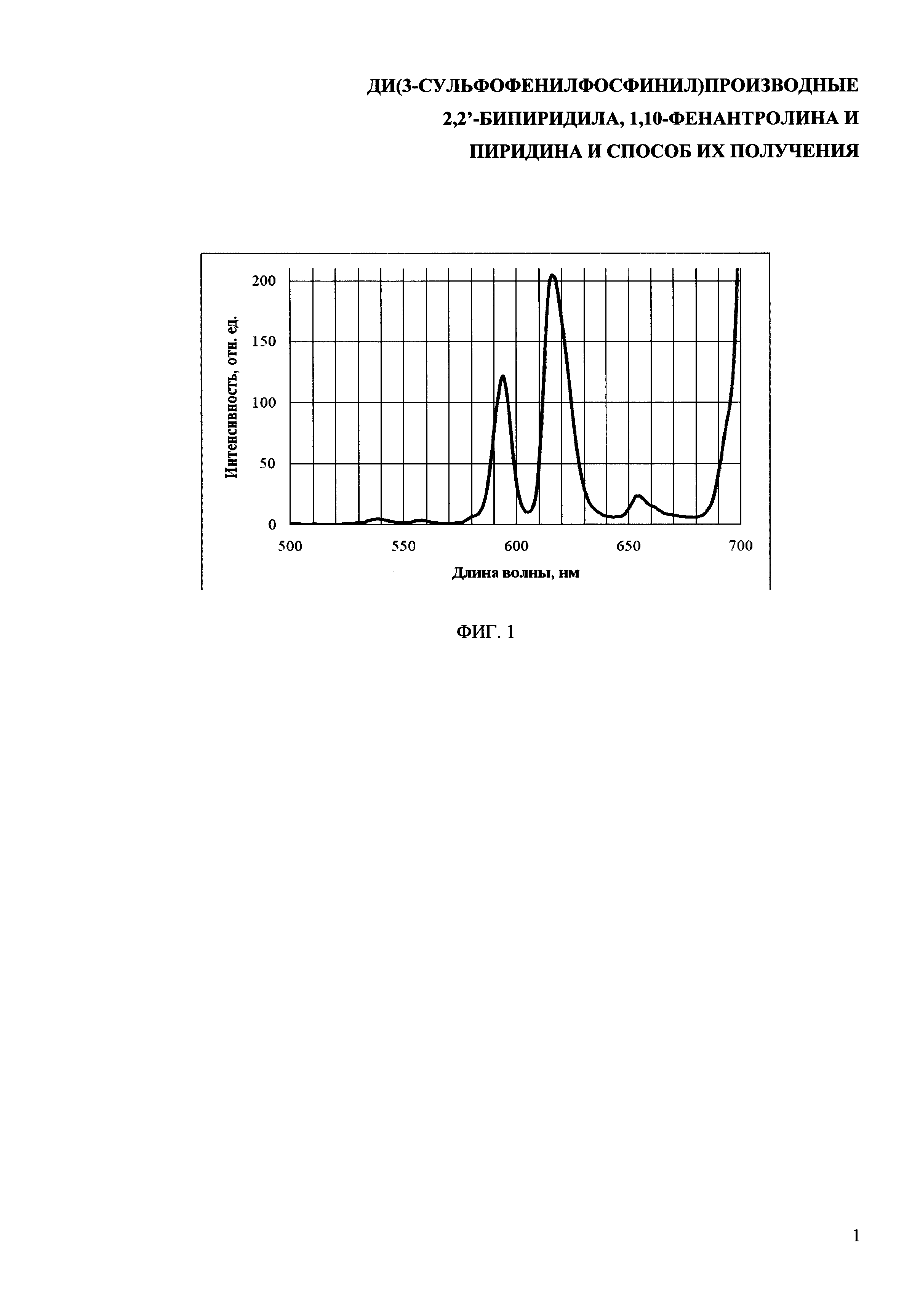
На фиг. 1 представлен спектр испускания люминесценции на длине волны возбуждения λex=270 нм для раствора комплекса европия с 2,9-бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролином в диметилсульфоксиде.
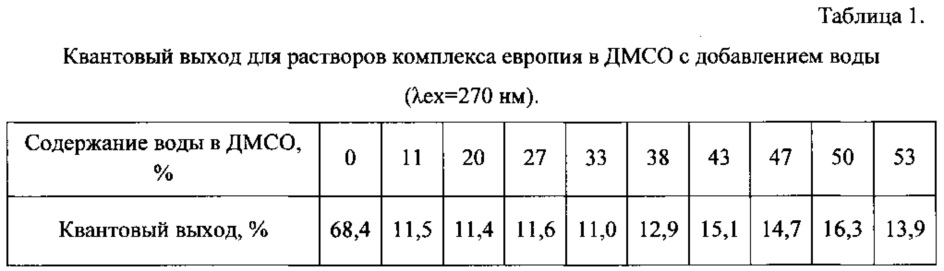
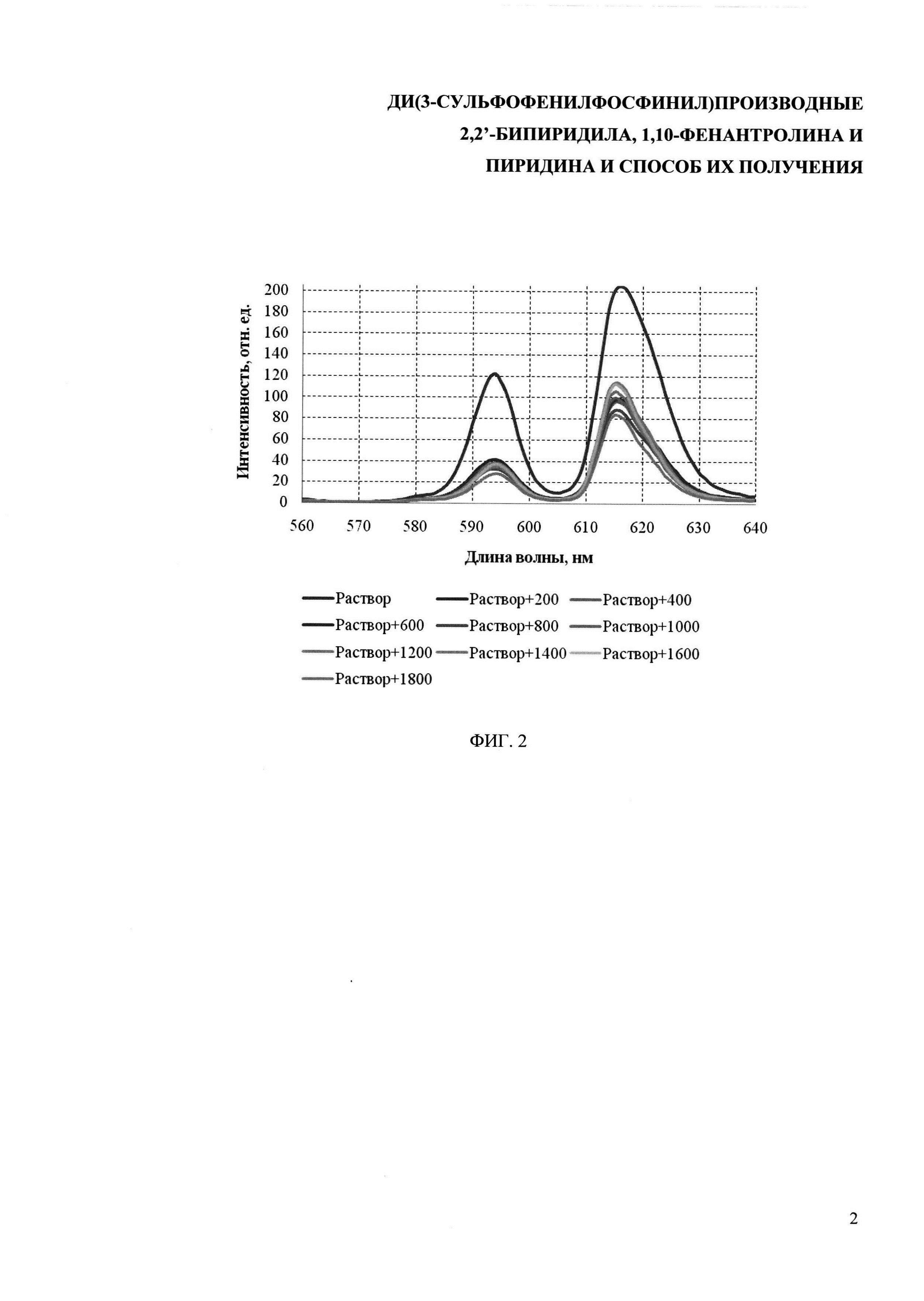
На фиг. 2 показаны спектры испускания люминесценции растворов комплекса европия в ДМСО с добавлением воды (λex=270 нм)
Осуществление изобретения
Постадийный метод синтеза сульфопроизводных описан ниже.
Пример 1. Синтез 6,6'-бис[(трет-бутил)фенилфосфинил]-2,2'-бипиридила (1 A=2,2'-бипирид-6,6'-ил, R=tBu).
К смеси натрия (0,92 г, 0.04 моль) в 60 мл сухого диоксана при перемешивании прибавляют под аргоном по каплям в течение 1 часа раствор 3,6 мл (0,02 моль) трет-бутилфенилфосфинхлорида в 20 мл сухого диоксана. В конце перемешивания раствор приобретает желто-коричневую окраску. Реакционную массу кипятят в течении 4 часов, после охлаждения при перемешивании прибавляют по каплям суспензию 2,25 г (0,01 моль) 6,6'-дихлор-2,2'-бипиридила в 10 мл сухого диоксана, перемешивают в течении 16 часов и обрабатывают 20% перекисью водорода (3×3 мл). После окончания реакции растворитель удаляют под вакуумом, остаток отфильтровывают, промывают водой (2×3 мл) и метанолом (1×3 мл) и высушивают на воздухе. Получают 2,8 г (55%) белого порошка. 1H NMR (400.6 MHz, CDCl3): δ 8.22 (dd, J=7.95, 3.70 Hz, 1 H); 7.98 (td, J=7.65, 3.70 Hz, 1 H); 7.92 (d, J=7.52 Hz, 1 H); 7.75-7.71 (m, 4H, HPh-2); 7.48 (t, 2H, HPh-4); 7.40-7.37 (m, 4H, HPh-3), 1.04 (d, 3JHP=16 Hz, 18H, Ht-Bu); 31P NMR (161.9 MHz, CDCl3): δ 32.7.
Элементный анализ Вычислено для C30H34N2O2P2: C 69,76, H 6,63, N 5,42, P 11,99. Найдено: C 69,51, H 6,85, N 4,99.
Пример 2. Синтез 2,6-бис[(трет-бутил)фенилфосфинил]пиридина (1 A=пиридин-2,6-диил, R=tBu).
К смеси натрия (0,92 г, 0.04 моль) в 60 мл сухого диоксана при перемешивании прибавляют под аргоном по каплям в течение 1 часа раствор 3,6 мл (0,02 моль) трет-бутилфенилфосфинхлорида в 20 мл сухого диоксана. В конце перемешивания раствор приобретает желто-коричневую окраску. Реакционную массу кипятят в течении 4 часов, после охлаждения при перемешивании прибавляют по каплям суспензию 2,35 г (0,01 моль) 2,6-дибромпиридина в 10 мл сухого диоксана, перемешивают в течении 16 часов и обрабатывают 25% перекисью водорода (3×3 мл). После окончания реакции растворитель удаляют под вакуумом, остаток отфильтровывают, промывают водой (2×3 мл) и метанолом (1×3 мл) и высушивают на воздухе. Получают 3,03 г (69%) белого порошка. 1H ЯМР (CDCl3): 8.35-8.25, (м, 3H, Py), 7.80-7.75 (m, 4H, HPh-2); 7.54 (t, 2H, HPh-4); 7.46-7.39 (m, 4H, HPh-3), 1.03 (d, 18H, Ht-Bu).
Элементный анализ. Вычислено для C25H31NO2P2: C 68,33, H 7,11, N 3,19. Найдено: C 68,61, H 6,88, N 2,93.
Пример 3. Синтез 2,9-бис[(трет-бутил)фенилфосфинил]-1,10-фенантролина (1 A=фенантролин-2,9-диил, R1=tBu).
К смеси натрия (0,92 г, 0.04 моль) в 60 мл сухого диоксана при перемешивании прибавляют под аргоном по каплям в течение 1 часа раствор 3,6 мл (0,02 моль) трет-бутилфенилфосфинхлорида в 20 мл сухого диоксана. В конце перемешивания раствор приобретает желто-коричневую окраску. Реакционную массу кипятят в течении 4 часов, после охлаждения при перемешивании прибавляют по каплям суспензию 2,48 г (0,01 моль) 2,9-дихлор-1,10-фенантролина в 10 мл сухого диоксана, перемешивают в течении 16 часов и обрабатывают 50% перекисью водорода (3×3 мл). После окончания реакции растворитель удаляют под вакуумом, остаток отфильтровывают, промывают водой (2×3 мл) и метанолом (1×3 мл) и высушивают на воздухе. Получают 3,89 г (72%) светло-серого порошка. 1H ЯМР (CDCl3, δ, м.д.) 8,02 (д, 2H), 7.70 (с, 2H), 7,63 (д, 2H); 7.75-7.71 (m, 4H, HPh-2); 7.45 (t, 2H, HPh-4); 7.42-7.38 (m, 4H, HPh-3), 1.04 (d, 18H, Ht-Bu). 31P ЯМР (161.9 MHz, CDCl3): 31,5 м.д.
Элементный анализ Вычислено для C32H34N2O2P2: C 71,10, H 6,34, N 5,18. Найдено: C 69,81, H 6,78, N 4,83.
Пример 4. Синтез 6,6'-бис[ди(3-сульфофенил)фосфинил]-2,2'-бипиридила (2 A=бипиридил-6,6'-диил, R1=3-SO3HC6H4)
В колбу объемом 30 мл добавляют 0,10 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,23 мл олеума (ω(SO3)=40%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,182 г (0,33 ммоль) 6,6'-бис(дифенилфосфинил)-2,2'-бипиридила (1, A=2,2'-бипиридил-6,6'-диил, R=Ph). После 24 часов перемешивания под аргоном при 50°C выливают содержимое колбы маленькими порциями в лед (объем льда ≈50 мл). Полученный раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 30 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор упаривают на роторном испарителе. Получают белое порошкообразное вещество массой 0,2212 г. Выход 77,15%. 1H NMR (400 MHz, METHANOL-d4): (δ ppm): 7.62 (td, J=7.76, 3.06 Hz, 2 H) 7.97 (dd, J=11.74, 7.83 Hz, 2 H) 8.05 (d, J=8.07 Hz, 2 H) 8.22 (dq, J=7.70, 7.54 Hz, 1 H) 8.15-8.27 (m, 1 H) 8.51 (d, J=11.98 Hz, 2 H) 8.62 (dt, J=7.64, 1.68 Hz, 1 H); 31P ЯМР (161.9 MHz, CDCl3): 21,79 м.д. ИК (KBr, см-1): 3448, 3062, 2956, 2923, 2854, 1637, 1569, 1550, 1465, 1436, 1427, 1384, 1139, 1137, 1108, 1037, 995, 798, 742, 692, 620, 539, 487.
Элементный анализ. Вычислено для C34H26N2O14P2S4: C 46,58, H 2,99, N 3,20. Найдено: C 46,79, H 3,27, N 3,51.
Пример 5. Синтез 2,6-бис[ди(3-сульфофенил)фосфинил]пиридина (2 A=пиридин-2,6-диил, R1=3-SO3HC6H4)
В колбу объемом 50 мл добавляют 0,15 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,35 мл олеума (ω(SO3)=45%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,24 г (0,5 ммоль) 2,6-бис(дифенилфосфинил)пиридина (1, A=пиридин-2,6-диил, R=Ph). После 24 часов перемешивания под аргоном при 45°C выливают содержимое колбы маленькими порциями в лед (объем льда ≈50 мл). Полученный раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 30 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор упаривают на роторном испарителе. Получают белое порошкообразное вещество массой 0,34 г. Выход 80%. 1H NMR (400 MHz, METHANOL-d4) (δ ppm): 7.68 (m, 2 H) 7.97 (m, 2 H) 8.12 (d, J=8.07 Hz, 2 H) 8.35-8.25, (м, 3H, Py), 8.56 (d, 2 H); 31P ЯМР (161.9 MHz, CDCl3): 23,80 м.д.
Элементный анализ. Вычислено для C29H23NO14P2S4: C 43,56, H 2,90, N 1,75. Найдено: C 43,81, H 3,31, N 2,07.
Пример 6. Синтез 2,9--бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролина (2 A=фенантролин-2,9-диил, R1=3-SO3HC6H4)
В колбу объемом 50 мл добавляют 0,15 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,35 мл олеума (ω(SO3)=60%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,29 г (0,5 ммоль) 2,9-бис(дифенилфосфинил)-1,10-фенантролина (1, A=фенантролин-2,9-диил, R=Ph). После 24 часов перемешивания под аргоном при 50°C выливают содержимое колбы маленькими порциями в лед (объем ≈70 мл). Полученый раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 45 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор испаряют на роторном испарителе. Получают белое порошкообразное вещество массой 0,31 г. Выход 69%. 1H NMR (400 MHz, METHANOL-d4) (δ ppm): 7.56 (td, J=7.76, 3.06 Hz, 2 H) 7,69 (д, 2H); 7.75 (с, 2H), 7.81 (dd, 2 H) 8.0 (d, 2 H) 8,12 (д, 2H), 8.39 (d, 2 H).
Элементный анализ. Вычислено для C36H26N2O14P2S4: C 48,00, H 2,91, N 3,11. Найдено: C 47,78, H 3,27, N 2,95.
Пример 7. Синтез 6,6`-бис[(трет-бутил)(3-сульфофенил)фосфинил]-2,2'-бипиридила (2 A=2,2'-бипиридил-6,6'-диил, R1=tBu).
В колбу объемом 100 мл добавляют 0,2 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,46 мл олеума (ω(SO3)=55%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,34 г (0,66 ммоль) 6,6'-бис[(трет-бутил)фенилфосфинил)-2,2'-бипиридила (1, A=2,2'-бипиридил-6,6'-диил, R=tBu). После 24 часов перемешивания под аргоном при 65°C выливают содержимое колбы маленькими порциями в лед (объем льда ≈100 мл). Полученный раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 60 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор упаривают на роторном испарителе. Получают белое порошкообразное вещество массой 0,36 г. Выход 81%. 1H NMR (400 MHz, METHANOL-d4) (δ ppm) 1.04 (s, 3JHP=16 Hz, 18H, Ht-Bu); 7.62-7.97 (m, 2 H) 7.85 (d, 1 H) 8.22 (dq, J=7.70, 7.54 Hz, 1 H) 8.15-8.27 (m, 1 H) 8.51 (m 1 H) 8.62 (dt, J=7.64, 1.68 Hz, 1 H); 31P ЯМР (161.9 MHz, CDCl3): 21,79 м.д.
Элементный анализ. Вычислено для C30H34N2O8P2S2: C 53,25, H 5,06, N 4,14. Найдено: C 53,56, H 4,83, N 4,29.
Пример 8. Синтез 2,6-бис[(трет-бутил)(3-сульфофенил)фосфинил]пиридина (2 A=пиридин-2,6-диил, R1=tBu)
В колбу объемом 100 мл добавляют 0,2 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,46 мл олеума (ω(SO3)=75%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,29 г (0,66 ммоль) 2,6'-бис[(трет-бутил)фенилфосфинил)пиридина (1, A=пиридин-2,2'-диил, R=tBu). После 24 часов перемешивания под аргоном при 60°C выливают содержимое колбы маленькими порциями в лед (объем льда ≈100 мл). Получении раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 60 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор упаривают на роторном испарителе. Получают белое порошкообразное вещество массой 0,34 г. Выход 85%. 1H NMR (400 MHz, METHANOL-d4) (δ ppm): 1.03 (d, 18H, Ht-Bu) 7.69 (m, 2 H) 8.0 (m, 2 H) 8.20 (d, J=8.07 Hz, 2 H) 8.25-8.30 (m, 3H, Py), 8.51 (d, 2 H).
Элементный анализ. Вычислено для C25H31NO8P2S2: C 50,08, H 5,21, N 2,34. Найдено: C 50,39, H 5,44, N 2,56.
Пример 9. Синтез 2,9-бис[(трет-бутил)(3-сульфофенил)фенилфосфинил]-1,10-фенантролина (2, A=фенантролин-2,9-диил, R1=tBu)
В колбу объемом 100 мл добавляют 0,2 мл концентрированной серной кислоты (ρ=1,8 г/мл) и 0,46 мл олеума (ω(SO3)=80%). После этого нагревают смесь до 50-55°C, под аргоном при перемешивании добавляют 0,324 г (0,66 ммоль) 2,9-бис[(трет-бутил)фенилфосфинил]-1,10-фенантролина (1, A=1,10-фенантролин-2,9-диил, R=tBu). После 24 часов перемешивания под аргоном при 65°C выливают содержимое колбы маленькими порциями в лед (объем льда ≈100 мл). Полученный раствор нейтрализуют до нейтральной реакции pH≈5-6 и добавляют 60 мл этилового спирта. В осадок выпадает Na2SO4×10H2O. Фильтруют раствор с осадком на стеклянном пористом фильтре с мелкими порами. Полученный раствор испаряют на роторном испарителе. Получают белое порошкообразное вещество массой 0,31 г. Выход 73%. 1H NMR (400 MHz, METHANOL-d4) (δ ppm): 1.04 (d, 18H, Ht-Bu) 7.51 (m 1 H) 7,69 (д, 1H); 7.72 (с, 1H), 7.80 (m 1 H) 8.03 (d, 1 H) 8,16 (д, 1 H), 8.30 (d, 1 H).
Элементный анализ. Вычислено для C32H34N2O8P2S2: C 54,85, H 4,89, N 4,00. Найдено: C 54,51, H 4,53, N 4,27.
Образование комплексов ионов f-элементов с заявляемыми веществами подтверждено следующими примерами.
Пример 10. Комплекс лантана с 2,9-бис(дифенилфосфинил)-1,10-фенантролином
В круглодонную колбу объемом 10 мл, снабженную магнитной мешалкой, помещают 20 мг 2,9-бис(дифенилфосфинил)-1,10-фенантролина, 15 мг гексагидрата нитрата лантана(III) и 5 мл ацетонитрила. Смесь перемешивают при комнатной температуре 15 минут, после чего отгоняют растворитель на роторном испарителе и к остатку прибавляют 2 мл эфира. После выпадения осадка эфир отгоняют, осадок промыва водой и высушивают. Выход 85%.
Элементный анализ: вычислено для LaC36H29N5O11P2 (%): C, 47.75; H, 2.89; N, 7.73. Найдено (%): C, 47.62; H, 3.02N, 7.89; Масс-спектр MALDI-TOF: 843 (100%) LaL(NO3)2+. 31P ЯМР (161.9 MHz, CDCl3): 41 м.д.
Пример 11. Комплекс европия с 2,9-бис(дифенилфосфинил)-1,10-фенантролином
В кругло донную колбу объемом 10 мл, снабженную магнитной мешалкой, помещают 20 мг 2,9-бис(дифенилфосфинил)-1,10-фенантролина, 15 мг гексагидрата нитрата европия(III) и 5 мл ацетонитрила. Смесь перемешивают при комнатной температуре 15 минут, после чего отгоняют растворитель на роторном испарителе и к остатку прибавляют 2 мл эфира. После выпадения осадка эфир отгоняют, осадок промывают водой и высушивают. Выход 78%.
Элементный анализ: вычислено для EuC36H29N5O11P2 (%): C, 47.07; H, 2.85; N, 7.62. Найдено (%): C, 47.43; H, 3.06N, 7.60; Масс-спектр MALDI-TOF: 867 (100%) EuL(NO3)2+. 31P ЯМР (161.9 MHz, CDCl3): 48 м.д.
Пример 12. Комплекс эрбия с 2,9-бис(дифенилфосфинил)-1,10-фенантролином
В круглодонную колбу объемом 10 мл, снабженную магнитной мешалкой, помещают 20 мг 2,9-бис(дифенилфосфинил)-1,10-фенантролина, 15 мг пентагидрата нитрата эрбия(III) и 5 мл ацетонитрила. Смесь перемешивают при комнатной температуре 15 минут, после чего отгоняют растворитель на роторном испарителе и к остатку прибавляют 2 мл эфира. После выпадения осадка эфир отгоняют, осадок промыва водой и высушивают. Выход 80%.
Элементный анализ: вычислено для ErC36H29N5O11P2 (%): C, 46.30; H, 2.81; N, 7.50. Найдено (%): C, 46.52; H, 2.56N, 7.33; Масс-спектр MALDI-TOF: 872 (100%) ErL(NO3)2+.
Пример 13. Комплекс европия с 2,9-бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролином
В колбу объемом 50 мл помещают 57 мг 2,9-бис[ди(3-сульфофенил)фосфонил]-1,10-фенантролина, 29 мг гексагидрата нитрата европия и добавляют 25 мл сухого CH3OH. Перемешивают 30 мин на магнитной мешалке при нагревании. Оставляют на ночь. Выпавший осадок отфильтровывают, промывают метанолом и высушивают. Получили 67 мг белого вещества. Выход 85%. ИК (KBr, см-1): 3390, 3072, 2927, 2859, 1637, 1589, 1567, 1469, 1444, 1402, 1384, 1311, 1253, 1238, 1168, 1105, 1035, 860, 796, 688, 617, 545, 457. 1H NMR (400 MHz, DMSO-d6) (δ ppm): 7.62 (br. s., 1 H) 7.93 (dd, J=8.07, 7.34 Hz, 1 H) 8.03 (d, J=5.14 Hz, 1 H) 8.27 (br. s., 1 H) 8.56 (d, J=9.29 Hz, 1 H) 8.63 (d, J=6.85 Hz, 1 H). 31P ЯМР (161.9 MHz, CDCl3): 14.10 м.д.
Элементный анализ: вычислено для EuC34H26N5O23P2S4 (%): C, 33.62; H, 2.16; N, 5.77. Найдено (%): C, 33.23; H, 1.70 N, 5.60.
Люминесцентные свойства комплексов лантаноидов с заявляемыми веществами подтверждаются следующими примерами:
Пример 14. Спектры испускания люминесценции комплекса европия с 2,9-бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролином в ДМСО
В кювету (Vкюветы=3,6 мл) добавляют 0,04 мл раствора комплекса с Eu3+ в диметилсульфоксиде и 1,6 мл диметилсульфоксида, после чего проводят спектральные измерения спектра люминесценции при длине волны возбуждения 270 нм. Спектр испускания люминесценции приведен на фиг. 1.
Пример 15. Спектры испускания люминесценции комплекса европия с 2,9-бис[ди(3-сульфофенил)фосфинил]-1,10-фенантролином в водном ДМСО
В кювету (Vкюветы=3,6 мл) добавляют 0,04 мл раствора комплекса с Eu3+ в диметилсульфоксиде и 1,6 мл диметилсульфоксида, после чего проводят спектральные измерения спектра люминесценции при длине волны возбуждения 270 нм. Затем каждый раз после измерений добавляют в кювету по 0,2 мл H2O до 1,8 мл H2O. Спектры испускания люминесценции приведены на фиг. 2. Данные по квантовым выходам люминесценции приведены в таблице 1.