Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pER-APHC3, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием APHC3, штамм Escherichia coli C3030/pER-APHC3 продуцент указанных белков и способ получения рекомбинантного APCH3
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генной и белковой инженерии. Оно может быть использовано для получения рекомбинантного АРНС3.
АРНС3 - это анальгетический полипептид актинии Heteractiscrispa. АРНС3 обладает трипсинингибирующей активностью, способен ингибировать in vitro болевой ваниллоидный рецептор TRPV1, а также оказывает анальгетическое действие in vivo. Проявляемые им свойства позволяют применять данный полипептид для лечения заболеваний, связанных с воспалительными или нейропатологическими процессами, а также использовать как анальгетический агент.
АРНС3 представляет собой 56-членный полипептид (SEQ ID NO 2).
Известен метод выделения АРНС3 из природного источника (S.A. Kozlov, Ya, A. Andreev, А.N. Murashev, D.I. Skobtsov, I.A. D'yachenko, and E.V. Grishin. Russian Journal of Bioorganic Chemistry, 2009, vol. 35, No. 6, pp. 711-719). Недостаток данного метода заключается в небольших выходах продукта и невозможности масштабировать выделение.
Прототип, наиболее близкий к заявленному для патентования способу получения АРНС3, описан в работе (Yaroslav A. Andreev, Sergey A. Kozlov, Yuliya V. Korolkova, Igor A. Dyachenko, Dmitrii A. Bondarenko, Denis I. Skobtsov, Arkadii N. Murashev, Polina D. Kotova, Olga A. Rogachevskaja, Natalia V. Kabanova, Stanislav S. Kolesnikov, and Eugene V. Grishin. MarDrugs. 2013 Dec; 11(12): 5100-5115). В данной работе пептид получали биотехнологическим методом с использованием экспрессии рекомбинантного гена в бактерии. В результате экспрессии гена синтезировался гибридный белок, состоящий из целевого пептида, тиоредоксина и аффинных меток. Недостаток данного метода заключается в необходимости использовать TEV-протеиназу для выделения из гибридного белка АРНС3.
Изобретение решает задачу получения высокопродуктивного рекомбинантного бактериального штамма-продуцента, позволяющего получать рекомбинантный АРНС3 с высоким выходом и по упрощенной технологии.
Поставленная задача решается за счет того, что:
1. Конструируют экспрессионную плазмиду ДНК pER-АРНС3 путем клонирования гена АРНС3 в векторной плазмидер TWIN1.
2. Путем трансформации плазмидной ДНК pER-АРНС3 клеток Escherichia coli С3030 получают штамм-продуцент.
3. При индуцированном культивировании штамм-продуцента происходит биосинтез рекомбинантной гибридного белка DnaBAPHC3 в виде телец включения, содержащего наряду с АРНС3 и последовательность мини-интеина Ssp DnaB.
4. Клеточную биомассу разрушают в буферном растворе и выделяют осадок, содержащий гибридный белок АРНС3. Гибридный белок АРНС3 экстрагируют из телец включения буферным раствором (50 мМ Трис/HCl, 2 М мочевина, 10 мМ ЭДТА, 1 мМ PMSF, 0,5 ДТТ, pH 10) центрифугируют и выделяют супернатант. Супернатант растворяют в ренатурирующем буфере (100 мМ Трис/HCl, 10 мМ глицерин, 1 мМ PMSF). Доводят pH раствора соляной кислотой до 7.2, тем самым инициируя автокаталитическое расщепление гибридного белка, и инкубируют при 22°С в течение 48 ч. Доводят pH раствора соляной кислотой до 3.0 и инкубируют при 8°С 24 ч. Центрифугируют и супернатант наносят на ионообменную смолу. Элюируют белок ступенью буфера 50 мМ MES, 1,5 М NaCl, pH 5,5-5,6. Дальнейшую очистку и анализ рекомбинантного АРНС3 проводят посредством обращенно-фазовой хроматографии. Идентификация образующегося рекомбинантного АРНС3 проведена с помощью масс-спектрометрии.
Техническим результатом автокаталитического расщепления гибридного белка является образование АРНС3, выход которого достигает 10% относительно суммарного белка клетки при чистоте препарата не ниже 98%.
Чтобы избежать трудностей, связанных с расщеплением рекомбинантного гибридного белка с помощью различных протеаз, таких как энтерокиназа, фактор X и др., а также с целью удешевления этой стадии мы использовали в составе гибридного белка мини-интеин dnaB из Synechocystissp. (Wu, Н., Xu, M.-Q., Liu, X.-Q. (1998) Biochim. Biophys. Acta, 1387, 422-4327) для направленного автокаталитического расщепления гибрида на целевой полипептид и интеин. Для этой цели амплифицируют ген АРНС3 (SEQ ID NO 1) с помощью ПЦР, используя в качестве матрицы плазмиду с искусственным геном АРНС3, и клонировали его в векторной плазмиде pTWIN1, содержащей ген интеина из Synechocystissp. dnaB (Wu, Н., Xu, M.-Q., Liu, X.-Q. (1998) Biochim. Biophys. Acta, 1387, 422-432.; Evans, J, T.C., Bermer, J., Xu, M.-Q., (1999) J. Biol. Chem., 274, 18359-18363), по сайтам рестриктаз SapI и BamHI. Полученной экспрессионной плазмидой pER-АРНС3, строение которой приведено на фиг. 1, трансформировали клетки E.coli С3030. Образующийся при экспрессии рекомбинантного гена гибридный белок DnaBAPHC3 способен к автокаталитическому расщеплению на АРНС3 и интеин. Выход АРНС3 высокой степени чистоты (98%) после обращенно-фазовой хроматографии достигает 10% относительно суммарного белка клетки.
В предлагаемом техническом решении используют штамм-продуцент Escherichia coli С3030, содержащий плазмидную ДНК pER-АРНС3 для суперпродукции гибридного белка DnaBAPHC3, содержащего последовательность АРНС3 и интеин Ssp dnaB.
Используют рекомбинантную плазмидную ДНК pER-АРНС3
- кодирующую аминокислотную последовательность рекомбинантного АРНС3;
- состоящую из:
BsaBI/Eco0109I-фрагмента ДНК коммерческой плазмиды pTWIN1 (фирма NewEnglandBiolabs), содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, NdeI/BamHI-фрагмент ДНК, содержащего ген мини-интеина DnaB и адаптированную к этим сайтам последовательность гена рекомбинантного АРНС3,
- содержащую:
в качестве генетического маркера ген β-лактамазы, детерминирующей устойчивость трансформированных плазмидой pER-АРНС3 клеток E.coli к пенициллиновым антибиотикам;
уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamHI-NdeI-: 849 п.о., XbaI - 888 п.о., EcoRV - 2921 п.о., HpaI - 2977 п.о.
Конструкция рекомбинантной плазмидной ДНК pER-АРНС3 обеспечивает высокий уровень экспрессии клонированного в ней гена гибридного белка DnaBAPHC3, содержащего на 3'-конце ген АРНС3, соединенного с геном SspDnaB. Для конструирования плазмиды используют химический подход, позволяющий использовать для экспрессии клонированного структурного гена оптимальные регуляторные элементы, контролирующие его экспрессию.
Ген АРНС3 получают амплификацией участка плазмиды (Yaroslav A. Andreev, Sergey А. Kozlov, Yuliya V. Korolkova, Igor A. Dyachenko, Dmitrii A. Bondarenko, Denis I. Skobtsov, Arkadii N. Murashev, Polina D. Kotova, Olga A. Rogachevskaja, Natalia V. Kabanova, Stanislav S. Kolesnikov, and Eugene V. Grishin. MarDrugs. 2013 Dec; 11(12): 5100-5115).
Концевые его участки, содержащие соответствующие вектору сайты эндонуклеаз рестриции, введены с помощью ПЦР с синтетическими олигонуклеотидными праймерами А1 и Bl (SEQ ID NO 3) и затем ген клонируют в векторную плазмиду pTWIN1.
Предлагаемый штамм-продуцент Escherichia coli С3030/pER-АРНС3 характеризуется следующими признаками.
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки. Клетки растут при температуре от 4°С до 40°С при оптимуме pH от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент E.coli С3030/pER-АРНС3 отличается от штамма-реципиента E.coli С3030 только наличием рекомбинантной плазмидной ДНК pER-АРНС3, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Штаммы-продуценты получают путем трансформации компетентных клеток E.coli С3030 соответствующей рекомбинантной плазмидной ДНК.
Клетки E.coli С3030/pER-АРНС3 являются суперпродуцентами. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез гибридного белка DnaBAPHC3, который накапливается в клетках в количестве 20% суммарного белка клетки в растворимом виде.
Изобретение осуществляют следующим образом. Конструируют рекомбинантную плазмидную ДНК pER-АРНС3, для чего ген рекомбинантного АРНС3 амплифицируют с помощью ПЦР с синтетическими олигонуклеотидными праймерами (SEQ ID NO 3), содержащими сайты рестриктаз SapI (N-конец гена, праймер А1) и BamHI (С - конец гена, праймер В1), полученную ДНК расщепляют соответствующими рестриктазами и затем лигируют с расщепленной по тем же сайтам векторной плазмидой pTWIN1. Лигазной смесью трансформируют компетентные клетки E.coli С3030 и высевают на LB-агар, содержащий 50 мкг/мл ампициллина или другого пенициллинового антибиотика. Полученные клоны анализируют с помощью секвенирования.
Штамм-продуцент E.coli C3030/pER-АРНС3 выращивают в богатой среде (YT-, LB-бульон и др.) (или индуцируют изопропилтио-β-D-галактозидом и снова выращивают) до достижения максимальной плотности культуры.
На (SEQIDNO 1) изображена структура гена рекомбинантного АРНС3. На (SEQIDNO 2) изображена аминокислотная последовательность рекомбинантного АРНС3.
Изобретение иллюстрируется следующими рисунками.
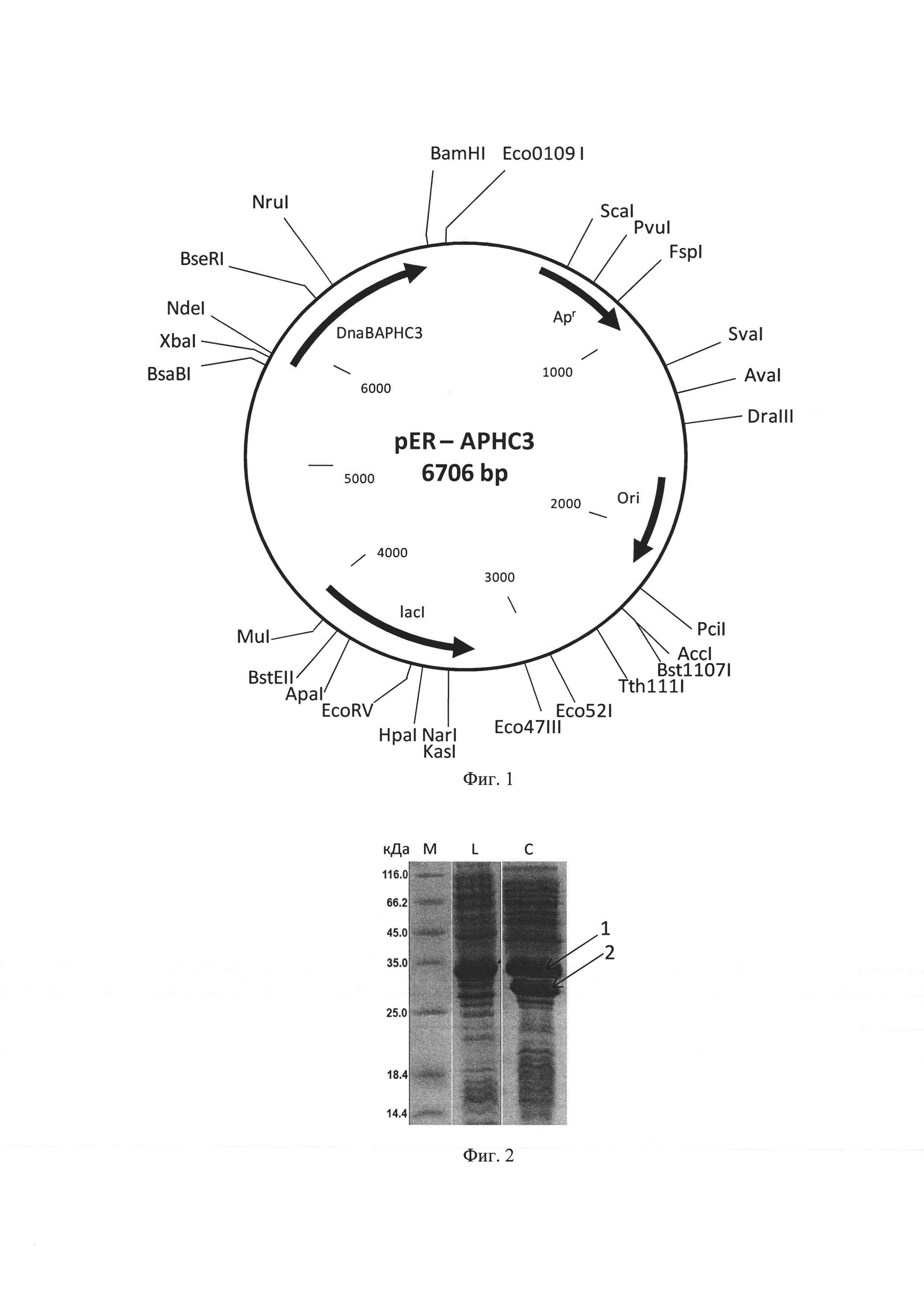
Фиг. 1 - Физическая карта плазмиды pER-АРНС3.
Фиг. 2 - Электрофорграммализата клеток штамма-продуцента E.coli С3030/pER-АРНС3.
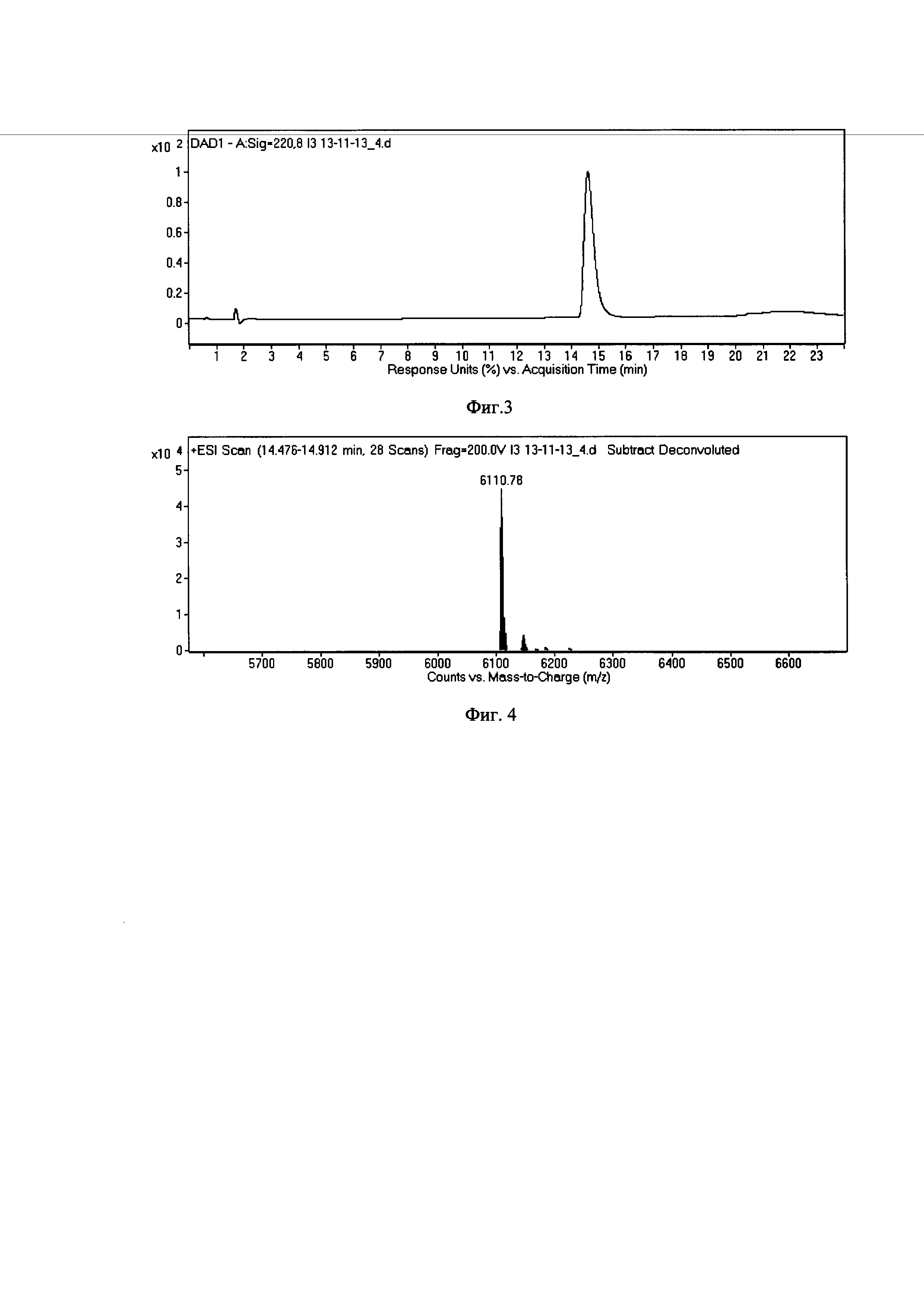
Фиг. 3 - Профиль аналитической ВЭЖХ рекомбинантного АРНС3.
Фиг. 4 - Масс-спектрометрический анализ рекомбинантного АРНС3.
Изобретение иллюстрируется нижеследующими примерами.
Пример 1
Конструирование рекомбинантной плазмидной ДНК
Химический синтез олигонуклеотидов выполняют твердофазным фосфоамидитным методом на ДНК-синтезаторе ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3'-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Используют синтетический цикл стандартного фосфоамидитного метода.
Для приготовления вектора ДНК плазмиды pTWTN1 (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, pH 7,9, 10 мМ Mg-ацетат, 66 мМ К-ацетат 1, 0,5 мМ DTT, 0,1 мг/мл BSA) рестриктазой SapI (10 ед. акт.), а затем - в 40 мкл буфера R (10 мМ трис-HCl, pH 8,5, 10 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл BSA) рестриктазой BamHII (10 ед. акт.) в течение 1 ч при 37°С. Векторный фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку Nucleo Spin ExtractII. Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Для приготовления гена АРНС3 проводят амплификацию с помощью ПЦР, используя в качестве матрицы плазмиду с искусственным геном АРНС3 (0,01 мкг в образце), а в качестве праймеров - синтетические олигонуклеотиды А1 и В1 (по 60 пмоль каждого). ПЦР проводят в ДНК-амплификаторе, в буферном растворе, состоящем каждый из четырех dNTP в концентрации 0,5 мМ и 5 ед. акт. Taq-ДНК-полимеразы, в следующем режиме: денатурация - 1 мин при 94°С, отжиг - 30 сек при 60°С, элонгация - 40 сек при 72°С, 30 циклов ПЦР. Ген после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку Nucleo Spin ExtractII. Промывают буфером NT 3 и элюируют 50 мкл буфера NE, затем расщепляют теми же рестриктазами, которые используют при приготовлении вектора, и выделяют целевой фрагмент из агарозного геля.
Полученный синтетический фрагмент с геном рекомбинантного АРНС3 в количестве 2 пмоль прибавляют к раствору 1 мкг описанного выше векторного фрагмента в 10 мкл буфера (20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреитол) и лигируют с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
Аликвоту реакционной смеси используют для трансформации компетентных клеток E.coli С3030. Трансформанты высевают на чашки с LB-агаром, содержащим 50 мкг/мл ампициллина. Из клонов выделяют ДНК плазмиды pER-АРНС3 и анализируют с помощью эндонуклеаз NdeI, BamHI. Скрининг рекомбинантов проводят с помощью секвенирования. Физическая карта плазмиды pER-АРНС3 представлена на фиг. 1. Указаны сайты эндонуклеаз рестрикции. Ori - участок инициации репликации пзамиды. ApR - ген устойчивости к ампицилину. Lad - ген репрессора лактозного оперона. DnaBAPHC3 - ген рекомбинантного белка, кодирующий АРНС3 и интеин DnaB.
Пример 2
Получение штамма-продуцента E.coli C3030/pER-АРНС3 и определение его продуктивности
Штамм-продуцент E.coli C3030/pER-АРНС3 получают трансформацией компетентных клеток E.coli С3030 плазмидой pER-АРНС3, как описано в примере 1.
Штамм продуцента E.coli C3030/pER-АРНС3 выращивают при 37°С в 100 мл LB-бульона (pH 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч, или продолжают выращивание в отсутствие индуктора в течение 6 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 сек ультразвуком, нагревают 3 мин при 100°С и пробы по 4 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930. На фиг 2. представлена электрофорграмма лизата клеток штамма-продуцента E.coli C3030/pER-АРНС3, где М - стандарт молекулярных масс, L - лизат клеток, С - расщепление гибридного белка, 1 - гибридный белок, содержащий АРНС3, 2 - интеин Dnab.
Пример 3
Получение гибридного белка АРНС3, его автокаталитическое расщепление и выделение рекомбинантного АРНС3
После окончания ферментации клетки продуцента гибридного белка (биомассу) отделяют центрифугированием (5000 g, 20 мин, 4°С), разрушают на ультразвуковом дезинтеграторе в буфере (50 мМ Tris/HCl, 10 mMEDTA, 1 mMPMSF) и выделяют центрифугированием (15000 g, 45 мин) осадок. Гибридный белок экстрагируют из телец включения буферным раствором (50 мМ Трис/HCl, 2 М мочевина, 10 мМ ЭДТА, 1 мМ PMSF, 0,5 ДТТ, pH 10) центрифугируют и выделяют супернатант. Супернатант растворяют в ренатурирующем буфере (100 мМ Трис/HCl, 10 мМ глицерин, 1 мМ PMSF). Доводят pH раствора соляной кислотой до 7.2, тем самым инициируя автокаталитическое расщепление гибридного белка, и инкубируют при 22°С в течение 48 ч. Из полученной смеси отбирают пробу в количестве 30 мкл и с красителем бромфеноловым синим нагревают 3 мин при 100°С. Пробы по 4 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930. Ha Фиг. 2 представлено расщепление гибридного белка. После инкубирования при 22°С в течение 48 ч доводят pH раствора соляной кислотой до 3.0 и инкубируют при 8°С 24 ч. Центрифугируют и супернатант наносят на ионообменную смолу. Элюируют белок ступенью буфера 50 мМ MES, 1,5 М NaCl, pH 5,5-5,6. Дальнейшую очистку и анализ рекомбинантного АРНС3 проводят посредством обращенно-фазовой хроматографии. Идентификацию образующегося рекомбинантного АРНС3 проводят с помощью TOF-ESI-масс-спектрометрии на масс-спектрометре Agilenttechnologies 6224. Полученный сигнал рекомбинантного АРНС3 соответствует расчетному значению массы 6111 Да. На фиг. 3 представлен профиль аналитической ОФ ВЭЖХ АРНС3. На Фиг. 4 представлен масс-спектр АРНС3.
Пример 4
Тестирование анальгетической активности АРНС3 на мышах в тесте горячая пластина
Мышей делят на 2 группы (контрольную и экспериментальную) по 10 особей в каждой. Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Болевое раздражение моделируют, помещая мышь на металлическую поверхность, разогретую до 55°С. Для предотвращения ожогов лап время воздействия раздражения ограничивают 180 секундами. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в дозе 0,1 мг/кг внутривенно. Анальгетический эффект измеряют по увеличению времени прошедшего от момента посадки животного на пластину до момента первого облизывания задней лапы. Измерение болевой чувствительности проводят через 15 минут после введения препарата. Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной группы определяют с помощью ANOVA и теста Тьюки. Полученный рекомбинантный пептид в данной концентрации увеличивает измеряемое время не менее чем на 50%.