Результат интеллектуальной деятельности: Универсальная противогриппозная вакцина
Вид РИД
Изобретение
Изобретение относится к биотехнологии и медицине и касается профилактики гриппа. Предложена противогриппозная вакцина на основе консервативных антигенов М2 и NP вируса гриппа А, которая способна защищать человека одновременно против различных штаммов вируса гриппа А, что позволяет рассматривать ее в качестве универсальной вакцины.
Предшествующий уровень техники
Грипп - социально значимое инфекционное заболевание, возбудителями которого являются различные штаммы вируса гриппа А, В и С. Наиболее высокую угрозу в эпидемическом отношении представляют вирусы гриппа А в следствии их высокой контагиозности, выраженной антигенной изменчивости, широкого распространения, а также способности вызывать пандемии через нерегулярные временные интервалы.
Научно-обоснованным методом профилактики гриппа является вакцинация. При этом основной проблемой является ее переменная эффективность, связанная с постоянной антигенной изменчивостью вируса, связанная преимущественно с поверхностными белками гемагглютинином и нейраминидазой.
Кроме того, существуют производственные ограничения для своевременной коррекции и выпуска в достаточном количестве вакцин, соответствующих циркулирующим штаммам вируса гриппа.
На сегодняшний день основную долю вакцин против гриппа составляют живые аттенуированные, инактивированные и субъединичные вакцины. Однако такие вакцины индуцируют образование, в основном штамм-специфичных антител к гемагглютинину и нейраминидазе, и поэтому не способны обеспечить защиту от широкого спектра различных штаммов вируса гриппа, существенно различающихся структурой своих поверхностных антигенов. Таким образом, существует необходимость постоянного мониторинга циркулирующих в человеческой популяции штаммов и периодического обновления специфических компонентов современных противогриппозных вакцин. Кроме того, актуальным остается вопрос о безопасности применения живых аттенуированных вакцин и о предупреждении поствакцинальных осложнений.
Создание высоко иммуногенных и безопасных противогриппозных вакцин, обеспечивающих индукцию протективного иммунного ответа широкого спектра действия против вируса гриппа А, является важной задачей современной биотехнологии. В настоящее время актуальна разработка универсальной вакцины, которая одновременно может защитить против различных штаммов вируса А. В качестве ключевых компонентов таких вакцин, должны выступать консервативные антигены вируса, индуцирующие образование кросс-реактивных антител и цитотоксических Т-лимфоцитов. Наиболее перспективными из таких антигенов вируса гриппа А считают белок М2 (ионный канал) и нуклеопротеин NP.
Белок М2 является одним из поверхностных антигенов вируса и обладает высокой степенью консервативности [1]. Антитела против эктодомена белка М2 способны ограничивать размножение вируса и образование вирусных бляшек в монослое клеток [2]. Кроме того, белок М2 способен индуцировать защиту против различных подтипов вируса гриппа [3].
Нуклеопротеин NP является одним из внутренних антигенов вируса и индуцирует выработку специфических цитотоксических Т-лимфоцитов. Антигенные изменения в последовательности белка NP среди различных штаммов вируса гриппа А являются очень редкими [4,5]. Показано, что кандидатные вакцины на основе вирусных векторов, несущих ген NP вируса гриппа А, способны обеспечивать защиту иммунизированных животных от штаммов вируса, относящихся к разным подтипам [6]. Вышеперечисленные свойства белков М2 и NP делают их перспективными для использования в качестве компонентов универсальной вакцины против гриппа.
Недостатком использования антигена М2 является сложность его получения, вследствие токсичности для эукариотических и прокариотических клеток. Поэтому для создания противогриппозных вакцин в основном используют эктодомен белка М2 (М2е), состоящий из первых 24 N-концевых аминокислот. В свою очередь недостатком использования М2е является его низкая иммуногенность, что делает необходимым применение различных адъювантов.
Недостатком использование одного антигена NP является индукция в основном цитотоксического иммунного ответа, кроме того, наличие у белка NP сигнала ядерной локализации препятствует его процессингу в цитоплазме и, таким образом, снижает его иммуногенность.
Известно техническое решение, в котором предложена вакцина против инфекции, вызываемой вирусом гриппа А птиц, включающая в качестве активного агента вирусоподобные частицы на основе ядерного антигена вируса гепатита В, представляющие на своей поверхности полипептиды внеклеточного домена М2 белка вируса гриппа птиц. Полученные препараты обладают активностью в отношении различных штаммов вируса гриппа птиц и, по мнению авторов, могут рассматриваться в качестве кандидата на универсальную вакцину против вируса гриппа птиц типа А, обеспечивающей эффективную защиту против эволюционирующих вирусов гриппа птиц (Патент RU №2358981, 07.08.2007). Недостатками данного технического решения можно считать:
1. Использование эктодомена белка М2, тогда как полноразмерный белок М2 является более иммунногенным.
2. Использование последовательностей М2е от конкретных штаммов вируса гриппа (подтипа H5N2 и H5N1), может быть недостаточно для индукции гетеросубтипического иммунного ответа против других подтипов вируса гриппа А птиц.
3. Отсутствие в частице М2Е-НВс компонента стимулирующего врожденный иммунный ответ, что может занижать иммуногенность вакцины.
4. Необходимость 2-х или 3-х-кратного подкожного или внутрибрюшинного введения, что усложняет процедуру иммунизации.
Аналогом настоящего изобретения также является универсальная вакцина против гриппа А, основанная на вирусоподобных частицах, где ключевым компонентом является химерный белок, состоящий из гетерологичных эктодоменов белка М2 (WO 2014070848 A1). Недостатком этого технического решения является отсутствие индуктора сильного клеточного иммунного ответа, кроме того эктодомен белка М2 является менее иммуногенным, чем полноразмерный белок М2.
Другим аналогом является универсальная рекомбинантная вакцина против гриппа, основанная на векторе вируса осповакцины, экспрессирующего гены НА, NA, M1, М2, NP вируса гриппа A H5N1, а также ген молекулярного адъюванта IL-15 (Proc Natl Acad Sci USA. 2014 Apr 15; 111(15): 5676-81). Препарат продемонстрировал протективную активность в отношении вирусов гриппа А подтипов Н1Н1 (пандемический 2009), H3N2, H7N7 и H7N9. Недостатком этого технического решения является использование генов от конкретного подтипа вируса гриппа А H5N1, что может быть недостаточным для индукции иммунного ответа широкого спектра и создания вакцины, эффективной в отношении всего многообразия сезонных штаммов вируса гриппа А.
Прототипом предлагаемого изобретения является вакцина против вируса гриппа А человека на основе рекомбинантных аденовирусов шимпанзе серотипов С68 и С6, экспрессирующих ген химерного полипептида M2e(3)-NP (AdC68-M2e(3)-NP и AdC6-M2e(3)-NP). Химерный полипептид M2e(3)-NP содержит три аминокислотные последовательности эктодомена белка М2 от трех различных подтипов вируса гриппа A (H1N1, H5N1 и H7N2), соединенные с аминокислотной последовательностью белка NP подтипа вируса A (H1N1), и несущие на N-конце сигнальный пептид от гликопротеина D вируса простого герпеса-1. Вакцина иммуногена и обладает протективной активностью в отношении вирусов гриппа A/PR/8/34 и A/Fort Monmouth/1/47 на лабораторных животных, что позволяет рассматривать ее в качестве кандидата на универсальную вакцину против вируса гриппа человека широкого спектра действия. (Патент США № US 2013/0209512 A1).
Недостатками подобной конструкции можно считать:
- использование не полноразмерного белка М2, а лишь его эктодомена, что снижает иммуногенные возможности препарата;
- наличие сигнального пептида от гликопротеина D вируса простого герпеса-1 способствует транспорту химерного полипептида M2e(3)-NP в межклеточное пространство, однако для индукции более высокого уровня клеточного иммунного ответа к антигену NP необходим его синтез и процессинг в цитоплазме;
- использование аминокислотных последовательностей белков М2е и NP от конкретных штаммов вируса гриппа, может быть недостаточным для индукции иммунного ответа широкого спектра и создания вакцины в отношении всего многообразия сезонных штаммов вируса гриппа А.
- необходимость двукратного внутримышечного введения, (требует праймирование AdC68-M2e(3)-NP и бустирование AdC6-M2e(3)-NP), что усложняет процедуру иммунизации.
Таким образом, существует необходимость в подборе более универсальных аминокислотных последовательностей антигенов М2 и NP, повышении их иммуногенности, а также подбор альтернативного способа введения вакцины.
Для расширения спектра защиты возможна подборка оптимальных консенсусных аминокислотных последовательностей антигенов М2 и NP, наиболее гомологичных среди различных штаммов вируса гриппа А. Для повышения иммуногенности белка М2 перспективно использование полноразмерной его последовательности вместо эктодомена. Проблемы, связанные с токсичностью полноразмерного белка М2, могут быть эффективно решены при помощи использования индуцибельного промотора, позволяющего с помощью антибиотика блокировать экспрессию гена М2 на стадии получения рекомбинантных аденовирусных частиц. Повышение иммуногенности антигена NP может быть достигнуто путем экспрессии его гена отдельно от гена М2, а также удалением из его аминокислотной последовательности сигнала ядерной локализации, что будет обеспечивать процессинг NP в цитоплазме и более эффективную презентацию его в составе МНС I класса, что необходимо для индукции цитотоксического иммунного ответа. Кроме того, повышение уровня иммуногенности антигена NP может быть достигнуто путем его модификации мотивом PEST. Как известно, последовательность мотива PEST является сигналом для полиубиквитинирования белка, в свою очередь это ведет к быстрой деградации убиквитинированного белка на мелкие пептиды, которые затем могут транспортироваться в эндоплазматический ретикулум, связываться с молекулами МНС I класса и стимулировать клеточный иммунный ответ.
Перспективным является использование интраназальной иммунизации, которая обеспечивает индукцию мукозального иммунного ответа, особенно важного при гриппозной инфекции, и, кроме того, позволяет эффективно избегать предсуществующего иммунного ответа, что исключает необходимость применения аденовирусов шимпанзе в качестве вектора и использовать наиболее изученные и клинически испытанные серотипы аденовируса человека.
Одним из наиболее эффективных на сегодняшний день подходов для создания безопасных и эффективных вакцин нового поколения является использование генетических вакцин, в том числе базирующихся на рекомбинантных аденовирусных векторах. При введении в организм таких вакцин происходит попадание генетического материала в клетки и экспрессия в них генов целевых белков патогена. В результате антигены соответствующих патогенов распознаются иммунной системой, что приводит к индукции как гуморального, так и клеточного иммунного ответа. В настоящее время наиболее перспективными и часто используемыми для создания генетических вакцин являются рекомбинантные псевдоаденовирусные частицы (РПАН), созданные на основе аденовируса человека пятого серотипа.
Сущность предлагаемого изобретения заключается в создании РПАН на основе аденовируса человека пятого серотипа со встроенной генетической конструкцией, кодирующей разработанные оптимальные консенсусные полноразмерные аминокислотные последовательности антигенов М2 и NP, наиболее гомологичные для различных штаммов вируса гриппа А, гены которых разделены последовательностью, кодирующей саморасщепляющийся пептид 2А вируса ящура, и экспрессируются под контролем системы Tet-off в качестве индуцибельного промотора для блокирования экспрессии гена М2 на стадии получения рекомбинантных аденовирусных частиц, и при этом ген белка NP модифицирован удалением сигнала ядерной локализации и мотивом PEST, являющимся сигналом для полиубиквитинирования белка.
Вакцины на основе РПАН имеют ряд преимуществ:
РПАН - являются репликативно-дефектными и не способны вызывать заболевания. Безопасность аденовирусов человека пятого серотипа с делегированными E1 и Е3 областями генома подтверждается целым рядом проведенных клинических испытаний различных вакцинных и терапевтических препаратов на их основе [7];
не требуют многократных дополнительных введений, так как экспрессия целевого антигена (фьюжн-белка) происходит непосредственно в организме иммунизированного субъекта;
РПАН позволяют проводить интраназальную иммунизацию, и, как следствие, индуцируют образование мукозального иммунного ответа;
РПАН по сравнению с рекомбинантными белками, получаемыми в культуре эукариотов, более дешевы и высокоиммуногенны, так как небольшая доза РПАН позволяет продуцировать в организме значительные количества белка;
на сегодняшний момент разработаны быстрые и гибкие технологии получения РПАН, позволяющие реализацию масштабного производства различных кандидатных вакцин на их основе, на одной технологической линии без ее переоборудования и изменения регламента.
Вышеперечисленные свойства делают РПАН хорошей технологической платформой для создания широкого спектра вакцин против различных патогенов.
Раскрытие изобретения
Цель настоящего изобретения - создание универсальной противогриппозной вакцины, обладающей протективной активностью.
Термин «универсальная вакцина» для целей настоящего изобретения означает вакцину, способную индуцировать протективный иммунный ответ широкого спектра против различных штаммов вируса гриппа А человека и птиц.
Технической задачей изобретения являлось получение противогриппозной вакцины широкого спектра действия на основе рекомбинантных псевдоаденовирусных частиц, экспрессирующих гены полноразмерных белков М2 и NP вируса гриппа А, под контролем индуцибельного промотора.
Технический результат - получение вакцины, способной одновременно эффективно защищать человека от заражения различными штаммами вируса гриппа А.
Задача решается за счет того, что противогриппозная вакцина широкого спектра действия против вируса гриппа А человека создана на основе полноразмерных белков М2 и NP, при этом гены данных белков экспрессируются рекомбинантными псевдоаденовирусными частицами непосредственно в организме субъекта. Заявленная противогриппозная вакцина содержит на дозу:
- рекомбинантные псевдоаденовирусные частицы, экспрессирующие гены М2 и NP, - 106-109 бляшкообразующих единиц (БОЕ)/мл;
- фармацевтически приемлемый буфер - до 0,5 мл.
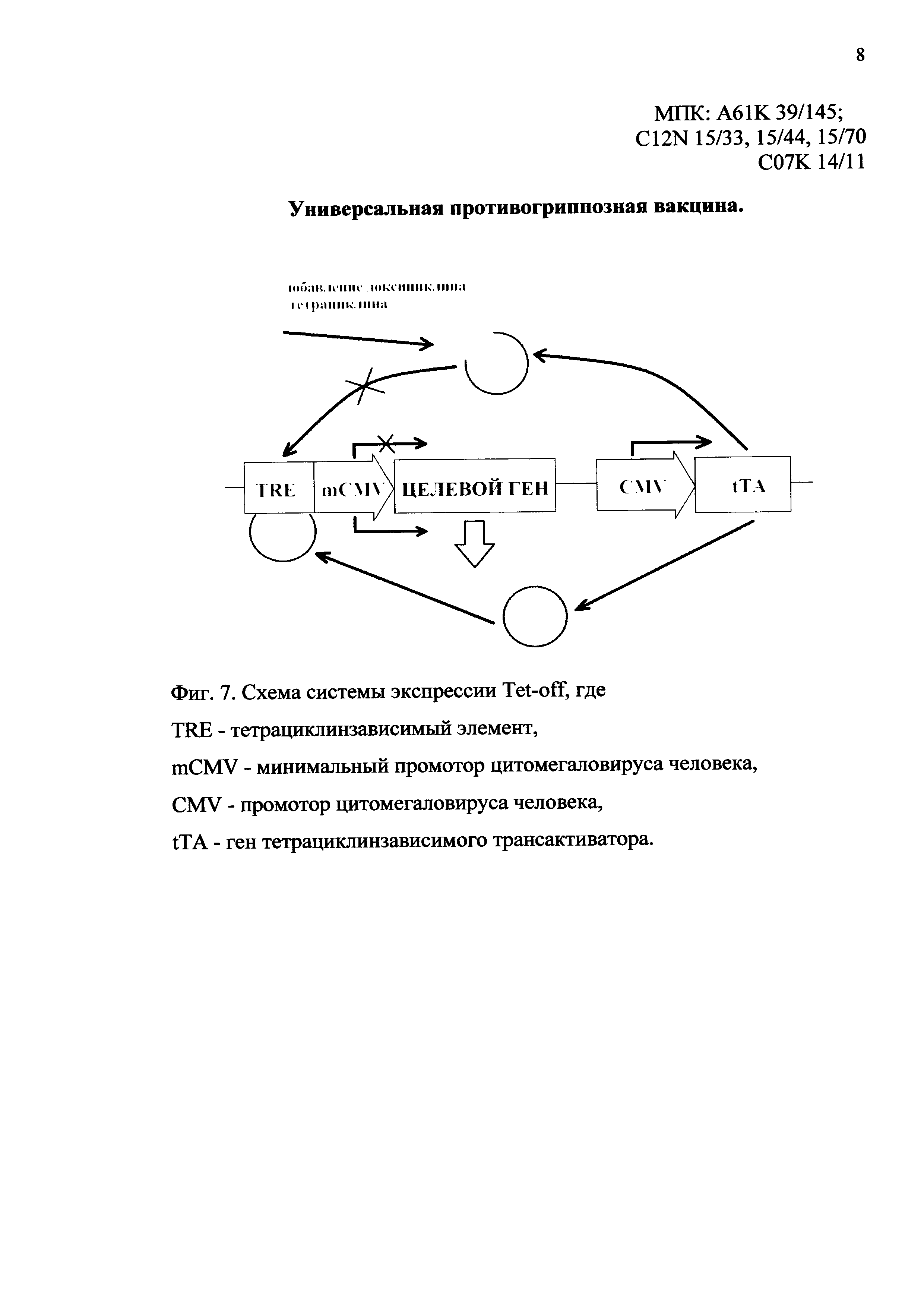
В заявленной противогриппозной вакцине нуклеотидная последовательность гена, кодирующего консенсусную аминокислотную последовательность белка М2 представлена SEQ ID NO: 4 (фиг. 4), нуклеотидная последовательность гена, кодирующего консенсусную аминокислотную последовательность белка NP, представлена SEQ ID NO: 5 (фиг. 5). Предлагаемые нуклеотидные последовательности разделены нуклеотидной последовательностью, кодирующей саморасщепляющийся пептид 2А вируса ящура, позволяющий экспрессировать гены полноразмерных белков М2 и NP раздельно под контролем общего промотора. Нуклеотидная последовательность пептида 2А представлена SEQ ID NO: 6 (фиг. 6). Аминокислотные последовательности белков М2, NP и 2А пептида представлены SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3 соответственно (фиг. 1-3). В качестве индуцибельного промотора заявленная вакцина содержит регуляторные элементы системы экспрессии Tet-off. Данная система позволяет блокировать экспрессию подконтрольных генов путем добавления доксициклина или тетрациклина. Система Tet-off основана на использовании двух экспрессионных кассет в одной плазмиде (фиг. 7). Первая кассета содержит целевые гены под контролем тетрациклинзависимого элемента (TRE), состоящего из оператора (tetO) и находящегося за ним минимального промотора цитомегаловируса человека (minCMV). Для активации экспрессии целевого гена необходимо, чтобы с TRE связался тетрациклинконтролируемый трансактиватор (tTA). Ген tTA находится во второй экспрессионной кассете под контролем промотора CMV и экспрессируется конститутивно. Доксициклин или тетрациклин способны блокировать трансактиватор tTA и предотвращать его связывание с TRE, что ведет к остановке экспрессии целевых генов в первой экспрессионной кассете. Таким образом, при трансфекции эукариотических клеток плазмидами, в состав которых включена Tet-off система, добавление в культуральную среду доксициклина приводит к ингибированию экспрессии целевого гена.
Краткое описание чертежей.
Для более ясного понимания заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ, далее приводится подробное описание и ссылки на фигуры чертежей.
На фиг. 1 представлена консенсусная аминокислотная последовательность полноразмерного белка М2 (SEQ ID NO: 1).
На фиг. 2 представлена консенсусная аминокислотная последовательность полноразмерного белка NP с удаленным сигналом ядерной локализации и модифицированная мотивом PEST (SEQ ID NO: 2).
На фиг. 3 представлена аминокислотная последовательность пептида 2А вируса ящура (SEQ ID NO: 3).
На фиг. 4 представлена нуклеотидная последовательность гена белка M2 (SEQIDNO: 4).
На фиг. 5 представлена нуклеотидная последовательность гена белка NP (SEQIDNO: 5).
На фиг 6 представлена нуклеотидная последовательность гена 2А пептида (SEQ ID NO: 3).
На фиг. 7 изображена схема системы экспрессии Tet-off, составные части которой:
TRE - тетрациклинзависимый элемент,
mCMV - минимальный промотор цитомегаловируса человека,
CMV - промотор цитомегаловируса человека,
tTA - ген тетрациклинзависимого трансактиватора.
На фиг. 8 представлена схема созданной генетической конструкции, экспрессирующей гены белков М2 и NP под контролем системы экспрессии Tet-off, составные части которой:
TRE - тетрациклинзависимый элемент,
mCMV - минимальный промотор цитомегаловируса человека,
CMV - промотор цитомегаловируса человека,
tTA - ген тетрациклинзависимого трансактиватора.
М2 - ген белка М2,
2А - нуклеотидная последовательность, кодирующая пептид 2А вируса ящура,
NP - ген белка NP.
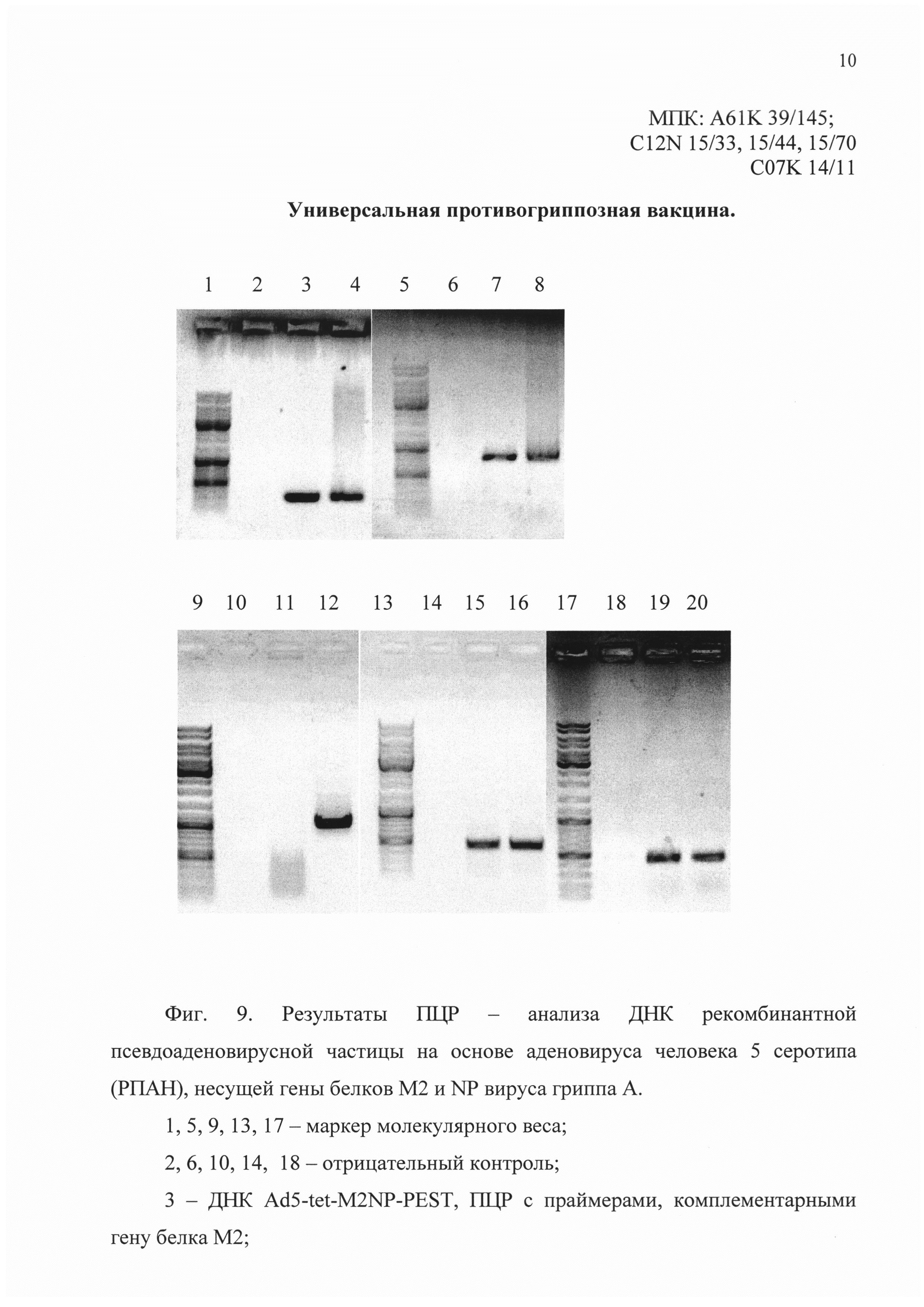
На фиг. 9 представлены результаты ПЦР - анализа ДНК рекомбинантной псевдоаденовирусной частицы (РПАН) на основе аденовируса человека 5 серотипа, несущей гены белков М2 и NP вируса гриппа A (Ad5-tet-M2NP-PEST).
Положительным результатом является темная полоса на дорожке геля.
На дорожках в зависимости от номера отображено:
1, 5, 9, 13, 17 - маркер молекулярного веса;
2, 6, 10, 14, 18 - отрицательный контроль;
3 - ДНК Ad5-tet-M2NP-PEST, ПЦР с праймерами, комплементарными гену белка М2;
4 - положительный контроль, ПЦР с праймерами, комплементарными гену белка М2 (pAL-TA-M2NP-PEST);
7 - ДНК Ad5-tet-M2NP-PEST, ПЦР с праймерами, комплементарными гену белка NP;
8 - положительный контроль, ПЦР с праймерами, комплементарными гену белка NP (pAL-TA-M2NP-PEST);
11 - ДНК Ad5-tet-M2NP-PEST, ПЦР с праймерами, комплементарными E1 области генома аденовируса человека пятого серотипа;
12 - положительный контроль, ПЦР с праймерами, комплементарными E1 области генома аденовируса человека пятого серотипа (геном аденовируса «дикого типа»).
15 - ДНК Ad5-tet-M2NP-PEST, ПЦР с праймерами, комплементарными элементу TRE;
16 - положительный контроль, ПЦР с праймерами, комплементарными элементу TRE (pShuttle-tetoff-tta);
19 - ДНК Ad5-tet-M2NP-PEST, ПЦР с праймерами, комплементарными гену гексона аденовируса человека пятого серотипа;
20 - положительный контроль, ПЦР с праймерами, комплементарными гену гексона аденовируса человека пятого серотипа (pAd-Easy).
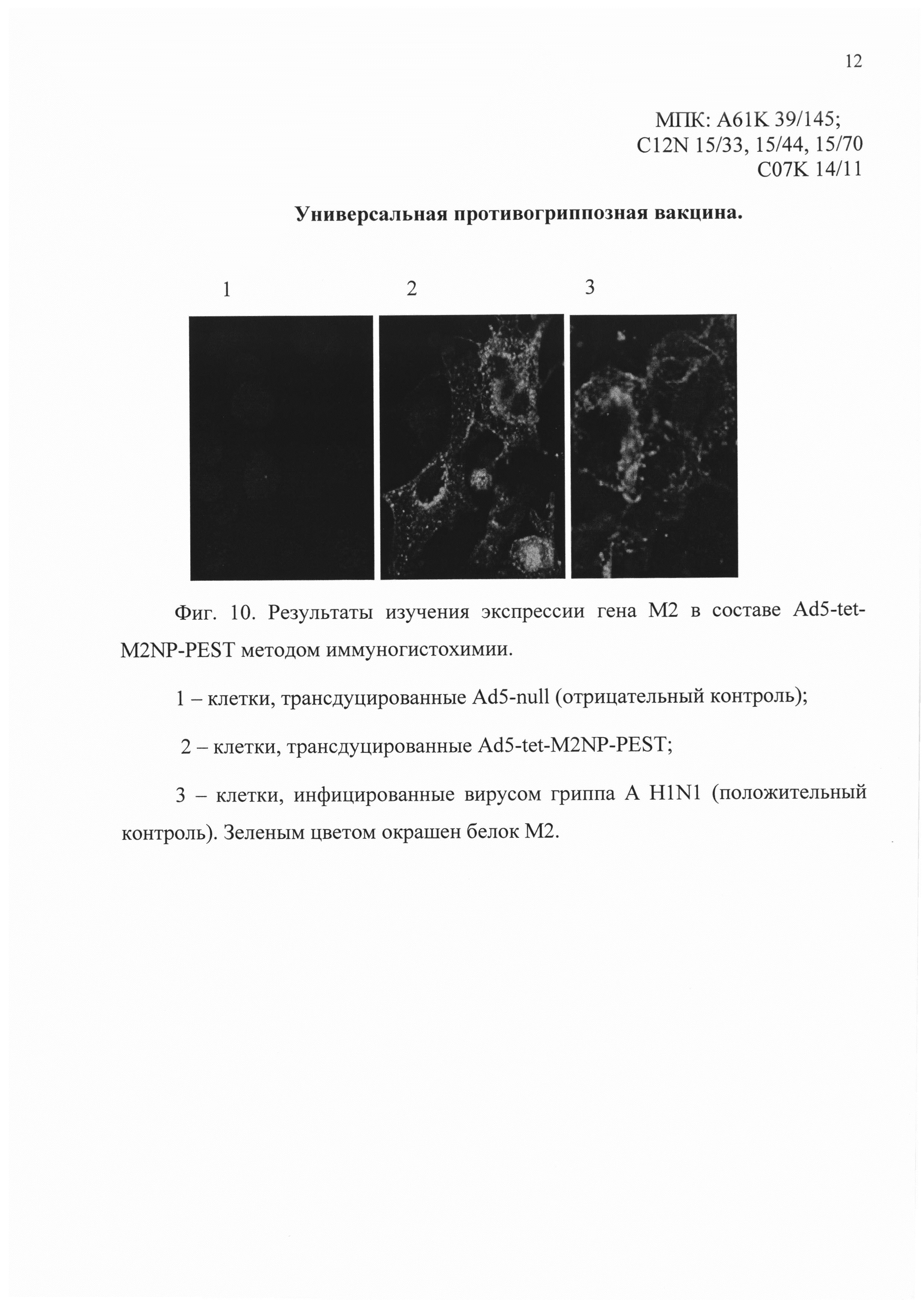
На фиг. 10 представлены результаты изучения экспрессии гена М2 в составе Ad5-tet-M2NP-PEST методом иммуногистохимии с помощью конфокальной микроскопии.
Положительным результатом является зеленое окрашивание клеток.
На снимках конфокальной микроскопии, в зависимости от номера:
1 - клетки, трансдуцированные Ad5-null (отрицательный контроль);
2 - клетки, трансдуцированные Ad5-tet-M2NP-PEST;
3 - клетки инфицированные вирусом гриппа A H1N1 (положительный контроль).
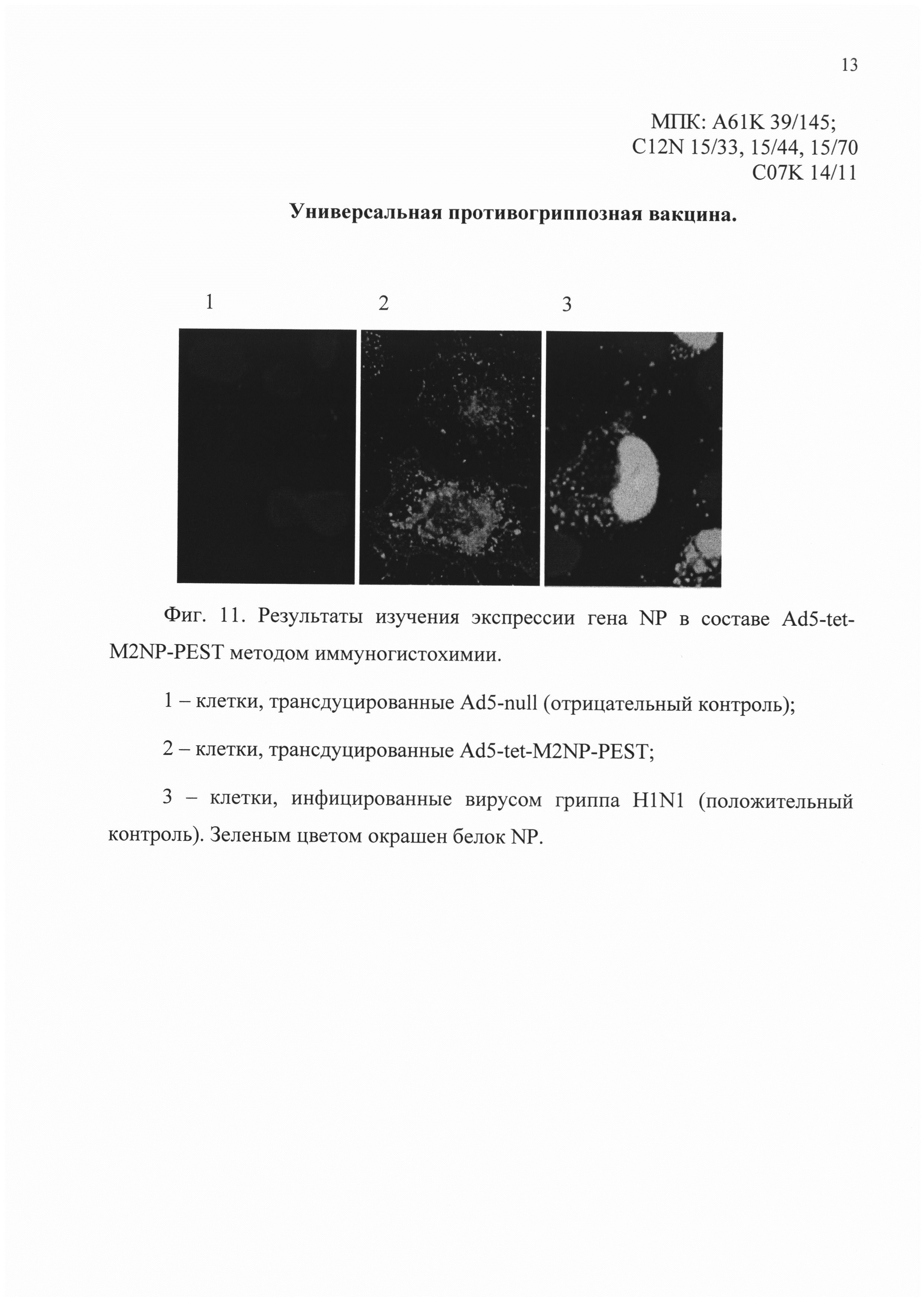
На фиг. 11 представлены результаты изучения экспрессии гена NP в составе Ad5-tet-M2NP-PEST методом иммуногистохимии с помощью конфокальной микроскопии.
Положительным результатом является зеленое окрашивание клеток.
На снимках конфокальной микроскопии, в зависимости от номера:
1 - клетки, трансдуцированные Ad5-null (отрицательный контроль);
2 - клетки, трансдуцированные Ad5-tet-M2NP-PEST;
3 - клетки, инфицированные вирусом гриппа A H1N1 (положительный контроль).
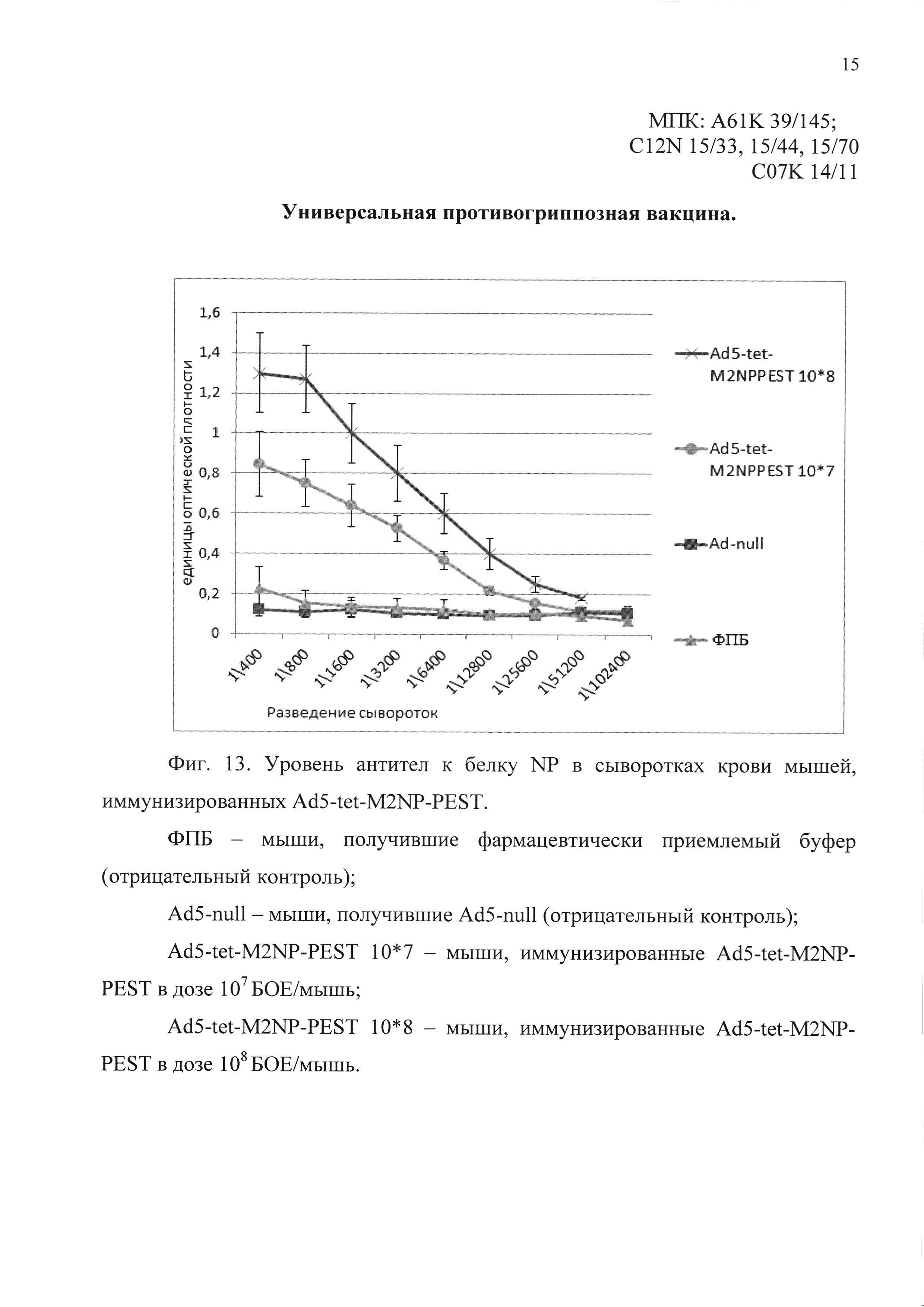
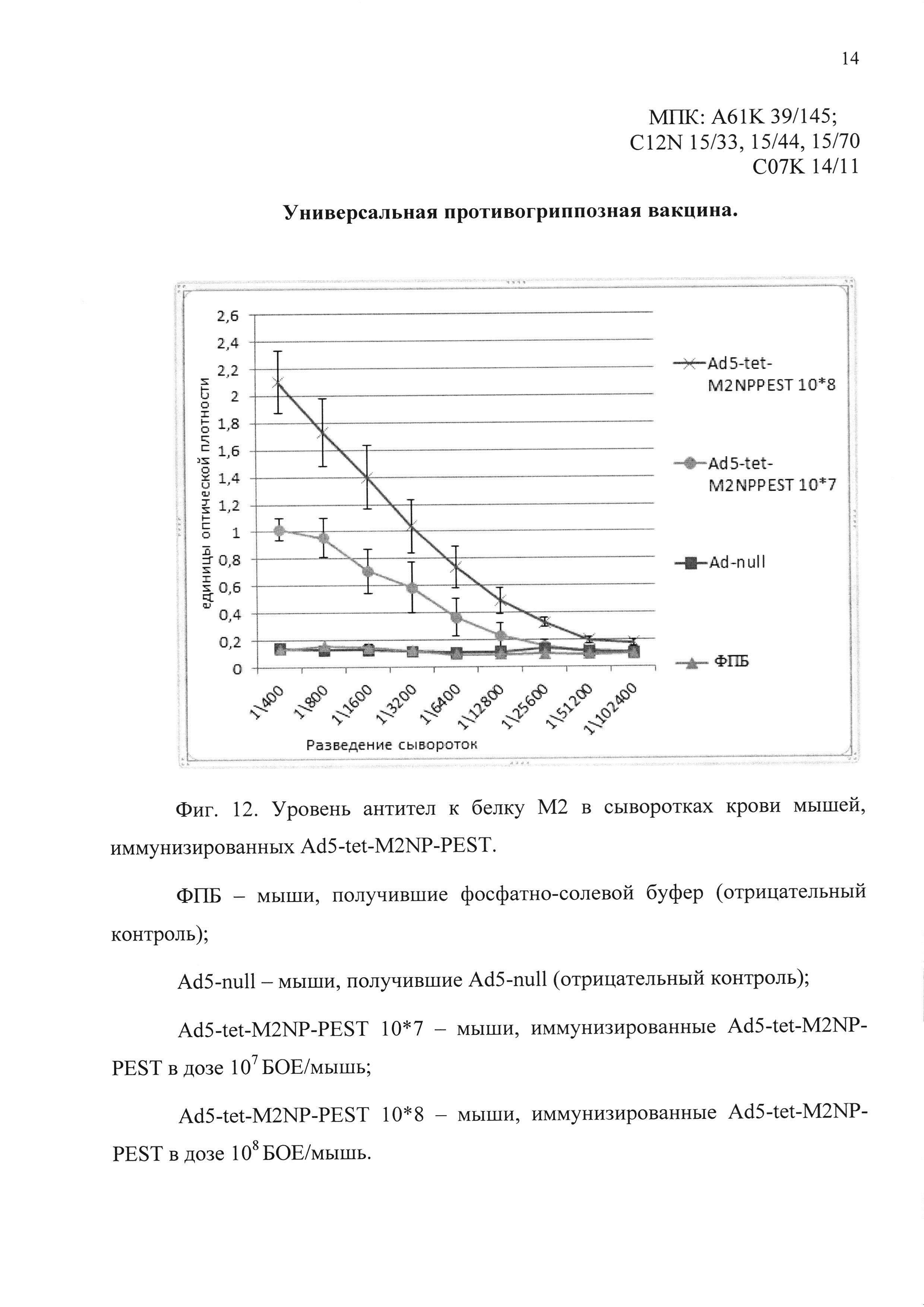
На фиг. 12 показаны уровни специфических антител к белку М2 в сыворотках крови мышей:
ФПБ - получивших однократно интраназально фармацевтически приемлемый буфер (отрицательный контроль);
Ad5-null - получивших однократно интраназально Ad5-null (отрицательный контроль);
Ad5-tet-M2NP-PEST - иммунизированных однократно интраназально кандидатной вакциной, содержащей Ad5-tet-M2NP-PEST.
На фиг. 13 показаны уровни специфических антител к белку NP в сыворотках крови мышей:
ФПБ - получивших однократно интраназально фармацевтически приемлемый буфер (отрицательный контроль);
Ad5-null - получивших однократно интраназально Ad5-null (отрицательный контроль);
Ad5-tet-M2NP-PEST - иммунизированных однократно интраназально кандидатной вакциной, содержащей Ad5-tet-M2NP-PEST.
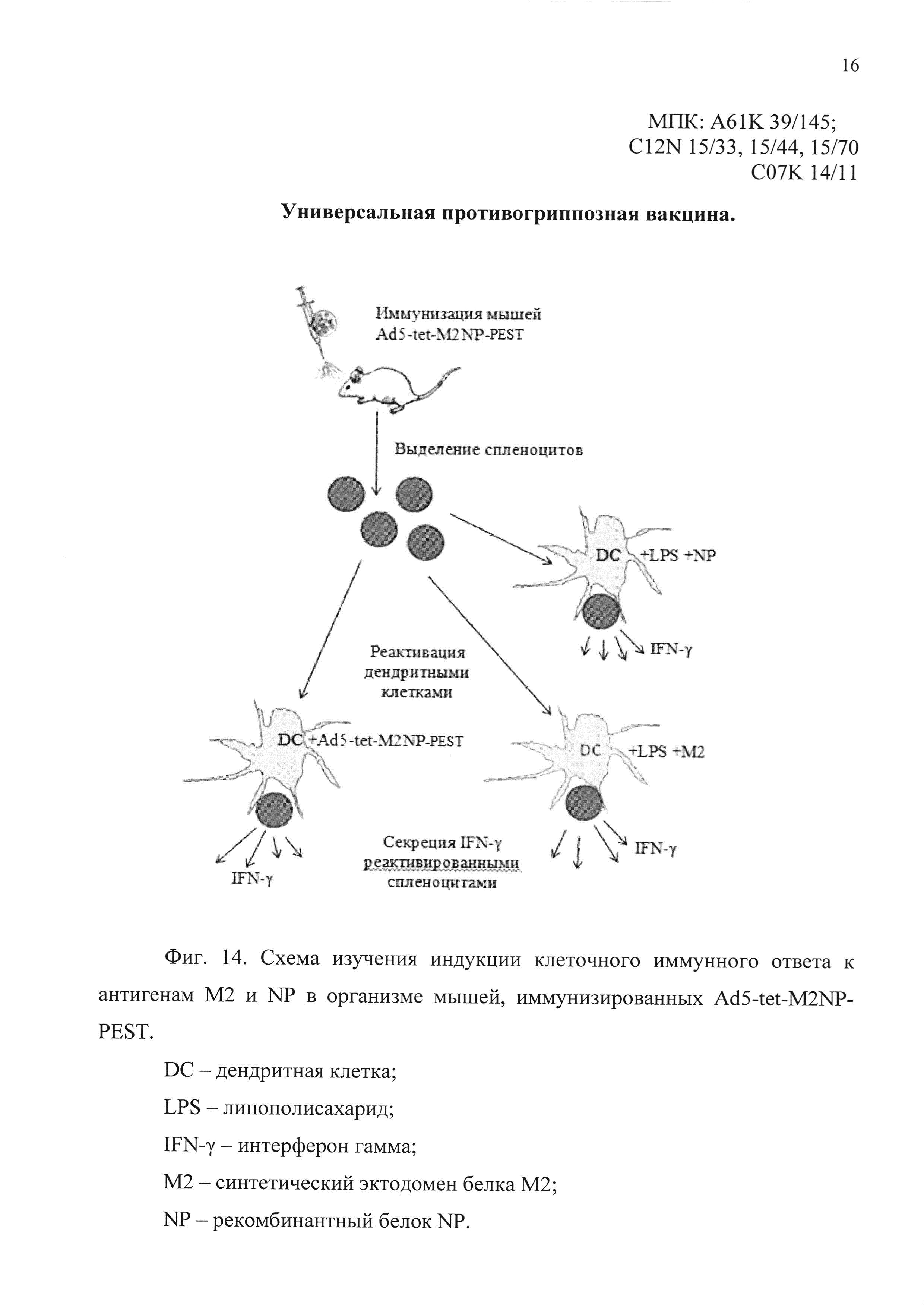
На фиг. 14 показана схема эксперимента по изучению индукции Т-клеточного иммунного ответа у мышей, иммунизированных однократно интраназально вакциной, содержащей Ad5-tet-M2NP-PEST:
DC - дендритная клетка;
IFN-γ - интерферон гамма;
LPS - липополисахарид;
М2 - синтетический эктодомен белка М2;
NP - рекомбинантный белок NP.
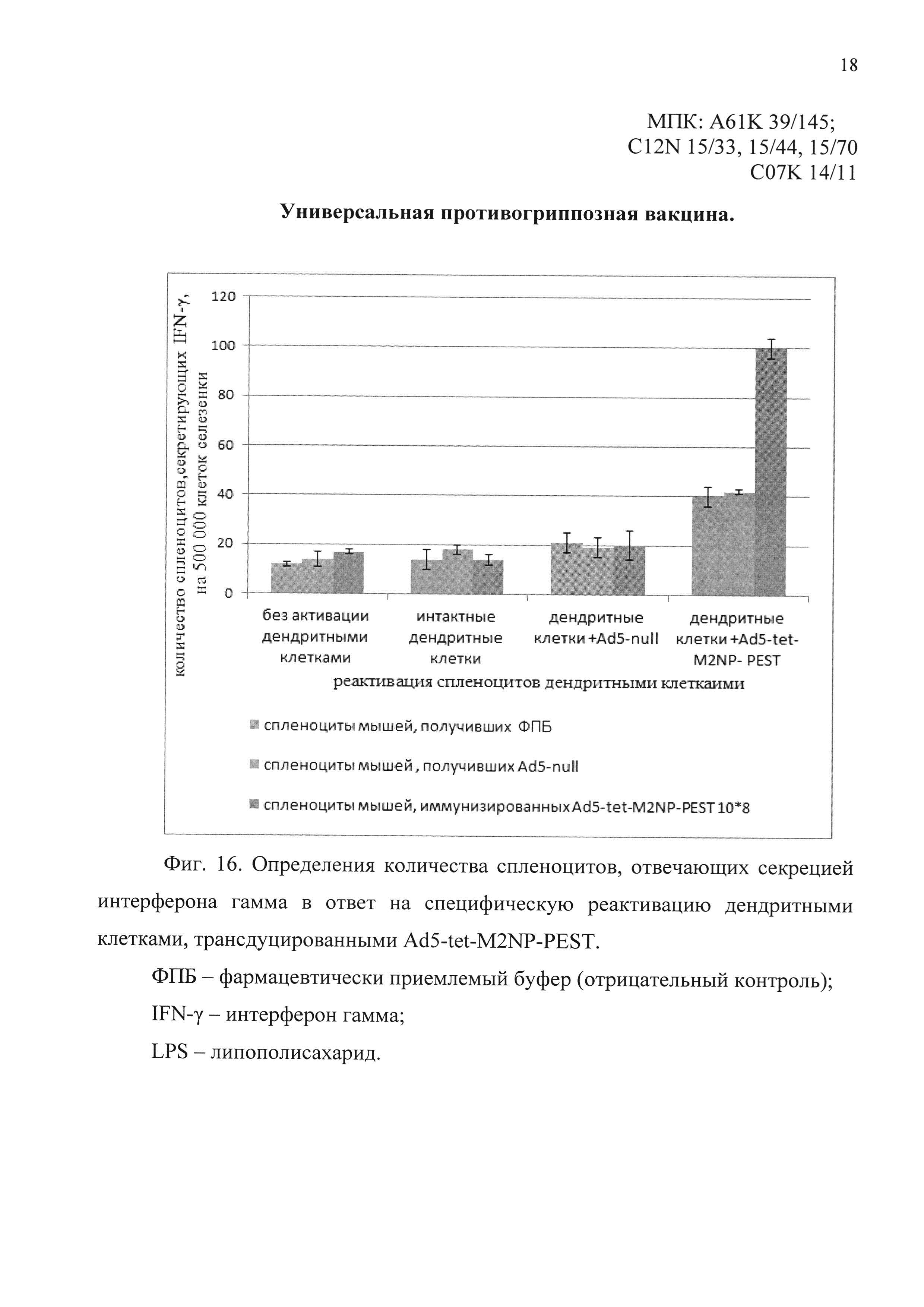
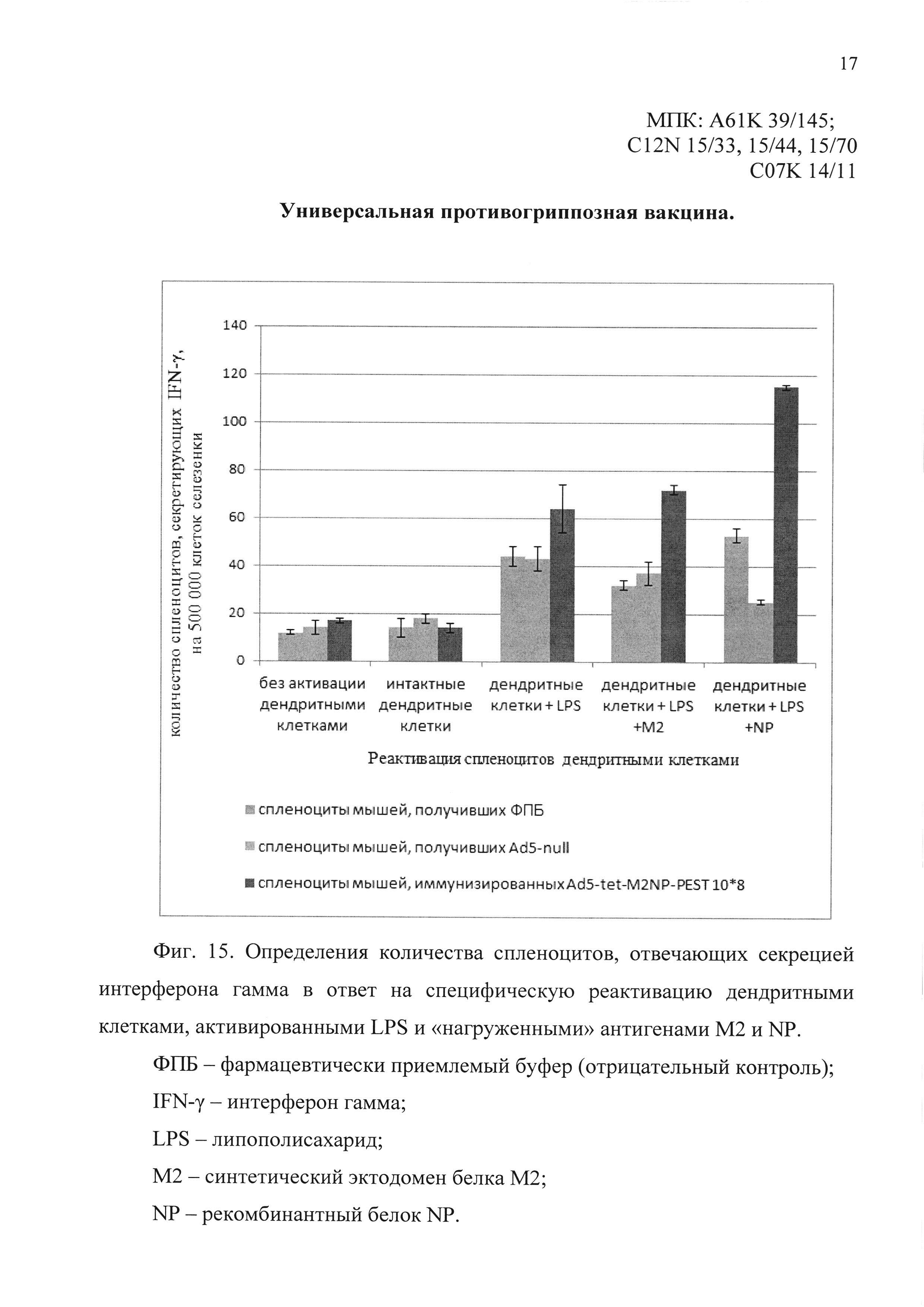
На фиг. 15 у мышей, иммунизированных однократно интраназально кандидатной вакциной, содержащей Ad5-tet-M2NP-PEST, показан уровень спленоцитов, отвечающих секрецией интерферона гамма в ответ на специфическую реактивацию дендритными клетками, активированными LPS и «нагруженными» антигенами М2 и NP.
ФПБ - фармацевтически приемлемый буфер (отрицательный контроль);
IFN-γ - интерферон гамма;
LPS - липополисахарид;
М2 - синтетический эктодомен белка М2;
NP - рекомбинантный белок NP.
На фиг. 16 у мышей, иммунизированных однократно интраназально кандидатной вакциной, содержащей Ad5-tet-M2NP-PEST, показан уровень спленоцитов, отвечающих секрецией интерферона гамма в ответ на специфическую реактивацию дендритными клетками, трансдуцированными Ad5-tet-M2NP-PEST.
ФПБ - фармацевтически приемлемый буфер (отрицательный контроль);
IFN-γ - интерферон гамма;
LPS - липополисахарид.
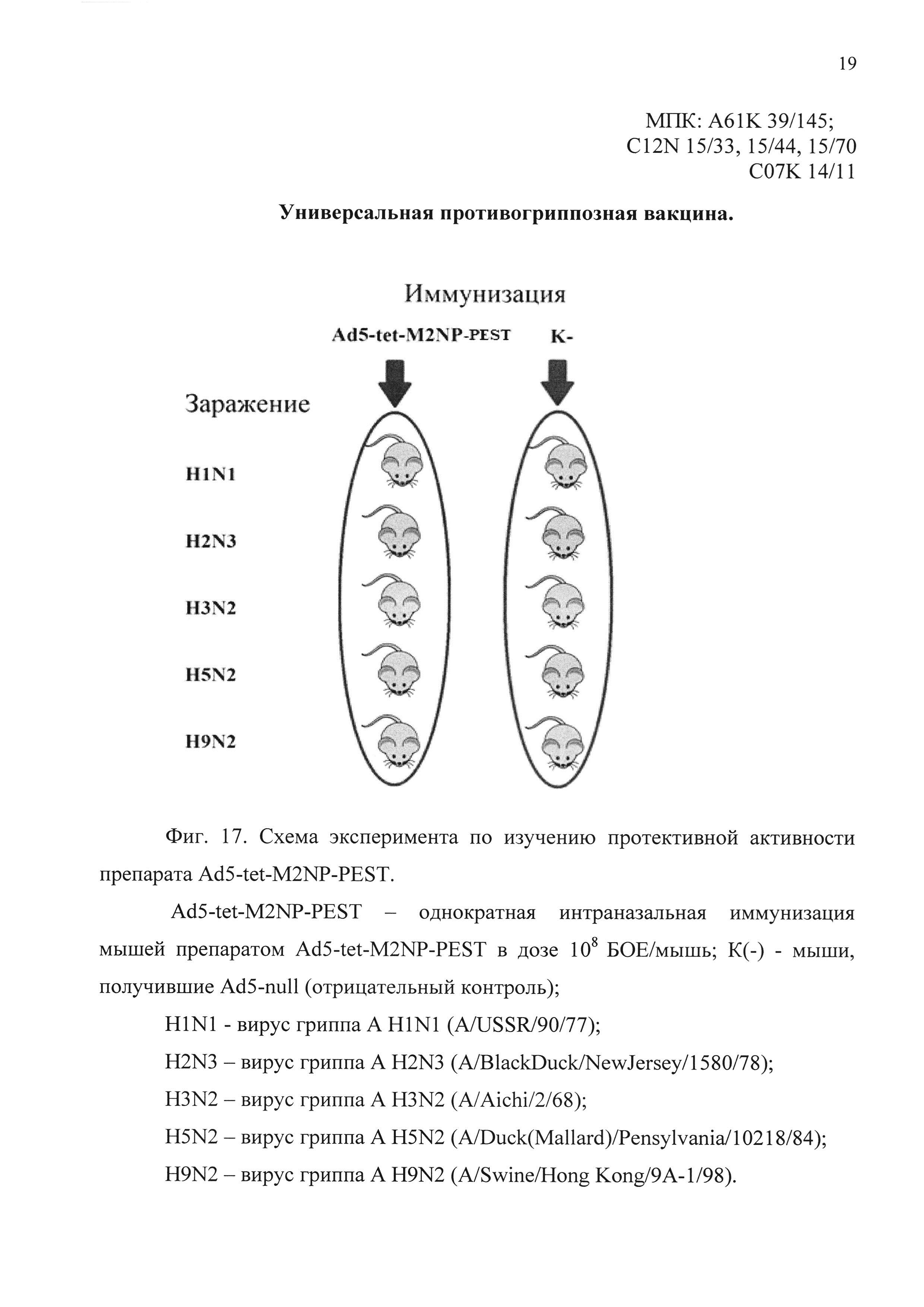
На фиг. 17 представлена схема эксперимента по изучению протективной активности кандидатной вакцины.
Ad5-tet-M2NP-PEST - однократная интраназальная иммунизация мышей кандидатной вакциной Ad5-tet-M2NP-PEST в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль);
H1N1 - вирус гриппа A H1N1 (A/USSR/90/77);
H2N3 - вирус гриппа A H2N3 (A/BlackDuck/NewJersey/1580/78);
H3N2 - вирус гриппа A H3N2 (A/Aichi/2/68);
H5N2 - вирус гриппа A H5N2 (A/Duck(Mallard)/Pensylvania/l0218/84);
H9N2 - вирус гриппа A H9N2 (A/Swine/Hong Kong/9A-1/98).
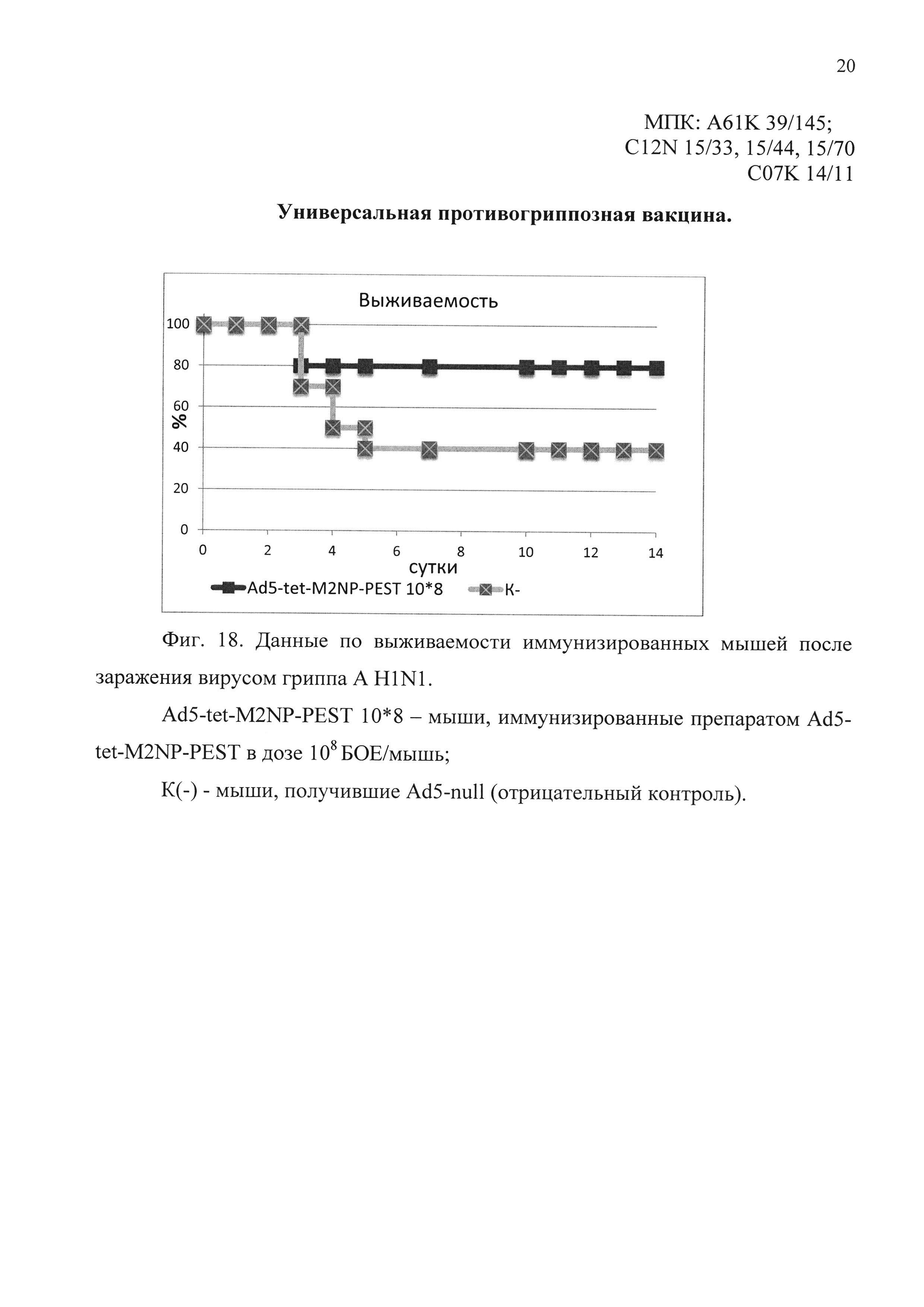
На фиг. 18 представлены данные по выживаемости иммунизированных мышей, после заражения вирусом гриппа A H1N1.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
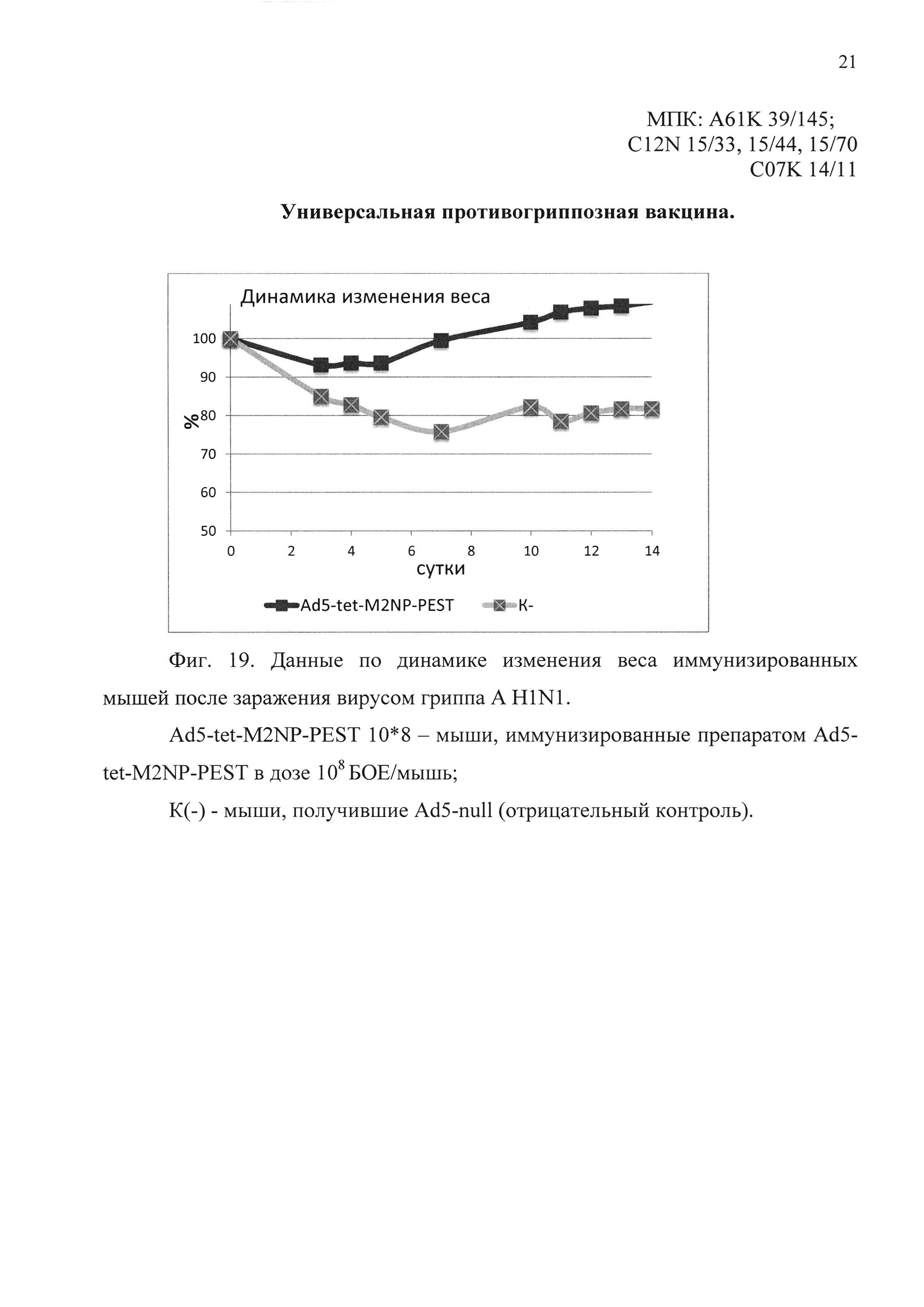
На фиг. 19 представлены данные по динамике изменения веса иммунизированных мышей, после заражения вирусом гриппа A H1N1.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
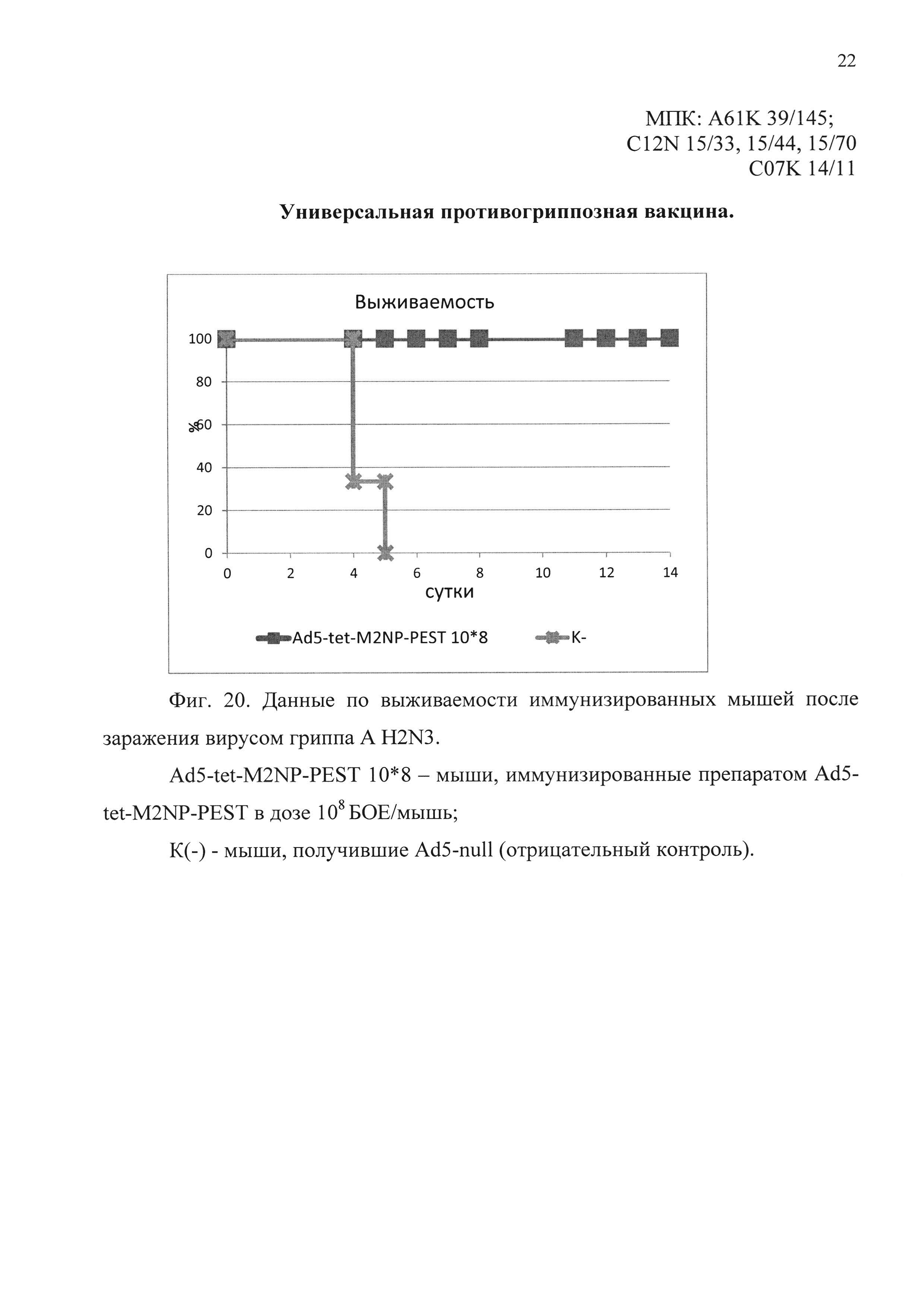
На фиг. 20 представлены данные по выживаемости иммунизированных мышей, после заражения вирусом гриппа A H2N3.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
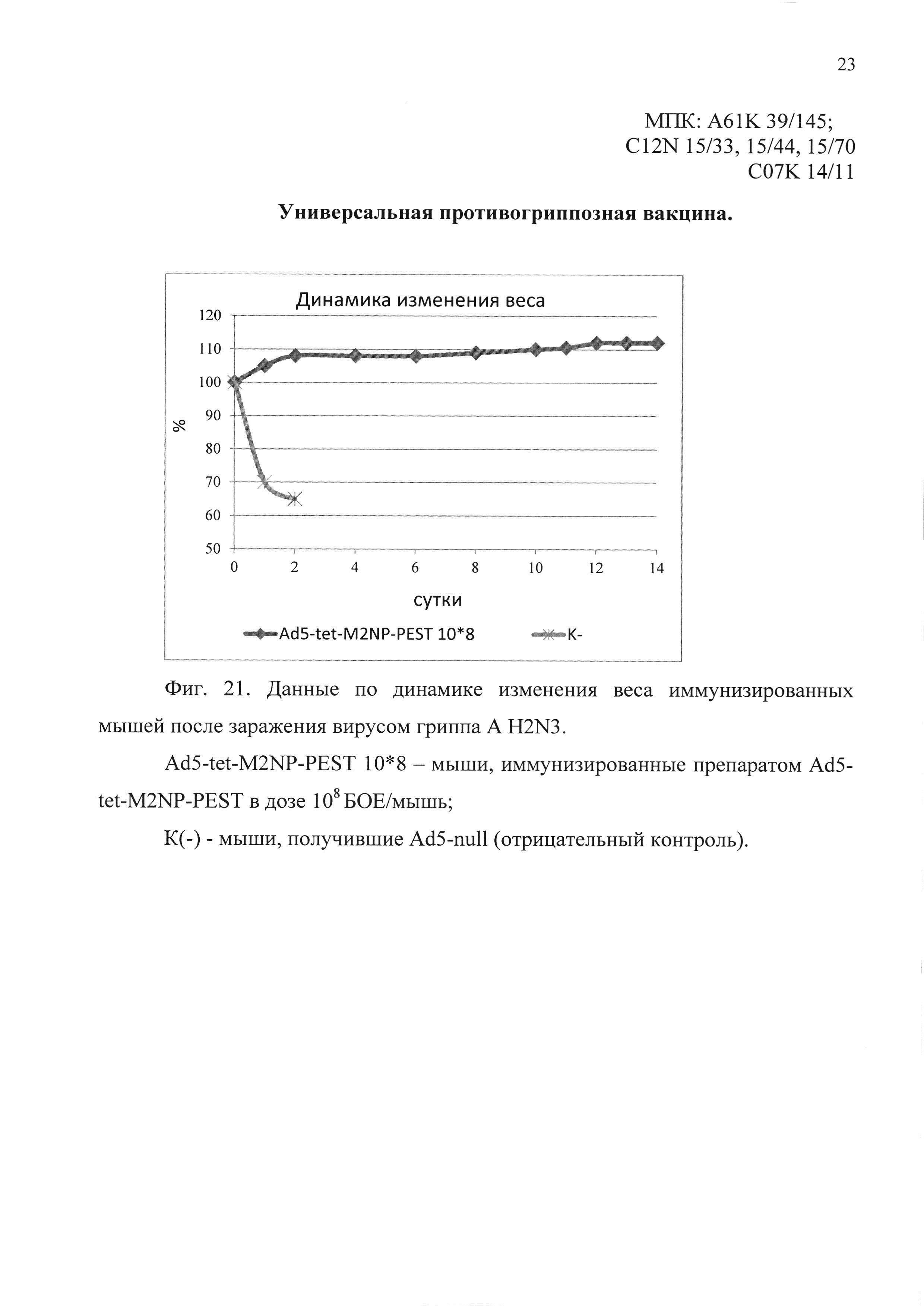
На фиг. 21 представлены данные по динамике изменения веса иммунизированных мышей, после заражения вирусом гриппа A H2N3.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
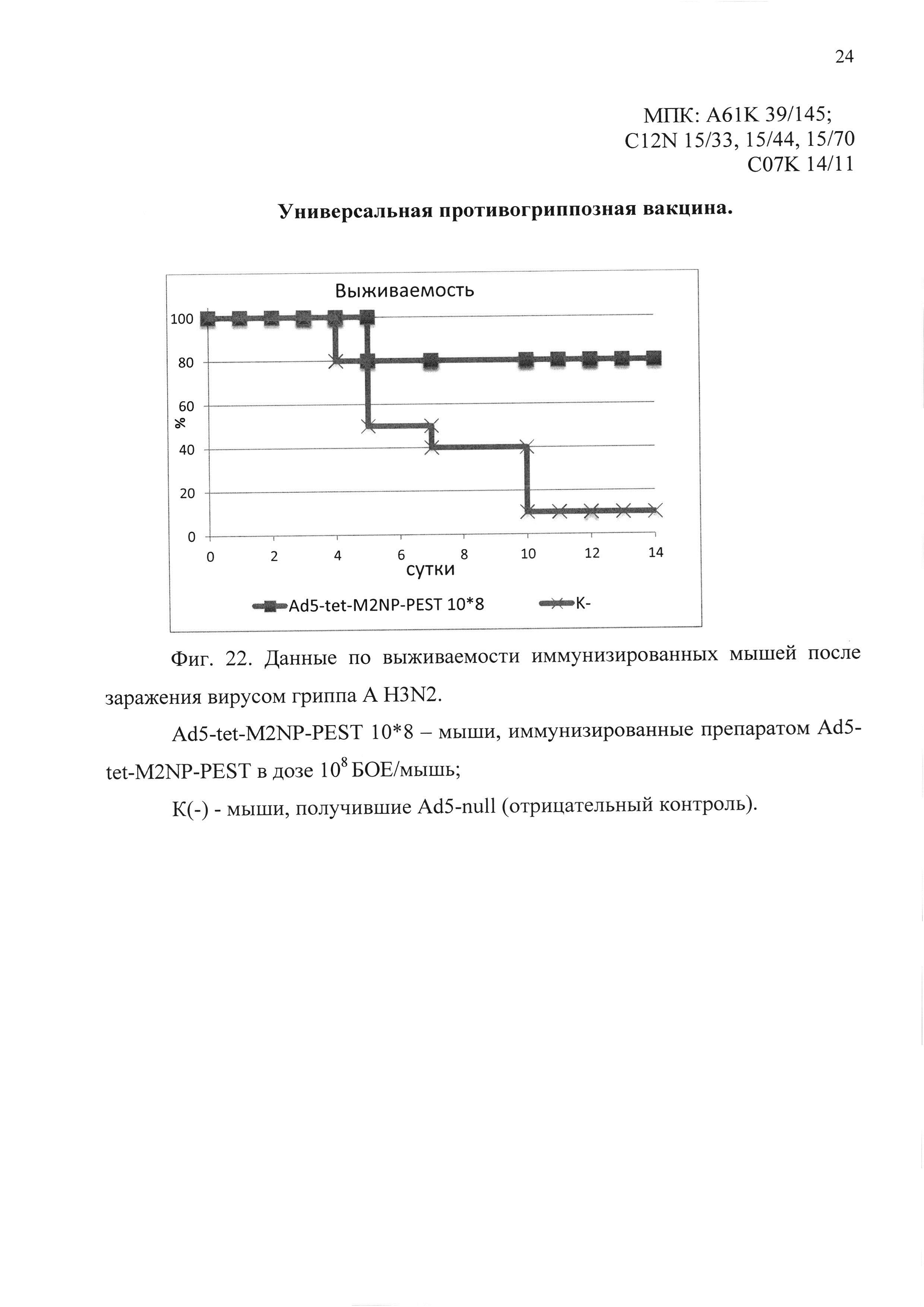
На фиг. 22 представлены данные по выживаемости иммунизированных мышей, после заражения вирусом гриппа A H3N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
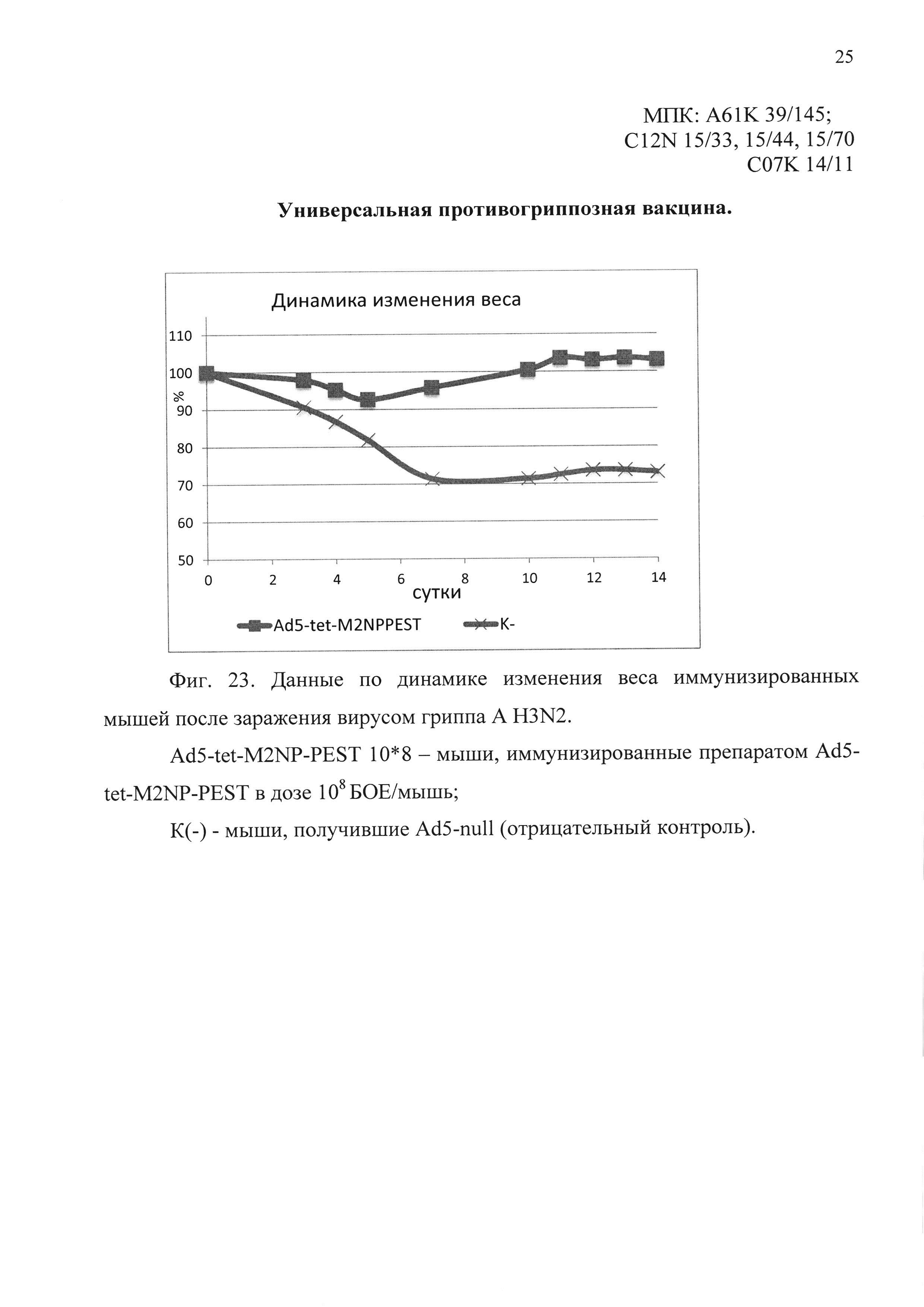
На фиг. 23 представлены данные по динамике изменения веса иммунизированных мышей, после заражения вирусом гриппа A H3N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
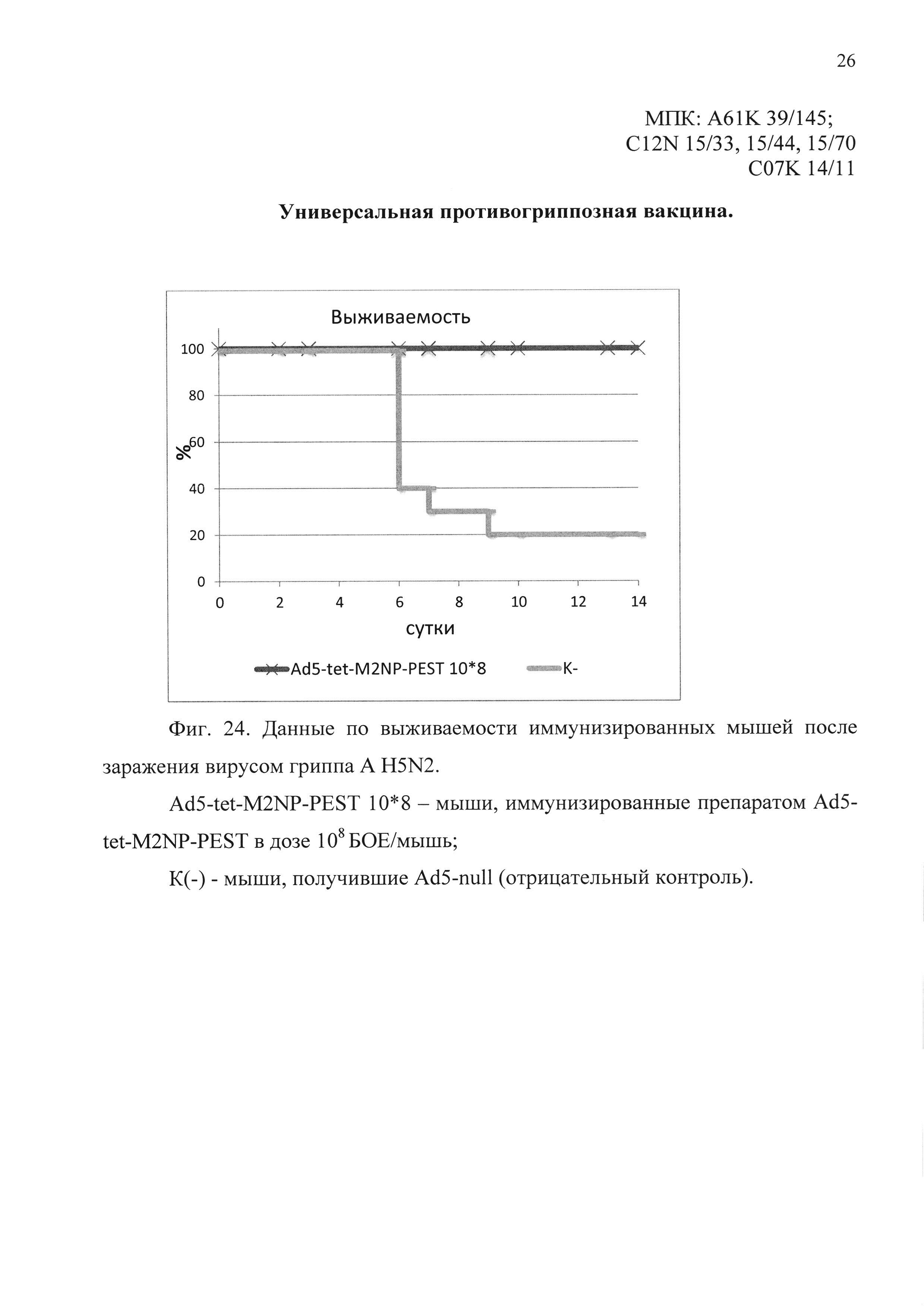
На фиг. 24 представлены данные по выживаемости иммунизированных мышей, после заражения вирусом гриппа A H5N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
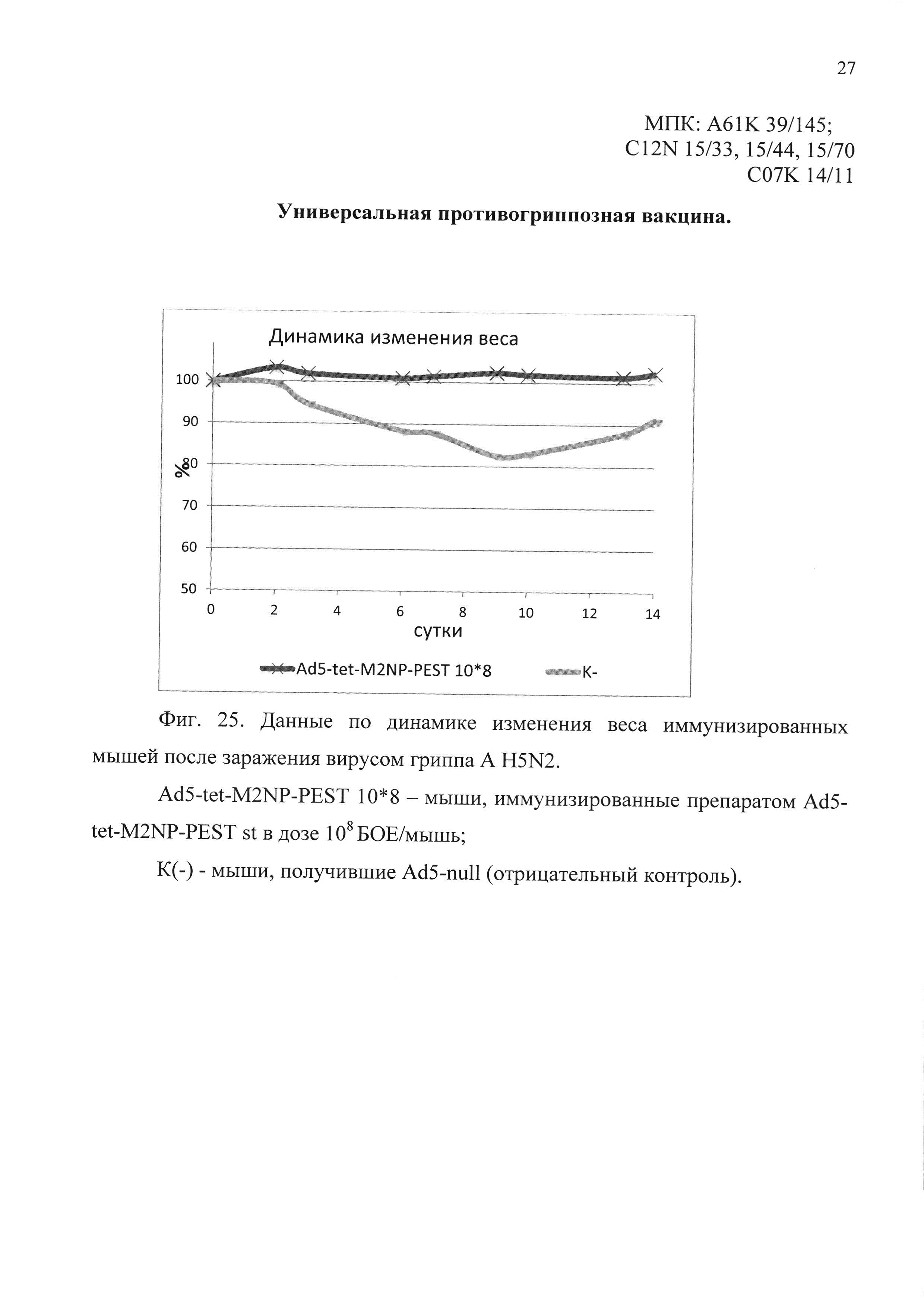
На фиг. 25 представлены данные по динамике изменения веса иммунизированных мышей, после заражения вирусом гриппа A H5N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
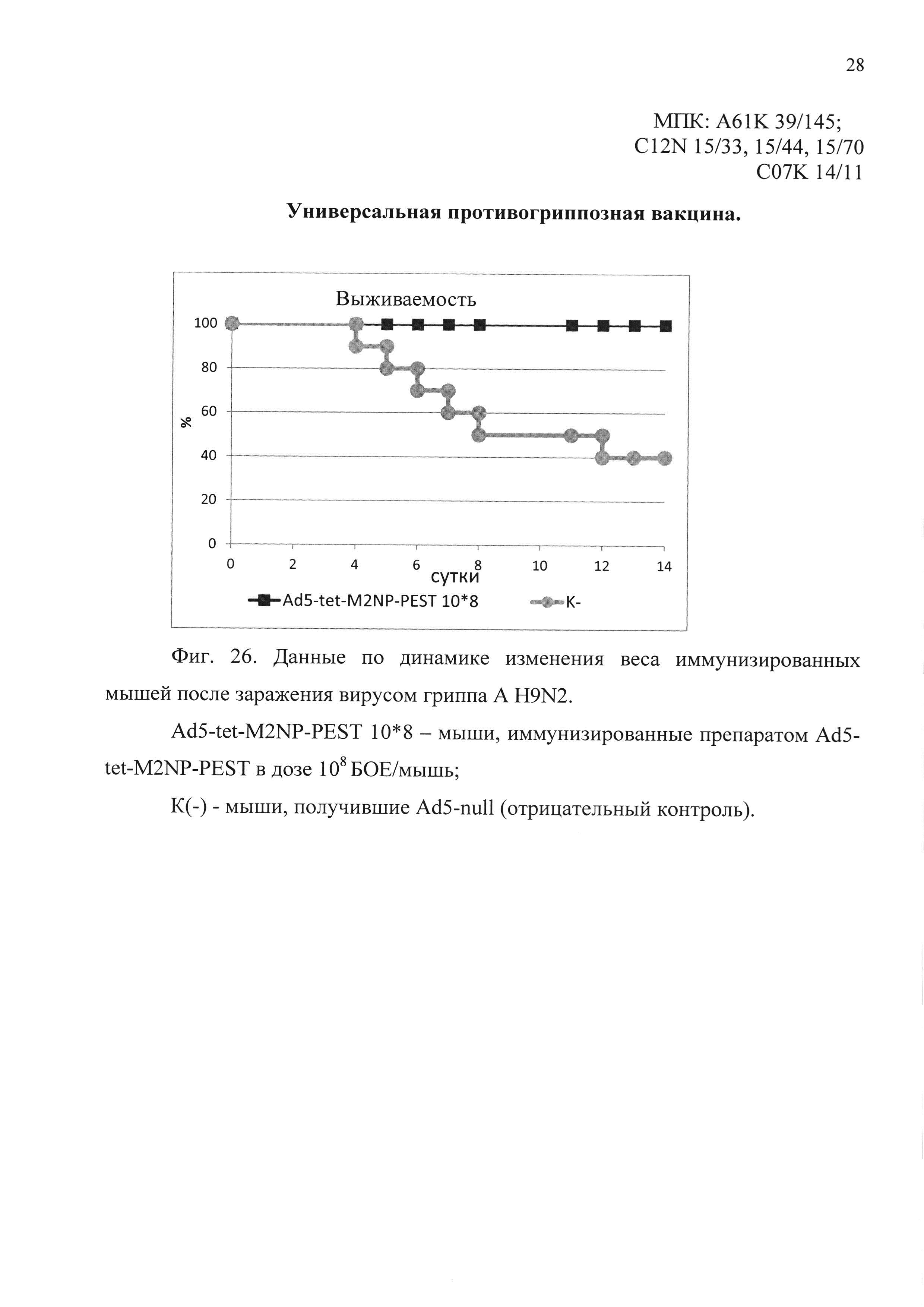
На фиг. 26 представлены данные по выживаемости иммунизированных мышей, после заражения вирусом гриппа A H9N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
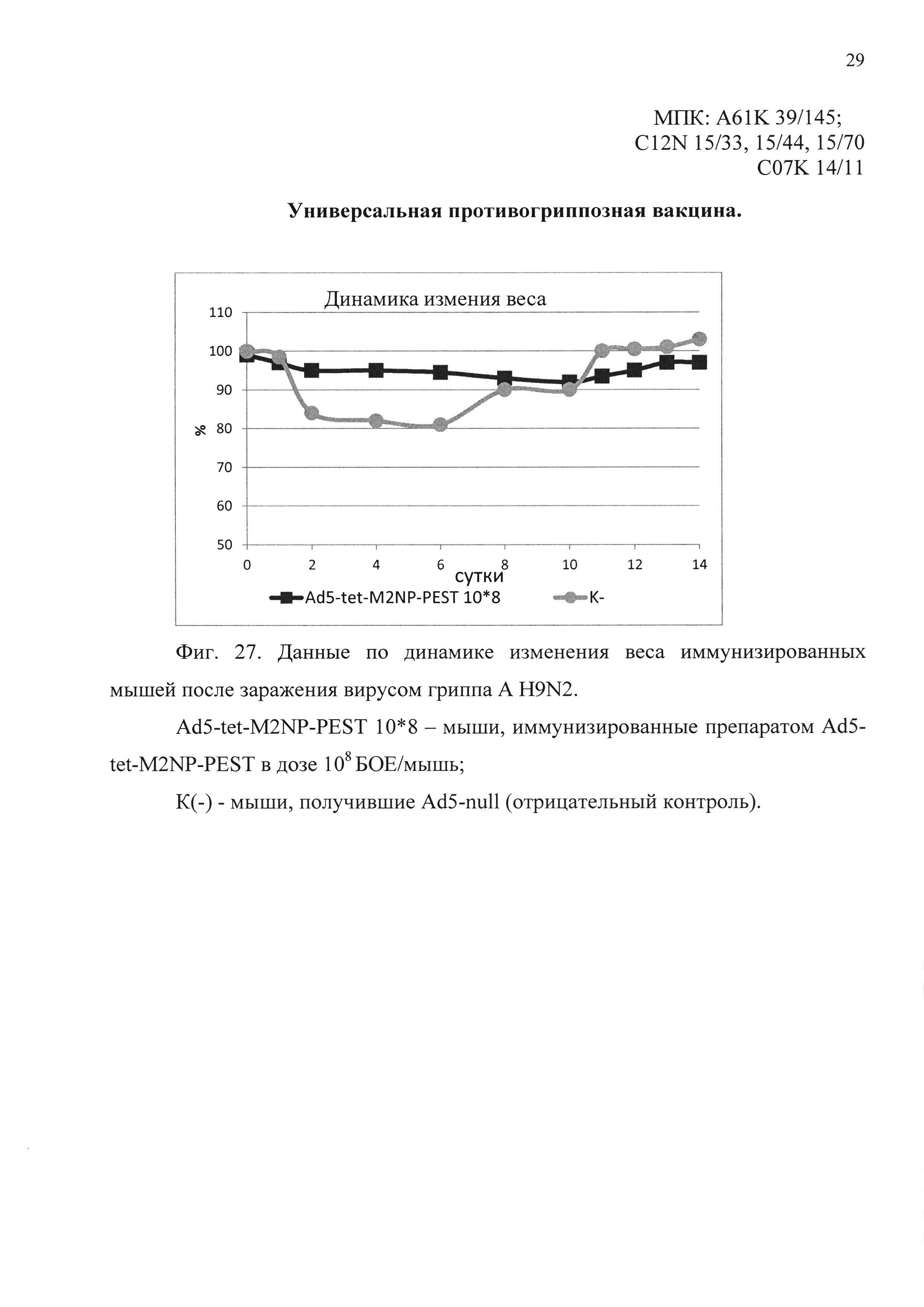
На фиг. 27 представлены данные по динамике изменения веса иммунизированных мышей, после заражения вирусом гриппа A H9N2.
Ad5-tet-M2NP-PEST 10*8 - мыши, иммунизированные кандидатной вакциной в дозе 108 БОЕ;
К(-) - мыши, получившие однократно интраназально Ad5-null (отрицательный контроль).
Примеры осуществления заявленного изобретения
Пример 1. Создание консенсусных аминокислотных последовательностей белков М2 и NP, наиболее гомологичных для различных штаммов вируса гриппа А.
Пример 2. Создание генетической конструкции, экспрессирующей гены консенсусных аминокислотных последовательностей белков М2 и NP под контролем индуцибельного промотора.
Пример 3. Получение рекомбинантных псевдоаденовирусных частиц, несущих полученную генетическую конструкцию.
Пример 4. Изучение экспрессии генов М2 и NP в составе полученных рекомбинантных аденовирусов.
Пример 5. Получение вакцины (кандидатной).
Пример 6. Изучение индукции гуморального иммунного ответа на кандидатную вакцину.
Пример 7. Изучение индукции Т-клеточного иммунного ответа на кандидатную вакцину.
Пример 8. Исследование протективной активности кандидатной вакцины.
Пример 1. Создание консенсусных аминокислотных последовательностей белков М2 и NP, наиболее гомологичных для различных штаммов вируса гриппа А.
В данном примере приведен способ создания консенсусных аминокислотных последовательностей белков М2 и NP, наиболее гомологичных для различных штаммов вируса гриппа А.
Исходные аминокислотные последовательности полноразмерных белков М2 и NP взяты из официального общедоступного источника NCBI, GenBank, США (www.ncbi.nlm.nih.gov). Был проведен анализ около 11000 последовательностей белка М2 и около 8000 последовательностей белка NP от различных штаммов вируса гриппа А человека и птиц. Работа с последовательностями осуществлялась с помощью компьютерной программы Geneious 4.8.5.
Для этого сначала была создана уникальная последовательность белка М2. Все полученные из NCBI, GenBank аминокислотные последовательности белков М2 были выровнены относительно друг друга и составлена консенсусная («усредненная») последовательность, наиболее гомологичная для всех выровненных последовательностей (SEQ ID NO: 1), представленная на фиг. 1. Аналогично получена уникальная консенсусная аминокислотная последовательность белка NP (SEQ ID NO: 2), представленная на фиг. 2.
Для повышения иммуногенности белка NP его последовательность была модифицирована удалением неканонического сигнала ядерной локализации. Данная процедура проводилась путем замены мотива T6KR8 на мотив А6АА8 согласно Ohba К. et al. [8]. Кроме того, для деградации белка NP в цитоплазме по убиквитинзависимому пути в его аминокислотную последовательность была включена аминокислотная последовательность мотива PEST (SRSEVTISPAETPESPPATPKTRS) белка силигериолизина О бактерии Listeria seeligeri (http://www.ncbi.nlm.nih.gov/protein/WP_012984716.1). По данным, полученным при помощи компьютерной программы epestfind (http://emboss.bioinformatics.nl/cgi-bin/emboss/epestfind), эта аминокислотная последовательность является сильным сигналом к полиубиквитинированию и быстрой деградации силигериолизина О в инфицированной листерией клетке.
Пример 2. Создание генетической конструкции, экспрессирующей гены консенсусных аминокислотных последовательностей белков М2 и NP под контролем индуцибельного промотора.
В данном примере приведен способ создания генетической конструкции, экспрессирующей гены консенсусных аминокислотных последовательностей белков М2 и NP под контролем системы Tet-off.
Для создания конечной генетической конструкции, кодирующей полученные консенсусные последовательности белков М2 и NP, указанные аминокислотные последовательности были переведены в нуклеотидные (SEQ ID NO: 4 и SEQ ID NO: 5), представленные на фиг. 4 и фиг. 5 соответственно. Для осуществления экспрессии генов М2 и NP отдельно друг от друга под контролем общей экспрессионной кассеты, они были разделены нуклеотидной последовательностью (SEQ ID NO: 6, фиг. 6), кодирующей саморасщепляющийся пептид 2А вируса ящура Picornavirus aftae штамма А10-61.
Аминокислотная последовательность, кодирующая саморасщепляющийся пептид 2А вируса ящура, взята из базы данных UNIPROT (UniProtKB/Swiss-Prot Р03306) и представлена SEQ ID NO: 3 (фиг. 3). Последовательность пептида 2А позволяет осуществлять синтез полипептидной цепи каждого белка отдельно с одной мРНК [9].
В таблице 1 представлены нуклеотидные и аминокислотные последовательности компонентов экспрессируемой конструкции М2-2А-NP-PEST.




Полученную уникальную нуклеотидную последовательность М2-2А-NP-PEST синтезировали общеизвестным химическим методом и клонировали в плазмиду pAL-TA. Затем при помощи стандартных методов нуклеотидная последовательность M2-2A-NP-PEST была клонирована в челночную плазмиду, несущую регуляторные элементы системы Tet-off (pShuttle-tet-off). Таким образом, была получена челночная плазмида, несущая гены консенсусных аминокислотных последовательностей М2 и NP, полученных в примере 1, под контролем системы экспрессии Tet-off (pShuttle-tet-M2NP-PEST). На фиг. 8 представлена схема полученной экспрессионной кассеты, содержащей гены М2 и NP под контролем системы экспрессии Tet-off.
Пример 3. Получение рекомбинантных псевдоаденовирусных частиц, несущих полученную генетическую конструкцию.
На данном этапе была получена рекомбинантная псевдоаденовирусная частица на основе генома аденовируса человека 5-го серотипа, содержащая генетическую конструкцию, созданную в примере 2.
Все нижеописанные работы по клонированию проводили с использованием общеизвестных стандартных методик, изложенных в руководствах для специалистов данной области.
Конструкцию рекомбинантной псевдоаденовирусной частицы на основе генома аденовируса человека пятого серотипа (размером 70-80 нм), получали методом гомологичной рекомбинации между общеизвестной плазмидой pAd-Eazy (Adenoeazy Adenoviral Vector System, Stratogen, США), содержащей геномную часть аденовируса человека 5 серотипа с удаленной E1 областью, и полученной в примере 2 челночной плазмидой pShuttle-tet-M2NP-PEST. Гомологичную рекомбинацию проводили в клетках Е. coli штамма BJ5183. Плазмиду Ad-Eazy смешивали с плазмидой pShuttle-tet-M2NP-PEST, которая была предварительно гидролизована эндонуклеазой рестрикции PmeI. Затем полученной смесью трансформировали клетки E.coli методом электропорации.
Таким образом, была сконструирована плазмида pAd-tet-M2NP-PEST, содержащая полноразмерный геном рекомбинантного аденовируса человека пятого серотипа со встроенной генетической конструкцией, полученной в примере 2. Далее плазмиду pAd-tet-M2NP-PEST гидролизовали эндонуклеазой рестрикции Рас I и трансфецировали ею пермессивную культуру клеток эмбриональной почки человека линии 293 НЕК. Клетки линии 293 НЕК содержат в своем геноме встроенную область E1 генома аденовируса человека пятого серотипа, благодаря чему в них может происходить размножение рекомбинантных репликативнодефектных аденовирусов человека пятого серотипа. Для подавления экспрессии гена М2 трансфецированные клетки 293 НЕК культивировали в присутствие доксициклина в концентрации 5,0 мкг/мл. Через несколько сут. после трансфекции на культуре образовывались бляшки, их отбирали и размножали на клетках в присутствие доксициклина 5,0 мкг/мл до получения титра 108 бляшкообразующих единиц (БОЕ)/мл. Далее осуществляли хроматографическую очистку, в результате был получен препарат Ad5-tet-M2NP-PEST с титром 2×109 БОЕ/мл.
Активность препарата Ad5-tet-M2NP-PEST здесь и далее оценивали стандартным методом титрования на культуре чувствительных клеток 293 НЕК в реакциях бляшкообразования.
Для подтверждения создания конструкции предлагаемой рекомбинантной псевдоаденовирусной частицы на основе аденовируса человека 5 серотипа, экспрессирующей гены белков М2 и NP, проводили полимеразную цепную реакцию (ПЦР) по известной стандартной методике. Для постановки ПЦР использовали пары праймеров, комплементарных:
гену гексона аденовируса человека 5 серотипа; на область E1 (которая должна отсутствовать у созданных рекомбинантных псевдоаденовирусных частиц);
гену белка М2;
гену белка NP;
тетрациклинзависемому элементу (TRE).
По результатам ПЦР было заключено, что
последовательность ДНК рекомбинантной псевдоаденовирусной частицы на основе аденовируса человека пятого серотипа - обнаружена,
ген белка М2 (SEQ ID NO: 4) - обнаружен;
ген белка NP (SEQ ID NO: 5) - обнаружен;
нуклеотидная последовательность TRE элемента - обнаружена;
E1 область, которая должна быть делетирована у рекомбинантных псевдоаденовирусных частиц, - не обнаружена (смотри фиг. 9).
Таким образом, нами была создана рекомбинантная псевдоаденовирусная (отсутствует E1 область аденовируса) частица на основе аденовируса человека 5 серотипа (есть гексон аденовируса человека 5 серотипа), несущая гены белков М2 и NP вируса гриппа А, что говорит о соответствии данной конструкции заявляемым по изобретению требованиям.
Далее была показана способность сконструированных рекомбинантных псевдоаденовирусных частиц экспрессировать гены белков М2 и NP, их иммуногенность и протективность.
Пример 4. Изучение экспрессии генов М2 и NP в составе препарата Ad5-tet-M2NP-PEST.
На данном этапе была подтверждена экспрессия генов М2 и NP в составе Ad5-tet-M2NP-PEST, полученного в примере 3, на культуре клеток аденокарциномы легких человека (А549).
Оценку экспрессии генов М2 и NP в составе Ad5-tet-M2NP-PEST проводили методом иммуногистохимии с использованием моноклональных антител мыши к белкам М2 (14С2) (Abcam, Великобритания) и NP (В248М) (Abcam, Великобритания) и вторичных антител, меченных флуоресцентным красителем Dylight 488 (Abcam, Великобритания). Для этого клетки линии А549 трансдуцировали Ad5-tet-M2NP-PEST (10 БОЕ на клетку). В качестве отрицательного контроля использовали клетки, трансдуцированные рекомбинантным аденовирусом Ad5-null, не несущим трансгена, в качестве положительного контроля использовали клетки, инфицированные вирусом гриппа A/USSR/90/77 (H1N1). Через 48 ч. после трансдукции клетки фиксировали ацетоном и инкубировали с антителами по стандартной методике постановки иммуногистохимии. Оценку результатов иммуногистохимии проводили с помощью конфокальной микроскопии. При помощи антител, меченных флуоресцентным красителем, белки М2 и NP окрашивались в зеленый цвет, что подтверждает экспрессию генов М2 и NP в составе Ad5-tet-M2NP-PEST. При помощи красителя DAPI (4',6-диамидино-2-фенилиндола-дигидрохлорид) происходило окрашивание ядер клеток в синий цвет.
Следует отметить, что белок М2 локализуется не только в цитоплазме, но и на цитоплазматической мембране, что имеет важное значение при использовании белка М2 как компонента, стимулирующего гуморальный иммунный ответ (фиг. 10). Кроме того в клетках, трансдуцированных Ad5-tet-M2NP-PEST, локализация белка NP является цитоплазматической в отличие от положительного контроля, где белок NP локализуется в ядре (фиг. 11). Цитоплазматическая локализация белка NP свидетельствует об успешном удалении из его последовательности сигнала ядерной локализации, что делает белок NP доступным для деградации в цитоплазме и для эффективной презентации в комплексе с молекулами МНС I класса.
Пример 5. Получение кандидатной вакцины.
Получение предлагаемой вакцины проходит в несколько этапов.
Разработанная технология должна обеспечивать производство вакцины следующего качества:
- доза 106-109 БОЕ/мл рекомбинантных псевдоаденовирусных частиц (РПАН), экспрессирующих гены белков М2 и NP;
- объем дозы 0,5 мл (доводится фармацевтически приемлемым буферным раствором).
Для этого полученную в примере 3 клеточную суспензию, содержащую рекомбинантные псевдоаденовирусные частицы Ad5-tet-M2NP-PEST с титром 108 БОЕ/мл, использовали для наращивания с целью приготовления вакцины с заданным содержанием рекомбинантных псевдоаденовирусных частиц (РПАН).
Для наработки необходимых титров рекомбинантных псевдоаденовирусных частиц волновой биореактор с 4500,0 мл суспензии пермиссивной клеточной культуры 293НЕК засевали клеточной суспензией объемом 500,0 мл, содержащей рекомбинантные псевдоаденовирусные частицы с титром 108 БОЕ/мл.
Для наращивания рекомбинантных псевдоаденовирусных частиц и достижения титра 2×108 БОЕ/мл, их культивировали в течение 48 часов в присутствие доксициклина в концентрации 5,0 мкг/мл. Затем клеточную массу очищали в несколько этапов:
1) Вначале проводили осаждение клеточной массы центрифугированием при режиме 6000g в течение 15 мин. Осадок, содержащий клетки и рекомбинантные псевдоаденовирусные частицы, подавали на дальнейшую очистку.
2) Извлечение рекомбинантных псевдоаденовирусных частиц из клеточной культуры проводили путем разрушения клеток перемораживанием при рН 8.0 (Буферный раствор 5 mМТрисНСI, 0.075 MNaCl, 1 mMMgCl2, 5% сахароза, 1% полисорбат 80) в жидком азоте.
3) Для дальнейшего удаления геномной клеточной ДНК проводили дополнительную обработку бензоназой (Merk Millipore, Германия) (150,0 ЕД/мл) и ставили на мягкое перемешивание на 3 часа при комнатной температуре (21-23°С).
4) Удаление клеточного дебриса с целью получения супернатанта, содержащего рекомбинантные псевдоаденовирусные частицы, осуществляли центрифугированием при 9000g.
5) Полученный супернатант разводили буфером (50mM TrisHCl рН 7.5, 1М NaCl, 2 mМ MgCl2, 5% сахароза, рН 7,5) до объема не менее 200 мл и подвергали ультрафильтрации.
6) Далее очистку производили путем анионобменной хроматографии.
Ретентат наносили на колонку (AxiChrom 70/300 объемом 400,0 мл), содержащую анионообменный сорбент Q Sepharose virus licenced (GE Healthcare, Швеция). Условия хроматографирования: поток 193,0 мл/мин, буфер А (40,0 mM TrisHCl, 0,27 M NaCl, 2,0 mМ MgCl2, 5% сахароза, 0,1% полисорбат 80, рН 7.5), проводимость ~28-30 mS/cm; буфер Б (40,0 mМ TrisHCl, 0.5 M NaCl, 2,0 mМ MgCl2, 5% сахароза, 0,1% полисорбат 80, рН 7.5) проводимость ~50 mS/cm.
7) Эксклюзионная хроматогафия.
Полученный в предыдущей стадии элюат в объеме 200,0 мл наносили на колонку (AxiChrom 100/300 объемом 800,0 мл), содержащую сорбент Q Sepharose 4 FastFlow (GE Healthcare, Щвеция). Высокомолекулярные вещества, не входящие в поры сорбента, элюировали первым пиком (к ним относятся рекомбинантные псевдоаденовирусные частицы), примеси элюировали после выхода пика нереплицирующихся наночастиц. Условия хроматографирования: поток 130,0 мл/мин, буфер (10 mM TrisHCl, 75 мМ NaCl, 1 mM MgCl2, 5% сахароза, 0,05% полисорбат 80, рН 8.0).
Затем элюат стабилизировали при помощи добавления этанола до концентрации 0,5% и этилендиаминтетрауксусной кислоты (ЭДТА) до концентрации 100 мкМ.
8) Нормальная фильтрация.
Для стерилизации полученный препарат фильтровали через систему фильтров с размером пор 0,22 мкМ и разбавляли стерильным фармацевтически приемлемым буферным раствором, например: 10 mМ TrisHCl, 75 mМ NaCl, 1 mМ MgCl2, 5% сахароза, 0,05% полисорбат 80, 0,5% этанол, 100 мкм ЭДТА, рН 8.0, до получения активного компонента с учетом требуемой конечной активности 106-109 БОЕ рекомбинантных псевдоаденовирусных частиц Ad5-tet-M2NP-PEST. Полученный объем препарата разливают по флаконам по 0,5 мл одна доза.
Таким образом, поставленная задача по приготовлению вакцины по изобретению выполнена. Возможно получение вакцины, содержащей:
- рекомбинантных псевдоаденовирусных частиц, экспрессирующих гены белков М2 и NP вируса гриппа А, - 106-109 БОЕ/мл.
- фармацевтически приемлемый буферный раствор - до 0,5 мл.
Для дальнейшего изучения иммуногенности кандидатной вакцины, содержащей Ad5-tet-M2NP-PEST, необходимо было оценить способность данного препарата индуцировать выработку специфических антител и специфических реакции Т-клеточного иммунного ответа.
Пример 6. Изучение индукции гуморального иммунного ответа на кандидатную вакцину.
Полученная в примере 5 кандидатная вакцина, содержащая Ad5-tet-M2NP-PEST, использована для изучения гуморального иммунного ответа у мышей. Все работы выполняли в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Исследование проводили на мышах линии Balb/c (самки), 7-8 недель (массой 16-18 г), которые были разделены на 4 группы, по 5 особей в каждой. Контролем служили первая и вторая группы животных. Первая группа мышей получила фармацевтически приемлемый буфер, вторая группа получила Ad5-null, конструкцию, содержащую полноразмерный геном рекомбинантного аденовируса и экспрессирующую кассету, не несущую трансгена. Третья группа мышей была иммунизирована препаратом вакцины, содержащей Ad5-tet-M2NP-PEST в дозе 107 БОЕ на мышь, и четвертая группа животных была иммунизирована препаратом Ad5-tet-M2NP-PEST в дозе 108 БОЕ на мышь. Мышам вводили однократно интраназально 50,0 мкл предлагаемого препарата, либо Ad5-null, либо ФПБ. Забор крови у животных во всех группах производили через 28 суток.
В сыворотке крови определяли титры специфических антител изотипа IgG к белкам М2 и NP в реакции непрямого иммуноферментного анализа (ИФА). В качестве антигена для оценки антител к белку NP использовали рекомбинантный белок NP вируса гриппа A/PuertoRico/8/34/Mount Sinai (H1N1) (Sino Biological, Китай) в концентрации 0,5 мкг на лунку. В качестве антигена для оценки антител к белку М2 использовали синтетический эктодомен белка М2 (MSLLTEVETPIRNEWGCRCNDSSD) в концентрации 5,0 мкг на лунку.
ИФА проводили общепринятым методом. Использовали 96-луночные планшеты с высокой сорбционной способностью (Greiner, Германия). Для определения специфических антител изотипа IgG в качестве конъюгата использовали кроличьи моноклональные антимышиные IgG (Invitrogen, США) в разведении 1:1000, меченые пероксидазой хрена. В качестве субстрата использовали тетраметилбензидин (ТМБ) (Invitrogen, США). Учет реакции проводили при длине волны 450 нм. За титр принимали наибольшее разведение сыворотки, которое дает оптическую плотность, по крайней мере в 2 раза больше, чем сыворотка, взятая у контрольных мышей.
Через 28 суток после иммунизации средние титры сывороточных IgG к антигенам М2 и NP у мышей, иммунизированных кандидатной вакциной, содержащей Ad5-tet-M2NP-PEST, были существенно выше, чем у мышей контрольных групп. Титр антител к антигену М2 в сыворотках крови мышей, иммунизированных Ad5-tet-M2NP-PEST в дозе 108 БОЕ на мышь, составил в среднем 25600. Средний титр антител в сыворотках крови мышей, иммунизированных Ad5-tet-M2NP-PEST в дозе 107 БОЕ на мышь, составил 12800. Средний титр антител к антигену NP в сыворотках крови мышей, иммунизированных Ad5-tet-M2NP-PEST в дозе 108 БОЕ на мышь, составил в среднем 25600. Средний титр антител в сыворотках крови мышей, иммунизированных Ad5-tet-M2NP-PEST в дозе 107 БОЕ на мышь, составил 6400 (см. фиг. 12 и 13).
Таким образом, был детектирован значимый уровень антител к белкам М2 и NP вируса гриппа А в сыворотках крови мышей, однократно интраназально иммунизированных кандидатной вакциной Ad5-tet-M2NP-PEST. Наличие специфической активности - иммуногенности означает возможность использования РПАН Ad5-tet-M2NP-PEST в качестве действующего вещества противогриппозной вакцины.
Пример 7. Изучение индукции Т-клеточного иммунного ответа на кандидатную вакцину.
Полученная в примере 5 кандидатная вакцина, содержащая Ad5-tet-M2NP-PEST, использована для изучения Т-клеточного иммунного ответа у мышей. Для этой цели применяли метод ELISPOT, позволяющий выявлять Т-лимфоциты, специфичные к белкам М2 и NP, по их способности секретировать IFN-γ в ответ на реактивацию дендритными клетками, презентирующими белки М2 и NP. Дендритные клетки получали из костного мозга интактных мышей и культивировали в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора.
Все работы выполняли в соответствие с «Правилами проведения работ с использованием экспериментальных животных». В исследовании использованы 3 группы мышей линии Balb/c (самки), 7-8 недель (массой 16-18 г), по 5 особей в каждой. Эксперимент проводили на животных после однократного интраназального введения 50,0 мкл препарата, содержащего Ad5-tet-M2NP-PEST. В качестве отрицательного контроля использовали мышей, которым однократно интраназально вводили Ad5-null или фармацевтически приемлемый буфер. Через месяц после иммунизации мышей умерщвляли бескровным методом и выделяли спленоциты. Спленоциты реактивировали in vitro дендритными клетками, презентирующими белки М2 и NP, и определяли количество спленоцитов, отвечающих секрецией IFΝ-γ в ответ на специфическую реактивацию.
Для реактивации спленоцитов in vitro использовали 2 варианта дендритных клеток. В первом варианте дендритные клетки предварительно активировали липополисахаридом (LPS) для индукции экспрессии молекул МНС класса II и ко-стимулирующих молекул CD80/CD86. Предварительно активированные дендритные клетки инкубировали в присутствии рекомбинантного белка NP вируса гриппа A/PuertoRico/8/34/Mount Sinai (H1N1) или в присутствие синтетического эктодомена белка М2 (MSLLTEVETPIRNEWGCRCNDSSD) для «нагрузки» антигенпрезентирующих клеток одним из указанных антигенов. В качестве контроля реактивации использовали дендритные клетки, активированные LPS, без нагрузки антигеном. При втором варианте постановки эксперимента дендритные клетки трансдуцировали Ad5-tet-M2NP-PEST и через 2 суток использовали их для реактивации спленоцитов. В качестве контроля реактивации применяли дендритные клетки, трансдуцированные Ad5-null. Схема постановки эксперимента представлена на фиг. 14.
При специфической реактивации спленоцитов дендритными клетками, активированными LPS и инкубированными с антигеном М2, было детектировано в среднем 144 IFN-γ-секретирующих клеток на 1 млн. спленоцитов. При специфической реактивации спленоцитов дендритными клетками, активированными LPS и инкубированными с антигеном NP, было детектировано в среднем 230 IFN-γ-секретирующих клеток на 1 млн. спленоцитов. Результаты эксперимента представлены на фиг. 15.
При специфической реактивации спленоцитов дендритными клетками, трансдуцированными препаратом Ad5-tet-M2NP-PEST, было детектировано в среднем 200 IFN-γ-секретирующих клеток на 1 млн. спленоцитов. Результаты эксперимента представлены на фиг. 16.
При всех вариантах специфической реактивации дендритными клетками, уровень IFN-γ-секретирующих клеток у иммунизированных Ad5-tet-M2NP-PEST мышей, был достоверно выше, чем в контрольных группах.
Таким образом, методом ELISPOT была продемонстрирована индукция значимого уровня Т-клеточного иммунного ответа к антигенам М2 и NP у мышей, однократно интраназально иммунизированных кандидатной вакциной.
Заключено, что изучение Т-клеточного ответа у животных, иммунизированных вакциной по изобретению, показало наличие выраженного Т-клеточного иммунного ответа, что соответствует современным требованиям к вакцинам.
Пример 8. Исследование протективной активности кандидатной вакцины.
В данном примере продемонстрирована возможность индукции протективного иммунного ответа широкого спектра действия при помощи однократной интраназальной иммунизации разработанной вакциной.
С этой целью поставлены эксперименты по изучению протективной активности в отношении различных штаммов вируса гриппа А подтипов H1N1, H2N3, H3N2, H5N2, H9N2 (всего 5 экспериментов). В исследовании использованы мыши линии Balb/c (самки), 7-8 недель (массой 16-18 г), в каждой группе было по 10 животных. Все работы выполняли в соответствие с «Правилами проведения работ с использованием экспериментальных животных».
Изучение протективной активности в отношении каждого подтипа проведено на мышах, которым однократно интраназально вводили предлагаемую вакцину в дозе 108 БОЕ/мышь (опытная группа). В качестве контроля животные однократно интраназально получали Ad5-null (контрольная группа).
Через 28 суток после иммунизации мышей интраназально заражали десятью 50%-ными летальными дозами (10ЛД50) вируса гриппа А различных подтипов, адаптированных для мышей. Заражение H1N1 (A/USSR/90/77) - первый эксперимент, заражение H2N3 (A/BlackDuck/NewJersey/1580/78) - второй эксперимент, заражение H3N2 (A/Aichi/2/68) - третий эксперимент, заражение H5N2 (A/Duck(Mallard)/Pensylvania/10218/84) - четвертый эксперимент и заражение H9N2 (A/Swine/Hong Kong/9A-1/98) - пятый эксперимент. Схема эксперимента представлена на фиг. 17. В течение 14 суток после заражения за животными вели наблюдение, фиксировали смертность и изменение веса.
Данные наблюдения представлены на фиг. 18-27.
В первом эксперименте было показано, что мыши, иммунизированные предлагаемым препаратом, были на 80% защищены от заражения вирусом гриппа A/USSR/90/77 (H1N1). Падение веса иммунизированных животных выявлено в пределах 10%. В контрольной группе погибло 60% животных. Результаты эксперимента представлены на фиг. 18 и 19.
Во втором эксперименте было показано, что мыши, иммунизированные предлагаемым препаратом, были на 100% защищены от заражения вирусом гриппа A/BlackDuck/NewJersey/1580/78 (H2N3). Падение веса иммунизированных животных не отмечено. В контрольной группе все животные (100%) погибли в течение 5 дней. Результаты эксперимента представлены на фиг. 20 и 21.
В третьем эксперименте было показано, что мыши, иммунизированные предлагаемым препаратом, были на 80% защищены от заражения вирусом гриппа A/Aichi/2/68 (H3N2). Падение веса иммунизированных животных выявлено в пределах 10%. В контрольной группе пало 90% животных. Результаты эксперимента представлены на фиг. 22 и 23.
В четвертом эксперименте было показано, что мыши, иммунизированные предлагаемым препаратом, были на 100% защищены от заражения вирусом гриппа A/Duck(Mallard)/Pensylvania/l0218/84 (H5N2). Падение веса иммунизированных животных не отмечено. В контрольной группе погибло 80% животных. Результаты эксперимента представлены на фиг. 24 и 25.
В пятом эксперименте было показано, что мыши, иммунизированные предлагаемым препаратом, были на 100% защищены от заражения вирусом гриппа A/Swine/Hong Kong/9A-l/98 (H9N2). Падение веса иммунизированных животных выявлено в пределах 5%. В контрольной группе погибло 70% животных. Результаты эксперимента представлены на фиг. 26 и 27.
Таким образом, однократная интраназальная иммунизация предлагаемым препаратом эффективно (эффективность 80-100%) защищает от летальной дозы (10ЛД50) вируса гриппа А различных подтипов, что говорит о широком спектре протективной активности разработанной вакцины. Суммарные данные экспериментов по иммунизации представлены в табл.2.
Промышленная применимость
Таким образом, создана универсальная вакцина на основе рекомбинантных псевдоаденовирусных частиц (РПАН), содержащая аденовирус человека пятого серотипа со встроенной генетической конструкцией, кодирующей разработанные оптимальные консенсусные полноразмерные аминокислотные последовательности антигенов М2 и NP, наиболее гомологичные для различных штаммов вируса гриппа А, при этом гены данных белков экспрессируются рекомбинантными псевдоаденовирусными частицами непосредственно в организме субъекта. В предлагаемой вакцине гены белков М2 и NP отделены последовательностью, кодирующей саморасщепляющийся пептид 2А вируса ящура, и экспрессируются под контролем системы Tet-off в качестве индуцибельного промотора для блокирования экспрессии гена М2 на стадии получения рекомбинантных аденовирусных частиц, и при этом ген белка NP модифицирован удалением сигнала ядерной локализации и мотивом PEST, являющимся сигналом для полиубиквитинирования белка. Разработанная универсальная вакцина может рассматриваться в качестве кандидатного препарата для доклинических исследований, как противовирусная вакцина широкого спектра действия, которая способна одновременно эффективно защищать человека от заражения различными штаммами вируса гриппа А. Предложена технология производства такой вакцины. Вакцину предпочтительно использовать интраназально.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Schotsaert M., De Filette M., Fiers W., Saelens X. Universal M2 ectodomain based influenza A vaccines: preclinical and clinical developments. // Expert Rev. Vaccines. - 2009. - V. 8 (4). - P. 499-508.
2. Ito T., Gorman O., Kawaoka Y., Bean W., Webster R. Evolutionary analysis of the influenza A virus M gene with comparison of the M1 and M2 proteins. // J. Virol. - 1991. - V. 65. - P. 5491-5498.
3. Treanor J.J., Tierney E.L., Zebedee S.L., Lamb R.A., Murphy B.R. Passively transferred monoclonal antibody to the M2 protein inhibits influenza A virus replication in mice. // J. Virol. - 1990. - V. 64 (3). - P. 1375-1377.
4. Scholtissek C, Ludwig S., Fitch W.M. Analysis of influenza A virus nucleoproteins for the assessment of molecular genetic mechanisms leading to new phylogenetic virus lineages. // Arch. Virol. - 1993. - V. 13(3/4). - P. 237-250.
5. Shu L.L., Bean W.J., Webster R.G. Analysis of the evolution and variation of the human influenza A virus nucleoprotein gene from 1933 to 1990. // J. Virol. - 1993. - V. 67 (5). - P. 2723-2729.
6. Haanen J.B., Wolkers M.C., Kruisbeek A.M., Schumacher T.N. Selective expansion of cross-reactive CD8+ memory Τ cells by viral variants. // J. Exp. Med. - 1999. - V. 190 (9). - P. 1319-1328.
7. Van Kampen K.R., Shi Z., Gao P., Zhang J., Foster K.W., Chen D.T., Marks D., Elmets C.A., Tang D.C. Safety and immunogenicity of adenovirus-vectored nasal and epicutaneous influenza vaccines in humans. // Vaccine. - 2005. - V. 23. - P. 1029-1036.
8. Ohba K., Yoshida S., Zahidunnabi Dewan M., Shimura H., Sakamaki N., Takeshita F., Yamamoto N., Okuda K. Mutant influenza A virus nucleoprotein is preferentially localized in the cytoplasm and its immunization in mice shows higher immunogenicity and cross-reactivity. // Vaccine. - 2007. - V. 25(21). - P.4291-4300.
9. Szymczak A.L., Vignali D.A. // Development of 2A peptide-based strategies in the design of multicistronic vectors. Expert Opin Biol Ther. - 2005. V. - 5(5). - P. 627-638.