Результат интеллектуальной деятельности: ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ НИКЛОЗАМИДА
Вид РИД
Изобретение
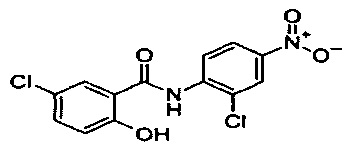
Изобретение относится к области фармакологии и медицины, конкретно к новому поколению противоопухолевых препаратов на основе никлозамида. Никлозамид хорошо известен как лекарственный препарат - противоглистное средство [1]. Систематическое название: 5-хлор-N-(2-хлор-4-нитрофенил)-2-оксибензамид [1]. Считается, что никлозамид является разобщителем дыхания и окислительного фосфорилирования в митохондриях. Ниже приведена его формула
Недавно было обнаружено, что никлозамид также обладает и противоопухолевой активностью широкого спектра действия. Показана высокая активность никлозамида в отношении клеток гепатомы линий Huh-6 и Hep3B [2], клеток рака предстательной железы [3], клеток аденокарциномы яичника [4], клеток немелкоклеточного рака легкого [5], клеток рака молочной железы линий MDA-MB-231, MCF-7, MDA-MB-468, 4Т1 [6]. Обнаружено, что препарат ингибировал пролиферацию клеток различных линий лейкоза человека in vitro и in vivo [7]. Никлозамид подавляет миграцию опухолевых клеток глиобластомы и снижает их злокачественный потенциал in vivo [8]. В экспериментах in vivo обнаружено ингибирование образования метастазов и увеличение продолжительности жизни мышей с привитыми опухолями рака толстой кишки после лечения никлозамидом [9]. Никлозамид обладает также высокой активностью и в отношении опухолевых стволовых клеток (ОСК). Эффективность его действия в отношении ОСК убедительно доказана в отношении ОСК миелолейкоза [7] и рака молочной железы [10]. Никлозамид, в комбинации с другими противоопухолевыми препаратами, способствует преодолению устойчивости опухолевых клеток к этим препаратам. Совокупность полученных в разных исследованиях результатов позволяет рассматривать никлозамид в качестве перспективного противоопухолевого лекарственного средства для лечения широкого круга онкологических заболеваний, в том числе прогрессирующих форм рака.
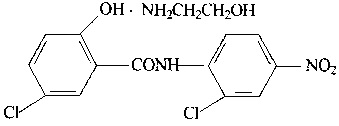
Растворимость никлозамида в воде очень низкая, особенно в кислой среде, несколько возрастает в щелочных условиях, что определяет его низкую биодоступность, которая при пероральном введении составляет 10%. Низкая биодоступность никлозамида является сдерживающим фактором его использования в качестве противоопухолевого препарата. Для повышения растворимости никлозамида была получена его соль с этаноламином (ниже приведена формула)
В патенте № CN 1883266 A «А snail-killing medicine-nano suspension concentrate of niclosamide ethanolamine and method for preparing same» [11] описана наносуспензия никлозамида, в которой содержание никлозамида этаноламина - 15-25%, водорастворимого полимера - 0,05-0,5%, поверхностно-активного вещества - 3-15%, пеногасителя - 1-10%, и остальное - вода в качестве дисперсионной среды. Описанная суспензия готовится методом распыления. В качестве полимеров могут быть использованы алкил, циклический алкил, арил или ар-алкил и др. В качестве модификатора поверхности могут быть использованы одноатомные спирты, имеющие от 6 до 20 атомов углерода, и моно- и полиненасыщенных их производные; многоатомные спирты, имеющие от 2 до 10 атомов углерода, и их моноэфиры, диэфиры, триэфиры, соевое масло и др., которыми инкапсулирует частицу путем коацервации. Таким образом, данная суспензия представляет собой мелкодисперсную форму никлозамида, в состав которой с целью увеличения растворимости включены водорастворимый полимер и поверхностно-активное вещество. Однако для описанной суспензии не является характерным свойством пролонгированность действия. Кроме того, в указанном патенте нет описания противоопухолевых свойств суспензии.
В патенте № CN 1067515 C «Slow-released or control-released molluscacide» [12] описан препарат моллюскоцид в виде композиции, обеспечивающей контролируемое/замедленное высвобождение, в форме таблетки, гранулы, пленки, диализного мешка или содержащей высокомолекулярный носитель. В композицию включены следующие компоненты: носитель - от 5% до 80%; вспомогательные вещества - от 10% до 65%; материал пленочного покрытия - от 1% до 30%; моллюскоцид - от 3% до 20%. В качестве моллюскоцида может использоваться никлозамид, пентахлорфенол Na, никотинамид анилин; в качестве носителя - сульфаты, каолин и др.; в качестве вспомогательного вещества - крахмал, декстрин, стеараты и др.; в качестве пленочного покрытия - озокерит, парафин, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, этилцеллюлоза, поливиниловый спирт, пчелиный воск и др. Описанный препарат используется как моллюскоцид, и в патенте отсутствует описание противоопухолевых свойств препарата.
В работе [13] приводятся данные по включению никлозамида в состав циклодекстринов и получению комплексов с полиамдоаминами - (PAMAM) дендримерами с целью увеличения их растворимости в водных средах. Сильное взаимодействие между функциональными группами никлозамида и поверхностными амино-группами PAMAM приводило к сильному торможению высвобождения лекарственного средства из его комплекса с полимером, что является предпосылкой пролонгированности его лекарственного действия. Основным недостатком дендримеров является их высокая стоимость.
Для повышения растворимости и биодоступности никлозамида также было осуществлено его включение в гидрофильную полимерную матрицу на основе полиэтиленгликоля и поликапролактона с последующим получением нановолокон методом электроформования [14]. Наночастицы включались на поверхность и в состав нановолокна. Диаметр полученных наночастиц составил 11,6 нм. Диаметр полимерных нановолокон находился в диапазоне от 150 до 300 нм. При изучении высвобождения никлозамида из полученных препаратов в модельных опытах было показано, что при использовании наночастиц быстро переходит в раствор 15% вещества, затем 43% препарата выходит в течение 20 дней. При использовании нановолокон высвобождение составило 15 и 50% соответственно. Нановолокона обеспечивают большую площадь поверхности для высвобождения лекарственного средства. Также авторами был получен комплексный препарат в виде нановолокон, сочетающий, кроме наночастиц с никлозамидом, частицы серебра. Данное соединение было более устойчивое и характеризовалось контролируемым высвобождением вещества. Исследование цитотоксичности препаратов in vitro на клетках линий MCF-7 и А549 показало, что никлозамид в составе нановолокон индуцировал гибель клеток при меньшей концентрации по сравнению с никлозамидом. Однако описанная технология получения нановолокон является достаточно дорогостоящей и малоприменимой для использования в медицине.
В работе [15] приводятся результаты по получению никлозамида в виде полимерных частиц с никлозамидом на основе PLGA (никлозамид-PLGA) с диаметром с 584-662 нм, получаемых с использованием элекстроспрей-систем. Предложенная одно- или двухъядерная капиллярная система «Микроспрей» может генерировать монодисперсные частицы. Полимерные частицы с никлозамидом показали увеличение растворимости в 1,6 раз по сравнению с обычным препаратом никлозамида. Высвобождение никлозамида из частиц составило 31,6% за 500 часов. Авторами показано, что частицы никлозамид-PLGA обладают более высокой цитотоксической активностью, чем обычный никлозамид, по отношению к опухолевым клеткам яичника линий СР70 и SKOV-3. Свойства описанных в данной публикации частиц не вполне удовлетворяет требованиям, предъявляемым к инъекционным лекарственным формам в виде частиц, средний размер которых должен быть менее 500 нм, предпочтительно не более 200 нм, что обеспечит наиболее оптимальное биораспределение частиц, так как позволит задержать частицы в кровотоке, избежать их захвата клетками ретикулоэндотелиальной системы (РЭС) и улучшит проникновение в опухолевые клетки.
Таким образом, все перечисленные композиции, составы и способы имеют ограничения в большей или меньшей степени, в связи с чем существует необходимость в разработке новых и/или усовершенствованных составов, композиций и способов для создания противоопухолевого лекарственного средства на основе никлозамида. Более конкретно, существует необходимость в разработке состава противоопухолевого лекарственного средства на основе никлозамида, которое характеризовалось бы субмикронными размерами (не более 500 нм), пролонгированным характером высвобождения никлозамида, противоопухолевой активностью и пониженным уровнем общетоксического действия.
Достижение технического результата осуществляется путем разработки противоопухолевого лекарственного средства на основе никлозамида, включающего биодеградируемый полимер в виде сополимера молочной и гликолевой кислот с молярным соотношением мономерных звеньев 50 на 50%, полимеры эудрагит Eudragit RS РО или эудрагит Eudragit RL РО, поверхностно-активное вещество в виде поливинилового спирта, криопротектор в виде D-маннитола, представляющего собой частицы субмикронного размера со средним размером не более 500 нм, следующего состава, мас.%:
|
Противоопухолевое лекарственное средство может быть выполнено, в виде капсул, или гранул, или порошка или другой пероральной формы, или в виде лиофилизата, или суспензии для инъекций.
Сопоставление характеристик заявляемого лекарственного средства с литературными данными о других полимерсодержащих продуктах (препараты, фармацевтические композиции, полимерные частицы и т.п.), содержащих никлозамид, приведено в таблице 1.
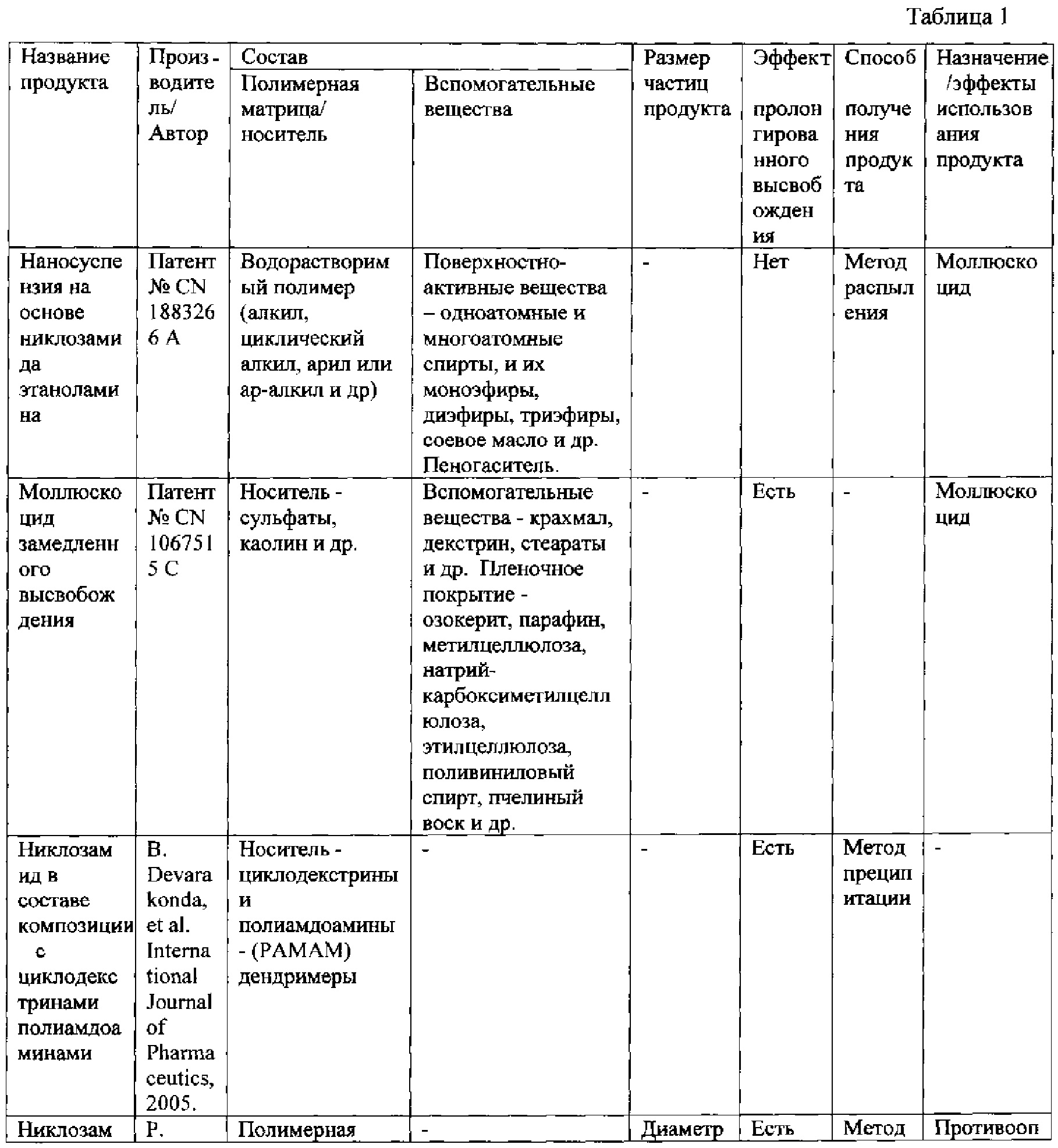
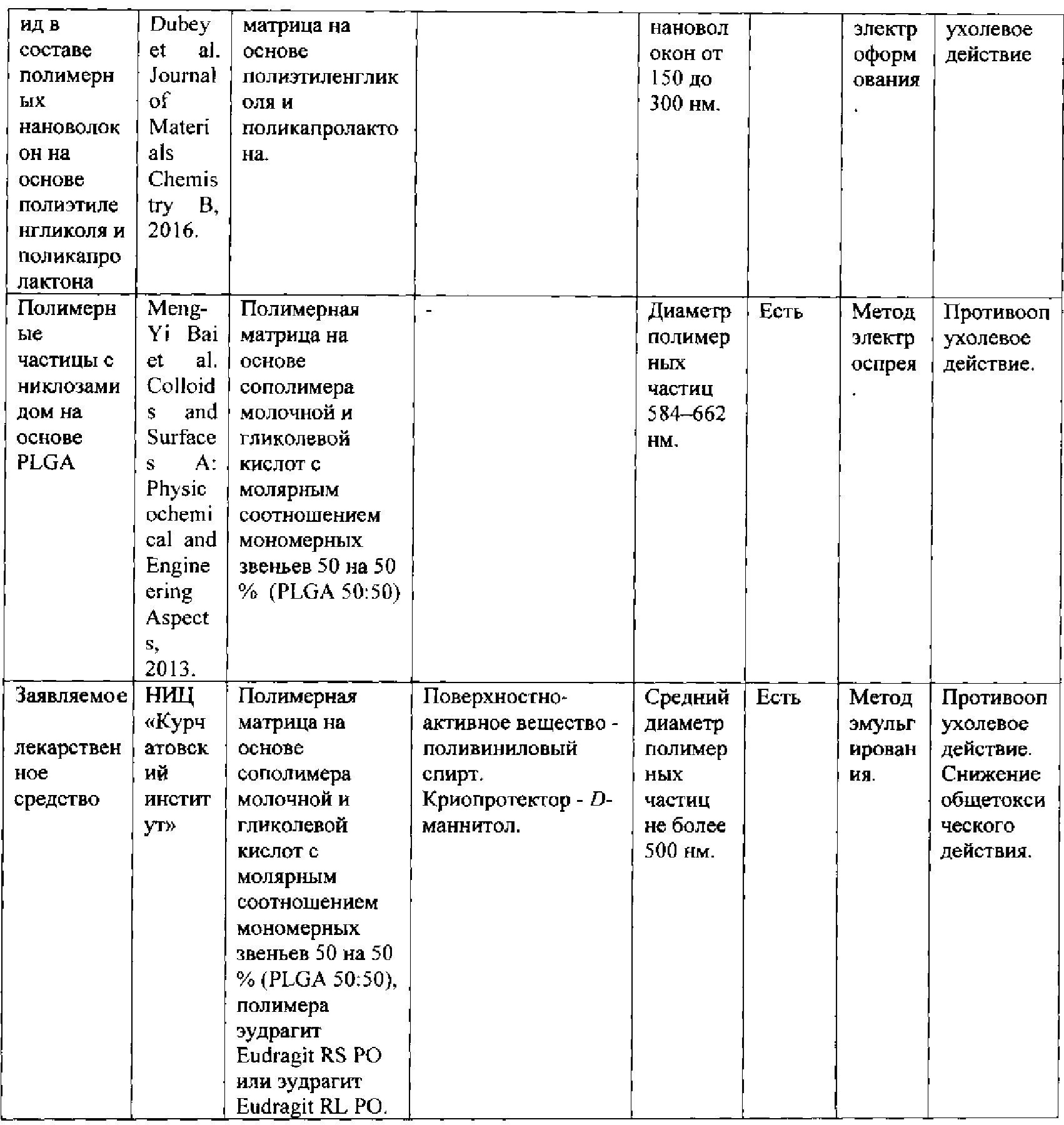
Таким образом, в сравнении с другими полимерсодержащими продуктами на основе никлозамида, указанными в таблице 1, заявляемый состав противоопухолевого лекарственного средства на основе никлозамида, включающего биодеградируемый полимер в виде сополимера молочной и гликолевой кислот с молярным соотношением мономерных звеньев 50 на 50%, полимеры эудрагит Eudragit RS РО или эудрагит Eudragit RL РО, поверхностно-активное вещество в виде поливинилового спирта, криопротектор в виде D-маннитола, позволяет достигать наиболее оптимальные характеристики в виде субмикронного размера частиц со средним размером не более 500 нм, и технического результата в виде пролонгированного высвобождения, противоопухолевого действия и снижения общетоксического действия. Описанный технический результат достигается по совокупности всех существующих признаков созданного лекарственного средства.
При разработке лекарственного средства наибольшее внимание было уделено выбору полимерного носителя. Влияние вида полимера на свойства будущей композиции с лекарственным веществом является первостепенным. Основные требования к полимерам, применяемым в медицине - биосовместимость, нетоксичность, апирогенность, отсутствие канцерогенных свойств, возможность стерилизации и др. Выбор типа полимера также ограничивается его коммерческой доступностью, возможностью медицинского применения. Как уже указывалось, одними из наиболее перспективных полимерных носителей для разработки систем доставки лекарственных веществ являются полилактидгликолиды [16-18]. В таблице 2 представлены результаты исследования свойств образцов полученных полимерсодержащих композиций на основе никлозамида. Эксперимент по получению образца NC-1, проведенный с использованием PLGA 50/50, показал, что примерно 90% никлозамида находится в свободном состоянии (степень сорбции никлозамида ≤10%). Таким образом, сополимер молочной и гликолевой кислот PLGA 50/50 малопригоден для получения частиц с никлозамидом. Использование для этих целей PLA или PLGA 75:25 также неперспективно, так как эти полимеры еще более гидрофобны по сравнению с PLGA 50/50. Полимер PLGA-COOH 50/50 не подходит для иммобилизации никлозамида, также несущего отрицательный заряд при нейтральных или щелочных значениях pH.
Известно, что никлозамид образует соли с органическими соединениями, несущими положительно заряженные функциональные группы, в частности с этаноламином. Это свойство было использовано Bharathi D. и др. для иммобилизации никлозамида на полиамдоаминах (PAMAM) дендримерах [13]. В последнее время эудрагиты стали применяться для получения полимерсодержащих форм лекарственных препаратов для различных способов введения: перорального, трансбуккального, подъязычного, глазного, ректального, вагинального и/или парентерального [19-22]. Нами для исследований были выбраны полимеры из семейства полиметакрилатов: EUDRAGIT® RL РО и EUDRAGIT® RS РО. Ниже приведена общая структурная формула полимеров
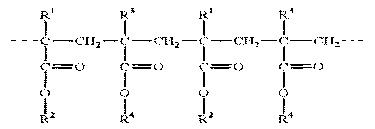
где R1 - атомом водорода или метильная группа; R2 - метильная или этильная группа; R3 - метильная группа; R4 - группа CH2-CH2-N(CH3)3+ Cl-.
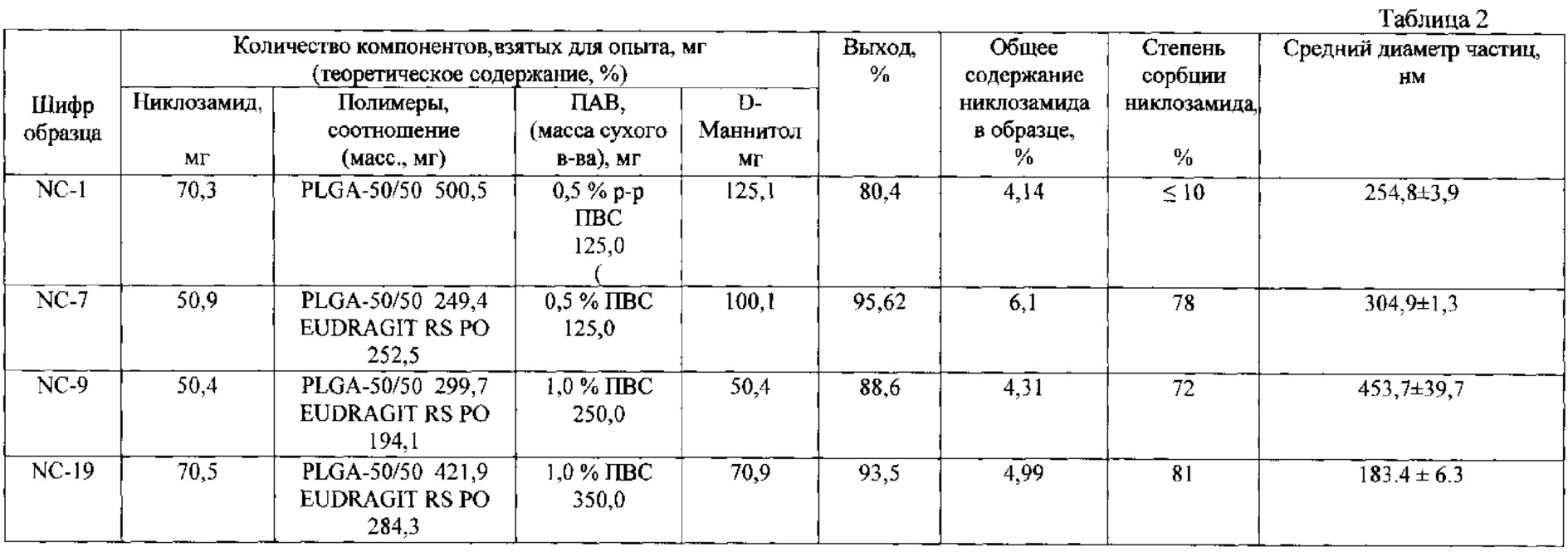
В экспериментах (NC-7, NC-9, NC-19) для получения полимерных частиц с никлозамидом была использована смесь полимеров PLGA 50/50 и EUDRAGIT® RL РО или EUDRAGIT® RS РО в разных массовых соотношениях. Использование EUDRAGIT® RS РО было более предпочтительным, так как давало частицы с никлозамидом меньшего размера с более узким интервалом их распределения, а также с более высоким уровнем включения никлозамида в полимерную матрицу (см. таблицу 1). Степень включения никлозамида в состав полимерных частиц существенно возрастала (≥75%). Определенные затруднения вызывала отгонка растворителя. После проведения данного процесса оставалось незначительное количество этилацетата, растворенное в водной среде, которое удалялось только при проведении стадии лиофилизации.
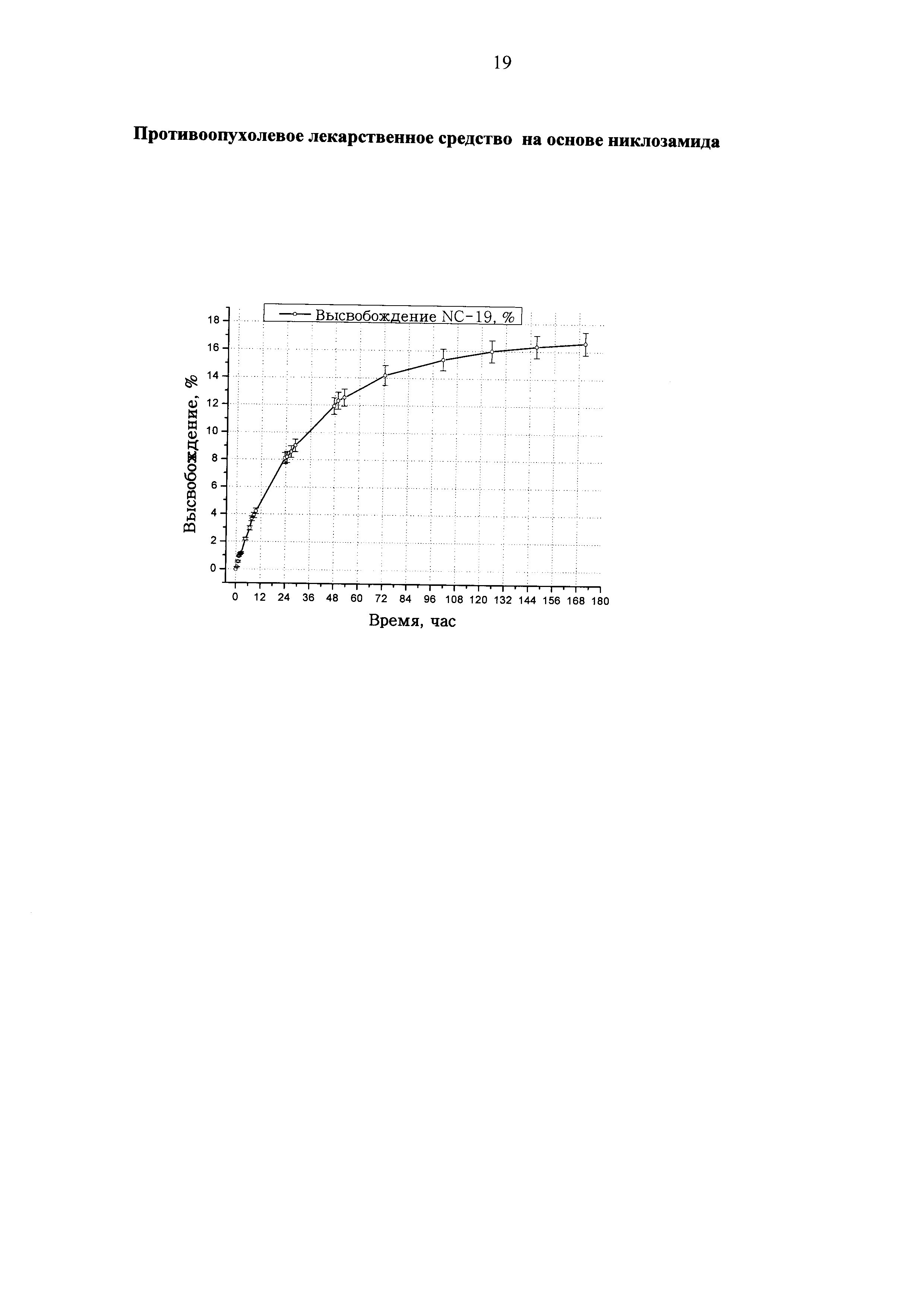
На чертеже представлены результаты эксперимента по изучению динамики выхода никлозамида из полимерсодержащей композиции NC-19 в условиях диализа при температуре 37°C и pH 7.5 в фосфатно-солевом буферном растворе. Как видно, в данных условиях наблюдается медленное выделение вещества в раствор (за 180 часов высвобождается не более 17% никлозамида от взятого в опыт), что является предпосылкой пролонгированности действия лекарственного препарата. Эти результаты хорошо согласуются с данными, приведенными в работе [17] по высвобождению никлозамида, включенного в состав комплексов с полиамдоаминами - (PAMAM).
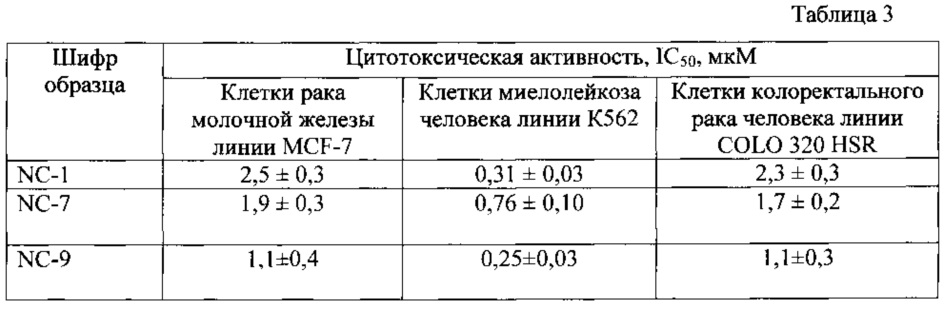
В таблице 3 приведены результаты исследования цитотоксической активности образцов полимерсодержащих композиций на основе никлозамида на различных линиях опухолевых клеток. В качестве веществ - сравнения использовали субстанцию никлозамида и «пустые» частицы, не содержащие никлозамид. Обнаружена высокая цитотоксическая активность исследованных образцов полимерсодержащих композиций на основе никлозамида, которая либо не отличалась от активности свободного никлозамида, либо превышала ее. Полимерные композиции без никлозамида, в используемом диапазоне концентраций, активностью не обладали.

Для исследования общетоксических свойств полимерсодержащей композиции на основе никлозамида (образец NC-19) избраны внутрибрюшинный и пероральный (внутрижелудочный) пути введения экспериментальным животным. Были определены полулетальные дозы полимерсодержащей композиции на основе никлозамида в сравнении с препаратом сравнения субстанцией никлозамида. Исследование острого токсического действия проводили на мышах линии C57BL/6 обоего пола в 4-х дозах. Контроль - введение стерильной воды для инъекций. Определение диапазона летальных доз полимерсодержащей композиции на основе никлозамида проводили путем токсикометрического анализа выживаемости животных после однократного введения препарата с последующим 30-дневным наблюдением. Для полимерсодержащей композиции на основе никлозамида установленные значения среднесмертельной дозы (LD50) при однократном введении мышам линии C57BL/6 составили: при в/б введении - LD50=92.8 мг/кг; при в/ж (пероральном) введении LD50>1700 мг/кг, что выше значений среднесмертельной дозы при в/б введении - LD50=44.8 мг/кг (C57BL/6); при в/ж введении LD50>1600 мг/кг (C57BL/6) субстанции никлозамида. Полученные результаты свидетельствуют о более низкой токсичности полученного препарата по сравнению с субстанцией никлозамида.
В качестве наиболее перспективного препарата, по совокупности полученных данных: по результатам исследования цитотоксической активности, по содержанию никлозамида, степени включения никлозамида в полимерные частицы (81%), среднему размеру полимерных частиц (средний размер частиц менее 200 нм) и способности к ресуспендированию, является образец полимерсодержащей композиции на основе никлозамида NC-19.
Предлагаемое изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение полимерных частиц с включенным в них никлозамидом.
В стеклянном флаконе взвешивали субстанцию никлозамида в количестве примерно 50 мг. Добавляли избыток полимера в количестве 7:1 или 10:1 (масс.), по отношению к массе никлозамида. В качестве полимеров использовали PLGA 50/50 или смесь PLGA 50/50 с EUDRAGIT RL РО в соотношениях 4:1, 3:2 и 1:1 (масс.) или смесь PLGA 50/50 с EUDRAGIT RS РО в соотношениях 4:1, 3:2 и 1:1 (масс.). Вещества растворяли при перемешивании на магнитной мешалке при 55-60°C в 6.0 мл этилацетата. Полученный раствор охлаждали до комнатной температуры. В реакционном сосуде взвешивали 25.0 г 0.5% или 1.0% раствора ПВС в деионизированной (д/и) воде. К раствору ПВС при интенсивном перемешивании на магнитной мешалке добавляли порциями в течение 3÷5 мин раствор никлозамида и полимеров в этилацетате. Продолжали перемешивание смеси в течение 10 мин при комнатной температуре. Проводили эмульгирование смеси погружным гомогенизатором Ultra-Turrax Т-25 basic с помощью насадки S25N - 25F при 24 тыс. об/мин 3 раза по 0.5 мин с 2 перерывами по 0.5 мин. Пенистую массу перегружали в круглодонную колбу. Остатки эмульсии смывали из реакционного сосуда и с насадки гомогенизатора д/и водой 2 раза по 3 мл. Упаривали этилацетат с помощью роторного испарителя в вакууме водоструйного насоса. Полученную смесь фильтровали через стеклянный фильтр (пор. 161 мкм) самотеком, добавляли раствор 100.1 мг D-маннитола в 1 мл д/и воды. Остатки смеси из колбы для упаривания и с фильтра смывали д/и водой 2 раза по 3 мл в приемник. Фильтрат замораживали в бане с жидким азотом. Процесс удаления воды проводили на лиофильной сушке при остаточном давлении 0.03÷0.1 мБар и комнатной температуре в течение 20 ч. Выходы готового продукта составляли от 80.4 до 95.5% от общей массы взятых ингредиентов.
Полученные частицы оценивались по следующим параметрам: размерам частиц и степени включения лекарственного вещества в частицы. Средний размер частиц определяли методом автокорреляционной спектроскопии на субмикронном лазерном спектрометре Coulter N4MD (USA). Полученные частицы имели субмикронные размеры (см. табл. 1).
Пример 2. Определение общего содержания никлозамида в образцах
Содержание никлозамида в полимерных частицах определяли методом ВЭЖХ после их растворения в диметилсульфоксиде и последующего разбавления метанолом. Для проведения ВЭЖХ использовали систему Agilent 1290 series, с УФ-детектором (США). Условия проведения ВЭЖХ: колонка - Agilent ZORBAX Eclipse XDB-C18, 250×4,6 мм, 5 мкм; температура термостата - 30°C; режим - изократический; подвижная фаза - элюент А - метанол для хроматографии = 87%, элюент В - 0,05% раствор муравьиной кислоты; скорость потока элюента - 1,2 мл/мин; объем вводимой пробы - 20 мкл; время регистрации хроматограммы - 10 минут; условия детектирования - длина волны 322±4 нм.
Образцы хроматографировались трехкратно для подтверждения воспроизводимости и получения статистически достоверных данных.
Пример 3. Определение степени включения никлозамида в полимерную матрицу
В флаконе перемешивали в течение 3 мин. 50.00 мг образца и 2.6 мл деионизированной воды. Суспензию центрифугировали в течение 20 мин при скорости 14000 об/мин на центрифуге Eppendorf Centrifuge 5415. Супернатант удаляли. Осадок перемешивали с 1.0 мл деионизированной воды на вихревом смесителе типа Vortex в течение 0.5 мин. Суспензию центрифугировали снова в течение 15 мин при скорости 14000 об/мин на центрифуге Eppendorf. Супернатант удаляли. Осадок сушили на лиофильной сушке в течение 22 ч до постоянного веса.
В стеклянном флаконе растворяли 11.00 мг (точная навеска), высушенного до постоянного веса, отмытого образца в 10 мл диметилсульфоксида, после чего определяли в нем содержание никлозамида методом ВЭЖХ в условиях, приведенных выше. Рассчитывали количество (масс.) никлозамида, связанное с полимерной матрицей.
Пример 4. Изучение динамики выхода никлозамида из полимерсодержащей композиции
Исследование динамики выхода (высвобождения) никлозамида в модельном эксперименте осуществляли в условиях равновесного диализа при температуре 37°C и pH 7.5 в фосфатно-солевом буферном растворе из композиции NC-19. Сосудом для проведения диализа служила емкость вместимостью 1000 мл с пластиковой крышкой, содержащая 400 мл раствора PBS. Для перемешивания диализной жидкости использовали магнитный элемент в тефлоновой оболочке (∅ 6×15 мм) и магнитную мешалку STIRRER Туре ОР-951 (Radelkis, Венгрия). Термостатирование осуществляли в термостате Shellab Model 1519Е-2 (Sheldon Manufacturing, Inc., США). В качестве диализных мешков использовали ленту MF-1230 MFPI (США), размер пор 12-14 кДа, ширина 45 мм. Содержание никлозамида в диализате определяли спектрофотометрически на спектрофотометре Ultrospec 2000 (США) при длине волны λ 340 нм.
В стеклянном флаконе на 10 мл с крышкой взвешивали 200.0 мг композиции NC-19 (общее содержание никлозамида - 10.9 мг). Из сосуда для диализа отбирали 8 мл раствора PBS, добавляли к навеске и перемешивали на магнитной мешалке в течение 7 мин. Полученную суспензию переносили пипеткой в подготовленный диализный мешок с зажатым пластиковым зажимом концом. Остатки суспензии во флаконе дважды смывали по 1 мл раствора PBS и переносили в мешок. Заполненный мешок герметизировали нитью и пластиковым зажимом, опускали в сосуд для диализа, банку плотно закрывали и помещали в термостат на магнитную мешалку, затем включали перемешивание и начинали отсчет времени. Через определенные промежутки времени проводили отбор проб из сосуда с диализатом по 3 мл. Измеряли оптическую плотность раствора диализата относительно раствора PBS. Затем пробы возвращали обратно в сосуды. Продолжительность эксперимента составила 9,125 суток. Кривая изменения во времени относительного количества никлозамида, перешедшего из мешка в диализат (высвобождение, в %), представлена на чертеже. За 100% принимали максимальное значение оптической плотности 1.282, которую теоретически может дать все количество никлозамида в 400 мл раствора PBS (0.023 мг/мл) из взятой навески образца композиции NC-19.
Пример 5. Определение цитотоксической активности образцов полимерсодержащих композиций на основе никлозамида в опытах in vitro.
Для изучения цитотоксической активности образцов полимерсодержащей композиции на основе никлозамида in vitro наряду с модельной клеточной тест-системой - линией аденокарциномы молочной железы человека MCF-7, была использована линия клеток миелолейкоза человека К562 и линия колоректального рака человека COLO 320 HSR (карцинома сигмовидной кишки). При проведении опытов in vitro использовали методику учета выживаемости опухолевых клеток. В качестве вещества сравнения использовали субстанцию никлозамида. Культивирование клеток проводили в CO2-инкубаторе при 37°C в увлажненной атмосфере, содержащей 5% CO2, в среде ДМЕМ (линия MCF-7) и RPMI1640 (линия К562), содержащей 10% фетальной бычьей сыворотки и 50 мкг/мл гентамицина (Life Technologies, США). За 24 часа до эксперимента клетки высевали в культуральные 96-луночные платы. Исследуемые препараты и свободный никлозамид вносили к клеткам не менее чем в трех повторах для каждой исследуемой концентрации в диапазоне от 0,05 до 40 мкМ по никлозамиду. При работе с полимерсодержащими композициями на основе никлозамида при приготовлении растворов концентрацию рассчитывали, исходя из процентной доли никлозамида в композиции полимерных препаратов никлозамида. Выживаемость клеток после инкубации с препаратами оценивали с помощью МТТ-теста и по кривым выживаемости определяли значения IC50. Для этого в лунки с клетками добавляли раствор МТТ, инкубировали 2-4 часа при 37°C, после чего удаляли раствор МТТ, вносили ДМСО и измеряли оптическую плотность по поглощению при 540 нм с помощью многоканального спектрофотометра. По полученным данным строили графики зависимости выживаемости клеток от концентрации препаратов. Статистическую обработку результатов проводили с использованием компьютерной программы Origin.
Пример 6. Исследование общей (острой) токсичности полимерсодержащей композиции на основе никлозамида.
Исследование по определению острой токсичности препарата проводили на инбредных мышах линии C57BL/6 обоего пола при внутрижелудочном (пероральном) и внутрибрюшинном введении из расчета по две однополые группы мышей (6 самок/6 самцов) на каждую дозу и 2 группы контроля. Мышей распределяли по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по весу тела (±10%). Препараты вводили внутрибрюшинно в предпаховую область мыши (максимальный объем однократного введения 1,0 мл) и внутрижелудочно (в/ж) в виде суспензии через рот в желудок мыши с помощью атравматического зонда (максимальный объем однократного введения не превышал 0,5 мл). Для достижения больших доз препарат вводили животным повторно с интервалами не менее 60 минут. После однократного введения препарата определяли летальность и время гибели животных. Определение диапазона летальных доз субстанции никлозамида и полимерсодержащей композиции на основе никлозамида проводили путем токсикометрического анализа выживаемости животных после однократного внутрижелудочного/внутрибрюшинного введения с последующим 30-дневным наблюдением. Количественные данные, полученные в эксперименте, обрабатывались методом вариационной статистики с применением «t»-критерия Стьюдента, методом Стьюдента-Манна-Уитни при Р=0.05, а также методами непараметрической статистики. При введении полимерсодержащей композиции на основе никлозамида наблюдались зависимые от доз летальные эффекты. Результаты испытания острого токсического действия препарата на мышах линии C57BL/6 позволили рассчитать значения среднесмертельных доз.
Таким образом, по совокупности всех полученных результатов испытаний лекарственное средство на основе никлозамида с использованием полимеров PLGA (50/50), эудрагит Eudragit RS РО или эудрагит Eudragit RL РО, стабилизатора эмульсии поливинилового спирта и криопротектора D-маннитола, в виде частиц субмикронного размера со средним размером не более 500 нм, обладает пролонгированным вывсвобождением, высокой цитотоксической активностью в отношении опухолевых клеток человека и пониженным уровнем общей (острой) токсичности.
Источники информации
1. The International Pharmacopoeia. The Fourth Edition // http://apps.who.int/phint/en/p/docf/
2. Tomizawa M.; Shinozaki F.; Motoyoshi Y.; Sugiyama Т.; Yamamoto S.; Sueishi M.; Yoshida T. Niclosamide suppresses Hepatoma cell proliferation via the Wnt pathway // Onco Targets Ther. - 2013. - Vol. 6. - P. 1685-93. doi: 10.2147/OTT.S50065.
3. Liu, C; Lou, W; Zhu, Y; Nadiminty, N; Schwartz, CT; Evans, CP; Gao, AC. Niclosamide inhibits androgen receptor variants expression and overcomes enzalutamide resistance in castration-resistant prostate cancer // Clin Cancer Res. - 2014. - Jun 15. - Vol. 20(12). - P. 3198-210. doi: 10.1158/1078-0432.CCR-13-3296.
4. Yoshioka, S; King, ML; Ran, S; Okuda, H; MacLean, JA 2nd; McAsey, ME; Sugino, N; Brard, L; Watabe, K; Hayashi, K. WNT7A regulates tumor growth and progression in ovarian cancer through the WNT/β-catenin pathway // Mol Cancer Res. - 2012. - Vol. 10(3). - P. 469-82. doi: 10.1158/1541-7786.
5. Li, R; Hu, Z; Sun, SY; Chen, ZG; Owonikoko, TK; Sica, GL; Ramalingam, SS; Curran, WJ; Khuri, FR; Deng, X. Niclosamide overcomes acquired resistance to erlotinib through suppression of STAT3 in non-small cell lung cancer // Molecular Cancer Therapeutics. - 2013. - Vol. 12(10). - P. 2200-2212. doi: 10.1158/1535-7163.MCT-13-0095.
6. Ye, T; Xiong, Y; Yan, Y; Xia, Y; Song, X; Liu, L; Li, D; Wang, N; Zhang, L; Zhu, Y; Zeng, J; Wei, Y; Yu, L. The anthelmintic drug niclosamide induces apoptosis, impairs metastasis and reduces immunosuppressive cells in breast cancer model // PLoS One. - 2014. - Vol. 9(1). - P. 85887. doi: 10.1371/journal.pone.0085887.
7. Jin, Y; Lu, Z; Ding, K; Li, J; Du, X; Chen, C; Sun, X; Wu, Y; Zhou, J; Pan, J. Antineoplastic mechanisms of niclosamide in acute myelogenous leukemia stem cells: inactivation of the NF-kappaB pathway and generation of reactive oxygen species // Cancer Res. - 2010. - Vol. 70(6). - P. 2516-27. doi: 10.1158/0008-5472.
8. Wieland, A; Trageser, D; Gogolok, S; Reinartz, R;  Keller, M; Leinhaas, A; Schelle, R; Normann, S; Klaas, L; Waha, A; Koch, P; Fimmers, R; Pietsch, T; Yachnis, AT; Pincus, DW; Steindler, DA;
Keller, M; Leinhaas, A; Schelle, R; Normann, S; Klaas, L; Waha, A; Koch, P; Fimmers, R; Pietsch, T; Yachnis, AT; Pincus, DW; Steindler, DA;  Simon, M; Glas, M; Scheffler, B. Anticancer effects of niclosamide in human glioblastoma // Clin Cancer Res. - 2013. - Aug 1. - Vol. 19(15). - P. 4124-36. doi: 10.1158/1078-0432.CCR-12-2895.
Simon, M; Glas, M; Scheffler, B. Anticancer effects of niclosamide in human glioblastoma // Clin Cancer Res. - 2013. - Aug 1. - Vol. 19(15). - P. 4124-36. doi: 10.1158/1078-0432.CCR-12-2895.
9. Sack, U; Walther, W; Scudiero, D; Selby, M; Aumann, J; Lemos, C; Fichtner, I; Schlag, PM; Shoemaker, RH; Stein, U. S100A4-induced cell motility and metastasis is restricted by the Wnt/β-catenin pathway inhibitor calcimycin in colon cancer cells // Mol Biol Cell. - 2011. - Vol. 22(18). - P. 3344-54. doi: 10.1091/mbc.E10-09-0739
10. Wang, YC; Chao, TK; Chang, CC; Yo, YT; Yu, MH; Lai, HC. Drug screening identifies niclosamide as an inhibitor of breast cancer stem-like cells // PLoS One. - 2013. - Sep 18. - Vol. 8(9). - P. 74538. doi: 10.1371/journal.pone.0074538.
11. Патент Китая CN 1883266 A на изобретение, опубл. 27.12.2006.
12. Патент Китая CN 1067515 C на изобретение, опубл. 27.06.2001.
13. Bharathi Devarakonda, Ronald A. Hill, Wilna Liebenberg, Marius Brits, Melgardt M. de Villiers Comparison of the aqueous solubilization of practically insoluble niclosamide by polyamidoamine (PAMAM) dendrimers and cyclodextrins // International Journal of Pharmaceutics - 2005 - Vol. 304. - P. 193-209.
14. Poornima Dubey and Gopinath P. Fabrication of electrospun poly(ethylene oxide) - poly(capro lactone) composite nanofibers for co-delivery of niclosamide and silver nanoparticles exhibits enhanced anti-cancer effects in vitro // Journal of Materials Chemistry В - JANUARY 2016.
15. Meng-Yi Bai, Hui-Ching Yang Fabrication of novel niclosamide-suspension using an electrospray system to improve its therapeutic effects in ovarian cancer cells in vitro // Colloids and Surfaces A: Physicochemical and Engineering Aspects - 2013 - Vol. 419 - P. 248-256.
16. Makadia, H.K.; Siegel, S.J. Poly Lactic-co-Glycolic Acid (PLGA) as Biodegradable Controlled // Drug Delivery Carrier Polymers. - 2011. - Vol. 3. - P. 1377-1397.
17. Semete, В.; Booysen, L.; Lemmer, Y.; Kalombo, L.; Katata, L.; Verschoor, J.; Swai, H. In vivo evaluation of the biodistribution and safety of PLGA nanoparticles as drug delivery systems // Nanomedicine: Nanotechnology, Biology, and Medicine. - 2010. - Vol. 6. - P. 662-671.
18. Stevanovic, M.; Uskokovic, D. Poly(lactide-co-glycolide)-based Micro and Nanoparticles for the Controlled Drug Delivery of Vitamins // Current Nanoscience. - 2009. - Vol. 5(1). - P. 1-14.
19. Caputoa A., Castaldelloa A., Brocca-Cofanoa E., Voltana R., Bortolazzia F., Altavillab G, Sparnacci с K, Lausc M, Induction of humoral and enhanced cellular immune responses by novel core-shell nanosphere- and microsphere-based vaccine formulations following systemic and mucosal administration. // Vaccine 2009. V. 27. P. 3605-3615.
20. Pignatello R., Ricupero N., Bucolo C., et al. Preparation and Characterization of Eudragit Retard Nanosuspensions for the Ocular Delivery of Cloricromene. // AAPS Pharm. Sci. Tech. 2006; V. 7(2). Article 27.
21. Morgen M., Tung D., Boras В., Miller W., Malfait A.-M., Tortorella M. Nanoparticles for Improved Local Retention after Intra-Articular Injection into the Knee Joint. // Pharm. Res. 2013. V. 30. P. 257-268.
22. Joshi M. Role of Eudragit in Targeted Drug Delivery. // Intern. J. Current Pharm. Res. 2013. V. 5 (2). P. 58-62.