Результат интеллектуальной деятельности: Синтетическая ДНК, кодирующая антимюллеров гормон человека, содержащий ее экспрессионный вектор pTVK4pu/MISOPT и штамм клеток яичников китайского хомячка CHO-MIS - продуцент рекомбинантного антимюллерового гормона человека
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к технологии получения рекомбинантного антимюллерова гормона человека.
Антимюллеров гормон (АМГ), в литературе известный также под синонимом Mullerian Inhibitory Substance (MIS), представляет собой гликопротеин, играющий ключевую роль в процессе половой дифференцировки, вызывающий в ходе эмбриогенеза редукцию Мюллерова протока, что обеспечивает развитие мужского эмбриона. Дефект продукции АМГ в эмбриональном периоде приводит к развитию псевдогермафродитизма (Behringer R.R., et al., Müllerian inhibiting substance function during mammalian sexual development. Cell 79: 415-425, 1994). В постнатальном периоде АМГ секретируется в гонадах, как у мужчин - клетками Сертоли в яичках, так и у женщин - гранулезными клетками в яичниках. В женском организме продукция АМГ коррелирует с количеством примордиальных фолликулов в яичниках. Уровень АМГ в сыворотке у женщин рассматривается как показатель, отражающий овариальный резерв. Патологическое увеличение уровня АМГ в сыворотке у женщин патогномонично для синдрома поликистозных яичников, а также для опухолей яичников, происходящих из гранулезных клеток. Снижение уровня АМГ в сыворотке у мужчин является признаком гипогонадизма (Hampl R., et al.  Hormone (АМН) Not Only a Marker for Prediction of Ovarian Reserve // Physiol. Res. 60: 217-223, 2011).
Hormone (АМН) Not Only a Marker for Prediction of Ovarian Reserve // Physiol. Res. 60: 217-223, 2011).
Установлено, что рецептор АМГ экспрессируется на клетках многих опухолей, гистогенез которых связан с тканями половой системы, в частности на клетках рака яичников, эндометрия, шейки матки. Есть сообщения, демонстрирующие экспрессию рецептора АМГ также на клетках рака молочной железы и простаты. Поскольку взаимодействие АМГ с рецептором приводит к апоптозу клеток-мишеней, то предполагается, что АМГ можно будет успешно использовать для лечения опухолей, на которых экспрессируется рецептор к данному гормону, прежде всего, опухолей женской половой системы (Donahoe Р.К., et al. Enhanced purification and production of  inhibiting substance for therapeutic applications // Molecular and Cellular Endocrinology 211 (2003) 37-41; Kim J.H., et al.
inhibiting substance for therapeutic applications // Molecular and Cellular Endocrinology 211 (2003) 37-41; Kim J.H., et al.  inhibiting substance/anti-
inhibiting substance/anti- hormone: A novel treatment for gynecologic tumors // Obstetrics & Gynecology Science (2014) 57 (5), 343-35.).
hormone: A novel treatment for gynecologic tumors // Obstetrics & Gynecology Science (2014) 57 (5), 343-35.).
Молекула антимюллерова гормона представляет собой гомодимерный гликопротеин, мономер которого с молекулярной массой 140 кДа состоит из 535 аминокислотных остатков. Два мономера белка соединены двумя дисульфидными связями. Для проявления биологической активности АМГ должен быть процессирован путем ферментативного протеолиза пептидной связи между Arg451 и Ser452. Оба образующихся при этом фрагмента, называемые также доменами, сохраняют димерную структуру за счет дисульфидных связей и остаются в комплексе друг с другом благодаря нековалентным взаимодействиям. С-концевой домен АМГ, относящийся к семейству трансформирующего фактора роста-бета, обеспечивает взаимодействие со специфическим рецептором. N-концевой домен обеспечивает увеличение времени циркуляции комплекса в организме (MacLaughlin D.T., et al. Mullerian duct regression and antiproliferative bioactivities of mullerian inhibiting substance reside in its carboxy-terminal domain // Endocrinology 1992; 131:291-6.; Wilson C.A., et al. Mullerian inhibiting substance requires its N-terminal domain for maintenance of biological activity, a novel finding within the transforming growth factor-beta superfamily // Mol Endocrinol 1993;7:247-57).
Получение АМГ из природных источников в значимых для терапии количествах не представляется возможным, поскольку его концентрация в сыворотке не превышает десятков нанограмм на миллилитр, а тестикулярная ткань также содержит сравнительно небольшие количества АМГ (US 4404188, 1983). Поэтому для получения АМГ используются рекомбинантные клетки бактерий и высших эукариот, трансформированные соответствующими векторами, экспрессирующими АМГ человека. Однако в клетках бактерий возможен синтез С-концевого домена АМГ, характеризующегося нестабильностью при введении in vivo по сравнению с полноразмерным белком, включающим также гликозилированный N-домен (Wilson С.А., et al. Mullerian inhibiting substance requires its N-terminal domain for maintenance of biological activity, a novel finding within the transforming growth factor-beta superfamily // Mol Endocrinol 1993; 7:247-57.).
Известно о возможности получения рекомбинантного АМГ в растениях (WO 2012085161, 2012), однако с удовлетворительной эффективностью авторам пока удалось экспрессировать в этой системе только С-концевой домен АМГ.
Наиболее близким по технической сущности к заявляемому изобретению является технология (ЕР 0221761, 1987), где описывается получение АМГ, производимого культурой клеток яичников китайского хомячка (СНО). Недостатком данной технологии является невысокий выход АМГ (10 мкг/мл) и необходимость использования фетальной сыворотки при культивировании штамма-продуцента, что создает дополнительные сложности при очистке белка.
Технической задачей являлось создание технологии получения АМГ, позволяющей получать целевой продукт с более высоким выходом.
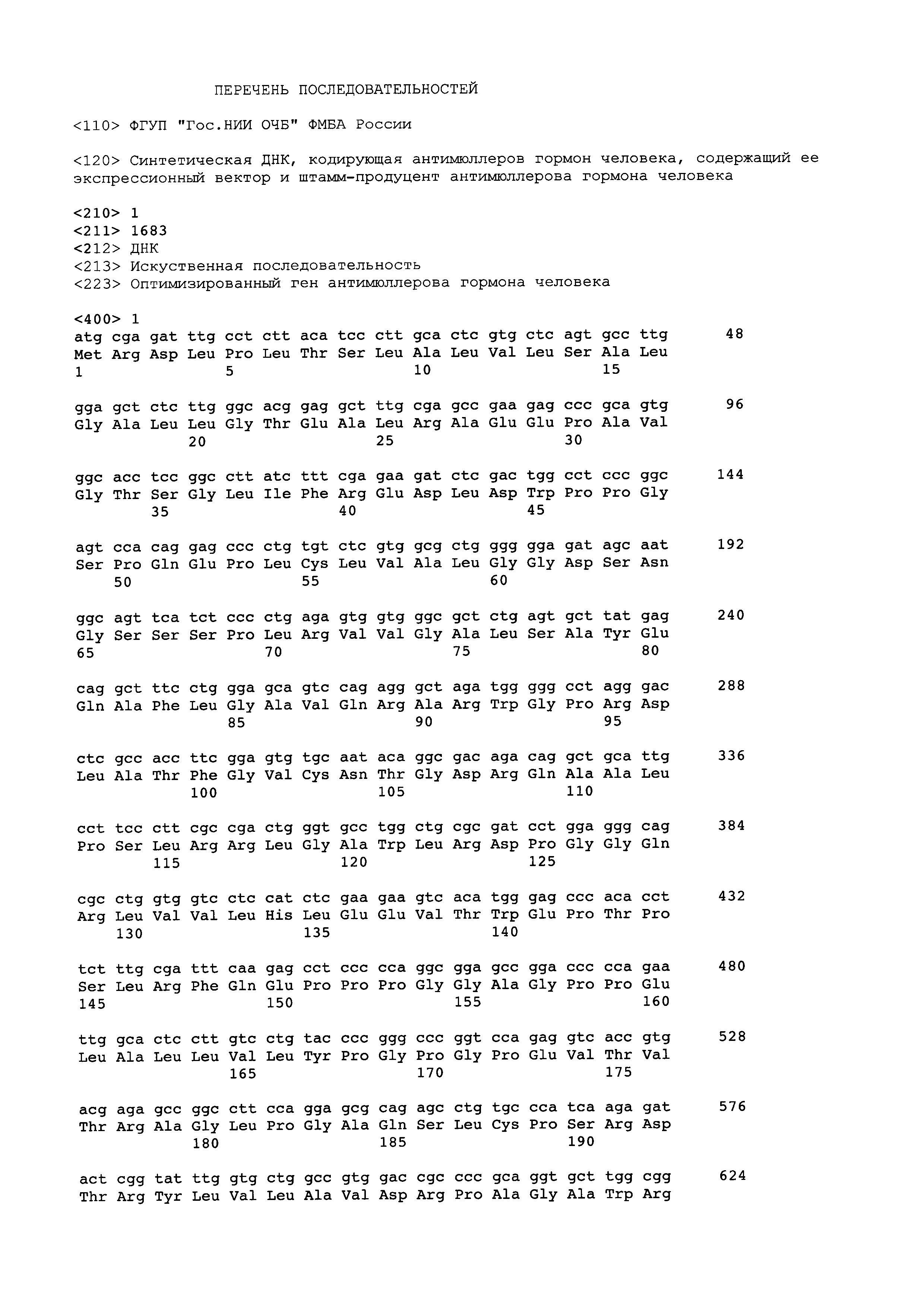
Технический результат достигался за счет создания синтетической ДНК, кодирующей антимюллеров гормон человека, имеющей последовательность Seq ID No. 1, конструирования содержащего ее экспрессионного вектора и получения на его основе нового штаммма клеток яичников китайского хомячка.
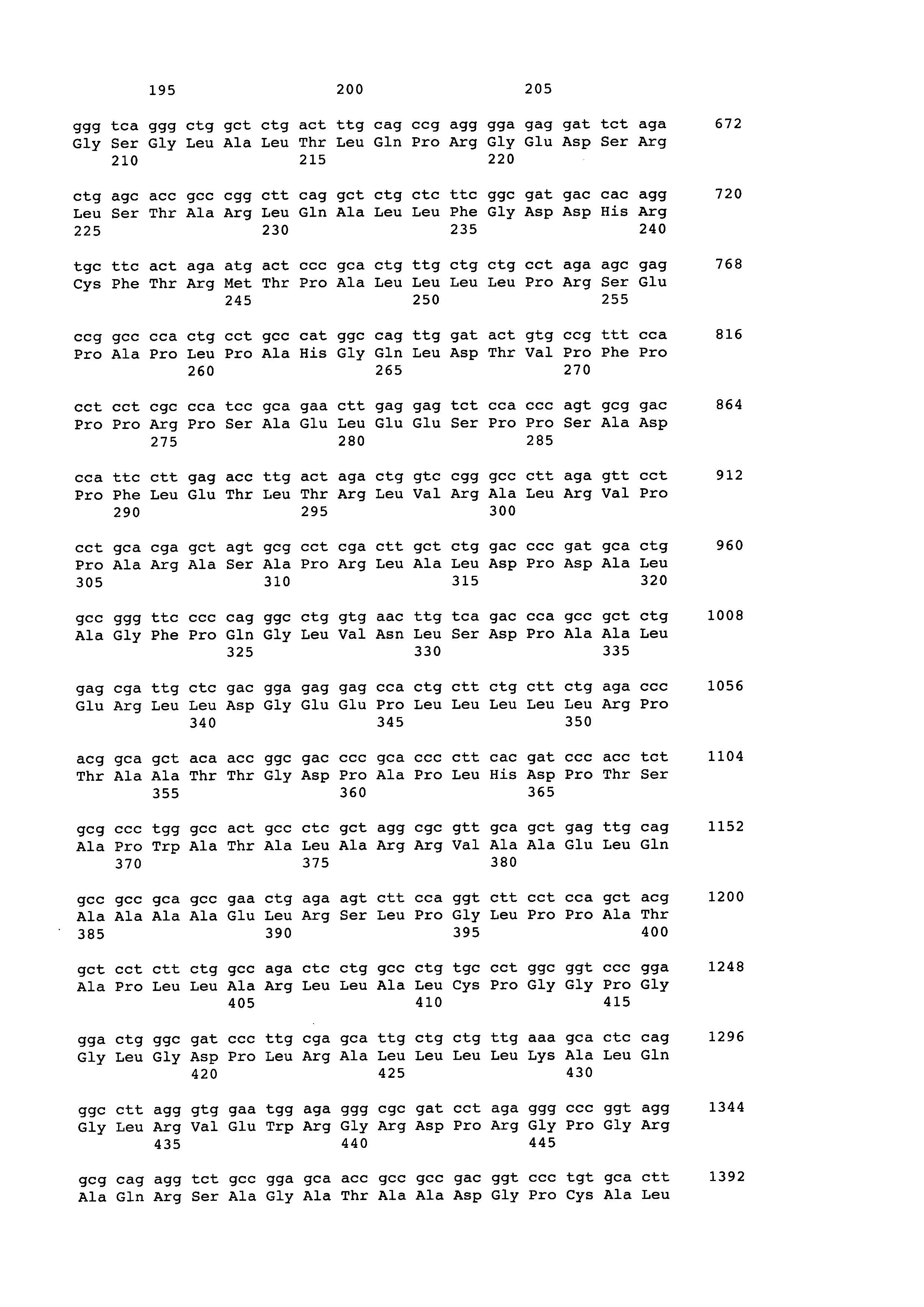
Синтетическая ДНК, кодирующая антимюллеров гормон человека, имеющая последовательность Seq ID No. 1., содержит ген антимюллерова гормона человека с кодонным составом и содержанием гуанина и цитозина, оптимизированным для экспрессии в клетках яичника китайского хомячка.
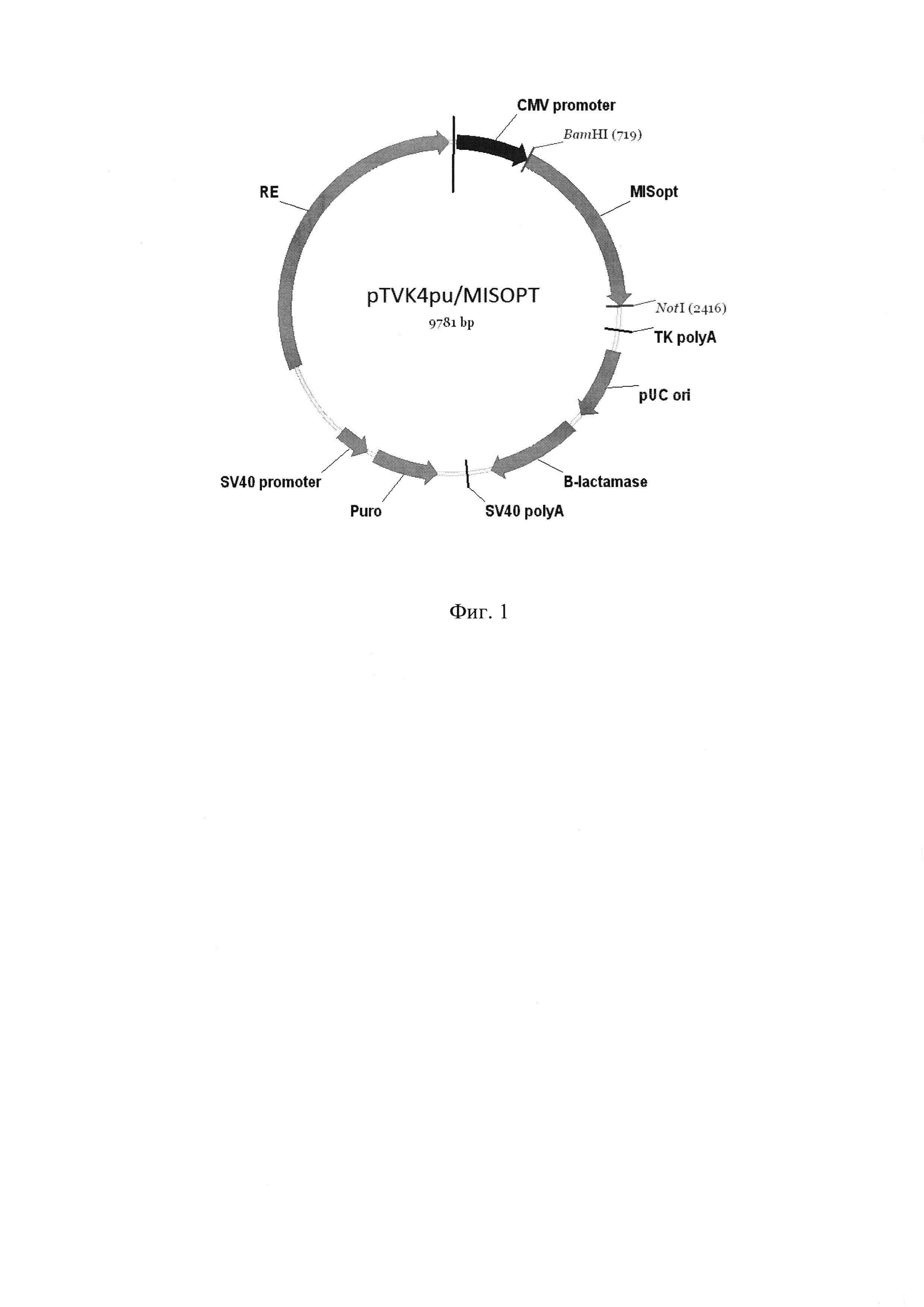
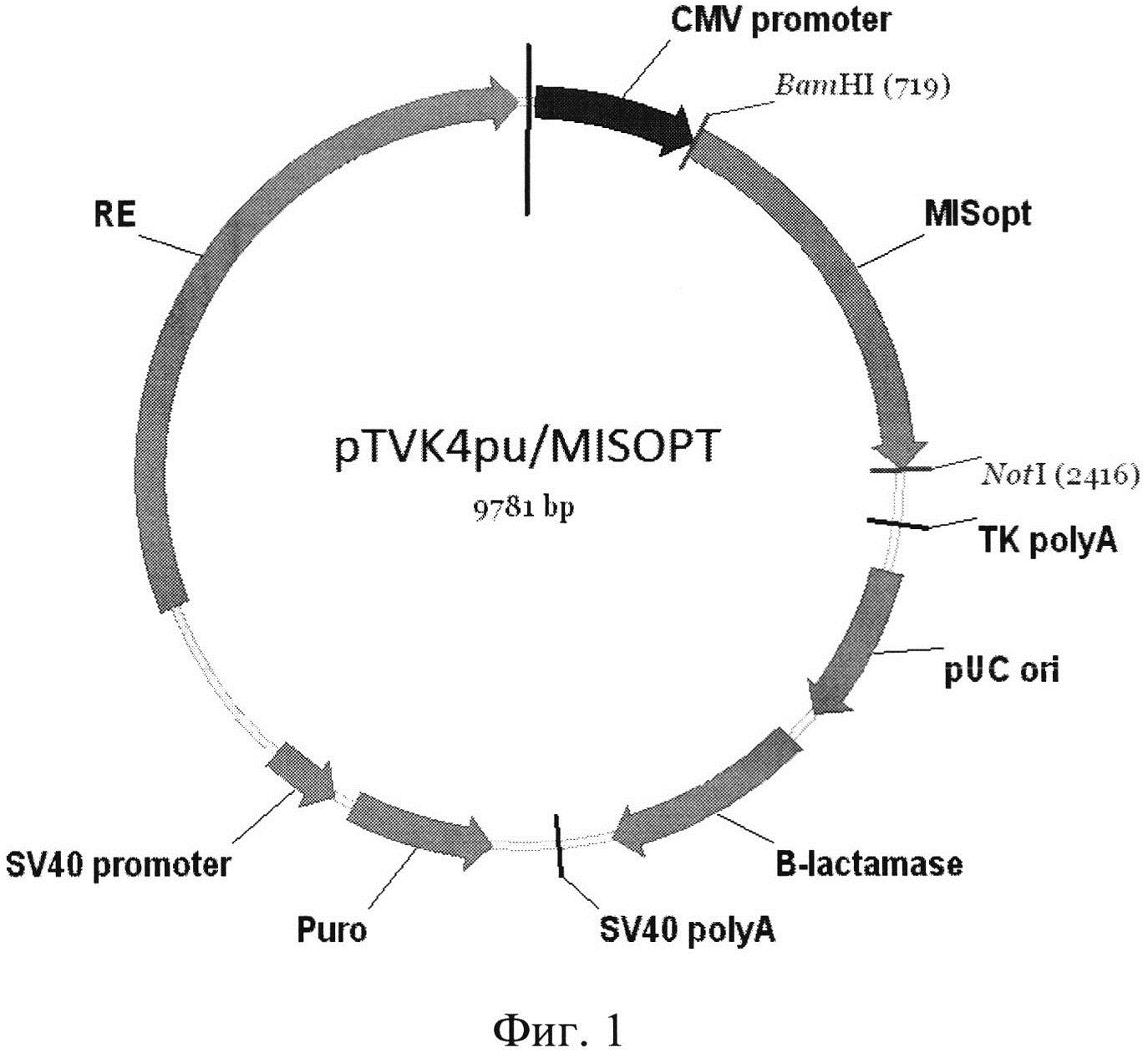
Вектор экспрессии, содержащий указанную ДНК, pTVK4pu/MISOPT, схема которого приведена на фиг. 1, содержит в качестве селективного маркера ген устойчивости к пуромицину.
Предложен также штамм клеток яичников китайского хомячка - продуцент рекомбинантного антимюллерова гормона человека, депонированный под номером РККК(П) 775Д, обеспечивающий накопление в среде культивирования до 200 мг/л АМГ за 11 суток культивирования в бессывороточной среде с химически определенным составом, не содержащей компонентов животного происхождения.
Данный штамм клеток яичников китайского хомячка CHO-MIS - продуцент антимюллерова гормона человека был помещен в Специализированную коллекцию культур клеток позвоночных Российской коллекции клеточных культур 31.03.2016 под №РККК(П) 775Д.
Штамм характеризуется следующими свойствами:
Родословная штамма: родительская клеточная линия СНО-К1. Трансфекция плазмидой pTVK4pu/MISOPT, отбор стабильного высокопродуктивного клона на среде с 10 мкг/мл пуромицина, клонирование методом лимитирующих разведений.
Число пассажей к моменту паспортизации и депонирования: 10
Стандартные условия выращивания: Среда CDM4CHO (НуClone) с 6 мМ глутамина, 10 мкг/мл пуромицина, 37°С, 5% СO2.
Культуральные свойства: суспензионное культивирование в пробирках, колбах или 6-луночных платах на орбитальном шейкере с частотой вращения 130-180 об/мин. Посевная доза 0,3-0,5×106/мл, пересев каждые 3-4 суток. Время удвоения 22-24 часа.
Данные по видовой принадлежности: Cricetulus griseus (ПЦР-анализ с видоспецифичными праймерами).
Продуцирует рекомбинантный антимюллеров гормон (оценка с помощью твердофазного иммуноферментного анализа, вестерн-блота).
Рекомбинантный антимюллеров гормон секретируется в культуральную среду в концентрации не менее 10 мкг/106 клеток за сутки. Стабильность культивирования - не менее 25 пассажей.
Способ криоконсервирования: 45% свежей среды CDM4CHO, 45% кондиционной среды, 10% DMSO, заморозка до -70°С со скоростью 1°С/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки от криоконсерванта 90% (с трипановым синим).
Сущность изобретения иллюстрируется следующими чертежами.
Фиг. 1 - Карта экспрессионной плазмиды pTVK4pu/MISOPT, где
CMV promoter - промотор предранних белков цитомегаловируса
MISopt - оптимизированный ген антимюллерова гормона человека
ТК polyA - сайт полиаденилирования РНК из гена тимидинкиназы
HSV
pUC ori - точка начала репликации
B-lactamase - ген бета-лактамазы
SV40 promoter - промотор ранних белков вируса SV40
Puro - ген устойчивости к пуромицину
SV40 polyA - сайт полиаденилирования ранних белков вируса SV40
RE - регуляторный элемент, усиливающий экспрессию целевого гена
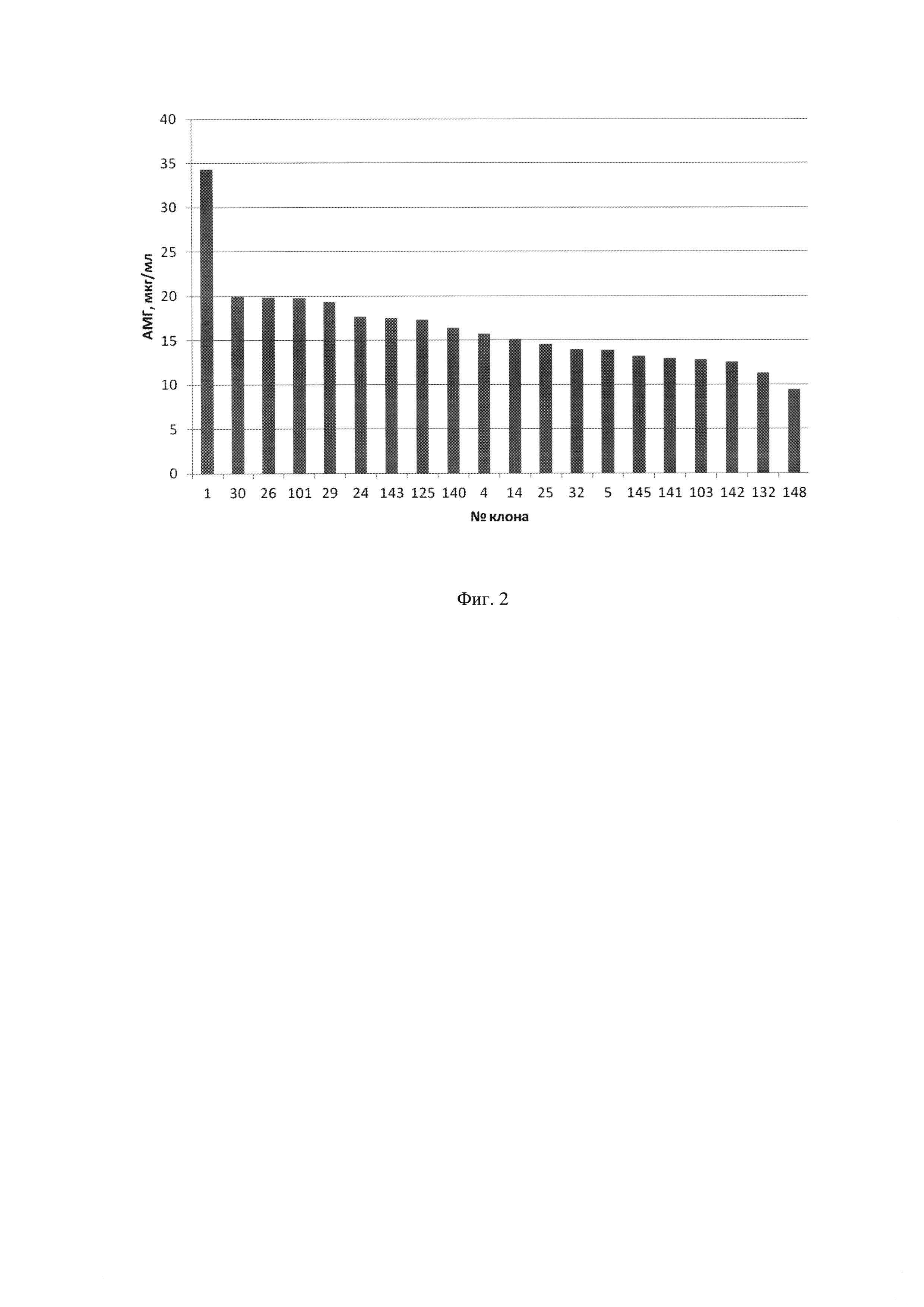
Фиг.2. - Влияние выбора клона на выход АМГ. Концентрация АМГ в супернатантах через 4 суток культивирования 20 кандидатных клонов в 12-луночной плате по данным твердофазного ИФА.
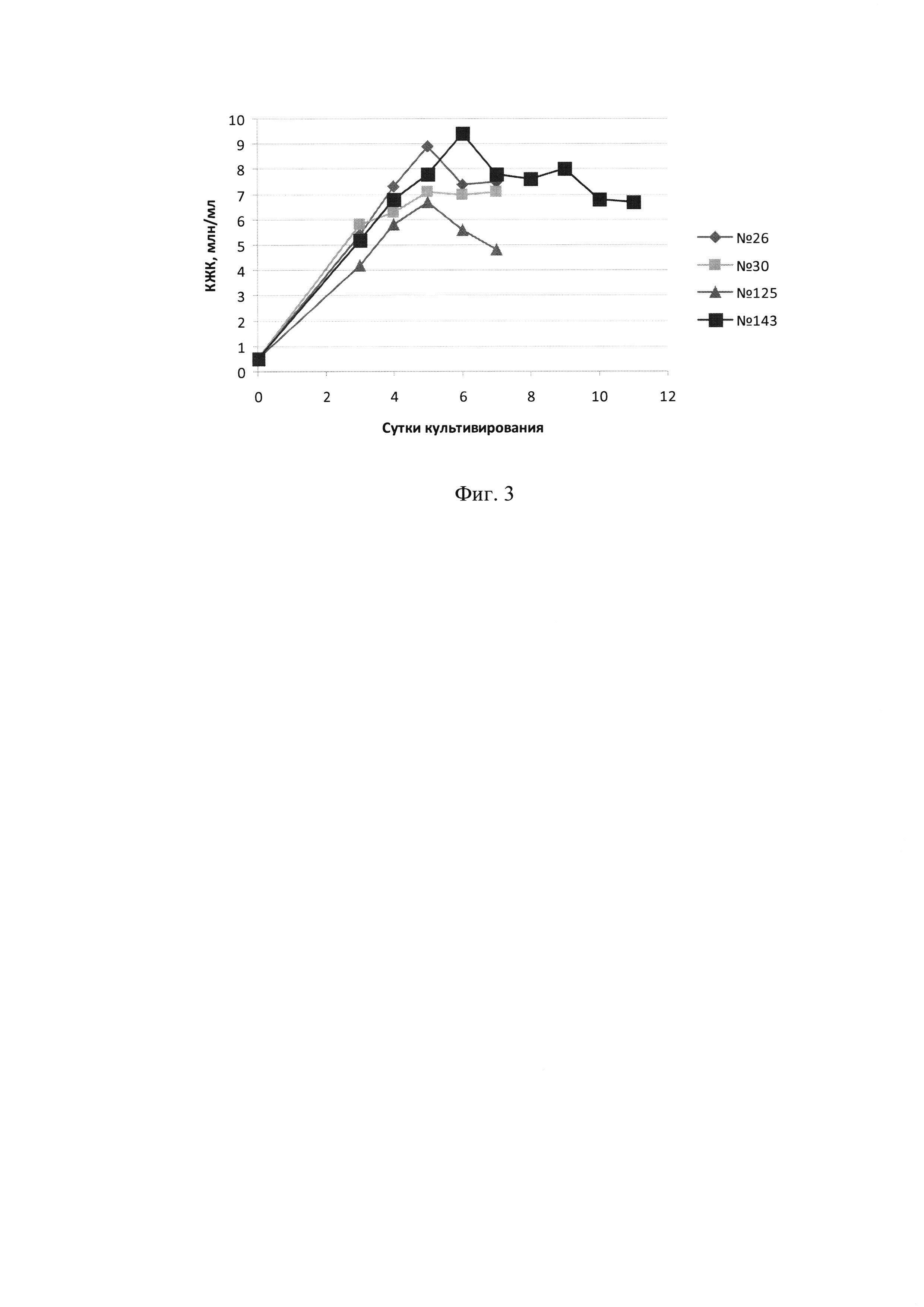
Фиг. 3 - Динамика концентрации жизнеспособных клеток при культивировании четырех кандидатных клонов-продуцентов АМГ (КЖК - концентрация жизнеспособных клеток)
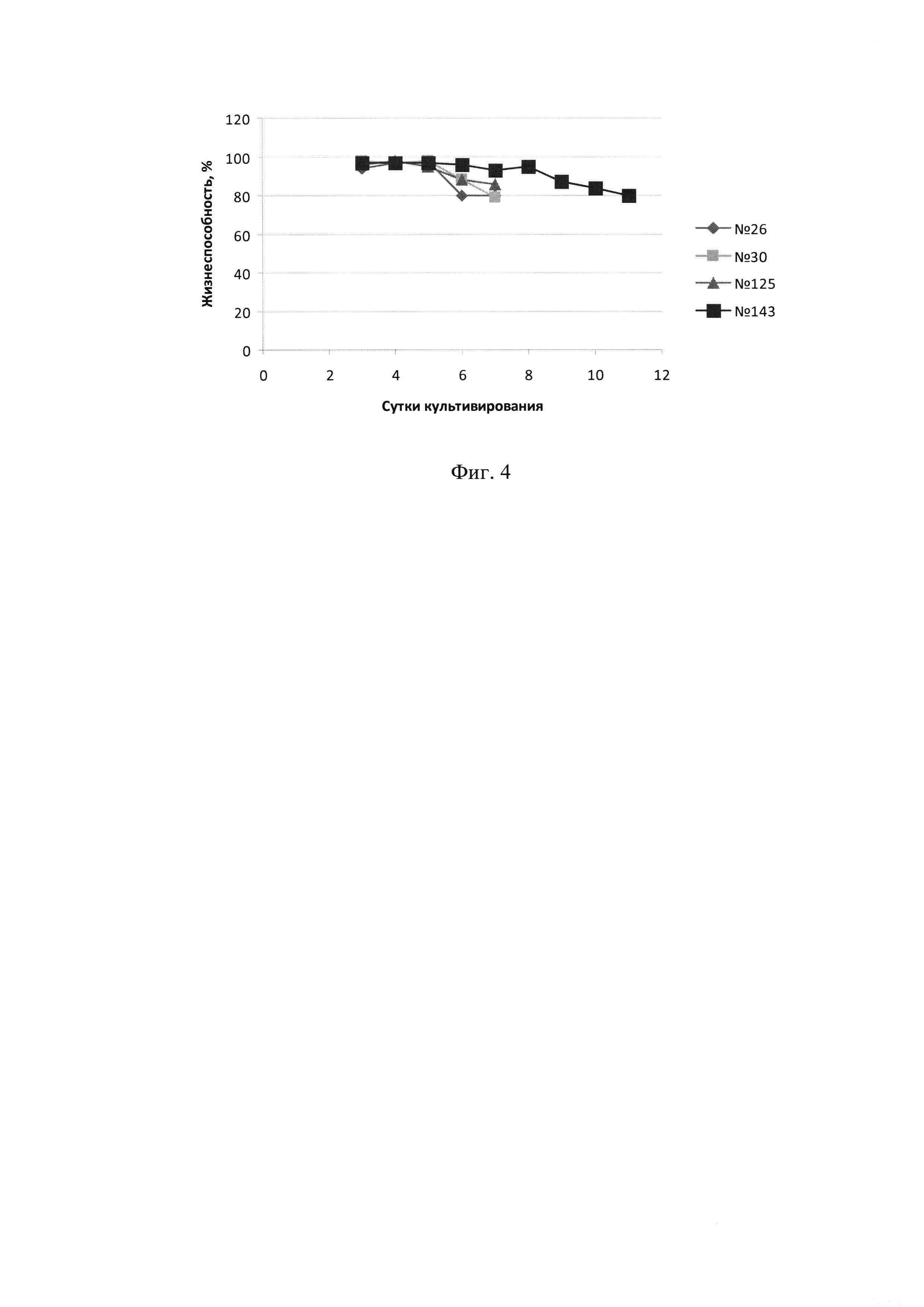
Фиг. 4 - Динамика жизнеспособности клеток при культивировании четырех кандидатных клонов-продуцентов АМГ.
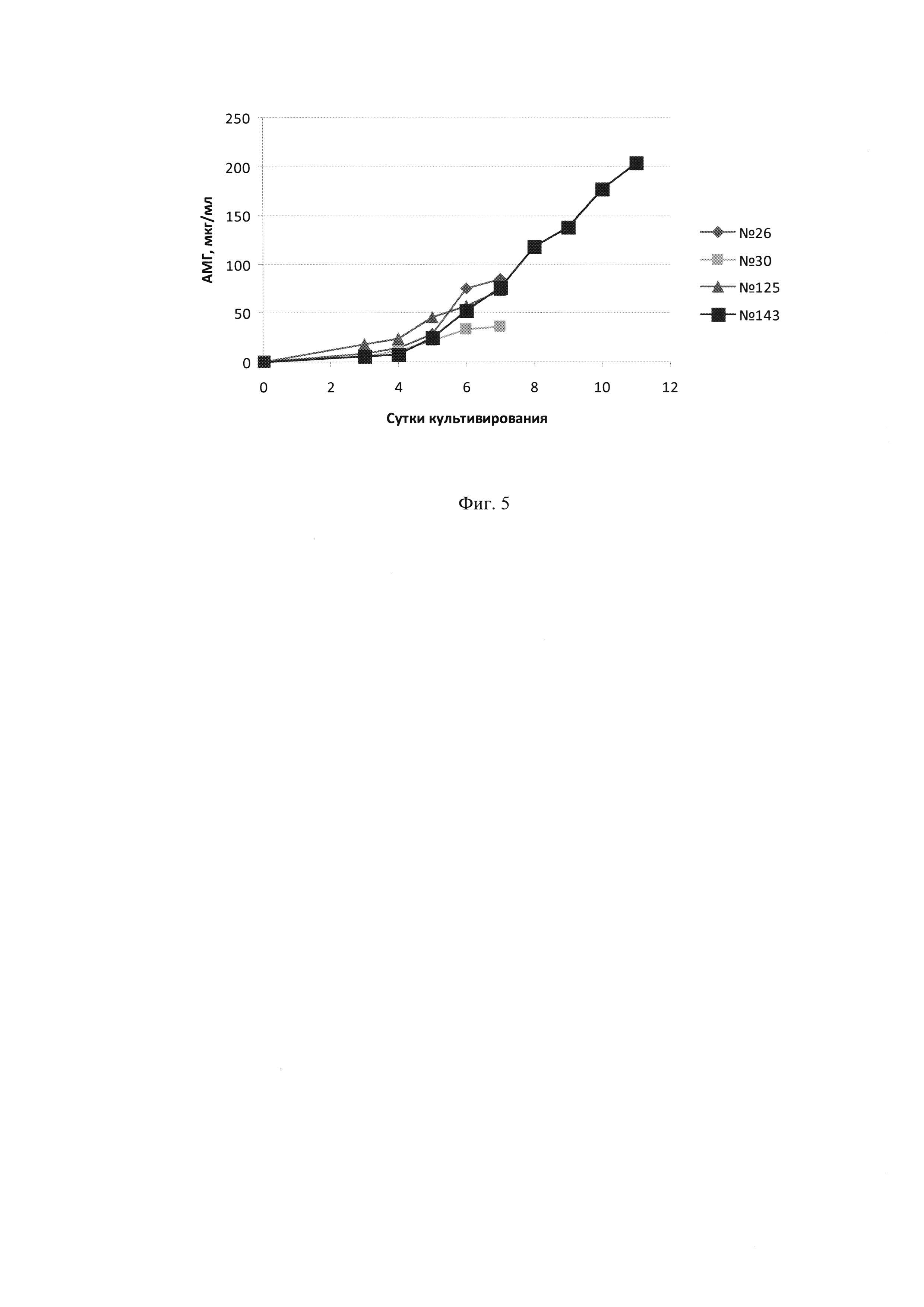
Фиг. 5 - Динамика концентрации АМГ в культуральной жидкости при культивировании четырех кандидатных клонов-продуцентов.
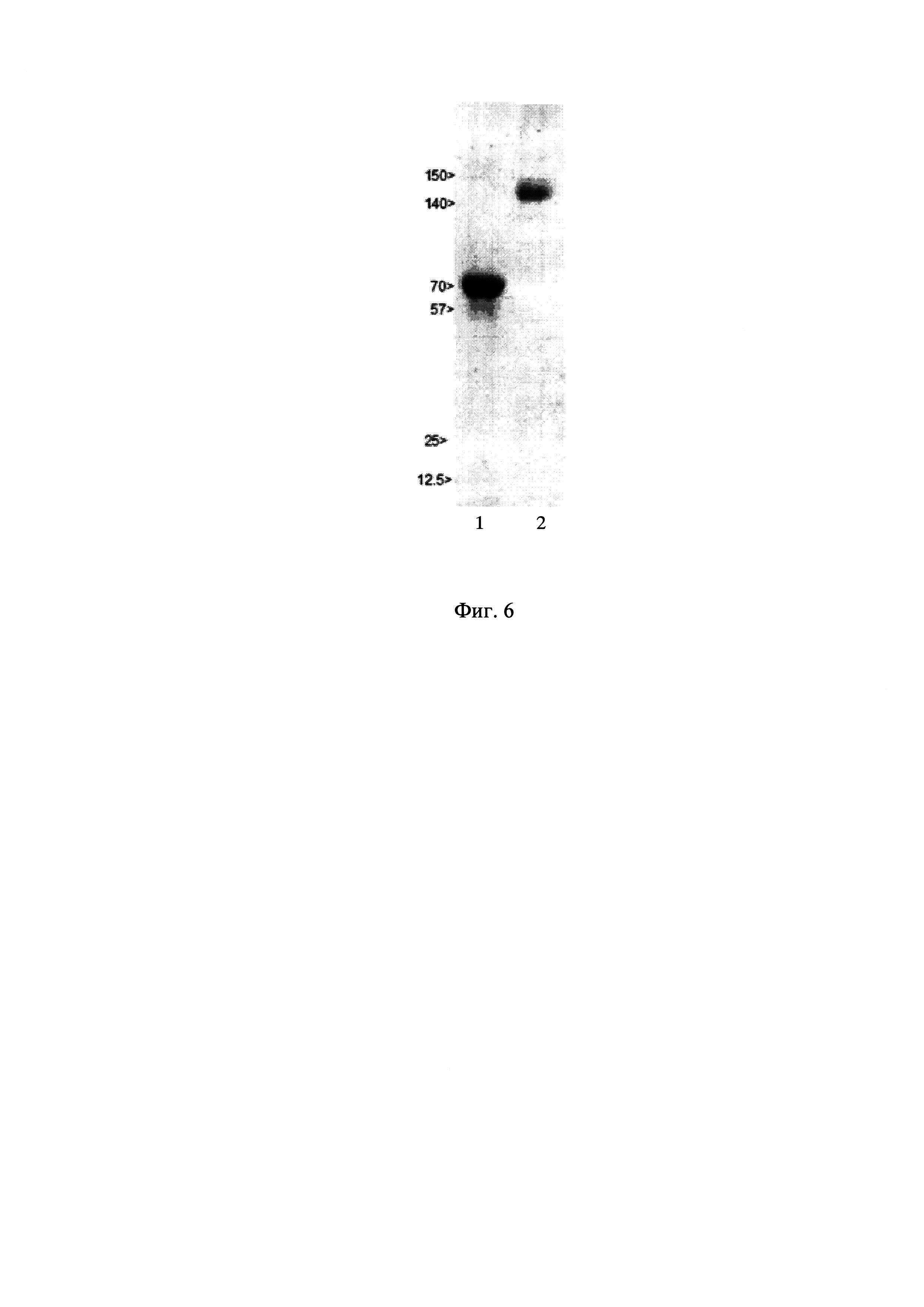
Фиг. 6 - Электрофорез рекомбинантного АМГ, очищенного из культуральной жидкости штамма-продуцента CHO-MIS (Дорожки: 1 - восстанавливающие условия; 2 - невосстанавливающие условия)
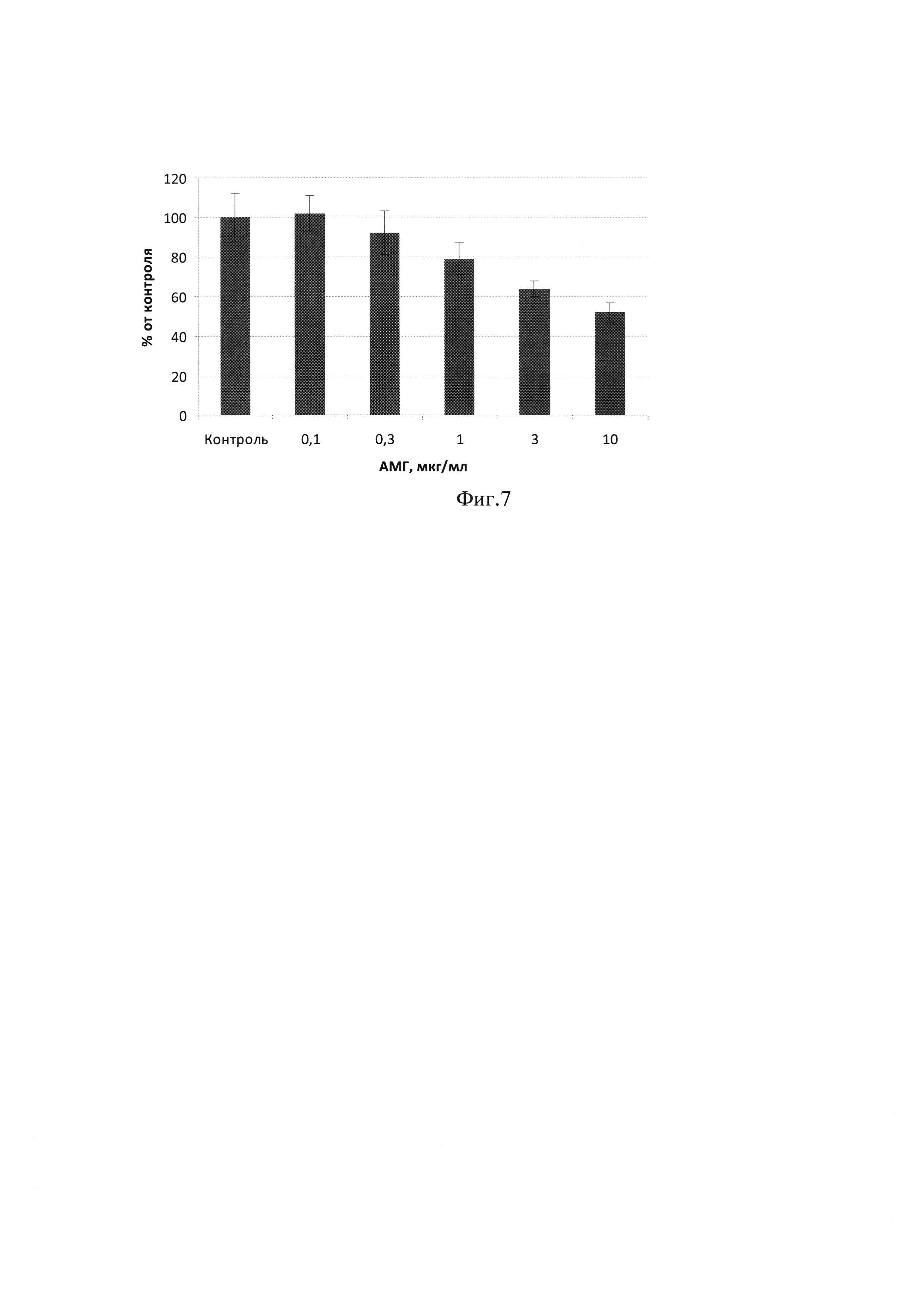
Фиг. 7 - Влияние АМГ, очищенного из культуральной жидкости штамма-продуцента CHO-MIS, на пролиферацию клеток линии OVCAR-8.
Список последовательностей Seq ID No 1 - оптимизированная последовательность ДНК, кодирующая антимюллеров гормон человека (Приложение)
Изобретение поясняется следующими примерами:
Пример 1. Дизайн нуклеотидной последовательности гена, кодирующего антимюллеров гормон человека, осуществляли с учетом частоты использования кодонов, а также оптимального содержания гуанина и цитозина в геноме китайского хомячка. Полученная последовательность, представленная в Seq ID No 1, кодирует последовательность антимюллерова гормона человека, включая сигнальный пептид. Данная последовательность была синтезирована с помощью автоматизированного химического синтеза и вставлена по сайтам рестрикции ВаmHI и NotI в экспрессионный вектор, pTVK4pu, содержащий, помимо экспрессионных элементов, указанных на фиг. 1, специализированный регуляторный элемент UCOE (Williams S. et al. CpG-island fragments from the HNRPA2B1/CBX3 genomic locus reduce silencing and enhance trans-gene expression from the hCMV promoter/enhancer in mammalian cells. BMC Biotechnology 2005, 5:17), обозначенный на Фиг. 1 как RE и несущий ген устойчивости к пуромицину. В результате была получена экспрессионная плазмида pTVK4pu/MISOPT, карта которой представлена на Фиг. 1. Правильность синтеза гена и сборки плазмиды были подтверждены сиквенированием.
Пример 2. Получение высокопродуктивного штамма культивируемых клеток - продуцента АМГ человека
Клетки линии яичников китайского хомячка СНО-К1, адаптированные к суспензионному росту в бессывороточной среде, культивировали в питательной среде CDM4CHO («HyClone», США) с добавлением 6 mМ аланилглутамина («Applichem», Германия) и 0,1% Pluronic F-68 («Sigma», США). Постоянную трансфекцию клеток плазмидной ДНК pTVK4pu/MISOPT проводили при помощи реагента для трансфекции «Freestyle» («Life Technologies», США). Через 48 часов после трансфекции клетки переводили на селективную среду, содержащую 15 мкг/мл пуромицина гидрохлорида («Sigma») и далее пересевали каждые 72 часа. После перевода на селективную среду через трое суток жизнеспособность трансфецированных клеток снизилась менее 30%, затем стала повышаться и на четвертом пассаже составила более 90%. Полученный пул клеток клонировали методом серийных разведений с целью отбора индивидуальных клонов. Было получено 478 единичных клонов, концентрацию АМГ в супернатантах этих клонов оценивали с помощью иммуноферментного анализа (ИФА) с использованием полученных нами ранее антител (WO 2008153433). На основании полученных результатов было отобрано 94 клона, в супернатантах которых концентрация АМГ была выше 2,5 мкг/мл. Клетки этих клонов были пересеяны в 24-луночную плату. Через трое суток из лунок платы были отобраны супернатанты и проведен второй анализ концентрации АМГ в супернатантах, на основании которого было выбрано 20 лучших по продукции белка клона. Клетки этих клонов были пересеяны в 12-луночную плату в плотности 0,25 млн/мл. Через четверо суток культивирования с помощью ИФА повторно оценивали концентрацию АМГ в супернатантах. Результаты представлены на Фиг. 2.
На основании полученных данных было отобрано 10 клонов, имеющих максимальную продукцию АМГ на 4-е сутки. Культивирование этих клонов продолжили на шейкере в микробиореакторах типа TubeSpin 50 в объеме 5 мл. После адаптации клеток к росту на шейкере в течение трех пассажей оценивали их динамику роста и продукции АМГ при культивировании в течение 6 суток без подпитки. Полученные данные представлены в таблице №1.
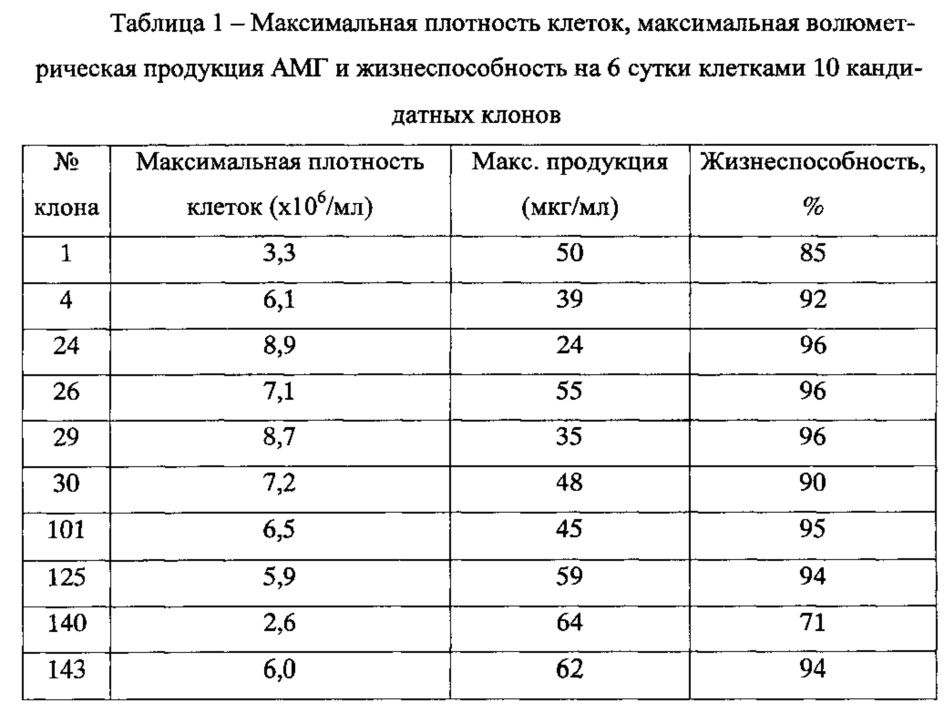
Учитывая полученные данные, для дальнейшей работы были выбраны четыре клона, показавшие максимальную волюметрическую продуктивность, максимальную плотность клеток и лучшую жизнеспособность, а именно - клоны №26, 30, 125 и 143.
Далее эти клоны культивировали в условиях, обеспечивающих накопление максимального уровня рекомбинантного АМГ в культуральной жидкости, а именно - в среде CDM4CHO с добавлением в питательную среду питательной добавки с химически определенным составом EX-CELL CD Hydrolysate Fusion (Sigma, США), в количестве 5% от объема. Клетки культивировали в минибиореакторах типа TubeSpin-50 при непрерывном перемешивании при 37°С. Стартовая плотность составляла 0,5×106/мл. Начиная с 4 суток, температуру в инкубаторе снижали до 32°С. Ежедневно, начиная с 3 суток, определяли концентрацию жизнеспособных клеток (КЖК), жизнеспособность по исключению трипанового синего, отбирали образцы культуральной жидкости (КЖ) для определения концентрации АМГ в динамике, которое выполнялось с помощью твердофазного ИФА. Культивирование прекращали при снижении жизнеспособности клеток менее 80%.
Как видно из результатов, графически представленных на Фиг. 3-5, клетки клона №143 сохраняли жизнеспособность выше 80% в течение 11 суток, за это время концентрация АМГ в КЖ достигала более 200 мкг/мл. Остальные три клона сохраняли жизнеспособность выше 80% только в течение 6-7 суток, а максимальная волюметрическая продукция составляла не более 85 мкг/мл. Уровни удельной и максимальной волюметрической продукции четырех кандидатных клонов показаны в таблице 2.
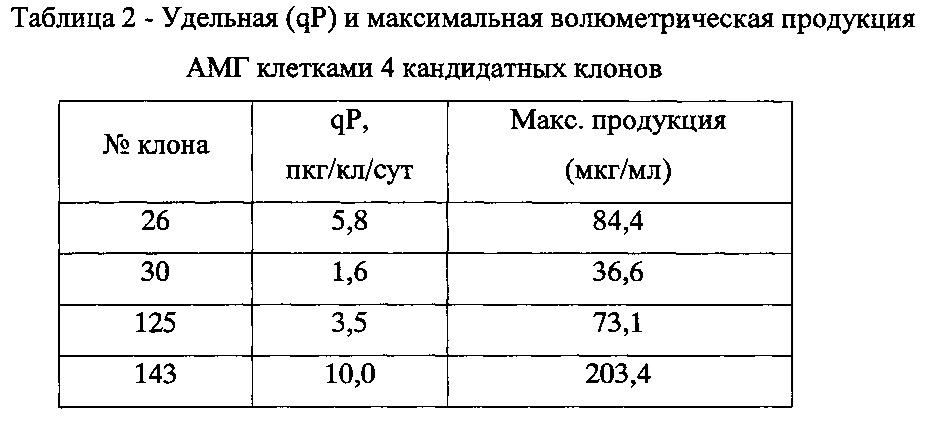
Таким образом, наиболее высокопродуктивным клоном оказался клон 143. Культура клеток этого клона была масштабирована для создания Главного Клеточного Банка и депонирована с авторским наименованием СНО-MIS в Специализированную коллекцию культур клеток позвоночных Российской коллекции клеточных культур под номером РККК (П) 775Д.
Пример 3. Анализ структуры рекомбинантного антимюллерова гормона из культуральной жидкости штамма-продуцента CHO-MIS
Штамм-продуцент CHO-MIS культивировали в среде CDM4CHO с 5% питательной добавки EX-CELL CD Hydrolysate Fusion по схеме со снижением температуры до 32°С на 4 сутки, как описано в примере 2, в колбах Эрленмейера с рабочим объемом 150 мл. На 11 сутки от начала культивирования к 1 л культуральной жидкости добавляли ингибитор сериновых протеаз фенилметилсульфонил фторид и азид натрия до конечных концентраций 1 мМ и 0,02%, соответственно, после чего осветляли путем центрифугирования в центрифуге JE-6 (Beckman) в роторе JA-10 при 10000 об/мин 30 мин при температуре 4°С.
Выделение рекомбинантного АМГ проводили с помощью иммуноаффинной хроматографии с использованием сорбента М2-сефароза (WO 2008153433). На хроматографическую колонку с М2-сефарозой объемом 100 мл, уравновешенную фосфатно-солевым буфером (рН 7,2), наносили полученную КЖ, содержащую АМГ. После нанесения колонку промывали двумя объемами уравновешивающего буфера, после чего пропускали два объема 20 мМ фосфатного буфера, содержащего 1М хлорида натрия (рН 7,2) для удаления неспецифически связанного материала. Элюцию целевого белка проводили 0,1 M раствором глицин-HCl буфера, рН 2,2. Белковую фракцию собирали под контролем ультрафиолетового монитора при длине волны λ=280 нм, рН элюата подводили до 7,0. Далее полученный элюат диализовали против фосфатно-солевого буфера, рН 7,4, концентрацию белка измеряли по поглощению при 280 нм. Всего таким способом в результате очитки 1 литра КЖ было выделено 175 мг белка.
На фиг. 6 представлен результат электрофоретического разделения полученного в результате описанной очистки белка. В невосстанавливающих условиях основная фракция представлена белком с молекулярной массой около 140 кДа, что соответствует ожидаемому размеру полноразмерного димерного АМГ. В восстанавливающих условиях выявляется мажорная полоса с кажущейся массой около 70 кДа, а также небольшие количества белка с массами 57 кДа и 12,5 кДа, что соответствует протеолитически процессированной форме АМГ. По данным ИФА с антителами M1 (WO 2008153433) доля процессированного АМГ в полученном образце составляет около 10%. В целом, электрофоретическая картина полностью соответствует таковой для АМГ, секретируемого в клетках млекопитающих (9).
Пример 4. Анализ биологической активности белка, продуцируемого клетками штамма CHO-MIS.
Определение биологической активности полученного по примеру 3 рекомбинантного АМГ человека выполняли на культуре клеток OVCAR-8 (АТСС). Клетки высевали в лунки 96-луночной плоскодонной платы для культур клеток по 103 на лунку в среде DMEM с 2% фетальной сыворотки. Одновременно к клеткам добавляли полученный АМГ в различных концентрациях. Плату инкубировали при 37°С в атмосфере с 5% СО2. Через 72 часа определяли интенсивность пролиферации клеток с помощью МТТ-теста. Результат представлен на Фиг. 7, из которой видно, что АМГ, секретируемый штаммом-продуцентом CHO-MIS, дозозависимо ингибирует пролиферацию клеток OVCAR-8. Из полученных результатов следует, что продуцируемый штаммом-продуцентом CHO-MIS рекомбинантный АМГ обладает ожидаемой биологической активностью. Выход АМГ по сравнению с аналогами возрос примерно в 20 раз.