Результат интеллектуальной деятельности: Способ лечения аллергической бронхиальной астмы, основанный на подавлении экспрессии генов цитокинов IL-4 и IL-13 с использованием молекул миРНК
Вид РИД
Изобретение
Изобретение относится к области медицины, и может быть использовано для лечения и профилактики аллергической бронхиальной астмы с использованием средства, содержащего молекулы миРНК, подавляющего экспрессию гена IL-13. А также использовано средство, дополнительно содержащее молекулы миРНК, подавляющие экспрессию гена IL-4.
Бронхиальная астма (БА) является едва ли не самым распространенным хроническим заболеванием дыхательный путей, от которого страдают как взрослые, так и дети. На фоне значительной распространенности БА среди разных слоев населения, высокого уровня смертности и существенных экономических потерь, разработка новых и безопасных способов лечения и профилактики данного заболевания продолжает оставаться актуальной задачей для здравоохранения во всем мире.
Патогенез бронхиальной астмы человека изучается на основе данных, полученных при исследовании биопсии бронхов, образцов бронхоальвеолярного лаважа (БАЛ), мокроты, сыворотки крови, а также клеток крови пациентов. Молекулярно-клеточные механизмы патогенеза БА изучают с использованием так называемых экспериментальных моделей БА (в основном на мышах), имеющих схожее с человеком развитие Th2-иммунного ответа и ряда других признаков [1] [8] [9].
В результате изучения клинического материала от пациентов с БА и экспериментальных моделей на лабораторных животных, удалось установить, что воспаление дыхательных путей связано с инфильтрацией в ткань легких воспалительных клеток, в частности эозинофилов, нейтрофилов и высвобождением ими провоспалительных медиаторов, таких как гистамин и лейкотриены, которые, в свою очередь, влияют на гладкую мускулатуру дыхательных путей, вызывая бронхоконстрикцию [1]. Также патогенез БА связан с ремоделированием бронхов, которое включает ряд патогенетических процессов, а именно: гипертрофию гладких мышц, гиперплазию бокаловидных клеток эпителия бронхов, утолщение субэпителиальной базальной мембраны, увеличение толщины стенок бронхов, что в совокупности приводит к необратимой обструкции и гиперчувствительности дыхательных путей. Считается, что ремоделирование бронхов происходит под действием факторов роста, которые выделяются инфильтрирующими в ткань легких клетками [3].
В большинстве случаев основной причиной такого воспаления дыхательных путей является сенсибилизация пациента к аллергену, например, к пыльце растений, клещам домашней пыли и т.д. Попавшие в организм аллергены захватываются дендритными клетками дыхательных путей, которые презентируют их Т-лимфоцитам. У лиц, имеющих генетическую предрасположенность, или подверженных воздействию определенных факторов окружающей среды, все это вызывает иммунную реакцию Th2-типа, т.е. происходит дифференцировка нативных Т-клеток в Th2-клетки, которые начинают продуцировать специфические цитокины: IL-4, IL-5, IL-9, IL-13 и др. Данные цитокины обеспечивают формирование основных признаков БА [3].
В многочисленных исследованиях показано, что наиболее патогенетически-значимыми цитокинами из вышеуказанных являются IL-4 и IL-13. Как известно, IL-4 и IL-13 способствуют синтезу В-клетками специфических IgE-антител, которые впоследствии фиксируются на поверхности тучных клеток и базофилов. Тучные клетки и базофилы, накапливающиеся в слизистой оболочке бронхов, подвергаются дегрануляции после взаимодействия вновь попавших аллергенов с IgE-антителами на их поверхности. В результате дегрануляции из клеток высвобождаются медиаторы аллергического воспаления: гистамин, лейкотриены, простагландины и тромбоцит-активирующий фактор, которые в течение нескольких минут вызывают сильное сужение дыхательных путей, отек стенок бронхов и гиперсекрецию слизи. Другие известные цитокины, такие как IL-5, IL-25 и IL-33, индуцируют инфильтрацию эозинофилами дыхательных путей, приводя к воспалению [2]. Инфильтрация эозинофилов в слизистую оболочку бронхов является важным признаком аллергической астмы, причем эозинофилия в легких сохраняется даже при отсутствии клинических симптомов. Эозинофилы, как тучные клетки и базофилы, также способны дегранулировать медиаторы воспаления, которые приводят к повреждению бронхов, в частности бронхиального эпителия. В результате этих повреждений эпителия образуются неплотные контакты между клетками, что способствует проникновению аллергенов в ткани дыхательных путей. Барьерные функции эпителия могут быть нарушены не только провоспалительными клетками, такими как эозинофилы, но и респираторными вирусами, факторами окружающей среды, что приводит к обострению БА [4]. Кроме того, эпителий дыхательных путей способен самостоятельно продуцировать провоспалительные цитокины, тем самым принимая участие в патогенезе заболевания [6].
Экспериментально была установлена роль IL-9 в развитии симптомов БА. В частности, IL-9 вовлечен в продукцию слизи, которая затрудняет процесс дыхания, что является одним из ключевых признаков БА. В моделях с использованием мышей, нокаутных по IL-9, показано снижение выработки слизи эпителием дыхательных путей после инактивации этого гена [5].
В настоящее время для подавления активности IL-4 и IL-13 активно используются моноклональные антитела, что описано в ряде патентных документов (ЕР 2 351 584 А1, ЕР 2 573 121 A1, US 20030235555 А1, US 008461125 B2,). Однако открытие РНК интерференции (РНКи) дало новые возможности для регуляции экспрессии патогенетически-значимых генов, в том числе и генов, вовлеченных в инициацию и развитие БА. РНКи активируется молекулами малых интерферирующих РНК (миРНК), которые имеют нуклеотидную последовательность комплементарную гену-мишени. Главными преимуществами использования препаратов на основе РНКи являются высокая специфичность и эффективность подавления гена-мишени (более чем на 90%), а также то что вводимые миРНК способны действовать в крайне низких концентрациях. Кроме того, привлекательной является сравнительная дешевизна методики. Синтез олигонуклеотидов в настоящее время вполне доступен и прост. Этот факт дает препаратам, созданным на базе, миРНК, важное конкурентное преимущество, по сравнению с моноклональными антителами.
Как было указано выше IL-4 представляет собой плейотропный цитокин, который обладает широким спектром биологических эффектов в патогенезе БА. Более поздние научные исследования показали, что IL-4 и другой патогенетически-значимый цитокин IL-13 и имеют общий рецепторный компонент, а также сходную сигнальную трансдукцию. Этот факт был использован при создании одного из подходов к терапии БА, заключающегося в применении моноклональных к обоим мишеням и биспецифических антител, которые связываются с IL-4 и/или IL-13. Исследователям удалось добиться стабильного производства данных антител и успешного использования этой системы in vivo. Этот подход представлен в одном из охранных документов (патент ЕР 2574630 А1).
Помимо ингибирования путем непосредственного связывания цитокина, можно снижать его активность посредством блокирования соответствующего рецептора. Известно, что сигнальный путь IL-4 опосредован гетеродимерным комплексом двух белков рецептора: IL-4Rα и γ-цепи IL-2-рецептора. Создание моноклонального антитела Х2/45, направленного против внеклеточного домена IL-4Rα позволило предположить его для ингибирования IL-4-опосредованных реакций, в том числе и для создания нового способа терапии БА. Этот подход представлен в одном из охранных документов (патент WO 2009121847 A2), который относится к области применения антител или антигенсвязывающих фрагментов антител, специфичных для человеческого рецептора к IL-4.
Известно, что связывание IgE с FcεRI-рецепторами эффекторных клеток (тучные клетки, базофилы) индуцирует высвобождение медиаторов воспаления (гистамин, лейкотриены) и вызывает острые симптомы аллергического воспаления. Таким образом, взаимодействие IgE-FcεRI является ключевым в патогенезе БА. Этот факт был использован при создании подхода к терапии аллергических воспалений в том числе БА. В результате исследования был идентифицирован Fab фрагмент антитела, который является ингибитором IgE-FcεRI взаимодействия. Показано также, что данный ингибитор способен связываться со свободным и клеточно-связанным IgE. Этот подход представлен в охранном документе (патент WO 2002079257 А1).
Поскольку IgE-антитела являются ключевыми в патогенезе аллергической БА, то был разработан способ лечения БА с помощью антител, нейтрализующих IgE. Этот подход реализован в одном из изобретений (патент 1997004807 А1).
Несмотря на сравнительно недавнее открытие РНКи уже имеются исследования по применению данного подхода к терапии БА. В частности, созданы молекулы миРНК способные подавлять гены, участвующие в синтезе IgE - одного из основных медиаторов аллергического воспаления. Данный подход представлен в одном из охранных документов (патент US 20060058255 А1), однако в данной разработке не фигурирует РНКи-опосредуемое подавление IL-13.
Известно, что CD23 участвует в активации Т-лимфоцитов, которые в свою очередь вовлечение в патогенезе БА. Этот факт был использован при создании подхода к терапии БА, основывающемся на подавлении CD23 с помощью миРНК. При реализации данного подхода доказано ингибирование связывания IgE в эффекторными клетками у пациентов. Этот подход описан в одном из охранных документов (патент US 8461125 В2).
Еще один подход, заключается в РНКи-опосредованном подавлении генов, регулирующих синтез IgE. Были изучены различные пути введения РНКи-агентов, в результате было предложено использовать такой подход для терапии IgE-опосредованных заболеваний, к которым в некоторых случаях относиться и БА. Этот подход описан в охранном документе (патент US 20110112169 A1).
Наиболее близким аналогом данного изобретения является способ лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний дыхательных путей с использованием препарата на основе малой интерферирующей РНК (миРНК) (RU 2526146, 20.08.2014).
Данный способ заключается в одновременном подавлении гена р респираторно-синцитиального вируса (далее - РСВ) и провоспалительного гена il-4 мыши, при этом для подавления гена р РСВ, необходимого для его репликации в клетке, используют молекулу миРНК - SEQ ID NO 1 (siP1), а для подавления провоспалительного гена il-4 мыши используют молекулу миРНК - SEQ ID NO 15 (siIL4-408).
Отличительной особенностью данного способа является применение препарата миРНК для лечения бронхиальной астмы на фоне респираторно-синцитиального вируса. К недостаткам данного метода можно отнести, то, что в отсутствии у астматиков РСВ-инфекции данный метод будет недостаточно эффективным, поскольку происходит подавления только IL-4.
Хотя IL-13 и IL-4 имеют определенные функциональные сходства, изучение заболевания на животных моделях и мышах с «выключенным» геном показало, что IL-13 обладает уникальными эффекторными функциями, отличными от IL-4 и независимо от других Th2-цитокинов, является необходимым и достаточным для индукции всех признаков аллергической астмы [7]. Многочисленные последующие эксперименты подтвердили, что IL-13 играет более значимую роль в патогенезе БА, чем другие Th2-цитокины в эффекторных функциях, связанных с симптомами астмы.
Поэтому задачей данного изобретения является разработка способа лечения бронхиальной астмы, включающий введение молекул малых интерферирующий РНК (миРНК), подавляющих экспрессию гена IL-13, а также их смесь с миРНК, подавляющих экспрессию гена IL-4.
Для решения данной задачи были разработаны молекулы миРНК, подавляющие экспрессию гена IL-13, а также разработано средство, содержащее их смесь с миРНК, подавляющими экспрессию гена IL-4 и их использование на мышиной модели аллергической БА.
Способ профилактики и лечения аллергической бронхиальной астмы включает введение субъекту эффективного количества средства, содержащего молекулы миРНК, подавляющие экспрессию гена IL-13, представленные последовательностями SEQ ID NO 7 и SEQ ID NO 8. Средство дополнительно содержит молекулы миРНК, подавляющие экспрессию гена IL-4, представленные последовательностями SEQ ID NO 3 и SEQ ID NO 6. Полученные молекулы миРНК вводят интраназально или ингаляционно.
Техническими результатами предлагаемого способа является эффективное воздействие вводимых молекул миРНК, представленных последовательностями SEQ ID NO 7 и SEQ ID NO 8, подавляющих экспрессию гена провоспалительного цитокина IL-13, а также их смесь с миРНК, подавляющих экспрессию гена IL-4, представленных последовательностями SEQ ID NO 3 и SEQ ID NO 6, что обеспечивает одновременное воздействие на два провоспалительных цитокина IL-13 и IL-4, т.е. подавление двух генов-мишеней, обуславливая синергетический эффект молекул миРНК, приводящий к существенному снижению уровня гиперреактивности бронхов (снижению удельной сопротивляемости бронхов) и аллергического воспаления в легких (снижение общей клеточности, эозинофилов).
Преимущественно, в способе профилактики и лечения бронхиальной астмы полученные препараты миРНК вводят интраназально.
Краткое описание чертежей.
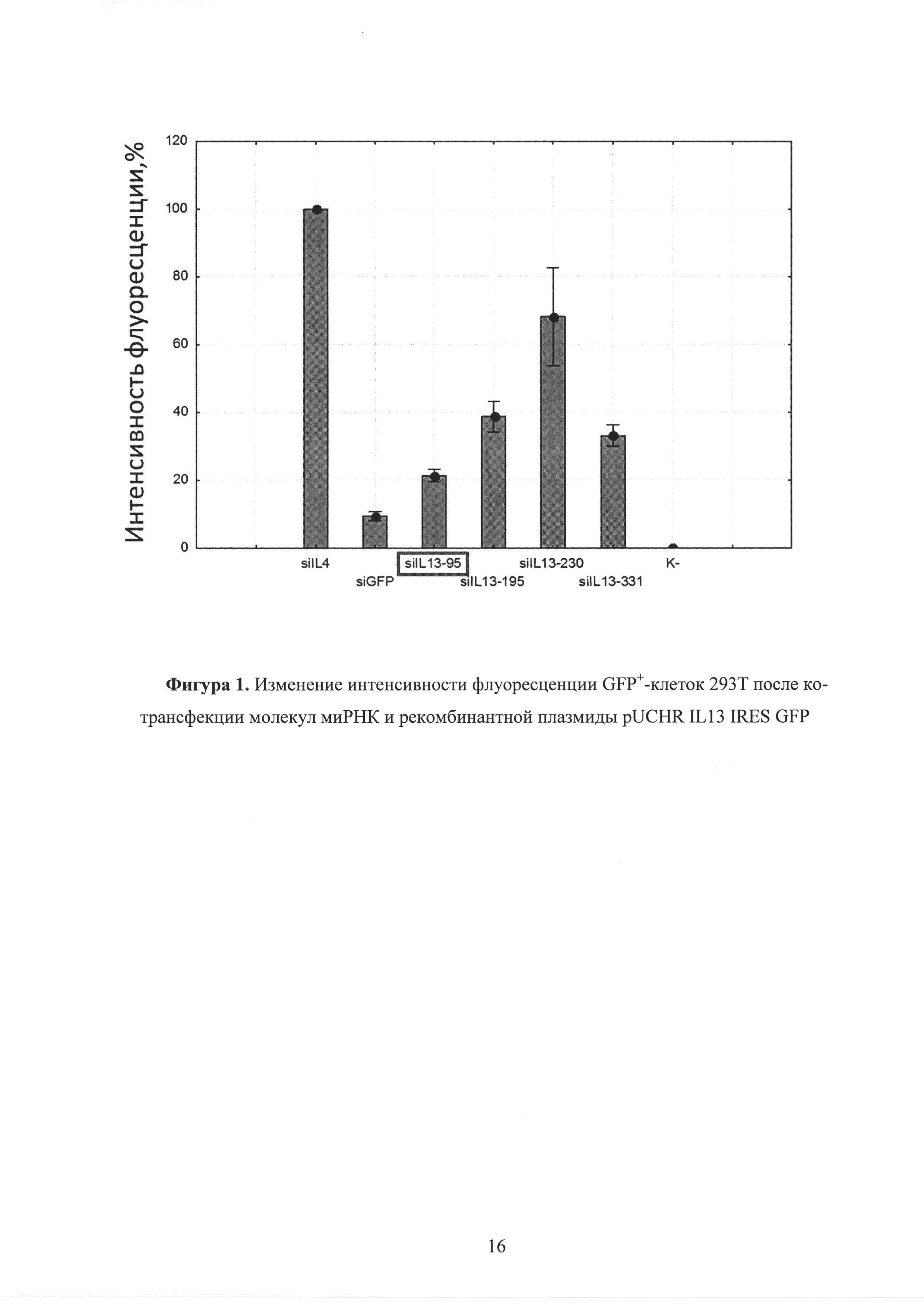
Фиг. 1. Изменение интенсивности флуоресценции GFP+-клеток 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL13 IRES GFP.
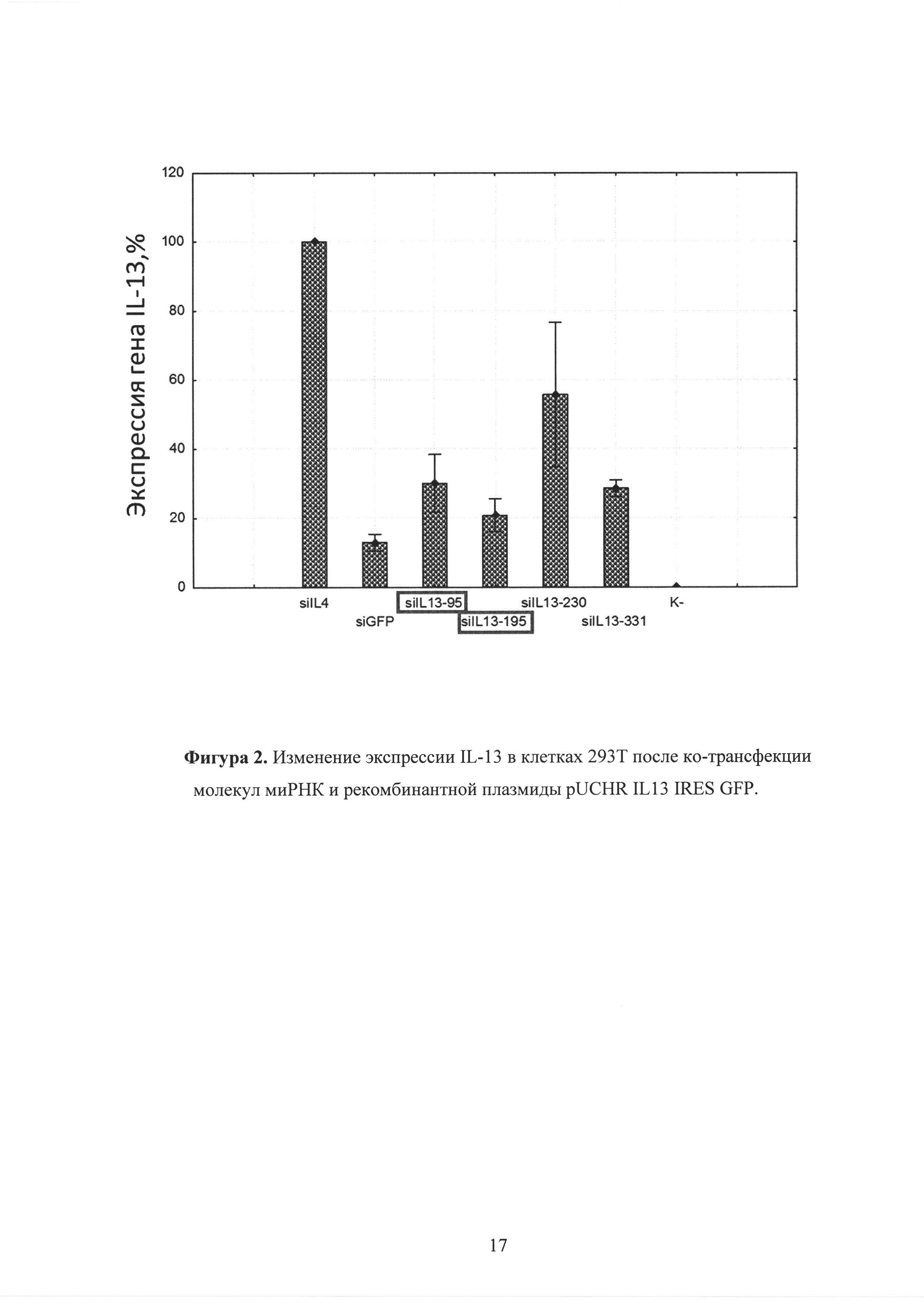
Фиг. 2. Изменение экспрессии IL-13 в клетках 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL13 IRES GFP.
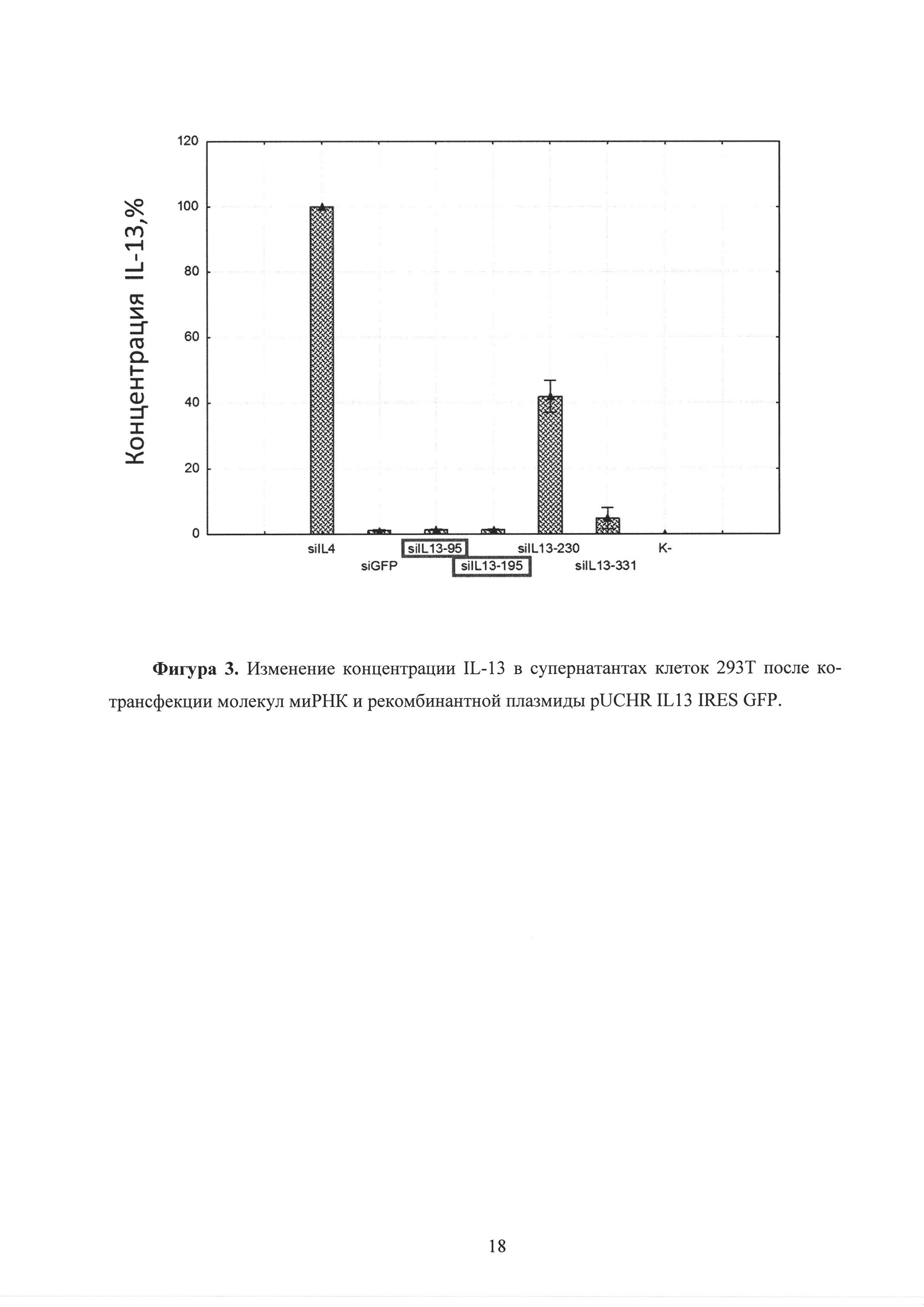
Фиг. 3. Изменение концентрации IL-13 в супернатантах клеток 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL13 IRES GFP.
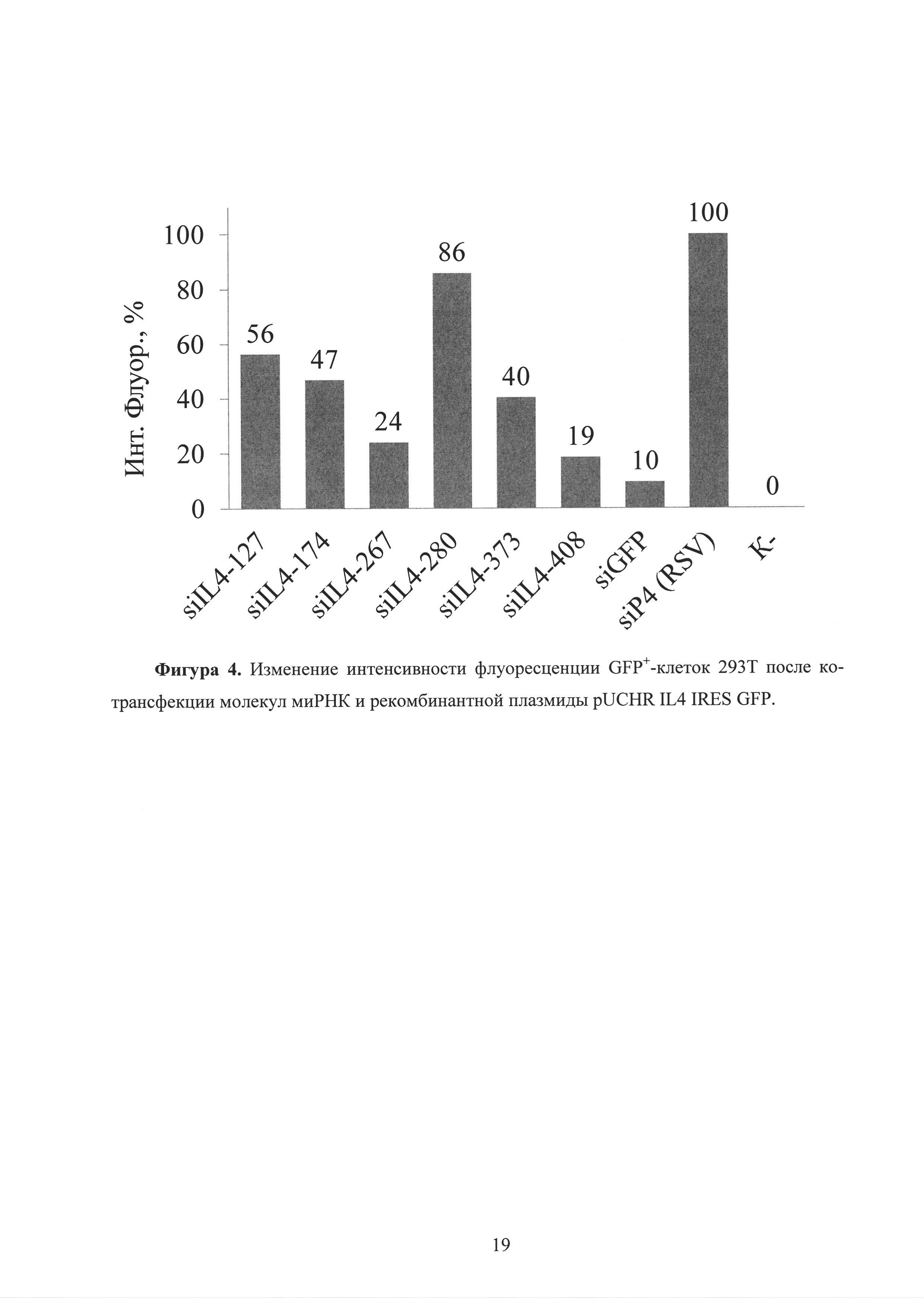
Фиг. 4. Изменение интенсивности флуоресценции GFP+-клеток 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP.
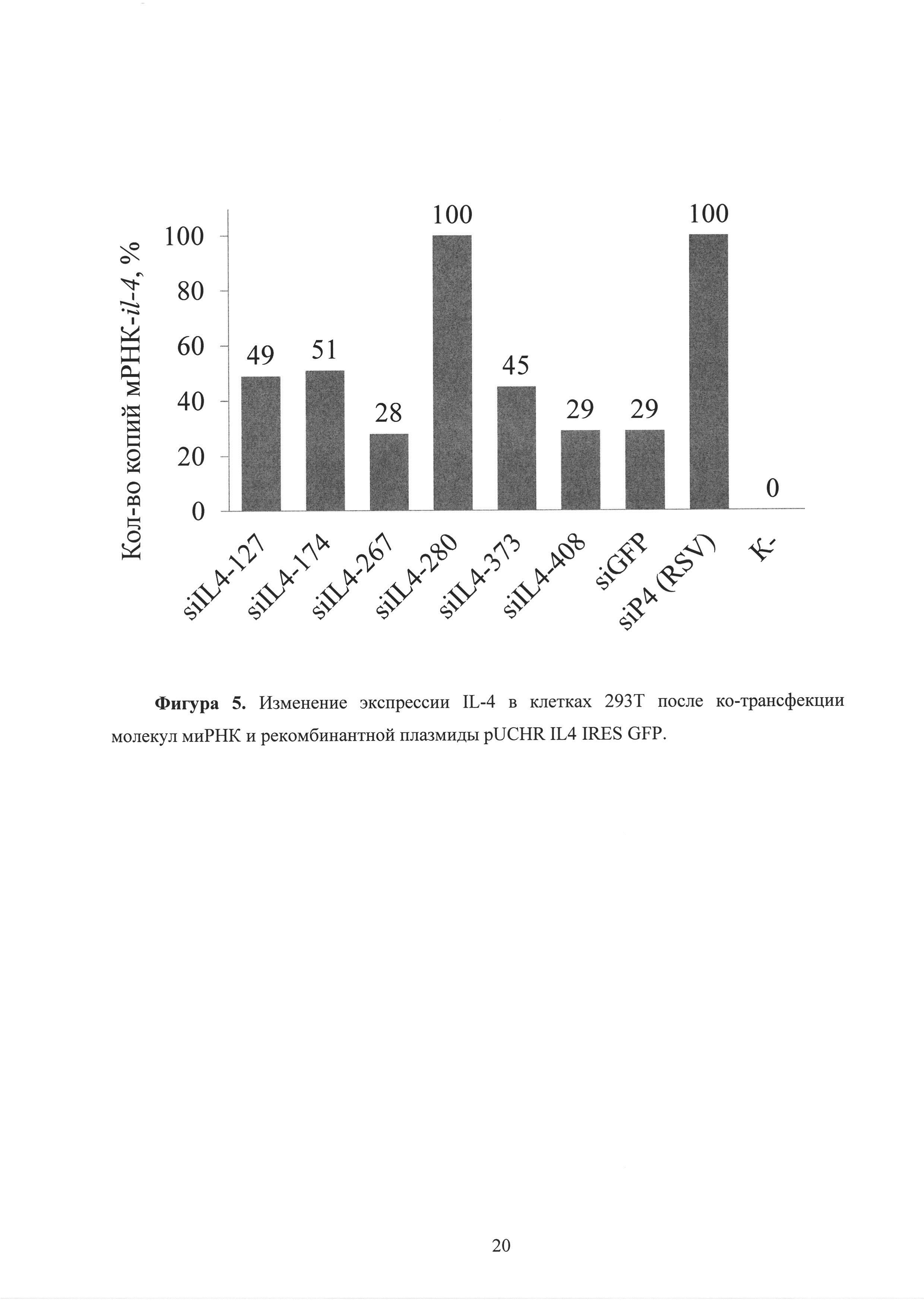
Фиг. 5. Изменение экспрессии IL-4 в клетках 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP.
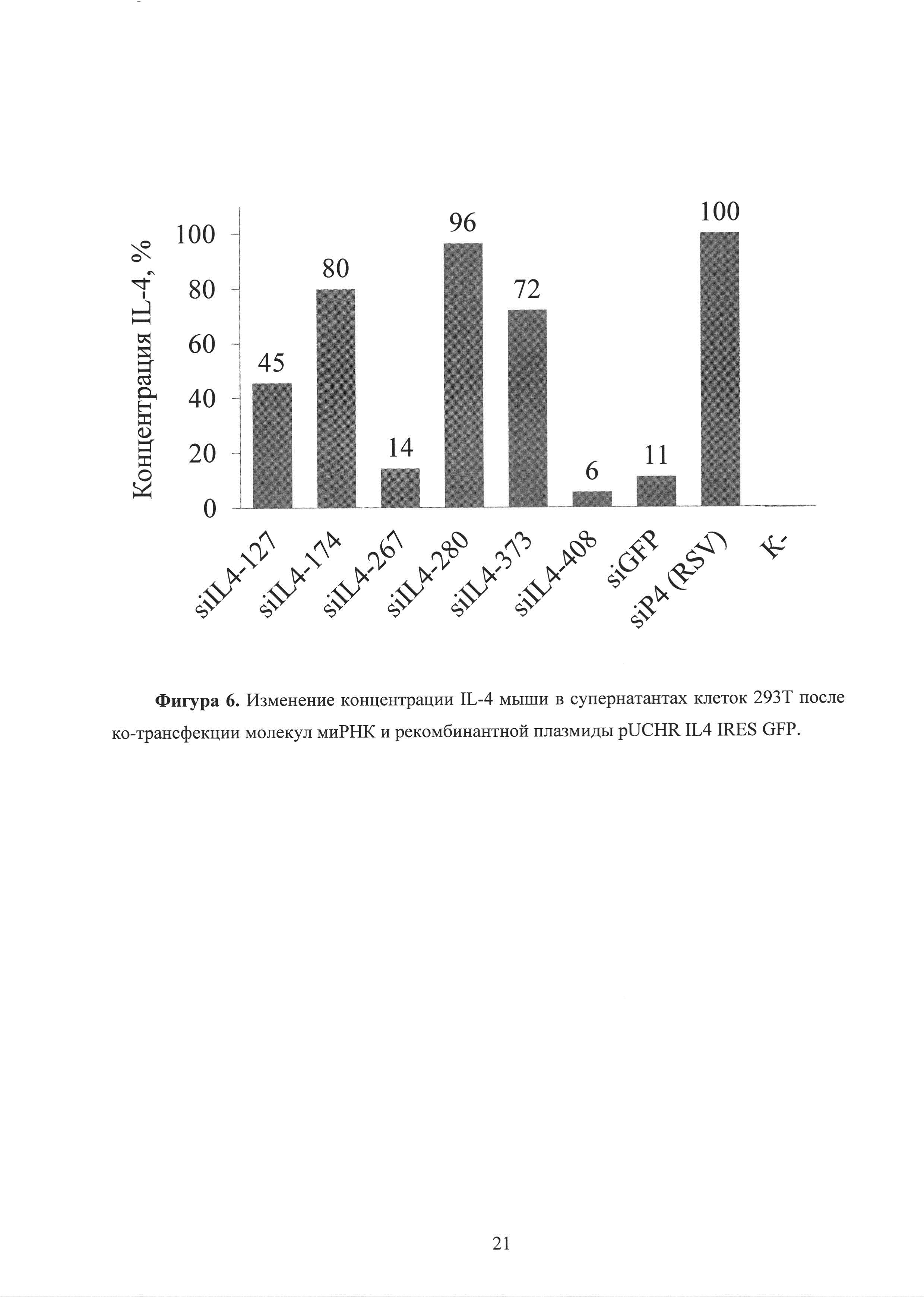
Фиг. 6. Изменение концентрации IL-4 мыши в супернатантах клеток 293Т после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP.
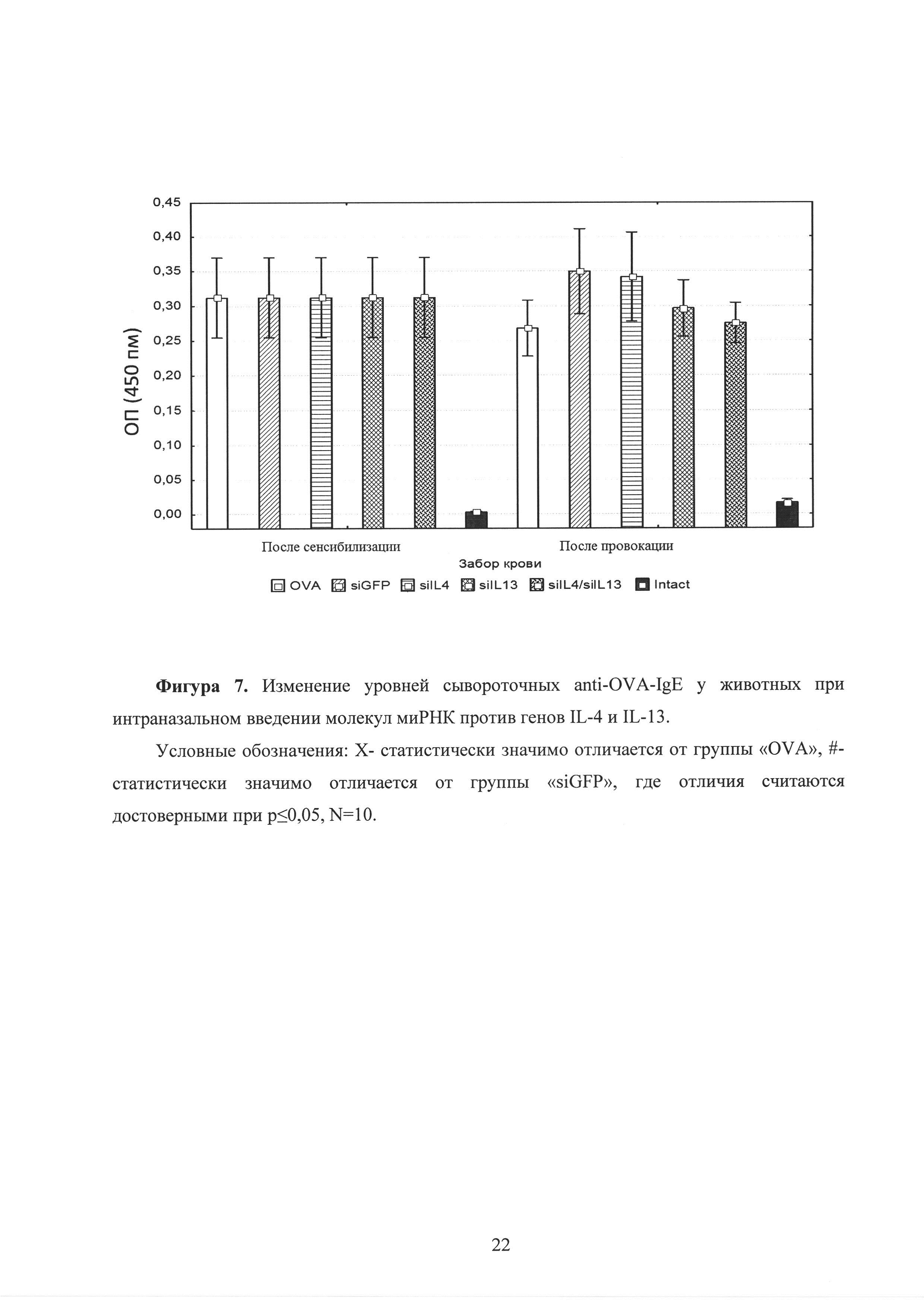
Фиг. 7. Изменение уровней сывороточных anti-OVA-IgE у животных при интраназальном введении молекул миРНК, подавляющих экспрессию генов IL-4 и IL-13.
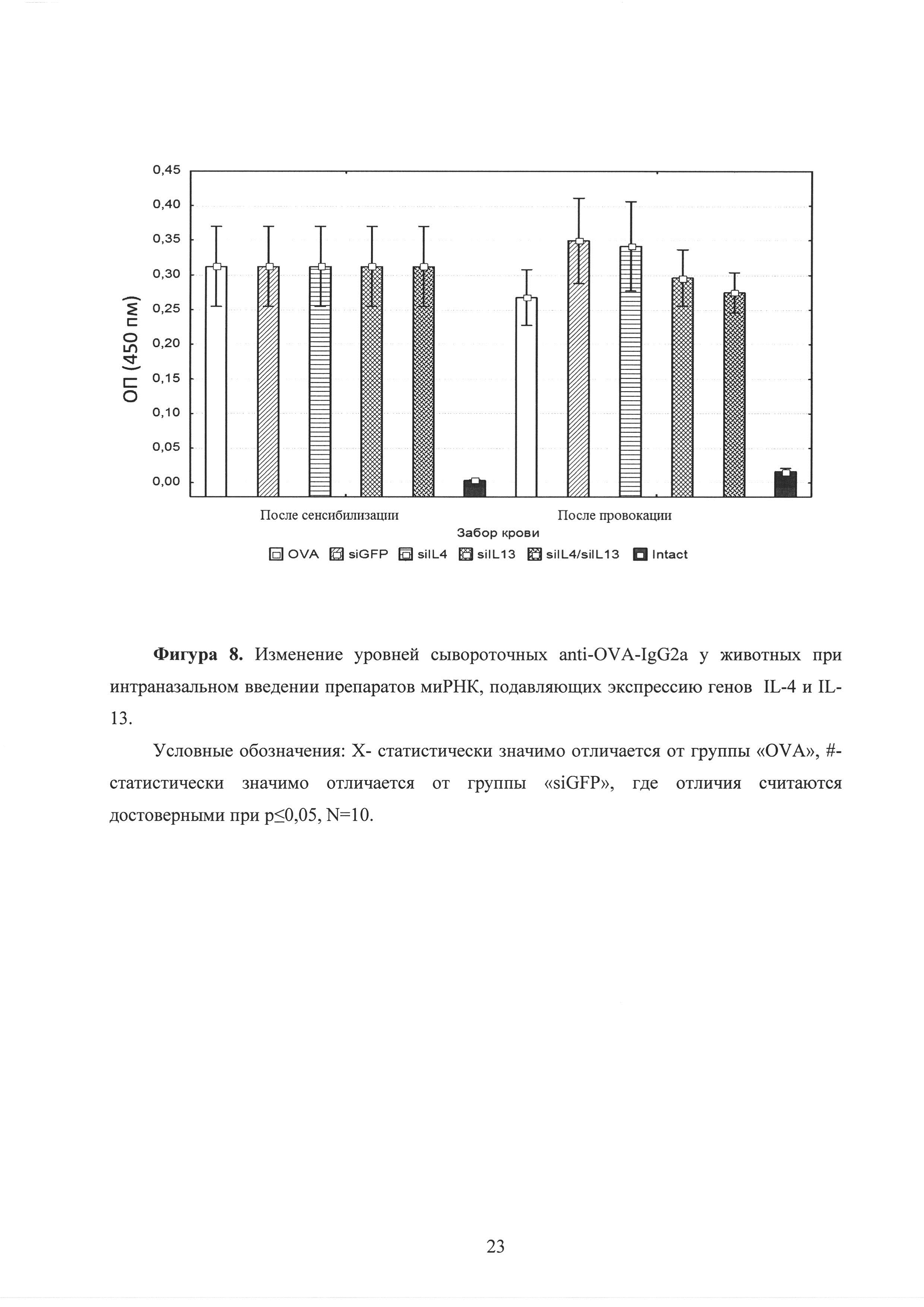
Фиг. 8. Изменение уровней сывороточных anti-OVA-IgG2a у животных при интраназальном введении препаратов миРНК, подавляющих экспрессию генов IL-4 и IL-13.
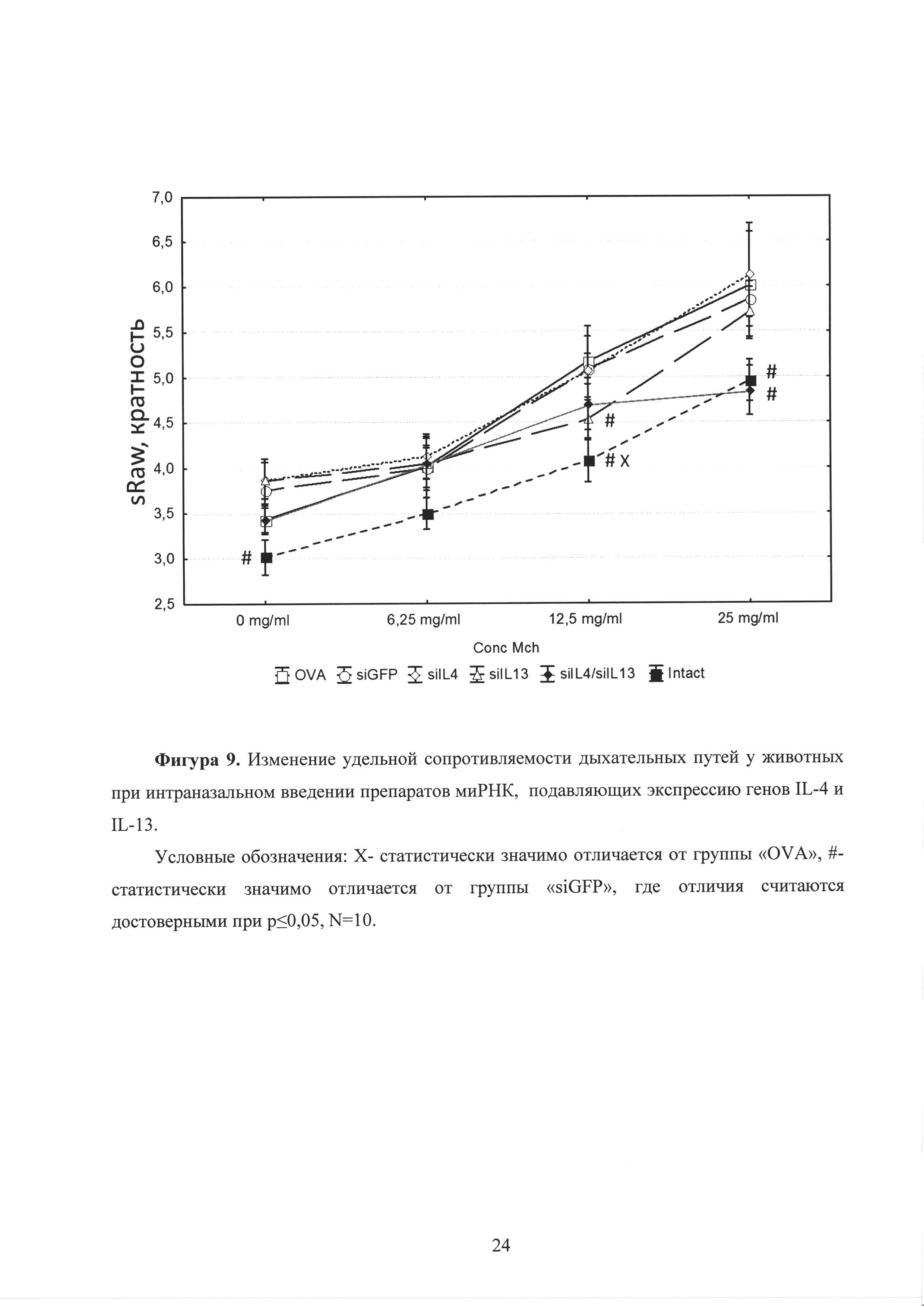
Фиг. 9. Изменение удельной сопротивляемости дыхательных путей у животных при интраназальном введении препаратов миРНК, подавляющих экспрессию генов IL-4 и IL-13.
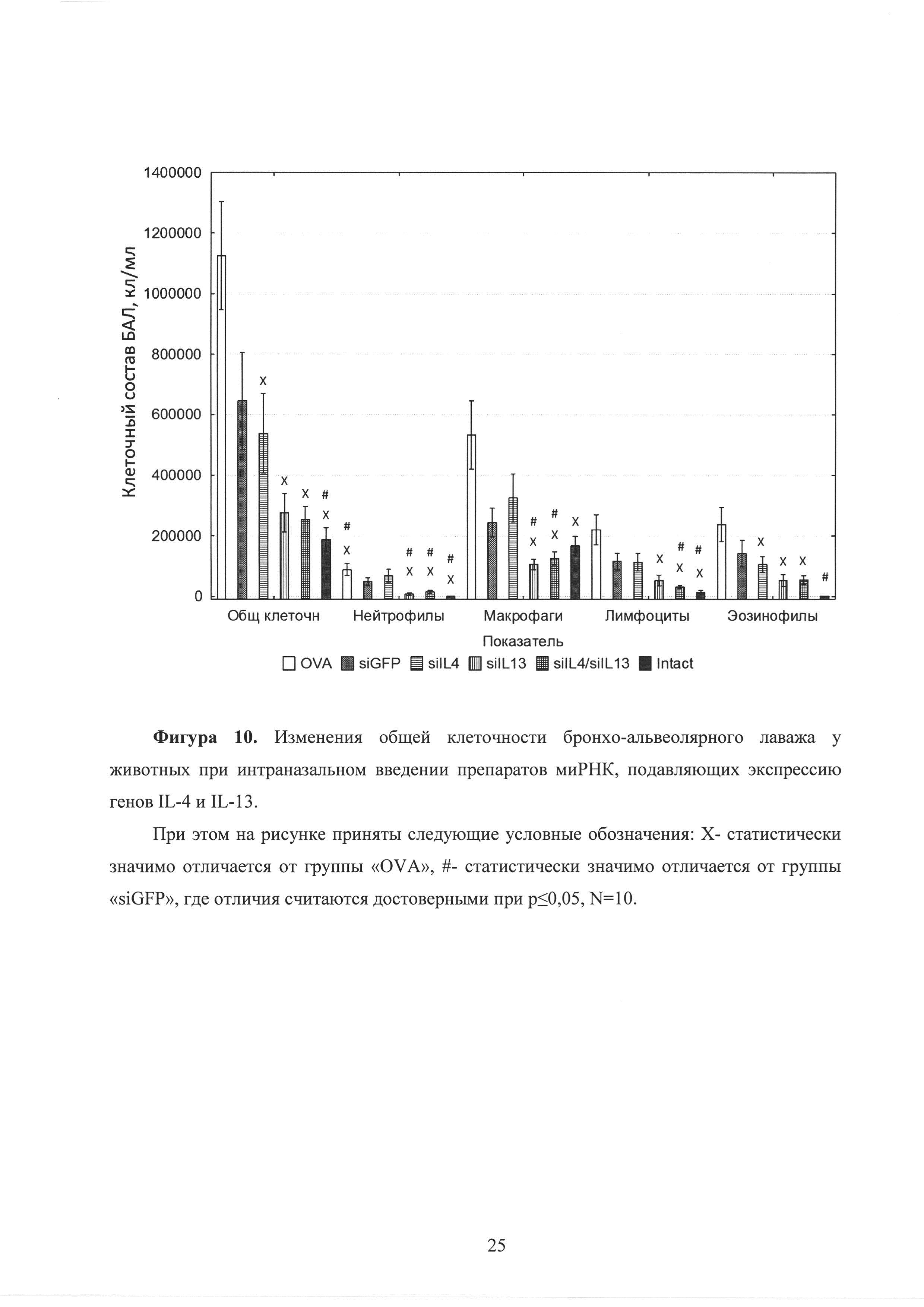
Фиг. 10. Изменения общей клеточности бронхо-альвеолярного лаважа у животных при интраназальном введении препаратов миРНК, подавляющих экспрессию генов IL-4 и IL-13.
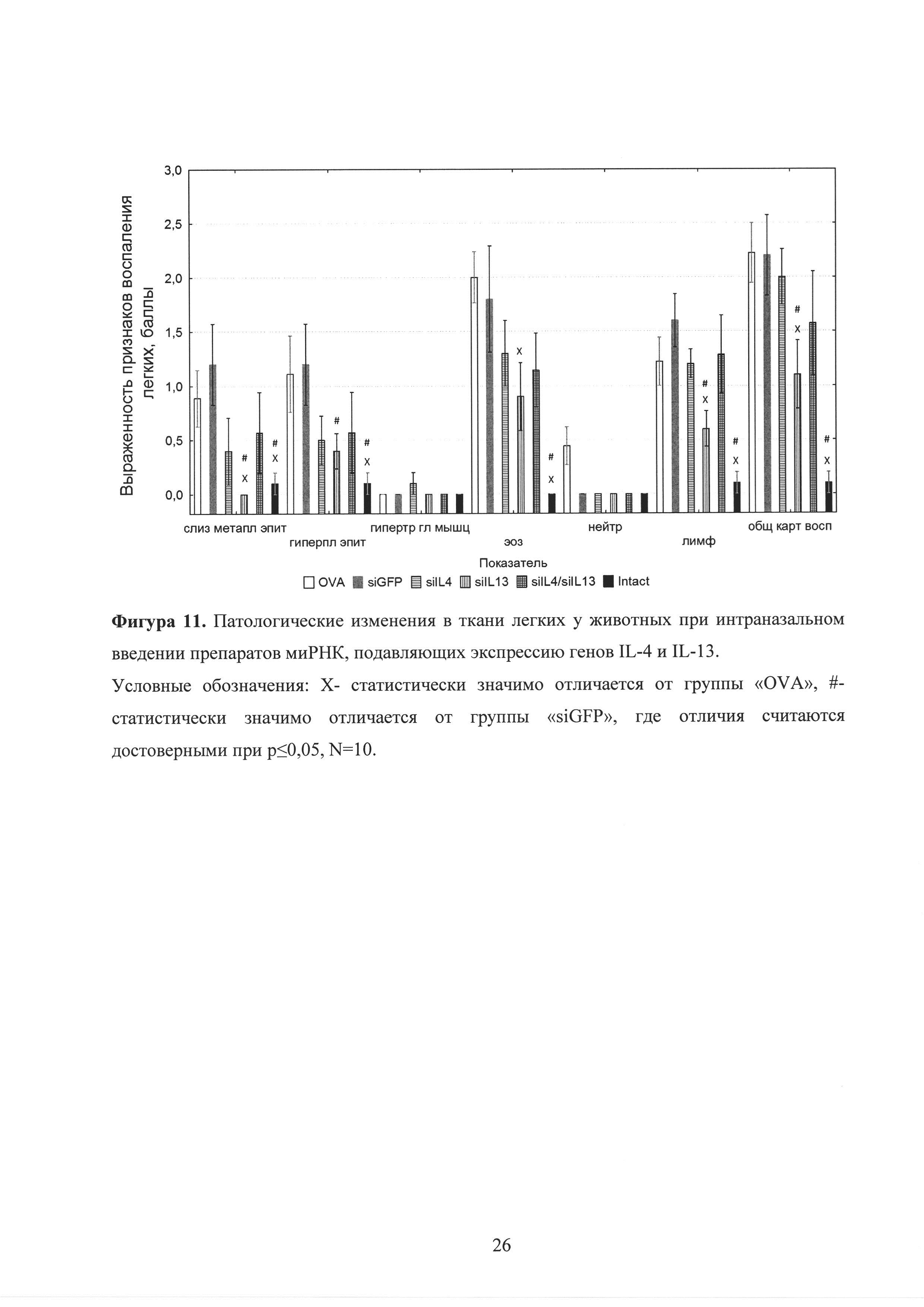
Фиг. 11. Патологические изменения в ткани легких у животных при интраназальном введении препаратов миРНК, подавляющих экспрессию генов IL-4 и IL-13.
Подробное описание изобретения.
Разработка способа лечения и профилактики аллергической бронхиальной астмы, работающего на основе механизма РНК-интерференции, проводилась с использованием мышиных моделей.
Пример 1. Получение молекул миРНК, подавляющих экспрессию IL-13 и IL-4.
Проектирование молекул миРНК было осуществлено с помощью специального программного обеспечения OligoWalk, которое рассчитывает термодинамические параметры гибридизации РНК-олигонуклеотидов, предсказывает их свободную энергию связывания с мРНК-мишенью. С использованием программы OligoWalk было спрогнозировано 44 различных вариантов молекул миРНК, из которых были выбраны наиболее оптимальные варианты миРНК. Выбор осуществлялся в соответствии со следующими критериями: положение участка отжига на мРНК гена-мишени (il-13 мыши) не должен находиться ближе 50 пн относительно Start-кодона гена, т.к. в данном участке мРНК-мишени инициируется трансляция, которая сопряжена с привлечением различных инициирующих белковых факторов, что снижает пространственную доступность данного участка для молекул миРНК, и как следствие понижает их активность. Кроме того, следовало избегать повторяющихся более 4 раз нуклеотидов таких как «АААА» и «GGGG». В итоге было создано 6 вариантов миРНК против гена гена IL-4 (SEQ ID NO 1-6) и 4 варианта миРНК против IL-13 (SEQ ID NO 7-10) (таб. 1).
Пример 2. Получение средства, содержащего молекулы миРНК, подавляющие экспрессию IL-13 и IL-4.
Получение средства, содержащего молекулы миРНК, подавляющие экспрессию IL-13: готовят водный раствор миРНК, содержащий siIL13-95 и siIL13-195 в массовом соотношении 1:1 концентрацией 0,6 мкг/мкл.
Получение средства, содержащего молекулы миРНК, подавляющие экспрессию IL-13 и IL-4: готовят водный раствор миРНК, содержащий siIL-4-267, siIL-4-408, siIL13-95 и siIL13-195 в массовом соотношении 1:1:1:1 концентрацией 0,6 мкг/мкл.
Возможность успешного использования молекул миРНК в качестве высокоспецифичного средства «выключения» экспрессии провоспалительных генов была доказана экспериментально. В ходе экспериментов in vitro экспрессия генов IL-4 и IL-13 была успешно подавлена с использованием молекул миРНК, что описывается примером 3.
Пример 3. Подавление экспресии генов IL-13 и IL-4 с использованием молекул миРНК in vitro.
Для тестирования спроектированных молекул миРНК, в экспериментах in vitro была создана экзогенная модель экспрессии этого гена в хорошо трансфецируемых клетках 293Т. Эффективность спроектированных молекул миРНК была оценена с использованием данной модели различными методами. Для этого 1×105 клеток 293Т трансфецировали смесью, состоящей из 0,5 мкг плазмиды pUCHR IL13 IRES GFP или pUCHR IL4 IRES GFP, экспрессирующей ИЛ-13 или ИЛ-4 и 1 мкг соответствующей миРНК. Сутки после ко-трансфекции методом проточной цитометрии было оценено количество GFP+-клеток, а также средняя интенсивность их флуоресценции. Как оказалось, вариант миРНК (siIL 13-95) приводил к заметному снижению интенсивности флуоресценции GFP+-клеток в 5 раз, в сравнении с отрицательным контролем (рисунок 1). На рисунке 1 представлена средняя интенсивность флуоресценции клеток 293Т в % относительно контроля (siIL4). Интенсивность флуоресценции клеток при ко-трансфекции siIL4 и pUCHR IL13 IRES GFP принято за 100%. Как оказалось, вариант миРНК (siIL4-408) приводил к заметному снижению интенсивности флуоресценции GFP+-клеток в 5 раз, в сравнении с отрицательным контролем (рисунок 4). На рисунке 4 представлена средняя интенсивность флуоресценции клеток 293Т в % относительно контроля (siP4). Интенсивность флуоресценции клеток при ко-трансфекции siP4 и pUCHR IL4 IRES GFP принято за 100%.
Результаты, полученные в ходе количественного ПЦР анализа и ИФА, показали сходную картину. В клетках, взятых через сутки после ко-трансфекции, наблюдается снижение количества копий мРНК-il-13. Наиболее эффективное снижения обеспечивала так же siIL13-95 и siIL13-195 до 3 раз (рисунок 2). На рисунке представлена экспрессия mIL-13 относительно контроля (siIL4). Количество мРНК-il-13 при ко-трансфекции siIL4 и pUCHR IL13 IRES GFP принято за 100%. В клетках, взятых через сутки после ко-трансфекции, наблюдается снижение количества копий мРНК-il-4. Наиболее эффективное снижения обеспечивала так же siIL4-408 до 3 раз (рисунок 5). На рисунке представлено количество копий мРНК-il-4 относительно контроля (siP4). Количество мРНК-il-4 при ко-трансфекции siP4 и pUCHR IL4 IRES GFP принято за 100%.
В клеточных супернатантах, в этот же период времени происходит снижение концентрации секретированного клетками IL-13 до 10 раз при внесении в клетки молекул siIL-13-95 и siIL-13-195 (рисунок 3). Аналогичное снижение концентрации IL-4 происходит в клеточных супернатантах, в этот же период времени, при внесении в клетки молекул siIL-4-267 и siIL-4-408 (рисунок 6).
Таким образом, было спроектировано 2 варианта молекул миРНК (siIL-13-95 и siIL-13-195) способных эффективно подавлять экспрессию провоспалительного гена il-13 мыши и 2 варианта молекул миРНК (siIL-4-267 и siIL-4-408) способных эффективно подавлять экспрессию провоспалительного гена il-4 мыши.
Был разработан режим введения препаратов миРНК модельным животным (мыши самки линии BALB/c с признаками бронхиальной астмы) и показано противовоспалительное действие созданных молекул миРНК, подавляющих экспрессию генов IL-4 и IL-13, что описывается примером 4.
Пример 4. Противовоспалительное действие молекул миРНК, подавляющих экспрессию генов IL-13 и IL-4.
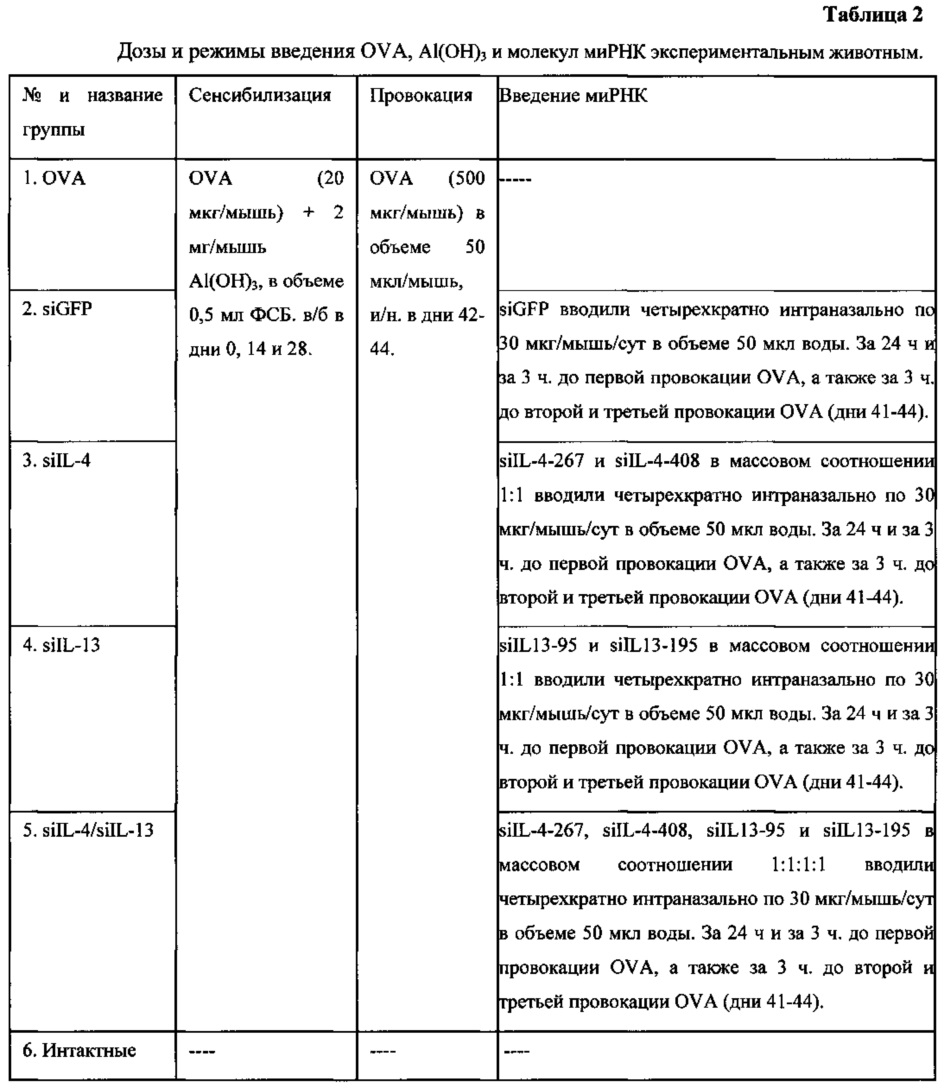
Для оценки противовоспалительной эффективности воздействия молекул миРНК к генам IL-4 и IL-13 экспериментальные животные были разделены на 6 групп, у первых 5-ти групп проводилось моделирование экспериментальной бронхиальной астмы (БА) с использованием модельного аллергена овальбумина (OVA). БА моделировалась у животных в два этапа: этап сенсибилизации, где OVA вводился внутрибрюшинно совместно с адъювантом Al(ОН)3; этап провокации, где OVA вводился интраназально. Доза и схема введения OVA и Al(ОН)3 представлены в таблице 2. Группа 1 не получала молекул миРНК. Группам №2, 3, 4 и 5 интраназально (и/н) вводили миРНК: группе 2 - против гена siGFP (неспецифический контроль), группе 3 - против гена IL-4, группе 4 - против гена IL-13 и группе 5 вводилась смесь миРНК против IL-4 и IL-13. Группа 6 никаким манипуляциям не подвергалась. Доза и режим введения молекул миРНК представлены в таблице 2.
После каждого этапа (сенсибилизации и провокации) был осуществлен забор крови и оценены уровни сывороточных антител класса IgE и субкласса IgG2a. Достоверных отличий в изменениях уровней анти-OVA IgE и IgG1 антител не выявлено (рисунок 7, рисунок 8). На рисунках представлены средние концентрации сывороточных анти-OVA IgE и IgG2a антител и ошибки средних. При этом на рисунке приняты следующие условные обозначения: Х - статистически значимо отличается от группы «OVA», #-статистически значимо отличается от группы «siGFP», где отличия считаются достоверными при р<0,05, N=10. Вероятно, это связано с тем, что животным миРНК вводилась локально (интраназально в ткань легких), а не системно (в кровоток), поэтому препарат не оказал влияния на уровни IgE и IgG2a в сыворотке крови.
Через сутки после заключительной провокации у животных была оценена удельная сопротивляемость дыхательных путей (sRaw), в ответ на введение возрастающих концентраций метахолина (6,25, 12,5, 25 мг/мл). В результате у группы, получавшей siIL-13, показана тенденция к снижению удельной сопротивляемости бронхов, по сравнению с группой, животных, не получавших миРНК (OVA), и группой, получавшей неспецифические молекулы миРНК (siGFP). Наибольший эффект снижения гиперреактивности бронхов достигался при интраназальном введении смеси молекул миРНК против обоих генов IL-4 и IL-13 мышам с индуцированной астмой, т.е. наблюдался синергетический эффект молекул миРНК (рисунок 9). При этом на рисунке приняты следующие условные обозначения: Х- статистически значимо отличается от группы «OVA», #-статистически значимо отличается от группы «siGFP», где отличия считаются достоверными при р<0,05, N=10. Таким образом, одновременное воздействие на два провоспалительных цитокина IL-4 и IL-13 обеспечивает подавление двух генов-мишеней, обуславливая синергетический эффект молекул миРНК, приводящий к существенному снижению уровня гиперреактивности бронхов (снижению удельной сопротивляемости бронхов), являющейся одним из ведущих патофизиологических признаков БА.
Кроме того, исследование общей клеточности и клеточного состава бронхо-альвеолярного лаважа мышей показало снижение количества клеток в БАЛ у экспериментальных животных группы 4, получавшей siIL-13, снижалось в 3,1 и 1,8 раза в сравнении с животными, не получавшими молекул миРНК (OVA) и животными, получавшими неспецифические молекулы миРНК (siGFP), соответственно. Более выраженное снижение общей клеточности БАЛ наблюдалось у группы 5, получавшей миРНК против обоих генов IL-4 и IL-13 - здесь наблюдалось снижение количества клеток в 5,5 и 3,3 раза в сравнении с животными, не получавшими молекул миРНК (OVA) и животными, получавшими неспецифические молекулы миРНК (siGFP), соответственно, что также свидетельствует о синергетическом эффекте молекул миРНК (рисунок 10). Как упоминалось выше важными маркерами аллергического воспаления в легких являются эозинофилы. В третьей, четвертой и пятой группах, получавших siIL-4, siIL-13 и siIL-4/siIL13, соответственно отмечалась тенденция к снижению эозинофилии по сравнению с группой, получавшей контрольную миРНК (siGFP) на 25%, 63% и 62%, соответственно. Эти данные свидетельствуют о том, что подавление гена IL-13 и подавление обоих цитокинов (IL-4 и IL-13) приводит к более существенному снижению аллергического воспаления, нежели подавление только гена IL-4 (рисунок 10). Аналогично, синергетических эффект молекулы миРНК обоих типов (siIL-4/siIL-13) оказывают на интенсивность инфильтрации других провоспалительных леток - лимфоцитов (рисунок 10). При этом на рисунке приняты следующие условные обозначения: Х - статистически значимо отличается от группы «OVA», #-статистически значимо отличается от группы «siGFP», где отличия считаются достоверными при р≤0,05, N=10.
Гистологические исследования срезов ткани легких показали сходную динамику: животные, получавшие миРНК против генов IL-4 и IL-13 или против обоих генов-мишеней демонтрировали снижение уровня инфильтрации провоспалительных клеток, в частности эозинофилов и лимфоцитов. Также анализ показал тенденцию к снижению слизистой метаплазии эпителия бронхов, гиперплазии эпителия и общей картины воспаления в группах 3, 4 и 5, в сравнении с первой группой, не получавшей миРНК и второй группой, получавшей неспецифические молекулы миРНК (siGFP) (рисунок 11). Однако стоит отметить, что наибольший положительный эффект, по данным гистологического анализа, проявляют молекулы миРНК, направленные против гена IL-13, а не против гена IL-4 или против обоих генов. Таким образом, синергичного эффекта молекул миРНК против обоих генов-мишеней, как было установлено при изменении гиперреактивности бронхов или при анализе клеточного состава БАЛ, не выявлялось данным методом анализа. Вероятно, это связано с тем, что изменение гиперреактивности бронхов и оценка состава БАЛ являются более интегральными показателями уровня воспаления в легких по сравнению с гистологическим анализов, т.е. они оценивают общее состояние дыхательной системы. В тоже время при приготовлении гистологических срезов ткани легких толщиной 4 мкм и при последующем их анализе могут ускользать некоторые локальные очаги воспаления в легких. В связи с этим данные об изменении гиперерактивности бронхов и клеточного состава БАЛ являются более значимыми при анализе результатов влияния молекул миРНК на показатели аллергической бронхиальной астмы.
Таким образом, результатом данного изобретения является успешное использование молекул миРНК, направленных против провоспалительного гена IL-13, а также их смесь миРНК против гена IL-4 для лечения бронхиальной астмы. Подавление данных генов в ткани легких приводит к существенному снижению уровня гиперреактивности бронхов и аллергического воспаления в легких, при этом значительный положительный эффект оказывают молекулы миРНК, направленные против гена IL-13, а также наблюдается синергетический эффект при применении молекул миРНК против обоих цитокинов одновременно.
Список источников
1. Agache I. [и др.]. Untangling asthma phenotypes and endotypes. // Allergy. 2012. №7 (67). C. 835-46.
2. Fahy J. V. Eosinophilic and Neutrophilic Inflammation in Asthma: Insights from Clinical Studies // Proceedings of the American Thoracic Society. 2009. №3 (6). C. 256-259.
3. Holgate S.T. Pathogenesis of asthma. // Clinical and experimental allergy: journal of the British Society for Allergy and Clinical Immunology. 2008. №6 (38). C. 872-97.
4. Holgate S.T. Innate and adaptive immune responses in asthma. // Nature medicine. 2012. №5(18). C. 673-83.
5. Kearley J. [и др.]. IL-9 governs allergen-induced mast cell numbers in the lung and chronic remodeling of the airways. // American journal of respiratory and critical care medicine. 2011. №7 (183). C. 865-75.
6. Koziol-White C.J., Damera G., Panettieri R.A. Targeting airway smooth muscle in airways diseases: an old concept with new twists. // Expert review of respiratory medicine. 2011. №6 (5). C. 767-77.
7. Walter D.M. [и др.]. Critical role for IL-13 in the development of allergen-induced airway hyperreactivity. // Journal of immunology (Baltimore, Md.: 1950). 2001. №8 (167). C. 4668-4675.
8. Крючков, H.A.; Бабахин, A.A.; Башкатова, Ю.Н.; Козмин, Л.Д.; Барсигян, Г.Г.; Хаитов, М.Р.; Мартынов А.И. Краткосрочная безадъювантная модель IgE-зависимой бронхиальной астмы у лабораторных мышей с использованием аллергена пыльцы тимофеевки // Российский аллергологический журнал. 2008. (4). С. 37-45.
9. Шиловский, И.П.; Бабахин, А.А.; Прозорова, М.С.; Гайсина, А.Р.; Камышников, О.Ю.; Хаитов М.Р. Разработка безадъювантной модели хронической бронхиальной астмы у мышей // Российский иммунологический журнал. 2014. №17 (3). С. 638-641.