Результат интеллектуальной деятельности: Композиция, подавляющая экспрессию генов интерлейкина-4 и интерлейкина-13, для терапии аллергического ринита
Вид РИД
Изобретение
Изобретение относится к области генной инженерии и биохимии, а также к медицине и фармацевтике. Изобретение может быть использовано для лечения и профилактики аллергического ринита с использованием композиции, которая содержит комплекс молекул миРНК, подавляющих экспрессию генов IL-4 и IL-13 и пептида b-LTP в основной форме.
Аллергический ринит (АР) - в широком смысле определяется как воспаление слизистой оболочки носовой полости. АР проявляется следующими основными симптомами [Kakli, Riley, 2016]: ринорея, чихание, зуд, заложенность носа, характерное дыхание ртом, сопение, храп, изменение голоса, снижение обоняния (на поздних стадиях ринита) и т.д. Основными этиологическими факторами АР являются: пыльца растений, бытовые аллергены, эпидермальные, аллергены тараканов и споры плесневых грибов, обитающих внутри помещений, пищевые аллергены. АР - это достаточно распространенное заболевание, затрагивающее в разных странах до 40% населения. Распространенность аллергического ринита среди населения России в настоящее время оценивается в 10-30% [Hosoya и др., 2011]. АР является фактором риска развития бронхиальной астмы (БА). По данным АР наносит экономический ущерб экономикам стран мира. Европе прямые затраты, связанные с АР, ежегодно составляют 1-1,5 млрд. евро, а непрямые затраты - 1,5-2 млрд. евро. При оценке социально-экономического значения болезни необходимо учитывать ассоциации АР с другими заболеваниями, в том числе бронхиальной астмой, синуситами, средним отитом, инфекциями дыхательных путей [6].
В последние годы стало очевидным, что в патогенезе АР ключевую роль играют Th2-клетки; они индуцируют и поддерживают аллергическое воспаление. Патофизиологические аспекты аллергических расстройств, таких, как продукция IgE-антител; рекрутирование и активация тучных клеток; базофилов и эозинофилов; гиперсекреция слизи; субэпителиальный фиброз; и ремоделирование тканей напрямую связаны с Th2-клетками, продуцирующими ряд провоспалительных цитокинов: IL-4, IL-5, IL-9 и IL-13 [9]. Эти цитокины опосредуют несколько эффекторных функций. В частности IL-4 и IL-13 инициируют дифференциацию В-клеток в IgE-продуцирующие плазматические клетки, осуществляют рекрутирование эозинофилов, способствуют гиперчувствительности дыхательных путей и гиперсекреции слизи [7, 8].
Сходства биологических свойств IL-4 и IL-13 также обусловлены тем, что они имеют общую цепь в индивидуальных рецепторных комплексах. Мембраносвязанный IL-13Rα1 обладает низким сродством к IL-13, но при димеризации с IL-4Rα приобретает высокую аффинность к IL-13. Второй рецептор - IL-13Rα2 - обладает высоким сродством к IL-13 и легко с ним связывается, но механизм передачи сигнала до конца не выяснен. В противоположность этому, IL-4 связывается с двумя различными типами рецепторных комплексов: первый тип состоит из цепи IL-4Rα и γс-цепи, а второй - из цепей IL-4Rα и IL-13Rα1 [Gour, Wills-Karp, 2015; Ranasinghe и др., 2014]. Таким образом, продукция цитокинов IL-4 и IL-13 важна как при ранней, так и при поздней фазе аллергического ответа, что делает их перспективными мишенями для разработки новых способов лечения аллергических заболевания и АР в частности.
Подходы к терапии АР включают, в основном, мероприятия по элиминации причинно-значимого аллергена, фармакотерапию [Greiwe, Bernstein, 2016; Juel-Berg и др., 2017] и аллерген-специфическую иммунотерапию [Juel-Berg и др., 2017; Kim и др., 2014; Passalacqua, Canonica, Bagnasco, 2016]. В большинстве случаев полностью исключить контакт с аллергеном невозможно. АСИТ применяется для лечения респираторной аллергии с 1911 г [Ring, Gutermuth, 2011]. На современном этапе развития аллергологии, АСИТ признана лечением первой линии для пациентов с IgE-зависимыми атопическими [ и др., 2013]. По данным многочисленных исследований, положительный терапевтический эффект АСИТ достигается в 80-90% случаев и более [Bidad, Nicknam, Farid, 2011; Narkus и др., 2013]. Однако проведение АСИТ сопряжено с определенным риском развития побочных реакций. В ходе терапии в ответ на введение аллергена могут возникнуть нежелательные побочные эффекты в виде местных или системных реакций. В случае проведения инъекционных методов АСИТ местные реакции отмечаются у большинства больных (80%) [Focke-Tejkl, Valenta, 2012]. Фармакотерапия АР располагает в настоящее время несколькими группами противоаллергических лекарственных препаратов, которыми можно эффективно контролировать симптомы заболевания: антигистаминные препараты, интраназальные глюкокортикостероиды, стабилизаторы мембран тучных клеток (препараты кромоглициевой кислоты), сосудосуживающие препараты (деконгестанты), антихолинергические средства, антилейкотриеновые препараты [Melvin, Patel, 2011; Simoens, Laekeman, 2009]. Тем не менее вышеописанных способе лечение АР недостаточно, о чем свидетельствует продолжающийся рост заболеваемости.
и др., 2013]. По данным многочисленных исследований, положительный терапевтический эффект АСИТ достигается в 80-90% случаев и более [Bidad, Nicknam, Farid, 2011; Narkus и др., 2013]. Однако проведение АСИТ сопряжено с определенным риском развития побочных реакций. В ходе терапии в ответ на введение аллергена могут возникнуть нежелательные побочные эффекты в виде местных или системных реакций. В случае проведения инъекционных методов АСИТ местные реакции отмечаются у большинства больных (80%) [Focke-Tejkl, Valenta, 2012]. Фармакотерапия АР располагает в настоящее время несколькими группами противоаллергических лекарственных препаратов, которыми можно эффективно контролировать симптомы заболевания: антигистаминные препараты, интраназальные глюкокортикостероиды, стабилизаторы мембран тучных клеток (препараты кромоглициевой кислоты), сосудосуживающие препараты (деконгестанты), антихолинергические средства, антилейкотриеновые препараты [Melvin, Patel, 2011; Simoens, Laekeman, 2009]. Тем не менее вышеописанных способе лечение АР недостаточно, о чем свидетельствует продолжающийся рост заболеваемости.
С учетом ведущей роль IL-4 и IL-13 в патогенезе АР появляются разработки т.н. таргетных препаратов, которые специфически блокируют активность выбранных биомишеней. Первоначально для подавления экспрессии IL-4 и IL-13 использовались моноклональные антитела, которые связываются с данными цитокинами и тем самым блокируют их активность, также используются т.н. мутеины (мутантные белки указанных цитокинов), которые связываются с рецептором, но не индуцирует передачу сигнала. Кроме того, используются растворимые рецепторы для IL-4 и IL-13, которые связываются со своими лигандами и предотвращют взаимодействие с полноценным рецептором на поверхности клетки. Все эти походы регулируют экспрессию IL-4 и IL-13 на белковом уровне, а большинство из них не оправдали ожиданий в клинических исследованиях.
Альтернативой использованию моноклональных антител служит стратегия применения антисмысловых технологий. Под антисмысловыми технологиями понимают способы регуляции активности генов-мишеней на посттранскрипционном уровне. Недавнее открытие механизма РНК-интерференции (РНКи; RNAi) дало новые возможности для регуляции экспрессии генов, в том числе и генов, участвующих в патогенезе АР. РНКи - это РНК-зависимый механизм регуляции экспрессии генов, в котором двухцепочечные молекулы миРНК ингибируют экспрессию генов с комплементарной нуклеотидной последовательностью. Таким образом, введение в клетки и ткани искусственных миРНК необходимого размера (21 пн) и с необходимой последовательностью позволяет осуществить специфическое подавление экспрессии гена-мишени. При этом экспрессия других генов с иной нуклеотидной последовательностью остается неизменной [Joo и др., 2014].
Одна из ключевых проблем, препятствующих внедрению метода РНК-интерференции в клиническую практику - эффективная доставка молекул миРНК в клетки. Из имеющихся способов, вирусные векторные системы являются наиболее эффективными транспортными средствами доставки нуклеиновых кислот. Однако, в этой сфере за последние 15 лет, реализация их в клинической практике осложняется, что связано с опасениями насчет возможности мутагенеза вирусного генома, активации онкогенов и высокой иммуногенности таких векторов.
В качестве альтернативных невирусных векторов предложено применять разнообразные поликатионные соединения, способные образовывать комплексы с отрицательно заряженными нуклеиновыми кислотами (НК) и конденсировать их в компактные наноструктуры. Комплексование, с одной стороны, обеспечивает защиту НК от.действия нуклеаз, а с другой, способствует их транслокации через клеточные мембраны, обычно, путем эндоцитоза. В качестве НК-связывающих агентов могут выступать катионные синтетические полимеры (например, полиэтиленимины), основные полиаминокислоты (полилизины, полиаргинины), хитозаны, катионные пептиды различного состава (например, пептид из белка ТАТ-ВИЧ), и липосомы. В настоящее время липосомы, используемые в качестве носителей для трансфекции клеток высоко токсичны и обладают плохой стабильностью, все это делает их малоприменимыми в практическом плане в медицине (in vivo). Всех этих недостатков лишены позитивно заряженные пептиды, которые также проявляют высокую транспортную активность, при этом малотоксичны и стабильны при хранении.
Основываясь на знании о ведущей роли IL-4/IL-13 в запуске синтеза IgE и развитии аллергического воспаления при АР представляется целесообразным осуществить блокаду генов, ответственных за синтез этих интерлейкинов, с помощью новейшей методологии интерференции РНК. Была создана композиция для терапии аллергического ринита, которая в своем составе содержит комплекс катионного дендримерного пептида b-LTP в основной форме и молекул миРНК (siIL4-153 и siIL13-395) в массовом соотношении 12,5/1. Молекулы миРНК состава 5- AAAGAUGUCUGUUACGGUCtt -3 (для siIL4-153) и 5- GGACCUGCUCUUACAUUUAtt -3 (для siIL 13-395). Катионный дендримерный пептид b-LTP в основной форме, отвечающий химическому строению (Arg)8 (Lys)4 (Lys)2 Lys-Ala-Cys-NH2.
В патенте № US 20160207995 A1 описаны антитела против IL-4 и биспецифические антитела и способы их использования. Использование антител против IL-4 уступает применению композиции для терапии аллергического ринита потому, что последний нацелен не только против IL-4, но и против IL-13 одновременно.
В патенте № WO 2018011405 A1 описывается применение неагонистического полипептидного лиганда, специфически реагирующего на IL-13Ral, при лечении или профилактике состояния, выбранного из нейтропении, аллергического воспаления, бактериемии и сепсиса. Композиция выгодно отличается от пептидного лиганда первый направлен не на рецептор к данному интерлейкину, а на мРНК самого цитокина, т.е. на более ранний этап активации провоспалительного каскада.
В патенте № US 20160075777 A1 описаны биспецифические антитела против IL-4 / IL-13 и систему буферизации, в которой рН составляет около 7, с низкой концентрацией соли в составе, чтобы уменьшить ионную силу препарата. Авторы патента указывают, что препарат может использоваться для лечения различных заболеваний, в том числе и аллергической природы. В отличие от данного изобретения разрабатываемая композиция направлена не на белковые продукты IL-4 / IL-13, а на молекулы мРНК, кодирующие эти белки. Блокировка мРНК позволяет достигать более выраженного эффекта, поскольку с одной молекулы мРНК может синтезироваться до 100 белков.
В патенте № US 20150225479 A1 описаны стабильные фармацевтические композиции антител, включая жидкие составы и лиофилизированные препараты, в частности биспецифические анти-IL-4 / анти-IL-13 антитела, полиаминокислоту, состоящую из глутаминовой кислоты, аспарагиновой кислоты или обеих кислот сразу, с добавлением витамина Е. также, в составе имеется криопротектор и буферизующая система, в которой рН композиции составляет около 7, с концентрацией соли 50 мМ или менее. Данный патент, также, включает способы получения таких композиций. По предположению заявителя эти пептиды могут быть использованы в медицине в качестве антагонистов для IL-4/IL-13 при терапии аллергопатологий. Как и в предыдущем изобретении биспецифические анти-IL-4 / анти-IL-13 антитела уступают композиции, так как молекулы миРНК (присутствующие в составе МРК-4-13) инициируют деградацию мРНК генов-мишеней, а не нейтрализуют их белковые продукты. Кроме того, синтетические молекул миРНК дешевле в получении, чем антитела, которые продуцируются гибрид омами.
В патенте № US 20170218376 A1 представлены асимметричные комплексы РНК, такие как asiRNAs и проникающие в клетку asiRNAs, которые ингибируют экспрессию IL4Rα, TRPA1 и/или F2RL1. Заявители патента утверждают о возможности применять данные препараты для лечения заболеваний аллергической природы, приводя в пример атопический дерматит и астму.
В патенте № WO 2005085443 A2 описаны композиции, содержащие один или несколько агентов RNAi (например, siRNAs, shRNAs или RNAi-векторы) для лечения состояний и заболеваний с IgE-опосредованной гиперчувствительностью, а также систем для определения эффективных агентов RNAi. Композиции подходят для лечения аллергического ринита и/или астмы. Агент RNAi нацелен на транскрипт, который кодирует белок, выбранный из: FC, RIα, цепи FC & epsiv; RIβ, c-Kit, Lyn, Syk, ICOS, OX40L, CD40, CD80, CD86, RelA, RelB, лиганд 4-IBB, TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, CD83, SLAM, обычную цепь F и COX-2. Некоторые варианты запатентованного препарата, содержащие агент RNAi, доставляются аэрозольным путем.
Композиции, содержащие агенты RNAi, указанные в патентах № US 20170218376 A1 и № WO 2005085443 A2 уступают заявленному препарату МРК-4-13 по причинам: а) вводящие в состав композиции молекулы миРНК имеют иную, уникальную нуклеотидную последовательность, позволяющую подавлять активность целевых генов до 80%; б) в составе композиции помимо молекул миРНК присутствует носитель -катионный дендримерный пептид b-LTP, способствующий проникновению молекул миРНК внутрь клеток-мишеней, что усиливает эффект in vivo.
В патенте № US 15335408 представлен блочный сополимер хитозана и полиэтиленгликоля, модифицированный транс-активатором транскриптазы ВИЧ 1 («Тат»); предполагается, что сформированные из этого материала наночастицы могут выступать в качестве невирусной системы доставки нуклеиновых кислот в клетки. Перечисленные в данном изобретении высокомолекулярные системы доставки уступают носителю b-LTP (используемый в составе композиции) в сложности изготовления: включают стадию N-ацилирования хитозана в среде ДМФА, что, однако, требует дополнительных процедур (растворение хитозана в кислоте, смешение с ДМФА, удаление кислоты); ацилирование ангидридом в присутствии органического основания может затрагивать гидроксильные группы хитозана, что также отрицательно сказывается на стандартности полуфабриката - блочного сополимера хитозана и ПЭГ. Высокая молекулярная масса и результирующая нестандартность модифицированного пептидами сополимера очевидным образом затрудняет его дозирование при приготовлении растворов комплексов переносчика с нуклеиновыми кислотами. Носитель b-LTP лишен этих недостатков по причинам: а) обладает постоянной относительно низкой молекулярной массой (2 338 у.е.); б) в получении используется меньшее число стадий, химическая модификация аминокислот или результирующего пептида в нем отсутствуют.
В патенте № US 15840933 описаны липиды, которые могут содержать варьирующее число лекарственных молекул. В частности, в изобретении представлен комплекс нуклеиновая кислота-липиды. Предполагается, что такие частицы могут выступать в качестве системы доставки нуклеиновых кислот. Перечисленные в данном изобретении липиды уступают b-LTP, так как: а) если из сложных эфиров ВЖК получают везикулы, то стабильность такой системы доставки будет значительно ниже, чем у b-LTP, который не формирует везикулярных структур при смешивании с миРНК; б) если сложные эфиры ВЖК используются для получения мицелл, связывание с нуклеиновой кислотой будет затрудненным по сравнению с b-LTP, а ее доступность также будет снижена.
В патенте № WO 2010142660 А2 представлены микрочастицы, которые содержат PLGA и катионный липид. Липид выступает в роли эмульгатора. Предполагается, что такие микрочастицы могут выступать в качестве системы доставки миРНК и использоваться для лечения заболеваний легких. Указанные микрочастицы уступают Ь-LTP, так как: а) высвобождение действующего вещества из микрокапсул будет происходить медленнее, чем из комплексов нуклеотида с b-LTP, в связи с чем терапевтический эффект изобретения будет развиваться дольше; б) в получении b-LTP используется меньшее число стадий, технологическая схема не предполагает получения эмульсий и малостабильных при хранении веществ, как PLGA (разрушается в водной среде); в) использование органических растворителей (хлористый метилен) для растворения PLGA повышает риск развития токсического действия, несмотря на стадию упаривания органического растворителя.
В патенте № US 20140134260 A1 представлены композиции на основе катионного липида и частиц нуклеиновая кислота/липиды, которые могут инкапсулировать нуклеиновые кислоты. Предполагается, что такие частицы могут выступать в качестве системы доставки нуклеиновых кислот. Описанные здесь липиды уступают b-LTP, так как: а) если из сложных эфиров ВЖК получают везикулы, стабильность такой системы доставки будет значительно ниже, чем у b-LTP; б) если сложные эфиры ВЖК используются для получения мицелл, связывание с нуклеиновой кислотой будет затрудненным по сравнению с b-LTP, а ее доступность также будет снижена.
В патенте № US 20130281658 A1 представлены композиции для направленной доставки нуклеиновых кислот. В качестве системы доставки используются пептиды, способные к проникновению в клетки. Предполагается, что пептиды, описанные в изобретении № US 20130281658 A1 могут выступать в качестве системы доставки нуклеиновых кислот. Перечисленные в изобретении № US 20130281658 А1 липиды уступают b-LTP, так как: а) линейные пептиды являются биодеградируемыми, обладают коротким периодом полураспада, вследствие чего такая структура может распасться, не достигнув органа-мишени, комплекс b-LTP обладает повышенной устойчивостью к ферментативному гидролизу, т.к. он не является линейным, а имеет разветвленную структуру.
В патенте № US 7879813 B2 представлены линейный полиаргининовый клеточно-проникающий пептид. Предполагается, что этот пептид может выступать в качестве системы доставки нуклеиновых кислот.Однако описанный пептид уступают b-LTP, так как: а) линейные пептиды в целом являются легко биодеградируемыми, обладают коротким периодом полураспада, вследствие чего такая структура может распасться, не достигнув органа-мишени, в то же время b-LTP обладает повышенной устойчивостью к ферментативному гидролизу за счет разветвленной структуры; б) линейные пептиды обладают повышенной токсичностью по сравнению с разветвленным b-LTP.
В изобретении RU 2609857 C1 представлена композиция катионного дендримерного пептида (LTP) и молекул миРНК, где структурная формула дендримерного пептида соответствует b-LTP. Предполагается, что комплекс LTP-миРНК может быть использован для лечения респираторных инфекций. Описанная композиция уступает пептиду b-LTP т.к.: а) массовое соотношение комплекса LTP/миРНК составляет 25/1, в то время как массовое соотношение комплекса b-LTP/миРНК составляет 12,5/1, что является экономически более целесообразным; б) пептид LTP является солью трифторуксусной кислоты, что может увеличивать риск развития токсического действия, в то же время b-LTP является основанием и не содержит потенциально токсичных противоионов.
В изобретении RU 2572575 C1 представлен катионный дендримерный пептид (LTP), структурная формула которого соответствует b-LTP. Предполагается, что катионный дендримерный пептид LTP может выступать в качестве системы доставки нуклеиновых кислот в клетки млекопитающих. Описанный пептид LTP уступает b-LTP, т.к. первый является солью трифторуксусной кислоты, что может увеличивать риск развития токсического действия, в то же время b-LTP является основанием и не содержит потенциально токсичных противоионов.
В изобретении RU 2563989 C1 представлена композиция, состоящая из катионного дендримерного пептида LTP с двумя молекулами РНК. LTP в солевой форме выступает в качестве носителя РНК, где структурная формула пептида соответствует b-LTP в щелочной форме. Предполагается использование данной композиции для подавления экспрессии гена интерлейкина-4.
Поэтому задачей данного изобретения является разработка композиции для лечения аллергического ринита на основе малых интерферирующий РНК (миРНК), подавляющих одновременно экспрессию гена IL-13 и гена IL-4, и катионного дендримерного пептида, находящегося в основной не солевой форме (b-LTP) с последовательностью (Arg)8(Lys)4(Lys)2Lys-Ala-Cys-NH2, выступающего в качестве носителя.
Для решения данной задачи были разработаны молекулы миРНК, подавляющие экспрессию гена IL-13 и гена IL-4, а также разработано средство, содержащее эффективное количество указанной смеси миРНК в сочетании с носителем для внутриклеточной доставки нуклеиновых кислот b-LTP и его использование на мышиной модели аллергического ринита.
Интраназальная композиция для лечения аллергического ринита содержит эффективное количество катионного дендримерного пептида с формулой (Arg)8(Lys)4(Lys)2Lys-Ala-Cys-NH2, находящегося в основной не солевой форме (b-LTP), выступающего в качестве носителя, и смесь молекул миРНК, подавляющих экспрессию гена IL-13 и IL-4, представленных последовательностями GGACCUGCUCUUACAUUUAtt и AAAGAUGUCUGUUACGGUCtt, соотвественно.
Техническими результатами предлагаемого способа является получение интраназальной композиции для лечения аллергического ринита на основе молекул миРНК, представленных последовательностями AAAGAUGUCUGUUACGGUCtt и GGACCUGCUCUUACAUUUAtt, что обеспечивает одновременное воздействие на два провоспалительных цитокина IL-4 и IL-13. Полученное массовое соотношение комплекса b-LTP/миРНК 12,5/1 в заявленной композиции является более целесообразным, поскольку необходимо в 2 раза меньше белка-носителя для равной по эффективности доставки одинакового количества молекул миРНК по сравнению с известным соотношением LTP/миРНК составляющим 25/1. Кроме того, использование катионного дендримерного пептида b-LTP в основной не солевой форме не содержит потенциально токсичных противоионов, что снижает риск токсического действия.
Краткое описание чертежей
Фиг. 1. Подавление активности IL-4 и IL-13 молекулами siIL4-153 и siIL 13-395.
Фиг. 2. Определение оптимального массового соотношения bLTP и нуклеиновых кислот.
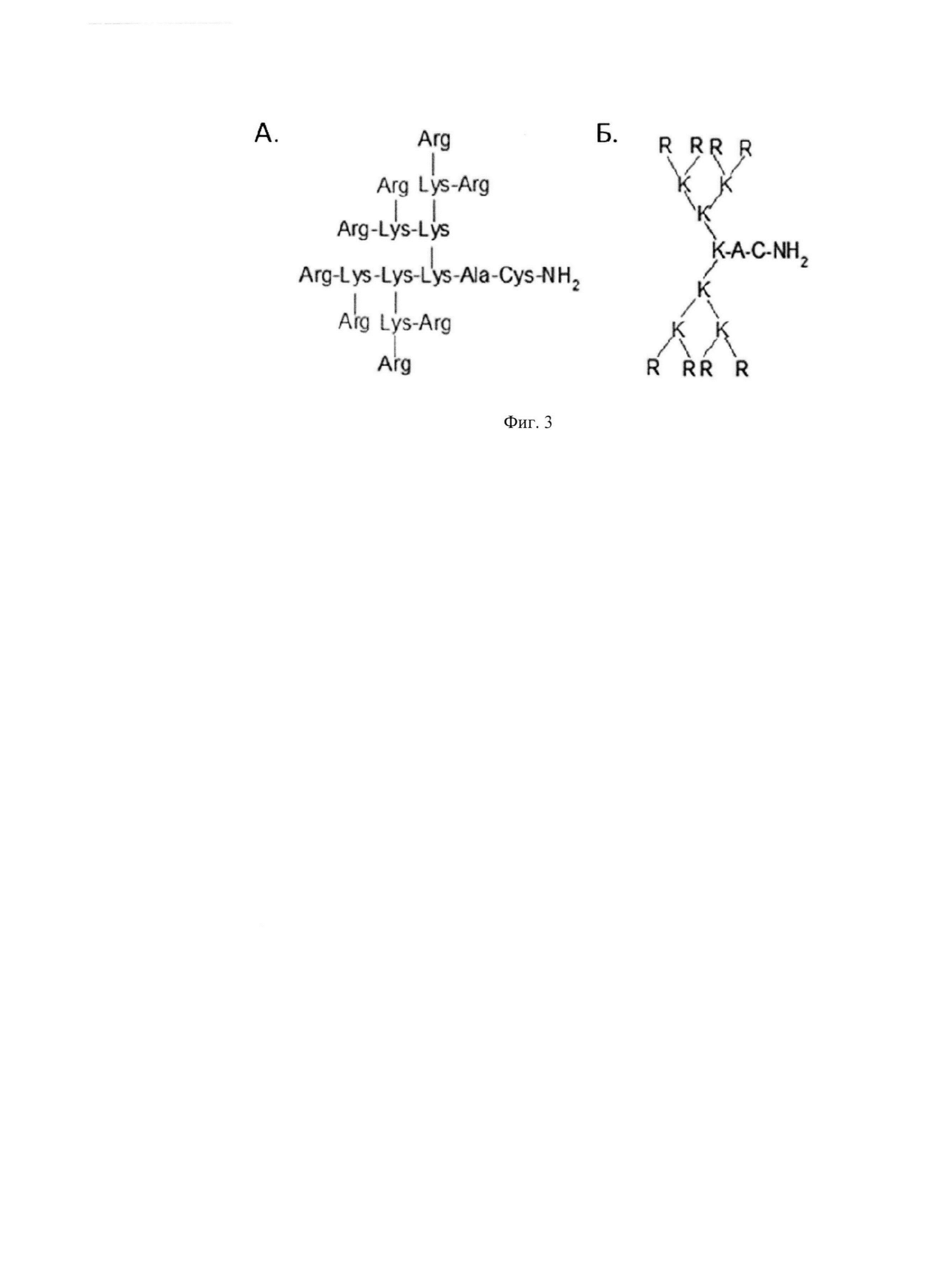
Фиг. 3. Структура катионного дендримерного пептида LTP в двух видах: А - аминокислоты представлены в трех-буквенном обозначении, Б - аминокислоты представлены в одно-буквенном обозначении, где А - аланин, К - лизин, R - аргинин, С - цистеин.
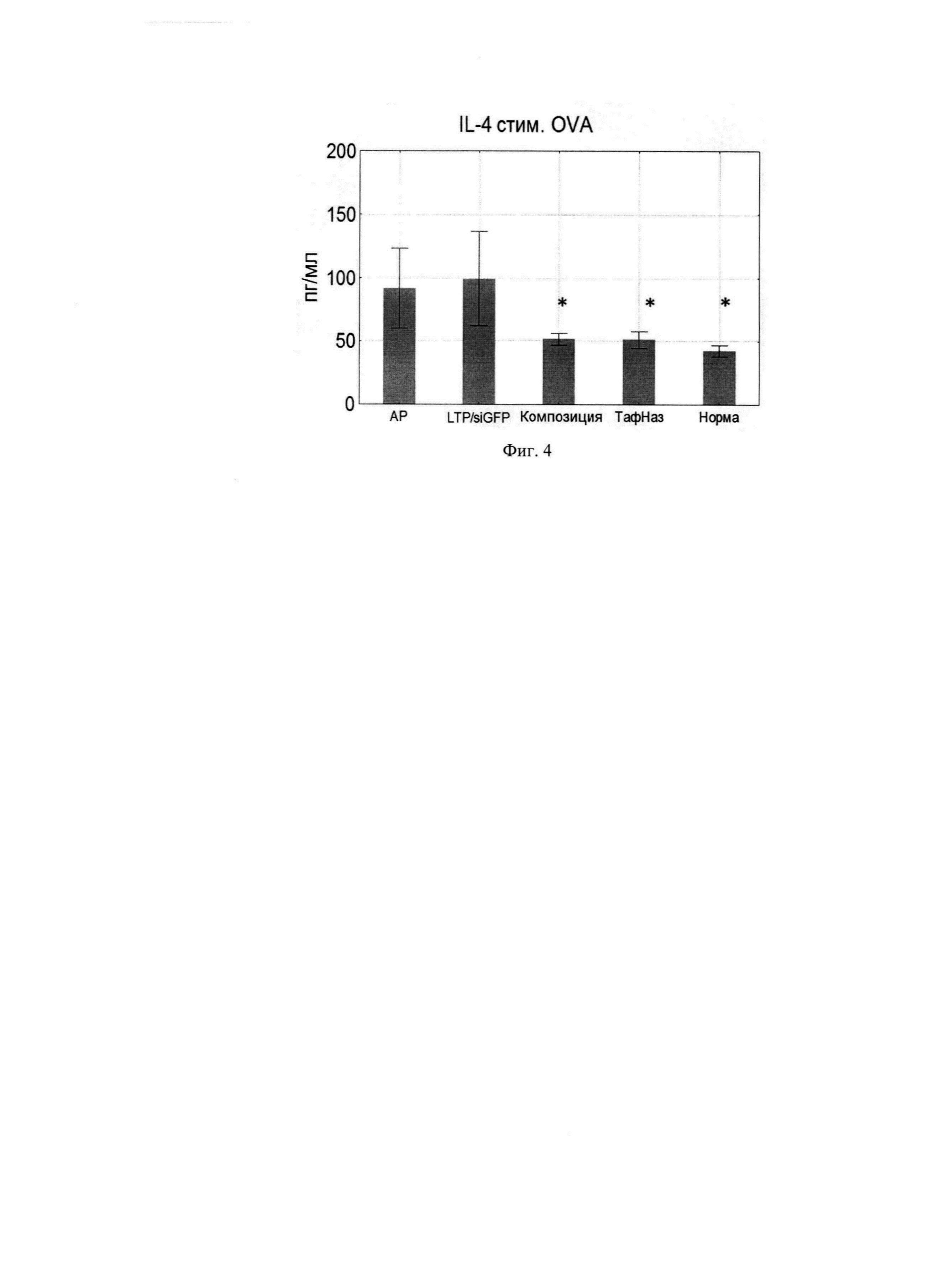
Фиг. 4. Продукция IL-4 клетками подчелюстных лимфоузлов.
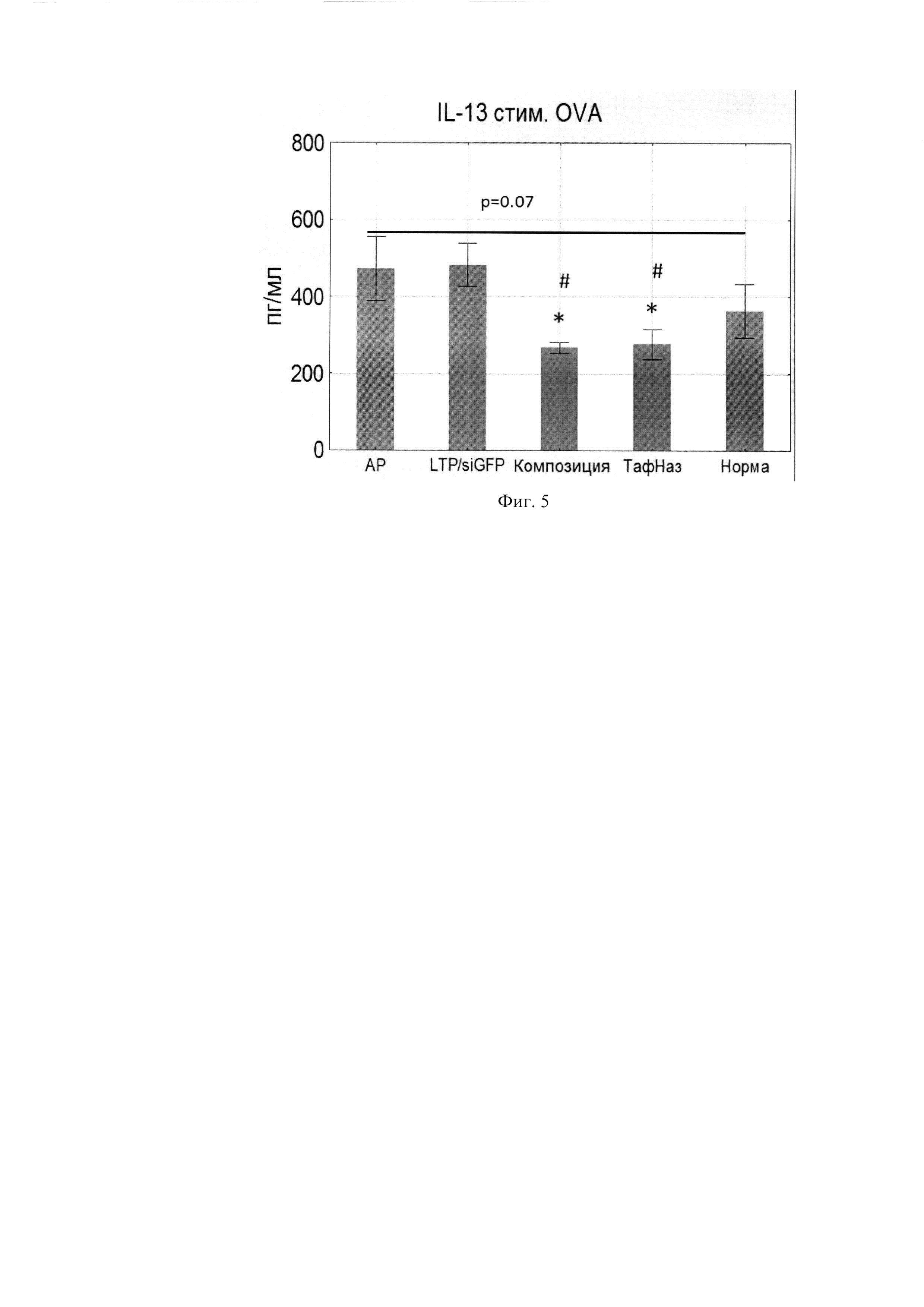
Фиг. 5. Продукция IL-13 клетками подчелюстных лимфоузлов.
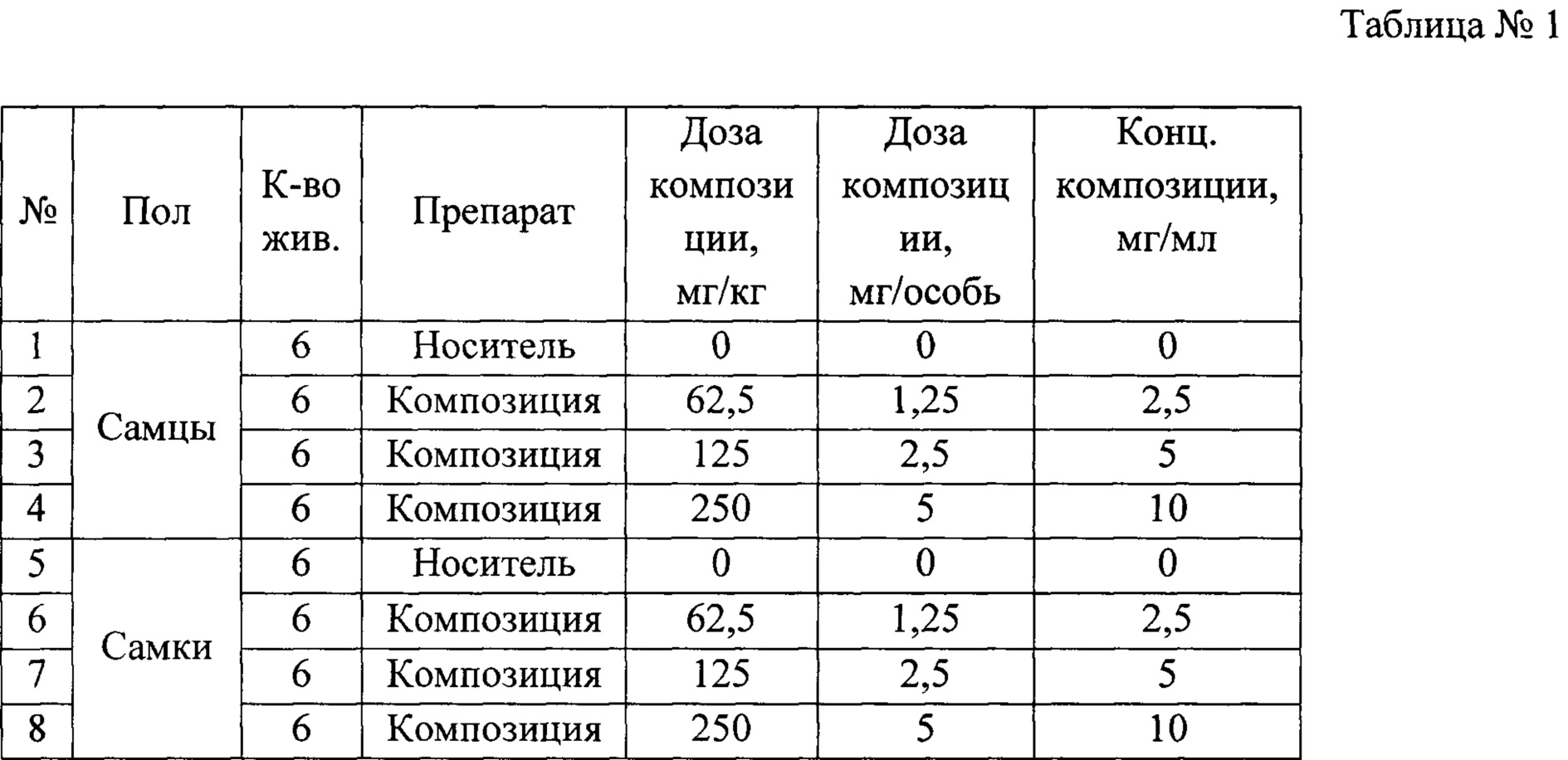
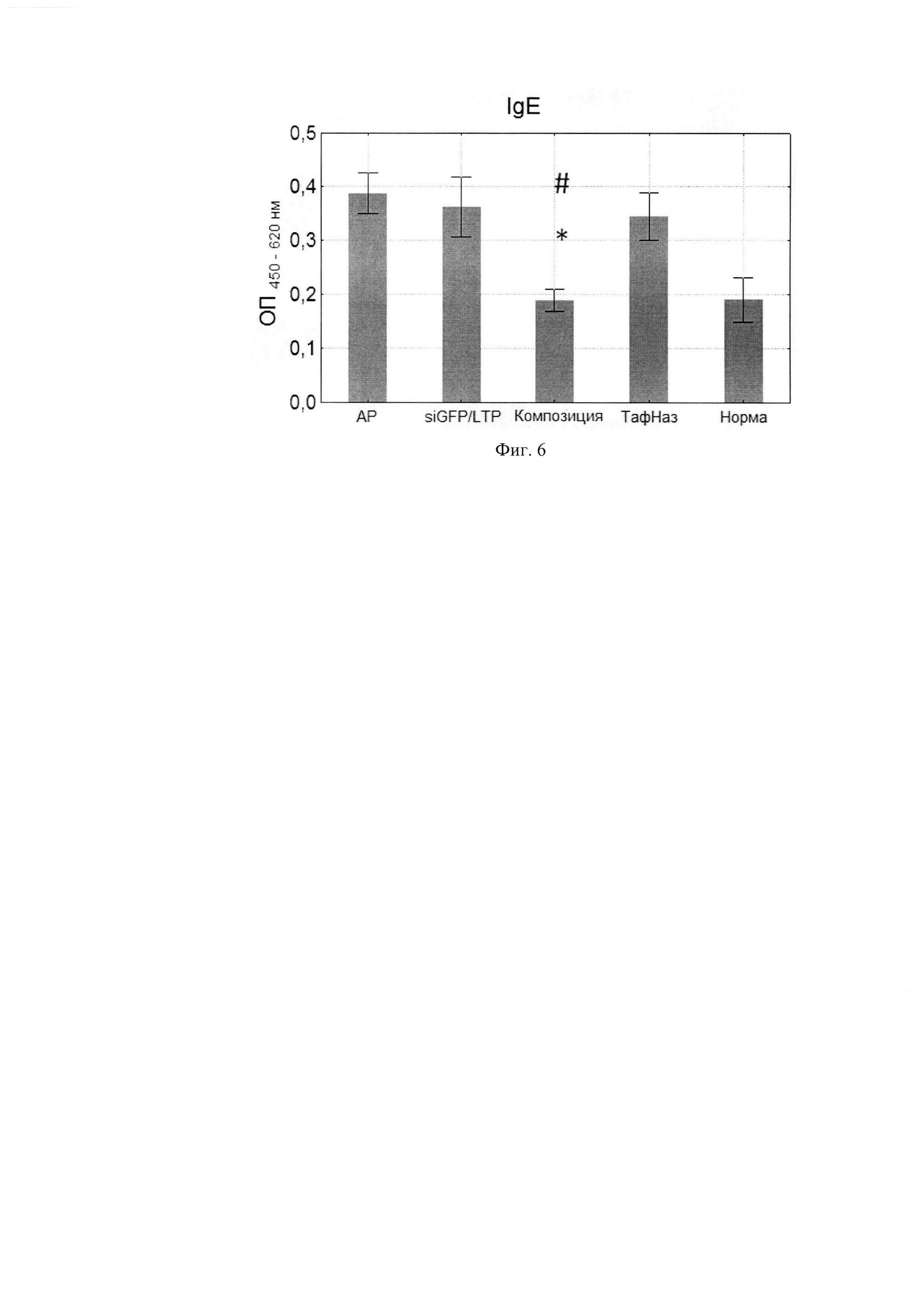
Фиг. 6. Уровни специфических IgE в сыворотке крови мышей. Фиг. 7. Уровни специфических IgG1 в сыворотке крови мышей.
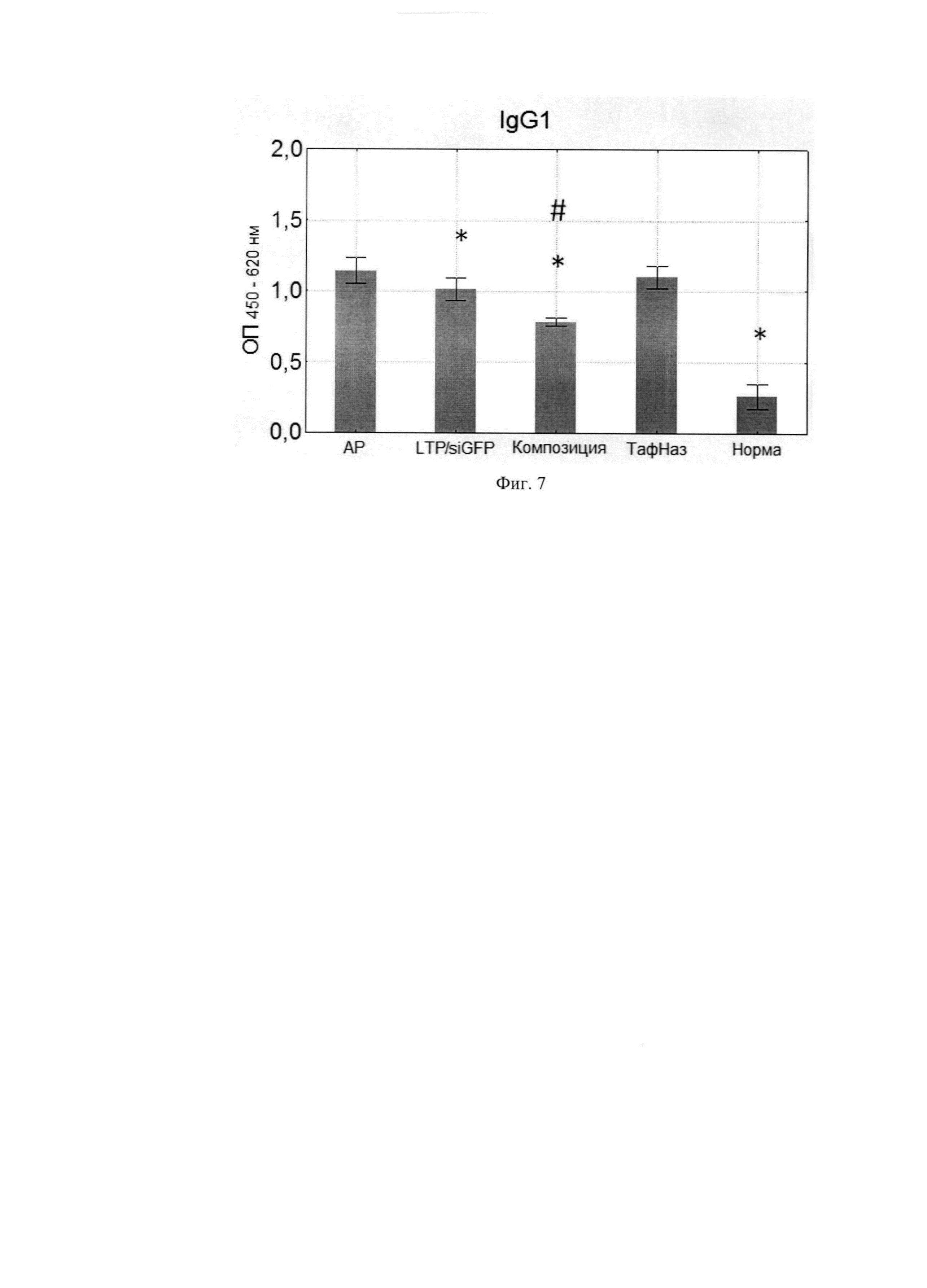
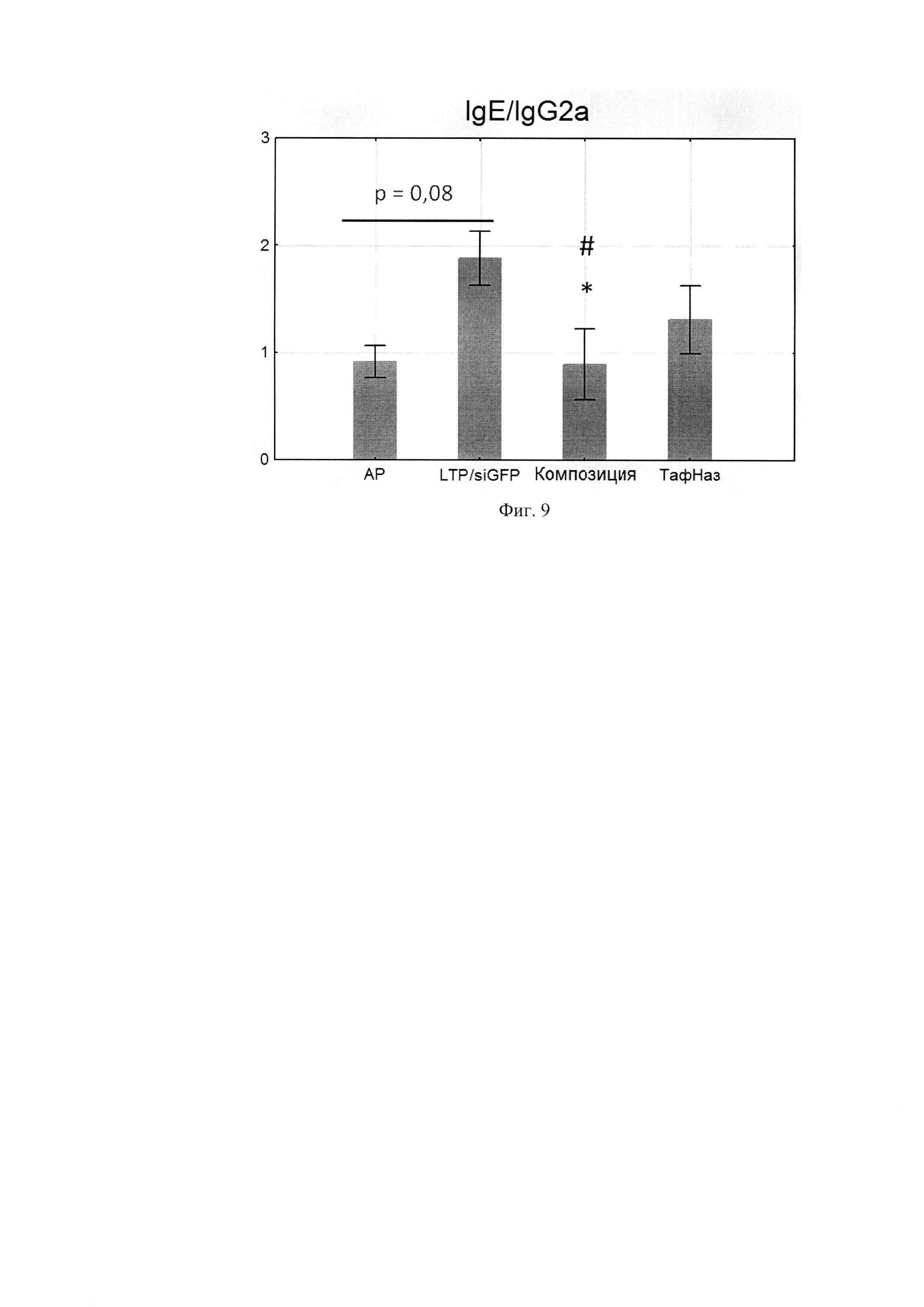
Фиг. 8. Уровни специфических IgG2a в сыворотке крови мышей. Фиг. 9. Соотношение уровней специфических IgE/IgG2a.
Фиг. 10. Соотношение уровней специфических IgGl/IgG2a.
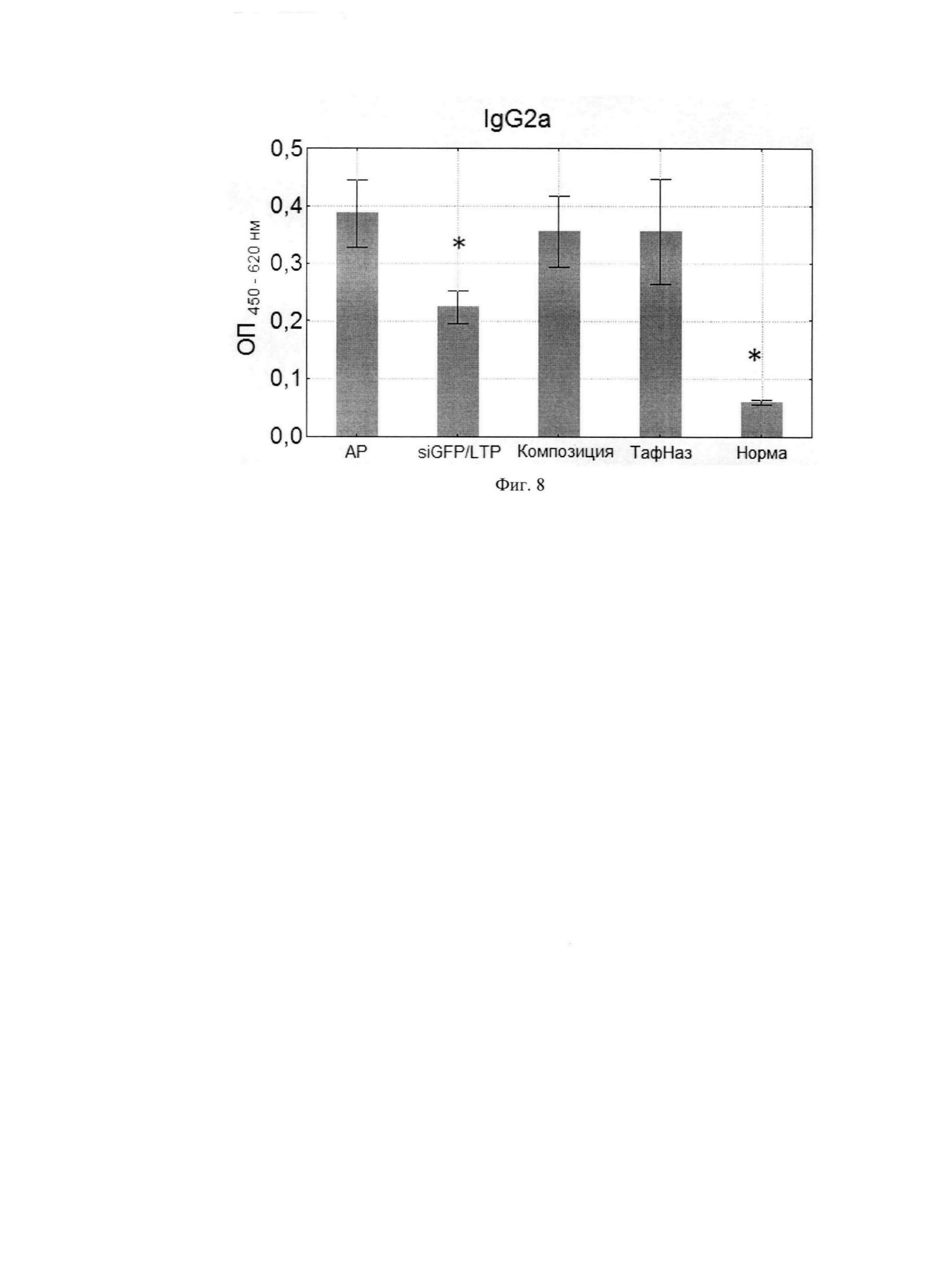
Фиг. 11. Частота чиханий мышей в разных группах в течение 5 минут после введения аллергена.
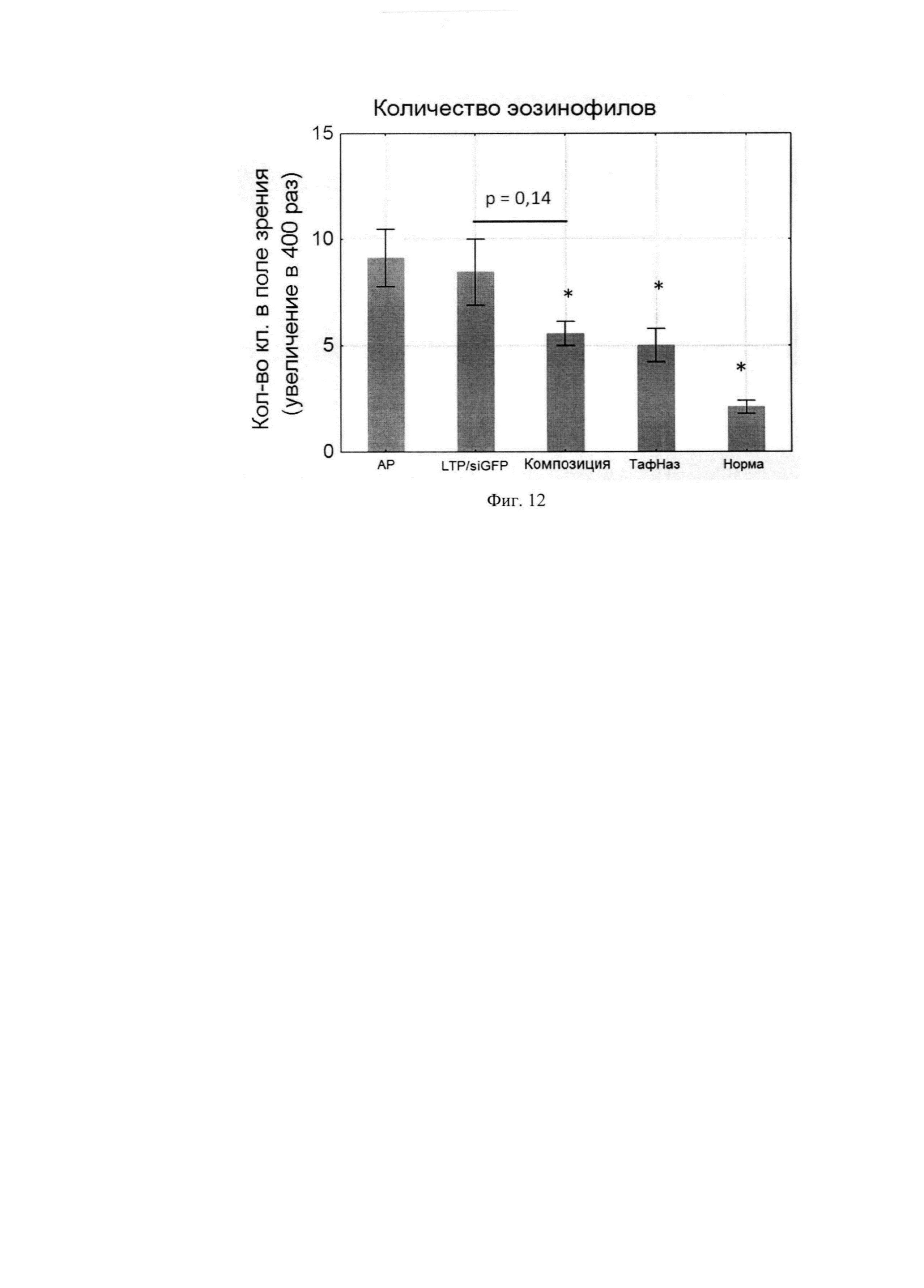
Фиг. 12. Количество эозинофилов в слизистой оболочке носа мышей разных групп.
Список сокращений
АР - аллергический ринит
АСИТ - аллерген-специфическая иммунная терапия
АП - антигистаминные препараты
БА - бронхиальная астма
БАЛ - бронхо-альвеолярный лаваж
ВЖК - высшие жирные кислоты
ГКС - глюкокортикостероиды / препараты на основе глюкокортикостероидов
ДМФА - N,N-Диметилформамид
ЛУ - лимфоузлы
миРНК - малые интерферирующие РНК
НК - нуклеиновые кислоты
ПЭГ - полиэтиленгликоль
РНК - рибонуклеиновая кислота
РНКи (RNAi) - РНК-интерференция
ТД - терапевтическая доза
AGO-белок - белок Аргонавт, каталитический компонент RISC
ARIA - Allergic Rhinitis and its Impact on Asthma - международный согласительный
CysLT1-рецепторы- лейкотриеновые рецепторы 1 типа
c-Kit - белковая тирозинкиназа
СОХ-2 - циклооксигеназа 2
ICOS - индуцибельные костимулирующие рецепторы
IgG1 - иммуноглобулин класса G, подкласс G1
IgG2a - иммуноглобулин класса G, подкласс G2a
IgE - иммуноглобулин класса Е
GM-CSF - гранулоцитарный-макрофагальный колониестимулирующий фактор
IL (4, 5, 6, 9, 10, 11, 13) - интерлейкины
IL-4Rα - рецептор к IL-4
IL-13Rα (1, 2) - рецепторы к IL-13
Lyn - тирозиновая протеинкиназа человека
MDC - цитокины макрофагального происхождения
NK-клетки - натуральные киллеры
OX40L - цитокин семейства факторов некроза опухоли, лиганд рецептора CD 134
OVA - овальбумин
PLGA - поли альфа-гидроксикислота
Rel (А, В) - транскрипционные факторы
REM фаза - фаза сна, характеризующаяся быстрым движением глаз
RISC - RNA-induced silencing complex - сайленсинговый комплекс, индуцируемый молекулами РНК
RIβ - субъединица АМФ-зависимой протеинкиназы
siGFP - миРНК против гена GFP
SLAM - сигнальнаямолекула активации лимфоцитов
STAT6 - сигнальный трансдуктер и активатор транскрипции 6 документ «Аллергический ринит и его влияние на астму»
Syk - тирозиновая киназа человека
Th1 - Т-хелперы 1 типа
Th2 - Т-хелперы 2 типа
TLR (1, 2, 3, 4, 5, 6, 7, 8, 9) - Toll-подобные рецепторы
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пример 1. Молекулы миРНК подавляют экспрессию IL-4 и IL-13 человека.
Проектирование молекул миРНК было осуществлено с помощью специального программного обеспечения OligoWalk, которое рассчитывает термодинамические параметры гибридизации РНК-олигонуклеотидов, предсказывает их свободную энергию связывания с мРНК-мишенью. С использованием программы OligoWalk было спрогнозировано более 50 различных вариантов молекул миРНК, из которых были выбраны наиболее оптимальные варианты миРНК. Выбор осуществлялся в соответствии со следующими критериями: положение участка отжига на мРНК гена-мишени (не должен находиться ближе 50 пн относительно Start-кодона гена, т.к. в данном участке мРНК-мишени инициируется трансляция, которая сопряжена с привлечением различных инициирующих белковых факторов, что снижает пространственную доступность данного участка для молекул миРНК, и как следствие понижает их активность. Кроме того, следовало избегать повторяющихся более 4 раз нуклеотидов таких как «АААА» и «GGGG». Последовательность миРНК не должна быть идентичной последовательностям других генов в геноме человека. В итоге были спроектированы следующие варианты миРНК против гена IL-4 (siIL4-153 состава SEQUENCE 1: AAAGAUGUCUGUUACGGUCtt) и IL-13 (siIL13-395 состава SEQUENCE 2: GGACCUGCUCUUACAUUUAtt).
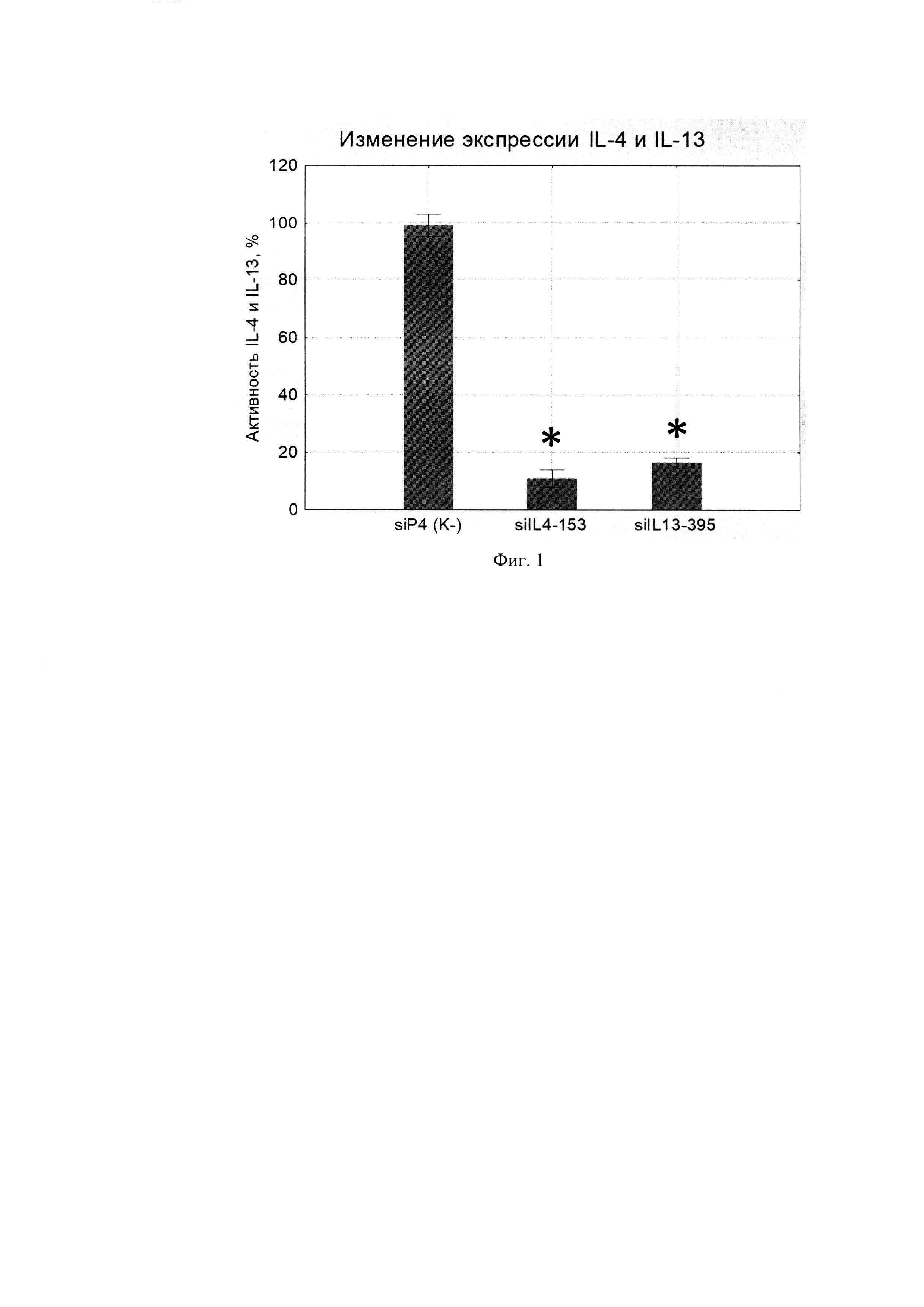
Для тестирования спроектированных молекул миРНК, в экспериментах in vitro была создана экзогенная модель экспрессии этого гена в хорошо трансфецируемых клетках 293Т. Эффективность спроектированных молекул миРНК была оценена с использованием данной модели различными методами. Для этого 1×105 клеток 293Т трансфецировали смесью, состоящей из 0,5 мкг плазмиды pUCHR IL13 IRES GFP или pUCHR IL4 IRES GFP, экспрессирующей IL-13 или IL-4 и 1 мкг соответствующей миРНК. В качестве отрицательного контроля ко-трасфецировали неспецифическую молекулу миРНК (siP4), не имеющую сходства с генами IL-4 и IL-13. Сутки после ко-трансфекции методом ИФА определяли концентрацию IL-4 и IL-13 супернатантах. Концентрацию IL-4 и IL-13 в супернатантах клеток, трасфецированных siP4 принимали за 100% и относительно этого значения выражали активность IL-4 и IL-13. Как оказалось, созданные варианты приводили к заметному активности IL-4 и IL-13 (Фиг. 1).
Пример 2. Обоснование состава композиции.
В качестве носителя для молекул миРНК был использован пептид b-LTP со структурной формулой (Arg)8(Lys)4(Lys)2LysAlaCys-NH2. Для установления оптимального количества b-LTP в составе композиции проведены исследования. Для этого культуру клеток HEK293T засевали в 48-луночный плейт в полной среде DMEM, которая содержит 10% эмбриональной телячий сыворотки (ЭТС), 300 мг/л Глутамина-L и 60 мг/мл Гентамицина в количестве 80 тыс.клеток на лунку в объеме 300 мкл полной среды DMEM и культивируют при 37С в 5% атмосфере СО2 до образования монослоя 75% конфлуентности (1 сутки).
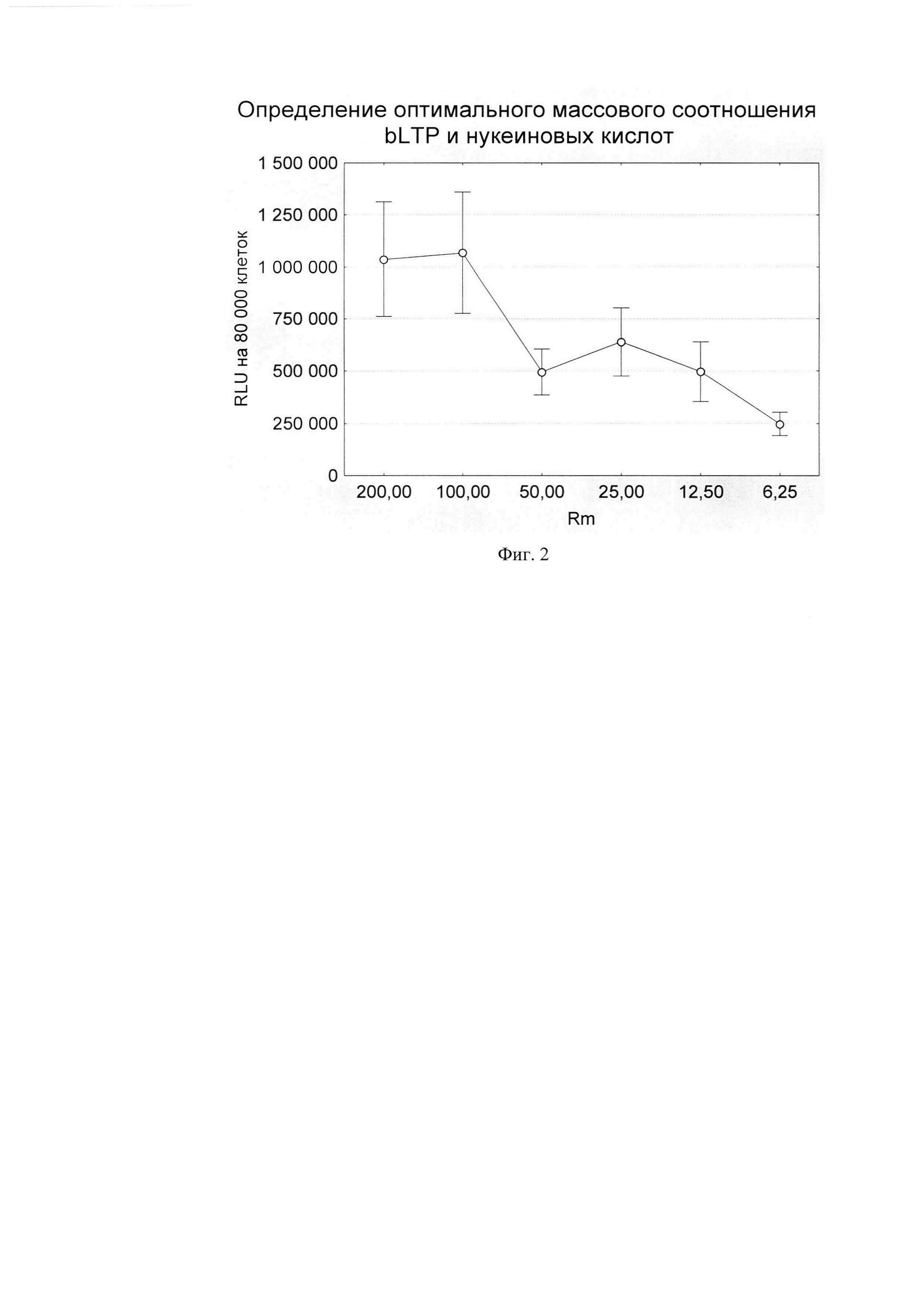
Комплекс pGL3 (несет репортерный ген люциферазы) и b-LTP готовился среде optiMEM (Gibco) не содержащей ЭТС и антибиотиков. Для этого b-LTP в различных массовый соотношениях по отношению к плазмиде pGL3 смешивали в 80 мкл optiMEM, смесь инкубировали при комнатной температуре в течение 25-30 минут и вносили к клеткам в лунки 48-луночного плейта по каплям и инкубировали при 37С в 5% атмосфере CO2 в течение 2 суток. После инкубации клеток с комплексом надосадочную среду удаляли из лунок плейта, а монослой клеток лизировали в 60 мкл специального буфера Luciferase Cell Culture Lysis Reagent (Promega). Лизат клеток переносили в отдельные пробирки на 1,5 мл и центрифугировали, и осуществляли цикл замораживания оттаивания для лучшего лизиса клеток; замораживание проводили в течение ночи при -70С, а оттаивание в течение 10-15 мин при 37С в твердотельном термостате/ Далее лизаты клеток вортексировали и центрифугировали при 10000 об/мин при 4С в течение 2 минут для удаления клеточного дебриза. Надосадок переносили в отдельные пробирки на 1,5 мл и проводили измерение люциферазной активности каждого образца путем смешивания 50 мкл лизата с 50 мкл люциферина - субстрата для люфиферазы. При наличии в образце фермента люциферазы происходит излучение света, интенсивность которого детектировалось люминометром (Promega). Оптимальное соотношение Rm (массовое соотношение b-LTP и плазмиды pGL3) при трансфекции клеток HEK293T составило 12,5/1 по массе (Фиг. 2 Условные обозначения рисунка: Rm - массовое соотношение b-LTP и плазмиды pGL3; pGL3 - плазмида кодирующая ген люциферазы luc; RLU - относительные световые единицы (relative light units)).
Таким образом, оптимальная композиция для подавление экспрессии генов IL-4 и IL-13 состоит из двух компонентов: 1) молекулы малых интерферирующих РНК (миРНК), направленных против генов IL-4 и IL-13 (siIL4-153 и siIL13-395); 2) Средство для внутриклеточной доставки нуклеиновых кислот в клетки млекопитающих - катионный дендримерный пептид b-LTP в основной (не солевой) форме, при этом он содержит 8 остатков аргинина, 7 остатков лизина, аланин и цистеин со структурной формулой (Arg)8(Lys)4(Lys)2LysAlaCys-NH2. (Фиг. 3 Условные обозначения рисунка: А - аланин, К - лизин, R - аргинин, С - цистеин). Массовое соотношение b-LTP/миРНК (смесь из siIL4-153 и siIL13-395)=12,5/1 (0,5 siIL4-153 и 0,5 siIL13-395, соответственно). Растворы обоих компонентов приготовлены в фосфатно-солевом буфере (1 мг/мл).
Пример 3. Композиция из пептида b-LTP и миРНК против IL-4 и IL-13 является малотоксичным соединением
В данном исследовании в качестве тест-системы были использованы мыши (CBA*C57B1)F1, которые являются стандартным объектом для исследований токсичности лекарственных средств. Композиция из пептида и миРНК против IL-4 и IL-13 вводилась мышам внутрибрюшинно в трех дозах: 250, 125 и 62,5 мг/кг, т.е. 5, 2,5 и 1,25 мг/мышь. Композицию вводили внутрибрюшинно мышам, т.к. данный способ обеспечивает максимальную биодоступность. Максимальная доза (5 мг/мышь) лимитирована растворимостью тестируемого объекта (10 мг/мл) и максимально допустимым объемом для подкожного введения мышам (0,5 мл/особь). Тестируемый препарат и носитель в заданных дозах были введены животным внутрибрюшинно однократно в соответствии со схемой эксперимента, представленной в таблице 1 (* - с учетом коэффициента пересчета доз). Период наблюдения после введения препарата составлял 14 суток. Некропсия и патоморфологический анализ проводились на 15-е сутки. В дни 0, 1, 2, 3, 4, 7 и 14 оценивали массу животных.
В первые часы после введения композиции у мышей наблюдалось снижение активности, взъерошенность шерстного покрова, но при этом гибели животных не было. В течение первых суток отмечена гибель 5-ти из 6-ти животных в группе с максимальной дозой у самцов и по 2 и 1 животному в группах 125 и 250 мг/кг (табл. 2). С учетом полученных данных о выживаемости, максимальной переносимой дозой для самцов является 125 мг/кг, а для самок 62,5 мкг/кг. Посчитаны летальные дозы; для самцов ЛД83 составила 250 мг/кг, а для самок ЛД34 составила 150 мг/кг.
Изучена динамика относительной массы тела у экспериментальных животных. Масса тела мышей в день 0 принята за 100%. Мыши, получавшие буфер, демонстрировали прирост массы тела на 3-10%. Было выявлено статистически значимое снижение относительной массы тела у самцов и самок, в группе получавшей 250 мг/кг в 1-й и 3-й дни эксперимента (таб. 3 * - статистически значимо отличается от группы животных, получавших буфер). В последующие дни наблюдений (с 4 по 14 дни) масса тела подопытных животных, получавших ЛС, восстанавливалась до значений сопоставимых с мышами, получавшими буфер (таб. 3). Это свидетельствует о процессе интоксикации первые 4 дня после введения препарата и об обратимости этой интоксикации. В группе самцов, получавших максимальную дозу, происходила гибель 5-ти мышей из 6-ти, ввиду чего статистический анализ был невозможен; стоит отметить, что выжившее животное к дню 4 потеряло до 20% массы тела, а к дню 14 произошло восстановление массы тела на 9%, что свидетельствует о интоксикации организма. Животные, получавшие минимальную дозу, не демонстрировали статистически значимых изменений массы тела. При этом животные, получавшие композицию в дозе 125 мг/кг, демонстрировали признаки интоксикации в первые 3 дня после введения композиции, которые были обратимы.
Таким образом, установлено, что максимальной переносимой дозой для самцов является 125 мг/кг, для самок - 62,5 мкг/кг, а значения ЛД50 препарата для мышей (CBA*C57B1)F1 обоего пола находится в диапазоне доз 125 мг/кг - 250 мг/кг; для самцов ЛД83 составила 250 мг/кг, а для самок ЛД34 составила 150 мг/кг, что позволяет отнести композицию, состоящую из пептида b-LTP и миРНК против IL-4 и IL-13 к классу малотоксичных веществ (классификация по К.К. Сидорову 1977). У мышей (как самок, так и самцов), получавших композицию в минимальной дозе 62,5 мг/кг, не отмечалось признаков интоксикации, выражавшихся в падении массы тела.
Пример 4. Композиция подавляет признаки аллергического ринита у мышей
Для изучения биологической активности композиции использовали модель АР у мышей-самок линии BALB/c, которых трехкратно подкожно сенсибилизировали OVA 20 мкг/мышь, 0,2 мл/мышь на 0, 14 и 28 дни после начала эксперимента. Далее произвели (начиная с 42 дня с начала эксперимента) недельную провокацию OVA 25 мкг/мышь, 10 мг/мл для проявления признаков развившейся у мышей патологии. Затем в течение недели проводили терапию композицией по следующей схеме: двукратно интраназально (и.н.) вводили препарат за 0,5-1 час до и после и.н. введения аллергена (25 мкл из р-ра 50 мг/мл OVA). В качестве отрицательного контроля использовали комплекс неспецифических молекул миРНК (siGFP) и носителя - b-LTP. В качестве положительного контроля использовали коммерческий препарат Тафен Назаль на основе глюкокортикостеройдов. Дозы и режимы введения представлены в таблице 4.
Поскольку композиция направлена против генов IL-4 и IL-13 было исследовано изменение продукции данных цитокинов клетками подчелюстных ЛУ, стимулированных OVA. Композиция оказывала эффект снижения уровней IL-4 и IL-13, сопоставимо эффекту Тафен Назаль (Фиг. 4, 5).
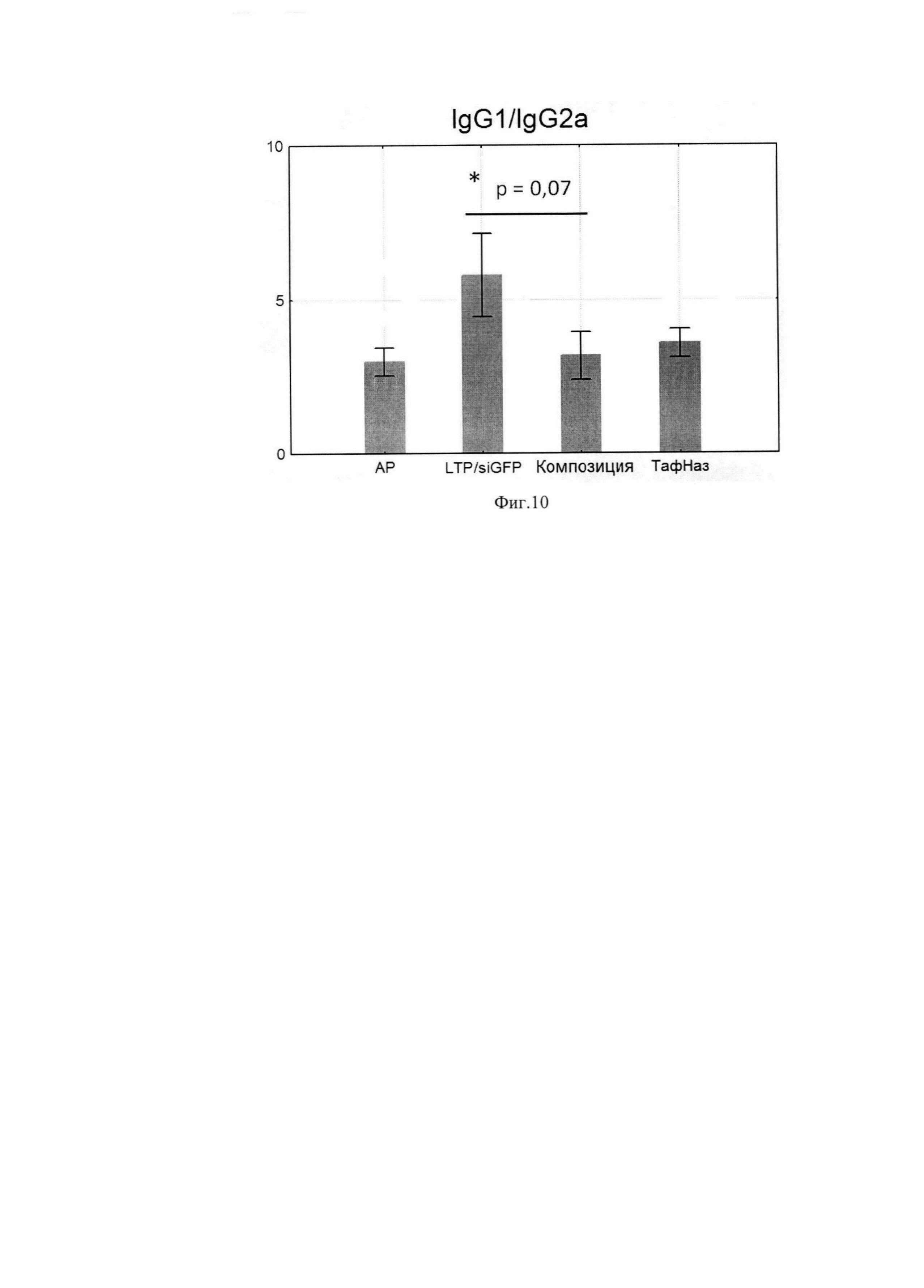
По данным научной литературы известно, что IL-4 и -13 ответственны за синтез IgE и IgG1, которые являются проаллергическими иммуноглобулинами, a IgG2a -протективным субклассом, поэтому были проанализированы уровни специфических иммуноглобулинов в сыворотке крови мышей после курса терапии. Композиция статистически значимо снижала IgE и IgG1-ответ по сравнению с группой, отрицательного контроля при этом не влияя на IgG2a. (Фиг. 6, 7, 8) Расчет индекса показал, что он снижался, а это говорит о профилировании ответа в сторону Th-1-типа после курса терапии композицией (Фиг. 9, 10).
Полученные нами данные говорят, что частота чиханий в группе, которой вводили композицию, в 3 раза ниже, чем в группе с АР, и в 2 раза ниже, чем в группе, получавшей неспецифические миРНК. Значения для группы «Композиция» сопоставимы с таковыми в положительном контроле (Тафен Назаль) (Фиг. И).
В результате терапии сенсибилизированных мышей происходила инфильтрация слизистой оболочки носа эозинофилами. Количество данных иммунных клеток в псевдо-леченой группе сопоставимо с количеством их в группе с АР. В группах, получавших терапию композицией и Тафен Назалем, количество эозинофилов снижалось в среднем на 30%. При этом степень инфильтрации эозинофилов у мышей после курса композиции и Тафен Назаль была сопоставима (Фиг. 12).
Таким образом, полученная интраназальной композиции для лечения аллергического ринита на основе молекул миРНК, представленных последовательностями AAAGAUGUCUGUUACGGUCtt и GGACCUGCUCUUACAUUUAtt, обеспечивает одновременное воздействие на два провоспалительных цитокина IL-4 и IL-13. Полученное массовое соотношение комплекса b-LTP/миРНК 12,5/1 в заявленной композиции является более целесообразным, поскольку необходимо в 2 раза меньше белка-носителя для равной по эффективности доставки одинакового количества молекул миРНК по сравнению с известным соотношением LTP/миРНК составляющим 25/1. Кроме того, показано, что использование катионного дендримерного пептида b-LTP в основной не солевой форме не содержит потенциально токсичных противоионов, снижая риск токсического действия.
Список литературы
1. М. и др. Allergen-specific immunotherapy: Update on immunological mechanisms // Allergol. Immunopathol. (Madr). 2013. T. 41. №4. C. 265-272.
М. и др. Allergen-specific immunotherapy: Update on immunological mechanisms // Allergol. Immunopathol. (Madr). 2013. T. 41. №4. C. 265-272.
2. Bidad K., Nicknam M.H., Farid R. A review of allergy and allergen specific immunotherapy // Iran. J. Allergy, Asthma Immunol. 2011. T. 10. №1. C. 1-9.
3. Focke-Tejkl M., Valenta R. Safety of engineered allergen-specific immunotherapy vaccines. // Curr. Opin. Allergy Clin. Immunol. 2012. T. 12. №5. C. 555-63.
4. Gour N., Wills-Karp M. IL-4 and IL-13 signaling in allergic airway disease // Cytokine. 2015. T. 75. №1. C. 68-78.
5. Greiwe J.C., Bernstein J.A. Combination therapy in allergic rhinitis: What works and what does not work // Am. J. Rhinol. Allergy. 2016. T. 30. №6. C. 391-396.
6. Hosoya K. и др. Gene silencing of STAT6 with siRNA ameliorates contact hypersensitivity and allergic rhinitis. // Allergy. 2011. T. 66. №1. C. 124-31.
7. Joo M.K. и др. The potential and advances in RNAi therapy: Chemical and structural modifications of siRNA molecules and use of biocompatible nanocarriers // J. Control. Release. 2014. T. 193. C. 113-121.
8. Juel-Berg N. и др. Intranasal corticosteroids compared with oral antihistamines in allergic rhinitis: A systematic review and metaanalysis // Am. J. Rhinol. Allergy. 2017. T. 31. №1. C. e19-e28.
9. Kakli H.A., Riley T.D. Allergic Rhinitis // Prim. Care - Clin. Off. Pract. 2016. T. 43. №3. C. 465-475.
10. Kim S.H. и др. Long-term Effects of Specific Allergen Immunotherapy Against House Dust Mites in Polysensitized Patients With Allergic Rhinitis // Allergy Asthma Immunol Res. 2014. T. 6. №6. C. 535-540.
11. Melvin T.A.N., Patel A.A. Pharmacotherapy for Allergic Rhinitis // Otolaryngol. Clin. North Am. 2011. T. 44. №3. C. 727-739.
12. Narkus А. и др. The placebo effect in allergen-specific immunotherapy trials. // Clin. Transl. Allergy. 2013. T. 3. №1. C. 42.
13. Passalacqua G., Canonica G.W., Bagnasco D. Benefit of SLIT and SCIT for Allergic Rhinitis and Asthma // Curr. Allergy Asthma Rep.2016. T. 16. №12.
14. Protudjer J.L.P. и др. Household costs associated with objectively diagnosed allergy to staple foods in children and adolescents // J. Allergy Clin. Immunol. Pract. 2015. T. 3. №1. C. 68-75.
15. Ranasinghe С. и др. Cytokine & Growth Factor Reviews IL-4 and IL-13 receptors: Roles in immunity and powerful vaccine adjuvants // Cytokine Growth Factor Rev. 2014. T. 25. №4. C. 437-442.
16. Ring J., Gutermuth J. 100 years of hyposensitization: History of allergen-specific immunotherapy (ASIT) // Allergy. 2011. T. 66. №6. C. 713-724.
17. Simoens S., Laekeman G. Pharmacotherapy of allergic rhinitis: A pharmaco-economic approach // Allergy Eur. J. Allergy Clin. Immunol. 2009. T. 64. №1. C. 85-95.
18. Stelmaszczyk-Emmel А. и др. Th1, Th2, Th17, and regulatory cytokines in children with different clinical forms of allergy // Adv. Exp. Med. Biol. 2013. T. 788. C. 321-328.
19. Tjota M.Y., Sperling A.I. Distinct dendritic cell subsets actively induce Th2 polarization // Curr. Opin. Immunol. 2014. T. 31. C. 44-50.
20. Хаитов M.P. Биобезопасность и интерференция РНК. Москва:, 2012. Вып. ОП ПИК "ВИ. 328 с.