Результат интеллектуальной деятельности: ОПИСАНИЕ СПОСОБА КУЛЬТИВИРОВАНИЯ ЖИВОТНОЙ КЛЕТКИ
Вид РИД
Изобретение
Область техники
Данное открытие относится к способу культивирования для модулирования гетерогенности целевого белка, при этом белок приготовлен культивированием животных клеток, которые вырабатывают белок, и к способу приготовления целевого белка с использованием того же способа. Более конкретно, данное открытие относится к способу приготовления целевого белка культивированием клеток, которые вырабатывают белок, где культивирование выполняется при нормальной температуре культивирования в течение некоторого периода и затем культивирование продолжается при температуре культивирования, сниженной до 25-35°C.
Предшествующий уровень техники
В случаях, когда животные клетки культивируются для того, чтобы добиться получения нативного белка, вырабатываемого клетками, или если целевой белок или ему подобный приготовлен культивированием животных клеток, в которые был введен ген, кодирующий белок, трудность заключалась в том, как модулировать в указанном нативном белке или целевом белке уровень гетерогенности компонентов, такой как зарядовая гетерогенность (кислотные пики, основные пики), и ассоциированной формы, которая, как правило, формируется из-за различий в дезамидированной форме, форме с замещенной или делетированной аминокислотой и структуре сахарной цепи.
В последние годы имеют место опасения по поводу проблем, таких как иммуногенность, и для того чтобы обеспечить безопасность и избежать осложнений на этапах выделения и очистки, существует необходимость в развитии клеточного способа культивирования, который модулирует уровень таких гетерогенных компонентов настолько, насколько это возможно.
Традиционно, развиваются различные способы культивирования животных клеток для решения вышеупомянутых проблем. Если быть точнее, были разработаны способы для снижения выработки белков в неправильно свернутой или агрегированной форме культивированием клеток при низкой температуре 27-30°C или низком pH (Патентный документ 1: WO 2008/131374) или добавлением меди и/или глутамата (Патентный документ 2: WO 2008/109410). Однако не имелось сообщений о способе контролирования зарядовой гетерогенности.
В качестве способа культивирования, посредством которого температура культивирования снижается до низкой температуры во время культивирования клеток CHO, был раскрыт способ, посредством которого количество выработанного белка, представляющего интерес, увеличено с использованием клеток CHO, которые обладают особенными характеристиками и которые проявляют повышение продуктивности представляющего интерес белка в расчете на клетку при низкой температуре (Патентный документ 3: JP H09-75077). Однако не было никаких предположений о модуляции гетерогенности представляющего интерес белка (предпочтительно, антитела), в частности зарядовой гетерогенности антитела, смещением температуры культивирования в сторону низкой температуры.
Цитированные источники
Патентные документы
Патентный документ 1: Международная патентная заявка № WO 2008/131374
Патентный документ 2: Международная патентная заявка № WO 2008/109410
Патентный документ 3: Японская нерассмотренная публикация патентной заявки № 09-075077
Сущность изобретения
Техническая задача
Задача данного открытия заключается в модулировании гетерогенности целевого белка, которая генернируется, при этом белок приготовлен культивированием животных клеток, которые вырабатывают белок.
Решение задачи
Авторы данного открытия приложили значительные усилия для того, чтобы решить вышеупомянутые задачи и, в качестве результата, обнаружили, что гетерогенность целевого белка может быть модулирована регулированием температурных условий для культивирования клеток. В частности, изобретатели обнаружили, что гетерогенность целевого белка может быть модулирована выполнением культивирования при нормальной температуре культивирования в течение некоторого периода и затем продолжением культивирования при сниженной температуре культивирования, и выполнили данное открытие на основе вышеупомянутого обнаружения.
Более конкретно, данное открытие относится к следующему:
(1) способ модулирования уровня гетерогенности компонентов целевого белка, при этом белок приготовлен культивированием животной клетки, которая вырабатывает белок для того, чтобы привести к тому, чтобы белок был выработан, где культивирование выполняется при нормальной температуре культивирования (36-38°C) в течение некоторого периода и затем культивирование продолжается при температуре культивирования, сниженной до 25-35°C;
(2) способ, как установлено в (1), где животная клетка является клеткой, имеющей такое свойство, что продуктивность целевого белка в расчете на клетку не возрастает или не снижается при более низкой температуре, чем нормальная температура культивирования (36-38°C);
(3) способ, как установлено выше, где модуляция уровня гетерогенности компонентов целевого белка включает в себя снижение уровня кислотных пиков;
(4) способ, как установлено выше, где культивирование выполняется при нормальной температуре культивирования до от 3 до 7 дней после даты начала культивирования и затем температура культивирования снижается;
(5) способ, как установлено выше, где культивирование выполняется при температуре 36-38°C в течение некоторого периода и затем культивирование продолжается при температуре культивирования, сниженной до 32-35°C;
(6) способ, как установлено выше, где клетка культивируется порционным культивированием, повторяемым порционным культивированием, подпитываемым порционным культивированием, повторяемым подпитываемым порционным культивированием, непрерывным культивированием или перфузионным культивированием;
(7) способ, как установлено выше, где животная клетка культивируется подпитываемым порционным культивированием;
(8) способ, как установлено выше, где животная клетка является клеткой, в которую был введен ген, кодирующий целевой белок;
(9) способ, как установлено выше, где целевой белок является антителом;
(10) способ, как установлено выше, где животная клетка является клеткой млекопитающего;
(11) способ, как установлено в (10), где клетка млекопитающего является клеткой CHO;
(12) способ, как установлено в (11), где клетка CHO выбрана из клеточных линий DG44, DXB-11, K-l и CHO-S;
(13) способ выработки целевого белка, где белок приготовлен культивированием клетки, которая вырабатывает белок с использованием способа, как установлено выше;
(14) способ, как установлено в (13), содержащий этап выращивания белка из культурального раствора после того, как была культивирована клетка, которая вырабатывает целевой белок;
(15) способ приготовления лекарственного препарата, содержащий белок, приготовленный способом, как установлено выше, в качестве активного ингредиента; и
(16) способ, как установлено выше, где целевой белок является анти-глипикан 3 антителом или анти-IL-31RA антителом.
Полезные эффекты изобретения
Данное открытие может быть очень выгодно использовано в выработке биологически активных пептидов или белков. Данное изобретение характеризуется тем, что оно может модулировать гетерогенность целевого белка, которая встречается, когда белок приготовлен культивированием животных клеток, которые вырабатывают белок. Таким образом, изобретение обладает большим потенциалом для выработки более гомогенных белков, упрощает этапы выделения и очистки и является преимущественным для промышленного производства. В частности, изобретение, как правило, может вносить значительный вклад в массовое обеспечение фармацевтическими антителами и тому подобное.
Краткое описание чертежей
Фиг. 1 демонстрирует результаты примера (Пример 1), рассматривающего снижение кислотных пиков антитела посредством температурного сдвига.
Фиг. 2 демонстрирует результаты примера (Пример 2), рассматривающего снижение кислотных пиков антитела посредством температурного сдвига.
Фиг. 3 демонстрирует результаты примера (Пример 3), рассматривающего снижение кислотных пиков антитела посредством температурного сдвига.
Описание вариантов осуществления
Варианты осуществления данного открытия далее будут описаны более подробно.
Способ в соответствии с данным открытием характеризуется модулированием уровня гетерогенности компонентов целевого белка, при этом белок приготовлен культивированием животной клетки, которая вырабатывает белок. В частности, разработанный способ характеризуется способом приготовления белка культивированием животной клетки, которая вырабатывает белок, где культивирование выполняется при нормальной температуре культивирования в течение некоторого периода и затем культивирование продолжается при температуре культивирования, сниженной до 25-35°C.
В одном аспекте данного изобретения в соответствии со способом культивирования по данному изобретению животная клетка является клеткой, имеющей такое свойство, что продуктивность целевого белка в расчете на клетку не возрастает или не снижается при более низкой температуре, чем нормальная температура культивирования (36-38°C).
Для целей данного описания выполнение культивирования при нормальной температуре культивирования в течение некоторого периода и затем продолжение культивирования при сниженной температуре культивирования называется "смещение температуры культивирования" или "температурный сдвиг". Нормальная температура культивирования часто лежит в пределах 36-38°C, что пригодно для роста полученных из гомеотермов клеток, и наиболее часто составляет 37°C. Сниженная температура культивирования называется "смещенная температура". Смещенная температура ниже, чем нормальная температура культивирования и составляет менее 37°C, для примера в пределах 25-35°C, предпочтительно в пределах 30-35°C и более предпочтительно в пределах 32-35°C.
Авторы данного открытия исследовали эффекты температурного сдвига на клеточные линии CHO, вырабатывающие рекомбинантное гуманизированное антитело, с точки зрения клеточной плотности, клеточной жизнеспособности, изменения в компонентах среды, концентрации выработанного антительного белка и изменения в гетерогенности компонентов антитела.
В результате было обнаружено, что по сравнению с контролем, который культивировался при температуре, поддерживавшейся при 37°C, во время всего периода культивирования, потребление глюкозы и накопление лактата было снижено, при этом количество жизнеспособных клеток и жизнеспособность поддерживались при условиях температурного сдвига. Дополнительно, с точки зрения свойств выработанного антитела, было обнаружено, что температурный сдвиг приводил к желаемому результату с точки зрения качества представляющего интерес продукта, т.е. к сниженному уровню кислотных пиков. Это явление указывает на то, что температурный сдвиг может модулировать уровень гетерогенности компонентов. Однако количество выработанного антительного белка слегка снижалось по сравнению со случаем культивирования при нормальных температурных условиях.
В одном аспекте данного изобретения модуляция уровня гетерогенности компонентов целевого белка включает в себя снижение зарядовой гетерогенности. "Зарядовая гетерогенность" относится к явлению, когда электрический заряд белка становится гетерогенным из-за уровня компонентов с более высоким pI, чем у главного компонента (основные пики), и компонентов с более низким pI (кислотные пики), что вызвано различиями в дезамидированной форме, формой с замещенной или удаленной аминокислотой и структуре сахарной цепи.
В еще одном аспекте данного изобретения модуляция уровня гетерогенности компонентов целевого белка включает в себя снижение уровня кислотных пиков.
Кислотные пики белка относятся к компонентам с более низким pI, чем у главного компонента, и, как правило, образуются из-за различий в дезамидированной форме и структуре сахарной цепи. Кислотные пики определяются ионообменной хроматографией и рассчитываются по отношению к главному компоненту (%).
Момент температурного сдвига варьируется в зависимости от типа животной клетки, которая будет использована, и условий культивирования. Для животной клетки, которая будет использована, было осуществлено тестирование для оптимизации использования в качестве индикатора баланса между продуктивностью представляющего интерес белка и уровнем гетерогенности компонентов.
В общем, процессы культивирования клеток подразделяются на порционное культивирование, непрерывное культивирование и подпитываемое порционное культивирование. Порционное культивирование является культуральным процессом, посредством которого малое количество раствора посевной культуры добавляется в среду и клетки выращиваются без добавления добавочной среды или выведения культурального раствора во время культивирования. Непрерывное культивирование является культуральным процессом, посредством которого среда непрерывно добавляется и выводится во время культивирования. Непрерывное культивирование также включает в себя перфузионнео культивирование. Fed-подпитываемое порционное культивирование, которое является промежуточным между порционным культивированием и непрерывным культивированием и также называется "полупорционное культивирование", является культуральным процессом, посредством которого среда непрерывно или последовательно добавляется во время культивирования но, в отличие от непрерывного культивирования, культуральный раствор не выводится непрерывно.
В способе по данному изобретению любой культуральный процесс может быть использован, но предпочтительно используется подпитываемое порционное культивирование или непрерывное культивирование, и особенно предпочтительно используется подпитываемое порционное культивирование. Среда, которая будет добавлена во время подпитываемого порционного культивирования (в дальнейшем в этом документе называемая "подпитывающая среда"), не должна обязательно быть той же средой, которая уже была использована для культивирования (в дальнейшем в этом документе называемая "первичная среда"); другая среда может быть добавлена, или только отдельные компоненты могут быть добавлены. Как правило, состав подпитывающей среды отрегулирован так, что компоненты, потребленные во время культивирования, пополняются. Например, глюкоза, основной источник энергии для роста животных клеток, может быть пополнена посредством стратегии подпитывания.
Момент температурного сдвига определяется по балансу между количеством представляющего интерес экспрессированного белка и уровнем кислотных пиков. В частности, оптимальный момент температурного сдвига может быть выяснен проведением испытания, приведенного в примере 2. Предпочтительно инициировать температурный сдвиг в такой момент, когда клеточная плотность становится достаточно высокой, т.е. обычно порядка от 106 клеток/мл до 108 клеток/мл, хотя она не может быть ограничена в узком диапазоне, потому что достигаемая клеточная плотность варьируется в зависимости от типа используемой клетки и условий культивирования.
В качестве компонентов культурального раствора для использования в способе по данному изобретению могут быть использованы различные компоненты, часто используемые в данной области в среде для культивирования клеток (предпочтительно, животных клеток), соответствующим образом, и примеры включают в себя аминокислоты, витамины, липидные факторы, источники энергии, осморегулирующие агенты, источники железа и буферизующие pH агенты. Вдобавок к вышеупомянутым компонентам также могут быть добавлены металлические следовые элементы, поверхностно-активные вещества, ростовые кофакторы, нуклеозиды и тому подобное.
Другие компоненты культурального раствора могут быть, в частности, проиллюстрированы аминокислотами, такими как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-орнитин, L-фенилаланин, L-пролин, L-треонин, L-триптофан и L-валин, предпочтительно, такими как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-треонин, L-триптофан и L-валин; витаминами, такими как i-инозит, биотин, фолиевая кислота, липоевая кислота, никотинамид, никотиновая кислота, п-аминобензойная кислота, пантотенат кальция, пиридоксаль гидрохлорид, пиридоксина гидрохлорид, рибофлавин, тиамина гидрохлорид, витамин B12 и аскорбиновая кислота, предпочтительно, такими как биотин, фолиевая кислота, липоевая кислота, никотинамид, пантотенат кальция, пиридоксаль гидрохлорид, рибофлавин, тиамина гидрохлорид, витамин B12 и аскорбиновая кислота; липидными факторами, такими как холинхлорид, тартрат холина, линолевая кислота, олеиновые кислоты и холестерин, предпочтительно, такими как холинхлорид; источниками энергии, такими как глюкоза, галактоза, манноза и фруктоза, предпочтительно, такими как глюкоза; осморегулирующими агентами, такими как хлорид натрия, хлорид калия и нитрат калия, предпочтительно, такими как хлорид натрия; источниками железа, такими как железный EDTA, цитрат железа (III), хлорид железа (II), хлорид железа (III), сульфат железа (II), сульфат железа (III) и нитрат железа (III), предпочтительно, такими как хлорид железа (III), железный EDTA и цитрат железа (III); и буферизующими pH агентами, такими как гидрокарбонат натрия, хлорид кальция, дигидрофосфат натрия, HEPES, и MOPS, предпочтительно, таким как гидрокарбонат натрия.
Компоненты, которые могут быть добавлены вдобавок к вышеупомянутым компонентам, включают в себя, но не ограничены ими, металлические следовые элементы, такие как сульфат меди, сульфат марганца, сульфат цинка, сульфат магния, хлорид никеля, хлорид олова, хлорид магния и силицид натрия, предпочтительно, такие как сульфат меди, сульфат цинка и сульфат магния; поверхностно-активные вещества, такие как Tween 80 и Pluronic F68; ростовые кофакторы, такие как рекомбинантный инсулин, рекомбинантный IGF, рекомбинантный EGF, рекомбинантный FGF, рекомбинантный PDGF, рекомбинантный TGF-α, этаноламин гидрохлорид, селенит натрия, ретиноевая кислота и путресцин гидрохлорид, предпочтительно, такие как селенит натрия, этаноламин гидрохлорид, рекомбинантный IGF и путресцин гидрохлорид; и нуклеозиды, такие как дезоксиаденозин, дезоксицитидин, дезоксигуанозин, аденозин, цитидин, гуанозин и уридин. В предпочтительных примерах данного открытия, как описано выше, могут быть включены антибиотики, такие как стрептомицин, пенициллин G калия и гентамицин, и индикаторы pH, такие как феноловый красный.
Целесообразно, чтобы культуральный раствор содержал другие компоненты в следующих количествах: 0,05-1500 мг/л аминокислот, 0,001-10 мг/л витаминов, 0-200 мг/л липидных факторов, 1-20 г/л источников энергии, 0,1-10000 мг/л осморегулирующих агентов, 0,1-500 мг/л источников железа, 1-10000 мг/л буферизующих pH агентов, 0,00001-200 мг/л металлических следовых элементов, 0-5000 мг/л поверхностно-активных веществ, 0,05-10000 мкг/л ростовых кофакторов и 0,001-50 мг/л нуклеозидов, но эти содержания могут быть определены соответствующим образом в зависимости от типа клетки, которая будет культивирована, типа целевого белка и тому подобного.
pH культурального раствора варьируется в зависимости от типа клетки, которая будет культивирована, но пригодные подходящие pH обычно лежат в пределах от pH 6,8 до 7,6 и во многих случаях в пределах от pH 7,0 до 7,4.
В данном изобретении клетки могут культивироваться с использованием химически определенной среды, с растворенными в ней вышеизложенными компонентами. Альтернативно, также возможно использовать общеизвестную культуральную среду для животных клеток в качестве основной среды и дополнять ее другими компонентами по необходимости. Примеры коммерчески доступной основной среды, которая может быть использована в качестве культуральной среды для животных клеток, включают в себя, но не ограничены ими, D-MEM (среда Игла, модифицированная по способу Дульбекко), D-MEM/F-12 смесь 1:1 (среда Игла, модифицированная по способу Дульбекко: питательная смесь F-12), RPMI1640, CHO-S-SFMII (Invitrogen), CHO-SF (Sigma-Aldrich), EX-CELL 301 (JRH biosciences), CD-CHO (Invitrogen), IS CHO-V (Irvine Scientific) и PF-ACF-CHO (Sigma-Aldrich). В случаях, когда клетки культивируются подпитываемым порционным культивированием, такая коммерчески доступная среда может быть использована в качестве начальной среды, которая должна быть использована на ранней стадии культивирования клеток.
Предпочтительным вариантом данного открытия является способ модулирования уровня гетерогенности компонентов целевого белка, при этом культивирование животных клеток, таких как клетки COS и клетки CHO, в которые был встроен ген посредством генно-инженерной манипуляции, или слитые клетки типизируются по гибридомам, таким как мышино-человеческая, мышино-мышиная, мышино-крысиная и другие гибридные клетки. Способ по данному изобретению также может быть использован для культивирования животных клеток для того, чтобы попытаться получить нативный белок, выработанный клетками.
Животные клетки, которые будут использованы в данном открытии для экспрессирования целевого белка, не ограничены особым образом, но предпочтительны клетки млекопитающего. Клетки млекопитающего, которые будут использованы, могут быть клетками, полученными из любых млекопитающих, включая приматов, таких как люди, шимпанзе, и грызунов, таких как мыши, крысы и хомяки, но широко используемые животные клетки, такие как клетки CHO, COS, 3T3, миеломы, BHK, HeLa и Vero, являются предпочтительными, и клетки CHO являются особенно предпочтительными с целью высокой экспрессии. С целью приготовления целевого белка клетки, пригодные для внесения целевого гена, являются особенно предпочтительными, такие как клетки dhfr-CHO, которые являются клетками CHO, лишенными гена DHFR (Proc. Natl Acad. ScL USA (1980) 77, 4216-4220), и клетки CHO K-l (Proc. Natl. Acad. Sci. USA (1968) 60, 1275).
Как выше изложено, клетки CHO, клеточные линии DG44, DXB-11, K-l и CHO-S предпочтительны, и клеточные линии DG44 и DXB-11 являются особенно предпочтительными.
Внесение векторов в клетки-хозяина может быть выполнено различными способами, включая способ с фосфатом кальция, способ с DEAE-декстраном, способ с использованием DOTAP катионной рибосомы (Boehringer Mannheim), электропорацию и липофекцию.
Особенно предпочтительными животными клетками в данном открытии являются клетки CHO, в которые был внесен ген, кодирующий целевой белок. Целевой белок не ограничен особым образом и может являться любым белком, включая антитела, такие как природные антитела, фрагменты антитела, миниантитела, химерные антитела, гуманизированные антитела и биспецифические антитела (например, анти-IL-6 рецептор антитела, анти-IL-6 антитела, анти-глипикан-3 антитела, анти-CD3 антитела, анти-CD20 антитела, анти-GPIIb/IIIa антитела, анти-TNF антитела, анти-CD25 антитела, анти-EGFR антитела, анти-Her2/neu антитела, анти-RSV антитела, анти-CD33 антитела, анти-CD52 антитела, анти-IgE антитела, анти-CD11a антитела, анти-VEGF антитела, анти-VLA4 антитела, анти-NR10 (IL-31RA) антитела, антиганглиозид GM3 антитела, анти-TPO агонист рецептора антитела, заменяющие коагулирующий фактор VIII антитела, анти-IL-31 рецептор антитела, анти-HLA антитела, анти-AXL антитела, анти-CXCR4 антитела, биспецифические антитела к факторам IX и X) и физиологически активные белки (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF), эритропоетин, интерферон, интерлейкины, такие как IL-1 и IL-6, t-PA, урокиназа, сывороточные альбумины, факторы свертывания крови), но антитела являются особенно предпочтительными.
Антитела включают в себя не только моноклональные антитела, полученные у животных, таких как люди, мыши, крысы, хомяки, кролики и обезьяны, но также искусственно генетически модифицированные рекомбинантные антитела, такие как химерные антитела, гуманизированные антитела и биспецифические антитела. Класс иммуноглобулинов антител не ограничен особым образом и может являться любым классом, включая IgG (например, IgG1, IgG2, IgG3 и IgG4), IgA, IgD, IgE и IgM, но IgG и IgM предпочтительны для фармацевтического использования. Антитела по данному открытию включают в себя не только полные антитела, но также фрагменты антител, такие как Fv, Fab и F(ab)2, и миниантитела, состоящие из одноцепочечного Fv (например, scFv, sc(Fv)2) моно-, двух- или большей валентости, в которых вариабельные области антитела соединены линкерами, такими как пептидные линкеры.
В предпочтительном варианте осуществления данное открытие представляет собой способ модулирования уровня кислотных пиков антитела во время культивирования клеток CHO, в которые был внесен ген, кодирующий антитело, с целью приготовления антитела, где культивирование выполняется при нормальной температуре культивирования до от 3 до 7 дней после даты начала культивирования, и затем температура культивирования снижается. Более конкретно, после того как культивирование выполнено при нормальной температуре культивирования, например, до 3, 4, 5, 6 или 7 дней после начала культивирования, осуществляется температурный сдвиг, и после этого культивирование продолжается при смещенной температуре.
Период после смещения температуры в сторону низкой температуры и до окончания культивирования обычно варьируется от 1 до 50 дней, предпочтительно от 5 до 15 дней и более предпочтительно от 7 до 12 дней.
Культуральные условия варьируются в зависимости от типа клеток, которые будут использованы, и таким образом подходящие условия могут быть определены соответствующим образом. Например, клетки CHO обычно могут быть культивированы в атмосфере газа CO2 в концентрации 0-40%, предпочтительно 2-10%, в течение 1-50 дней, предпочтительно 1-14 дней.
Культивирование может быть выполнено с использованием различных культуральных систем для животных клеток, таких как ферментерные емкостные культуральные системы, аэрлифтные культуральные системы, культуральные системы колбового типа, культуральные системы с вращающейся колбой, культуральные системы с микроносителем, культуральные системы с псевдоожиженным слоем, культуральные системы с полым волокном, культуральные системы с вращающимся флаконом и культуральные системы с уплотненным слоем.
Предпочтительные культуральные условия, выбранные в данном открытии, являются такими условиями, при которых уровень гетерогенности компонентов представляющего интерес белка, выработанного животными клетками, модулируется для достижения небольшого падения продуктивности. В действительности, авторы данного открытия обнаружили, что в соответствии с данной заявкой количество антитела, выработанного в расчете на клетку, слегка снижалось из-за температурного сдвига, но коррекция смещенной температуры и момента предоставляет возможность минимизации снижения количества экспрессированного представляющего интерес белка, а также модуляции уровня гетерогенности компонентов.
Для выработки белка с использованием животных клеток некоторые клетки необходимо только культивировать, или для некоторых могут требоваться специальные манипуляции, и манипуляции, культуральные условия или тому подобное могут быть определены соответствующим образом в зависимости от типа животных клеток, которые должны быть культивированы. Например, в случае, когда клетки CHO, трансформированные посредством генно-инженерной манипуляции вектором, содержащим ген, кодирующий антитело, такое как мышинно-человеческое химерное антитело или гуманизированное антитело, или любой другой белок, культивируются при вышеизложенных условиях, целевой белок может быть выработан в среде в течение около 1-50 дней, предпочтительно в течение около 5-21 дня и более предпочтительно в течение около 7-14 дней. Полученный в результате белок выделяется и очищается общепринятыми способами (например, см.: Kotaikogakunyumon (Introduction to Antibody Engineering), Chijin Shokan Co. Ltd., (1994) p. 102-104; and Affinity Chromatography Principles & Methods, GE Healthcare, (2003) p. 56-60) так, что может быть получен целевой белок.
Белок, секретированный из культивированных животных клеток в среду, может быть собран из культурального раствора общепринятым способом. Альтернативно, белок может также быть собран из лизата клеток хозяина общепринятым способом. Если быть точнее, целевой белок может быть собран удалением клеток и клеточных фрагментов из клеточного культурального раствора или клеточного лизата, как правило, центрифугированием и затем применением обычных технологий выделения и очистки белка, таких как высаливание (например, фракционирование сульфатом аммония), осаждение спиртом (например, осаждение этанолом), PEG, электрофорез, ионообменная хроматография, ультрацентрифугирование, гель-фильтрация, гидрофобная хроматография и аффинная хроматография. В случаях, когда целевой белок является антителом, преимущественно используется хроматография с белком A, но это не единственный пример. Кроме того, посредством использования различных основанных на аффинности способов разделения и фракционирования, антитела могут быть разделены в соответствии с классом иммуноглобулинов или фракционированы на основании их антигенной аффинности.
Данное открытие делает возможным приготовление рекомбинантных антител (например, природные антитела, фрагменты антитела, миниантитела, химерные антитела, гуманизированные антитела и биспецифические антитела), генетически рекомбинантных белков (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF), эритропоетин, интерферон, интерлейкины, такие как IL-1 и IL-6, t-PA, урокиназа, сывороточные альбумины, факторы свертывания крови) и тому подобного, при этом поддерживаются высокая продуктивность и гомогенность.
В случаях, когда белок или полипептид, приготовленный по способу данного открытия (также называемый "разработанный белок"), имеет фармацевтически применимую биологическую активность, может быть приготовлен лекарственный препарат смешиванием белка или полипептида с фармацевтически приемлемыми носителями или добавками для образования состава. Разработанный белок и лекарственный препарат, содержащий разработанный белок в качестве активного ингредиента, также попадают в объем данного изобретения.
Примеры фармацевтически приемлемых носителей и добавок включают в себя, но не ограничены ими, воду, фармацевтически приемлемые органические растворители, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, карбоксиметилцеллозу натрия, полиакрилат натрия, альгинат натрия, растворимый в воде декстран, карбоксиметилкрахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую камедь, аравийскую камедь, казеин, агар, полиэтиленгликоль, диглицерин, глицерин, пропиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, человеческий сывороточный альбумин (HSA), маннит, сорбит, лактозу и поверхностно-активные вещества, которые являются приемлемыми в качестве фармацевтических добавок.
В существующих применениях добавки выбраны независимо или по желанию в комбинации из приведенных выше в зависимости от лекарственной формы лечебного агента, т.е. лекарственного препарата по данному изобретению, но это, естественно, не является единственным примером. Например, в случае с использованием лекарственного препарата по изобретению в качестве состава для инъекции, может быть использован продукт, приготовленный растворением очищенного полипептида в растворителе, таком как физиологический раствор, буферный раствор или глюкозный раствор и добавлением антиадсорбционного агента, такого как Tween 80, Tween 20, желатин или человеческий сывороточный альбумин. Альтернативно, также может быть выполнена лиофилизация для предоставления лекарственной формы, которая позволяет растворение для восстановления перед использованием, и иллюстративные вспомогательные вещества, которые могут быть использованы для лиофилизации, включают в себя сахарные спирты, такие как маннит, и сахара, такие как глюкоза.
Эффективная доза полипептида выбрана соответствующим образом в зависимости от различных факторов, включая тип полипептида, тип заболевания, которое должно быть вылечено или предотвращено, возраста пациента и тяжести заболевания. Например, в случаях, когда разработанный белок является антителом, таким как антиглипикан антитело, эффективная доза выбрана из диапазона от 0,001 до 1000 мг в расчете на кг массы тела в расчете на дозу. Альтернативно, доза может быть выбрана из диапазона от 0,01 до 100000 мг/тело в расчете на пациента. Однако эффективная доза не ограничена вышеизложенными диапазонами доз.
Лекарственный препарат по данному открытию может быть введен как орально, так и парентерально, но парентеральное введение предпочтительно, и конкретные примеры включают в себя инъекцию (например, общее или местное введение внутривенной, внутримышечной, внутрибрюшинной, подкожной или другими инъекциями), трансназальное введение, транспульмональное введение и чрескожное введение.
ПРИМЕРЫ
Данное открытие далее будет подробно описано посредством примеров и сравнительных примеров. Необходимо отметить, что эти примеры предусмотрены для иллюстрации данного изобретения и не ограничивают объем изобретения.
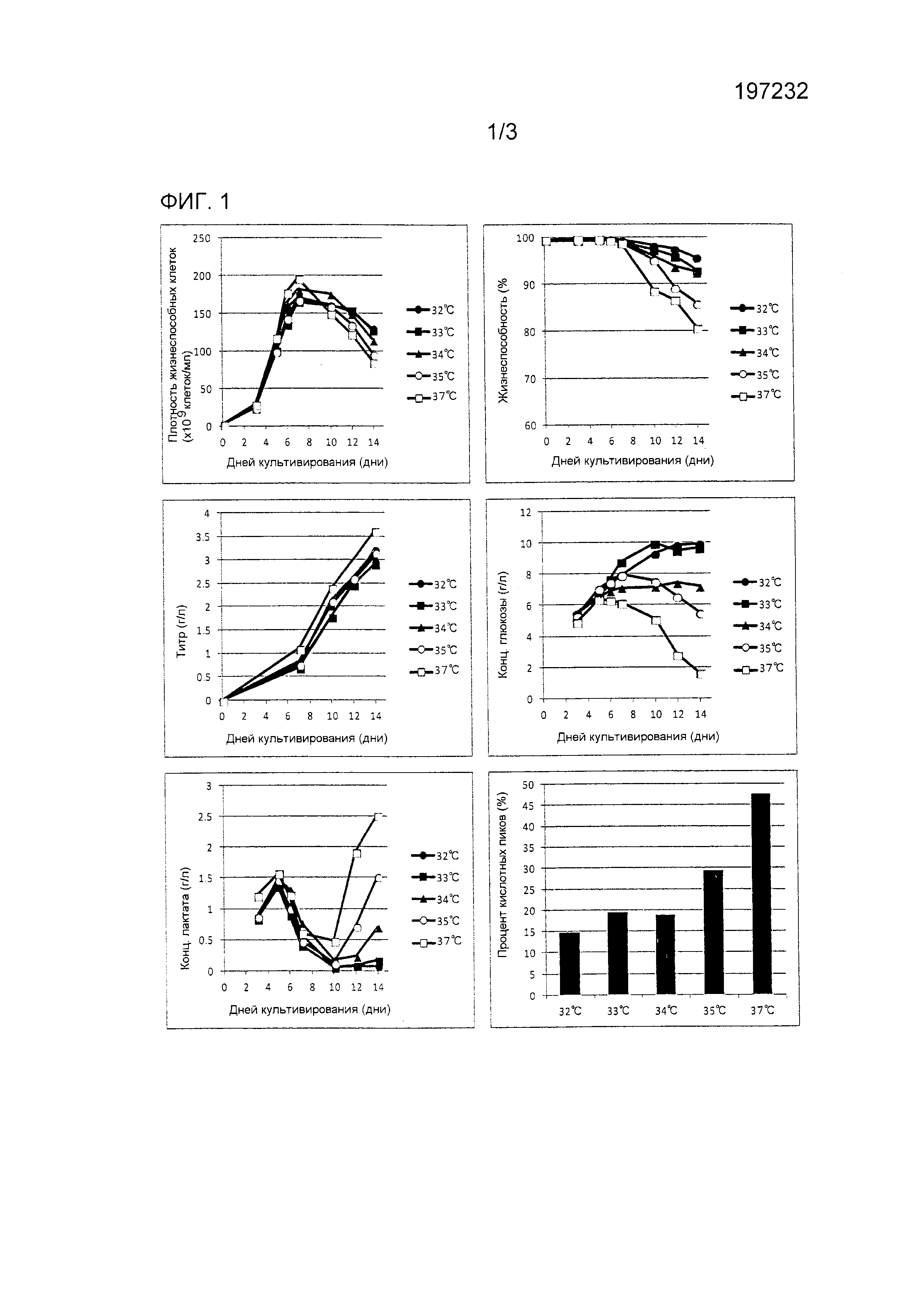
[Пример 1] Снижение кислотных пиков антитела посредством температурного сдвига
(Исследование смещенной температуры)
Первичная среда
Полученный из растения гидролизат добавляли к коммерчески доступной бессывороточной культуральной среде для животных клеток, смесь растворяли и затем раствор фильтровали и стерилизовали.
Подпитывающая среда
Глюкозу добавляли в коммерчески доступную бессывороточную культуральную среду для животных клеток и растворяли в ней и раствор фильтровали и стерилизовали.
Клетки
Клеточная линия CHO (DXB-11; G. Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216-4220 1980; коммерчески доступная от ATCC), вырабатывающая рекомбинантное анти-глипикан-3 (GPC-3) гуманизированное антитело (гуманизированное GC33 антитело класса IgG1, которое приготовили выполнением гуманизации по процедуре, раскрытой в примере 24 в WO 2006/006693, и модификацией L цепи посредством процедуры, раскрытой в примере 25 там же).
Процедура культивирования
Каждые из 1 л сосудов клеточных культуральных систем (5 единиц) загружали первичной средой, клеточную линию CHO засеивали туда так, чтобы была получена плотность 2×105 клеток/мл, и культивирование начинали при 37°C. Температурный сдвиг осуществляли с дня 5 после начала культивирования. Смещенные температуры в культуральных емкостях 1-5 составляли 32°C, 33°C, 34°C, 35°C и 37°C (без сдвига), соответственно, и последующее культивирование продолжали при каждой из этих смещенных температур. DO и pH контролировалась при 40% и 6,9, соответственно. Подпитываемая среда была инъецирована при фиксированной скорости потока с дня 3.
Процедура анализа
Количество жизнеспособных клеток и жизнеспособность измеряли окрашиванием трипановым синим. 1 мл каждой из клеточных суспензий помещали в автоматический анализатор клеток Cedex для определения количеств жизнеспособных и мертвых клеток. Определение количеств жизнеспособных мертвых клеток и расчет плотности жизнеспособных клеток (105 клеток/мл) и жизнеспособности (%) выполняли автоматически с использованием программного обеспечения для анализа данных Cedex Loader (Ver. 1.51 или более поздние; Innovatis).
Концентрации глюкозы и молочной кислоты определяли анализатором биохимии (модель 2700; YSI) с использованием супернатантов, полученных центрифугированием отобранных культуральных растворов (1000 об/мин, 5 мин).
Концентрацию антитела определяли посредством белок A-HPLC с использованием супернатантов, полученных центрифугированием отобранных культуральных растворов (1000 об/мин, 5 мин).
Ионообменную хроматографию (ВЕС) выполняли с ипользованием катионообменных колонн (ProPac WCX-10).
Результаты
Результаты показаны на фиг. 1.
С точки зрения максимума клеточной плотности образец, культивированный при 37°C без температурного сдвига, достигал наибольшего значения, и другие образцы, которые подвергались температурному сдвигу, демонстрировали сниженный клеточный рост. Однако имела место тенденция, что чем более низкой была смещенная температура, тем лучше сохранялась жизнеспособность и большее количество жизнеспособных клеток поддерживалось даже на более поздней стадии культивирования. С точки зрения количества выработанного антитела, образец, культивированный при 37°C без температурного сдвига, демонстрировал наибольшее значение 3,61 г/л, при этом все из других образцов, которые подвергались температурному сдвигу, давали значение не более 3,2 г/л; этот результат указывает на то, что температурный сдвиг снижал количество выработанного антитела. Это может иметь место из-за того, что температурный сдвиг снижает активность самих клеток. Относительно глюкозы и молочной кислоты во время культивирования, было обнаружено, что чем более низкой была смещенная температура, тем меньшим были потребление глюкозы и выработка молочной кислоты. Это также может иметь место из-за того, что температурный сдвиг снижает активность самих клеток. Частоты возникновения кислотного пика, определенные DEC, составляли 47,5% без температурного сдвига, 29,1% для сдвига до 35°C, 18,7% для сдвига до 34°C, 19,4% для сдвига до 33°C и 14,7% для сдвига до 32°C; этот результат указывает на то, что температурный сдвиг снижал уровень кислотных пиков, и что чем меньше была смещенная температура, тем меньше была частота возникновения кислотного пика.
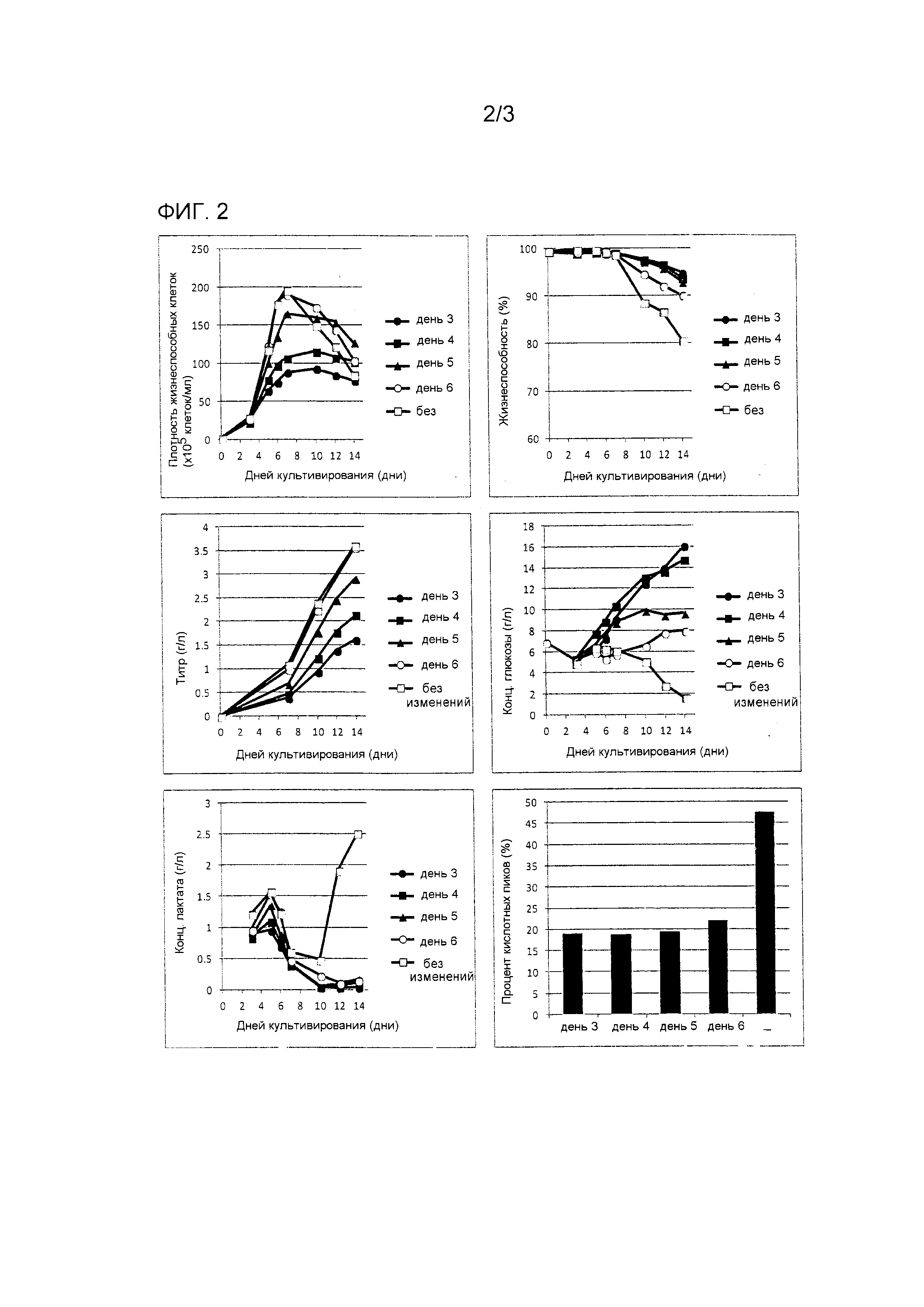
[Пример 2] Снижение кислотных пиков антитела посредством температурного сдвига (Исследование момента сдвига ~ 1)
Первичная среда
Полученный из растения гидролизат добавляли к коммерчески доступной бессывороточной культуральной среде для животных клеток, смесь растворяли и затем раствор фильтровали и стерилизовали.
Подпитывающая среда
Глюкозу добавляли к коммерчески доступной бессывороточной культуральной среде для животных клеток и растворяли в ней и раствор фильтровали и стерилизовали.
Клетки
Клеточная линия CHO, вырабатывающая рекомбинантное анти-глипикан-3 (GPC-3) гуманизированное антитело.
Процедура культивирования
В каждый из 1 л сосудов системы для культивирования клеток (5 единиц) загружали первичную среду, засеивали туда клеточную линию CHO так, чтобы была получена плотность 2×105 клеток/мл, и культивирование начинали при 37°C. Была установлена смещенная температура 33°C, и были установлены моменты сдвига в культуральных емкостях 1-5 в дни 3, 4, 5 и 6 после начала культивирования и отсутствие сдвига, соответственно. Последующее культивирование продолжалось при смещенной температуре. DO и pH контролировали при 40% и 6,9, соответственно. Подпитывающая среда вводилась с фиксированной скоростью потока с дня 3.
Процедура анализа
Количество жизнеспособных клеток и жизнеспособность измеряли окрашиванием трипановым синим. 1 мл каждой из клеточных суспензий помещали в автоматический анализатор клеток Cedex для определения количества жизнеспособных и мертвых клеток. Определение количества жизнеспособных и мертвых клеток и расчет плотности жизнеспособных клеток (105 клетки/мл) и жизнеспособности (%) выполняли автоматически с использованием программного обеспечения для анализа данных Cedex Loader (Ver. 1.51 или более поздние; Innovatis).
Концентрации глюкозы и молочной кислоты определяли анализатором биохимии (модель 2700; YSI) с использованием супернатантов, полученных центрифугированием отобранных культуральных растворов (1000 об/мин, 5 мин).
Концентрацию антитела определяли белок A-HPLC с использованием супернатантов, полученных центрифугированием отобранных культуральных растворов (1000 об/мин, 5 мин).
Ионообменную хроматографию (IEC) выполняли с использованием катионообменной колонны (ProPac WCX-10).
Результаты
Результаты показаны на фиг. 2.
С точки зрения максимума клеточной плотности образец, культивированный без температурного сдвига, достигал наибольшего значения, и другие образцы, которые подвергались температурному сдвигу, демонстрировали сниженный клеточный рост. Имело место тенденция, что чем более ранним был момент температурного сдвига, тем меньше был максимум клеточной плотности, но жизнеспособность сохранялась. С точки зрения количества выработанного антитела, образец, культивированный без температурного сдвига, демонстрировал наибольшее значение 3,61 г/л, образец, который подвергался температурному сдвигу на день 6, демонстрировал значение 3,57 г/л, и те, которые подверглись температурному сдвигу на дни 5, 4 и 3 демонстрировали значения 2,91, 2,13 и 1,61 г/л, соответственно; результат указывает на то, что чем более ранним был момент температурного сдвига, тем меньшее количество антитела было выработано. В отношении концентрации глюкозы, чем более ранним был момент сдвига, тем большее количество глюкозы было накоплено. С точки зрения количества выработанной молочной кислоты, только образец, культивированный без температурного сдвига, демонстрировал накопление молочной кислоты на более поздней стадии культивирования, при том, что все из тех, что подвергались температурному сдвигу, имели концентрацию не более 0,5 г/л. Частоты возникновения кислотного пика, определенные IEC, составляли 47,5% при отсутствии температурного сдвига, 21,9% для сдвига на день 6 и не более 20% для сдвигов в дни 3, 4 и 5; уровень кислотных пиков, определенный IEC, был снижен даже в случае культивирования, выполненного на день 6.
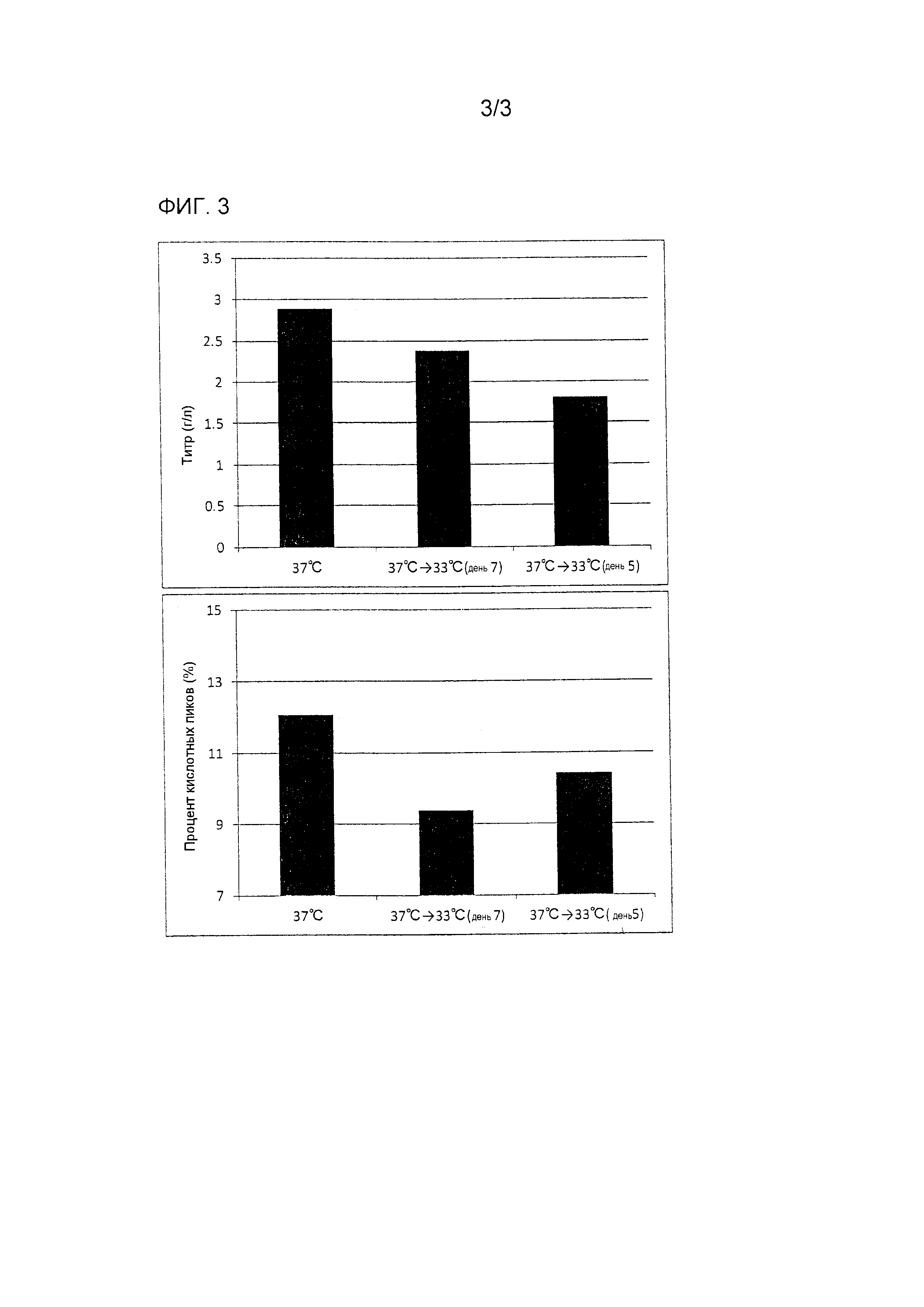
[Пример 3] Снижение кислотных пиков антитела посредством температурного сдвига (Исследование момента сдвига - 2)
Первичная среда
Коммерчески доступную бессывороточную культуральную среду для животных клеток растворяли и затем раствор фильтровали и стерилизовали.
Подпитывающая среда
Глюкозу добавляли в коммерчески доступную бессывороточную культуральную среду для животных клеток и растворяли в ней и раствор фильтровали и стерилизовали.
Клетки
Клеточная линия CHO (DXB-11; G. Urlaub et al, Proc. Natl. Acad. Sci. USA IT. 4216-42: 1980; коммерчески доступная от ATCC), вырабатывающая анти-NR10 (IL-31RA) гуманизированное антитело (полностью гуманизированное NS22 антитело, приготовленное процедурой, раскрытой в примере 12 в WO 2009/072604). Анти-NR10 гуманизированное антитело являлось антителом класса IgG2.
Процедура культивирования
Культивирование выполняли по той же процедуре, что в примере 2. Более конкретно культивирование начинали при 37°C, была установлена смещенная температура 33°C, были установлены моменты сдвига в дни 5 и 7 после начала культивирования и отсутствие сдвига, и последующее культивирование продолжалось при смещенной температуре.
Процедура анализа
Анализ выполняли по той же процедуре, что в примере 2.
Результаты
Как и в примере 2, уровень кислотных пиков антитела был значительно снижен, когда был осуществлен температурный сдвиг (фиг. 3).